БИОХИМИЯ, 2020, том 85, вып. 4, с. 587 - 597
УДК 576
УАБАИН И МАРИНОБУФАГЕНИН:
ВОЗМОЖНЫE ФИЗИОЛОГИЧЕСКИЕ ЭФФЕКТЫ
НА КЛЕТКИ ЭПИТЕЛИЯ И ЭНДОТЕЛИЯ ЧЕЛОВЕКА
© 2020
Е.А. Климанова*, Д.А. Федоров, С.В. Сидоренко,
П.А. Абрамичева, О.Д. Лопина, С.Н. Орлов
Московский государственный университет им. М.В. Ломоносова, биологический факультет,
119234 Москва, Россия; электронная почта: klimanova.ea@yandex.ru
Поступила в редакцию 19.12.2019
После доработки 18.02.2020
Принята к публикации 18.02.2020
Продолжительные исследования, направленные на поиск эндогенных ингибиторов Na,K ATPазы в тканях
млекопитающих, привели к идентификации в биологических жидкостях уабаина, маринобуфагенина
(МБГ) и других кардиотонических стероидов (КТС). Известно, что продукция уабаина и МБГ увеличивает
ся при гипертонической болезни и других заболеваниях, сопровождающихся гиперволемией. Был проведен
сравнительный анализ действия этих двух КТС на активность Na,K ATPазы, измеренную по транспорту
Na+, K+ и Rb+, пролиферацию и гибель клеток почечного эпителия (HREC) и эндотелия пупочной вены че
ловека (HUVEC), экспрессирующих α1 Na,K ATPазу. Концентрация уабаина, обеспечивающая полумак
симальное ингибирование входа Rb+ (IC50) в HREC и HUVEC, составляла 0,07 мкМ. В обоих типах клеток
IC50 для МБГ было на порядок выше, чем для уабаина. Инкубация HREC и HUVEC c уабаином в диапазо
не концентраций 1-10 нМ в течение 30 ч приводила к росту включения [3H] тимидина в ДНК до 40%, при
этом увеличение концентрации уабаина до 0,1 мкМ полностью ингибировало синтез ДНК. МБГ в концент
рации 0,1 мкМ активировал синтез ДНК на 25% в HREC, но не в HUVEC; 1 мкМ МБГ полностью подавлял
синтез ДНК в HREC и на 50% - в HUVEC. В отличие от HREC, инкубация HUVEC в бессывороточной сре
де провоцировала апоптоз, который практически полностью подавлялся уабаином и МБГ в концентрациях
0,1 и 3 мкМ соответственно. Суммируя эти данные, можно сделать два основных заключения: 1) эффекты
МБГ в концентрациях, детектируемых в плазме крови (< 10 нМ), на HREC и HUVEC не опосредованы из
менением соотношения [Na+]i/[K+]i; 2) влияние уабаина в физиологическом диапазоне концентраций на
эти клетки связано, скорее всего, с активацией Na,K ATPазы, что приводит к клеточной пролиферации.
КЛЮЧЕВЫЕ СЛОВА: уабаин, маринобуфагенин, Na,K ATPаза, соотношение [Na+]i/[K+]i, эпителий, эндо
телий.
DOI: 10.31857/S0320972520040119
Благоприятное действие отвара из листьев
изолированы другие члены суперсемейства
наперстянки (Digitalis purpurea и Digitalis lanata)
КТС, буфадиенолиды [2].
при лечении хронической сердечной недоста
Ранние исследования показали, что добавле
точности, описанное более 200 лет назад сэром
ние КТС в окружающую клетки среду ингибиру
William Withering [1], привело к идентификации
ет энергозависимое выведение Na+ из клетки [3]
растительных КТС, или карденолидов. К этой
и блокирует Na,K ATPазу [4], фермент, обнару
группе соединений относится также уабаин, по
женный Skou J. Chr. в 1957 г. [5]. Еще в 1953 г.
лученный из африканской лианы Strophanthus
Szent Gyorgyi предположил, что в организме че
gratus, который благодаря своей гидрофильнос
ловека и других млекопитающих существуют
ти использовали в подавляющем большинстве
так называемые «эндогенные» КТС, и дал этому
исследований in vitro. Позже из амфибий были
физиологическое обоснование [6]. В настоящее
время существует большое количество данных,
свидетельствующих о том, что подобные соеди
Принятые сокращения: КТС - кардиотонические
нения присутствуют во многих тканях млекопи
стероиды; МБГ - маринобуфагенин; Ac DEVD AMC - тающих, а их содержание в плазме человека ко
N ацетил Asp Glu Val Asp 7 амидо 4 метилкумарин; леблется в пределах субнаномолярных концент
HREC - клетки почечного эпителия человека; HUVEC -
клетки эндотелия пупочной вены человека; PAEC - клет
раций, достигая значения нескольких нM при
ки эндотелия аорты свиньи; REC - клетки почечного эпи
некоторых патологиях [7].
телия.
Na,K ATPаза - это гетеродимерный белок,
* Адресат для корреспонденции.
находящийся в плазматической мембране всех
587
9*
588
КЛИМАНОВА и др.
клеток животных. Каталитическая α субъедини
Для установления взаимосвязи физиологи
ца Na,K ATPазы (~110 кДа) в ходе каталитичес
ческих эффектов, вызываемых двумя различны
кого цикла претерпевает конформационный пе
ми КТС, с изменением внутриклеточного соот
реход E1-E2, обеспечивая электрогенный (3Na+
ношения [Na+]i/[K+]i в нашем исследовании
vs 2K+) транспорт ионов против электрохими
проведен сравнительный анализ действия уаба
ческого градиента за счет энергии, освобождаю
ина и маринобуфагенина на транспорт однова
щейся при гидролизе АТP. За исключением пов
лентных катионов, пролиферацию и гибель эн
семестно присутствующей α1 изоформы, три
дотелиальных клеток (HUVEC) и клеток почеч
другие изоформы α субъединицы экспрессиру
ного эпителия (HREC) человека, экспрессиру
ются тканеспецифичным образом и встречаются
ющих только α1 Na,K ATPазу.
в значительных количествах в клетках нейронов
и скелетных мышц (α3 и α2), кардиомиоцитах
(α2) и семенниках (α4). Три изоформы β субъе
МАТЕРИАЛЫ И МЕТОДЫ
диницы, кодирующей ~35 кДа белок, сильно
гликозилированы. Они контролируют доставку,
Культура клеток. Клетки почечного эпителия
конформационную стабильность α субъедини
(HREC) и эндотелия человека (HUVEC), приоб
цы, а также влияют на ее сродство к K+o, Nai+ и
ретенные у фирмы «Clonetics» (CША) и у фир
КТС [8-10]. α1 Субъединица Na,K ATPазы яв
мы «Cell Applications» (США) соответственно,
ляется единственной изоформой, экспрессируе
культивировали в соответствии с инструкциями
мой в эпителиальных клетках почек (REC) [11,
производителя с использованием ростовой сре
12] и в клетках эндотелия [13, 14].
ды для почечного эпителия (REGM) и эндоте
КТС, взаимодействуя с Na,K ATPазой, вли
лиальной ростовой среды (ECGM). Для HREC в
яют на клеточные функции, связанные с актив
качестве бессывороточной среды использовали
ностью фермента и поддержанием трансмемб
DMEM. Все исследования проводили на клет
ранного градиента Na+ и K+, такие как электри
ках 4-8 го пассажей. В этом диапазоне количе
ческий мембранный потенциал, клеточный
ство пассажей клеток существенно не влияет на
объем, Na+/H+ и Na+(K+)/Ca2+ обмен, симпорт
максимальную активность Na,K ATPазы (дан
Na+ и неорганического фосфата, глюкозы, ами
ные не приведены), а также на передачу сигна
нокислот, нуклеотидов и др. Кроме того, вне за
лов, вызванную рецептором эпидермального
висимости от ингибирования Na насоса, связы
фактора роста [20]. Морфологию клеток оцени
вание с ним КТС может активировать сигналь
вали с помощью фазово контрастной микрос
ные пути, вовлеченные в регуляцию процессов
копии при увеличении в 100 раз без предвари
транскрипции и трансляции, клеточной адге
тельной фиксации.
зии, пролиферации и гибели клеток [15]. Таким
Оценка жизнеспособности клеток. Для оцен
образом, эти ответы клеток могут быть обуслов
ки гибели клеток, обработанных КТС, анализи
лены как изменением соотношения [Na+]i/[K+]i,
ровали степень их открепления от подложки,
так и/или конформационными переходами Na,
расщепление хроматина и активность каспазы
K ATPазы, опосредованными ее связыванием с
3. Для количественной оценки открепления
КТС. Следует учитывать, что изменение соотно
клетки выращивали в 24 луночных планшетах в
шения [Na+]i/[K+]i может быть следствием не
отсутствие или присутствии КТС. Общее содер
только ингибирования Na насоса, но и его ак
жание белка и содержание белка в клетках,
тивации, которая наблюдается в области более
прикрепленных к пластиковым подложкам, из
низких концентраций КТС, чем те, что вызыва
меряли после 3 кратного промывания 2 мл сре
ют его ингибирование [15].
ды W с помощью модифицированного метода
Известно, что различные представители се
Lowry et al. [21]. Среда W содержала 100 мМ
мейства КТС по разному влияют не только на
MgCl2 и 10 мМ буфер Hepes Tris, рН 7,4.
разные типы клеток, они могут оказывать также
Анализ расщепления хроматина проводили
различное действие на одну и ту же клетку [16,
как описано ранее [22]. Клетки, выращенные в
17]. При условии, что Na,K ATPаза является
24 луночных планшетах, помещали в ростовую
единственным рецептором КТС, это явление
среду, содержащую 0,2-0,5 мкКи/мл [3H] тими
может быть обусловлено: 1) различным срод
дина. Через 24 ч их дважды промывали 2 мл рос
ством разных изоформ Na,K ATPазы к ее спе
товой среды и инкубировали в течение 24 ч в
цифическим ингибиторам [18] и/или 2) различ
обычных условиях. Затем клетки промывали
ными конформационными переходами Na,K
PBS и инкубировали в 0,5 мл среды различного
ATPазы, вызванными связыванием с разными
состава (таблица), не содержащей [3H] тими
КТС [19], что приводит к инициации различных
дин, в течение следующих 18-24 ч. Для опреде
сигнальных путей.
ления фрагментации хроматина планшеты пе
БИОХИМИЯ том 85 вып. 4 2020
ДЕЙСТВИЕ КАРДИОСТЕРОИДОВ НА ЭПИТЕЛИЙ И ЭНДОТЕЛИЙ
589
Влияние бессывороточной среды, уабаина и МБГ на активность каспазы 3 и расщепление хроматина в HUVEC
Условия инкубации
Активность каспазы 3,
Фрагменты хроматина, %
нмоль (мг белка)-1⋅ч-1
Ростовая среда
0,8 ± 0,3
6 ± 2
Среда без сыворотки
4,5 ± 0,7
27 ± 6
Среда без сыворотки + 0,1 мкM уабаин
1,4 ± 0,3
12 ± 4
Среда без сыворотки + 3 мкM маринобуфагенин
1,6 ± 0,5
10 ± 4
p1,2
<0,01
<0,02
P1,3
Н/Д
Н/Д
P1,4
Н/Д
Н/Д
Примечание. Клетки инкубировали в указанных условиях в течение 24 ч. Общее содержание ДНК, меченой [3H] тимиди
ном, принимали за 100%. Результаты представлены в виде среднего значения ± S.E., n = 3 (активность каспазы 3), n = 4
(расщепление хроматина).
реносили на лед и добавляли 1 мл ледяного бу
содержащей 0,5 мкКи/мл 86Rb+ или 2 мкКи/мл
фера для лизиса (10 мМ ЭДТА, 10 мМ Tris HCl,
22Na+ и КТС, и инкубировали в течение 10 мин.
0,5% ный Triton Х 100, рН 8,0). Через 15 мин
Для определения внутриклеточного содер
клеточный лизат собирали, центрифугировали
жания ионов клетки трижды промывали 1,5 мл
(16 000 g, 10 мин) и переносили для измерения
холодного раствора 0,1 М MgCl2, после чего ли
радиоактивности в жидкостный сцинтиллятор
зировали их 5% ной ТХУ. Полученные лизаты
(фракция F1). Оставшуюся в осадках и лунках
центрифугировали, в супернатанте определяли
радиоактивность экстрагировали с помощью
содержание ионов методами жидкостной сцин
раствора 1% ного Ds Na, 4 мМ ЭДТА (фракция
тилляции («LKB», Финляндия) и пламенной
F2). Относительное содержание фрагментов
атомно абсорбционной спектрометрии («Кор
внутриклеточного хроматина определяли как
тек», Россия). Осадок белка растворяли в 0,1 М
процент от общего количества [3H] меченой
NaOH и определяли его концентрацию моди
ДНК: F1 / (F1 + F2) ×100%. Активность каспа
фицированным методом Lowry et al. [21]. Содер
зы 3 определяли по гидролизу флуоресцентного
жание ионов нормировали на общее количество
субстрата каспазы 3 (Ac DEVD AMC, N аце
белка в образце.
тил Asp Glu Val Asp AMC) в присутствии и в
Статистическая обработка данных. Анализ
отсутствие ее ингибитора Ac DEVD CHO, как
данных и их визуализацию проводили с исполь
описано ранее [23].
зованием пакета ggplot2 в языке R [25]. Все зна
Внутриклеточное содержание Na+, K+ и Rb+.
чения представлены в виде среднего ± стандарт
Активность Na,K ATPазы оценивали по ско
ная ошибка.
рости КТС чувствительного входа Rb+ или
Материалы. Метил [3H] тимидин, 22NaCl и
86Rb+, устойчивого к буметаниду (ингибитор
86RbCl были приобретены у
«PerkinElmer»
Na,K,Cl котранспортера) [22]. Клетки предва
(США),
«ICN Biomedicals Inc.» (США) и
рительно инкубировали в 0,5 мл среды REGM
«Amersham» (Канада) соответственно. DEVD
(HREC) или ECGM (HUVEC), содержащей раз
AMC и DEVD CHO были получены от «BIO
личные концентрации уабаина или МБГ. Через
MOL Research Laboratories» (США). Остальные
3 ч добавляли 0,5 мл той же среды, содержащей
реактивы были приобретены у фирм «Sigma
2 мкКи/мл 86Rb+ (HREC) или 2,5 мМ RbCl
Aldrich» (США),
«Gibco
«Thermo Fisher
(HUVEC), 10 мкМ буметанида и КТС, и инку
Scientific» (США) и «Anachemia» (Канада).
бировали в течение 10 мин.
Внутриклеточное содержание Na+ и K+ в
HREC определяли как стационарное распреде
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
ление внеклеточного и внутриклеточного 22Na+
и 86Rb+ [23], в HUVEC - с помощью метода пла
Ионные потоки. Взаимодействие Na,K
менной атомно абсорбционной спектрометрии,
ATPазы с КТС является относительно медлен
как это описано в [24]. HREC предварительно
ным процессом. Например, в клетках эпителия
инкубировали в 0,5 мл среды REGM, содержа
почки собаки (MDCK) насыщение участков
щей различные концентрации уабаина или
связывания уабаином в концентрации 0,13 мкМ
МБГ. Через 3 ч добавляли 0,5 мл той же среды,
происходит в течение 1 ч [26]. Учитывая этот
БИОХИМИЯ том 85 вып. 4 2020
590
КЛИМАНОВА и др.
а
б
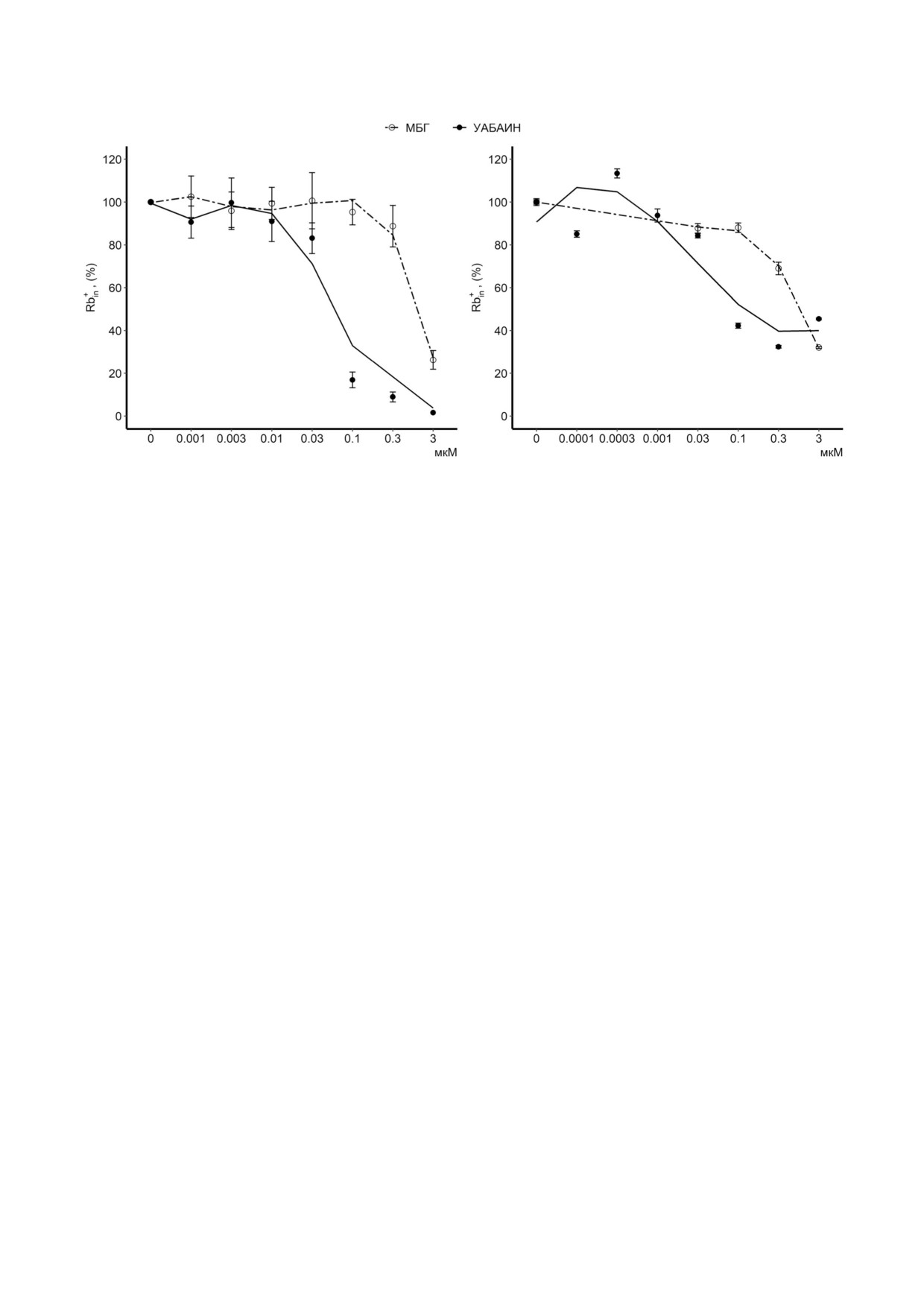
Рис. 1. Дозозависимое влияние уабаина и МБГ на транспорт Rb+ в HREC (а) и HUVEC (б). Клетки предварительно инку
бировали в 0,5 мл ростовой среды, содержащей различные концентрации уабаина или МБГ. Через 3 ч добавляли 0,5 мл
той же среды, содержащей 2 мкКи/мл 86Rb+ (HREC) или 2,5 мМ RbCl (HUVEC), 10 мкМ буметанида и КТС, и инкубиро
вали в течение 10 мин. Результаты представлены в виде среднего значения ± S.E., n = 3-6
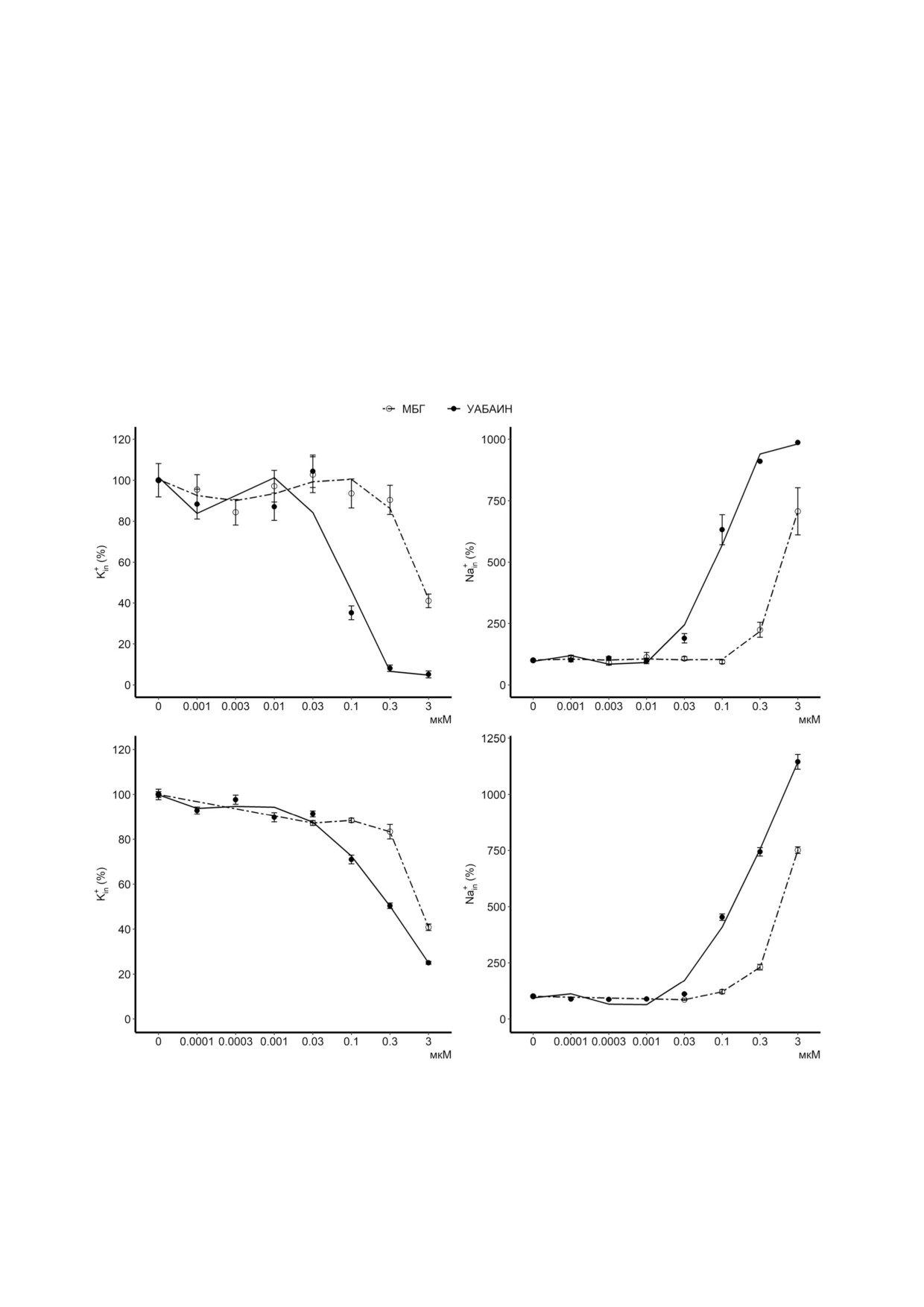
факт, клетки предварительно инкубировали с
ветственно (рис. 2, а, б). Существенные разли
различными концентрациями уабаина и МБГ в
чия были зафиксированы также при анализе
течение 3 ч, после чего добавляли к ним Rb+
действия этих КТС на внутриклеточное содер
(HUVEC) или 86Rb+ (HREC), используемый в
жание Na+ и K+ в HUVEC (IC50 ~0,3 и 1 мкМ для
качестве аналога K+ для оценки активности
уабаина и МБГ соответственно) (рис. 2, в, г).
Na,K ATPазы в стандартных условиях. На рис. 1
Суммируя эти данные, можно заключить, что
показано, что в HREC и HUVEC уабаин в кон
сродство Na,K ATPазы к уабаину существенно
центрации 0,07 мкМ приводил к полумакси
выше (минимум на порядок), чем к МБГ, в обо
мальному ингибированию скорости входа Rb+.
их типах исследуемых клеток, что согласуется с
В обоих типах клеток МБГ обеспечивал такой
нашими данными, полученными ранее с ис
же эффект в концентрациях, минимум на поря
пользованием высокоочищенной α1β1 изо
док больше (IC50 ~ 2 и 0,7 мкМ в HREC и
формы Na,K ATPазы [29]. При этом значитель
HUVEC соответственно). Кроме того, в присут
ное изменение внутриклеточного содержания
ствии 0,3 нМ уабаина наблюдали достоверное
Na+ и K+ вследствие ингибирования Na насоса
увеличение буметанид чувствительного входа
происходило при концентрациях обоих КТС,
Rb+ в HUVEC, что, скорее всего, связано с акти
превышающих физиологический диапазон.
вацией Na,K ATPазы. Активация Na,K АТРазы
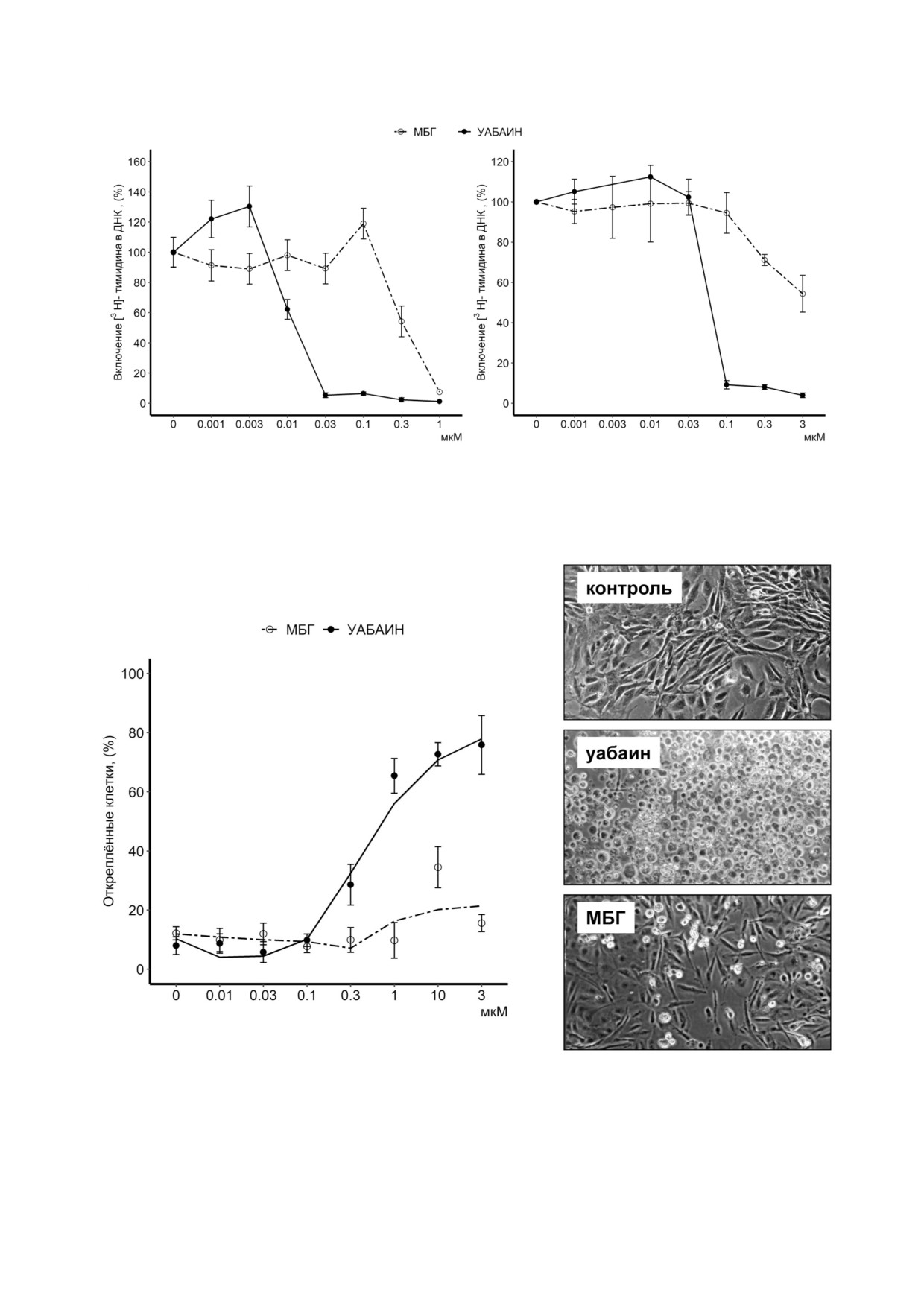
Синтез ДНК. Как в случае HREC, так и в
наномолярными концентрациями уабаина - яв
случае HUVEC, 30 часовая преинкубация кле
ление, описанное еще в 1960 х гг. [27, 28]. Меха
ток с уабаином в диапазоне концентраций от 1
низм этого явления обсуждается в литературе.
до 10 нМ увеличивала включение [3H] тимиди
Поскольку это явление неоднократно наблюда
на в ДНК до 40% (рис. 3). Это наблюдение сог
лось не только на клетках, но и на очищенном
ласуется с полученными ранее данными об уве
ферменте, предполагается, что это явление
личении синтеза ДНК и клеточной пролифера
обусловлено олигомерной структурой фермента
ции, полученными на гладкомышечных клет
(αβ)2, когда насыщение только одного центра за
ках сосудов (VSMC) собаки, быка и человека
счет наличия кооперативных взаимодействий
[30-32], клетках гладких мышц предстательной
вызывает активацию, а последующее насыще
железы человека [33], REC крысы и опоссума
ние второго центра олигомера приводит к инги
[12, 34] и HUVEC [35, 36]. В отличие от низких
бированию активности.
доз уабаина, повышение его концентрации до
Инкубация HREC в течение 3 ч в присут
0,03 и 0,1 мкМ полностью ингибировало вклю
ствии уабаина и МБГ приводила к полумакси
чение [3H] тимидина в ДНК в HREC и HUVEC
мальному ингибированию активности Na,K
соответственно. Не было обнаружено какой
ATPазы со значениями IC50 ~0,08 и 3 мкМ соот
либо активации синтеза ДНК под действием
БИОХИМИЯ том 85 вып. 4 2020
ДЕЙСТВИЕ КАРДИОСТЕРОИДОВ НА ЭПИТЕЛИЙ И ЭНДОТЕЛИЙ
591
МБГ в HUVEC, тогда как в HREC наблюдали
жение роста клеток наблюдали при более высо
~ 25% активацию включения метки в ДНК при
ких концентрациях уабаина, вызывающих дис
концентрации этого КТС 0,1 мкМ. При повы
сипацию трансмембранного градиента Na+ и K+
шении концентрации до 1 мкМ МБГ пол
[37].
ностью ингибировал синтез ДНК в HREC, а в
Действительно, максимальное увеличение
HUVEC происходило его снижение на 50%
синтеза ДНК в HREC было отмечено в присут
(рис. 3).
ствии 3 нМ уабаина (рис. 3), тогда как значи
Эти результаты коррелируют с данными о
тельное снижение входа 86Rb+ и повышение
том, что инкубация HUVEC в присутствии
[Na+]i были обнаружены при его концентрациях
1-3 нМ уабаина, которая сопровождается
>10 нМ (рис. 1 и 2).
уменьшением соотношения [Na+]i/[K+]i за счет
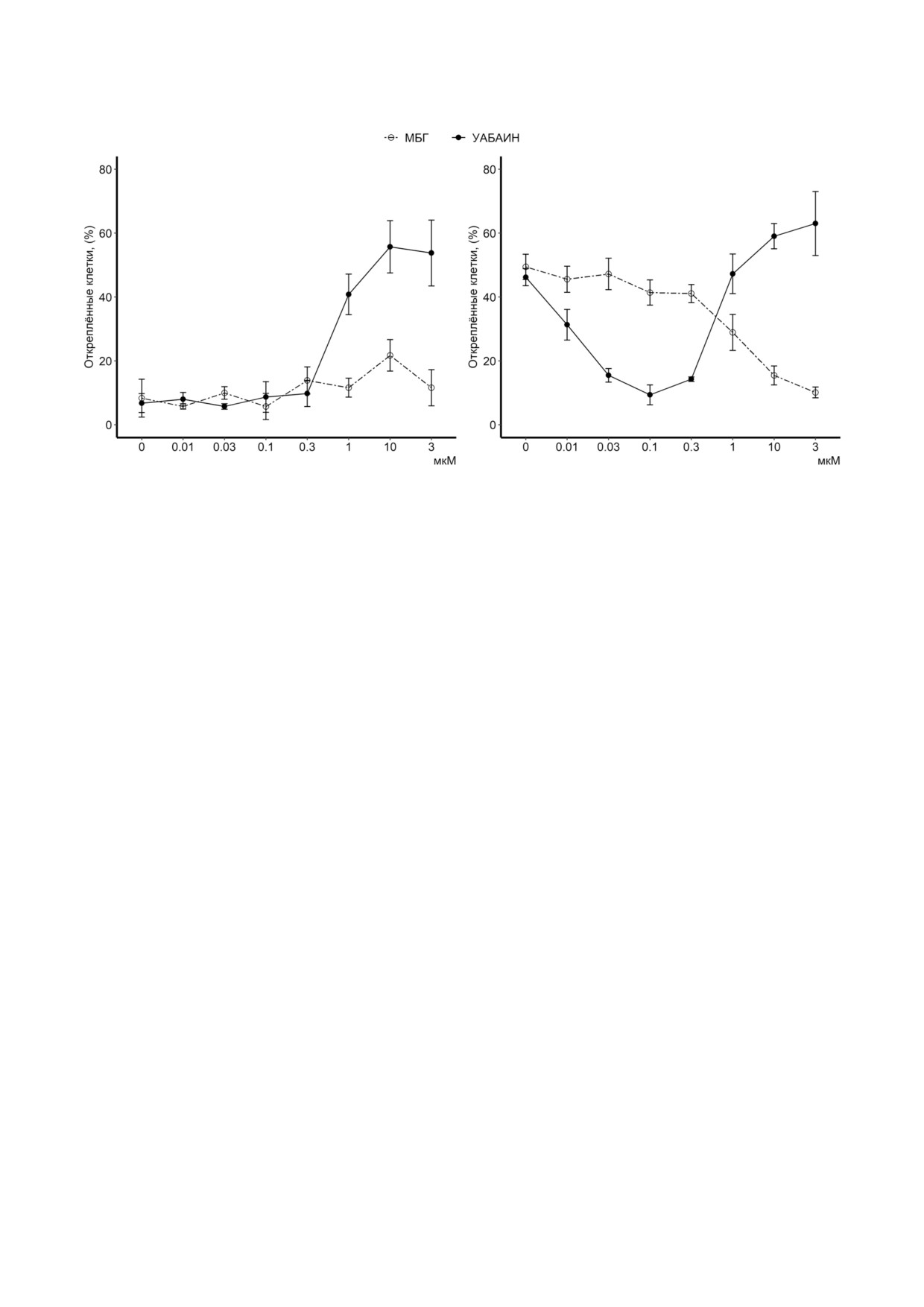
Гибель клеток. Наряду со снижением синтеза
активации Na,K ATPазы, приводит к увеличе
ДНК существенное ингибирование включения
нию клеточной пролиферации. При этом сни
[3H] тимидина в ДНК в HREC и HUVEC, обра
а
б
в
г
Рис. 2. Дозозависимое влияние уабаина и МБГ на внутриклеточное содержание K+ и Na+ в HREC (а, б) и HUVEC (в, г).
HREC предварительно инкубировали в 0,5 мл ростовой среды, содержащей различные концентрации уабаина или МБГ.
Через 3 ч добавляли 0,5 мл той же среды, содержащей 0,5 мкКи/мл 86Rb+ или 2 мкКи/мл 22Na+ и КТС, и инкубировали в
течение 10 мин. Внутриклеточное содержание Na+ и K+ в отсутствие КТС было принято за 100%. Результаты представле
ны в виде среднего значения ± S.E., n = 3-6
БИОХИМИЯ том 85 вып. 4 2020
592
КЛИМАНОВА и др.
а
б
Рис. 3. Дозозависимое влияние уабаина и МБГ на включение [3H] тимидина в ДНК HREC (а) и HUVEC (б). Клетки ин
кубировали в течение 30 ч в 1 мл ростовой среды, содержащей различные концентрации уабаина или МБГ, а затем добав
ляли 50 мкл той же среды, содержащей 1 мкг [3H] тимидина, и инкубировали в течение 15 ч. Результаты представлены в
виде среднего значения ± S.E., n = 4
а
б
Рис. 4. Влияние уабаина и МБГ на выживаемость HREC. а - Доля открепившихся клеток в зависимости от концентрации
уабаина и МБГ. HREC инкубировали в бессывороточной среде, содержащей различные концентрации уабаина или МБГ,
в течение 45 ч. Общее количество прикрепленных и открепившихся клеток было принято за 100%. Результаты представ
лены в виде среднего значения ± S.E., n = 4.; б - фазово контрастная микроскопия HREC, обработанных бессывороточ
ной средой, содержащей 3 мкМ уабаина или МБГ, в течение 45 ч (×100 увеличение)
БИОХИМИЯ том 85 вып. 4 2020
ДЕЙСТВИЕ КАРДИОСТЕРОИДОВ НА ЭПИТЕЛИЙ И ЭНДОТЕЛИЙ
593
а
б
Рис. 5. Влияние уабаина и МБГ на выживаемость HUVEC. Доля открепившихся HUVEC в зависимости от концентрации
уабаина и МБГ. Клетки инкубировали в ростовой (а) или в бессывороточной среде (б), содержащей различные концент
рации уабаина или МБГ, в течение 45 ч. Общее количество прикрепленных и открепившихся клеток было принято за
100%. Результаты представлены в виде среднего значения ± S.E., n = 4
ботанных уабаином в концентрациях
анализом расщепления хроматина и активности
>0,03 мкМ, может быть обусловлено снижением
каспазы 3 (таблица). Увеличение концентрации
выживаемости клеток. Чтобы оценить это, была
уабаина до 3 мкМ приводило к массовому от
использована фазово контрастная микроско
креплению клеток (рис. 5, б).
пия и проанализировано прикрепление клеток к
подложкам. Не было обнаружено увеличения
смертности HREC по отношению к контролю
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
при их выдерживании в течение 45 ч в бессыво
роточной среде с 0,1 мкМ уабаина, тогда как по
В течение последних трех десятилетий мно
вышение его концентрации с 0,3 до 3 мкМ при
гие исследовательские группы сообщали, что
водило к отслоению и массивному увеличению
концентрация уабаина, МБГ и других КТС в
количества набухших плавающих клеток
плазме крови в норме изменяется от 0,1 до 1 нМ
(рис. 4). Этот тип гибели клеток впервые был
и увеличивается до 10 нМ при некоторых пато
обнаружен в обработанных уабаином клетках
логических состояниях [7]. Последние данные
MDCK [38] и эндотелия из аорты свиньи
свидетельствуют в пользу того, что эндогенные
(PAEC) [39] и назван онкозом [40]. В отличие от
КТС наряду с повышением [Na+]i за счет инги
уабаина 45 часовая инкубация с 3 мкМ МБГ не
бирования Na насоса могут участвовать в пато
влияла на выживаемость HREC (рис. 4). Анало
генезе гипертонической болезни и других нару
гичные результаты были получены при исследо
шений, вызывая также Na+i независимую пере
вании дозозависимого действия уабаина и МБГ
дачу сигналов, которая приводит к тканеспеци
на открепление HUVEC, содержащихся в росто
фической модуляции клеточной пролиферации
вой среде (рис. 5, а).
и смерти [15]. Стоит отметить, что в настоящий
В отличие от REC и PAEC [38,39] отсутствие
момент существует несколько основных вопро
сыворотки в среде вызывало апоптоз HUVEC, о
сов, связанных с функционированием Na,K
чем свидетельствуют данные по активации кас
ATPазы, относительно которых отсутствует еди
пазы 3 [41]. На рис. 5, б показано, что открепле
ное мнение среди различных групп исследовате
ние апоптотических клеток в бессывороточной
лей. К таким вопросам относится и проблема
среде практически полностью устранялось под
«эндогенных КТС» [42]. Данные, полученные в
действием уабаина и МБГ в концентрациях 0,1 и
нашем исследовании, привели нас к четырем
3 мкМ соответственно. Антиапоптотическое
выводам:
действие уабаина и МБГ было подтверждено
1) МБГ в физиологических концентрациях
фазово контрастной микроскопией, а также не может влиять на функцию клеток почечного
БИОХИМИЯ том 85 вып. 4 2020
594
КЛИМАНОВА и др.
эпителия и сосудистого эндотелия человека,
мы, лежащие в основе этого интригующего яв
экспрессирующих α1 Na,K ATPазу, посред
ления, остаются неизвестными.
ством изменения [Na+]i/[K+]i соотношения.
Таким образом, активация синтеза ДНК в
Действительно, существенную модуляцию
обоих исследуемых типах клеток наблюдалась
активности Na,K ATPазы (рис. 1), измене
при концентрации уабаина <10 нМ, при этом
ние внутриклеточного содержания Na+ и K+
полное ингибирование синтеза ДНК происхо
(рис. 2), а также влияние на пролиферацию и
дило в присутствии 30 и 100 нМ уабаина в HREC
смерть HREC и HUVEC (рис. 3 и 5) мы наблю
и HUVEC соответственно. Смерть клеток обоих
дали при концентрациях МБГ >100 нМ, что как
типов наблюдалась при концентрации уабаина,
минимум в 50 раз выше его максимальной кон
превышающей 0,3 мкМ. Концентрации уабаи
центрации, детектированной в плазме крови
на, обеспечивающие полумаксимальное инги
[34]. Следует подчеркнуть, что наши результаты
бирование Na,K ATPазы в HREC и HUVEC,
не исключают возможного влияния маринобу
составляли ~0,08 и 0,3 мкМ соответственно. По
фагенина на функции этих клеток из за его
всей видимости, ингибирование синтеза ДНК и
локального накопления в ограниченных в
смерть клеток обусловлены увеличением
пространстве клеточных компартментах. Дозо
[Na+]i/[K+]i соотношения в результате ингиби
зависимый эффект этого КТС на Na+i, K+i
рования Na,K ATPазы.
опосредованные и независимые сигналы в
Активацию синтеза ДНК в HREC наблюда
других типах клеток заслуживает дальнейшего
ли при 0,1 мкМ МБГ, на синтез ДНК в HUVEC
изучения;
МБГ подобного действия не оказывал, при этом
2) уабаин в физиологических концентрациях
1 мкМ этого стероида полностью подавлял син
влияет на пролиферациию клеток почечного
тез ДНК в HREC и на 50% - в HUVEC. Однако
эпителия, что не связано с ингибированием
не была обнаружена гибель обоих типов клеток
Na,K ATPазы и увеличением соотношения
при воздействии на них МБГ. Концентрация
[Na+]i/[K+]i. Действительно, максимальное уве
этого КТС, при которой происходило полумак
личение синтеза ДНК в HREC наблюдалось в
симальное ингибирование Na,K ATPазы в
присутствии 3 нМ уабаина (рис. 3), тогда как
HREC и HUVEC, составляла ~1 мкМ.
значительное снижение входа 86Rb+ и увеличе
Разницу в эффектах, обусловленных разны
ние [Na+]i было обнаружено при концентрациях
ми стероидами на один и тот же тип клеток,
уабаина, превышающих 10 нМ (рис. 1 и 2). В от
можно объяснить различием в сродстве этих
личие от HREC, в HUVEC в присутствии нано
КТС к Na,K ATPазе [29]. Различия в эффектах
молярных концентраций уабаина происходило
одного КТС на разные типы клеток опосредова
снижение входа Rb+ (рис. 1). Для оценки отно
ны, по всей видимости, изоферментным соста
сительного влияния эндогенного уабаина на ре
вом Na,K ATPазы, присутствующей в мембра
гуляцию Na+i,K+i опосредованных функций
нах этих клеток. Так, в HREC экспрессируется
клеток эндотелия также требуются дополни
только α1β1 изофермент, тогда как в HUVEC
тельные эксперименты;
присутствует также α1β3 (собственные неопуб
3) уабаин и МБГ ингибировали апоптоз
ликованные данные).
HUVEC, индуцированный их инкубацией в сре
Принято считать, что Na,K АТРаза является
де без сыворотки (т. е., без ростовых факторов),
единственным рецептором для КТС. Однако в
в концентрациях, превышающих 10 и 1000 нМ
последнее время появились данные, свидетель
соответственно (рис. 5). При этих концентраци
ствующие, что эти соединения влияют на мета
ях они ингибировали Na,K ATPазу (рис. 1) и
болизм клетки (например, на синтез холестери
увеличивали соотношение [Na+]i/[K+]i. Это наб
на), воздействуя на синтез белков через белки
людение согласуется с [Na+]i/[K+]i опосредо
регуляторы [16, 44, 45]. Стоит отметить, что
ванным механизмом антиапоптотического
прямых доказательств того, что КТС взаимодей
действия уабаина, выявленным у VSMC крыс
ствуют с этими регуляторными белками, лока
[22] и PAEC [39];
лизованными внутри клетки, в цитируемых ра
4) уабаин при концентрациях выше 0,1 мкМ
ботах нет. Ранее нами было показано, что изме
вызывал смерть HREC и HUVEC, классифици
нение
[Na+]i/[K+]i соотношения влияет на
рованную ранее как онкоз. Несмотря на значи
экспрессию многих генов даже в присутствии
тельное ингибирование Na,K ATPазы и увели
внутри и внеклеточных хелаторов Ca2+ [46], т.е.
чение отношения [Na+]i/[K+]i, 3 мкМ МБГ не
изменение метаболизма, обнаруженное в ука
оказывало цитотоксического действия на оба
занных выше работах, может быть обусловлено
типа клеток (рис. 4, рис. 5). Это наблюдение сог
именно изменением [Na+]i/[K+]i соотношения,
ласуется с отчетливым влиянием уабаина и МБГ
которое авторы этих работ не контролировали.
на выживаемость клеток MDCK [43]. Механиз
С другой стороны, мы обнаружили, что инкуба
БИОХИМИЯ том 85 вып. 4 2020
ДЕЙСТВИЕ КАРДИОСТЕРОИДОВ НА ЭПИТЕЛИЙ И ЭНДОТЕЛИЙ
595
ция HUVEC с уабаином и МБГ в концентраци
Благодарности. Мы выражаем глубокую
ях, не оказывающих влияния на [Na+]i/[K+]i со
признательность профессору А.Я. Багрову
отношение, не приводит к изменению тран
(Санкт Петербург, Россия) за любезно предо
скриптома этих клеток [47]. Таким образом,
ставленный маринобуфагенин.
вопрос о наличии иных мишеней для КТС, по
Конфликт интересов. Авторы заявляют, что у
мимо Na,K АТРазы, остается открытым.
них нет конфликта интересов.
Cоблюдение этических норм. Настоящая ра
бота не содержит каких либо исследований, в
Финансирование. Работа выполнена при фи
которых были использованы в качестве объек
нансовой поддержке РФФИ (грант 18 34 00344). тов люди и животные.
СПИСОК ЛИТЕРАТУРЫ
1.
Krikler, D. M. (1985) The foxglove, “the old woman from
human umbilical vein endothelial cells (HUVEC): evi
Shropshire” and William Withering, J. Am. Coll. Cardiol.,
dence for the presence of alpha1 and beta3, Cell. Mol. Biol.,
5, 3 9, doi: 10.1016/s0735 1097(85)80457 5.
47, 319 324.
2.
Krenn, L., and Kopp, B. (1998) Bufadienolides from ani
14.
Zahler, R., Sun, W., Ardito, T., and Kashgarian, M. (1996)
mal and plant sources, Phytochemistry,
48,
1 29,
Na K ATPase alpha isoform expression in heart and vas
doi: 10.1016/s0031 9422(97)00426 3.
cular endothelia: cellular and developmental regulation,
3.
Schatzmann, H. J. (1953) Cardiac glycosides as inhibitors
Am. J. Physiol.,
270,
361371, doi:
10.1152/ajp
of active potassium and sodium transport by erythrocyte
cell.1996.270.1.C361.
membrane, Helv. Physiol. Pharmacol. Acta, 11, 346 354.
15.
Orlov, S. N., Klimanova, E. A., Tverskoi, A. M.,
4.
Skou, J. Chr. (1960) Further investigations on a Mg++ Na+
Vladychenskaya, E. A., Smolyaninova, L. V., and Lopina, O. D.
activated adenosintriphosphatase, possibly related to the
(2017) Na+i,K+i dependent and independent signaling
active, linked transport of Na+ and K+ across the nerve
triggered by cardiotonic steroids: facts and artifacts., Mol.
membrane, Biochim. Biophys. Acta, 42, 6 23, doi: 10.1016/
Basel Switz., 22, 635, doi: 10.3390/molecules22040635.
0006 3002(60)90746 0.
16.
Riganti, C., Campia, I., Kopecka, J., Gazzano, E.,
5.
Skou, J. Chr. (1957) The influence of some cations on an
Doublier, S., Aldieri, E., Bosia, A., and Ghigo, D. (2011)
adenosine triphosphatase from peripheral nerves, Biochim.
Pleiotropic effects of cardioactive glycosides, Curr. Med.
Biophys. Acta, 23, 394 401.
Chem., 18, 872 885, doi: 10.2174/092986711794927685.
6.
Szent Györgyi, A. (1953) Chemical physiology of contrac
17.
Dvela, M., Rosen, H., Feldmann, T., Nesher, M., and
tion in body and heart muscle, Science, 119, 803,
Lichtstein, D. (2007) Diverse biological responses to dif
doi: 10.1126/science.119.3101.803.
ferent cardiotonic steroids, Pathophysiology, 14, 159 166,
7.
Khalaf, F. K., Dube, P., Mohamed, A., Tian, J., Malhotra, D.,
doi: 10.1016/j.pathophys.2007.09.011.
Haller, S. T., and Kennedy, D. J. (2018) Cardiotonic
18.
Katz, A., Lifshitz, Y., Bab Dinitz, E., Kapri Pardes, E.,
steroids and the sodium trade balance: new insights into
Goldshleger, R., Tal, D. M., and Karlish, S. J. D. (2010)
trade off mechanisms mediated by the Na+/K+ ATPase,
Selectivity of digitalis glycosides for isoforms of human
Int. J. Mol. Sci., 19, 2576, doi: 10.3390/ijms19092576.
Na,K ATPase, J. Biol. Chem.,
285,
1958219592,
8.
Blanco, G., and Mercer, R. W. (1998) Isozymes of the Na
doi: 10.1074/jbc.M110.119248.
K ATPase: heterogeneity in structure, diversity in func
19.
Тверской А. М., Локтева В. А., Орлов С. Н., Лопина О. Д.
tion, Am. J. Physiol.,
275,
633650, doi:
10.1152/
(2019) Изменение конформации резистентной и
ajprenal.1998.275.5.F633.
чувствительной к кардиотоническим стероидам α1
9.
Therien, A. G. and Blostein, R. (2000) Mechanisms of
Na,K ATPазы при связывании уабаина, дигоксина и
sodium pump regulation, Am. J. Physiol., 279, 541 566,
маринобуфагенина, Рецепторы и внутриклеточная
doi: 10.1152/ajpcell.2000.279.3.C541.
сигнализация, 1, 181 185.
10.
Rajasekaran, S. A., Gopal, J., Willis, D., Espineda, C.,
20.
Reich, H., Tritchler, D., Herzenberg, A. M., Kassiri, Z.,
Twiss, J. L., and Rajasekaran, A. K. (2004) Na,K ATPase
Zhou, X., Gao, W., and Scholey, J. W. (2005) Albumin
β1 subunit increases the translation efficiency of the α1
activates ERK via EGF receptor in human renal epithelial
subunit in MSV MDCK cells, Mol. Biol. Cell, 15, 3224
cells, J. Am. Soc. Nephrol., 16, 1266 1278, doi: 10.1681/
3232, doi: 10.1091/mbc.E04 03 0222.
ASN.2004030222.
11.
Herrera, V. L., Emanuel, J. R., Ruiz Opazo, N.,
21.
Hartree, E. F. (1972) Determination of protein: a modifi
Levenson, R., and Nadal Ginard, B. (1987) Three differ
cation of the Lowry method that gives a linear photometric
entially expressed Na, K ATPase alpha subunit isoforms:
response, Anal. Biochem., 48, 422 427, doi: 10.1016/0003
structural and functional implications, J. Cell Biol., 105,
2697(72)90094 2.
1855 1865, doi: 10.1083/jcb.105.4.1855.
22.
Orlov, S. N., Thorin Trescases, N., Kotelevtsev, S. V.,
12.
Dmitrieva, R. I., and Doris, P. A. (2003) Ouabain is a
Tremblay, J., and Hamet, P. (1999) Inversion of the intra
potent promoter of growth and activator of ERK1/2 in
cellular Na+/K+ ratio blocks apoptosis in vascular smooth
ouabain resistant rat renal epithelial cells, J. Biol. Chem.,
muscle at a site upstream of caspase 3, J. Biol. Chem., 274,
278, 28160 28166, doi: 10.1074/jbc.M303768200.
16545 16552, doi: 10.1074/jbc.274.23.16545.
13.
Pierre, S., Compe, E., Grillasca, J. P., Plannells, R.,
23.
Pchejetski, D., Taurin, S., Der Sarkissian, S., Lopina, O. D.,
Sampol, J., Pressley, T. A., and Maixent, J. M. (2001) RT
Pshezhetsky, A. V., Tremblay, J., deBlois, D., Hamet, P.,
PCR detection of Na,K ATPase subunit isoforms in
and Orlov, S. N. (2003) Inhibition of Na+,K+ ATPase by
БИОХИМИЯ том 85 вып. 4 2020
596
КЛИМАНОВА и др.
ouabain triggers epithelial cell death independently of
Proteomics analysis of the proliferative effect of low dose
inversion of the [Na+]i/[K+]i ratio, Biochem. Biophys. Res.
ouabain on human endothelial cells., Biol. Pharm. Bull.,
Commun.,
301,
735744, doi:
10.1016/s0006
30, 247 253, doi: 10.1248/bpb.30.247.
291x(02)03002 4.
37.
Tverskoi, A. M., Sidorenko, S. V., Klimanova, E. A.,
24.
Shiyan, A. A., Sidorenko, S. V., Fedorov, D., Klimanova, E. A.,
Akimova, O. A., Smolyaninova, L. V., Lopina, O. D., and
Smolyaninova, L. V., Kapilevich, L. V., Grygorczyk, R.,
Orlov, S. N. (2016) Effects of ouabain on proliferation of
and Orlov, S. N. (2019) Elevation of intracellular Na+ con
human endothelial cells correlate with Na+,K+ ATPase
tributes to expression of early response genes triggered by
activity and intracellular ratio of Na+ and K, Biochemistry
endothelial cell shrinkage, |Cell. Physiol. Biochem., 53,
(Moscow), 81, 876 883, doi: 10.1134/S0006297916080083.
638 647, doi: 10.33594/000000162.
38.
Bolivar, J. J., Lazaro, A., Fernandez, S., Stefani, E., Pena
25.
Wickham, H. (2009) Ggplot2: elegant graphics for data
Cruz, V., Lechene, C., and Cereijido, M. (1987) Rescue of
analysis,
2nd edn., Springer Publishing Company,
a wild type MDCK cell by a ouabain resistant mutant, Am.
Incorporated.
J. Physiol. Cell Physiol., 253, 151 161, doi: 10.1152/ajp
26.
Akimova, O. A., Hamet, P., and Orlov, S. N. (2007)
cell.1987.253.1.C151.
[Na+]i/[K+]i independent death of ouabain treated renal
39.
Orlov, S. N., Thorin Trescases, N., Pchejetski, D., Taurin, S.,
epithelial cells is not mediated by Na+,K+ ATPase inter
Farhat, N., Tremblay, J., Thorin, E., and Hamet, P. (2004)
nalization and de novo gene expression, Pflüg. Arch. Eur. J.
Na+/K+ pump and endothelial cell survival:
Physiol., 455, 711, doi: 10.1007/s00424 007 0283 6.
[Na+]i/[K+]i independent necrosis triggered by ouabain,
27.
Palmer, R. F., Lasseter, K. C., and Melvin, S. L. (1966)
and protection against apoptosis mediated by elevation of
Stimulation of Na+ and K+ dependent adenosine triphos
[Na+]i, Pflüg. Arch., 448, 335 345, doi: 10.1007/s00424
phatase by ouabain, Arch. Biochem. Biophys., 113, 629
004 1262 9.
633, doi: 10.1016/0003 9861(66)90240 2.
40.
Orlov, S. N., and Hamet, P. (2005) Apoptosis vs. oncosis:
28.
Godfraind, T., and Ghysel Burton, J. (1977) Binding sites
role of cell volume and intracellular monovalent cations. In
related to ouabain induced stimulation or inhibition of the
cell volume and signaling (Lauf, P. K., and Adragna, N. C.,
sodium pump, Nature, 265, 165, doi: 10.1038/265165a0.
eds) Springer, US, pp. 219233, doi: 10.1007/0 387
29.
Klimanova, E. A., Petrushanko, I. Y., Mitkevich, V. A.,
23752 6_21.
Anashkina, A. A., Orlov, S. N., Makarov, A.A., and
41.
Trevisi, L., Visentin, B., Cusinato, F., Pighin, I., and
Lopina, O. D. (2015) Binding of ouabain and marinobufa
Luciani, S. (2004) Antiapoptotic effect of ouabain on
genin leads to different structural changes in Na,K ATPase
human umbilical vein endothelial cells, Biochem. Biophys.
and depends on the enzyme conformation, FEBS Lett.,
Res. Commun., 321, 716 721, doi: 10.1016/j.bbrc.2004.
589, 2668 2674, doi: 10.1016/j.febslet.2015.08.011.
07.027.
30.
Aydemir Koksoy, A., Abramowitz, J., and Allen, J. C.
42.
Askari, A. (2019) The sodium pump and digitalis drugs:
(2001) Ouabain induced signaling and vascular smooth
dogmas and fallacies, Pharmacol. Res. Perspect., 7, e00505,
muscle cell proliferation, J. Biol. Chem., 276, 46605 46611,
doi: 10.1002/prp2.505.
doi: 10.1074/jbc.M106178200.
43.
Akimova, O. A., Bagrov, A. Y., Lopina, O. D., Kamernitsky,
31.
Abramowitz, J., Dai, C., Hirschi, K., Dmitrieva, R. I.,
A. V., Tremblay, J., Hamet, P., and Orlov, S. N. (2005)
Doris, P. A., Liu, L., and Allen, J. C. (2003) Ouabain and
Cardiotonic steroids differentially affect intracellular Na+
marinobufagenin induced proliferation of human umbili
and [Na+]i/[K+]i independent signaling in C7 MDCK
cal vein smooth muscle cells and a rat vascular smooth
cells, J. Biol. Chem., 280, 832 839, doi: 10.1074/jbc.
muscle cell line, A7r5, Circulation, 108, 30483053,
M411011200.
doi: 10.1161/01.CIR.0000101919.00548.86.
44.
Campia, I., Gazzano, E., Pescarmona, G., Ghigo, D.,
32.
Li, M., Wang, Q., and Guan, L. (2007) Effects of ouabain
Bosia, A. and Riganti, C. (2009) Digoxin and ouabain
on proliferation, intracellular free calcium and c myc
increase the synthesis of cholesterol in human liver cells,
mRNA expression in vascular smooth muscle cells, J.
Cell. Mol. Life Sci., 66, 1580 1594, doi: 10.1007/s00018
Comp. Physiol., 177, 589 595, doi: 10.1007/s00360 007
009 9018 5.
0157 4.
45.
Campia, I., Sala, V., Kopecka, J., Leo, C., Mitro, N.,
33.
Chueh, S. C., Guh, J. H., Chen, J., Lai, M. K., and
Costamagna, C., Caruso, D., Pescarmona, G., Crepaldi, T.,
Teng, C. M. (2001) Dual effects of ouabain on the regula
and Ghigo, D. et al. (2012) Digoxin and ouabain induce
tion of proliferation and apoptosis in human prostatic
the efflux of cholesterol via liver X receptor signalling and
smooth muscle cells, J. Urol.,
166,
347353,
the synthesis of ATP in cardiomyocytes, Biochem. J., 447,
doi: 10.1016/S0022 5347(05)66157 5.
301 311, doi: 10.1042/BJ20120200.
34.
Khundmiri, S. J., Metzler, M. A., Ameen, M., Amin, V.,
46.
Sidorenko, S., Klimanova, E., Milovanova, K., Lopina, O. D.,
Rane, M. J. and Delamere, N. A. (2006) Ouabain induces
Kapilevich, L. V., Chibalin, A. V., and Orlov, S. N. (2018)
cell proliferation through calcium dependent phosphory
Transcriptomic changes in C2C12 myotubes triggered by
lation of Akt (protein kinase B) in opossum kidney proxi
electrical stimulation: role of Ca2+i mediated and Ca2+i
mal tubule cells, Am. J. Physiol. Cell Physiol., 291, 1247
independent signaling and elevated [Na+]i/[K+]i ratio,
1257, doi: 10.1152/ajpcell.00593.2005.
Cell Calcium, 76, 72-86, doi: 10.1016/j.ceca.2018.09.
35.
Saunders, R. and Scheiner Bobis, G. (2004) Ouabain
007.
stimulates endothelin release and expression in human
47.
Klimanova, E. A., Tverskoi, A. M., Koltsova, S. V.,
endothelial cells without inhibiting the sodium pump, Eur.
Sidorenko, S. V., Lopina, O. D., Tremblay, J., Hamet, P.,
J. Biochem.,
271,
10541062, doi:
10.1111/j.1432
Kapilevich, L. V., and Orlov, S. N. (2017) Time and dose
1033.2004.04012.x.
dependent actions of cardiotonic steroids on transcriptome
36.
Qiu, J., Gao, H. Q., Zhou, R. H., Liang, Y., Zhang, X. H.,
and intracellular content of Na+ and K+: a comparative
Wang, X. P., You, B. A., and Cheng, M.
(2007)
analysis, Sci. Rep., 7, 45403, doi: 10.1038/srep45403.
БИОХИМИЯ том 85 вып. 4 2020
ДЕЙСТВИЕ КАРДИОСТЕРОИДОВ НА ЭПИТЕЛИЙ И ЭНДОТЕЛИЙ
597
OUABAIN AND MARINOBUFAGENIN: A POSSIBLE PHYSIOLOGICAL
EFFECTS ON HUMAN EPITHELIAL AND ENDOTHELIAL CELLS
Е. А. Klimanova*, D. А. Fedorov, S. V. Sidorenko,
P. А. Abramicheva, О. D. Lopina, and S. N. Orlov
Lomonosov Moscow State University, Faculty of Biology, 119234 Moscow, Russia; E+mail: klimanova.ea@yandex.ru
Received December 19, 2019
Revised February 18, 2020
Accepted February 18, 2020
Longtime study focused on the search of Na,K ATPase (NKA) endogenous inhibitors of mammalian tissues resulted
in the purification of ouabain, marinobufagenin (MBG) and other cardiotonic steroids (CTS) from blood plasma.
Production of ouabain and MBG is known to increase during essential hypertension and other diseases coupled to
hypervolemia. We carried out comparative analysis of the effect of these two CTS on the Na,K АТРase activity mea
sured as transport of Na+, K+, and Rb+, proliferation and death of human renal epithelial cells (HREC) and human
umbilical vein endothelial cells (HUVEC) expressing α1 Na,K ATPase. Ouabain concentrations which provide half
maximal inhibition of Rb+ influx (IC50) into HREC and HUVEC were 0,07 μМ. In both types of cells, the values of
IC50 for MBG were by a factor of 10 higher than for ouabain. Incubation of HREC and HUVEC with ouabain in the
range of concentrations 0,001 0,01 μМ for 30 h led to the growth of [3H] thimidine incorporation into DNA by 40%,
further increase of ouabain concentration up to 0,1 μМ completely suppressed DNA synthesis. MBG at concentra
tion 0,1 μМ activated DNA synthesis by 25% in HREC, but not in HUVEC; 1 μМ MBG completely inhibited DNA
synthesis in HREC, and by 50% in HUVEC. In contrast to HREC, HUVEC incubation in free serum media provoked
apoptosis, which was almost completely suppressed by ouabain and MBG at concentrations 0,1 and 3 μМ respec
tively. Taking into account all these data we can conclude: 1) in HREC and HUVEC MBG effects at concentrations
detected in blood plasma (< 0,01 μМ) are not due to the [Na+]i/[K+]i ratio change; 2) ouabain effect on these cells
in physiological concentrations range is mediated probably by activation of Na,K ATPase that leads to cell prolifera
tion.
Keywords: ouabain, marinobufagenin, Na,K ATPase, [Na+]i/[K+]i ratio, epithelium, endothelium
БИОХИМИЯ том 85 вып. 4 2020