БИОХИМИЯ, 2020, том 85, вып. 5, с. 729 - 735
УДК 57.013:577.11
МЕЛАНИН ЛИШАЙНИКОВ Cetraria islandica И Pseudevernia furfuracea:
ОСОБЕННОСТИ СТРОЕНИЯ И ФИЗИКО ХИМИЧЕСКИЕ СВОЙСТВА
© 2020
А.Е. Рассабина1, О.П. Гурьянов1, Р.П. Бекетт2, Ф.В. Минибаева1,3*
1 Казанский институт биохимии и биофизики - обособленное структурное подразделение
Федерального государственного бюджетного учреждения науки «Федеральный исследовательский центр
«Казанский научный центр Российской академии наук», 420111 Казань, Россия;
электронная почта: minibayeva@kibb.knc.ru
2 School of Life Sciences, University of KwaZulu+Natal, 3209 Scottsville, South Africa
3 Казанский (Приволжский) федеральный университет, 420008 Казань, Россия
Поступила в редакцию 20.02.2020
После доработки 27.03.2020
Принята к публикации 30.03.2020
Лишайники, симбиотические фотосинтезирующие организмы, таллом которых образован грибом и водо!
рослью/цианобактерией, обладают высокой стрессовой устойчивостью. Одним из компонентов эффектив!
ной защиты лишайников от действия неблагоприятных факторов среды является наличие уникальных ме!
таболитов, в частности высокомолекулярных темных пигментов - меланинов. Химический состав и струк!
турная организация меланинов лишайников остаются малоизученными. В настоящей работе проанализи!
рованы элементный состав, основные функциональные группы и физико!химические свойства меланина,
экстрагированного из лишайников Cetraria islandica и Pseudevernia furfuracea. По соотношению C/N установ!
лено, что данный пигмент относится к типу алломеланина. В структуре меланина выявлены функциональ!
ные группы, обеспечивающие его фотопротекторные и антиоксидантные свойства. Предполагается, что
синтез меланина является одним из ключевых защитных механизмов, обеспечивающих выживание лишай!
ников в условиях УФ!излучения.
КЛЮЧЕВЫЕ СЛОВА: меланин, лишайник, ИК!спектроскопия, фотопротекторные свойства, антиокси!
дантная активность.
DOI: 10.31857/S0320972520050115
ВВЕДЕНИЕ
сивности и ультрафиолетового (УФ) облучения
[2]. Пигментация верхней стороны слоевища
Лишайники являются своеобразной группой
лишайников действует как первая линия защи!
симбиотических фотосинтезирующих организ!
ты для предотвращения УФ!индуцированного
мов, таллом которых образован двумя основны!
внутриклеточного повреждения. Особую роль в
ми организмами - грибом (микобионт) и водо!
защите от светового стресса играют меланины.
рослью/цианобактерией (фотобионт). Взаимо!
Меланин представляет собой высокополи!
действие фотобионта и микобионта в лишайни!
мерный пигмент, содержащий фенольные и ин!
ках обусловливает образование в них разнооб!
дольные группы. Меланин придает черную, ко!
разных вторичных метаболитов, таких как ли!
ричневую, красную или рыжую окраску тканям
шайниковые кислоты (в т.ч. усниновая и гиро!
различных живых организмов, включая челове!
форовая кислоты), катехины и полисахариды (в
ка. В зависимости от наличия тех или иных про!
т.ч. лихенин) и другие. Синтез вторичных мета!
межуточных метаболитов различают следующие
болитов в слоевищах лишайников является
основные типы меланинов: эумеланин, феоме!
сложным процессом и зависит как от таксоно!
ланин, 1,8!дигидроксинафталин (DHN)!мела!
мической принадлежности лихенизированного
нин, алломеланин, нейромеланин, пиомеланин
гриба, так и от факторов окружающей среды [1].
и сепия меланин [3]. Такое многообразие обес!
Такими факторами являются высота местности,
печивается различиями в химическом строении
колебания температуры, сезон года, а также ги!
и элементном составе. Характерной особен!
перинсоляция - действие света высокой интен!
ностью алломеланина является то, что он прак!
тически не содержит азота и поэтому представ!
ляет собой полимер простых фенолов. Эумела!
Принятые сокращения: DHN - 1,8!дигидрокси!
нафталин; DPPH - 2,2!дифенил!1!пикрилгидразил; УФ -
нин содержит связанный азот и представляет
ультрафиолет.
собой полимер фенольных и индольных ве!
* Адресат для корреспонденции.
ществ [3].
729
730
РАССАБИНА и др.
Известны два основных метаболических пу!
выживать в условиях интенсивной УФ радиации
ти биосинтеза меланинов - шикиматный и аце!
[9]. В отличие от меланинов человека [11, 12],
татно!малонатный [4]. Субстратом для синтеза
грибов [13, 14], бактерий [15] и дрожжей [16],
эумеланина является аминокислота тирозин,
структура и физико!химические свойства мела!
которая с помощью тирозиназы превращается в
нинов лишайников изучены недостаточно.
L!3,4!диоксифенилаланин (L!DOPA), а затем в
Морфологическая комплексность таллома ли!
дофахинон (DOPA!quinone). Последующее
шайников, многообразие грибных и фотосинте!
окисление дофахинона приводит к получению
зирующих симбионтов, переключение путей
различных мономеров: 5,6!дигидроксииндол!2!
биосинтеза метаболитов в зависимости условий
карбоновой кислоты (DHICA) и 5,6!дигидрок!
окружающей среды - все это обусловливает
сииндола (DHI). В результате полимеризации
сложность изучения свойств меланинов лишай!
данных мономеров образуется эумеланин. Син!
ников. Настоящая работа посвящена анализу
тез алломеланина осуществляется преимущест!
элементного состава, наличия функциональных
венно по ацетатно!малонатному пути, однако
групп, свето!поглотительной способности и ан!
алломеланин содержит в своем составе мономер
тиоксидантной активности меланина лишайни!
ацетат бензохинона, синтезированный по ши!
ков C. islandica и Pseudevernia furfuracea.
киматному пути [4, 5]. Сначала ацетил!КоА под
воздействием фермента поликетидсинтазы
превращается в 1,3,6,8!тетрагидроксинафталин,
МАТЕРИАЛЫ И МЕТОДЫ
а затем в результате активности различных фер!
ментов - в DHN. На данном этапе происходит
Выделение меланина. В качестве объекта ис!
полимеризация DHN!меланина и ацетат бензо!
следований использовали лишайники C. islandi+
хинона с образованием алломеланина.
ca и P. furfuracea, собранные в Айшинском лес!
Ранее нами было проведено количественное
ничестве в окрестностях г. Казани и в окрестнос!
определение меланинов in vivo путем измерения
тях г. Ос, Норвегия. Таллом лишайников очища!
индекса меланизации (Browning reflectance
ли от загрязнений и высушивали при температу!
index, BRI) таллома с использованием интегри!
ре 40 °С в течение 10 мин. Навеску лишайника
рующей сферы и отражающего спектрометра.
(4 г) измельчали в ступке до порошкообразного
Было обнаружено, что лишайник Cetraria
состояния с добавлением жидкого азота. Полу!
islandica характеризуется более высоким индек!
ченный порошок переносили в пробирку и до!
сом меланизации (10,1) по сравнению с другими
бавляли 50 мл 2 М NаOH, рН 10,5. Раствори!
меланизированными лишайниками (4,4 - для
мость в концентрированных растворах щелочей,
Lobaria pulmonaria и 4,8 - для Crocodia aurata) [6].
а не в органических растворителях является од!
До настоящего времени тип и физико!химичес!
ним из критериев отнесения пигментов к мела!
кие свойства меланина C. islandica не были изу!
нинам [17]. В предварительных экспериментах
чены.
было установлено, что меланины не экстрагиро!
Протекторные свойства меланинов, особен!
вались при добавлении воды, этилового спирта,
но при действии на организмы света в диапазо!
ацетона и хлороформа. После 24!часовой инку!
не УФ и света высокой интенсивности, вызыва!
бации смесь фильтровали, а затем центрифуги!
ют большой интерес исследователей к структуре
ровали
(«Hermle Z
36HK», Германия) при
этих полимеров [7, 8]. В настоящее время появ!
15 000 g в течение 10 мин. Супернатант подкис!
ляется информация о защитной роли мелани!
ляли добавлением 2 М HCl до рН 2,5, инкубиро!
нов в талломах лишайников при световом стрес!
вали 12 ч при комнатной температуре и затем
се. Имеются сведения о том, что меланин, со!
повторно центрифугировали при 15 000 g в тече!
держащийся в верхнем коровом слое лишайни!
ние 10 мин. Полученный осадок промывали дис!
ка, защищает фотобионт от разрушения при
тиллированной водой и последовательно очища!
действии света высокой интенсивности [2].
ли органическими растворителями (хлороформ,
Кроме того, меланины лишайников могут обра!
этилацетат и ацетон), а затем высушивали в су!
зовывать комплексы с различными металлами и
шильном шкафу при температуре 40 °С. Очи!
полимерами, например хитином, который явля!
щенный меланин представлял собой темно!ко!
ется компонентом клеточной стенки микобион!
ричневый порошок без посторонних включе!
та [9]. Показано, что в лишайнике Trapelia invo+
ний. Выход продукта составлял ∼10 % от теоре!
luta присутствует эумеланин, который способен
тически возможного.
образовывать комплексы с ураном [10], а ли!
Качественные реакции на меланин. Для про!
шайник Pseudephebe pubescens способен накап!
ведения качественных реакций был приготов!
ливать целый ряд тяжелых металлов благодаря
лен 0,1%!ный раствор меланинов, выделенных
активным парамагнитным центрам меланина и
из лишайников. К навеске меланина (0,001 г)
БИОХИМИЯ том 85 вып. 5 2020
АЛЛОМЕЛАНИНЫ ЛИШАЙНИКОВ
731
добавляли
1
мл дистиллированной воды и
тщательно перемешивали и инкубировали при
50 мкл раствора NH4OH. Проводили три качест!
комнатной температуре в темноте в течение
венные реакции с добавлением к раствору мела!
30 мин, после чего пурпурно!синяя окраска
нина 10% H2O2, 0,5 М KMnO4 и 1% FeCl3 в соот!
раствора менялась на малиновую. Поглощение
ношении 1 : 1 [18].
раствора регистрировали спектрофотометри!
Элементный анализ меланина. Элементный
чески («Shimadzu», Япония) при 517 нм в кюве!
состав меланинов (С, N, Н, S) определяли с по!
те с толщиной поглощающего свет слоя 2 мм. В
мощью анализатора EuroEA
3028!HT!ОМ
качестве стандартного соединения использова!
(«Eurovector SpA», Италия) путем сожжения
ли галловую кислоту («Диаэм», Россия).
пробы в присутствии окислителя в токе инерт!
ного газа. Содержание металлов (металлы I, II и
III групп) и неметаллов (P, S и Cl) оценено при
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
помощи рентгенофлуоресцентного анализа (РФА)
[10] на энергодисперсионном флуоресцентном
Качественные реакции показали, что щелоч!
рентгеновском спектрометре EDX!800HS2
ные растворы меланинов, экстрагированных из
(«Shimadzu», Япония). Для проведения количе!
лишайников C. islandica и P. furfuracea, обесцве!
ственных измерений и оценки полученных дан!
чивались в присутствии H2O2, а в присутствии
ных использовали программное обеспечение
KMnO4 изменяли окраску с коричневой на зеле!
Callidus 4.1.
ную с последующим выпадением осадка (дан!
ИК спектроскопия. Основные функциональ!
ные не представлены). Добавление FeCl3 приво!
ные группы были проанализированы методом
дило к выпадению осадка, который растворялся
ИК!спектроскопии
[10] с использованием
в присутствии избытка FeCl3 (данные не пред!
спектрофотометра IR!Affinty1
(«Shimadzu»,
ставлены). Такое поведение исследуемых пиг!
Япония) в рабочем диапазоне 400-700 см-1. Об!
ментов характерно для меланинов и свидетель!
разец готовили методом прессования меланина
ствует о присутствии в их структуре хиноидных
с KBr. Анализ ИК!спектров меланинов осущест!
и фенольных компонентов [4, 21, 22].
вляли с помощью программного обеспечения
Анализ элементного состава показал, что ме!
OriginPro 8 и базы данных AIST:Spectral Database
ланины в лишайниках C. islandica и P. furfuracea со!
for Organic Compounds, SDBS.
держат в среднем 42% С, 6% H и <2% N (табл. 1).
УФ спектроскопия. Спектры поглощения
Низкое содержание N и соотношение С/N рав!
щелочного раствора меланина (25 мкг/мл в
ное 34 и 35 для C. islandica и P. furfuracea соотве!
0,1 М NaOH) регистрировали в кварцевых кюве!
тственно указывает на то, что данные пигменты
тах с длиной оптического пути 2 мм на спектро!
относятся к типу алломеланин.
фотометре UV!1900 («Shimadzu», Япония) в УФ
Нами установлено, что исследуемые мелани!
и видимом диапазоне спектра (200-700 нм). На
ны лишайников содержат в небольшом количе!
основании экспериментальных данных рассчи!
стве S, K и Fe. Такие элементы, как Na и Ca, от!
тывали коэффициент цветности Е465/665 [12]. Для
сутствуют в меланине C. islandica, Al и Cu отсут!
анализа полученных данных использовалось
ствуют в меланине P. furfuracea. Наличие метал!
программное обеспечение UVProbe 2.70 [17].
ла Zn не было обнаружено в меланинах обоих
Антиоксидантная активность. Антиоксидант!
лишайников (табл. 1). Ранее [9, 17] было показа!
ная активность была измерена c использовани!
но, что меланины лишайников Umbilicaria
ем радикала 2,2!дифенил!1!пикрилгидразила
аfricana, P. Pubescens и Usnea sphacelata также
(«Sigma!Aldrich», Германия) (DPPH) [19, 20].
имеют в своем составе данные элементы.
Меланин различной концентрации (0,5-3 мг/мл)
Результаты ИК!спектроскопии свидетель!
растворяли в диметилсульфоксиде (DMSO), за!
ствуют о наличии разнообразных структурных
тем 10 мкл полученного раствора добавляли к
групп в составе алломеланина. Так, в алломела!
1 мл 0,004% раствора DPPH в этаноле. Образцы
нине, выделенном из C. islandica, наблюдается
Таблица 1. Процентное содержание С, Н, N и прочих элементов в меланинах лишайников C. islandica и P. furfuracea
Вид
Элементный состав, масс. %
Элементы, обнаруженные методом РФА, %
лишайника
С
H
N
C/N
Na
Al
Si
S
Cl
K
Ca
Fe
Cu
Zn
C. islandica
41,0
6,5
1,3
35,2
-
2,7
2,7
1,0
85,7
1,9
0,1
4,1
2,0
-
P. furfuracea
42,1
6,3
1,2
34,4
18,1
−
0,3
3,0
76,5
0,7
0,8
0,6
-
−
БИОХИМИЯ том 85 вып. 5 2020
732
РАССАБИНА и др.
заметная интенсивность пика в области
1020 см-1 (рис. 1, а и б), который относится к ва!
лентным колебаниям (С-О-С)!групп [23, 24].
Напротив, в области 1500-1630 см!1 наблю!
дается небольшая интенсивность пиков, это мо!
жет быть связано с низким содержанием арома!
тических групп (С=С, С=N, С=О) либо с отсут!
ствием (N-H) деформационных колебаний в
алломеланине. Поглощения при 1720 см!1 обна!
ружено не было, что может свидетельствовать об
отсутствии свободных карбоксильных групп
[23]. В области 2340-2360 см-1 наблюдались ва!
лентные колебания (С-С) тройных связей, а в
области 2880-2940 см-1 - валентные колебания
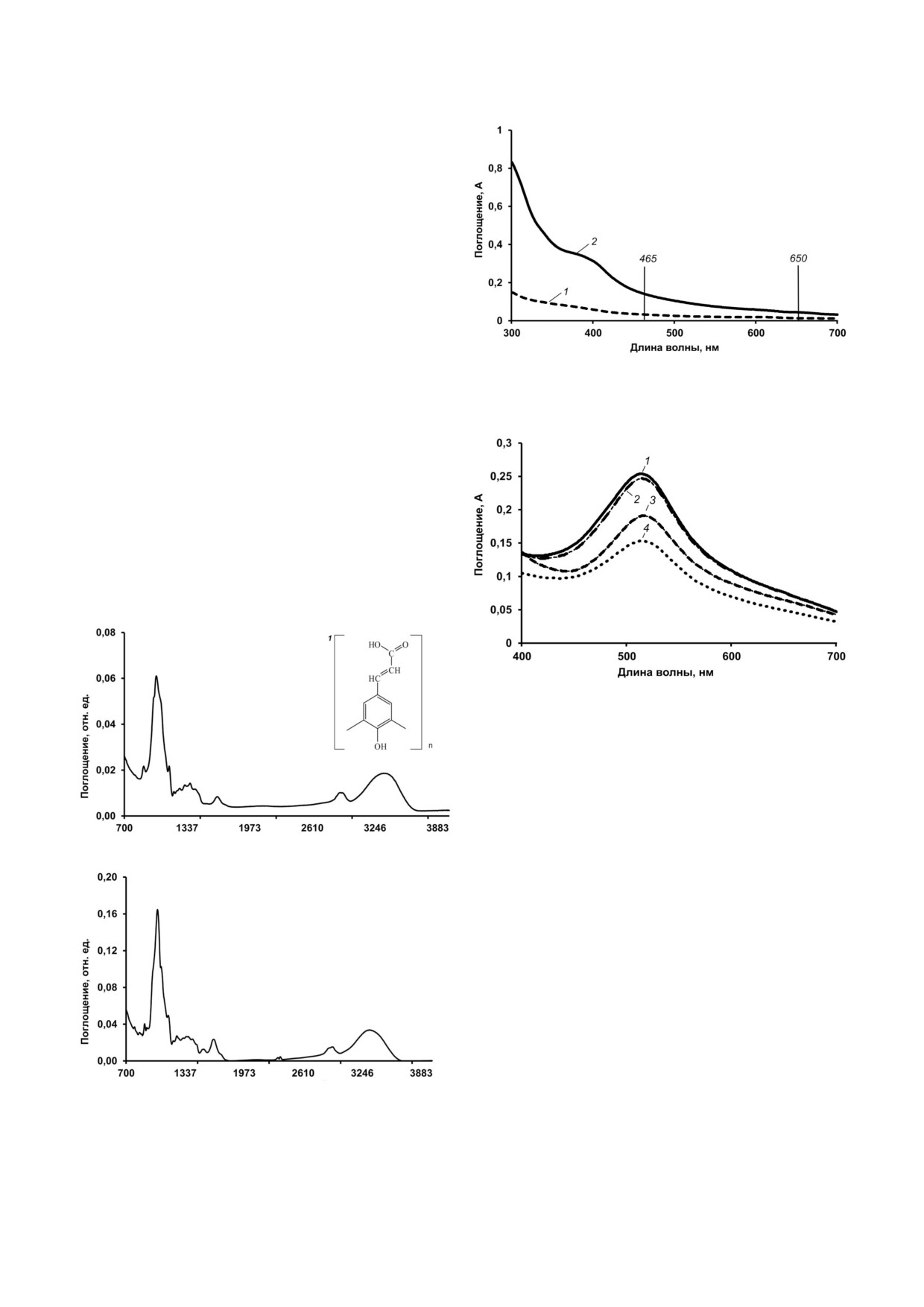
Рис. 2. УФ!спектры поглощения меланинов, выделенных
алифатических (С-Н)!групп (рис. 1, а и б). В
из C. islandica (1) и P. furfuracea (2). Вертикальными линия!
обоих образцах меланинов присутствует широ!
ми обозначены длины волн 465 и 650 нм
кая полоса в области 3350 см-1, которая являет!
ся характеристикой меланина, связанная с вале!
нтными колебаниями ОН!групп [23, 24].
Анализ электронных спектров меланинов ли!
шайников с помощью УФ!спектроскопии вы!
явил плавное снижение поглощения с увеличе!
нием длины волны в области 240-700 нм (рис. 2).
Одномерная характеристика УФ!видимого
поглощения меланинов по параметру E465/E650,
а
Рис. 3. Спектр поглощения спиртового раствора стабиль!
ного радикала DPPH (1) после 30!минутного инкубирова!
ния DPPH с меланинами, выделенными из P. furfuracea (2)
и C. islandica (3), галловая кислота (4)
свидетельствующему о соотношении алифати!
ческих и ароматических структур [7, 21, 25], сос!
тавила 3,42 - для меланина из P. furfuracea и
Волновое число, см-1
2,28 - для меланина из C. islandica.
б
Анализ антиоксидантной активности с ис!
пользованием радикала DPPH показал, что ко!
эффициент IC50 составил 405 и 456 мкг/мл для
меланинов из C. islandica и P. furfuracea соответ!
ственно (рис 3). Для сравнения IC50 для аскорби!
новой кислоты составил 34 мкг/мл, а для галло!
вой кислоты 128 мкг/мл. Данные указывают на
то, что меланины проявляют более низкую анти!
оксидантную активность по сравнению с кисло!
тами органического происхождения.
Волновое число, см-1
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Рис. 1. ИК!спектры меланинов, выделенных из лишайни!
ков C. islandica (а) и P. furfuracea (б). Во вставке показана
Среди разнообразных вторичных метаболи!
химическая структура мономера алломеланина (1)
тов лишайников традиционно большое внима!
БИОХИМИЯ том 85 вып. 5 2020
АЛЛОМЕЛАНИНЫ ЛИШАЙНИКОВ
733
ние уделяется изучению свойств и активности
сокой сорбционной емкостью в отношении
уникальных соединений, в частности лишайни!
многих ионов металлов. Меланины могут легко
ковых веществ, например, париетина, атрано!
связывать потенциально токсичные металлы в
рина, гирофоровой и усниновой кислот, полиса!
лишайниках, благодаря наличию карбоксиль!
харидов, в т.ч. лихенина [26]. Достаточно под!
ных и гидроксильных функциональных групп
робно исследован химический состав многих
[29]. Металлы проникают через коровый слой
метаболитов лишайника C. islandica [27]. Ин!
[30]. Данный слой, образующий внешний кар!
формация о структуре, физико!химических
кас лишайника, состоит из хитин!глюкан!мела!
свойствах и особенностях меланинов лишайни!
нинового комплекса. Жесткий каркас формиру!
ков крайне ограничена. Известно, что мелани!
ется благодаря взаимодействию хитин!мелани!
ны имеют сложную гетероатомную структуру и
нового комплекса микобионта с Ca и Si [31, 32].
способны проявлять антиоксидантные, сорбци!
Это объясняет наличие Ca и Si в составе мелани!
онные, фотопротекторные и другие свойства
нов (табл. 1). Накопление в меланине таких эле!
[17]. В настоящей работе проанализирован эле!
ментов, как Al, Fe, Cu и S (табл. 1), может быть
ментный состав, изучены структурные группы и
связано со степенью загрязнения воздуха [9, 30].
физико!химические свойства меланинов,
Соотношение С/N определяет тип синтезируе!
экстрагированных из лишайников C. islandica и
мого меланина. Так, в алломеланинах из
P. furfuracea. Эти физико!химические свойства
C. islandica и P. furfuracea соотношение С/N сос!
способствуют проявлению защитных свойств
тавило 34 и 35 соответственно (табл. 1).
пигмента.
Синтез меланинов - сложный многостадий!
На начальном этапе исследования принад!
ный процесс, проходящий по разнообразным
лежность экстрагированных пигментов к мела!
путям (см. Введение). Алломеланин синтезиру!
нинам была подтверждена с помощью качест!
ется по ацетатно!малонатному пути и образует!
венных реакций по обесцвечиванию в присут!
ся в результате полимеризации простых фено!
ствии Н2О2, а также изменению окраски с ко!
лов [7]. Анализ характеристических полос по!
ричневой на зеленую с последующим выпаде!
глощения ИК!спектров меланинов, выделен!
нием осадка в присутствии сильного окислителя
ных из лишайников C. islandica и P. furfuracea,
KMnO4 (данные не представлены). При добав!
подтвердил наличие ароматических групп в со!
лении FeCl3 наблюдалось выпадение осадка, ко!
ставе алломеланинов. С помощью базы данных
торый растворялся в избытке FeCl3, такие ре!
AIST: Spectral Database for Organic Compounds
зультаты предполагают наличие фенольных
(SDBS) было выявлено, что колебательные по!
фрагментов в структуре полимера.
лосы определенных групп атомов меланинов
Элементный состав меланина является важ!
обоих лишайников имеют приблизительно оди!
ным критерием, определяющим его тип, сорб!
наковые частоты (табл. 2) и мало зависят от ха!
ционные свойства и наличие реакционных
рактера окружающих их групп. Данные указыва!
центров. Элементный состав меланина зависит
ют на незначительное содержание алифатичес!
от видовой принадлежности лишайника, его
ких фрагментов и повышенное содержание аро!
возраста, субстрата произрастания, условий
матических групп. Значение пиков ИК!спект!
обитания [28] и типа фотобионта. Лишайники
ров меланинов, выделенных из лишайников
C. islandica и P. furfuracea являются представите!
C. islandica и P. furfuracea, близко к таковым для
лями напочвенных лишайников и обладают вы!
алломеланина гриба чаги Inonotus obliquus [17].
Таблица 2. Области поглощения колебаний некоторых связей ИК!спектров меланина
Волновые числа, см-1
Функциональные группы
900
внеплоскостные деформационные колебания (С-Н)!групп
1020-1040
валентные колебания С-О!групп; симметричные валентные колебания (С-О-С)!групп
1150-1250
плоскостные деформационные колебания ОН!(С=С, С=N, С=О)!групп
1300-1380
плоскостные деформационные колебания ОН!групп
1525
валентные колебания С=С ароматического кольца
2340-2360
валентные колебания (С-С) тройных связей
2880-2940
валентное колебание алифатических СН2!, CH3!групп
3325
валентные колебания фенольных ОН!групп
БИОХИМИЯ том 85 вып. 5 2020
734
РАССАБИНА и др.
Меланины обладают фотопротекторными
В настоящей работе впервые в лишайниках
свойствами [7]. Значительное снижение погло!
C. islandica и P. furfuracea идентифицирован тип
щения в диапазоне 230-650 нм свидетельствует о
меланина как алломеланин. Обнаруженные в
том, что алломеланины лишайников поглощают
структуре меланина функциональные группы,
световое излучение как в УФ, так и в видимой
в том числе ОH!группы, обеспечивают его фо!
областях спектра (рис. 2). Поглощение света ме!
топротекторные и антиоксидантные свойства.
ланином обеспечивает защиту кортекса лишай!
Анализ физико!химических свойств исследо!
ника от УФ!индуцированного стресса и позво!
ванных меланинов позволяет полагать, что
ляет находиться под облучением продолжитель!
синтез меланина является одним из ключевых
ное время. В частности показано, что пигменти!
защитных механизмов, обеспечивающих вы!
рованные грибы Cryomyces antarcticus и Cryomyces
живание лишайников в условиях УФ!излуче!
minteri проявляют высокую устойчивость к УФ!
ния.
облучению (280-360 нм), выдерживая его в тече!
ние нескольких часов, тогда как непигментиро!
ванные дрожжевые клетки Saccharomyces pastori+
Финансирование. Работа проводилась в рам!
anus погибают через 30 мин облучения [7].
ках выполнения государственного задания
Меланины являются активными акцептора!
ФИЦ КазНЦ РАН (экстракция, элементный
ми и донорами электронов и обладают антиок!
анализ, антиоксидантная активность), частично
сидантной активностью [33]. В настоящей ра!
при финансовой поддержке Российского науч!
боте была выявлена антиоксидантная актив!
ного фонда (грант № 18!14!00198, спектраль!
ность меланинов, выделенных из лишайников
ный анализ) и частично Программы Повыше!
C. islandica и P. furfuracea, по восстановлению ра!
ния Конкурентоспособности КФУ (анализ хи!
дикала DPPH (рис. 3). Можно полагать, что ан!
мического стандарта).
тиоксидантная активность алломеланинов ли!
Благодарности. Авторы благодарны профес!
шайников обусловлена их фенольной природой
сору Кнут Солхаг (Университет Наук о Жизни,
и наличием в структуре алифатических фраг!
Ос, Норвегия) за помощь в сборе лишайников, а
ментов. Фенольные соединения в ходе окисли!
также В.М. Бабаеву и Д.А. Файзуллину (ФИЦ
тельных процессов образуют феноксильные ра!
КазНЦ РАН) за методическую помощь в прове!
дикалы, которые обладают меньшей реакцион!
дении экспериментов.
ной активностью, чем другие кислородные ра!
Конфликт интересов. Авторы заявляют об от!
дикалы, и способны прерывать цепной меха!
сутствии конфликта интересов.
низм окисления [32, 33]. Таким образом, мела!
Соблюдение этических норм. Настоящая
нины вносят вклад в защиту таллома лишайни!
статья не содержит описания выполненных ав!
ков от окислительного стресса, индуцированно!
торами исследований с участием людей или ис!
го в том числе воздействием светового стресса.
пользованием животных в качестве объектов.
СПИСОК ЛИТЕРАТУРЫ
1.
Бязров Л. Г. (2016) Вторичные метаболиты лихенизи!
ing rather than photobiont acclimation, Lichenologist, 51,
рованных грибов как фармацевтический потенциал,
483!491, doi: 10.1017/S0024282919000276.
Успехи медицинской микологии, 16, 249!254.
7. Гесслер Н. Н., Егорова А. С., Белозерская Т. А. (2014)
2.
Nybakken, L., Solhaug, K. A., Bilger, W., and Gauslaa, Y.
Меланиновые пигменты грибов в экстремальных ус!
(2004) The lichens Xanthoria elegans and Cetraria islandica
ловиях существования, Прикладная биохимия и микро+
maintain a high protection against UV!B radiation in
биология, 50, 125!134.
Arctic habitats, Oecologia, 140, 211!216, doi: 10.1007/
8. Тюкавкина Н. А., Зурабян С. Э., Белобородов В. Л. (2008)
s00442!004!1583!6.
Органическая химия: учебник для вузов, Дрофа, Москва.
3.
Plonka, P. M., and Grabacka, M. (2006) Melanin synthe!
9. Багманян И. А., Мямин В. Е., Гигиняк Ю. Г., Бородин О. И.,
sis in microorganisms - biotechnological and medical
Курченко В. П. (2004) Биохимическая фармакология гриб!
aspects, Acta Biochim. Pol., 53, 429!443, doi: 10.18388/
ных меланинов, Успехи медицинской микологии, 3, 156!158.
abp.2006_3314.
10. Purvis, O. W., Bailey, E. H., McLean, J., and Kasama, T.
4.
Wong, H. J., Mohamad!Fauzi, N., Rizman!Idid, M.,
(2004) Uranium biosorption by the lichen Trapelia involu+
Convey, P., and Alias, S. A. (2018) Protective mechanisms
ta at a uranium mine, Geomicrobiol. J., 21, 159!167,
and responses of micro!fungi towards ultraviolet!induced
doi: 10.1080/01490450490275398.
cellular damage, Polar Science, 20, 19!34, doi: 10.1016/
11. Schroeder, R. L., Double, K. L., and Gerber, J. P. (2015)
j.polar.2018.10.001.
Using Sepia melanin as a PD model to describe the binding
5.
Bell, A. A., and Wheeler, M. H. (1986) Biosynthesis and
characteristics of neuromelanin, J. Chem. Neuroanat., 64
functions of fungal melanins, Phytopathology, 24, 411!451,
65, 20!32, doi: 10.1016/j.jchemneu.2015.02.001.
doi: 10.1146/annurev.py.24.090186.002211.
12. Wakamatsu, K., Fujikawa, K., Zucca, F. A., Zecca, L., and
6.
Beckett, R. P., Solhaug, K. A., Gauslaa, Y., and
Ito, S. (2003) The structure of neuromelanin as studied by
Minibayeva, F. V. (2019) Improved photoprotection in
chemical degradative methods, J. Neurochem., 86, 1015!
melanized lichens is a result of fungal solar radiation screen!
1023, doi: 10.1046/j.1471!4159.2003.01917.x.
БИОХИМИЯ том 85 вып. 5 2020
АЛЛОМЕЛАНИНЫ ЛИШАЙНИКОВ
735
13.
Eisenman, H. C., and Casadevall, A. (2012) Synthesis and
Tuber melanosporum Vitt., Food Chemistry, 58, 69!73,
assembly of fungal melanin, Appl. Microbiol. Biotechnol.,
doi: 10.1016/S0308!8146(96)00215!4.
93, 931!940, doi: 10.1007/s00253!011!3777!2.
24. Mbonyiryivuze, A., Mwakikunga, B., Dhlamini, S. M.,
14.
Babitskaya, V. G., Scherba, V. V., Ikonnikova, N. V.,
and Maaza, M. (2015) Fourier transform infrared spec!
Bisko, N. A., and Mitropolskaya, N. Y. (2002) Melanin
troscopy for Sepia melanin, Phys. Mater. Chem., 3, 25!29,
complex from medicinal mushroom Inonotus obliquus, Int.
doi: 10.12691/pmc!3!2!2.
J. Med. Mushrooms, 4, 139!145.
25. Solhaug, K. A., and Gauslaa, Y. (2001) Fungal melanins as
15.
Tarangini, K., and Mishra, S. (2013) Production, charac!
a sun screen for symbiotic green algae in the lichen Lobaria
terization and analysis of melanin from isolated marine
pulmonaria, Oecologia,
126,
462!471, doi:
10.1007/
Pseudomonas sp. using vegetable waste, Res. J. Eng. Sci., 2,
s004420000541.
40!46.
26. Подтероб А. П. (2008) Химический состав лишайни!
16.
Таширев А. Б., Романовская В. А., Рокитко П.В., Мат!
ков и их медицинское применение, Хим. Фарм. Журн.,
веева Н. А., Шилин С. О., Таширева А. А. (2012) Син!
42, 32!38.
тез меланиновых пигментов антарктическими чёрны!
27. Книга О. П., Тихонова Г. А., Хижан Е. И., Николаевс!
ми дрожжами, Микробиол. Журн., 74, 2!8.
кий А. Н. (2011) Действие фенольных антиоксидантов
17.
Сушинская Н. В., Курченко В. П. (2006) Меланины
при окислении веществ в модельных водно!липидных
трутовых грибов, Труды БГУ, 1, 147!158.
системах, Бутлеровские сообщения, 27, 57!62.
18.
Агаджанян А. Е., Асатурян Р. А., А. Амбарцумян А.,
28. Блинова К. Ф., Борисова Н. А., Гортинский Г. Б.
Саргисян Л. Б., Овсепян А. С., Варданян А. А., Саги!
(1990) Ботанико+фармакогностический словарь, Выс!
ян А. С. (2011) Микробиологическое получение водо!
шая школа, Москва.
растворимого меланина и изучение его физико!хими!
29. Mafole, T. C., Solhaug, K. A., Minibayeva, F. V., and
ческих свойств, Прикладная биохимия и микробиология,
Beckett, R. P. (2019) Occurrence and possible roles of
47, 551!557.
melanic pigments in lichenized ascomycetes, Fungal Biol.
19.
Manivasagan, P., Venkatesan, J., Senthilkumar, K.,
Rev., 33, 159!165, doi: 10.1016/j.fbr.2018.10.002.
Sivakumar, K., and Kim, S. K. (2013) Isolation and char!
30. Курченко В. П., Багманян И. А., Мямин В. Е., Боро!
acterization of biologically active melanin from
дин О. И., Гигиняк Ю. Г. (2016) Тяжелые металлы в
Actinoalloteichus sp. MA!32, Int. J. Biol. Macromol., 58,
кустистых лишайниках как индикатор атмосферного
263!274, doi: 10.1016/j.ijbiomac.2013.04.041.
переноса загрязняющих веществ в Антарктиде, Труды
20.
Wang, L. F., and Rhim, J. W. (2019) Isolation and charac!
БГУ, 11, 351!355.
terization of melanin from black garlic and sepia ink, LWT,
31. Скрябин К. Г., Вихорева Г. А., Варламов В. П. (2002)
99, 17!23, doi: 10.1016/j.lwt.2018.09.033.
Хитин и хитозан. Получение, свойства и применение,
21.
Chen, J., Wang, C., Shu, C., Zhu, M., and Zhou, E. (2015)
Наука, Москва.
Isolation and characterization of a melanin from
32. Красногорская Н. Н., Клеттер Е. А., Сулейманова Р.
Rhizoctonia solani, the causal agent of rice sheath blight,
Р., Журавлева С. Е. (2012) Анализ содержания тяжелых
Eur. J. Plant. Pathol., 142, 281!290, doi: 10.1007/s10658!
металлов и соединений серы в лишайниках Parmelia
015!0612!0.
sulcata в условиях городской среды, Современные проб+
22.
Сильверстейн Р., Вебстер Ф., Кимл Д. (2012) Спектро+
лемы науки и образования, 2, 30!39.
метрическая идентификация органических соединений,
33. Grossi, G. F., Durante, M., Gvalanella, G., Pugliese, M.,
Бином, Москва.
and Mosse, I. (1998) Effects of melanin on high!LET radi!
23.
Harki, E., Talou, T., and Dargent, R. (1997) Purification,
ation response of human epithelial cells, Radiat. Environ.
characterization and analysis of melanin extracted from
Biophys., 37, 63!67, doi: 10.1007/s004110050094.
MELANIN OF LICHENS Cetraria islandica AND Pseudevernia furfuracea:
STRUCTURAL FEATURES AND PHYSICO CHEMICAL PROPERTIES
A. E. Rassabina1, O. P. Gurjanov1, R. P. Beckett2, and F. V. Minibayeva1,3*
1 Kazan Institute of Biochemistry and Biophysics, FRC Kazan Scientific Center of the Russian Academy of Sciences,
420111 Kazan, Russia; E+mail: minibayeva@kibb.knc.ru
2 School of Life Sciences, University of KwaZulu+Natal, 3209, Scottsville, South Africa
3 Kazan (Volga region) Federal University, 420008 Kazan, Russia
Received February 20, 2020
Revised March 27, 2020
Accepted March 30, 2020
Lichens are symbiotic photosynthesizing organisms with thalli formed by fungi and algae/cyanobacteria that possess
high stress tolerance. One of the factors contributing to the lichen protection from harsh environmental conditions is
the presence of unique metabolites, including high!molecular!weight dark pigments melanins. The chemical compo!
sition and structure of lichen melanins remain poorly studied. We analyzed the elemental composition, the main func!
tional groups, and the physicochemical properties of melanin extracted from Cetraria islandica and Pseudevernia fur+
furacea lichens. Based on the C/N ratio, this pigment is allomelanin. We also identified functional groups that pro!
vide photoprotective and antioxidant properties of melanin. Melanin synthesis might be an essential defense mecha!
nism contributing to the survival of lichens under exposure to UV radiation.
Keywords: melanin, lichen, IR spectroscopy, photoprotection, antioxidant activity
БИОХИМИЯ том 85 вып. 5 2020