БИОХИМИЯ, 2020, том 85, вып. 6, с. 774 - 782
УДК 616 006.6
ВОВЛЕЧЕННОСТЬ SASH1 В ПОДДЕРЖАНИЕ
СТАБИЛЬНОЙ МЕЖКЛЕТОЧНОЙ АДГЕЗИИ*
© 2020
А.С. Ильницкая, И.Ю. Житняк, Н.А. Глушанкова**
ФГБУ «Национальный медицинский исследовательский центр онкологии им. Н.Н. Блохина»
Министерства здравоохранения Российской Федерации, 115478 Москва, Россия;
электронная почта: natglu@hotmail.com
Поступила в редакцию 01.04.2020
После доработки 29.04.2020
Принята к публикации 03.05.2020
SASH1 является адаптерным сигнальным белком, имеющим в своей структуре SH3 и SAM домены, отвеча
ющие за межбелковые взаимодействия. Выраженное снижение экспрессии SASH1 описано для многих опу
холей. С использованием конфокальной микроскопии нами было проведено иммунофлуоресцентное ис
следование распределения SASH1 в культурах нормальных эпителиальных клеток IAR 20 и клеток линии
колоректального рака НТ 29. Нормальные эпителиоциты IAR 20 и эпителиоциты НТ 29, имеющие эпите
лиальный фенотип, образовывали стабильные линейные межклеточные адгезионные контакты (АК), ассо
циированные с кольцевыми актиновыми пучками. В этих клетках SASH1 колокализовался с кольцевыми
пучками и линейными АК. В ламеллиподиях SASH1 не детектировался. Под воздействием эпидермального
фактора роста клетки IAR 20 и НТ 29 вступали в эпителиально мезенхимальный переход (ЭМП). ЭМП в
культурах IAR 20 и НТ 29 имел существенные различия. Клетки IAR 20 проходили неполный ЭМП, при
обретая способность к миграции, но при этом сохраняя Е кадхерин в радиальных нестабильных АК. SASH1
присутствовал в таких контактах. При прохождении ЭМП клетками НТ 29 наблюдалось полное исчезнове
ние АК, что также приводило к разрушению стабильной межклеточной адгезии. SASH1 уходил из зон меж
клеточного взаимодействия. Супрессия SASH1 посредством RNA интерференции вызывала разрушение
стабильных линейных АК клеток IAR 20. Через 48 ч после трансфекции siRNA SASH1 в культуре отмеча
лось появление клеток с мезенхимальным фенотипом. Полученные данные указывают на вовлеченность
SASH1 в поддержание стабильной межклеточной адгезии.
КЛЮЧЕВЫЕ СЛОВА: SASH1, межклеточная адгезия, Е кадхерин, эпителиально мезенхимальный переход.
DOI: 10.31857/S0320972520060032
ВВЕДЕНИЕ
женное снижение его экспрессии показано для
продвинутых стадий опухолевого роста. В аде
Ген SASH1 был впервые описан при анализе
номах и карциномах на ранних стадиях экспрес
генов, экспрессия которых была значительно
сия SASH1 сохранялась на высоком уровне [1,
снижена в карциномах молочной железы [1].
3-5].
SASH1 экспрессируется во многих тканях, за
Белок SASH1 является адаптерным сигналь
исключением дендритных клеток и лимфоци
ным белком, он содержит центральную область,
тов, и рассматривается в качестве кандидата в
включающую NLS домен, ответственный за
опухолевые супрессоры. Снижение экспрессии
ядерную локализацию белка, а также два домена
SASH1 было обнаружено в 74% образцов рака
SAM (sterile α module domain) и домен SH3 (Src
молочной железы, а также в карциномах легких,
homology 3 domain), участвующие в межбелко
щитовидной железы и гепатоцеллюлярных кар
вых взаимодействиях [1]. Присутствие в составе
циномах [1, 2]. Для карцином молочной железы,
молекулы домена SH3 указывает на возможное
толстой кишки, яичника и шейки матки SASH1
участие SASH1 в сигналинге и его возможную
считается прогностическим маркером, выра
связь с интегральными мембранными белками,
как скаффолдного и адаптерного белка. При
Принятые сокращения: АК - межклеточные адге
оверэкспрессии SASH1 в клетках линий гепато
зионные контакты, ЭМП - эпителиально мезенхималь
карциномы и карциномы желудка отмечалось
ный переход, EGF - эпидермальный фактор роста.
уменьшение экспрессии мезенхимальных мар
* Первоначально английский вариант рукописи опубли
керов виментина и N кадхерина, повышение
msu.ru/biokhimiya, в рубрике «Papers in Press», BM20 082,
экспрессии Е кадхерина, снижение клеточной
01.06.2020.
подвижности и инвазивной активности, усиле
** Адресат для корреспонденции.
ние адгезии клеток к внеклеточному матриксу
774
SASH1 В МЕЖКЛЕТОЧНОЙ АДГЕЗИИ
775
[6, 7]. В клетках НСТ116 нокдаун SASH1 с ис
радиальными [16]. Было обнаружено, что свя
пользованием CRISPR Cas9 приводил к угнете
занные с АК кольцевые актиновые пучки, обра
нию экспрессии Е кадхерина, активации
зованные β актином [17], разрушаются уже на
экспрессии виментина и транскрипционного
самых ранних этапах ЭМП, что приводит к пе
фактора эпителиально мезенхимального пере
рестройке АК и ослаблению межклеточной ад
хода (ЭМП) - Zeb1. Подавление SASH1 приво
гезии. Целью настоящей работы было исследо
дило к активации миграционной и инвазивной
вание распределения SASH1 в зонах межклеточ
активности клеток in vitro, а также стимулирова
ного взаимодействия эпителиальных клеток,
ло метастатическую активность клеток in vivo
изучение особенностей его внутриклеточной
при росте в ортотопических ксенотранспланта
локализации в ходе ЭМП при разрушении ста
тах у иммунодефицитных мышей [8]. Было по
бильных АК и кольцевых актиновых пучков.
казано, что SASH1 взаимодействует с N конце
вым SH3 доменом белка CRKL. Предполагает
ся, что CRKL активирует SRC/FAK сигналинг,
МАТЕРИАЛЫ И МЕТОДЫ
тем самым активируя ЭМП [9]. Кроме того, бел
ки CRK (CRK II и CRKL) могут рекрутировать
Клеточные культуры. Линия нормальных им
факторы обмена нуклеотидов в непосредствен
мортализованных эпителиоцитов IAR 20 была
ной близости от мембраны, тем самым активи
выделена из печени крыс в Международном ра
руя малые ГТФазы Rap1 и Rac1 [10]. Хорошо из
ковом агентстве Монтесано и коллегами [18]. В
вестно, что малая ГТФаза Rac1 играет централь
работе была также использована линия колорек
ную роль в клеточной миграции. Активный
тальной аденокарциномы человека НТ 29
Rac1 посредством WAVE активирует комплекс
(АТСС, США). 1 × 105 клеток рассевали в чашки
ARP2/3, нуклеирующий полимеризацию акти
Петри с покровными стеклами или в чашки Пет
новой сети в ламеллиподиях на ведущем крае
ри со стеклянным дном («MatTek Corporation»,
клетки [11]. До настоящего времени, несмотря
США) и культивировали в модифицированной
на достаточно большое количество данных о
Дальбекко среде Игла (DMEM) («Sigma», США)
влиянии изменений содержания SASH1 на
c 10% ной телячьей эмбриональной сывороткой
функциональные характеристики клеток, ис
(«PAA Laboratories», Австрия) в течение 24 ч. Да
следований внутриклеточной локализации
лее клетки культивировали в среде с 1% ной те
SASH1 не проводили. В единственной работе
лячьей эмбриональной сывороткой в течение
Martini et al. [12] утверждается, что SASH1 акку
20 ч. Для индукции ЭМП клетки IAR 20 и НТ
мулируется в ламеллиподиях и колокализуется с
29 обрабатывали EGF («Sigma», США) в концен
кортактином, который, как известно, связыва
трации 40 и 50 нг/мл соответственно, добавляя в
ясь с комплексом Arp2/3, стабилизирует струк
культуральную среду из стокового раствора.
туру актиновой сети, что способствует эффек
Иммунофлуоресцентная микроскопия и DIC
тивной миграции клеток [13].
видеомикроскопия. Для иммунофлуоресцентно
Появление миграционной активности у эпи
го окрашивания были использованы следую
телиальных клеток является ключевой характе
щие антитела: мышиные моноклональные ан
ристикой ЭМП - программы, которая играет
титела к Е кадхерину (клон 36, 1 : 200; «BD
ведущую роль в эмбриональном развитии и при
Transduction Labs», США), кроличьи антитела к
заживлении ран. Раковые клетки используют
SASH1 (клон 266А, 1 : 100; «Bethyl Laboratories»,
программу ЭМП для инициации инвазионно
США), мышиные моноклональные антитела к
метастатического каскада. Важнейшими звень
β актину (клон 4С2, 1 : 100; «Merck, Millipore»,
ями ЭМП являются утрата эпителиоцитами
США,), мышиные моноклональные антитела к
апикально базальной полярности и стабильной
кортактину (клон 4F11, 1 : 200; «Sigma», США),
межклеточной адгезии и приобретение мигра
а также антитела козы к мышиным IgG1, IgG2a
ционного фенотипа [14, 15]. Пусковым меха
и антитела козы к мышиному и кроличьему
низмом ЭМП считается индукция транскрип
IgG, конъюгированные с Alexa Fluor488, Alexa
ционных факторов ЭМП (Snail, Twist, Zeb и др.)
Fluor594 или Alexa Fluor647 (1 : 200; «Jackson
и связанное с этим угнетением экспрессии Е
ImmunoResearch», США). Клетки на стеклах
кадхерина, и ослабление межклеточной адгезии.
фиксировали 15 мин смесью метанола/ацетона
Недавно мы показали, что разрушение стабиль
(1/1) при -10 °С, после чего инкубировали с
ной межклеточной адгезии может быть также
первыми антителами. После промывки фосфат
обусловлено специфической реорганизацией
ным буфером (1× PBS pH 7,4) инкубировали со
актинового цитоскелета и замещением стабиль
вторыми антителами. Препараты исследовали с
ных линейных Е кадхериновых межклеточных
применением конфокального микроскопа Leica
адгезионных контактов (АК) нестабильными
TCS SP5, с использованием объектива HDX PL
БИОХИМИЯ том 85 вып. 6 2020
776
ИЛЬНИЦКАЯ и др.
APO 63×/1.3 («Leica Microsystems», Швейцария)
нием 0,1% (v/v) Tween 20 мембраны инкубиро
и эпифлуоресцентного микроскопа Axioplan
вали со вторыми антителами, конъюгированны
Zeiss, с использованием объектива Plan
ми с пероксидазой, в течение 1 ч при комнатной
Neofluar 100×/1.3 («Carl Zeiss», Германия). Для
температуре. Для контроля загрузки использо
получения изображений с помощью DIC видео
вали моноклональные антитела к общему акти
микроскопии за 20 мин до визуализации произ
ну (клон С4, 1 : 1000; «Merck, Millipore», США)
водили смену культуральной среды на
Сигнал детектировали с помощью Pierce ECL
DMEM/F12 без фенолового красного, с L глу
Western Blotting Substrate
(«Thermo Fisher
тамином и HEPES с добавлением 1% ной те
Scientific», США), изображения получали с по
лячьей эмбриональной сыворотки. Через час
мощью прибора Image Quant LAS 4000 («GE
после начала съемки в культуральную среду до
Healthcare», США). Для денситометрии полу
бавляли EGF для индукции ЭМП. Прижизнен
ченных изображений блотов использовали
ную микроскопию осуществляли с помощью
программу ImageJ [imagej.net]. Значения опти
микроскопа NikonEclipseTi с использованием
ческой плотности полос SASH1 нормировали на
объектива PlanFluor40× и цифровой камеры
маркерный белок - актин. При статистической
ORCA ER («Hamamatsu Photonics», Япония) и
обработке результатов трех экспериментов ис
программного обеспечения NIS Elements AR
пользовали критерий Стьюдента, данные предс
3.22 («Nikon», Япония). Частота съемки 1 кадр в
тавляли, как средние значения ± ошибка сред
мин в течение 6 ч (для клеточной культуры Iar
него.
20) и каждые 10 мин в течение 10 ч (для клеточ
ной культуры HT 29).
RNA6интерференция. Для супрессии SASH1
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
была
использована
ON TARGETplus
SMARTpool rat Sash1 siRNA (50 нM) и в качест
С использованием конфокальной микроско
ве трансфицирующего агента - DharmaFECT1
пии было проведено исследование распределе
(«Dharmacon», США). GFP siRNA использова
ния SASH1 в нормальных эпителиоцитах линии
ли в качестве негативного контроля. Культуры
IAR 20, а также в клетках линии колоректально
инкубировали 48 ч в среде DMEM с 10% ной
го рака НТ 29. Клетки этих линий имели эпите
сывороткой. Далее клетки лизировали и анали
лиальный фенотип и в редкой культуре образо
зировали с помощью иммуноблоттинга. Стекла
вывали островки, а в густой культуре - моно
с трансфицированными клетками также фикси
слои. Было выполнено тройное иммунофлуо
ровали для иммунофлуоресцентного окрашива
ресцентное окрашивание Е кадхерина, актина и
ния.
SASH1 (рис. 1, а). Как показала конфокальная
Иммуноблоттинг. Клетки лизировали лизис
микроскопия, клетки IAR 20 формировали ли
буфером RIPA (50 мM Tris HCl, pH 7,4 («MP
нейные межклеточные адгезионные контакты,
Biomedicals», Франция); 150 мM NaCl («Sigma»,
ассоциированные с кольцевыми актиновыми
США); 2 мM EDTA («Sigma», США); 1% NP 40
пучками. Такие контакты аккумулировали
(«Fluka», США); 0,1% SDS («AppliChem», Испа
SASH1. SASH1 также детектировался в зоне
ния) с добавлением 0,25 мM Na3VO4, 1 мM DTT,
краевого актинового пучка. Антитела хорошо
10 мM NaF и коктейля ингибиторов протеаз
выкрашивали SASH1 при фиксации клеток ме
(«Sigma», США). Образцы смешивали с 5× буфе
танолом/ацетоном, которая вместе с тем приво
ром для нанесения (250 мM Tris HCl, pH 6,8;
дила к неспецифическому свечению вторых ан
10% SDS, 30% (v/v) глицерин, 5% β меркапто
тител (рис. 1, б). Выраженное свечение в цито
этанол, 0,02% бромфеноловый синий) и инку
плазме при микроскопии клеток в дальнем
бировали при 95 °C в течение 10 мин. Далее об
красном канале конфокального микроскопа не
разцы наносили на 10% SDS полиакриламид
было связано с SASH1 и было обусловлено сорб
ный гель и проводили вертикальный электро
цией меченных Alexa647 вторичных антител к
форез согласно протоколу («Bio Rad», США).
кроличьему иммуноглобулину на внутриклеточ
Белки после электрофореза переносили с гелей
ных органеллах. Также в цитоплазме отмечалось
на Amersham Hybond P PVDF мембраны («GE
неспецифическое свечение вторичных антител
Healthcare», США). Мембраны блокировали
к изотипам мышиных иммуноглобулинов, кото
5% м раствором молока («Fluka», США) на фос
рые использовались для одновременной детек
фатном буфере (1× PBS pH 7,4) с добавлением
ции Е кадхерина и β актина. Вместе с тем на пе
0,1% (v/v) Tween 20 («AppliChem», Испания) в
риферии клеток неспецифическое свечение
течение 1 ч на качалке. Далее мембраны инкуби
вторичных антител не было выражено, что поз
ровали с первыми антителами 16 ч при 4 °C.
волило детально исследовать межклеточные
После отмывки фосфатным буфером с добавле
границы и зоны клеточного края.
БИОХИМИЯ том 85 вып. 6 2020
SASH1 В МЕЖКЛЕТОЧНОЙ АДГЕЗИИ
777
Рис. 1. SASH1 в нормальных эпителиальных клетках IAR 20. а - Конфокальная микроскопия: Е кадхерин (красный ка
нал), β актин (зеленый канал), SASH1 (дальний красный канал). Флажок указывает на межклеточный контакт, представ
ленный с большим увеличением на врезках. SASH1 аккумулируется в области АК. б - Конфокальная микроскопия. Конт
роль вторых антител. Неспецифическое свечение вторичных антител. Красный канал - анти мышиные IgG2a, меченные
Alexa594, зеленый канал - анти мышиные IgG1, меченные Alexa488, дальний красный канал - анти кроличьи IgG, ме
ченные Alexa647. в - Флуоресцентное окрашивание на кортактин, Е кадхерин и SASH1. SASH1 присутствует в АК и в зо
не краевого актинового пучка в основании ламеллы. Флажок указывает на ламеллиподию, в которой SASH1 не присут
ствует, стрелка - на аккумуляцию SASH1 в зоне краевого актинового пучка. Во врезках - участок клеточного края при
большем увеличении. Масштаб - 10 мкм. (С цветными вариантами рис. 1-4 можно ознакомиться в электронной версии
Martini et al. [12] утверждали, что SASH1 де
группы клеток, они могут устанавливать кон
тектируется в ламеллиподиях и колокализуется
такты с соседними клетками, но такие контакты
с кортактином, белком, тесно связанным с ак
нестабильны. При исследовании ранних этапов
тиновой сетью. Как показали наши экспери
ЭМП мы обнаружили, что ослабление межкле
менты, в клетках IAR 20 и НТ 29 колокализа
точной адгезии у клеток IAR 20 связано не с уг
ции кортактина и SASH1 нет. В клетках IAR 20
нетением экспрессии Е кадхерина или его акку
кортактин присутствовал в актиновой сети ла
муляцией на межклеточных границах, а с разру
меллиподий на свободном крае и также колока
шением кольцевого актинового пучка, связан
лизовался с краевым актиновым пучком
ного с линейными АК, появлением ламеллипо
(рис. 1, в), в то время как SASH1 в зонах ламел
дий на границах между клетками и замещением
липодий отсутствовал. Его распределение на ак
линейных АК нестабильными радиальными АК,
тивном крае клеток было ограничено краевым
также образованными Е кадхерином. В связи с
актиновым пучком.
этим мы задались вопросом, как меняется рас
Ранее мы показали, что при обработке эпи
пределение SASH1 в клетках IAR 20, вступив
дермальным фактором роста (EGF) клетки IAR
ших в ЭМП. Оказалось, что параллельно с реор
20 вступают в ЭМП, разрывая стабильные связи
ганизацией АК также изменялась и локализация
друг с другом и приобретая способность к миг
SASH1 в зонах межклеточного взаимодействия.
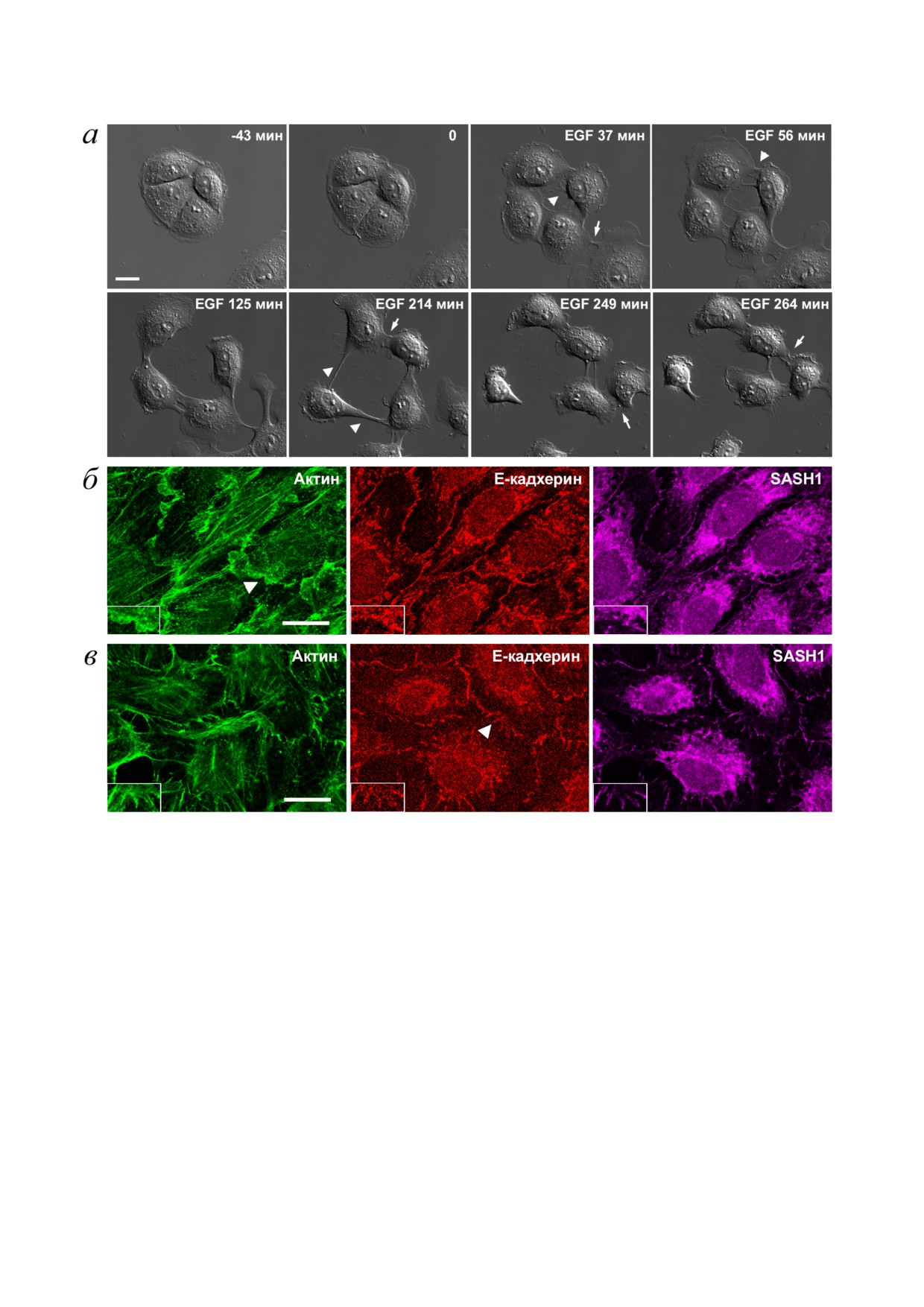
рации [16] (рис. 2, а).
Как показала конфокальная микроскопия, в ла
Клетки IAR 20 в присутствии EGF могут
меллиподиях, образующихся как на свободном
мигрировать как индивидуально, так и в составе клеточном крае, так и на межклеточных грани
БИОХИМИЯ том 85 вып. 6 2020
778
ИЛЬНИЦКАЯ и др.
Рис. 2. Эпителиоциты IAR 20 в присутствии EGF. а - DIC видеомикроскопия. До добавления EGF клетки IAR 20 обра
зуют островки. После добавления EGF (0 мин) клетки вступают в ЭМП: индуцируется протрузионная активность, разру
шаются межклеточные контакты, активируется клеточная миграция. При миграции клетки могут формировать контакты
с соседними клетками. Такие контакты нестабильны. Флажки - зоны разрыва межклеточных контактов, стрелки - вновь
образованные контакты. б, в - Флуоресцентное окрашивание клеток IAR 20 на β актин, Е кадхерин, SASH1. б - 10 мин
инкубации с EGF. Появление ламеллиподий на межклеточных границах. SASH1 не детектируется в ламеллиподиях.
в - 30 мин инкубации с EGF. SASH1 присутствует в радиальных E кадхерин содержащих АК. Флажки указывают на
межклеточные границы, представленные с большим увеличением на врезках. Масштаб - 10 мкм
цах, SASH1 отсутствовал, при этом во вновь об
вым пучком. SASH1 аккумулировался в области
разованных радиальных АК SASH1 детектиро
линейных АК клеток НТ 29. Клетки НТ 29 под
вался (рис. 2, б и в).
действием EGF также вступали в ЭМП. В отли
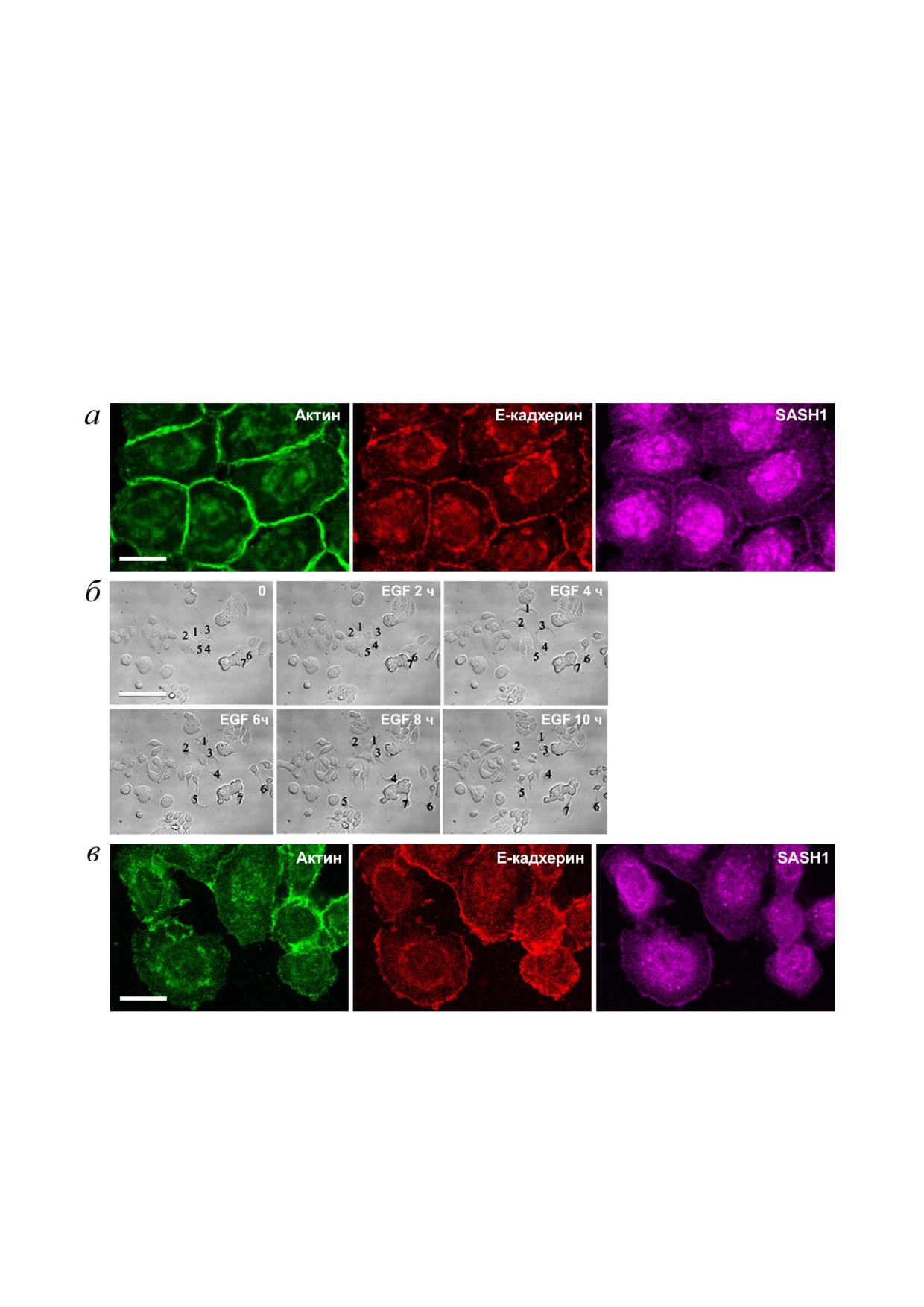
Исследование было продолжено на клетках
чие от эпителиоцитов IAR 20, клетки НТ 29
линии колоректальной аденокарциномы НТ 29.
проходили полный ЭМП, они теряли связи друг
Клетки НТ 29 имеют эпителиальный фенотип и
с другом и по субстрату мигрировали индивиду
формируют стабильные линейные АК, которые
ально (рис. 3, б). Иммунофлуоресцентное окра
образованы Е кадхерином (рис. 3, а). Такие
шивание показало полное разрушение АК у кле
контакты ассоциированы с кольцевым актино
ток НТ 29, обработанных EGF. Е кадхерин ухо
БИОХИМИЯ том 85 вып. 6 2020
SASH1 В МЕЖКЛЕТОЧНОЙ АДГЕЗИИ
779
дил из контактов и обнаруживался в эндосомах,
ON TARGETplus SMARTpool rat SASH1 siRNA
из зон межклеточного взаимодействия парал
(рис. 4, а, б). Как показало иммунофлуоресцент
лельно разрушению АК уходил и SASH1. В не
ное исследование, супрессия SASH1 в клетках
которых клетках, для которых была характерна
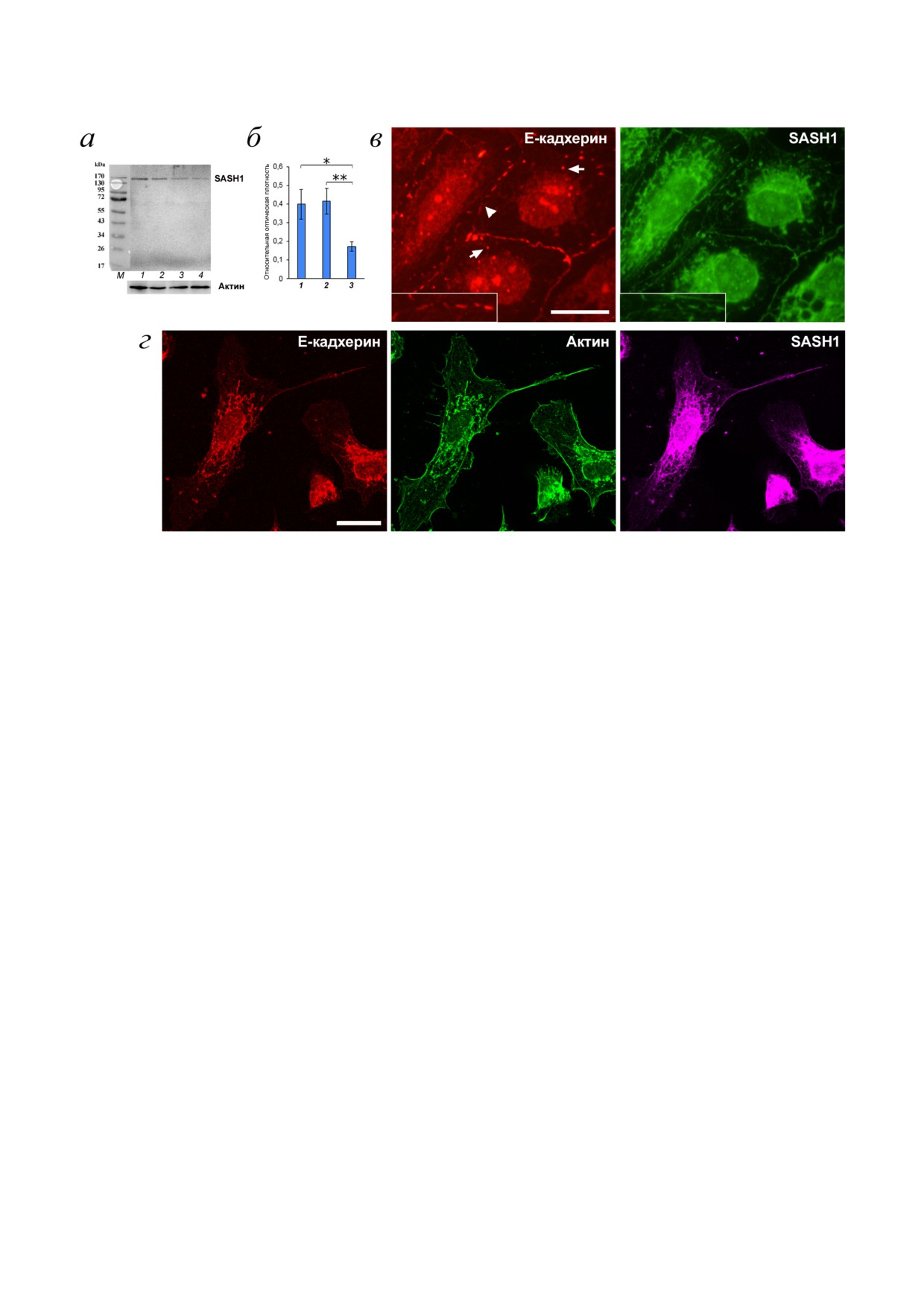
IAR 20 оказывала значительное влияние на
аккумуляция актиновых филаментов на клеточ
структуры межклеточной адгезии. Через 48 ч
ном крае, SASH1 также аккумулировался в этой
после трансфекции SASH1 siRNA стабильные
зоне в виде тонкой линии (рис. 3, в).
линейные Е кадхериновые АК, характерные для
Полученные данные указывают на то, что
эпителиоцитов IAR 20, разрушались. На меж
SASH1 присутствует в АК, и это свидетельствует
клеточных границах были видны отдельные то
о его возможном участии в функционировании
чечные или короткие радиальные АК (рис. 4, в).
АК. Мы решили выяснить, как влияет супрес
В цитоплазме были видны эндосомы, заполнен
сия SASH1 на морфологию клеток и межклеточ
ные Е кадхерином. Островки клеток часто рас
ную адгезию. Для этого мы использовали
падались, в культуре было много клеток, кото
Рис. 3. SASH1 в клетках карциномы НТ 29. а - Флуоресцентное окрашивание контрольной культуры на Е кадхерин,
β актин и SASH1. Конфокальная микроскопия. Клетки образуют линейные АК, ассоциированные с кольцевыми актино
выми пучками. SASH1 аккумулируется в области АК. Масштаб - 10 мкм. б, в - Индукция ЭМП под действием EGF.
б - DIC видеомикроскопия. До добавления EGF клетки НТ 29 образуют островки. Под действием EGF клетки проходят
ЭМП: разрушается стабильная межклеточная адгезия, индуцируется миграционная активность. Цифрами отмечено по
ложение клеток. Масштаб - 50 мкм. в - 8 часовая инкубация с EGF. Флуоресцентное окрашивание на Е кадхерин, β ак
тин и SASH1. Полное разрушение АК и эндоцитоз Е кадхерина, разрушение стабильной межклеточной адгезии. SASH1
уходит из АК, но присутствует на свободном крае клеток. Масштаб - 10 мкм
БИОХИМИЯ том 85 вып. 6 2020
780
ИЛЬНИЦКАЯ и др.
Рис. 4. Супрессия SASH1 в клетках культуры IAR 20. а - Иммуноблоттинг культуры через 48 ч после трансфекции SASH1
siRNA. Окрашивание полноразмерной мембраны на SASH1 и на общий актин. 1 - GFP siRNA (негативный контроль),
2 - контрольная культура, 3, 4 - SASH1 siRNA. б - Денситометрический анализ блотов из трех экспериментов. * p < 0,05,
** p < 0,01. 1 - GFP siRNA (негативный контроль), 2 - контрольная культура, 3 - SASH1 siRNA. в, г - Флуоресцентное
окрашивание культуры через 48 ч после трансфекции SASH1 siRNA. в - Эпифлуоресцентная микроскопия Е кадхерина
и SASH1. На межклеточных границах Е кадхерин аккумулируется в редких точечных АК. Эндосомы содержат Е кадхе
рин (стрелки). г - Конфокальная микроскопия Е кадхерина, β актина, SASH1. Клетки приобрели мезенхимальный фе
нотип. Масштаб - 10 мкм
рые утратили эпителиальную форму и приобре
эффектором Rac1. Вместе с тем данные о вовле
ли мезенхимальный фенотип (рис. 4, г). Таким
ченности Rac1 в формирование АК противоре
образом, оказалось, что уменьшение содержа
чивы. С одной стороны, считается, что актив
ния SASH1 в клетках снижает стабильность
ный Rac1 стабилизирует АК, рекрутируя актин к
межклеточной адгезии, что влияет на морфоло
гомофильно связанным Е кадхериновым ре
гию клеток и может приводить к появлению у
цепторам [20]. С другой стороны, известно, что
клеток миграционного фенотипа.
активность Rac1 детектируется в зонах межкле
точного взаимодействия только на самых ран
них этапах формирования стабильных АК - при
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
взаимодействии ламеллиподий и существенно
снижается по мере расширения и созревания
Таким образом, мы впервые показали, что
линейного АК [21]. Недавно мы показали, что в
SASH1 участвует в поддержании межклеточной
клетках IAR 20 на ранних этапах ЭМП разруше
адгезии. В наших экспериментах супрессия
ние кольцевого актинового пучка и замещение
SASH1 посредством RNA интерференции при
стабильных АК нестабильными радиальными
водила к разрушению стабильных Е кадхерино
АК сопровождается полимеризацией Arp2/3 за
вых АК и сдвигала фенотип эпителиальных кле
висимой актиновой сети и появлением ламел
ток в сторону мезенхимального. Эти данные
липодий в зонах межклеточного взаимодей
согласуются с данными Franke et al. [8], описав
ствия, то есть активацией Rac [16]. Мы считаем,
ших индукцию ЭМП у клеток гепатокарциномы
что Rac, скорее всего, не участвует в поддержа
при выключении SASH1 посредством CRISPR
нии стабильности АК. Его активация при воз
Cas9. Ранее с использованием дрожжевого дву
действии ростовых факторов, напротив, инду
гибридного скрининга было показано взаимо
цирует образование ламеллиподий на межкле
действие SASH1 с активным Rac1 [19], и на ос
точных границах, что приводит к утрате контакт
новании этого можно было бы считать SASH1
ного паралича и дестабилизации межклеточной
БИОХИМИЯ том 85 вып. 6 2020
SASH1 В МЕЖКЛЕТОЧНОЙ АДГЕЗИИ
781
адгезии. На основании полученных нами дан
нормальных эпителиальных клеток. Подобная
ных, мы предполагаем, что SASH1, возможно,
регуляторная функция описана, в частности,
не является эффектором Rac GTP, но является
для многофункционального белка мерлина, ко
его негативным регулятором на межклеточных
торый не только ассоциирован с кольцевым ак
границах, стабилизируя адгезию между клетка
тиновым пучком и АК, но также негативно регу
ми. Ранее было показано, что SASH1 взаимо
лирует EGFR и Rac/PAK сигналинг и способ
действует с N концевым SH3 доменом белка
ствует переходу из ядра в цитоплазму тран
CRKL и активирует SRC/FAK онкогенный сиг
скрипционных коактиваторов YAP/TAZ при
налинг [9]. С другой стороны, имеются данные о
высокой плотности эпителиального монослоя
том, что оверэкспрессия CRK белков (CRK II и
[23]. Возможно, SASH1 является тем ключевым
CRKL) вызывает активацию Rac, образование
игроком, чья способность формировать комп
ламеллиподий на свободном клеточном крае,
лексы с многими белками на мембране и в ядре
разрушение АК и скэттеринг эпителиальных
может обеспечивать его значимую роль в опухо
островков [22]. Возможно, в зонах межклеточ
левой супрессии, связывая воедино негативное
ных контактов SASH1, как скаффолд белок,
влияние на миграционную и пролиферативную
связывая белок CRKL и активный Rac или фак
активность клеток.
торы обмена гуаниновых нуклеотидов (GEF)
Rac, приводит к угнетению его активности, что
стабилизирует АК. Супрессия SASH1 высво
Финансирование. Работа поддержана Рос
бождает онкогенную активность CRKL, что
сийским фондом фундаментальных исследова
способствует активации Rac и приводит к разру
ний (грант № 18 54 16005). Работа по изучению
шению межклеточной адгезии. Подтверждение
ЭМП поддержана Российским научным фон
высказанной нами гипотезы, очевидно, требует
дом (грант № 16 15 10288).
дальнейшей экспериментальной проверки.
Конфликт интересов. Авторы заявляют об от
Следует также отметить, что SASH1, локали
сутствии конфликта интересов.
зуясь на межклеточных границах и имея в струк
Соблюдение этических норм. Настоящая
туре NLS последовательность для транспорти
статья не содержит описания выполненных ав
ровки в ядро, может быть связан с контактным
торами исследований с участием людей или ис
торможением пролиферации, характерным для
пользованием животных в качестве объектов.
СПИСОК ЛИТЕРАТУРЫ
1.
Zeller, C., Hinzmann, B., Seitz, S., Prokoph, H.,
8. Franke, F. C., Müller, J., Abal, M., Medina, E. D.,
Burkhard Goettges, E., Fischer, J., Jandrig, B.,
Nitsche, U., Weidmann, H., Chardonnet, S., Ninio, E.,
Schwarz, L. E., Rosenthal, A., and Scherneck, S. (2003)
and Janssen, K. P. (2018) The tumor suppressor SASH1
SASH1: a candidate tumor suppressor gene on chromo
interacts with the signal adaptor CRKL to inhibit epithe
some 6q24.3 is downregulated in breast cancer, Oncogene,
lial-mesenchymal transition and metastasis in colorectal
22, 2972 2983, doi: 10.1038/sj.onc.1206474.
cancer, Cell. Mol. Gastroenterol. Hepatol., 7, 3353,
2.
Peng, L., Wei, H., and Liren, L. (2014) Promoter methyla
doi: 10.1016/j.jcmgh.2018.08.007.
tion assay of SASH1 gene in hepatocellular carcinoma, J.
9. Franke, F. C., Slusarenko, B. O., Engleitner, T., Johannes, W.,
BUON, 19, 1041 1047.
Laschinger, M., Rad, R., Nitsche, U., and Janssen, K. P.
3.
Rimkus, C., Martini, M., Friederichs, J., Rosenberg, R.,
(2020) Novel role for CRK adaptor proteins as essential
Doll, D., Siewert, J. R., Holzmann, B., and Janssen, K. P.
components of SRC/FAK signaling for epithelial-mes
(2006) Prognostic significance of downregulated expres
enchymal transition and colorectal cancer aggressiveness,
sion of the candidate tumour suppressor gene SASH1 in
Int. J. Cancer, 146, doi: 10.1002/ijc.32955.
colon cancer, Br. J. Cancer, 95, 1419 1423, doi: 10.1038/
10. Feller, S. (2001) Crk family adaptors - signalling complex
sj.bjc.6603452.
formation and biological roles, Oncogene, 20, 6348 6371,
4.
Ren, X., Liu, Y., Tao, Y., Zhu, G., Pei, M., Zhang, J., and
doi: 10.1038/sj.onc.1204779.
Liu, J. (2016) Downregulation of SASH1 correlates with
11. Krause, M., and Gautreau, A. (2014) Steering cell migra
tumor progression and poor prognosis in ovarian carcino
tion: lamellipodium dynamics and the regulation of direc
ma, Oncol. Lett., 11, 3123 3130, doi: 10.3892/ol.2016.4345.
tional persistence, Nat. Rev. Mol. Cell Biol., 15, 577 590,
5.
Xie, J., Zhang, W., Zhang, J., and Luan, Y. F. (2017) Down
doi: 10.1038/nrm3861.
regulation of SASH1 correlates with poor prognosis in cervi
12. Martini, M., Gnann, A., Scheikl, D., Holzmann, B., and
cal cancer, Eur. Rev. Med. Pharm. Sci., 21, 3781 3786.
Janssen, K. P. (2011) The candidate tumor suppressor
6.
He, P., Zhang, H., Sun, C., Chen, C., and Jiang, H. (2016)
SASH1 interacts with the actin cytoskeleton and stimulates
Overexpression of SASH1 Inhibits the proliferation, inva
cell-matrix adhesion, Int. J. Biochem. Cell. Biol., 43, 1630
sion, and EMT in hepatocarcinoma cells, Oncol. Res., 24,
1640, doi: 10.1016/j.biocel.2011.07.012.
25 32, doi: 10.3727/096504016X14575597858609.
13. Rottner, K., and Stradal, T. (2016) How distinct Arp2/3
7.
Zong, W., Yu, C., Wang, P., and Dong, L.
(2016)
complex variants regulate actin filament assembly, Nat. Cell
Overexpression of SASH1 inhibits TGF b1 induced EMT
Biol., 18, 1 3, doi: 10.1038/ncb3293.
in gastric cancer cells, Oncol. Res., 24, 17 23, doi: 10.3727/
14. Lamouille, S., Xu, J., and Derynck, R. (2014) Mole
096504016X14570992647203.
cular mechanisms of epithelial mesenchymal transition,
БИОХИМИЯ том 85 вып. 6 2020
782
ИЛЬНИЦКАЯ и др.
Nat. Rev. Mol. Cell Biol., 15, 178 196, doi:
10.1038/
движения среди недавно обнаруженных партнеров
nrm3758.
связывания ГТФазы Rac, Успехи молекулярной онколо
15.
Nieto, M. A., Huang, R. Y., Jackson, R. A., and Thiery, J. P.
гии, 3, 20.
(2016) EMT: 2016, Cell, 166, 21 45, doi: 10.1016/j.cell.
20. McCormack, J., Welsh, N. J., and Braga, V. M. (2013)
2016.06.028.
Cycling around cell-cell adhesion with Rho GTPase regu
16.
Zhitnyak, I. Y., Rubtsova, S. N., Litovka, N. I., and
lators, J. Cell Sci., 126, 379 391, doi: 10.1242/jcs.097923.
Gloushankova, N. A. (2020) Early events in actin
21. Yamada, S., and Nelson, W. J. (2007) Localized zones of
cytoskeleton dynamics and E cadherin mediated cell-cell
Rho and Rac activities drive initiation and expansion of
adhesion during epithelial-mesenchymal transition, Cells,
epithelial cell cell adhesion, J. Cell Biol., 178, 517 527,
9, pii: E578, doi: 10.3390/cells9030578.
doi: 10.1083/jcb.200701058.
17.
Dugina, V., Zwaenepoel, I., Gabbiani, G., Clément, S.,
22. Lamorte, L., Royal, I., Naujokas, M., and Park, M. (2002)
and Chaponnier, C. (2009) β and γ Сytoplasmic actins
Crk adapter proteins promote an epithelial mesenchymal
display distinct distribution and functional diversity, J. Cell
like transition and are required for HGF mediated cell
Sci., 122, 2980 2988, doi: 10.1242/jcs.041970.
spreading and breakdown of epithelial adherens junctions,
18.
Montesano, R., Saint Vincent, L., Drevon, C., and
Mol. Biol. Cell, 13, 1449 1461, doi: 10.1091/mbc.01 10 0477.
Tomatis, L. (1975) Production of epithelial and mesenchy
23. Furukawa, K. T., Yamashita, K., Sakurai, N., and Ohno, S.
mal tumors with rat liver cells transformed in vitro, Int. J.
(2017) The epithelial circumferential actin belt regulates
Cancer, 16, 550 558, doi: 10.1002/ijc.2910160405.
YAP/TAZ through nucleocytoplasmic shuttling of merlin,
19.
Ломакина М. Е., Полесская А., Александрова А. Ю.,
Cell Rep.,
20,
14351447, doi:
10.1016/j.celrep.
Готро А. (2016) Поиск новых регуляторов клеточного
2017.07.032.
INVOLVEMENT OF SASH1 IN THE MAINTENANCE
OF STABLE CELL-CELL ADHESION*
A. S. Ilnitskaya, I. Y. Zhitnyak, and N. A. Gloushankova**
Blokhin National Medical Research Center of Oncology of the Ministry of Health of the Russian Federation,
115478 Moscow, Russia; E mail: natglu@hotmail.com
Received April 1, 2020
Revised April 29, 2020
Accepted May 3, 2020
SASH1 is an adapter and signaling protein that contains SH3 and SAM domains responsible for protein-protein
interactions. SASH1 downregulation has been observed in many tumors. We examined localization of SASH1 in cul
tures of normal IAR 20 epithelial cells and HT 29 colorectal cancer cells using immunofluorescence staining and
confocal microscopy. IAR 20 normal epithelial cells and HT 29 cells with epithelial phenotype formed stable linear
adherens junctions (AJs) associated with circumferential actin bundles. In both IAR 20 and HT 29 cells, SASH1
was co localized with zones of circumferential actin bundles and linear AJs. SASH1 was not detected in lamellipo
dia. IAR 20 and HT 29 cells treated with Epidermal Growth Factor underwent epithelial mesenchymal transition
(EMT). We observed significant differences in the course of EMT between IAR 20 and HT 29 cultures. IAR 20 cells
underwent partial EMT acquiring migratory phenotype but retaining E cadherin in unstable radial AJs. SASH1 was
present in these contacts. Disappearance of AJs was observed in HT 29 cell undergoing a complete EMT, which also
resulted in disruption of stable cell-cell adhesion. SASH1 was lost from the zones of cell-cell interaction. SASH1
depletion by means of RNA interference in IAR 20 cells led to destruction of stable linear AJs and acquisition of
mesenchymal phenotype by some of the cells. These data indicate involvement of SASH1 in the maintenance of sta
ble cell-cell adhesion.
Keywords: SASH1, cell-cell adhesion, E cadherin, epithelial mesenchymal transition
БИОХИМИЯ том 85 вып. 6 2020