БИОХИМИЯ, 2020, том 85, вып. 6, с. 783 - 795
УДК 577.117; 541.515; 678.048
ОММОХРОМЫ СЛОЖНОГО ГЛАЗА НАСЕКОМЫХ:
ФИЗИКО ХИМИЧЕСКИЕ СВОЙСТВА
И АНТИОКСИДАНТНАЯ АКТИВНОСТЬ*
© 2020
А.Е. Донцов1, Н.Л. Сакина1, М.А. Яковлева1, А.И. Бастраков2, И.Г. Бастракова3,
А.А. Загоринский4, Н.А. Ушакова2, Т.Б. Фельдман1,5, М.А. Островский1,5**
1 ФГБУН Институт биохимической физики им. Н.М. Эмануэля РАН,
119334 Москва, Россия; электронная почта: ostrovsky3535@mail.ru
2 ФГБУН Институт проблем экологии и эволюции им. А.Н. Северцова РАН, 119071 Москва, Россия
3 ФБУ ВНИИ лесоводства и механизации лесного хозяйства, 141200 Пушкино, Московская обл., Россия
4 ФБУ Рослесозащита, 141202 Пушкино, Московская обл., Россия
5 Московский государственный университет имени М.В. Ломоносова, 119991 Москва, Россия
Поступила в редакцию 01.04.2020
После доработки 05.05.2020
Принята к публикации 08.05.2020
Цель работы - скрининг и сравнительное исследование антиоксидантных свойств оммохромов сложного
глаза насекомых. Оммохромы были выделены в препаративных количествах из насекомых пяти различных
семейств: Stratiomyidae, Sphingidae, Blaberidae, Acrididae и Tenebrionidae. Количественный выход оммохро"
мов в зависимости от вида насекомого составил 0,9-5,4% сухого веса пигмента от влажного веса исходного
сырья. Методом высокоэффективной жидкостной хроматографии был проведен качественный анализ всех
изолированных оммохромов. Показано, что эти пигменты представляют собой смесь нескольких оммохро"
мов омматинового типа. Оммохромы, выделенные из всех перечисленных видов животных, проявляют вы"
раженную флуоресценцию с максимумами эмиссии в области 435-450 нм и 520-535 нм, причем интенсив"
ность эмиссионного максимума значительно возрастает при окислении оммохромов пероксидом водорода.
Установлено, что оммохромы имеют стабильный сигнал ЭПР, представляющий собой синглетную линию с
величиной g = 2,0045-2,0048, шириной 1,20-1,27 мТ и высокой концентрацией парамагнитных центров
(> 1017 спин/г сухого веса). Все исследованные оммохромы проявляют высокую антирадикальную актив"
ность, измеряемую по степени тушения хемилюминесценции в модельной системе окисления, содержащей
люминол, гемоглобин и пероксид водорода. Оммохромы проявляли высокую ингибирующую активность в
отношении пероксидации наружных сегментов фоторецепторных клеток, индуцированную видимым све"
том в присутствии в качестве сенсибилизатора липофусциновых гранул из клеток ретинального пигментно"
го эпителия глаза человека, а также в отношении железо"аскорбат"индуцированной пероксидации липи"
дов. Полученные результаты важны как для понимания биологической функции оммохромов у беспозво"
ночных, так и для выявления тех видов беспозвоночных, оммохромы которых можно было бы наиболее эф"
фективно использовать как фармакологические препараты, главным образом, для предотвращения и лече"
ния патологий, связанных с развитием окислительного стресса.
КЛЮЧЕВЫЕ СЛОВА: оммохромы, насекомые, ЭПР спектрометрия, флуоресценция, антиоксидантная ак"
тивность.
DOI: 10.31857/S0320972520060044
ВВЕДЕНИЕ
матины и оммины, представляющие собой ди"
меры или олигомеры производных кинуренина
Оммохромы - природные пигменты беспоз"
соответственно [1, 2]. Омматины и оммины in
воночных животных. Характерная особенность
vivo - темноокрашенные пигменты, как прави"
этих пигментов - наличие в структуре фенокса"
ло, желто"коричневого или пурпурного цвета.
зинового/фенотиазинового колец. Оммохромы
Насекомые используют оммохромы для окраски
подразделяют на две основных подгруппы - ом"
различных частей тела, для мимикрии. Так, на"
Принятые сокращения: УФ - ультрафиолет; ВЭЖХ - высокоэффективная жидкостная хроматография; ЭПР -
электронный перамагнитный резонанс; ТБК - тиобарбитуровая кислота.
biokhimiya, в рубрике «Papers in Press», BM20"084, 29.05.2020.
** Адресат для корреспонденции.
783
784
ДОНЦОВ и др.
пример, было показано, что ксантомматин и его
гих могут выполнять оммохромы. Известно, что
производные (такие как омматин D) ответ"
те виды ракообразных и насекомых, которые со"
ственны за цвет и его изменения у членистоно"
держат большие количества экранирующих пиг"
гих [3-5]. Значительные количества оммохро"
ментов, крайне устойчивы к прооксидантным
мов содержатся в сложном глазу членистоногих,
факторам [6, 10, 14]. Причем для ракообразных
где они находятся в высокой концентрации и
на примере креветки M. relicta нами было пока"
выполняют важную функцию. Так, ранее было
зано, что эффект этой устойчивости клеток
нами показано, что концентрация оммохромов
сложного глаза к действию прооксидантных
в глазу креветки"опоссум Mysis relicta достигает
факторов не связан с более высоким содержани"
80 мг сухого веса на 1 мл или 200 мкг сухого веса
ем в них низкомолекулярных антиоксидантов и
на 1 мг белка [6]. Сложный глаз большинства
антиоксидантных ферментов, а обусловлен
членистоногих состоит из множества неболь"
именно наличием большого количества гранул,
ших глазков (омматидиев), каждый со своими
содержащих оммохромы [14].
фоторецепторными клетками (рабдомами). Во
Оммохромы могут быть как донорами, так и
всех органах зрения, наряду со светочувстви"
акцепторами электронов и функционировать
тельными ретиналь"содержащими зрительными
как эффективные антирадикальные молекулы
пигментами, присутствуют и не светочувстви"
[15-17]. Одним из механизмов защитного
тельные экранирующие пигменты оммохромы.
действия оммохромов от фотоповреждения зри"
Их главная функция в сложных глазах оптичес"
тельных клеток может быть их реакция с синг"
кая - светофильтрующая и светопоглощающая
летным молекулярным кислородом, чрезвычай"
[7, 8]. Оммохромы участвуют в формировании
но токсичным для клетки оксидантом. Нами ра"
спектральной чувствительности глаза, погло"
нее было показано, что оммохромы глаза кре"
щая или пропуская свет в определенных облас"
ветки Pandalus latirostris тушат фотосенсибили"
тях спектра. Кроме того, поглощая рассеянный
зированную люминесценцию синглетного кис"
свет, они повышают контрастность и четкость
лорода [18]. В то же время не исключено, что
изображения.
оммохромы могут быть и генераторами синглет"
Наряду с оптической, оммохромы выполня"
ного кислорода. Такая возможность показана,
ют также защитную, антиоксидантную функ"
например, для кинуренина - предшественника
цию [9-12]. Эта защита необходима в связи с
биосинтеза оммохромов [19-21]. Однако дан"
тем, что кванты света, особенно в фиолетовой и
ных по фотовозбуждению оммохромов, образо"
синей областях спектра, высокоэнергетичны.
ванию триплета и генерации синглетного кис"
Вследствие этого они представляют потенци"
лорода в литературе нет. Скорее всего оммохро"
альную опасность для структур глаза, особенно
мы лишь тушители синглетного кислорода.
для фоторецепторных клеток сетчатки (т.н.
В настоящее время общепринято, что анти"
«Blue Light Hazard»). Опасность фотоповрежде"
оксидантная активность оммохромов обуслов"
ния структур глаза насекомых имеет свои осо"
лена их способностью нейтрализовать активные
бенности. Во"первых, в условиях длительной
формы кислорода и связывать ионы металлов
световой экспозиции в ретинулярных клетках
переменной валентности в неактивные комп"
глаза насекомых, в отличие от позвоночных жи"
лексы [9, 11]. Ранее нами было показано, что
вотных, могут накапливаться фагосомы [13], со"
оммохромы мухи черная львинка Hermetia illuB
держащие большое количество ненасыщенных
cens способны тушить хемилюминесценцию лю"
жирнокислотных остатков, легко подвержен"
минола, индуцированную пероксидом водорода
ных процессу пероксидации. Во"вторых, опти"
в присутствии гемоглобина
[12]. Величина
ческие среды глаза многих насекомых пропуска"
константы тушения хемилюминесценции ом"
ют УФ"облучение, которое является активным
мохромами мухи черная львинка (> 104 M-1) [22]
экзогенным прооксидантным фактором. В та"
сопоставима с аналогичными константами для
ких условиях облучение УФ" и интенсивным ви"
синтетических антиоксидантов, таких как мек"
димым светом может приводить к появлению
сидол и призводные гидрокси(алкокси)"2"ами"
токсичных продуктов пероксидации, которые
нобензотиазола [23].
способны проникать в мембраны рабдома и
Различные членистоногие, такие как ра"
повреждать их. Поэтому вероятность фотопо"
кообразные и насекомые, являются хорошим
вреждения в омматидии сложного глаза, по всей
источником природных биологически активных
видимости, более высока, чем в глазах позво"
пигментов оммохромов. Эти природные анти"
ночных животных. Вследствие этого наличие
оксиданты могут быть использованы в практи"
дополнительной защиты клеток сложного глаза
ческих целях, например, в фармакологии. Цель
от прооксидантных факторов жизненно необхо"
настоящей работы - получение оммохромов из
димо. Роль такой защиты в глазах членистоно"
различных кормовых насекомых и исследова"
БИОХИМИЯ том 85 вып. 6 2020
АНТИОКСИДАНТНАЯ АКТИВНОСТЬ ОММОХРОМОВ НАСЕКОМЫХ
785
ние их физико"химических характеристик и ан"
комых были отделены вручную и хранились при
тиоксидантных свойств.
температуре -180 °С. При необходимости голо"
вы насекомых были предварительно проинку"
бированы в нейтральном метаноле в соотноше"
МАТЕРИАЛЫ И МЕТОДЫ
нии ∼10 г голов на 300 мл метанола в течение су"
ток (в темноте), при комнатной температуре и
Выделение оммохромов из голов насекомых.
периодическом перемешивании. После фильт"
Оммохромы были получены из пяти видов насе"
рации 500 мл абсолютного метанола, содержа"
комых. Муха «черная львинка» (Hermetia illucens,
щего
1% по объему хлористого водорода
семейство Strationyidae) и ее личинки широко
(MeOH"HCl смесь), был добавлен к массе го"
используются для питания сельскохозяйствен"
лов, и смесь инкубировали при 6 °С в темноте, в
ных животных и конвертации биологических
течение 48 ч при периодическом встряхивании.
отходов в доступный источник пищевого белка,
После этого экстракт фильтровали через бумаж"
жиров, хитина и меланина. Чистая культура
ный фильтр (Ватман, Grade 6). Полученный су"
этих мух содержится в Институте проблем эко"
пернатант вишневого цвета нейтрализовали
логии и эволюции им. А.Н. Северцева (ИПЭЭ
20%"ным раствором аммиака и центрифугиро"
РАН). Технология культивирования мух вклю"
вали при 5000 g в течение 15 мин. Супернатант
чает следующие стадии: содержание взрослых
удаляли, к осадку добавляли свежий раствор
мух в инсектарии в контролируемых условиях;
MeOH"HCl до его полного растворения. Проце"
инкубация яиц и получение личинок в инкуба"
дуру осаждения оммохромов раствором аммиа"
торе; выращивание личинок в контейнере с пи"
ка повторяли дважды. Окончательно осадок ом"
тательным субстратом; получение предкуколок,
мохромов высушивали в эксикаторе в темноте, в
затем куколок и имаго. Взрослые мухи живут
присутствии безводного хлорида кальция.
5-8 дней. Нуклеотидная последовательность
Выделение липофусциновых гранул. Липо"
Hermetia illucens зарегистрирована в Генном бан"
фусциновые гранулы выделяли из клеток рети"
ке (Hermetia illucens, sample H"il 1 No. KY817115).
нального пигментного эпителия (РПЭ) кадавер"
После окончания жизненного цикла подмор
ных глаз доноров разных возрастов с помощью
мух замораживали и хранили при температуре
модифицированной методики, предложенной
-180 °C.
Boulton и Marshall [24]. Кадаверные глаза чело"
Жук чернотелка (большой мучной хрущак)
века были получены по договору из Глазного
(Tenebrio molitor, семейство Tenebrionidae) в нас"
тканевого банка ФГБУ МНТК «Микрохирургия
тоящее время является одним из самых попу"
глаза» им. акад. С.Н. Федорова» Минздрава Рос"
лярных видов кормовых насекомых, которых
сии. Изолированные липофусциновые гранулы
используют для кормления различных экзоти"
промывали 0,1 М К"фосфатным буфером, pH
ческих животных. Существуют крупные произ"
7,6, после чего ресуспендировали в фосфатном
водства в Европе, Китае, США. Культура содер"
буфере и хранили в морозильной камере при
жится в лабораторных условиях ИПЭЭ РАН.
- 20° С. Концентрацию гранул подсчитывали,
Таракан мраморный (Nauphoeta cinerea, се"
используя камеру Горяева.
мейство Blaberidae) - также популярный вид
Получение наружных сегментов фоторецепто
кормовых насекомых для насекомоядных жи"
ров быка. Наружные сегменты фоторецептор"
вотных. Культура содержится в лабораторных
ных клеток были выделены из сетчаток глаз бы"
условиях ИПЭЭ РАН.
ка модифицированным методом, предложен"
Бабочка табачный бражник (Manduca sexta,
ным Mc Dowell [25]. Полученные наружные сег"
семейство Sphingidae). Гусеницы этой бабочки
менты были суспендированы в 0,1 М К"фосфат"
служат популярным кормом для насекомояд"
ном буфере и хранились при температуре
ных экзотических животных. Культура содер"
-20 °C.
жится в энтомологическом отделе Московского
Получение кардиолипиновых липосом. Кар"
зоопарка.
диолипиновые липосомы были получены путем
Саранча пустынная (Schistocerca gregaria, се"
суспендирования кардиолипина в 0,1 М К"фос"
мейство Acrididae) - вид кормовых насекомых
фатном буфере, рН 7,4. В эксперименте исполь"
для насекомоядных животных. Пользуется по"
зовали натриевую соль кардиолипина («Sigma"
пулярностью как живой корм для насекомояд"
Aldrich», США) в метанольном растворе. Раст"
ных животных. Культура содержится в энтомо"
вор кардиолипина (5 мг/мл) испаряли на ротор"
логическом отделе Московского зоопарка.
ном испарителе, липидную пленку солюбилизи"
Экстракция оммохромов из голов насеко"
ровали в фосфатном буфере и тщательно пере"
мых была выполнена без их предварительной
мешивали на мешалке типа «Vortex». Суспензию
гомогенизации. Головы взрослых умерших насе"
липосом хранили при температуре 2-4 °С.
3 БИОХИМИЯ том 85 вып. 6 2020
786
ДОНЦОВ и др.
Анализ экстрактов оммохромов. Оммохромы
Окисление оммохромов пероксидом водорода.
анализировали методом высокоэффективной
Окислительная деструкция оммохромов была
жидкостной хроматографии (ВЭЖХ) на хрома"
вызвана 1,0-1,5% пероксидом водорода. Сус"
тографе фирмы «Knauer» (Германия) с колон"
пензию пигментов (2-3 мг/мл) в 0,1 М К"фос"
кой «Диасфер 120 С18» (4 х 250 мм, размер час"
фатном буфере, рН 7,4, или раствор оммохро"
тиц сорбента 5 мкм). Растворитель А - 10%"
мов в MeOH"HCl (0,5-1,0 мг/мл) инкубировали
ный ацетонитрил + 90% воды (+ 0,5% муравьи"
в присутствии пероксида водорода не менее 2 ч.
ной кислоты). Растворитель Б - 100%"ный аце"
После этого сравнивали физико"химические ха"
тонитрил (+ 0,5% муравьиной кислоты). Разде"
рактеристики исходного и окисленного образ"
ление осуществляли путем линейного градие"
цов.
нтного элюирования в системе: от 100% раство"
Определение антиоксидантной активности
рителя А до 60% растворителя А и 40% раство"
оммохромов. Антирадикальную активность по"
рителя Б за
60 мин, скорость потока
лученных оммохромов определяли с помощью
0,4 мл/мин. Температура колонки 24 °С. Про"
гомогенной гидрофильной хемилюминесцент"
дукты хроматографического разделения изме"
ной системы, состоящей из гемоглобина, пе"
ряли с помощью фотометрического детектора
роксида водорода и люминола [27]. В качестве
«Knauer К"2501», а также флуориметрического
измеряемых параметров был взят латентный
детектора (RF"10A"xl, «Shimadzu»). Образец
период достижения максимальной интенсив"
оммохромов или стандарта растворяли в
ности свечения. Кинетику хемилюминесцен"
100 мкл смеси метанола с 0,5%"ной HCl. Для
ции регистрировали на спектрофлуориметре
работы использовали готовые стандарты: трип"
«Shimadzu RF 5301PC» (Япония) при длине вол"
тофан, кинуренин,
3"гидроксикинуренин,
ны люминесценции 470 нм при комнатной тем"
ксантуреновая кислота фирмы «Sigma"Aldrich»
пературе. Для количественной оценки способ"
(США). Ксантомматин был синтезирован пу"
ности оммохромов взаимодействовать с радика"
тем автоокисления из 3"гидроксикинуренина,
лами, локализованными в водной фазе данной
согласно методике, описанной в [26]. Спектры
модельной системы, результаты тушения хеми"
оптического поглощения измеряли на спектро"
люминесценции пересчитывали в координатах
фотометре «Shimadzu UV-1601PC» (Япония).
зависимости латентного периода от концентра"
Спектры флуоресценции регистрировали на
ции пигмента. Среда для инкубации содержала
флуориметре «Shimadzu RF"5301PC» (Япония).
0,05 М К"фосфатный буфер, рН 7,4, 2,0 мкМ ге"
Для обработки полученных данных использова"
моглобина, 100 мкМ люминола, 100 мкМ ЭДТА,
ли программное обеспечение RFPC версия 2.0
и различные концентрации оммохромов в 0,1 М
(«Shimadzu»).
К"фосфатном буфере, рН 7,4 или в растворе ме"
Измерение концентрации свободно радикаль
танол"HCl. Реакцию начинали добавлением
ных центров. Параметры парамагнитных цент"
100 мкМ пероксида водорода. В качестве конт"
ров в оммохромах определяли методом спектро"
роля использовали буферный раствор без ом"
метрии электронного парамагнитного резонан"
мохромов.
са (ЭПР). Для этого использовали либо сухие
Кинетику пероксидации липидов кардиоли"
образцы оммохромов, либо их замороженные
пиновых липосом или наружных сегментов фо"
суспензии в К"фосфатном буфере, которые го"
торецепторных клеток определяли по накопле"
товили с помощью насадки из полиэтиленовой
нию продуктов реакции с тиобарбитуровой кис"
трубочки длиной 10-15 мм и внутренним диа"
лотой (ТБК"активные продукты) [28]. Процесс
метром 0,45 мм. На каждую пробу отбирали сус"
пероксидации липидов индуцировали либо
пензию оммохромов объемом 0,3 мл и быстро
ионами двухвалентного железа, либо видимым
замораживали в жидком азоте (-196 °С). Образ"
светом в присутствии липофусциновых гранул.
цы сохраняли в замороженном виде до момента
Для облучения полным видимым светом ис"
измерения. Для измерения спектров ЭПР из
пользовали галогенную лампу КГМ 24"150,
трубочки поршнем выдавливали замороженный
снабженную фокусирующей системой и тепло"
столбик образца. Регистрацию спектров ЭПР
вым фильтром. Энергия облучения составляла
образцов проводили при 77°К на радиоспектро"
80 мВт/см2. Спектральная область облучения
метре ЭПР «Bruker EMX» (Германия) в цилинд"
390-700 нм. Облучение проводили, как прави"
рическом резонаторе. Условия записи спектров
ло, при комнатной температуре и постоянном
ЭПР: ΔН развертка - 50 Гс; Н центр - 3440 Гс;
перемешивании. Среднюю скорость накопле"
амплитуда модуляции - 3 Гс, мощность СВЧ -
ния ТБК"активных продуктов рассчитывали,
20 мкВт. Эталон для определения концентрации
измеряя концентрацию продуктов, образовав"
спинов - УДА №5, сертификат о калибровке
шихся через 10, 25 и 40 мин после начала реак"
№ 905/910"2012.
ции.
БИОХИМИЯ том 85 вып. 6 2020
АНТИОКСИДАНТНАЯ АКТИВНОСТЬ ОММОХРОМОВ НАСЕКОМЫХ
787
Статистический анализ проводили с исполь"
Основные максимумы возбуждения корот"
зованием t"критерия Стьюдента (p < 0.05). Дан"
коволновой флуоресценции оммохромов были
ные были выражены как среднее арифметичес"
290 нм, 330 нм и 380 нм, а длинноволновой флуо"
кое ± стандартное отклонение.
ресценции - 330 нм и 460 нм.
Исследование качественного состава оммо"
хромов было выполнено методом ВЭЖХ. На
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
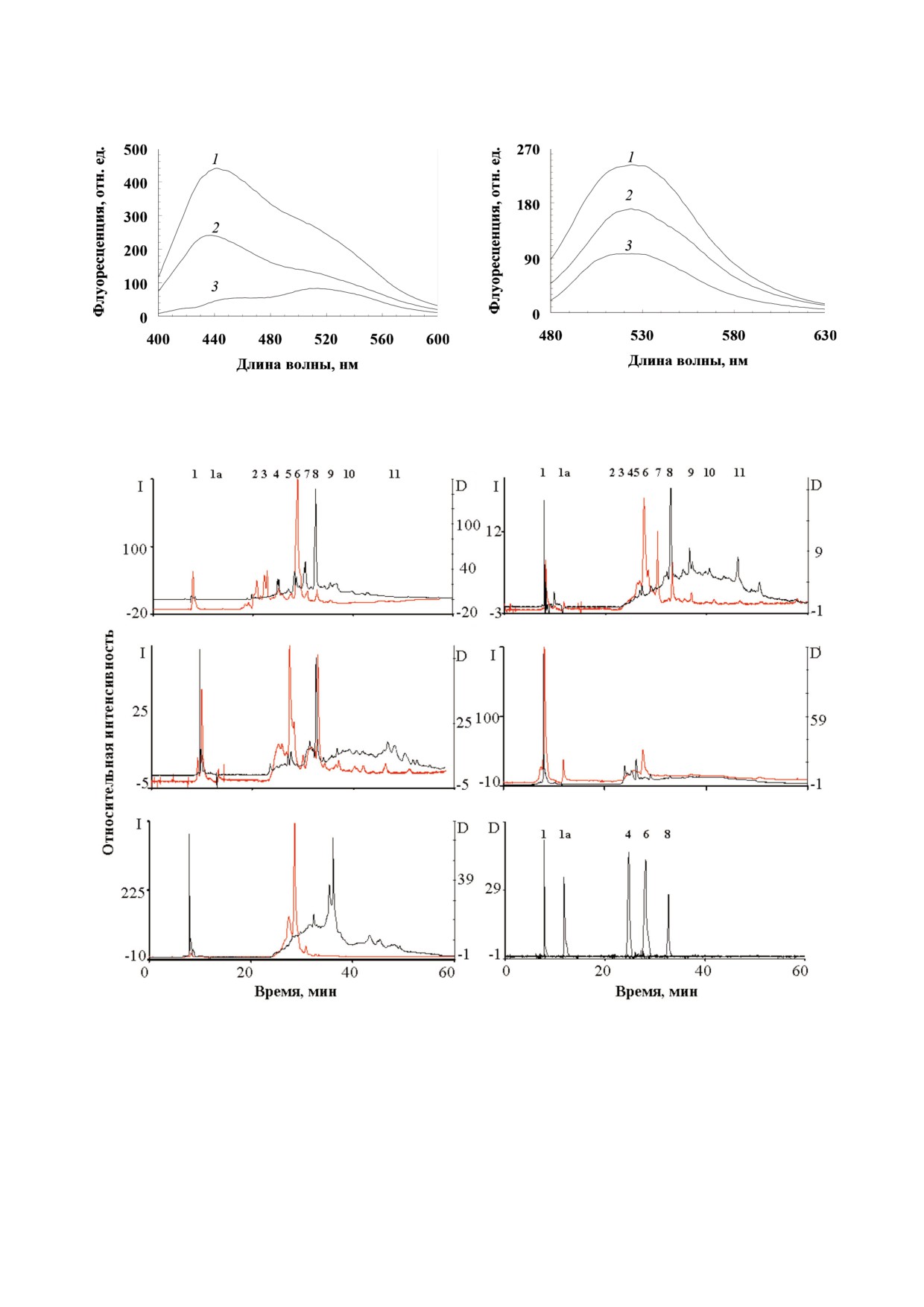
рис. 3 приведены хроматограммы всех изучен"
ных оммохромов, измеренных по поглощению
Все изученные насекомые содержали высо"
при длине волны 490 нм и по интенсивности
кие концентрации оммохромов, которые
флуоресценции при длине волны возбуждения
экстрагировали из голов насекомых с довольно
460 нм и эмиссии 520 нм.
высокими выходами. Выход оммохромов в % су"
Состав оммохромов был различен для разных
хого веса пигмента от влажного веса исходного
видов насекомых (рис. 3). Оммохромы представ"
сырья составил 0,9, 1,4, 1,7, 4,2 и 4,8% для мра"
ляли собой смесь нескольких веществ, главным
морного таракана, пустынной саранчи, бабочки
образом, смесь ксантомматина и нескольких его
бражник табачный, мухи черная львинка и жука
производных. Оммохромы мраморного таракана
чернотелки соответственно. Максимумы спект"
довольно сильно отличаются по составу от ос"
ров поглощения оммохромов всех изученных
тальных представителей класса насекомых
насекомых в видимой области спектра находи"
(рис. 3, д). Оммохромы бабочки бражник табач"
лись в диапазоне от 430 нм до 502 нм (рис. 1).
ный и мухи черная львинка (рис. 3, а и б) близки
Наиболее длинноволновые максимумы пог"
между собой по составу веществ, детектируемых
лощения были характерны для оммохромов ба"
как по поглощающим, так и по флуоресцирую"
бочки бражник табачный (502 нм, рис. 1, а) и
щим компонентам. Однако оммохромы бабочки
мраморного таракана (497 нм, рис. 1, д). Оммо"
табачный бражник в отличие от оммохромов му"
хромы жука чернотелки имели выраженный
хи черная львинка, возможно, содержат в своем
максимум поглощения при 454 нм (рис. 1, в).
составе омматин D с максимумом поглощения
Менее выраженный, но самый коротковолно"
490 нм, что согласуется с данными работы [30], в
вый максимум поглощения имели оммохромы
которой омматин D в смеси с ксантомматином
мухи черная львинка - 430 нм (рис. 1, б). Ом"
был найден как хромофор оммохром"связываю"
мохромы саранчи пустынной не показывали вы"
щего белка в гемолимфе бабочки бражник та"
раженного максимума поглощения в видимой
бачный. Жук чернотелка по составу оммохромов
области спектра, демонстрируя лишь «плечо» в
скорее ближе к бабочке и мухе, чем к мраморно"
области 490 нм (рис. 1, г). Характер спектров
му таракану (рис. 3, в). Важно отметить, что ом"
поглощения оммохромов не изменялся при не"
мохромы большинства изученных насекомых
зависимых выделениях из одного источника
имеют максимум поглощения близкий к макси"
(3-4 независимых выделения). Это связано, по"
муму поглощения омматинов. Однако полный
видимому, с тем, что условия культивирования
качественный состав оммохромов в глазах изу"
насекомых на протяжении эксперимента не из"
чаемых насекомых требует дальнейшего иссле"
менялись. Максимумы поглощения оммохро"
дования, возможно, с использованием масс"
мов при 430-490 нм характерны для класса ом"
спектрометрического анализа.
матинов, а максимумы поглощения при 520 нм
Все исследованные оммохромы имели выра"
и выше характерны для омминов [1]. Абсорбци"
женный синглетный сигнал ЭПР (рис. 4).
онные спектры оммохромов мухи черная львин"
Параметры сигнала ЭПР оммохромов из
ка, жука чернотелки и пустынной саранчи более
всех пяти видов насекомых приведены в табли"
характерны для спектров омматинов; абсорбци"
це. Видно, что все оммохромы имеют g факторы
онные спектры мраморного таракана и бабочки
близкие к g фактору свободного электрона и до"
бражник табачный имеют промежуточный ха"
вольно высокое содержание парамагнитных
рактер, что может быть связано с наличием у
центров. Наибольшая концентрация спинов,
них двух типов оммохромов - омматинов и ом"
отнесенная на грамм сухого веса, была у оммо"
минов.
хромов мухи и бабочки (>1018).
Все изолированные оммохромы интенсивно
Оммохромы остальных насекомых имели
флуоресцировали в видимой области спектра.
концентрацию парамагнитных центров меньше,
Наблюдалось два основных пика флуоресцен"
чем 1018, причем концентрация спинов оммо"
ции - коротковолновый с максимумом эмиссии
хромов пустынной саранчи и жука чернотелки
при 440 нм и длинноволновый с максимумом
была более чем на порядок ниже, чем у мухи чер"
эмиссии при 530 нм (рис. 2, а и рис. 2, б соответ"
ная львинка. Высокая концентрация стабильных
ственно).
свободно радикальных центров позволяет рас"
БИОХИМИЯ том 85 вып. 6 2020
3*
788
ДОНЦОВ и др.
а
б
в
г
д
Рис. 1. Спектры поглощения оммохромов насекомых в метанол"HCL. а - Бабочка бражник табачный; б - муха черная
львинка; в - жук чернотелка; г - саранча пустынная; д - таракан мраморный. Концентрация оммохромов была
0,4-0,6 мг/мл
сматривать оммохромы как сборщики («мусор"
структуру молекулы оммохромов, проявляют
щики») активных свободных радикалов. Вели"
стабильный сигнал ЭПР [32, 33] и могут, по"ви"
чина g фактора оммохромов, находящаяся в ин"
димому, обуславливать сигнал ЭПР, обнаружен"
тервале между 2,004 и 2,005 (таблица), характер"
ный нами у оммохромов насекомых. Более того,
на для феноксирадикалов [31]. Известно, что ин"
не исключено, что именно феноксазин и опреде"
термедиаты феноксазина, который входит в
ляет антирадикальную активность оммохромов
БИОХИМИЯ том 85 вып. 6 2020
АНТИОКСИДАНТНАЯ АКТИВНОСТЬ ОММОХРОМОВ НАСЕКОМЫХ
789
а
б
Рис. 2. Спектры флуоресценции оммохромов пустынной саранчи (1), бабочки бражник табачный (2) и мраморного тара"
кана (3) в метанол"НСl. Длина волны возбуждения составляла: a - 380 нм и б - 460 нм
а
б
в
г
д
е
Рис. 3. ВЭЖХ анализ экстрактов оммохромов из глаз насекомых различных видов. а - Бабочка бражник табачный; б - му"
ха черная львинка; в - жук чернотелка; г - саранча пустынная; д - таракан мраморный; е - панель разделения стандарт"
ных веществ. Детектирование по поглощению на длине волны 490 нм (хроматограмма черного цвета). Детектирование
флуоресценции на длине волны 520 нм при возбуждении флуоресценции длиной волны 460 нм (хроматограмма красного
цвета). Пики: 1-3"гидроксикинуренин, 1а - кинуренин, 4 - триптофан, 5 - предположительно дигидроксантомматин
[29], 6 - ксантуреновая кислота, 7 - предположительно декарбоксилированный ксантомматин [29], 8 - ксантомматин.
Для хроматограмм с детектированием по поглощению (D) и по флуоресценции (I) показаны отдельные оси ординат.
biokhsm/)
БИОХИМИЯ том 85 вып. 6 2020
790
ДОНЦОВ и др.
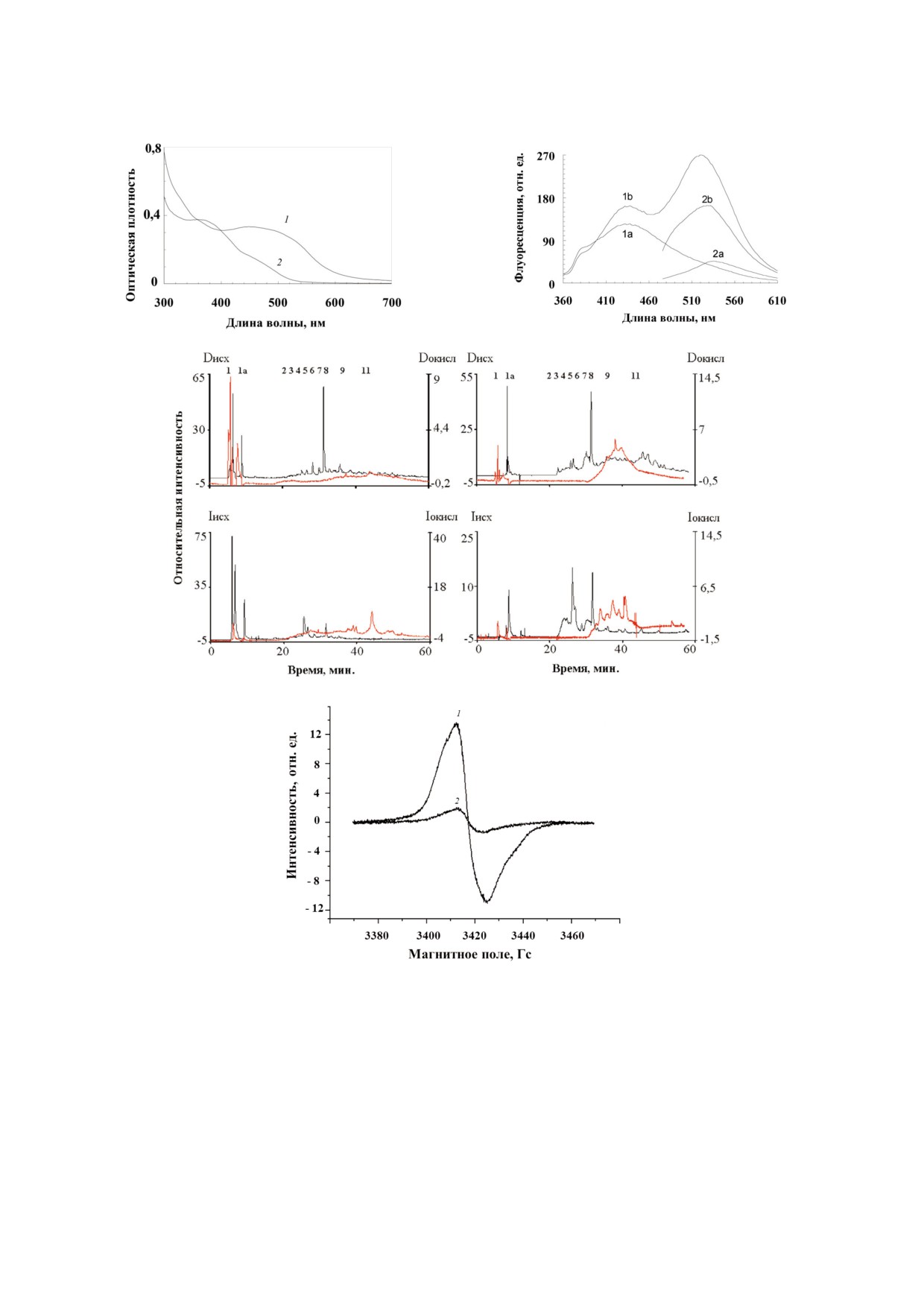
мента, сопровождающееся дальнейшим умень"
шением абсорбции пигментов в видимой облас"
ти спектра (рис. 5, а) и значительной потерей
количества парамагнитных центров.
Флуоресцентные свойства оммохромов так"
же претерпевали изменения при окислении ом"
мохромов пероксидом водорода. На рисунке 5, б
видно, что при окислении происходит значи"
тельный рост интенсивности флуоресценции
исследуемых образцов, главным образом, в
длинноволновой области спектра (500-600 нм).
ВЭЖХ анализ оммохромов показал замет"
ные качественные и количественные изменения
в их составе после окисления пероксидом водо"
рода (рис. 5, в-е). Видно, что пики 2-8, присут"
ствующие в исходном не окисленном образце,
Рис. 4. Спектры ЭПР оммохромов мухи черная львинка
после воздействия пероксидом водорода прак"
(1), бабочки бражник табачный (2), мраморного таракана
(3) и пустынной саранчи (4). Регистрацию спектров прово"
тически исчезают. Одновременно увеличивается
дили, используя сухие образцы препаратов оммохромов
содержание пиков 9-11, имеющих значитель"
при комнатной температуре
ную флуоресценцию. Однако для окончательно"
го выяснения причин увеличения интенсивнос"
ти флуоресценции оммохромов при окислении
[17]. Сигнал ЭПР оммохромов был чувствителен
пероксидом водорода необходимы дополни"
к облучению как УФ, так и видимым светом при
тельные исследования.
температуре жидкого азота (на рис. не показа"
Сигнал ЭПР оммохромов также оказался
но). При облучении оммохромов интенсивность
чувствительным к действию пероксида водорода
исходного сигнала ЭПР значительно возрастала.
(рис. 5, ж, кривые 1 и 2). Окисление оммохро"
Оммохромы оказались чувствительными к
мов пероксидом водорода приводило к резкому
окислению пероксидом водорода и/или надпе"
падению сигнала ЭПР и, в конечном счете, к
роксидом калия. Окисление пероксидом водоро"
полной потере парамагнетизма, что вероятно
да приводило к исчезновению длинноволнового
связано с разрушением феноксазинового кольца
максимума поглощения в области 430-502 нм
в структуре молекул оммохромов [17], исходно
(рис. 5, а, кривая 1) и появлению коротковолно"
проявляющего свободнорадикальные свойства.
вого максимума в области 370-390 нм (рис. 5, а,
Деструкция оммохромов из глаза дрозофилы пе"
кривая 2). Это свидетельствует о том, что изоли"
роксидом водорода была показана ранее [34].
рованные оммохромы находились, главным об"
Оммохромы в относительно невысоких кон"
разом, в восстановленном состоянии. Действие
центрациях тушат хемилюминесценцию люми"
пероксида водорода имеет, как минимум, двух"
нола, инициируемую пероксидом водорода. На
фазный характер. Сначала наблюдается переход
рис. 6, а показана кинетика хемилюминесцен"
оммохромов в окисленную форму, а затем при
ции люминола в присутствии различных концен"
длительной инкубации с окислителем, по"види"
траций оммохромов мраморного таракана. В
мому, происходит постепенное разрушение пиг"
присутствии оммохромов наблюдается как па"
Параметры сигнала ЭПР оммохромов насекомых
Оммохромы, порошок, комнатная температура
Образец
бабочка
муха
саранча
таракан
жук
бражник
черная львинка
пустынная
мраморный
чернотелка
Параметры сигнала ЭПР
табачный
g"фактор
2,0048
2,0045
2,0045
2,0046
2,0045
Полуширина линии, ΔHpp
12,0
12,4
12,6
12,7
10,2
Концентрация парамагнитных центров,
27,5 × 1017
48,0 × 1017
4,6 × 1017
9,7 × 1017
0,5 × 1017
спин/г сухого вещества
БИОХИМИЯ том 85 вып. 6 2020
АНТИОКСИДАНТНАЯ АКТИВНОСТЬ ОММОХРОМОВ НАСЕКОМЫХ
791
а
б
в
д
г
е
ж
Рис. 5. Действие пероксида водорода на оммохромы насекомых. а - Абсорбционный спектр оммохромов жука чернотел"
ки до (1) и после (2) окисления пероксидом водорода; б - спектры флуоресценции оммохромов жука чернотелки при дли"
не волны возбуждения 340 нм (1) и 460 нм (2). Исходный спектр (а) и спектр после действия пероксида водорода (б);
в-е - ВЭЖХ анализ оммохромов из глаз жука чернотелки до и после воздействия на них перексидом водорода (в - детек"
тирование по поглощению на длине волны 380 нм; г - детектирование флуоресценции на длине волны 520 нм при воз"
буждении флуоресценции длиной волны 380 нм; д - детектирование по поглощению на длине волны 490 нм; е - детек"
тирование флуоресценции на длине волны 520 нм при возбуждении флуоресценции длиной волны 460 нм); черная кри"
вая - исходный образец, красная кривая - после воздействия пероксидом водорода. Для хроматограмм исходного образ"
ца (Dисх или Iисх) и после воздействия пероксидом водорода (Dокисл и Iокисл) показаны отдельные оси ординат. D - детекти"
рование по поглощению, I - детектирование по флуоресценции; ж - сигнал ЭПР оммохромов бабочки бражник табач"
ный. Исходный спектр (1); спектр после окисления пероксидом водорода (2). Измерения проведены на суспензии оммо"
хромов в фосфатном буфере при температуре жидкого азота
БИОХИМИЯ том 85 вып. 6 2020
792
ДОНЦОВ и др.
а
б
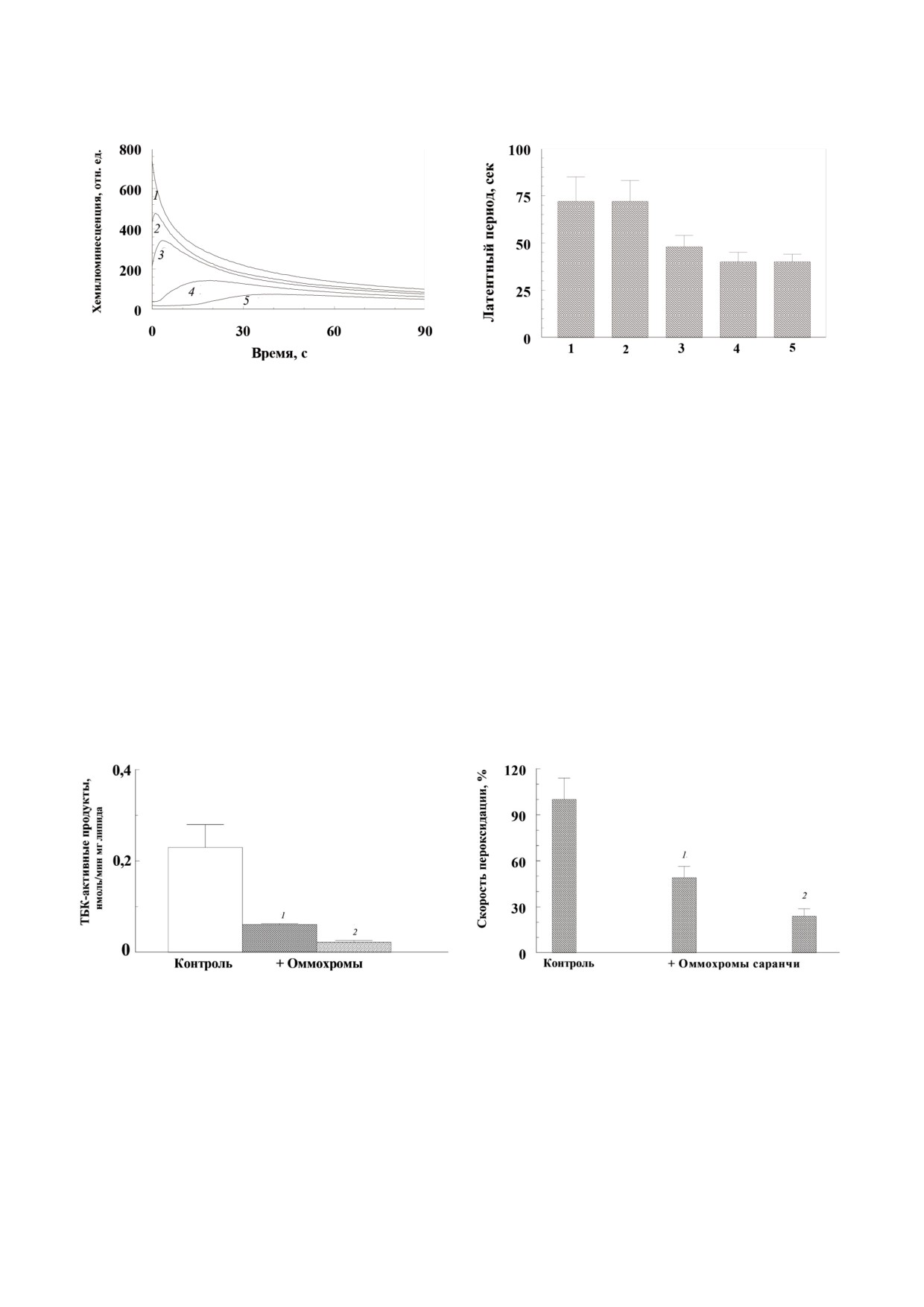
Рис. 6. Тушение хемилюминесценции люминола оммохромами насекомых. а - Кинетика хемилюминесценции люмино"
ла в присутствии различных концентраций оммохромов мраморного таракана. 1 - контроль, 2-5 - добавлено 100 мкг/мл,
150 мкг/мл, 250 мкг/мл и 400 мкг/мл оммохромов соответственно. Контрольными образцами служили пробы, содержа"
щие буферный раствор без оммохромов; б - латентный период возгорания хемилюминесценции люминола в присутствии
различных оммохромов в концентрации 750 мкг/мл. 1 - муха черная львинка, 2 - таракан мраморный, 3 - бабочка браж"
ник табачный, 4 - жук чернотелка, 5 - саранча пустынная. Каждый столбик - результат 4 независимых измерений. Дан"
ные статистически значимы для р < 0,05. Среда инкубации содержала 0,05 М К"фосфатный буфер, рН 7,4, 2,0 мкМ гемо"
глобин, 100 мкМ люминол, 100 мкМ ЭДТА и суспензию различных оммохромов в К"фосфатном буфере. Реакцию начи"
нали добавлением 100 мкМ пероксида водорода
дение амплитуды хемилюминесценции, так и
нола при одинаковой концентрации всех изуча"
увеличение временного периода достижения
емых оммохромов (рис. 6, б), составляющей
максимума свечения.
750 мкг/мл. Каждый столбик - среднее 4 неза"
Концентрация оммохромов
400 мкг/мл
висимых измерений латентного периода разви"
(рис. 6, а, кривая 5) вызывала значительное ин"
тия хемилюминесценции (рис. 6, б). В этих усло"
гибирование развития процесса хемилюминес"
виях наибольшей антирадикальной активностью
ценции люминола. Для сравнения антиради"
обладали оммохромы мухи черная львинка и
кальной активности различных оммохромов,
мраморного таракана (столбики 1 и 2), а оммо"
были определены сравнительные величины ла"
хромы жука чернотелки и саранчи пустынной
тентного периода хемилюминесценции люми"
(столбики 4 и 5) проявляли наименьшую антира"
Рис. 7. Ингибирующее действие оммохромов мухи черная
Рис. 8. Ингибирующее действие оммохромов пустынной
львинка (1) и бабочки бражник табачный (2) на Fe2+ - ас"
саранчи на пероксидацию наружных сегментов фоторе"
корбат индуцированную пероксидацию кардиолипиновых
цепторных клеток (НСФ), инициализированную облуче"
липосом. Каждый столбик - результат трех независимых
нием видимым светом в присутствии липофусциновых
измерений. Результат статистически значим для p < 0,05.
гранул. Каждый столбик - результат трех независимых из"
Среда инкубации содержала 0,1 М К"фосфатный буфер,
мерений. Результат статистически значим для p < 0,05.
рН 7,4, 265 мкг/мл кардиолипиновых липосом, 0,5 мМ ас"
Среда инкубации содержала 0,1 М К"фосфатный буфер,
корбат и 35 мкМ Fe2+. Концентрация оммохромов была
рН 7,4, 200 мкг/мл белка НСФ и 5 × 106 гранул/мл липо"
90 мкг/мл; контроль без добавления оммохромов
фусцина; концентрация оммохромов составляла 46 (1) и 77
мкг/мл (2), соответственно; контроль - скорость перокси"
дации НСФ в отсутствие оммохромов принята за 100%
БИОХИМИЯ том 85 вып. 6 2020
АНТИОКСИДАНТНАЯ АКТИВНОСТЬ ОММОХРОМОВ НАСЕКОМЫХ
793
дикальную активность. Этот результат коррели"
вого ряда [23]. В наших экспериментах оммохро"
рует с данными по концентрации стабильных
мы в концентрации 0,5 мг/мл приводили к прак"
свободно радикальных центров в оммохромах.
тически 90% ингибированию свободнорадикаль"
Действительно, их концентрация в оммохромах
ных процессов. Важно отметить, что оммохромы
жука чернотелки и саранчи пустынной мини"
эффективно тормозили сенсибилизированную
мальна. С другой стороны, остается непонятным
липофусцином фотопероксидацию наружных
более высокая антирадикальная активность ом"
сегментов фоторецепторных клеток (рис. 8). Уже
мохромов мраморного таракана (столбик 2) по
в концентрации 0,08 мг/мл (≈ 0,2 мМ) они инги"
сравнению с таковой для оммохромов бабочки
бировали эту реакцию на 70%, тогда как хорошо
табачного бражника (столбик 3), поскольку кон"
известный синтетический антиоксидант мекси"
центрация парамагнитных центров оммохромов
дол в концентрации 0,5 мМ ингибировал эту же
бабочки значительно выше, чем у мраморного
реакцию не более чем на 50% [35]. Поэтому, ра"
таракана. Как уже упоминалось, константа ту"
зумно предположить, что оммохромы, содержа"
шения хемилюминесценции люминола оммо"
щиеся в сложных глазах насекомых в большом
хромами мухи черная львинка довольно высока,
избытке, могут оказывать значительное антиок"
что характеризует эти пигменты как довольно
сидантное действие. Механизмы антиоксидант"
сильные антиоксиданты. Из рис. 6, б следует, что
ного действия оммохромов могут быть связаны с
эффективность тушения хемилюминесценции
их реакцией с активными формами кислорода и
оммохромами мраморного таракана не уступает
со способностью утилизировать свободные ради"
таковой для оммохромов черной львинки, а эф"
калы [9, 11, 15, 16].
фективность тушения хемилюминесценции ом"
Таким образом, разработана относительно
мохромами бабочки бражник табачный, жука
простая процедура изоляции оммохромов из го"
чернотелки и саранчи пустынной хотя и ниже,
лов кормовых насекомых. По своим типичным
чем у оммохромов мухи черная львинка, но со"
физико"химическим характеристикам эти пиг"
поставима с ней. Важно отметить, что концент"
менты могут быть отнесены к группе оммати"
рация оммохромов в глазах изученных насеко"
нов [1, 2, 8, 36]. Кормовые насекомые, широко
мых очень высока. По нашим расчетам, содер"
используемые в практических целях и культи"
жание оммохромов, например, в глазу мухи чер"
вируемые в контролируемых условиях (как в ла"
ная львинка достигает 90 мг/мл, а в глазу саран"
бораторных, так и промышленных масштабах),
чи пустынной 45 мг/мл. Это значительно пре"
являются хорошими природными источниками
восходит использованные нами в эксперименте
большого количества оммохромов. Так, по на"
концентрации оммохромов (< 1 мг/мл).
шим данным, из голов мухи черная львинка
Оммохромы всех изученных насекомых ин"
можно извлечь более 4% сухого веса оммохро"
гибировали реакции пероксидации, индуциро"
мов от влажного веса исходного сырья. Благо"
ванные различными прооксидантными систе"
даря своей биологической активности эти при"
мами. Антиоксидантная активность оммохро"
родные пигменты могут рассматриваться как
мов была определена для трех различных систем
перспективные фармакологические препараты,
индукции процесса пероксидации, для: Fe2+"ас"
главным образом, для предотвращения и лече"
корбат"индуцированной пероксидации кардио"
ния патологий, связанных с развитием окисли"
липиновых липосом (рис. 7); аскорбат индуци"
тельного стресса. Полученные нами результаты
рованной пероксидации наружных сегментов
важны для понимания механизмов осуществле"
фоторецепторных клеток глаза быка (не показа"
ния биологической функции оммохромов как
но); фотоиндуцированной пероксидации на"
экранирующих и антиоксидантных пигментов,
ружных сегментов фоторецепторных клеток,
в первую очередь, в омматидиях сложного глаза
сенсибилизированной липофусциновыми гра"
беспозвоночных животных.
нулами из клеток ретинального пигментного
эпителия глаза человека (рис. 8).
В этих экспериментах использовали оммо"
Финансирование. Работа выполнена при фи"
хромы мухи черная львинка, бабочки бражник
нансовой поддержке РФФИ (грант № 19"04"
табачный (рис. 7) и саранчи пустынной (рис. 8).
00411).
Все они проявляли выраженную антиоксидант"
Конфликт интересов. Авторы заявляют об от"
ную активность, ингибируя процессы перокси"
сутствии конфликта интересов.
дации и фотопероксидации уже в относительно
Соблюдение этических норм. Содержание и
низких концентрациях. Антиоксидантная актив"
эксперименты с животными были выполнены в
ность оммохромов насекомых была сопоставима
соответствии с Правилами лабораторной прак"
с таковой для природных меланинов [12] и для
тики Российской Федерации (приказ МЗ РФ №
синтетических антиоксидантов оксипиридино"
708н от 23"08.2010).
БИОХИМИЯ том 85 вып. 6 2020
794
ДОНЦОВ и др.
СПИСОК ЛИТЕРАТУРЫ
1.
Butenandt, A., and Schafer, W. (1962) Recent Progress in
kynurenines: density functional theory calculations, PLoS
the Chemistry of Natural and Synthetic Coloring Matters and
Comput. Biol., 12, e1005213, doi: 10.1371/journal.pcbi.
Related Fields (Gore, T. S., Joshi, B. S., Sunthankar, S. V.,
1005213.
and Tilak, B. D., eds.) Academic Press, NY, USA, pp. 13"
17.
Farmer, L. A., Haidasz, E. A., Griesser, M., and Pratt, D. A.
34, doi: 10.1177/004051756303300710.
(2017) Phenoxazine: a privileged scaffold for radical"trap"
2.
Figon, F., and Casas, J. (2019) Ommochromes in inverte"
ping antioxidants, J. Org. Chem., 82, 10523"10536,
brates: biochemistry and cell biology, Biol. Rev. Camb.
doi: 10.1021/acs.joc.7b02025.
Philos. Soc., 94, 156"183, doi: 10.1111/brv.12441.
18.
Егоров С. Ю., Красновский А. А., Донцов А. Е.,
3.
Riou, M., and Christides, J."P. (2010) Cryptic color
Островский М. А. (1987) Тушение синглетного моле"
change in a crab spider (Misumena vatia): Identification
кулярного кислорода экранирующими пигмента"
and quantification of precursors and ommochrome pig"
ми - меланинами и оммохромами, Биофизика, 32,
ments by HPLC, J. Chem. Ecol.,
36,
412"423,
685"687.
doi: 10.1007/s10886"010"9765"7.
19.
Егоров С. Ю., Бабижаев М. А., Красновский А. А.,
4.
Stavenga, D. G., Leertouwer, H. L., and Wilts, B. D.
Шведова А. А. (1987) Фотосенсибилизированная ге"
(2014) Coloration principles of nymphaline butterflies -
нерация синглетного молекулярного кислорода эндо"
thin films, melanin, ommochromes and wing scale stack"
генными фотосенсибилизаторами хрусталика глаза
ing, J. Exp. Biol., 217, 2171"2180, doi: 10.1242/jeb.098673.
человека, Биофизика, 32, 169"171.
5.
Panettieri, S., Gjinaj, E., John, G., and Lohman, D. J.
20.
Снытникова О. А., Шерин П. С., Копылова Л. В.,
(2018) Different ommochrome pigment mixtures enable
Центалович Ю. П. (2007) Кинетика и механизм реак"
sexually dimorphic Batesian mimicry in disjunct popula"
ции фотовозбужденного кинуренина с молекулами
tions of the common palmfly butterfly, Elymnias hyperB
биологических соединений, Известия РАН. Сер. Хим.,
mnestra, PLoS One,
13, e0202465, doi:
10.1371/
4, 704"710, doi: 10.1007/s11172"007"0109"x.
journal.pone.0202465.
21.
Tsentalovich, Y. P., Snytnikova, O. A., Sherin, P. S., and
6.
Dontsov, A. E., Fedorovich, I. B., Lindström, M., and
Forbes, M. D. (2005) Photochemistry of kynurenine, a
Ostrovsky, M. A. (1999) Comparative study of spectral and
tryptophan metabolite: properties of the triplet state, J.
antioxidant properties of pigments from the eyes of two
Phys. Chem. A, 109, 3565"3568, doi: 10.1021/jp045142k.
Mysis relicta (Crustacea, Mysidacea) populations, with dif"
22.
Донцов А. Е., Ушакова Н. А., Садыкова В. С., Бастра"
ferent light damage resistance, J. Compar. Physiol. B, 169,
ков А. И. (2020) Оммохромы Hermetia illucens: получе"
157"164, doi: 10.1007/s003600050206.
ние, исследование антиоксидантных характеристик и
7.
Грибакин Ф. Г. (1981) Механизмы фоторецепции насеB
антимикробной активности, Прикл. Биохим. МикробиB
комых, Наука, Л., с. 214.
ол., 56, 90"95, doi: 10.31857/S0555109920010043.
8.
Островский М. А., Зак П. П., Донцов А. Е. (2018) Ме"
23.
Смирнов Л. Д., Кузнецов Ю. В., Проскуряков С. Я.,
ланосомы глаза позвоночных и оммохромы глаза бес"
Скворцов В. Г., Носко Т. Н., Донцов А. Е. (2011) Антира"
позвоночных как экранирующие клеточные органел"
дикальная и NO"ингибирующая активность β"гидрок"
лы, Известия РАН Сер. Биол., 6, 658"668, doi: 10.1134/
си(этокси) производных азотистых гетероциклов, БиоB
S0002332918060103.
физика, 56, 316"321, doi: 10.1134/S000635091102028X.
9.
Ostrovsky, M. A., Sakina, N. L., and Dontsov, A. E. (1987)
24.
Донцов А. Е., Сакина Н. Л., Островский М. А. (2017)
An antioxidative role of ocular screening pigments, Vis.
Потеря меланина клетками РПЭ глаза связана с его
Res., 27, 893"899, doi: 10.1016/0042"6989(87)90005"8.
окислительной деструкцией в составе меланолипо"
10.
Insausti, T. C., LeGall, M., and Lazzari, C. R. (2013)
фусциновых гранул, Биохимия, 82, 8, 1188"1198,
Oxidative stress, photodamage and the role of screening
doi: 10.1134/S0006297917080065.
pigments in insect eyes, J. Exp. Biol., 216, 3200"3207,
25.
Mc Dowell, J. H. (1993) Preparing rod outer segment
doi: 10.1242/jeb.082818.
membranes, regenerating rhodopsin, and determining
11.
Островский М. А., Донцов А. Е. (2019) Меланосомы
rhodopsin concentration, in: Methods in Neurosciences
глаза позвоночных и оммохромы глаза беспозвоноч"
(Hargrave, P. A., ed) Acad. Press, New York, 15, pp. 123"
ных как антиоксидантные клеточные органеллы, ИзB
130, doi: 10.1016/B978"0"12"185279"5.50013"3.
вестия РАН Сер. Биол.,
1,
95"108, doi:
10.1134/
26.
Li, J., Berntsen, B. T., and James, A. A. (1999) Oxidation
S0002332919010089.
of 3"hydroxykynurenine to produce xanthommatin for eye
12.
Ushakova, N., Dontsov, A., Sakina, N., Bastrakov, A., and
pigmentation: a major branch pathway of tryptophan
Ostrovsky, M. (2019) Antioxidative properties of melanins
catabolism during pupal development in the yellow fever
and ommochromes from black soldier fly Hermetia illu"
mosquito, Aedes aegypti, Bioch. Mol. Biol., 29, 329-338,
cens, Biomolecule, 9, 408, doi: 10.3390/biom9090408.
doi: 10.1016/s0965"1748(99)00007"7.
13.
Stowe, S. (1983) Phagocytosis of rhabdomeral membrane
27.
Теселкин Ю. О., Бабенкова И. В., Любицкий О. Б.,
by crab photoreceptors, Cell Tissue Res., 234, 463"467,
Клебанов Г. И., Владимиров Ю. А. (1997) Измерение
doi: 10.1007/BF00213782.
антиоксидантной активности плазмы крови в системе
14.
Фельдман Т. Б., Донцов А. Е., Яковлева М. А., Федо"
гемоглобин - пероксид водорода - люминол, Вопросы
рович И. Б., Линдстрем М., Доннер К., Островский М. А.
Мед. Химии, 43, 87"92.
(2008) Сравнение систем антиоксидантной защиты в
28.
Ottolenghi, A. (1959) Interaction of ascorbic acid and
глазах двух популяций креветок Mysis relicta
mitochondrial lipids, Arch. Biochem. Biophys., 7, 355-363,
(Crustacea: Mysidacea), отличающихся по их устойчи"
вости к фотоповреждению, Сенсорные системы, 22,
29.
Figon, F., Munsch, T., Croix, C., Viaud"Massuard, M."C.,
309"316.
Lanoue, F., and Casas, J. (2019) Biological identification
15.
Romero, Y., and Martinez, A. (2015) Antiradical capacity
and localization of uncyclized xanthommatin, a key inter"
of ommochromes, J. Mol. Model., 21, 220, doi: 10.1007/
mediate in ommochrome biosynthesis: an in vitro-in vivo
s00894"015"2773"3.
study, bioRxiv Preprint, doi: 10.1101/666529.
16.
Zhuravlev, A. V., Zakharov, G. A., Shchegolev, B. F., and
30.
Martel, R. R., and Law, J. H. (1991) Purification and prop"
Savvateeva"Popova, E. V. (2016) Antioxidant properties of
erties of an ommochrome"binding protein from the
БИОХИМИЯ том 85 вып. 6 2020
АНТИОКСИДАНТНАЯ АКТИВНОСТЬ ОММОХРОМОВ НАСЕКОМЫХ
795
hemolymph of the tobacco hornworm, Manduca sexta,
34. Ephrussi, B., and Herold, J. L. (1944) Studies of eye pig"
J. Biol. Chem., 266, 21392"21398.
ments of drosophila. I. Methods of extraction and quanti"
31.
Bolton, J. R. (1972) Experimental aspects of biological
tative estimation of the pigment components, Genetics, 39,
electron spin resonance studies, in Biological Application of
148"175.
Electron Spin Resonance (Swartz, H. M., Bolton, J. R., and
35. Донцов А. Е., Коромыслова А. Д., Кузнецов Ю. В., Са"
Borg, D. C., eds.), Wiley (Interscience), NY, USA, 1972,
кина Н. Л., Островский М. А. (2014) Антирадикальная
p. 11.
и фотопротекторная активность оксибиола - нового
32.
Lhoste, J."M., Haug, A., and Ptak, M. (1966) Electron
водорастворимого антиоксиданта гетероароматичес"
paramagnetic resonance studies of photoselected triplet
кого ряда, Известия РАН. Сер. Хим., 5, 1159"1163,
molecules. I. Phenoxazine, J. Chem. Phys., 44, 648"654,
doi: 10.1007/s11172"014"0565"z.
doi: 10.1063/1.1726739.
36. Becker, E. (1942) On the properties, distribution and the
33.
Bolognese, A., Bonomo, R. P., Chillemi, R., and Sciuto, S.
genetic developmental physiological significance of the
(1990) Oxidation of 3"hydroxykynurenine. An EPR inves"
pigments of the ommatin and ommin group (ommo"
tigation, J. Heterocyclic Chem.,
27,
2207"2208,
chromes) in arthropods, Mol. Gener. Genet., 80, 157"204,
doi: 10.1002/jhet.5570270762.
doi: 10.1007/BF01741981.
OMMOCHROMES OF THE COMPLEX EYE OF INSECTS:
PHYSICOCHEMICAL PROPERTIES AND ANTIOXIDANT ACTIVITY*
A. E. Dontsov1, N. L. Sakina1, M. A. Yakovleva1, A. I. Bastrakov2, I. G. Bastrakova3,
A. A. Zagorinsky4, N. A. Ushakova2, T. B. Feldman1,5, and M. A. Ostrovsky1,5**
1 Emanuel Institute of Biochemical Physics, Russian Academy of Sciences,
119334 Moscow, Russia; EBmail: ostrovsky@mail.ru
2 Severtsov Institute of Ecology and Evolution, Russian Academy of Sciences, 119071 Moscow, Russia
3 AllBRussian Research Institute of Silviculture and Mechanization of Forestry,
141200 Pushkino, Moscow Region, Russia
4 Russian Forest Protection Center, 141202 Pushkino, Moscow Region, Russia
5 Lomonosov Moscow State University, 119991 Moscow, Russia
Received April 1, 2020
Revised May 5, 2020
Accepted May 8, 2020
The objective of this study was screening of ommochromes from the compound eyes of insects and comparison of
their antioxidant properties. Ommochromes were isolated in preparative quantities from insects of five different fam"
ilies: Stratiomyidae, Sphingidae, Blaberidae, Acrididae, and Tenebrionidae. The yield of ommochromes (dry pig"
ment weight) was 0.9"5.4% of tissue wet weight depending on the insect species. Isolated pigments were analyzed by
high"performance liquid chromatography and represented a mixture of several ommochromes of the ommatin series.
The isolated ommochromes displayed a pronounced fluorescence with the emission maxima at 435"450 nm and 520"
535 nm; furthermore, the emission intensity increased significantly upon ommochrome oxidation with hydrogen
peroxide. The ommochromes produced a stable EPR signal consisting of a singlet line with g = 2.0045"2.0048, width
of 1.20"1.27 mT, and high concentration of paramagnetic centers (> 1017 spin/g dry weight). All the investigated
ommochromes demonstrated high antiradical activity measured from the degree of chemiluminescence quenching
in a model system containing luminol, hemoglobin, and hydrogen peroxide. The ommochromes strongly inhibited
peroxidation of the photoreceptor cell outer segments induced by visible light in the presence of lipofuscin granules
from the human retinal pigment epithelium, as well as suppressed iron/ascorbate"mediated lipid peroxidation. The
obtained results are important for understanding the biological functions of ommochromes in invertebrates and
identifying invertebrate species that could be used as efficient sources of ommochromes for pharmacological prepa"
rations to prevent and treat pathologies associated with the oxidative stress development.
Keywords: ommochromes, insects, EPR spectrometry, fluorescence, antioxidant activity
БИОХИМИЯ том 85 вып. 6 2020