БИОХИМИЯ, 2020, том 85, вып. 6, с. 796 - 806
УДК 577.355.132
ФУНКЦИОНАЛЬНАЯ СВЯЗЬ ФИКОЭРИТРИНА
С ФОТОСИСТЕМОЙ II У КРИПТОФИТОВОЙ
ВОДОРОСЛИ Rhodomonas salina*
© 2020
И.Н. Стадничук1**, Т.М. Новикова2, Г.С. Минюк2,
В.А. Бойченко3
,
Ю.В. Болычевцева4, Е.С. Гусев1, Е.П. Лукашев5
1 Институт физиологии растений им. К.А. Тимирязева РАН,
127276 Москва, Россия; электронная почта: stadnichuk@mail.ru
2 ФИЦ Институт биологии южных морей им. А.О. Ковалевского РАН, 299011 Севастополь, Россия
3 Институт фундаментальных проблем биологии Российской академии наук,
142290 Пущино, Московская обл., Россия
4 ФИЦ Биотехнологии, Институт биохимии им. А.Н. Баха РАН, 119071 Москва, Россия
5 Московский государственный университет имени М.В. Ломоносова,
биологический факультет, 119991 Москва, Россия
Поступила в редакцию 09.04.2020
После доработки 02.05.2020
Принята к публикации 03.05.2020
Криптофитовые водоросли занимают особую пигментную нишу среди оксигенных фотосинтетиков, обла
дая уникальным для пластид сочетанием фикобилипротеинов и хлорофилл а/с содержащей антенны. Све
дения о фотосинтезе криптофит, несмотря на успехи в изучении морфологии, экологии и геносистематики,
остаются недостаточными. Неизвестно соотношение фотосистем I и II (ФС I и II) и противоречивы данные
о специфике участия антенных комплексов в их функционировании. В данной работе впервые удалось по
казать, что у криптофитовой водоросли Rhodomonas salina ФС I и ФС II входят в состав тилакоидных мемб
ран в соотношении 1 : 4, в то время как известные пропорции у цианобактерий и высших растений равня
ются соответственно 3 : 1 и 1 : 1. Кроме того, выявлено, что фикобилипротеиновая антенна, представлен
ная у R. salina фикоэритрином 545 (ФЭ 545), связана, в отличие от цианобактерий, только с ФС II, что оз
начает особую пространственную укладку этих белков пигментов, не вступающих внутри тилакоидов в
контактные взаимодействия с ФС I.
КЛЮЧЕВЫЕ СЛОВА: криптофиты, фикобилипротеины, фикоэритрин, хлорофилл а, хлорофилл с, фото
система I, фотосистема II.
DOI: 10.31857/S0320972520060056
ВВЕДЕНИЕ
хлоропласты имеют четыре наружные мембра
ны и содержат хлорофилл с (Хл с). У оксигенных
Двужгутиковые криптофитовые водоросли
фотосинтетиков фотосинтез связан с фотораз
(криптофиты) благодаря фикобилипротеинам,
ложением воды и выделением кислорода за счет
поглощающим свет в «зеленом окне» хлорофил
взаимодействия двух фотосистем. Пигмент бел
ла, формируемом поверхностными водоросля
ковые комплексы фотосистемы I (ФС I) и фото
ми других групп, могут обитать в глубоких ниж
системы II (ФС II) находятся в тилакоидах
них слоях фитопланктона [1-3]. Криптофиты
криптофит и других водорослей, как и высших
входят в разнообразную по составу представите
растений, в виде димеров ФС II и мономеров
лей группу Chromoalveolates - водорослей, чьи
ФС I [4, 5]. Антенные комплексы, передающие
поглощенную световую энергию фотосистемам,
характеризуются разнообразием. Известны три
Принятые сокращения: ФБС - фикобилисома; ФЭ
545 - фикоэритрин 545; ФС II (ФС I) - фотосистема II типа антенн: 1) фикобилисомная у цианобакте
(фотосистема I); Хл а - хлорофилл а; Хл с - хлорофилл с; рий и красных водорослей; 2) Хл a/b содержа
Хл а/с протеин - хлорофилл а/с протеин.
щая у зеленых водорослей и высших растений;
* Первоначально английский вариант рукописи опублико
3) Хл а/с содержащая у многочисленных групп
msu.ru/biokhimiya, в рубрике «Papers in Press», BM20 092,
Chromophyta. Хлорофилл с в составе хлорофилл
01.06.2020.
а/с протеина является аналогом хлорофилла b в
** Адресат для корреспонденции.
Хл а/b содержащих белках. Эти мембранные
796
ПЕРЕНОС ЭНЕРГИИ У КРИПТОФИТОВЫХ ВОДОРОСЛЕЙ
797
светособирающие пигмент белковые комплек
находятся не на стромальной поверхности тила
сы (LHC) делятся на несколько белковых се
коидной мембраны подобно фикобилисомам, а
мейств. Хлорофилл а/с комплексы криптофит
располагаются во внутренней, люменальной
входят в семейство САС протеинов (сhlorophyll
части тилакоидов [14, 15].
a/c proteins) [6, 7]. Общим свойством гомоло
Надмолекулярная организация фикобили
гичных LHC белков пигментов является нали
протеинов и их локализация в объеме тилакоид
чие до 14-15 хлорофилльных молекул. Соотно
ного люмена остаются под вопросом. Димеры
шение Хл а : Хл b, как и Хл а : Хл с в LHC семей
заполняют все пространство люмена и, возмож
ствах может быть различным, но всегда с преоб
но, собираются в цилиндрические структуры,
ладанием молекул Хл а [8]. Известно несколько
расположенные перпендикулярно к мембране
хлорофиллов с: Хл с1, Хл с2, Хл с3 и др. У боль
тилакоида [14-16]. Структурные данные, полу
шинства видов криптофит в клетках находится
ченные различными методами, не позволяют в
Хл с2 [6, 9].
настоящее время прийти к окончательным вы
Криптофитовые водоросли уникальны до
водам о надмолекулярной архитектуре [17]. Раз
бавлением к Хл а/с протеину фикобилипротеи
личить детали самосборки в клетке относитель
новой антенны. Фикобилипротеины криптофит
но мелких (∼60 кДа) димеров, подобную само
не встречаются в цианобактериях или красных
сборке фикобилисом, или биохимически выде
водорослях, являясь оригинальными белками
лить возможные белковые макроструктуры не
пигментами. В соответствии с окраской их делят
удается, это требует дальнейших исследований.
на синие фикоцианины (ФЦ) и красные фико
Вопрос об особенностях Хл а/с протеинов
эритрины (ФЭ). Семь (или, возможно, восемь)
сводится к изучению топографии этих белков в
белков пигментов двух цветовых групп обозна
плоскости тилакоидной мембраны. Благодаря
чаются по своим длинноволновым максимумам
использованию одночастичной электронной
(нм) поглощения: ФЭ 545, ФЭ 555, ФЭ 566,
микроскопии удалось выяснить, что Хл а/с про
ФЦ 569, ФЦ 612, ФЦ 630 и ФЦ 645 [10, 11].
теины в числе от четырех до восьми примыкают
Окраска белков и вид спектров определяются
к боковым поверхностям димеров ФС II и моно
различными сочетаниями хромофоров в составе
меров ФС I [5], повторяя в значительной мере
каждого фикобилипротеина. Из шести хими
вид суперкомплексов Хл a/b протеинов в соста
чески идентифицированных фикобилиновых
ве ФС II и ФС I у высших растений и зеленых
хромофоров фикоцианобилин и фикоэритроби
водорослей [7]. Эти данные вместе с различны
лин совпадают с установленными для красных
ми спектральными исследованиями обоснован
водорослей и цианобактерий, остальные четы
но привели к заключению о прямой передаче
ре - оригинальны [11]. Каждый фикобилипро
поглощенной энергии от Хл а/с содержащей
теин является полипептидным гетеродимером
антенны к обеим фотосистемам. Тем более акту
(α1βα2β), т.е. содержит две разные α субъедини
альным становится вопрос о роли фикобили
цы и два идентичных β полипептида общей
протеинов как антенны криптофит. Передача
массой ∼60 кДа. На α полипептидах находится
энергии от фикобилипротеинов к Хл а в клетке
по одному хромофору, на β - три хромофора, и,
была выявлена спектроскопически, начиная с
в итоге, в состав димера входит восемь хромо
первых исследований на эту тему [18], но вопрос
форных групп. Субъединицы β кодируются в ге
о возможности миграции только к ФС II или
номе пластид, но α1 и α2 кодируются клеточным
также к ФС I исследуется до сих пор. Из солю
ядром и с помощью сигнальных пептидов
билизированных пластид водоросли Cryptomonas
транспортируются клеткой через четыре наруж
rufescens в градиенте плотности сахарозы полу
ные мембраны внутрь хлоропласта, где собира
чен комплекс ФЭ 565 и ФС II [19], а из вида
ются в димерные комплексы. При наличии
Chroomonas placoidea выделен комплекс, содер
лишь двух генов β субъединицы [12] неоднок
жащий одновременно ФЦ 645 и Хл а/с протеин
ратная дупликация привела к появлению боль
[20]. Ограниченные возможности совместного
шого семейства α субъединиц, насчитывающем
выделения водорастворимых фикобилипротеи
до 20 генов, хотя в каждый момент, зависящий
нов и мембранных белков (ФС II или Хл а/с
от условий обитания, преимущественно
протеин) не исключают возможности артефак
экспрессируются какие либо две из них [13]. У
тов. Проблема усугубляется нехваткой сведений
цианобактерий и красных водорослей фикоби
о соотношении двух фотосистем в пластидах
липротеины собраны в фикобилисомы - мега
криптофит и тем самым о доле антенного Хл а,
комплексы массой несколько миллионов даль
приходящейся на каждую из них.
тон, насчитывающие несколько сот фикобили
Существуют разные представления о воз
новых хромофоров. У криптофит (α1βα2β) гете
можной связи с фотосистемами и тем самым о
родимеры не объединяются в фикобилисомы и
передаче поглощаемой фикобилипротеинами
БИОХИМИЯ том 85 вып. 6 2020
798
СТАДНИЧУК и др.
энергии к ФС I и ФС II. Сделаны предположе
Спектр каждого образца записывали 3-5 раз,
ния о ферстеровском механизме переноса энер
усредняли, после чего вычитали вклад рассеян
гии напрямую или при посредничестве Хл а/с
ного света, используя математическое обеспече
протеина [21, 22]. Проводили регистрацию ста
ние флуориметра.
ционарных спектров флуоресценции или воз
Получение ФЭC545 и тилакоидных мембран.
буждения для клеток при комнатной и низкой
Клетки, промытые 0,01 М К фосфатным буфер
температуре, когда излучение относится только
ным раствором, рН 6,5, дважды подвергали замо
к Хл а ФС II или к Хл а обеих фотосистем [23,
раживанию оттаиванию при -20 °С, вызывая у
24]; проводили сверхбыстрые флуоресцентные
криптофит, не имеющих прочных клеточных сте
измерения и глобальный спектральный анализ
нок, выход ФЭ 545 (и других водорастворимых
флуоресценции пигментов у криптофитовых во
белков) в буферный раствор. Водонераствори
дорослей в широком спектральном диапазоне
мую мембранную фракцию отделяли на настоль
[25], допускающие возможность распределения
ной центрифуге, собирая белок пигмент из над
поглощенной энергии между фотосистемами.
осадочной жидкости высаливанием 60% ным
Для решения вопроса о роли фикобилипро
сульфатом аммония. После ресуспендирования и
теинов в клетках криптофит провели сопо
диализа в том же буферном растворе препарат на
ставление стационарных флуоресцентных изме
носили на ионообменную хроматографическую
рений, оценку влияния фикобилипротеинов на
колонку с носителем ДЕАЕ 52 (2 × 11 см,
степень фотоокисления реакционного центра
«Whatman», США), получая очищенный ФЭ 545.
Р700, принадлежащего ФС I, регистрацию
Зеленую осадочную фракцию после суспендиро
спектров действия двух фотосистем, а также
вания в 0,1 М Tris глициновом буферном раство
сделаны расчеты, определяющие соотношение
ре (рН 8,5) собирали и после дополнительной
ФС I, ФС II и антенных комплексов. Водоросли
промывки и удаления неразрушенных клеток ис
Rhodomonas являются удобными моделями для
пользовали как препарат тилакоидных мембран.
изучения криптофит и их фотосинтетического
Обратимое фотоокисление Р700 фиксировали
аппарата. Был использован вид R. salina, кото
по разности поглощения клеток при 810 и
рый, как и многие другие виды данного рода,
870 нм с помощью двухволнового регистратора
содержит ФЭ 545 наряду с Хл а/с протеином.
сигнала ED P700 DW (РАМ 101, Германия) [26].
Образец после темновой адаптации (10 мин) ос
вещали галогеновой лампой КL 1500 («Schott»,
МЕТОДЫ ИССЛЕДОВАНИЯ
Германия). Свет после интерференционных
фильтров BPF 680/35 или BPF 580/35 (ООО
Штаммы и условия культивирования. Морс
«Фотооптик», Россия) и теплового фильтра
кую микроводоросль Rhodomonas salina
(«Balzers», Лихтенштейн) выравнивали по ин
(Wislouch) (Cryptomonades) из коллекции ФИЦ
тенсивности (500 мкМ фотонов м-2с-1), проводя
ИнБЮМ РАН выращивали на стандартной сре
измерения в кювете толщиной 0,3 см для образ
де Уолна в 100 мл колбах при температуре 22 °С
цов с концентрацией Хл а, равной 10 мкг мл-1.
на постоянном белом свету 30 мкМ м-2 с-1 и пе
Спектры действия фотосинтеза регистрирова
ремешивании культуры магнитной мешалкой.
ли по фотоиндуцированному парциальному вы
Клетки собирали центрифугированием при 180 g
делению O2 (ФС II) и по светозависимому по
в конце логарифмической фазы роста, на 5 й
глощению кислорода (ФС I) на специализиро
или 6 й день выращивания, сразу используя в
ванной установке [27], сочетающей полярогра
экспериментах.
фию и освещение клеток вспышками монохро
Спектры поглощения и флуоресценции. Пог
матического света в области от 400 до 720 нм с
лощение клеток R. salina и выделенного из них
равной интенсивностью 0,2 мкМ см-2 с-1. Тем
ФЭ 545 регистрировали на спектрофотометре
новые перерывы для восстановления исходной
Varian 2300 UV Vis (США). Размер кювет для ми
фотоактивности образцов составляли 40 с. Кле
нимизации светорассеяния равнялся
2 мм.
точную суспензию объемом 20 мкл в 50 мМ Na
Спектры флуоресценции клеток измеряли на
фосфатном буферном растворе/50 мМ KCl, pH
спектрофлуориметре Fluorolog 3 («Horiba Jobin
6,8, и с оптической плотностью 0,15 (Хл а) по
Ivon», Япония). При комнатной температуре
мещали на поверхность высокочувствительного
клеточные образцы помещали в 5 мм кюветы и
освещаемого платинового электрода c Ag/AgCl-
при 77 К - в стеклянные капилляры с внутрен
электродом сравнения. Для регистрации фото
ним диаметром 2 мм, где их оптическая плот
активности ФС II кислородное дыхание клеток
ность при 678 нм не превышала 0,1. Полушири
нейтрализовали, подсвечивая образец слабым
на спектральной щели для возбуждающего и ре
постоянным светом ≥ 700 нм. Для регистрации
гистрируемого излучения составляла
3 нм.
активности ФС I к образцу добавляли 10 мкМ
БИОХИМИЯ том 85 вып. 6 2020
ПЕРЕНОС ЭНЕРГИИ У КРИПТОФИТОВЫХ ВОДОРОСЛЕЙ
799
DCMU для нейтрализации активности ФС II,
как подробно описано ранее [27, 28]. Спектры
усредняли, проводя измерения для 3-5 незави
симых клеточных образцов.
Стехиометрию пигмент-белковых комплексов
и соотношение ФС I/ФС II рассчитывали, ис
пользуя коэффициенты экстинкции ФЭ 545
Хл а и Хл с [29-31]. Соотношение ФС I и ФС II
(соотношение реакционных центров ФС I/ФС
II) определяли, суммируя спектры действия двух
фотосистем и приводя сумму к минимальному
расхождению со спектром поглощения клеток
R. salina благодаря итерациям с использованием
метода наименьших квадратов в спектральной
области суммирования [28, 32].
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
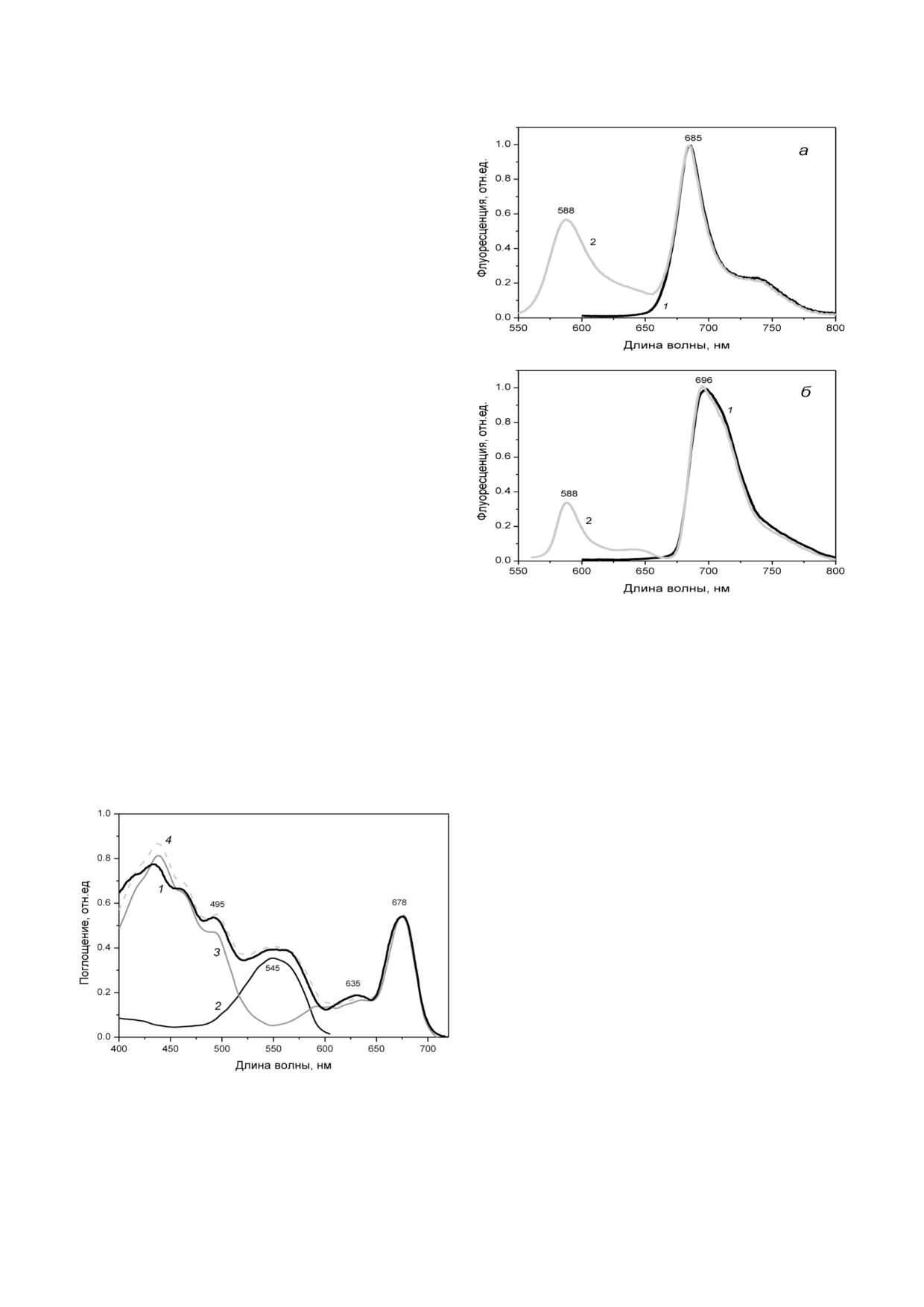
Спектры поглощения. Спектр поглощения
клеток R. salina типичен для водорослей RhodoD
monas (рис. 1). Полоса Соре Хл а находится на
участке 400-440 нм, полоса Хл с - при 455 нм;
интенсивная полоса каротиноидов, с основным
из них, аллоксантином [3], расположена при
495 нм. Максимум, принадлежащий в красной
области Хл с, выявляется при 635 нм, основная
Рис. 2. Спектры флуоресценции клеток R. salina, измерен
красная полоса Хл а - при 676 нм. Спектр по
ные при комнатной температуре (а) и при 77 К (б). Возбуж
глощения ФЭ 545, выделенного из клеток
дение флуоресценции при 440 нм (1) и при 525 нм (2).
R. salina (рис. 1), имеет характерный контур [33].
Спектры приравнены в наибольших максимумах излучения
Максимум при 545 нм сопровождается близко
расположенным с ним плечом 565 нм; эти поло
сы характеризуют два вида («сорта») фикобили
В спектре целых клеток участок длинновол
нов в составе ФЭ 545, более коротковолновый
нового склона, принадлежащий поглощению
фикоэритробилин и более длинноволновый ди
ФЭ 545, заметно уширен за счет перекрывания
гидробиливердин [33].
с сателлитными полосами Хл с и Хл а, которые
хорошо различимы также в спектре выделенно
го из тилакоидов Хл а/с протеина [8] и в спект
ре действия ФС I (см. далее). Полосы, наблюда
емые в спектре тилакоидных мембран R. salinа,
повторяют полосы в спектре поглощения целых
клеток за исключением области, принадлежа
щей поглощению ФЭ 545 (рис. 1).
Спектры флуоресценции клеток R. salina
(рис. 2, а) при комнатной температуре зарегист
рированы для возбуждения при двух длинах
волн: 440 нм (полосы Соре Хл а и Хл с) и 525 нм
(ФЭ 545). В первом случае спектр представлен
одной интенсивной полосой ФС II при 685 нм.
Более коротковолновая флуоресценция, кото
рая могла бы теоретически принадлежать Хл с,
не наблюдается, подобно тому, как отсутствует
флуоресценция Хл b у высших растений. Ее от
сутствие указывает на практически 100% пере
Рис. 1. Спектр поглощения клеток R. salina (1); спектры
дачу энергии от Хл с к Хл а.
выделенных из клеток ФЭ 545 (2), тилакоидных мембран
(3) и суммарный спектр (4) (спектр 2 + спектр 3), модели
Возбуждение излучения при 525 нм, в облас
рующий спектр клеток (1)
ти поглощения ФЭ 545, также приводит к ин
БИОХИМИЯ том 85 вып. 6 2020
800
СТАДНИЧУК и др.
тенсивной флуоресценции Хл а с полным сов
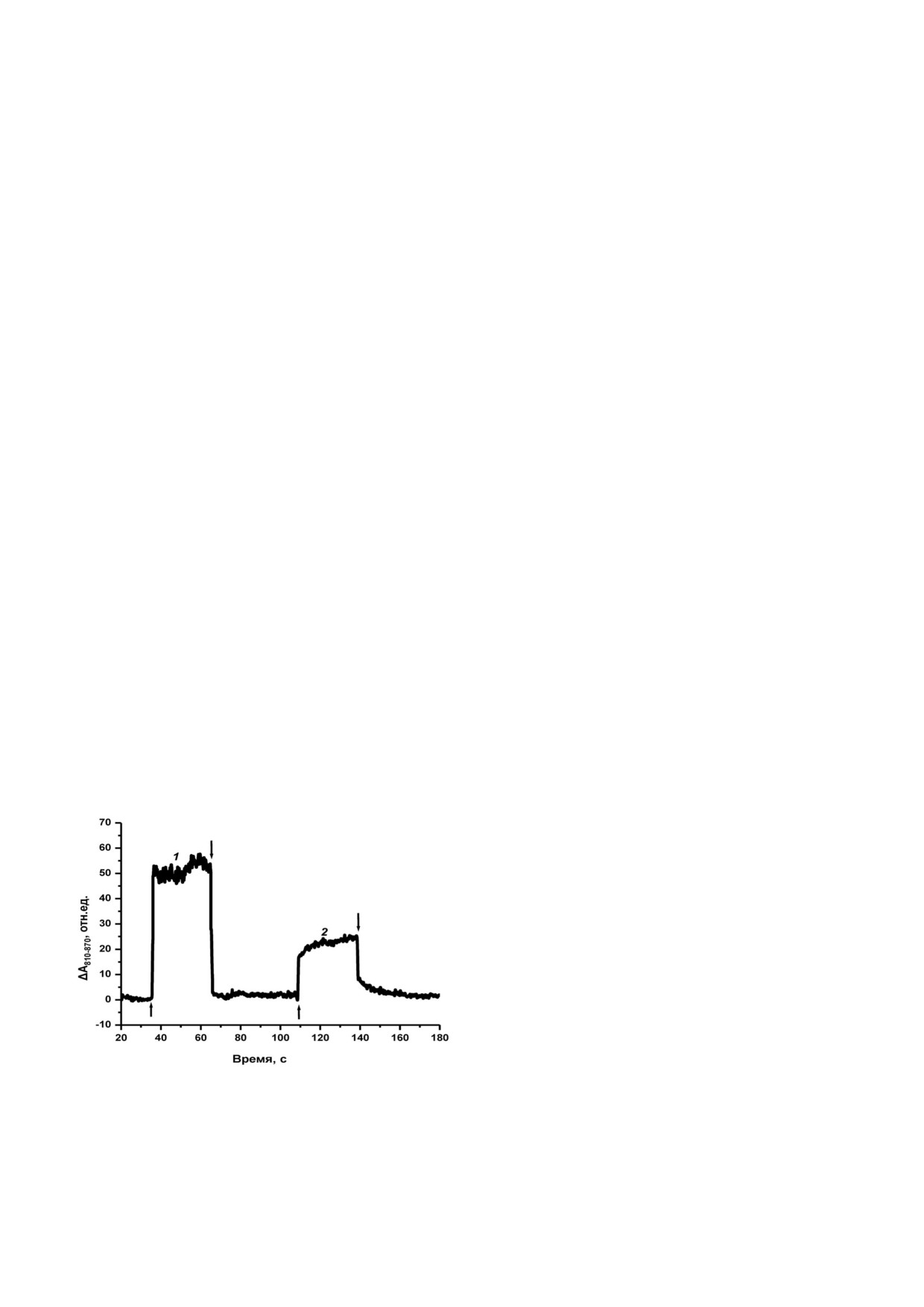
Можно допустить, что двойное падение сиг
падением максимума 685 нм с предыдущим
нала (рис. 3) указывает на малую эффективность
спектром, что означает перенос энергии от фи
участия ФЭ 545 в функционировании ФС I. Па
кобилипротеиновой антенны (рис. 2, а). Наблю
дение интенсивности сопровождается замедле
даемая коротковолновая менее интенсивная по
нием кинетики фотоокисления Р700 (участки
лоса 588 нм принадлежит, как известно [10, 34],
между стрелками ↑ и ↓ на рис. 3). Это указывает
собственно ФЭ 545.
на увеличение светопоглощения со стороны ФС
При понижении температуры клеток до 77 К
II при 580 нм, которое должно сопровождаться
заметного появления длинноволновой флуорес
ростом линейного потока электронов от ФС II к
ценции ФС I в спектрах R. salina не происходит.
ФС I. «Подпитка» ФС I дополнительными отри
Различие со спектрами, полученными при ком
цательными зарядами выражается в снижении
натной температуре, сводится к небольшому
скорости фотоокисления Р700. В итоге при на
красному смещению максимума Хл а от 685 к
личии признаков связи ФЭ 545 с ФС II одноз
696 нм (рис. 2, б). Изменения слишком невели
начно судить, чем вызвано меньшее фотоокис
ки, чтобы спектрально можно было с уверен
ление Р700 - недостаточной миграцией энергии
ностью различить две фотосистемы. Отдельные
от ФЭ 545 к ФС I, особенностями взаимодей
полосы ФС I и ФС II неразличимы, в отличие,
ствия двух фотосистем, или иными причина
например, от низкотемпературной флуоресцен
ми - было бы преждевременным.
ции высших растений, поэтому возможность
Спектры действия фотосинтеза. Регистрация
участия ФЭ 545 в активности ФС I при исполь
спектров действия соответствует условиям, в ко
зовании стационарных спектров флуоресцен
торых при поглощении клеткой света ФС II
ции не проясняется.
спектральное проявление активности ФС I не
Фотоиндуцированное окисление Р700. Пер
сказывается, и наоборот. Поэтому контур спект
вичное фоторазделение заряда в реакционном
ра действия каждой фотосистемы повторяет
центре Р700 свидетельствует о передаче погло
спектр ее поглощения, не искажаемый присут
щенной световой энергии к ФС I. Для выявле
ствием в тилакоидах другой фотосистемы [27].
ния передачи необходимо сравнение степени
Спектр действия ФС II в коротковолновой
фотоокисления Р700 для двух длин волн, при
области от 400 до 470 нм представляет собой су
одной из которых (680 нм) свет напрямую воз
перпозицию полос, принадлежащих Хл а, Хл с и
буждает Хл а, и при 580 нм - преимущественно
каротиноидам. В оранжево красной области,
антенный комплекс ФЭ 545. Сравнение степе
наряду с максимумом Хл а при 676 нм и мень
ни обратимого фотоокисления Р700 показывает,
шим по интенсивности максимумом Хл с при
что в последнем случае сигнал уменьшается
636 нм, спектр характеризуется очень интенсив
вдвое в сравнении с прямым возбуждением Хл а
ной полосой 545 нм, легко распознаваемой для
в составе комплекса ФС I (рис. 3). Свет 580 нм в
ФЭ 545, к которой присоединяется длинновол
клетках, согласно спектру поглощения (рис. 1),
новое плечо 555 - 575 нм вследствие вклада, да
на 75% поглощается ФЭ 545.
ваемого Хл а/с протеином (рис. 4, а). Спектр
действия ФС I (рис. 4, а) характеризуется всеми
полосами, принадлежащими Хл а и Хл с и отме
ченными как в спектре поглощения клеток, так
и в спектре действия ФС II, но с двумя особен
ностями, отличающими его от спектра ФС II.
Бóльшая относительная интенсивность синей
полосы Хл с при 460 нм в сравнении со спект
ром ФС II означает и бóльшую долю Хл а/с про
теина в составе ФС I [31]. Главной же особен
ностью спектра действия ФС I служит полное
отсутствие спектральных признаков ФЭ 545,
что самым наглядным образом свидетельствует
о связи ФЭ 545 только с ФС II. Этот вывод убе
дительно подтверждается разностным спектром
этих двух кривых (рис. 4, а, вставка), который
своим контуром повторяет спектр поглощения
Рис. 3. Фотоиндуцированные изменения поглощения ре
ФЭ 545, представленный на рис. 1.
акционного центра Р700 в клетках R. salina, освещаемых в
Соотношение ФС I/ФС II. Соотношение
течение 30 с действующим светом 680 нм (1) или 580 нм (2)
в отсутствие диурона. Стрелками ↑ и ↓ обозначены вклю
двух фотосистем в хлоропластах является нет
чение и выключение света
ривиальной проблемой, в решении которой с
БИОХИМИЯ том 85 вып. 6 2020
ПЕРЕНОС ЭНЕРГИИ У КРИПТОФИТОВЫХ ВОДОРОСЛЕЙ
801
Рис. 4. а - Спектры действия фотосинтеза ФС I (1) и ФС II (2), измеренные для клеток R. salina. Спектры нормированы
в красном максимуме поглощения Хл а при 676-678 нм. На вставке: 3 - разность между спектрами (2) и (1); 4 - спектр
поглощения ФЭ 545; б - спектр поглощения клеток R. salina (1) и спектр, моделируемый суммой спектров действия ФС I
и ФС II, представленных на рис. 4, а и взятых в соотношении 40 и 60% в максимуме хлорофилла (2)
разной степенью достоверности используются
Стехиометрия антенных пигментCбелковых
электрофорез тилакоидных мембран, атразино
комплексов в составе ФС I и ФС II. Для выясне
вая методика выявления активности ФС II и
ния особенностей молекулярной организации
ряд вспомогательных оценок, включая фото
пигментного аппарата криптофит представля
окисление Р700. Мы применили наиболее точ
лось существенным установить размеры фико
ный из методов - моделирование спектра пог
эритриновой антенны, т.е. число димеров ФЭ 545,
лощения суммой спектров действия, так как
приходящихся на каждый реакционный центр
сумма двух спектров, взятых в соответствую
ФС II. Моделирование спектра поглощения
щей пропорции, должна повторять его контур,
клеток R. salina суммой спектра тилакоидов и
тем самым устанавливая соотношение двух фо
спектра ФЭ показал, что оценка вклада ФЭ в
тосистем. Как и в случае фикобилисом, у циа
спектр и определение его соотношения с Хл а
нобактерий [28] значимая для расчетов сумма
возможны (рис. 1). Расчет, однако, усложняется
ция спектров ограничена областью 500-700 нм,
тем, что часть Хл а в тилакоидах входит в состав
так как на спектральном участке 400-500 нм
Хл а/с протеина. Поэтому одновременно с ФЭ 545
некоторые каротиноиды, входящие в состав
требуются данные о стехиометрии антенного
фотосистем, не способны к 100% передаче
комплекса Хл а/с протеина и коровых комплек
энергии к Хл а, что не позволяет получить кор
сов ФС II и ФС I. Они могут быть получены с
ректные результаты. В итоге осуществленного
учетом долевого вклада каждого компонента в
суммирования (рис. 4, б) было получено соот
максимумы поглощения других пигментов и ис
ношение двух фотосистем, точнее, их реакци
пользованием молярных коэффициентов эксти
онных центров, равное 4:1 в пользу ФС II. Дан
нкции в максимумах поглощения (ФЭ 545 при
ный результат следует из сравнения амплитуд
545 нм; Хл с при 636 нм и Хл а при 676-678 нм).
красных полос 676-678 нм в спектрах действия,
Общая методика расчетов подробно излагается
чья интенсивность пропорциональна содержа
в [28].
нию Хл а в коровых комплексах ФС I и ФС II.
На длинноволновом склоне спектра погло
Соотношение реакционных центров получено
щения ФЭ 545 вследствие быстрого падения
с учетом того, что ФС I (96 хлорофиллов [35])
интенсивности доля пигмента в суммарном
содержит в 2,6 раза бóльшую хлорофилльную
поглощении клеток R. salina в используемом
антенну, чем ФС II (36 молекул хлорофилла,
масштабе сравнения для области ≥ 600 нм прак
[36]). Реальными структурами тилакоидной
тически равна нулю (рис. 1). Поэтому, если
мембраны являются, как уже отмечали, димеры
принять поглощение в максимуме ФЭ545 в отно
ФС II и мономеры ФС I. Тем самым на каждый
сительных величинах равным 1, можно запи
мономер ФС I в тилакоидах R. salina приходит
сать, что для ФЭ 545: ФЭ545 = 1,00; ФЭ636 = 0,00
ся два димера ФС II.
и ФЭ6768 = 0,00 (1).
4 БИОХИМИЯ том 85 вып. 6 2020
802
СТАДНИЧУК и др.
Для Хл а относительные доли поглощения,
соотношением 4 : 1, найденным для близкород
полученные из данных для пигмента в растворе
ственного вида R. lens после экстракции и хро
и в составе корового комплекса ФС II, также
матографического разделения пигментов [8].
известны [28]:
Полученный контрольный результат служит хо
рошим подтверждением возможности расчетов
Хл а6768 = 1,00; Хл а636 = 0,26 и Хл а545 = 0,1 (2);
соотношения Хл а/Хл с в клетках R. salina,
R. lens и других видов криптофитовых водорос
аналогичные доли для Хл с составляют [31]:
лей, содержащих ФЭ 545, не мешающий подоб
ным спектральным оценкам.
Хл с636 = 1,00; Хл с6768 = 0,00 и Хл с545 = 0,14 (3).
Опираясь на полученные данные и регистра
цию спектров действия, можно перейти к стехио
Нас интересует переход от соотношений по
метрии пигмент белковых комплексов для обе
лос (1) - (3) к молярным соотношениям пиг
их фотосистем. Состав Хл а/с протеина [8] со
ментов и возможность контроля проводимых
ответствует, по аналогии с составом Хл a/b про
расчетов. Коэффициент экстинкции ФЭ 545 с
теина [37], суммарному наличию 14 молекул
учетом мол. массы (α1βα2β) димера, равной 58
двух пигментов, 6 молекул Хл с и 8 молекул Хл а,
кДа, составляет { ФЭ545} = 730 мМ-1см-1 [29].
связанных с каждой молекулой апопротеина.
Для Хл а молярный коэффициент экстинкции
Амплитуда красного максимума Хл а при
in vivo составляет { Хл a676} = 64 мМ-1 см-1 [30],
676-678 нм в спектрах действия, как и в спектре
отличаясь меньшей величиной в сравнении с
поглощения, складывается из вклада двух ком
экстинкцией Хл а в различных растворителях
понент: поглощения собственного Хл а в коро
[31]. Для Хл с коэффициент экстинкции в крас
вом комплексе ФС I или ФС II и поглощения
ной полосе отличается от коэффициента Хл а
молекул Хл а в составе Хл а/с протеинов, при
вдвое меньшим значением [31], что дает для
мыкающих [5] в тилакоидной мембране к каж
пигмента величину { Хл с636}
= 32 мМ-1 см-1.
дому коровому комплексу. С учетом упомянуто
Очевидно, вклад ФЭ 545 в поглощение при
го соотношения пигментов в Хл а/с протеине,
636 нм, где находится максимум полосы Хл а/с
равном 6 : 8, после вычета из амплитуды красно
протеина, и тем более при 676-678 нм (красный
го максимума Хл а той доли, которая принадле
максимум Хл а), согласно (1), может не учиты
жит хлорофилльным молекулам Хл а/с протеи
ваться; также не учитывается, согласно (3), и
на, нами было получено соотношение, равное
вклад Хл с в поглощение Хл а в его красном мак
25 молекулам Хл с на каждые 72 молекулы Хл а,
симуме, что минимизирует стехиометрические
составляющих димер ФС II. Аналогично, сог
расчеты.
ласно расчетам, выполненным для спектра
Наиболее простым является определение
действия ФС I, на каждые 96 молекул Хл а (сос
молярных соотношений комплекса Хл а/с про
тав мономера ФС I) приходится 35-36 молеку
теина и коровых комплексов фотосистем. При
лы Хл с. Эти соотношения, с округлением до де
нимая во внимание, как указывалось, вдвое
сятых долей, позволили заключить, что каждый
меньший коэффициент экстинкции Хл с в срав
димер ФС II, наиболее вероятно, связан с че
нении с Хл а и соотношения амплитуд (2) и (3),
тырьмя пигмент белковыми комплексами
молярная доля { Хл с} по отношению к доле { Хл
Хл а/с протеина, а в контакте с мономерами ФС
а} для спектра поглощения D, измеряемого в
I в тилакоидной мембране в среднем находится
единицах оптической плотности или сопостав
шесть Хл а/с антенных комплексов. Эти расчет
ляемого с ним спектра действия определяется
ные результаты полностью согласуются с дан
формулой:
ными электронной микроскопии [5].
Полученный спектр действия ФС II (рис. 4, а)
{ Хл с}/{ Хл а} = 2(D636 - 0,26D6768)/64 =
позволил провести аналогичные расчеты моляр
ного соотношения между хлорофилльными ди
= 0,16(D636 - 0,26D6768)
(4).
мерами ФС II и ФЭ 545. Поскольку каждый ди
мер ФС II (72 молекулы Хл а), в среднем, связан
Для тилакоидов исследуемого вида R. salina
с четырьмя Хл а/с протеинами (32 молекулы
(рис. 1) соотношение { Хл а} /{ Хл с} , согласно
Хл а), измеренная амплитуда полосы Хл а при
(4), составило величину, равную 4,1. После про
676 нм в спектре действия ФС II должна быть
ведения (дополнительно к расчету) клеточной
уменьшена для расчетов на 40%. Одновременно
экстракции Хл а и Хл с в 80% ном ацетоне [8]
вследствие вклада контура полос Хл с и Хл а в
было получено то же самое соотношение для
полосу 545 нм ее интенсивность, согласно (2) и
пигментов в экстракте (данные не представле
(3), должна быть уменьшена на ∼20%. С учетом
ны). Результат расчета полностью совпадает с
этих спектральных поправок и молярных коэф
БИОХИМИЯ том 85 вып. 6 2020
ПЕРЕНОС ЭНЕРГИИ У КРИПТОФИТОВЫХ ВОДОРОСЛЕЙ
803
фициентов экстинкции каждый димер ФС II в
можности препаративного выделения фикоби
клетках R. salina получает энергию в среднем от
липротеинов совместно с мембранными пигме
9 димеров ФЭ 545. В сравнении с цианобакте
нтными комплексами оказались ограниченны
риями эта величина представляется не слишком
ми их разной гидрофобностью [19, 20]. В этих
большой. Действительно, в составе типичной
условиях было важно найти неинвазивный
фикобилисомы, контактирующей с димером
спектральный подход к вопросу о связи фикоби
ФС II, у цианобактерий находится 250-300 фи
липротеинов с фотосистемами, что и было осу
кобилиновых хромофоров [28]. Наличие до 9
ществлено в нашей работе. Использовали три
димеров в нашем случае означает связь с диме
метода: 1) низкотемпературные спектры флуо
ром ФС II лишь 8 × 9 = 72 хромофоров, что в 4
ресценции клеток; 2) фотоокисление реакцион
раза уступает «фикобилисомному» варианту.
ного центра Р700; 3) спектры действия двух фо
Часть этой разницы в размере фикобилипротеи
тосистем. Первый из них из за отсутствия длин
ной антенны для криптофит компенсируется
новолновой флуоресценции у R. salina не дал ни
другой антенной, Хл а/с протеином [38].
какого ответа. Второй из за перекрывания
спектров поглощения ФЭ 545 и Хл а/с протеи
на указал лишь на ограничения в миграции к ФС
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
I. Лишь третий из подходов, ранее не применяв
шийся к исследованию пигментного аппарата у
Миграция поглощенной световой энергии от
криптофит, - регистрация спектров действия
фикобилипротеинов к ФС II у криптофит, как и
фотосинтетической активности - предоставил
от фикобилисом у цианобактерий и красных во
однозначный результат, указывающий на отсут
дорослей, никогда не вызывала сомнений. В
ствие связи ФЭ 545 с ФС I.
итоге многолетних исследований было выясне
Спектр действия ФС II у водоросли R. salina со
но, что фикобилисомы передают энергию наря
держит высокоинтенсивный максимум ФЭ 545,
ду с ФС II и к ФС I [28] . Возможная аналогия с
подобный полосам фикобилисом в спектрах ФС
фикобилисомами наводила на мысль о подоб
II у цианобактерий и красных водорослей [28]. В
ной возможности и для криптофитовых водо
спектре действия ФС I полоса ФЭ 545, однако,
рослей [39]. Стационарные спектры флуорес
не обнаруживается (рис. 4, а), и поэтому срод
ценции и ее возбуждения указывали на преиму
ство фикобилипротеиновой антенны к ФС II
щественное [23] или исключительное [24] взаи
является избирательным. Если бы в тилакоид
модействие фикобилипротеинов с ФС II. Им
ной мембране R. salina существовал контакт
пульсная техника и глобальный спектральный
между пигмент белковыми комплексами двух
анализ при множестве измеряемых временных
фотосистем, то часть энергии от ФЭ 545 дости
кинетик и построении теоретически возможных
гала бы ФС I благодаря посредничеству ФС II.
моделей переноса возбуждения указывали на
Такой контакт, приводящий к «спилловеру»
наиболее вероятную возможность миграции к
энергии между фотосистемами, не исключен
обеим фотосистемам [25]. Крайняя чувствитель
для хлоропластов высших растений [40]. Пос
ность криптофитовых водорослей как жгутико
кольку у криптофит подобное не наблюдается,
вых микроорганизмов к нарушению условий
взаимодействие ФС I и ФС II происходит на
культивирования и подготовки образцов создает
уровне электрон транспортной цепи, но не на
высокую вероятность артефактов. В работах [25,
уровне миграции энергии. Подводя итог, можно
34] на это указывает высокая интенсивность
заключить, что фикобилипротеины у крипто
собственной флуоресценции фикобилипротеи
фитовых водорослей, находясь, в отличие от
нов, значительно превышающая излучение Хл а
фикобилисом, в мелкодисперсном состоянии
в составе клетки, в то время как в норме ([23, 24]
(α1βα2β) димеров, контактируют лишь с ФС II.
и данная работа, рис. 2) преобладает флуорес
Коэффициенты диффузии фикобилипроте
ценция хлорофилла. Среди кинетических ком
инов в люмене хлоропластов у криптофит ука
понент возбуждения появляются компоненты с
зывают, что их подвижность снижена в сравне
временами жизни, характерные для фикобилип
нии с той, которую можно было бы ожидать при
ротеинов в растворе [25, 34], но не в клетке, где
отсутствии ограничений [41]. Габариты диме
энергия от антенны передается к фотосистемам.
ров, согласно рентгеноструктурным данным,
Эти данные служат индикатором нарушения
составляют 4 × 6 × 7 нм [41], что почти на два по
контактов фикобилипротеинов с тилакоидной
рядка меньше средних размеров фикобилисом у
мембраной и потери нативности хлоропластов,
цианобактерий, но с внесением размерной поп
что ведет в случае [25, 34] к появлению дополни
равки коэффициенты диффузии становятся
тельных спектральных компонент и возможным
сравнимыми [41]. По аналогии с фикобилисо
некорректным выводам. Биохимические воз
мами, заякоренными на наружной стороне ти
БИОХИМИЯ том 85 вып. 6 2020
4*
804
СТАДНИЧУК и др.
лакоидной мембраны цианобактерий, это срав
виртуальной укладки подобных «блюдечек» в
нение может указывать на связь ФЭ 545 с опре
цилиндрические структуры, упоминаемые в
деленными сайтами на люменальной поверх
электронно микроскопической литературе
ности мембран. Ограничения диффузии диме
[14-16]. Поперечные размеры люмена позволя
ров хорошо согласуются с полученными в на
ют разместить в нем архитектурные блоки ци
шей работе данными об избирательной связи
линдры, сложенные, вероятно, из четырех, мак
ФЭ 545 с ФС II.
симум, пяти «блюдечек». Тогда с каждым димер
Значительная часть люменальной мембран
ным комплексом ФС II должны состыковаться
ной поверхности комплексов ФС II занята не
изнутри люмена по два цилиндра, собранных из
содержащим хлорофилла водоокисляющим
димеров ФЭ 545, что не противоречит нашим
комплексом [36], что ограничивает у криптофит
расчетным данным.
площадь пигментного контакта с димерами фи
Вопросы о передаче энергии от антенных
кобилипротеинов. Поэтому такой контакт ап
комплексов к комплексам ФС I и ФС II и доля
риорно возможен как напрямую, так и с участи
каждой из фотосистем в тилакоидах тесно свя
ем Хл а/с протеинов, находящихся в латераль
заны. У высших растений соотношение двух фо
ном соприкосновении с димерами ФС II и уве
тосистем близко к 1 : 1. У цианобактерий содер
личивающих общую поверхность контакта. Од
жание ФС I в 2-3 раза превышает содержание
нако нефотохимическое тушение, реализуемое у
ФС II [28]. Поэтому установленное нами для
криптофит с помощью Хл а/с протеина без
R. salina соотношение ФС I/ФС II, равное 4 : 1,
участия фикобилипротеинов, указывает на
говорит об особенностях транспорта электронов
пространственную разобщенность двух антен
в тилакоидах криптофитовых водорослей. Бла
ных комплексов в тилакоидах [42]. Полученные
годаря линейному транспорту между фотосисте
данные оставляют проблему открытой для даль
мами в итоге световой стадии фотосинтеза про
нейших исследований. Не менее интересным
исходит образование АТФ и НАДФН. Цикли
представляется противоположный по смыслу
ческий перенос электрона в ФС I достаточен
вопрос о механизмах или структурах, которые
лишь для синтеза АТФ [43]. Поэтому увеличен
препятствуют присоединению, в данном случае
ная доля ФС II у криптофит означает больший
ФЭ 545, к поверхности ФС I. Так как Хл а/с
биосинтез НАДФН в сравнении с высшими рас
протеины находятся и в ее составе, это, скорее,
тениями и цианобактериями. Надо отметить,
добавляет сходства с ФС II, чем способствует
что у всех иных жгутиконосцев фотосинтетиков
выяснению проблемы. Можно высказать пред
этот вопрос совершенно не изучен, хотя подоб
положение, что препятствием служит положи
ный тип движения, без сомнения, должен иметь
тельный поверхностный заряд ФС I, необходи
свои закономерности в протекании энергети
мый для взаимодействия с пластохиноном как
ческих процессов. Дальнейшие исследования
участником циклического транспорта элек
помогут выяснению, с какими биохимическими
трона.
особенностями в клетках криптофит связаны
Избирательность фикобилипротеинов по
эти различия.
отношению к ФС II указывает на их самосборку
с созданием надмолекулярной архитектуры во
внутреннем пространстве тилакоида. Самосбор
Финансирование. Работу Новиковой Т.М. и
ка фикобилисом обеспечивается так называе
Минюк Г.С. выполняли в рамках темы Госзада
мыми линкерными, или связующими, белками,
ния ФИЦ ИнБЮМ № 0828 2020 0004 (АААА
но наличие линкеров для (α1βα2β) димеров не
А18 118021350003 6).
выявлено ни при их выделении, ни при анализе
Конфликт интересов. Авторы заявляют об от
генома. Они могут остаться неопознанными, не
сутствии конфликта интересов.
имея гомологии с линкерами фикобилисом и
Соблюдение этических норм. Настоящая
оставляя вопрос открытым. По своей форме
статья не содержит описания каких либо иссле
(α1βα2β) димеры несколько напоминают блю
дований с участием людей или использованием
дечко. В перспективе существует возможность
животных в качестве объектов.
СПИСОК ЛИТЕРАТУРЫ
1.
Краснова Е. Д., Пантюлин А. Н., Маторин Д. Н.,
ря, Микробиология,
83,
346354, doi:
10.7868/
Тодоренко Д. А., Белевич Т. А., Милютина И. А.,
S0026365614030100.
Воронов Д. А. (2014) Цветение криптофитовой водо
2.
Митрофанова Е. Ю. (2015) Chroomonas acuta Uterm. (Cryp
росли Rhodomonas sp. (Cryptophyta, Pyrenomodaceae)
tophyta) в Телецком озере (Алтай, Россия), Turczaninowia,
в редокс зоне водоемов, отделяющихся от Белого мо
18, 96 104, doi: 10.14258/turczaninowia.18.2.10.
БИОХИМИЯ том 85 вып. 6 2020
ПЕРЕНОС ЭНЕРГИИ У КРИПТОФИТОВЫХ ВОДОРОСЛЕЙ
805
3.
Hoef Emden, K., and Archibald, J. M. (2017) Cryptophyta
studies of photosystem particles from a Cryptophyceae
(Cryptomonads), in Handbook of the Protists (Archibald, J. M.
Cryptomonas rufescens: isolation of an active phycoerythrin
et al., eds), Springer International Publishing AG 2017,
particle, Biochim. Biophys. Acta,
894,
7690, doi:
851 891, doi: 10.1007/978 3 319 28149 0_35.
10.1016/0005 2728(87)90214 3.
4.
Janssen, J., and Rhiel, E. (2008) Evidence of monomeric
20.
Chen, M., Li, S. H., and Sun, L. (2007) A novel phyco
photosystem I complexes and phosphorylation of chloro
cyanin-Chl a/c2-protein complex isolated from chloro
phyll a/c binding polypeptides in Chroomonas sp. strain LT
plasts of Chroomonas placoidea, Chinese Chem. Lett., 18,
(Cryptophyceae), Intern. Microbiol., 11, 171 178, doi:
1374 1378, doi: 10.1016/j.cclet.2007.09.025.
10.2436/20.1501.01.57.
21.
MacColl, R., and Berns, D. S. (1978) Energy transfer stud
5.
Kere che, S., Kouřil, R., Oostergetel, G. T., Fusetti, F.,
ies on cryptomonad biliprotеins, Photochem. Photobiol.,
Boekema, E. J., Doust, A. B., Van der Weij de Wit, C. D.,
27, 343 349, doi: 10.1111/j.1751 1097.1978.tb07610.x.
and Dekker, J. P. (2008) Association of chlorophyll a/c2
22.
Mimuro, M., Tamai, N., Murakami, A., Watanabe, M.,
complexes to photosystem I and photosystem II in the
Erata, M., Watanabe, M. M., Tokutomi, M., and
cryptophyte Rhodomonas CS24, Biochim. Biophys. Acta,
Yamazaki, T. (1998) Multiple pathways of excitation ener
1777, 122 1128, doi: 10.1016/j.bbabio.2008.04.045.
gy flow in the photosynthetic pigment system of a crypto
6.
Hoffman, G. E., Sanchez Puerta, M. V. S., and Delwiche, C. F.
phyte, Cryptomonas sp. (CR 1), Phycol. Res., 46, 155 164,
(2011) Evolution of light harvesting complex proteins from
doi: 10.1111/j.1440 1835.1998.tb00108.x.
Chl c containing algae, BMC Evol. Biol., 11, 101, doi:
23.
Bruce, D., Biggins, J., Steiner, T., and Thewalt, M. (1986)
10.1186/1471 2148 11 101.
Excitation energy transfer in the cryptophytes. Fluores
7.
Neilson, J. A. D., and Durnford, D. G. (2010) Structural
cence excitation spectra and picosecond time resolved emis
and functional diversification of the light harvesting com
sion spectra of intact algae at 77 K, Photochem. Photobiol., 44,
plexes in photosynthetic eukaryotes, Photosynth. Res., 106,
519 525, doi: 10.1111/j.1751 1097.1986.tb04702.x.
57 71, doi: 10.1007/s11120 010 9576 2.
24.
Lichtlé, C., Jupin, C. H., and Duval, I. C. (1980) Energy
8.
Ingram, K., and Hiller, R. G. (1983) Isolation and characteri
transfer from PS II to PS I in Cryptomonas rufescens
zation of a major chlorophyll a/c2 light harvesting protein from
(Cryptophyceae), Biochim. Biophys. Acta, 591, 104 112,
a Chroomonas species (Cryptophyceae), Biochim. Biophys.
doi: 10.1016/0005 2728(80)90224 8.
Acta, 722, 310 319, doi: 10.1016/0005 2728(83)90078 6.
25.
Van der Weij de Wit, C. D., Doust, A. B., Van Stokkum, I.
9.
Schimek, С., Stadnichuk, I. N., Knaust, R., and
H. M., Dekker, J. P., Wilk, K. E., Curmi, P. M. G.,
Wehrmeyer, W. (1994) Detection of chlorophyll c1 and
Scholes, G. D., and Van Grondelle, R. (2006) How energy
magnesium 2,4 divinylpheoporphyrin a5 monomethyl
funnels from the phycoerythrin antenna complex to photo
ester in cryptophytes, J. Phycol., 30, 621627, doi:
system I and photosystem II in cryptophyte Rhodomonas
10.1111/j.0022 3646.1994.00621.x.
CS24 cells, J. Phys. Chem. B, 110, 25066 25073, doi:
10.
Hill, D. R., and Rowan, K. S. (1989) The biliproteins of
10.1021/jp061546w.
the cryptophyceae, Phycologia,
28,
455463, doi:
26.
Schreiber, U., Klughammer, C., and Neubauer, C. (1988)
10.2216/i0031 8884 28 4 455.1.
Measuring P700 absorbance changes around 830 nm with a
11.
Glazer, A. N., Wedemayer, G. J. (1995) Cryptomonad
new type of pulse modulation system, Z. Naturforsch., 43,
biliproteins: an evolutionary perspective, Photosynth. Res.,
686 698, doi: 10.1515/znc 1988 9 1010.
46, 93 105, doi: 10.1007/BF00020420.
27.
Boichenko, V. A. (1998) Action spectra and functional
12.
Broughton, M. J., Howe, C. J., and Hiller, R. G. (2006)
antenna sizes of photosystems I and II in relation to the
Distinctive organization of genes for light harvesting pro
thylakoid membrane organization and pigment composi
teins in the cryptophyte alga Rhodomonas, Gene, 369, 72
tion, Photosynth. Res.,
58,
163174, doi:
10.1023/
79, doi: 10.1016/j.gene.2005.10.026.
A:1006187425058.
13.
Kieselbach, T., Cheregi, O., Green, B. R., and Funk, C.
28.
Rakhimberdieva, M., Boichenko, V., Karapetyan, N., and
(2018) Proteomic analysis of the phycobiliprotein antenna
Stadnichuk, I. (2001) Interaction of phycobilisomes with
of the cryptophyte alga Guillardia theta cultured under dif
photosystem II dimers and photosystem I monomers and
ferent light intensities, Photosynth. Res., 135, 149 163, doi:
trimers in the cyanobacterium Spirulina platensis,
10.1007/s11120 017 0400 0.
Biochemistry, 40, 15780 15788, doi: 10.1021/bi010009t.
14.
Ludwig, M., and Gibbs, S. P. (1989) Localization of phy
29.
MacColl, R., Berns, D. S., and Gibbons, O. (1976)
coerythrin at the lumenal surface of the thylakoid mem
Characterization of cryptomonad phycoerythrin and phy
brane in Rhodomonas lens, J. Cell Biol., 108, 875 884, doi:
cocyanin, Arch. Biochem. Biophys., 177, 265 275, doi:
10.1083/jcb.108.3.875.
10.1016/0003 9861(76)90436 7.
15.
Spear Bernstein, L., and Miller, K. R. (1989) Unique loca
30.
Rögner, M., Mühlenhoff, U., Boekema, E. J., and Witt, H.
tion of the phycobiliprotein light harvesting pigment in the
(1990) Mono , di and trimeric PS I reaction center com
cryptophyceae, J. Phycol., 25, 412 419, doi: 10.1111/
plexes isolated from the thermophilic cyanobacterium
j.1529 8817.1989.tb00245.x.
Synechococcus sp.: size, shape and activity, Biochim.
16.
Mörschel, E., and Wehrmeyer, W. (1979) Elektronen
Biophys. Acta,
1015,
415424, doi:
10.1016/0005
mikroskopische feinstrukturanalyse von nativen bilipro
2728(90)90074 E.
teidaggregaten und deren räumliche ordnung, Ber. Dtsch.
31.
Jeffrey, S. W., and Humphrey, G. F. (1975) New spec
Bot. Ges., 92, 393 402, doi: 10.1111/j.1438 8677.1979.
trophotometric equations for determining chlorophylls a,
tb03286.x.
b, c1 and c2 in higher plants, algae and natural phytoplank
17.
Vesk, M., Dwarte, D., Fowler, S., and Hiller, R. G. (1992)
ton, Biochem. Physiol. Pflanzen, 167, 191194, doi:
Freeze fracture immunocytochemistry of light harvesting
10.1016/S0015 3796(17)30778 3.
pigment complexes in a cryptophyte, Protoplasma, 170, 66
32.
Boichenko, V. A., Pinevich, A. V., and Stadnichuk, I. N.
176, doi: 10.1007/BF01378791.
(2007) Association of chlorophyll a/b binding Pcb proteins
18.
Haxo, F. T., and Fork, D. C. (1959) Photosynthetically
with photosystems I and II in Prochlorothrix hollandica,
active accessory pigments of cryptomonads, Nature, 184,
Biochim. Biophys. Acta, 1767, 801 806, doi: 10.1016/
1051 1052: doi: 10.1038/1841051a0.
j.bbabio.2006.11.001.
19.
Lichtlé, C., Duval, J. D., and Lemoine, Y.
(1987)
33.
Doust, A. B., van Stokkum, I. H. M., Larsen, D. S., Wilk,
Comparative biochemical, functional and ultrasructural
K. E., Curmi, P. M. G., van Grondelle, R., and Scholes,
БИОХИМИЯ том 85 вып. 6 2020
806
СТАДНИЧУК и др.
G. D. (2005) Mediation of ultrafast light harvesting by a
Richardson T. L. (2019) Light capture and pigment diver
central dimer in phycoerythrin 545 studied by transient
sity in marine and freshwater cryptophytes, J. Phycol., 55,
absorption and global analysis, J. Phys. Chem. B, 109,
552 564, doi: 10.1111/jpy.12816.
14219 14226, doi: 10.1021/jp051173j.
39. Doust, A. B., Wilk, K. E., Curmi, P. M. G., and
34.
Van der Weij De Wit, C. D., Doust, A. B., Van Stokkum,
Scholes, G. D. (2006) The photophysics of cryptophyte
I. H. M., Dekker, J. P., Wilk, K. E., Curmi, P. M. G., and
light harvesting, J. Photochem. Photobiol. A, 184, 1 17, doi:
Van Grondelle, R. (2008) Phycocyanin sensitizes both
10.1016/j.jphotochem.2006.06.006.
photosystem I and photosystem II in cryptophyte
40. Yokono, M., and Akimoto, S. (2018) Energy transfer and
Chroomonas CCMP270 cells, Biophys. J., 94, 2423 2433,
distribution in photosystem super/megacomplexes of
doi: 10.1529/biophysj.107.113993.
plants, Curr. Opin. Biotechnol., 54, 50 56, doi: 10.1016/
35.
Jordan, P., Fromme, P., Witt, H. T., Klukas, O., Saenger, W.,
j.copbio.2018.01.001.
and Krauß, N. (2001) Three dimensional structure of
41. Mirkovic, T., Wilk, K. E., Curmi, P. M. G., and
cyanobacterial photosystem I at 2.5 Å resolution, Nature,
Scholes, G. D. (2009) Phycobiliprotein diffusion in
411, 909 917, doi: 10.1038/35082000.
chloroplasts of cryptophyte Rhodomonas CS24, Photosynth.
36.
Ferreira, K. N, Iverson, T. M., Maghlaoui, K., Barber, J.,
Res., 100, 7 17, doi: 10.1007/s11120 009 9412 8.
and Iwata, S. (2004) Architecture of the photosynthetic
42. Kuthanová Trsková, E., B na, D., Santabarbara, S.,
oxygen evolving center, Science, 303, 1831 1838, doi:
Sobotka, R., Kana, R., and Belgio, E. (2019) Isolation and
10.1126/science.1093087.
characterization of CAC antenna proteins and photosystem I
37.
Kühlbrandt, W., Wang, D. N., and Fujiyoshi, Y. (1994)
supercomplex from the cryptophytic alga Rhodomonas salina,
Atomic model of plant light harvesting complex by elec
Physiol. Plant., 166, 309 319, doi: 10.1111/ppl.12928.
tron crystallography, Nature,
367,
614621, doi:
43. Dann, M., and Leister, D. (2019) Evidence that cyanobac
10.1038/367614a0.
terial Sll1217 functions analogously to PGRL1 in enhanc
38.
Cunningham, B. R., Greenwold, M. J., Lachenmyer, E. M.,
ing PGR5 dependent cyclic electron flow, Nat. Commun.,
Heidenreich, K. M., Davis, A. C., Dudycha, J. L., and
10, 5299, doi: 10.1038/s41467 019 13223 0.
PHYCOERYTHRIN CONNECTION WITH PHOTOSYSTEM II
IN THE CRYPTOPHYTE ALGA Rhodomonas salina*
I. N. Stadnichuk1**, T. M. Novikova2, G. S. Miniuk2, V. A. Boichenko3
,
Yu. V. Bolychevtseva4, E. S. Gusev1, and E. P. Lukashev5
1 Timiryasev Institute of Plant Physiology of the Russian Academy of Sciences,
127726 Moscow, Russia; EDmail: stadnichuk@mail.ru
2 Kovalevski Institute of Biology of the Southern Seas of the Russian Academy of Sciences, 299011 Sevastopol, Russia
3 Institute of Fundamental Problems of Biology of the Russian Academy of Sciences,
142290 Puschino, Moscow Region, Russia
4 Bach Institute of Biochemistry, Research Center of Biotechnology
of the Russian Academy of Sciences, 119071 Moscow, Russia
5 Lomonosov Moscow State University, Faculty of Biology, 119991 Moscow, Russia
Received April 9, 2020
Revised May 2, 2020
Accepted May 3, 2020
Cryptophyte algae belong to a special group of oxygenic photosynthetic organisms containing pigment combination
unique for plastids - phycobiliproteins and chlorophyll a/c containing antenna. Despite the progress in investiga
tion of morphological and ecological features, as well as genome based systematics of cryptophytes, their photosyn
thetic apparatus remains poorly understood. The ratio of the photosystems (PS)s I and II is unknown and informa
tion on participation of the two antennal complexes in functions of the two photosystems is inconsistent. In the pre
sent work we demonstrated for the first time that the cryptophyte alga Rhodomonas salina had the PSI to PSII ratio
in thylakoid membranes equal to 1 : 4, whereas this ratio in cyanobacteria and higher plants was known to be 3 : 1
and 1 : 1, respectively. Furthermore, it was established that contrary to the case of cyanobacteria the phycobilipro
tein antenna represented by phycoerythrin 545 (PE 545) in R. salina was associated only with the PSII, which indi
cated specific spatial organization of these protein pigments within the thylakoids that did not facilitate interaction
with the PSI.
Keywords: cryptophytes, phycobiliproteins, phycoerythrin, chlorophyll a, chlorophyll c, photosystem I, photosystem II
БИОХИМИЯ том 85 вып. 6 2020