БИОХИМИЯ, 2020, том 85, вып. 6, с. 807 - 816
УДК 548.73
ВЫСОКОАКТИВНАЯ РЕКОМБИНАНТНАЯ
ФОРМИАТДЕГИДРОГЕНАЗА ПАТОГЕННЫХ БАКТЕРИЙ
Staphylococcus aureus: ПОЛУЧЕНИЕ И КРИСТАЛЛИЗАЦИЯ*
© 2020
А.А. Пометун1,2,3#, К.М. Бойко2#, Т.С. Юрченко1,3, А.Ю. Николаева2,4,
И.С. Каргов2,3, Д.Л. Атрошенко1,2,3, С.С. Савин1,2,3, В.О. Попов2,4, В.И. Тишков1,2,3**
1 Московский государственный университет имени М.В. Ломоносова, химический факультет,
119991 Москва, Россия; электронная почта: vitishkov@gmail.com
2 Институт биохимии им. А.Н. Баха, ФИЦ «Фундаментальные основы биотехнологии»
Российской академии наук, 119071 Москва, Россия
3 ООО «Инновации и высокие технологии МГУ», 109559 Москва, Россия
4 НИЦ «Курчатовский институт», 123182 Москва, Россия
Поступила в редакцию 16.04.2020
После доработки 02.05.2020
Принята к публикации 02.05.2020
NAD+ зависимая формиатдегидрогеназа бактерий Staphylococcus aureus (SauFDH) является одним из клю
чевых ферментов, отвечающих за выживание этого патогена в условиях биопленок. Высокоселективные ин
гибиторы SauFDH могут быть использованы в качестве антибактериального препарата именно против био
пленок S. aureus. Наиболее перспективным путем является поиск таких ингибиторов на основе трехмерной
структуры фермента. Проведено культивирование штамма E. coli - суперпродуцента рекомбинантной
SauFDH с выходом 1 г целевого белка с литра среды. Разработана и оптимизирована процедура выделения
и очистки, позволившая получить 400 мг гомогенного фермента с выходом 61%. Показано, что SauFDH
имеет самую высокую удельную активность 20 ед. на мг белка, что в два раза выше по сравнению с таковой
для всех описанных формиатдегидрогеназ. Проведено два цикла поиска и оптимизации условий кристалли
зации. В результате для апо и холо форм SauFDH получены кристаллы размером 200 и 40 мкм соответ
ственно. Проведен сбор наборов дифракционных данных, определены пространственные группы и пара
метры элементарных ячеек. Кристаллы апо и холо форм SauFDH, которые дифрагировали до разрешения
2,2 и 2,7 Å соответственно, принадлежали к разным пространственным группам, что может свидетельство
вать о связывании кофактора в случае холо формы фермента.
КЛЮЧЕВЫЕ СЛОВА: формиатдегидрогеназа, Staphylococcus aureus, экспрессия, очистка, кристаллизация,
рентгеноструктурный анализ.
DOI: 10.31857/S0320972520060068
ВВЕДЕНИЕ
ленного кофермента NADH в условиях стресса.
Активное развитие методов высокопродуктив
NAD+ зависимая формиатдегидрогеназа
ного секвенирования привело к тому, что в базах
(FDH) найдена в бактериях, дрожжах, микро
данных появились последовательности геномов
скопических грибах и растениях. Основная фи
большого количества патогенов. Гены формиат
зиологическая роль фермента в патогенных
дегидрогеназы были аннотированы практичес
микроорганизмах и растениях заключается в
ки во всех геномах патогенных бактерий и дрож
снабжении клетки энергией в виде восстанов
жей [1-3], включая и Staphylococcus aureus
(SauFDH). S. aureus является одним из наиболее
опасных патогенов человека и может вызывать
Принятые сокращения: SauFDH, PseFDH - фор
широкий диапазон заболеваний, включая пнев
миатдегидрогеназы из бактерий Staphylococcus aureus и
монию, инфекционно токсический шок, сеп
Pseudomonas sp. 101 соответственно.
сис и др. Данный патоген также является одной
* Первоначально английский вариант рукописи опубли
из наиболее частых причин госпитальных ин
msu.ru/biokhimiya, в рубрике «Papers in Press», BM20 094,
фекций. Стафилококки представляют особую
29.05.2020.
опасность при росте в виде биопленок, посколь
** Адресат для корреспонденции.
ку в этом состоянии у них резко возрастает ре
# Авторы внесли равный вклад в работу.
зистентность к традиционным антибактериаль
807
808
ПОМЕТУН и др.
ным агентам. Результаты транскриптомного
щую антибиотики хлорамфеникол (25 мкг/мл) и
анализа [4] показали, что в биопленках S. aureus
ампициллин (150 мкг/мл), и культивировали на
по сравнению с ростом патогена в виде планкто
качалке при 37 °С и 180 об/мин в течение 12 ч.
на уровень экспрессии SauFDH возрастает в 20
Ночную культуру пересевали в колбу с отбойни
раз и более, а общее количество ее мРНК нахо
ками (общий объем 500 мл, объем среды 60 мл),
дится на третьем месте среди мРНК остальных
разбавляли в 1000 раз (60 мкл посевного матери
белков и ферментов
[4]. Таким образом,
ала,
60
мл среды 2YT, с хлорамфениколом
SauFDH является ключевым ферментом для вы
(25 мкг/мл) и ампициллином 150 мкг/мл) и
живания S. aureus в виде биопленок. В связи с
культивировали на качалке при температуре
этим данный фермент представляется перспек
37 °С, 120 об/мин. При достижении величины
тивной мишенью для борьбы именно с биоп
поглощения среды, на 600 нм (А600) значения
ленками стафилококков. Однако для целенап
0,6-0,8, содержимое колбы делили на три рав
равленного поиска высокоспецифичных инги
ные части по 20 мл и переносили в три одно
биторов SauFDH необходимо установить прост
литровые колбы с отбойниками, содержащими
ранственную структуру фермента (т.н. structure
180 мл среды 2YT без добавления антибиотиков,
based drug design).
и культивировали при 30 °С и 120 об/мин. Далее
SauFDH представляет большой интерес и с
при величине поглощения А600 0,6-0,8 проводи
точки зрения фундаментальной энзимологии.
ли индукцию, добавляя в среду для культивиро
NAD+ зависимая формиатдегидрогеназа, состо
вания раствор лактозы (300 г/л) до конечной
ящая из двух идентичных полипептидных цепей
концентрации индуктора (20 г/л), снижали тем
и не содержащая в своем составе других допол
пературу до 20 °С и продолжали культивирова
нительных групп, является высококонсерватив
ние до утра (20 °С, 120 об/мин). Утром клетки
ным ферментом. Внутри одного семейства (бак
осаждали на центрифуге фирмы Beckman J 21
терии, дрожжи, растения) уровень гомологии
(«Beckman», США) в течение
20 мин при
между аминокислотными последовательностя
5000 об/мин, 4 °С (стаканы 250 мл, ротор J14).
ми таких формиатдегидрогеназ составляет более
Выделение и очистка SauFDH. Полученную
80%, в то время как гомология SauFDH с други
биомассу ресуспендировали в 0,1 М Na фосфат
ми бактериальными формиатдегирогеназами
ном буфере, рН 8,0 (концентрация клеток 10 вес
(включая и другие патогеные бактерии) состав
%) и замораживали при 20 °С. После размороз
ляет всего 40% [2, 3]. Поэтому исследование та
ки клетки разрушали на ультразвуковом дезин
кого фермента представляет несомненный на
теграторе Branson Ultrasonic 250 («Branson»,
учный интерес.
США). Полученную суспензию без центрифуги
В нашей лаборатории ген saufdh был клони
рования подвергали термообработке в течение
рован в плазмиду pET23a, и было показано, что
20 мин при 55 °C. Далее раствор оставляли при
в клетках E. coli рекомбинантная SauFDH
комнатной температуре на 30 мин и осаждали
экспрессируется в активной форме [5]. В данной
клеточный дебрис центрифугированием
работе была разработана и оптимизирована ме
(30 мин, 18 000 об/мин, 4 °С, ротор J 20). Супер
тодика выделения фермента, что позволило по
натант отделяли от осадка, к нему при постоян
лучить достаточное количество для поиска и оп
ном перемешивании добавляли твердый суль
тимизации условий кристаллизации, и получе
фат аммония до концентрации 35% от насыще
ния предварительных данных о структуре
ния и оставляли при 4 °С на 4-4,5 ч. Для уда
SauFDH как в свободной форме, так и в комп
ления образовавшегося осадка проводили цент
лексе с коферментом (апо и холо формы соот
рифугирование (30 мин, 18 000 об/мин, 4 °С, ро
ветственно).
тор J 20), отделяли супернатант, измеряли объ
ем и затем к нему аккуратно при перемешива
нии добавляли твердый сульфат аммония до
МАТЕРИАЛЫ И МЕТОДЫ
концентрации 85% от насыщения. Полученный
раствор оставляли на ночь при 4 °С и центрифу
Экспрессия SauFDH в клетках E. coli. Для по
гировали в течение 30 мин (18 000 об/мин, 4 °С,
лучения штамма продуцента проводили транс
ротор J 20). Супернатант удаляли, к осадку до
формацию клеток E. coli BL21(DE3)
бавляли раствор сульфата аммония (35% от на
CodonPlus/pLysS плазмидой pSauFDH, полу
сыщения) в 0,1 М Na фосфатном буфере, pH 7,0
ченной клонированием гена saufdh в плазмиду
(раствор А), аккуратно перемешивали и остав
pET23a. Единичную колонию с чашки Петри
ляли при 4 °С на 1,5-2 ч. Нерастворившиеся
помещали в пробирку с 4 мл среды 2YT (16 г/л
белки удаляли центрифугированием (30 мин,
бактотриптона, 10 г/л дрожжевого экстракта
16 000 об/мин, 4 °С, ротор J 20), а раствор фер
(«Difco», США), NaCl 5 г/л, рН 7,0), содержа
мента наносили на колонку 2,5 × 12 см с высо
БИОХИМИЯ том 85 вып. 6 2020
ПОЛУЧЕНИЕ И КРИСТАЛЛИЗАЦИЯ ФОРМИАТДЕГИДРОГЕНАЗЫ S. aureus
809
козамещенной фенил сефарозой Phenyl Sepha
буфере, рН 7,0. Концентрация формиата натрия
rose Fast Flow («Pharmacia Biotech», Австрия),
и NAD+ в кювете составляла 0,6 М и 1,5 мг/мл
уравновешенной раствором А. После нанесения
соответственно.
фермента колонку промывали раствором А до
Анализ чистоты препаратов SauFDH. Чистоту
исчезновения поглощения на 280 нм. Фермент
препаратов SauFDH на разных стадиях очистки
элюировали с колонки нисходящим линейным
определяли с помощью аналитического элект
градиентом сульфата аммония (35-0% от насы
рофореза в 12% ном полиакриламидном геле в
щения) в 0,1 М фосфатном буфере, рН 7,0, об
присутствии 0,1% ного додецилсульфата натрия
щий объем градиента 500 мл. Во время проведе
на приборе Mini Protean II фирмы «Bio Rad»
ния хроматографии собирали фракции по 5 мл и
(США) по протоколам фирмы производителя.
измеряли поглощение на 280 нм (A280) и фер
Определение концентрации SauFDH. При
ментативную активность (А). Отбирали фрак
подготовке экспериментов по кристаллизации
ции с постоянным отношением (актив
концентрацию исходного раствора очищенной
ность/A280). Обессоливание и перевод фермента
ФДГ определяли спектрофотометрически при
в требуемый буфер проводили с помощью гель
длине волны
280
нм на спектpофотометpе
фильтрации через Sephadex G25 («Pharmacia
«Schimadzu UV 1800» ( Германия), используя ко
Fine Chemicals», Швеция).
эффициент молярного поглощения, для димер
Растворимость SauFDH в растворах сульфата
ной SauFDH ε280 = 57180 M-1cм-1, рассчитанный
аммония. Для определения зависимости раство
по формуле, предложенной в работе [6]: ε280 =
римости SauFDH от концентрации (NH4)2SO4 к
5690·NTrp+1280·NTyr, где NTrp и NTyr - количество
100 мкл раствора бесклеточного экстракта
остатков Trp и Tyr в молекуле фермента (для
(20 ед/мл) добавляли 0,6-1,8 мл насыщенного
SauFDH шесть и девять остатков соответствен
раствора сульфата аммония в 0,1 М Na фосфат
но).
ном буфере, рН 7,0, и буфер до общего объема
Для пересчета концентрации SauFDH в
2 мл. Пробы оставляли на 5 ч при комнатной
мг/мл молярную концентрацию фермента дели
температуре, центрифугировали в течение
ли на мол. массу (Mr ) димера 75 973,28 Da.
15 мин при 14 000 об/мин и 4 °С на центрифуге
На разных стадиях очистки для определения
Eppendorf 5415D («Eppendorf», Германия). Затем
общей концентрации белков использовали ме
отбирали пробы по 25 мкл и измеряли остаточ
тод Бредфорда по протоколу фирмы «Bio Rad».
ную активность фермента в растворе.
Однако вместо бычьего сывороточного альбу
Связывание SauFDH на гидрофобном носитеB
мина в качестве стандарта использовали реком
ле. Для определения оптимальной концентра
бинантную FDH из бактерий Pseudomonas sp.
ции сульфата аммония для нанесения на колон
101. Разница между определением концентра
ку с Phenyl Sepharose Fast Flow использовали
ции очищенной SauFDH с помощью спектро
раствор фермента (раствор Б), полученный пос
фотометрии и методом Бредфорда составляла
ле перерастворения в растворе A (сульфат аммо
менее 10%.
ния 35% от насыщения в 0,1 М Na фосфатном
Анализ препаратов SauFDH с помощью
буфере, рН 7,0) осадка, образовавшегося после
MALDIBмассBспектрометрии. При проведении
стадии осаждения в 85% от насыщения сульфа
данных исследований использовали оборудова
те аммония. Растворы SauFDH c заданной кон
ние Центра коллективного пользования «Про
центрацией сульфата аммония (5-35% от насы
мышленные биотехнологии» ФГУ ФИЦ «Фун
щения) готовили добавлением к 200 мкл раство
даментальные основы биотехнологии» РАН.
ра Б необходимых объемов растворов сульфата
Для подготовки образца на анализ проводи
аммония (35% от насыщения) и фосфатного бу
ли триптический гидролиз белка в полиакрила
фера до общего объема 1,6 мл. К полученным
мидном геле. Из геля, окрашенного с помощью
пробам добавляли по 400 мкл 50% ной суспен
Coomassie Brilliant Blue (рис. 1), вырезали кусо
зии Phenyl Sepharose Fast Flow в растворе суль
чек размером 3-4 мм3 с полосой фермента, ко
фата аммония требуемой концентрации. Про
торый для удаления красителя дважды промы
бирки с пробами перемешивали и оставляли на
вали в 100 мкл 40% ного раствора ацетонитрила
столе на 15 мин для осаждения носителя. Затем
в 0,1М NH4HCO3 в течение 20 мин при 37 °С.
отбирали пробы по 25 мкл и измеряли остаточ
После удаления раствора для дегидратации к ге
ную активность фермента в растворе.
лю добавляли 100 мкл ацетонитрила. Для удале
Измерение активности. Активность SauFDH
ния ацетонитрила кусочек геля высушивали и
определяли спектрофотометрически по накоп
затем к нему прибавляли 3,5 мкл раствора
лению NADH на длине волны 340 нм (ε340 =
(15
мкг/мл) модифицированного трипсина
6220 М-1см-1) на спектpофотометpе «Schimadzu
(«Promega») в 0,05М NH4HCO3. Гидролиз прово
UV 1800» при 30 °С в 0,1 М натрий фосфатном
дили в течение 20 ч при 37 °С, затем к раствору
БИОХИМИЯ том 85 вып. 6 2020
810
ПОМЕТУН и др.
добавляли 5,25 мкл 0,5% ной трифторуксусной
Оптимизацию найденных условий проводи
кислоты (ТФУ) в 50% ном растворе водного
ли при температуре 15 °С методом диффузии в
ацетонитрила и тщательно перемешивали. Над
парах (вариант «висячая капля») в 24 х луноч
гелевый раствор использовали в качестве исход
ных планшетах фирмы «VDX» (США). В каж
ного раствора для получения MALDI масс
дую лунку планшета добавляли по 400 мкл осаж
спектров.
дающего раствора. 1,5 мкл раствора белка и эк
Для масс спектрометрического анализа на
вивалентное количество противораствора, сме
мишени смешивали по 1,5 мкл раствора образца
шивали и наносили на силиконизированное
и 0,5 мкл раствора 2,5 дигидроксибензойной
стекло диаметром
22
мм фирмы «Hampton
кислоты (10 мг/мл, «Aldrich», США) в 20% ном
Reseаrch» (США).
водном ацетонитриле, 0,5% ной ТФУ («Merk»,
Сбор и обработка дифракционных данных.
Германия). Полученную смесь высушивали на
Перед сбором дифракционных данных кристал
воздухе.
лы вылавливали петлёй и переносили в криора
Масс спектры были получены на MALDI
створ, содержащий, кроме компонентов, входя
TOF/TOF масс спектрометре Ultraflextreme
щих в противораствор, 25% ный глицерин, пос
BRUKER (Германия), оснащенном УФ лазером
ле чего кристалл в петле замораживали в парах
(Nd) в режиме положительных ионов с исполь
азота. Дифракционные наборы собирали при
зованием рефлектрона. Точность измеренных
температуре 100 K на синхротронных источни
моноизотопных масс после докалибровки по
ках Spring8 (станция BL41XU) и European syn
пикам автолиза трипсина составляла 0,002-
chrotron radiation facilities (станция ID29 [8]).
0,011% (20-110 ррм). Спектры получали в диа
Для расчета стратегии сбора данных использо
пазоне масс 500-6500 m/z, выбирая мощность
вали программы HKL2000 [9] и BEST [10]. На
лазера, оптимальную для достижения наилуч
боры были обработаны с помощью программ
шего разрешения.
Mosflm [11] и XDS [12].
Идентификацию белков осуществляли с по
com). Масс спектры были обработаны с по
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
мощью программного пакета FlexAnalysis 3.3
ИХ ОБСУЖДЕНИЕ
(«Bruker Daltonics», Германия). Используя прог
рамму Mascot (опция «пептидный фингерп
Получение рекомбинантной SauFDH. Полу
ринт»), провели поиск в локальной базе данных
чение кристаллов целевого фермента является
с указанной выше точностью, с учетом возмож
критической стадией экспериментов по опреде
ных модификаций: Acetyl (Protein N term),
лению структуры белка с помощью метода рент
Gln→pyro Glu (N term Q), Oxidation (M),
геноструктурного анализа. В свою очередь, ус
Propionamide (C). Кандидатные белки, имею
пех кристаллизации зависит от чистоты и каче
щие параметры достоверности score >42 в базе
ства препарата фермента. Для получения высо
данных NCBI, считали определенными надеж
коочищенных препаратов целевого белка часто
но (p < 0,05).
используют аффинную металл хелатную хрома
Кристаллизация. Первичный подбор условий
тографию путем введения последовательности
кристаллизации SauFDH осуществляли мето
из 6-12 остатков гистидина (His tag) на N или
дом диффузии в парах (вариант «сидячая кап
С конец фермента. Однако наличие такой пос
ля») с помощью роботизированной системы
ледовательности часто приводит к изменению
кристаллизации фирмы «Rigaku» (США) [7] с
свойств фермента. В случае формиатдегидроге
использованием белкового препарата с концен
наз это было показано на примере ферментов из
трацией 10 мг/мл в буфере состава: 0,1 М Tris
Ogataea parapolymorpha DL 1 [5, 13], Candida
HCl, pH 8,0, и стандартных наборов для крис
methylica [14], Chaetomium thermophilum [15] и
таллизации глобулярных белков компании
Pseudomonas sp. 101 (PseFDH) [16]. Изменения в
«Hampton Research» (США): Crystal Screen HT,
каталитических свойствах и стабильности, по
Crystal Screen Cryo HT, Index HT, PEG/Ion HT,
видимому, связаны с влиянием His tag на струк
PEGRx HT и SaltRx HT. Для кристаллизации ис
туру фермента. Поскольку в дальнейшем струк
пользовали кристаллизационные планшеты на
туру SauFDH планируется использовать для по
96 лунок («ArtRobbins»).
иска селективных ингибиторов нативного фер
Для получения холо формы фермента к
мента, то было решено для кристаллизации по
раствору белка перед кристаллизацией добавля
лучить фермент без аффинных меток.
ли NAD+ и конкурентный по формиату ингиби
Культивирование штамма продуцента реком
тор SauFDH азид натрия до финальной концен
бинантной SauFDH. В нашей лаборатории отра
трации 7,0 и 0,11 мМ соответственно.
ботана технология получения рекомбинантных
БИОХИМИЯ том 85 вып. 6 2020
ПОЛУЧЕНИЕ И КРИСТАЛЛИЗАЦИЯ ФОРМИАТДЕГИДРОГЕНАЗЫ S. aureus
811
формиатдегидрогеназ как из прокариот, так и
эукариот с использованием системы экспрессии
на основе плазмид серии pET и штамма E. coli
BL21(DE3) [2, 5]. В этой системе уровень
экспрессии формиатдегидрогеназ составляет до
40% от общего растворимого белка клетки. Та
кое высокое содержание целевого фермента
позволяет получить практически гомогенный
препарат с минимальным количеством стадий
очистки без введения в последовательность бел
ка дополнительной аффинной метки. Эта систе
ма и была использована для получения SauFDH
дикого типа. Как и в случае других формиатде
гидрогеназ, при культивировании штамма про
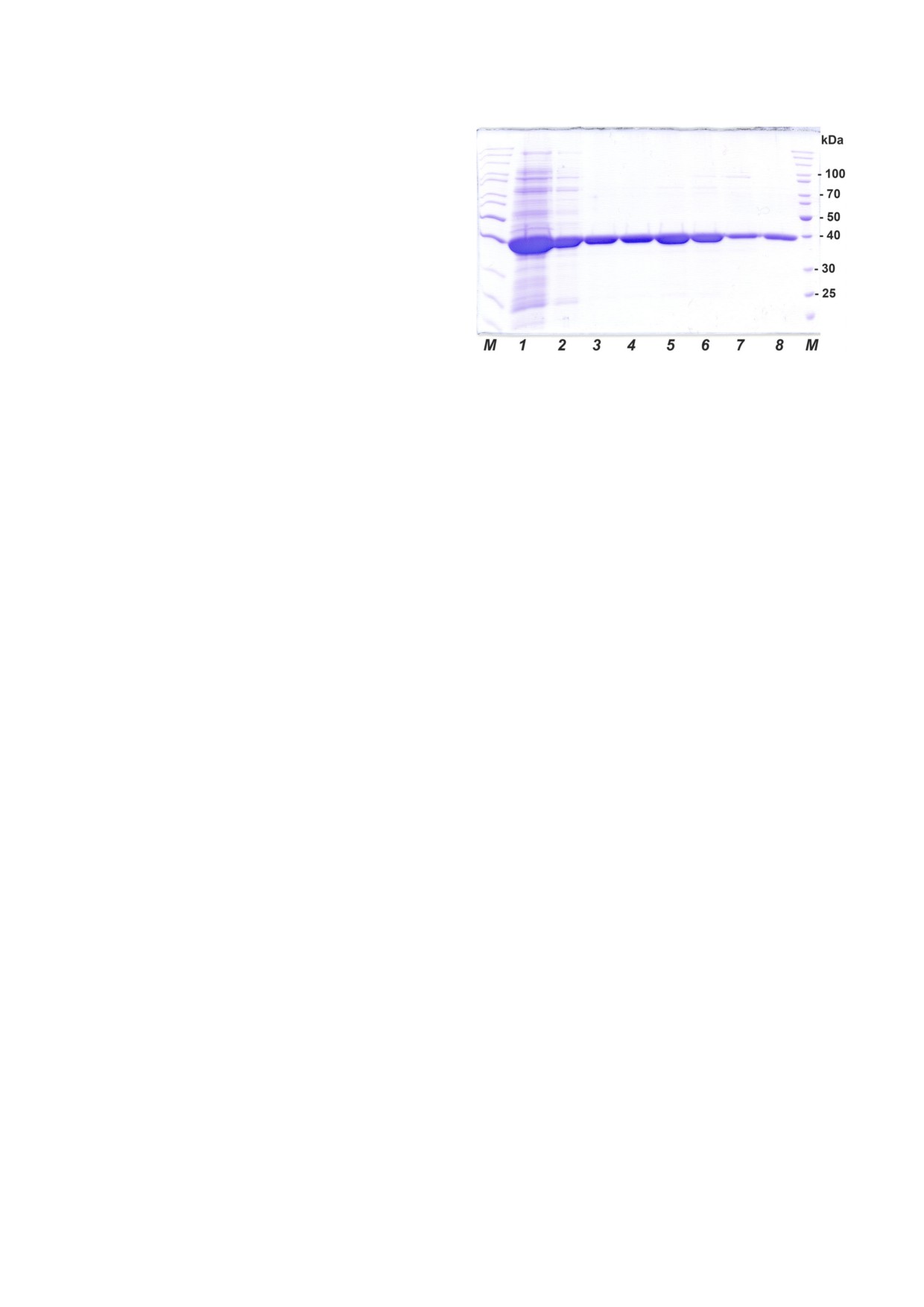
Рис. 1. Аналитический электрофорез в ПААГ в присут
дуцента для SauFDH также происходит супер
ствии SDS Na препаратов SauFDH после различных ста
экспрессия целевого белка. На рис. 1, дорожка 1
дий очистки. 1 - суспензия клеток после ультразвуковой
представлены данные аналитического электро
дезинтеграции, 2 - препарат после термообработки и
фракционирования сульфатом аммония; 3-7 - различные
фореза бесклеточного экс тракта клеток E. coli
фракции на стадии гидрофобной хроматографии, 8 - пре
после экспрессии в них SauFDH. Из рисунка хо
парат SauFDH после обессоливания, М - маркер мол.
рошо видно, что содержание фермента состав
массы, кДа. (С цветными вариантами рис. 1, 4 можно оз
ляет не менее 35-40% от растворимых белков
накомиться в электронной версии статьи на сайте:
клетки. Выход SauFDH на стадии культивирова
sciencejournals.ru/journal/biokhsm)
ния составил ∼600 мг фермента из 600 мл куль
туральной среды, т.е. 1 г с литра среды, что явля
ется очень высоким показателем при культиви
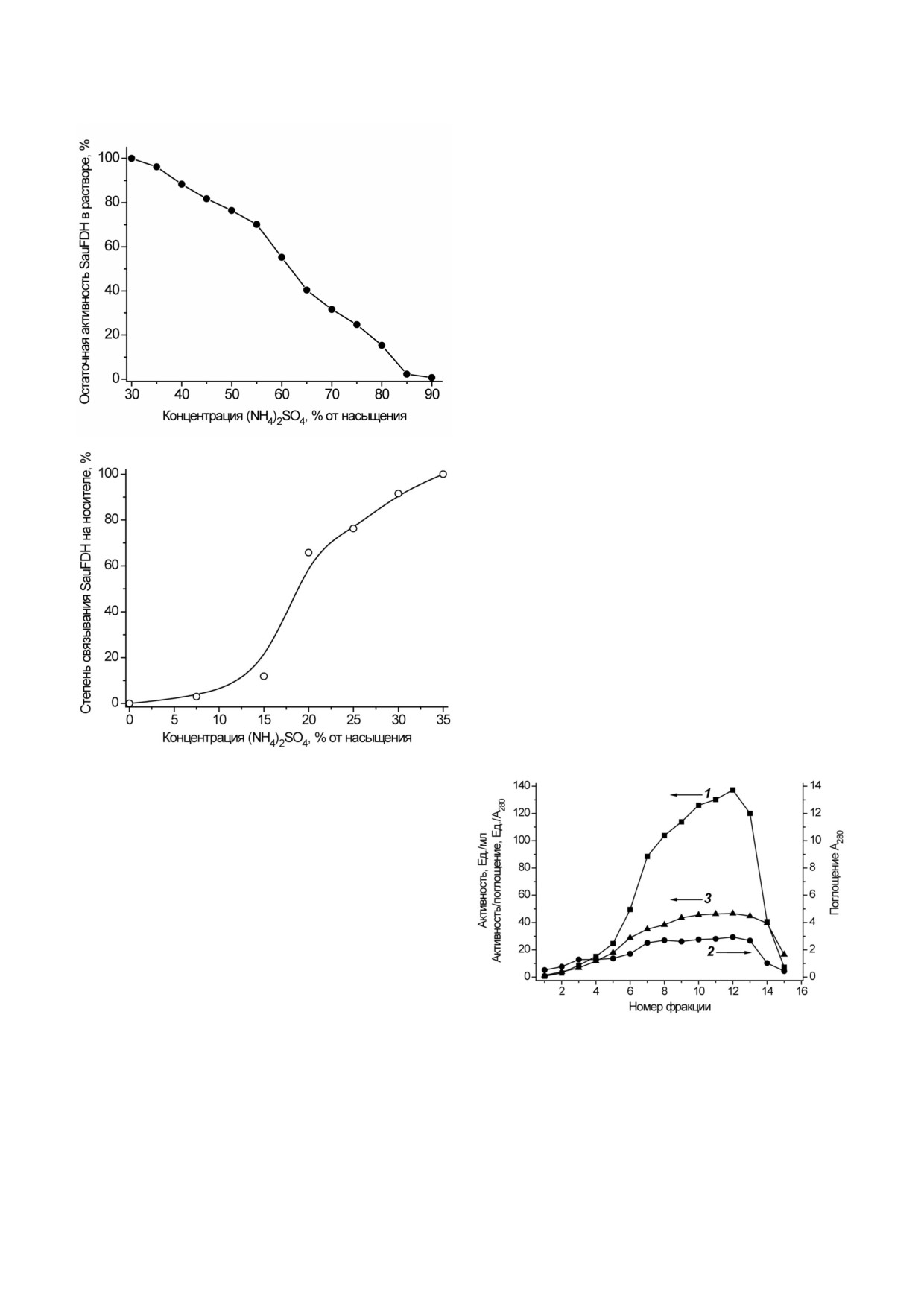
лена зависимость растворимости SauFDH в
ровании клеток в качалочных колбах.
растворах сульфата аммония различной концен
Очистка рекомбинантной SauFDH. Для полу
трации. На основании полученной зависимости
чения высокоочищенных препаратов формиат
для удаления части примесных белков и после
дегидрогеназ, экспрессированных в клетках
дующего осаждения фермента были выбраны
E. coli, используется унифицированная методи
концентрации (NH4)2SО4 35 и 85% от насыще
ка, основанная на фракционировании бескле
ния соответственно. На рис. 1 представлены ре
точного экстракта сульфатом аммония с после
зультаты анализа препаратов SauFDH на разных
дующей гидрофобной хроматографией на
стадиях очистки с помощью аналитического
Phenyl Sepharose Fast Flow [17]. Для формиатде
электрофореза в денатурирующих условиях.
гирогеназ с высокой термостабильностью перед
Данные дорожки 2 показывают, что в результате
фракционированием (NH4)2SO4 проводится
термообработки и фракционирования сульфа
термообработка бесклеточного экстракта при
том аммония чистота фермента повышается до
55 °С в течение 15-25 мин [2]. Данные диффе
величины не менее 80%.
ренциальной сканирующей калориметрии по
Финальная очистка SauFDH от примесных
казали, что SauFDH по термостабильности
белков была выполнена с помощью гидрофоб
очень близка к таковой для PseFDH [18], кото
ной хроматографии на Phenyl Sepharose Fast
рая до сих пор остается чемпионом по этому па
Flow. Было необходимо определить оптималь
раметру среди всех описанных формиатдегидро
ные концентрации сульфата аммония как для
геназ. Поэтому в процедуру очистки SauFDH
связывания фермента на носителе, так и для
также была введена стадия термообработки
промывки колонки от примесных белков перед
бесклеточного экстракта в течение 20 мин при
десорбцией SauFDH в нисходящем градиенте
55 °С. Такая обработка приводит к денатурации
соли. На рис. 2, б представлена зависимость эф
части белков E. coli, обеспечивает формирова
фективности сорбции SauFDH на Phenyl
ние крупнодисперсного осадка и упрощает пос
Sepharose Fast Flow от концентрации сульфата
ледующее фракционирование сульфатом аммо
аммония. Из рисунка видно, что полное связы
ния.
вание SauFDH на носителе происходит только
Фракционирование сульфатом аммония
при концентрации (NH4)2SO4 35% от насыще
потребовало проведения отдельных экспери
ния. Данные рис. 2, а и б свидетельствуют, что
ментов для нахождения оптимальных концент
при очистке SauFDH необходимо использовать
раций (NH4)2SО4 как для переосаждения фер
концентрацию сульфата аммония 35% от насы
мента, так и для его связывания на колонке с
щения. Эти результаты отличаются от данных
гидрофобным носителем. На рис. 2, а представ
по другим формиатдегидрогеназам. Например,
БИОХИМИЯ том 85 вып. 6 2020
812
ПОМЕТУН и др.
а
ность/поглощение на 280 нм. Как следует из
рис. 3, для фракций 7-13 эта величина практи
чески постоянная, что свидетельствует об оди
наковой чистоте препаратов SauFDH в этих
фракциях. Результаты анализа препаратов фер
мента в различных фракциях (рис. 1, дорожки
3-7) с помощью аналитического электрофоре
за в денатурирующих условиях свидетельству
ют, что после стадии гидрофобной хроматогра
фии получается практически гомогенная
SauFDH. Всего было получено 400 мг высоко
очищенного фермента с выходом по активнос
ти 61%.
Расчет величины удельной активности для
полученной SauFDH дал неожиданный резуль
тат. Она оказалась равной 20 ед/мг белка. Для
всех ранее описанных формиатдегидрогеназ наи
большей активностью обладали ферменты из
б
бактерий - 10 ед/мг белка. Максимальная
удельная активность для известных ФДГ из
дрожжей и растений составляет 6,5 ед/мг белка
[2, 3, 5, 19, 20]. Инженерия каталитических
свойств формиатдегидрогеназ методом рацио
нального дизайна в случае бактерий позволила
улучшить значения КМ по формиату и кофер
менту NAD+, но не каталитическую константу
[20, 21]. В случае ФДГ из дрожжей Candida boi=
dinii методом направленной эволюции, а для
ФДГ из сои методом рационального дизайна,
удельная активность ферментов была повышена
в 1,7 раза [22, 23]. Таким образом, по своей ак
тивности SauFDH минимум в два раза превос
ходит все другие известные ФДГ. Формиатде
гидрогеназы активно используются для регене
Рис. 2. Влияние концентрации сульфата аммония на раст
воримость SauFDH (а) и связывание фермента на Phenyl
Sepharose Fast Flow (б); 0,1 М фосфатный буфер, рН 7,0,
25 °С
в случае PseFDH на стадии фракционирования
используются концентрации сульфата аммония
40 и 80% от насыщения, а при нанесении фер
мента на колонку с гидрофобным носителем и
последующей промывки носителя оптимальной
будет концентрация (NH4)2SO4 30% от насыще
ния [17]. Такая разница в поведении ферментов
в присутствии сульфата аммония, по видимому,
связана с существенным различием аминокис
лотных последовательностей этих формиатде
Рис. 3. Очистка формиатдегидрогеназы S. aureus гидро
гидрогеназ (гомология менее 40% [5]).
фобной хроматографией на Phenyl Sepharose Fast Flow в
На рисунке
3 представлены результаты
нисходящем градиенте концентрации сульфата аммония
(35-0% от насыщения). 1 - Активность SauFDH в отдель
очистки SauFDH с помощью гидрофобной хро
ной фракции, ед/мл; 2 - поглощение фермента на 280 нм
матографии. Для экспресс анализа чистоты
А280; 3 - относительная активность ед/А280. Стрелками ука
препаратов фермента в отдельных фракциях
заны оси, соответствующие данной кривой. 0,1 М Na фос
использовали величину отношения актив
фатный буфер, рН 7,0
БИОХИМИЯ том 85 вып. 6 2020
ПОЛУЧЕНИЕ И КРИСТАЛЛИЗАЦИЯ ФОРМИАТДЕГИДРОГЕНАЗЫ S. aureus
813
а
б
Рис. 4. Кристаллы апо (а) и холо форм (б) SauFDH, выросшие в оптимизированных условиях
рации NAD(P)H в процессах хирального синте
го было подготовлено 6 таких планшетов при
за с помощью оксидоредуктаз [2, 5]. Поэтому
двух значениях температуры 15 и 4 °С (итого
SauFDH является очень перспективным канди
1728 вариантов). Соотношения белка и проти
датом для применения на практике. Кроме того,
вораствора в каждой лунке были следующими:
определение структуры этого фермента позво
1 : 1, 2 : 1 и 1 : 2, при этом суммарный объем бел
лит исследовать причины такой высокой ката
ка в лунке был 0,1 мкл для соотношений 1 : 1 и
литической активности.
2 : 1 или 0,2 мкл для соотношения 1 : 2 соответ
Анализ препарата SauFDH с помощью тан
ственно. Объем противораствора составлял
демной MALDI масc спектрометрии показал
50 мкл.
идентичноcть аминокислотной последователь
Первые кристаллы для апо формы белка бы
ности белка, кодируемой геном saufdh2 в плаз
ли получены в следующих условиях:
0,1М
миде pET23a, т.е при экспрессии и очистке фер
HEPES, pH 7,5, 2% ный PEG 400, 2 M cульфат
мент не претерпевает посттрансляционной мо
аммония. Кристаллы росли при температуре
дификации.
15 °С в течение 7 дней, имели ромбическую фор
Получение гомогенных препаратов SauFDH
му и достигали размеров порядка 30 мкм по наи
в препаративных количествах позволило перей
большей из граней. К сожалению, полученные
ти к экспериментам по кристаллизации.
на данном этапе кристаллы имели слишком ма
SauFDH является высокостабильным фермен
лые размеры. Поэтому найденные условия
том [18]. Он не терял активности при хранении
кристаллизации нуждались в дальнейшей опти
при 4 °С в течение 12 месяцев. Поэтому одной
мизации.
партии полученного препарата SauFDH было
Для получения кристаллов холо формы фер
достаточно для проведения всего цикла экспе
мента к раствору белка перед кристаллизацией
риментов по кристаллизации.
добавляли NAD+ и азид натрия. Раствор затем
Кристаллизация. Скрининг условий кристал
центрифугировали для удаления примесей и
лизации свободной формы SauFDH и комплек
возможных агрегатов, и проводился первичный
са с кофактором проводился в кристаллизаци
скрининг по методике, описанной выше. В ре
онных планшетах на 96 лунок (ArtRobbins), при
зультате первичного скрининга для холо формы
этом каждая лунка содержала три подлунки, ко
SauFDH были найдены следующие условия. Ва
торые использовались для варьирования концен
риант 1 - 0,2 M CaCl2, 0,1 M ацетат натрия
трации белка в рамках одного условия кристал
pH 4,6, 30% ный 2 метипентадиол 2,4 и вари
лизации. Таким образом, один кристаллизаци
ант 2 - 0,1 M HEPES Na, pH 7,5, 1,4 M трехза
онный планшет позволял провести скрининг
мещенный цитрат натрия. В обоих условиях бы
96 × 3 = 288 кристаллизационных условий. Все
ли обнаружены микрокристаллические осадки,
БИОХИМИЯ том 85 вып. 6 2020
814
ПОМЕТУН и др.
Кристаллографические данные и параметры съемки кристаллов апо и холо форм NAD+ зависимой формиатдегидроге
назы из S. тaureus
Параметр
Апо форма
Холо форма*
Пространственная группа
P43212
P212121
a, b, c, Å
116,91; 116,91; 186,77
69,73; 87,09; 117,57
α = β = γ, град
90,0
90,0
Т, K
100
100
λ, Å
1,0
0,96770
Разрешение, Å
99,1-2,2 (2,26-2,20)*
87,1-2,7 (2,87-2,72)
Число независимых рефлексов
66 243 (14959)
19 763 (2838)
Повторяемость
9,6 (7,5)
4,3 (4,1)
Полнота набора, %
99,9 (99,9)
99,5 (99,7)
I/σ (I)
20,15 (3,3)
6,5 (2,5)
Rmeas, %
8,9 (59,5)
24,7 (80,7)
CC1/2
99,9 (88,1)
96,8 (45,2)
* Кристаллизация в присутствии 7,0 мМ NAD+ и 0,11 мМ азида натрия.
** Данные в скобках приведены для последнего слоя.
которые ввиду малого размера (∼10 мкм) и пло
пространственным группам (таблица), что мо
хой морфологии нельзя было использовать для
жет свидетельствовать о связывании кофактора
рентгеноструктурного исследования.
в случае холо формы. Оценка содержания раст
Поскольку для обеих форм фермента были
ворителя в элементарной ячейке по методу Мэт
получены кристаллы, непригодные для РСА, то
тьюса [24], проведенная с помощью пакета
был проведен дополнительный этап оптимиза
CCP4i [25], показала, что в независимой части
ция найденных условий, заключавшийся в варь
как апо , так и холо формы находятся по две
ировании параметров кристаллизации в узких
субъединицы белка, что типично для данного
пределах относительно таковых, найденных на
класса ферментов, функционирующих в виде
первом этапе. Кристаллы апо формы, пригод
стабильных гомодимеров.
ные для рентгеноструктурного эксперимента,
Таким образом, в результате выполненных
были получены в следующих условиях - 0,1 M
экспериментов получена новая рекомбинантная
HEPES, pH 7,0, 2% ный PEG 400, 0,1 M хлорид
формиатдегидрогеназы из патогена S. aureus,
натрия и 1,9 M сульфат аммония (рис. 4, а). Для
которая имеет самую высокую удельную актив
холо формы SauFDH кристаллы были получе
ность среди всех ранее описанные в литературе
ны в течение 30 дней при 15оС (0,1M HEPES,
аналогичных ферментов. Также получены крис
pH 7,5, 1,4 M трехосновный цитрат натрия и
таллы и собраны дифракционные данные, необ
10% трегалоза) (рис. 4, б). Из рис. 4, а и б видно,
ходимые для определения структур апо и холо
что визуально качество кристаллов для апо
форм SauFDH, которые будут использованы в
формы выше, чем для холо SauFDH. Для удоб
последующих исследованиях по поиску высоко
ства на рис. 4 кристаллы для апо и холо форм
эффективных ингибиторов фермента.
представлены в сравнимом виде, однако их ре
альные размеры составляют 200 и 40 мкм соот
ветственно. Тем не менее, качество кристаллов
Финансирование. Работа выполнена при час
было достаточно для их исследования с по
тичной финансовой поддержке РФФИ (согла
мощью рентгеноструктурного анализа.
шения 17 04 01662 и 20 04 00915 - получение и
Сбор и обработка дифракционных данных.
кристаллизации фермента), Федерального кос
Дифракционные наборы собирали при темпера
мического агентства (эксперимент «Кристалли
туре
100 K на синхротронных источниках
затор» - кристаллизация и сбор данных рентге
Spring8 (станция BL41XU) и European synchro
ноструктурного эксперимента) и Министерства
tron radiation facilities (станция ID29). Статисти
науки и высшего образования РФ (предвари
ка наборов данных приведена в таблице.
тельный анализ данных РСА).
Полученные кристаллы апо и холо форм
Благодарности. При проведении исследова
SauFDH дифрагировали до разрешения 2,2 и
ний было использовано оборудование Центра
2,7 Å соответственно, и принадлежали к разным
коллективного пользования «Промышленные
БИОХИМИЯ том 85 вып. 6 2020
ПОЛУЧЕНИЕ И КРИСТАЛЛИЗАЦИЯ ФОРМИАТДЕГИДРОГЕНАЗЫ S. aureus
815
биотехнологии» ФГУ ФИЦ «Фундаментальные
Соблюдение этических норм. Настоящая
основы биотехнологии» РАН».
статья не содержит описания каких либо иссле
Конфликт интересов. Авторы заявляют об от
дований с участием людей или животных в каче
сутствии конфликта интересов.
стве объектов.
СПИСОК ЛИТЕРАТУРЫ
1.
Tishkov, V. I., and Popov, V. O. (2004) Catalytic mechanism
15.
Esen, H., Alpdağtaş, S., Mervan Çakar, M., and Binay, B.
and application of formate dehydrogenase, Biochemistry
(2019) Tailoring of recombinant FDH: effect of histidine
(Moscow), 69, 1252 1267, doi: 10.1007/ s10541 005 0071 x.
tag location on solubility and catalytic properties of
2.
Tishkov, V. I., and Popov, V. O. (2006) Protein engineering
Chaetomium thermophilum formate dehydrogenase
of formate dehydrogenase, Biomol. Eng., 23, 89 110,
(CtFDH), Prepar. Biochem. Biotechnol., 49, 529534,
doi: 10.1016/j.bioeng.2006.02.003.
doi: 10.1080/10826068.2019.1599394.
3.
Alekseeva, A. A., Savin, S. S., and Tishkov, V. I. (2011)
16.
Пометун А. А., Паршин П. Д., Галаничева Н. П., Упо
NAD+ dependent formate dehydrogenase from plants,
ров И. В., Атрошенко Д. Л., Савин С. С., Тишков В. И.
Acta Naturae, 3, 38 54, PMID: 22649703.
(2020) Влияние последовательности His6 на свойства
4.
Resch, A., Rosenstein, R., Nerz, C., and Gotz, F. (2005)
формиатдегидрогеназы из бактерий Pseudomonas sp.
Differential gene expression profiling of Staphylococcus
101, Вестник МГУ, Cер. 2 Химия, 61, 317 325.
aureus cultivated under biofilm and planktonic conditions,
17.
Rojkova, A. M., Galkin, A. G., Kulakova, L. B., Serov, A. E.,
Appl. Environ. Microbiol., 71, 2663 2676.
Savitsky, P. A., Fedorchuk, V. V., and Tishkov, V. I. (1999)
5.
Tishkov, V. I., Pometun, A. A., Stepashkina, A. V.,
Bacterial formate dehydrogenase. Increasing the enzyme
Fedorchuk, V. V., Zarubina, S. A., Kargov, I. S.,
thermal stability by hydrophobization of alpha helices,
Atroshenko, D. L., Parshin, P. D., Kovalevski, R. P.,
FEBS Lett.,
445,
183188, doi:
10.1016/S0014
Boiko, K. M., Eldarov, M. A., D’Oronzo, E., Facheris, S.,
5793(99)00127 1.
Secundo, F., and Savin, S. S. (2018) Rational design of
18.
Pometun, A. A., Kleymenov, S. Yu, Zarubina, S. A.,
practically important enzymes, Moscow Univ. Chem. Bull.,
Kargov, I. S., Parshin, P. D., Sadykhov, E. G., Savin, S. S.,
73, 1 6, doi: 10.3103/S0027131418020153.
and Tishkov, V. I. (2018) Comparison of thermal stability of
6.
Pace, C. N., Vajdos, F., Fee, L., Grimsley, G., and Gray, T.
new formate dehydrogenases with differential scanning
(1995) How to measure and predict the molar absorption
calorimetry, Moscow Univ. Chem. Bull.,
73,
8084,
coefficient of a protein, Protein Sci., 4, 24112423,
doi: 10.3103/S002713141802013X.
doi: 10.1002/pro.5560041120.
19.
Slusarczyk, H., Felber, S., Kula, M. R., and Pohl, M.
7.
Boyko, K. M., Lipkin, A. V., Popov, V. O., and Kovalchuk, M. V.
(2000) Stabilization of NAD dependent formate dehydro
(2013) From gene to structure: the protein factory of the
genase from Candida boidinii by site directed mutagenesis
NBICS centre of Kurchatov institute, Crystallogr. Rep., 58,
of cysteine residues, Eur. J. Biochem., 267, 1280 1289,
442 449, doi: 10.1134/S106377451105004x.
doi: 10.1046/j.1432 1327.2000.01123.x.
8.
De Sanctis, D., Beteva, A., Caserotto, H., Dobias, F.,
20.
Tishkov, V. I., Goncharenko, K. V., Alekseeva, A. A.,
Gabadinho, J., Giraud, T., Gobbo, A., Guijarro, M.,
Kleymenov, S. Yu., and Savin, S. S. (2015) Role of a struc
Lentini, M., Lavault, B., Mairs, T., McSweeney, S.,
turally equivalent phenylalanine residue in catalysis and
Petitdemange, S., Rey Bakaikoa, V., Surr, J., Theveneau, P.,
thermal stability of formate dehydrogenases from different
Leonard, G. A., and Mueller Dieckmann, C. (2012) ID29:
sourсes, Biochemistry (Moscow),
80,
16901700,
a high intensity highly automated ESRF beamline for
doi: 10.1134/S0006297915130052.
macromolecular crystallography experiments exploiting
21.
Alekseeva, A. A., Fedorchuk, V. V., Zarubina, S. A.,
anomalous scattering, J. Synchrotron Radiat., 19, 455 461,
Sadykhov, E. G., Matorin, A. D., Savin, S. S., and
doi: 10.1107/S0909049512009715.
Tishkov, V. I. (2015) Role of Ala198 in stability and coen
9.
Otwinowski, Z., and Minor, W. (1997) Processing of X ray
zyme specificity of bacterial formate dehydrogenases, Acta
diffraction data collected in oscillation mode, Methods
Naturae, 7, 60 69, PMID: 25927002.
Enzymol., 276, 307 326.
22.
Slusarczyk, H., Felber, S., Kula, M. R., and Pohl, M.
10.
Bourenkov, G. P., and Popov, A. N. (2006) A quantitative
(2003) Novel mutants of formate dehydrogenase from
approach to data collection strategies, Acta Crystallogr. D Biol.
Candida boidinii, US Patent Application Publication
Crystallogr., 62, 58 64, doi: 10.1107/S0907444905033998.
US2003/0157664, 21.09.2003.
11.
Battye, T. G. G., Kontogiannis, L., Johnson, O.,
23.
Kargov, I. S., Kleymenov, S. Y., Savin, S. S., Tishkov, V. I.,
Powell, H. R., and Leslie, A. G. W. (2011) iMOSFLM:
and Alekseeva, A. A. (2015) Improvement of the soy
a new graphical interface for diffraction image processing
formate dehydrogenase properties by rational design,
with MOSFLM, Acta Crystallogr. D Biol. Crystallogr., 67,
Prot. Eng. Des. Select., 28, 171 178, doi: 10.1093/protein/
271 281, doi: 10.1107/S0907444910048675.
gzv007.
12.
Kabsch, W.
(2010) XDS, Acta Crystallogr. D Biol.
24.
Matthews, B. W. (1968) Solvent content of protein crys
Crystallogr., 66, 125 132, doi: 10.1107/S0907444909047337.
tals, J. Mol. Biol., 33, 491497, doi 10.1016/0022
13.
Yu, S., Zhu, L., Zhou, C., An, T., Zhang, T., Jiang, B., and
2836(68)90205 2.
Mu, W. (2014) Promising properties of a formate dehydro
25.
Winn, M. D., Ballard, C. C., Cowtan, K. D., Dodson, E. J.,
genase from a methanol assimilating yeast Ogataea para=
Emsley, P., Evans, P. R., Keegan, R. M., Krissinel, E. B.,
polymorpha DL 1 in His tagged form, Appl. Microbiol.
Leslie, A. G., McCoy, A., McNicholas, S. J., Murshudov,
Biotechnol., 98, 1621 1630, doi: 10.1007/s00253 013 4996 5.
G. N., Pannu, N. S., Potterton, E. A., Powell, H. R.,
14.
Ordu, E. B., and Karagüler, N. G. (2007) Improving the
Read, R. J., Vagin, A., and Wilson, K. S. (2011) Overview
purification of NAD+ dependent formate dehydrogenase
of the CCP4 suite and current developments, Acta
from Candida methylica, Prepar. Biochem. Biotechnol., 37,
Crystallogr. D Biol. Crystallogr., 67, 235 242, doi: 10.1107/
333 341, doi: 10.1080/10826060701593233.
S0907444910045749.
БИОХИМИЯ том 85 вып. 6 2020
816
ПОМЕТУН и др.
HIGHLY ACTIVE RECOMBINANT FORMATE DEHYDROGENASE
FROM PATHOGENIC BACTERIUM Staphylococcus aureus:
PREPARATION AND CRYSTALLIZATION*
А. А. Pometun1,2,3#, K. M. Boyko2#, T. S. Yurchenko1,2, A. Yu. Nikolaeva2,4, I. S. Kargov2,3,
D. L. Atroshenko1,2,3, S. S. Savin1,2,3, V. O. Popov2,4, and V. I. Tishkov1,2,3**
1 Lomonosov Moscow State University, Faculty of Chemistry, 119991 Moscow, Russia; E=mail: vitishkov@gmail.com
2 Bach Institute of Biochemistry, Research Centre “Fundamentals of Biotechnology”
of the Russian Academy of Sciences, 119071 Moscow, Russia
3 Innovations and High Technologies MSU Ltd, 109559 Moscow, Russia
4 National Research Center “Kurchatov institute”, 123182 Moscow, Russia
Received April 16, 2020
Revised May 2, 2020
Accepted May 2, 2020
NAD+ dependent formate dehydrogenase from Staphylococcus aureus (SauFDH) is one of the key enzymes respon
sible for the survival of this pathogen in the form of biofilms. 3D structure of the enzyme might be helpful in the
search for highly specific SauFDH inhibitors that can be used as antibacterial agents exactly against S. aureus
biofilms. Here, we prepared a recombinant SauFDH in Escherichia coli cells with a yield of 1 g target protein per liter
medium. The developed procedure for the enzyme purification allowed to obtain 400 mg of homogenous enzyme
with 61% yield. The specific activity of the purified recombinant SauFDH was 20 U per mg protein, which was
2 times higher than the previously reported activities of formate dehydrogenases. We also found crystallization con
ditions in the course of two rounds of optimization and obtained 200 and 40 μm crystals for the SauFDH apo and
holoenzymes, respectively. X ray analysis using synchrotron X ray sources produced diffraction data sufficient for
solving the three dimensional structures of the apo and holoenzymes with the resolution of 2.2 and 2.7 Å, respec
tively. Crystals of the apo and holoforms of SauFDH had different crystal space groups, which suggest coenzyme
binding in the SauFDH holoenzyme.
Keywords: formate dehydrogenase, Staphylococcus aureus, expression, purification, crystallization, X ray diffraction
analysis
БИОХИМИЯ том 85 вып. 6 2020