БИОХИМИЯ, 2020, том 85, вып. 6, с. 817 - 830
УДК 577.125.3
ЭВОЛЮЦИОННАЯ УТРАТА СПОСОБНОСТИ ПЕРВИЧНОГО
ДОНОРА ЭЛЕКТРОНА ФОТОСИСТЕМЫ 1
К РЕДОКС ВЗАИМОДЕЙСТВИЮ
С Mn БИКАРБОНАТНЫМИ КОМПЛЕКСАМИ
© 2020
В.В. Терентьев*, С.К. Жармухамедов
Институт фундаментальных проблем биологии РАН ФИЦ
«Пущинский научный центр биологических исследований РАН»,
142290 Пущино Московской обл., Россия; электронная почта: v.v.terentyev@gmail.com
Поступила в редакцию 14.10.2019
После доработки 21.02.2020
Принята к публикации 03.04.2020
Структурно функциональная организация донорной стороны реакционного центра (РЦ) фотосистемы 1
(ФС1) проявляет значительное сходство с РЦ пурпурных бактерий (бРЦ), хотя они относятся к разным ти
пам. Более того, значения редокс потенциалов их первичных доноров электрона идентичны и составляют
∼0,5 В. Ранее в наших работах (Khorobrykh et al. (2008) Pilos. Trans. R. Soc. B., 363, 1245 1251; Terentyev et al.
(2011) Biochemistry (Moscow), 76, 1360 1366; Khorobrykh et al. (2018) Chem. Bio. Chem., 14, 1725 1731) была по
казана возможность редокс взаимодействия «низкопотенциальных» Mn2+ бикарбонатных комплексов с
бРЦ, что, как предполагается, могло быть одним из начальных этапов эволюционного возникновения Mn
кластера водоокисляющего комплекса фотосистемы 2 в Архее (> 3 млрд лет назад). В данной работе иссле
довали редокс взаимодействие между Mn2+ бикарбонатными комплексами и ФС1. Было выявлено, что по
добное взаимодействие практически отсутствует на исходных препаратах ФС1 и проявляется лишь на пред
варительно окисленных препаратах, содержащих ∼50% окисленных РЦ. При этом редокс взаимодействие
между Mn2+ бикарбонатными комплексами и ФС1 требовало повышенного содержания Mn2+, а концент
рационная зависимость от HCO– указывала на участие электронейтрального «низкопотенциального» комп
лекса [Mn(HCO3)2] в данном процессе. Анализ известной кристаллографической структуры ФС1 показал
стерические затруднения на донорной стороне РЦ, которые могут препятствовать непосредственному ре
докс взаимодействию между Mn2+ бикарбонатными комплексами и окисленным первичным донором
электрона. Сравнение структур РЦ ФС1 и более древнего РЦ из гелиобактерий, относящихся к одному ти
пу РЦ, позволило предположить отсутствие у примитивной ФС1 в Архее подобных стерических затрудне
ний на донорной стороне, а их эволюционное возникновение объяснить как следствие вовлечения РЦ ФС1
в функционирование в единой электрон транспортной цепи фотосинтетической мембраны, что сопровож
далось эволюционной утратой у ФС1 способности к редокс взаимодействию с Mn2+ бикарбонатными комп
лексами.
КЛЮЧЕВЫЕ СЛОВА: фотосинтез, эволюция фотосинтеза, фотосистема 1, фотосинтетические реакцион
ные центры, Mn бикарбонатные комплексы.
DOI: 10.31857/S032097252006007X
Памяти Козлова Юрия Николаевича
ВВЕДЕНИЕ
(кислородный) фотосинтез является также ис
точником практически всего молекулярного
Фотосинтез является одним из важнейших
кислорода современной атмосферы.
глобальных биохимических процессов, в ре
Фотоиндуцированные реакции оксигенного
зультате которого за счет энергии солнечного
фотосинтеза протекают в тилакоидных мембра
излучения происходит ассимиляция СО2, син
нах цианобактерий, зеленых водорослей и выс
тез органического вещества и, как следствие,
ших растений. В мембрану погружены крупные
накопление его в биосфере земли. Оксигенный
пигмент белковые комплексы двух фотосис
Принятые сокращения: ФС2 - фотосистема 2; ФС1 - фотосистема 1; ЭТЦ - электрон транспортная цепь;
РЦ - реакционный центр; бРЦ - бактериальный реакционный центр; гбРЦ - бактериальный реакционный центр из ге
лиобактерий; Хл - хлорофилл; бХЛ - бактериохлорофилл; Пц - пластоцианин; ДХФИФ - восстановленный 2,6 дихлор
фенолиндофенол; БК - бикарбонат.
* Адресат для корреспонденции.
5
817
818
ТЕРЕНТЬЕВ, ЖАРМУХАМЕДОВ
тем - фотосистемы 2 (ФС2) и фотосистемы 1
ризуются сравнимыми расстояниями между
(ФС1), объединённые в единую электрон транс
вторичными и первичными донорами электро
портную цепь (ЭТЦ) [1-3]. Основу обеих фото
на, и значениями диэлектрической проницае
систем образуют гетеродимерные фотохимичес
мости этого участка [11]. В отличие от бРЦ типа
кие реакционные центры (РЦ), в которых при
II и РЦ ФС1, Em первичного донора электрона в
участии кофакторов цепи переноса электрона
РЦ ФС2, Р680, гораздо выше и может достигать
происходят реакции фотоиндуцированного пер
значения 1,12-1,20 В [12, 13], что делает его од
вичного разделения зарядов. В ФС2 этому сопут
ним из наиболее сильных окислителей в приро
ствует перенос электронов от молекул воды на
де. Вторичным донором электрона в РЦ ФС2
акцепторы хиноновой природы, QA и QB, а в ФС1 -
является редокс активный тирозин Yz белка D1,
от небольших водорастворимых белков пласто
восстанавливающийся от Mn кластера [3, 6, 8],
цианина (Пц) или цитохрома с6, восстановлен
а значение диэлектрической проницаемости
ных в результате транспорта электронов от ФС2,
участка между Mn кластером, Yz и P680 в РЦ
на Fe S кластеры и далее на ферредоксин [1-3].
ФС2 значительно ниже по сравнению с таковым
Аноксигенный (бескислородный) фотосин
между вторичным и первичным донором элект
тез, протекающий в фотосинтезирующих бакте
рона в бРЦ типа II и РЦ ФС1 [11].
риях, является эволюционно более древним [4].
Наиболее вероятно, что отличия в структур
На впячиваниях цитоплазматической мембра
но функциональной организации донорной
ны бактерий, в отличие от тилакоидной мембра
стороны РЦ ФС2 от бРЦ типа II и РЦ ФС1 были
ны оксигенных организмов, функционирует
вызваны возникновением у его непосредствен
лишь один РЦ (бРЦ), который, как считается,
ного эволюционного предшественника (наибо
структурно функционально гомологичен либо
лее вероятно, что это были бРЦ типа II) способ
РЦ ФС2, либо РЦ ФС1 [4, 5]. Все известные РЦ,
ности к использованию молекул воды в качестве
соответственно, относят либо к типу II, либо к
донора электронов. Для протекания подобной
типу I РЦ [4, 6]. Фотосинтетический аппарат
реакции требуется накопление четырех окисли
бактерий также содержит пигмент бактериохло
тельных эквивалентов, необходимых для однов
рофилл (бХл) вместо хлорофилла (Хл), который
ременного окисления двух молекул воды, а так
характерен для фотосистем тилакоидной мемб
же, чтобы первичный донор электрона РЦ обла
раны [6]. Стоит отметить, что бРЦ типа II (пур
дал достаточно высоким значением Em.
пурные и зеленые нитчатые бактерии) являются
В ФС2 современных организмов сопряже
гетеродимерными белковыми комплексами, так
ние четырехэлектронного окисления двух моле
же, как и РЦ ФС2 и ФС1. В то же время бРЦ ти
кул воды с одноэлектронным фотоиндуциро
па I (зеленые серные, гелиобактерии и ацидо
ванным переносом электрона в РЦ осуществля
бактерии) имеют гомодимерную структуру [2, 6,
ется благодаря уникальному Mn содержащему
7], что может указывать на более раннее ответв
кластеру (Mn4CaO5) [14], расположенному на
ление бРЦ типа I от общего эволюционного пу
донорной стороне.
ти развития фотосинтетических РЦ.
Несмотря на основополагающее значение
Разделение всех РЦ на два типа, описанное
Mn кластера для оксигенного фотосинтеза,
выше, в основном зависит от химической при
вопрос о его эволюционном возникновении не
роды их конечных акцепторов электрона. Так,
решен до сих пор. Mn кластер отсутствует у бРЦ
РЦ типа II содержат акцепторы электрона хино
типа II, которые эволюционно наиболее близки
новой природы, а РЦ типа I в качестве акцепто
к РЦ ФС2. Также не обнаружено ни «переход
ров электрона содержат Fe S кластеры [5-8].
ных», ни содержащих «примитивный» Mn клас
Подобное разделение полностью игнорирует
тер фотосинтезирующих организмов.
структурно функциональные различия и сход
Мы предполагаем, что в эволюционном воз
ства РЦ на их донорных сторонах. Согласно им,
никновении Mn кластера в Архее (более 2,5 млрд
как описано ниже, бРЦ типа II и РЦ ФС1
лет назад) ключевую роль могли сыграть Mn2+
(тип I РЦ) очень похожи и значительно отлича
бикарбонатные комплексы [15-19]. Одни из них,
ются от РЦ ФС2 (тип II РЦ). Так, значения ре
[Mn(HCO3)2], согласно данным электрохимии,
докс потенциала (Em) первичных доноров
являются электронейтральными и характеризу
электрона в РЦ пурпурных бактерий, Р870, и
ются по сравнению с аква катионом Mn2+ до
РЦ ФС1, P700, составляют ∼0,5 В [3, 9, 10]. Вто
вольно низким потенциалом окисления Mn2+,
ричными донорами электрона для бРЦ типа II и
равным ∼0,52 В [20-23]. Это значение довольно
РЦ ФС1 служат небольшие водорастворимые
близко к Em первичного донора электрона в РЦ
белки, соответственно цитохром с2 и цитохром
пурпурных бактерий [9] и, как было показано
с6 или Пц, обладающие близкими значениями
[16-18], бРЦ типа II действительно способны ис
Em [6, 8]. Также бРЦ типа II и РЦ ФС1 характе
пользовать такие комплексы в качестве доноров
БИОХИМИЯ том 85 вып. 6 2020
ВЗАИМОДЕЙСТВИЕ Мn БИКАРБОНАТНЫХ КОМПЛЕКСОВ С ФС1
819
электрона. Основываясь на данных геохимии, в
ных ФС1 (далее ФС1), использовали 2-3 не
Архее концентрация СО2 была высокой [15],
дельные листья гороха (Pisum sativum). Из сус
Mn2+ бикарбонатные комплексы могли быть дос
пензии солюбилизированных в присутствии
таточно широко представлены и, соответственно,
Triton X 100 тилакоидных мембран с помощью
использоваться бРЦ типа II в качестве доноров
центрифугирования осаждали кислород выде
электронов. Впоследствии в результате эволюци
ляющие фрагменты мембран, обогащенные
онных изменений в структуре РЦ на донорной
ФС2 [24]. Используемое соотношение Triton X
стороне мог возникнуть специальный сайт связы
100 к Хл составляло 20:1. Легкие фрагменты,
вания Mn2+ бикарбонатных комплексов, способ
обогащенные ФС1, оставшиеся в супернатанте,
ствующий более эффективному редокс взаимо
осаждали ультрацентрифугированием: сначала
действию этих комплексов с первичным донором
при 80 000 g, 30 мин (осадок отбрасывали), затем
электрона. Это, в свою очередь, могло стать пред
при 180 000 g, 3 ч. Осадок, содержащий ФС1, ре
посылкой для формирования примитивного тет
суспендировали в среде, содержащей 25 мM
ра марганец бикарбонатного кластера.
MES NaOH, pH 6,5, 15 мМ NaCl, 5 мМ MgCl2 и
В отличие от донорной стороны РЦ ФС2, до
300
мМ сахарозы до концентрации по Хл
норная сторона РЦ ФС1 не подвергалась подоб
1,5-2 мг/мл. Препараты хранили в присутствии
ным масштабным эволюционным изменениям,
10% ного глицерина при -70 °С. Все этапы ра
и ее структурно функциональная организация
боты по изолированию ФС1 проводили при 4 °С
до сих пор проявляет сходство с донорной сто
и слабом освещении зеленым светом.
роной бРЦ типа II [11]. Более того, значение Em
Общую концентрацию Хл в препаратах ФС1
первичных доноров электрона обоих РЦ прак
определяли спектрофотометрически после
тически идентичны (∼0,5 В) [3, 9, 10]. Исходя из
экстракции пигментов 80 % ным ацетоном [25].
этого, можно ожидать, что редокс взаимодей
Кинетику фотоиндуцированных изменений
ствие между Mn2+ бикарбонатными комплекса
поглощения, связанных с обратимым фото
ми и бРЦ типа II, показанное нами ранее
окислением Р700, измеряли в 10 мм кювете при
[16-18], возможно и в случае с РЦ ФС1. Это
комнатной температуре на фосфороскопичес
могло бы свидетельствовать о сходной направ
кой установке, позволяющей разделять действу
ленности в эволюционной приспосабливаемос
ющий и измерительный свет [16]. Интенсив
ти фотосинтезирующих организмов к условиям
ность действующего света (660 < λ < 800 нм)
высокого содержания бикарбоната (БК) в окру
составляла ∼1000 мкмолей фотонов м-2 с-1.
жающей среде Архея (до 200 мМ [15]) и, как
Измерения проводили в среде, содержащей
следствие, к использованию широко представ
50
мМ Hepes (pH 8,3) и обедненной по
ленных Mn2+ бикарбонатных комплексов в ка
СО2/HCO–. Удаление СО2/HCO– достигали бла
честве доноров электронов разными типами РЦ.
годаря продуванию среды воздухом без CO2, для
В данной работе исследовали редокс взаи
чего его пропускали через 20 см слой аскарита и
модействие между Mn2+ бикарбонатными
50 % ный раствор NaOH [26].
комплексами и первичным донором электрона
Визуализация взаимного расположения Р700
РЦ ФС1, Р700. Полученные результаты свиде
и аминокислотных остатков в ФС1 была выпол
тельствуют о возможности подобного взаимо
нена с помощью программы VMD (Иллинойс
действия, но только на предварительно окис
кий университет, США) [27] с использованием
ленных препаратах ФС1. Это может рассматри
данных о кристаллической структуре ФС1 из
ваться как подтверждение предположения о
высших растений (2WSE [28]), взятых с сайта
возможном использовании Mn2+ бикарбонат
ных комплексов в Архее непосредственно перед
возникновением оксигенного фотосинтеза в ка
честве доноров электрона примитивными РЦ
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
ФС2 (бРЦ) и ФС1 и дальнейшей потерей этой
способности у РЦ ФС1 в результате адаптации
Пигмент белковые комплексы ФС2 и ФС1 у
ее структурной организации для функциониро
современных организмов строго разделены в
вания в единой фотосинтетической ЭТЦ окси
тилакоидной мембране: ФС2 преимущественно
генной тилакоидной мембраны.
находится в стэкированных мембранах гран, в
то время как ФС1 локализуется в мембранах ла
мелл и поверхностных (нестэкированных)
МАТЕРИАЛЫ И МЕТОДЫ
мембранах гран [1, 3]. Это позволяет легко полу
чать мембранные препараты, обогащенные ли
Для получения фотохимически активных
бо ФС2, либо ФС1. Спектральные характерис
фрагментов тилакоидных мембран, обогащен
тики обеих фотосистем в подобных препаратах
БИОХИМИЯ том 85 вып. 6 2020
5*
820
ТЕРЕНТЬЕВ, ЖАРМУХАМЕДОВ
хорошо известны и служат надежным способом
как для проверки степени чистоты той или дру
гой фотосистемы, так и их фотоиндуцирован
ной активности.
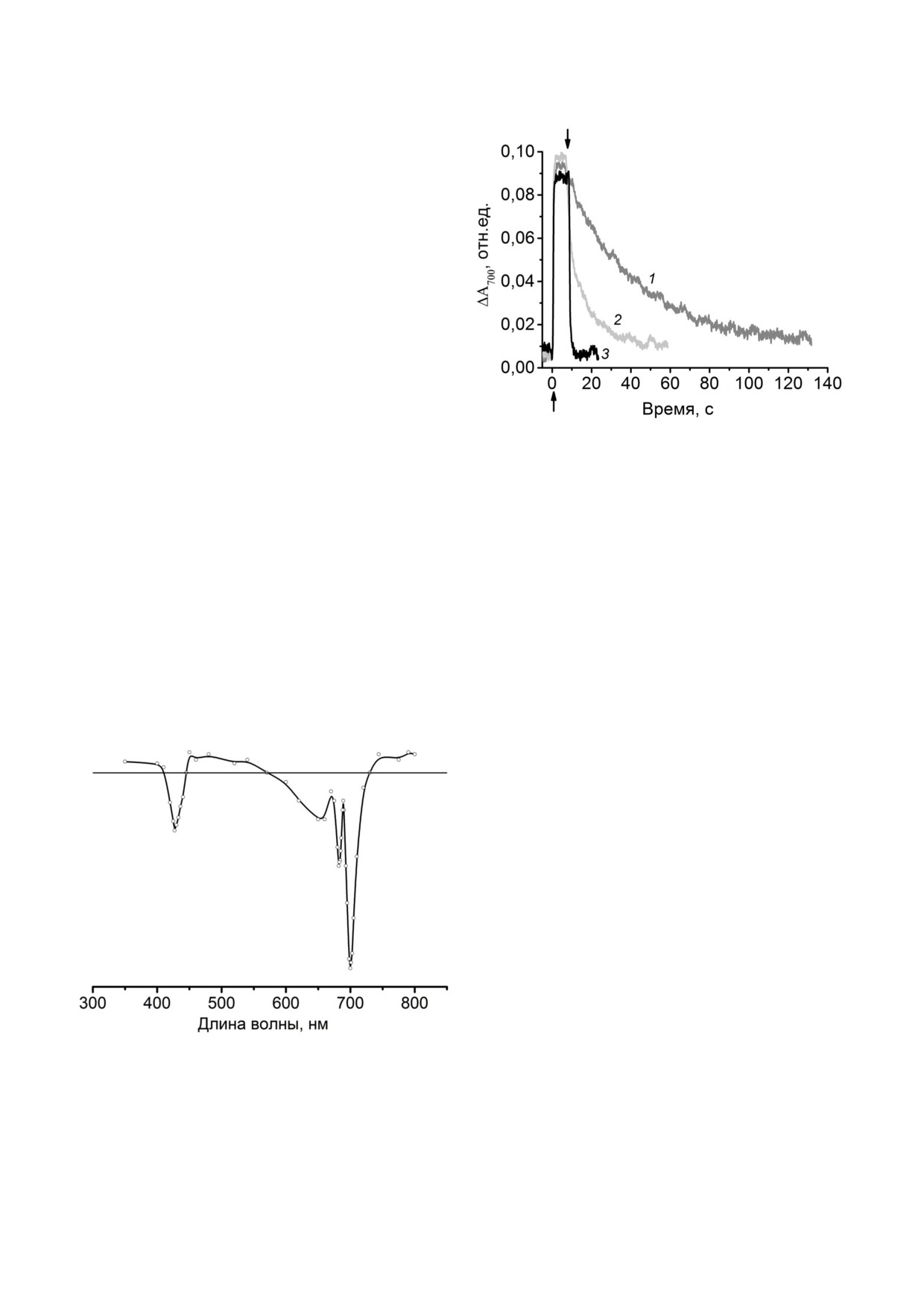
Дифференциальный спектр поглощения
«свет минус темнота» выделенных нами препа
ратов ФС1 из гороха представлен на рис. 1. По
своим спектральным характеристикам он пол
ностью соответствует опубликованным ранее
данным для высших растений [29-31]. Известно
[31], что полосы выцветания при 700 нм и 430 нм
отражают фотоиндуцированное образование и
накопление Р+700, а максимум при 682 нм и, соот
ветственно, минимум при 689 нм являются
электрохромным сдвигом полосы поглощения
Хл при 680 нм, вызванным электростатическим
полем образовавшегося Р+700. Таким образом,
амплитуда изменения поглощения в области
Рис. 2. Кинетика фотоиндуцированных изменений погло
700 нм (ΔА700) при освещении препаратов ФС1
щения при 700 нм, связанных с фотоокислением и после
дующим темновым восстановлением первичного донора
действующим светом отражает непосредствен
электрона, Р700, в препаратах ФС1. Кривые: 1 - в отсут
ное фотонакопление Р+700, а темновая релакса
ствии добавок (контроль), 2 - в присутствии 1 мМ аскор
ция, соответственно, восстановление до Р700.
бата Na, 3 - в присутствии 1 мМ аскорбата Na и 0,1 мМ
Как показано на рис. 2 в препаратах ФС1 в
2,6 дихлорфенолиндофенола. Стрелками (↑↓) обозначе
ны, соответственно, включение и выключение действую
ответ на включение действующего света наблю
щего света. Условия измерений см. в подписи к рис. 1. Для
далось быстрое (неразрешаемое) нарастание
удобства представления шкала поглощения здесь и далее
ΔА700 до максимального значения (ΔАM0AX), кото
дана в обратных значениях
рое не изменялось со временем. На величину
ΔАM0AX практически не оказывали влияния изве
стные доноры электронов - аскорбат Na или
первичных доноров электрона, и при включе
восстановленный 2,6 дихлорфенолиндофенол
нии действующего света в окисленное состоя
(ДХФИФ). Это свидетельствовало о том, что из
ние переходило 100% P700. То есть ΔАM0AX эквива
начально препараты не содержали окисленных
лентно переходу всех первичных доноров элект
рона в окисленное состояние.
Тем не менее доноры электрона значительно
ускоряли кинетику темнового восстановления
Р+700 (рис. 2). В отсутствиe добавок практически
полное темновое восстановление Р+700 происхо
дило ∼ за 150 с (τ ∼ 35 с) и значительно ускоря
лось в присутствии доноров электронов - ас
корбата Na (τ ∼ 7 с) или ДХФИФ.
Известно, что значение Em первичного доно
ра электрона в РЦ ФС1 составляет ∼0,5 В [3, 10],
что эквивалентно Em первичного донора элект
рона в РЦ пурпурных бактерий [9]. Как было
показано в предыдущих работах [16-18], РЦ из
пурпурных бактерий в отсутствие на донорной
стороне цитохромной С субъединицы способ
ны к редокс взаимодействию с Mn2+, но только
в присутствии ионов БК (HCO–), т.е., когда
Mn2+ находится в составе Mn2+ бикарбонатных
комплексов. Причем согласно ЭПР данным,
Рис. 1. Дифференциальный спектр поглощения «свет ми
полученным при криогенных температурах
нус темнота» препаратов ФС1, выделенных из листьев го
(5K), бРЦ под действием света окисляют Mn2+ в
роха. Измерения проводили в присутствии 0,2 мМ аскор
присутствии БК до Mn3+ [18].
бата Na и 0,1 мМ 2,6 дихлорфенолиндофенола (режим фо
Ранее экспериментально было установлено,
тонакопления Р+700). Содержание хлорофилла 10 мкг/мл.
Действующий свет 660 < λ < 800 нм, 1000 мкмолей фотонов
что значение Em первичного донора электрона
м-2 с-1
РЦ является одним из условий осуществления
БИОХИМИЯ том 85 вып. 6 2020
ВЗАИМОДЕЙСТВИЕ Мn БИКАРБОНАТНЫХ КОМПЛЕКСОВ С ФС1
821
подобного редокс взаимодействия, которое
полностью исчезало в случае бРЦ типа II изоли
рованных из зеленой нитчатой бактерии
Chloroflexus aurantiacus, характеризующихся бо
лее низким значением Em первичного донора
электрона по сравнению с РЦ пурпурных бакте
рий [17]. Другими необходимыми условиями ре
докс взаимодействия между Mn2+ бикарбонат
ными комплексами и первичным донором
электрона бРЦ являются значение рН среды и
концентрация растворенного в ней БК. Так, сти
мулирование восстановления Р+870 в бРЦ в присут
ствии Mn2+ и HCO– наблюдалось только при
рН ∼ 8,3 и концентрации БК > 30 мМ [16, 17].
Как было позднее показано с помощью электро
химии, формирование и доминирование в раст
воре «низкопотенциальных» (по сравнению с
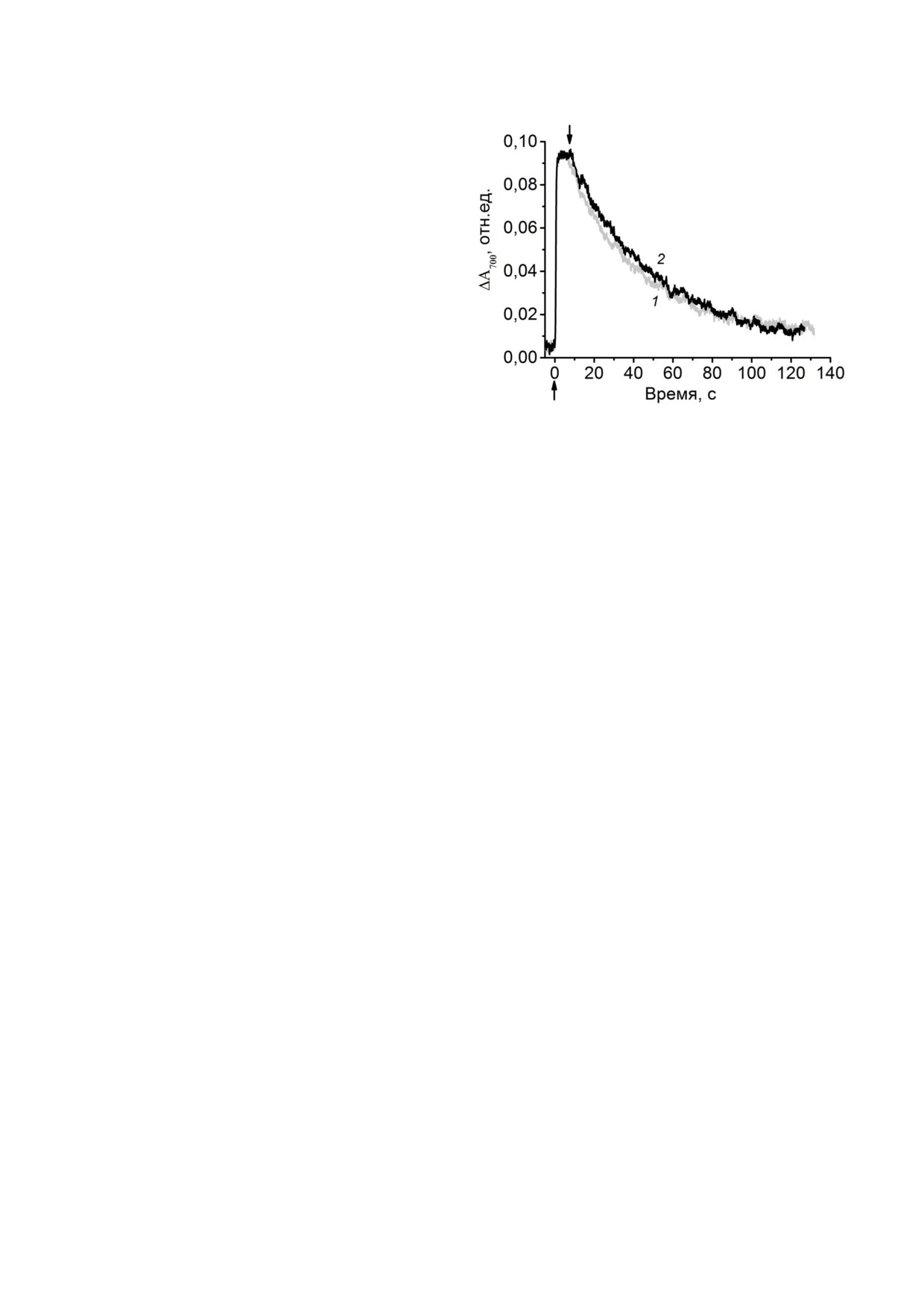
Рис. 3. Фотоокисление Р700 и его темновое восстановление.
аква катионом Mn2+) комплексов [Mn(HCO3)2] c
Кривые: 1 - в отсутствие добавок (контроль), 2 - в присут
потенциалом окисления Mn2+, равным 0,52 В,
ствии 0,5 мМ MnCl2 и 50 мМ NaHCO3. Стрелками (↑↓)
-
обозначены соответственно включение и выключение
помимо высокой концентрации ионов HCO3
действующего света. Условия измерений см. в подписи к
[21-23], также требуется рН ∼ 8,3 [32]. Исходя из
рис. 1
полных констант устойчивости для разных ти
пов Mn2+ бикарбонатных комплексов [22, 23],
было рассчитано распределение Mn2+ между ни
карбонатных комплексов, способных к редокс
ми в растворе при рН 8,3 в зависимости от кон
взаимодействию с Р+870 в бРЦ) не оказывает вли
центрации ионов HCO– [19], которое показало,
яния ни на величину ΔА700, ни на кинетику тем
что при 30 мМ БК только ∼25% Mn2+ находится
нового восстановления Р+700 (рис. 3), что свиде
в комплексе [Mn(HCO3)2], а при 50 мМ БК на
тельствовало об отсутствии редокс взаимодей
долю этого комплекса приходится уже более
ствия между комплексами [Mn(HCO3)2] и Р+700.
40%.
Кристаллографические структуры РЦ из пур
РЦ ФС1, помимо «подходящего» для редокс
взаимодействия с
«низкопотенциальными»
рактеризуются схожим расстоянием между пер
Mn2+ бикарбонатными комплексами значения
вичным донором электрона и поверхностью до
Em первичного донора электрона, также харак
норной стороны. Кроме того, оба РЦ имеют
теризуются оптимумом своей фотосинтетичес
близкие значения диэлектрической проницае
кой активности в области рН 8,5-9,0 [33, 34],
мости этого участка, а перенос электрона от вто
что совпадает с указанным выше необходимым
ричного к первичному донору электрона на
значением рН для формирования комплексов
протеолипосомах, содержащих РЦ из пурпур
[Mn(HCO3)2]. С одной стороны, это может слу
ных бактерий или ФС1, сопровождается генера
жить косвенным указанием на то, что эволюци
цией сравнимой разности электрических потен
онный предшественник современной ФС1 мог
циалов Δψ (∼20% от трансмембранного значе
функционировать при значениях pH благопри
ния Δψ) [11, 35]. Исходя из вышесказанного, наи
ятных для формирования в среде комплексов
более логичным объяснением наблюдаемого от
[Mn(HCO3)2]. С другой стороны, интересно от
сутствия редокс взаимодействия между Mn2+
метить, что рН оптимум фотосинтетической ак
бикарбонатными комплексами и Р+700 могло быть
тивности ФС2, с которой ФС1 параллельно
наличие некого стерического затруднения для
функционирует в тилакоидной мембране, нахо
осуществления переноса электрона на донор
дится в более кислой области 6,2-6,5 [26], а рН
ной стороне РЦ ФС1 от Mn2+ (в составе бикар
люмена тилакоидов современных оксигенных
бонатного комплекса) на Р+700.
фотосинтезирующих организмов колеблется в
В ходе изучения данного предположения мы
диапазоне от 7,0 до 6,0 (возможно до 5,5) (см.
искусственно переводили Р700 в препаратах ФС1
подробнее в [26]). Тем не менее в результате се
в «долгоживущее» окисленное состояние. Для
рии проведенных нами экспериментов на пре
этого адаптированные к темноте ФС1 инкуби
паратах ФС1 было обнаружено, что при рН 8,3
ровали в присутствии 1 мМ K3[Fe(CN)6] в тече
-
присутствие 0,5 мМ Mn2+
вместе с 50 мМ HCO3
ние 1 мин с последующим переосаждением пре
(т.е. в условиях формирования и доминирова
паратов в исходном буфере, не содержащем
ния в среде «низкопотенциальных» Mn2+ би
K3[Fe(CN)6]. В результате такой обработки у
БИОХИМИЯ том 85 вып. 6 2020
822
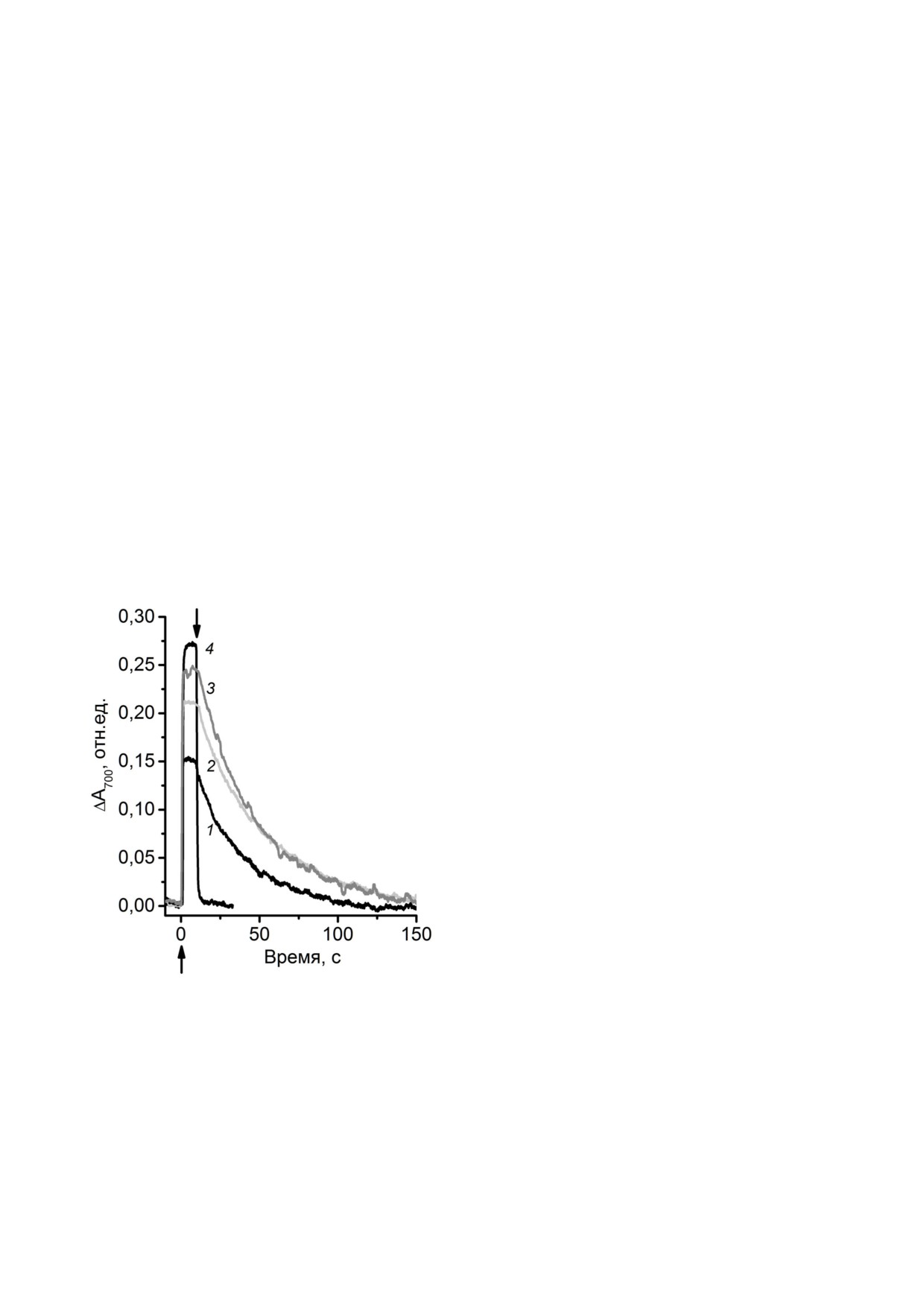
ТЕРЕНТЬЕВ, ЖАРМУХАМЕДОВ
∼40-45% ФС1 первичный донор электрона на
P700 в препаратах «окисленных» ФС1 возрастало
ходился в «долгоживущем» окисленном состоя
на 20-25%. Более того, было выявлено, что пос
нии («окисленные» ФС1), о чем свидетельство
ледующее дополнительное темновое инкубиро
вало снижение величины ΔА700 на 40-45%
вание «окисленных» ФС1 в присутствии Mn2+
(рис. 4, кинетика 1) по сравнению с таковой,
бикарбонатных комплексов приводит к увели
наблюдаемой в присутствии экзогенных доно
чению доли восстановленных P700 в препаратах.
ров электрона (0,1 мМ аскорбата Na и 0,1 мМ
Через 10 мин темновой инкубации удавалось
ДХФИФ), способных к быстрому и полному
достичь максимального эффекта, так что ΔА700
восстановлению Р+700 в темноте (рис. 4, кинетика
составляла ∼90% от ΔАM0AX (рис. 4, кинетика 3).
4). Учитывая, что ΔА700 в присутствии доноров
Тем не менее, в проведенных экспериментах не
электрона соответствует ΔАM0AX (рис. 2), детекти
было обнаружено очевидного влияния присут
руемые 55-60% от ΔАM0AX, соответственно, отра
ствия 0,5 мМ Mn2+ вместе с 50 мМ HCO– на ки
жали количество РЦ с восстановленными Р700,
нетику темнового восстановления Р+700 в отличие
способными к фотоокислению, от общего коли
от того, как это наблюдалось в присутствии ас
чества РЦ. Темновая инкубация «окисленных»
корбата Na или ДХФИФ (рис. 4, кинетика 4).
ФС1 в течение 20-30 мин не изменяла долю
Важно отметить, что наблюдаемый эффект по
ΔА700 относительно ΔАM0AX, что свидетельствова
казывал специфичность по отношению к Mn2+
ло об отсутствии спонтанного темнового восста
бикарбонатным комплексам. Как следует из
новления Р+700 в условиях эксперимента.
рис. 5, добавление к «окисленным» ФС1 0,5 мМ
При добавлении к таким «окисленным» ФС1
Mn2+ или 50 мМ HCO– отдельно друг от друга не
0,5 мМ Mn2+ вместе с 50 мМ HCO– нам удалось
оказывало влияния ни на ΔА700, ни на кинетику
обнаружить возрастание амплитуды ΔА700 до,
темнового восстановления Р+700 даже после инку
примерно, 80% от ΔАM0AX (рис. 4, кинетика 2).
бации в темноте в течение 10 мин (рис. 5, а).
Это свидетельствовало о том, что в ходе экспе
Также эффект отсутствовал при добавлении
римента количество восстановленных в темноте
других двухвалентных катионов металлов (Mg2+
и Ca2+) в присутствии 50 мМ HCO– (рис. 5, б,
кинетики 3 и 4) или ионов ацетата и формиата в
присутствии 0,5 мМ Mn2+ после 10 мин инкуба
ции в темноте (рис. 5, б, кинетики 5 и 6).
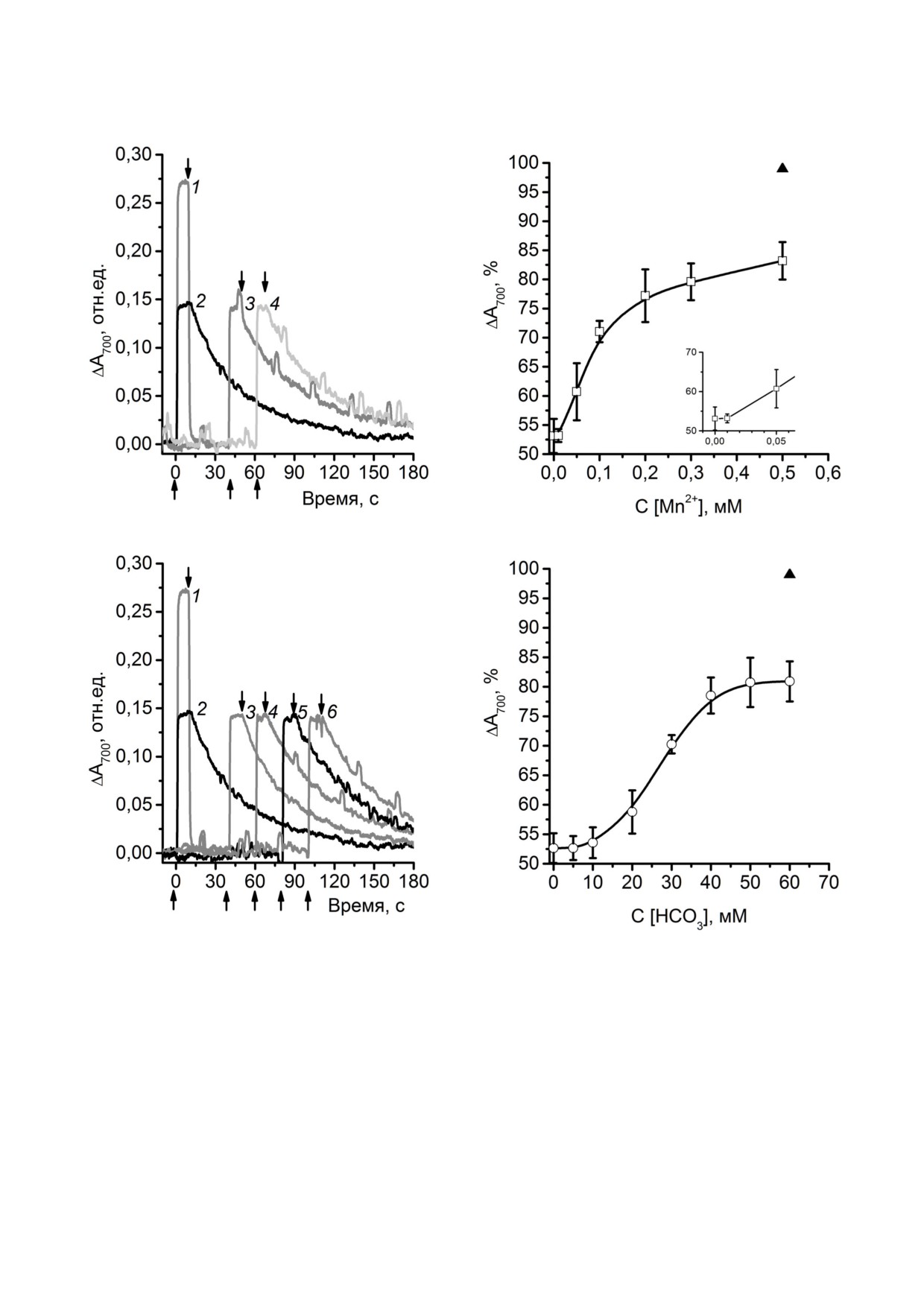
Как было сказано выше, одним из необходи
мых условий для доминирования «низкопотен
циальных» комплексов [Mn(HCO3)2] среди дру
гих комплексов в растворе является повышен
ная концентрация БК [21-23]. В то же время,
как было показано с помощью ЭПР спектрос
копии, от концентрации катионов Mn2+ зависит
лишь количество этих комплексов, но не их тип
[22]. В предыдущих работах на бРЦ мы наблю
дали зависимость эффективности редокс взаи
модействия Mn2+ бикарбонатных комплексов с
Р+870 от концентраций HCO– и Mn2+ [16]. Так, в
присутствии 0,5 мМ Mn2+ и при добавлении БК
до 10-15 мМ не наблюдалось ускорения темно
вого восстановления Р+870, которое начинало про
являться при увеличении концентрации БК до
30 мМ и достигало максимального эффекта при
50 мМ БК [16]. В то же время в присутствии
50 мМ HCO– ускорение темнового восстановле
Рис. 4. Кинетики фотоиндуцированных изменений погло
ния Р+870 наблюдалось уже при 0,01 мМ Mn2+ и
щения при 700 нм препаратов «окисленных» ФС1 (предин
достигало максимума при 0,5 мМ Mn2+ [16], что,
кубированных с K3[Fe(CN)6]). Кривые: 1 - в отсутствие до
бавок, в присутствии 0,5 мМ MnCl2 и 50 мМ NaHCO3: ин
по видимому, отражало насыщение раствора
кубирование перед измерением 3 мин (2) и 10 мин (3);
комплексами [Mn(HCO3)2], способными к ре
4 - в присутствии 0,1 мМ аскорбата Na и 0,1 мМ 2,6 ди
докс взаимодействию с Р+870 в бРЦ.
хлорфенолиндофенола. Концентрация препаратов по хло
На рис. 6, а показано влияние увеличиваю
рофиллу 30 мкг/мл. Действующий свет 660 < λ < 800 нм,
щейся концентрации Mn2+ на ΔА700 в «окислен
1000 мкмолей фотонов м-2 с-1. Стрелками (↑↓) обозначе
ны, соответственно, включение и выключение действую
ных» ФС1 в присутствии 50 мМ HCO–. Явное
щего света.
увеличение ΔА700, по сравнению с исходным
БИОХИМИЯ том 85 вып. 6 2020
ВЗАИМОДЕЙСТВИЕ Мn БИКАРБОНАТНЫХ КОМПЛЕКСОВ С ФС1
823
а
а
б
б
-
Рис. 5. Кинетики фотоиндуцированных изменений погло
Рис. 6. Зависимость стимулирующего эффекта Mn2+ би
щения при 700 нм препаратов «окисленных» ФС1 (предин
карбонатных комплексов на амплитуду ΔА700 в «окислен
кубированных с K3[Fe(CN)6]). а) Кривые: 1 - в присутствии
ных» ФС1 от концентрации Mn2+ (а) или HCO– (б). Изме
0,1 мМ аскорбата Na и 0,1 мМ 2,6 дихлорфенолиндофено
рения проводили соответственно в присутствии 50 мМ
ла; 2 - в отсутствие добавок; 3 - в присутствии 0,5 мМ
NaHCO3 или 0,5 мМ MnCl2. Черным треугольником обоз
MnCl2; 4 - в присутствии 50 мМ NaHCO3; б) кривые: 1 - в
начено максимальное значение ΔА700 в присутствии 1 мМ
присутствии 0,1 мМ аскорбата Na и 0,1 мМ 2,6 дихлорфе
аскорбата Na и 0,1 мМ 2,6 дихлорфенолиндофенола
нолиндофенола; 2 - в отсутствие добавок; 3 - в присут
(ΔАM0AX). На врезке показан тот же график, что и (а), но в
ствии 0,5 мМ MgCl2 и 50 мМ NaHCO3; 4 - в присутствии
области концентраций Mn2+ от 0 до 50 мкМ.
0,5 мМ CaCl2 и 50 мМ NaHCO3; 5 - 0,5 мМ MnCl2 и 50 мМ
формиата; 6 - 0,5 мМ MnCl2 и 50 мМ ацетата. Стрелками
(↑↓) обозначены, соответственно, включение и выключе
ние действующего света. Условия измерений см. в подписи
к рис. 4
БИОХИМИЯ том 85 вып. 6 2020
824
ТЕРЕНТЬЕВ, ЖАРМУХАМЕДОВ
значением в «окисленных» ФС1, наблюдалось
руднение на донорной стороне ФС1, препят
при 0,05 мМ Mn2+ и достигало максимума при
ствующее возможному редокс взаимодействию
0,2-0,3 мМ Mn2+. В то же время в присутствии
Mn2+ бикарбонатных комплексов с Р+700.
0,5 мМ Mn2+ влияние HCO– на ΔА700 в «окислен
Действительно, как следует из кристаллографи
ных» ФС1 начинало явно проявляться при кон
ческих структур ФС1, изолированных из циано
центрациях выше 20 мМ, достигая максимума
бактерий, зеленых водорослей и высших расте
при 40 мМ HCO– (рис. 6, б). Полученные ре
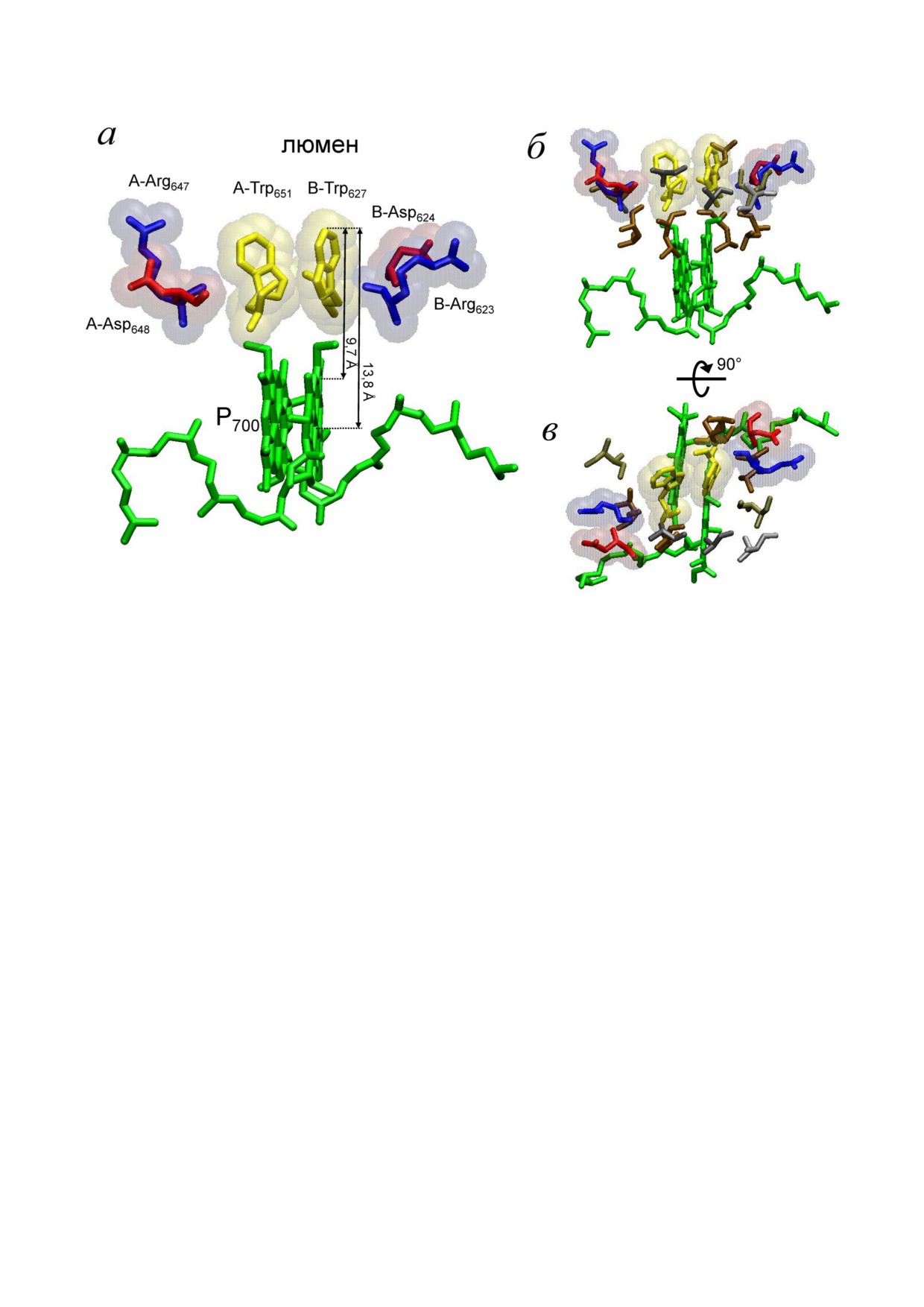
ний, их РЦ имеют консервативный гидрофоб
зультаты хорошо коррелируют с зависимостью
ный мотив на донорной стороне, расположен
доминирования в растворе комплексов
ный прямо перед P700. Он сформирован амино
[Mn(HCO3)2] от концентрации БК. Кроме того,
кислотными остатками двух триптофанов, при
они практически совпали с данными, получен
надлежащих параллельным люменальным пет
ными нами ранее на бРЦ [16].
лям разных субъединиц РЦ (соответственно
Интересно отметить, что зависимость эф
PsaA Trp655/Trp651 и PsaB Trp631/Trp627 в циано
фекта от концентрации Mn2+ отличалась от по
бактериях/водорослях и высших растениях)
лученной нами ранее на бРЦ [16]. В случае с
(рис. 7, а). Считается, что эти триптофаны обра
ФС1 эффект полностью отсутствовал при
зуют своеобразный сэндвич с объединенной
0,01 мМ Mn2+ (в отличие от бРЦ), начиная про
электронной системой в непосредственной бли
являться только при 0,05 мМ Mn2+ (рис. 6, а).
зости от Р700 [36, 37]. Согласно современным
Учитывая, что Mn2+ влияет на концентрацию со
представлениям, такая структура играет важную
держащихся в среде комплексов [Mn(HCO3)2],
роль в корректном докинге молекул цитохро
можно предположить, что для инициирования
ма с6 и Пц для быстрого донирования электрона
редокс взаимодействия Mn2+ бикарбонатных
на первичный донор электрона [36-38]. Допол
комплексов с Р+700 требуется более высокое со
нительно белковая поверхность около Р700 окру
держание в растворе комплексов [Mn(HCO3)2],
жена отрицательно заряженными (PsaA Asp648 и
чем в случае с бРЦ, даже на предварительно
PsaB Asp624) и положительно заряженными
окисленных препаратах ФС1.
(PsaA Arg647 и PsaB Arg623) аминокислотными
остатками, играющими роль в правильном ори
ентировании гема в цитохроме с6 или меди в Пц
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
относительно гидрофобного сэндвича и Р+700 [36,
37]. Более того, вокруг триптофанового сэндви
В предыдущих работах мы впервые экспери
ча легко прослеживается своеобразное кольцо,
ментально показали способность бРЦ типа II к
сформированное гидрофобными аминокисло
редокс взаимодействию с Mn2+ в присутствии
тами, которое вместе с ним практически пол
БК [16-18]. Учитывая, что бРЦ типа II считают
ностью отделяет P700 от люмена (рис. 7, б и в). В
ся наиболее вероятными эволюционными пред
настоящее время в литературе отсутствуют дан
шественниками РЦ ФС2, полученные в тех ра
ные о каком либо функциональном значении
ботах результаты рассматривались как подтверж
данного гидрофобного кольца на донорной сто
дение гипотезы о возможном участии Mn2+ би
роне ФС1.
карбонатных комплексов в эволюционном воз
Подобное окружение Р700 может сильно зат
никновении Mn кластера водоокисляющего
руднять редокс взаимодействие Mn2+ бикарбо
комплекса ФС2 в Архее (> 2,5 млрд лет назад)
натных комплексов с Р+700. Гидратная оболочка
[15-18].
Mn2+ в комплексах с БК сохраняет 5 или 4 моле
Учитывая сходство структурно функцио
кул воды в зависимости от типа комплекса (из 6
нальных характеристик донорных сторон [11] и
возможных в аква катионе Mn2+) [20, 21]. Соот
значений редокс потенциалов первичных доно
ветственно, гидрофобный сэндвич из двух трип
ров электрона в бРЦ типа II и ФС1 [3, 9, 10]
тофанов, находящийся непосредственно перед
(см. Введение), было предположено, что ре
Р700, совместно с гидрофобным кольцом не поз
докс взаимодействие между комплексами
воляют комплексам подходить достаточно близ
[Mn(HCO3)2] и первичным донором электрона
ко к Р700 для осуществления прямого редокс
должно быть характерно и для РЦ ФС1. Однако,
взаимодействия. Как показано на рис. 7, а рас
как показали проведенные нами эксперименты,
стояние между внешним кольцом триптофана,
присутствие «низкопотенциальных» Mn2+ би
обращенным в люмен, и ближайшим к нему
карбонатных комплексов не оказывало влияния
циклом в молекуле Хл в Р700 составляет
ни на фотоокисление Р700, ни на его восстанов
∼9,6-9,7 Å, а расстояние до центра молекулы Хл
ление в темноте (рис. 3).
составляет уже 13,6-13,8 Å. При этом, для Mn2+
Одной из наиболее вероятных причин по
бикарбонатных комплексов эти значения могут
добного результата могло быть стерическое зат
быть еще больше вследствие гидрофобного воз
БИОХИМИЯ том 85 вып. 6 2020
ВЗАИМОДЕЙСТВИЕ Мn БИКАРБОНАТНЫХ КОМПЛЕКСОВ С ФС1
825
Рис. 7. Взаимное расположение Р700 и гидрофобных и заряженных аминокислот в его окружении. Гидрофобный сэндвич
перед Р700 (зелёный цвет), образованный парой A Trp651/B Trp627 (желтый цвет), отрицательно заряженные A Asp648 и B
Asp624 (красный цвет) и положительно заряженные A Arg647 и B Arg623 (синий цвет), участвующие в корректном докинге ци
тохрома с6 или Пц. A и B , соответственно, субъединицы PsaA и PsaB в РЦ ФС1. а - Стрелками указаны расстояния меж
ду внешним кольцом Trp и ближайшим к нему кольцом и центром молекулы хлорофилла Р700; б - указано гидрофобное
кольцо, образованное A Ala654/652 (темно серый цвет), A Val657 (серый цвет), A Ile658 и B Ile634 (темно желтый), A Leu646/650 и
B Leu628/626/622 (коричневый); вид со стороны тилакоидной мембраны; в - то же самое, что б, но вид со стороны люмена.
journal/biokhsm/)
действия сэндвича (рис. 7, а). Заряженные ами
шает потенциал окисления Mn2+ уже до ∼0,67 В
нокислотные остатки, в свою очередь, могут
[20, 21, 23]. Положительно заряженные PsaA
оказывать влияние на электрохимические свой
Arg647 и PsaB Arg623, наоборот, могут оттягивать
ства Mn2+ в комплексе с БК. Согласно имею
на себя ионы HCO– из комплексов, отталкивая
щимся данным [20-23], «низкопотенциальные»
положительно заряженные [Mn(HCO3)]+ или
Mn2+ бикарбонатные комплексы формируются
даже Mn2+, также повышая потенциал окисле
с участием двух ионов HCO–, которые, помимо
ния Mn2+ по описанному выше принципу. Учи
снижения потенциала окисления Mn2+ до
тывая, что аминокислотные остатки в разноза
∼0,52 В, также нейтрализуют и общий заряд
ряженных парах PsaA Asp648/Arg647 и PsaB
комплекса [Mn(HCO3)2]. Отрицательно заря
Asp624/Arg623 находятся параллельно друг другу
женные PsaA Asp648 и PsaB Asp624, находящиеся
на довольно близком расстоянии, соответствен
вблизи Р700, могут притягивать к себе Mn2+ в
но ∼4,0 и ∼3,3 Å (рис. 7, в), можно предположить
-
комплексах, одновременно выталкивая HCO3
их совместное влияние на электрохимические
из их оболочки. При этом удаление даже одного
свойства Mn2+ в комплексе с БК. В результате
из двух ионов HCO–, т.е. изменение стехиомет
это может значительно затруднять редокс взаи
рии комплекса [Mn(HCO3)2] → [Mn(HCO3)]+
модействие Mn2+ с Р+700 даже в присутствии высо
(как показано ранее [20, 21, 23]) приводит к по
ких концентраций БК.
вышению потенциала окисления Mn2+ до
Тем не менее редокс взаимодействие Mn2+
∼0,61 В, делая термодинамически затруднитель
бикарбонатных комплексов с Р+700 возможно, хо
ным его редокс взаимодействие с Р+700
тя и сильно затруднено. Для этого первичный
(Em ∼ 0,5 В). Удаление обоих ионов HCO– повы
донор электрона было необходимо перевести в
БИОХИМИЯ том 85 вып. 6 2020
826
ТЕРЕНТЬЕВ, ЖАРМУХАМЕДОВ
окисленное состояние и инкубировать в присут
шо известно [43] и, согласно предположению
ствии Mn2+ и БК несколько минут (рис. 4). Но
авторов, могло произойти в результате восста
даже в этом случае, по сравнению с эксперимен
новления оксидов Mn (IV) углеродом органи
тами на бРЦ типа II [16-18], требовалось в 5 раз
ческого происхождения (уравнения 1 и 2) [42].
больше Mn2+ (т.е. Mn2+ бикарбонатных комп
лексов) для наблюдения эффекта (рис. 6, а). За
, (1)
висимость эффекта от присутствия Mn2+ и
HCO– (рис. 5), а также от высокой концентра
(2)
ции БК (рис. 6, б), указывали на участие именно
«низкопотенциальных»
комплексов
[Mn(HCO3)2] в редокс взаимодействии с окис
Однако при этом утверждается, что в анок
ленным первичным донором электрона ФС1.
сигенном Архее окисление Mn2+ с последую
Недавно полученный кристалл бРЦ типа I из
щим образованием его оксидов в концентраци
гелиобактерии (гбРЦ) [39] позволяет провести
ях, необходимых для формирования обнару
сравнительный анализ структурной организа
женных пород, было невозможно в отсутствие
ции между РЦ ФС1 и его наиболее возможного
сильного окислителя [42]. Если принять во вни
эволюционного предшественника (бРЦ типа I).
мание выдвигаемую нами гипотезу окисления
Интересно, что, как указывают сами авторы ра
Mn2+ фотосинтетическими РЦ, то масштабное
боты, несмотря на то, что в структуре гбРЦ, так
образование и накопление MnO2 в осадочных
же, как и в РЦ ФС1, на донорной стороне при
породах можно было бы объяснить следующими
сутствуют поверхностные параллельные спира
процессами (ур. 3-7):
ли двух белков РЦ, в гбРЦ они короче и не несут
гидрофобных триптофанов. Более того, поверх
,
(3)
ность гбРЦ около первичного донора в основ
,
(4)
ном содержит нейтральные и гидрофильные
аминокислотные остатки [39], хотя вторичным
,
(5)
донором электрона выступает цитохром с553, ко
торый имеет очень схожую структуру c цитохро
мом c6 [39].
,
(6)
Таким образом, можно предположить, что
эволюционный предшественник РЦ ФС1 (бРЦ
типа I) или даже РЦ примитивной ФС1 могли
. (7)
не иметь описанных выше стерических затруд
нений на донорной стороне и его РЦ был досту
пен для редокс взаимодействия с Mn2+ бикар
Интересно, что авторы вышеуказанной ра
бонатными комплексами, подобно бРЦ типа II.
боты тоже приходят к выводу об отсутствии абио
Согласно данным геохимии, содержание
тических механизмов в Архее, которые могли бы
СО2 в древней бескислородной атмосфере Архея
привести к окислению Mn2+ при формировании
(> 3 млрд лет назад) было гораздо выше совре
изучаемых пород. Более того, они поддержива
менного уровня [40, 41], вследствие чего концен
ют идею широкого присутствия Mn окисляю
трация растворенного в воде БК могла достигать
щих фотосинтезирующих организмов в окружа
200 мМ [15]. Очевидно, что это благоприятство
ющей среде Архея непосредственно перед воз
вало нахождению большей части растворенного
никновением и распространением оксигенных
Mn2+ в виде «низкопотенциальных» Mn2+ би
организмов.
карбонатных комплексов [20, 21, 23], которые,
Перед возникновением единой ЭТЦ оба ти
вероятно, могли использоваться в качестве до
па РЦ должны были локализоваться в одной
норов электронов РЦ обоих типов.
мембране, но при этом функционировать неза
В подтверждение предположения о широко
висимо друг от друга. Вернее всего, тип II РЦ
распространенной в Архее Mn2+ фототрофии у
был представлен бРЦ, которые уже обладали
фотосинтезирующих организмов можно рас
специальным сайтом связывания Mn2+ бикар
сматривать данные, полученные при изучении
бонатных комплексов или даже содержали на
осадочных пород в глубоких скважинах Южной
донорной стороне примитивный тетра марга
Африки [42]. Согласно им, в слоях карбонатов,
нец бикарбонатный кластер (пред ФС2). В то
относящихся ко времени >2,4 млрд лет назад,
же время тип I РЦ, по видимому, был представ
детектируется аномально высокое содержание
лен примитивной ФС1. Проводя аналогию со
Mn (до 16,6% по весу). Вторичное диагенетичес
схемой электронного транспорта в РЦ пурпур
кое формирование подобных карбонатов хоро
ных бактерий (бРЦ типа II) и зеленых серных
БИОХИМИЯ том 85 вып. 6 2020
ВЗАИМОДЕЙСТВИЕ Мn БИКАРБОНАТНЫХ КОМПЛЕКСОВ С ФС1
827
бактерий (бРЦ типа I) [4], можно предполо
наоборот, могло привести к вовлечению прими
жить, что, соответственно, пред ФС2 имела
тивной ФС1 в акцептирование электронов от
циклический транспорт электронов с участием
участников циклического транспорта электро
цитохромного bc1 комплекса, пронизывающего
нов пред ФС2 (т.е. трансмембранного цито
мембрану, и небольшого растворимого белка -
хромного bc1 комплекса и мобильного белка
цитохрома с2, а примитивная ФС1 могла осуще
цитохрома с), находящихся в той же самой фо
ствлять как циклический транспорт электронов
тосинтетической мембране. Появление и пос
посредством цитохромного bc1 комплекса и ци
ледующее эволюционное закрепление единой
тохрома с, так и линейный транспорт - от доно
ЭТЦ с участием обеих фотосистем, которая ха
ра электрона на ферредоксин и далее на
рактерна для всех современных оксигенных фо
НАДФ+. В случае линейного транспорта элект
тосинтезирующих организмов, способствовали
ронов примитивная ФС1 так же, как и бРЦ ти
максимальному переключению ФС2 на исполь
па II в аноксигенных бактериях, могла активно
зование воды в качестве донора электронов
использовать Mn2+ бикарбонатные комплексы
и, соответственно, к повышению продуцирова
в качестве доноров электрона. Интересно, что
ния О2.
переключение между циклическим и нецикли
Присутствие все большего количества О2 в
ческим транспортом электронов характерно
фотосинтетической мембране оказывало нега
также для ФС1 современных организмов. Одна
тивное влияние на активность ФС1, поскольку
ко неизвестно, является ли это сохраненным и
вероятность образования активных форм кис
адаптированным свойством бРЦ типа I, кото
лорода около ее РЦ в результате взаимодей
рые были эволюционными предшественниками
ствия О2 с кофакторами цепи переноса электро
ФС1, или это все же заново приобретенный ме
нов довольно высокая [44]. Как предполагается,
ханизм. В пред ФС2 часть электронов цикли
это могло привести к структурным изменениям
ческого транспорта могла акцептироваться дру
в архитектуре РЦ ФС1, направленных на сни
гими молекулами, выпадая из цикла, что вос
жение вероятности образования активных
полнялось электронами от Mn2+ бикарбонат
форм кислорода. В частности, это привело к
ных комплексов.
потере мобильности хиноновых акцепторов и
Предполагается, что молекулярный кисло
погружению их в белковый матрикс [45], а так
род начал накапливаться в атмосфере Земли
же к изменению взаимного расположения ко
∼2,5 млрд лет назад [6]. Однако резкая интенси
факторов цепи переноса электронов [39, 45],
фикация формирования слоистых железных
что вполне могло повлиять и на окружение Р700
формаций (руд) (движущей силой мог быть фо
и, как следствие, на механизм его редокс взаи
тосинтетический О2) произошла гораздо рань
модействия со вторичными донорами электро
ше, ∼3,1 млрд лет назад [6]. Следовательно, к
на. Более того, в результате дальнейшего совер
этому времени уже должно было произойти объ
шенствования водоокисляющего комплекса, в
единение ФС2 и ФС1 в единую ЭТЦ и завер
частности, вовлечения Ca в структуру Mn клас
шиться формирование Mn кластера на донор
тера, появления дополнительных белковых
ной стороне ФС2, окисляющего воду и проду
субъединиц (внешние белки ФС2), во
цирующего О2 в окружающую среду. Примерно
влечения антенных субъединиц в лигандирова
к этому же времени в атмосфере Земли прои
ние Mn кластера [14], возрастал поток электро
зошло резкое снижение концентрации СО2 [40,
нов от ФС2 в ЭТЦ, что могло способствовать
41], поэтому ∼3 млрд лет назад уровень СО2
адаптации донорной стороны ФС1 к макси
практически достиг современного значения.
мально эффективному редокс взаимодействию
Это должно было сопровождаться значитель
со вторичным донором электрона, цитохро
ным снижением в окружающей среде «низкопо
мом с6. В результате могло произойти эволюци
тенциальных» Mn2+ бикарбонатных комплек
онное появление и закрепление гидрофобного
сов, способных к редокс взаимодействию с РЦ,
сэндвича из двух триптофанов перед Р700 и заря
-
однако требующих высокого содержания HCO3
женных аминокислот в окружении P700 (см. вы
[15-19].
ше) [36, 37], обеспечивающих правильную ори
Эволюционное возникновение у пред ФС2
ентацию гема в молекуле цитохрома с6 относи
Mn кластера, и, соответственно, появление
тельно Р700 и высокую скорость переноса элект
способности к окислению воды (т.е. эволюци
рона на Р700. Однако одновременно с этим по
онное возникновение ФС2 и оксигенного фо
добные адаптации донорной стороны ФС1
тосинтеза) привело к снижению роли цикли
практически полностью заблокировали воз
ческого транспорта электронов у этого РЦ. В то
можность эффективного редокс взаимодей
же время снижение доступности доноров элект
ствия между Р+700 и «низкопотенциальными»
ронов в виде Mn2+ бикарбонатных комплексов,
Mn2+ бикарбонатными комплексами, несмотря
БИОХИМИЯ том 85 вып. 6 2020
828
ТЕРЕНТЬЕВ, ЖАРМУХАМЕДОВ
на то, что термодинамически подобное взаимо
Конфликт интересов. Авторы заявляют об от
действие возможно.
сутствии конфликта интересов.
Соблюдение этических норм. В данной работе
отсутствуют исследования, в которых использо
Финансирование. Работа выполнена в рамках
вали в качестве объектов людей или животных.
Госзадания (AAAA A17 117030110136 8).
СПИСОК ЛИТЕРАТУРЫ
1.
Nelson, N., and Yocum, C. F. (2006) Structure and func
cyanobacteria having the different special pair chloro
tion of photosystems I and II, Annu. Rev. Plant Biol., 57,
phylls, Proc. Natl. Acad. Sci., 107, 3924 3929, doi: 10.1073/
521 565, doi: 10.1146/annurev.arplant.57.032905.105350.
pnas.0913460107.
2.
Nelson, N. (2013) Evolution of photosystem I and the con
14.
Umena, Y., Kawakami, K., Shen, J. R., and Kamiya, N.
trol of global enthalpy in an oxidizing world, Photosynth.
(2011) Crystal structure of oxygen evolving photosystem II
Res., 116, 145 151, doi: 10.1007/s11120 013 9902 6.
at a resolution of 1.9 Å, Nature, 473, 5560, doi:
3.
Caffarri, S., Tibiletti, T., Jennings, R., and Santabarbara,
10.1038/nature09913.
S. (2014) A comparison between plant photosystem I and
15.
Dismukes, G. C., Klimov, V. V., Baranov, S. V., Kozlov, Y.
photosystem II architecture and functioning, Curr.
N., DasGupta, J., and Tyryshkin, A. (2001) The origin of
Protein Pept. Sci.,
15,
296 331, doi:
10.2174/
atmospheric oxygen on Earth: the innovation of oxygenic
1389203715666140327102218.
photosynthesis, Proc. Natl. Acad. Sci., 98, 2170 2175,
4.
Blankenship, R. E. (2010) Early evolution of photosynthe
doi: 10.1073/pnas.061514798.
sis, Plant Physiol.,
154,
434438, doi:
10.1104/
16.
Khorobrykh, A. A., Terentyev, V. V., Zharmukhamedov, S.
pp.110.161687.
K., and Klimov, V. V. (2008) Redox interaction of Mn
5.
Allen, J. P., and Williams, J. C. (1998) Photosynthetic
bicarbonate complexes with reaction centres of purple bac
reaction centers, FEBS Lett., 438, 5 9, doi: 10.1016/
teria, Philos. Trans. R. Soc. B Biol. Sci., 363, 1245 1251,
S0014 5793(98)01245 9.
doi: 10.1098/rstb.2007.2221.
6.
Hohmann Marriott, M. F., and Blankenship, R. E. (2011)
17.
Terentyev, V. V., Shkuropatov, A. Y., Shkuropatova, V. A.,
Evolution of photosynthesis, Annu. Rev. Plant Biol., 62,
Shuvalov, V. A., and Klimov, V. V. (2011) Investigation of
515 548, doi: 10.1146/annurev arplant 042110 103811.
the redox interaction between Mn bicarbonate complexes
7.
Heathcote, P., Jones, M. R., and Fyfe, P. K. (2003) Type I
and reaction centers from Rhodobacter sphaeroides R 26,
photosynthetic reaction centres: structure and function,
Chromatium minutissimum, and Chloroflexus aurantiacus,
Philos. Trans. R. Soc. London. Ser. B Biol. Sci., 358, 231
Biochemistry (Moscow), 76, 13601366, doi: 10.1134/
243, doi: 10.1098/rstb.2002.1178.
S0006297911120091.
8.
Blankenship, R. E. (1992) Origin and early evolution of
18.
Khorobrykh, A., Dasgupta, J., Kolling, D. R. J., Terentyev,
photosynthesis, Photosynth. Res.,
33,
91111,
V., Klimov, V. V., and Dismukes, G. C. (2013) Evolutionary
doi: 10.1007/BF00039173.
origins of the photosynthetic water oxidation cluster: bicar
9.
Lin, X., Murchison, H. A., Nagarajan, V., Parson, W. W.,
bonate permits Mn2+ photo oxidation by anoxygenic bac
Allen, J. P., and Williams, J. C. (1994) Specific alteration of
terial reaction centers, Chembiochem, 14, 17251731,
the oxidation potential of the electron donor in reaction
doi: 10.1002/cbic.201300355.
centers from Rhodobacter sphaeroides., Proc. Natl. Acad.
19.
Terentyev, V. V., Khorobrykh, A. A., and Klimov, V. V.
Sci., 91, 10265 10269, doi: 10.1073/pnas.91.22.10265.
(2015) Photooxidation of Mn bicarbonate complexes by
10.
Brettel, K., and Leibl, W. (2001) Electron transfer in pho
reaction centers of purple bacteria as a possible stage in the
tosystem I, Biochim. Biophys. Acta, 1507, 100114,
evolutionary origin of the water oxidizing complex of pho
doi: 10.1016/S0005 2728(01)00202 X.
tosystem II, in: Photosynthesis: New Approaches to the
11.
Semenov, A. Y., Kurashov, V. N., and Mamedov, M. D.
Molecular, Cellular, and Organismal Levels (Allakhverdiev,
(2011) Transmembrane charge transfer in photosynthetic
S. I., ed.) Scrivener Publishing LLC, pp.
85132,
reaction centers: some similarities and distinctions, J.
doi: 10.1002/9781119084150.ch2.
Photochem. Photobiol. B Biol., 104, 326 332, doi: 10.1016/
20.
Kozlov, Y. N., and Kazakova, A. A. (1997) Changes in the
j.jphotobiol.2011.02.004.
redox potential and catalase activity of Mn2+ ions during
12.
Rappaport, F., Guergova Kuras, M., Nixon, P. J., Diner,
formation of Mn bicarbonate complexes, Membr. Cell
B. A., and Lavergne, J. (2002) Kinetics and pathways of
Biol., 11, 115 120.
charge recombination in photosystem II, Biochemistry, 41,
21.
Kozlov, Y. N., Zharmukhamedov, S. K., Tikhonov, K. G.,
8518 8527, doi: 10.1021/bi025725p.
Dasgupta, J., Kazakova, A. A., Dismukes, G. C., and
13.
Allakhverdiev, S. I., Tomo, T., Shimada, Y., Kindo, H.,
Klimov, V. V. (2004) Oxidation potentials and electron
Nagao, R., Klimov, V. V., and Mimuro, M. (2010) Redox
donation to photosystem II of manganese complexes
potential of pheophytin a in photosystem II of two
containing bicarbonate and carboxylate ligands, Phys.
БИОХИМИЯ том 85 вып. 6 2020
ВЗАИМОДЕЙСТВИЕ Мn БИКАРБОНАТНЫХ КОМПЛЕКСОВ С ФС1
829
Chem. Chem. Phys.,
6,
49054911, doi:
10.1039/
behavior of plant photosystem I particles, Russ. J. Plant
b406569g.
Physiol., 56, 599 606, doi: 10.1134/S1021443709050033.
22.
Dasgupta, J., Tyryshkin, A. M., Kozlov, Y. N., Klimov, V. V.,
34.
Petrova, A., Mamedov, M., Ivanov, B., Semenov, A., and
and Dismukes, G. C. (2006) Carbonate complexation of
Kozuleva, M. (2018) Effect of artificial redox mediators on
Mn2+ in the aqueous phase: redox behavior and ligand
the photoinduced oxygen reduction by photosystem I com
binding modes by electrochemistry and EPR spectroscopy,
plexes, Photosynth. Res., 137, 421 429, doi: 10.1007/
J. Phys. Chem. B, 110, 5099 5111, doi: 10.1021/jp055213v.
s11120 018 0514 z.
23.
Tikhonov, K. G., Zastrizhnaya, O. M., Kozlov, Y. N., and
35.
Semenov, A., Cherepanov, D., and Mamedov, M. (2008)
Klimov, V. V. (2006) Composition and catalase like activity
Electrogenic reactions and dielectric properties of photo
of Mn(II) bicarbonate complexes, Biochemistry (Moscow),
system II, Photosynth. Res., 98, 121 130, doi: 10.1007/
71, 1270 1277, doi: 10.1134/S0006297906110137.
s11120 008 9377 z.
24.
Ford, R. C., and Evans, M. C. W. (1983) Isolation of a
36.
Sommer, F., Drepper, F., Haehnel, W., and Hippler, M.
photosystem II preparation from higher plants with highly
(2004) The hydrophobic recognition site formed by
enriched oxygen evolution activity, FEBS Lett., 160, 159
residues PsaA Trp 651 and PsaB Trp 627 of photosystem
164, doi: 10.1016/0014 5793(83)80957 0.
I in chlamydomonas reinhardtii confers distinct selectiv
25.
Porra, R. J., Thompson, W. A., and Kriedemann, P. E.
ity for binding of blastocyanin and cytochrome c6, J.
(1989) Determination of accurate extinction coefficients
Biol. Chem.,
279,
20009 20017, doi:
10.1074/
and simultaneous equations for assaying chlorophylls a and
jbc.M313986200.
b extracted with four different solvents: verification of the
37.
Busch, A., and Hippler, M. (2011) The structure and func
concentration of chlorophyll standards by atomic absorp
tion of eukaryotic photosystem I, Biochim. Biophys. Acta,
tion spectroscopy, Biochim. Biophys. Acta, 975, 384 394,
1807, 864 877, doi: 10.1016/j. bbabio. 2010.09.009.
doi: 10.1016/S0005 2728(89)80347 0.
38.
Hippler, M., Drepper, F., Farah, J., and Rochaix, J. D.
26.
Terentyev, V. V., Shukshina, A. K., and Shitov, A. V. (2019)
(1997) Fast electron transfer from cytochrome c 6 and plas
Carbonic anhydrase CAH3 supports the activity of photo
tocyanin to photosystem I of Chlamydomonas reinhardtii
system II under increased pH, Biochim. Biophys. Acta,
requires PsaF, Biochemistry, 36, 6343 6349, doi: 10.1021/
1860, 582 590, doi: 10.1016/j.bbabio.2019.06.003.
bi970082c.
27.
Humphrey, W., Dalke, A., and Schulten, K. (1996) VMD:
39.
Gisriel, C., Sarrou, I., Ferlez, B., Golbeck, J. H., Redding,
Visual molecular dynamics, J. Mol. Graph., 14, 33 38,
K. E., and Fromme, R. (2017) Structure of a symmetric
doi: 10.1016/0263 7855(96)00018 5.
photosynthetic reaction center-photosystem, Science,
28.
Amunts, A., Toporik, H., Borovikova, A., and Nelson, N.
357, 1021 1025, doi: 10.1126/science.aan5611.
(2010) Structure determination and improved model of
40.
Nunn, J. F. (1998) Evolution of the atmosphere, Proc. Geol.
plant photosystem I, J. Biol. Chem., 285, 3478 3486,
Assoc., 109, 1 13, doi: 10.1016/S0016 7878(98)80001 1.
doi: 10.1074/jbc. M109.072645.
41.
Royer, D. L. (2006) CO2 forced climate thresholds during
29.
Melis, A. (1989) Spectroscopic methods in photosynthesis:
the Phanerozoic, Geochim. Cosmochim. Acta, 70, 5665
photosystem stoichiometry and chlorophyll antenna size,
5675, doi: 10.1016/j.gca.2005.11.031.
Philos. Trans. R. Soc. B Biol. Sci.,
323,
397409,
42.
Johnson, J. E., Webb, S. M., Thomas, K., Ono, S.,
doi: 10.1098/rstb. 1989.0019.
Kirschvink, J. L., and Fischer, W. W. (2013) Manganese
30.
Hu, Q., Miyashita, H., Iwasaki, I., Kurano, N., Miyachi,
oxidizing photosynthesis before the rise of cyanobacteria,
S., Iwaki, M., and Itoh, S. (1998) A photosystem I reaction
Proc. Natl. Acad. Sci., 110, 11238 11243, doi: 10.1073/
center driven by chlorophyll d in oxygenic photosynthesis,
pnas.1305530110.
Proc. Natl. Acad. Sci., 95, 13319 13323, doi: 10.1073/
43.
Okita, P. M., Maynard, J. B., Spiker, E. C., and Force, E.
pnas.95.22.13319.
R. (1988) Isotopic evidence for organic matter oxidation by
31.
Shuvalov, V. A. (1976) The study of the primary photo
manganese reduction in the formation of stratiform man
processes in photosystem I of chloroplasts recombination
ganese carbonate ore, Geochim. Cosmochim. Acta, 52,
luminescence, chlorophyll triplet state and triplet-triplet
2679 2685, doi: 10.1016/0016 7037(88)90036 1.
annihilation, Biochim. Biophys. Acta, 430, 113121,
44.
Kozuleva, M. A., and Ivanov, B. N. (2016) The mecha
doi: 10.1016/0005 2728(76)90227 9.
nisms of oxygen reduction in the terminal reducing seg
32.
Kozlov, Y. N., Tikhonov, K. G., Zastrizhnaya, O. M., and
ment of the chloroplast photosynthetic electron transport
Klimov, V. V. (2010) pH Dependence of the composition
chain, Plant Cell Physiol., 57, 1397 1404, doi: 10.1093/
and stability of MnIII-bicarbonate complexes and its
pcp/pcw035.
implication for redox interaction of MnII with
45.
Orf, G. S., Gisriel, C., and Redding, K. E.
(2018)
photosystemII, J. Photochem. Photobiol. B Biol., 101, 362
Evolution of photosynthetic reaction centers: insights from
366, doi: 10.1016/j.jphotobiol.2010.08.009.
the structure of the heliobacterial reaction center,
33.
Yang, X., Zhang, Y. H., Yang, Z. L., Chen, L. J., He, J. L.,
Photosynth. Res., 138, 11 37, doi: 10.1007/s11120 018
and Wang, R. F. (2009) pH dependence of photosynthetic
0503 2.
БИОХИМИЯ том 85 вып. 6 2020
830
ТЕРЕНТЬЕВ, ЖАРМУХАМЕДОВ
EVOLUTIONARY LOSS OF THE ABILITY OF THE PHOTOSYSTEM I
PRIMARY ELECTRON DONOR FOR THE REDOX INTERACTION
WITH Mn BICARBONATE COMPLEXES
V. V. Terentyev* and S. K. Zharmukhamedov
Institute of Basic Biological Problems, Pushchino Scientific Center for Biological Research,
Russian Academy of Sciences, 142290 Pushchino, Moscow Region,
Russia; E?mail: v.v.terentyev@gmail.com
Received October 14, 2019
Revised February 21, 2020
Accepted April 3, 2020
The structure and functional organization of the photosystem I (PSI) reaction center (RC) donor side has a signifi
cant similarity to the reaction centers of purple bacteria (bRCs), despite the fact that they belong to different types
of RCs. Moreover, the redox potential values of their primary electron donors are identical (∼0.5 V). In our earlier
reports [Khorobrykh et al. (2008) Phylos. Trans. R. Soc. B., 363, 1245 1251; Terentyev et al. (2011) Biochemistry
(Moscow), 76, 1360 1366; Khorobrykh et al. (2018) ChemBioChem, 14, 1725 1731], we have demonstrated redox
interaction of low potential Mn2+ bicarbonate complexes with bRCs, which might have been one of the first steps
in the evolutionary origin of Mn cluster of the photosystem II water oxidizing complex that occurred in the Archean
(over 3 billion years ago). In this study, we investigated redox interactions between Mn2+ bicarbonate complexes and
PSI. Such interactions were almost absent in the original PSI preparations and emerged only in preoxidized PSI
preparations containing ∼50% oxidized RCs. The interaction between Mn2+ bicarbonate complexes and PSI
required increased Mn2+ concentrations, while its dependence on the HCO– concentration indicated involvement
of electroneutral low potential [Mn(HCO3)2] complex in the process. Analysis of the PSI crystal structure revealed
steric hindrances on the RC donor side, which could block the redox interaction between Mn2+ bicarbonate com
plexes and oxidized primary electron donor. Comparison of structures of RCs from the PSI and ancient RCs from
heliobacteria belonging to the same type of RCs suggested that such hindrances should be absent in the primitive PSI
in the Archean and allowed to explain their evolutionary origin as a consequence of PSI RCs into the united elec
tron transport chain (ETC) of the photosynthetic membrane that was accompanied by the evolutionary loss of PSI
capacity for the redox interaction with Mn2+ bicarbonate complexes.
Keywords: photosynthesis, evolution of photosynthesis, photosystem I, photosynthetic reaction centers, Mn bicar
bonate complexes
БИОХИМИЯ том 85 вып. 6 2020