БИОХИМИЯ, 2020, том 85, вып. 6, с. 831 - 839
УДК 577.151.32
ВЛИЯНИЕ ЗАМЕН ОСТАТКА ЦИСТЕИНА В СОСТАВЕ МОТИВА
GCSAG АКТИВНОГО ЦЕНТРА НА СВОЙСТВА ЭСТЕРАЗЫ PMGL2
© 2020
М.В. Крюкова1, Л.Е. Петровская2*, К.А. Новотоцкая$Власова3,
Е.А. Крюкова2, С.А. Якимов2, А.Ю. Николаева1,
К.М. Бойко4, Д.А. Долгих2,5, М.П. Кирпичников2,5
1 НИЦ «Курчатовский институт», 123182 Москва, Россия
2 Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН,
117997 Москва, Россия; электронная почта: lpetr65@yahoo.com
3 Институт физико+химических и биологических проблем почвоведения РАН,
142290 Пущино, Московская обл., Россия
4 Институт биохимии им. А.Н. Баха, ФИЦ «Фундаментальные основы биотехнологии»
Российской академии наук, 119071 Москва, Россия
5 Московский государственный университет имени М.В. Ломоносова,
биологический факультет, 119991 Москва, Россия
Поступила в редакцию 28.02.2020
После доработки 07.04.2020
Принята к публикации 09.04.2020
Эстераза PMGL2, ген которой был обнаружен в результате скрининга метагеномной библиотеки ДНК из
вечномерзлого грунта, относится к семейству HSL (гормон"чувствительной липазы млекопитающих). Ами"
нокислотная последовательность PMGL2 характеризуется наличием не описанного ранее варианта консер"
вативного мотива активного центра GXSXG, включающего остаток Cys173 рядом с каталитическим остат"
ком Ser174. С целью выяснения функциональной роли данного остатка цистеина сконструирован ряд мутант"
ных вариантов PMGL2, содержащих в этом положении остатки треонина, аспарагиновой кислоты или се"
рина, и определены их свойства. Удельная активность мутанта С173D по отношению к п"нитрофенилбути"
рату на 60% выше, чем для фермента дикого типа (wtPMGL2), в то время как вариант C173T/C202S проде"
монстрировал пониженную активность. По отношению к п"нитрофенилоктаноату, вариант С173D активнее
wtPMGL2 на 15%, тогда как замены C173T/C202S понизили активность на 17%. Для мутанта С173D также
характерна высокая активность в области пониженных температур (20-35 °C) при существенной потере
термостабильности. Значение kcat для данного белка на 56% выше, чем для исходного фермента, тогда как
для варианта С173S, который обнаружил наиболее высокую термостабильность среди исследованных му"
тантов, она такая же как для фермента дикого типа. Полученные результаты демонстрируют, что замены
аминокислотных остатков, соседних с каталитическим остатком серина в составе мотива GXSXG, оказыва"
ют существенное влияние на свойства эстеразы PMGL2.
КЛЮЧЕВЫЕ СЛОВА: эстераза PMGL2, семейство HSL, мотив GCSAG, мутагенез, термостабильность,
пространственная структура.
DOI: 10.31857/S0320972520060081
ВВЕДЕНИЕ
ного происхождения находят применение в раз"
личных областях промышленности, включая
Липолитические ферменты (липазы и эсте"
фармакологическую и пищевую отрасли, произ"
разы; триацил"глицерол"ацилгидролазы) ката"
водство бытовой химии и тонкий органический
лизируют реакции гидролиза эфиров глицерина
синтез [2, 3].
и высших карбоновых кислот и широко предс"
Липолитические ферменты относятся к су"
тавлены в царствах животных и растений, а так"
персемейству α/β"гидролаз, характерной осо"
же в бактериях и археях [1, 2]. Липазы микроб"
бенностью строения которых является наличие
центрального (каталитического) домена, имею"
щего структуру α/β"сэндвича, и каталитической
Принятые сокращения: HSL - гормон"чувствитель" триады, включающей остатки серина (нуклео"
ная липаза млекопитающих, wtPMGL2 - эстераза PMGL2
дикого типа, SOE"PCR (splicing by overlapping extension
фил), гистидина и дикарбоновой аминокислоты
PCR) - ПЦР с перекрывающимися праймерами, ПЭГ -
(Asp/Glu) [4, 5]. Большинство подобных белков
полиэтиленгликоль.
содержит также cap"домен, расположенный над
* Адресат для корреспонденции.
активным центром и участвующий в связыва"
831
832
КРЮКОВА и др.
нии субстрата. Структура каталитического до"
ной библиотеки ДНК из вечномерзлых грунтов,
мена характеризуется наличием β"слоя, образо"
что позволило обнаружить ряд генов, кодирую"
ванного 5-11 (обычно восемью) β"тяжами,
щих потенциальные липолитические ферменты
фланкированного α"спиралями [2]. Консерва"
семейства HSL [12, 13]. Установлено, что ката"
тивный участок последовательности, содержа"
литический остаток серина одного из таких
щий каталитический остаток серина, образует
ферментов - эстеразы PMGL2 находится в сос"
т.н. «нуклеофильный локоть» - γ"поворот с нук"
таве последовательности GCSAG, которая явля"
леофилом на вершине. Каталитические остатки
ется новым, ранее не описанным вариантом
дикарбоновой кислоты и гистидина чаще всего
консервативного мотива GXSXG. Были получе"
расположены в петлях, следующих за тяжами β7
ны рекомбинантный белок PMGL2 и определе"
и β8 соответственно.
ны его биохимические свойства [12] и простран"
По классификации, основанной на сходстве
ственная структура [14], а также точечный му"
аминокислотных последовательностей, липоли"
тант C173T/C202S, содержащий остаток трео"
тические ферменты делятся на несколько се"
нина вместо остатка цистеина из мотива
мейств, число которых непрерывно растет за
GCSAG [14]. В данной работе с целью получе"
счет обнаружения новых белков [6, 7]. Семей"
ния дополнительных данных о функциональной
ство IV (семейство гормон"чувствительных ли"
роли остатка Cys173 был сконструирован ряд
паз, HSL) объединяет белки, аминокислотные
новых точечных мутантов эстеразы PMGL2 и
последовательности которых обнаруживают
определены их биохимические свойства.
сходство с последовательностью каталитическо"
го домена HSL липаз млекопитающих [6, 8]. Ха"
рактерной особенностью этих ферментов явля"
МАТЕРИАЛЫ И МЕТОДЫ
ется также наличие консервативного мотива ак"
тивного центра GXSXG, который включает в се"
В работе использовали реактивы фирм «Bio"
бя каталитический остаток серина.
Rad» (США), «Merck» (США), «Panreac» (Испа"
В последние десятилетия развитие метаге"
ния), субстраты для определения липолитичес"
номных подходов открыло широкие возмож"
кой активности «Sigma» (США), органические
ности обнаружения генов новых биокатализато"
растворители производства «Химмед» (Россия).
ров, которые ранее были ограничены доступ"
Растворы готовили на деионизованной воде
ностью геномов микроорганизмов, поддающих"
MilliQ.
ся культивированию в лабораторных условиях
Для множественного выравнивания амино"
[9, 10]. В результате было выделено и охаракте"
кислотных последовательностей использовали
ризовано значительное количество липолити"
алгоритм ClustalOmega [15].
ческих ферментов, в том числе относящихся к
Клонирование рекомбинантных ДНК осущест"
семейству HSL, из различных местообитаний,
вляли стандартными методами в клетках
включая морские, озерные и арктические отло"
Escherichia coli XL"1 Blue («Stratagene»). Исполь"
жения, лесные и горные почвы [7, 11].
зовали ферменты производства «Thermo Fisher
Ранее нами были проведены конструирова"
Scientific» (США). Олигонуклеотиды были син"
ние и функциональный скрининг метагеном"
тезированы в «Евроген» (Россия). Ген мутантно"
го варианта C173T/C202S был получен нами ра"
нее [14]. Для конструирования мутантов ис"
Таблица 1. Нуклеотидные последовательности праймеров,
пользовали двухступенчатый SOE"PCR c прай"
использованных для конструирования генов мутантных
мерами, приведенными в табл. 1. Мутантные ге"
вариантов эстеразы PMGL2
ны клонировали в вектор pET32a («Novagen»,
США), как и ген исходного белка, и подтверж"
Обозначение
Нуклеотидная последовательность, 5′-3′
дали последовательность секвенированием
(«Евроген»).
C173Tfor
CTTCGGCACCTCGGCGG
Выделение рекомбинантных белков, опреде"
C173Trev
CGCCGAGGTGCCGAAGATG
ление липолитической активности и стабиль"
C202Sfor
GCACCCTGAGCGGCACC
ности проводили как описано ранее [12]. Изме"
C202Srev
GTGCCGCTCAGGGTGCC
рение липолитической активности осуществля"
C173Sfor
CTTCGGCTCCTCGGCGG
ли спектрофотометрическим методом после ин"
кубации белка (1 мкг/мл) с 0,25 mM п"нитрофе"
C173Srev
CGCCGAGGAGCCGAAGATG
нилбутиратом (С4) в буфере 50 mM CHES"
C173Dfor
CTTCGGCGACTCGGCGG
NaOH, pH 8,5, 100 mM NaCl в течение 15 мин
C173Drev
CGCCGAGTCGCCGAAGATG
при 45 °C. Реакцию останавливали добавлением
SDS до 2%. Светопоглощение при 415 нм изме"
БИОХИМИЯ том 85 вып. 6 2020
МУТАНТНЫЕ ВАРИАНТЫ ЭСТЕРАЗЫ PMGL2
833
ряли с помощью планшетного ридера Model 680
последовательностей липолитических ферментов
(«Bio"Rad»).
семейства HSL, гомологичных wtPMGL2, было
Кинетические параметры реакции опреде"
установлено, что в положении N"1 по отноше"
ляли, варьируя концентрацию субстрата в диа"
нию к каталитическому остатку Ser174 чаще
пазоне 0,3-2,1 мМ. Реакцию проводили в тече"
всего обнаруживается один из следующих остат"
ние 1 мин, концентрация фермента в реакцион"
ков - треонин, серин или аспартат (рис. 1, а).
ной смеси составляла 3 мкг/мл. Значения Km и
Соответственно нами были получены и иссле"
Vmax оценивали методом нелинейной регрессии
дованы три точечных мутанта PMGL2
-
с помощью программы Origin 8 с использовани"
C173T/C202S, C173S и С173D. Мутагенез остат"
ем уравнения Михаэлиса-Ментен.
ка Cys202 при получении первого мутанта был
Аналитическую гель$фильтрацию проводили
проведен с целью предотвращения его участия в
на колонке Superdex
75
10/300 GL
(«GE
замыкании межмолекулярных дисульфидных
Healthcare») при скорости потока 0,4 мл/мин в
связей, однако в результате исследований
буфере 100 мМ Tris"HCl, рН 8,0, 150 мМ NaCl.
пространственной структуры показано, что бо"
Детекцию белка осуществляли по светопогло"
ковая цепь этого остатка направлена внутрь бел"
щению при 230 нм.
ковой глобулы и практически недоступна для
растворителя [12, 14]. Гены мутантных вариан"
тов PMGL2 были сконструированы с помощью
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
ПЦР и клонированы в вектор pET32а под конт"
ролем промотора Т7lac аналогично гену PMGL2
Конструирование мутантных вариантов
дикого типа. Экспрессию полученных генов и
PMGL2. В результате сравнения аминокислотных выделение мутантных белков проводили соглас"
M
1
2
3
4
Рис. 1. Получение и свойства мутантных вариантов PMGL2. а - Выравнивание аминокислотных последовательностей эс"
тераз семейства HSL, содержащих различные варианты мотива GXSXG, с помощью ClustalOmega. Показан участок
152-191 (нумерация wtPMGL2), содержащий каталитический остаток серина (обозначен черным кружком). 4Q3O - эс"
тераза MGS"MT1 [16]; 4Q05 - эстераза Е25 [17]; 3K6K - эстераза EstE7; б - электрофорез в 13%"ном SDS"ПААГ по Лэм"
мли очищенного белка wtPMGL2 (дорожка 1) и мутантов C173T/C202S (дорожка 2), C173S (дорожка 3), С173D (дорож"
ка 4). М - маркеры мол. массы (кДа); в - гель"фильтрационный анализ wtPMGL2 и мутантных вариантов на колонке
Superdex 75. Расчетная мол. масса PMGL2 составляет 37,5 кДа, время выхода с колонки 23,8 мин. Штриховыми линиями
обозначены время выходов бычьего сывороточного альбумина (24,3 мин, мол. масса 66,5 кДа) и овальбумина (27,4 мин,
43 кДа). Данные гель"фильтрационного анализа wtPMGL2 и мутанта C173T/C202S взяты из ранней публикации [14].
journal/biokhsm/)
6 БИОХИМИЯ том 85 вып. 6 2020
834
КРЮКОВА и др.
Липолитическая активность мутантных вари$
антов PMGL2. Ранее нами было установлено,
что максимальный уровень липолитической ак"
тивности PMGL2 наблюдается при 45 °C с ис"
пользованием п"нитрофенилбутирата (С4) в ка"
честве субстрата [12]. Измерения липолитичес"
кой активности мутантных вариантов PMGL2
проводили в данных условиях. Удельная актив"
ность варианта С173D превысила удельную ак"
тивность PMGL2 на 60% и составила 3200 ед/мг,
в то время как вариант C173T/C202S продемон"
стрировал пониженную активность (60% от ак"
тивности PMGL2, 1215 ед/мг). Белок C173S об"
ладал удельной активностью, сопоставимой с
исходным ферментом (2330 ед/мг).
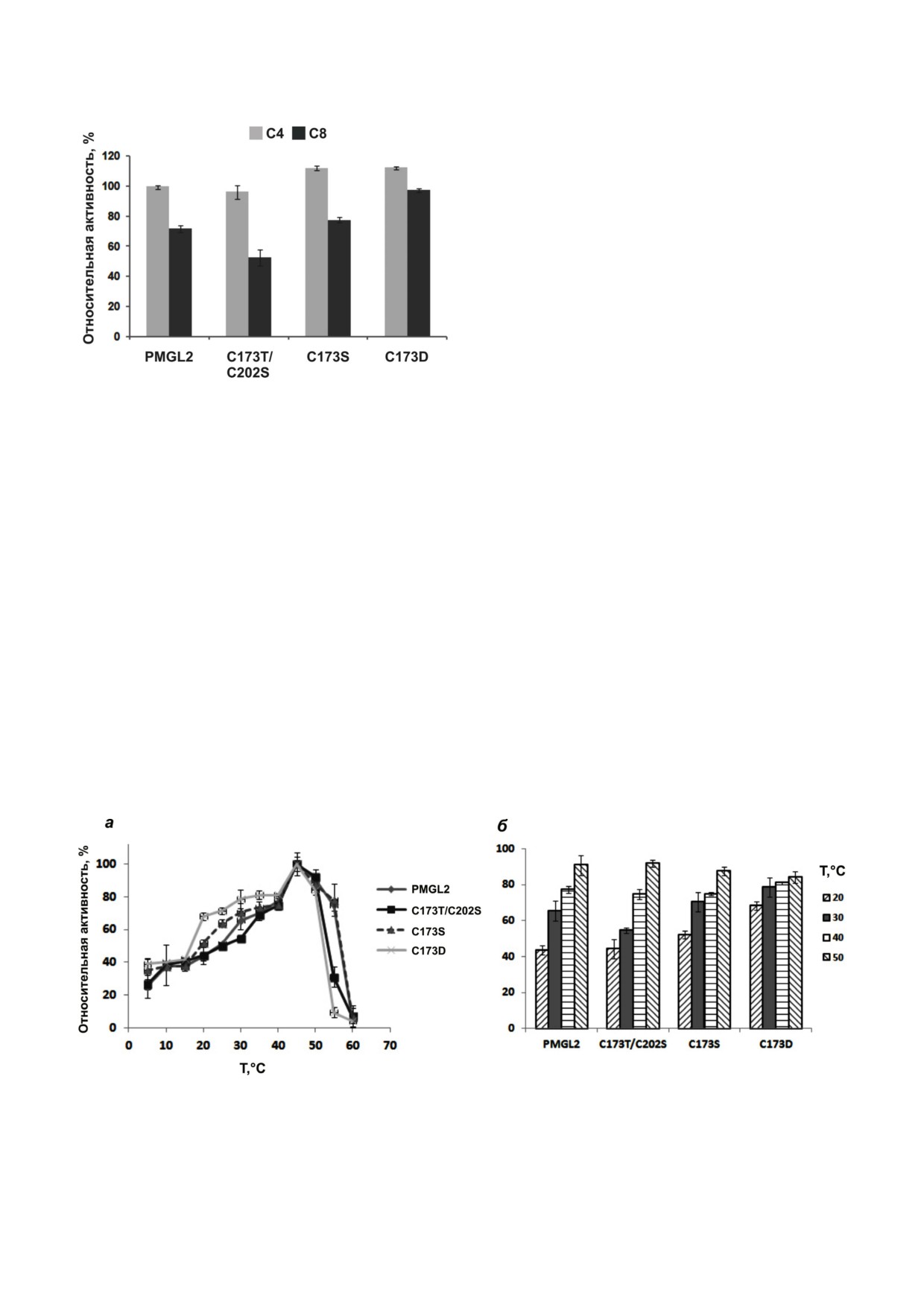
Рис. 2. Специфичность PMGL2 и его мутантов по отноше"
Исследование субстратной специфичности
нию к субстратам. Реакцию проводили в стандартных ус"
полученных мутантов показало, что, как и для
ловиях с субстратами с разной длиной углеводородной це"
пи (C4, C8). Активность wtPMGL2 по отношению к п"нит"
PMGL2, предпочтительным субстратом для них
рофенилбутирату принята за 100%. Представлены средние
является п"нитрофенилбутират (С4) (рис. 2). По
значения из трех повторностей ± стандартное отклонение
сравнению с PMGL2, вариант С173D продемо"
нстрировал увеличенную на 15% активность по
отношению к п"нитрофенилоктаноату (С8), в то
но протоколу, описанному для wtPMGL2 [12]. С
же время активность мутанта C173T/C202S,
помощью белкового электрофореза в присут"
напротив, была на 17% снижена. Активность ис"
ствии SDS показано, что все мутантные белки
следованных белков по отношению к субстра"
демонстрируют высокую чистоту и электрофо"
там большей длины (С10, С12, С16) оказалась
ретическую подвижность, соответствующую
незначительной.
расчетной мол. массе (рис. 1, б).
Для определения температурной зависимос"
Монодисперсность выделенных белков была
ти липолитической активности мутантных ва"
подтверждена с помощью аналитической гель"
риантов PMGL2 реакцию проводили с исполь"
фильтрации на предварительно откалиброван"
зованием п"нитрофенилбутирата (С4) в качест"
ной колонке Superdex 75 (рис. 1, в). Установле"
ве субстрата в диапазоне температур 5-60 °C
но, что время выхода с колонки мутантных ва"
(рис. 3, а). Температурный оптимум активности
риантов PMGL2 составляет 23,8 мин, что соот"
мутантных белков составил 45 °C, как и у дико"
ветствует димерной форме аналогично исходно"
го типа. Для всех вариантов наблюдалось резкое
му белку [14].
падение активности при повышении температу"
Рис. 3. а - Зависимость активности PMGL2 и мутантных вариантов от температуры. Ферменты инкубировали в реакци"
онной смеси, содержавшей 50 мM CHES"NaOH, pH 8,5, 100 мM NaCl и 0,25 мМ С4 в течение 15 мин при указанной тем"
пературе; б - сравнение относительной активности PMGL2 и мутантных вариантов при 20, 30, 40 и 50 °C. Активность при
45 °C принята за 100%. Представлены средние значения трех опытов ± стандартное отклонение
БИОХИМИЯ том 85 вып. 6 2020
МУТАНТНЫЕ ВАРИАНТЫ ЭСТЕРАЗЫ PMGL2
835
ры реакционной смеси до 60 °C. При температу"
ре 55 °С активность PMGL2 и C173S оставалась
достаточно высокой (75 и 78% от максималь"
ной), в то время как активность мутантов
C173T/C202S и С173D существенно снижалась
и составляла 31 и 9,5% соответственно. По срав"
нению с белком дикого типа и другими мутанта"
ми, вариант С173D показал наибольшую актив"
ность в области пониженных температур
(20-35 °C). Так, его активность при 20 °C соста"
вила 68% от максимальной, тогда как для
wtPMGL2 - лишь 44% (рис. 3, б). Более высо"
кую активность в этой области, по сравнению с
исходным ферментом (52% от максимальной),
имел также вариант C173S.
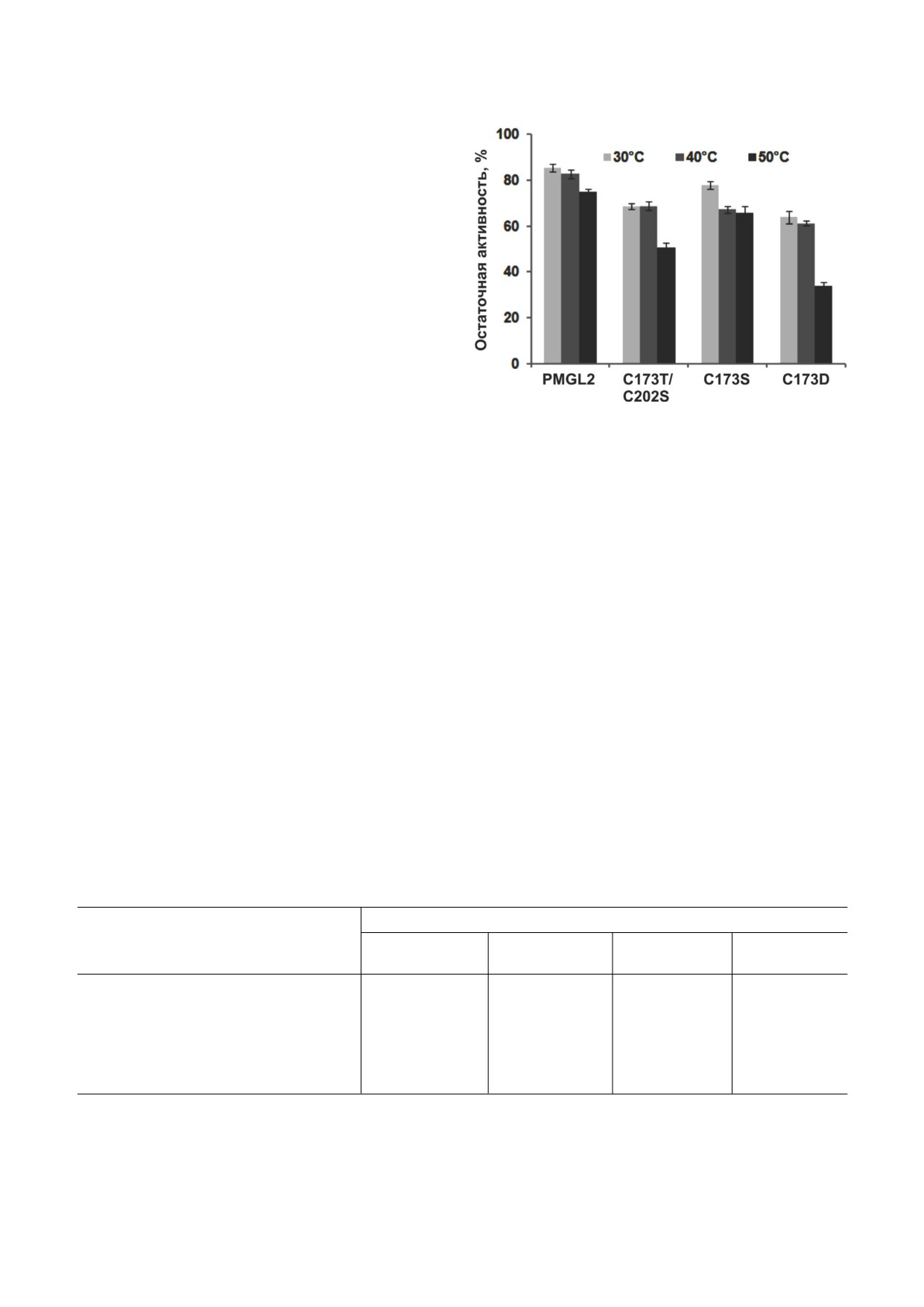
Термостабильность мутантных вариантов
PMGL2. В предыдущей работе нами было пока"
Рис. 4. Анализ температурной стабильности мутантных ва"
зано, что wtPMGL2 обладает относительно вы"
риантов PMGL2. Белки инкубировали в реакционной сме"
сокой термостабильностью и выдерживает ин"
си без субстрата при 30, 40 и 50 °C в течение 1 ч, остаточ"
ную активность измеряли в стандартных условиях с
кубацию в течение 1 ч при 45 °C без существен"
0,25 мМ С4. Активность до прогрева принимали за 100%.
ной потери активности [12]. Остаточная актив"
Представлены средние значения трех экспериментов
ность этого фермента после инкубации в тече"
± стандартное отклонение
ние 1 ч при 40 °С составила 85,5% от исходной, а
при 50 °С - 75% (рис. 4). Аналогичные экспери"
менты, проведенные для мутантных вариантов,
продемонстрировали, что они обладают пони"
фермент дикого типа, в то время как для мутан"
женной стабильностью по сравнению с исход"
та С173D Km выше в 1,3 раза, а для мутанта
ным ферментом. Активность мутанта C173T/
C173T/C202S - в 1,7 раза [14]. По «числу оборо"
C202S в результате инкубации при 40 °С умень"
тов» (kcat) мутант C173S похож на фермент дико"
шалась до 68% от исходной, а при 50 °С - до
го типа, а для C173T/C202S и С173D этот пара"
51%. Наиболее стабильным оказался мутант
метр выше в 1,3 и 1,6 раза соответственно. Уве"
C173S, сохранявший после прогрева 67 и 66%
личение Km привело к уменьшению каталити"
активности соответственно. Существенное сни"
ческой эффективности (kcat/Km) варианта
жение термостабильности обнаружил вариант
C173T/C202S на 24%, что отразилось в наблюда"
С173D. После прогрева при 40 °С он сохранил
емом понижении удельной активности данного
61% активности, а после инкубации при 50 °С -
белка, измеренной при ненасыщающей концен"
всего лишь 34%.
трации субстрата (0,25 мМ). Каталитическая
Кинетические параметры реакции мутантных
эффективность варианта C173S примерно такая
вариантов PMGL2. Как видно из табл. 2, по ве"
же как для wtPMGL2, а для варианта С173D она
личине Km мутантный вариант C173S похож на
в 1,2 раза выше (табл. 2).
Таблица 2. Кинетические параметры реакции wtPMGL2 и мутантных вариантов
Численное значение
Параметр
wtPMGL2
C173T/C202S
C173S
С173D
Km, мМ
1,13 ± 0,10
1,88 ± 0,06
1,03 ± 0,05
1,45 ± 0,07
kcat, с-1
38 ± 1
48 ± 1
36 ± 0,6
59 ± 1
kcat/Km, с-1/мМ-1*
33 (100%)
25 (76%)
35 (106%)
41 (124%)
* В скобках приведен процент по отношению к величине kcat/Km для wtPMGL2.
Измерения проводили в буфере 50 мM CHES"NaOH, pH 8,5, 100 мM NaCl при 45 °C с использованием п"нитрофенилбу"
тирата (С4) в качестве субстрата в диапазоне концентраций 0,3-2,1 мМ.
БИОХИМИЯ том 85 вып. 6 2020
6*
836
КРЮКОВА и др.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
зультате мутагенеза эстеразы Thermogutta terri+
fontis [23], холодоактивной липазы Salinisphaera
Сайт"направленный мутагенез аминокис"
sp. P7"4 [24] и липазы MgMDL2 Malassezia glo+
лотных остатков, расположенных рядом с остат"
bosa [25].
ками, образующими каталитическую триаду,
В настоящей работе впервые исследовано
широко используется в белковой инженерии
влияние замен аминокислотных остатков, явля"
липолитических ферментов, в том числе отно"
ющихся частью консервативного мотива
сящихся к семейству HSL, с целью повышения
GXSXG, на свойства эстеразы PMGL2, относя"
их термостабильности, изменения субстратной
щейся к семейству HSL. Классическим вариан"
специфичности и энантиоселективности [18,
том данного мотива считается GDSAG, который
19]. Так, замена в молекуле эстеразы PsyEst из
обнаруживается в последовательностях большин"
психрофильной бактерии Psychrobacter sp.
ства микробных липолитических ферментов
Ant300 остатка глицина, расположенного в пет"
данного семейства. Недавно в последователь"
ле по соседству с активным центром, на остаток
ностях ряда эстераз, полученных в результате
пролина привела к значительному увеличению
скрининга метагеномной библиотеки ДНК из
времени полуинактивации фермента [20]. Мутант"
литоральных отложений, был обнаружен новый
ный вариант эстеразы E. coli R48S отличался от
вариант этого мотива GTSAG, что послужило
исходного белка повышенной каталитической
основанием для выделения содержащих его бел"
эффективностью (величина kcat возросла в три
ков в отдельное подсемейство [26]. В результате
раза), а также более высокой термостабиль"
выравнивания последовательностей липолити"
ностью [21]. Замены остатков Мet211 и Arg215,
ческих ферментов, относящихся к семейству
находящихся в участке связывания субстрата
HSL, установлено, что в положении N"1, где N
термофильной эстеразы 2 Alicyclobacillus acido+
обозначает нуклеофил (остаток серина), могут
caldarius, существенно увеличивали эффектив"
находиться остатки Asp (Glu), Thr, Ser, Cys [17].
ность расщепления длинноцепочечных субстра"
Для уточнения роли остатка цистеина в данном
тов [22]. Аналогичный эффект наблюдался в ре"
положении на свойства липолитических фер"
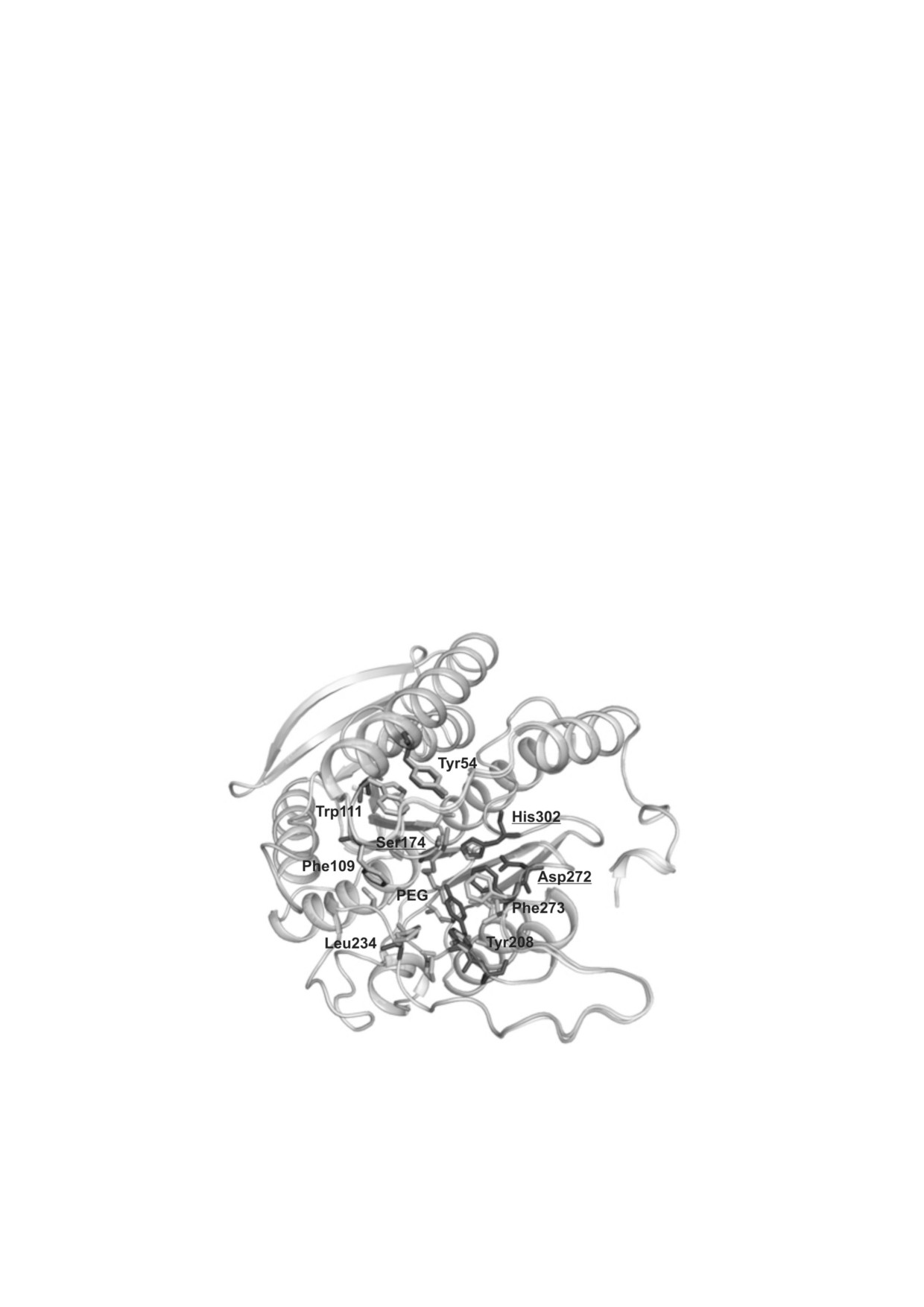
Рис. 5. Наложение пространственных структур wtPMGL2 (PDB 6QIN) и mPMGL2 (PDB 6QLA), выполненное с помощью
программы COOT [32]. Показаны аминокислотные остатки, входящие в каталитическую триаду (подчеркнуты) и образу"
ющие участок связывания субстрата. Темно"серым цветом обозначены боковые цепи остатков, относящихся к wtPMGL2,
а также молекула ПЭГ в структуре мутантной формы фермента. Для остатка Tyr208 в структуре wtPMGL2 приведены два
положения боковой цепи, наблюдаемые в кристаллической структуре
БИОХИМИЯ том 85 вып. 6 2020
МУТАНТНЫЕ ВАРИАНТЫ ЭСТЕРАЗЫ PMGL2
837
ментов семейства HSL ранее мы сконструирова"
было показано, что для этого мутанта характер"
ли мутант С173Т/C202S [14]. В данной работе
но более высокое значение константы Михаэ"
были дополнительно получены и охарактеризо"
лиса по сравнению с белком дикого типа [14].
ваны мутанты С173S и С173D. Были определе"
Каталитическая эффективность данного мутан"
ны субстратная специфичность, температурный
та оказалась сниженной на 24%. Сравнение
оптимум, термостабильность мутантных вари"
пространственных структур активного центра
антов, а также кинетические параметры катали"
wtPMGL2 и мутанта C173T/C202S не обнаружи"
зируемой ими реакции.
ло существенных различий между ними за иск"
Установлено, что мутант С173S по удельной
лючением присутствия в активном центре му"
активность, температурному профилю актив"
танта молекулы ПЭГ, входившей в состав крис"
ности и термостабильности и кинетическим
таллизационной смеси [14]. Наблюдаемые раз"
константам очень похож на исходный белок.
личия в конформациях некоторых остатков,
Мутантный вариант С173D проявил повышен"
например, Phe273 и Tyr208, по"видимому, связа"
ную на 15% активность по п"нитрофенилокта"
ны с присутствием молекулы ПЭГ в участке свя"
ноату и повышенную активность по п"нитрофе"
зывания субстрата мутантной формы (рис. 5).
нилбутирату в температурном диапазоне
Можно предположить, что причиной измене"
20-35 °C, а также существенное снижение тер"
ния каталитических характеристик варианта
мостабильности по сравнению с диким типом и
C173T/C202S является различная конформаци"
другими мутантами. График температурной за"
онная подвижность остатков, образующих
висимости эстеразной активности С173D при"
субстрат"связывающий «карман» белка дикого
обрел более «сглаженный» вид (рис. 3), что ра"
типа и мутантной формы.
нее было продемонстрировано нами для неко"
Таким образом, в результате проведенной
торых липолитических ферментов психротроф"
работы показано, что замены аминокислотных
ной бактерии Psychrobacter cryohalolentis K5T
остатков, входящих в состав консервативного
[27-29]. Для данного варианта значение kcat ока"
мотива GXSXG, приводят к изменению свойств
залось на 56%, а значение Km - на 30 % выше,
PMGL2 и, возможно, других липолитических
чем соответствующие параметры wtPMGL2.
ферментов семейства HSL. Полученные данные
Повышение каталитической константы kcat фер"
могут быть использованы для дальнейшей опти"
ментов является одной из адаптивных страте"
мизации каталитических характеристик
гий, направленных на нейтрализацию негатив"
PMGL2, а также других ферментов, относящих"
ного воздействия низких температур у приспо"
ся к данному семейству.
собленных к холодным местообитаниям орга"
низмов. Также холодоактивные ферменты дос"
таточно часто демонстрируют более высокие
Финансирование. Работу проводили при час"
значения Km по сравнению с гомологами из ме"
тичной финансовой поддержке гранта РФФИ
зофильных организмов [30]. Таким образом,
№ 18"04"00491 и Программы РАН «Молекуляр"
свойства мутанта С173D оказались приближен"
ная и клеточная биология».
ными к свойствам холодоактивных ферментов
Конфликт интересов. Авторы заявляют об от"
[30, 31].
сутствии конфликта интересов.
В данной работе была обнаружена понижен"
Соблюдение этических норм. В статье отсут"
ные удельная активность и термостабильность
ствуют исследования, в которых в качестве объ"
мутантного варианта C173T/C202S. Ранее нами
ектов использовали людей или животных.
СПИСОК ЛИТЕРАТУРЫ
1.
Casas"Godoy, L., Duquesne, S., Bordes, F., Sandoval, G.,
4.
Ollis, D. L., Cheah, E., Cygler, M., Dijkstra, B., Frolow, F.,
and Marty, A. (2012) in Lipases and Phospholipases
Franken, S. M., Harel, M., Remington, S. J., Silman, I.,
(Sandoval, G. ed.), Humana Press, pp. 3"30, doi: 10.1007/
and Schrag, J. (1992) The α/β hydrolase fold, Protein Eng.,
978"1"61779"600"5_1.
5, 197"211, doi: 10.1093/protein/5.3.197.
2.
Gaur, R., Hemamalini, R., and Khare, S. (2017) in
5.
Nardini, M., and Dijkstra, B. W. (1999) α/β Hydrolase fold
Current Developments in Biotechnology and Bioengineer+
enzymes: the family keeps growing, Curr. Opin. Struct.
ing (Pandey, A. N. S., and Soccol, C. R., eds)
Biol., 9, 732"737, doi: 10.1016/S0959"440X(99)00037"8.
Elsevier, pp. 175"198, doi: 10.1016/B978"0"444"63662"
6.
Arpigny, J., and Jaeger, K. (1999) Bacterial lipolytic
1.00008"7.
enzymes: classification and properties, Biochem. J., 343,
3.
Romano, D., Bonomi, F., Mattos, M. C., Fonseca, T. D.,
177"183, doi: 10.1042/bj3430177.
Oliveira, M. D. F., and Molinari, F. (2015) Esterases as
7.
Ferrer, M., Bargiela, R., Mart nez Mart nez, M., Mir, J.,
stereoselective biocatalysts, Biotechnol. Adv., 33, 547"565,
Koch, R., Golyshina, O. V., and Golyshin, P. N. (2015)
doi: 10.1016/j.biotechadv.2015.01.006.
Biodiversity for biocatalysis: a review of the α/β"hydrolase
БИОХИМИЯ том 85 вып. 6 2020
838
КРЮКОВА и др.
fold superfamily of esterases"lipases discovered in
19.
Jochens, H., Hesseler, M., Stiba, K., Padhi, S. K.,
metagenomes, Biocat. Biotrans.,
33,
235"249, doi:
Kazlauskas, R. J., and Bornscheuer, U. T. (2011) Protein
10.3109/10242422.2016.1151416.
engineering of alpha/beta"hydrolase fold enzymes,
8.
Kim, T. D. (2017) Bacterial hormone"sensitive lipases
Chembiochem, 12, 1508"1517, doi: 10.1002/cbic.201000771.
(bHSLs): Emerging enzymes for biotechnological applica"
20.
Kulakova, L., Galkin, A., Nakayama, T., Nishino, T., and
tions, J. Microbiol. Biotechnol., 27, 1907"1915, doi:
Esaki, N. (2004) Cold"active esterase from Psychrobacter
10.4014/jmb.1708.08004.
sp. Ant300: gene cloning, characterization, and the effects
9.
Mirete, S., Morgante, V., and González"Pastor, J. E.
of Gly→Pro substitution near the active site on its catalyt"
(2016) Functional metagenomics of extreme environ"
ic activity and stability, Biochim. Biophys. Acta, 1696, 59"
ments, Curr. Opin. Biotech., 38, 143"149, doi: 10.1016/
65, doi: 10.1016/j.bbapap.2003.09.008.
j.copbio.2016.01.017.
21.
Kobayashi, R., Hirano, N., Kanaya, S., Saito, I., and
10.
Handelsman, J. (2004) Metagenomics: application of
Haruki, M. (2010) Enhancement of the enzymatic activity
genomics to uncultured microorganisms, Microbiol. Mol.
of Escherichia coli acetyl esterase by random mutagenesis,
Biol. Rev., 68, 669"685, doi: 10.1128/MMBR.68.4.669"
J. Mol. Cat. B: Enzymatic, 67, 155"161, doi: 10.1016/
685.2004.
j.molcatb.2010.08.003.
11.
López López, O., Cerdán, M. E., and Siso, M. I. G.
22.
Manco, G., Mandrich, L., and Rossi, M. (2001) Residues
(2014) New extremophilic lipases and esterases from
at the active site of the esterase 2 from Alicyclobacillus aci+
metagenomics, Curr. Prot. Pept. Sci., 15, 445"455, doi:
docaldarius involved in substrate specificity and catalytic
10.2174/1389203715666140228153801.
activity at high temperature, J. Biol. Chem., 276, 37482"
12.
Petrovskaya, L. E., Novototskaya"Vlasova, K. A.,
37490, doi: 10.1074/jbc.M103017200.
Spirina, E. V., Durdenko, E. V., Lomakina, G. Y.,
23.
Sayer, C., Isupov, M. N., Bonch"Osmolovskaya, E., and
Zavialova, M. G., Nikolaev, E. N., and Rivkina, E. M.
Littlechild, J. A. (2015) Structural studies of a thermophilic
(2016) Expression and characterization of a new esterase
esterase from a new Planctomycetes species, Thermogutta
with GCSAG motif from a permafrost metagenomic
terrifontis, FEBS J., 282, 2846"2857, doi: 10.1111/
library, FEMS Microbiol. Ecol., 92, fiw046, doi: 10.1093/
febs.13326.
femsec/fiw046.
24.
Kim, B. Y., Yoo, W., Huong Luu Le, L. T., Kim, K. K.,
13.
Petrovskaya, L. E., Novototskaya"Vlasova, K. A., Gapizov,
Kim, H. W., Lee, J. H., Kim, Y. O., and Kim, T. D. (2019)
S. S., Spirina, E. V., Durdenko, E. V., and Rivkina, E. M.
Characterization and mutation anaylsis of a cold"active
(2017) New member of the hormone"sensitive lipase
bacterial hormone"sensitive lipase from Salinisphaera sp.
family from the permafrost microbial community,
P7"4, Arch. Biochem. Biophys., 663, 132"142, doi: 10.1016/
Bioengineered, 8, 420"423, doi: 10.1080/21655979.2016.
j.abb.2019.01.010.
1230571.
25.
Lan, D., Xu, H., Xu, J., Dubin, G., Liu, J., Khan, F. I.,
14.
Boyko, K. M., Kryukova, M. V., Petrovskaya, L. E.,
and Wang, Y. (2017) Malassezia globosa MgMDL2 lipase:
Nikolaeva, A. Y., Korzhenevsky, D. A., Novototskaya"
Crystal structure and rational modification of substrate
Vlasova, K. A., Rivkina, E. M., Dolgikh, D. A.,
specificity, Biochem. Biophys. Res. Commun., 488, 259"265,
Kirpichnikov, M. P., and Popov, V. O. (2020) Crystal struc"
doi: 10.1016/j.bbrc.2017.04.103.
ture of PMGL2 esterase from the hormone"sensitive lipase
26.
Jeon, J. H., Lee, H. S., Kim, J. T., Kim, S. J., Choi, S. H.,
family with GCSAG motif around the catalytic serine,
Kang, S. G., and Lee, J. H. (2012) Identification of a new
PLoS One, 15, e0226838, doi: 10.1371/journal.pone.
subfamily of salt"tolerant esterases from a metagenomic
0226838.
library of tidal flat sediment, Appl. Microbiol. Biotechnol.,
15.
Madeira, F., Park, Y. M., Lee, J., Buso, N., Gur, T.,
93, 623"631, doi: 10.1007/s00253"011"3433"x.
Madhusoodanan, N., Basutkar, P., Tivey, A. R. N.,
27.
Novototskaya"Vlasova, K., Petrovskaya, L., Yakimov, S.,
Potter, S. C., Finn, R. D., and Lopez, R. (2019) The
and Gilichinsky, D. (2012) Cloning, purification, and
EMBL"EBI search and sequence analysis tools APIs in
characterization of a cold adapted esterase produced by
2019, Nucleic Acids Res., 47, W636"W641, doi: 10.1093/
Psychrobacter cryohalolentis K5T from Siberian cryopeg,
nar/gkz268.
FEMS Microbiol. Ecol., 82, 367"375, doi: 10.1111/j.1574"
16.
Alcaide, M., Stogios, P. J., Lafraya, Б., Tchigvintsev, A.,
6941.2012.01385. x.
Flick, R., Bargiela, R., Chernikova, T. N., Reva, O. N.,
28.
Novototskaya"Vlasova, K., Petrovskaya, L., Kryukova, E.,
Hai, T., Leggewie, C. C., Katzke, N., La Cono, V.,
Rivkina, E., Dolgikh, D., and Kirpichnikov, M. (2013)
Matesanz, R., Jebbar, M., Jaeger, K."E., Yakimov, M. M.,
Expression and chaperone"assisted refolding of a new cold"
Yakunin, A. F., Golyshin, P. N., Golyshina, O. V.,
active lipase from Psychrobacter cryohalolentis K5T, Protein
Savchenko, A., Ferrer, M., and Consortium, T. M. (2015)
Expr. Purif., 91, 96"103, doi: 10.1016/j.pep.2013.07.011.
Pressure adaptation is linked to thermal adaptation in salt"
29.
Novototskaya"Vlasova, K., Petrovskaya, L., Rivkina, E.,
saturated marine habitats, Environ. Microbiol., 17, 332"
Dolgikh, D., and Kirpichnikov, M. (2013) Characterization
345, doi: 10.1111/1462"2920.12660.
of a cold"active lipase from Psychrobacter cryohalolentis
17.
Li, P. Y., Ji, P., Li, C. Y., Zhang, Y., Wang, G. L.,
K5T and its deletion mutants, Biochemistry (Moscow), 78,
Zhang, X. Y., Xie, B. B., Qin, Q. L., Chen, X. L., Zhou, B. C.,
385"394, doi: 10.1134/S000629791304007X.
and Zhang, Y. Z. (2014) Structural basis for dimerization
30.
Siddiqui, K. S., and Cavicchioli, R. (2006) Cold"adapted
and catalysis of a novel esterase from the GTSAG motif
enzymes, Annu. Rev. Biochem., 75, 403"433, doi: 10.1146/
subfamily of the bacterial hormone"sensitive lipase family,
annurev.biochem.75.103004.142723.
J. Biol. Chem., 289, 19031"19041, doi: 10.1074/jbc.M114.
31.
Feller, G., and Gerday, C. (2003) Psychrophilic enzymes:
574913.
hot topics in cold adaptation, Nat. Rev. Microbiol., 1, 200"
18.
Kourist, R., Brundiek, H., and Bornscheuer, U. T. (2010)
208, doi: 10.1038/nrmicro773.
Protein engineering and discovery of lipases, Europ. J.
32.
Emsley, P., and Cowtan, K. (2004) Coot: Model"building
Lipid Sci. Technol.,
112,
64"74, doi:
10.1002/ejlt.
tools for molecular graphics, Acta Crystallogr. D Biol.
200900143.
Crystallogr., 60, 2126"2132, doi: 10.1107/S0907444904019158.
БИОХИМИЯ том 85 вып. 6 2020
МУТАНТНЫЕ ВАРИАНТЫ ЭСТЕРАЗЫ PMGL2
839
THE INFLUENCE OF SUBSTITUTIONS OF THE CYSTEINE RESIDUE
IN GCSAG MOTIF OF THE ACTIVE CENTER
ON THE PROPERTIES OF THE PMGL2 ESTERASE
M. V. Kryukova1, L. E. Petrovskaya2*, K. A. Novototskaya$Vlasova3, E. A. Kryukova2,
S. A. Yakimov2, A. Y. Nikolaeva1, K. M. Boyko4, D. A. Dolgikh2,5, and M. P. Kirpichnikov2,5
1 Kurchatov Complex of NBICS+Technologies, National Research Centre “Kurchatov Institute”, 123182 Moscow, Russia
2 Shemyakin-Ovchinnikov Institute of Bioorganic Chemistry, Russian Academy of Sciences,
117997 Moscow, Russia; E+mail: lpetr65@yahoo.com
3 Institute of Physicochemical and Biological Problems in Soil Science,
Russian Academy of Sciences, 142290 Pushchino, Moscow Region, Russia
4 Bach Institute of Biochemistry, Research Center of Biotechnology
of the Russian Academy of Sciences, 119071 Moscow, Russia
5 Lomonosov Moscow State University, Department of Biology, 119991 Moscow, Russia
Receive February 28, 2020
Revised April 7, 2020
Accepted April 9, 2020
The gene coding for PMGL2 esterase, which belongs to the family of mammalian hormone"sensitive lipases (HSLs),
was discovered by screening a metagenomic DNA library from a permafrost soil. The active site of PMGL2 contains
conserved GXSXG motif which includes Cys173 residue next to the catalytic Ser174. In order to clarify the func"
tional role of the cysteine residue in the GCSAG motif, we constructed a number of PMGL2 mutants with Cys173
substitutions and studied their properties. The specific activity of the C173D mutant exceeded the specific activity
of the wild"type enzyme (wtPMGL2) by 60%, while the C173T/C202S mutant displayed reduced catalytic activity.
The activity of the C173D mutant with p"nitrophenyl octanoate was 15% higher, while the activity of the
C173T/C202S mutant was 17% lower compared to wtPMGL2. The C173D mutant was also characterized by a high
activity at low temperatures (20"35°C) and significant loss of thermal stability. The kcat value for this protein was 56%
higher than for the wild"type enzyme. The catalytic constants of the C173S mutant were close to those of
wtPMGL2; this enzyme also demonstrated the highest thermal stability among the studied mutants. The obtained
results demonstrate that substitutions of amino acid residues adjacent to the catalytic serine residue in the GXSXG
motif can have a significant effect on the properties of PMGL2 esterase.
Keywords: PMGL2 esterase, HSL family, GCSAG motif, mutagenesis, thermal stability, three"dimensional structure
БИОХИМИЯ том 85 вып. 6 2020