БИОХИМИЯ, 2020, том 85, вып. 8, с. 1021 - 1036
УДК 577.214
ТРАНСЛЕЗИОННЫЙ СИНТЕЗ И РЕ ИНИЦИАЦИЯ СИНТЕЗА ДНК
В ФОРМИРОВАНИИ УСТОЙЧИВОСТИ К ХИМИОТЕРАПИИ
Обзор
© 2020
Е.С. Шилкин1, Е.О. Болдинова1, А.Д. Столяренко1, Р.И. Гончарова2,
Р.Н. Чупров Неточин3, М.П. Смаль2*, А.В. Макарова1*
1 ФГБУН Институт молекулярной генетики РАН, 123182 Москва, Россия;
электронная почта: amakarova%img@yandex.ru
2 Институт генетики и цитологии НАН Беларуси, 220072 Минск, Беларусь; электронная почта: m.smal@igc.by
3 ФГАОУ ВО Московский физико%технический институт (Национальный исследовательский университет),
141701 Долгопрудный, Московская область, Россия
Поступила в редакцию 16.04.2020
После доработки 26.06.2020
Принята к публикации 26.06.2020
Многие препараты химиотерапии блокируют деление опухолевых клеток, повреждая ДНК. ДНК полиме
разы эта (Pol η), йота (Pol ι), каппа (Pol κ), REV1 Y семейства и зета (Pol ζ) В семейства эффективно вклю
чают нуклеотиды напротив ряда повреждений ДНК в ходе транслезионного синтеза. Праймаза полимераза
PrimPol и комплекс ДНК полимераза альфа праймаза ре инициируют синтез ДНК с помощью праймазной
активности. Эти ферменты могут снижать эффективность препаратов химиотерапии, способствовать вы
живанию опухолевых клеток и прогрессированию злокачественных заболеваний. ДНК полимеразы явля
ются перспективными мишенями для повышения эффективности химиотерапии, а мутации и полимор
физмы некоторых ДНК полимераз могут служить дополнительными прогностическими маркерами при
выборе терапии ряда онкологических заболеваний.
КЛЮЧЕВЫЕ СЛОВА: транслезионный синтез ДНК, реинициация синтеза, репликация повреждения
ДНК, резистентность к препаратам химиотерапии.
DOI: 10.31857/S0320972520080035
ВВЕДЕНИЕ
реждений ДНК. Основным механизмом защиты
является репарация, в ходе которой большин
При делении клеток ДНК полимераза
ство поврежденных оснований и нуклеотидов
(ДНКП) удваивают ДНК в ходе репликации.
удаляются из ДНК. Для защиты от поврежде
Многосубъединичные репликативные ДНКП
ний, которые избежали репарации, запускается
B семейства дельта (Pol δ), эпсилон (Pol ε) и аль
альтернативный механизм — «синтез через пов
фа (Pol α) обеспечивают точное копирование ге
реждение», или транслезионный синтез ДНК.
номной ДНК: комплекс Pol α праймаза иници
ДНКП Y семейства йота (Pol ι), эта (Pol η), кап
ирует репликацию и синтезирует РНК ДНК
па (Pol κ), REV1 и В семейства зета (Pol ζ) эф
праймеры, тогда как Pol ε и Pol δ копируют
фективно включают нуклеотиды напротив пов
большую часть ДНК на лидирующей и отстаю
реждений ДНК в ходе транслезионного синтеза
щей цепях соответственно [1, 2]. Многие пов
и способствуют преодолению блоков реплика
реждения ДНК блокируют работу репликатив
ции (рис. 1) [4-7].
ных ДНКП, вызывая остановку репликации [3].
В отличие от репликативных ДНКП, транс
Существует несколько уровней защиты от пов лезионные ДНКП обладают низкой точностью
синтеза на неповрежденной ДНК и, защищая
клетки от повреждений, являются источником
Принятые сокращения: ДНКП - ДНК полимераза;
XP V - xeroderma pigmentosum variant (вариант пигмент
мутаций в организме. Нарушения в работе этих
ной ксеродермы); MAF - minor allele frequency (частота ферментов повышают риск развития онкологи
минорного аллеля); OR - оdds ratio (отношение шансов);
ческих заболеваний. Функции транслезионных
HR - hazard ratio (отношение рисков); RIR - REV1 inter
acting region (район взаимодействия с REV1); UBM2 -
ДНКП и их роль в канцерогенезе и защите от он
ubiquitin binding motif 2 (убиквитин связывающий мотив 2).
кологических заболеваний рассмотрена в недав
* Адресат для корреспонденции.
нем обзоре [10]. В настоящем обзоре рассматри
1021
1022
ШИЛКИН и др.
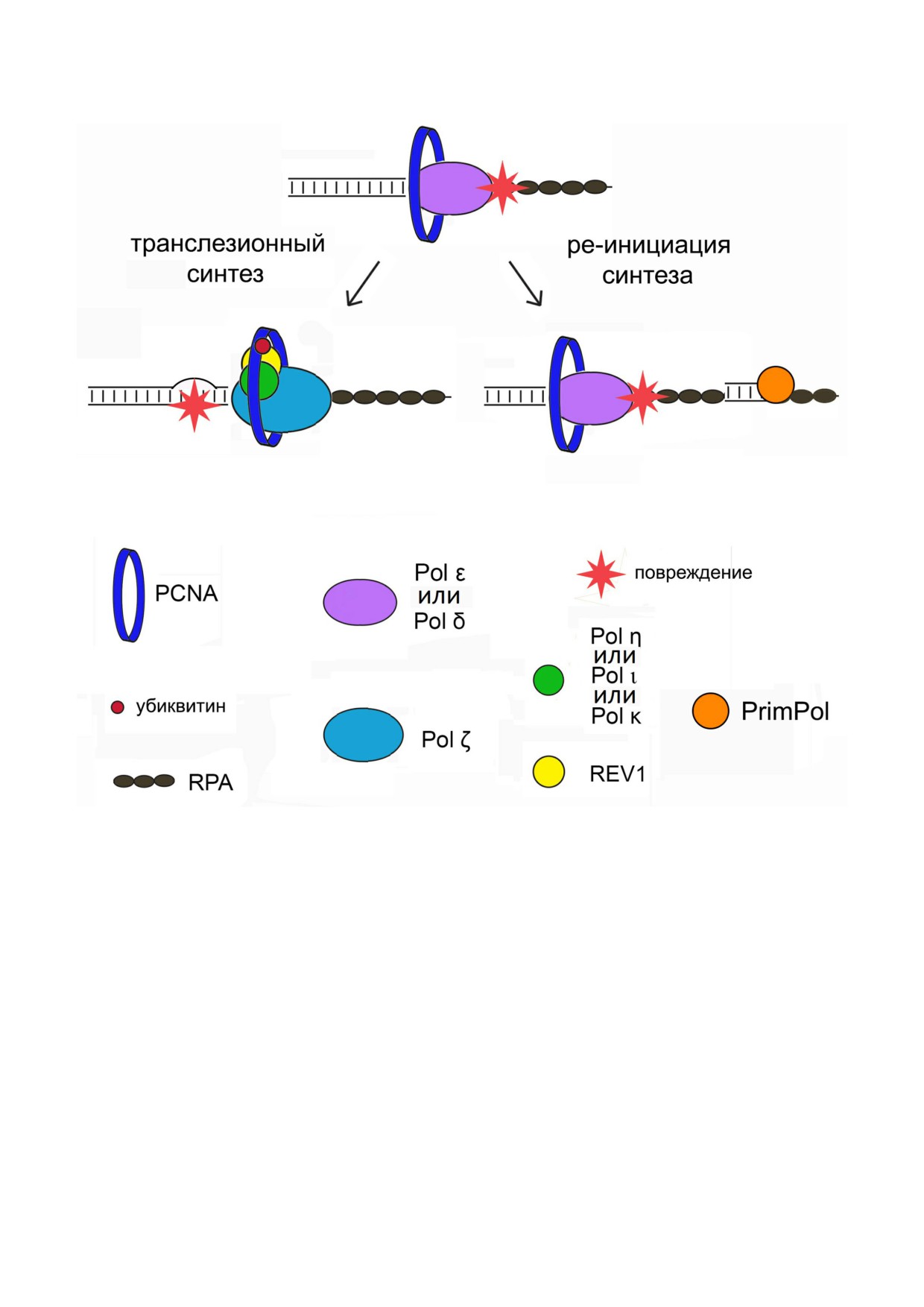
Рис.1. Транслезионный синтез ДНК и ре инициация синтеза ДНК с участием PrimPol. После остановки репликативной
ДНКП В семейства Pol δ или Pol ε в поврежденном участке ДНК происходит убиквитинирование PCNA и переключение
на транслезионный синтез. Транслесома состоит из ДНКП Y семейства Pol η, Pol ι или Pol κ («инсертера»), ДНКП В се
мейства Pol ζ («экстендера»), а также ДНКП Y семейства REV1 — белка, который одновременно взаимодействует с PCNA
и остальными ДНКП и выполняет координирующую и регуляторную функции [4-7]. Репликация может быть также за
пущена праймазами с помощью репрайминга. ДНК праймаза и ДНК полимераза PrimPol синтезирует ДНК de novo на ли
дирующей цепи и взаимодействует с RPA, но не PCNA [8, 9]. (С цветными вариантами рис. 1 и 2 можно ознакомиться в
вается роль Pol η, Pol ι, Pol κ, REV1 и Pol ζ в реп
ПРОТИВООПУХОЛЕВЫЕ ПРЕПАРАТЫ,
ликации ДНК, содержащей повреждения, выз
БЛОКИРУЮЩИЕ РЕПЛИКАЦИЮ
ванные химиотерапевтическими препаратами,
обсуждаются роль этих ферментов в механизмах
Действие многих химиотерапевтических
резистентности к химиотерапии и успехи в по
препаратов основано на блокировании репли
лучении ингибиторов транслезионных ДНКП, а
кации быстро делящихся опухолевых клеток с
также роль ре инициации репликации ДНК (с
помощью повреждения ДНК. К таким препара
помощью ДНК праймазы и ДНК полимеразы
там относят аналоги нуклеозидов, алкилирую
PrimPol и комплекса Pol α праймаза) в развитии
щие соединения (производные бис β хлорэти
устойчивости к химиотерапии.
ламина и нитрозомочевины, митомицин С) и
БИОХИМИЯ том 85 вып. 8 2020
ТРАНСЛЕЗИОННЫЙ СИНТЕЗ И РЕ ИНИЦИАЦИЯ СИНТЕЗА ДНК
1023
препараты платиновой группы (цисплатин, ок
рина (циклофосфамид и др.), мелфалан, хло
салиплатин), вызывающие внутринитевые и
рамбуцил. Структура циклофосфамида показа
межнитевые сшивки ДНК [11].
на на рис. 2, в. Данные препараты реагируют с
Препараты платиновой группы. К препаратам
ДНК через образование нестабильных активных
платиновой группы относят
4 замещенные
азиридиновых интермедиатов, атакующих пре
комплексы Pt2+, содержащие, как правило, две
имущественно N7 атомы G. Соединения обра
прочные координационные связи с молекулами
зуют межцепочечные сшивки между N7 атома
аммиака или аминами, а две другие - с лабиль
ми G в GNC контексте [22, 23]. Минимальное
ными лигандами (например, анионом Cl-). В за
расстояние между двумя G в такой последова
висимости от взаимного расположения лигандов
тельности больше, чем длина сшивающего
различают цис% и транс комплексы платины.
фрагмента, и предполагается, что это приводит
Одним из наиболее известных и используемых
к изгибу структуры ДНК [24].
препаратов является цис диамминдихлороплати
Производные нитрозомочевины - ещё одна
на (II) - цисплатин (рис. 2, а). В клетки циспла
группа бифункциональных алкилирующих пре
тин попадает с помощью диффузии и в результа
паратов, к которым относятся фотемустин, кар
те работы белков транспортеров [12, 13]. Внутри
мустин, ломустин и стрептозоцин. Соединения
клеток из за низкой концентрации Cl- ионов
этой группы легко проникают через гематоэн
происходит замещение Cl- в составе комплекса
цефалический барьер и широко используются в
на молекулы воды. Активированная гидратиро
терапии опухолей головного мозга [25, 26].
ванная форма цисплатина атакует нуклеофиль
Структура фотемустина показана на рис. 2, г.
ные сайты N7 атомов пуриновых оснований
При физиологических значениях pH производ
ДНК [14]. Сначала образуется моноаддукт, и в за
ные нитрозомочевины гидролизуются с образо
висимости от расположения второго пурина воз
ванием
2 хлорэтилдиазогидроксида. В ходе
можно образование 1,2 GG
(65%), 1,2 AG
электрофильной атаки ДНК по О6 и N7 атомам
(25%) и 1,3 GNG
(5-10%) внутрицепочечных
гуанина образуются различные 2 хлорэтилпро
сшивок ДНК и малого количества (<1-3%) меж
изводные [26]. Нуклеофильная атака по второму
цепочечных сшивок ДНК [15, 16]. Цисплатино
реакционному центру моноаддуктов приводит к
вые повреждения ДНК ингибируют репликацию
образованию внутрицепочечных сшивок между
и транскрипцию, приводят к остановке клеточ
N7 атомами соседних G или внутримолекуляр
ного цикла в G2 фазе и апоптозу [11].
ной циклизации между О6 и N1 атомами G.
Митомицин С относится к группе противо
При атаке N3 атома комплементарного C обра
опухолевых антибиотиков, продуцируемых
зуется межцепочечная сшивка [27].
Streptomyces caespitosus (рис. 2, б). Митомицин С
Алкилирующие триазины (дакарбазин и про
является бифункциональным алкилирующим
изводные) и тетразины (темозоломид) - группа
агентом и реагирует с ДНК после внутриклеточ
монофункциональных алкилирующих препара
ной восстановительной активации оксидоре
тов. Структура темозоломида показана на рис. 2,
дуктазами [17, 18.]. Митомицин С проявляет
д. В ходе ферментативной (дакарбазин) или
высокую субстратную специфичность, алкили
спонтанной активации в физиологических усло
руя экспонированные в малую бороздку ДНК
виях (темозоломид) образуется реакционноспо
N2 атомы гуаниновых оснований, хотя в ряде
собный катион метилдиазония, который несе
случаев (например, при активации DT диафо
лективно метилирует основания ДНК. В продук
разой) возможно образование аддуктов по N7
тах реакции обнаружены O6 метилгуанин
атому G [19]. Алкилирование N2 dG зависит от
(6-8%), N7 метилгуанин (70%), N1 и N3 мети
сиквенс контекста и происходит преимущест
ладенин (15% и 10%) и N3 метилцитозин (<1%)
венно в CpG островках, что объясняется стаби
[28, 29]. О6 метилгуанин образует пару с включа
лизацией молекулы митомицина С во время
ющимся dTТР, что приводит к резкому возраста
атаки N2 атома первого G взаимодействием с гу
нию числа мутаций при репликации ДНК [30].
аниновым основанием в комплементарной це
Антиметаболиты антагонисты нуклеотидов.
пи ДНК [18]. Таким образом, основным продук
Широкое распространение из этой группы пре
том бифункционального присоединения мито
паратов получили аналоги пуриновых нуклеози
мицина С к ДНК являются межцепочечные G
дов флударабин, кладрибин, клофарабин и ана
G сшивки в CpG островках и реже - внутрице
логи цитидина цитарабин и гемцитабин (рис. 2,
почечные 1,2 GG аддукты (рис. 2, б) [20, 21.].
е) [31]. Большинство соединений представляют
Производные бис β хлорэтиламина (азотис
собой модифицированные нуклеозиды и при
тые иприты) - класс алкилирующих агентов,
попадании в клетку фосфорилируются до нук
среди которых клинически важными являются
леозидтрифосфатов - нуклеотидов. Такие нук
бифункциональные производные оксазафосфо
леотиды конкурируют с клеточными dNTP за
БИОХИМИЯ том 85 вып. 8 2020
1024
ШИЛКИН и др.
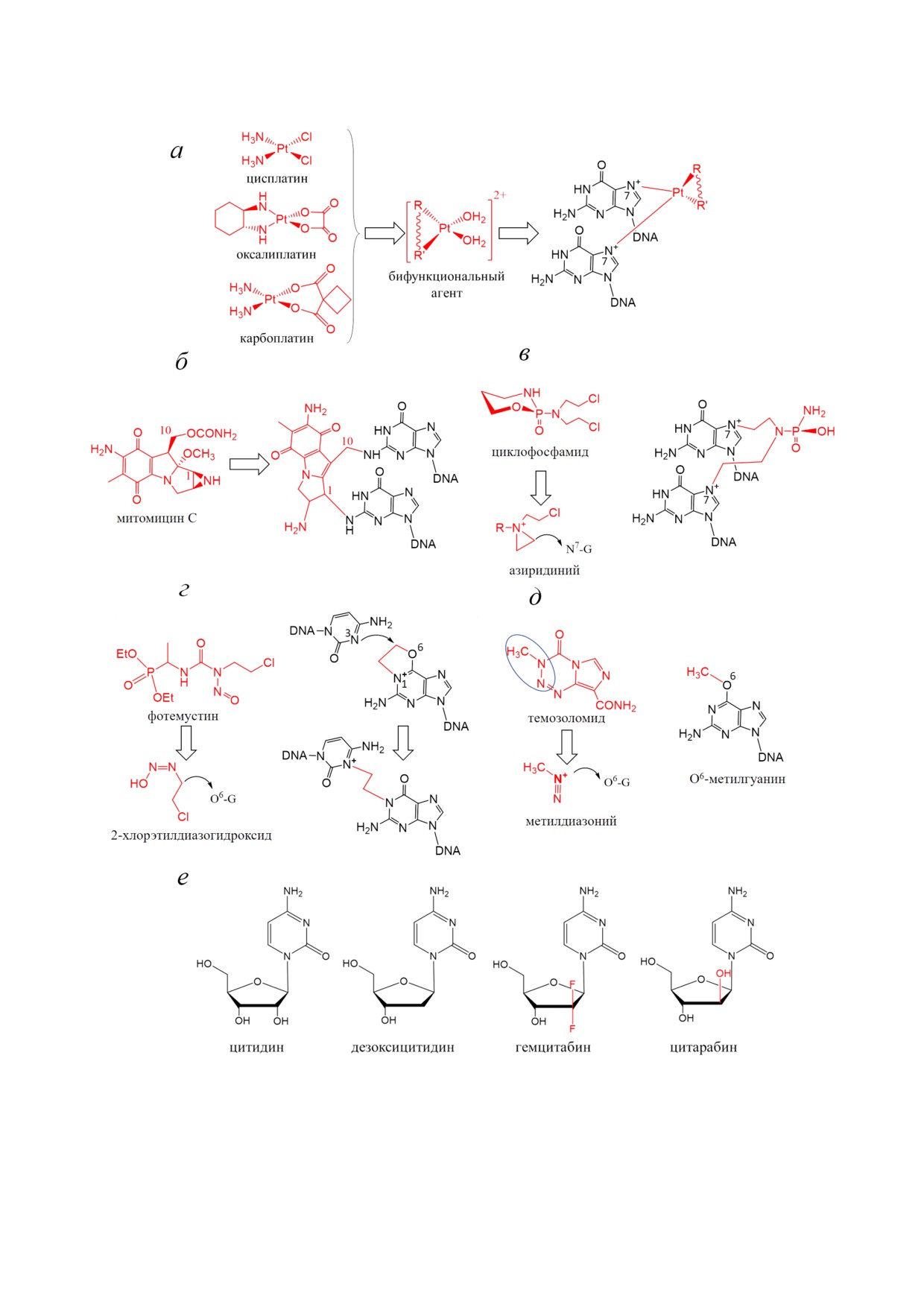
Рис 2. Химиотерапевтические препараты, модифицирующие ДНК. На рисунке показаны препараты платины (а), би
функциональные (б, в, г) и монофункциональные (д) алкилирующие соединения и аналоги цитидина (е). Красным пока
заны молекулы препаратов и их активные производные (а-д) или выделены группы, отличающие соединение от цитиди
на (е). Синим овалом на рис. д изображена часть молекулы темозоломида, являющаяся предшественником для метилди
азония
БИОХИМИЯ том 85 вып. 8 2020
ТРАНСЛЕЗИОННЫЙ СИНТЕЗ И РЕ ИНИЦИАЦИЯ СИНТЕЗА ДНК
1025
связывание с ДНКП и включаются в растущую
пересадки бестимусным мышам даже без тера
цепь ДНК, терминируя синтез и блокируя реп
пии [45]. Это может быть связано с участием Pol
ликацию в активно делящихся опухолевых клет
η в транслезионном синтезе напротив эндоген
ках [32]. Некоторые препараты дополнительно
ных повреждений.
ингибируют другие клеточные ферменты. Нап
Показано, что высокий уровень экспрессии
ример, гемцитабин, F атомы которого имитиру
POLH в клетках опухолей повышает уровень
ют OH группу рибонуклеотидов, ингибирует
смертности среди пациентов с немелкоклеточ
рибонуклеотидредуктазу, CTP синтазу и тими
ным раком легкого и аденокарциномой желуд
дилатсинтазу, а также РНК полимеразу, блоки
ка, что может быть связано со снижением эф
руя транскрипцию [33].
фективности химиотерапии цисплатином или
Данный список препаратов не является пол
оксалиплатином у данной группы пациентов
ным. Например, не были рассмотрены антра
[46, 47]. Напротив, падение активности Pol η в
циклиновые антибиотики и ингибиторы топо
опухолевых клетках пациентов с пигментной
изомераз. Эти темы освещены в обзорах [34, 35].
ксеродермой XP V фенотипа обуславливает вы
сокую эффективность химиотерапии цисплати
ном, и делает цисплатин у данной группы паци
ТРАНСЛЕЗИОННЫЙ СИНТЕЗ
ентов препаратом выбора [48]. Следует отме
И ХИМИОТЕРАПИЯ
тить, что из за повышенной чувствительности
клеток к цисплатину у XP V пациентов при хи
Согласно двухполимеразной модели, в про
миотерапии чаще развиваются побочные эф
цессе транслезионного синтеза полимераза
фекты (потеря слуха, повреждение почек, мие
«инсертер» Y семейства Pol η, Pol ι или Pol κ
лосупрессия) [49]. Это необходимо учитывать
включает нуклеотиды непосредственно напро
при выборе дозировки.
тив поврежденного участка ДНК, после чего
Кроме того, исследования активности Pol η
происходит переключение на полимеразу «экс
in vitro и в культуре клеток позволяют предполо
тендер» В семейства Pol ζ (рис. 1) [5].
жить, что Pol η может снижать эффективность
Pol η и Pol ι. Мутации, которые приводят к
таких химиотерапевтических препаратов, как
потере или снижению активности Pol η, вызыва
цитарабин и гемцитабин [50-53]. Показан так
ют развитие варианта наследственной пигмент
же эффективный и высокоошибочный трансле
ной ксеродермы (xeroderma pigmentosum variant,
зионный синтез Pol η и Pol κ на ДНК матрицах
XP V), характеризующегося высокой частотой
с аддуктами тамоксифена — модулятора рецеп
опухолей кожи [36]. Защитное антиканцероген
торов эстрогена, который используется для ле
ное действие Pol η в клетках кожи обусловлено
чения эстроген зависимых опухолей [54]. Инду
эффективным и точным транслезионным синте
цированные Pol η и Pol κ мутации могут быть
зом напротив тимин тиминовых димеров, обра
связаны с генотоксическими свойствами препа
зующихся под влиянием ультрафиолета [36].
рата.
Pol η также эффективнее других ДНКП осу
Pol ι является ближайшим гомологом Pol η
ществляет транслезионный синтез на ДНК мат
[55]. Данные об участии Pol ι в развитии резис
рицах с внутрицепочечными сшивками, образу
тентности к препаратам платиновой и алкили
ющимися под действием препаратов платино
рующей групп в литературе отсутствуют. Однако
вой группы цисплатина и оксалиплатина
способность Pol ι к транслезионному синтезу на
[37-41]. Нокдаун POLH, кодирующего Pol η,
участках ДНК с межнитевыми сшивками была
снижает эффективность транслезионного син
показана in vitro для аддуктов псоралена, кото
теза напротив внутринитевой цисплатиновой
рый используется в фотохимиотерапии псориа
сшивки в клетках U2OS ∼ в 2 раза [42]. Предпо
за [56]. Как и Pol η, Pol ι эффективно включает
лагается, что в культуре клеток высокий уровень
dNTP на матрицах с аддуктами цитарабина, и
экспрессии POLH вызывает резистентность кле
нокдаун POLI, кодирующего Pol ι, приводит к
ток опухолей яичников, легких и мочевого пу
падению выживаемости клеток после обработки
зыря к цисплатину, а снижение уровня экспрес
этим препаратом [53].
сии POLH сенсибилизирует клетки яичников и
Pol κ. In vitro Pol κ «проходит» межнитевые
легких к действию препарата [43-45]. Интерес
сшивки разной структуры между остатками N2
но, что потеря POLH подавляет рост клеток ксе
G [57, 58], аддукты тамоксифена [54] и эффек
нографта* опухоли легких человека Н1975 после
тивно продолжает синтез от концов праймеров,
спаренных с внутринитевой цисплатиновой
сшивкой [59]. Вклад Pol κ в развитие резистент
* Ксенографт - экспериментальная онкологическая мо
дель, использующая привитые животным (например, мы
ности к препаратам химиотерапии подтвержда
шам) опухоли человека.
ется работами на культурах клеток и модельных
БИОХИМИЯ том 85 вып. 8 2020
1026
ШИЛКИН и др.
Таблица 1. Полиморфные варианты транслезионных ДНКП, ассоциированные с ответом на лечение и исходом заболева
ния при применении препаратов платины (если не указано иное), 5 фторурацила и дакомитиниба
ДНКП
Полиморфизм*
MAF
Связь генотипа с заболеванием
Ссылки
Pol κ
синонимичная
0,226
АА ассоциирован с ответом на лечение при раке легкого (OR = 1,91;
[64]
замена, rs3213801
95%CI 1,00-3,54)
интрон,
0,238
АА ассоциирован с ответом на лечение при раке легкого (OR = 1,91;
[64]
rs5744533
95%CI 1,00-3,54)
интрон,
0,013
АА ассоциирован с отсутствием ответа на лечение при раке легкого
[64]
rs5744655
(OR = 0,46; 95%CI 0,23-0,99)
интрон,
0,136
GG ассоциирован с низкой степенью общей (OR = 0,69; 95%CI
[64]
rs3756558
0,50-0,94) и гематологической токсичности при раке легкого (OR =
0,71; 95%CI 0,50-0,98)
интрон,
0,133
GG ассоциирован с лучшей выживаемостью до прогрессирования при
[64]
rs10077427
раке легкого (HR = 0,55; 95%CI 0,41-0,73)
5′ UTR,
0,102
AG и GG ассоциированы с низкой выживаемостью до прогрессирова
[64]
rs5744545
ния при раке легкого (HR = 2,19; 95%CI 1,53-2,55)
Pol ζ:
3′ UTR, rs465646
0,195
лучшая общая выживаемость при мезотелиоме (HR = 0,50; 95%CI
[65]
REV3L
0,30-0,83)
высокая степень гематологической токсичности при раке легкого
[66]
(OR = 2,54; 95%CI 1,17-5,42)
миссенс замена,
0,330
лучшая общая выживаемость при мезотелиоме (HR = 0,58; 95%CI
[65]
T1224I, rs462779
0,36-0,92)
низкий уровень общей выживаемости при остеосаркоме (HR = 2,60;
[67]
95%CI 1,18-5,74)
низкий риск тромбоцитопении при раке легкого (OR = 0,40; 95%CI
[68]
0,20-0,78)
синонимичная
0,40
СТ и ТТ ассоциированы с гастроинтестинальной токсичностью при ме
[65]
замена, rs455732
зотелиоме (OR = 2,71; 95%CI 1,18-6,21)
интрон, rs240969
0,207
GG ассоциирован с ответом на лечение при раке легкого (OR = 0,55;
[66]
95%CI 0,36-0,83)
интрон, rs240966
0,28
аллель G ассоциирован с низкой степенью гематологической токсич
[66]
ности при раке легкого (OR = 0,44; 95%CI 0,21-0,94)
интрон,
0,059
GG ассоциирован с высокой степенью гематологической токсичности
[66]
rs4945880
при раке легкого (OR = 1,50; 95%CI 1,05-2,15)
миссенс замена,
0,0009
аллель T обнаружен у пациентов с метастатическим колоректальным
[69]
R2762Q,
раком, не ответивших на лечение 5 фторурацилом
rs3218592
соматические
чувствительность к дакомитинибу при плоскоклеточной карциноме го
[70]
мутации G1398V,
ловы и шеи
I1992fs, Y2479fs
Pol ζ:
интрон,
0,172
аллель G ассоциирован с низкой степенью гематологической токсич
[66]
REV7
rs2233025
ности при раке легкого (OR = 0,29; 95%CI 0,10-0,82)
(MAD2L2)
БИОХИМИЯ том 85 вып. 8 2020
ТРАНСЛЕЗИОННЫЙ СИНТЕЗ И РЕ ИНИЦИАЦИЯ СИНТЕЗА ДНК
1027
Окончание таблицы 1
ДНКП
Полиморфизм*
MAF
Связь генотипа с заболеванием
Ссылки
REV1
миссенс замена,
0,260
риск лейкопении (OR = 2,74; 95%CI 1,24-6,06) и нейтропении (OR =
[65]
V138M,
2,07; 95%CI 1,01-4,24) при мезотелиоме
rs3087403
низкий уровень общей выживаемости при остеосаркоме (HR = 4,44;
[67]
95%CI 1,92-10,27)
миссенс замена,
0,398
АА и AG ассоциированы с низким риском нейтропении при мезотели
[65]
F257S, rs3087386
оме (OR = 0,44; 95%CI 0,21-0,92)
низкая выживаемость при раке легкого (HR = 1,92; 95%CI 1,08-3,39)
[71]
интрон,
0,142
низкая выживаемость при раке легкого (HR = 2,36; 95%CI 1,30-4,25)
[71]
rs3792136
Примечание. * Синонимичные замены и замены в интронах могут нарушать сплайсинг или влиять на уровень экспрес
сии, затрагивая регуляторные области.
животных. Pol κ в кооперации с Pol ζ с низкой
раке легких и лимфомах у мышей приводит к хо
точностью «проходит» цисплатиновые внутри
рошему ответу на препараты химиотерапии [76,
цепочечные сшивки в клетках U2OS ∼ в 30%
77, 80, 81, 85-87].
случаев [42]. Потеря функции Pol κ повышает
Полиморфизмы гена REV3L оказывают вли
как чувствительность клеток к митомицину С,
яние на эффективность химиотерапии циспла
так и частоту индуцированного мутагенеза в
тином у пациентов с остеосаркомой и мезотели
культуре клеток человека и у мышей [60, 61].
омой [65, 67], и дакомитинибом у пациентов с
Наконец, показано участие Pol κ в независимой
плоскоклеточными карциномами головы и шеи
от репликации репарации сшивок, образован
(соматические мутации) [70] (табл. 1). Высокий
ных цисплатином и митомицином С, в неделя
уровень экспрессии регуляторной субъединицы
щихся клетках [62, 63].
Pol ζ REV7 вызывает устойчивость к радиотера
Ассоциация полиморфизмов POLK с повы
пии [88], а также коррелирует с негативным
шенной чувствительностью к препаратам пла
прогнозом, и является независимым прогности
тиновой группы показана у пациентов с немел
ческим фактором развития устойчивости к ри
коклеточным раком легких [64] (табл. 1).
туксимабу (препарат на основе моноклональ
Pol ζ состоит из нескольких субъединиц: ка
ных антител к CD20 антигену В лимфоцитов) у
талитической REV3 и регуляторных REV7 (в
пациентов с В клеточными лимфомами, хотя
форме димера), POLD2 (p50) и POLD3 (p66)
механизм развития устойчивости неясен [89].
[72-75]. Функции ДНКП Y семейства частично
REV1 относится к Y семейству ДНКП, одна
взаимозаменяемы, тогда как роль Pol ζ в транс
ко обладает низкой полимеразной активностью
лезионном синтезе является уникальной. Pol ζ
и включает только dCMP напротив неповреж
играет роль в развитии устойчивости разных ти
денных матричных нуклеотидов, АП сайтов и
пов клеток и опухолей к цисплатину [76-82], 5
N2 аддуктов гуанина в материнской цепи ДНК
фторурацилу [83] и препаратам алкилирующего
[4, 5, 90-92]. REV1 играет важную структурную
действия темозоломиду и фотемустину [84]. По
и регуляторную роли в процессе транслезионно
казано, что Pol ζ повышает эффективность
го синтеза. REV1 взаимодействует с другими по
транслезионного синтеза Pol η напротив цисп
лимеразами Y семейства, с Pol ζ и с фактором
латиновых сшивок in vitro [73]. В клетках U2OS
процессивности PCNA, координируя сборку и
Pol ζ осуществляет до 80% событий транслези
работу транслесомы [4, 5].
онного синтеза напротив внутринитевой цисп
Высокий уровень экспрессии REV1 вызыва
латиновой сшивки в кооперации с Pol η или Pol
ет устойчивость клеток карциномы яичника к
κ [42]. Подавление уровня экспрессии катали
цисплатину [93, 94]. Низкий уровень экспрес
тической субъединицы Pol ζ REV3L в клетках
сии REV1 сопровождается полной регрессией
карциномы головы и шеи, немелкоклеточного
плоскоклеточных карцином головы и шеи после
рака легкого, глиомы головного мозга, рака
комбинированной химиотерапии и лучевой те
шейки матки, а также подавление Rev3l непос
рапии, а высокий уровень экспрессии коррели
редственно в опухолях при метастазирующем
рует с устойчивостью к радиотерапии [95]. Ис
БИОХИМИЯ том 85 вып. 8 2020
1028
ШИЛКИН и др.
следования на модели Eμ%myc мышей, доклини
2) с убиквитинсвязывающим мотивом UBM2,
ческой модели лимфомы Беркитта, показали,
взаимодействующим c моноубиквитинилирова
что подавление экспрессии Rev1 снижает мута
ным PCNA [102], 3) С концевым районом взаи
генез, индуцированный цисплатином и цикло
модействия с регуляторной субъединицей REV7
фосфамидом, и предупреждает развитие резис
Pol ζ [103] (табл. 2). Был предложен и ингиби
тентности к циклофосфамиду [87].
тор, нарушающий взаимодействие между RЕV3
Полиморфизмы REV1, в частности, амино
и REV7 (табл. 2) [96]. Ингибирующее действие
кислотная замена V138M (rs3087403), оказыва
большинства соединений и их способность по
ют влияние на эффективность химиотерапии
вышать чувствительность клеток к препаратам
цисплатином у пациентов с остеосаркомой [67],
химиотерапии были показаны в культуре клеток
а полиморфизм F257S может служить маркером
(табл. 2). Высокая эффективность ингибитора
негативного прогноза при раке легких [71]
REV1 JH RE 06, блокирующего взаимодей
(табл. 1).
ствие между REV1 и REV7, была продемонстри
рована также на модели ксенографта меланомы
человека у мышей [103]. Совместная терапия
ИНГИБИТОРЫ ТРАНСЛЕЗИОННОГО
ингибитором JH RE 06 и цисплатином почти
СИНТЕЗА ДНК
полностью остановила рост опухоли.
Высокоспецифичные ингибиторы на основе
Подавление клеточных механизмов толерант
рибозимов и РНК аптамеров были получены
ности к повреждениям ДНК может повысить
для REV1 [106] и Pol ι [107]. Доставка рибозимов
эффективность химиотерапии. В последние го
в легкие мышей с помощью небулайзера снизи
ды ведется поиск ингибиторов ДНКП, участву
ла частоту мутаций, индуцированных бен
ющих в транслезионном синтезе ДНК. Страте
зо[α]пиреном, и в два раза сократила количест
гии разработки ингибиторов включают созда
во химически индуцированных опухолей [106].
ние ингибиторов, непосредственно подавляю
Потенциальным ингибитором Pol η может слу
щих каталитическую активность ДНКП, инги
жить микроРНК miRNA 93. Показано, что су
биторов, нарушающих ключевые белок белко
перэкспрессия данной микроРНК снижает
вые взаимодействия между компонентами
экспрессию POLH и увеличивает эффектив
транслесомы, и ингибиторов убиквитинилиро
ность химиотерапии цисплатином [43]. Недавно
ванного PCNA.
были получены ингибирующие ДНК аптамеры
Было проведено несколько исследований по
к Pol η [Бондаренко К.А., Макарова А.В., нео
поиску низкомолекулярных ингибиторов
публикованные данные].
ДНКП Y семейства. Скрининг тысяч химичес
Ингибиторами транслезионного синтеза
ких соединений in vitro и компьютерное модели
также могут выступать соединения, выделенные
рование позволили обнаружить более десятка
из живых организмов: 3 О метилфуникон из
ингибиторов Pol η, Pol κ, Pol ι и REV1, характе
Penicillium pinophlium, соединения пенициллиол
ризующихся разной эффективностью и специ
(penicilliol) А и В из Penicillium daleae, гликоли
фичностью [96-105] (табл. 2).
пиды шпината, кохаминовая кислота морской
Было показано, что соединения кандесартан
губки рода Ircinia, а также соединения таларо
цилексетил (антагонист рецептора ангиотензи
флавон (talaroflavone) и 1 дезоксирубралактон
на), маноалид и МК 886 ингибируют Pol κ в
(1 deoxyrubralactone) из штамма грибов, собран
микромолярных концентрациях (табл. 2) [104].
ных с водорослей Японского моря [108]. Разра
Кандесартан цилексетил не оказывал сущест
батываются новые аналоги dNTP, ингибирую
венного влияния на репликацию в культуре кле
щие работу ДНКП транслезионного синтеза
ток, но повышал их чувствительность к УФ, а
[109].
также ингибировал активность Pol ι и Pol η
[104]. Производные тиобарбитуровой кислоты
ингибируют Pol η в 3-10 раз эффективнее дру
РЕ ИНИЦИАЦИЯ СИНТЕЗА ДНК
гих ДНКП, повышая чувствительность клеток к
препаратам платиновой группы (табл. 2) [97,
Праймаза полимераза PrimPol относится к
105].
классу архео эукариотических праймаз. В отли
Для REV1 был предложен целый ряд низко
чие от других ДНКП PrimPol обладает ДНК
молекулярных ингибиторов, блокирующих
праймазной активностью и может ре иници
ключевые белок белковые взаимодействия
ировать синтез ДНК после встречи репликатив
транслесомы. Полученные соединения связыва
ной ДНКП с повреждением и остановки репли
ются с разными районами REV1: 1) RIR моти
кации (рис. 1) [110, 111]. Можно предположить,
вом, взаимодействующим с Y ДНКП [98-101],
что, осуществляя ре инициацию репликации,
БИОХИМИЯ том 85 вып. 8 2020
ТРАНСЛЕЗИОННЫЙ СИНТЕЗ И РЕ ИНИЦИАЦИЯ СИНТЕЗА ДНК
1029
Таблица 2. Низкомолекулярные ингибиторы ДНКП Y семейства и Pol ζ
Ингибитор
ДНКП
IC50 in
Эффекты в культуре клеток или организме жи
Ссылка
vitro, μM*
вотных
Производные тиобарбитуровой
Pol η
16-17
нет данных
[97]
кислоты ITBA 16 и ITBA 19
PNR 7 02, производное индол
Pol η
8
чувствительность к препаратам платины
[105]
тиобарбитуровой кислоты
Кандесартан цилексетил, анта
Pol κ
9
чувствительность к УФ
[104]
гонист рецептора ангиотензина
Pol η
11
Pol ι
6
Маноалид, антагонист фосфо
Pol κ
3
нет данных
[104]
липазы А2
МК 886, антагонист лейкотри
Pol κ
13
нет данных
[104]
енов
Тиофены
REV1 RIR
#4-4,1;
чувствительность к УФ и цисплатину
[100,
#5-2,5
101]
Феназопиридин (#1) и его про
REV1 RIR
#1-1;
нет данных
[98]
изводные
#3-0,39
Соединения, близкие по струк
REV1 RIR
#4-1,6;
чувствительность к цисплатину
[99]
туре феназопиридину #4 6
#5 6,7;
#6-4,9
Соединения #1 и #2
REV1 UBM2
#1-3,4;
#1 - чувствительность к циклофосфамиду и
[102]
#2-9,7
цисплатину
Производное 1,4 дигидрохино
REV1, район
0,8
чувствительность к цисплатину и целому ряду
[103]
лина JH RE 06
взаимодейст
ДНК повреждающих агентов в культурах клеток,
вия с REV7
ингибирует рост опухоли в комбинации с циспла
тином на модели ксенографта меланомы человека
у мыши
Соединение #7
REV7, район
78
чувствительность к цисплатину
[96]
взаимодейст
вия с REV3
Примечание. * Для неповрежденной ДНК, если не указано иное.
PrimPol играет роль в развитии резистентности
BRCA2 необходимы для регуляции и координа
ко многим химиотерапевтическим препаратам,
ции достаточно точного процесса гомологичной
повреждающим ДНК.
рекомбинации двухцепочечных разрывов ДНК.
Первые исследования на культурах клеток
BRCA1 и BRCA2 взаимодействуют с рекомбина
подтверждают вклад PrimPol в развитие резистент
зой RAD51 и участвуют в образовании RAD51
ности к цисплатину. Нокаут гена PRIMPOL по
нуклеопротеиновых филаментов гомологичных
вышает чувствительность кератиноцитов кури
участков одноцепочечной ДНК [114]. Показано,
цы DT40 к цисплатину [112]. Предполагается,
что PrimPol необходима для выживания
что именно PrimPol отвечает за развитие резис
BRCA1-/- клеток после обработки цисплатином
тентности к цисплатину в клетках опухолей гру
[113]. Сверхэкспрессия PrimPol в клетках
ди и яичников с дефектами гомологичной ре
BRCA1-/- снижает чувствительность к комбини
комбинации, вызванных нарушениями в работе
рованной химиотерапии ингибиторами ATR
белков онкосупрессоров BRCA [113]. BRCA1 и
киназ и цисплатином [113].
БИОХИМИЯ том 85 вып. 8 2020
1030
ШИЛКИН и др.
Кроме того, было показано, что PrimPol
ные низкомолекулярные соединения CD437 и
включает противоопухолевые аналоги нуклео
ST1926 обладают выраженной противоопухоле
тидов цитарабин и гемцитабин в новосинтези
вой активностью для целого ряда опухолевых
рованную цепь ДНК in vitro [115].
клеток и связывают каталитическую субъедини
Исследования ассоциаций полиморфизмов
цу Pol α - POLA1 [126, 127].
PrimPol с развитием онкологических заболева
ний пока не проводились, но было показано,
В настоящем обзоре рассмотрена роль ДНКП
что в опухолях легких часто встречается замена
в транслезионном синтезе ДНК в ответ на пов
Y100H, затрагивающая активный центр фер
реждения, вызванные препаратами химиотера
мента [116]. Было высказано предположение о
пии. Важно отметить, что из за «толерантности»
том, что данная мутация может давать преиму
активного центра, отсутствия 3′ 5′ корректиру
щество раковым клеткам на ранних стадиях
ющей активности и использования неканони
канцерогенеза, поскольку стимулирует включе
ческих взаимодействий при включении нуклео
ние рибонуклеотидов. Концентрации рибонук
тидов точность синтеза транслезионных ДНКП
леотидов в клетках в несколько раз превышают
на неповрежденной ДНК на несколько поряд
концентрации дезоксирибонуклеотидов, а опу
ков ниже точности синтеза репликативных
холевые клетки часто характеризуются допол
ДНКП [6, 7]. Поэтому транслезионный синтез
нительным падением концентраций dNTP, поэ
может способствовать ускоренному накопле
тому включение рибонуклеотидов PrimPol при
нию мутаций, некоторые из которых могут дать
репликации может стимулировать деление
преимущества опухолевым клеткам и вызвать
[117]. Можно предположить, что замена Y100H
резистентность. Подавление транслезионного
может вносить вклад в развитие резистентности
синтеза не только блокирует репликацию, но и
к препаратам, направленным на ингибирование
снизит скорость появления клонов опухолевых
синтеза нуклеотидов, таких как метотрексат,
клеток с новыми свойствами, замедлив химио
гидроксимочевина и 5 фторурацил [108].
индуцированную клональную эволюцию опухо
Важно отметить, что недавние [118] и более
ли.
ранние [119] исследования показали, что встреча
Таким образом, ДНКП транслезионного
репликативной ДНКП Saccharomyces cerevisiae с
синтеза являются перспективными мишенями
блокирующим повреждением (и в отстающей, и
для повышения эффективности химиотерапии,
в лидирующей цепях) не останавливает репли
а мутации, полиморфизмы и уровень активнос
кацию: Pol α праймаза продолжает синтез на
ти некоторых ДНКП могут быть ценными прог
отстающей цепи за счет ре инициации, синте
ностическими маркерами при выборе терапии
зируя новые фрагменты Оказаки. Анализ репли
ряда онкологических заболеваний. Несомнен
кации плазмидной ДНК c Т Т димером в
но, получение новых специфичных и эффектив
экстрактах клеток человека [120, 121] и монито
ных ингибиторов транслезионных ДНКП и
ринг динамики синтеза нитей ДНК в клетках
ключевых белок белковых взаимодействий
человека [122] также показали, что повреждение
транслесомы является перспективным подхо
в отстающей цепи не блокирует репликацию.
дом повышения эффективности и снижения
Предполагается, что (как и у низших эукариот) у
цитотоксичности химиотерапевтических препа
млекопитающих Pol α праймаза продолжает
ратов.
синтезировать новые фрагменты Оказаки [123],
хотя экспериментальные доказательства еще не
получены.
Финансирование. Работа выполнена при фи
PrimPol, вероятно, осуществляет репрай
нансовой поддержке грантами: 1) разделы по
минг на лидирующей цепи в случаях, когда пов
ДНКП Y семейства [РФФИ комфи 17 00 00264
реждения затрагивают лидирующую цепь или
(АВМ), РФФИ Бел а 18 54 00024 (АВМ) и
обе цепи (межнитевая сшивка). Эксперимен
БРФФИ Б18Р 094 (МПС)];
2) раздел по
тальные свидетельства, указывающие на то, что
PrimPol: РНФ 18 14 00354 (АВМ).
PrimPol осуществляет синтез ДНК de novo на ли
Конфликт интересов. Авторы заявляют об от
дирующей цепи, были получены в культуре кле
сутствии конфликта интересов.
ток курицы [124] и В лимфоцитах мыши [125].
Соблюдение этических норм. Статья не содер
Таким образом, Pol α праймаза и PrimPol
жит исследований, в которых участвовали люди,
также являются мишенями для разработки про
и экспериментов, выполненных с использова
тивоопухолевых препаратов. Ретиноидоподоб
нием животных.
БИОХИМИЯ том 85 вып. 8 2020
ТРАНСЛЕЗИОННЫЙ СИНТЕЗ И РЕ ИНИЦИАЦИЯ СИНТЕЗА ДНК
1031
СПИСОК ЛИТЕРАТУРЫ
1.
Burgers, P. M. J., and Kunkel, T. A. (2017) Eukaryotic
of immunochemical techniques, Carcinogenesis, 6, 561
DNA replication fork, Annu. Rev. Biochem., 86, 417 438,
566, doi: 10.1093/carcin/6.4.561.
doi: 10.1146/annurev biochem 061516 044709.
17.
Cummings, J., Spanswick, V. J., and Smyth, J. F. (1995)
2.
Kunkel, T. A. (2009) Evolving views of DNA replication
Re evaluation of the molecular pharmacology of mito
(in)fidelity, Cold Spring Harb. Symp. Quant. Biol., 74, 91
mycin C, Eur. J. Cancer, 31, 1928 1933, doi: 10.1016/
101, doi: 10.1101/sqb.2009.74.027.
0959 8049(95)00364 9.
3.
Friedberg, E. C., Walker, G. C., Siede, W., Wood, R. D.,
18.
Tomasz, M., (1995) Mitomycin C: small, fast and deadly
Schultz, R. A., and Ellenberger, T. (2006) DNA Repair and
(but very selective), Chem. Biol., 2, 575 579, doi: 10.1016/
Mutagenesis. Second Edition, ASM Press, Washington (DC).
1074 5521(95)90120 5.
4.
Makarova, A. V., and Burgers, P. M. (2015) Eukaryotic
19.
Umar, G. S., Lipman, R., Cummings, J., and Tomasz, M.
DNA polymerase ζ, DNA Rep. (Amst), 29, 4755,
(1997) Mitomycin cDNA adducts generated by DT
doi: 10.1016/j.dnarep.2015.02.012.
diaphorase. revised mechanism of the enzymatic reductive
5.
Rizzo, A. A., and Korzhnev, D. M. (2019) The Rev1 Pol ζ
activation of mitomycin C, Biochemistry, 36, 14128 14136,
translesion synthesis mutasome: structure, interactions and
doi: 10.1021/bi971394i.
inhibition, Enzymes, 45, 139 181, doi: 10.1016/bs.enz.
20.
Warren, A. J., Maccubbin, A. E., and Hamilton, J. W.
2019.07.001.
(1998) Detection of mitomycin C DNA adducts in vivo by
6.
Sale, J. E., Lehmann, A. R., and Woodgate, R. (2012) Y
32P postlabeling: time course for formation and removal of
family DNA polymerases and their role in tolerance of cel
adducts and biochemical modulation, Cancer Res., 58,
lular DNA damage, Nat. Rev. Mol. Cell Biol., 13, 141 152,
453 461.
doi: 10.1038/nrm3289.
21.
Tomasz, M., Lipman, R., Chowdary, D., Pawlak, J.,
7.
Yang, W., and Woodgate, R. (2007) What a difference a
Verdine, G., and Nakanishi, K. (1987) Isolation and struc
decade makes: insights into translesion DNA synthesis,
ture of a covalent cross link adduct between mitomycin C
Proc. Natl. Acad. Sci. USA,
104,
1559115598,
and DNA, Science,
235,
12041208, doi:
10.1126/
doi: 10.1073/pnas.0704219104.
science.3103215.
8.
Guilliam, T. A., Jozwiakowski, S. K., Ehlinger, A.,
22.
Dong, Q., Barsky, D., Colvin, M. E., Melius, C. F.,
Barnes, R. P., Rudd, S. G., Bailey, L. J., Skehel, M.,
Ludeman, S. M., Moravek, J. F., Colvin, O. M., Bigner, D. D.,
Eckert, K. A., Chazin, W. J., and Doherty, A. J. (2015)
Modrich, P., and Friedman, H. S. (1995) A structural basis
Human PrimPol is a highly error prone polymerase regu
for a phosphoramide mustard induced DNA interstrand
lated by single stranded DNA binding proteins, Nucleic
cross link at 5′ d(GAC), Proc. Natl. Acad. Sci. USA, 92,
Acids Res., 43, 1056 1068, doi: 10.1093/nar/gku1321.
12170 12174, doi: 10.1073/pnas.92.26.12170.
9.
Mart nez Jiménez, M. I., Lahera, A., and Blanco, L.
23.
Rink, S. M., Solomon, M. S., Taylor, M. J., Hopkins, P. B.,
(2017) Human PrimPol activity is enhanced by RPA, Sci.
Rajur, S. B., and McLaughlin, L. W. (1993) Covalent struc
Rep., 7, 783, doi: 10.1038/s41598 017 00958 3.
ture of a nitrogen mustard induced DNA interstrand
10.
Шилкин Е. С., Болдинова Е. О., Столяренко А. Д.,
cross link: an N7 to N7 Linkage of deoxyguanosine
Гончарова Р. И., Чупров Неточин Р. Н., Хайруллин Р. Ф.,
residues at the duplex sequence 5′ d(GNC), J. Am. Chem.
Смаль М. П., Макарова А. В. (2020) Транслезионный
Soc., 115, 2551 2557, doi: 10.1021/ja00060a001.
синтез и канцерогенез, Биохимия, 85, 494 506.
24.
Rink, S. M., and Hopkins, P. B. (1995) A mechlore
11.
Siddik, Z. H. (2003) Cisplatin: mode of cytotoxic action
thamine induced DNA interstrand cross link Bends
and molecular basis of resistance, Oncogene, 22, 7265
duplex DNA, Biochemistry, 34, 1439 1445, doi: 10.1021/
7279, doi: 10.1038/sj.onc.1206933.
bi00004a039.
12.
Gately, D., and Howell, S. (1993) Cellular accumulation of
25.
Brandes, A. A., Bartolotti, M., Tosoni, A., and Franceschi, E.
the anticancer agent cisplatin: a review, Br. J. Cancer, 67,
(2016) Nitrosoureas in the management of malignant
1171 1176, doi: 10.1038/bjc.1993.221.
gliomas, Curr. Neurol. Neurosci. Rep., 16, 13, doi: 10.1007/
13.
Zhou, J., Kang, Y., Chen, L., Wang, H., Liu, J., Zeng, S.,
s11910 015 0611 8.
and Yu, L. (2020) The drug resistance mechanisms of five
26.
Nikolova, T., Roos, W. P., Krämer, O. H., Strik, H. M., and
platinum based antitumor agents, Front. Pharmacol., 11,
Kaina, B. (2017) Chloroethylating nitrosoureas in cancer
1 17, doi: 10.3389/fphar.2020.00343.
therapy: DNA damage, repair and cell death signaling,
14.
Bancroft, D. P., Lepre, C. A., and Lippard, S. J. (1990)
Biochim. Biophys. Acta Rev. Cancer,
1868,
2939,
Platinum 195 NMR kinetic and mechanistic studies of cis
doi: 10.1016/j.bbcan.2017.01.004.
and trans diamminedichloroplatinum(II) binding to
27.
Chen, F. X., Bodell, W. J., Liang, G., and Gold, B. (1996)
DNA, J. Am. Chem. Soc., 112, 6860 6871, doi: 10.1021/
Reaction of N (2 chloroethyl) N nitrosoureas with DNA:
ja00175a020.
effect of buffers on DNA adduction, cross linking, and
15.
Fichtinger Schepman, A. M. J., Lohman, P. H. M.,
cytotoxicity, Chem. Res. Toxicol., 9, 208 214, doi: 10.1021/
Berends, F., and van Oosterom, A. T. (1987) Cis
tx950097g.
diamminedichloroplatinum(ii) induced DNA adducts in
28.
Denny, B. J., Tsang, L. L. H., Slack, J. A., Wheelhouse, R. T.,
peripheral leukocytes from seven cancer patients: quantita
and Stevens, M. F. G. (1994) NMR and molecular model
tive immunochemical detection of the adduct induction
ing investigation of the mechanism of activation of the
and removal after a single dose of cis diamminedichloro
antitumor drug temozolomide and its interaction with
platinum(ii), Cancer Res., 47, 3000 3004.
DNA, Biochemistry,
33,
90459051, doi:
10.1021/
16.
Plooy, A. C. M., Fichtinger Schepman, A. M. J., Schutte,
bi00197a003.
H. H., Van Dijk, M., and Lohman, P. H. M. (1985) The
29.
Friedman, H. S., Kerby, T., and Calvert, H.
(2000)
quantitative detection of various Pt DNA adducts in chi
Temozolomide and treatment of malignant glioma, Clin.
nese hamster ovary cells treated with cisplatin: application
Cancer Res., 6, 2585 2597.
БИОХИМИЯ том 85 вып. 8 2020
1032
ШИЛКИН и др.
30.
Tentori, L., and Graziani, G. (2002) Pharmacological
tributes to cisplatin resistance of ovarian cancer stem cells,
strategies to increase the antitumor activity of methylating
Proc. Natl. Acad. Sci. USA, 112, 4411 4416.
agents, Curr. Med. Chem., 9, 1285 1301, doi: 10.2174/
44.
Li, X. Q, Ren, J., Chen, P., Chen, Y. J., Wu, M., Wu, Y.,
0929867023369916.
Chen, K., and Li, J. (2018) Co inhibition of Pol η and
31.
Tsesmetzis, N., Paulin, C. B. J., Rudd, S. G., and Herold, N.
ATR sensitizes cisplatin resistant non small cell lung can
(2018) Nucleobase and nucleoside analogues: resistance
cer cells to cisplatin by impeding DNA damage repair, Acta
and re sensitisation at the level of pharmacokinetics, phar
Pharmacol. Sin., 39, 1359 1372, doi: 10.1038/aps.2017.
macodynamics and metabolism, Cancers (Basel), 10, 240,
187.
doi: 10.3390/cancers10070240.
45.
Zhang, J., Sun, W., Ren, C., Kong, X., Yan, W., and
32.
Berdis, A. J. (2017) Inhibiting DNA polymerases as a ther
Chen, X. (2019) A PolH transcript with a short 3′UTR
apeutic intervention against cancer, Front. Mol. Biosci., 4,
enhances PolH expression and mediates cisplatin resis
1 12, doi: 10.3389/fmolb.2017.00078.
tance, Cancer Res., 79, 3714 3724, doi: 10.1158/0008
33.
Mini, E., Nobili, S., Caciagli, B., Landini, I., and Mazzei, T.
5472.CAN 18 3928.
(2006) Cellular pharmacology of gemcitabine, Ann. Oncol.,
46.
Ceppi, P., Novello, S., Cambieri, A., Longo, M., Monica, V.,
17, 7 12, doi: 10.1093/annonc/mdj941.
Iacono, M. L., Giaj Levra, M., Saviozzi, S., Volante, M.,
34.
Liang, X., Wu, Q., Luan, S., Yin, Z., He, C., Yin, L.,
and Papotti, M. (2009) Polymerase eta mRNA expression
Zou, Y., Yuan, Z., Li, L., Song, X., He, M., Lv, C., and
predicts survival of non small cell lung cancer patients
Zhang, W. (2019) A comprehensive review of topoiso
treated with platinum based chemotherapy, Clin. Cancer
merase inhibitors as anticancer agents in the past decade,
Res.,15, 10391045, doi: 10.1158/1078 0432.CCR 08
Europ. J. Med. Chem., 171, 129168, doi: 10.1016/
1227.
j.ejmech.2019.03.034.
47.
Teng, K., Qiu, M., Li, Z., Luo, H., Zeng, Z., Luo, R.,
35.
Minotti, G., Menna, P., Salvatorelli, E., Cairo, G., and
Zhang, H., Wang, Z., Li, Y., and Xu, R. (2010) DNA poly
Gianni, L. (2004) Anthracyclines: molecular advances and
merase η protein expression predicts treatment response
pharmacologic developments in antitumor activity and
and survival of metastatic gastric adenocarcinoma patients
cardiotoxicity, Pharmacol. Rev., 56, 185 229, doi: 10.1124/
treated with oxaliplatin based chemotherapy, J. Transl.
pr.56.2.6.
Med., 8, 126, doi: 10.1186/1479 5876 8 126.
36.
Masutani, C., Kusumoto, R., Yamada, A., Dohmae, N.,
48.
Albertella, M. R., Green, C. M., Lehmann, A. R., and
Yokoi, M., Yuasa, M., Araki, M., Iwai, S., Takio, K., and
O’Connor, M. J. (2005) A role for polymerase eta in the
Hanaoka, F. (1999) The XPV (xeroderma pigmentosum
cellular tolerance to cisplatin Induced damage, Cancer
variant) gene encodes human DNA polymerase eta,
Res., 65, 9799 806, doi: 10.1158/0008 5472.CAN 05
Nature, 399, 700 704, doi: 10.1038/21447.
1095.
37.
Alt, A., Lammens, K., Chiocchini, C., Lammens, A.,
49.
Sumiyoshi, M., Soda, H., Sadanaga, N., Taniguchi, H.,
Pieck, J. C., Kuch, D., Hopfner, K. P., and Carell, T.
Ikeda, T., Maruta, H., Dotsu, Y., Ogawara, D., Fukuda, Y.,
(2007) Bypass of DNA lesions generated during anticancer
and Mukae, H. (2017) Alert regarding cisplatin induced
treatment with cisplatin by DNA polymerase eta, Science,
severe adverse events in cancer patients with xeroderma
318, 967 970, doi: 10.1126/science.1148242.
pigmentosum, Intern. Med., 56, 979 982, doi: 10.2169/
38.
Ouzon Shubeita, H., Baker, M., Koag, M. C., and Lee, S.
internalmedicine.56.7866.
(2019) Structural basis for the bypass of the major oxali
50.
Chen, Y. W., Cleaver, J. E., Hanaoka, F., Chang, C. F.,
platin DNA adducts by human DNA polymerase η,
and Chou, K. M. (2006) A novel role of DNA polymerase
Biochem J., 476, 747 758, doi: 10.1042/BCJ20180848.
eta in modulating cellular sensitivity to chemotherapeutic
39.
Ummat, A., Rechkoblit, O., Jain, R., Roy Choudhury, J.,
agents, Mol. Cancer Res., 4, 257 265, doi: 10.1158/1541
Johnson, R. E., Silverstein, T. D., Buku, A., Lone, S.,
7786.MCR 05 0118.
Prakash, L., Prakash, S., and Aggarwal, A. K. (2012)
51.
Rechkoblit, O., Choudhury, J. R., Buku, A., Prakash, L.,
Structural basis for cisplatin DNA damage tolerance
Prakash, S., and Aggarwal, A. K. (2018) Structural basis for
by human polymerase η during cancer chemotherapy,
polymerase η promoted resistance to the anticancer nucle
Nat. Struct. Mol. Biol., 19, 628 632, doi: 10.1038/nsmb.
oside analog cytarabine, Sci. Rep.,
8,
12702,
2295.
doi: 10.1038/s41598 018 30796 w.
40.
Vaisman, A., Masutani, C., Hanaoka, F., and Chaney, S. G.
52.
Rechkoblit, O., Johnson, R. E., Buku, A., Prakash, L.,
(2000) Efficient translesion replication past oxaliplatin and
Prakash, S., and Aggarwal, A. K. (2019) Structural insights
cisplatin GpG adducts by human DNA polymerase eta,
into mutagenicity of anticancer nucleoside analog cytara
Biochemistry, 39, 4575 4580, doi: 10.1021/bi000130k.
bine during replication by DNA polymerase η, Sci. Rep., 9,
41.
Zhao, Y., Biertümpfel, C., Gregory, M. T., Hua, Y. J.,
16400, doi: 10.1038/s41598 019 52703 7.
Hanaoka, F., and Yang, W. (2012) Structural basis of
53.
Yoon, J. H., Choudhury, R. J., Prakash, L., and Prakash, S.
human DNA polymerase η mediated chemoresistance to
(2019) Translesion synthesis DNA polymerases η, ι, and υ
cisplatin, Proc. Natl. Acad. Sci. USA, 109, 7269 7274,
promote mutagenic replication through the anticancer
doi: 10.1073/pnas.1202681109.
nucleoside cytarabine, J. Biol. Chem., 294, 19048 19054,
42.
Shachar, S., Ziv, O., Avkin, S., Adar, S., Wittschieben, J.,
doi: 10.1074/jbc.RA119.011381.
Reissner, T., Chaney, S., Friedberg, E. C., Wang, Z.,
54.
Yasui, M., Suzuki, N., Laxmi, Y. S., and Shibutani, S.
Carell, T., Geacintov, N., and Livneh, Z. (2009) Two poly
(2006) Translesion synthesis past tamoxifen derived
merase mechanisms dictate error free and error prone
DNA adducts by human DNA polymerases eta and
translesion DNA synthesis in mammals, EMBO J., 28,
kappa, Biochemistry, 45, 1216712174, doi: 10.1021/
383 393, doi: 10.1038/emboj.2008.281.
bi0608461.
43.
Srivastava, A. K., Han, C., Zhao, R., Cui, T., Dai, Y.,
55.
McDonald, J. P., Rapić Otrin, V., Epstein, J. A.,
Mao, C., Zhao, W., Zhang, X., Yu, J., and Wang, Q. E.
Broughton, B. C., Wang, X., Lehmann, A. R., Wolgemuth, D. J.,
(2015) Enhanced expression of DNA polymerase eta con
and Woodgate, R. (1999) Novel human and mouse
БИОХИМИЯ том 85 вып. 8 2020
ТРАНСЛЕЗИОННЫЙ СИНТЕЗ И РЕ ИНИЦИАЦИЯ СИНТЕЗА ДНК
1033
homologs of Saccharomyces cerevisiae DNA polymerase
68.
Zheng, Y., Deng, Z., Yin, J., Wang, S., Lu, D., Wen, X.,
eta, Genomics, 60, 20 30, doi: 10.1006/geno.1999.5906.
Li, X., Xiao, D., Hu, C., Chen, X., Zhang, W., Zhou, H.,
56.
Smith, L. A., Makarova, A. V., Samson, L., Thiesen, K. E.,
and Liu, Z. (2017) The association of genetic variations in
Dhar, A., and Bessho, T. (20120 Bypass of a psoralen DNA
DNA repair pathways with severe toxicities in NSCLC
interstrand cross link by DNA polymerases β, ι, and κ in
patients undergoing platinum based chemotherapy, Int. J.
vitro, Biochemistry,
51,
89318938, doi:
10.1021/
Cancer, 141, 2336 2347, doi: 10.1002/ijc.30921.
bi3008565.
69.
Wang, J., Wang, X., Zhao, M., Choo, S. P., Ong, S. J.,
57.
Minko, I. G., Harbut, M. B., Kozekov, I. D., Kozekova, A.,
Ong, S. Y., Chong, S. S., Teo, Y. Y., and Lee, C. G. (2014)
Jakobs, P. M., Olson, S. B., Moses, R. E., Harris, T. M.,
Potentially functional SNPs (pfSNPs) as novel genomic
Rizzo, C. J., and Lloyd, R. S. (2008) Role for DNA poly
predictors of 5 FU response in metastatic colorectal can
merase kappa in the processing of N2 N2 guanine inter
cer patients, PLoS One, 9, e111694, doi: 10.1371/journal.
strand cross links, J. Biol. Chem., 283, 17075 17082,
pone.0111694.
doi: 10.1074/jbc.M801238200.
70.
Huang, K. K., Jang, K. W., Kim, S., Kim, H. S., Kim, S. M.,
58.
Ho, V., Guainazzi, A., Derkunt, S. B., Enoiu, M., and
Kwon, H. J., Kim, H. R., Yun, H. J., Ahn, M. J., and Park,
Schärer, O. D. (2011) Structure dependent bypass of DNA
K. U. (2016) Exome sequencing reveals recurrent REV3L
interstrand crosslinks by translesion synthesis polymerases,
mutations in cisplatin resistant squamous cell carcinoma
Nucleic Acids Res., 39, 7455 7464, doi: 10.1093/nar/
of head and neck, Sci. Rep., 6, 19552, doi: 10.1038/
gkr448.
srep19552.
59.
Jha, V., and Ling, H. (2018) Structural basis for human
71.
Xu, H. L., Gao, X. R., Zhang, W., Cheng, J. R.,
DNA polymerase kappa to bypass cisplatin intrastrand
Tan, Y. T., Zheng, W., Shu, X. O., and Xiang, Y. B. (2013)
cross link (Pt GG) lesion as an efficient and accurate
Effects of polymorphisms in translesion DNA synthesis
extender,
J.
Mol.
Biol.,
430,
15771589,
genes on lung cancer risk and prognosis in Chinese men,
doi: 10.1016/j.jmb.2018.04.023.
Cancer Epidemiol., 37, 917 922, doi: 10.1016/j.canep.
60.
Kanemaru, Y., Suzuki, T., Sassa, A., Matsumoto, K.,
2013.08.003.
Adachi, N., Honma, M., Numazawa, S., and Nohmi, T.
72.
Baranovskiy, A. G., Lada, A. G., Siebler, H. M., Zhang, Y.,
(2017) DNA polymerase kappa protects human cells
Pavlov, Y. I., and Tahirov, T. H. (2012) DNA polymerase δ
against MMC induced genotoxicity through error free
and ζ switch by sharing accessory subunits of DNA poly
translesion DNA synthesis, Genes Environ.,
39,
6,
merase δ, J. Biol. Chem., 287, 17281 17287, doi: 10.1074/
doi: 10.1186/s41021 016 0067 3.
jbc.M112.351122.
61.
Takeiri, A., Wada, N. A., Motoyama, S., Matsuzaki, K.,
73.
Lee, Y. S., Gregory, M. T., and Yang, W. (2014) Human Pol
Tateishi, H., Matsumoto, K., Niimi, N., Sassa, A., Grúz, P.,
ζ purified with accessory subunits is active in translesion
Masumura, K., Yamada, M., Mishima, M., Jishage, K. I.,
DNA synthesis and complements Pol η in cisplatin bypass,
and Nohmi, T. (2014) In vivo evidence that DNA poly
Proc. Natl. Acad. Sci. USA,
111,
29542959,
merase kappa is responsible for error free bypass across
doi: 10.1073/pnas.1324001111.
DNA cross links induced by mitomycin C, DNA Rep., 24,
74.
Makarova, A. V., Stodola, J. L., and Burgers, P. M. (2012)
113 121, doi: 10.1016/j.dnarep.2014.09.002.
A four subunit DNA polymerase ζ complex containing Pol
62.
Williams, H. L., Gottesman, M. E., and Gautier, J. (2012)
δ accessory subunits is essential for PCNA mediated muta
Replication independent repair of DNA interstrand
genesis, Nucleic Acids Res.,
40,
1161811626,
crosslinks, Mol. Cell, 47, 140 147, doi: 10.1016/j.mol
doi: 10.1093/nar/gks948.
cel.2012.05.001.
75.
Rizzo, A. A., Vassel, F. M., Chatterjee, N., D’Souza, S.,
63.
Zhuo, M., Gorgun, M. F., and Englander, E. W. (2018)
Li, Y., Hao, B., Hemann, M. T., Walker, G. C., and
Translesion synthesis DNA polymerase kappa is indispens
Korzhnev, D. M. (2018) Rev7 dimerization is important
able for DNA repair synthesis in cisplatin exposed dorsal
for assembly and function of the Rev1/Polζ translesion
root ganglion neurons, Mol. Neurobiol., 55, 2506 2515,
synthesis complex, Proc. Natl. Acad. Sci. USA, 115, 8191
doi: 10.1007/s12035 017 0507 5.
8200, doi: 10.1073/pnas.1801149115.
64.
Shao, M., Jin, B., Niu, Y., Ye, J., Lu, D., and Han, B.
76.
Adachi, M., Ijichi, K., Hasegawa, Y., Ogawa, T.,
(2014) Association of POLK polymorphisms with plat
Nakamura, H., Yasui, Y., Fukushima, M., and Ishizaki, K.
inum based chemotherapy response and severe toxicity
(2008) Hypersensitivity to cisplatin after hRev3 mRNA
in non small cell lung cancer Patients, Cell
knockdown in head and neck squamous cell carcinoma
Biochem. Biophys., 70, 1227 1237, doi: 10.1007/s12013
cells, Mol. Med. Rep.,
1,
695698, doi:
10.3892/
014 0046 x.
mmr_00000015.
65.
Goričar, K., Kovač, V., and Dolžan, V. (2014) Polymor
77.
Chen, X., Zhu, H., Ye, W., Cui, Y., and Chen, M. (2019)
phisms in translesion polymerase genes influence treat
MicroRNA 29a enhances cisplatin sensitivity in non small
ment outcome in malignant mesothelioma, Pharmaco%
cell lung cancer through the regulation of REV3L, Mol.
genomics, 15, 941 950, doi: 10.2217/pgs.14.14.
Med. Rep., 19, 831 840, doi: 10.3892/mmr.2018.9723.
66.
Ye, J., Chu, T., Li, R., Niu, Y., Jin, B., Xia, J., Shao, M.,
78.
Lin, X., Trang, J., Okuda, T., Stephen, B., and Howell, S. B.
and Han, B. (2015) Pol ζ polymorphisms are associated
(2006) DNA polymerase zeta accounts for the reduced
with platinum based chemotherapy response and side
cytotoxicity and enhanced mutagenicity of cisplatin in
effects among non small cell lung cancer patients,
human colon carcinoma cells that have lost DNA mis
Neoplasma, 62, 833 839, doi: 10.4149/neo_2015_101.
match repair, Clin. Cancer Res.,
12,
563568,
67.
Goričar, K., Kovač, V., Jazbec, J., Zakotnik, B., Lamovec, J.,
doi: 10.1158/1078 0432.CCR 05 1380.
and Dolžan, V. (2015) Translesion polymerase genes poly
79.
Song, L., McNeil, E. M., Ritchie, A. M., Astell, K. R.,
morphisms and haplotypes influence survival of osteosar
Gourley, C., and Melton, D. W. (2017) Melanoma cells
coma patients, OMICS, 19, 180 185, doi: 10.1089/omi.
replicate through chemotherapy by reducing levels of key
2014.0159.
homologous recombination protein RAD51 and increasing
4 БИОХИМИЯ том 85 вып. 8 2020
1034
ШИЛКИН и др.
expression of translesion synthesis DNA polymerase ζ,
J. Biol. Chem., 283, 2364523655, doi: 10.1074/jbc.
BMC Cancer, 17, 864, doi: 10.1186/s12885 017 3864 6.
M801686200.
80.
Wang, H., Zhang, S. Y., Wang, S, Lu, J., Wu, W., Weng, L.,
93. Lin, X., Okuda, T., Trang, J., and Howell, S. B. (2006)
Chen, D., Zhang, Y., Lu, Z., Yang, J., Chen, Y., Zhang, X.,
Human REV1 modulates the cytotoxicity and mutagenici
Chen, X., Xi, C., Lu, D., and Zhao, S. (2009) REV3L con
ty of cisplatin in human ovarian carcinoma cells, Mol.
fers chemoresistance to cisplatin in human gliomas: the
Pharmacol.,
69,
17481754, doi:
10.1124/mol.105.
potential of its RNAi for synergistic therapy, Neuro Oncol.,
020446.
11, 790 802, doi: 10.1215/15228517 2009 015.
94. Okuda, T., Lin, X., Trang, J., and Howell, S. B. (2005)
81.
Wang, W., Sheng, W., Yu, C., Cao, J., Zhou, J., Wu, J.,
Suppression of hREV1 expression reduces the rate at which
Zhang, H., and Zhang, S. (2015) REV3L modulates cis
human ovarian carcinoma cells acquire resistance to cis
platin sensitivity of non small cell lung cancer H1299 cells,
platin, Mol. Pharmacol., 67, 1852 1860, doi: 10.1124/mol.
Oncol. Rep., 34, 1460 1468, doi: 10.3892/or.2015.4121.
104.010579.
82.
Wu, F., Lin, X., Okuda, T., and Howell, S. B. (2004) DNA
95. Rusz, O., Pál, M., Szilágyi, É., Rovó, L., Varga, Z.,
Polymerase zeta regulates cisplatin cytotoxicity, muta
Tomisa, B., Fábián, G., Kovács, L., Nagy, O., Mózes, P.,
genicity, and the rate of development of cisplatin resis
Reisz, Z., Tiszlavicz, L., Deák, P., and Kahán, Z. (2017)
tance, Cancer Res., 64, 8029 8035, doi: 10.1158/0008
The expression of checkpoint and DNA repair genes in
5472.CAN 03 3942.
head and neck cancer as possible predictive factors, Pathol.
83.
Zhu, X., Zou, S., Zhou, J., Zhu, H., Zhang, S., Shang, Z.,
Oncol. Res., 23, 253 264, doi: 10.1007/s12253 016 0088 z.
Ding, W. Q., Wu, J., and Chen, Y. (2016) REV3L, the cat
96. Actis, M. L., Ambaye, N. D., Evison, B. J., Shao, Y.,
alytic subunit of DNA polymerase ζ, is involved in the pro
Vanarotti, M., Inoue, A., McDonald, E. T., Kikuchi, S.,
gression and chemoresistance of esophageal squamous cell
Heath, R., Hara, K., Hashimoto, H., and Fujii, N. (2016)
carcinoma, Oncol. Rep., 35, 1664 1670, doi: 10.3892/or.
Identification of the first small molecule inhibitor of the
2016.4549.
REV7 DNA repair protein interaction, Bioorg. Med.
84.
Roos, W. P., Tsaalbi Shtylik, A., Tsaryk, R., Güvercin, F.,
Chem., 24, 4339 4346, doi: 10.1016/j.bmc.2016.07.026.
de Wind, N., and Kaina, B., The translesion polymerase
97. Coggins, G. E., Maddukuri, L., Penthala, N. R.,
Rev3L in the tolerance of alkylating anticancer drugs, Mol.
Hartman, J. H., Eddy, S., Ketkar, A., Crooks, P. A., and
Pharmacol., 76, 927 934, doi: 10.1124/mol.109.058131.
Eoff, R. L. (2013) N aroyl indole thiobarbituric acids as
85.
Doles, J., Oliver, T. G., Cameron, E. R., Hsu, G., Jacks, T.,
inhibitors of DNA repair and replication stress response
Walker, G. C., and Hemann, M. T. (2010) Suppression of
polymerases, ACS Chem. Biol., 8, 1722 1729, doi: 10.1021/
Rev3, the catalytic subunit of pol zeta, sensitizes drug
cb400305r.
resistant lung tumors to chemotherapy, Proc. Nat. Acad.
98. Dash, R. C., Ozen, Z., McCarthy, K. R., Chatterjee, N.,
Sci. USA,
107,
2078620791, doi:
10.1073/pnas.
Harris, C. A., Rizzo, A. A., Walker, G. C., Korzhnev, D. M.,
1011409107.
and Hadden, M. K. (2019) Virtual pharmacophore screen
86.
Yang, L., Shi, T., Liu, F., Ren, C., Wang, Z., Li, Y., Tu, X.,
ing identifies small molecule inhibitors of the Rev1
Yang, G., and Cheng, X. (2015) REV3L, a promising tar
CT/RIR protein protein interaction, Chem. Med. Chem.,
get in regulating the chemosensitivity of cervical cancer
14, 1610 1617, doi: 10.1002/cmdc.201900307.
cells, PLoS One,
10, e0120334, doi:
10.1371/
99. Dash, R. C., Ozen, Z., Rizzo, A. A., Lim, S., Korzhnev, D.
journal.pone.0120334.
M., and Hadden, M. K. (2018) Structural approach to
87.
Xie, K., Doles, J., Hemann, M. T., and Walker, G. C.
identify a lead scaffold that targets the translesion synthesis
(2010) Error prone translesion synthesis mediates acquired
polymerase Rev1, J. Chem. Inf. Model., 58, 2266 2277,
chemoresistance, Proc. Natl. Acad. Sci. USA, 107, 20792
doi: 10.1021/acs.jcim.8b00535.
20797, doi: 10.1073/pnas.1011412107.
100. Ozen, Z., Dash, R. C., McCarthy, K. R., Chow, S. A.,
88.
Gu, C., Luo, J., Lu, X., Tang, Y., Ma, Y., Yun, Y., Cao, J.,
Rizzo, A. A., Korzhnev, D. M., and Hadden, M. K. (2018)
Cao, J., Huang, Z., and Zhou, X. (2019) REV7 confers
Small molecule scaffolds that disrupt the Rev1 CT/RIR
radioresistance of esophagus squamous cell carcinoma by
protein-protein interaction, Bioorg. Med. Chem., 26,
recruiting PRDX2, Cancer Sci., 110, 962, doi: 10.1111/
4301 4309, doi: 10.1016/j.bmc.2018.07.029.
cas.13946.
101. Sail, V., Rizzo, A. A., Chatterjee, N., Dash, R. C., Ozen, Z.,
89.
Okina, S., Yanagisawa, N., Yokoyama, M., Sakurai, Y.,
Walker, G. C., Korzhnev, D. M., and Hadden, M. K.
Numata, Y., Umezawa, A., Higashihara, M., and
(2017) Identification of small molecule translesion synthe
Murakumo, Y. (2015) High expression of REV7 is an inde
sis inhibitors that target the Rev1 CT/RIR protein-pro
pendent prognostic indicator in patients with diffuse large
tein interaction, ACS Chem. Biol.,
12,
19031912,
B cell lymphoma treated with rituximab, Int. J.
doi: 10.1021/acschembio.6b01144.
Hematology, 102, 662669, doi: 10.1007/s12185 015
102. Vanarotti, M., Evison, B. J., Actis, M. L., Inoue, A.,
1880 3.
McDonald, E. T., Shao, Y., Heath, R. J., and Fujiia, N.
90.
Masuda, Y., and Kamiya, K. (2002) Biochemical proper
(2018) Small molecules that bind to the ubiquitin binding
ties of the human REV1 protein, FEBS Lett., 520, 88 92,
motif of REV1 inhibit REV1 interaction with K164
doi: 10.1016/s0014 5793(02)02773 4.
monoubiquitinated PCNA and suppress DNA damage tol
91.
Choi, J. Y., Lim, S., Kim, E. J., Jo, A., and Guengerich, F.
erance, Bioorg. Med. Chem., 26, 2345 2353, doi: 10.1016/
P. (2010) Translesion synthesis across abasic lesions by
j.bmc.2018.03.028.
human B family and Y family DNA polymerases α, δ, η,
103. Wojtaszek, J. L., Chatterjee, N., Najeeb, J., Ramos, A.,
ι, κ, and REV1, J. Mol. Biol., 404, 34 44, doi: 10.1016/
Lee, M., Bian, K., Xue, J. Y., Fenton, B. A., Park, H., Li, D.,
j.jmb.2010.09.015.
Hemann, M. T., Hong, J., Walker, G. C., and Zhou, P.
92.
Choi, J. Y., and Guengerich, F. P. (2008) Kinetic analysis
(2019) A small molecule targeting mutagenic translesion
of translesion synthesis opposite bulky N2 and O6 alkyl
synthesis improves chemotherapy, Cell, 178, 152 159,
guanine DNA adducts by human DNA polymerase REV1,
doi: 10.1016/j.cell.2019.05.028.
БИОХИМИЯ том 85 вып. 8 2020
ТРАНСЛЕЗИОННЫЙ СИНТЕЗ И РЕ ИНИЦИАЦИЯ СИНТЕЗА ДНК
1035
104. Yamanaka, K., Dorjsuren, D., Eoff, R. L., Egli, M.,
116. Liu, J., Lee, W., Jiang, Z., Chen, Z., Jhunjhunwala, S.,
Maloney, D. J., Jadhav, A., Simeonov, A., Stephen, R., and
Haverty, P. M., Gnad, F., Guan, Y., Gilbert, H. N.,
Lloyd, R. S. (2012) A comprehensive strategy to discover
Stinson, J., Klijn, C., Guillory, J., Bhatt, D., Vartanian, S.,
inhibitors of the translesion synthesis DNA polymerase κ,
Walter, K., Chan, J., Holcomb, T., Dijkgraaf, P., Johnson, S.,
PLoS One, 7, e45032, doi: 10.1371/journal.pone.0045032.
Koeman, J., Minna, J. D., Gazdar, A. F., Stern, H. M.,
105. Zafar, M. K., Maddukuri, L., Ketkar, A., Penthala, N. R.,
Hoeflich, K. P., Wu, T. D., Settleman, J., de Sauvage, F. J.,
Reed, M. R., Eddy, S., Crooks, P. A., and Eoff, R. L.
Gentleman, R. C., Neve, R. M., Stokoe, D., Modrusan, Z.,
(2018) A small molecule inhibitor of human DNA poly
Seshagiri, S., Shames, D. S., and Zhang, Z.
(2012)
merase η potentiates the effects of cisplatin in tumor cells,
Genome and transcriptome sequencing of lung cancers
Biochemistry, 57, 1262 1273, doi: 10.1021/acs.biochem.
reveal diverse mutational and splicing events, Genome Res.,
7b01176.
22, 2315 2327, doi: 10.1101/gr.140988.112.
106. Dumstorf, C. A., Mukhopadhyay, S., Krishnan, E.,
117. D az Talavera, A., Calvo, P. A., González Acosta, D.,
Haribabu, B., and McGregor, W. G. (2009) REV1 is impli
D az, M., Sastre Moreno, G., Blanco Franco, L., Guerra, S.,
cated in the development of carcinogen induced lung can
Mart nez Jiménez, M. I., Méndez, J., and Blanco, L.
cer, Mol. Cancer Res., 7, 247 254, doi: 10.1158/1541
(2019) A cancer associated point mutation disables the
7786.MCR 08 0399.
steric gate of human PrimPol, Sci. Rep., 9, 1121,
107. Lakhin, A. V., Kazakov, A. A., Makarova, A. V., Pavlov, Y. I.,
doi: 10.1038/s41598 018 37439 0.
Efremova, A. S., Shram, S. I., Tarantul, V. Z., and Gening,
118. Taylor, M. R. G., and Yeeles, J. T. P. (2018) The initial
L. V. (2012) Isolation and characterization of high affinity
response of a eukaryotic replisome to DNA damage, Mol.
aptamers against DNA polymerase iota, Nucleic Acids
Cell, 70, 1067 1080, doi: 10.1016/j.molcel.2018.04.022.
Ther., 22, 49 57, doi: 10.1089/nat.2011.0324.
119. Lopes, M., Foiani, M., and Sogo, J. M. (2006) Multiple
108. Zafar, M. K., and Eoff, R. L. (2017) Translesion DNA syn
mechanisms control chromosome integrity after replica
thesis in cancer: molecular mechanisms and therapeutic
tion fork uncoupling and restart at irreparable UV
opportunities, Chem. Res. Toxicol.,
30,
19421955,
lesions, Mol. Cell, 21, 15 27, doi: 10.1016/j.molcel.2005.
doi: 10.1021/acs.chemrestox.7b00157.
11.015.
109. Choi, J. S., Kim, S., Motea, E., and Berdis, A. (2017)
120. Svoboda, D. L., and Vos, J. M. (1995) Differential replica
Inhibiting translesion DNA synthesis as an approach to
tion of a single, UV induced lesion in the leading or lagging
combat drug resistance to DNA damaging agents,
strand by a human cell extract: fork uncoupling or gap for
Oncotarget, 20, 40804 40816, doi: 10.18632/oncotarget.
mation, Proc. Natl. Acad. Sci. USA, 92, 11975 11979,
17254.
doi: 10.1073/pnas.92.26.11975.
110. Garc a Gómez, S., Reyes, A., Mart nez Jiménez, M. I.,
121. Veaute, X., Mari Giglia, G., Lawrence, C. W., and Sarasin, A.
Chocrón, E. S., Mourón, S., Terrados, G., Powell, C.,
(2000) UV lesions located on the leading strand inhibit
Salido, E., Méndez, J., Holt, I. J., and Blanco, L. (2013)
DNA replication but do not inhibit SV40 T antigen heli
PrimPol, an archaic primase/polymerase operating in
case activity, Mutat. Res., 459, 19 28, doi: 10.1016/s0921
human cells, Mol. Cell, 52, 541 553, doi: 10.1016/j.mol
8777(99)00052 x.
cel.2013.09.025.
122. Elvers, I., Johansson, F., Groth, P., Erixon, K., and
111.
Bianchi, J., Rudd, S. G., Jozwiakowski, S. K., Bailey, L. J.,
Helleday, T. (2011) UV stalled replication forks restart by
Soura, V., Taylor, E., Stevanovic, I., Green, A. J.,
re priming in human fibroblasts, Nucleic Acids Res., 39,
Stracker, T. H., Lindsay, H. D., and Doherty, A. J. (2013)
7049 7057, doi: 10.1093/nar/gkr420.
PrimPol bypasses UV photoproducts during eukaryotic
123. Hedglin, M., and Benkovic, S. J. (2017) Eukaryotic
chromosomal DNA replication, Mol. Cell, 52, 566 573,
translesion DNA synthesis on the leading and lagging
doi: 10.1016/j.molcel.2013.10.035.
strands: unique detours around the same obstacle, Chem.
112. Kobayashi, K., Guilliam, T. A., Tsuda, M., Yamamoto, J.,
Rev., 117, 7857 7877, doi: 10.1021/acs.chemrev.7b00046.
Bailey, L. J., Iwai, S., Takeda, S., Doherty, A. J., and
124. Schiavone, D., Jozwiakowski, S. K., Romanello, M.,
Hirota, K. (2016) Repriming by PrimPol is critical for
Guilbaud, G., Guilliam, T. A., Bailey, L. J., Sale, J. E., and
DNA replication restart downstream of lesions and chain
Doherty, A. J. (2016) PrimPol is required for replicative
terminating nucleosides, Cell Cycle, 15, 19972008,
tolerance of G quadruplexes in vertebrate cells, Mol. Cell,
doi: 10.1080/15384101.2016.1191711.
61, 161 169, doi: 10.1016/j.molcel.2015.10.038.
113. Quinet, A., Tirman, S., Jackson, J., Šviković, S.,
125. Pilzecker, B., Buoninfante, O. A., Pritchard, C.,
Lemaçon, D., Carvajal Maldonado, D., González
Blomberg, O. S., Huijbers, I. J., van den Berk, P. C. M.,
Acosta, D., Vessoni, A. T., Cybulla, E., Wood, M., Tavis, S.,
and Jacobs, H. (2016) PrimPol prevents APOBEC/AID
Batista, L. F. Z., Méndez, J., Sale, J. E., and Vindigni, A.
family mediated DNA mutagenesis, Nucleic Acids Res., 44,
(2020) PRIMPOL mediated adaptive response suppresses
4734 4744, doi: 10.1093/nar/gkw123.
replication fork reversal in BRCA deficient cells, Mol. Cell,
126. Han, T., Goralski, M., Capota, E., Padrick, S. B., Kim, J.,
77, 461 474, doi: 10.1016/j.molcel.2019.10.008.
Xie, Y., and Nijhawan, D. (2016) The anti tumor toxin
114. Hatano, Y., Tamada, M., Matsuo, M., and Hara, A. (2020)
CD437 is a direct inhibitor of DNA polymerase α, Nat.
Molecular trajectory of BRCA1 and BRCA2 mutations,
Chem. Biol., 12, 511 515, doi: 10.1038/nchembio.2082.
Front Oncol., 10, 361, doi: 10.3389/fonc.2020.00361.
127. Abdel Samad, R., Aouad, P., Gali Muhtasib, H.,
115. Tokarsky, E. J., Wallenmeyer, P. C., Phi, K. K., and Suo, Z.
Sweidan, Z., Hmadi, R., Kadara, H., D’Andrea, E. L.,
(2017) Significant impact of divalent metal ions on the
Fucci, A., Pisano, C., and Darwiche, N.
(2018)
fidelity, sugar selectivity, and drug incorporation efficiency
Mechanism of action of the atypical retinoid ST1926 in
of human primPol, DNA Rep., 49, 51 59, doi: 10.1016/
colorectal cancer: DNA damage and DNA polymerase α,
j.dnarep.2016.11.003.
Am. J. Cancer Res., 8, 39 55.
БИОХИМИЯ том 85 вып. 8 2020
4*
1036
ШИЛКИН и др.
TRANSLESION SYNTHESIS AND RE INITIATION
OF DNA SYNTHESIS IN CHEMOTHERAPY RESISTANCE
Review
E. S. Shilkin1, Е. O. Boldinova1, A. D. Stolyarenko1, R. I. Goncharova2,
R. N. Chuprov Netochin3, M. P. Smal2*, and A. V. Makarova1*
1 Institute of Molecular Genetics of the Russian Academy of Sciences,
123182 Moscow, Russia; E%mail: amakarova%img@yandex.ru
2 Institute of Genetics and Cytology of the National Academy of Sciences of Belarus,
220072 Minsk, Belarus; E%mail: m.smal@igc.by
3 Moscow Institute of Physics and Technology, 141701 Dolgoprudny, Moscow Region, Russia
Received April 16, 2020
Revised June 26, 2020
Accepted June 26, 2020
Many chemotherapy drugs block tumor cell division by damaging DNA. DNA polymerases eta (Pol η), iota (Pol ι),
kappa (Pol κ), REV1 of the Y family and zeta (Pol ζ) of the B family efficiently incorporate nucleotides opposite a
number of DNA lesions during translesion DNA synthesis. Primase polymerase PrimPol and the Pol α primase com
plex reinitiate DNA synthesis downstream of the damaged sites using their DNA primase activity. These enzymes can
decrease the efficacy of chemotherapy drugs, contribute to the survival of tumor cells and to the progression of malig
nant diseases. DNA polymerases are promising targets for increasing the effectiveness of chemotherapy, and muta
tions and polymorphisms in some DNA polymerases can serve as additional prognostic markers in a number of onco
logical disorders.
Keywords: translesion DNA synthesis, DNA lesions, resistance to chemotherapy drugs
БИОХИМИЯ том 85 вып. 8 2020