БИОХИМИЯ, 2020, том 85, вып. 8, с. 1037 - 1050
УДК 576.32/.36
РОЛЬ ГИДРОЛАЗ СЕМЕЙСТВА NUDIX В МЕТАБОЛИЗМЕ NAD
И ADP РИБОЗЫ У МЛЕКОПИТАЮЩИХ
Обзор
© 2020
В.А. Куликова1,2,3*, А.А. Никифоров2
1 ФГАОУ ВО Санкт Петербургский политехнический университет имени Петра Великого,
195251 Санкт Петербург, Россия; электронная почта: veronika.a.kulikova@gmail.com
2 ФГБУН Институт цитологии РАН, 194064 Санкт Петербург, Россия
3 ФГБУ Институт эволюционной физиологии и биохимии имени И.М. Сеченова РАН,
194223 Санкт Петербург, Россия
Поступила в редакцию 29.04.2020
После доработки 21.06.2020
Принята к публикации 22.06.2020
Белки суперсемейства NUDIX гидролаз (NUDT), расщепляющие органические пирофосфаты, найдены во
всех классах организмов от архей и бактерий до высших эукариот. У млекопитающих белки данного семей#
ства имеют широкий спектр функций и характеризуются различной субстратной специфичностью и внут#
риклеточной локализацией. Они контролируют концентрации различных метаболитов в клетке, в том чис#
ле ключевых регуляторных молекул, таких как NAD, ADP#рибоза и их производных. В данном обзоре рас#
смотрена роль белков NUDT в метаболизме NAD и ADP#рибозы в клетках человека и животных.
КЛЮЧЕВЫЕ СЛОВА: NUDIX гидролазы, NAD, ADP#рибоза, метаболизм.
DOI: 10.31857/S0320972520080047
ВВЕДЕНИЕ
щих структуру NDP#X (NDP - нуклеозидди#
фосфат, Х - любое соединение). В результате
Белки суперсемейства NUDIX гидролаз
гидролиза пирофосфатной связи образуется
(NUDT) найдены во всех классах организмов от
нуклеозидмонофосфат (NMP) и P#X. Субстра#
архей и бактерий до высших эукариот. Данные
тами NUDIX гидролаз являются (дезокси)нук#
ферменты расщепляют широкий спектр органи#
леозидтрифосфаты, в том числе их окисленные
ческих пирофосфатов, преимущественно имею#
формы, нуклеотидные сахара и спирты, динук#
леозидные полифосфаты (NpnN), а также кэп#
Принятые сокращения: NUDT - белки суперсе# структуры РНК. Все белки семейства NUDIX
мейства NUDIX гидролаз; ADPR - ADP#рибоза (ADP# имеют
консервативный каталитический
ribose); OAcADPR - О#ацетил#ADP#рибоза (O#acetyl#
NUDIX домен (NUDIX box), состоящий из 23
ADP#ribose); PARP - семейство белков поли(ADP#рибо#
за)полимераз (poly(ADP#ribose)polymerase); Nam - нико#
аминокислот GX5EX5[UA]XREX2EEXGU, где
тинамид (nicotinamide); PAR - полимеры ADP#рибозы
U - алифатическая гидрофобная аминокисло#
(poly(ADP#ribose)); ЭР - эндоплазматический ретикулум; та, X - любая аминокислота [1].
PARG - поли#ADP#рибозилгликогидролаза (poly(ADP#
К настоящему времени у млекопитающих
ribose) glycohydrolase); ARH - семейство белков ADP#ри#
бозилгидролаз (ADP#ribosylhydrolase); TARG - терминаль#
охарактеризовано 24 гена, кодирующих белки
ная ADP#рибозилгидролаза (terminal ADP#ribose protein
семейства NUDIX гидролаз. Белки данного се#
glycohydrolase1); SIRT1#7 - белки семейства сиртуинов;
мейства имеют широкий спектр функций и ха#
cADPR - циклическая ADP#рибоза (cyclic ADP#ribose); рактеризуются различной субстратной специ#
R5′P- рибозо#5′#фосфат (ribose#5′#phosphate); АФК - ак#
фичностью и внутриклеточной локализацией.
тивные формы кислорода; GAPDH - глицеральдегид#3#
фосфатдегидрогеназа (glyceraldehyde 3#phosphate dehydro#
Одни гидролазы расщепляют окисленные нук#
genase); NMN - никотинамидмононуклеотид (nicoti#
леотиды, которые обладают мутагенным потен#
namide mononucleotide); NMNAT - семейство белков циалом, другие контролируют внутриклеточные
никотинамидмононуклеотидаденилилтрансфераз (nicoti# концентрации различных метаболитов, в том
namide mononucleotide adenylyltransferase); ANT - аденин#
числе важнейших регуляторных молекул [1, 2].
нуклеотидтранслоказа (adenine nucleotide translocase);
AMPK - AMP#активируемая протеинкиназа (AMP#activat#
Например, цитозольные NUDIX гидролазы
ed protein kinase); NAD - никотинамидадениндинуклеотид.
млекопитающих (NUDT1, NUDT5 и NUDT15)
* Адресат для корреспонденции.
расщепляют окисленные нуклеотиды и предо#
1037
1038
КУЛИКОВА, НИКИФОРОВ
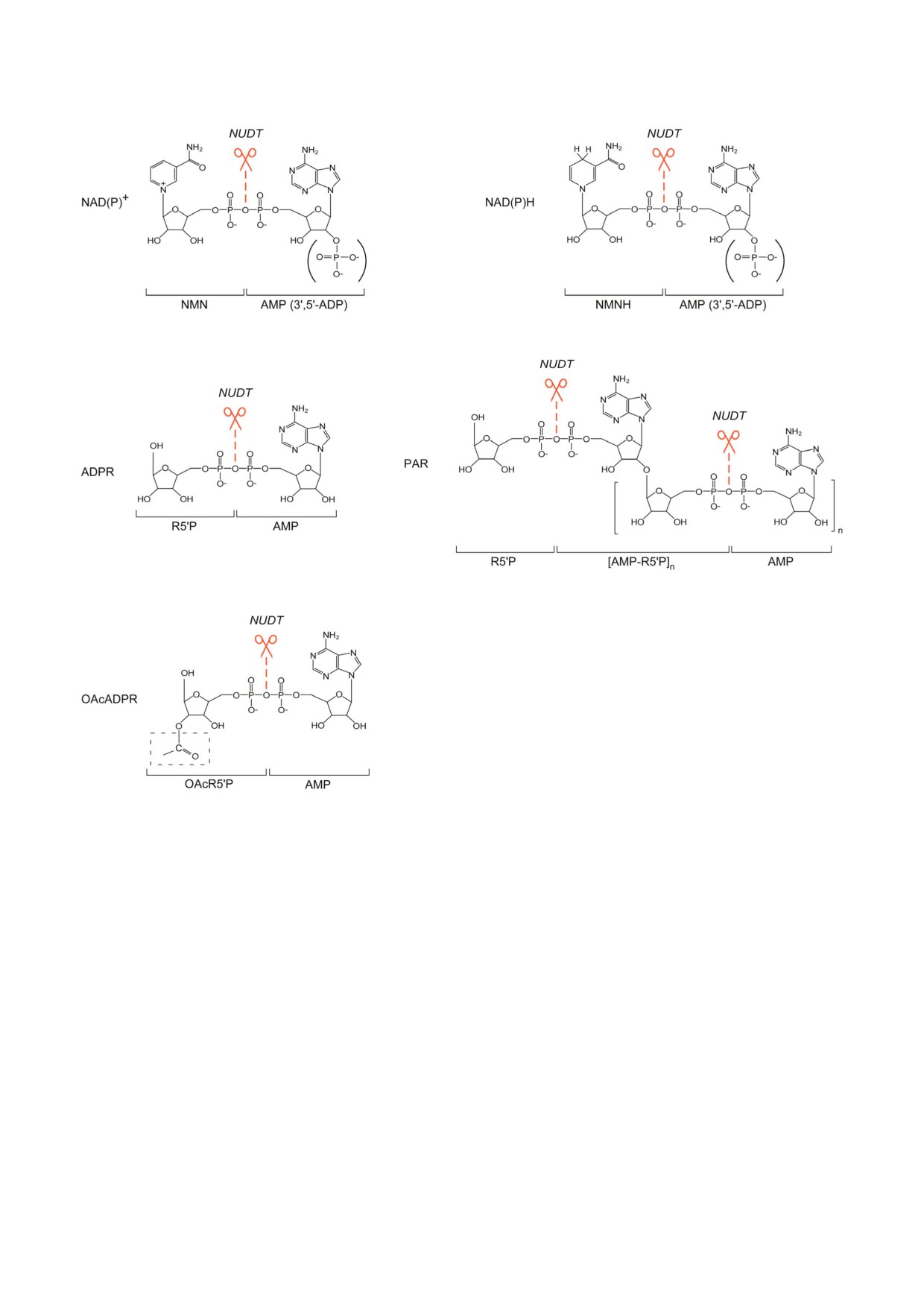
Рис. 1. Структуры NAD(P), ADP#рибозы и её производных - субстратов гидролаз семейства NUDIX. NUDIX гидролазы
(NUDT) млекопитающих расщепляют NAD(P)+ на NMN и AMP (3′,5′#ADP). NAD(P)H расщепляется на NMNH и AMP
(3′,5′#ADP). ADP#рибоза (ADPR) расщепляется на рибозо#5′#фосфат (R5′P) и AMP. Полимеры ADP#рибозы (PAR) рас#
щепляются с образованием R5′P, AMP и AMP, соединенного с R5′P (AMP#R5′P). О#ацетил#ADP#рибоза (OAcADPR) рас#
щепляется с образованием O#ацетил#рибозо#5′#фосфата (OAcR5′P) и AMP. (С цветными вариантами рис. 1-3 можно оз#
твращают их встраивание в ДНК и РНК, под#
с образованием 3′,5′#ADP и соответствующих
держивая стабильность генома и повышая ус#
ацильных производных
4′#фосфопантетеина
тойчивость клеток к оксидативному стрессу
[9-11]. Более того, установлено, что Nudt19
[3-6]. Другие представители семейства NUDIX
участвует в регуляции уровня СоА в почках, а
(белки NUDT20, NUDT16 и NUDT3) убирают
сверхэкспрессия Nudt7 в печени мышей приво#
5′#кэп (7#метилгуанозин) с РНК, и таким обра#
дит к уменьшению концентрации короткоцепо#
зом регулируют стабильность мРНК и малых яд#
чечных Ацил#CoA, что коррелирует со значи#
рышковых РНК и контролируют экспрессию
тельным снижением уровня желчных кислот и
генов [7, 8]. Тогда как пероксисомальные белки
скорости окисления жирных кислот в гепатоци#
мыши Nudt7 и Nudt19, а также митохондриаль#
тах [10, 11].
ный белок Nudt8 расщепляют кофермент#А
Такие важнейшие низкомолекулярные сое#
(СоA) и его ацильные производные (Ацил#СоА) динения, как NAD, NADP, ADP#рибоза и
БИОХИМИЯ том 85 вып. 8 2020
РОЛЬ NUDIX ГИДРОЛАЗ В МЕТАБОЛИЗМЕ NAD И ADP#РИБОЗЫ
1039
OAcADPR, также являются субстратами гидро#
множества других клеточных процессов, таких
лаз семейства NUDIX (рис. 1). В данном обзоре
как поддержание теломер, синтез и процессинг
рассмотрена роль белков NUDT в метаболизме
РНК, трансляция, деградация белков, ответ на
NAD и ADP#рибозы в клетках человека и жи#
клеточный стресс, вызванный накоплением в
вотных.
эндоплазматическом ретикулуме несвернутых
белков (ЭР#стресс), иммунный ответ, диффе#
ренцировка и многие другие [16, 17]. ADP#рибо#
МЕТАБОЛИЗМ NAD И ADP РИБОЗЫ
зилирование является обратимой модификаци#
У МЛЕКОПИТАЮЩИХ
ей. Поддержание баланса между ADP#рибози#
лированием белков и отщеплением ADP#рибо#
NAD является коферментом дегидрогеназ,
зы крайне важно для регуляции ответа клетки на
катализирующих окислительно#восстанови#
различные стрессовые факторы. Например, эф#
тельные реакции центральных метаболических
фективность ответа клетки на повреждение
путей в клетках человека. Ключевые реакции
ДНК зависит от баланса между активностями
гликолиза, цикла Кребса и β#окисления жир#
поли(ADP#рибоза)полимеразы PARP1 и фер#
ных кислот сопряжены с обратимым переходом
мента PARG, расщепляющего полимеры ADP#
NAD из его окисленной формы (NAD+) в вос#
рибозы [16]. Ферменты PARG и ARH3 (ADP#
становленную форму (NADH). NADH является
ribosyl#acceptor hydrolase 3) расщепляют O#гли#
донором электронов для электрон#транспорт#
козидную связь в полимерах ADP#рибозы, в то
ной цепи, работа которой сопряжена с окисли#
время как оставшуюся молекулу ADP#рибозы,
тельным фосфорилированием ADP до ATP.
присоединенную к белку, убирают ферменты -
Фосфорилированная форма NAD (NADP) так#
MacroD1, MacroD2, гликогидролаза TARG1
же является жизненно необходимым внутрикле#
(terminal ADP#ribose protein glycohydrolase 1), а
точным метаболитом. Данный динуклеотид су#
также ARH3 и ARH1 [18] (рис. 2). Недавно было
ществует преимущественно в восстановленной
показано, что субстратами ферментов семейства
форме (NADPH) и является коферментом реак#
PARP являются не только белки, но и нуклеино#
ций в анаболических процессах синтеза жирных
вые кислоты [19, 20] (рис. 2). Обратимое моно# и
кислот и холестерина, а также необходим для за#
поли#ADP#рибозилирование ДНК может играть
щиты клетки от окислительного стресса [12].
важную роль в репарации ДНК, а также в защите
В настоящее время известно, что NAD, по#
ДНК от деградации нуклеазами. Также было про#
мимо ключевой роли в энергетическом метабо#
демонстрировано, что белки человека PARP10,
лизме клетки, также играет важнейшую роль в
PARP11 и PARP15 моно#ADP#рибозилируют
различных регуляторных процессах в клетке
фосфорилированные концы РНК in vitro [21].
[13-15] (рис. 2). NAD+ используется в качестве
Другим семейством NAD+#зависимых регу#
субстрата ферментами семейства PARP для
ляторных ферментов в клетке является семей#
внутриклеточного ADP#рибозилирования бел#
ство высококонсервативных деацетилаз - сирту#
ков. В результате этой посттрансляционной мо#
инов [22]. Данные ферменты отщепляют Nam от
дификации NAD+ расщепляется на никотин#
NAD+ и переносят ацетильную группу с остатка
амид (NAM) и ADP#рибозу, затем одна (моно#
лизина модифицированного белка на ADP#ри#
ADP#рибозилирование) или несколько (поли#
бозу, в результате чего образуется OAcADPR [23].
ADP#рибозилирование) молекул ADP#рибозы
Установлено, что cиртуины деацетилируют ши#
переносятся на специфические аминокислоты
рокий спектр белковых субстратов, включая гис#
белка#мишени. Семейство PARP включает 17
тоны, регуляторные, структурные и каталити#
ферментов, четыре из которых PARP1, PARP2,
чески активные белки, и таким образом участву#
PARP5a и PARP5b являются поли(ADP#рибо#
ют в регуляции транскрипции, репарации, апо#
за)полимеразами и могут присоединять к своим
птоза, секреции инсулина, работы биологичес#
мишеням длинные разветвленные цепочки по#
ких часов, старения и многих других процессов
лимеров ADP#рибозы, PAR. Остальные предс#
[22, 24-26]. Образующаяся в результате NAD+#
тавители семейства PARP являются ADP#рибо#
зависимого деацетилирования белков OAcADPR
зилтрансферазами, катализирующими моно#
может активировать катионные каналы TRPM2
ADP#рибозилирование белков. Поли#ADP#ри#
на плазматической мембране [27]. OAcADPR
бозилирование белков является важнейшей ре#
расщепляется до ADP#рибозы белками ARH3,
гуляторной модификацией и играет ключевую
MacroD1 и MacroD2 [28, 29] (рис. 2).
роль в ответе клетки на повреждение ДНК, в ре#
Также NAD+ является субстратом ADP#ри#
гуляции транскрипции, а также в гибели клетки
бозилциклаз CD38 и SARM1, которые исполь#
[16, 17]. Также внутриклеточные моно# и поли#
зуют данный динуклеотид для синтеза ADP#ри#
ADP#рибозилирование вовлечены в регуляцию
бозы и циклической ADP#рибозы (cADPR),
БИОХИМИЯ том 85 вып. 8 2020
1040
КУЛИКОВА, НИКИФОРОВ
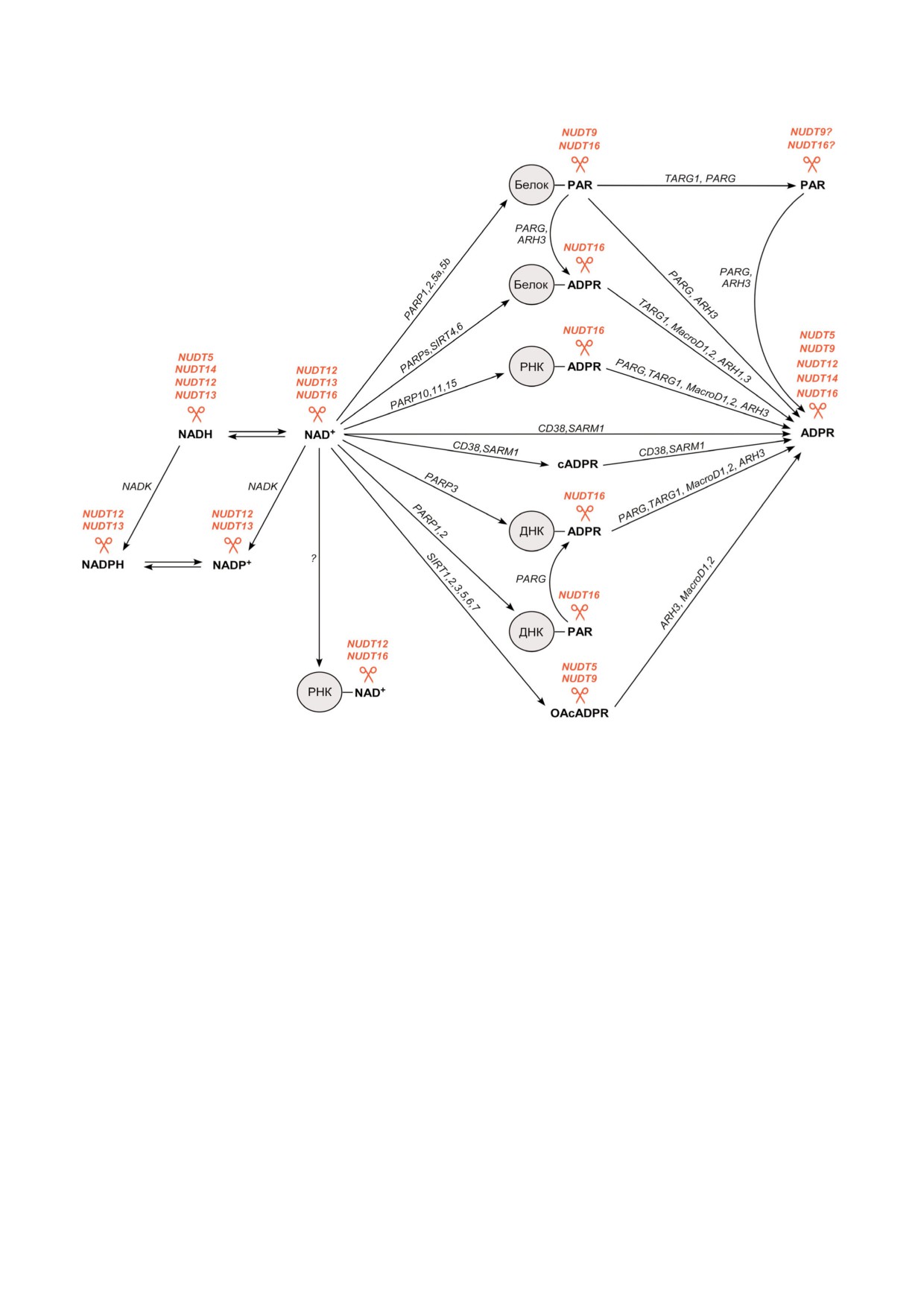
Рис. 2. Участие NUDIX гидролаз в метаболизме NAD и ADP#рибозы в клетках человека и животных. NAD+(H) фосфори#
лируется до NADP+(H) киназой NADK. В окислительно#восстановительных реакциях NAD+ и NADP+ обратимо перехо#
дят, соответственно, в восстановленные формы NADH и NADPH. NAD+(H) и NADP+(H) являются субстратами гидролаз
NUDT12 и NUDT13. NUDT5 и NUDT14 расщепляют NADH. NUDT16 расщепляет NAD+, который используется в каче#
стве субстрата ферментами семейства PARP для ADP#рибозилирования белков, ДНК и РНК, сиртуинами (SIRT) для де#
ацетилирования и ADP#рибозилирования белков, а также белками CD38 и SARM1 для синтеза ADP#рибозы (ADPR) и
циклической ADP#рибозы (cADPR) - вторичных посредников мобилизации кальция в клетке. ADPR и полимеры ADP#
рибозы (PAR), ковалентно присоединенные к молекулам белков, ДНК и РНК, О#ацетил#ADP#рибоза (OAcADPR) и
cADPR расщепляются до свободной ADPR гидролазами PARG, ARH1, ARH3, MacroD1, MacroD2, TARG1, SARM1 и
CD38. Свободная ADPR, ADPR и PAR, ковалентно присоединенные к молекулам белков, ДНК и РНК, а также OAcADPR
расщепляются гидролазами семейства NUDIX - NUDT5, NUDT9, NUDT12, NUDT14 и NUDT16. NUDT12 и NUDT16
расщепляют NAD+#кэп на 5′#конце РНК
участвующих в мобилизации кальция в клетке
Биологическая роль такой модификации пока не
[30]. Более того, белки CD38 и SARM1 могут
до конца выяснена, однако установлено, что
расщеплять cADPR с образованием ADP#рибо#
РНК, кэпированные NAD+ с 5′#конца, не могут
зы (рис. 2). cADPR стимулирует выход кальция
эффективно транслироваться, а также менее ста#
из эндоплазматического ретикулума, в то время
бильны, чем молекулы РНК, кэпированные 7#
как ADP#рибоза может активировать транспорт
метилгуанозином, и некэпированные РНК [33].
кальция из внеклеточного пространства через
Для эффективной регуляции множества
катионные каналы TRPM2 на плазматической
важнейших процессов клетка должна поддер#
мембране [31, 32].
живать определенный уровень NAD в различ#
Недавно было показано, что РНК млекопита#
ных компартментах, а также поддерживать ба#
ющих может быть кэпирована NAD+ [33] (рис. 2). ланс между образованием и расщеплением
БИОХИМИЯ том 85 вып. 8 2020
РОЛЬ NUDIX ГИДРОЛАЗ В МЕТАБОЛИЗМЕ NAD И ADP#РИБОЗЫ
1041
ADP#рибозы [14, 34, 35]. Нарушение регуляции
вативной последовательности, определяющей
уровня NAD в клетках и тканях ассоциированы
их субстратную специфичность. Однако у мно#
с широким спектром заболеваний, таких как
гих охарактеризованных гидролаз ADP#рибозы
нейродегенеративные заболевания, диабет,
семейства NUDIX из разных организмов был
ожирение, метаболический синдром, рак и мно#
выявлен консервативный остаток пролина, на#
гие другие [36]. Основным способом поддержа#
ходящийся на расстоянии 15-16 аминокислот
ния уровня NAD в клетках человека и животных
со стороны С#конца от Nudix box [44, 45].
является его синтез из Nam, который поступает
NUDIX гидролаза Ysa1 дрожжей S. сerevisiae
в организм с пищей, а также образуется в ре#
локализуется преимущественно в митохондрии
зультате расщепления NAD+ в различных регу#
и расщепляет ADP#рибозу до AMP и рибозо#5′#
ляторных процессах. Помимо этого, NAD мо#
фосфата (R5′P) in vitro и in vivo [46]. Установле#
жет эффективно синтезироваться из других
но, что белок Ysa1 контролирует уровень ADP#
форм витамина В3, а также образовываться de
рибозы в клетке, тем самым, влияя на устойчи#
novo из триптофана [35, 37, 38].
вость клеток к оксидативному стрессу и на уро#
вень эндогенных активных форм кислорода
(АФК). Ysa1 повышает уровень АФК в клетке с
РОЛЬ NUDIX ГИДРОЛАЗ ПРОСТЕЙШИХ
помощью двух различных механизмов. Показа#
В МЕТАБОЛИЗМЕ NAD И ADP РИБОЗЫ
но, что в отсутствии Ysa1 в митохондрии накап#
ливается ADP#рибоза, которая подавляет комп#
В клетках прокариот и простейших эукариот
лекс I электрон—транспортной цепи, утечка
уровень NAD регулируется не только за счет био#
электронов из которого является одним из ос#
синтеза, но также путем ферментативного рас#
новных источников образования АФК в клетке
щепления данного динуклеотида гидролазами
[46, 47]. Также было продемонстрировано, что в
семейства NUDIX [39-42].
отсутствии Ysa1 в клетках накапливается ADP#
NUDIX гидролазы, субстратами которых яв#
рибоза, которая подавляет гликолиз, ингибируя
ляются NAD+(H), обнаружены во многих клас#
глицеральдегид#3#фосфатдегидрогеназу (GAPDH),
сах организмов. Показано, что NUDIX гидрола#
в результате чего увеличивается окисление глю#
за E. сoli YjaD расщепляет NAD+ и NADH in
козы в пентозофосфатном пути и продукция
vitro. При этом NADH является в 120 раз более
NADPH. Накопление NADPH приводит к по#
предпочтительным субстратом, чем NAD+ [39].
вышению устойчивости клетки к оксидативно#
Пероксисомальный белок S. cerevisiae Npy1p
му стрессу, так как NADPH является кофермен#
также является NUDIX гидролазой, расщепля#
том редуктаз, защищающих клетку от АФК
ющей NAD+(H) и NADP+(H) in vitro [41, 42]. Ус#
[46, 48].
тановлено, что в A. nidulans белок NdxA семей#
ства NUDIX гидролаз расщепляет NAD+ и
NADH in vitro и in vivo и таким образом контро#
РОЛЬ NUDIX ГИДРОЛАЗ
лирует уровень внутриклеточного NAD и под#
МЛЕКОПИТАЮЩИХ
держивает соотношение NAD+ и NADH, тем са#
В МЕТАБОЛИЗМЕ NAD
мым регулируя важнейшие NAD#зависимые
клеточные процессы [40]. NdxA негативно регу#
Среди представителей белков семейства
лирует активность сирутина sirA, который
NUDIX у млекопитающих охарактеризовано
NAD+#зависимым образом деацетилирует оста#
два белка NUDT12 и NUDT13, последователь#
ток лизина 16 гистона Н4, тем самым регулируя
ности которых наиболее гомологичны последо#
экспрессию генов [40].
вательностям описанных ранее NAD+(H) гидро#
NUDIX гидролазы можно разделить на под#
лаз из прокариот и низших эукариот [43, 49].
семейства, характеризующиеся гомологичными
NUDT12. NUDIX гидролаза человека
последовательностями аминокислот, которые
NUDT12 имеет сигнальный пептид PNL на C#
определяют специфичность гидролаз к различ#
конце и локализуется в пероксисомах [43]. Так#
ным субстратам. У всех описанных NAD+(H)
же была показана его цитозольная локализация
гидролаз из разных организмов была выявлена
[2, 50]. Белок NUDT12 был охарактеризован in
последовательность SQPWPFPXS со стороны C#
vitro как NAD+(H) гидролаза [43]. Показано, что
конца от NUDIX box [43].
NUDT12 эффективно гидролизует NADH до
Белки семейства NUDIX, субстратом кото#
восстановленной формы NMN (NMNH) и AMP
рых является ADP#рибоза, обнаружены во мно#
(Кm = 11 мкМ, kcat = 11 с-1) и NADPH до NMNH
гих классах организмов, включая E. сoli, S. сere
и 2′,5′#ADP (Кm = 16 мкМ, kcat = 16 с-1) in vitro.
visiae и млекопитающих. У NUDIX гидролаз,
Менее эффективно белок также гидролизует
расщепляющих ADP#рибозу, нет общей консер#
NAD+ (Кm = 190 мкМ, kcat = 10,5 с-1). Также ме#
БИОХИМИЯ том 85 вып. 8 2020
1042
КУЛИКОВА, НИКИФОРОВ
нее эффективно белок гидролизует Ap2A,
ной цепи [57]. Таким образом, NUDT12 может
NADP+, FAD и ADP#рибозу. Для гидролазной
играть важную роль в регуляции экспрессии ге#
активности NUDT12 необходимы катионы
нов на уровне стабильности мРНК, однако на
Mn2+ или Mg2+. Наибольшая активность белка с
сегодняшний день функциональная роль
NADH наблюдается при значениях pH от 8,0 до
NAD+#кэпирования молекул РНК у млекопита#
9,0, при этом NUDT12 сохраняет 50% актив#
ющих до конца не ясна.
ности при значениях pH 6,5 и 11,0 [43]. Было
NUDT13. Мышиный белок Nudt13 является
продемонстрировано, что у трансгенных мышей
еще одной гидролазой млекопитающих, рас#
с полным отсутствием белка Nudt12 в печени и
щепляющей NAD+(H). Nudt13 локализуется в
почках уровень NADH (но не NAD+) в данных
митохондриях и ядре [2, 49]. Было показано, что
тканях значительно повышен [50].
Nudt13 эффективно гидролизует NADH (Кm =
NAD в пероксисомах используется как ко#
= 340 мкМ, kcat = 7 с-1) и NADPH in vitro (рис. 2).
фактор для бета#окисления жирных кислот [51].
Менее эффективно белок также расщепляет
Пероксисомальный белок NUDT12 потенци#
NAD+, NADP+, ADP#рибозу, FAD и Ap2A [49].
ально может участвовать в регуляции уровня
Для эффективного катализа Nudt13 необходи#
NAD в органелле, расщепляя его на NMN и
мы катионы Mn2+ или Mg2+ в необычно больших
AMP (рис. 3). Было показано, что NAD может
концентрациях (соответственно 2-5 мМ Mn2+ и
транспортироваться из цитозоля в пероксисомы
40-100 мМ Mg2+). Наибольшая активность бел#
с помощью переносчика SLC25A17 [52], тогда
ка наблюдается при pH от 7,8 до 8,2 [49].
как молекулы размером до 300 Да, например,
В некоторых тканях митохондрии содержат
AMP, могут входить и выходить из пероксисомы
до 70 % клеточного NAD [58, 59]. Митохондри#
через каналы Pxmp2 [53-55]. Вероятно, NMN
альный NAD является коферментом таких жиз#
тоже может выходить из перкосисомы через
ненно необходимых метаболических процессов,
данные каналы. Таким образом, расщепление
как цикл трикарбоновых кислот и окисление
пероксисомального NAD на NMN и AMP гид#
жирных кислот, а NADH является донором
ролазой NUDT12 может быть одним из меха#
электронов для дыхательной цепи на внутрен#
низмов регуляции не только пероксисомально#
ней мембране митохондрии, который сопряжен
го, но и цитозольного пула NAD [35].
с синтезом АТР [60]. NAD+ в митохондрии так#
В клетках эукариот в процессе транскрип#
же является субстратом белков SIRT3, 4 и 5, ре#
ции РНК подвергается модификации - кэпиро#
гулируюших активность ключевых метаболи#
ванию 5′#конца транскрипта 7#метилгуанози#
ческих ферментов [61].
ном. Кэпирование защищает 5′#конец РНК от
Механизмы регуляции митохондриального
действия рибонуклеаз, участвует в экспорте
пула NAD на сегодняшний день до конца не яс#
мРНК из ядра, а также в инициации трансляции
ны. Вероятнее всего, механизмы поддержания
[56]. Недавно было показано, что РНК млеко#
митохондриального пула NAD отличаются в
питающих также может быть кэпирована NAD+
разных типах клеток в зависимости от их ткане#
[33] (рис. 2). РНК, кэпированные NAD+ с 5′#
вого происхождения. В одних клетках прямого
конца, не могут эффективно транслироваться, а
обмена между митохондриальным и цитоплаз#
также менее стабильны, чем молекулы РНК, кэ#
матическим пулами NAD не происходит
пированные 7#метилгуанозином, и некэпиро#
[62-64]. Локализация NAD#биосинтетического
ванные РНК [33]. Белки семейства DXO могут
фермента никотинамидмононуклеотидаденил#
детектировать и убирать NAD+#кэпы с молекул
илтрансферазы NMNAT3 в митохондриальном
РНК, что приводит к их деградации [33]. Уста#
матриксе указывает на то, что предшественни#
новлено, что NUDIX гидролаза NUDT12 также
ком митохондриального NAD может являться
может убирать NAD+#кэпы с 5′#конца мРНК
цитозольный NMN, который транспортируется
[50, 57] (рис. 2). Продемонстрировано, что мы#
в митохондриальный матрикс и используется
шиный белок Nudt12 и белок человека NUDT12
там для синтеза NAD [65]. В других клетках
могут расщеплять NAD+#кэп молекул РНК in
NAD напрямую транспортируется через мито#
vitro. Расщепление происходит по фосфоди#
хондриальную мембрану из цитозоля в митохон#
эфирной связи, в результате образуется NMN и
дриальный матрикс [66]. Подавление экспрес#
AMP, связанный с РНК [50, 57]. Нокаут по
сии NMNAT3 приводит к значительному сни#
NUDT12 в клетках НЕК293 приводит к увеличе#
жению уровня митохондриального NAD в клет#
нию количества кэпированных NAD+ мРНК в
ках НЕК293, при этом никак не влияет на уро#
1,5 раза, при этом растет уровень кэпированных
вень митохондриального NAD в клетках линии
NAD+ мРНК, кодирующих белки, вовлеченные
HeLa [67]. Белок NUDT13 потенциально может
в энергетический метаболизм клетки, в том чис#
участвовать в регуляции уровня NAD и NAD#за#
ле митохондриальные белки электрон#транспорт#
висимых процессов в митохондрии, а также
БИОХИМИЯ том 85 вып. 8 2020
РОЛЬ NUDIX ГИДРОЛАЗ В МЕТАБОЛИЗМЕ NAD И ADP#РИБОЗЫ
1043
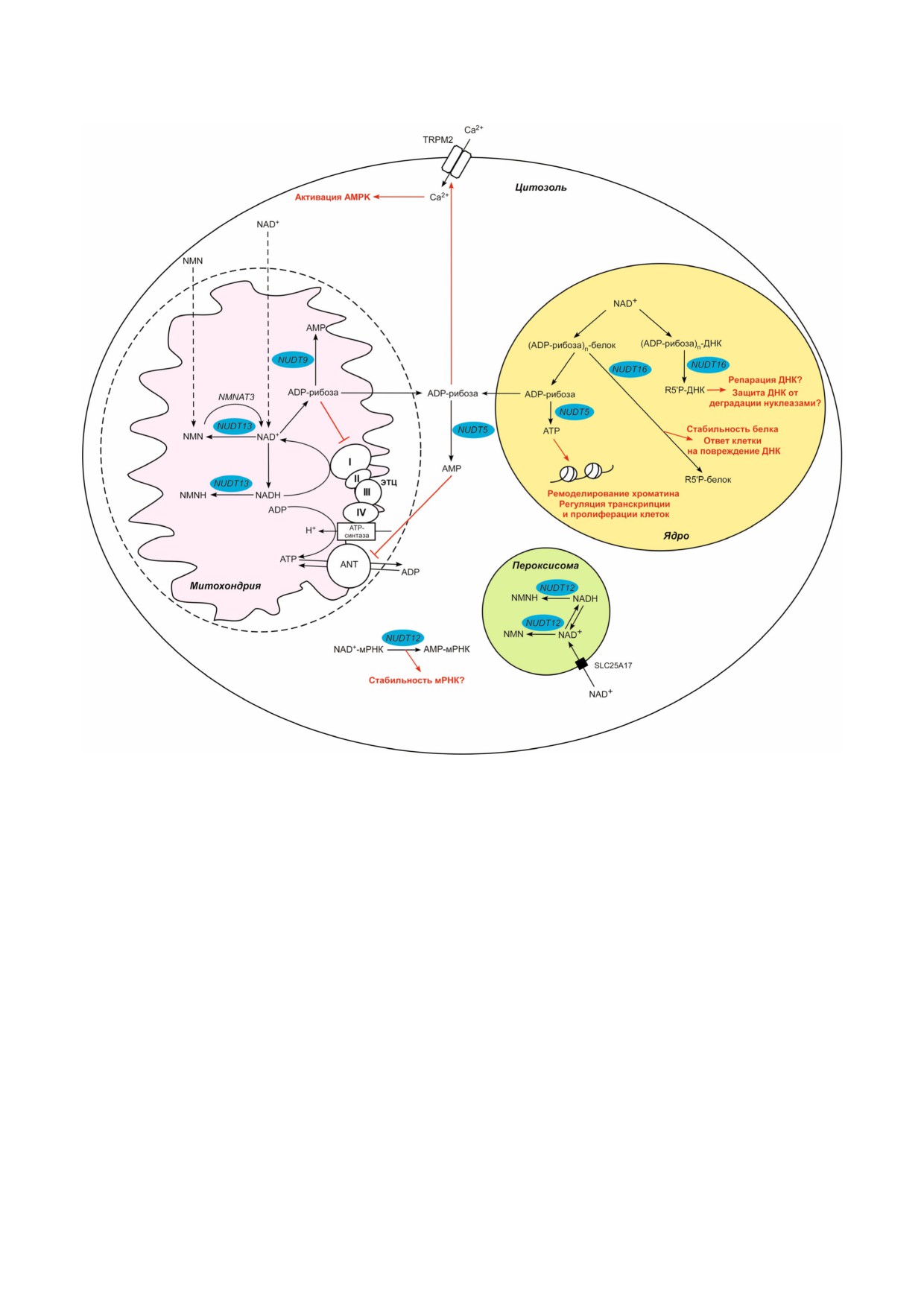
Рис. 3. Компартментализация NUDT#зависимого расщепления NAD, ADP#рибозы и их производных. NUDT5 расщеп#
ляет ADP#рибозу в цитозоле, тем самым, предотвращая активацию транспорта Ca2+ из внеклеточного пространства через
каналы TRPM2 на плазматической мембране и последующую активацию AMP#активируемой протеинкиназы (AMPK).
Расщепление ADP#рибозы в цитозоле белком NUDT5 приводит к накоплению AMP, который ингибирует синтез ATP на
внутренней мембране митохондрии, блокируя ANT. Пероксисомальный белок NUDT12 может участвовать в регуляции
уровня NAD и NAD#зависимых процессов в пероксисомах, а также контролировать соотношение NAD+/NADH в данной
органелле путем расщепления пероксисомального NAD+(H) на NMN(H) и AMP. Цитозольная форма NUDT12 расщеп#
ляет NAD+ на 5′#конце мРНК и может регулировать стабильность транскриптов. NUDT13 может участвовать в регуляции
уровня NAD и NAD#зависимых процессов в митохондрии, а также контролировать соотношение NAD+/NADH в данной
органелле за счет расщепления митохондриального NAD+(H) на NMN(H) и AMP. NUDT9 расщепляет ADP#рибозу в ми#
тохондрии, не позволяя ей выходить в цитозоль, и таким образом регулирует импорт Ca2+ из внеклеточного пространства
и активность AMPK. NUDT9#зависимое расщепление ADP#рибозы может играть важную роль для энергетического ме#
таболизма клетки, так как свободная ADP#рибоза является ингибитором окисления NADH комплексом I электрон#
транспортной цепи (ЭТЦ). В ядре NAD+ используется белками семейства PARP для обратимого моно# и поли#ADP#ри#
бозилирования белков и ДНК. NUDT16 расщепляет ADP#рибозу и полимеры ADP#рибозы, присоединенные к белку или
ДНК, в результате чего белок или ДНК остаются модифицированы рибозо#5′#фосфатом (R5′P). NUDT16 регулирует ста#
бильность белков в ядре и играет важную роль в ответе клетки на повреждение ДНК. NUDT5 использует ADP#рибозу для
синтеза ATP в ядре. NUDT5#зависимое повышение уровня ATP в ядре необходимо для ремоделирования хроматина, ре#
гуляции транскрипции и пролиферации клеток
контролировать соотношение NAD+/NADH в
Комплексный сравнительный анализ
данной органелле путем расщепления митохон#
субстратной специфичности 18 гидролаз чело#
дриального NAD+(H) на NMN(H) и AMP
века семейства NUDIX, помимо NUDT12 и
(рис. 3).
NUDT13, выявил еще два белка NUDT5 и
БИОХИМИЯ том 85 вып. 8 2020
1044
КУЛИКОВА, НИКИФОРОВ
NUDIX гидролазы млекопитающих в метаболизме NAD и ADP#рибозы
Гидролаза семейства NUDIX
Локализация в клетке
Субстраты
Ссылки
mNudt5
ядро, цитозоль
ADPR, OAcADPR
[77]
hNUDT5
ядро, цитозоль
ADPR, NADH, NADPH
[2, 69, 70, 86]
hNUDT9
митохондрии, цитозоль
ADPR, OAcADPR, PAR#белок
[2, 77, 79, 86]
hNUDT12
пероксисомы, цитозоль
NAD+(H), NADP+(H), ADPR, NAD+#РНК
[2, 43, 50]
mNudt12
пероксисомы, цитозоль
NAD+#РНК
[57, 68]
mNudt13
митохондрии
NAD+(H), NADP+(H), ADPR
[49]
hNUDT14
цитозоль
NADH, ADPR
[2, 86]
mNudt16
цитозоль, ядро
NAD+, NAD+#РНК
[68]
hNUDT16
цитозоль, ядро
ADPR, ADPR#белок, PAR#белок, ADPR#
[19-21, 68,
ДНК, PAR#ДНК, ADPR#РНК, NAD+#РНК
86-88]
NUDT14, расщепляющих NADH in vitro [2].
U2OS приводит к значительному снижению
Также было показано, что мышиный белок
скорости гидролиза ADP#рибозы в экстрактах
Nudt16 расщепляет NAD+ и NAD+#кэп молекул
клеток по сравнению с контрольными экстрак#
РНК in vitro [68] (таблица).
тами [71], тогда как нокдаун NUDT5 в клетках
HeLa приводит к накоплению ADP#рибозы, ко#
торая активирует каналы TRPM2 на плазмати#
РОЛЬ NUDIX ГИДРОЛАЗ
ческой мембране [72] (рис. 3).
МЛЕКОПИТАЮЩИХ
Также показано, что расщепление ADP#ри#
В МЕТАБОЛИЗМЕ ADP РИБОЗЫ
бозы NUDIX гидролазами NUDT5 и NUDT9
приводит к накоплению AMP, который ингиби#
Анализ субстратной специфичности белков
рует синтез ATP на внутренней мембране мито#
семейства NUDIX выявил у млекопитающих нес#
хондрии, блокируя адениннуклеотидтранслока#
колько ферментов, катализирующих расщепление
зу (ANT) [73] (рис. 3). ANT — белок внутренней
ADP#рибозы и её производных, таких как поли#
мембраны митохондрии, который отвечает за
меры ADP#рибозы и OAcADPR (таблица). Наибо#
импорт цитозольного ADP в митохондриальный
лее хорошо охарактеризованы NUDIX гидролазы
матрикс для последующего фосфорилирования
млекопитающих NUDT5, NUDT9 и NUDT16.
ATP#синтазой и за выход ATP из митохондрии.
NUDT5. Из всех NUDIX гидролаз человека
ANT высокоспецифична по отношению к ADP и
белок NUDT5 имеет наибольшую гомологию с
ATP [74] и играет важнейшую роль в энергети#
дрожжевым белком Ysa1 (63% идентичных ами#
ческом метаболизме клетки. В ответ на повреж#
нокислот) и локализуется в цитозоле и ядре [2,
дение ДНК PARP1 гиперактивируется, в резуль#
69, 70]. Показано, что белок NUDT5 расщепля#
тате чего повышается уровень полимеров ADP#
ет преимущественно ADP#рибозу (Km = 60 мкМ,
рибозы. PARG расщепляет полимеры ADP#ри#
Vmax = 8 мкМоль·мин-1·мг-1). Продуктами рас#
бозы, а NUDIX гидролазы NUDT5 и NUDT9
щепления ADP#рибозы являются AMP и рибо#
расщепляют образовавшиеся молекулы свобод#
зо#5′#фосфат. Менее эффективно гидролаза так#
ной ADP#рибозы, что приводит к накоплению
же расщепляет и другие нуклеозид#5′#дифосфо#
цитозольного AMP, который конкурирует с ADP
сахара, такие как ADP#манноза и ADP#глюкоза,
за связывание с ANT и блокирует транслоказу,
а также динуклеотиды NADH и NADPH. Важно
таким образом подавляя синтез ATP [73] (рис. 3).
отметить, что cADPR не является субстратом
Еще одной потенциальной ролью NUDIX
для NUDT5. Для эффективного катализа
гидролазы NUDT5 является регуляция актив#
NUDT5 необходимы катионы Mn2+ или Mg2+.
ности важнейшего энергетического сенсора
Наибольшая активность белка наблюдается при
клетки - AMPK. AMPK активируется в ответ на
значениях pH от 7,4 до 9,0 [70].
накопление AMP и подавление синтеза ATP.
Было продемонстрировано, что подавление
Главная функция данной серин/треониновой
экспрессии NUDT5 в клетках человека линии
протеинкиназы - поддержание энергетического
БИОХИМИЯ том 85 вып. 8 2020
РОЛЬ NUDIX ГИДРОЛАЗ В МЕТАБОЛИЗМЕ NAD И ADP#РИБОЗЫ
1045
баланса в клетке в ответ на различные виды ме#
сравнению с нормальными также подтвержда#
таболического стресса. AMPK фосфорилирует
ется данными иммуногистологического окра#
широкий спектр субстратов, тем самым активи#
шивания образцов опухолей пациентов специ#
руя катаболические пути, в результате которых
фичными антителами к NUDT5 [78]. Кроме то#
синтезируется ATP, и подавляя анаболические
го, у пациентов с раком молочной железы, име#
пути, в которых ATP расходуется [75]. AMP ал#
ющих повышенный уровень экспрессии
лостерически активирует AMPK: он связывает#
NUDT5, был более высокий риск рецидивов и
ся с её γ#субъединицей, что стимулирует фосфо#
метастазирования [69]. Таким образом, повы#
рилирование Thr172 α#субъединицы AMPK
шенный уровень экспрессии NUDT5 является
[76]. Расщепляя ADP#рибозу, NUDT5 может
прогностическим маркером более агрессивного
контролировать уровень AMP в клетке, и таким
фенотипа различных типов опухолей [78]. Было
образом регулировать активность AMPK.
установлено, что NUDT5 повышает агрессив#
NUDIX гидролаза мыши Nudt5 эффективно
ность опухоли через модуляцию экспрессии ря#
расщепляет пирофосфатную связь в молекуле
да ключевых онкогенов, таких как убиквитин#
OAcADPR in vitro, в результате чего образуется
специфичная пептидаза 22 (USP22), RAB35B,
O#ацетил#рибозо#5′#фосфат и AMP [77] (рис. 1
FOCAD и простагландин Е#синтаза (PTGES)
и 2). NUDT5 может контролировать концентра#
[78]. Также было показано, что раковые клетки
цию внутриклеточной OAcADPR, которая наря#
с нокдауном по NUDT5 и раковые клетки раз#
ду с ADPR, активирует катионные каналы
личных линий, в которых активность NUDT5
TRPM2 на плазматической мембране [27]. Та#
подавлена специфичным ингибитором, не мо#
ким образом, расщепляя ADP#рибозу и её аце#
гут расти в формате 3D#культур, так как синтез
тилированную производную, NUDT5 может иг#
ATP в ядре белком NUDT5 необходим для регу#
рать важную роль в регуляции Ca2+ сигналинга в
ляции экспрессии генов, участвующих в кле#
клетке, однако экспериментальные подтверж#
точной адгезии, поддержании раковых стволо#
дения данной гипотезы еще предстоит полу#
вых клеток и в эпителиально#мезенхимальном
чить.
переходе [78].
Недавно было показано, что белок NUDT5
NUDT9. Митохондриальный белок человека
обладает не только гидролазной, но и фосфори#
NUDT9 является еще одной NUDIX гидролазой
лазной активностью, катализируя образование
высокоспецифичной по отношению к ADP#ри#
ATP и рибозо#5′#фосфата из ADP#рибозы и пи#
бозе [79] (рис. 2).
рофосфата (PPi) in vitro [69]. С использованием
Источниками свободной ADP#рибозы в ми#
siRNA к NUDT5 было установлено, что в ответ
тохондрии может быть обратимое моно#ADP#
на обработку раковых клеток T47D прогестина#
рибозилирование белков ферментом SIRT4 [80,
ми уровень ATP в ядре повышается NUDT5#за#
81], а также неферментативное ADP#рибозили#
висимым образом (рис. 3). В частности, было
рование [82, 83]. Кроме того, сиртуины NAD+#
показано, что в ответ на обработку клеток про#
зависимым образом деацетилируют белки в ми#
гестинами активируется PARP1, в результате
тохондриальном матриксе с образованием
чего повышается уровень полимеров ADP#ри#
OAcADPR, которая расщепляется ферментом
бозы. PARG расщепляет полимеры ADP#рибо#
ARH3 до ADP#рибозы [29] (рис. 2).
зы, и NUDT5 использует образовавшиеся моле#
В нескольких исследованиях продемонстри#
кулы ADP#рибозы для синтеза ATP. Повыше#
ровано, что расщепление ADP#рибозы гидрола#
ние ATP в ядре необходимо для прогестин#ин#
зой NUDT9 регулирует транспорт Ca2+ из вне#
дуцированного ремоделирования хроматина,
клеточного пространства через каналы TRPM2
регуляции транскрипции и пролиферации кле#
на плазматической мембране [72, 84] (рис. 3). В
ток [69] (рис. 3). В другой работе было продемо#
ответ на оксидативный стресс в клетке происхо#
нстрировано, что ингибирование NUDT5 в
дит накопление ADP#рибозы, которая активи#
клетках T47D приводит к снижению уровня
рует каналы TRPM2. Сверхэкспрессированный
ATP в ядре по сравнению с необработанными
в митохондрии клеток НЕК293 белок NUDT9
клетками, а также блокирует прогестин#инду#
расщепляет ADP#рибозу, не позволяя ей выхо#
цированное ремоделирование хроматина и
дить в цитозоль и активировать транспорт Ca2+
экспрессию прогестин#зависимых генов в ра#
из внеклеточного пространства через каналы
ковых клетках [71].
TRPM2 [84]. В другой работе было показано, что
Анализ данных базы TGCA (The Cancer
в условиях гипоксии при подавлении экспрес#
Genome Atlas) показал, что уровень мРНК
сии NUDT9 в клетках HeLa транспорт Ca2+ че#
NUDT5 во многих видах опухолей выше, чем в
рез каналы TRPM2 значительно возрастает [72].
нормальных тканях [78]. Более высокий уро#
Повышение уровня Ca2+ приводит к активации
вень экспрессии NUDT5 в раковых клетках по
Ca2+/кальмодулин#зависимой протеинкиназы
БИОХИМИЯ том 85 вып. 8 2020
1046
КУЛИКОВА, НИКИФОРОВ
II, которая фосфорилирует и активирует AMPK
рован рибозо#5′#фосфатом [86, 87], а также мо#
(рис. 3). Активация AMPK в ответ на подавле#
лекулы свободной ADP#рибозы [87] (рис. 2).
ние NUDT9 приводит к повышению уровня
Недавно было показано, что субстратами
HIF#1α и к активации экспрессии генов мише#
ферментов семейства PARP являются не только
ней HIF#1α [72]. Таким образом, было установ#
белки, но и нуклеиновые кислоты (рис. 2). PARP1
лено, что в условиях гипоксии гидролаза
и PARP2 обратимо поли#ADP#рибозилируют
NUDT9 негативно регулирует уровень белка
фосфорилированные концы одно# и двунитевых
HIF#1α и его функции [72].
ДНК in vitro [19]. PARP3 обратимо моно#ADP#ри#
Помимо этого, митохондриальный белок
бозилирует преимущественно фосфатные группы
NUDT9 может играть важную роль в регуляции
на тупых 5′#концах двунитевых ДНК, а так же на
энергетического метаболизма клетки, так как
5′#концах однонитевых разрывов ДНК in vitro [20,
свободная ADP#рибоза является ингибитором
90]. Кроме того, однонитевой разрыв ДНК, мо#
окисления NADH комплексом I дыхательной
но#ADP#рибозилированный белком PARP3, мо#
цепи в митохондриях [85] (рис. 3).
жет быть лигирован в отсутствии АТP с образова#
Помимо свободной ADP#рибозы, субстра#
нием двунитевой ДНК, содержащей некласси#
том NUDT9 также являются полимеры ADP#
ческий апурин#апиримидиновый сайт (ribo#AP#
рибозы, связанные с белком. Было показано,
сайт), который служит субстратом для белков
что при инкубации автомодифицированного
эксцизионной репарации оснований [90]. Фер#
белка PARP1 с NUDT9 in vitro полимеры ADP#
менты PARG, ARH3, MacroD1, MacroD2 и
рибозы эффективно расщепляются [86] (рис. 2).
TARG1 отщепляют ADP#рибозу от ДНК [20]
NUDT16. NUDIX гидролаза человека NUDT16
(рис. 2). Обратимое моно# и поли#ADP#рибози#
расщепляет фосфодиэфирную связь в молекуле
лирование ДНК может играть важную роль в ре#
ADP#рибозы. Субстратами NUDT16 являются
парации ДНК, а также в защите ДНК от деграда#
как свободная ADP#рибоза, так и молекулы мо#
ции нуклеазами. Было показано, что NUDT16
но#ADP#рибозы, которыми модифицированы
расщепляет моно#ADP#рибозу и полимеры ADP#
белки, ДНК и РНК. Также NUDT16 расщепляет
рибозы, присоединенные к ДНК in vitro, в резуль#
полимеры ADP#рибозы, которыми модифици#
тате чего ДНК остается модифицирована рибозо#
рованы белки и ДНК [19-21, 86-88] (рис. 2).
5′#фосфатом [19, 20] (рис. 2). Таким образом,
Было установлено, что при инкубации авто#
NUDIX гидролаза NUDT16 может играть роль в
модифицированного белка PARP1 с NUDT16 in
ответе клетки на повреждение ДНК, регулируя
vitro полимеры ADP#рибозы эффективно рас#
ADP#рибозилирование ДНК (рис. 3).
щепляются, в результате чего молекула белка ос#
Помимо этого, было продемонстрировано,
тается модифицирована рибозо#5′#фосфатом, и
что белки человека PARP10, PARP11 и PARP15
образуются AMP и AMP, соединенный с рибозо#
моно#ADP#рибозилируют фосфорилированные
5′#фосфатом [86, 87] (рис. 1). Совсем недавно
концы РНК in vitro [21]. Ферменты PARG,
было показано, что NUDIX гидролаза NUDT16
ARH3, MacroD1, MacroD2 и TARG1 отщепляют
расщепляет полимеры ADP#рибозы, присоеди#
ADP#рибозу от РНК, в то время как NUDT16
ненные к С#концу белка 53BP1, регулируя его
расщепляет фосфодиэфирную связь в молекуле
стабильность и выживаемость клеток в ответ на
моно#ADP#рибозы, которой модифицирована
повреждение ДНК [88] (рис. 3). Белок 53BP1 иг#
молекула РНК in vitro [21] (рис. 2).
рает важную роль в ответе клетки на поврежде#
Также совсем недавно было установлено, что
ние ДНК [89]. Поли#ADP#рибозилирование
белок мыши Nudt16 может расщеплять свобод#
53BP1 в клетке приводит к его узнаванию E3
ный NAD+ и NAD+#кэп молекул РНК in vitro
убиквитин лигазой RNF146, в результате чего
(таблица). Нокаут по NUDT16 в клетках
происходит его полиубиквитинилирование и
НЕК293 приводит к увеличению количества кэ#
деградация [88]. Было показано, что С#конец
пированных NAD+ РНК в 1,3 раза [68].
белка 53BP1 поли#ADP#рибозилируется in vitro,
и NUDT16 убирает образовавшиеся полимеры
ADP#рибозы. В клетках с нокаутом по NUDT16
Финансирование. Работа выполнена при фи#
уровень белка 53BP1 ниже, а уровень его поли#
нансовой поддержке РНФ (проект 18#74#00081)
ADP#рибозилирования в ответ на повреждение
и РФФИ (проект 19#34#60039).
ДНК выше, чем в контрольных клетках. Более
Конфликт интересов. Авторы заявляют об от#
того, в отсутствии NUDT16 снижается выживае#
сутствии конфликта интересов.
мость клеток после повреждения ДНК [88]. Так#
Соблюдение этических норм. Настоящая
же было установлено, что NUDT16 расщепляет
статья не содержит описания каких#либо иссле#
моно#ADP#рибозу, которой модифицирован бе#
дований с участием людей или животных в каче#
лок, в результате чего белок остается модифици#
стве объектов.
БИОХИМИЯ том 85 вып. 8 2020
РОЛЬ NUDIX ГИДРОЛАЗ В МЕТАБОЛИЗМЕ NAD И ADP#РИБОЗЫ
1047
СПИСОК ЛИТЕРАТУРЫ
1.
McLennan, A. G. (2006) The Nudix hydrolase superfami#
16.
Gupte, R., Liu, Z., and Kraus, W. L. (2017) PARPs and
ly, Cell. Mol. Life Sci., 63, 123#143, doi: 10.1007/s00018#
ADP#ribosylation: recent advances linking molecular
005#5386#7.
functions to biological outcomes, Genes Dev., 31, 101#126,
2.
Carreras#Puigvert, J., Zitnik, M., Jemth, A. S., Carter, M.,
doi: 10.1101/gad.291518.116.
Unterlass, J. E. et al. (2017) A comprehensive structural,
17.
Cohen, M. S., and Chang, P. (2018) Insights into the bio#
biochemical and biological profiling of the human NUDIX
genesis, function, and regulation of ADP#ribosylation, Nat.
hydrolase family, Nat. Commun., 8, 1541, doi: 10.1038/
Chem. Biol., 14, 236#243, doi: 10.1038/nchembio.2568.
s41467#017#01642#w.
18.
Rack, J. G. M., Palazzo, L., and Ahel, I. (2020) (ADP#
3.
Rai, P., and Sobol, R. W. (2019) Mechanisms of MTH1
ribosyl)hydrolases: structure, function, and biology, Genes
inhibition#induced DNA strand breaks: the slippery
Dev., 34, 263#284, doi: 10.1101/gad.334631.119.
slope from the oxidized nucleotide pool to genotoxic dam#
19.
Talhaoui, I., Lebedeva, N. A., Zarkovic, G., Saint#Pierre,
age, DNA Rep., 77, 18#26, doi: 10.1016/j.dnarep.2019.
C., Kutuzov, M. M., Sukhanova, M. V., Matkarimov, B. T.,
03.001.
Gasparutto, D., Saparbaev, M. K., Lavrik, O. I., and
4.
Ishibashi, T., Hayakawa, H., and Sekiguchi, M. (2003) A
Ishchenko, A. A. (2016) Poly(ADP#ribose) polymerases
novel mechanism for preventing mutations caused by oxi#
covalently modify strand break termini in DNA fragments
dation of guanine nucleotides, EMBO Rep., 4, 479#483,
in vitro, Nucl. Acids Res., 44, 9279#9295, doi: 10.1093/
doi: 10.1038/sj.embor.embor838.
nar/gkw675.
5.
Cai, J. P., Ishibashi, T., Takagi, Y., Hayakawa, H., and
20.
Munnur, D., and Ahel, I. (2017) Reversible mono#ADP#
Sekiguchi, M. (2003) Mouse MTH2 protein which pre#
ribosylation of DNA breaks, FEBS J., 284, 4002#4016,
vents mutations caused by 8#oxoguanine nucleotides,
doi: 10.1111/febs.14297.
Biochem. Biophys. Res. Commun.,
305,
1073#1077,
21.
Munnur, D., Bartlett, E., Mikolcevic, P., Kirby, I. T.,
doi: 10.1016/s0006#291x(03)00864#7.
Rack, J. G. M., Mikoc, A., Cohen, M. S., and Ahel, I.
6.
Ishibashi, T., Hayakawa, H., Ito, R., Miyazawa, M.,
(2019) Reversible ADP#ribosylation of RNA, Nucl. Acids
Yamagata, Y., and Sekiguchi, M. (2005) Mammalian
Res., 47, 5658#5669, doi: 10.1093/nar/gkz305.
enzymes for preventing transcriptional errors caused by
22.
Houtkooper, R. H., Pirinen, E., and Auwerx, J. (2012)
oxidative damage, Nucleic Acids Res., 33, 3779#3784,
Sirtuins as regulators of metabolism and healthspan, Nat.
doi: 10.1093/nar/gki682.
Rev. Mol. Cell Biol., 13, 225#238, doi: 10.1038/nrm3293.
7.
Grudzien#Nogalska, E., and Kiledjian, M. (2017) New
23.
Tanner, K. G., Landry, J., Sternglanz, R., and Denu, J. M.
insights into decapping enzymes and selective mRNA
(2000) Silent information regulator 2 family of NAD#
decay, Wiley Interdisc. rev. RNA,
8, doi:
10.1002/
dependent histone/protein deacetylases generates a unique
wrna.1379.
product, 1#O#acetyl#ADP#ribose, Proc. Natl. Acad. Sci.
8.
Lu, G., Zhang, J., Li, Y., Li, Z., Zhang, N., Xu, X., Wang, T.,
USA, 97, 14178#14182, doi: 10.1073/pnas.250422697.
Guan, Z., Gao, G. F., and Yan, J. (2011) hNUDT16: a
24.
Sassone#Corsi, P. (2016) The Epigenetic and Metabolic
universal decapping enzyme for small nucleolar RNA and
Language of the Circadian Clock, in A Time for Metabolism
cytoplasmic mRNA, Protein Cell, 2, 64#73, doi: 10.1007/
and Hormones (Sassone#Corsi, P., and Christen, Y. eds.)
s13238#011#1009#2.
Cham (CH), pp. 1#11
9.
Gasmi, L., and McLennan, A. G. (2001) The mouse
25.
Imai, S., and Guarente, L. (2014) NAD+ and sirtuins in
Nudt7 gene encodes a peroxisomal nudix hydrolase specif#
aging and disease, Trends Cell. Biol., 24, 464#471,
ic for coenzyme A and its derivatives, Biochemi. J., 357, 33#
doi: 10.1016/j.tcb.2014.04.002.
38, doi: 10.1042/0264#6021:3570033.
26.
Cao, Y., Jiang, X., Ma, H., Wang, Y., Xue, P., and Liu, Y.
10.
Shumar, S. A., Kerr, E. W., Geldenhuys, W. J.,
(2016) SIRT1 and insulin resistance, J. Diabetes Complic.,
Montgomery, G. E., Fagone, P., Thirawatananond, P.,
30, 178#183, doi: 10.1016/j.jdiacomp.2015.08.022.
Saavedra, H., Gabelli, S. B., and Leonardi, R. (2018)
27.
Grubisha, O., Rafty, L. A., Takanishi, C. L., Xu, X., Tong, L.,
Nudt19 is a renal CoA diphosphohydrolase with biochem#
Perraud, A. L., Scharenberg, A. M., and Denu, J. M.
ical and regulatory properties that are distinct from the
(2006) Metabolite of SIR2 reaction modulates TRPM2 ion
hepatic Nudt7 isoform, J. Biol. Chem., 293, 4134#4148,
channel, J. Biolog. Chem.,
281,
14057#14065,
doi: 10.1074/jbc.RA117.001358.
doi: 10.1074/jbc.M513741200.
11.
Kerr, E. W., Shumar, S. A., and Leonardi, R. (2019) Nudt8
28.
Chen, D., Vollmar, M., Rossi, M. N., Phillips, C.,
is a novel CoA diphosphohydrolase that resides in the mito#
Kraehenbuehl, R., Slade, D., Mehrotra, P. V., von Delft, F.,
chondria, FEBS Lett., 593, 1133#1143, doi: 10.1002/1873#
Crosthwaite, S. K., Gileadi, O., Denu, J. M., and Ahel, I.
3468.13392.
(2011) Identification of macrodomain proteins as novel O#
12.
Ying, W. (2008) NAD+/NADH and NADP+/NADPH in
acetyl#ADP#ribose deacetylases, J. Biolog. Chem., 286,
cellular functions and cell death: regulation and biological
13261#13271, doi: 10.1074/jbc.M110.206771.
consequences, Antioxid. Redox Signal., 10, 179#206,
29.
Ono, T., Kasamatsu, A., Oka, S., and Moss, J. (2006) The
doi: 10.1089/ars.2007.1672.
39#kDa poly(ADP#ribose) glycohydrolase ARH3
13.
Kulikova, V. A., Gromyko, D. V., and Nikiforov, A. A.
hydrolyzes O#acetyl#ADP#ribose, a product of the Sir2
(2018) The regulatory role of NAD in human and animal
family of acetyl#histone deacetylases, Proc. Natl. Acad. Sci.
cells, Biochemistry (Moscow), 83, 800#812, doi: 10.1134/
USA, 103, 16687#16691, doi: 10.1073/pnas.0607911103.
S0006297918070040.
30.
Lee, H. C., and Zhao, Y. J. (2019) Resolving the topologi#
14.
Stromland, O., Niere, M., Nikiforov, A. A., VanLinden, M. R.,
cal enigma in Ca2+ signaling by cyclic ADP#ribose and
Heiland, I., and Ziegler, M. (2019) Keeping the balance in
NAADP, J. Biolog. Chem.,
294,
19831#19843,
NAD metabolism, Biochem. Soc. Trans., 47, 119#130,
doi: 10.1074/jbc.REV119.009635.
doi: 10.1042/BST20180417.
31.
Guse, A. H. (2015) Calcium mobilizing second messengers
15.
Yang, Y., and Sauve, A. A. (2016) NAD(+) metabolism:
derived from NAD, Biochim. Biophys. Acta, 1854, 1132#
Bioenergetics, signaling and manipulation for therapy,
1137, doi: 10.1016/j.bbapap.2014.12.015.
Biochim.
Biophys.
Acta,
1864,
1787#1800,
32.
Sumoza#Toledo, A., and Penner, R. (2011) TRPM2: a
doi: 10.1016/j.bbapap.2016.06.014.
multifunctional ion channel for calcium signalling, J.
БИОХИМИЯ том 85 вып. 8 2020
1048
КУЛИКОВА, НИКИФОРОВ
Physiol., 589, 1515#1525, doi:
10.1113/jphysiol.2010.
47.
Adam#Vizi, V., and Chinopoulos, C. (2006) Bioenergetics
201855.
and the formation of mitochondrial reactive oxygen
33.
Jiao, X., Doamekpor, S. K., Bird, J. G., Nickels, B. E.,
species, Trends Pharmacolog. Sci.,
27,
639#645,
Tong, L., Hart, R. P., and Kiledjian, M. (2017) 5′#End
doi: 10.1016/j.tips.2006.10.005.
nicotinamide adenine dinucleotide cap in human cells pro#
48.
Jamieson, D. J. (1998) Oxidative stress responses of the
motes RNA decay through DXO#mediated deNADding,
yeast Saccharomyces cerevisiae, Yeast, 14, 1511#1527,
Cell, 168, 1015#1027, doi: 10.1016/j.cell.2017.02.019.
doi: 10.1002/(SICI)1097#0061(199812)14:16<1511::AID#
34.
Luscher, B., Butepage, M., Eckei, L., Krieg, S., Verheugd, P.,
YEA356>3.0.CO;2#S.
and Shilton, B. H. (2018) ADP#ribosylation, a multifac#
49.
Abdelraheim, S. R., Spiller, D. G., and McLennan, A. G.
eted posttranslational modification involved in the control
(2017) Mouse Nudt13 is a mitochondrial Nudix hydrolase
of cell physiology in health and disease, Chem. Rev., 118,
with NAD(P)H pyrophosphohydrolase activity, Protein J.,
1092#1136, doi: 10.1021/acs.chemrev.7b00122.
36, 425#432, doi: 10.1007/s10930#017#9734#x.
35.
Nikiforov, A., Kulikova, V., and Ziegler, M. (2015) The
50.
Wu, H., Li, L., Chen, K. M., Homolka, D., Gos, P.,
human NAD metabolome: functions, metabolism and
Fleury#Olela, F., McCarthy, A. A., and Pillai, R. S. (2019)
compartmentalization, Crit. Rev. Biochem. Mol. Biol., 50,
Decapping enzyme NUDT12 partners with BLMH for
284#297, doi: 10.3109/10409238.2015.1028612.
cytoplasmic surveillance of NAD#capped RNAs, Cell Rep.,
36.
Katsyuba, E., Romani, M., Hofer, D., and Auwerx, J.
29, 4422#4434, doi: 10.1016/j.celrep.2019.11.108.
(2020) NAD+ homeostasis in health and disease, Nat.
51.
Wanders, R. J., Waterham, H. R., and Ferdinandusse, S.
Metab., 2, doi: 10.1038/s42255#019#0161#5.
(2015) Metabolic interplay between peroxisomes and other
37.
Dolle, C., Skoge, R. H., Vanlinden, M. R., and Ziegler, M.
subcellular organelles including mitochondria and the
(2013) NAD biosynthesis in humans - enzymes, metabo#
endoplasmic reticulum, Front. Cell Dev. Biol., 3, 83,
lites and therapeutic aspects, Curr. Top. Med. Chem., 13,
doi: 10.3389/fcell.2015.00083.
2907#2917, doi: 10.2174/15680266113136660206.
52.
Agrimi, G., Russo, A., Scarcia, P., and Palmieri, F. (2012)
38.
Yang, Y., Zhang, N., Zhang, G., and Sauve, A. A. (2020)
The human gene SLC25A17 encodes a peroxisomal trans#
NRH salvage and conversion to NAD+ requires NRH
porter of coenzyme A, FAD and NAD+, Biochem. J., 443,
kinase activity by adenosine kinase, Nat. Metab., 2, 364#
241#247, doi: 10.1042/BJ20111420.
379, doi: 10.1038/s42255#020#0194#9.
53.
Antonenkov, V. D., and Hiltunen, J. K. (2012) Transfer of
39.
Frick, D. N., and Bessman, M. J. (1995) Cloning, purifi#
metabolites across the peroxisomal membrane, Biochim.
cation, and properties of a novel NADH pyrophosphatase.
Biophys. Acta, 1822, 1374#1386, doi: 10.1016/j.bbadis.
Evidence for a nucleotide pyrophosphatase catalytic
2011.12.011.
domain in MutT#like enzymes, J. Biolog. Chem., 270,
54.
Antonenkov, V. D., Sormunen, R. T., and Hiltunen, J. K.
1529#1534, doi: 10.1074/jbc.270.4.1529.
(2004) The rat liver peroxisomal membrane forms a per#
40.
Shimizu, M., Masuo, S., Fujita, T., Doi, Y., Kamimura, Y.,
meability barrier for cofactors but not for small metabolites
and Takaya, N. (2012) Hydrolase controls cellular NAD,
in vitro, J. Cell Sci., 117, 5633#5642, doi: 10.1242/jcs.
sirtuin, and secondary metabolites, Mol. Cell. Biol., 32,
01485.
3743#3755, doi: 10.1128/MCB.00032#12.
55.
Rokka, A., Antonenkov, V. D., Soininen, R., Immonen, H. L.,
41.
Xu, W., Dunn, C. A., and Bessman, M. J. (2000) Cloning
Pirila, P. L., Bergmann, U., Sormunen, R. T., Weckstrom,
and characterization of the NADH pyrophosphatases from
M., Benz, R., and Hiltunen, J. K. (2009) Pxmp2 is a chan#
Caenorhabditis elegans and Saccharomyces cerevisiae,
nel#forming protein in Mammalian peroxisomal mem#
members of a Nudix hydrolase subfamily, Biochem.
brane, PLoS One, 4, e5090, doi: 10.1371/journal.pone.
Biophys.
Res.
Commun.,
273,
753#758,
0005090.
doi: 10.1006/bbrc.2000.2999.
56.
Ramanathan, A., Robb, G. B., and Chan, S. H. (2016)
42.
AbdelRaheim, S. R., Cartwright, J. L., Gasmi, L., and
mRNA capping: biological functions and applications,
McLennan, A. G. (2001) The NADH diphosphatase
Nucleic Acids Res.,
44,
7511#7526, doi:
10.1093/
encoded by the Saccharomyces cerevisiae NPY1 Nudix
nar/gkw551.
hydrolase gene is located in peroxisomes, Arch. Biochem.
57.
Grudzien#Nogalska, E., Wu, Y., Jiao, X., Cui, H.,
Biophys., 388, 18#24, doi: 10.1006/abbi.2000.2268.
Mateyak, M. K., Hart, R. P., Tong, L., and Kiledjian, M.
43.
AbdelRaheim, S. R., Spiller, D. G., and McLennan, A. G.
(2019) Structural and mechanistic basis of mammalian
(2003) Mammalian NADH diphosphatases of the Nudix
Nudt12 RNA deNADding, Nat. Chem. Biol., 15, 575#582,
family: cloning and characterization of the human peroxi#
doi: 10.1038/s41589#019#0293#7.
somal NUDT12 protein, Biochem. J., 374, 329#335,
58.
Alano, C. C., Tran, A., Tao, R., Ying, W., Karliner, J. S.,
doi: 10.1042/BJ20030441.
and Swanson, R. A. (2007) Differences among cell types in
44.
Dunn, C. A., O’Handley, S. F., Frick, D. N., and
NAD(+) compartmentalization: a comparison of neurons,
Bessman, M. J. (1999) Studies on the ADP#ribose
astrocytes, and cardiac myocytes, J. Neurosci. Res., 85,
pyrophosphatase subfamily of the nudix hydrolases and
3378#3385, doi: 10.1002/jnr.21479.
tentative identification of trgB, a gene associated with tel#
59.
Stein, L. R., and Imai, S. (2012) The dynamic regulation
lurite resistance, J. Biol. Chem., 274, 32318#32324,
of NAD metabolism in mitochondria, Trends Edocrinol.
doi: 10.1074/jbc.274.45.32318.
Metab., 23, 420#428, doi: 10.1016/j.tem.2012.06.005.
45.
Lin, S., Gasmi, L., Xie, Y., Ying, K., Gu, S., Wang, Z.,
60.
Wallace, D. C. (2009) Mitochondria, bioenergetics, and
Jin, H., Chao, Y., Wu, C., Zhou, Z., Tang, R., Mao, Y.,
the epigenome in eukaryotic and human evolution, Cold
and McLennan, A. G. (2002) Cloning, expression and
Spring Harb. Symp. Quant. Biol.,
74,
383#393,
characterisation of a human Nudix hydrolase specific for
doi: 10.1101/sqb.2009.74.031.
adenosine 5′#diphosphoribose (ADP#ribose), Biochim.
61.
Dolle, C., Rack, J. G., and Ziegler, M. (2013) NAD and
Biophys. Acta,
1594,
127#135, doi:
10.1016/s0167#
ADP#ribose metabolism in mitochondria, FEBS J., 280,
4838(01)00296#5.
3530#3541, doi: 10.1111/febs.12304.
46.
Tong, L., Lee, S., and Denu, J. M. (2009) Hydrolase regu#
62.
Yang, H., Yang, T., Baur, J. A., Perez, E., Matsui, T.,
lates NAD+ metabolites and modulates cellular redox, J.
Carmona, J. J., Lamming, D. W., Souza#Pinto, N. C.,
Biolog. Chem.,
284,
11256#11266, doi:
10.1074/jbc.
Bohr, V. A., Rosenzweig, A., de Cabo, R., Sauve, A. A.,
M809790200.
and Sinclair, D. A. (2007) Nutrient#sensitive mitochondri#
БИОХИМИЯ том 85 вып. 8 2020
РОЛЬ NUDIX ГИДРОЛАЗ В МЕТАБОЛИЗМЕ NAD И ADP#РИБОЗЫ
1049
al NAD+ levels dictate cell survival, Cell, 130, 1095#1107,
75.
Hardie, D. G., Ross, F. A., and Hawley, S. A. (2012)
doi: 10.1016/j.cell.2007.07.035.
AMPK: a nutrient and energy sensor that maintains energy
63.
Pittelli, M., Formentini, L., Faraco, G., Lapucci, A.,
homeostasis, Nat. Rev. Mol. Cell Biol., 13, 251#262,
Rapizzi, E., Cialdai, F., Romano, G., Moneti, G.,
doi: 10.1038/nrm3311.
Moroni, F., and Chiarugi, A. (2010) Inhibition of nicoti#
76.
Gowans, G. J., Hawley, S. A., Ross, F. A., and Hardie, D. G.
namide phosphoribosyltransferase: cellular bioenergetics
(2013) AMP is a true physiological regulator of AMP#acti#
reveals a mitochondrial insensitive NAD pool, J. Biol.
vated protein kinase by both allosteric activation and
Chem., 285, 34106#34114, doi: 10.1074/jbc.M110.136739.
enhancing net phosphorylation, Cell Metab., 18, 556#566,
64.
Barile, M., Passarella, S., Danese, G., and Quagliariello, E.
doi: 10.1016/j.cmet.2013.08.019.
(1996) Rat liver mitochondria can synthesize nicotinamide
77.
Rafty, L. A., Schmidt, M. T., Perraud, A. L., Scharenberg, A. M.,
adenine dinucleotide from nicotinamide mononucleotide
and Denu, J. M. (2002) Analysis of O#acetyl#ADP#ribose
and ATP via a putative matrix nicotinamide mononu#
as a target for Nudix ADP#ribose hydrolases, J. Biol.
cleotide adenylyltransferase, Biochem. Mol. Biol. Intern.,
Chem., 277, 47114#47122, doi: 10.1074/jbc.M208997200.
38, 297#306.
78.
Pickup, K. E., Pardow, F., Carbonell#Caballero, J.,
65.
Nikiforov, A., Dolle, C., Niere, M., and Ziegler, M. (2011)
Lioutas, A., Villanueva#Canas, J. L., Wright, R. H. G., and
Pathways and subcellular compartmentation of NAD
Beato, M. (2019) Expression of oncogenic drivers in 3D
biosynthesis in human cells: from entry of extracellular
cell culture depends on nuclear ATP synthesis by NUDT5,
precursors to mitochondrial NAD generation, J. Biol.
Cancers, 11, doi: 10.3390/cancers11091337.
Chem., 286, 21767#21778, doi: 10.1074/jbc.M110.213298.
79.
Perraud, A. L., Shen, B., Dunn, C. A., Rippe, K., Smith, M. K.,
66.
Davila, A., Liu, L., Chellappa, K., Redpath, P.,
Bessman, M. J., Stoddard, B. L., and Scharenberg, A. M.
Nakamaru#Ogiso, E., Paolella, L. M., Zhang, Z.,
(2003) NUDT9, a member of the Nudix hydrolase family,
Migaud, M. E., Rabinowitz, J. D., and Baur, J. A. (2018)
is an evolutionarily conserved mitochondrial ADP#ribose
Nicotinamide adenine dinucleotide is transported into
pyrophosphatase, J. Biol. Chem., 278, 1794#1801, doi:
mammalian mitochondria, Elife, 7, doi: 10.7554/eLife.
10.1074/jbc.M205601200.
33246.
80.
Ahuja, N., Schwer, B., Carobbio, S., Waltregny, D., North, B. J.,
67.
Cambronne, X. A., Stewart, M. L., Kim, D., Jones#
Castronovo, V., Maechler, P., and Verdin, E.
(2007)
Brunette, A. M., Morgan, R. K., Farrens, D. L.,
Regulation of insulin secretion by SIRT4, a mitochondrial
Cohen, M. S., and Goodman, R. H. (2016) Biosensor
ADP#ribosyltransferase, J. Biol. Chem., 282, 33583#33592,
reveals multiple sources for mitochondrial NAD(+),
doi: 10.1074/jbc.M705488200.
Science, 352, 1474#1477, doi: 10.1126/science.aad5168.
81.
Haigis, M. C., Mostoslavsky, R., Haigis, K. M., Fahie, K.,
68.
Sharma, S., Grudzien#Nogalska, E., Hamilton, K., Jiao, X.,
Christodoulou, D. C., Murphy, A. J., Valenzuela, D. M.,
Yang, J., Tong, L., and Kiledjian, M. (2020) Mammalian
Yancopoulos, G. D., Karow, M., Blander, G., Wolberger, C.,
Nudix proteins cleave nucleotide metabolite caps on
Prolla, T. A., Weindruch, R., Alt, F. W., and Guarente, L.
RNAs, Nucleic Acids Res., 48, 6788#6798, doi: 10.1093/
(2006) SIRT4 inhibits glutamate dehydrogenase and
nar/gkaa402.
opposes the effects of calorie restriction in pancreatic beta
69.
Wright, R. H., Lioutas, A., Le Dily, F., Soronellas, D.,
cells, Cell, 126, 941#954, doi: 10.1016/j.cell.2006.06.057.
Pohl, A., Bonet, J., Nacht, A. S., Samino, S., Font#Mateu, J.,
82.
Zhang, J., Zhang, J., Benovic, J. L., Sugai, M., Wetzker, R.,
Vicent, G. P., Wierer, M., Trabado, M. A., Schelhorn, C.,
Gout, I., and Rittenhouse, S. E. (1995) Sequestration of a
Carolis, C., Macias, M. J., Yanes, O., Oliva, B., and Beato, M.
G#protein beta gamma subunit or ADP#ribosylation of
(2016) ADP#ribose#derived nuclear ATP synthesis by
Rho can inhibit thrombin#induced activation of platelet
NUDIX5 is required for chromatin remodeling, Science,
phosphoinositide 3#kinases, J. Biol. Chem., 270, 6589#
352, 1221#1225, doi: 10.1126/science.aad9335.
6594, doi: 10.1074/jbc.270.12.6589.
70.
Gasmi, L., Cartwright, J. L., and McLennan, A. G. (1999)
83.
Jacobson, E. L., Cervantes#Laurean, D., and Jacobson, M. K.
Cloning, expression and characterization of YSA1H, a
(1997) ADP#ribose in glycation and glycoxidation reac#
human adenosine 5′#diphosphosugar pyrophosphatase
tions, Adv. Exp. Med. Biol., 419, 371#379, doi: 10.1007/
possessing a MutT motif, Biochem. J., 344 Pt. 2, 331#337.
978#1#4419#8632#0_49.
71.
Page, B. D. G., Valerie, N. C. K., Wright, R. H. G.,
84.
Perraud, A. L., Takanishi, C. L., Shen, B., Kang, S.,
Wallner, O., Isaksson, R., Carter, M., Rudd, S. G., Loseva, O.,
Smith, M. K., Schmitz, C., Knowles, H. M., Ferraris, D.,
Jemth, A. S., Almlof, I., Font#Mateu, J., Llona#Minguez, S.,
Li, W., Zhang, J., Stoddard, B. L., and Scharenberg, A. M.
Baranczewski, P., Jeppsson, F., Homan, E., Almqvist, H.,
(2005) Accumulation of free ADP#ribose from mitochon#
Axelsson, H., Regmi, S., Gustavsson, A. L., Lundback, T.
dria mediates oxidative stress#induced gating of TRPM2
et al. (2018) Targeted NUDT5 inhibitors block hormone
cation channels, J. Biol. Chem.,
280,
6138#6148,
signaling in breast cancer cells, Nat. Commun., 9, 250,
doi: 10.1074/jbc.M411446200.
doi: 10.1038/s41467#017#02293#7.
85.
Zharova, T. V., and Vinogradov, A. D. (1997) A competitive
72.
Yoon, B., Yang, E. G., and Kim, S. Y. (2018) The ADP#
inhibition of the mitochondrial NADH#ubiquinone oxi#
ribose reactive NUDIX hydrolase isoforms can modulate
doreductase (complex I) by ADP#ribose, Biochim. Biophys.
HIF#1alpha in cancer cells, Biochem. Biophys. Res.
Acta, 1320, 256#264, doi: 10.1016/s0005#2728(97)00029#7.
Commun., 504, 321#327, doi: 10.1016/j.bbrc.2018.08.
86.
Palazzo, L., Thomas, B., Jemth, A. S., Colby, T.,
185.
Leidecker, O., Feijs, K. L., Zaja, R., Loseva, O.,
73.
Formentini, L., Macchiarulo, A., Cipriani, G., Camaioni, E.,
Puigvert, J. C., Matic, I., Helleday, T., and Ahel, I. (2015)
Rapizzi, E., Pellicciari, R., Moroni, F., and Chiarugi, A.
Processing of protein ADP#ribosylation by Nudix hydro#
(2009) Poly(ADP#ribose) catabolism triggers AMP#depen#
lases, Biochem. J., 468, 293#301, doi: 10.1042/BJ20141554.
dent mitochondrial energy failure, J. Biol. Chem., 284,
87.
Thirawatananond, P., McPherson, R. L., Malhi, J.,
17668#17676, doi: 10.1074/jbc.M109.002931.
Nathan, S., Lambrecht, M. J., Brichacek, M.,
74.
Nury, H., Dahout#Gonzalez, C., Trezeguet, V., Lauquin, G. J.,
Hergenrother, P. J., Leung, A. K. L., and Gabelli, S. B.
Brandolin, G., and Pebay#Peyroula, E. (2006) Relations
(2019) Structural analyses of NudT16#ADP#ribose com#
between structure and function of the mitochondrial
plexes direct rational design of mutants with improved pro#
ADP/ATP carrier, Annu. Rev. Biochem., 75, 713#741,
cessing of poly(ADP#ribosyl)ated proteins, Sci. Rep., 9,
doi: 10.1146/annurev.biochem.75.103004.142747.
5940, doi: 10.1038/s41598#019#39491#w.
5 БИОХИМИЯ том 85 вып. 8 2020
1050
КУЛИКОВА, НИКИФОРОВ
88. Zhang, F., Lou, L., Peng, B., Song, X., Reizes, O.,
responses and tumor suppression in mice, Mol. Cell. Biol.,
Almasan, A., and Gong, Z. (2020) Nudix hydrolase
23, 2556#2563, doi: 10.1128/mcb.23.7.2556#2563.2003.
NUDT16 regulates 53BP1 protein by reversing 53BP1
90. Belousova, E. A., Kutuzov, M. M., Ivankina, P. A.,
ADP#ribosylation, Cancer Res.,
80,
999#1010,
Ishchenko, A. A., and Lavrik, O. I. (2018) A new DNA
doi: 10.1158/0008#5472.CAN#19#2205.
break repair pathway involving PARP3 and base excision
89. Ward, I. M., Minn, K., van Deursen, J., and Chen, J. (2003)
repair proteins, Dokl. Biochem. Biophys., 482, 233#237,
p53 Binding protein 53BP1 is required for DNA damage
doi: 10.1134/S1607672918050010.
THE ROLE OF NUDIX HYDROLASES IN NAD
AND ADP RIBOSE METABOLISM IN MAMMALS
Review
V. A. Kulikova1,2,3* and A. A. Nikiforov2
1 Peter the Great St. Petersburg Polytechnic University, 195251 St. Petersburg, Russia;
E mail: veronika.a.kulikova@gmail.com
2 Institute of Cytology, Russian Academy of Sciences, 194064 St. Petersburg, Russia
3 Sechenov Institute of Evolutionary Physiology and Biochemistry,
Russian Academy of Sciences, 194223 St. Petersburg, Russia
Received April 29, 2020
Revised June 21, 2020
Accepted June 22, 2020
Proteins of the NUDIX hydrolase (NUDT) superfamily that cleave organic pyrophosphates are found in all classes of
organisms, from archaea and bacteria to higher eukaryotes. In mammals, NUDTs exhibit a wide range of functions
and are characterized by different substrate specificity and intracellular localization. They control the concentration
of various metabolites in the cell, including key regulatory molecules such as nicotinamide adenine dinucleotide
(NAD), ADP#ribose, and their derivatives. In this review, we discuss the role of NUDT proteins in the metabolism of
NAD and ADP#ribose in human and animal cells.
Keywords: NUDIX hydrolases, NAD, ADP#ribose, metabolism
БИОХИМИЯ том 85 вып. 8 2020