БИОХИМИЯ, 2020, том 85, вып. 8, с. 1051 - 1065
УДК 577.12
СИНТЕЗ ГЛУТАТИОНА В ОПУХОЛЕВЫХ КЛЕТКАХ
Обзор
© 2020
Е.В. Калинина*, Л.А. Гаврилюк
Российский университет дружбы народов, 117198 Москва, Россия; электронная почта: kalinina#ev@rudn.ru
Поступила в редакцию 23.05.2020
После доработки 20.06.2020
Принята к публикации 20.06.2020
Трипептид GSH связан не только с контролем и поддержанием окислительно восстановительного гомео
стаза клетки, но и процессами детоксикации, пролиферации, дифференцировки клеток, регуляцией меха
низмов клеточной гибели. Нарушения синтеза GSH и изменение соотношения GSH/GSSG являются об
щей чертой многих патологических состояний, включая злокачественные новообразования. Многочислен
ные данные свидетельствуют о значимости GSH и соотношения GSH/GSSG в регуляции жизнеспособнос
ти опухолевых клеток, в инициации развития опухоли, её прогрессировании и лекарственной устойчивос
ти. Однако контроль механизма синтеза GSH в злокачественных опухолях остаётся малоизученным. В об
зоре рассматриваются особенности синтеза GSH и его регуляции в опухолевых клетках и обсуждается роль
синтеза GSH в механизме апоптоза, некроптоза, ферроптоза, аутофагии.
КЛЮЧЕВЫЕ СЛОВА: синтез GSH de novo, микроРНК, апоптоз, некроптоз, ферроптоз, аутофагия.
DOI: 10.31857/S0320972520080059
ВВЕДЕНИЕ
В настоящее время всё большее внимание
обращается на тот факт, что нарушения синтеза
Трипептид глутатион (GSH) является наибо
GSH, изменения его содержания и соотноше
лее распространённым низкомолекулярным,
ния восстановленной и окисленной формы
водорастворимым антиоксидантом, содержание
(GSH/GSSG) являются общей чертой многих
которого достигает 1-10 мМ в большинстве кле
патологических процессов, включая развитие
ток (10 мМ для гепатоцитов) [1]. Внутриклеточ
злокачественных новообразований [3, 4]. Ре
ный уровень восстановленного глутатиона сос
зультаты исследований последнего десятилетия
тавляет 90-95% от его общей концентрации.
свидетельствуют о том, что при различных видах
Функции GSH связаны не только с контролем и
рака наблюдается повышение содержания GSH
поддержанием окислительно восстановитель
и активности глутатион зависимых ферментов
ного гомеостаза клетки посредством участия в
[5, 6]. Кроме того, получены эксперименталь
антиоксидантной защите и тиол дисульфидном
ные данные, подтверждающие двойственную
обмене пептидов и белков, редокс зависимой
роль АФК и GSH в инициации и прогрессиро
регуляции клеточного сигналинга и экспрессии
вании злокачественных опухолей [7].
генов, но и с участием в процессах детоксика
Ряд работ указывает на определенный дуа
ции токсичных соединений, синтезе эйкозанои
лизм роли GSH в развитии злокачественных
дов [1, 2].
новообразований. С одной стороны, GSH игра
ет важную роль в защите клеток от действия
канцерогенов, участвуя в их детоксикации и
Принятые сокращения: AIF - фактор, индуцирую
элиминации из организма с помощью изоформ
щий апоптоз; АФК - активные формы кислорода; ARE -
суперсемейства глутатионтрансферазы [8]. С
антиоксидант респонсивный элемент; ASK 1 - регулирую
щая апоптотические сигналы киназа 1; BSO - L бутио
другой стороны, повышенный уровень GSH в
нин (S, R) сульфоксимин; γ GT - γ глутамилтрансфера
различных опухолях (в частности, при раке
за; GPx - глутатионпероксидаза; Grx - глутаредоксин; костного мозга, молочной железы, толстого ки
GS - глутатионсинтаза; GSH, GSSG - глутатион восста
шечника, гортани, лёгкого) вносит вклад в ме
новленный, окисленный; γ GCL - γ глутамилцистеинли
газа; GST - глутатион S трансфераза; MAPK - митоген
ханизм адаптационной защиты опухолевых
активируемая протеинкиназа; miR - микроРНК, NF κB -
клеток, способствуя развитию лекарственной
ядерный фактор κB; Nrf2 - NF E2 зависимый фактор 2.
устойчивости к противоопухолевым препара
* Адресат для корреспонденции.
там [6, 9].
1051
5*
1052
КАЛИНИНА, ГАВРИЛЮК
Влияние GSH на окислительный стресс,
между цистеином и глутаминовой кислотой, ко
возникновение и прогрессирование опухоли ос
торая катализируется γ глутамилцистеинлигазой
ложняется двойственной ролью АФК в этих
(γ GCL) и является скорость лимитирующей ре
процессах. Низкий уровень АФК необходим для
акцией в синтезе GSH. Второй этап - реакция,
многих внутриклеточных процессов метаболиз
катализируемая глутатионсинтетазой (GS), при
ма и пролиферации клеток. Значительный рост
водящая к образованию GSH в результате связы
уровня АФК вызывает нарушение механизмов
вания глицина с γ глутамилцистеином [14]. Фер
их инактивации, возникающий дефицит анти
мент, способный гидролизовать специфическую
оксидантов может привести к серьезному пов
связь в молекуле GSH между остатками глутами
реждению и гибели клеток [10]. Однако повы
новой кислоты и цистеина, - γ глутамилтранс
шение генерации АФК, активируя сигнальные
фераза (γ GT), локализован на внешней стороне
пути, может способствовать злокачественному
цитоплазматической мембраны определенных
росту. В опухолевых клетках повышение уровня
типов клеток и обеспечивает перенос γ глута
АФК в результате дисфункции митохондрий, ге
мильного остатка на нейтральную аминокисло
нетических мутаций, изменений метаболизма
ту, делая возможным её транспорт в клетку. Об
приводит к накоплению большого количества
разующийся в результате действия γ GT дипеп
окисленных белков, ДНК, липидов. В ответ на
тид цистеинилглицин расщепляется дипептида
развитие окислительного стресса возникает ре
зой на цистеин и глицин, которые становятся
докс зависимое повышение экспрессии генов
субстратами для γ GCL и GS. γ Глутамилциклот
антиоксидантных ферментов [10, 11]. Наблюда
рансфераза обеспечивает разрыв связи γ глута
ется рост активности многих антиоксидантных
мильного остатка с аминокислотой с образова
ферментов, в том числе, супероксиддисмутазы,
нием свободной аминокислоты и 5 оксопроли
каталазы, тиоредоксинов, гемоксигеназы, пе
на, который под действием оксопролиназы де
роксиредоксинов. Таким образом, в опухолевых
циклизуется, образуя глутаминовую кислоту,
клетках происходит изменение баланса
также служащей субстратом для γ GCL. Таким
АФК/антиоксиданты, включая соотношение
образом, внеклеточный GSH может быть разру
GSH/GSSG, при более высоких их уровнях по
шен, входящие в его состав аминокислоты пос
сравнению с нормальными клетками [2].
тупают в клетку, где вновь возможно их включе
В то же время отмечается, что повышенный
ние в состав молекулы GSH.
уровень GSH может способствовать метастази
Синтез GSH происходит, в основном, в ци
рованию, в частности, при меланоме, гепато
топлазме клеток печени с последующим импор
карциноме, раке поджелудочной железы [6, 12].
том в митохондрии и ядро. Большая часть со
Обнаружено, что при метастазировании наблю
держания GSH плазмы крови обеспечивается
дается корреляция между содержанием глутати
его синтезом в печени, поэтому нарушения это
она и степенью метастазирования [13]. Прямая
го процесса в гепатоцитах ведут к системным
корреляция выявлена между повышением уров
межорганным изменениям гомеостаза глутатио
ня GSH и активностью патологического про
на [15]. Необходимое для нормального функци
цесса как следствия рецидива после хирургичес
онирования внутриклеточных процессов содер
кого удаления первичной опухоли [13].
жание GSH пополняется не только за счет син
Несмотря на высокий уровень накопленных
теза de novo, но и благодаря активности глутати
данных о значимой роли GSH в злокачествен
онредуктазы (GR), которая восстанавливает
ной трансформации, особенности его синтеза в
окисленный глутатион (GSSG) в присутствии
опухолевых клетках остаются малоизученными.
NADPH(H+) до GSH [14]. Регуляция синтеза
В настоящем обзоре проведен анализ механизма
GSH может значительно меняться при развитии
синтеза GSH и его регуляции в опухолевых
патологии, в частности, при онкогенезе [16].
клетках наряду с оценкой роли GSH в разных
В опухолевых клетках наблюдается значи
типах программируемой гибели.
тельное изменение экспрессии генов и актив
ности ферментов, участвующих в синтезе GSH.
Повышение синтеза GSH может быть следстви
СИНТЕЗ GSH de novo
ем метаболического перепрограммирования
В ОПУХОЛЕВЫХ КЛЕТКАХ
опухолевых клеток, связанного с редокс зави
симым сигналингом, характер которого в значи
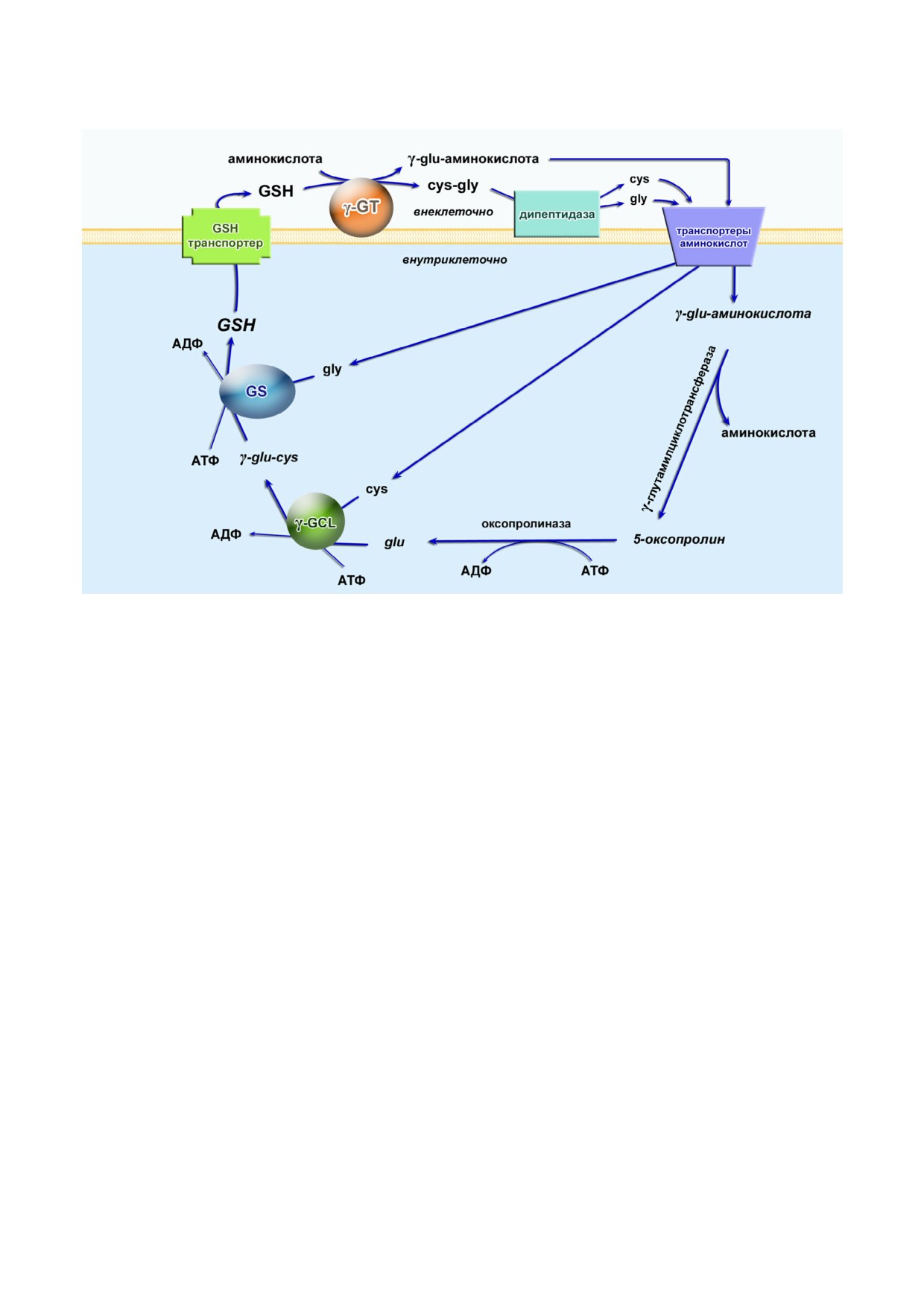
Синтез GSH de novo проходит в два АТФ за
тельной степени определяется соотношением
висимых этапа, которые включены в цикл шести
GSH/ GSSG, что позволяет GSH участвовать в
ферментативных реакций, получивших назва
регуляции клеточных систем с взаимообратной
ние γ глутамильного цикла (рис. 1). Первый
связью. В частности показано, что онкогенная
этап - реакция образования пептидной связи
передача сигналов фосфатидилинозитол 3 ки
БИОХИМИЯ том 85 вып. 8 2020
СИНТЕЗ ГЛУТАТИОНА В ОПУХОЛЕВЫХ КЛЕТКАХ
1053
Рис. 1. γ Глутамильный цикл синтеза GSH. γ GCL - γ глутамилцистеинлигаза; GS - глутатионсинтетаза; γ GT - γ глу
тамилтрансфераза. (С цветными вариантами рис. 1 и 2 можно ознакомиться в электронной версии статьи на сайте:
назой (PI3K) может стимулировать повышение
наружено повышение содержания GSH и уров
содержания GSH в клетках рака молочной же
ня транскрипции гена GCLC, индуцированное
лезы [17].
ингибитором протеасом лактацистином. На
При физиологических условиях активность
блюдаемое изменение уровня белка GCLC зави
γ GCL и содержание цистеина являются факто
село от активности p38 MAPK. Исследования в
рами, лимитирующими скорость синтеза GSH
клетках, трансфицированных микроРНК про
[16]. Дефицит γ GCL является редким аутосом
тив фактора транскрипции Nrf2, показали, что
ным заболеванием, характеризующимся сниже
промоторная активность гена GCLC зависит от
нием содержания GSH, гемолитической анеми
функциональной активности Nrf2 [19].
ей и неврологическими симптомами [18]. γ
На клетках MG 63 остеосаркомы показано,
GCL является гетеродимером, состоящим из 73
что действие простагландина (15d PGJ2) приво
kD каталитической субъединицы (GCLC) и 31
дит к повышению генерации АФК, вызывая ак
kD модулирующей субъединицы (GCLM) [16],
тивацию p38 MAPK и последующее фосфорили
оказывающей регуляторное действие на актив
рование киназы Akt (RAC alpha serine/threo
ность каталитической субъединицы. Мыши с
nine protein kinase) [20]. Киназа Akt является
нулевой мутацией гена GCLM имеют менее 25%
ключевым ферментом сигнального пу
внутриклеточного GSH. γ GCL может ингиби
ти PI3K/AKT и вовлечена в регуляцию проли
роваться по типу обратной связи продуктом
ферации и выживания клеток. Данный путь
синтеза - GSH [16]. В условиях окислительного
участвует в активации транскрипционных фак
стресса или при патологических состояниях со
торов Nrf2 и Egr1, что приводит к повышению
держание γ GCL в клетке в значительной степе
экспрессии гена каталитической субъединицы
ни может регулироваться транскрипционными
GCLС. Значительное повышение экспрессии
факторами Nrf2 и NF κB [14].
гена GCLC обнаружено у пациентов, страдаю
Во многих типах опухолевых клеток наблю
щих раком лёгких [21]. Повышенная экспрессия
дается рост экспрессии генов GCLС и GCLM.
гена GCLC и высокая активность γ GCL отмече
Так, в клетках НТ 29 колоректального рака об
ны у больных с плоскоклеточным раком головы
БИОХИМИЯ том 85 вып. 8 2020
1054
КАЛИНИНА, ГАВРИЛЮК
и шеи [22]. При наблюдении пациентов с коло
GT, поставляющего γ глутамильный остаток
ректальными опухолями установлен рост содер
(рис. 1). Гетеродимерный гликопротеин γ GT,
жания мРНК GCLC в 18,8% случаев аденом и
состоящий из двух субъединиц, чаще всего
84,2% карцином [23]. Повышенная активность
экспрессируется на люминальных поверхностях
γ GCL обнаружена у пациентов с почечно кле
секреторных клеток, таких как желчные прото
точным раком [24]. Рост экспрессии гена GCLM
ки и почечные проксимальные канальцы [32].
в опухолевых клетках может быть связан с раз
Активность γ GT значительно повышается при
витием лекарственной устойчивости [21, 25].
окислительном стрессе, особенно в опухолевых
Кроме того, мутации гена GCLM приводят к от
клетках с высоким уровнем метаболизма, и кор
сроченному возникновению опухоли на моде
релирует с содержанием GSH [33]. Ингибирова
лях с саркомой молочной железы и лимфомой,
ние γ GT является одним из механизмов сниже
что делает GCLM эффективной фармакологи
ния внутриклеточного содержания GSH как
ческой мишенью для борьбы с химиотерапевти
средства повышения чувствительности опухо
ческой устойчивостью при этих видах злокаче
лей к различным химиотерапевтическим аген
ственных новообразований [16, 26]. Получен
там. Наиболее часто применяемыми ингибито
ные данные, как полагают авторы, позволяют
рами γ GT являются аналоги глутамата (ацивин,
рассматривать ген GCLM в качестве возможной
L азазерин,
6 диазо 5 оксо 1 норлейцин) и
эффективной фармакологической мишени для
производные бороната [32]. К сожалению, при
борьбы с лекарственной устойчивостью при
менение таких конкурентных ингибиторов, как
этих видах злокачественных новообразований.
аналоги глутаминовой кислоты, оказывает вы
GS, второй ключевой фермент синтеза GSH,
сокое токсическое действие. Кроме этих препа
является димером, состоящим из двух идентич
ратов предлагается использование неконкуре
ных субъединиц и содержащим два домена:
нтных ингибиторов, например, таких как
один предназначен для АТФ, второй является
OU749, которые обладают низкой токсич
каталитическим центром. Для присоединения
ностью и значительно повышают чувствитель
АТФ к ферменту в качестве кофакторов необхо
ность клеток опухоли к терапии путем сниже
димы два иона магния (Mg2+). У человека де
ния уровня GSH и цистеина [34]. Перспектив
фекты гена GS наследуются по аутосомно ре
ным является поиск новых ингибиторов γ GT
цессивному пути. Возникновение мутаций в ге
среди GSH конъюгатов, к которым можно от
не GS может являться причиной разной степени
нести S геранилгеранил L глутатион и дарина
тяжести метаболического ацидоза, 5 оксопро
парсин [35, 36].
линурии, усиленного гемолиза и нарушения
Скорость синтеза GSH в значительной сте
функции центральной нервной системы. Опре
пени определяется концентрацией трёх амино
деление активности GS у таких пациентов выя
кислот: глутаминовой кислоты, цистеина и гли
вило её корреляцию с содержанием GSH [26].
цина, среди которых доминирующая роль при
Дефицит GS может наблюдаться в отсутствии
надлежит цистеину. Цистеин образуется в зна
мутаций в гене GS и быть следствием нарушения
чительной степени путём транссульфурации
сплайсинга [27]. Мутации могут быть сочетан
аминокислот. Согласно этому пути, метионин
ными, в частности, мутации гена GS и гена
активируется с использованием АТФ, превра
OPLAH, кодирующего 5 оксопролиназу [28]. Го
щаясь в S аденозилметионин (SAM), который
мозиготные мыши, нокаутные по гену GS, нес
является донором метильной группы, необходи
пособны синтезировать GSH и быстро погиба
мой для метилирования многих субстратов, с
ют. Данные результаты свидетельствуют о необ
помощью метионинаденозилтрансферазы [37].
ходимости для выживания синтеза GSH de novo
При гидролизе SAM образуется гомоцистеин,
[29]. Появление и развитие злокачественных
который в процессе катаболизма превращается
новообразований может сопровождаться изме
в цистатионин с последующим образованием
нением активности GS. Повышение активности
цистеина и α кетобутирата [38].
GS обнаружено у пациентов с рецидивом рака
В опухолевых клетках отмечается повыше
мочевого пузыря, с мелкоклеточным раком лёг
ние процесса транссульфурации. В клетках по
кого и колоректальным раком [30, 31]. Однако,
чечно клеточной карциномы с низкой ско
несмотря на эти и другие имеющиеся в литера
ростью пролиферации найдено повышенное со
туре работы, отмечающие повышенную актив
держание серина, гомоцистеина, SAM и S аде
ность GS в опухолевых клетках, роль этого фер
нозилгомоцистеина [39]. Клетки опухолей с вы
мента в злокачественных новообразованиях де
сокой степенью пролиферации содержат повы
тально всё ещё остается малоизученной.
шенное количество α гидроксибутирата и про
Большое значение для синтеза GSH имеет
дуктов метаболизма метионина - S аденозилго
активность мембранно связанного фермента γ
моцистеина и гомоцистеина. Предполагается,
БИОХИМИЯ том 85 вып. 8 2020
СИНТЕЗ ГЛУТАТИОНА В ОПУХОЛЕВЫХ КЛЕТКАХ
1055
что на ранней и поздней стадии агрессивной по
уровня глутамата, необходимого для синтеза
чечно клеточной карциномы уровень цистеина
GSH [44]. Глутамин может транспортироваться
предпочтительно пополняется путем транссуль
несколькими различными системами транспор
фурации [39].
та аминокислот. Среди них семейство транспор
В клетки опухоли цистеин также может пос
тёров растворённых веществ 1, из которых белок
тупать из микроокружения с помощью незави
5 (SLC1A5/ASCT2) является наиболее часто
сящего от натрия цистин/глутаматного анти
сверхэкспрессируемым транспортным белком в
порта, который известен как Xc или xCT сис
различных клетках опухолей человека, зависи
тема, кодируемая геном SLC7A11 [40]. Гетероди
мых от внеклеточного глутамина [45]. Содержа
мерный цистин/глутаматный антипортер состо
ние глутамина и GSH снижается в клетках с
ит из трансмембранного белка SLC7A11, свя
низкой экспрессией гена этого транспортёра,
занного с регуляторным белком SLC3A2 дисуль
также как и снижается активность глутаминаз 1
фидной связью. Белок SLC7A11 имеет 12 транс
и 2. Эта система регулируется онкогенным фак
мембранных доменов и в основном импортиру
тором транскрипции c Myc в клетках рака
ет в клетку (в обмен на глутамат) цистин, кото
предстательной железы и лимфомы [45, 46]. Об
рый восстанавливается до цистеина цистинре
наружено, что miR 23a и miR 24b могут подав
дуктазой [41]. Таким образом, помимо синтеза с
лять экспрессию гена SLC1A5, снижая метабо
помощью транссульфурации, опухолевые клет
лизм глутамина в опухоли [46]. Репрессия этих
ки могут получать цистеин, используя этот
микроРНК онкогенным фактором c Myc при
транспортный путь, пополняя внутриклеточное
водила к повышению экспрессии гена GLS и
содержание Cys, необходимое для синтеза GSH.
усилению катаболизма глутамина в клетках ме
Ген SLC7A11, который, как было показано, не
ланомы. Второй механизм влияния глутамина
обходим для пролиферации клеток рака проста
на уровень GSH связан с его ролью в поддержа
ты, молочной железы, почек, толстого кишеч
нии содержания GSH в восстановленной форме
ника, определяет содержание лёгкой цепи Xc
благодаря поддержанию уровня образования
системы в мембранах клеток этих опухолей [38].
NADPH(H+) путем регуляции содержания ма
В опухолевых стволовых клетках обнаружен по
лата [44]. Образование малата из глутамина мо
вышенный уровень этого транспортёра, корре
жет осуществляться двумя путями. По первому
лирующий с содержанием в них GSH [42].
пути малат, полученный из глутамина, транс
Функциональная активность цистин/глутамат
портируется из митохондрий в цитоплазму и
ного антипортера Xc способствует онкогенной
превращается малик ферментом в пируват, вос
трансформации белков RAS и вносит заметный
станавливая NADP+ до NADPH(H+). По второ
вклад в сохранение внутриклеточного окисли
му пути, связанному с малат аспартатным чел
тельно восстановительного баланса опухолевых
ночным механизмом, аспартат, полученный в
клеток [43]. Некоторые типы опухолевых клеток
матриксе митохондрий при переаминировании
(лейкемия, лимфома) не способны генериро
глутамата и оксалоацетата, транспортируется из
вать цистеин. Поэтому для поддержания роста
митохондрий в цитозоль. В цитозоле аспартат
таких клеток аминокислота должна поступать в
трансаминируется в оксалоацетат под действи
клетки из их микроокружения. При снижении
ем АсАТ и затем превращается в малат с после
содержания цистеина в клетках оно пополняет
дующим образованием пирувата и NADPH(H+)
ся с помощью Хc системы благодаря экскреции
[47]. NADPH(H+) имеет решающее значение
цистина соседними клетками (фибробластами,
для регенерации GSH из окисленной формы
активированными макрофагами). Поэтому цис
GSSG при действии фермента GR [14].
тин/глутаматный антипортер рассматривается
Третий механизм влияния глутамина на син
как потенциальная мишень для лечения злока
тез GSH связан с транспортом цистина в клетку.
чественных новообразований, при которых рост
Транспортная цистин глутаматная система Xc
и выживание опухолевых клеток зависят от пос
зависит от доступности глутамата для клеток,
тупления аминокислот извне [40, 42]. Помимо
так как одна молекула глутамата обменивается
цистеина синтез GSH зависит от содержания
на молекулу цистина. Экспериментально дока
глутамина и глутаминовой кислоты. Доступ
зано, что содержание глутамина и глутамата
ность глутамина влияет на синтез GSH тремя
имеет решающее значение для поддержания не
различными механизмами. Во первых, глута
обходимого для клетки уровня GSH [44].
мин является основным источником глутами
Помимо глутамата и цистеина синтез GSH
новой кислоты, образующейся с помощью глу
зависит от доступности глицина, который явля
таминазы 1 и 2 [44]. Экспериментально показа
ется необходимой аминокислотой для многих
но, что активность глутаминазы строго регули
метаболических процессов, одним из которых
руется для поддержания внутриклеточного
является синтез пуринов (аденин, гуанин) в
БИОХИМИЯ том 85 вып. 8 2020
1056
КАЛИНИНА, ГАВРИЛЮК
быстро делящихся опухолевых клетках. Дефи
miR 18a in vivo приводит к повышению экспрес
цит серина и глицина вызывает снижение син
сии гена GCLC и содержания GSH в опухоли
теза GSH, повышая генерацию АФК в культуре
[52]. Экспрессия гена GCLC может подавляться
опухолевых клеток. Глицин является заменимой
действием miR 18a при раке предстательной же
аминокислотой, синтез которой возможен из
лезы и miRNA 153 в клетках глиобластомы [53,
серина. В некоторых случаях серин может быть
54]. На моделях почечного и печёночного фиб
получен путем транссульфурации. В опухолях,
роза установлено подавление экспрессии генов
где этот путь нарушен, обнаружено повышенное
GCLС, GCLМ и снижение содержания GSH при
накопление 3 фосфоглицерата [48]. Экспери
действии miR 433 [55]. MiRNA 433 подавляет
ментально показано, что повышение содержа
экспрессию этих генов (как каталитической, так
ния глицина способствует онкогенезу [49]. В
и регуляторной субъединиц γ GCL) с помощью
опухолевых клетках NCI 60 обнаружено, что
Nrf2 независимого механизма в клетках злока
потребление глицина и экспрессия генов фер
чественных опухолей яичника и кишечника
ментов, необходимых для биосинтеза глицина,
[56,57]. Напротив, в клетках гепатоклеточной
коррелируют со скоростью пролиферации кле
карциномы miRNA 27a/b модулирует экспрес
ток.
сию гена GCLС Nrf2 зависимым путём [58]. При
Высокое соотношение GSH/GSSG в опухо
исследовании уровня экспрессии гена GS у па
левых клетках может быть объяснено повыше
циентов с хроническим лимфоцитарным лейко
нием активности пентозофосфатного пути
зом установлено обратно пропорциональное со
(ПП), в результате которого образуется
отношение между экспрессией этого гена и
NADPH(H+) [50]. Так, активация ПП, значи
уровнем miRNA125 b [59].
тельное количество GSH и промежуточных ме
Сверхэкспрессия miRNA 214 приводит к
таболитов ПП обнаружены в клетках почечно
снижению экспрессии гена GR в клетках рака
клеточной карциномы [51]. ПП является един
молочной железы, лёгкого, шейки матки, толс
ственным внутриклеточным путём, в процессе
того кишечника, что связано с плохим прогно
которого образуются пентозы (рибоза), необхо
зом для пациентов [60-63]. MiRNA22 подавляет
димые для синтеза нуклеиновых кислот, кофер
экспрессию гена GGT в клетках злокачествен
ментов (NAD, FAD), макроэргических соедине
ных опухолей, толстого кишечника и предста
ний (АТФ, ГТФ), циклических нуклеотидов
тельной железы [64, 65].
(цАМФ, цГМФ). Второй биосинтетической осо
Отмечается влияние микроРНК на поступ
бенностью ПП является образование
ление в клетки цистеина, необходимого для
NADPH(H+), составляющего 65-70% от его об
синтеза GSH, посредством регуляции его транс
щего содержания в клетке, необходимого для
порта Xc системой, которая стабилизируется в
биосинтеза жирных кислот, холестерина, желч
клеточной мембране с помощью CD44v, извест
ных кислот, стероидных гормонов. Все эти сое
ного маркёра опухолевых стволовых клеток [41].
динения необходимы клеткам растущей опухо
В опухолевых клетках колоректального рака
ли, как и GSH, пополнению пула которого спо
экспрессия гена SLC7A11, кодирующего Xc сис
собствует GR, катализирующая восстановление
тему, имеет обратную корреляцию с уровнем
GSSG с использованием NADPH(H+) [14].
экспрессии miRNA 26b [66]. Рост экспрессии
miRNA 375 вызывает подавление экспрессии
гена SLC7A11, что повышает радиочувствитель
РОЛЬ микроРНК В РЕГУЛЯЦИИ СИНТЕЗА
ность и снижает пролиферацию и инвазию
GSH В ОПУХОЛЕВЫХ КЛЕТКАХ
плоскоклеточного рака полости рта [67]. Подоб
ный эффект имеет место и при сверхэкспрессии
Особое внимание в последнее время уделя
miRNA 27a, которая снижает уровень Xc и, как
ется роли микроРНК в регуляции метаболизма
следствие, содержание внутриклеточного GSH,
опухолевых клеток и возможности их использо
тем самым повышая чувствительность к проти
вания в комбинации с противоопухолевыми
воопухолевым препаратам клеток рака мочевого
препаратами. Данные многих работ демонстри
пузыря, устойчивых к цисплатину [68].
руют значительную роль микроРНК в регуля
ции содержания GSH в опухолевых клетках,
контролируя не только его синтез, но и восста
РОЛЬ GSH В ПРОГРАММИРУЕМОЙ
новление GSSG (таблица). Установлено, что
ГИБЕЛИ ОПУХОЛЕВЫХ КЛЕТОК
действие c Myc активированной miR 18a при
водит к подавлению экспрессии гена GCLC и по
Уровень GSH и соотношение GSH/GSSG
вышению чувствительности опухолей к окисли
являются важной характеристикой клеточного
тельному стрессу. Напротив, ингибирование
редокс статуса, поддерживающего клеточный
БИОХИМИЯ том 85 вып. 8 2020
СИНТЕЗ ГЛУТАТИОНА В ОПУХОЛЕВЫХ КЛЕТКАХ
1057
МикроРНК, участвующие в регуляции синтеза GSH и восстановления GSSG в пухолевых клетках
МикроРНК
Мишень
Эффект
Вид новообразования
Ссылки
miRNA 18a
γ GCL
онкоген
гепатоклеточная карцинома
[52]
рак простаты
[53]
miRNA 433
γ GCL
онкосупрессор
рак яичника
[56]
рак кишечника
[57]
miRNA 27a/b
γ GCL
онкосупрессор
гепатоклеточная карцинома
[58]
miRNA 153
γ GCL
онкосупрессор
глиобластома
[54]
miRNA 125b
GS
онкосупрессор
хронический лимфолейкоз
[59]
miRNA 214
GR
онкосупрессор
рак молочной железы
[60]
рак лёгкого
[61]
колоректальный рак
[62]
рак шейки матки
[62]
рак почки
[63]
miRNA 22
γ GGT
онкосупрессор
колоректальный рак
[64]
онкоген
рак простаты
[65]
miRNA 26b
Xc
онкосупрессор
колоректальный рак
[66]
miRNA 375
Xc
онкосупрессор
плоскоклеточный рак ротовой полости
[67]
miRNA 27a
Xc
онкосупрессор
рак мочевого пузыря
[68]
гомеостаз и влияющего на жизнеспособность
гибирования процесса синтеза GSH, усилен
клетки, в том числе на способность к пролифе
ного использования GSH в процессах детокси
рации, дифференцировке, программируемой
кации и активации транспорта GSH из клетки
гибели. Значительное снижение содержания
[70]. Уменьшение содержания GSH в клетке
GSH и соотношения GSH/GSSG может быть
приводит к недостаточности антиоксидантной
пусковым триггером для разных типов програм
системы и росту образования АФК, что вызыва
мируемой гибели клеток (апоптоз, аутофагия,
ет повреждение мембран митохондрий, падение
некроптоз, ферроптоз), однако, возможно и
трансмембранного потенциала, нарушение про
включение смешанных или множественных
цессов синтеза АТФ, активацию внутреннего
форм гибели [69].
пути развития апоптоза (рис. 2). Повышенный
Апоптотическая гибель клеток, как наиболее
уровень АФК и снижение митохондриального
изученный тип программируемой гибели, ха
отношения mGSH/GSSG приводит к повыше
рактеризуется уменьшением объёма цитоплаз
нию проницаемости наружной мембраны мито
мы, конденсацией хроматина, фрагментаци
хондрий благодаря мегапорам (образованным, в
ей ядра, блеббингом клеточной мембраны и об
частности, в результате роста соотношения бел
разованием апоптотических телец. Снижение
ков Bax/Bcl2), что сопровождается высвобожде
содержания GSH терапевтическими факторами
нием фактора AIF, активирующего апоптоз, ци
(ряд противоопухолевых препаратов, радиоте
тохрома с, образованием апоптосом и активаци
рапия) может сопровождаться инициацией
ей каспаз [69, 70].
апоптоза и происходит в результате ряда при
Снижение синтеза GSH при действии необ
чин: дефицита субстратов для синтеза GSH, ин ратимого ингибитора γ GCL L бутионин (S,
БИОХИМИЯ том 85 вып. 8 2020
1058
КАЛИНИНА, ГАВРИЛЮК
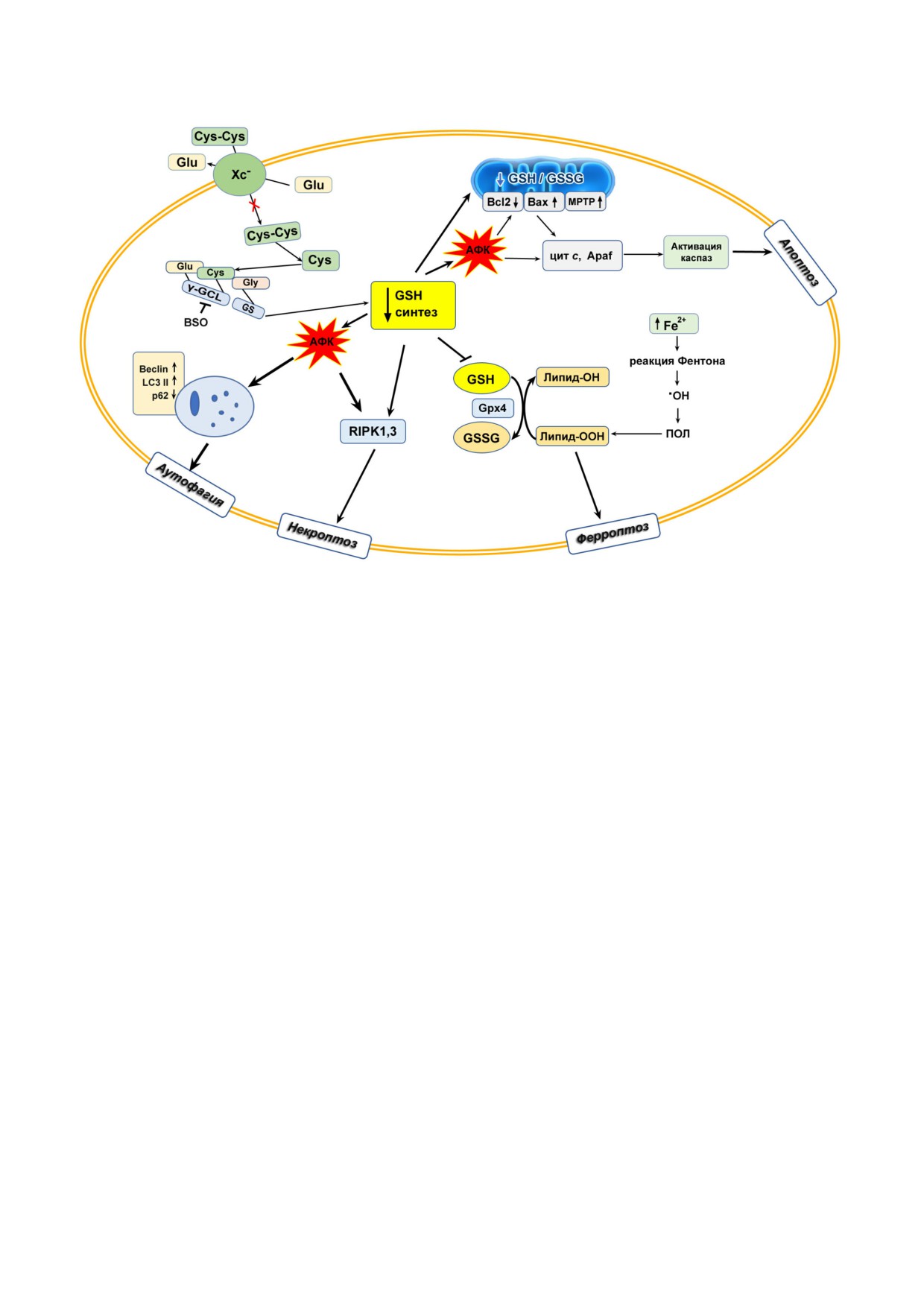
Рис. 2. Роль GSH в механизмах программируемой гибели опухолевых клеток. Подавление синтеза GSH способствует ак
тивации: а) апоптоза: путем снижения поступления GSH в митоходриии и отношения mGSH/GSSG с последующим по
вышением уровня АФК, пермеабилизации внешних митохондриальных мембран (мPTP), соотношения белков Bax/Bcl2,
высвобождением про апоптотических факторов, цитохрома с, образованием апоптосом, активацией каспаз и фрагмента
цией ДНК; б) некроптоза: падение уровня GSH сопровождается ростом генерации АФК, активации киназ RIPK1 и
RIPK3, сборкой некросом; в) ферроптоза: распад ферритина, значительно повышающий содержание ионов Fe2+, наряду
с ростом уровня H2O2 запускает реакцию Фентона, которая приводит к образованию •ОН радикалов, инициирующих пе
рекисное окисление липидов (ПОЛ). Дефицит GSH, как косубстрата Gpx4, приводит к накопление гидроперекисей ли
пидов, активирующих ферроптоз; г) аутофагии: истощение содержания GSH способствует Н2О2 зависимой активации
аутофагии, сопровождающейся усиленным образованием аутофагосом и изменением содержания маркеров аутофагии
ростом содержания белков Beclin, LC3 II и деградацией белка p62, связывающегося с убиквитинированными белками
R) сульфоксимина (BSO) способствует актива
в результате снижения активности γ GCL и со
ции апоптоза в клетках рака молочной железы,
держания GSH [74].
яичников и почки и замедляет рост клеток при
При некроптозе отсутствует фрагмента
раке пищевода [71]. Комбинированная терапия
ция ДНК, в отличие от апоптоза происходит
BSO и мелфалана, используемая для пациентов
увеличение объёма органелл и клетки, разруше
с резистентной нейробластомой, сопровожда
ние цитоплазматической мембраны [75]. Клю
лась активацией апоптоза опухолевых клеток
чевыми регуляторами некроптоза являются
[72]. Введение BSO повышало чувствительность
протеинкиназы 1 (RIPK1, receptor interacting
клеток опухоли к химиотерапевтическим сред
serine/threonine protein kinase 1) и 3 (RIPK3,
ствам у пациентов с миеломой и раком шеи [73].
receptor interacting
serine/threonine protein
Препарат повышал действие нифуртимокса для
kinase 3), взаимодействующие с так называемы
подавления роста опухолевых клеток и проде
ми рецепторами смерти, среди которых выделя
монстрировал способность эффективного моду
ют TNFR1 и TNFR2 (рецепторы некроза опухо
лятора GSH опосредованной лекарственной
ли TNF α), рецепторы FasL (Fas ligand) и TRAIL
резистентности за счёт повышения цитотоксич
(TNF related apoptosis inducing ligand). RIPK1 и
ности алкилирующих агентов и радиации in
RIPK3 аутофосфорилируются, трансфосфори
vitro.
лируют друг друга и собираются в некросомы.
Использование флавоноида лютеолина при
Активаторы некроптоза и внешнего апоптоза
водит к снижению жизнеспособности клеток
могут быть общими. Так, каспаза 8 и протеинки
холангиокарциномы путём активации апоптоза
наза
1 контролируют переключение между
благодаря росту генерации АФК, возникающего
апоптозом и некрозом [76]. Во многих работах
БИОХИМИЯ том 85 вып. 8 2020
СИНТЕЗ ГЛУТАТИОНА В ОПУХОЛЕВЫХ КЛЕТКАХ
1059
показана связь между снижением содержания
тоза являются Fe+2 зависимая инактивация глу
GSH и активацией некроптоза. Так, действие
татионпероксидазы 4 (Gpx4), основным суб
диметилфумарата, используемого для лечения
стратом которой являются гидроперекиси фос
рассеянного склероза, активировало некроптоз
фолипидов [82]. Одним из основных факторов,
клеток карциномы толстого кишечника мы
активирующих ферроптоз, является снижение
ши CT26, вызывая падение уровня GSH и рост
содержания GSH, косубстрата Gpx4, чаще всего
генерации АФК наряду с активацией MAP ки
за счёт дефицита Xc системы, поставляющей
наз JNK, p38, ERK. Добавление GSH и N аце
цистин, необходимый для синтеза GSH [83].
тилцистеина препятствовало развитию некроп
Эрастин, первый обнаруженный индуктор фер
тоза [77]. Аналогичный эффект был получен при
роптоза, являясь ингибитором системы транс
действии оритодина (дитерпеноид, обладаю
порта Хс , активно снижает транспорт цистина
щий противовоспалительным действием, полу
в клетку, вызывая дефицит синтеза GSH, что ак
чаемый из китайского лекарственного растения
тивирует образование АФК, гидроперекисей
Rabdosia rubescens) на клетки аденокарциномы
фосфолипидов и ферроптоз [82]. Эрастин необ
786 O: развитию некроптоза, связанного с акти
ратимо связывается с транспортным белком
вацией JNK, p38, ERK, препятствовало введе
SLC7A11 Хс системы, инактивируя его. Дей
ние GSH и его предшественника N ацетилцис
ствие эрастина снижает антиоксидантную за
теина [78]. Снижение соотношения GSH/GSSG
щиту клетки путем подавления активности
и повышение образования АФК под действием
Gpx4, которая не может восстанавливать гидро
противомалярийного препарата артесуната в
перекиси липидов вследствие дефицита GSH
клетках почечной карциномы человека также
как косубстрата [84]. Этот эффект может быть
приводило к развитию некроптоза. Этот эффект
блокирован добавлением в среду GSH и N аце
подавлялся при введении некростатина 1 или
тилцистеина. Имидазолилкетоэрастин, аналог
при нокдауне RIPK1 [79]. Дефицит цисти
карбонилэрастина, также может ингибировать
на/цистеина, необходимого для синтеза GSH,
систему Xc и является более эффективным в
также вызывает развитие окислительного стрес
отношении подавления роста опухолевых кле
са и приводит к активации как некроптоза, так и
ток, чем эрастин [85]. Действие эрастина не вы
ферроптоза [80].
зывает морфологических или биохимических
Характерной особенностью ферроптоза яв
изменений, подобных тем, которые происходят
ляется активация Fe2+ зависимого перекисного
при апоптозе клеток, такие как изменение хро
окисления липидов [81]. Морфологически клет
матина или распад поли АДФ рибозо полиме
ки, подвергнутые ферроптозу, отличаются
разы (PARP). Кроме того, гибель клеток, выз
уменьшением размера митохондрий и митохон
ванная эрастином, не блокируется ингибитора
дриальных крист, а также наличием разры
ми апоптоза, некроптоза или аутофагии. Однако
вов внешней митохондриальной мембраны. Ме
антиоксиданты (витамин Е) и хелаторы железа
ханизм ферроптоза связан с накоплением в
(мезилат дефероксамина) блокируют гибель
клетке свободного Fe2+. Медиаторами ферро
клеток. Таким образом, ферроптоз является же
птоза являются белки, участвующие в метабо
лезо зависимой, неапоптотической формой ре
лизме железа: трансферрин, рецептор трансфер
гулируемой гибели клеток [81].
рина (TFR), ферропортин, тяжёлая и лёгкая це
Механизм ферроптоза связан с регуляцией
пи ферритина. Уровень железа в клетках регули
некоторых патологических процессов, в том
руется TFR, который транспортирует железо в
числе развития злокачественных новообразова
клетки, и ферропортином, экспортирующим
ний. Многочисленные исследования подтвер
железо из клетки. Ионы железа (Fe3+) поступают
дили, что ферроптоз играет ключевую роль в по
в клетку с помощью TFR и затем восстанавлива
давлении роста опухоли. Так, ферроптоз может
ются с образованием Fe2+. Железо, хранящееся в
быть причиной гибели опухолевых клеток лёг
ферритине, высвобождается в результате его
ких, молочной железы, поджелудочной железы,
распада в лизосомах. Распад ферритина, значи
почек [86]. В связи с этим индукция ферроптоза
тельно повышающий содержание ионов Fe2+,
рассматривается как новая терапевтическая
наряду с ростом уровня H2O2 запускает реакцию
стратегия в лечения рака. Часто используемые
Фентона, которая приводит к образованию вы
ингибиторы Xc системы (сульфасалазин и эрас
соко реакционноспособных •ОН радикалов,
тин) могут применяться в качестве терапевти
инициирующих пероксидное окисление липи
ческих средств для повышения чувствительнос
дов (ПОЛ) и накопление гидроперекисей липи
ти клеток опухоли к противоопухолевым аген
дов (в основном гидроперекисей фосфатидилэ
там. Данные препараты, снижая внутриклеточ
таноламинов), активирующих ферроптоз [82]
ный уровень цистеина, вызывают ферроптоз
(рис. 2). Дополнительным признаком ферроп
[87]. Такие препараты, как сорафениб и артесу
БИОХИМИЯ том 85 вып. 8 2020
1060
КАЛИНИНА, ГАВРИЛЮК
нат, могут вызывать ферроптоз клеток некото
которых содержимое подвергается распаду. Дли
рых видов злокачественных новообразований.
тельное время аутофагию считали механизмом
Поэтому их предлагается использовать в комби
защиты клеток. Однако аутофагия может вызы
нированных схемах химиотерапии. Обнаруже
вать гибель клеток, и её можно рассматривать
но, что сорафениб вызывает ферроптоз в клет
как механизм подавления роста опухолей [91].
ках гепатокарциномы, ингибируя Xc систему и
Низкий уровень GSH в клетке, способствуя раз
снижая содержание GSH [88]. Сорафениб, как
витию окислительного стресса, является сигна
ингибитор протоонкогенных киназ, применяет
лом для активации аутофагии как реакции адап
ся для лечения пациентов с почечно клеточной
тации к стрессу [92]. Различные пути снижения
карциномой, распространённой гепатоцеллю
внутриклеточного GSH способствуют актива
лярной карциномой и другими солидными опу
ции аутофагии. Так, ингибирование Xc системы
холями. Противоопухолевая эффективность со
при действии сульфасалазина, приводящее к
рафениба коррелирует с ингибированием сиг
снижению транспорта цистина в опухолевые
нального пути Raf MEK ERK и нескольких ре
клетки и подавлению синтеза GSH, сопровож
цепторных тирозинкиназ, включая рецептор
дается активацией аутофагии [93]. Истощение
фактора роста эндотелия сосудов VEGF, тем са
содержания GSH способствует Н2О2 зависимой
мым ингибируя неоангиогенез. Однако индук
активации аутофагии, сопровождающейся уси
ция ферроптоза не связана с ингибирующим
ленным образованием аутофагосом и изменени
действием сорафениба на RAF киназы. Сущест
ем содержания маркеров аутофагии - ростом
вует два основных механизма, с помощью кото
содержания белка LC3 II и деградацией белка
рых сорафениб вызывает ферроптоз. Согласно
p62, связывающегося с убиквитинированны
первому механизму сорафениб, как и эрастин,
ми белками [94]. Процессы аутофагии и фер
ингибирует импорт цистина Хc системой, вы
роптоза часто развиваются одновременно при
зывая стресс эндоплазматического ретикулума,
снижении уровня GSH и активности Gpx4.
истощение GSH и железо зависимое накопле
Ферроптоз, вызываемый дигидроартемизини
ние липидных АФК [87]. Другой механизм свя
ном в клетках острого миелоидного лейкоза,
зан с путём p62 Keap1 NRF2, когда предполага
развивается в результате активации процесса ау
ется, что Nrf2 является ключевым фактором в
тофагии при понижении содержания GSH, дег
определении терапевтического ответа на лече
радации ферритина и накоплении ионов Fe2+
ние, направленное на активацию ферроптоза в
[95]. Повышение активности лизосом при фер
клетках опухоли [89].
роптозе связано с усилением шаперон опосре
Среди противоопухолевых препаратов, ис
дуемой аутофагии, приводящей к деградации
пользуемых для лечения солидных опухолей,
Gpx4 [96]. Действие эрастина стимулирует как
цисплатин обладает весьма высокой эффектив
ферроптоз, так и аутофагию опухолевых клеток
ностью. Его противоопухолевый эффект в зна
[97]. Ингибирование лизосомальной функции
чительной степени обусловлен алкилирующим
биламицином A1 и хлорохином может значи
действием на ДНК. Однако недавние исследова
тельно замедлить процесс ферроптоза, активи
ния показали, что цисплатин может активиро
рованный эрастином [98]. Внутриклеточный
вать как ферроптоз, так и апоптоз в опухолевых
распад ферритина является зависимым от ауто
клетках [90]. Такое свойство цисплатина объяс
фагии, для этого коактиватор ядерного рецепто
няется способностью легко связываться с тиоль
ра 4 (NCOA4) в качестве транспортёра доставля
ными группами, что определяет его высокое
ет ферритин к аутофагосоме [99].
сродство к GSH, являющимся одним из самых
Снижение внутриклеточного содержания
распространённых небелковых тиолов в клетках.
GSH в результате подавления его синтеза и/или
Показано, что большая часть внутриклеточного
повышенного использования за счёт роста гене
цисплатина связывается с GSH, образуя комп
рации АФК может быть общим событием в воз
лекс Pt GS. Подобно эрастину истощение GSH,
никновении одновременно разных форм прог
наряду с инактивацией Gpx4, является основ
раммируемой гибели опухолевых клеток. Так,
ным механизмом действия цисплатина, вызыва
фенетилизотиоцианат, обладающий противо
ющим активацию ферроптоза [82, 90].
опухолевым эффектом в отношении многих ви
При аутофагии происходит процесс разру
дов злокачественных новообразований, при
шения цитоплазматических компонентов в ли
действии на клетки остеосаркомы K7M2, вызы
зосомах клетки в условиях стресса. Аутофагия
вая снижение уровня GSH (за счёт связывания с
сопровождается образованием аутофагосом,
его SH группой) с последующим ростом образо
включающих удаляемые органеллы и цитоплаз
вания АФК и активацией редокс зависимого
му, с последующим формированием аутофаго
сигналинга, приводит к гибели опухолевых кле
лизосом в результате слияния с лизосомами, в
ток путём активации как ферроптоза, так и ауто
БИОХИМИЯ том 85 вып. 8 2020
СИНТЕЗ ГЛУТАТИОНА В ОПУХОЛЕВЫХ КЛЕТКАХ
1061
фагии, апоптоза [100]. Данный факт может рас
более селективных и менее токсичных ингиби
сматриваться в качестве возможного доказа
торов синтеза GSH, которые можно применять
тельства роли внутриклеточного уровня GSH и
в сочетании с противоопухолевыми препарата
соотношения GSH/GSSG как триггера в ре
ми для эффективного подавления роста злока
докс зависимой регуляции механизмов прог
чественных новообразований.
раммируемой клеточной гибели.
Таким образом, многочисленные данные
свидетельствуют о значимости GSH и соотно
Финансирование. Публикация подготовлена
шения GSH/GSSG в регуляции жизнеспособ
при финансовой поддержке Программы РУДН
ности опухолевых клеток, инициации развития
«5 100».
опухоли, её прогрессии и лекарственной устой
Конфликт интересов. Авторы заявляют об от
чивости. Тем не менее контроль механизмов
сутствии конфликта интересов.
синтеза глутатиона в доброкачественных и зло
Соблюдение этических норм. Настоящая
качественных опухолях остаётся малоизучен
статья не содержит описания каких либо иссле
ным. Дальнейшее исследование механизмов ре
дований с участием людей или животных в каче
гуляции синтеза GSH может помочь в поиске
стве объектов.
СПИСОК ЛИТЕРАТУРЫ
1.
Scirè, A., Cianfruglia, L., Minnelli, C., Bartolini, D.,
11.
Kirtonia, A., Sethi, G., and Garg, M. (2020) The multifac
Torquato, P., Principato, G., Galli, F., and Armeni, T.
eted role of reactive oxygen species in tumorigenesis, Cell.
(2019) Glutathione compartmentalization and its role in
Mol. Life Sci., doi: 10.1007/s00018 020 03536 5.
glutathionylation and other regulatory processes of cellular
12.
Xiao, Y., Yang, H., and Lu, J. (2019) Serum gamma glu
pathways, Biofactors, 45, 152 168, doi: 10.1002/biof.1476.
tamyltransferase and the overall survival of metastatic pan
2.
Kalinina, E. V., Chernov, N. N., and Novichkova, M. D.
creatic cancer, BMC Cancer, 19, 1020, doi: 10.1186/s12885
(2014) Role of glutathione, glutathione transferase, and
019 6250 8.
glutaredoxin in regulation of redox dependent processes,
13.
Huang, Z. Z., Chen, C., Zeng, Z., Yang, H., Oh, J., Chen, L.,
Biochemistry (Moscow), 79, 15621583, doi: 10.1134/
and Lu, S. C. (2001) Mechanism and significance of
S0006297914130082.
increased glutathione level in human hepatocellular carci
3.
Dwivedi, D., Megha, K., Mishra, R., and Mandal, P. K.
noma and liver regeneration, FASEB J., 15, 1921,
(2020) Glutathione in brain: overview of its conformations,
doi: 10.1096/fj.00 0445fje.
functions, biochemical characteristics, quantitation and
14.
Lu, S. C. (2013) Glutathione synthesis, Biochim. Biophys.
potential therapeutic role in brain disorders, Neurochem.
Acta, 1830, 3143 3153, doi: 10.1016/j.bbagen.2012.09.008.
Res., doi: 10.1007/s11064 020 03030 1.
15.
Ookhtens, M., and Kaplowitz, N. (1998) Role of the liver in
4.
Teskey, G., Abrahem, R., Cao, R., Gyurjian, K., Islamoglu, H.,
interorgan homeostasis of glutathione and cyst(e)ine, Semin.
Lucero, M., Martinez, A., Paredes, E., Salaiz, O.,
Liver Dis., 18, 313 329, doi: 10.1055/s 2007 1007167.
Robinson, B., and Venketaraman, V. (2018) Glutathione as
16.
Lu, S. C. (2009) Regulation of glutathione synthesis, Mol.
a marker for human disease, Adv. Clin. Chem., 87, 141 159,
Aspects Med., 30, 42 59, doi: 10.1016/j.mam.2008.05.005.
doi: 10.1016/bs.acc.2018.07.004.
17.
Lien, E. C., Lyssiotis, C. A., Juvekar, A., Hu, H., Asara, J. M.,
5.
Xiao, Y., and Meierhofer, D. (2019) Glutathione metabo
Cantley, L. C., and Toker, A. (2016) Glutathione biosynthe
lism in renal cell carcinoma progression and implications
sis is a metabolic vulnerability in PI(3)K/Akt driven breast
for therapies, Int. J. Mol. Sci., 20, 3672, doi: 10.3390/
cancer, Nat. Cell Biol., 18, 572 578, doi: 10.1038/ncb3341.
ijms20153672.
18.
Ristoff, E., and Larsson, A. (2007) Inborn errors in the
6.
Bansal, A., and Simon, M. C. (2018) Glutathione metabo
metabolism of glutathione, Orphanet J. Rare Dis., 2, 16,
lism in cancer progression and treatment resistance, J. Cell
doi: 10.1186/1750 1172 2 16.
Biol., 217, 2291 2298, doi: 10.1083/jcb.201804161.
19.
Huseby, N. E., Ravuri, C., and Moens, U. (2016) The pro
7.
Galadari, S., Rahman, A., Pallichankandy, S., and
teasome inhibitor lactacystin enhances GSH synthesis
Thayyullathil, F. (2017) Reactive oxygen species and cancer
capacity by increased expression of antioxidant components
paradox: to promote or to suppress? Free Radic. Biol. Med.,
in an Nrf2 independent, but p38 MAPK dependent man
104, 144 164, doi: 10.1016/j.freeradbiomed.2017.01.004.
ner in rat colorectal carcinoma cells, Free Radic. Res., 50, 1
8.
Chatterjee, A., and Gupta, S. (2018) The Multifaceted role
13, doi: 10.3109/10715762.2015.1100730.
of glutathione S transferases in cancer, Cancer Lett., 433,
20.
Koyani, C. N., Kitz, K., Rossmann, C., Bernhart, E.,
33 42, doi: 10.1016/j.canlet.2018.06.028.
Huber, E., Trummer, C., Windischhofer, W., Sattler, W.,
9.
Desideri, E., Ciccarone, F., and Ciriolo, M. R. (2019)
and Malle, E. (2016) Activation of the MAPK/Akt/Nrf2
Targeting glutathione metabolism: partner in crime in anti
Egr1/HO 1 GCLc axis protects MG 63 osteosarcoma cells
cancer therapy, Nutrients,
11,1926, doi:
10.3390/
against
15d PGJ2 mediated cell death, Biochem.
nu11081926.
Pharmacol., 104, 29 41, doi: 10.1016/j.bcp.2016.01.011.
10.
Kengen, J., Deglasse, J. P., Neveu, M. A., Mignion, L.,
21.
Hiyama, N., Ando, T., Maemura, K., Sakatani, T., Amano, Y.,
Desmet, C., Gourgue, F., Jonas, J. C., Gallez, B., and
Watanabe, K., Kage, H., Yatomi, Y., Nagase, T., Nakajima,
Jordan, B. F. (2018) Biomarkers of tumour redox status in
J., and Takai, D. (2018) Glutamate cysteine ligase catalytic
response to modulations of glutathione and thioredoxin
subunit is associated with cisplatin resistance in lung adeno
antioxidant pathways, Free Radic. Res., 52, 256266,
carcinoma, Jpn. J. Clin. Oncol., 48, 303 307, doi: 10.1093/
doi: 10.1080/10715762.2018.1427236.
jjco/hyy013.
БИОХИМИЯ том 85 вып. 8 2020
1062
КАЛИНИНА, ГАВРИЛЮК
22.
Dequanter, D., Van De Velde, M., Bar, I., Nuyens, V.,
crossroads of tumor progression, drug resistance and drug
Rousseau, A., Nagy, N., Vanhamme, L., Vanhaeverbeek, M.,
targeting, Anticancer Res., 30, 1169 1181.
Brohée, D., Delrée, P., Boudjeltia, K., Lothaire, P., and
35.
Lu, E., Wolfrey, F. D., Muppidi, J. R., Xu, Y., and Cyster, J. G.
Uzureau, P. (2016) Nuclear localization of glutamate cys
(2019) S geranylgeranyl L glutathione is a ligand for
teine ligase is associated with proliferation in head and neck
human B cell confinement receptor P2RY, Nature, 567,
squamous cell carcinoma, Oncol. Lett., 11, 3660 3668,
244 248, doi: 10.1038/s41586 019 1003 z.
doi: 10.3892/ol.2016.4458.
36.
Ramsay, E. E., and Dilda, P. J. (2014) Glutathione S con
23.
Tatebe, S., Unate, H., Sinicrope, F. A., Sakatani, T.,
jugates as prodrugs to target drug resistant tumors, Front.
Sugamura, K., Makino, M., Ito, H., Savaraj, N., Kaibara, N.,
Pharmacol., 5, 181, doi: 10.3389/fphar.2014.00181.
and Kuo, M. T. (2002) Expression of heavy subunit of
37.
Lu, S. C., and Mato, J. M. (2012) S adenosylmethionine in
gamma glutamylcysteine synthetase (gamma GCSh) in
liver health, injury, and cancer, Physiol. Rev., 92, 1515
human colorectal carcinoma, Int. J. Cancer, 97, 21 27,
1542, doi: 10.1152/physrev.00047.2011.
doi: 10.1002/ijc.1574.
38.
Kredich, N. M. (2008) Biosynthesis of cysteine, EcoSal
24.
Li, M., Zhang, Z., Yuan, J., Zhang, Y., and Jin, X. (2014)
Plus., 3, 1 30, doi: 10.1128/ecosalplus.3.6.1.11.
Altered glutamate cysteine ligase expression and activity in
39.
Hakimi, A. A., Reznik, E., Lee, C. H., Creighton, C. J.,
renal cell carcinoma, Biomed. Rep.,
2,
831834,
Brannon, A. R., Luna, A., Aksoy, B. A., Liu, E. M., Shen, R.,
doi: 10.3892/br.2014.359.
and Lee, W. (2016) An integrated metabolic atlas of clear
25.
Syu, J. P., Chi, J. T., and Kung, H. N. (2016) Nrf2 is the key
cell renal cell carcinoma, Cancer Cell, 29, 104116,
to chemotherapy resistance in MCF7 breast cancer cells
doi: 10.1016/j.ccell.2015.12.004.
under hypoxia,
Oncotarget,
7,
1465914672,
40.
Shin, C. S., Mishra, P., Watrous, J. D., Carelli, V.,
doi: 10.18632/oncotarget.7406.
D’Aurelio, M., Jain, M., and Chan, D. C. (2017) The glu
26.
Njålsson, R., and Norgren, S. (2005) Physiological and
tamate/cystine xCT antiporter antagonizes glutamine
pathological aspects of GSH metabolism, Acta Paediatr.,
metabolism and reduces nutrient flexibility, Nat. Commun.,
94, 132 137, doi: 10.1111/j.1651 2227.2005.tb01878.x.
8, 5074, doi: 10.1038/ncomms15074.
27.
Njålsson, R., Carlsson, K., Winkler, A., Larsson, A., and
41.
Lo, M., Wang, Y. Z., and Gout, P. W. (2008) The x(c)( )
Norgren, S. (2003) Diagnostics in patients with glutathione
cystine/glutamate antiporter: a potential target for therapy
synthetase deficiency but without mutations in the exons of
of cancer and other diseases, J. Cell Physiol., 215, 593 602,
the GSS gene, Hum. Mutat., 22, 14659 14672, doi: 10.1002/
doi: 10.1002/jcp.21366.
humu.9199.
42.
Lewerenz, J., Hewett, S. J., Huang, Y., Lambros, M.,
28.
Li, X., Ding, Y., Liu, Y., Ma, Y., Song, J., Wang, Q., and
Gout, P. W., Kalivas, P. W., Massie, A., Smolders, I.,
Yang, Y. (2015) Five Chinese patients with 5 oxoprolinuria
Methner, A., Pergande, M., Smith, S. B., Ganapathy, V.,
due to glutathione synthetase and 5 oxoprolinase deficien
and Maher, P. (2013) The cystine/glutamate antiporter sys
cies, Brain Dev., 37, 952 959, doi: 10.1016/j.braindev.
tem x(c)( ) in health and disease: from molecular mecha
2015.03.005.
nisms to novel therapeutic opportunities, Antioxid. Redox
29.
Winkler, A., Njalsson, R., Carlsson, K., Elgadi, A., Rozell, B.,
Signal., 18, 522 555, doi: 10.1089/ars.2011.4391.
Abraham, L., Ersal, N., Shi, Z. Z., Lieberman, M. W.,
43.
Lim, J. K. M., Delaidelli, A., Minaker, S. W., Zhang, H. F.,
Larsson, A., and Norgren, S. (2011) Glutathione is essential
Colovic, M., Yang, H., Negri, G. L., von Karstedt, S.,
for early embryogenesis analysis of a glutathione synthetase
Lockwood, W. W., Schaffer, P., Leprivier, G., and
knockout mouse. Biochem. Biophys. Res. Commun., 412,
Sorensen, P. H. (2019) Cystine/glutamate antiporter xCT
121 126, doi: 10.1016/j.bbrc.2011.07.056.
(SLC7A11) facilitates oncogenic Russian Academy of
30.
Ke, H. L., Lin, J., Ye, Y., Wu, W. J., Lin, H. H., Wei, H.,
Sciences transformation by preserving intracellular redox
Huang, M., Chang, D. W., Dinney, C. P., and Wu, X.
balance, Proc. Natl. Acad. Sci. USA, 116, 9433 9442,
(2015) Genetic variations in glutathione pathway genes pre
doi: 10.1073/pnas.1821323116.
dict cancer recurrence in patients treated with transurethral
44.
Zhang, J., Pavlova, N. N., and Thompson, C. B. (2017)
resection and Bacillus Calmette-Guerin instillation for
Cancer cell metabolism: The essential role of the nonessen
non muscle invasive bladder cancer, Ann. Surg. Oncol., 22,
tial amino acid, glutamine, EMBO J., 36, 1302 1315,
4104 4110, doi: 10.1245/s10434 015 4431 5.
doi: 10.15252/embj.201696151.
31.
Strohkamp, S., Gemoll, T., Humborg, S., Hartwig, S.,
45.
Yang, L., Venneti, S., and Nagrath, D. (2017) Glutamino
Lehr, S., Freitag Wolf, S., Becker, S., Franzén, B.,
lysis: a hallmark of cancer metabolism, Annu. Rev. Biomed.
Pries, R., Wollenberg, B., Roblick, U. J., Bruch, H. P.,
Eng., 19, 163 194, doi: 10.1146/annurev bioeng 071516
Keck, T., Auer, G., and Habermann, J. K. (2018) Protein
044546.
levels of clusterin and glutathione synthetase in platelets
46.
Gao, P., Tchernyshyov, I., Chang, T. C., Lee, Y. S., Kita, K.,
allow for early detection of colorectal cancer, Cell. Mol. Life
Ochi, T., Zeller, K. I., De Marzo, A. M., Van Eyk, J. E.,
Sci., 75, 323 334, doi: 10.1007/s00018 017 2631 9.
Mendell, J. T., and Dang, C. V. (2009) cMyc suppression of
32.
Terzyan, S. S., Burgett, A. W. G., Heroux, A., Smith, C. A.,
miR 23a/b enhances mitochondrial glutaminase expression
Mooers, B. H., and Hanigan, M. H. (2015) Human γ glu
and glutamine metabolism, Nature,
458,
762765,
tamyl transpeptidase 1: structures of the free enzyme,
doi: 10.1038/nature07823.
inhibitor bound tetrahedral transition states, and gluta
47.
Altman, B. J., Stine, Z. E., and Dang, C. V. (2016) From
mate bound enzyme reveal novel movement within the
Krebs to clinic: Glutamine metabolism to cancer therapy,
active site during catalysis, J. Biol. Chem., 290, 17576
Nat. Rev. Cancer, 16, 619 634, doi: 10.1038/nrc.2016.71.
17586, doi: 10.1074/jbc.M115.659680.
48.
Locasale, J. W., Grassian, A. R., Melman, T., Lyssiotis, C. A.,
33.
Hofbauer, S. L., Stangl, K. I., de Martino, M., Lucca, I.,
Mattaini, K. R., Bass, A. J., Heffron, G., Metallo, C. M.,
Haitel, A., Shariat, S. F., and Klatte, T. (2014) Pretherapeu
Muranen, T., Sharfi, H., Sasaki, A. T., Anastasiou, D.,
tic gamma glutamyltransferase is an independent prognos
Mullarky, E., Vokes, N. I., Sasaki, M., Beroukhim, R.,
tic factor for patients with renal cell carcinoma, Br. J.
Stephanopoulos, G., Ligon, A. H., Meyerson, M.,
Cancer, 111, 1526 1531, doi: 10.1038/bjc.2014.450.
Richardson, A. L., Chin, L., Wagner, G., Asara, J. M.,
34.
Corti, A., Franzini, M., Paolicchi, A., and Pompella, A.
Brugge, J. S., Cantley, L. C., and Van der Heiden, M. G.
(2010) Gamma glutamyltransferase of cancer cells at the
(2011) Phosphoglycerate dehydrogenase diverts glycolytic
БИОХИМИЯ том 85 вып. 8 2020
СИНТЕЗ ГЛУТАТИОНА В ОПУХОЛЕВЫХ КЛЕТКАХ
1063
flux and contributes to oncogenesis, Nat. Genet., 43, 869
boxypeptidase D, DNA Cell Biol.,
35,
715721,
874, doi: 10.1038/ng.890.
doi: 10.1089/dna.2016.3398.
49.
Jain, M., Nilsson, R., Sharma, S., Madhusudhan, N.,
62.
Chandrasekaran, K. S., Sathyanarayanan, A., and
Kitami, T., Souza, A. L., Kafri, R., Kirschner, M. W.,
Karunagaran, D. (2016) MicroRNA suppresses growth,
Clish, C. B., and Mootha, V. K. (2012) Metabolite profiling
migration and invasion through a novel target, high mobili
identifies a key role for glycine in rapid cancer cell prolifer
ty group AT hook 1, in human cervical and colorectal can
ation, Science, 336, 10401044, doi: 10.1126/science.
cer cells, Br. J. Cancer, 115, 741751, doi: 10.1038/
1218595.
bjc.2016.234.
50.
Zhang, Z. Z., Lee, E. E., Sudderth, J., Yue, Y., Zia, A.,
63.
Das, F., Dey, N., Bera, A., Kasinath, B. S., Ghosh
Glass, D., Deberardinis, R. J., and Wang, R. C. (2016)
Choudhury, N., and Choudhury, G. G. (2016) MicroRNA
Glutathione depletion, pentose phosphate pathway activa
214 reduces insulin like growth factor 1 (IGF 1) receptor
tion, and hemolysis in erythrocytes protecting cancer cells
expression and downstream mTORC1 signaling in renal
from vitamin C induced oxidative stress, J. Biol. Chem.,
carcinoma cells, J. Biol. Chem.,
291,
1466214676,
291, 22861 22867, doi: 10.1074/jbc.C116.748848.
doi: 10.1074/jbc.M115.694331.
51.
Li, B., Qiu, B., Lee, D. S. M., Walton, Z. E., Ochocki, J. D.,
64.
Xia, S. S., Zhang, G. J., Liu, Z. L., Tian, H. P., He, Y.,
Mathew, L. K., Mancuso, A., Gade, T. P., Keith, B.,
Meng, C. Y., Li, L. F., Wang, Z. W., and Zhou, T. (2017)
Nissim, I., and Simon, M. C. (2014) Fructose 1,6 bispho
MicroRNA 22 suppresses the growth, migration and inva
sphatase opposes renal carcinoma progression, Nature, 513,
sion of colorectal cancer cells through a Sp1 negative feed
251 255, doi: 10.1038/nature13557.
back loop, Oncotarget, 8, 36266 36278, doi: 10.18632/
52.
Anderton, B., Camarda, R., Balakrishnan, S.,
oncotarget.16742.
Balakrishnan, A., Kohnz, R. A., Lim, L., Evason, K. J.,
65.
Dhar, S., Kumar, A., Gomez, C. R., Akhtar, I., Hancock, J. C.,
Momcilovic, O., Kruttwig, K., Huang, Q., Xu, G.,
Lage, J. M., Pound, C. R., and Levenson, A. S. (2017)
Nomura, D. K., and Goga, A. (2017) MYC driven inhibi
MTA1 activated EpimicroRNA 22 regulates E cadherin
tion of the glutamate cysteine ligase promotes glutathione
and prostate cancer invasiveness, FEBS Lett., 591, 924 933,
depletion in liver cancer, EMBO Rep., 18, 569585,
doi: 10.1002/1873 3468.12603.
doi: 10.15252/embr.201643068.
66.
Fan, D., Lin, X., Zhang, F., Zhong, W., Hu, J., Chen, Y.,
53.
Hsu, T. I., Hsu, C. H., Lee, K. H., Lin, J. T., Chen, C. S.,
Cai, Z., Zou, Y., He, X., Chen, X., Lan, P., and Wu, X.
Chang, K. C., Su, C. Y., Hsiao, M., and Lu, P. J. (2014)
(2018) MicroRNA
26b promotes colorectal cancer
MicroRNA 18a is elevated in prostate cancer and promotes
metastasis by downregulating phosphatase and tensin
tumorigenesis through suppressing STK4 in vitro and in
homolog and wingless type MMTV integration site fami
vivo, Oncogenesis, 3, 99, doi: 10.1038/oncsis.2014.12.
ly member 5A, Cancer Sci., 109, 354 362, doi: 10.1111/
54.
Liu, Z., Wang, J., Li, Y., Fan, J., Chen, L., and Xu, R.
cas.13451.
(2017) MicroRNA 153 regulates glutamine metabolism in
67.
Zhang, B., Li, Y., Hou, D., Shi, Q., Yang, S., and Li, Q.
glioblastoma through targeting glutaminase, Tumour Biol.,
(2017) MicroRNA 375 inhibits growth and enhances
39, 1010428317691429, doi: 10.1177/1010428317691429.
radiosensitivity in oral squamous cell carcinoma by target
55.
Espinosa Diez, C., Fierro Fernández, M., Sánchez
ing insulin like growth factor 1 receptor, Cell Physiol.
Gómez, F., Rodr guez Pascual, F., Alique, M., Ruiz
Biochem., 42, 2105 2117, doi: 10.1159/000479913.
Ortega, M., Beraza, N., Mart nez Chantar, M. L.,
68.
Drayton, R. M., Dudziec, E., Peter, S., Bertz, S.,
Fernández Hernando, C., and Lamas, S. (2015) Targeting
Hartmann, A., Bryant, H. E., and Catto, J. W. (2014)
of gamma glutamyl cysteine ligase by miR 433 reduces
Reduced expression of miRNA 27a modulates cisplatin
glutathione biosynthesis and promotes TGF b dependent
resistance in bladder cancer by targeting the cystine/gluta
fibrogenesis, Antioxid. Redox Signal., 23, 10921105,
mate exchanger SLC7A11, Clin. Cancer Res., 20, 1990
doi: 10.1089/ars.2014.6025.
2000, doi: 10.1158/1078 0432.CCR 13 2805.
56.
Liang, T., Guo, Q., Li, L., Cheng, Y., Ren, C., and Zhang, G.
69.
D’Arcy, M. S. (2019) Cell death: a review of the major forms
(2016) MicroRNA 433 inhibits migration and invasion of
of apoptosis, necrosis and autophagy, Cell Biol. Int., 43,
ovarian cancer cells via targeting Notch1, Neoplasma, 63,
582 592, doi: 10.1002/cbin.11137.
696 704, doi: 10.4149/neo_2016_506.
70.
Franco, R., and Cidlowski, J. A. (2009) Apoptosis and glu
57.
Li, H., Li, J., Yang, T., Lin, S., and Li, H.
(2018)
tathione: beyond an antioxidant, Cell Death Differ., 16,
MicroRNA 433 represses proliferation and invasion of
1303 1314, doi: 10.1038/cdd.2009.107.
colon cancer cells by targeting homeobox A1, Oncol. Res.,
71.
Nishizawa, S., Araki, H., Ishikawa, Y., Kitazawa, S., Hata, A.,
26, 315 322, doi: 10.3727/096504017X15067856789781.
Soga, T., and Hara, T. (2018) Low tumor glutathione level
58.
Tak, H., Kang, H., Ji, E., Hong, Y., Kim, W., and Lee, E. K.
as a sensitivity marker for glutamate cysteine ligase
(2018) Potential use of TIA 1, MFF, microRNA 200a 3p,
inhibitors, Oncol. Lett., 15, 87358743, doi: 10.3892/
and microRNA 27 as a novel marker for hepatocellular car
ol.2018.8447.
cinoma, Biochem. Biophys. Res. Commun., 497, 1117 1122,
72.
Villablanca, J. G., Volchenboum, S. L., Cho, H., Kang, M. H.,
doi: 10.1016/j.bbrc.2018.02.189.
Cohn, S. L., Anderson, C. P., Marachelian, A., Groshen, S.,
59.
Tili, E., Michaille, J. J., Luo, Z., Volinia, S., Rassenti, L. Z.,
Tsao Wei, D., Matthay, K. K., Maris, J. M., Hasenauer, C. E.,
Kipps, T. J., and Croce, C. M. (2012) The down regulation
Czarnecki, S., Lai, H., Goodarzian, F., Shimada, H., and
of miR 125b in chronic lymphocytic leukemias leads to
Reynolds, C. P. (2016) A phase I new approaches to neu
metabolic adaptation of cells to a transformed state, Blood,
roblastoma therapy study of buthionine sulfoximine and
120, 2631 2638, doi: 10.1182/blood 2012 03 415737.
melphalan with autologous stem cells for recurrent/refrac
60.
Wang, F., Li, L., Chen, Z., Zhu, M., and Gu, Y. (2016)
tory high risk neuroblastoma, Pediatr. Blood Cancer, 63,
MicroRNA 214 acts as oncogene in breast cancer by target
1349 1356, doi: 10.1002/pbc.25994.
ing the PTENPI3K/Akt signaling pathway, Int. J. Mol.
73.
Tagde, A., Singh, H., Kang, M. H., and Reynolds, C. P.
Med., 37, 1421 1428, doi: 10.3892/ijmm.2016.2518.
(2014) The glutathione synthesis inhibitor buthionine sul
61.
Zhao, X., Lu, C., Chu, W., Zhang, Y., Zhang, B., Zeng, Q.,
foximine synergistically enhanced melphalan activity
Wang, R., Li, Z., Lv, B., and Liu, J. (2016) MicroRNA 214
against preclinical models of multiple myeloma, Blood
governs lung cancer growth and metastasis by targeting car
Cancer J., 4, 229, doi: 10.1038/bcj.2014.45.
БИОХИМИЯ том 85 вып. 8 2020
1064
КАЛИНИНА, ГАВРИЛЮК
74.
Kittiratphatthana, N., Kukongviriyapan, V., Prawan, A.,
87. Shibata, Y., Yasui, H., Higashikawa, K., Miyamoto, N.,
and Senggunprai, L. (2016) Luteolin induces cholangiocar
and Kuge, Y. (2019) Erastin, a ferroptosis inducing agent,
cinoma cell apoptosis through the mitochondrial depen
sensitized cancer cells to X ray irradiation via glutathione
dent pathway mediated by reactive oxygen species, J.
starvation in vitro and in vivo, PLoS One, 14, 0225931,
Pharm. Pharmacol., 68, 1184 1192, doi: 10.1111/jphp.
doi: 10.1371/journal.pone.0225931.
12586.
88. Louandre, C., Marcq, I., Bouhlal, H., Lachaier, E.,
75.
Liu, Y., Liu, T., Lei, T., Zhang, D., Du, S., Girani, L., Qi, D.,
Godin, C., Saidak, Z., Francois, C., Chatelain, D.,
Lin, C., Tong, R., and Wang Y. (2019) RIP1/RIP3 regulat
Debuysscher, V., Barbare, J. C., Chauffert, B., and
ed necroptosis as a target for multifaceted disease therapy
Galmiche, A. (2015) The retinoblastoma (Rb) protein reg
(review), Int. J. Mol. Med., 44, 771 786, doi: 10.3892/
ulates ferroptosis induced by sorafenib in human hepato
ijmm.2019.4244.
cellular carcinoma cells, Cancer Lett., 35, 971977,
76.
Schwarzer, R., Laurien, L., and Pasparakis, M. (2020) New
doi: 10.1016/j.canlet.2014.11.014.
insights into the regulation of apoptosis, necroptosis, and
89. Cao, S. S., and Kaufman, R. J. (2014) Endoplasmic retic
pyroptosis by receptor interacting protein kinase 1 and cas
ulum stress and oxidative stress in cell fate decision and
pase 8, Curr. Opin. Cell Biol., 63, 186 193, doi: 10.1016/
human disease, Antioxid. Redox Signal., 21, 396 413,
j.ceb.2020.02.004.
doi: 10.1089/ars.2014.5851.
77.
Xie, X., Zhao, Y., Ma, C. Y., Xu, X. M., Zhang, Y. Q.,
90. Guo, J., Xu, B., Han, Q., Zhou, H., Xia, Y., Gong, C.,
Wang, C. G., Jin, J., Shen, X., Gao, J. L., Li, N., Sun, Z. J.,
Dai, X., Li, Z., and Wu, G. (2018) Ferroptosis: a novel
and Dong, D. L. (2015) Dimethyl fumarate induces
anti tumor action for cisplatin, Cancer Res. Treat., 50,
necroptosis in colon cancer cells through GSH deple
445 460, doi: 10.4143/crt.2016.572.
tion/ROS increase/MAPKs activation pathway, Br. J.
91. Dikic, I., Johansen, T., and Kirkin, V. (2010) Selective
Pharmacol., 172, 3929 3943, doi: 10.1111/bph.13184.
autophagy in cancer development and therapy, Cancer
78.
Zheng, W., Zhou, C. Y., Zhu, X. Q., Wang, X. J., Li, Z. Y.,
Res., 70, 3431 3434, doi: 10.1158/0008 5472.CAN 09
Chen, X. C., Chen, F., Che, X. Y., and Xie, X. (2018)
4027.
Oridonin enhances the cytotoxicity of 5 FU in renal carci
92. Mancilla, H., Maldonado, R., Cereceda, K., Villarroel
noma cells by inducting necroptotic death, Biomed.
Espindola, F., De Oca, M. M., Angulo, C., Castro, M. A.,
Pharmacother.,
106,
175182, doi:
10.1016/j.biopha.
Slebe, J. C., Vera, J. C., Lavandero, S., and Concha, I. I.
2018.06.111.
(2015) Glutathione depletion induces spermatogonial cell
79.
Chauhan, A. K., Min, K. J., and Kwon, T. K. (2017) RIP1
autophagy, J. Cell. Biochem.,
116,
22832292,
dependent reactive oxygen species production executes
doi: 10.1002/jcb.25178.
artesunate induced cell death in renal carcinoma Caki cells,
93. Guo, W., Zhao, Y., Zhang, Z., Tan, N., Zhao, F., Ge, C.,
Mol. Cell. Biochem., 435, 15 24, doi: 10.1007/s11010 017
Liang, L., Jia, D., Chen, T., Yao, M., Li, J., and He, X.
3052 7.
(2011) Disruption of xCT inhibits cell growth via the
80.
Chen, M. S., Wang, S. F., Hsu, C. Y., Yin, P. H., Yeh, T. S.,
ROS/autophagy pathway in hepatocellular carcinoma,
Lee, H. C., and Tseng, L. M. (2017) CHAC1 degradation of
Cancer Lett.,
312,
5561, doi:
10.1016/j.can
glutathione enhances cystine starvation induced necropto
let.2011.07.024.
sis and ferroptosis in human triple negative breast cancer
94. Desideri, E., Filomeni, G., and Ciriolo, M. R. (2012)
cells via the GCN2 eIF2α ATF4 pathway, Oncotarget, 8,
Glutathione participates in the modulation of starvation
114588 114602, doi: 10.18632/oncotarget.23055.
induced autophagy in carcinoma cells, Autophagy, 8, 1769
81.
Lei, P., Bai, T., and Sun, Y. (2019) Mechanisms of ferropto
1781, doi: 10.4161/auto.22037.
sis and relations with regulated cell death. (Review), Front
95. Du, J., Wang, T., Li, Y., Zhou, Y., Wang, X., Yu, X.,
Physiol., 10, 139, doi: 10.3389/fphys.2019.00139.
Ren, X., An, Y., Wu, Y., Sun, W., Fan, W., Zhu, Q.,
82.
Ursini, F., and Maiorino, M. (2020) Lipid peroxidation and
Wang, Y., and Tong, X. (2019) DHA inhibits proliferation
ferroptosis: the role of GSH and GPx4 (review), Free Radic.
and induces ferroptosis of leukemia cells through autophagy
Biol. Med., 152, 175185, doi: 10.1016/j.freeradbio
dependent degradation of ferritin, Free Radic. Biol. Med.,
med.2020.02.027.
131, 356 369, doi: 10.1016/j.freeradbiomed.2018.12.011.
83.
Miess, H., Dankworth, B., Gouw, A. M., Rosenfeldt, M.,
96. Wu, Z., Geng, Y., Lu, X., Shi, Y., Wu, G., Zhang, M.,
Schmitz, W., Jiang, M., Saunders, B., Howell, M.,
Shan, B., Pan, H., and Yuan, J. (2019) Chaperone medi
Downward, J., Felsher, D. W., Peck, B., and Schulze, A.
ated autophagy is involved in the execution of ferroptosis,
(2018) The glutathione redox system is essential to prevent
Proc. Natl. Acad. Sci. USA,
116,
29963005,
ferroptosis caused by impaired lipid metabolism in clear cell
doi: 10.1073/pnas.1819728116.
renal cell carcinoma, Oncogene,
37,
54355450,
97. Hou, W., Xie, Y., Song, X., Sun, X., Lotze, M. T., Zeh, H. J.,
doi: 10.1038/s41388 018 0315 z.
Kang, R., and Tang, D. (2016) Autophagy promotes fer
84.
Seibt, T. M., Proneth, B., and Conrad, M. (2019) Role of
roptosis by degradation of ferritin, Autophagy, 12, 1425
GPX4 in ferroptosis and its pharmacological implication,
1428, doi: 10.1080/15548627.2016.1187366.
Free Radic. Biol. Med., 133, 144 152, doi: 10.1016/j.freer
98. Gao, M., Monian, P., Pan, Q., Zhang, W., Xiang, J., and
adbiomed.2018.09.014.
Jiang, X. (2016) Ferroptosis is an autophagic cell death
85.
Larraufie, M. H., Yang, W. S., Jiang, E., Thomas, A. G.,
process, Cell Res., 26, 1021 1032, doi: 10.1038/cr.2016.95.
Slusher, B. S., and Stockwell, B. R. (2015) Incorporation of
99. Santana Codina, N., and Mancias, J. D. (2018) The role
metabolically stable ketones into a small molecule probe to
of NCOA4 mediated ferritinophagy in health and disease,
increase potency and water solubility, Bioorg. Med. Chem.
Pharmaceuticals, 11, 114 129, doi: 10.3390/ph11040114.
Lett., 25, 4787 4792, doi: 10.1016/j.bmcl.2015.07.018.
100. Lv, H. H., Zhen, C. X., Liu, J. Y., and Shang, P. (2020)
86.
Han, C., Liu, Y., Dai, R., Ismail, N., Su, W., Li, B. (2020)
PEITC triggers multiple forms of cell death by GSH iron
Ferroptosis and its potential role in human diseases, Front.
ROS regulation in K7M2 murine osteosarcoma cells, Acta
Pharmacol., 11, 239, doi: 10.3389/fphar.2020.00239.
Pharmacol. Sin., doi: 10.1038/s41401 020 0376 8.
БИОХИМИЯ том 85 вып. 8 2020
СИНТЕЗ ГЛУТАТИОНА В ОПУХОЛЕВЫХ КЛЕТКАХ
1065
GLUTATHIONE SYNTHESIS IN CANCER CELLS
Review
E. V. Kalinina* and L. A. Gavriliuk
Peoples’s Friendship University of Russia (RUDN University), 117198 Moscow, Russia; E#mail: kalinina#ev@rudn.ru
Received May 23, 2020
Revised June 20, 2020
Accepted June 20, 2020
Tripeptide GSH is associated not only with the control and maintenance of redox cell homeostasis, but also with the
processes of detoxification, proliferation, cell differentiation, and regulation of cell death. Disruptions in GSH syn
thesis and changes in the GSH/GSSG ratio are common for many pathological conditions, including malignant neo
plasms. Numerous data indicate the importance of GSH and the GSH/GSSG ratio in the regulation of tumor cell
viability, in the initiation of tumor development, progression, and drug resistance. However, control of the mechanism
of GSH synthesis in malignant tumors remains poorly understood. This review discusses the features of GSH synthe
sis and its regulation in tumor cells. The role of GSH in the mechanisms of apoptosis, necroptosis, ferroptosis, and
autophagy is considered.
Keywords: synthesis of GSH de novo, microRNA, apoptosis, necroptosis, ferroptosis, autophagy
6 БИОХИМИЯ том 85 вып. 8 2020