БИОХИМИЯ, 2020, том 85, вып. 9, с. 1139 - 1158
УДК 612.822;577.1
ЭПИГЕНЕТИЧЕСКАЯ РЕГУЛЯЦИЯ КАК ОСНОВА
ДОЛГОВРЕМЕННЫХ ИЗМЕНЕНИЙ В НЕРВНОЙ СИСТЕМЕ:
В ПОИСКАХ МЕХАНИЗМОВ СПЕЦИФИЧНОСТИ*
Обзор
© 2020
А.А. Бородинова**, П.М. Балабан
Институт высшей нервной деятельности и нейрофизиологии РАН,
117485 Москва, Россия; электронная почта: borodinova.msu@mail.ru
Поступила в редакцию 01.06.2020
После доработки 16.07.2020
Принята к публикации 29.07.2020
Долговременные адаптивные изменения функционирования нервной системы (пластичность, память) пря
мо связаны с изменением уровней экспрессии многих генов, но не отражаются в структуре ДНК, то есть яв
ляются проявлением эпигенетической регуляции. Суммируя известные данные о роли эпигенетических
процессов и путей регуляции и хранения изменений в нервной системе, можно выделить несколько ключе
вых моментов. (1) Разнообразные факторы, управляющие структурной перестройкой хроматина и ДНК ме
тилтрансферазы в составе сложных мультибелковых репрессорных комплексов, координированно и коопе
ративно функционируют в качестве «молекулярных тормозов» («molecular brake pad»), избирательно сохра
няя низкий уровень экспрессии только некоторых генов в условиях покоя. (2) В ответ на значимые физио
логические стимулы в активированных нейронах запускается каскад биохимических событий, сопряжен
ных с транспортом различных активаторных молекул (протеинкиназы, NO содержащие комплексы) в яд
ро. (3) Стимул специфичное нитрозилирование и фосфорилирование отдельных эпигенетических факто
ров сопряжено со снижением их ферментативной активности или изменением внутриклеточной локализа
ции, что выражается во временной дестабилизации репрессорных комплексов. (4) Снятие «молекулярных
тормозов» открывает «критическое окно» для глобальных и локальных эпигенетических перестроек, запус
ка специфических транскрипционных программ и модуляции эффективности синаптических связей. Мож
но считать, что обратимые посттрансляционные модификации гистонов служат основой для пластических
изменений в функциональных сетях нейронов. С другой стороны, метилирование ДНК и метил зависимые
способы трехмерной организации хроматина могут служить стабильной молекулярной основой для долго
временного хранения пластических изменений и памяти.
КЛЮЧЕВЫЕ СЛОВА: память, обучение, эпигенетика, экспрессия генов, гистондеацетилаза, метилирова
ние ДНК, оксид азота.
DOI: 10.31857/S0320972520090018
ВВЕДЕНИЕ
логий памяти. За последние годы накопилось
много данных о том, что долговременные изме
Исследованию механизмов памяти посвя
нения в нервной системе, в том числе и память,
щено огромное количество работ, однако до сих
ассоциированы с изменением экспрессии опре
пор нет единого мнения о молекулярных меха
деленных групп генов [1, 2]. Одной из сущест
низмах формирования и долговременного хра
венных проблем является понимание того, как
нения памятного следа, а также эффективных
решается вопрос специфического контроля от
способов изменения памяти, коррекции пато
дельных групп генов в определенные моменты
времени в определенных функциональных сетях
Принятые сокращения: HDAC - гистондеацетила
нейронов при обучении и какие механизмы сто
за; HAT - гистонацетилтрансфераза; DNMT - ДНК метил
ят за поддержанием этих изменений. Поскольку
трансфераза; PK - протеинкиназа; PP - протеинфосфата
долговременная память является приобретен
за; H3K(n) - n й лизин третьего гистона; NO - оксид азо
ным свойством любого организма и не отража
та.
ется в структуре генома, но является следствием
* Статья на английском языке опубликована в режиме
длительного изменения уровней экспрессии оп
Open Access (открытого доступа) на сайте издательства
ределенных генов, она по определению являет
вып. 9, 2020.
ся эпигенетически регулируемым феноменом
** Адресат для корреспонденции.
[2, 3]. В экспериментах in vitro и in vivo было по
1139
1140
БОРОДИНОВА, БАЛАБАН
казано, что механизмы пластичности и памяти
В литературе последних лет накопилось мно
тесно сопряжены с эпигенетическими пере
го данных о балансе гистонацетилтрансфераз
стройками, контролирующими доступность оп
(HAT) и гистондеацетилаз (HDAC), изменения
ределенных участков генов для различных регу
которого нарушают/улучшают пластичность,
ляторных молекул [4-6]. В рамках данного об
память и процессы обучения у взрослых живот
зора мы попытаемся разобраться в некоторых
ных [5]. Нарушение этого баланса не только из
составляющих специфического контроля экс
меняет эффективность обучения, но и является
прессии генов на молекулярном и клеточном
коррелятом многих нейропатологий. Примене
уровне и обсудим роль эпигенетики в этих про
ние ингибиторов, меняющих эпигенетический
цессах.
баланс, может быть основой терапии патологий
[9]. Широкое распространение получило инги
бирование HDAC с целью изменения когнитив
ПОВЕДЕНИЕ И ЭПИГЕНЕТИКА:
ных способностей животных, в том числе дол
ЕСТЬ ЛИ СПЕЦИФИКА?
говременной памяти [5, 9]. Положительное вли
яние ингибиторов HDAC на формирование и
Анализируя зависимость изменений поведе
восстановление синаптической пластичности и
ния (в том числе и долговременные измене
памяти было показано не только на млекопита
ния - память) от любых молекулярных процес
ющих, но и на дрозофилах [10] и цыплятах [11].
сов, чрезвычайно важно понять, насколько спе
На моллюсках была продемонстрирована воз
цифична взаимосвязь исследуемых явлений.
можность улучшения обстановочной памяти и
Нет никаких сомнений в том, что изменения
восстановления нарушенной памяти введением
практически в любых молекулярных или нейро
ингибитора HDAC - бутирата натрия. Сущест
химических процессах отразятся в активности
венным в этом исследовании является демон
нейронов и в поведении, поэтому стандартный
страция того, что ингибитор HDAC не изменяет
подход с избирательной блокадой какой либо
величину поведенческой реакции в обычных ус
молекулярной системы и анализом изменений
ловиях, но избирательно действует на величину
поведения говорит лишь о том, что данная сис
реакции у этого же животного только в условиях
тема активна в мозге.
(обстановке) обучения, то есть усиливает па
Необходимость синтеза нового белка (транс
мять, не меняя поведения в нормальных услови
ляции) и синтеза РНК для долговременных из
ях [12]. В сравнительном исследовании роли гис
менений поведения (формирования памяти)
тондеацетилаз HDAC1 и HDAC2 у мышей было
показана сравнительно давно на брюхоногом
показано, что усиление экспрессии HDAC2, но
моллюске Aplysia [7]. На этом же моллюске
не HDAC1 приводит к уменьшению плотности
впервые было продемонстрировано, что извест
синапсов, ухудшению синаптической пластич
ный стимулятор пластических процессов, серо
ности и формирования памяти, причем эти яв
тонин, индуцирует сборку активаторных комп
ления можно было снять применением ингиби
лексов транскрипционного фактора CREB1 c
торов HDAC [13]. Заметим, что большинство ин
гистонацетилтрансферазой CBP и вызывает
гибиторов HDAC не являются специфичными, и
ацетилирование гистонов в промоторе гена
в этом смысле получаемые результаты неодно
пластичности C/EBP, которое коррелирует с
значны, учитывая разную роль HDAC1 и
уровнем его экспрессии [8]. С другой стороны,
HDAC2. В этом плане интересна работа Morris et
конкурирующий с серотонином тормозный ме
al., в которой использовали нокаутных мышей и
диатор нейропептидной природы FMRFa облег
отдельно оценивали роль HDAC1 и HDAC2 [14].
чает связывание транскрипционного фактора
В этой работе показано, что у нокаутных по
CREB2 с промотором гена и стимулирует деаце
HDAC2 мышей ускорено угасание условной обо
тилирование гистонов за счет привлечения гис
ронительной памяти и условной аверзии к пище,
тондеацетилаз HDAC5. В электрофизиологи
причем задачи на внимание эти животные вы
ческих экспериментах на идентифицированных
полняли лучше контрольных. У этих мышей не
сенсорных нейронах было экспериментально
было отмечено ухудшения моторного обучения
показано, что серотонин вызывает усиление си
и эпизодической памяти, что прямо указывает
наптических ответов, а FMRFa - депрессию
на специфичность участия HDAC2 в разных по
этих же ответов. Учитывая известную роль этих
веденческих задачах. Авторы делают вывод о
нейронов в поведении, можно считать эту рабо
том, что торможение активности HDAC2 улуч
ту одной из первых, в которых показана роль
шает ассоциативные процессы, не влияя на не
посттрансляционных модификаций гистонов в
ассоциативные [14].
регуляции синаптической пластичности, отра
Существенно отметить, что изменения плот
жающейся на поведении животного [8].
ности упаковки хроматина большей частью об
БИОХИМИЯ том 85 вып. 9 2020
ЭПИГЕНЕТИЧЕСКАЯ РЕГУЛЯЦИЯ ПЛАСТИЧНОСТИ МОЗГА
1141
ратимы и только «снимают тормоза», открывая
анализировать профиль экспрессии генов для
возможность для долговременных изменений
двух ключевых для обстановочной оборонитель
экспрессии генов [2]. С другой стороны, дли
ной памяти областей мозга (зона СА1 гиппо
тельное хранение информации в нервных клет
кампа и передняя поясная извилина неокортек
ках может быть связано с другими эпигенетичес
са), разных клеточных типов (нейроны, глия) и
кими процессами, протекающими на уровне
трех временных точек до и после формирования
ДНК. В пионерских работах 70-80 х годов
обстановочной памяти у мышей [3]. Авторам
прошлого века были продемонстрированы инте
удалось обнаружить, что паттерн изменений ме
ресные данные, отмечающие сопряженность
тилирования ДНК хорошо коррелирует с изве
пластических процессов в нервной системе и ме
стными данными о пространственной локализа
тилирования ДНК. В работах Ванюшина и соавт.
ции памяти, были отмечены стабильные и дина
было описано изменение метилирования ДНК в
мические изменения в нейронах. Заметим, что
функционально активных областях мозга крыс,
метилирование гистонов наблюдалось и в ней
которое авторы рассматривали в качестве одного
ронах, и в глиальных клетках и было скорее гло
из механизмов запуска транскрипции генов при
бальным с небольшим количеством локальных
обучении [15, 16]. Уже в 1976 году разделение
изменений.
фракций ядер нейронов и глиальных клеток с
Считается, что посттрансляционные изме
помощью ультрацентрифугирования позволило
нения хроматина в основном связаны с фазой
определить, что «при выработке условного реф
консолидации памяти [22, 23], что проявилось и
лекса физиологические процессы в первую оче
в том, что метилирование гистонов не коррели
редь отражаются на геноме более лабильных,
ровало с дифференциальной экспрессией генов
быстро реагирующих клеток нейронов и, воз
во время хранения памяти [3]. Изменения мети
можно, сопряжены с вовлечением в работу не
лирования ДНК в этой работе наблюдали как в
ких специфических участков ДНК» [16]. Позд
фазу консолидации, так и в период хранения па
нее Holliday [17] было высказано предположение
мяти. В литературе рассматривается также и
о том, что одним из механизмов долговременно
роль метилирования ДНК в качестве механизма
го хранения памяти в нейроне является метили
стабилизации активности нервной сети (энг
рование ДНК. Было предположено, что нейро
раммы) во время консолидации, что служит ос
ны нервной сети (энграммы) конкретного вида
новой для успешного воспроизведения/хране
памяти в ответ на специфические стимулы могут
ния памяти [24].
изменить состояние метилирования некоторых
Таким образом, можно предположить, что
сайтов ДНК, и это состояние будет храниться
обратимые посттрансляционные модификации
долго, так как, по некоторым данным, в случае
гистонов служат основой для пластических из
повреждения ДНК бывшие метилированными
менений в функциональных сетях нейронов [2].
восстановленные цитозины опять подвергаются
С другой стороны, метилирование ДНК изме
метилированию, поддерживая общий паттерн
няет экспрессию генов на длительный срок (по
метилирования ДНК [18]. Учитывая количество
жизненно), и поскольку нейроны взрослых жи
сайтов метилирования и количество нейронов,
вотных не делятся, может служить стабильной
информационная емкость такого хранения па
молекулярной основой для хранения пластичес
мяти очень высока. Holliday рассматривал также
ких изменений и памяти.
и модификации гистонов как возможный эпиге
нетический механизм, но считал, что из за отсу
тствия ковалентных связей гистонов с ДНК ста
ПРОСТРАНСТВЕННО)ВРЕМЕННЫЕ
бильность этих изменений будет существенно
ЭПИГЕНЕТИЧЕСКИЕ ПЕРЕСТРОЙКИ
меньше, чем метилирование цитозина в ДНК.
В ФУНКЦИОНАЛЬНЫХ СЕТЯХ НЕЙРОНОВ
Позднее эти предсказания получили экспери
ментальные подтверждения в многочисленных
Формирование и поддержание следа памяти
работах на млекопитающих и беспозвоночных
зависит от координированной и тонко настраи
[3, 18-20]. Учитывая, что метилирование ДНК
ваемой работы различных групп эпигенетичес
обычно связано с уменьшением активности ге
ких регуляторов в определенных отделах мозга и
на, наличие гиперметилирования после обуче
при разных парадигмах обучения. Стимул зави
ния должно свидетельствовать о постоянном по
симые изменения эпигенетического ландшафта в
давлении активности определенных групп генов.
специфических функциональных сетях нейро
Эта идея получила подтверждение в исследова
нов или регионах мозга, по сути, отражают харак
ниях на млекопитающих и моллюсках [19, 21].
тер и продолжительность регуляции транскрип
В одной из работ удалось провести деталь
ционных процессов, иными словами, «критичес
ный полногеномный анализ хроматина и про
кое окно» для пластических изменений.
БИОХИМИЯ том 85 вып. 9 2020
1142
БОРОДИНОВА, БАЛАБАН
Регион)специфичные эпигенетические пере)
Было показано, что во время обучения меж
стройки. На сегодняшний день подавляющее
ду клетками подкорковых структур (гиппокамп,
число сведений о динамике эпигенетических
миндалина) и кортикальными нейронами опре
изменений (посттрансляционные модификации
деленным образом изменяются функциональ
гистонов, метилирование ДНК) при обучении
ные связи, объединяющие затронутые нейроны
или извлечении памяти получено в ходе анализа
в энграмму [29]. Входы от гиппокампа, энтори
различных областей мозга (подкорковые струк
нальной коры и миндалины обеспечивают опре
туры и участки коры) [3, 20, 22, 25-28]. Показа
деленный уровень сетевой активности, который
но, что эпигенетические изменения в регуля
влияет на установление и «созревание» актив
торных областях отдельных генов пластичности
ности нейросети в корковых отделах [23, 29].
коррелируют с уровнем их экспрессии [3, 20, 22,
Направленное подавление активности любого
25-28]. Гетерогенность анализируемых образ
из этих входов (химически или оптогенетичес
цов может осложнить интерпретацию данных.
ки) при обучении приводит к последующим на
Согласно современным представлениям, след
рушениям длительного хранения памяти
памяти может быть «закодирован» в специфи
(remote memory).
ческих функциональных сетях (энграммах) оп
По нашим предположениям, сигналы, при
ределенных областей мозга в процессе обуче
ходящие из подкорковых структур, способны
ния, поэтому вполне логичным и интересным
запускать в кортикальных нейронах эпигенети
продолжением этого направления будет изуче
ческие изменения, которые могут быть частью
ние молекулярных механизмов, лежащих в ос
процесса «созревания памяти» в сетях неокор
нове энграмм специфичной консолидации и
текса. В качестве подтверждения этого предпо
реконсолидации (повторной консолидации при
ложения интересно рассмотреть работу, в кото
реактивации) памяти.
рой с помощью протокола высокочастотной
Как оказалось, регион специфичные перест
стимуляции индуцировали долговременные
ройки хроматина и метилирование ДНК корре
пластические изменения в медиальной пре
лируют с вовлеченностью соответствующих
фронтальной коре крыс in vivo и наблюдали от
структур мозга или даже определенных энграмм
ставленное и продолжительное (часы) увеличе
в формирование и поддержание недавней и от
ние активности ключевых эпигенетических ре
ставленной памяти [3, 25]. Первоначальная кон
гуляторов (HAT, DNMT), приводящее к тоталь
солидация памяти в сети нейронов гиппокампа
ным перестройкам хроматина [27]. Выборочная
(недавняя память, recent memory; часы-дни)
проверка выявила эпигенетические изменения в
[29] сопровождается быстрым, но обратимым
промоторных областях некоторых генов плас
увеличением представленности некоторых пост
тичности (Bdnf, Reln), сопряженные с увеличе
трансляционных модификаций гистонов (аце
нием их транскрипции и трансляции. Продукты
тилирование, метилирование, фосфорилирова
этих генов могут участвовать в изменении
ние) и гидроксиметилирования ДНК [23, 25, 28].
структурных характеристик и эффективности
Впоследствии происходит постепенное сниже
связей между нейронами [30, 31]. В другой рабо
ние вклада сетей гиппокампа в воспроизведение
те быстрое, но обратимое увеличение ацетили
памяти по мере увеличения роли сетей коры [29].
рования гистонов наблюдали в орбитофрон
Функциональные сети участков коры, связан
тальной коре животных после обучения [23]. С
ные с длительным хранением и воспроизведени
течением времени у этих животных было отме
ем памяти (отставленная память, remote memory;
чено увеличение количества синаптических ши
дни-недели), устанавливаются сразу при обуче
пиков. Оказалось, что инъекции ингибиторов
нии, но вклад этих энграмм в воспроизведение
гистондеацетилаз на ранней стадии после обу
памяти нарастает со временем по мере их «созре
чения не только продлевают ацетилированное
вания» (морфологического и функционального)
состояние гистонов, но стимулируют образова
[23, 29]. Немногочисленные исследования вре
ние шипиков и улучшают отставленную память
менных характеристик эпигенетических перест
животных, чего не наблюдается при более позд
роек в корковых отделах содержат противоречи
нем введении веществ [23]. При исследовании
вые данные, не позволяющие сделать однознач
молекулярных механизмов, стоящих за увеличе
ного вывода. По некоторым данным, эпигенети
нием ацетилирования гистонов в орбитофрон
ческие перестройки хроматина в префронталь
тальной коре в ответ на обучение, была обнару
ной коре появляются с задержкой (24 часа), но
жена связь с активацией MAPK/ERK1/MSK1
сохраняются в неизменном виде по меньшей ме
сигнального каскада. Блокирование активности
ре в течение недели [25]. Согласно другой рабо
этих киназ сопровождается исчезновением эпи
те, в орбитофронтальной коре эпигенетические
генетических и морфологических перестроек в
изменения носят обратимый характер [23].
коре и нарушением отставленной памяти [23].
БИОХИМИЯ том 85 вып. 9 2020
ЭПИГЕНЕТИЧЕСКАЯ РЕГУЛЯЦИЯ ПЛАСТИЧНОСТИ МОЗГА
1143
Сопряженность эпигенетических перестроек в
ной «перестройке» гиппокамп кортикальных и
разных регионах мозга. При исследовании регу
кортико кортикальных связей.
ляции эффективности обучения и памяти ак
тивно применяется стратегия направленного
изменения ацетилирования или метилирования
СПЕЦИФИЧНОСТЬ ЭПИГЕНЕТИЧЕСКОЙ
гистонов и метилирования ДНК в различных
РЕГУЛЯЦИИ ГЕНОВ ПЛАСТИЧНОСТИ
регионах мозга [4, 6]. Из отдельных работ следу
ет довольно интересный вывод: направленное
Своевременное и выверенное изменение
изменение эпигенетического ландшафта в од
экспрессии генов, в том числе изменение тран
ной структуре мозга может коррелировать с пе
скрипции генов синаптической пластичности
рестройками хроматина и изменением экспрес
(plasticity transcriptome), в ответ на изменения в
сии генов в другой структуре и отражается на
синаптической активности нейронов основано
эффективности связей между регионами моз
на сложном взаимодействии между эпигенети
га/элементами энграммы [26, 32]. В частности,
ческими модификациями гистонов, вовлечении
изменение эпигенетического профиля в энто
регуляторных белков, изменении уровня мети
ринальной коре обученных животных (сниже
лирования ДНК. В мозге взрослых животных
ние репрессорных меток H3K9me2, рост актив
ландшафт экспрессии генов подвержен измене
ных меток H3K9ac, H3K4me3), вызванное ло
ниям в зависимости от активности нейронов и
кальным введением ингибитора гистонметил
поведенческого опыта (отражающего нейрон
трансфераз G9a/GLP, сопровождается неожи
ную активность). Эти изменения критичны для
данным увеличением представленности репрес
адаптивных изменений поведения, включая
сорных меток H3K9me2 в зоне CA1 гиппокампа
асоциативную долговременную память [20, 33,
[26]. Эпигенетические манипуляции в энтори
34]. Изменения синаптической эффективности
нальной коре - одной из главных узловых точек
и уровня возбудимости мембраны клетки влия
для обмена информацией между гиппокам
ют на характер связей между нейронами, регу
пом/корой и миндалиной/корой - затрагивают
лируют общий уровень активности нервной се
промоторные области некоторых генов плас
ти и являются триггером модуляции транскрип
тичности (DNMT3a, Egr1, Bdnf) и приводят к
ции определенных групп генов, экспрессия ко
улучшению контекстной (гиппокамп зависи
торых зависит от клеточной активности. В лите
мой) и ключевой (миндалина зависимой) памя
ратуре различают гены раннего и позднего отве
ти, возможно, за счет изменения эффективнос
та [35, 36]. Эти наборы генов различаются по не
ти связей энторинальной коры с другими струк
обходимости синтеза новых белков и скорости
турами [26]. Наоборот, ингибирование G9a/
индукции изменений экспрессии. Недавно бы
GLP в гиппокампе животных при обучении со
ло экспериментально показано, что разные пат
провождается ростом числа активных меток
терны клеточной активности индуцируют отли
H3K4me3 в энторинальной коре [26]. По дан
чающиеся программы экспрессии генов. В зави
ным литературы, изменение активности минда
симости от длительности стимула наблюдается
лины тоже сопряжено с модуляцией молекуляр
градуальное увеличение вовлеченности генов,
ных каскадов в структурах, связанных с ней
принадлежащих к группам генов раннего (пер
функционально. В частности, введение ингиби
вичного) и позднего (вторичного) ответа [37].
тора HDAC в базолатеральное ядро миндалины
Непродолжительная стимуляция кортикальных
сопровождается увеличением количества белка
нейронов в культуре или нейронов зрительной
BDNF в дорзальном гиппокампе обученных жи
коры in vivo достаточна для активации экспрес
вотных [32]. Приведенные данные свидетель
сии небольшой группы генов раннего ответа с
ствуют, что динамические эпигенетические пе
очень быстрой кинетикой (немедленные ранние
рестройки хроматина в одних структурах мозга
гены). Существенно, что первая волна тран
могут влиять на молекулярные характеристики в
скрипции не зависит от de novo синтеза белков.
других структурах, возможно, за счет изменения
Некоторые из этих генов первой волны активи
активности этих структур и характера взаимо
руются в ответ на широкий набор внешних сти
действия между ними.
мулов и, по всей видимости, являются необхо
Таким образом, изменение эпигенетическо
димым и универсальным, но неспецифичным
го ландшафта на ранних стадиях после обуче
звеном клеточного ответа. Авторы показали, что
ния, по видимому, критически необходимо для
при увеличении длительности стимуляции за
«перенастройки» сети для длительного хране
первой волной транскрипции следуют вторая и
ния следа памяти, а искусственно вызванные
третья волны транскрипции, затрагивающие ге
эпигенетические перестройки хроматина способ
ны раннего ответа с медленной кинетикой и ге
ствуют еще более эффективной функциональ
ны позднего ответа соответственно [37]. Гены
БИОХИМИЯ том 85 вып. 9 2020
1144
БОРОДИНОВА, БАЛАБАН
позднего ответа изменяют экспрессию с боль
ции пластичности, во время формирования дол
шой задержкой, для изменений им необходим
говременных изменений и не подверженных из
синтез новых белков, их экспрессия регулирует
менениям во время хранения памяти. Сущест
ся белковыми продуктами генов раннего ответа
венным и интересным в этой работе является
[35, 36].
четкая формулировка роли эпигенетической ре
В очень интересной работе на культуре кор
гуляции в процессе формирования и хранения
тикальных нейронов мыши анализировалась
памяти - возможность изменений в норме бло
стабильность спонтанной активности нейронов
кирована эпигенетически, а снятие эпигенети
[38]. Проверялось предположение о том, что для
ческого «тормоза» открывает на некоторое вре
поддержания постоянного уровня активности
мя возможность пластических изменений
(гомеостаза активности нейрона) необходимо
экспрессии генов, тогда как при хранении уже
участие активность зависимой транскрипции,
сформированной памяти возможность долго
однако гомеостаз наблюдался и в нейронах с по
временных изменений опять заблокирована.
давленной активностью гена пластичности Arc,
Рассматривая механизмы хранения и регуля
отсутствием активность зависимых транскрип
ции памяти в нервной сети, мы неизбежно при
ционных факторов AP1 and SRF. Авторы делают
ходим к противопоставлению изменений в от
вывод о том, что активность регулируемая тран
дельном синапсе и в ядре нейрона. В последнем
скрипция не является необходимой для посто
случае изменения коснутся всех синапсов дан
янно поддерживаемой активности нейрона [38].
ного нейрона. Эпигенетические механизмы ре
Интересная гипотеза о связи между синап
гуляции формирования и хранения памяти ско
тическими и эпигенетическими механизмами
рее относятся ко второму способу, так как изме
хранения памяти высказана в работе Kyrke
нения уровня экспрессии любого гена в случае
Smith и Williams [2]. Опираясь на идею о том, что
синтеза белкового продукта гена в теле клетки
изменения синаптической эффективности при
должны одинаково отразиться во всех синапсах
обучении образуют поддерживаемые на сетевом
данной клетки. Известны и уникальные исклю
уровне долговременные изменения работы
чения из этого правила, когда в синапс идет
нервной сети (энграмма памяти), авторы пред
мРНК и трансляция происходит прямо в синап
ложили путь создания и хранения энграмм па
се. Это установлено для двух важнейших генов,
мяти. Суть гипотезы заключается в том, что
участие продуктов которых в формировании
предлагается выделить «транскриптом пластич
(Arc) и хранении (PKMζ) памяти многократно
ности» (plasticity transcriptome), который лежит
показаны [39, 40].
в основе структурных и функциональных моди
По всей видимости, базовые принципы фор
фикаций синаптических связей в сети во время
мирования и хранения памяти должны быть до
обучения и несколько часов после обучения
вольно консервативными, поскольку одни и те
(время консолидации памяти). В это время мак
же регуляторные молекулы присутствуют в ряду
симально активны гены, продукты которых свя
от улиток и дрозофил до человека. Ввиду высо
заны с пластичностью (CREB, Egr1, AP1, Arc,
кой консервативности гистоновых белков в ряду
BDNF), и этот период заканчивается активаци
организмов от самых простейших беспозвоноч
ей репрессоров активности генов (гистондеаце
ных до человека, эпигенетические модифика
тилаз), переходя к работе «транскриптома хра
ции хроматина могут осуществляться по общим
нения памяти» [2]. По сути, авторы выделяют
законам у отдаленных групп организмов, из за
специфическую для формирования и хранения
чего их можно рассматривать как уникальный
памяти роль ацетилирования гистонов в отдель
высокоэффективный способ долговременной
ный механизм метапластичности, регулирую
регуляции работы нервных клеток и основу для
щий хранение энграммы памяти. Очень важным
кодирования памяти.
для нашего анализа является выделение «Разре
шающего (пластичность) эпигенетического сос
тояния» (Permissive epigenetic state), которое сов
ГИПОТЕЗА «МОЛЕКУЛЯРНЫХ ТОРМОЗОВ»
падает с периодом индукции долговременных
И СПОСОБЫ СТИМУЛ)СПЕЦИФИЧНОЙ
изменений функционирования нервных сетей
РЕГУЛЯЦИИ АКТИВНОСТИ ГЕНОВ
(консолидация, реконсолидация). Можно ска
зать, что это эпигенетическое «состояние» отк
Почти 10 лет назад была высказана гипотеза,
рывает окно возможностей для долговременных
согласно которой в качестве «молекулярных
изменений. Специфичность эпигенетической
тормозов» (molecular brake pad) экспрессии спе
регуляции авторами гипотезы имплицитно под
цифических генов рассматривают комплексы
разумевается специфичным набором генов, из
HDAC с различными ко репрессорами (см. да
меняющих уровень экспрессии во время индук
лее) [41]. Временное снятие этих «молекуляр
БИОХИМИЯ том 85 вып. 9 2020
ЭПИГЕНЕТИЧЕСКАЯ РЕГУЛЯЦИЯ ПЛАСТИЧНОСТИ МОЗГА
1145
ных тормозов» для активации экспрессии генов
рессорных комплексов (Sin3A, NuRD, CoREST
может происходить только в ответ на достаточно
для HDAC1/HDAC2, и NCoR/SMRT для
сильные физиологические стимулы [41]. Дан
HDAC3) (рис. 1, а), которые, по всей видимос
ный обзор не ставит целью описание всех воз
ти, направляют гистондеацетилазы в определен
можных биохимических механизмов, необходи
ные локусы/участки хроматина для осуществле
мых для временного снятия «молекулярных тор
ния контроля транскрипции специфических ге
мозов» в функциональных сетях нейронов при
нов [13, 41, 42, 45, 55, 56].
физиологических нагрузках, однако далее мы
С помощью метода иммунопреципитации
остановимся на некоторых наиболее значимых
хроматина (ChIP) в образцах мозга мышей было
и специфичных, по нашему мнению.
проанализировано распределение HDAC1 и
Устройство репрессорных комплексов. Ассо
HDAC2 в промоторных областях ряда генов,
циированные с хроматином репрессорные
часть которых не связана с синаптической плас
комплексы представляют собой сложно устро
тичностью (Atf4, Pgk1, Gapdh и др.), а белковые
енные мультибелковые кластеры, центральной
продукты других считаются специфическими
частью которых, по всей видимости, являются
регуляторами морфологии (NrxnI, Shank3,
гистондеацетилазы класса I (HDAC I) [42]. В ли
Synapsin2, PSD95 и др.), синаптической плас
тературе описаны взаимодействия между HDAC
тичности (GluR1/2, CamKIIa, Creb, Cbp, PKMζ
I и другими гистондеацетилазами (класс HDAC
и др.) или регулируются клеточной активностью
II), некоторыми гистонметилтрансферазами
(BDNF, Egr 1, c Fos, Arc и др.) [13]. Оказалось,
(SUV39H1), гистондеметилазами (JMJD2A и
что в норме HDAC2 с высокой избиратель
LSD1), ДНК метилтрансферазами (DNMT3a,
ностью (в сравнении с HDAC1) связываются с
DNMT3b, DNMT1) и фосфатазами (PP1) (рис.
промоторными областями большинства пере
1, а) [42-52]. Находящиеся в комплексах эпиге
численных специфических генов [13]. Анализ
нетические агенты могут работать кооператив
ядерных экстрактов на предмет взаимодействия
но. Результатом координированной работы раз
HDAC1/2 с репрессорными комплексами Sin3A,
личных комбинаций эпигенетических агентов
NuRD и CoREST показал, что только HDAC2
будут комплексные сайт специфичные эпиге
связывается с комплексом ремоделинга хрома
нетические перестройки (рис. 1, а), создающие
тина CoREST. По всей видимости, взаимодей
«молекулярные тормоза» для отдельных генов
ствие HDAC2 в составе репрессорных комплек
мишеней [6, 46, 49]. Потенциально, взаимодей
сов CoREST с промоторными участками неко
ствие разного набора эпигенетических агентов с
торых генов пластичности сдерживает их экс
молекулами, распознающими специфические
прессию в покое. При нарушении продукции
сайты на хроматине, открывает возможности
HDAC2 у нокаутных животных наблюдается се
для более тонкой и эффективной регуляции
лективное увеличение уровня ацетилирования
транскрипции специфических генов мишеней.
гистонов в промоторных областях некоторых ге
Гистондеацетилазы класса I (HDAC I). Из ли
нов пластичности, которое не может быть ском
тературы хорошо известно, что представители
пенсировано нативной HDAC1. Необходимо от
HDAC I (HDAC1, 2, 3) являются важным эле
метить, что описанный механизм едва ли явля
ментом механизмов пластичности и памяти [13,
ется единственным, и HDAC в составе других
41]. В экспериментах in vitro и in vivo было на
корепрессорных комплексов могут принимать
глядно продемонстрировано, что в покое HDAC
участие в тонкой модуляции работы отдельных
в составе репрессорных комплексов связаны с
генов пластичности. Будучи частью NCoR/
промоторными областями некоторых генов и
SMRT репрессорного комплекса, HDAC3 спе
подавляют их транскрипцию [13, 53-55]. Одна
цифически связывается регуляторными областя
ко первый же вопрос, с которым сталкиваются
ми некоторых генов пластичности (Bdnf, Npas4,
исследователи, заключается в том, каким обра
но не Fos), при этом в целом по геному большая
зом достигается специфическая эпигенетичес
часть сайтов связывания HDAC3 приходится на
кая регуляция отдельных генов пластичности
межгенные и внутригенные участки [55].
при отсутствии субстратной специфичности
По некоторым данным, взаимодействие
гистондеацетилаз. Исчерпывающего ответа на
представителей HDAC I с другими эпигенети
этот вопрос нет. Основная информация о харак
ческими агентами (см. далее), в частности с гис
теристиках HDAC была получена в ходе работы
тонметилтрансферазой SUV39H1, обеспечивает
с не нейрональными клеточными линиями. На
доставку репрессорных комплексов в участки
основании имеющихся литературных данных,
хроматина для подавления транскрипции от
HDAC не связываются с последовательностью
дельных генов [46]. Это объясняет наблюдения о
ДНК напрямую, но являются центральной, ка
том, что процессы деацетилирования и метили
талитически активной частью различных реп
рования гистонов зачастую сопряжены [6].
БИОХИМИЯ том 85 вып. 9 2020
1146
БОРОДИНОВА, БАЛАБАН
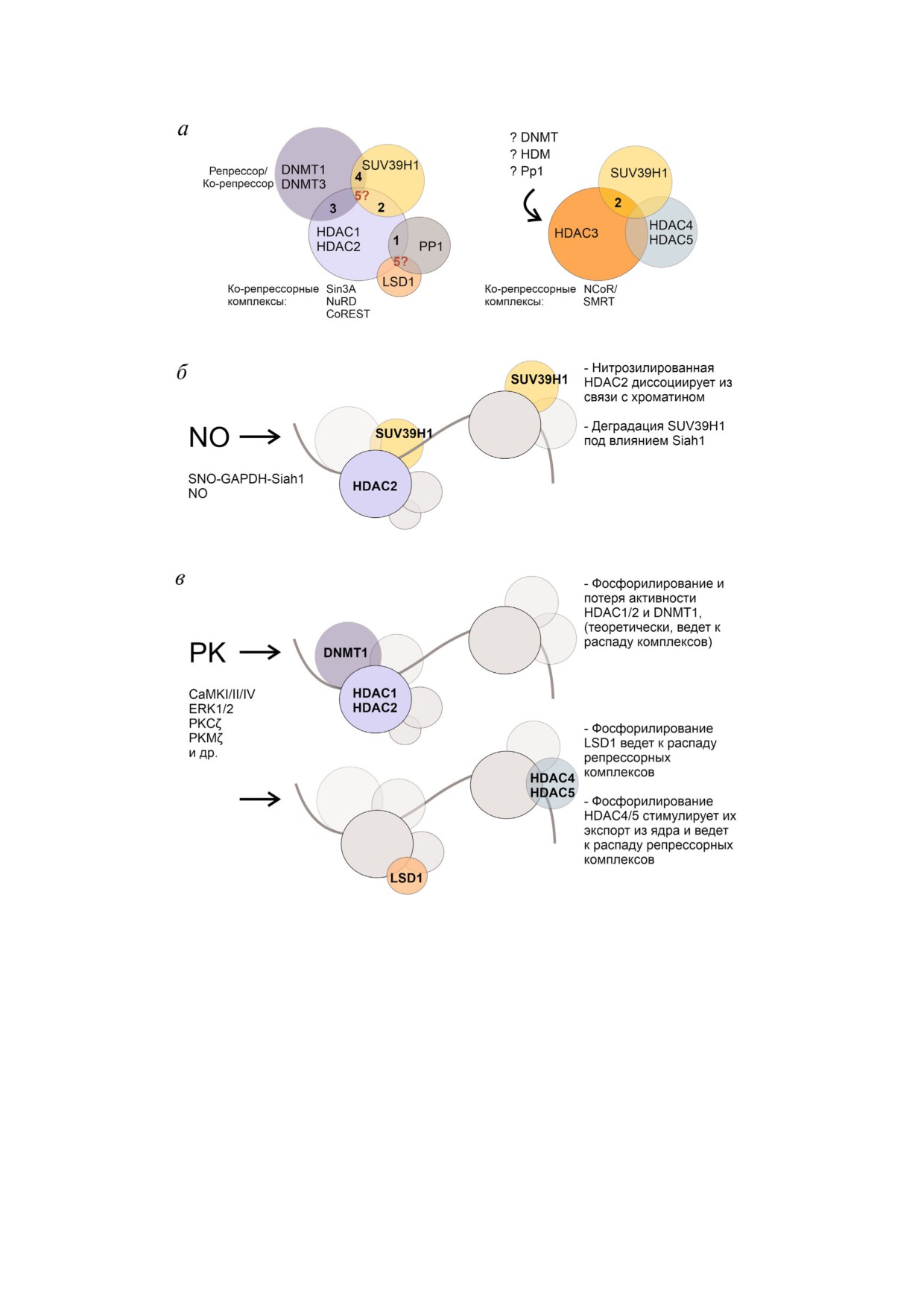
Организация репрессорных комплексов и способы регуляции их связи с хроматином (по данным, представленным в об
зоре). а - Схематичное изображение возможных комбинаций репрессорных (HDAC, DNMT) и ко репрессорных белков
разных классов в составе мультибелковых репрессорных комплексов. Возможность белок белкового взаимодействия
между представителями гистондеацетилаз (HDAC), ДНК метилтрансфераз (DNMT), протеинфосфатаз (PP), гистондеме
тилаз (HDM, LSD1) и гистонметилтрансфераз (SUV39H1) изображена в виде пересекающихся сфер. Цифрами обозначе
ны возможные комбинации эпигенетических перестроек как результат координированной работы репрессорных белков
(по данным литературы: 1 - деацетилирование и дефосфорилирование гистонов; 2 - деацетилирование и метилирование
гистонов; 3 - деацетилирование гистонов и метилирование ДНК; 4 - метилирование гистонов и ДНК; 5 - возможные бо
лее сложные комбинации). б и в - Регуляция функций компонентов репрессорных комплексов посредством оксида азо
та (NO) или протеинкиназ (PK). Активация нейронов в результате пластических изменений сопровождается перемеще
нием PK и новосинтезированных молекул NO в ядро, в результате чего компоненты репрессорных комплексов подверга
ются соответствующим модификациям (фосфорилирование, нитрозилирование), которые влияют на их стабильность,
активность или внутриклеточную локализацию. Временная дестабилизация и диссоциация мультибелковых репрессор
ных комплексов из связи с хроматином открывает «окно возможностей» для изменения эпигенетического профиля и ак
тивации определенных групп генов пластичности. (С цветным вариантом рисунка можно ознакомиться в электронной
БИОХИМИЯ том 85 вып. 9 2020
ЭПИГЕНЕТИЧЕСКАЯ РЕГУЛЯЦИЯ ПЛАСТИЧНОСТИ МОЗГА
1147
Гистондеацетилазы класса IIa (HDAC IIa).
правило нарушалось для потенциальных клеток
При рассмотрении механизмов пластичности,
энграммы, где авторы регистрировали очень
эффективности обучения и хранения памяти от
слабое перекрытие между Fos положительными
дельный интерес представляют некоторые
клетками (маркер нейронов энграммы) и ядер
представители гистондеацетилаз класса HDAC
но локализованной HDAC4. Было показано,
IIa (HDAC4, HDAC5), которые участвуют в ре
что нарушение продукции HDAC4/5 продлевает
гуляции транскрипционных программ, связан
экспрессию некоторых немедленных ранних ге
ных со структурными изменениями синапсов и
нов (до 5 часов), увеличивает количество Fos и
эффективностью синаптических связей [57-59].
Egr1 положительных клеток (примерно в 1,5-2
Особенностью представителей HDAC IIa яв
раза) и сопровождается когнитивными наруше
ляется способность перемещаться между цито
ниями в серии поведенческих тестов. С учетом
плазмой и ядром в зависимости от степени их
других данных, полученных авторами, актив
фосфорилирования, что неизбежно отражается
ность HDAC4/5, фактически, ограничивает
на возможности HDAC IIa взаимодействовать с
«размер» энграммы (количество нейронов, под
компонентами репрессорных комплексов и
вергающихся морфо функциональным измене
обеспечивает дополнительный уровень прост
ниям в ответ на внешние стимулы) посредством
ранственно временного контроля экспрессии
пространственно временного контроля тран
генов (см. далее) [51]. В спонтанно активных
скрипции генов в нейронах.
культурах нейронов гистондеацетилазы HDAC
Транспортируемые в ядро дефосфорилиро
IIa распределены между цитоплазматическим
ванные HDAC IIa не могут связываться с хрома
(HDAC4) и ядерным компартментами (HDAC5)
тином напрямую, специфическое взаимодей
[60, 61]. Физиологическая стимуляция нейро
ствие их N концевого фрагмента с транскрип
нов и увеличение концентрации внутриклеточ
ционными факторами и C концевого участка с
ного кальция являются факторами, стимулиру
ко репрессорами обеспечивает привлечение
ющими фосфорилирование HDAC IIa (см. да
сложных мультибелковых комплексов в опреде
лее) и их экспорт из ядра в цитоплазму [60]. По
ленные области хроматина [44, 51, 56, 58, 63, 64].
давление нейрональной активности или приме
Репрессорные функции низкоактивных по сво
нение специфических кальций связывающих
ей природе HDAC IIa (HDAC4/5) во многом за
агентов, наоборот, стимулирует перемещение
висят от избирательного взаимодействия с фер
HDAC IIa в ядро [58, 60, 61]. Было продемон
ментативно активными представителями HDAC
стрировано, что смещение равновесия в сторону
I (HDAC3) в составе мультибелковых комплек
избыточного содержания HDAC IIa в ядре (при
сов NCoR/SMRT (рис. 1, а) [44, 51, 56, 64].
оверэкспрессии устойчивой к фосфорилирова
Возникает вопрос о том, какова функция ма
нию мутантной изоформы) сопровождается
лоактивных представителей HDAC IIa в актив
стимул зависимым подавлением транскрипции
ных репрессорных комплексах? В одной из ра
целого ряда генов пластичности (Homer1, Arc,
бот было показано, что потеря каталитического
Npas4, Nr4a1, Egr2 и т.д.) [59, 61].
домена HDAC4 не сказывается на ее функциях в
По некоторым данным, ядерно цитоплазма
мозге, связанных с регуляцией транскрипции
тические транслокации HDAC4/5 могут играть
генов пластичности [58]. Полученные данные
существенную роль при формировании энграмм
позволяют предполагать, что каталитически ма
и кодировании памяти (memory encoding) [59]. В
лоактивные представители HDAC IIa могут слу
норме размер энграммы фиксирован и процесс
жить специфической платформой для привле
вовлечения (allocation) клеток в ограниченную
чения других репрессорных белков. По некото
функциональную сеть сопровождается опреде
рым данным, связывание HDAC IIa (и ассоци
ленным отбором нейронов по меньшей мере на
ированных с ними транскрипционных факто
основании характеристик их возбудимости на
ров) с предсуществующими каталитически ак
момент обучения [62]. Возможно, уровень воз
тивными HDAC3 NCoR/SMRT комплексами
будимости нейронов влияет на распределение
обеспечивает дополнительный уровень специ
HDAC4/5 между ядром и цитоплазмой и опре
фичности при таргетировании образованных
деляет, какие клетки более эффективно будут
репрессорных комплексов в промоторные об
вовлекаться в функциональную сеть. Это пред
ласти генов [44]. Было обнаружено, что предста
положение находит подтверждение в работе Zhu
вители HDAC IIa (HDAC4/5) могут взаимодей
et al. [59], где с помощью иммуногистохимичес
ствовать с белком гетерохроматина HP1, кото
кого анализа было исследовано распределение
рый распознает и связывается с метилирован
HDAC4 в ядрах нейронов после обучения. Было
ным H3K9 сайтом на хроматине, а кроме того,
продемонстрировано общее увеличение содер
привлекает гистонметилтрансферазу SUV39H1
жания HDAC4 в ядрах нейронов, однако это
[63]. Ко локализация HDAC IIa с SUV39H1 в
БИОХИМИЯ том 85 вып. 9 2020
1148
БОРОДИНОВА, БАЛАБАН
мультибелковых комплексах (рис. 1, а), а также
47]. Вдобавок к этому, применение неспецифи
приведенные выше данные о взаимодействии
ческих блокаторов HDAC оказывается доста
HDAC IIa/HDAC I и SUV39H1/HDAC I могут
точным для диссоциации DNMT/HDAC реп
объяснять функциональную связанность про
рессорных комплексов из промоторных облас
цессов деацетилирования и метилирования гис
тей и активации транскрипции соответствую
тонов кооперативным действием упомянутых
щих генов мишеней [43, 49]. Было показано,
репрессорных комплексов или даже существо
что снятие «молекулярных тормозов» в промо
ванием репрессорных комплексов более высо
торных участках генов мишеней сопровождает
кого порядка [6, 44, 46, 56, 63].
ся снижением метилирования ДНК и ростом
ДНК метилтрансферазы (DNMT). Отдель
ацетилирования гистонов [49].
ную и довольно значительную роль в механизмах
Из анализа литературы не прослеживается
пластичности и памяти отводят представителям
причинно следственная связь DNMT-HDAC
семейства ДНК метилтрансфераз (DNMT), от
взаимодействия. С одной стороны, метилирова
ветственным за поддержание существующего
ние ДНК в определенных локусах может слу
статуса метилирования участков ДНК (DNMT1)
жить сигналом для привлечения HDAC ассоци
и создание новых метильных меток (DNMT3a,
ированных репрессорных комплексов и конден
DNMT3b) [21, 24, 52, 65]. По литературным дан
сации хроматина, в результате чего соответству
ным, пластические процессы в нервной системе
ющие гены «фиксируются» в репрессированном
сопряжены со смещением существующего ба
состоянии. С другой стороны, присутствие
ланса в сторону метилирования ДНК в промо
HDAC/HMT содержащих комплексов ремоде
торах генов супрессоров памяти (фосфатазы
лирования хроматина может обеспечить опреде
Ppp1cc, Ppp3ca), параллельно с которым проис
ленный эпигенетический ландшафт в участках
ходит быстрое деметилирование в промоторах
хроматина, облегчающий узнавание различны
генов пластичности (Reln) [21, 65].
ми ДНК метилтрансферазами, создание меток
С учетом данных о сравнительно низкой из
метилирования ДНК и подавление транскрип
бирательности DNMT возникает вопрос о том,
ционной активности генов. Так или иначе, ин
каким образом в определенных последователь
дукция комплексных эпигенетических пере
ностях ДНК генов может быть сгенерирован
строек за счет координированной работы
специфический паттерн метилирования. При
HDAC/HMT/DNMT содержащих комплексов
влечение DNMT в определенные локусы может
потенциально может обеспечить эффективный
происходить с учетом локального эпигенетичес
контроль транскрипции соответствующих ге
кого ландшафта, поскольку появление меток
нов мишеней: предположительно, подавление
метилирования гистонов в участках неактивно
работы отдельных генов - негативных регулято
го хроматина зачастую предшествует метилиро
ров памяти и активацию некоторых генов плас
ванию ДНК [66]. Было показано, что в N конце
тичности.
вом фрагменте de)novo метилтрансфераз
Нитрозилирование как инструмент снятия
(DNMT3) содержатся домены, распознающие
«молекулярных тормозов». Оксид азота (NO) мо
репрессорные гистоновые метки [52, 67]. Кроме
жет выступать в качестве модулятора эпигенети
того, привлечение DNMT в соответствующие
ческого ландшафта в различных клетках [69].
участки хроматина может происходить опосре
Несмотря на имеющиеся данные об участии NO
дованно, за счет взаимодействия с гистонметил
в реализации механизмов памяти у позвоноч
трансферазами (SUV39H1, рис. 1, а) и другими
ных и беспозвоночных животных, рассмотрение
регуляторными молекулами [49, 66-68].
NO зависимой долговременной пластичности в
Для осуществления эффективного контроля
аспекте эпигенетической регуляции генов не
транскрипции генов в N концевых фрагментах
получило большого резонанса [70, 71]. Согласно
молекул DNMT располагаются сайты взаимо
немногим данным, физиологическая стимуля
действия с гистондеацетилазами (HDAC1/2)
ция клеток и увеличение уровня внутриклеточ
[43, 47, 49, 52]. ДНК метилтрансферазы могут
ного кальция приводят к активации нейрональ
кооперироваться друг с другом и с HDAC1 (рис.
ной NO синтазы (nNOS) и продукции NO, ко
1, а), формируя мультибелковые репрессорные
торая сопровождается S нитрозилированием
комплексы в промоторных областях отдельных
белковых мишеней, NO зависимыми пере
генов [49]. Отдельные данные указывают на то,
стройками хроматина и активацией экспрессии
что HDAC играют центральную роль в таких
генов пластичности (см. далее).
комплексах, поскольку ко репрессорные функ
Вопреки распространенному мнению о том,
ции представителей семейства DNMT3 могут
что эффекты NO не имеют специфики, с по
быть реализованы независимо от функциональ
мощью протеомного анализа в ядерных
ной целостности каталитического домена [43,
экстрактах кортикальных нейронов среди 3078
БИОХИМИЯ том 85 вып. 9 2020
ЭПИГЕНЕТИЧЕСКАЯ РЕГУЛЯЦИЯ ПЛАСТИЧНОСТИ МОЗГА
1149
белков было идентифицировано всего 614 по
плексов с хроматином (рис. 1, б) [71]. Любопыт
тенциальных белковых мишеней для NO зави
но, что продолжительность нитрозилирования
симого S нитрозилирования [72]. В списке ми
HDAC2 коррелирует с критическим временным
шеней для нитрозилирования оказались неко
окном реконсолидации памяти (около 6 часов)
торые гистондеацетилазы (HDAC1/2), субъеди
[71], свидетельствуя в пользу высказанной ранее
ницы корепрессорных комплексов (Sin3a,
гипотезы о функционировании HDAC в качест
NuRD), протеинфосфатазы (PP1, PP2A), тран
ве «молекулярных тормозов» при пластических
скрипционные факторы (CREB, YY1) и другие
изменениях в нервной системе [41]. Дополни
ядерные белки, участвующие в реорганизации
тельные эксперименты дают основание считать,
структуры хроматина и регуляции транскрип
что извлечение недавней памяти сопряжено с
ции [53, 54, 72, 73]. При анализе нитрозилиро
временной лабилизацией памяти, отчасти обус
ванных фрагментов белковых мишеней метода
ловленной NO зависимым S нитрозилировани
ми жидкостной хроматографии и масс спектро
ем HDAC2, увеличением ацетилирования гисто
метрии (liquid chromatography-tandem mass
нов и индукции транскрипции генов пластич
spectrometry) авторы идентифицировали уни
ности [71]. Полученные результаты согласуются
кальные мотивы - сайты нитрозилирования
с другими работами о роли NO в лабилизации
[72]. За редким исключением, мы не располага
памяти при реконсолидации [70].
ем данными о том, как нитрозилирование ска
Сравнение динамики молекулярных про
зывается на функциях белковых мишеней в фи
цессов в гиппокампе мышей при исследовании
зиологических условиях. По всей видимости,
недавней и отставленной памяти выявило на
нитрозилирование может быть как дестабили
личие NO зависимой регуляции эпигенетичес
зирующим фактором (в случае репрессорных
кого ландшафта в первом случае и отсутствие
комплексов с HDAC2), так и стабилизатором
регуляции - во втором [71]. По всей видимости,
некоторых белковых комплексов (в случае
наблюдаемые различия связаны с изменением
комплексов GAPDH Siah1) (см. далее).
вовлеченности сетей гиппокампа в обеспечение
В in vitro экспериментах было показано, что
недавней и отставленной памяти [29]. Мы не
физиологические стимулы (Ca2+, BDNF,
исключаем, что при исследовании отставлен
NMDA, KCl) вызывают в нейронах и не нейро
ной памяти в активных энграммах префрон
нальных клетках продукцию NO, сопряженную
тальной коры могут быть найдены молекуляр
с S нитрозилированием ряда белковых мише
ные изменения, аналогичные описанным в
ней (HDAC2, CREB, рис. 1, б) [54, 72, 73]. Нит
гиппокампе.
розилирование HDAC2 по определенным сай
Существование ядерной функции NO в фи
там в консервативном каталитическом домене
зиологических условиях может восприниматься
не влияет на активность фермента, но, видимо
с долей скептицизма, учитывая сведения об уда
за счет конформационных перестроек, приво
ленной от ядра локализации nNOS, нестабиль
дит к высвобождению HDAC2 из комплексов с
ности продуцируемых молекул NO (время жиз
хроматином в промоторах некоторых генов
ни всего несколько секунд) и, как следствие, не
пластичности (Fos, Egr1, Vgf, Nos1) и создает ус
доступности ядерных белков для S нитрозили
ловия для связывания активаторов транскрип
рования. Однако, с помощью NO связывающей
ции [54]. Было показано, что под влиянием NO
флуоресцентной метки в активированных ней
происходит нитрозилирование транскрипцион
ронах было показано быстрое накопление NO в
ного фактора CREB в С концевом ДНК связы
цитоплазме и ядре [54]. Возможность аккумуля
вающем домене [72] и его привлечение в промо
ции NO в ядре была описана в другой работе,
торные области генов мишеней [53]. В результа
посвященной исследованию белок белкового
те стимул зависимое связывание HAT CBP с
транснитрозилирования как механизма избира
CREB приводит к росту ацетилирования гисто
тельного «перебрасывания» NO групп на неко
нов и инициации транскрипции CREB зависи
торые ядерные белки [73]. Авторы обнаружили,
мых генов [53, 54].
что цитоплазматические белки GAPDH подвер
Аналогичные данные были получены in vivo
гаются нитрозилированию (SNO GAPDH) и в
в ходе поведенческих экспериментов. При ис
этой форме транспортируются в ядро в комп
следовании реактивации недавней памяти у мы
лексах с белками Siah1, имеющими сигналы
шей авторы обнаружили увеличение представ
ядерной локализации (рис. 1, б). Было экспери
ленности меток ацетилированных гистонов в
ментально доказано, что SNO GAPDH служат
CA1 области гиппокампа, и в частности в про
физиологическими источниками NO групп для
моторной области гена пластичности Fos, кото
селективного нитрозилирования ядерных бел
рое было связано с нитрозилированием HDAC2
ков - мишеней GAPDH (HDAC2, SIRT1), но не
и высвобождением гистондеацетилазы из ком
цитоплазматических белков (β тубулин).
БИОХИМИЯ том 85 вып. 9 2020
1150
БОРОДИНОВА, БАЛАБАН
Представленная схема специфического белок
«молекулярных тормозов» и подавлять тран
белкового «перебрасывания» NO групп, предпо
скрипцию генов пластичности в покое. В образ
ложительно, может быть реализована с участием
цах мозга мышей было показано, что присут
других белковых «носителей» и является до
ствие фосфатазы PP1 в промоторных областях
вольно распространенным элементом физиоло
отдельных генов пластичности (CREB, Nfkb1)
гических и патологических сигнальных каска
отрицательно коррелирует с некоторыми актив
дов в нервных клетках [72, 74]. Похоже, что вли
ными сайт специфичными модификациями
яние нитрозильных комплексов не ограничива
хроматина (фосфорилирование, ацетилирова
ется регуляцией ацетилирования гистонов, но
ние, метилирование), что отражается на тран
может затрагивать также метилирование гисто
скрипционной активности соответствующих ге
нов. В активированных нейронах коры элемен
нов [48, 77]. Потеря/снижение ферментативной
ты попавших в ядро нитрозилированных ком
активности любого из компонентов (PP1,
плексов (Siah1) могут вызывать деградацию
HDAC I, LSD1) сопровождается дестабилизаци
SUV39H1 (рис. 1, б), что выражается в снижении
ей репрессорных комплексов и их диссоциаци
количества репрессорных меток H3K9me3 и об
ей из связи с хроматином, иными словами, сня
легчает CREB зависимую транскрипцию генов
тием «молекулярных тормозов» со специфичес
[75].
ких генов мишеней [45, 48, 50, 77, 81]. Подавле
Фосфорилирование как инструмент контроля
ние активности PP1 in vivo в мозге трансгенных
«молекулярных тормозов». Поддержание опреде
мышей коррелирует с падением деацетилазной
ленного уровня фосфорилирования клеточных
активности в ядре и увеличением представлен
мишеней за счет скоординированной работы
ности активных меток гистонов в отдельных ре
различных протеинкиназ и протеинфосфатаз
гионах мозга [25, 48, 77]. Полученные данные
является неотъемлемым компонентом пласти
объясняют, каким образом использование инги
ческих и когнитивных процессов в нервной сис
биторов гистондеацетилаз и протеинфосфатаз в
теме [25, 40, 48, 76-78]. В рамках данного обзо
электрофизиологических и поведенческих экс
ра мы не будем останавливаться на важных си
периментах приводит к сходным изменениям
наптических функциях протеинкиназ и проте
синаптической пластичности и эффективности
инфосфатаз, но попробуем рассмотреть на
обучения животных [77, 83].
конкретных примерах, как в нейронах и не ней
Хроническое нарушение дефосфорилирова
рональных клетках различные представители
ния эпигенетических мишеней in vitro в культу
этих групп оперируют на уровне хроматина на
рах кортикальных нейронов и in vivo в образцах
прямую (фосфорилирование гистонов), а также
мозга трансгенных мышей сопровождается из
опосредованно за счет изменения работы раз
менением экспрессии целого спектра генов [50,
личных эпигенетических агентов [48, 77, 79, 80].
84]. В числе снизивших свою экспрессию были
Роль фосфатаз в стабилизации «молекуляр
охарактеризованы группы генов, вовлеченных в
ных тормозов». По имеющимся сведениям, уста
трансмембранную передачу сигналов и метабо
новление равновесия между работой протеин
лические процессы, тогда как целые кластеры
киназ и фосфатаз в состоянии покоя направле
генов, связанных с транскрипцией/трансляцией
но на стабилизацию «молекулярных тормозов».
межклеточными коммуникациями, были ак
В покое в не нейрональных клетках и нейронах
тивированы [84]. Эти данные хорошо согласу
ядерные фосфатазы (PP1, PP4) взаимодей
ются с результатами поведенческих экспери
ствуют с различными гистондеацетилазами
ментов, где через сутки после обучения наблю
(HDAC1/2; HDAC3) и гистондеметилазами
дается увеличение экспрессии генов, вовлечен
(LSD1) с образованием стабильных фермента
ных в синаптическую передачу сигналов, а так
тивно активных репрессорных комплексов на
же снижение экспрессии генов - регуляторов
хроматине (рис. 1, а) [45, 48, 50, 81, 82]. Цито
метаболических процессов [20]. Полученные
плазматические фосфатазы (PP2A) в неактивных
данные дают представление о затронутых в ходе
не нейрональных клетках осуществляют дефос
изменения баланса фосфорилирования клеточ
форилирование представителей HDAC IIa, что
ных процессах, возможно, указывая на участие
служит сигналом для их транспортировки из ци
фосфатаз в поддержании метаболического тран
топлазмы в ядро и облегчает взаимодействие с
скриптома в норме (гомеостаз). Смещение базо
ядерными репрессорными белками [51, 64].
вого равновесия в сторону фосфорилирования
По некоторым данным, сформированные
мишеней, наоборот, облегчает включение плас
мультибелковые репрессорные комплексы, сос
тического транскриптома.
тоящие из гистондеацетилаз (HDAC I; HDAC
Роль протеинкиназ в дестабилизации «молеку
IIa), фосфатаз и гистондеметилаз (рис. 1, а), мо
лярных тормозов» и стимул зависимой индукции
гут кооперативно работать над стабилизацией
эпигенетических перестроек. Пластические про
БИОХИМИЯ том 85 вып. 9 2020
ЭПИГЕНЕТИЧЕСКАЯ РЕГУЛЯЦИЯ ПЛАСТИЧНОСТИ МОЗГА
1151
цессы в нервной системе сопряжены с актива
можно, других изоформ) в ядро может приво
цией и ядерной транслокацией различных про
дить к снижению метилтрансферазной актив
теинкиназ, активный импорт некоторых проте
ности DNMT, изменению профиля метилиро
инкиназ (CaMKIδ, Erk, PKCζ, PKMζ) в ядро в
вания ДНК и модуляции экспрессии генов в ак
ответ на физиологические нагрузки описан в
тивных нейронах.
нейронах и не нейрональных клетках
[80,
Стимул зависимое фосфорилирование пред
85-88]. Временная динамика ядерных трансло
ставителей HDAC IIа активированными Ca за
каций довольно сильно отличается для разных
висимыми киназами (CaMK I, II, IV; Erk1/2)
протеинкиназ, что может указывать на различия
приводит к нарушению взаимодействия HDAC
в их субстратной специфичности [80, 86, 88].
IIа с другими репрессорными белками и их экс
Транспортируемые в ядро протеинкиназы могут
порту из ядра в цитоплазму (рис. 1, в), тем са
играть особую роль в молекулярных механизмах
мым ограничивая доступ репрессорных молекул
обучения и памяти, осуществляя точечный
HDAC IIа к генам мишеням [51, 60, 61, 63].
пространственный и временной контроль эпи
Таким образом, временная стимул специ
генетического ландшафта и экспрессии опреде
фичная дестабилизация репрессорных комплек
ленных групп генов.
сов, связанная со снижением активности или
Стимул специфичное фосфорилирование
внутриклеточной локализации входящих в их
эпигенетических регуляторов вызывает кон
состав репрессорных белков, открывает «окно
формационные перестройки, приводящие к по
возможностей» для индукции эпигенетических
тере ферментативной активности (HDAC I,
перестроек и активации транскрипции генов
DNMT1) или изменению внутриклеточной ло
мишеней. Было показано, что в ответ на деполя
кализации (HDAC IIa) репрессорных белков,
ризацию клеток и увеличение концентрации
временной дестабилизации соответствующих
кальция транспортируемые в ядро протеинки
репрессорных комплексов и снятию «молеку
назы могут стимулировать фосфорилирование
лярных тормозов» (рис. 1, в). На сегодняшний
гистонов [79] и компонентов активаторных
день часть данных получена на не нейрональ
комплексов, в частности некоторых транскрип
ных клетках, тем не менее схожие принципы
ционных факторов (CREB, C/EBP, Elk1) и HAT
регуляции могут присутствовать и в нейронах.
[80, 86, 87, 90-93]. По некоторым данным, фос
Было показано, что гиперфосфорилирование
форилирование может облегчать взаимодей
HDAC1/2 сопровождается падением деацети
ствие транскрипционных факторов (TF) с их
лазной активности и приводит к распаду связей
ко активаторами HAT [94]. Отдельные работы
HDAC1/2 с ко репрессорными белками или
свидетельствуют, что фосфорилирование CREB
транскрипционными факторами и высвобож
не является обязательным условием CREB за
дению HDAC1/2 из связи с хроматином (рис. 1,
висимой транскрипции генов, по мере взросле
в) [45]. Фосфорилирование гистондеметилазы
ния организма лимитирующим фактором акти
LSD1 в нейронах не влияет на ее ферментатив
вации CREB-CBP сигнального каскада стано
ную активность, но сопровождается конформа
вится фосфорилирование HAT CBP [93, 95]. В
ционными перестройками и дестабилизацией
нескольких работах удалось установить, что
комплексов LSD1 с репрессорными белками
HAT CBP может служить мишенью для сайт
HDAC1/2 и CoREST (рис. 1, в) [50]. По некото
специфичного фосфорилирования целым ря
рым данным, сайты фосфорилирования обна
дом протеинкиназ (CaMKIV, MAPK, представи
ружены в последовательностях DNMT, что, в
тели aPKC), и в комплексах с транскрипцион
сочетании с отрывочными экспериментальны
ными факторами CREB или Elk1 фосфорилиро
ми данными, делает их потенциальными мише
ванная CBP активирует транскрипцию соответ
нями для протеинкиназ [52, 67, 89]. Особый ин
ствующих генов/репортерных конструктов [80,
терес в рамках нашего обзора представляет ра
91-93, 96].
бота Lavoie et al. [89], в которой были продемон
Из достаточно большого списка мишеней в
стрированы способности отдельных представи
рамках пластических процессов и механизмов
телей семейства PKC модифицировать
памяти наибольший интерес представляют ком
DNMT1. Фосфорилирование DNMT1 под
поненты CREB-CBP сигнального пути [83, 97].
действием PKCζ вызывает снижение ее фер
В ходе анализа литературы мы заметили, что ос
ментативной активности (рис. 1, в) и сопровож
новная масса работ на нейронах и не нейро
дается общим падением уровня метилирования
нальных клетках указывает на ключевую, хотя и
ДНК в промоторных областях генов в не ней
не исключительную роль атипичных протеин
рональных клетках. На основании приведен
киназ (aPKC) в регуляции работы CBP [80, 91,
ных данных мы предполагаем, что стимул зави
92]. В ее последовательности был обнаружен
симый транспорт протеинкиназ (PKCζ и, воз
сайт связывания атипичных протеинкиназ
БИОХИМИЯ том 85 вып. 9 2020
1152
БОРОДИНОВА, БАЛАБАН
(Ser436), который в ответ на определенные сти
ПАМЯТЬ: ЧТО ОСТАЕТСЯ
мулы подвергается фосфорилированию проте
ПОСЛЕ ОБУЧЕНИЯ
инкиназой PKCi в периферических тканях [91] и
протеинкиназами Cζ/Mζ в мозге [80, 92, 93].
Структурные изменения хроматина (пост
Фосфорилирование по сайту Ser436 критически
трансляционные модификации гистонов) явля
необходимо для рекрутирования CBP в промо
ются неотъемлемой частью процессов, связан
торные области генов мишеней, взаимодей
ных с формированием памяти. Снятие молеку
ствия с CREB и индукции перестроек хромати
лярных тормозов открывает «критическое окно»
на [80, 92, 93]. Было показано, что в развиваю
для глобальных пластических изменений, запус
щемся мозге aPKC зависимое фосфорилирова
ка специфических транскрипционных прог
ние приводит к связыванию CBP с промоторны
рамм и модуляции эффективности синаптичес
ми областями некоторых развитийных генов и
ких связей (см. выше). В частности, это подтвер
регуляции дифференцировки клеток предшест
ждается данными РНК секвенирования не
венников в корковой зоне [92]. Во взрослом
больших групп клеток и фрагментов ткани гип
мозге aPKC-CBP сигнальный путь контролиру
покампа, согласно которым обучение сопро
ет нейрогенез и критически необходим для фор
вождается специфическими изменениями
мирования и длительного хранения гиппокамп
экспрессии целых кластеров поздних генов,
зависимых форм памяти [93]. Полученные дан
связанных с синаптическими функциями, субъ
ные согласуются с результатами экспериментов
единицами рецепторов и ионных каналов [20,
на позвоночных и беспозвоночных животных, у
99]. В литературе обсуждается обратимый харак
которых нарушение хранения памяти, вызван
тер посттрансляционных модификаций гисто
ное введением блокаторов aPKC, можно ком
нов, который не исключает сохранения некото
пенсировать увеличением ацетилирования гис
рых довольно локальных перестроек в регуля
тонов за счет нарушения ре ассоциации репрес
торных областях отдельных генов, но оставляет
сорных комплексов с помощью HDAC ингиби
открытым вопрос о способах поддержания
торов [80, 98].
пластических изменений на определенном
Приведенные данные демонстрируют, что
уровне в течение долгого времени [25, 26, 79].
протеинкиназы служат важнейшим связующим
Результаты секвенирования наводят на
звеном между зависимыми от активности си
мысль, что ключом к пониманию этого могут
наптическими изменениями на периферии
быть процессы, связанные со стимул специ
клетки и процессами, протекающими в ядре.
фичным изменением и стабильным поддержа
Активация клеток и увеличение уровня кальция
нием определенного профиля метилирования
стимулируют транспортировку некоторых PK в
ДНК в отдельных межгенных, внутригенных и
ядро, где происходит стимул зависимое фосфо
промоторных участках генов до следующего ак
рилирование связанных с хроматином белковых
та снятия «молекулярных тормозов» в ответ на
регуляторов (рис. 1, в), временное снятие «моле
значимые стимулы (например, напоминание)
кулярных тормозов» и облегчение формирова
[3, 20]. Важнейшая роль процессов метилирова
ния активаторных комплексов. Сопряженное
ния ДНК в механизмах пластичности была про
появление различных активных меток гистонов
иллюстрирована на беспозвоночных, где иссле
во время формирования и/или извлечения па
дователи смогли искусственно воссоздать спе
мяти может быть результатом взаимодействия
цифический след памяти у необученных мол
ядерных протеинкиназ с TF HAT на хроматине,
люсков Aplysia путем инъекции им фракций
при котором близлежащие гистоны подвергают
РНК, выделенных из нервной системы обучен
ся двойному воздействию: ацетилированию ак
ных животных [100]. Было показано, что инъек
тивированными HAT и фосфорилированию со
ции факторов (предположительно, некодирую
ответствующими PK [25, 48, 79]. Результатом
щих РНК), содержащихся в нейронах обучен
комплексных перестроек хроматина и привле
ных животных, генерируют определенный пат
чения активаторных молекул будет включение
терн метилирования ДНК, своего рода, «эпиге
определенных транскрипционных программ,
нетическую энграмму», которую можно разру
направленных на изменение эффективности си
шить посредством введения блокаторов DNMT.
наптических связей и изменение «статуса» акти
На млекопитающих было показано, что увели
вированных нейронов в сети. По всей видимос
чение продукции ДНК метилтрансферазы
ти, закрытие «критического окна» пластичности
DNMT3a2 в специфической функциональной
и восстановление базовых характеристик в про
сети нейронов стимулирует изменение профиля
моторных областях генов мишеней координи
метилирования генов синаптической пластич
руется вновь собранными репрессорными
ности и повышает стабильность этой энграммы
комплексами.
при извлечении памяти (см. выше) [24]. Miller et
БИОХИМИЯ том 85 вып. 9 2020
ЭПИГЕНЕТИЧЕСКАЯ РЕГУЛЯЦИЯ ПЛАСТИЧНОСТИ МОЗГА
1153
al. [21] пошли дальше и с помощью ингибиторов
буемых для регуляции пластичности и поддер
DNMT производили нарушение установленно
жания/хранения памяти неопределенно долгое
го профиля метилирования ДНК в префрон
время.
тальной коре крыс через 30 дней после обуче
ния. Оказалось, что локальное введение инги
битора DNMT отражается на характере
ЗАКЛЮЧЕНИЕ
экспрессии генов и приводит к нарушению хра
нения отставленной памяти (remote memory).
Поиск специфических механизмов для уп
При детальном рассмотрении оказалось, что
равления когнитивными процессами в норме и
профиль метилирования ДНК в определенных
при патологиях довольно остро стоит в рамках
участках хроматина контролирует возможность
современной нейробиологии. На сегодняшний
посадки фактора CTCF, ключевого регулятора
день происходит переключение внимания ис
3D организации хроматина [101]. За счет взаи
следователей на молекулярные процессы, про
модействия с удаленными участками ДНК и
текающие в ядре, поскольку изменение работы
формирования петель CTCF может сближать
генома лежит в основе адаптивных функций ор
регуляторные области генома (энхансеры, инсу
ганизма, в том числе обучения и памяти. В рам
ляторы) с участками генов мишеней и модули
ках настоящего обзора мы попытались сумми
ровать уровень их экспрессии [102]. Было пока
ровать некоторые накопившиеся в литературе
зано, что CTCF специфически вовлечен в регу
данные и рассмотреть в деталях предпосылки и
ляцию экспрессии генов пластичности и памяти
механизмы эпигенетических перестроек, кото
в гиппокампе и префронтальной коре [103, 104].
рые на сетевом и клеточном уровне могут обес
При исследовании влияния CTCF на недавнюю
печить специфический контроль работы генов.
гиппокамп зависимую память были получены
Оперируя на уровне хроматина, различные эпи
противоречивые результаты, которые не позво
генетические агенты в составе сложных мульти
ляют сделать однозначного вывода, но и не от
белковых репрессорных комплексов координи
рицают возможной роли CTCF в гиппокампе
рованно и кооперативно функционируют в ка
при определенных условиях [103, 104]. Генети
честве «молекулярных тормозов» (molecular
ческие манипуляции с количеством CTCF в воз
brake pad), избирательно сохраняя низкий уро
буждающих и тормозных сетях нейронов пре
вень экспрессии генов пластичности в покое
фронтальной коры демонстрируют критичес
(см. выше). Активация нейронов в ответ на фи
кую роль этого фактора в регуляции синапти
зиологически значимые стимулы запускает се
ческой пластичности и длительном (4 недели)
рию биохимических событий (фосфорилирова
хранении памяти [104]. Подавление продукции
ние, нитрозилирование), результатом которых
CTCF приводит к изменению базовой экспрес
является временное снятие «молекулярных тор
сии разных групп генов [103, 104]. Полученные
мозов» и открытие «критического окна» для гло
данные дают основания считать, что CTCF под
бальных и локальных эпигенетических пере
держивает определенную 3D организацию хро
строек, активации специфических транскрип
матина, при которой базовая экспрессия таких
ционных программ и модуляции эффективнос
мишеней, как HDAC3 и HDAC7, находится на
ти синаптических связей (см. выше). Довольно
достаточно низком уровне [103]. Кроме того,
сложным вопросом для нас остается то, как
при обучении в гиппокампе мышей с дефици
устроена система специфической «навигации»
том CTCF наблюдается стимул специфичное
эпигенетических агентов, и их привлечение в
увеличение экспрессии генов супрессоров па
регуляторные области определенных групп ге
мяти (Ppp1c) и нарушение экспрессии целого
нов. Мы попытались представить в обзоре неко
ряда генов пластичности (Arc, Bdnf, Reln) [103].
торые сведения по этой теме, однако продолже
Нарушение экспрессии генов пластичности в
ние исследования, на наш взгляд, требует де
условиях недостатка CTCF может быть связано
тального рассмотрения роли различных групп
с изменением архитектуры хроматина в этих ло
некодирующих РНК, в огромном количестве
кусах, о чем свидетельствует потеря части
представленых в нервной ткани. По некоторым
CTCF зависимых контактов генов Arc и Bdnf с
данным, малоизученные на сегодняшний день
другими участками на хромосоме [103].
некодирующие РНК могут участвовать в изме
Полученные данные указывают на то, что
нении эпигенетического ландшафта и служить
характер метилирования ДНК в определенных
важнейшим элементом тонкой регуляции рабо
локусах хроматина и метил зависимые способы
ты определенных генов, в том числе генов плас
его трехмерной организации могут служить ста
тичности [105].
бильной молекулярной основой реализации оп
Другим не менее важным аспектом является
ределенных транскрипционных программ, тре
обнаружение стабильной молекулярной основы
2 БИОХИМИЯ том 85 вып. 9 2020
1154
БОРОДИНОВА, БАЛАБАН
для поддержания и сохранения соответствую
равление, позволяющее избирательно редакти
щих пластических изменений, т.е. памяти. На
ровать эпигеном [106]. Разработка технологий и
сегодняшний день мнения исследователей еди
систем для редактирования эпигенома имеет
ногласно сходятся на метилировании ДНК как
большой потенциал в рамках исследования раз
конечной и наиболее устойчивой системе хра
вития мозга, когнитивных функций в норме и
нения информации в клетке [3, 21, 24]. В ходе
коррекции нейропатологий, обусловленных
исследований данная концепция претерпевает
аномальной работой генов. Применение этих
усложнения. Отрывочные данные дают основа
технологий является логичным продолжением
ния считать, что сохранение определенной
текущих исследований, поскольку может вы
пространственной организации хроматина,
вести на новый уровень рассмотрение специ
представляющее метил зависимый процесс,
фических механизмов регуляции нейроплас
критически важно для поддержания транскрип
тичности и памяти.
ционных программ [103, 104]. Возможно, что
стимул зависимое метилирование ДНК прово
цирует изменение цитоархитектуры хроматина,
Финансирование. Исследование выполнено
которое «запирает» в определенном функцио
при финансовой поддержке Российского фонда
нальном состоянии те или иные гены, однако
фундаментальных исследований (грант № 19
данные предположения требуют отдельного де
115 50290).
тального исследования.
Конфликт интересов. Авторы заявляют об от
Экспериментальные данные, полученные
сутствии конфликта интересов.
на модельных организмах, демонстрируют пер
Соблюдение этических норм. Настоящая
спективность разработки эпигенетических ме
статья не содержит исследований с участием
ханизмов управления активностью генов. В
людей или использованием животных в качест
последние годы получило развитие новое нап
ве объектов.
СПИСОК ЛИТЕРАТУРЫ
1.
Alberini, C. M., and Kandel, E. R. (2014) The regulation
9. Ganai, S. A., Ramadoss, M., and Mahadevan, V. (2016)
of transcription in memory consolidation, Cold Spring
Histone deacetylase (HDAC) inhibitors - emerging roles
Harb. Perspect. Biol., 7, a021741, doi: 10.1101/cshperspect.
in neuronal memory, learning, synaptic plasticity and neu
a021741.
ral regeneration, Curr. Neuropharmacol., 14, 55 71.
2.
Kyrke Smith, M., and Williams, J. M. (2018) Bridging
10. Latcheva, N. K., Viveiros, J. M., Waddell, E. A.,
synaptic and epigenetic maintenance mechanisms of the
Nguyen, P. T. T., Liebl, F. L. W., and Marenda, D. R.
engram, Front. Mol. Neurosci., 11, 369.
(2018) Epigenetic crosstalk: pharmacological inhibition of
3.
Halder, R., Hennion, M., Vidal, R. O., Shomroni, O.,
HDACs can rescue defective synaptic morphology and
Rahman, R. U., Rajput, A., Centeno, T. P., van Bebber, F.,
neurotransmission phenotypes associated with loss of the
Capece, V., Garcia Vizcaino, J. C., Schuetz, A. L.,
chromatin reader Kismet, Mol. Cell. Neurosci., 87, 77 85.
Burkhardt, S., Benito, E., Navarro Sala, M., Javan, S. B.,
11. Торопова K. A., Анохин K. В., Тиунова A. A. (2014)
Haass, C., Schmid, B., Fischer, A., and Bonn, S. (2016)
Блокада деацетилирования гистонов в мозге модули
DNA methylation changes in plasticity genes accompany
рует экспрессию транскрипционных факторов c Fos и
the formation and maintenance of memory, Nat. Neurosci.,
ZENK и потенциирует образование долговременной
19, 102 110.
памятиу новорожденных цыплят, Журнал Высшей
4.
Jarome, T. J., and Lubin, F. D. (2014) Epigenetic mecha
Нервной Деятельности им. И.П. Павлова, 64, 551 561.
nisms of memory formation and reconsolidation,
12. Zuzina, A., Vinarskaya, A., and Balaban, P. (2020) Histone
Neurobiol. Learn. Mem., 115, 116 127.
deacetylase inhibitors rescue the impaired memory in ter
5.
Penney, J., and Tsai, L. H. (2014) Histone deacetylases in
restrial snails, J. Compar. Physiol. A, 206, 639649,
memory and cognition, Sci. Signal.,
7, re12,
doi: 10.1007/s00359 020 01422 w.
doi: 10.1126/scisignal.aaa0069.
13. Guan, J. S., Haggarty, S. J., Giacometti, E., Dannenberg, J. H.,
6.
Kim, S., and Kaang, B. K. (2017) Epigenetic regulation
Joseph, N., Gao, J., Nieland, T. J., Zhou, Y., Wang, X.,
and chromatin remodeling in learning and memory, Exp.
Mazitschek, R., Bradner, J. E., DePinho, R. A., Jaenisch, R.,
Mol. Med., 49, e281.
and Tsai, L. H. (2009) HDAC2 negatively regulates mem
7.
Montarolo, P. G., Goelet, P., Castellucci, V. F., Morgan, J.,
ory formation and synaptic plasticity, Nature, 459, 55 60.
Kandel, E. R., and Schacher, S. (1986) A critical period for
14. Morris, M. J., Mahgoub, M., Na, E. S, Pranav, H., and
macromolecular synthesis in long term heterosynaptic
Monteggia, L. M. (2013) Loss of histone deacetylase 2
facilitation in Aplysia, Science, 234, 1249 1254.
improves working memory and accelerates extinction
8.
Guan, Z., Giustetto, M., Lomvardas, S., Kim, J. H.,
learning, J. Neurosci., 33, 6401 6411.
Miniaci, M. C., Schwartz, J. H., Thanos, D., and Kandel, E. R.
15. Ванюшин Б. Ф., Тушмалова Н. А., Гуськова Л. В.
(2002) Integration of long term memory related synaptic
(1974) Метилирование ДНК мозга как показатель
plasticity involves bidirectional regulation of gene expres
участия генома в механизмах индивидуально приоб
sion and chromatin structure, Cell, 111, 483 493.
ретенной памяти, Доклады АН СССР, 219, 742 744.
БИОХИМИЯ том 85 вып. 9 2020
ЭПИГЕНЕТИЧЕСКАЯ РЕГУЛЯЦИЯ ПЛАСТИЧНОСТИ МОЗГА
1155
16.
Гуськова Л. В., Бурцева Н. Н., Тушмалова Н. А., Ваню
and transcriptional regulation over presynaptic and postsy
шин Б. Ф. (1977) Уровень метилирования ДНК ядер
naptic elements in the adult hippocampus, Front. Cell.
нейронов и глии коры больших полушарий мозга
Neurosci., 10, 138.
крыс и его изменения при выработке условного реф
32.
Valiati, F. E., Vasconcelos, M., Lichtenfels, M., Petry, F. S.,
лекса, Доклады АН СССР, 233, 993 996.
de Almeida, R. M. M., Schwartsmann, G., Schröder, N.,
17.
Holliday, R. (1999) Is there an epigenetic component in
de Farias, C. B., and Roesler, R. (2017) Administration of
long term memory? J. Theor. Biol., 200, 339 341.
a histone deacetylase inhibitor into the basolateral amyg
18.
Day, J. J., and Sweatt, J. D. (2010) DNA methylation and
dala enhances memory consolidation, delays extinction,
memory formation, Nat. Neurosci., 13, 1319 1323.
and increases hippocampal BDNF levels, Front.
19.
Pearce, K., Cai, D., Roberts, A. C., and Glanzman, D. L.
Pharmacol., 8, 415.
(2017) Role of protein synthesis and DNA methylation in
33.
Hermey, G., Mahlke, C., Gutzmann, J. J., Schreiber, J.,
the consolidation and maintenance of long term memory
Blüthgen, N., and Kuhl, D. (2013) Genome wide profiling
in Aplysia, Elife, 6, e18299.
of the activity dependent hippocampal transcriptome,
20.
Duke, C. G., Kennedy, A. J., Gavin, C. F., Day, J. J., and
PLoS One., 8, e76903.
Sweatt, J. D. (2017) Experience dependent epigenomic
34.
Benito, E., and Barco, A. (2015) The neuronal activity
reorganization in the hippocampus, Learn. Mem., 24, 278
driven transcriptome, Mol. Neurobiol., 5, 1071 1088.
288.
35.
Fowler, T., Sen, R., and Roy, A. L. (2011) Regulation of
21.
Miller, C. A., Gavin, C. F., White, J. A., Parrish, R. R.,
primary response genes, Mol. Cell, 44, 348 360.
Honasoge, A., Yancey, C. R., Rivera, I. M., Rubio, M. D.,
36.
Herschman, H, R. (1991) Primary response genes induced
Rumbaugh, G., and Sweatt, J. D. (2010) Cortical DNA
by growth factors and tumor promoters, Annu. Rev.
methylation maintains remote memory, Nat. Neurosci., 13,
Biochem., 60, 281 319.
664 666.
37.
Tyssowski, K. M., DeStefino, N. R., Cho, J. H., Dunn, C. J.,
22.
Gupta, S., Kim, S. Y., Artis, S., Molfese, D. L.,
Poston, R. G., Carty, C. E., Jones, R. D., Chang, S. M.,
Schumacher, A., Sweatt, J. D., Paylor, R. E., and Lubin, F. D.
Romeo, P., Wurzelmann, M. K., Ward, J. M., Andermann, M. L.,
(2010) Histone methylation regulates memory formation,
Saha, R. N., Dudek, S. M., and Gray, J. M. (2018)
J. Neurosci., 30, 3589 3599.
Different neuronal activity patterns induce different gene
23.
Lesburguères, E., Gobbo, O. L., Alaux Cantin, S.,
expression programs, Neuron, 98, 530 546.e11.
Hambucken, A., Trifilieff, P., and Bontempi, B. (2011)
38.
Tyssowski, K. M., Letai, K. C., Rendall, S. D., Tan, C.,
Early tagging of cortical networks is required for the forma
Nizhnik, A., Kaeser, P. S., and Gray, J. M. (2019) Firing
tion of enduring associative memory, Science, 331, 924
rate homeostasis can occur in the absence of neuronal
928.
activity regulated transcription, J. Neurosci., 39, 9885
24.
Gulmez Karaca, K., Kupke, J., Brito, D. V. C., Zeuch, B.,
9899.
Thome, C., Weichenhan, D., Lutsik, P., Plass, C., and
39.
Shepherd, J. D., and Bear, M. F. (2011) New views of Arc,
Oliveira, A. M. M. (2020) Neuronal ensemble specific
a master regulator of synaptic plasticity, Nat. Neurosci., 14,
DNA methylation strengthens engram stability, Nat.
279 284.
Commun., 11, 639.
40.
Sacktor, T. C. (2011) How does PKMζ maintain long term
25.
Gräff, J., Woldemichael, B. T., Berchtold, D., Dewarrat, G.,
memory? Nat. Rev. Neurosci., 12, 9 15.
and Mansuy, I. M. (2012) Dynamic histone marks in the
41.
McQuown, S. C., and Wood, M. A. (2011) HDAC3 and
hippocampus and cortex facilitate memory consolidation,
the molecular brake pad hypothesis, Neurobiol. Learn.
Nat. Commun., 3, 991.
Mem., 96, 27 34.
26.
Gupta Agarwal, S., Franklin, A. V., Deramus, T.,
42.
Kelly, R. D., and Cowley, S. M. (2013) The physiological
Wheelock, M., Davis, R. L., McMahon, L. L., and
roles of histone deacetylase (HDAC) 1 and 2: complex co
Lubin, F. D. (2012) G9a/GLP histone lysine dimethyl
stars with multiple leading parts, Biochem. Soc. Trans., 4,
transferase complex activity in the hippocampus and the
741 749.
entorhinal cortex is required for gene activation and silencing
43.
Fuks, F., Burgers, W. A., Godin, N., Kasai, M., and
during memory consolidation, J. Neurosci., 32, 5440 5453.
Kouzarides, T. (2001) Dnmt3a binds deacetylases and is
27.
Sui, L., Wang, Y., Ju, L. H., and Chen, M. (2012) Epi
recruited by a sequence specific repressor to silence tran
genetic regulation of reelin and brain derived neurotroph
scription, EMBO J., 20, 2536 2544.
ic factor genes in long term potentiation in rat medial pre
44.
Fischle, W., Dequiedt, F., Hendzel, M. J., Guenther, M. G.,
frontal cortex, Neurobiol. Learn. Mem., 97, 425 440.
Lazar, M. A., Voelter, W., and Verdin, E. (2002) Enzymatic
28.
Webb, W. M., Sanchez, R. G., Perez, G., Butler, A. A.,
activity associated with class II HDACs is dependent on a
Hauser, R. M., Rich, M. C., O’Bierne, A. L., Jarome, T. J.,
multiprotein complex containing HDAC3 and SMRT/N
and Lubin, F. D. (2017) Dynamic association of epigenet
CoR, Mol. Cell, 9, 45 57.
ic H3K4me3 and DNA 5hmC marks in the dorsal hip
45.
Galasinski, S. C., Resing, K. A., Goodrich, J. A., and
pocampus and anterior cingulate cortex following reactiva
Ahn, N. G. (2002) Phosphatase inhibition leads to histone
tion of a fear memory, Neurobiol. Learn. Mem., 142, 66 78.
deacetylases 1 and 2 phosphorylation and disruption of
29.
Kitamura, T., Ogawa, S. K., Roy, D. S., Okuyama, T.,
corepressor interactions, J. Biol. Chem., 277, 19618 19626.
Morrissey, M. D., Smith, L. M., Redondo, R. L., and
46.
Vaute, O., Nicolas, E., Vandel, L., and Trouche, D. (2002)
Tonegawa, S. (2017) Engrams and circuits crucial for sys
Functional and physical interaction between the histone
tems consolidation of a memory, Science, 356, 73 78.
methyl transferase Suv39H1 and histone deacetylases,
30.
Бородинова A. A., Саложин С. В. (2016) Различия био
Nucleic Acids Res., 30, 475 481.
логических функций BDNF и proBDNF в централь
47.
Bai, S., Ghoshal, K., Datta, J., Majumder, S., Yoon, S. O.,
ной нервной системе, Журнал Высшей Нервной Дея)
and Jacob, S. T. (2005) DNA methyltransferase 3b regu
тельности им. И.П. Павлова, 66, 3 23.
lates nerve growth factor induced differentiation of PC12
31.
Bosch, C., Muhaisen, A., Pujadas, L., Soriano, E., and
cells by recruiting histone deacetylase 2, Mol. Cell. Biol.,
Mart nez, A. (2016) Reelin exerts structural, biochemical
25, 751 766.
БИОХИМИЯ том 85 вып. 9 2020
2*
1156
БОРОДИНОВА, БАЛАБАН
48.
Koshibu, K., Graff, J., Beullens, M., Heitz, F. D.,
tion in control of muscle differentiation, Mol. Cell. Biol.,
Berchtold, D., Russig, H., Farinelli, M., Bollen, M., and
22, 7302 7312.
Mansuy, I. M. (2009) Protein phosphatase 1 regulates the
64.
Paroni, G., Cernotta, N., Dello Russo, C., Gallinari, P.,
histone code for long term memory, J. Neurosci., 29,
Pallaoro, M., Foti, C., Talamo, F., Orsatti, L., Steinkühler, C.,
13079 13089.
and Brancolini, C. (2008) PP2A regulates HDAC4 nuclear
49.
Kundakovic, M., Chen, Y., Guidotti, A., and Grayson, D. R.
import, Mol. Biol. Cell, 19, 655 667.
(2009) The reelin and GAD67 promoters are activated by
65.
Miller, C. A., and Sweatt, J. D. (2007) Covalent modification
epigenetic drugs that facilitate the disruption of local
of DNA regulates memory formation, Neuron, 53, 857 869.
repressor complexes, Mol. Pharmacol., 75, 342 354.
66.
Du, J., Johnson, L. M., Jacobsen, S. E., and Patel, D. J.
50.
Toffolo, E., Rusconi, F., Paganini, L., Tortorici, M.,
(2015) DNA methylation pathways and their crosstalk with
Pilotto, S., Heise, C., Verpelli, C., Tedeschi, G., Maffioli, E.,
histone methylation, Nat. Rev. Mol. Cell Biol., 16, 519 532.
Sala, C., Mattevi, A., and Battaglioli, E. (2014) Phos
67.
Denis, H., Ndlovu, M. N., and Fuks, F. (2011) Regulation
phorylation of neuronal lysine specific demethylase
of mammalian DNA methyltransferases: a route to new
1LSD1/KDM1A impairs transcriptional repression by reg
mechanisms, EMBO Rep., 12, 647 656.
ulating interaction with CoREST and histone deacetylases
68.
Fuks, F., Hurd, P. J., Deplus, R., and Kouzarides, T. (2003)
HDAC1/2, J. Neurochem., 128, 603 616.
The DNA methyltransferases associate with HP1 and the
51.
Mathias, R. A., Guise, A. J., and Cristea, I. M. (2015)
SUV39H1 histone methyltransferase, Nucleic Acids Res.,
Post translational modifications regulate class IIa histone
31, 2305 2312.
deacetylase (HDAC) function in health and disease, Mol.
69.
Vasudevan, D., Bovee, R. C., and Thomas, D. D. (2016)
Cell. Proteomics., 14, 456 470.
Nitric oxide, the new architect of epigenetic landscapes,
52.
Bayraktar, G., and Kreutz, M. R. (2018) Neuronal DNA
Nitric Oxide, 59, 54 62.
methyltransferases: epigenetic mediators between synaptic
70.
Balaban, P. M., Roshchin, M., Timoshenko, A. K.,
activity and gene expression? Neuroscientist, 24, 171 185.
Gainutdinov, K. L., Bogodvid, T. K., Muranova, L. N.,
53.
Riccio, A., Alvania, R. S., Lonze, B. E., Ramanan, N.,
Zuzina, A. B., and Korshunova, T. A. (2014) Nitric oxide is
Kim, T., Huang, Y., Dawson, T. M., Snyder, S. H., and
necessary for labilization of a consolidated context memo
Ginty, D. D. (2006) A nitric oxide signaling pathway con
ry during reconsolidation in terrestrial snails, Eur. J.
trols CREB mediated gene expression in neurons, Mol.
Neurosci., 40, 2963 2970.
Cell, 21, 283 294.
71.
Gräff, J., Joseph, N. F., Horn, M. E., Samiei, A., Meng, J.,
54.
Nott, A., Watson, P. M., Robinson, J. D., Crepaldi, L., and
Seo, J., Rei, D., Bero, A. W., Phan, T. X., Wagner, F.,
Riccio A. (2008) S Nitrosylation of histone deacetylase 2
Holson, E., Xu, J., Sun, J., Neve, R. L., Mach, R. H.,
induces chromatin remodelling in neurons, Nature, 455,
Haggarty, S. J., and Tsai, L. H. (2014) Epigenetic priming
411 415.
of memory updating during reconsolidation to attenuate
55.
Louis Sam Titus, A. S. C., Sharma, D., Kim, M. S., and
remote fear memories, Cell, 156, 261 276.
D’Mello, S. R. (2019) The Bdnf and Npas4 genes are tar
72.
Smith, J. G., Aldous, S. G., Andreassi, C., Cuda, G.,
gets of HDAC3 mediated transcriptional repression, BMC
Gaspari, M., and Riccio, A. (2018) Proteomic analysis of
Neurosci., 20, 65.
S nitrosylated nuclear proteins in rat cortical neurons, Sci.
56.
Guenther, M. G., Barak, O., and Lazar, M. A. (2001) The
Signal., 11, aar3396, doi: 10.1126/scisignal.aar3396.
SMRT and N CoR corepressors are activating cofactors
73.
Kornberg, M. D., Sen, N., Hara, M. R., Juluri, K. R.,
for histone deacetylase 3, Mol. Cell. Biol., 21, 6091 6101.
Nguyen, J. V., Snowman, A. M., Law, L., Hester, L. D.,
57.
Broide, R. S., Redwine, J. M., Aftahi, N., Young, W.,
and Snyder, S. H. (2010) GAPDH mediates nitrosylation
Bloom, F. E., and Winrow, C. J. J. (2007) Distribution of
of nuclear proteins, Nat. Cell Biol., 12, 1094 1100.
histone deacetylases 1 11 in the rat brain, Mol. Neurosci.,
74.
Nakamura, T., and Lipton, S. A. (2013) Emerging role of
31, 47 58.
protein protein transnitrosylation in cell signaling path
58.
Sando, R. 3rd, Gounko, N., Pieraut, S., Liao, L., Yates, J.
ways, Antioxid. Redox Signal., 18, 239 249.
3rd, and Maximov, A. (2012) HDAC4 governs a transcrip
75.
Sen, N., and Snyder, S. H. (2011) Neurotrophin mediated
tional program essential for synaptic plasticity and memo
degradation of histone methyltransferase by S nitrosyla
ry, Cell, 151, 821 834.
tion cascade regulates neuronal differentiation, Proc. Natl.
59.
Zhu, Y., Huang, M., Bushong, E., Phan, S., Uytiepo, M.,
Acad. Sci. USA, 108, 20178 20183.
Beutter, E., Boemer, D., Tsui, K., Ellisman, M., and
76.
Pi, H. J., and Lisman, J. E. (2008) Coupled phosphatase
Maximov, A. (2019) Class IIa HDACs regulate learning
and kinase switches produce the tristability required for
and memory through dynamic experience dependent
long term potentiation and long term depression, J.
repression of transcription, Nat. Commun., 10, 3469.
Neurosci., 28, 13132 13138.
60.
Chawla, S., Vanhoutte, P., Arnold, F. J., Huang, C. L., and
77.
Koshibu, K., Graff, J., and Mansuy, I. M. (2011) Nuclear
Bading, H. (2003) Neuronal activity dependent nucleocy
protein phosphatase 1: an epigenetic regulator of fear
toplasmic shuttling of HDAC4 and HDAC5, J.
memory and amygdala long term potentiation,
Neurochem., 85, 151 159.
Neuroscience, 173, 30 36.
61.
Schlumm, F., Mauceri, D., Freitag, H. E., and Bading, H.
78.
Borodinova, A. A., Zuzina, A. B., and Balaban, P. M.
(2013) Nuclear calcium signaling regulates nuclear export
(2017) Role of atypical protein kinases in maintenance of
of a subset of class IIa histone deacetylases following
long term memory and synaptic plasticity, Biochemistry
synaptic activity, J. Biol. Chem., 288, 8074 8084.
(Mosccow), 82, 243 256.
62.
Josselyn, S. A., and Frankland, P. W. (2018) Memory allo
79.
Chwang, W. B., O’Riordan, K. J., Levenson, J. M., and
cation: mechanisms and function, Annu. Rev. Neurosci.,
Sweatt, J. D. (2006) ERK/MAPK regulates hippocampal
41, 389 413.
histone phosphorylation following contextual fear condi
63.
Zhang, C. L., McKinsey, T. A., and Olson, E. N. (2002)
tioning, Learn. Mem., 13, 322 328.
Association of class II histone deacetylases with hete
80.
Ko, H. G., Kim, J. I., Sim, S. E., Kim, T., Yoo, J., Choi,
rochromatin protein 1: potential role for histone methyla
S. L., Baek, S. H., Yu, W. J., Yoon, J. B., Sacktor, T. C., and
БИОХИМИЯ том 85 вып. 9 2020
ЭПИГЕНЕТИЧЕСКАЯ РЕГУЛЯЦИЯ ПЛАСТИЧНОСТИ МОЗГА
1157
Kaang, B. K. (2016) The role of nuclear PKMζ in memo
94. Kwok, R. P., Lundblad, J. R., Chrivia, J. C., Richards, J. P.,
ry maintenance, Neurobiol. Learn. Mem., 135, 50 56.
Bächinger, H. P., Brennan, R. G., Roberts, S. G., Green, M. R.,
81.
Canettieri, G., Morantte, I., Guzmán, E., Asahara, H.,
and Goodman, R. H. (1994) Nuclear protein CBP is a
Herzig, S., Anderson, S. D., Yates, J. R. 3rd, and
coactivator for the transcription factor CREB, Nature,
Montminy, M. (2003) Attenuation of a phosphorylation
370, 223 226.
dependent activator by an HDAC PP1 complex, Nat.
95. Briand, L. A., Lee, B. G., Lelay, J., Kaestner, K. H., and
Struct. Biol., 10, 175 181.
Blendy, J. A. (2015) Serine 133 phosphorylation is not
82.
Zhang, X., Ozawa, Y., Lee, H., Wen, Y. D., Tan, T. H.,
required for hippocampal CREB mediated transcription
Wadzinski, B. E., and Seto, E. (2005) Histone deacetyl
and behavior, Learn. Mem., 22, 109 115.
ase 3 (HDAC3) activity is regulated by interaction with
96. Impey, S., Fong, A. L., Wang, Y., Cardinaux, J. R., Fass, D. M.,
protein serine/threonine phosphatase 4, Genes Dev., 19,
Obrietan, K., Wayman, G. A., Storm, D. R., Soderling, T.
827 839.
R., and Goodman, R. H. (2002) Phosphorylation of CBP
83.
Vecsey, C. G., Hawk, J. D., Lattal, K. M., Stein, J. M.,
mediates transcriptional activation by neural activity and
Fabian, S. A., Attner, M. A., Cabrera, S. M., McDonough, C. B.,
CaM kinase IV, Neuron., 34, 235 244.
Brindle, P. K., Abel, T., and Wood, M. A. (2007) Histone
97. Barrett, R. M., Malvaez, M., Kramar, E., Matheos, D. P.,
deacetylase inhibitors enhance memory and synaptic plas
Arrizon, A., Cabrera, S. M., Lynch, G., Greene, R. W., and
ticity via CREB: CBP dependent transcriptional activa
Wood, M. A. (2011) Hippocampal focal knockout of CBP
tion, J. Neurosci., 27, 6128 6140.
affects specific histone modifications, long term potentia
84.
Graff, J., Koshibu, K., Jouvenceau, A., Dutar, P., and
tion, and long term memory, Neuropsychopharmacology,
Mansuy, I. M. (2010) Protein phosphatase 1 dependent
36, 1545 1556.
transcriptional programs for long term memory and plas
98. Chen, S., Cai, D., Pearce, K., Sun, P. Y., Roberts, A. C.,
ticity, Learn. Mem., 17, 355 363.
and Glanzman, D. L. (2014) Reinstatement of long term
85.
Wooten, M. W., Zhou, G., Wooten, M. C., and
memory following erasure of its behavioral and synaptic
Seibenhener, M. L. (1997) Transport of protein kinase C
expression in aplysia, Elife, 3, e03896.
isoforms to the nucleus of PC12 cells by nerve growth fac
99. Rao Ruiz, P., Couey, J. J., Marcelo, I. M., Bouwkamp, C. G.,
tor: association of atypical zeta PKC with the nuclear
Slump, D. E., Matos, M. R., van der Loo, R. J., Martins, G. J.,
matrix, J. Neurosci. Res., 49, 393 403.
van den Hout, M., van IJcken, W. F., Costa, R. M., van den
86.
Sakagami, H., Kamata, A., Nishimura, H., Kasahara, J.,
Oever, M. C., and Kushner, S. A. (2019) Engram specific
Owada, Y., Takeuchi, Y., Watanabe, M., Fukunaga, K., and
transcriptome profiling of contextual memory consolida
Kondo, H. (2005) Prominent expression and activity
tion, Nat. Commun., 10, 2232.
dependent nuclear translocation of Ca2+/calmodulin
100. Bédécarrats, A., Chen, S., Pearce, K., Cai, D., and
dependent protein kinase Idelta in hippocampal neurons,
Glanzman, D. L. (2018) RNA from trained aplysia can
Eur. J. Neurosci., 22, 2697 2707.
induce an epigenetic engram for long term sensitization in
87.
Zhai, S., Ark, E. D., Parra Bueno, P., and Yasuda, R.
untrained aplysia, eNeuro,
5, doi:
10.1523/ENEU
(2013) Long distance integration of nuclear ERK signaling
RO.0038 18.2018.
triggered by activation of a few dendritic spines, Science,
101. Maurano, M. T., Wang, H., John, S., Shafer, A., Canfield, T.,
342, 1107 1111.
Lee, K., and Stamatoyannopoulos, J. A. (2015) Role of
88.
Melgarejo da Rosa, M., Yuanxiang, P., Brambilla, R.,
DNA methylation in modulating transcription factor
Kreutz, M. R., and Karpova, A.
(2016) Synaptic
occupancy, Cell Rep., 12, 1184 1195.
GluN2B/CaMKII α signaling induces synapto nuclear
102. Phillips, J. E., and Corces, V. G. (2009) CTCF: master
transport of ERK and Jacob, Front. Mol. Neurosci., 9, 66.
weaver of the genome, Cell, 137, 1194 1211.
89.
Lavoie, G., Estève, P. O., Laulan, N. B., Pradhan, S., and
103. Sams, D. S., Nardone, S., Getselter, D., Raz, D., Tal, M.,
St Pierre, Y. (2011) PKC isoforms interact with and phos
Rayi, P. R., Kaphzan, H., Hakim, O., and Elliott, E.
phorylate DNMT1, BMC Biol., 9, 31.
(2016) Neuronal CTCF is necessary for basal and experi
90.
Wegner, M., Cao, Z., and Rosenfeld, M. G. (1992)
ence dependent gene regulation, memory formation, and
Calcium regulated phosphorylation within the leucine zip
genomic structure of BDNF and Arc, Cell Rep., 17, 2418
per of C/EBP beta, Science, 256, 370 373.
2430.
91.
He, L., Sabet, A., Djedjos, S., Miller, R., Sun, X.,
104. Kim, S., Yu, N. K., Shim, K. W., Kim, J. I., Kim, H.,
Hussain, M. A., Radovick, S., and Wondisford, F. E.
Han, D. H., Choi, J. E., Lee, S. W., Choi, D. I., Kim, M. W.,
(2009) Metformin and insulin suppress hepatic gluconeo
Lee, D. S., Lee, K., Galjart, N., Lee, Y. S., Lee, J. H., and
genesis through phosphorylation of CREB binding protein,
Kaang, B. K. (2018) Remote memory and cortical synap
Cell, 137, 635 646.
tic plasticity require neuronal CCCTC binding factor
92.
Wang, J., Weaver, I. C., Gauthier Fisher, A., Wang, H.,
(CTCF), J. Neurosci., 38, 5042 5052.
He, L., Yeomans, J., Wondisford, F., Kaplan, D. R., and
105. Savell, K. E., Gallus, N. V., Simon, R. C., Brown, J. A.,
Miller, F. D. (2010) CBP histone acetyltransferase activity
Revanna, J. S., Osborn, M. K., Song, E. Y., O’Malley, J. J.,
regulates embryonic neural differentiation in the normal
Stackhouse, C. T., Norvil, A., Gowher, H., Sweatt, J. D.,
and Rubinstein Taybi syndrome brain, Dev. Cell, 18, 114
and Day, J. J. (2016) Extra coding RNAs regulate neuronal
125.
DNA methylation dynamics, Nat. Commun., 7, 12091,
93.
Gouveia, A., Hsu, K., Niibori, Y., Seegobin, M., Cancino,
doi: 10.1038/ncomms12091.
G. I., He, L., Wondisford, F. E., Bennett, S., Lagace, D.,
106. Балабан П. М., Бородинова А. А. (2019) Нейрогенети
Frankland, P. W., and Wang, J. (2016) The aPKC CBP
ческие технологии исследования механизмов хране
pathway regulates adult hippocampal neurogenesis in an
ния памяти, Рос. физиол. журн. им. И.М. Сеченова, 105,
age dependent manner, Stem Cell Rep., 7, 719 734.
1392 1405, doi: 10.1134/S0869813919110025.
БИОХИМИЯ том 85 вып. 9 2020
1158
БОРОДИНОВА, БАЛАБАН
EPIGENETIC REGULATION AS A BASIS FOR LONG)TERM
CHANGES IN THE NERVOUS SYSTEM:
IN SEARCH OF SPECIFICITY MECHANISMS*
Review
A. A. Borodinova** and P. M. Balaban
Institute of Higher Nervous Activity and Neurophysiology, Russian Academy of Sciences,
177485 Moscow, Russia; E)mail: borodinova.msu@mail.ru
Received June 1, 2020
Revised July 16, 2020
Accepted July 29, 2020
Adaptive long term changes in the functioning of nervous system (plasticity, memory) are not written in the genome,
but are directly associated with the changes in expression of many genes comprising epigenetic regulation.
Summarizing the known data regarding the role of epigenetics in regulation of plasticity and memory, we would like
to highlight several key aspects. (i) Different chromatin remodeling complexes and DNA methyltransferases can be
organized into high order multiprotein repressor complexes that are cooperatively acting as the “molecular brake
pads”, selectively restricting transcriptional activity of specific genes at rest. (ii) Relevant physiological stimuli induce
a cascade of biochemical events in the activated neurons resulting in translocation of different signaling molecules
(protein kinases, NO containing complexes) to the nucleus. (iii) Stimulus specific nitrosylation and phosphorylation
of different epigenetic factors is linked to a decrease in their enzymatic activity or changes in intracellular localization
that results in temporary destabilization of the repressor complexes. (iv) Removing “molecular brakes” opens a “crit
ical time window” for global and local epigenetic changes, triggering specific transcriptional programs and modula
tion of synaptic connections efficiency. It can be assumed that the reversible post translational histone modifications
serve as the basis of plastic changes in the neural network. On the other hand, DNA methylation and methylation
dependent 3D chromatin organization can serve a stable molecular basis for long term maintenance of plastic changes
and memory.
Keywords: memory, learning, epigenetics, gene expression, histone deacetylase, DNA methylation, nitric oxide
БИОХИМИЯ том 85 вып. 9 2020