БИОХИМИЯ, 2020, том 85, вып. 9, с. 1159 - 1188
УДК 577.053, 616 006.04, 615.277.3
РЕЦЕПТОР ЭПИДЕРМАЛЬНОГО ФАКТОРА РОСТА:
КЛЮЧ ДЛЯ СЕЛЕКТИВНОЙ ДОСТАВКИ В КЛЕТКИ*
Обзор
© 2020
А.А. Розенкранц1,2**, Т.А. Сластникова2
1 Московский государственный университет имени М.В. Ломоносова, биологический факультет,
119234 Москва, Россия; электронная почта: aar@igb.ac.ru
2 Институт биологии гена РАН, 119334 Москва, Россия
Поступила в редакцию 15.06.2020
После доработки 23.07.2020
Принята к публикации 23.07.2020
Рецептор эпидермального фактора роста (epidermal growth factor receptor, EGFR) - интегральный поверх
ностный белок, который обусловливает ответ клеток на ряд факторов роста. Увеличение его экспрессии и
активности за счет мутаций являются одними из наиболее часто встречающихся признаков клеток многих
видов рака. Разработка и клиническое применение средств блокирования активации EGFR стали ярким
примером использования персонализованной таргетной медицины. Несмотря на очевидные успехи этого
направления, в большинстве случаев излечение рака остается недостижимым. Причины этого, а также по
иск возможных путей преодоления сложностей лечения привели к появлению огромного количества разра
боток новых методов лечения, опирающихся на использование сверхэкспрессии EGFR и его изменений для
уничтожения раковых клеток. В обзоре рассмотрены и структурированы современные данные о строении,
функционировании и внутриклеточном транспорте EGFR, его природных лигандах, а также запускаемых
при активации EGFR сигнальных каскадах, особенностях экспрессии и активации EGFR при онкологичес
ких заболеваниях, а также о применяемых терапевтических подходах, направленных на блокировку сиг
нального пути EGFR. Подробно рассмотрены создаваемые подходы к адресной доставке внутрь раковых
клеток с увеличенной экспрессией EGFR различных химиотерапевтических средств, радионуклидов, им
мунотоксинов, фотосенсибилизаторов, а также перспективы генной терапии таких клеток мишеней. Необ
ходимо отметить, что все большее внимание уделяется разработке многофункциональных систем, как несу
щих несколько разных действующих агентов, так и обладающих несколькими зависящими от окружения
транспортными функциями. Обсуждается потенциал систем, основанных на рецептор опосредуемом эндо
цитозе EGFR, их возможные достоинства и ограничения.
КЛЮЧЕВЫЕ СЛОВА: рецептор эпидермального фактора роста, сверхэкспрессия, рак, эндоцитоз, направ
ленная терапия рака, доставка лекарств.
DOI: 10.31857/S032097252009002X
ВВЕДЕНИЕ
одним из наиболее изучаемых белков: количест
во научных публикаций в базе PubMed, описы
Рецептор эпидермального фактора роста
вающих изучение его структуры и свойств, а
(epidermal growth factor receptor, EGFR) является также функционирования в норме и патологии
приближается к ста тысячам. Несмотря на это,
Принятые сокращения: АФК - активные формы
многие аспекты его участия в регуляции процес
кислорода, МНТ - модульные нанотранспортеры, ПЭГ -
сов, протекающих в организме, остаются до сих
полиэтиленгликоль, ФС - фотосенсибилизатор, ЭО - пор недостаточно изученными, а постоянно
электроны Оже, ЭР - эндоплазматический ретикулум, увеличивающийся список создаваемых для воз
EGF - эпидермальный фактор роста, EGFR - рецептор
действия на него веществ и оценка их действия
эпидермального фактора роста, ErbB - гомолог В вирусно
го онкогена эритробластной лейкемии птиц (синоним
требуют периодического систематического ана
EGFR/HER), mAb - моноклональные антитела, PLGA -
лиза, позволяющего выбрать наиболее перспек
сополимер молочной и гликолевой кислот, TGFα - транс
тивные направления исследования и разработки
формирующий фактор роста альфа, PRMT1 - аргинин
новых лекарственных препаратов. Являясь ин
метилтрансфераза 1, ФДТ - фотодинамическая терапия.
тегральным поверхностным рецептором, EGFR
* Статья на английском языке опубликована в режиме
опосредует внешние сигналы целого семейства
Open Access (открытого доступа) на сайте издательства
регуляторных факторов, наиболее известными
вып. 9, 2020.
из которых являются эпидермальный фактор
** Адресат для корреспонденции.
роста (EGF) и трансформирующий фактор рос
1159
1160
РОЗЕНКРАНЦ, СЛАСТНИКОВА
та альфа (TGFα) [1]. Взаимодействие этих вне
твердым ядром, так и липосомы, мицеллы и им
клеточных сигнальных молекул с EGFR приво
подобные варианты, несущие цитотоксические
дит к активации нескольких внутриклеточных
вещества. Еще одним возможным вариантом
сигнальных каскадов: RAS/MAPK(ERK),
является использование EGFR для транспорта в
PI3K/AKT/mTOR и JAK/STAT, что способствует
раковые клетки с помощью вирусов или синте
пролиферации, ингибированию апоптоза и вы
тических систем доставки, генов, кодирующих
живаемости клеток [2, 3]. Особое внимание
фермент, превращающий пролекарство в цито
привлекает участие EGFR в канцерогенезе и
токсический продукт. Современные направле
возможность использования этого рецептора
ния специфичной для раковых клеток доставки
для лечения онкологических заболеваний. Ак
цитотоксического начала внутрь клеток с повы
тивация EGFR является одним из факторов,
шенной экспрессией EGFR, их перспективы и
способствующих эпителиально мезенхималь
ограничения являются основной темой настоя
ному переходу, который приводит к появлению
щего обзора.
фенотипа раковых стволовых клеток [4]. Его му
тации и увеличение экспрессии часто приводят
к возникновению и прогрессии злокачествен
EGFR КАК КОМПОНЕНТ
ных новообразований [5]. Увеличение количест
СИГНАЛЬНОЙ СЕТИ
ва EGFR в клетке встречается при многих онко
логических заболеваниях (см. раздел «Экспрес
Активация EGFR приводит к целому ряду
сия EGFR при онкологических заболеваниях»).
биологических реакций, включая пролифера
Поэтому естественно, что EGFR является од
цию клеток, миграцию и выживание, которые в
ним из значимых объектов таргетной терапии.
норме призваны обеспечивать сохранность и
Такие препараты, как цетуксимаб, панитумумаб,
регенерацию эпителия. Именно эти свойства
нимотузумаб и нецитумумаб, представляющие
делают нарушение регуляции EGFR важным и
собой моноклональные антитела к EGFR, пре
часто необходимым звеном развития многих ви
дотвращающие активацию EGFR природными
дов онкологических заболеваний. Этот рецеп
лигандами, уже широко применяются в клини
тор принадлежит к одному из семейств тирозин
ке. Другим вариантом таргетной терапии, на
киназ (ErbB или HER), состоящему из 4 х близ
правленной на EGFR, является использование
кородственных мембранных рецепторов:
специфических ингибиторов фосфорилирова
EGFR/ErbB1/HER1, Neu/ErbB2/HER2, ErbB3/
ния, к которым относятся гефитиниб, эрлоти
HER3, ErbB4/HER4. Все рецепторы ErbB (от
ниб, лапатиниб, афатиниб и ряд других (см. раз
avian erythroblastic leukemia viral oncogene B
дел «Успехи и ограничения направленной бло
homolog - гомолог В вирусного онкогена эрит
кировки сигнального пути EGFR»). К сожале
робластной лейкемии птиц) человека являются
нию, далеко не все варианты опухолей с повы
крупными трансмембранными белками, содер
шенной экспрессией EGFR или его мутациями
жат богатую цистеинами внеклеточную часть,
с конститутивной активацией фосфорилирова
единственный трансмембранный участок и
ния отвечают на воздействие вышеупомянутых
внутриклеточную цитоплазматическую часть,
антител и ингибиторов из за независимой акти
состоящую из примембранного, тирозинкиназ
вации нижележащих звеньев сигнальных цепей
ного и С концевого доменов [6]. Внеклеточную
(киназ семейств RAS, BRAF), прежде всего,
часть EGFR, как и других ErbB, подразделяют
KRAS и BRAF, что делает применяемую тера
на четыре домена, причем для связывания ли
пию, направленную на EGFR, неэффективной.
ганда требуются контакты EGFR с доменами I и
Вариантом преодоления неэффективности в
III. При этом происходит изменение конформа
таких случаях является использование рецеп
ции рецептора, которое обеспечивает появле
тор опосредуемого эндоцитоза EGFR для спе
ние выступающей «ручки» в домене II внекле
цифической таргетной доставки в раковые клет
точной части рецептора. Выступающая «ручка»
ки с повышенной экспрессией этого рецептора
получает возможность взаимодействовать с со
различных терапевтических, прежде всего, ци
ответствующей структурой другого ErbB. В
тотоксических агентов, что позволяет уничто
обычном, не активированном, состоянии появ
жать раковые клетки независимо от активации
лению этой димеризационной «ручки» препят
нижележащих сигнальных цепей. Для этой цели
ствует взаимодействие домена II c IV доменом
создаются как конъюгаты цитотоксических ве
рецептора. Лиганд, взаимодействуя с I и III до
ществ с лигандами EGFR (как с природными,
менами рецептора, высвобождает «ручку» для
так и с синтетическими), так и более сложные
взаимодействия с соседним рецептором [7]. Не
молекулярные и надмолекулярные конструк
активные молекулы EGFR существуют на поверх
ции. К ним можно отнести наночастицы как с
ности клеток в основном в виде мономеров не
БИОХИМИЯ том 85 вып. 9 2020
ИСПОЛЬЗОВАНИЕ EGFR ДЛЯ ДОСТАВКИ ЛЕКАРСТВ В КЛЕТКИ
1161
активных димеров и некоторой доли олигоме
распределения в плазматической мембране.
ров, которые находятся в равновесии друг с дру
Часть EGFR находится в олигомеризованном
гом [8]. Активация EGFR контролируется извне
состоянии, что обеспечивает возможность фос
клетки соответствующими лигандами и приво
форилирования нескольких рецепторов в ответ
дит к образованию его гомодимеров и гетероди
на один связанный лиганд при низкой концен
меров с другими ErbB. Связывание активирую
трации добавленного лиганда [18]. Как показы
щего лиганда приводит к сдвигу равновесия в
вают наблюдения за единичными молекулами,
сторону димеризации с образованием активных
подвижность EGFR сменяется несколькими
димеров и активации предсуществующих диме
разными короткоживущими состояниями: сво
ров. Это приводит к активации тирозинкиназ
бодным, ограниченным в перемещении и не
ного домена и специфическому фосфорилиро
подвижным. В неподвижном состоянии EGFR
ванию остатков тирозина цитоплазматической
имеет тенденцию олигомеризоваться в покры
части рецептора партнера в димере. К последо
тых клатрином ямках, перекрестное фосфори
вательностям с фосфорилированными остатка
лирование в которых дополнительно усиливает
ми тирозина присоединяются соответствующие
проходящий сигнал [19]. По видимому, олиго
внутриклеточные сигнальные молекулы, что
меры могут быть сопряжены и с другими струк
обеспечивает активацию сети взаимодействую
турами, обеспечивающими эндоцитоз [20].
щих внутриклеточных сигнальных путей [9]. Та
Фосфорилирование EGFR и его часто сверх
ким образом, реализация сигнала от связывания
экспрессированного при ряде видов рака парт
внеклеточного регуляторного лиганда с рецеп
нера ErbB2 стимулирует такие внутриклеточные
тором, происходит с помощью фосфорилирова
регуляторные пути, как RAS/RAF/MEK/ERK,
ния не только самого EGFR в результате гомо
PI3K/AKT/TOR, Src киназы и факторы тран
димеризации, но и его партнеров, в первую оче
скрипции STAT [3]. Эти регуляторные пути
редь, ErbB2, не имеющего собственного внекле
можно рассматривать в качестве компонентов
точного регуляторного лиганда [1]. В сущест
сложной регуляторной сети, с большим количе
венно меньшей степени прохождение сигнала
ством положительных и отрицательных обрат
от EGFR в клетку обеспечивается остальными
ных связей. Сигнальная сеть, на которую оказы
рецепторами этого семейства ErbB3 [10, 11] и
вает влияние EGFR, насчитывает более 300
ErbB4 [12], которые являются тканеспецифич
компонентов, связанных более чем двумя сот
ными и экспрессируются в основном в нервной
нями реакций [21]. Сигнализация EGFR тонко
ткани. Известно также, что, кроме родственных
настраивается в клетках с помощью множества
ErbB рецепторов, EGFR может образовывать
координированных механизмов, включая регу
димеры в мембране с другими рецепторными
ляцию фосфатазами, обратными связями ниже
тирозинкиназами. Взаимодействие активиро
лежащих звеньев сигнальной цепи, эндоцито
ванного EGFR c рецепторами тромбоцитарного
зом и внутриклеточным транспортом [21]. Спе
фактора роста бета [13, 14], рецепторами факто
цифичность, направление и величина клеточно
ра роста гепатоцитов/фактора мезенхимально
го ответа определяются экспрессией положи
эпителиального перехода (mesenchymal epithe
тельных и отрицательных регуляторов, активи
lial transition factor receptor, MET)
[15] и
рующим лигандом, компонентами димеров ре
родственного ему RON [16], а также рецептором
цепторов и набором белков, взаимодействую
инсулиноподобного фактора роста 1 (IGF1R)
щих с фосфорилированными тирозинами C
[17] приводит к их фосфорилированию и к фи
концевых доменов тирозинкиназных рецепто
зиологически, и терапевтически значимым ре
ров.
зультатам в активируемых через эти рецепторы
регуляторных внутриклеточных путях (рис. 1).
Это означает, что ответ клетки на связывание
ПРИРОДНЫЕ ЛИГАНДЫ EGFR
лиганда с EGFR определяется не только нали
чием и количеством этого рецептора, но зависит
В нормальных клетках активация тирозин
также от набора и количества рецепторов парт
киназной функции EGFR строго регулируется
неров на клеточной поверхности. Кроме этого,
извне достаточно большим набором природных
ответ клетки на внешний сигнал зависит еще и
полипептидных лигандов. Эта регуляция кон
от свойств связывающегося с EGFR фактора
центрационно зависима, сродство EGF к моно
роста (см. раздел «Природные лиганды EGFR»).
мерному рецептору существенно выше, чем к
Дополнительный уровень регуляции про
димеру, с которым уже связана одна молекула
хождения сигнала обеспечивает необходимость
EGF, что может быть интерпретировано как на
встречи с другим рецептором, что зависит от
личие отрицательной кооперативности [22]. На
диффузионных свойств рецептора и его микро
иболее известным лигандом EGFR является
БИОХИМИЯ том 85 вып. 9 2020
1162
РОЗЕНКРАНЦ, СЛАСТНИКОВА
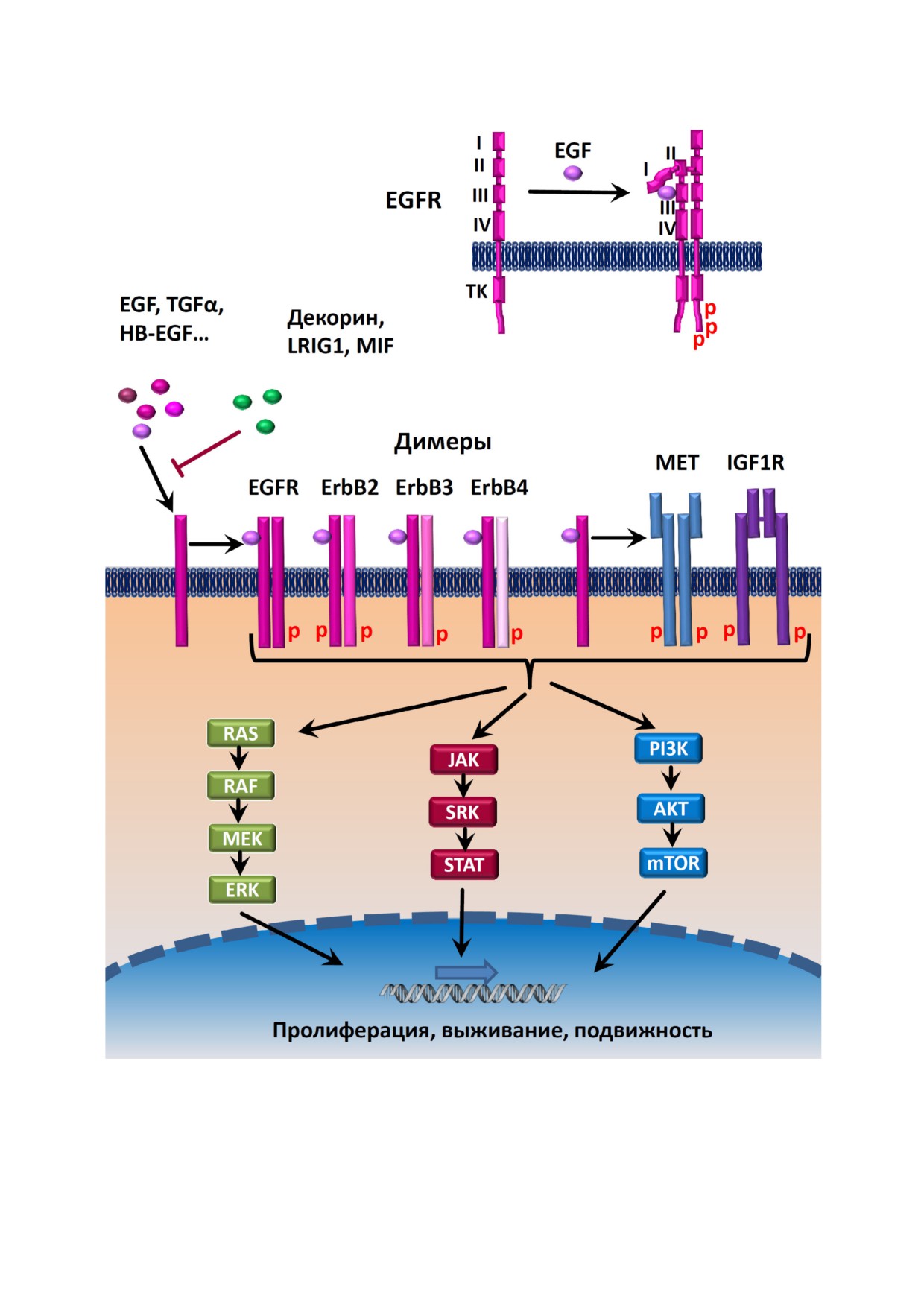
Рис. 1. Принципиальная схема основных сигнальных путей сети, активируемых EGFR. I-IV - внеклеточные домены
EGFR, TK - тирозинкиназный домен, P - фосфорилированные тирозины, MET - рецептор фактора мезенхимально
эпителиального перехода, IGF1R - рецептор инсулиноподобного фактора роста 1. (С цветными вариантами рис. 1 и 2
БИОХИМИЯ том 85 вып. 9 2020
ИСПОЛЬЗОВАНИЕ EGFR ДЛЯ ДОСТАВКИ ЛЕКАРСТВ В КЛЕТКИ
1163
EGF. Другие природные лиганды подобны ему
ных, чем при связывании EGF и TGFα коротко
по структуре: основной особенностью этих мо
живущих димеров. Тем не менее эта ослаблен
лекул является наличие трех дисульфидных
ная димеризация рецепторов приводит к более
мостиков, которые определяют жесткую трех
длительной устойчивой сигнализации, вызывая
мерную структуру белка (EGF подобный до
дифференцировку клеток рака молочной желе
мен). Именно эта трехмерная структура в значи
зы и не приводя к пролиферации клеток, как это
тельной мере, наряду с конкретными аминокис
делает EGF [32]. Природные лиганды EGFR мо
лотными последовательностями, взаимодей
гут различаться также по способности индуци
ствующими с I и III внеклеточными доменами,
ровать образование димеров семейства ErbB,
по видимому, определяет взаимодействие с
что также может вызывать разные биологичес
центром связывания рецептора [23]. Большин
кие эффекты при активации через EGFR разны
ство лигандов ErbB рецепторов образуется из
ми лигандами в одной и той же клетке. Радиоли
больших трансмембранных предшественников,
гандный анализ показал, что сродство EGF и
протеолитическое расщепление которых приво
TGFα к гетеродимерам EGFR/ErbB2 выше, чем
дит к образованию растворимого фактора роста.
сродство к гомодимерам EGFR, в то время как
В настоящее время известно уже более дюжины
бетацеллюлин и амфирегулин показали одина
природных полипептидов, которые могут с раз
ковое сродство к обоим димерам. Амфирегулин
ной эффективностью и результатом взаимодей
проявляет свойства частичного агониста, что
ствовать с внеклеточной частью ERGR. EGF,
отражается в более низком уровне фосфорили
TGFα, амфирегулин связываются с EGFR, тог
рования рецепторов, индуцируемого им по
да как бетацеллюлин, гепарин связывающий
сравнению с EGF, TGFα и бетацеллюлином
фактор роста и эпирегулин, помимо EGFR, мо
[33]. В отличие от других лигандов, амфирегу
гут также активировать ErbB4 [9]. Недавно было
лин показывает двухфазную кинетику образова
показано, что EGFR активируется путем связы
ния димеров, что позволяет предположить, что
вания с ним также одним из ключевых регулято
его путь активации EGFR включает связывание
ров ангиогенеза - ангиогенином. Ангиогенин
как с мономерами, так и с предсуществующими
связывается с EGFR с достаточно высоким
неактивными димерами. В отличие от него,
сродством (~40 нМ) и, кроме этого, обладает
EGF, TGFα и бетацеллюлин, по видимому, в ос
также слабой РНКазной активностью, что отра
новном активируют рецептор через связывание
жает его другое название - RNase 5 [24, 25]. Два
с мономерами рецептора и его димеризацию
фактора роста, неурегулины 2α и 2β, основными
[33]. Таким образом, отличия в биологическом
рецепторами которых являются ErbB3 и ErbB4,
ответе на различные лиганды EGFR могут быть
могут также связываться и активировать EGFR
результатом нескольких процессов: полного или
[26, 27]. Кроме агонистов у EGFR имеются так
частичного агонизма в отношении образования
же естественные антагонисты. Протеогликан
димеров, различий в кинетическом пути генера
декорин связывается с EGFR c наномолярным
ции димеров активированных рецепторов и до
сродством [28] и приводит к уменьшению коли
ле образования гетеродимеров ErbB по сравне
чества рецептора на поверхности клетки за счет
нию с гомодимерами.
кавеолинового эндоцитоза и последующей дег
Еще один путь регуляции сродства лигандов
радации рецептора [29]. Гомолог декорина - от
к EGFR осуществляется путем метилирования
щепленный растворимый внеклеточный домен
внеклеточной части рецептора аргинин метил
LRIG1 (Leucine rich repeats and immunoglobulin
трансферазой (PRMT1), что может обеспечить
like domains 1) также способен взаимодейство
трехкратное увеличение сродства лигандов к
вать с EGFR с наномолярным сродством и кон
EGFR [34]. Нокдаун PRMT1 или отсутствие со
курировать с EGF за связывание [30]. Фактор,
ответствующих аргининов (R198 и R200) умень
ингибирующий миграцию макрофагов (MIF),
шают сродство к EGFR как EGF и TGFα [34],
известный регулятор врожденного иммунитета
так и ангиогенина/RNase 5 [35]. Метилирование
может блокировать активацию EGFR за счет
этих аргининов, дестабилизирует взаимодей
связывания с внеклеточным доменом рецептора
ствие между II и IV доменами внеклеточной час
[31].
ти EGFR, что облегчает взаимодействие лиган
В последнее время стало ясно, что разные
дов с I и III доменами, вызывает изменение кон
природные лиганды EGFR стабилизируют раз
формации и димеризацию рецепторов. Экзоген
личающиеся по структуре димеры рецепторов,
ная экспрессия PRMT1 повышает сродство ли
что приводит к разным физиологическим по
ганда к EGFR и активирует опосредованные ре
следствиям [32]. Эпирегулин и эпиген, которые
цептором дальнейшие сигнальные события [34].
можно рассматривать как частичные агонисты
Имеющаяся к настоящему моменту сумма
EGFR, индуцируют образование менее стабиль
сведений о связывании факторов роста и других
БИОХИМИЯ том 85 вып. 9 2020
1164
РОЗЕНКРАНЦ, СЛАСТНИКОВА
природных лигандов с EGFR вряд ли в полной
дятся несколько сигналов интернализации, ко
мере описывается в терминах изотермы адсорб
торые демаскируются при связывании лиганда.
ции Ленгмюра с единственным значением
К ним относятся два разных мотива распознава
константы диссоциации и количеством мест
ния субъединиц адапторного белка 2 (AP2), ко
связывания на клетку, что является усредненной
торый связывает мембранные белки с клатрино
и огрубленной моделью реального процесса. Об
вой решеткой [38]. Некоторые фосфотирозины
этом свидетельствует наличие отрицательной
в цитоплазматическом хвосте EGFR после фос
кооперативности, образование димеров с рецеп
форилирования также обеспечивают присоеди
торами партнерами, уже известные ковалент
нение E3 убиквитин лигазы Cbl как напрямую
ные модификации, влияющие на связывание,
[39], так и через еще один адапторный белок
гетерогенность клеток, динамический процесс
Grb2 [40], который связывает фосфорилирован
изменения доступных для связывания рецепто
ный рецептор с E3 убиквитин лигазой Cbl. Это
ров на поверхности клетки. Более уверенно
обеспечивает активацию сигнального каскада
можно говорить об интервале значений конс
RAS/MAPK и эндоцитоз EGFR. Такое дублиро
тант диссоциации комплекса лиганд-рецептор,
ванное взаимодействие между Cbl и EGFR не
который для EGF находится в диапазоне от до
обходимо для стабильного привлечения Cbl и
лей до единиц наномолей на литр, что для раз
эффективного убиквитинирования рецепторов
ных объектов может отражать как наличие отри
[41]. Необходимо отметить, что множественное
цательной кооперативности, так и добавление
убиквитинирование является не единственным
влияния какого то другого фактора. Такими
фактором, влияющим на эндоцитоз EGFR. Да
факторами могут быть образование комплекса с
же замена 15 остатков лизина в его киназной
рецепторами партнерами (например, с ErbB2),
части, приводящая к почти полному подавле
разная степень метилированности значимых
нию убиквитинирования, может не приводить к
для связывания аргининов, наличие мутаций в
существенному подавлению интернализации
части рецепторов. Такие варианты могут быть
[42]. Клатрин зависимый эндоцитоз активиро
также описаны через наличие нескольких раз
ванного EGFR регулируется несколькими меха
личающихся по сродству субпопуляций рецеп
низмами, функционирующими избыточным и
торов.
кооперативным образом, включая убиквитини
рование киназного домена рецептора и С кон
цевых остатков лизина, а также адапторных бел
ЭНДОЦИТОЗ И ДАЛЬНЕЙШИЙ
ков AP 2 и Grb2 [43]. Сложности регуляции эн
ВНУТРИКЛЕТОЧНЫЙ ТРАНСПОРТ
доцитоза EGFR добавляет наличие еще одного
механизма ковалентной модификации рецепто
Для EGFR, как и для множества поверхност
ра, помимо убиквитинирования. EGFR также
ных клеточных рецепторов, опосредующих от
модифицируется убиквитин подобной молеку
вет на внешние регуляторные сигналы, эндоци
лой Nedd8 (Neural Precursor Cell Expressed,
тоз служит обычным способом снижения ответа
Developmentally Down Regulated 8) [44]. Эта мо
путем отрицательной обратной связи. Дополни
дификация катализируется Cbl в комплексе с
тельная регуляция обеспечивается сортировкой
Nedd8 специфической лигазой E2 (Ubc12) и об
интернализованного рецептора, который может
легчает присоединение остатков убиквитина с
быть направлен обратно на плазматическую
помощью Cbl и лигазы UbcH7. Такая сложность
мембрану, на деградацию в лизосомы или в дру
и многократное дублирование механизмов, вов
гие клеточные компартменты, в которых он до
леченных в интернализацию активированного
полнительно регулирует клеточные процессы
EGFR, делают этот процесс устойчивым к воз
[36]. В отсутствие лигандов EGFR интернализу
мущениям (например, мутациям или измене
ется медленно: культуры клеток, экспрессирую
нию экспрессии компонентов механизма эндо
щих умеренное количество EGFR (<200 000 ре
цитоза) [38]. В частности, для того чтобы суще
цепторов на клетку), показывают t1/2 (время по
ственно подавить клатриновый эндоцитоз
луобновления) в диапазоне 6-10 ч, тогда как в
EGFR необходимо одновременное предотвра
клетках с аномально высокой экспрессией
щение (например, за счет мутирования) работы
EGFR, таких как эпидермоидная карцинома че
мотивов, связывающих AP2, множественного
ловека А431 (~ 2 миллиона рецепторов на клет
убиквитинирования и ацетилирования EGFR
ку), t1/2 может достигать суток и более. Связыва
[43]. Возможным объяснением устойчивости
ние лиганда и активация тирозинкиназы приво
процесса эндоцитоза EGFR является также су
дит к быстрому эндоцитозу и многократно уве
ществование дублирующих друг друга клатрин
личивает константу скорости эндоцитоза EGFR
зависимых и клатрин независимых процессов.
[37]. В цитоплазматической части EGFR нахо
Клетки могут убирать активированный EGFR с
БИОХИМИЯ том 85 вып. 9 2020
ИСПОЛЬЗОВАНИЕ EGFR ДЛЯ ДОСТАВКИ ЛЕКАРСТВ В КЛЕТКИ
1165
поверхности несколькими разными путями: при
эндоцитоза необходимо убиквитинирование
помощи клатрин зависимого, клатрин незави
EGFR, поскольку мутации, препятствующие
симого, эндофилин зависимого эндоцитоза и
присоединению убиквитина, ингибируют и эн
макропиноцитоза [45]. Во всех типах клеток,
доцитоз [41]. Этот вариант эндоцитоза EGFR
экспрессирующих рецептор, в ответ на добавле
зависит от обогащенных холестерином доменов
ние лиганда EGFR интернализуется с помощью
плазматической мембраны, но не зависит от ка
быстрого клатрин зависимого эндоцитоза при
веолина [36].
всех физиологических концентрациях EGF [36].
Независимо от пути интернализации EGFR
Заметная часть EGFR, поступающего в клетку
поступает в ранние эндосомы, где происходит
таким путем, возвращается обратно на плазма
их сортировка для регуляции ответа на связыва
тическую мембрану [46], что может осущес
ние лиганда с EGFR. Пути дальнейшего транс
твляться двумя путями с разным временным ин
порта EGFR оказывают существенное влияние
тервалом [47]. Клатрин зависимый эндоцитоз,
на регуляторные процессы в клетке, способ
по видимому, является насыщаемым, что стано
ствуя сбалансированности ответа на поступив
вится заметным при высокой экспрессии рецеп
ший сигнал, что подробно рассмотрено в не
тора, и при более высоких концентрациях до
скольких обзорах [36, 53]. Как уже было отмече
бавленного EGF (> 2 нМ) во многих типах кле
но, двумя основными направлениями транспор
ток подключаются более медленные клатрин
та EGFR являются путь в лизосомы для деграда
независимые виды эндоцитоза [36]. Кроме того,
ции EGFR, что приводит к снижению ответа на
при достаточно высоких концентрациях лиган
стимуляцию рецептора, и его возвращение об
да, превышающих в несколько раз значение
ратно на плазматическую мембрану для продол
константы диссоциации комплекса лиганд-ре
жения ответа на поступивший сигнал. Однако
цептор, на эндоцитозе начинает сказываться и
некоторая небольшая часть рецепторов через
насыщение рецептора лигандом. Это делает
COP1 зависимый везикулярный транспорт по
дальнейшее увеличение концентрации лиганда
падает из эндосом в эндоплазматический рети
малоэффективным с точки зрения его транс
кулум (ЭР) [54]. Кроме этого, известны и допол
порта в клетку при помощи рецептор опосреду
нительные варианты транспорта EGFR в ядро
емого эндоцитоза.
(обсуждается ниже) и митохондрии. Транспорт
Кроме клатрин зависимого эндоцитоза су
активированного EGFR в митохондрии зависит
ществует также быстрый эндофилин зависи
от c Src и может приводить к фосфорилирова
мый эндоцитоз, который активен, по видимо
нию субъединицы COXII цитохром с оксидазы
му, на переднем крае мигрирующей клетки, и
в клетках рака молочной железы, что было пока
необходим для пространственно ограниченной
зано при помощи добавления c Src и EGFR к
EGF зависимой передачи сигналов [45]. Дан
иммунопреципитатам COХII или к очищенному
ный вариант поглощения EGFR опосредуется
фрагменту COXII
[55]. Такое перемещение
CBL, адапторным белком CIN85 и зависит, как
EGFR увеличивает устойчивость клеток к апоп
и клатрин зависимый эндоцитоз, от наличия
тозу [56]. Обнаружено также, что транспорт
динамина [45, 48].
EGFR в митохондрии клеток немелкоклеточно
Тип эндоцитоза EGFR может также зависеть
го рака легких приводит к увеличению инвазив
и от лиганда, связавшегося с рецептором. Так,
ности и появлению метастазов [57, 58]. Однако
например активация EGFR в результате связы
доля рецептора, оказывающегося в митохондри
вания EGF или TGFα, приводила в клетках
ях, крайне невелика, ~2% фосфорилированного
HeLa только к клатрин зависимому эндоцитозу,
EGFR оказываются в митохондриях [57].
тогда как гепарин связывающий EGF подоб
ный фактор роста (HB EGF) и бетацеллюлин
стимулировали как клатрин опосредованные,
ТРАНСПОРТ EGFR В ЯДРО
так и клатрин независимые варианты поглоще
ния [49]. Поглощение EGFR может осущест
Внутриклеточная примембранная часть
вляться и с помощью макропиноцитоза, что
EGFR содержит трехчастный сигнал ядерной
наблюдается в ответ на стимуляцию EGF в клет
локализации (RRRHIVRKRTLRR), который
ках A431 [50, 51], или через формирующиеся из
опосредует появление небольшой доли полно
дорзальных складок клеточной мембраны вези
размерного рецептора в ядре клетки после акти
кулярно трубчатые структуры, образование ко
вации рецептора [59]. Похожие трехчастные
торых зависит от динамина и фосфоинозитид
сигналы есть и в остальных ErbB. Транспорт
киназы PI3, происходящих из дорсальных скла
EGFR от плазматической мембраны в ядро не
док плазматической мембраны [51, 52]. Необхо
является систематическим постоянным ответом
димо отметить, что для клатрин независимого
на связывание лиганда с рецептором, но, ско
БИОХИМИЯ том 85 вып. 9 2020
1166
РОЗЕНКРАНЦ, СЛАСТНИКОВА
рее, наблюдается в определенных тканях или
тастазировании, репарации ДНК, а также обес
при определенных условиях [60]. Этот транс
печивает устойчивость к повреждающему ДНК
порт происходит в результате эндоцитоза и тре
излучению и алкилирующим противораковым
бует импортина β1, что указывает на прохожде
агентам [63].
ние через ядерную пору [61]. Процесс нахожде
ния EGFR в ядре является контролируемым, на
что указывает и наличие у EGFR функциональ
ЭКСПРЕССИЯ EGFR
ного сигнала ядерного экспорта [61]. EGFR
ПРИ ОНКОЛОГИЧЕСКИХ
транспортируется в ядро в комплексе с EGF [62]
ЗАБОЛЕВАНИЯХ
и обнаруживается как в нуклеоплазме, так и во
внутренней ядерной мембране [63]. Лиганды
Активация EGFR при малигнизации может
EGFR по разному влияют на возможность это
быть вызвана повышенным содержанием ре
го транспорта: так, добавление EGF, TGFα, HB
цепторов, увеличенной аутокринной или парак
EGF и бетацеллюлина приводило к дозозависи
ринной продукцией активирующего фактора
мому накоплению EGFR в ядрах клеток адено
роста и изменением собственной тирозинки
карциномы печени человека, тогда как амфире
назной активности в результате мутаций. Часто
гулин и эпирегулин не оказывали такого
причиной активации EGFR является сочетание
действия [64]. Механизмы, приводящие к ядер
сразу нескольких факторов, что усложняет по
ному накоплению рецептора, остаются не до
иск лечения.
конца ясными до настоящего момента, возмож
Одной из наиболее частых причин актива
но, что EGFR оказывается в ядре несколькими
ции EGFR является увеличение его экспрессии.
путями [60, 63, 65, 66]. Из эндосом рецепторы
Причиной этого может быть не только ампли
могут попадать в ЭР и выходить в цитозоль при
фикация гена, но и усиление его транскрипции,
помощи ретроградного транспорта через транс
трансляции, уменьшение деградации рецептора
локон Sec61, который обеспечивает как транс
и изменение в экспрессии некодирующих РНК
порт вновь синтезируемых белков в ЭР, так и пе
[70-72]. Приводимые в разных работах оценки
ремещение неправильно свернутых белков об
экспрессии EGFR для разных онкологических
ратно в цитозоль. Несколько исследований по
заболеваний сильно варьируют, что зависит от
казали, что EGFR взаимодействует с Sec61β, од
стадии заболевания, использованной ранее те
ной из трех субъединиц транслокона [67, 68].
рапии, популяции, метода исследования (опре
Однако, где происходит перемещение EGFR че
деление мРНК, иммуногистохимия), оценивае
рез этот транслокон, почему этому не мешает
мого параметра, используемых антител, време
гликозилированность рецептора и каким обра
ни хранения препаратов. В некоторых случаях
зом в ядре он оказывается в комплексе с лиган
было обнаружено достаточно большое увеличе
дом, неизвестно. Непонятно также, что обеспе
ние экспрессии EGFR. Так, при раке головы и
чивает растворимость EGFR в нуклеоплазме.
шеи содержание мРНК EGFR увеличивается в
Среди предлагаемых путей транспорта EGFR в
среднем в 69 раз по сравнению с нормальной
ядро отмечают выход его в цитозоль из ЭР с пос
тканью [73]. Прямого однозначного соответ
ледующим транспортом через ядерную пору и
ствия между мРНК и экспрессией белка иссле
транспорт в виде интегрального белка до наруж
дования не выявляют, а иммуногистохимичес
ной оболочки ядра и далее через периферичес
кое выявление экспрессии не является строго
кие каналы ядерной поры. Возможен также пря
количественным, и кроме того, подвержено
мой транспорт некоторой фракции эндосом к
влиянию многих не всегда учитываемых факто
ядру с последующим слиянием с ядерной обо
ров [74]. В тех случаях, когда в исследованиях
лочкой и транспортом через ядерную пору на
использовали несколько методов, иммуногис
внутреннюю мембрану ядра [69]. Поскольку
тохимическое окрашивание показывает мень
Sec61 был обнаружен во внутренней мембране
шую частоту встречаемости сверхэкспрессии
ядерной оболочки, возможно, EGFR проникает
EGFR по сравнению с увеличением уровня
в ядро непосредственно из нее [67].
мРНК. Так, выявляемая сверхэкспрессия, по
Внутри ядра EGFR может взаимодейство
данным иммуногистохимических исследова
вать с транскрипционными факторами STAT3,
ний, при колоректальном раке составляла 61%,
STAT5, E2F1, фосфорилировать ядерный анти
по анализу мРНК - 79% и при выявлении од
ген пролиферирующих клеток (PCNA), обеспе
ним из двух способов - 82% [75]. В одном и том
чивая ускорение пролиферации и репарацион
же исследовании образцов немелкоклеточного
ных процессов, и увеличивать радиорезистент
рака легкого в зависимости от выбранных ком
ность клеток. Благодаря этому ядерный EGFR
мерческих антител сверхэкспрессия EGFR
участвует в пролиферации, опухолегенезе, ме
варьировала в диапазоне 5-56% [76]. Тем не ме
БИОХИМИЯ том 85 вып. 9 2020
ИСПОЛЬЗОВАНИЕ EGFR ДЛЯ ДОСТАВКИ ЛЕКАРСТВ В КЛЕТКИ
1167
нее именно этот вариант оценки экспрессии
иммуногистохимии, для полноты картины при
EGFR позволяет получить данные по содержа
ведены данные из предыдущих обзоров, в части
нию рецептора, суммирующие изменения тран
которых цитированы работы как проведенные с
скрипции, трансляции и деградации белка. Ча
использованием иммуногистохимии, так и с
ще всего при этом в зависимости от интенсив
использованием других методов. Необходимо
ности окраски препараты распределяют по нес
также отметить, что эти данные трудно соотно
кольким группам (обычно четырем), относя к
симы с получаемыми при работе на клеточных
повышенной экспрессии одну или две группы с
культурах величинами количества рецепторов
наиболее выраженной экспрессией рецептора.
на клетку и соответствуют изменениям относи
Анализ большого числа проведенных исследо
тельно содержания рецептора в той же нор
ваний позволяет выявить те онкологические за
мальной ткани. В ряде случаев (рак мочевого
болевания, при которых увеличение экспрес
пузыря, глиомы, рак головы и шеи, рак легкого)
сии EGFR является существенным (табл. 1).
это дает основания для разработки местных
Все экспериментальные работы, цитированные
таргетных методов терапии с использованием
в таблице, были проведены с использованием
радионуклидов, фотосенсибилизаторов, нано
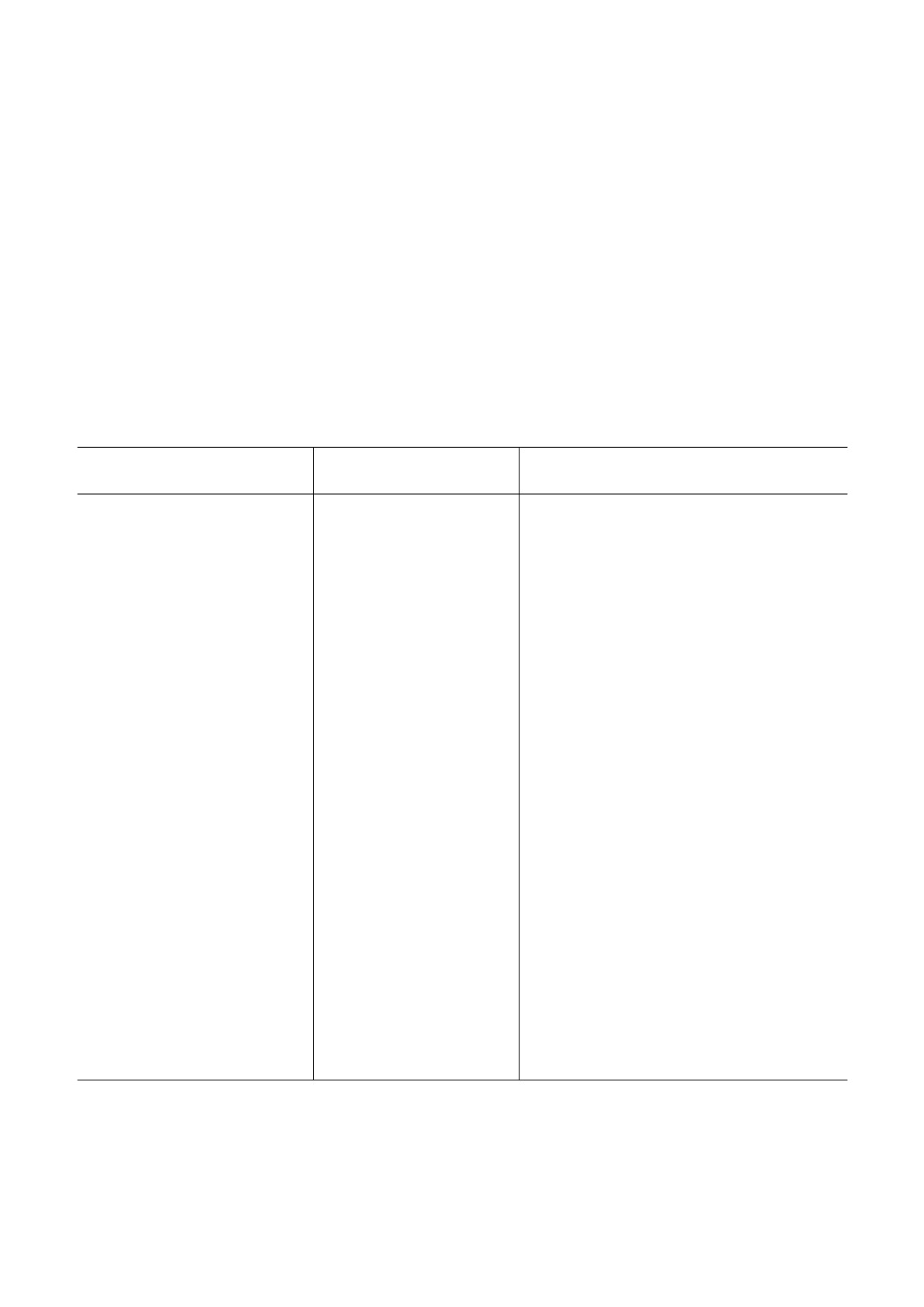
Таблица 1. Частота увеличенной экспрессии EGFR при онкологических заболеваниях
Заболевание
Процент опухолей со
Источник
сверхэкспрессией EGFR
Рак головы и шеи
80-100
обзор [79]
38-92
обзор [80]
46, 68, 56-85, 49, 68
[81], [82], [83], [84], [85]
Рак шейки матки
70-90
обзор [86]
30-98
обзор [87]
18-87
обзор [88]а
76-79
[89]
Мезотелиома
44-97
обзор [70]
Рак толстой кишки
25-77
обзор [79]
61, 53, 39, 62
[75], [90], [91], [92]
Рак поджелудочной железы
30-89
обзор [93]
30-95
обзор [94]
40-70
обзор [95]
42-64
[96]
Немелкоклеточный рак легкого
40-80
обзор [79]
32-100
обзор [76]б
56
[76]в
Рак молочной железы
14-91
обзор [79]
2-60
обзор [97]г
Рак яичников
35-70
обзор [79]
9-62
обзор [98]
46-64, 57
[99], [100]
Глиома
40-63
обзор [79]
68, 65
[101], [102]
Рак мочевого пузыря
31-48
обзор [79]
27, 74, 71
[103], [104], [105]
Нейроэндокринные опухоли
42-100
обзор [106]д
28-57, 87
[107], [108]
а - Средневзвешенное - 48,5% по 20 работам с использованием иммуногистохимии и 1823 пациентам; б - средневзвешен
ное - 49,8% по 15 исследованиям и 2399 пациентам с одинаковыми mAb; в - 71% - плоскоклеточный рак, 48% - адено
карцинома; г - средневзвешенное 21,4% по 36 иммуногистохимическим исследованиям и 12 066 пациентам; д - тимома,
средневзвешенное - 70,5%, по 8 иммуногистохимическим исследованиям и 227 пациентам.
БИОХИМИЯ том 85 вып. 9 2020
1168
РОЗЕНКРАНЦ, СЛАСТНИКОВА
частиц, реагирующих на различные типы излу
количество разнообразных искусственных по
чения.
липептидов, способных к связыванию с внекле
В целом, повышенная экспрессия EGFR яв
точными доменами EGFR: к настоящему време
ляется одним из наиболее частых событий, ре
ни их насчитывается ~40 [109]. Они включают в
гистрируемых при онкологических заболевани
себя химерные антитела, фрагменты антител,
ях. Так, при анализе опухолей с неизвестным
однодоменные антитела, антителомимиетики,
первичным происхождением экспрессия EGFR
сконструированные на основе различных кар
была обнаружена в 55% случаев, причем ампли
касных белков: DARPin на основе анкириновых
фикация его гена (17%) оказалась наиболее час
повторов, аффибоди на основе Z домена белка
тым событием среди всех проанализированных
A, аднектинов на основе 10 го домена фибро
маркеров [77].
нектина III типа. Вариантами, успешно дошед
Гетерогенность тех изменений, которые при
шими до широкого терапевтического примене
водят к онкологическим заболеваниям, приво
ния, являются такие моноклональные антитела,
дит к тому, что при одной и той же локализации
как цетуксимаб (Эрбитукс), панитумумаб (Век
опухоли возникают принципиально разные ва
тибикс), нимотузумаб (Тералок), нецитумумаб
рианты заболеваний. При подробной генетичес
(Портразза) (табл. 2). Эти антитела связываются
кой характеристике выявляются подтипы рака в
с доменом III внеклеточной части EGFR, не
рамках одной локализации, в которых с очень
позволяя природным лигандам - факторам рос
высокой вероятностью наблюдаются одни и те
та - активировать рецептор. Цетуксимаб явля
же изменения в ключевых регуляторных белках,
ется производным высокоаффинного монокло
к которым относится и EGFR. Так, например
нального мышиного антитела C225, слитого с
сверхэкспрессия EGFR выявляется в 97% случа
константной частью IgG1 человека [110]. Изо
ев «классической» формы мультиформной глио
тип IgG1 обусловливает также способность це
бластомы [78].
туксимаба вызывать антителозависимую кле
точную цитотоксичность, в отличие от паниту
мумаба, привлекая NK клетки для уничтожения
УСПЕХИ И ОГРАНИЧЕНИЯ
раковых клеток [111]. К преимуществам паниту
НАПРАВЛЕННОЙ БЛОКИРОВКИ
мумаба, относится то, что он полностью осно
СИГНАЛЬНОГО ПУТИ EGFR
ван на IgG человека, и поэтому его применение
менее подвержено появлению аллергических
Контролируя один из наиболее часто работа
реакций и анафилаксии [112]. Эти два первых
ющих «входов» сигнальной сети, опосредующей
терапевтических моноклональных антитела на
регуляцию деления клеток, EGFR является зна
чали широко применяться в клинической прак
чимым маркером малигнизации. Более важно,
тике начиная с середины 2000 х гг. В 2015 г. к
что во многих случаях состояние или экспрес
ним добавилось еще одно моноклональное че
сия этого рецептора является одним из необхо
ловеческое антитело - нецитимумаб [113], ко
димых звеньев злокачественного перерождения
торое применяют для лечения плоскоклеточной
клеток. Нарушение активации EGFR часто дает
немелкоклеточной карциномы легких. Его от
постоянный пролиферативный сигнал, без пре
личает существенно большее, чем у цетуксимаба
рывания которого деление клеток становится
и панитумумаба, время полувыведения (~ 2 не
постоянным. Нужно отметить, что повышенная
дели). Еще одно терапевтическое моноклональ
экспрессия EGFR в солидных опухолях часто
ное антитело - нимотузумаб, представляющее
ассоциируется с увеличенной продукцией соот
собой гуманизированное мышиное антитело,
ветствующих лигандов, что приводит к хрони
отличают менее выраженные, чем при примене
ческой активации рецептора. Естественным ре
нии остальных терапевтических антител, побоч
шением этой проблемы является прерывание
ные эффекты [114]. Это объясняют оптималь
активации EGFR, что может быть достигнуто
ным для лечения сродством к EGFR, что позво
как блокированием связывания активирующего
ляет оказывать эффект в основном на клетки со
лиганда, так и ингибированием тирозинкиназ
средней и большой экспрессией рецептора и ма
ной активности. Первый вариант эффективен
ло затрагивает клетки с небольшим количеством
при повышенной экспрессии EGFR, второй -
EGFR [115, 116]. Еще ряд моноклональных ан
при перманентной активации рецептора за счет
тител, ингибирующих EGFR, прошел несколь
мутаций, в особенности, при подборе специ
ко стадий клинических испытаний, но не полу
фичного при данной мутации ингибитора.
чил разрешения для широкого клинического
Моноклональные антитела к EGFR. На вос
применения в силу отсутствия выраженного
требованность прерывания взаимодействия
улучшения от лечения по сравнению с уже при
между лигандами и EGFR указывает большое
меняемыми вариантами терапии. К ним отно
БИОХИМИЯ том 85 вып. 9 2020
ИСПОЛЬЗОВАНИЕ EGFR ДЛЯ ДОСТАВКИ ЛЕКАРСТВ В КЛЕТКИ
1169
Таблица 2. Антитела к EGFR, применяемые в клинической практике
Название
Kd
Тип
Тип рака
Цетуксимаб
0,1 нМ
химерное, С225 мыши и IgG1 человека
колоректальный рак, плоскоклеточный рак
головы и шеи, немелкоклеточный рак легкого
Панитумумаб
0,05 нМ
IgG2 человека
колоректальный рак, рак молочной железы
Нимотузумаб
1 нМ
IgG1, гуманизированное
плоскоклеточный рак головы и шеи,
назофарингеальная карцинома, глиома,
рак поджелудочной железы
Нецитумумаб
0,3 нМ
IgG1 человека
немелкоклеточный рак легкого
сятся гуманизированные IgG1 матузумаб и им
ботки и испытания ингибиторов фосфорилиро
гатузумаб, человеческие залутумумаб и долиго
вания EGFR. В практику лечения ряда онколо
тузумаб, который взаимодействует и с EGFR, и
гических заболеваний (табл. 3) вошли такие ин
с ErbB3 [109].
гибиторы, как гефитиниб (Иресса), эрлотиниб
Большая часть применяемых в настоящее
(Тарцева), лапатиниб (Тайверб), афатиниб (То
время и разрабатываемых блокаторов связыва
вок), осимертиниб (Тагриссо), бригатиниб
ния EGFR обладает двумя механизмами
(Алунбриг) и дакомитиниб (Визимпро) [122], а
действия: ингибированием пролиферативного
также икотиниб (Конмана) [123]. Применение
сигнального пути и антителозависимой цито
пероральных ингибиторов первого поколения
токсичностью. Однако цитотоксический ком
(гефитиниб и эрлотиниб) при немелкоколеточ
понент действия этих антител не способен обес
ном раке легкого (плоскоклеточный рак и аде
печить достаточный противоопухолевый эф
нокарцинома) показало значительно большую
фект. Появление же активирующих мутаций в
эффективность лечения по сравнению с тради
расположенных ниже по сигнальной цепи
ционной химиотерапией [124]. Наиболее рас
звеньях, как правило, сводит на нет блокирова
пространенными мутациями EGFR являются
ние сигнала, поступающего от рецептора. Наи
делеции 746-750 в экзоне 19 или точечная мута
более известным примером таких мутаций явля
ция с заменой лейцина на аргинин L858R [125].
ются активирующие мутации KRAS. Опухоли, в
Пациенты с активирующими мутациями EGFR
которых детектируется дикий тип KRAS,
оказались достаточно чувствительны к обрати
чувствительны к блокированию антителами,
мым ингибиторам первого поколения, которые
тогда как, например, мутации в кодонах 12 и 13
имеют во много раз большее сродство к этим
экзона 2 гена KRAS приводят к стабилизации
мутантным формам рецептора по сравнению с
функционально активного комплекса RAS GTP
нормальным EGFR. Несмотря на то, что эти ин
и непрерывной передаче сигнала по MAPK пу
гибиторы оказались эффективными в качестве
ти, и действие антител на опухоли с таким изме
начальной терапии, они не действуют на сочета
ненным KRAS не проявляется. Такие мутации
ние вышеупомянутых мутаций, а также на ряд
встречаются в 40-45% случаев колоректального
других, прежде всего, T790M [126]. Это стиму
рака и в 15-30% случаев немелкоклеточного ра
лировало продвижение в практику необратимых
ка легких [117]. Активирующие мутации не ог
ингибиторов второго поколения с более широ
раничиваются KRAS, причиной устойчивости
ким воздействием на другие рецепторы семей
опухолей к блокирующей EGFR терапии могут
ства ErbB, таких как афатиниб и дакомитиниб,
быть также изменения в генах NRAS, BRAF,
призванных преодолеть нечувствительность
PIK3CA, PTEN и других [118], а также экспрес
EGFR с мутацией T790M к эрлотинибу и гефи
сия некодирующих РНК [119]. Кроме того, пос
тинибу. Такой вариант оказался не более успеш
ле первоначального ответа на лечение антитела
ным, чем ингибиторы первого поколения, из за
ми к EGFR неизменно возникает вторичная ре
невозможности достичь достаточной величины
зистентность, причиной которой могут быть как
терапевтического воздействия в силу их токсич
мутации KRAS [120], так и других генов [121].
ности для нормальных тканей [127]. Значитель
Ингибиторы тирозинкиназной активности
но успешнее в лечении немелкоклеточного рака
EGFR. После раскрытия деталей активации
легкого оказался более селективный осимерти
EGFR в результате связывания факторов роста
ниб [128, 129]. Несмотря на заметное увеличе
огромные усилия были приложены для разра
ние продолжительности периода без прогресса
3 БИОХИМИЯ том 85 вып. 9 2020
1170
РОЗЕНКРАНЦ, СЛАСТНИКОВА
Таблица 3. Ингибиторы тирозинкинзы EGFR, применяемые в медицинской практике
Название
Мишень
Тип
Заболевание
Гефитиниб
EGFR, del 746-750, L858R
обратимый
немелкоклеточный рак легких
Эрлотиниб
EGFR, del 746-750, L858R
обратимый
немелкоклеточный рак легких, рак поджелудочной железы
Икотиниб
EGFR, del 746-750, L858R
обратимый
немелкоклеточный рак легких
Бригатиниб
EGFR, C797S, ALK*
обратимый
немелкоклеточный рак легких
Лапатиниб
EGFR, ErbB2
необратимый
рак молочной железы
Афатиниб
EGFR, ErbB2
необратимый
немелкоклеточный рак легких
Осимертиниб
EGFR, del 746-750, L858R,
необратимый
немелкоклеточный рак легких
T970M, ins 20
Дакомитиниб
EGFR, del 19, L858R, HER2,
необратимый
немелкоклеточный рак легких
EGFR, HER4, AKT, ERK
* ALK - киназа анапластической лимфомы.
заболевания, постепенное развитие резистент
тате перманентной активации Ras/Raf/MEK/
ности к лечению требует как применения соче
ERK через EGFR [133] оказывается недостаточ
тания разных ингибиторов, так и поиска даль
но для радикального уничтожения опухолей.
нейших более эффективных средств воздей
Возникающая резистентность опухолей обус
ствия. Возникающие мутации в локусе С797, по
ловлена, помимо мутаций в гене EGFR, также
которому осимертиниб присоединяется к
другими нарушениями в сигнальной сети, регу
EGFR, приводят к появлению устойчивых вари
лирующей пролиферацию. Такие нарушения
антов опухолей [130].
включают в себя активирующие мутации KRAS,
В основном успехи в применении ингибито
BRAF, каталитической субъединицы фосфати
ров тирозинкиназной активности EGFR отно
дилинозитол 4 5 бифосфат киназы (PIK3CA),
сятся к немелкоклеточному раку легкого. Для
слияние генов, затрагивающее активацию RET,
данного варианта рака легких характерна как
FGFR3 и BRAF, амплификацию MET, FGFR,
сверхэкспрессия EGFR (примерно в половине
ErbB2 и другие [134-139], а также экспрессию
случаев), так и мутации, приводящие к перма
длинных некодирующих РНК, например UCA1
нентной активации рецептора [127]. Подбор
(urothelial cancer associated 1) [140]. В ряде слу
комбинаций ингибиторов тирозинкиназ на ос
чаев лечение ингибиторами приводит к измене
новании разной чувствительности мутантных
нию типа заболевания, переходу от немелкокле
форм EGFR к разным ингибиторам [131, 132] с
точного к мелкоклеточному раку легкого [141].
добавлением блокирующих антител могут, по
Таким образом, направленная или таргетная
видимому, улучшать результаты терапии [127].
терапия, достаточно хорошо развитым приме
Таким образом, разработка панели ингибито
ром которой являются подходы, направленные
ров EGFR стала ярким примером персонализо
на EGFR, сталкивается с той же проблемой по
ванного подхода к лечению рака, опирающего
явления устойчивости опухоли, что и традици
ся на данные о строении и мутациях одного из
онная химиотерапия. Как уже было описано вы
ключевых звеньев развития злокачественного
ше, одним из решений этой проблемы может
процесса.
служить подбор набора ингибиторов активиро
Общими ограничениями направленной на
ванного сигнального пути, включающий не
блокирование EGFR терапии являются необхо
только ингибиторы EGFR, но и ингибиторы ни
димость перманентного применения терапевти
жележащих звеньев - KRAS, BRAF и других.
ческих средств и недостаточная эрадикация ра
Быстрое развитие методов жидкостной биопсии
ковых клеток. Длительность применения инги
[142] и современных методов секвенирования -
биторов и наличие большого количества опухо
NGS (new generation sequencing) [143] делают эту
левых клеток приводят к появлению резистент
проблему технически решаемой. Тем не менее
ных к терапии вариантов и последующей кло
высокая гетерогенность, генетическая неста
нальной селекции наиболее устойчивых из них
бильность и клональная эволюция опухолей
[127]. Снятия ингибирования апоптоза в резуль
[144-146] не позволяют рассчитывать на безус
БИОХИМИЯ том 85 вып. 9 2020
ИСПОЛЬЗОВАНИЕ EGFR ДЛЯ ДОСТАВКИ ЛЕКАРСТВ В КЛЕТКИ
1171
ловный успех такого подхода. Блокировка про
лирования. Антитела к EGFR блокируют этот
лиферативного сигнала замедляет рост опухоли,
процесс, однако по крайней мере некоторые из
но не приводит к ее исчезновению. Добавление
них способны относительно эффективно посту
к лечению токсических химиотерапевтических
пать в клетки. Так, mAb 225, вариабельная часть
средств далеко не во всех случаях способно при
которого обеспечивает функциональность це
вести к излечению. Поэтому во многих лабора
туксимаба, эндоцитируется со скоростью в 6-7
ториях большое внимание уделяется развитию
раз меньшей скорости эндоцитоза EGF [147],
другого решения проблемы устойчивости онко
что тем не менее существенно превышает по
логических заболеваний к терапии - использо
ступление EGFR без лиганда в клетку. Как пока
ванию направленного подхода не для ингибиро
зывают эксперименты, проведенные на клетках
вания патологически измененных звеньев нор
аденокарциномы легкого A549 с умеренной
мальных регуляторных процессов, а для селек
экспрессией EGFR (~105 рецепторов на клетку),
тивного уничтожения раковых клеток. Много
больше половины поглощенного mAb и EGFR в
численные варианты различных онкологичес
течение первого часа возвращаются обратно на
ких заболеваний с повышенной экспрессией
поверхность, в отличие от рецептора в комплек
EGFR являются перспективными кандидатами
се с EGF, более 70% которого остается внутри
на разработку такого подхода.
клетки и деградирует в лизосомах. Интересно,
что цетуксимаб способен обеспечивать транс
порт некоторой части EGFR в ЭР, где он обна
ИСПОЛЬЗОВАНИЕ EGFR
руживается в комплексе с Sec61, и далее в ядро
В КАЧЕСТВЕ СИСТЕМЫ ДОСТАВКИ
клетки [148]. Такой транспорт зависит от связы
вания антител в сайте связывания лигандов и
Традиционно для терапии онкологических
поливалентности связывания антитела, по
заболеваний чаще всего применяется химиоте
скольку он не был обнаружен для блокирующе
рапия, действующая в первую очередь на быст
го антитела к другому участку рецептора и Fab′
ро делящиеся клетки, и радиотерапия, которая в
фрагментов цетуксимаба [148]. Для эндоцитоза
большей мере воздействует на ДНК и также
как цетуксимаба, так и наночастиц, покрытых
сильнее воздействует на делящиеся клетки. И
им, требуется кластеризация комплексов ли
то, и другое воздействие не являются селектив
ганд-рецептор на клеточной поверхности в гли
ными по отношению к собственно раковым
косфинголипидных доменах, после чего следует
клеткам, что приводит к появлению тяжелых
кавеолин и динамин 2 зависимый эндоцитоз
побочных эффектов, делающих затруднитель
[149]. Кластеризация цетуксимаб рецепторных
ным излечение. Кроме этих основных методов
комплексов в качестве промежуточного шага в
для противораковой терапии разрабатываются и
процессе инициирования эндоцитоза была так
в некоторых случаях используются также фото
же обнаружена при помощи анализа движения
динамическая терапия (ФДТ) и генотерапия.
единичных частиц на поверхности клетки [150].
Все эти варианты терапевтических воздействий
Вышеизложенное объясняет большой интерес к
могут быть соединены с таргетной терапией не
цетуксимабу в качестве лиганда для доставки
только в виде сочетания одновременного или
цитотоксических агентов в раковые клетки ми
последовательного применения, но и для нап
шени. Перспективным вариантом лигандов
равленной доставки соответствующего терапев
считаются искусственные антителоподобные
тического начала (токсического химиотерапев
каркасные белки, позволяющие позициониро
тического вещества, источника ионизирующего
вать в пространстве набор остатков, обеспечи
излучения, фотосенсибилизатора (ФС) или не
вающих взаимодействие с целевой молекулой. К
обходимого гена) в опухолевые клетки мишени.
ним относятся аффибоди, создаваемые на осно
EGFR в силу прямой вовлеченности в актива
ве белка А, которые отличаются небольшим раз
цию деления клеток, эндоцитируемости и час
мером [151]. Несколько аффибоди эффективно
той повышенной экспрессией при многих онко
взаимодействуют с EGFR, но скорость их эндо
логических заболеваниях представляется одним
цитоза также невелика [152]. Существует также
из самых привлекательных объектов для созда
используемый для создания различных систем
ния направленной противоопухолевой терапии.
доставки противораковых средств короткий
Как уже было отмечено в разделе «Эндоци
пептид GE11, способный связываться с EGFR,
тоз и дальнейший внутриклеточный транс
обеспечивающий интернализацию модифици
порт», стимуляция внеклеточными сигнальны
рованных им наночастиц [153]. Среди искус
ми лигандами увеличивает скорость интернали
ственных лигандов, способных связываться с
зации EGFR на порядки. Этот процесс зависит
EGFR, помимо антител и пептидов, есть и апта
от димеризации рецептора и его автофосфори
меры. РНК аптамер E07 оказался способным
БИОХИМИЯ том 85 вып. 9 2020
3*
1172
РОЗЕНКРАНЦ, СЛАСТНИКОВА
связываться с EGFR с наномолярным срод
способно в 6 раз увеличивать накопление лекар
ством, и около четверти связанного с поверх
ства в ксенографтах рака молочной железы
ностью аптамера было способно интернализо
MDA MB 468 [160].
ваться клетками за 30 минут [154].
Целый ряд похожих систем доставки, ис
Наночастицы. Наночастицы представляют
пользующих химиотерапевтические средства,
собой крайне гетерогенный по свойствам класс
упакованные в липосомы, которые модифици
объектов, размер которых позволяет присоеди
руют лигандами к EGFR, находится на стадии
нять к ним (или нагружать в них) большое коли
доклинических исследований (рис. 2). К ним
чество низкомолекулярных противоопухолевых
относятся иммунолипосомы с доксорубицином
агентов, например традиционных химиотера
и цетуксимабом, присоединенным через фолат
певтических средств. Уже только такое объеди
связывающий белок [161], с бор содержащим
нение может существенно изменять распределе
анионом для нейтрон захватной терапии, а так
ние и фармакокинетику веществ. В отношении
же с холестерин цетуксимабом [162], цисплати
онкологических заболеваний присоединение
ном и нимотузумабом [163], 5 фторурацилом и
противоопухолевых агентов к наночастицам
цетуксимабом [164], липосомы с ФС фталоциа
производится в расчете на эффект повышенной
нином цинка и однодоменными антителами к
проницаемости и удержания (enhanced perme
EGFR EGa1 [165], липосомы с оксалиплатином
ability and retention, EPR) [155]. На использова
и EGF [166], цисплатином и mAb к EGFR [167],
ние этого эффекта, причиной которого является
липосомы с гемцитабином с присоединенными
наличие значительного числа больших пор в
ПЭГ и mAb к EGFR [168]. Необходимо отме
местах быстрого и хаотичного роста сосудов в
тить, что такие подходы с направленной достав
опухоли, возлагали большие надежды в исполь
кой противораковых средств показали возмож
зовании наночастиц для противоопухолевой те
ность преодоления множественной лекарствен
рапии. Однако клинические исследования по
ной устойчивости, что часто является пробле
казали, что, в отличие от экспериментальных
мой при терапии рака [160].
опухолей у мышей, в опухолях человека EPR ме
Все перечисленные варианты могут оказать
нее выражен и может сильно различаться не
ся полезными для клиники, однако поиск опти
только между опухолями одного типа у разных
мального лекарства, лиганда и способа присо
пациентов, но и между разными метастазами
единения продолжает интенсивно развиваться.
одного пациента [156]. Среди вариантов преодо
Так, для получения однородного присоедине
ления нестабильности эффекта наночастиц рас
ния к липосомам использовали сортазу, соеди
сматривается и придание им функционального
няющую пептидные цепи по специфической
адреса, в частности присоединение лиганда к
последовательности LPETG на C конце с пен
EGFR [157, 158].
таглицином на N конце [169]. Другим направле
Типичным вариантом реализации такого
нием совершенствования противораковых
подхода и единственным дошедшим пока до
средств является применение нескольких цито
стадии клинической проверки являются имму
токсических агентов, загруженных в иммуноли
нолипосомы, нагруженные одним из наиболее
посомы. Для реализации этого подхода были ис
распространенных противораковых лекарств -
следованы иммунолипосомы с доксорубицином
доксорубицином. С целью обеспечения устой
и винорелбином с новыми однодоменными scFv
чивости в крови такие липосомы несут остатки
EGFR s10 [170]. Еще одним вариантом исполь
полиэтиленгликоля (ПЭГ), а для придания спе
зования сочетанного воздействия являются им
цифичности по отношению к раковым клеткам
мунолипосомы с цетуксимабом, несущие док
со сверхэкспрессией EGFR - Fab′ фрагмент це
сорубицин и β излучатель 188Re в качестве по
туксимаба [159]. Такие липосомы, названные
тенциального тераностического средства [171].
авторами anti EGFR ILs dox, содержат в сред
Общим направлением поиска лучших противо
нем по 4000 молекул доксорубицина, лучше пе
раковых лекарств является разработка много
реносятся пациентами, чем те же дозы свобод
функциональных систем доставки лекарствен
ного доксорубицина и не показывают побочных
ных средств. В применении липосомных вари
эффектов, связанных с блокированием EGFR.
антов доставки это реализуется, в частности в
В настоящее время этот вариант направленной
виде так называемых функционализованных
доставки доксорубицина в клетки с повышен
липосом. Одним из вариантов подхода являются
ной экспрессией EGFR при лечении трижды
термочувствительные липосомы с доксорубици
негативного рака молочной железы находится
ном и пептидом GE11 [172]. Эти липосомы, ста
на второй стадии клинических испытаний. В
бильные при температуре тела, при повышении
экспериментах на животных введение такого
температуры становятся неустойчивыми и выс
рода липосом с Fab′ фрагментами цетуксимаба
вобождают лекарство при 40 °С, что при необхо
БИОХИМИЯ том 85 вып. 9 2020
ИСПОЛЬЗОВАНИЕ EGFR ДЛЯ ДОСТАВКИ ЛЕКАРСТВ В КЛЕТКИ
1173
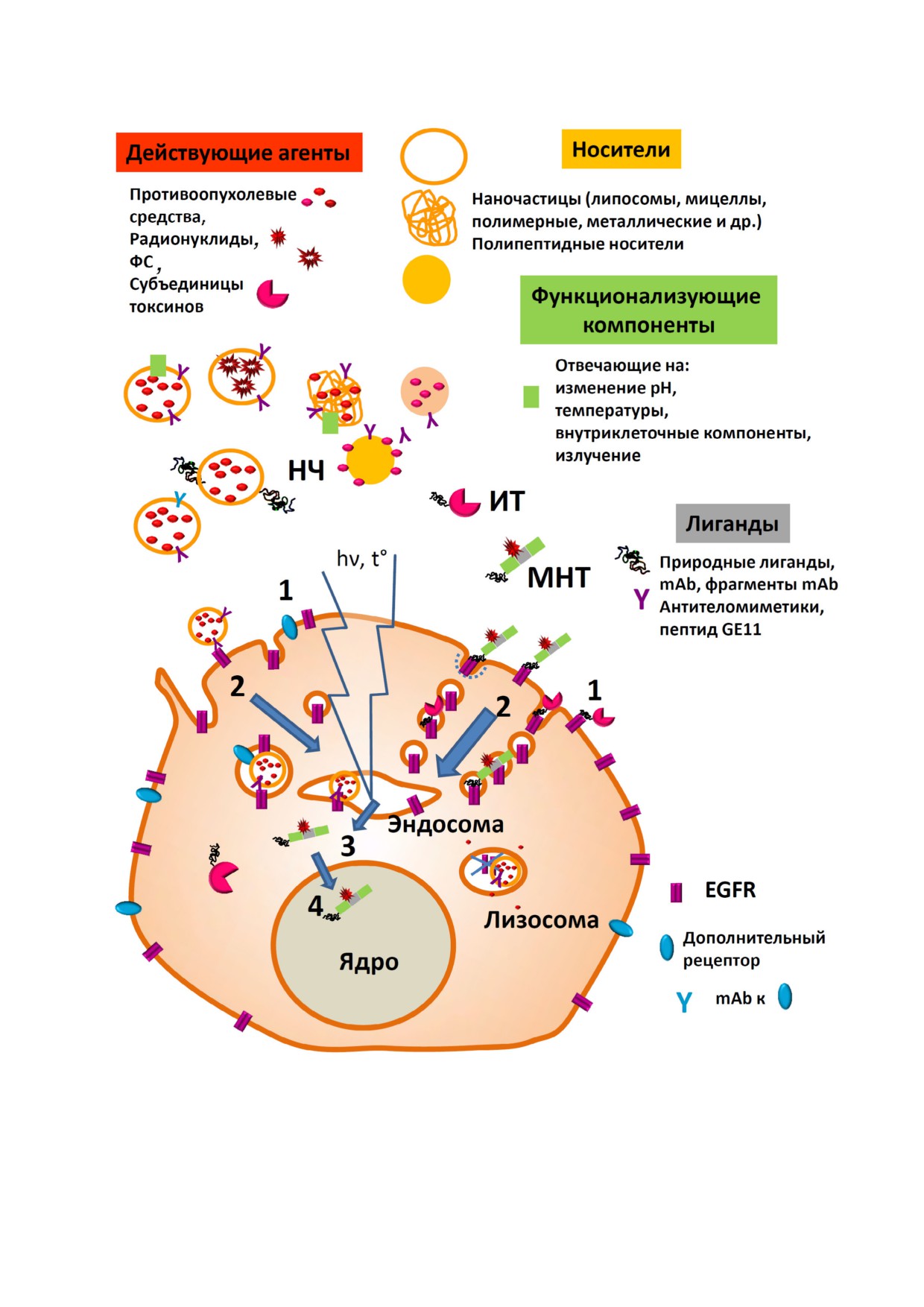
Рис. 2. Схема основных разрабатываемых подходов для направленной доставки терапевтических агентов в клетки через
EGFR. 1 - Связывание с рецептором, 2 - эндоцитоз: макропиноцитоз, фагоцитоз, кавеолиновый, быстрые клатрин за
висимый, эндофилин зависимый варианты эндоцитоза, 3 - выход из эндосом, 4 - транспорт в ядро. Сокращения: ФС -
фотосенсибилизаторы, НК - нуклеиновые кислоты, НЧ - наночастицы, ИТ - иммунотоксины, МНТ - модульные на
нотранспортеры
БИОХИМИЯ том 85 вып. 9 2020
1174
РОЗЕНКРАНЦ, СЛАСТНИКОВА
димости может обеспечить дополнительную се
мальный переход [4], и маркеры стволовых ра
лективность воздействия за счет локального
ковых клеток. Перспективным вариантом явля
нагрева. Чувствительность к pH окружения яв
ются наночастицы из сополимеров PLGA с
ляется другим вариантом реализации дополни
двойной специфичностью, обусловленной апта
тельных функций: иммунолипосомы с mAb к
мерами к EGFR и CD133, нагруженные салино
EGFR начинают высвобождать гемцитабин при
мицином, антибиотиком, наиболее активно
понижении pH [173], что может быть реализова
действующим на стволовые клетки опухолей
но как в эндосомах, так и в закисленной части
[179]. Подобной направленностью обладают на
внеклеточного пространства ряда опухолей.
ночастицы на основе гиалуроновой кислоты с
Еще одним вариантом наночастиц для на
двойной специфичностью - EGFR (пептид
правленной доставки противораковых лекарств
GE11) и CD44 за счет связывания с ней гиалуро
в клетки с использованием EGFR являются ми
новой кислоты. В качестве цитотоксического
целлы. Мицеллы на основе сополимеров гид
агента эти частицы несли сериновую протеазу
роксипропилметакриламида и лактата с ПЭГ с
гранзим Б [180].
доксорубицином присоединенным через pH
К настоящему времени создано и проверено
чувствительный линкер были модифицированы
на модельных опухолях лабораторных живот
наноантителом EGa1 для взаимодействия с
ных большое количество сочетаний взаимодей
EGFR. Полученные мицеллы обладали как спо
ствующих с EGFR наночастиц и загружаемых в
собностью тормозить рост ксенографтов клеток
них терапевтических агентов. Так, гибридные
рака головы и шеи за счет блокирования EGFR,
липид PLGA наночастицы с присоединенным
так и токсичностью за счет доставки доксоруби
ПЭГ и Fab′ фрагментами антител к EGFR, за
цина в клетки [174]. Подобная мицеллярная
груженные адрианомицином, тормозили рост
конструкция, несущая паклитаксел, была созда
ксенографтов гепатоцеллюлярной карциномы
на на основе сополимеров молочной и гликоле
[181]. Несущие паклитаксел самособирающиеся
вой кислот (PLGA) и ПЭГ с присоединенным
липидные наночастицы, стабилизированные
цетуксимабом [175]. Следующий вариант нано
плюроником и ПЭГ, с присоединенными mAb к
частиц с паклитакселом и квантовыми точками
EGFR также показали увеличенную эффектив
для тераностики содержит фосфолипид с при
ность по отношению к клеткам рака яичника in
соединенным ПЭГ и лиганд к EGFR в виде це
vitro и in vivo [182]. Вариант с пролекарством
туксимаба или аптамера. Мицеллы с лигандами
паклитаксел ацетатом, загруженным в наночас
к EGFR достоверно сильнее тормозили рост
тицы PLGA с присоединенным цетуксимабом,
ксенотрансплантата рака поджелудочной желе
был исследован при терапии ксенографтов рака
зы, чем исходные варианты наночастиц [176].
легкого A549 и не показал улучшения накопле
Создаются также мицеллярные конструкции,
ния в опухоли. Тем не менее иммунонаночасти
доставляющие в клетки несколько терапевти
цы с цетуксимабом показали лучший терапевти
ческих агентов. Примером такой конструкции
ческий эффект по сравнению с исходными на
могут служить катионные мицеллы с цетукси
ночастицами [183]. Доставку паклитаксела в
мабом, доставляющие цитотоксический гемци
клетки рака желудка in vitro и in vivo обеспечива
табин и миРНК miR 205, сниженный уровень
ли наночастицы на основе полиглутамата и хи
которой ассоциирован с опухолевыми стволо
тозана с присоединенным цетуксимабом [184].
выми клетками. Такой подход, предназначен
Наночастицы PLGA с использованием цетукси
ный для лечения прогрессирующего рака под
маба и паклитаксела показали также увеличение
желудочной железы, привел к повышению эф
эффективности терапии ксенографтов рака лег
фективности терапии ксенографтов по сравне
кого [185]. Наночастицы из двуокиси кремния с
нию с каждым из агентов, доставляемых мицел
доксорубицином, модифицированные цетукси
лами по отдельности [177]. Еще один вариант
мабом, улучшали терапию ксенографтов гепато
мицелл - токоферил ПЭГ с присоединенным
целлюлярной карциномы [186].
цетуксимабом был успешно использован для те
Многие перспективные варианты лекар
рапии ксенографтов трижды негативного рака
ственных средств используют вещества, о при
молочной железы для доставки паклитаксела
менении которых в медицинской практике нет
[178].
достаточной информации. В таких случаях путь
Ряд работ по направленной доставке цито
от результатов, полученных на культурах клеток
токсических средств используют лиганды к не
и на животных, до клинического применения
скольким рецепторам раковых клеток. Особен
требует значительного времени и больших зат
но интересными представляются подходы с од
рат. Примером попытки создания варианта с
новременной нацеленностью на EGFR, как ре
максимальным количеством уже разрешенных
цептор, вызывающий эпителиально мезенхи
для лечения компонентов служат модифициро
БИОХИМИЯ том 85 вып. 9 2020
ИСПОЛЬЗОВАНИЕ EGFR ДЛЯ ДОСТАВКИ ЛЕКАРСТВ В КЛЕТКИ
1175
ванные ПЭГ липидные наночастицы на основе
энергии (9-26 кэВ/мкм). При распаде в непо
лецитина с присоединенным EGF, несущие гем
средственной близости от ядерной ДНК эмитте
цитабин [187].
ры ЭО являются перспективными агентами для
Собственные свойства материала наночас
избирательного уничтожения целевых клеток с
тиц также могут быть использованы при на
минимальным повреждением окружающих
правленной доставке с помощью EGFR. Так,
[191]. Учитывая характерную для многих типов
наночастицы оксида железа с присоединенным
рака сверхэкспрессию EGFR на поверхности
цетуксимабом могут быть использованы не
опухолевых клеток, а также способность EGFR
только для магнитно резонансной диагностики,
импортироваться в ядро, были разработаны и
но и для усиления эффекта радиотерапии. По
разрабатываются различные варианты систем
падая в клетки, такие частицы вызывают при
EGFR направленной доставки эмиттеров ЭО
облучении увеличение продукции активных
разной степени сложности. Внутривенное вве
форм кислорода (АФК), что увеличивает эф
дение меченных [125I] мышиных mAb 425 приво
фект радиотерапии ксенографтов глиомы [188].
дило к существенному увеличению (с 7 до 16 ме
Дополнительное покрытие гемцитабином
сяцев) продолжительности жизни пациентов с
золотых наночастиц с присоединенным цетук
тяжелыми формами глиобластомы при моноте
симабом оказывало терапевтический эффект
рапии [192]. Эти антитела являются отчасти ин
при лечении ксенографтов аденокарциномы
тернализуемыми, как показали эксперименты с
поджелудочной железы [189]. Нельзя не упомя
глиомными клеточными линиями от 20 до 40%
нуть и о возможности использования золотых
антител, связанных с поверхностью клеток, мо
наночастиц, покрытых антителами к EGFR для
гут интернализоваться [193]. Среди наиболее
фототермального уничтожения клеток опухоли
простых и хорошо изученных вариантов таких
[190]. В этом случае специфическое поглощение
систем доставки находится EGF с присоединен
наночастиц является причиной долговременно
ным к нему хелатирующим агентом DTPA для
го удерживания наночастиц в опухоли.
связывания одного из перспективных для кли
Приведенные примеры показывают широ
нического применения эмиттеров ЭО - 111In.
кое поле деятельности для совершенствования
Первые исследования эффективности [111In]
традиционных химиотерапевтических средств
DTPA EGF были опубликованы 20 лет назад
лечения рака с помощью их направленной дос
[191]. В них было показано, что [111In] DTPA
тавки и добавления фармакокинетических,
EGF проникал в экспрессирующие EGFR клет
собственных транспортных и цитотоксических
ки рака молочной железы, при этом 15% интер
свойств. Общим для этих подходов является не
нализованной радиоактивности достигало кле
обходимость включения в состав конструкций
точного ядра. Инкубация с [111In] DTPA EGF
элементов, предотвращающих поглощение час
значительно замедляла рост клеток мишеней. В
тиц мононуклеарно макрофагальной системой,
последующих работах была показана эффектив
в качестве которых чаще всего используют ПЭГ.
ность и безопасность подобного подхода in vivo
Радионуклидная терапия. В качестве цито
на мышиной модели рака молочной железы
токсического начала в направленной радионук
[194], а также оценена потенциальная возмож
лидной терапии используются изотопы, испус
ность замены EGF на связывающийся с EGFR,
кающие α , β частицы, γ излучение и электро
но не активирующий его, урезанный вариант
ны Оже (ЭО). Для β частиц нахождение внутри
EGF [195]. Первая фаза клинических исследо
клетки не имеет значения с точки зрения пов
ваний показала отсутствие высокой токсичнос
реждения раковой клетки, эндоцитоз может
ти и иммуногенности [111In] DTPA EGF после
только улучшить удержание в опухоли присое
однократного введения [196]. Эффективность
диненного к лекарственному средству β излуча
подобного подхода может быть улучшена путем
теля. Действие α частиц существенно более вы
введения в состав узнающих EGFR конструк
ражено при излучении внутри ядра, для прояв
ций дополнительного сигнала ядерной локали
ления эффекта ЭО, как правило, необходима
зации, позволяющего увеличить импорт в ядро.
ядерная локализация. Часто радионуклиды, ис
Так, добавление сигнала ядерной локализации в
пользуемые для терапии и диагностики, испус
состав доставляющей 111In конструкции на ос
кают несколько видов излучения. С точки зре
нове нимотузумаба (антитела к EGFR) значи
ния доставки в клетки мишени, наибольший
тельно увеличило накопление радиоактивности
интерес представляют ЭО, испускаемые в ре
в ядрах клеток рака молочной железы со сверх
зультате электронного захвата или внутренней
экспрессией EGFR, тем самым придав
конверсии. Они характеризуются очень малым
конструкции большую цитотоксичность по
пробегом в тканях (типично - в нанометровом
сравнению с контрольной без сигнала ядерной
диапазоне) и высокой линейной передачей
локализации. Сигнал ядерной локализации был
БИОХИМИЯ том 85 вып. 9 2020
1176
РОЗЕНКРАНЦ, СЛАСТНИКОВА
успешно задействован и в более сложной систе
[206-208], так и in vivo на животной модели пос
ме двойной адресной доставки 111In, где входя
ле однократного местного введения в EGFR
щий в конструкцию EGF отвечал за узнавание
экспрессирующую опухоль, что приводило к до
клеток мишеней, а антитело к γ H2AX позволя
зозависимому терапевтическому эффекту,
ло осуществить доставку радионуклида к марке
вплоть до исчезновения опухолей у 40% живот
ру ранней репарации ДНК гистону γ H2AX
ных в группе с наибольшей дозой препарата
[197]. Взаимодействие с опосредующими им
[207].
порт в ядро факторами происходит в цитозоле,
Вариантом использования радионуклидной
при этом после связывания с EGFR нацеленная
терапии, основанной на использовании повы
на него конструкция претерпевает интернализа
шенной экспрессии EGFR, являются липосомы
цию и оказывается в замкнутых внутриклеточ
с присоединенным 186Re (излучающий β части
ных везикулах. Собственный транспорт поверх
цы и ЭО) или 188Re (только β частицы), которые
ностных рецепторов, в том числе для EGFR, в
вводили постоперационно в резекционную по
ядро невелик (см. раздел «Транспорт EGFR в
лость крыс с ортотопическими опухолями рака
ядро») и направлен в основном в лизосомы и на
молочной железы человека. Такой подход приз
поверхность клетки. В то же время клетки обла
ван улучшить существующие химиотерапевти
дают развитой системой транспорта между орга
ческие и радиотерапевтические варианты тера
неллами, которую можно использовать для из
пии, используемые в клинике [209].
менения транспорта создаваемых лекарствен
Высокая линейная передача энергии
ных средств [198]. Для того чтобы доставить ци
(50-230 кэВ/мкм) и относительно небольшой
тотоксические агенты в ядра клеток мишеней
пробег (50-100 мкм) α частиц делают испуска
Sobolev et al. были разработаны рекомбинант
ющие их радионуклиды более цитотоксичными
ные модульные конструкции, названные мо
в случае их распада внутри клетки [200]. Адрес
дульными нанотранспортерами (МНТ) [199
ная доставка эмиттеров α частиц внутрь рако
201]. Такие МНТ включают в себя следующие
вых клеток, экспрессирующих EGFR, была ус
модули: EGF, связывание которого с EGFR на
пешно осуществлена в ряде исследований. В ос
поверхности клеток мишеней обеспечивает из
новном в качестве нацеливающей на EGFR мо
бирательность и запускает процесс интернали
лекулы используют давно применяемое в кли
зации; транслокационный домен дифтерийного
нике моноклональное антитело к EGFR, цетук
токсина (ДТокс), обеспечивающего выход
симаб. Так, α эмиттер 213Bi, присоединенный к
транспортеров в цитозоль; сигнал ядерной лока
цетуксимабу, показал высокую цитотоксичность
лизации - большого Т антигена вируса SV 40; а
in vitro на клетках трижды негативного рака мо
также бактериальный гемоглобиноподобный
лочной железы, экспрессирующих EGFR [210].
белок (НМР) - носитель [199]. Было показано
In vivo213Bi, доставляемый анти EGFR антите
сохранение функциональной активности каж
лом матузумабом, показал высокую эффектив
дого модуля, входящего в состав МНТ [202],
ность на ортотопической мышиной модели рака
способность МНТ достигать ядер EGFR
мочевого пузыря человека, значительно увели
экспрессирующих раковых клеток in vitro [202] и
чив продолжительность жизни животных по
in vivo [203]. Первые данные о перспективности
сравнению с контрольными группами [211, 212].
использования МНТ для доставки эмиттеров
Пилотное исследование эффективности мест
ЭО в ядра раковых EGFR экспрессирующих
ного применения 213Bi, доставляемого цетукси
клеток были получены in vitro с использованием
мабом, для лечения рака мочевого пузыря на
двух различных радионуклидов: 125I [204] и 67Ga
стадии in situ продемонстрировало потенциаль
[205]. В обоих случаях 55-60% интернализован
ную перспективность такого подхода: у 3 из 12
ных радионуклидов, доставляемых МНТ, дости
пациентов наблюдалась полная ремиссия после
гало ядер целевых клеток, и наблюдалось мно
одно или двукратной инстилляции данного ра
гократное усиление их цитотоксичности по
диофармпрепарата [213].
сравнению с контролями. Для осуществления
На мышиной модели диссеминированных
эффективной доставки 111In с использованием
внутрибрюшинных опухолей LS 174T (рак ки
МНТ был сначала разработан метод присоеди
шечника человека) была показана эффектив
нения данного эмиттера ЭО к белкам (в част
ность противоопухолевого действия другого α
ности, МНТ), позволяющий получить меченый
эмиттера, 212Pb, доставляемого цетуксимабом:
продукт с очень высокой удельной радиоактив
медианная продолжительность жизни живот
ностью [206]. В итоге эффективность поврежда
ных увеличилась до 84 дней по сравнению с 34
ющего действия 111In после присоединения к
днями в группе животных, которым вводили
МНТ значительно увеличивалась как на EGFR
212Pb, доставляемый неспецифическим антите
экспрессирующих раковых клетках в культуре
лом [214]. Эффективность терапии 212Pb-цетук
БИОХИМИЯ том 85 вып. 9 2020
ИСПОЛЬЗОВАНИЕ EGFR ДЛЯ ДОСТАВКИ ЛЕКАРСТВ В КЛЕТКИ
1177
симабом можно было еще увеличить как пред
частью дифтерийного токсина (Элзонрис) для
варительным введением гемцитабина, так и
лечения злокачественных бластных плазмоци
комбинацией 212Pb-трастузумабом, антителом к
тоидных дендритных клеток [220].
HER 2.
Создание лекарственного средства, исполь
Доставка радионуклидов, испускающих α
зующего такой принцип для лечения солидных
частицы в ядра клеток мишеней, позволяет уве
опухолей, представляет собой более сложную
личить как повреждающее действие на клетку
задачу. Тем не менее одно из таких соединений,
самой α частицы, так и задействовать цитоток
ТП 38, представляющее собой лиганд к EGFR,
сический потенциал ядер отдачи, образующихся
TGFα, слитый с частью псевдомонадного экзо
при α распаде [215]. Так, при доставке 211At,
токсина с делецией, оставляющей токсическую
присоединенного к МНТ, было показано специ
АДФ рибозилирующую активность, но неспо
фичное увеличение цитотоксичности данного
собной связываться с клетками, показало обе
α эмиттера до 18 раз на нескольких линиях ра
щающие результаты в доклинических исследо
ковых клеток со сверхэкспрессией EGFR [216].
ваниях. Этот иммунотоксин был применен для
Иммунотоксины. Использование в качестве
проверки возможности лечения глиобластомы
токсического начала каталитических субъеди
при местном введении в головной мозг при по
ниц бактериальных токсинов представляет со
мощи конвекционно усиленной доставки. Для
бой еще один из возможных вариантов противо
глиобластом характерна частая сверхэкспрессия
опухолевых средств. Такие вещества включают в
EGFR (см. раздел «Экспрессия EGFR при онко
себя токсин, в котором лигандная часть, обеспе
логических заболеваниях»). Исследования по
чивающая связывание с клетками, заменена на
казали, что такой метод интрапаренхимальной
антитело, его фрагмент или другой лиганд к
доставки лекарственных средств привел к пол
выбранному интернализуемому рецептору. Об
ному ответу на лечение у нескольких пациентов
щепринятое название - иммунотоксины - не
[221]. Аналогичный иммунотоксин (D2C7
совсем удачно, поскольку к этому типу противо
(scdsFv) PE38KDEL) [222] был создан с исполь
раковых агентов относят и фрагменты токси
зованием вариабельного фрагмента антитела,
нов, химически соединенные или генно инже
способного связываться как с диким типом
нерно слитые с природными лигандами. К на
EGFR, так и с EGFRvIII (постоянно активиро
стоящему времени было создано и исследовано
ванным мутантом, делеционным по части внек
более полутора десятков конструкций с лиган
леточного домена рецептора) [223], который
дами к EGFR и частями различных токсинов,
особенно часто встречается при глиобластомах.
главным образом псевдомонадного экзотокси
Данная конструкция показала значительное
на, дифтерийного токсина и сапорина
увеличение продолжительности жизни живот
[217-219]. Природные токсины помимо
ных при терапии ортотопических опухолей гли
собственно токсической активности обладают
ом человека у иммунодефицитных мышей [224].
также собственным механизмом проникнове
Сочетание терапии D2C7 (scdsFv) PE38KDEL
ния в цитозоль клетки. Например, дифтерий
ортотопических опухолей головного мозга у мы
ный токсин за счет транслокационного домена в
шей с ингибиторами контрольных точек иммун
слабокислой среде способен к встраиванию в
ного ответа αCTLA 4/αPD 1/αPD L1 позволи
мембрану эндосомы и переносу каталитической
ло элиминировать экспериментальные глиомы
субъединицы в цитозоль, псевдомонадный эк
у части животных [225].
зотоксин по системе везикулярного транспорта
Доставка фотосенсибилизаторов. ФДТ пред
через аппарат Гольджи попадает в ЭР и оттуда
ставляет собой достаточно интересный и пер
путем ретроградного транспорта в цитозоль.
спективный подход к лечению ряда заболева
АДФ рибозилирующие субъединицы этих ток
ний, в первую очередь онкологических [226].
синов обладают крайне высокой цитотоксич
Данный вид терапии основан на избирательном
ностью, что часто ставит вопрос о достаточнос
накоплении в опухоли ФС и последующем ее
ти для терапевтического применения ширины
облучении светом с длиной волны, соответству
терапевтического диапазона иммунотоксинов
ющей максимуму поглощения ФС. При этом
[220]. Тем не менее три иммунотоксина уже по
происходит запуск фотодинамических реакций,
лучили одобрение для клинического примене
приводящих к образованию АФК, обладающих
ния при лечении нескольких гематологических
сильным повреждающим действием. Пробег на
онкологий: на основе IL 2 и части дифтерийно
иболее реакционноспособных АФК (синглет
го токсина (Онтак) для лечения Т клеточной
ный кислород, гидроксильный радикал) огра
лимфомы; анти CD22 с частью псевдомонадно
ничен несколькими десятками нанометров, что
го экзотоксина (Лумоксити) для лечения воло
делает их наиболее эффективными в случае по
сатоклеточного лейкоза и на основе IL 3 с
падания в ядро целевой клетки [227, 228]. Для
БИОХИМИЯ том 85 вып. 9 2020
1178
РОЗЕНКРАНЦ, СЛАСТНИКОВА
доставки ФС в ядра раковых клеток мишеней
ности его мутантный вариант EGFRvIII, обра
были исследованы МНТ, в том числе нацелен
зующий уникальный эпитоп, интенсивно ис
ные на EGFR. Было показано сохранение спо
следуются, в том числе, в нескольких клиничес
собности ФС, присоединенных к МНТ, генери
ких испытаниях на возможность использования
ровать АФК при облучении [202]. ФС, присое
в CAR T терапии [235].
диненный к МНТ, обладал на три порядка уве
личенной фотоцитотоксичностью на культурах
раковых клеток со сверхэкспрессией EGFR по
ЗАКЛЮЧЕНИЕ: СОВРЕМЕННЫЕ
сравнению со свободным ФС [229, 202]. Значи
ТЕНДЕНЦИИ И ПЕРСПЕКТИВЫ
тельное увеличение эффективности фотодина
мического действия ФС, присоединенного к
Анализ тенденций исследования EGFR, его
МНТ, по сравнению со свободным было показа
участия в онкологических заболеваниях и разра
но in vivo на бестимусных мышах с привитой
ботке методов использования для лечения пока
эпидермоидной карциномой человека A431, ха
зывает, что, как и прежде, большое внимание
рактеризующейся сверхэкспрессией EGFR. Так,
уделяется способам блокирования EGFR опо
эффективность проводимой ФДТ привела к
средованной сигнализации. Однако все боль
75% выживших животных, при лечении ФС,
ший интерес вызывают подходы, интегрирую
доставляемым МНТ, при 20% выживших живот
щие использование сверхэкспрессии и измене
ных при лечении в идентичных условиях сво
ния в EGFR с дополнительными воздействием,
бодным ФС [203].
прежде всего, поражающим, на раковые клетки
Среди наиболее продвинутых к использова
[93, 236, 237]. Помимо традиционных широко
нию средств необходимо отметить RM 1929,
применяемых комбинаторных подходов с од
представляющее собой иммуноконъюгат ФС
новременным использованием нескольких ле
dyeIRDye700DX с цетуксимабом, антителом к
карств, создаются многофункциональные систе
EGFR, в настоящее время проходящий клини
мы, сочетающие доставку с несколькими однов
ческие испытания для лечения рецидивирую
ременно или последовательно применяемыми
щего рака головы и шеи методом ФДТ [230]. Це
адресами с уничтожающим измененную клетку
лый ряд иммуноконъюгатов ФС mAb или их
воздействием. Наряду с направленным цитоток
фрагментами находится на стадии доклиничес
сическим воздействием рецептор опосредуемая
ких исследований [231].
доставка в клетку мишень может быть использо
Генотерапевтические подходы. Несколько
вана и для вмешательства во внутриклеточную
комбинированных подходов было предложено
регуляцию, например путем доставки блокирую
для транспорта через EGFR генетического мате
щих регуляторные процессы антител или тран
риала, генов и миРНК. Для этого использовали,
скрипционных факторов [238-240]. EGFR, как
например перенацеливание аденовирусной
один из наиболее изученных входов в сигналь
трансфекции на клетки, сверхэкспрессирующие
ную систему, регулирующую извне пролифера
EGFR с помощью химерного белка, состоящего
цию клетки, является часто используемым вари
из EGFR и внеклеточного домена рецептора
антом для обкатки новых систем доставки в
аденовируса hCAR (human coxsackie B and adeno
клетку мишень. Сложности на пути практичес
virus receptor) [232]. Модифицированный адено
кого использования таких подходов добавляет
вирус, доставляющий ген тимидинкиназы виру
необходимость учета возможностей организма
са простого герпеса человека, обеспечивал
по нейтрализации чужеродных веществ и час
уничтожение клеток опухоли яичников, что за
тиц, однако эти препятствия не выглядят непре
медляло рост ксенографтов [232]. Другим вари
одолимыми в обозримой перспективе.
антом комбинированного подхода является дос
тавка гена натрий иодидного транспортера, ко
торый способен накачивать в клетки иодид. На
Финансирование. Работа была выполнена
ночастицы на основе полиэтиленимина и GE11
при поддержке Российского фонда фундамен
доставляли этот ген в ксенографты рака толстой
тальных исследований (грант
№ 19 14
кишки, что обеспечивало как визуализацию
50385\19).
опухолей, так и торможение их роста [233]. Ли
Конфликт интересов. Авторы заявляют об от
посомы с миРНК для инактивации сурвивина с
сутствии конфликта интересов.
двумя лигандами - пептид GE11 к EGFR и гиа
Соблюдение этических норм. Настоящая
луроновая кислота к CD44 - тормозили рост
статья не содержит каких либо исследований с
ксенографтов гепатоцеллюлярной карциномы
участием людей или использованием животных
[234]. Нельзя не отметить, что EGFR, в особен
в качестве объектов.
БИОХИМИЯ том 85 вып. 9 2020
ИСПОЛЬЗОВАНИЕ EGFR ДЛЯ ДОСТАВКИ ЛЕКАРСТВ В КЛЕТКИ
1179
СПИСОК ЛИТЕРАТУРЫ
1.
Jorissen, R. N., Walker, F., Pouliot, N., Garrett, T. P.,
MET in lung cancer with MET amplification, Br. J.
Ward, C. W., and Burgess, A. W. (2003) Epidermal growth
Cancer, 105, 807 813, doi: 10.1038/bjc.2011.322.
factor receptor: mechanisms of activation and signalling,
16.
Peace, B. E., Hill, K. J., Degen, S. J., and Waltz, S. E.
Exp. Cell Res.,
284,
3153, doi:
10.1016/s0014
(2003) Cross talk between the receptor tyrosine kinases
4827(02)00098 8.
Ron and epidermal growth factor receptor, Exp. Cell Res.,
2.
Yarden, Y., and Pines, G. (2012) The ERBB network: at
289, 317 325, doi: 10.1016/s0014 4827(03)00280 5.
last, cancer therapy meets systems biology, Nat. Rev.
17.
Morgillo, F., Woo, J. K., Kim, E. S., Hong, W. K., and
Cancer, 12, 553 563, doi: 10.1038/nrc3309.
Lee, H. Y. (2006) Heterodimerization of insulin like
3.
Roskoski, R., Jr. (2014) The ErbB/HER family of protein
growth factor receptor/epidermal growth factor receptor
tyrosine kinases and cancer, Pharmacol. Res., 79, 34 74,
and induction of survivin expression counteract the antitu
doi: 10.1016/j.phrs.2013.11.002.
mor action of erlotinib, Cancer Res., 66, 10100 10111,
4.
Lamouille, S., Xu, J., and Derynck, R. (2014) Molecular
doi: 10.1158/0008 5472.CAN 06 1684.
mechanisms of epithelial mesenchymal transition, Nat.
18.
Needham, S. R., Roberts, S. K., Arkhipov, A., Mysore, V. P.,
Rev. Mol. Cell Biol., 15, 178 196, doi: 10.1038/nrm3758.
Tynan, C. J., Zanetti Domingues, L. C., Kim, E. T.,
5.
Sigismund, S., Avanzato, D., and Lanzetti, L.
(2018)
Losasso, V., Korovesis, D., Hirsch, M., Rolfe, D. J.,
Emerging functions of the EGFR in cancer, Mol. Oncol.,
Clarke, D. T., Winn, M. D., Lajevardipour, A., Clayton, A. H.,
12, 3 20, doi: 10.1002/1878 0261.12155.
Pike, L. J., Perani, M., Parker, P. J., Shan, Y., Shaw, D. E.,
6.
Lemmon, M. A., Schlessinger, J., and Ferguson, K. M.
and Martin Fernandez, M. L. (2016) EGFR oligomeriza
(2014) The EGFR family: not so prototypical receptor
tion organizes kinase active dimers into competent sig
tyrosine kinases, Cold Spring Harb. Perspect. Biol., 6,
nalling platforms, Nat. Commun., 7, 13307, doi: 10.1038/
a020768, doi: 10.1101/cshperspect.a020768.
ncomms13307.
7.
Arkhipov, A., Shan, Y., Das, R., Endres, N. F.,
19.
Ibach, J., Radon, Y., Gelleri, M., Sonntag, M. H.,
Eastwood, M. P., Wemmer, D. E., Kuriyan, J., and Shaw, D. E.
Brunsveld, L., Bastiaens, P. I., and Verveer, P. J. (2015)
(2013) Architecture and membrane interactions of the
Single particle tracking reveals that EGFR signaling activ
EGF receptor, Cell, 152, 557 569, doi: 10.1016/j.cell.2012.
ity is amplified in clathrin coated pits, PLoS One, 10,
12.030.
e0143162, doi: 10.1371/journal.pone.0143162.
8.
Purba, E. R., Saita, E. I., and Maruyama, I. N. (2017)
20.
Clarke, D. T., and Martin Fernandez, M. L. (2019) A brief
Activation of the EGF receptor by ligand binding and
history of single particle tracking of the epidermal growth
oncogenic mutations: the “rotation model”, Cells, 6, 13,
factor receptor, Methods Protoc., 2, 12, doi: 10.3390/
doi: 10.3390/cells6020013.
mps2010012.
9.
Holbro, T., and Hynes, N. E. (2004) ErbB receptors:
21.
Lemmon, M. A., and Schlessinger, J. (2010) Cell signaling
directing key signaling networks throughout life, Annu.
by receptor tyrosine kinases, Cell, 141, 11171134,
Rev. Pharmacol. Toxicol., 44, 195217, doi: 10.1146/
doi: 10.1016/j.cell.2010.06.011.
annurev.pharmtox.44.101802.121440.
22.
Macdonald, J. L., and Pike, L. J. (2008) Heterogeneity in
10.
Frolov, A., Schuller, K., Tzeng, C. W., Cannon, E. E.,
EGF binding affinities arises from negative cooperativity
Ku, B. C., Howard, J. H., Vickers, S. M., Heslin, M. J.,
in an aggregating system, Proc. Natl. Acad. Sci. USA, 105,
Buchsbaum, D. J., and Arnoletti, J. P. (2007) ErbB3
112 117, doi: 10.1073/pnas.0707080105.
expression and dimerization with EGFR influence pancre
23.
Riese, D. J., and Stern, D. F. (1998) Specificity within the
atic cancer cell sensitivity to erlotinib, Cancer Biol. Ther.,
EGF family/ErbB receptor family signaling network,
6, 548 554, doi: 10.4161/cbt.6.4.3849.
Bioessays,
20,
4148, doi:
10.1002/(SICI)1521
11.
Zhu, S., Belkhiri, A., and El Rifai, W. (2011) DARPP 32
1878(199801)20:1<41::AID BIES7>3.0.CO;2 V.
increases interactions between epidermal growth factor
24.
Wang, Y. N., Lee, H. H., Chou, C. K., Yang, W. H., Wei, Y.,
receptor and ERBB3 to promote tumor resistance to gefi
Chen, C. T., Yao, J., Hsu, J. L., Zhu, C., Ying, H., Ye, Y.,
tinib, Gastroenterology, 141, 1738 1748, doi: 10.1053/
Wang, W. J., Lim, S. O., Xia, W., Ko, H. W., Liu, X.,
j.gastro.2011.06.070.
Liu, C. G., Wu, X., Wang, H., Li, D., Prakash, L. R.,
12.
Huang, Z., Wang, Y., Nayak, P. S., Dammann, C. E., and
Katz, M. H., Kang, Y., Kim, M., Fleming, J. B.,
Sanchez Esteban, J. (2012) Stretch induced fetal type II
Fogelman, D., Javle, M., Maitra, A., and Hung, M. C.
cell differentiation is mediated via ErbB1 ErbB4 interac
(2018) Angiogenin/ribonuclease 5 is an EGFR ligand and
tions, J. Biol. Chem., 287, 18091 18102, doi: 10.1074/jbc.
a serum biomarker for erlotinib sensitivity in pancreatic
M111.313163.
cancer, Cancer Cell, 33, 752 769, doi: 10.1016/j.ccell.2018.
13.
Saito, Y., Haendeler, J., Hojo, Y., Yamamoto, K., and
02.012.
Berk, B. C. (2001) Receptor heterodimerization: essential
25.
Wang, Y. N., Lee, H. H., and Hung, M. C. (2018) A novel
mechanism for platelet derived growth factor induced epi
ligand receptor relationship between families of ribonucle
dermal growth factor receptor transactivation, Mol. Cell.
ases and receptor tyrosine kinases, J. Biomed. Sci., 25, 83,
Biol.,
21,
63876394, doi:
10.1128/mcb.21.19.6387
doi: 10.1186/s12929 018 0484 7.
6394.2001.
26.
Pinkas Kramarski, R., Shelly, M., Guarino, B. C.,
14.
Black, P. C., Brown, G. A., Dinney, C. P., Kassouf, W.,
Wang, L. M., Lyass, L., Alroy, I., Alimandi, M., Kuo, A.,
Inamoto, T., Arora, A., Gallagher, D., Munsell, M. F.,
Moyer, J. D., Lavi, S., Eisenstein, M., Ratzkin, B. J.,
Bar Eli, M., McConkey, D. J., and Adam, L. (2011)
Seger, R., Bacus, S. S., Pierce, J. H., Andrews, G. C., and
Receptor heterodimerization: a new mechanism for
Yarden, Y. (1998) ErbB tyrosine kinases and the two
platelet derived growth factor induced resistance to anti
neuregulin families constitute a ligand receptor network,
epidermal growth factor receptor therapy for bladder can
Mol. Cell Biol., 18, 60906101, doi: 10.1128/mcb.18.
cer, J. Urol., 185, 693700, doi: 10.1016/j.juro.2010.
10.6090.
09.082.
27.
Gilmore, J. L., Gallo, R. M., and Riese, D. J. (2006) The
15.
Tanizaki, J., Okamoto, I., Sakai, K., and Nakagawa, K.
epidermal growth factor receptor (EGFR) S442F
(2011) Differential roles of trans phosphorylated EGFR,
mutant displays increased affinity for neuregulin 2beta
HER2, HER3, and RET as heterodimerisation partners of
and agonist independent coupling with downstream sig
БИОХИМИЯ том 85 вып. 9 2020
1180
РОЗЕНКРАНЦ, СЛАСТНИКОВА
nalling events, Biochem. J., 396, 79 88, doi: 10.1042/
nation of the EGFR directs receptor fate, EMBO J., 32,
BJ20051687.
2140 2157, doi: 10.1038/emboj.2013.149.
28.
Santra, M., Reed, C. C., and Iozzo, R. V. (2002) Decorin
42.
Huang, F., Goh, L. K., and Sorkin, A. (2007) EGF recep
binds to a narrow region of the epidermal growth factor
tor ubiquitination is not necessary for its internalization,
(EGF) receptor, partially overlapping but distinct from the
Proc. Natl. Acad. Sci USA, 104, 16904 16909.
EGF binding epitope, J. Biol. Chem., 277, 35671 35681,
43.
Goh, L. K., Huang, F., Kim, W., Gygi, S., and Sorkin, A.
doi: 10.1074/jbc.M205317200.
(2010) Multiple mechanisms collectively regulate clathrin
29.
Zhu, J. X., Goldoni, S., Bix, G., Owens, R. T., McQuillan, D. J.,
mediated endocytosis of the epidermal growth factor
Reed, C. C., and Iozzo, R. V. (2005) Decorin evokes pro
receptor, J. Cell Biol., 189, 871 883, doi: 10.1083/jcb.
tracted internalization and degradation of the epidermal
201001008.
growth factor receptor via caveolar endocytosis, J. Biol.
44.
Oved, S., Mosesson, Y., Zwang, Y., Santonico, E.,
Chem., 280, 32468 32479, doi: 10.1074/jbc.M503833200.
Shtiegman, K., Marmor, M. D., Kochupurakkal, B. S.,
30.
Goldoni, S., Iozzo, R. A., Kay, P., Campbell, S.,
Katz, M., Lavi, S., Cesareni, G., and Yarden, Y. (2006)
McQuillan, A., Agnew, C., Zhu, J. X., Keene, D. R.,
Conjugation to Nedd8 instigates ubiquitylation and down
Reed, C. C., and Iozzo, R. V. (2007) A soluble ectodomain
regulation of activated receptor tyrosine kinases, J. Biol.
of LRIG1 inhibits cancer cell growth by attenuating basal
Chem., 281, 21640 21651, doi: 10.1074/jbc.M513034200.
and ligand dependent EGFR activity, Oncogene, 26, 368
45.
Boucrot, E., Ferreira, A. P., Almeida Souza, L., Debard, S.,
381, doi: 10.1038/sj.onc.1209803.
Vallis, Y., Howard, G., Bertot, L., Sauvonnet, N., and
31.
Zheng, Y., Li, X., Qian, X., Wang, Y., Lee, J. H., Xia, Y.,
McMahon, H. T. (2015) Endophilin marks and controls a
Hawke, D. H., Zhang, G., Lyu, J., and Lu, Z. (2015)
clathrin independent endocytic pathway, Nature, 517,
Secreted and O GlcNAcylated MIF binds to the human
460 465, doi: 10.1038/nature14067.
EGF receptor and inhibits its activation, Nat. Cell Biol., 17,
46.
Sigismund, S., Argenzio, E., Tosoni, D., Cavallaro, E.,
1348 1355, doi: 10.1038/ncb3222.
Polo, S., and Di Fiore, P. P. (2008) Clathrin mediated
32.
Freed, D. M., Bessman, N. J., Kiyatkin, A., Salazar
internalization is essential for sustained EGFR signaling
Cavazos, E., Byrne, P. O., Moore, J. O., Valley, C. C.,
but dispensable for degradation, Dev. Cell, 15, 209 219,
Ferguson, K. M., Leahy, D. J., Lidke, D. S., and Lemmon, M. A.
doi: 10.1016/j.devcel.2008.06.012.
(2017) EGFR ligands differentially stabilize receptor
47.
Sorkin, A., Krolenko, S., Kudrjavtceva, N., Lazebnik, J.,
dimers to specify signaling kinetics, Cell, 171, 683 695,
Teslenko, L., Soderquist, A. M., and Nikolsky, N. (1991)
doi: 10.1016/j.cell.2017.09.017.
Recycling of epidermal growth factor receptor complexes
33.
Macdonald Obermann, J. L., and Pike, L. J. (2014)
in A431 cells: identification of dual pathways, J. Cell Biol.,
Different epidermal growth factor (EGF) receptor ligands
112, 55 63, doi: 10.1083/jcb.112.1.55.
show distinct kinetics and biased or partial agonism for
48.
Soubeyran, P., Kowanetz, K., Szymkiewicz, I., Langdon,
homodimer and heterodimer formation, J. Biol. Chem.,
W. Y., and Dikic, I. (2002) Cbl CIN85 endophilin com
289, 26178 26188, doi: 10.1074/jbc.M114.586826.
plex mediates ligand induced downregulation of EGF
34.
Liao, H. W., Hsu, J. M., Xia, W., Wang, H. L., Wang, Y. N.,
receptors, Nature, 416, 183 187, doi: 10.1038/416183a.
Chang, W. C., Arold, S. T., Chou, C. K., Tsou, P. H.,
49.
Henriksen, L., Grandal, M. V., Knudsen, S. L. J., van
Yamaguchi, H., Fang, Y. F., Lee, H. J., Lee, H. H., Tai, S. K.,
Deurs, B., and Grovdal, L. M. (2013) Internalization
Yang, M. H., Morelli, M. P., Sen, M., Ladbury, J. E.,
mechanisms of the epidermal growth factor receptor after
Chen, C. H., Grandis, J. R., Kopetz, S., and Hung, M. C.
activation with different ligands, PLoS One, 8, e58148,
(2015) PRMT1 mediated methylation of the EGF recep
doi: 10.1371/journal.pone.0058148.
tor regulates signaling and cetuximab response, J. Clin.
50.
West, M. A., Bretscher, M. S., and Watts, C. (1989)
Invest., 125, 4529 4543, doi: 10.1172/JCI82826.
Distinct endocytotic pathways in epidermal growth factor
35.
Wang, W. J., Hsu, J. M., Wang, Y. N., Lee, H. H.,
stimulated human carcinoma A431 cells, J. Cell Biol., 109,
Yamaguchi, H., Liao, H. W., and Hung, M. C. (2019) An
2731 2739, doi: 10.1083/jcb.109.6.2731.
essential role of PRMT1 mediated EGFR methylation in
51.
Yamazaki, T., Zaal, K., Hailey, D., Presley, J., Lippincott
EGFR activation by ribonuclease 5, Am. J. Cancer Res., 9,
Schwartz, J., and Samelson, L. E. (2002) Role of Grb2 in
180 185.
EGF stimulated EGFR internalization, J. Cell Sci., 115,
36.
Caldieri, G., Malabarba, M. G., Di Fiore, P. P., and
1791 1802.
Sigismund, S. (2018) EGFR trafficking in physiology and
52.
Orth, J. D., Krueger, E. W., Weller, S. G., and McNiven, M. A.
cancer, Prog. Mol. Subcell. Biol.,
57,
235272,
(2006) A novel endocytic mechanism of epidermal growth
doi: 10.1007/978 3 319 96704 2_9.
factor receptor sequestration and internalization, Cancer
37.
Sorkin, A., and Goh, L. K. (2008) Endocytosis and intra
Res., 66, 3603 3610, doi: 10.1158/0008 5472.CAN 05
cellular trafficking of ErbBs, Exp. Cell Res., 315, 683 696,
2916.
doi: 10.1016/j.yexcr.2008.07.029.
53.
Tomas, A., Futter, C. E., and Eden, E. R. (2014) EGF
38.
Goh, L. K., and Sorkin, A. (2013) Endocytosis of receptor
receptor trafficking: consequences for signaling and cancer,
tyrosine kinases, Cold Spring Harb. Perspect. Biol., 5,
Trends Cell Biol., 24, 26 34.
a017459, doi: 10.1101/cshperspect.a017459.
54.
Wang, Y. N., Wang, H., Yamaguchi, H., Lee, H. J., Lee, H.
39.
Waterman, H., Levkowitz, G., Alroy, I., and Yarden, Y.
H., and Hung, M. C. (2010) COPI mediated retrograde
(1999) The RING finger of c Cbl mediates desensitization
trafficking from the Golgi to the ER regulates EGFR
of the epidermal growth factor receptor, J. Biol. Chem.,
nuclear transport, Biochem. Biophys. Res. Commun., 399,
274, 22151 22154, doi: 10.1074/jbc.274.32.22151.
498 504, doi: 10.1016/j.bbrc.2010.07.096.
40.
Jiang, X., Huang, F., Marusyk, A., and Sorkin, A. (2003)
55.
Demory, M. L., Boerner, J. L., Davidson, R., Faust, W.,
Grb2 regulates internalization of EGF receptors through
Miyake, T., Lee, I., Huttemann, M., Douglas, R., Haddad, G.,
clathrin coated pits, Mol. Biol. Cell,
14,
858870,
and Parsons, S. J. (2009) Epidermal growth factor receptor
doi: 10.1091/mbc.e02 08 0532.
translocation to the mitochondria: regulation and effect, J.
41.
Sigismund, S., Algisi, V., Nappo, G., Conte, A., Pascolutti, R.,
Biol. Chem., 284, 36592 36604, doi: 10.1074/jbc.M109.
Cuomo, A., Bonaldi, T., Argenzio, E., Verhoef, L. G.,
000760.
Maspero, E., Bianchi, F., Capuani, F., Ciliberto, A., Polo, S.,
56.
Cao, X., Zhu, H., Ali Osman, F., and Lo, H. W. (2011)
and Di Fiore, P. P. (2013) Threshold controlled ubiquiti
EGFR and EGFRvIII undergo stress and EGFR kinase
БИОХИМИЯ том 85 вып. 9 2020
ИСПОЛЬЗОВАНИЕ EGFR ДЛЯ ДОСТАВКИ ЛЕКАРСТВ В КЛЕТКИ
1181
inhibitor induced mitochondrial translocalization: a
of the EGFR by tumor hypoxia provides a nonmutational
potential mechanism of EGFR driven antagonism of
explanation for its overexpression in human cancer, Proc.
apoptosis, Mol. Cancer, 10, 26, doi: 10.1186/1476 4598
Natl. Acad. Sci. USA, 104, 13092 13097, doi: 10.1073/
10 26.
pnas.0702387104.
57.
Wang, T. H., Lin, Y. H., Yang, S. C., Chang, P. C.,
72.
Liu, X., Wang, P., Zhang, C., and Ma, Z. (2017) Epidermal
Wang, T. C., and Chen, C. Y. (2017) Tid1 S regulates the
growth factor receptor (EGFR): a rising star in the era of
mitochondrial localization of EGFR in non small cell lung
precision medicine of lung cancer, Oncotarget, 8, 50209
carcinoma, Oncogenesis, 6, e361, doi: 10.1038/oncsis.
50220, doi: 10.18632/oncotarget.16854.
2017.62.
73.
Grandis, J. R., and Tweardy, D. J. (1993) Elevated levels of
58.
Che, T. F., Lin, C. W., Wu, Y. Y., Chen, Y. J., Han, C. L.,
transforming growth factor alpha and epidermal growth
Chang, Y. L., Wu, C. T., Hsiao, T. H., Hong, T. M., and
factor receptor messenger RNA are early markers of car
Yang, P. C. (2015) Mitochondrial translocation of EGFR
cinogenesis in head and neck cancer, Cancer Res., 53,
regulates mitochondria dynamics and promotes metastasis
3579 3584.
in NSCLC, Oncotarget, 6, 37349 37366, doi: 10.18632/
74.
Atkins, D., Reiffen, K. A., Tegtmeier, C. L., Winther, H.,
oncotarget.5736.
Bonato, M. S., and Storkel, S. (2004) Immunohisto
59.
Hsu, S. C., and Hung, M. C. (2007) Characterization of a
chemical detection of EGFR in paraffin embedded tumor
novel tripartite nuclear localization sequence in the EGFR
tissues: variation in staining intensity due to choice of fixa
family, J. Biol. Chem., 282, 10432 10440, doi: 10.1074/
tive and storage time of tissue sections, J. Histochem.
jbc.M610014200.
Cytochem., 52, 893 901, doi: 10.1369/jhc.3A6195.2004.
60.
Shah, P., Chaumet, A., Royle, S. J., and Bard, F. A. (2019)
75.
Yen, L. C., Uen, Y. H., Wu, D. C., Lu, C. Y., Yu, F. J.,
The NAE pathway: autobahn to the nucleus for cell surface
Wu, I. C., Lin, S. R., and Wang, J. Y. (2010) Activating
receptors, Cells, 8, doi: 10.3390/cells8080915.
KRAS mutations and overexpression of epidermal growth
61.
Lo, H. W., Ali Seyed, M., Wu, Y., Bartholomeusz, G.,
factor receptor as independent predictors in metastatic colo
Hsu, S. C., and Hung, M. C. (2006) Nuclear cytoplasmic
rectal cancer patients treated with cetuximab, Ann. Surg.,
transport of EGFR involves receptor endocytosis, importin
251, 254 260, doi: 10.1097/SLA.0b013e3181bc9d96.
beta1 and CRM1, J. Cell Biochem., 98, 15701583,
76.
Lee, H. J., Xu, X., Choe, G., Chung, D. H., Seo, J. W.,
doi: 10.1002/jcb.20876.
Lee, J. H., Lee, C. T., Jheon, S., Sung, S. W., and
62.
De Angelis Campos, A. C., Rodrigues, M. A., de Andrade, C.,
Chung, J. H. (2010) Protein overexpression and gene
de Goes, A. M., Nathanson, M. H., and Gomes, D. A.
amplification of epidermal growth factor receptor in nons
(2011) Epidermal growth factor receptors destined for the
mall cell lung carcinomas: comparison of four commercial
nucleus are internalized via a clathrin dependent pathway,
ly available antibodies by immunohistochemistry and fluo
Biochem. Biophys. Res. Commun.,
412,
341346,
rescence in situ hybridization study, Lung Cancer, 68, 375
doi: 10.1016/j.bbrc.2011.07.100.
382, doi: 10.1016/j.lungcan.2009.07.014.
63.
Lo, H. W. (2010) Nuclear mode of the EGFR signaling
77.
Gatalica, Z., Millis, S. Z., Vranic, S., Bender, R., Basu, G. D.,
network: biology, prognostic value, and therapeutic impli
Voss, A., and Von Hoff, D. D. (2014) Comprehensive
cations, Discov. Med., 10, 44 51.
tumor profiling identifies numerous biomarkers of drug
64.
Faria, J. A. Q. A., de Andrade, C., Goes, A. M., Rodrigues, M. A.,
response in cancers of unknown primary site: analysis of
and Gomes, D. A. (2016) Effects of different ligands on
1806 cases, Oncotarget, 5, 12440 12447, doi: 10.18632/
epidermal growth factor receptor (EGFR) nuclear translo
oncotarget.2574.
cation, Biochem. Biophys. Res. Commun., 478, 39 45,
78.
Verhaak, R. G., Hoadley, K. A., Purdom, E., Wang, V., Qi, Y.,
doi: 10.1016/j.bbrc.2016.07.097.
et al. (2010) Integrated genomic analysis identifies clinical
65.
Han, W., and Lo, H. W. (2012) Landscape of EGFR signal
ly relevant subtypes of glioblastoma characterized by
ing network in human cancers: biology and therapeutic
abnormalities in PDGFRA, IDH1, EGFR, and NF1,
response in relation to receptor subcellular locations, Cancer
Cancer Cell, 17, 98 110.
Lett., 318, 124 134, doi: 10.1016/j.canlet.2012.01.011.
79.
Herbst, R. S., and Shin, D. M. (2002) Monoclonal anti
66.
Wang, Y. N., Yamaguchi, H., Hsu, J. M., and Hung, M. C.
bodies to target epidermal growth factor receptor positive
(2010) Nuclear trafficking of the epidermal growth factor
tumors: a new paradigm for cancer therapy, Cancer, 94,
receptor family membrane proteins, Oncogene, 29, 3997
1593 1611, doi: 10.1002/cncr.10372.
4006, doi: 10.1038/onc.2010.157.
80.
Kalyankrishna, S., and Grandis, J. R. (2006) Epidermal
67.
Wang, Y. N., Yamaguchi, H., Huo, L., Du, Y., Lee, H. J.,
growth factor receptor biology in head and neck cancer, J.
Lee, H. H., Wang, H., Hsu, J. M., and Hung, M. C. (2010)
Clin. Oncol., 24, 26662672, doi: 10.1200/JCO.2005.
The translocon Sec61beta localized in the inner nuclear
04.8306.
membrane transports membrane embedded EGF receptor
81.
Chua, D. T., Nicholls, J. M., Sham, J. S., and Au, G. K.
to the nucleus, J. Biol. Chem.,
285,
3872038729,
(2004) Prognostic value of epidermal growth factor recep
doi: 10.1074/jbc.M110.158659.
tor expression in patients with advanced stage nasopharyn
68.
Liao, H. J., and Carpenter, G. (2007) Role of the Sec61
geal carcinoma treated with induction chemotherapy and
translocon in EGF receptor trafficking to the nucleus and
radiotherapy, Int. J. Radiat. Oncol. Biol. Phys., 59, 11 20,
gene expression, Mol. Biol. Cell,
18,
10641072,
doi: 10.1016/j.ijrobp.2003.10.038.
doi: 10.1091/mbc.e06 09 0802.
82.
Wei, Q., Chen, L., Sheng, L., Nordgren, H., Wester, K.,
69.
Chaumet, A., Wright, G. D., Seet, S. H., Tham, K. M.,
and Carlsson, J. (2007) EGFR, HER2 and HER3 expres
Gounko, N. V., and Bard, F. (2015) Nuclear envelope
sion in esophageal primary tumours and corresponding
associated endosomes deliver surface proteins to the nucle
metastases, Int. J. Oncol., 31, 493 499.
us, Nat. Commun., 6, 8218, doi: 10.1038/ncomms9218.
83.
Grobe, A., Eichhorn, W., Fraederich, M., Kluwe, L.,
70.
Chia, P. L., Scott, A. M., and John, T. (2019) Epidermal
Vashist, Y., Wikner, J., Smeets, R., Simon, R., Sauter, G.,
growth factor receptor (EGFR) targeted therapies in
Heiland,
M., and Blessmann, M.
(2014)
mesothelioma, Expert Opin. Drug Deliv., 16, 441 451,
Immunohistochemical and FISH analysis of EGFR and its
doi: 10.1080/17425247.2019.1598374.
prognostic value in patients with oral squamous cell carci
71.
Franovic, A., Gunaratnam, L., Smith, K., Robert, I.,
noma, J. Oral. Pathol. Med., 43, 205 210, doi: 10.1111/jop.
Patten, D., and Lee, S. (2007) Translational up regulation
12111.
БИОХИМИЯ том 85 вып. 9 2020
1182
РОЗЕНКРАНЦ, СЛАСТНИКОВА
84.
Wang, X., Niu, H., Fan, Q., Lu, P., Ma, C., Liu, W.,
Amir, E., and Vera Badillo, F. E. (2018) Epidermal growth
Liu, Y., Li, W., Hu, S., Ling, Y., Guo, L., Ying, J., and
factor receptor overexpression and outcomes in early breast
Huang, J. (2016) Predictive value of EGFR overexpression
cancer: a systematic review and a meta analysis, Cancer
and gene amplification on icotinib efficacy in patients with
Treat. Rev., 62, 1 8, doi: 10.1016/j.ctrv.2017.10.008.
advanced esophageal squamous cell carcinoma,
98. Sheng, Q., and Liu, J. (2011) The therapeutic potential of
Oncotarget, 7, 24744 24751, doi: 10.18632/oncotarget.
targeting the EGFR family in epithelial ovarian cancer, Br.
8271.
J. Cancer, 104, 1241 1245, doi: 10.1038/bjc.2011.62.
85.
Politi, A., Tsiambas, E., Mastronikolis, N. S., Peschos, D.,
99. Wang, K., Li, D., and Sun, L. (2016) High levels of EGFR
Asproudis, I., Kyrodimos, E., Armata, I. E., Chrysovergis, A.,
expression in tumor stroma are associated with aggressive
Asimakopoulos, A., Papanikolaou, V. S., Batistatou, A.,
clinical features in epithelial ovarian cancer, Onco Targets
and Ragos, V. (2019) Combined EGFR/ALK expression
Ther., 9, 377 386, doi: 10.2147/OTT.S96309.
analysis in laryngeal squamous cell carcinoma, In Vivo, 33,
100. Perren, T. J. (2016) Mucinous epithelial ovarian carcino
815 819, doi: 10.21873/invivo.11544.
ma, Ann. Oncol., 27 Suppl. 1, i53 i57, doi: 10.1093/
86.
Schrevel, M., Gorter, A., Kolkman Uljee, S. M., Trimbos, J. B.,
annonc/mdw087.
Fleuren, G. J., and Jordanova, E. S. (2011) Molecular
101. Shinojima, N., Tada, K., Shiraishi, S., Kamiryo, T., Kochi, M.,
mechanisms of epidermal growth factor receptor overex
Nakamura, H., Makino, K., Saya, H., Hirano, H.,
pression in patients with cervical cancer, Mod. Pathol., 24,
Kuratsu, J., Oka, K., Ishimaru, Y., and Ushio, Y. (2003)
720 728, doi: 10.1038/modpathol.2010.239.
Prognostic value of epidermal growth factor receptor in
87.
Gui, T., and Shen, K. (2012) The epidermal growth factor
patients with glioblastoma multiforme, Cancer Res., 63,
receptor as a therapeutic target in epithelial ovarian cancer,
6962 6970.
Cancer Epidemiol., 36, 490 496, doi: 10.1016/j.canep.2012.
102. Zhao, L. L., Xu, K. L., Wang, S. W., Hu, B. L., and
06.005.
Chen, L. R. (2012) Pathological significance of epidermal
88.
Tian, W. J., Huang, M. L., Qin, Q. F., Chen, Q., Fang, K.,
growth factor receptor expression and amplification in
and Wang, P. L. (2016) Prognostic impact of epidermal
human gliomas, Histopathology, 61, 726 736, doi: 10.1111/
growth factor receptor overexpression in patients with cer
j.1365 2559.2012.04354.x.
vical cancer: a meta analysis, PLoS One, 11, e0158787,
103. Wang, X., Zhang, S., MacLennan, G. T., Eble, J. N.,
doi: 10.1371/journal.pone.0158787.
Lopez Beltran, A., Yang, X. J., Pan, C. X., Zhou, H.,
89.
Li, Q., Tang, Y., Cheng, X., Ji, J., Zhang, J., and Zhou, X.
Montironi, R., and Cheng, L. (2007) Epidermal growth
(2014) EGFR protein expression and gene amplification in
factor receptor protein expression and gene amplification
squamous intraepithelial lesions and squamous cell carci
in small cell carcinoma of the urinary bladder, Clin. Cancer
nomas of the cervix, Int. J. Clin. Exp. Pathol., 7, 733 741.
Res., 13, 953 957, doi: 10.1158/1078 0432.CCR 06 2167.
90.
Rokita, M., Stec, R., Bodnar, L., Charkiewicz, R.,
104. Chaux, A., Cohen, J. S., Schultz, L., Albadine, R.,
Korniluk, J., Smoter, M., Cichowicz, M., Chyczewski, L.,
Jadallah, S., Murphy, K. M., Sharma, R., Schoenberg, M. P.,
Niklinski, J., Kozlowski, W., and Szczylik, C.
(2013)
and Netto, G. J. (2012) High epidermal growth factor
Overexpression of epidermal growth factor receptor as a
receptor immunohistochemical expression in urothelial
prognostic factor in colorectal cancer on the basis of the
carcinoma of the bladder is not associated with EGFR
Allred scoring system, Onco. Targets Ther., 6, 967 976,
mutations in exons 19 and 21: a study using formalin fixed,
doi: 10.2147/OTT.S42446.
paraffin embedded archival tissues, Hum. Pathol., 43,
91.
Yun, S., Kwak, Y., Nam, S. K., Seo, A. N., Oh, H. K.,
1590 1595, doi: 10.1016/j.humpath.2011.11.016.
Kim, D. W., Kang, S. B., and Lee, H. S. (2018) Ligand
105. Carlsson, J., Wester, K., De La Torre, M., Malmstrom, P. U.,
independent epidermal growth factor receptor overexpres
and Gardmark, T. (2015) EGFR expression in primary
sion correlates with poor prognosis in colorectal cancer,
urinary bladder cancer and corresponding metastases and
Cancer Res. Treat., 50, 1351 1361, doi: 10.4143/crt.2017.
the relation to HER2 expression. On the possibility to tar
487.
get these receptors with radionuclides, Radiol. Oncol., 49,
92.
Huang, C. W., Chen, Y. T., Tsai, H. L., Yeh, Y. S., Su, W. C.,
50 58, doi: 10.2478/raon 2014 0015.
Ma, C. J., Tsai, T. N., and Wang, J. Y. (2017) EGFR
106. Girard, N. (2010) Thymic tumors: relevant molecular data
expression in patients with stage III colorectal cancer after
in the clinic, J. Thorac. Oncol.,
5, S291 S295,
adjuvant chemotherapy and on cancer cell function,
doi: 10.1097/JTO.0b013e3181f209b9.
Oncotarget, 8, 114663 114676, doi: 10.18632/oncotarget.
107. Rusch, V. W., Klimstra, D. S., and Venkatraman, E. S.
23072.
(1996) Molecular markers help characterize neuroen
93.
Grapa, C. M., Mocan, T., Gonciar, D., Zdrehus, C.,
docrine lung tumors, Ann. Thorac. Surg., 62, 798 809,
Mosteanu, O., Pop, T., and Mocan, L. (2019) Epidermal
doi: 10.1016/s0003 4975(96)00435 3.
growth factor receptor and its role in pancreatic cancer
108. Srirajaskanthan, R., Shah, T., Watkins, J., Marelli, L.,
treatment mediated by nanoparticles, Int. J. Nanomedicine,
Khan, K., and Caplin, M. E. (2010) Expression of the
14, 9693 9706, doi: 10.2147/IJN.S226628.
HER 1 4 family of receptor tyrosine kinases in neuroen
94.
Cook, N., Frese, K. K., and Moore, M. (2014) Assessing
docrine tumours, Oncol. Rep., 23, 909 915, doi: 10.3892/
the role of the EGF receptor in the development and pro
or_00000714.
gression of pancreatic cancer, Gastrointest Cancer, 4, 23 37.
109. London, M., and Gallo, E. (2020) Epidermal growth fac
95.
Karandish, F., and Mallik, S. (2016) Biomarkers and tar
tor receptor (EGFR) involvement in epithelial derived
geted therapy in pancreatic cancer, Biomarkers Cancer, 8,
cancers and its current antibody based immunotherapies,
BIC S34414.
Cell Biol. Int., 44, 1267 1282, doi: 10.1002/cbin.11340.
96.
Park, S. J., Gu, M. J., Lee, D. S., Yun, S. S., Kim, H. J.,
110. Cunningham, D., Humblet, Y., Siena, S., Khayat, D.,
and Choi, J. H. (2015) EGFR expression in pancreatic
Bleiberg, H., Santoro, A., Bets, D., Mueser, M., Harstrick, A.,
intraepithelial neoplasia and ductal adenocarcinoma, Int.
Verslype, C., Chau, I., and Van Cutsem, E.
(2004)
J. Clin. Exp. Pathol., 8, 8298 8304.
Cetuximab monotherapy and cetuximab plus irinotecan in
97.
Gonzalez Conchas, G. A., Rodriguez Romo, L.,
irinotecan refractory metastatic colorectal cancer, N. Engl.
Hernandez Barajas, D., Gonzalez Guerrero, J. F.,
J. Med., 351, 337 345, doi: 10.1056/NEJMoa033025.
Rodriguez Fernandez, I. A., Verdines Perez, A.,
111.
Trivedi, S., Srivastava, R. M., Concha Benavente, F.,
Templeton, A. J., Ocana, A., Seruga, B., Tannock, I. F.,
Ferrone, S., Garcia Bates, T. M., Li, J., and Ferris, R. L.
БИОХИМИЯ том 85 вып. 9 2020
ИСПОЛЬЗОВАНИЕ EGFR ДЛЯ ДОСТАВКИ ЛЕКАРСТВ В КЛЕТКИ
1183
(2016) Anti EGFR targeted monoclonal antibody isotype
Lancet Respir. Med., 5, 707 716, doi: 10.1016/S2213
influences antitumor cellular immunity in head and neck
2600(17)30262 X.
cancer patients, Clin. Cancer Res.,
22,
52295237,
124. Mok, T. S., Wu, Y. L., Thongprasert, S., Yang, C. H.,
doi: 10.1158/1078 0432.CCR 15 2971.
Chu, D. T., Saijo, N., Sunpaweravong, P., Han, B.,
112. Cohenuram, M., and Saif, M. W. (2007) Panitumumab the
Margono, B., Ichinose, Y., Nishiwaki, Y., Ohe, Y., Yang, J. J.,
first fully human monoclonal antibody: from the bench to
Chewaskulyong, B., Jiang, H., Duffield, E. L., Watkins, C. L.,
the clinic, Anticancer Drugs, 18, 7 15, doi: 10.1097/CAD.
Armour, A. A., and Fukuoka, M. (2009) Gefitinib or carbo
0b013e32800feecb.
platin paclitaxel in pulmonary adenocarcinoma, N. Engl. J.
113. Thatcher, N., Hirsch, F. R., Luft, A. V., Szczesna, A.,
Med., 361, 947 957, doi: 10.1056/NEJMoa0810699.
Ciuleanu, T. E., Dediu, M., Ramlau, R., Galiulin, R. K.,
125. Sequist, L. V., Waltman, B. A., Dias Santagata, D.,
Balint, B., Losonczy, G., Kazarnowicz, A., Park, K.,
Digumarthy, S., Turke, A. B., Fidias, P., Bergethon, K.,
Schumann, C., Reck, M., Depenbrock, H., Nanda, S.,
Shaw, A. T., Gettinger, S., Cosper, A. K., Akhavanfard, S.,
Kruljac Letunic, A., Kurek, R., Paz Ares, L., and
Heist, R. S., Temel, J., Christensen, J. G., Wain, J. C.,
Socinski, M. A. (2015) Necitumumab plus gemcitabine
Lynch, T. J., Vernovsky, K., Mark, E. J., Lanuti, M.,
and cisplatin versus gemcitabine and cisplatin alone as
Iafrate, A. J., Mino Kenudson, M., and Engelman, J. A.
first line therapy in patients with stage IV squamous non
(2011) Genotypic and histological evolution of lung can
small cell lung cancer (SQUIRE): an open label, ran
cers acquiring resistance to EGFR inhibitors, Sci. Transl.
domised, controlled phase 3 trial, Lancet Oncol., 16, 763
Med., 3, 75ra26, doi: 10.1126/scitranslmed.3002003.
774, doi: 10.1016/S1470 2045(15)00021 2.
126. Pao, W., Miller, V. A., Politi, K. A., Riely, G. J., Somwar, R.,
114. Li, J., and Yan, H. (2018) Skin toxicity with anti EGFR
Zakowski, M. F., Kris, M. G., and Varmus, H. (2005)
monoclonal antibody in cancer patients: a meta analysis of
Acquired resistance of lung adenocarcinomas to gefitinib
65 randomized controlled trials, Cancer Chemother.
or erlotinib is associated with a second mutation in the
Pharmacol., 82, 571 583, doi: 10.1007/s00280 018 3644 2.
EGFR kinase domain, PLoS Med.,
2, e73,
115. Boland, W. K., and Bebb, G. (2009) Nimotuzumab: a novel
doi: 10.1371/journal.pmed.0020073.
anti EGFR monoclonal antibody that retains anti EGFR
127. Murtuza, A., Bulbul, A., Shen, J. P., Keshavarzian, P.,
activity while minimizing skin toxicity, Expert Opin. Biol.
Woodward, B. D., Lopez Diaz, F. J., Lippman, S. M., and
Ther., 9, 1199 1206, doi: 10.1517/14712590903110709.
Husain, H. (2019) Novel third generation EGFR tyrosine
116. Garrido, G., Tikhomirov, I. A., Rabasa, A., Yang, E.,
kinase inhibitors and strategies to overcome therapeutic
Gracia, E., Iznaga, N., Fernandez, L. E., Crombet, T.,
resistance in lung cancer, Cancer Res., 79, 689698,
Kerbel, R. S., and Perez, R. (2011) Bivalent binding by
doi: 10.1158/0008 5472.CAN 18 1281.
intermediate affinity of nimotuzumab: a contribution to
128. Soria, J. C., Ohe, Y., Vansteenkiste, J., Reungwetwattana, T.,
explain antibody clinical profile, Cancer Biol. Ther., 11,
Chewaskulyong, B., Lee, K. H., Dechaphunkul, A.,
373 382, doi: 10.4161/cbt.11.4.14097.
Imamura, F., Nogami, N., Kurata, T., Okamoto, I., Zhou, C.,
117. Ciardiello, F., and Tortora, G. (2008) EGFR antagonists in
Cho, B. C., Cheng, Y., Cho, E. K., Voon, P. J., Planchard, D.,
cancer treatment, N. Engl. J. Med., 358, 1160 1174,
Su, W. C., Gray, J. E., Lee, S. M., Hodge, R., Marotti, M.,
doi: 10.1056/NEJMra0707704.
Rukazenkov, Y., and Ramalingam, S. S. (2018) Osimer
118. Therkildsen, C., Bergmann, T. K., Henrichsen Schnack, T.,
tinib in untreated EGFR mutated advanced non small
Ladelund, S., and Nilbert, M. (2014) The predictive value
cell lung cancer, N. Engl. J. Med., 378, 113125,
of KRAS, NRAS, BRAF, PIK3CA and PTEN for anti
doi: 10.1056/NEJMoa1713137.
EGFR treatment in metastatic colorectal cancer: a system
129. Ramalingam, S. S., Vansteenkiste, J., Planchard, D.,
atic review and meta analysis, Acta Oncol., 53, 852 864,
Cho, B. C., Gray, J. E., Ohe, Y., Zhou, C.,
doi: 10.3109/0284186X.2014.895036.
Reungwetwattana, T., Cheng, Y., Chewaskulyong, B.,
119. Lu, Y., Zhao, X., Liu, Q., Li, C., Graves Deal, R., Cao, Z.,
Shah, R., Cobo, M., Lee, K. H., Cheema, P., Tiseo, M.,
Singh, B., Franklin, J. L., Wang, J., Hu, H., Wei, T., Yang,
John, T., Lin, M.C., Imamura, F., Kurata, T., Todd, A.,
M., Yeatman, T. J., Lee, E., Saito Diaz, K., Hinger, S.,
Hodge, R., Saggese, M., Rukazenkov, Y., and Soria, J. C.
Patton, J. G., Chung, C. H., Emmrich, S., Klusmann, J. H.,
(2020) Overall survival with osimertinib in untreated,
Fan, D., and Coffey, R. J. (2017) lncRNA MIR100HG
EGFR mutated advanced NSCLC, N. Engl. J. Med., 382,
derived miR 100 and miR 125b mediate cetuximab resis
41 50, doi: 10.1056/NEJMoa1913662.
tance via Wnt/beta catenin signaling, Nat. Med., 23, 1331
130. Nagano, T., Tachihara, M., and Nishimura, Y. (2018)
1341, doi: 10.1038/nm.4424.
Mechanism of resistance to epidermal growth factor recep
120. Misale, S., Yaeger, R., Hobor, S., Scala, E., Janakiraman, M.,
tor tyrosine kinase inhibitors and a potential treatment
et al. (2012) Emergence of KRAS mutations and acquired
strategy, Cells, 7, doi: 10.3390/cells7110212.
resistance to anti EGFR therapy in colorectal cancer,
131. Li, R., Zhou, X., Yao, H., and Li, L. (2020) Four genera
Nature, 486, 532 536, doi: 10.1038/nature11156.
tions of EGFR TKIs associated with different pathogenic
121. Siravegna, G., Mussolin, B., Buscarino, M., Corti, G.,
mutations in non small cell lung carcinoma, J. Drug
Cassingena, A., et al. (2015) Clonal evolution and resis
Target, 1 12, doi: 10.1080/1061186X.2020.1737934.
tance to EGFR blockade in the blood of colorectal cancer
132. Vyse, S., and Huang, P. H. (2019) Targeting EGFR exon
patients, Nat. Med., 21, 795 801, doi: 10.1038/nm.3870.
20 insertion mutations in non small cell lung cancer,
122. Roskoski, R., Jr. (2020) Properties of FDA approved small
Signal. Transduct. Target Ther., 4, 5, doi: 10.1038/s41392
molecule protein kinase inhibitors: A 2020 update,
019 0038 9.
Pharmacol. Res., 152, 104609, doi: 10.1016/j.phrs.2019.
133. Sordella, R., Bell, D. W., Haber, D. A., and Settleman, J.
104609.
(2004) Gefitinib sensitizing EGFR mutations in lung can
123. Yang, J. J., Zhou, C., Huang, Y., Feng, J., Lu, S., Song, Y.,
cer activate anti apoptotic pathways, Science, 305, 1163
Huang, C., Wu, G., Zhang, L., Cheng, Y., Hu, C., Chen, G.,
1167, doi: 10.1126/science.1101637.
Zhang, L., Liu, X., Yan, H. H., Tan, F. L., Zhong, W., and
134. Oxnard, G. R., Hu, Y., Mileham, K. F., Husain, H., Costa, D. B.,
Wu, Y. L. (2017) Icotinib versus whole brain irradiation in
Tracy, P., Feeney, N., Sholl, L. M., Dahlberg, S. E.,
patients with EGFR mutant non small cell lung cancer
Redig, A. J., Kwiatkowski, D. J., Rabin, M. S., Paweletz, C. P.,
and multiple brain metastases (BRAIN): a multicentre,
Thress, K. S., and Janne, P. A. (2018) Assessment of resis
phase 3, open label, parallel, randomised controlled trial,
tance mechanisms and clinical implications in patients
БИОХИМИЯ том 85 вып. 9 2020
1184
РОЗЕНКРАНЦ, СЛАСТНИКОВА
with EGFR T790M positive lung cancer and acquired
147. Jaramillo, M. L., Leon, Z., Grothe, S., Paul Roc, B.,
resistance to osimertinib, JAMA Oncol., 4, 1527 1534,
Abulrob, A., and O’Connor, M. M. (2006) Effect of the
doi: 10.1001/jamaoncol.2018.2969.
anti receptor ligand blocking 225 monoclonal antibody on
135. Piotrowska, Z., Isozaki, H., Lennerz, J. K., Gainor, J. F.,
EGF receptor endocytosis and sorting, Exp. Cell Res., 312,
Lennes, I. T., Zhu, V. W., Marcoux, N., Banwait, M. K.,
2778 2790, doi: 10.1016/j.yexcr.2006.05.008.
Digumarthy, S. R., Su, W., Yoda, S., Riley, A. K., Nangia, V.,
148. Liao, H. J., and Carpenter, G. (2009) Cetuximab/C225
Lin, J. J., Nagy, R. J., Lanman, R. B., Dias Santagata, D.,
induced intracellular trafficking of epidermal growth factor
Mino Kenudson, M., Iafrate, A. J., Heist, R. S., Shaw, A. T.,
receptor, Cancer Res., 69, 6179 6183, doi: 10.1158/0008
Evans, E. K., Clifford, C., Ou, S. I., Wolf, B., Hata, A. N.,
5472.CAN 09 0049.
and Sequist, L. V. (2018) Landscape of acquired resistance
149. Bhattacharyya, S., Singh, R. D., Pagano, R., Robertson, J. D.,
to osimertinib in EGFR mutant NSCLC and clinical vali
Bhattacharya, R., and Mukherjee, P. (2012) Switching the
dation of combined EGFR and RET inhibition with
targeting pathways of a therapeutic antibody by nanode
osimertinib and BLU 667 for acquired RET fusion, Cancer
sign, Angew. Chem. Int. Ed. Engl.,
51,
15631567,
Discov., 8, 1529 1539, doi: 10.1158/2159 8290.CD 18
doi: 10.1002/anie.201105432.
1022.
150. Kim, D. H., Kim, D. K., Zhou, K., Park, S., Kwon, Y.,
136. Wang, Q., Yang, S., Wang, K., and Sun, S. Y. (2019) MET
Jeong, M. G., Lee, N. K., and Ryu, S. H. (2017) Single
inhibitors for targeted therapy of EGFR TKI resistant lung
particle tracking based reaction progress kinetic analysis
cancer, J. Hematol. Oncol., 12, 63, doi: 10.1186/s13045
reveals a series of molecular mechanisms of cetuximab
019 0759 9.
induced EGFR processes in a single living cell, Chem. Sci.,
137. Terai, H., Soejima, K., Yasuda, H., Nakayama, S.,
8, 4823 4832, doi: 10.1039/c7sc01159h.
Hamamoto, J., Arai, D., Ishioka, K., Ohgino, K.,
151. Tolmachev, V., and Orlova, A. (2020) Affibody molecules
Ikemura, S., Sato, T., Yoda, S., Satomi, R., Naoki, K., and
as targeting vectors for PET imaging, Cancers (Basel), 12,
Betsuyaku, T. (2013) Activation of the FGF2 FGFR1
doi: 10.3390/cancers12030651.
autocrine pathway: a novel mechanism of acquired resis
152. Gцstring, L., Chew, M. T., Orlova, A., Hoiden
tance to gefitinib in NSCLC, Mol. Cancer Res., 11, 759
Guthenberg, I., Wennborg, A., Carlsson, J., and Frejd, F. Y.
767, doi: 10.1158/1541 7786.MCR 12 0652.
(2010) Quantification of internalization of EGFR binding
138. Schoenfeld, A. J., Chan, J. M., Kubota, D., Sato, H.,
Affibody molecules: methodological aspects, Int. J. Oncol.,
Rizvi, H., Daneshbod, Y., Chang, J. C., Paik, P. K., Offin, M.,
36, 757 763, doi: 10.3892/ijo_00000551.
Arcila, M. E., Davare, M. A., Shinde, U., Pe’er, D.,
153. Genta, I., Chiesa, E., Colzani, B., Modena, T., Conti, B.,
Rekhtman, N., Kris, M. G., Somwar, R., Riely, G. J.,
and Dorati, R. (2017) GE11 peptide as an active targeting
Ladanyi, M., and Yu, H. A. (2020) Tumor analyses reveal
agent in antitumor therapy: a minireview, Pharmaceutics,
squamous transformation and off target alterations as early
10, doi: 10.3390/pharmaceutics10010002.
resistance mechanisms to first line osimertinib in EGFR
154. Li, N., Nguyen, H. H., Byrom, M., and Ellington, A. D.
mutant lung cancer, Clin. Cancer Res., 26, 2654 2663,
(2011) Inhibition of cell proliferation by an anti EGFR
doi: 10.1158/1078 0432.CCR 19 3563.
aptamer, PLoS One, 6, e20299, doi: 10.1371/journal.
139. Zhu, V. W., Klempner, S. J., and Ou, S. I. (2019) Receptor
pone.0020299.
tyrosine kinase fusions as an actionable resistance mecha
155. Maeda, H., Wu, J., Sawa, T., Matsumura, Y., and Hori, K.
nism to EGFR TKIs in EGFR mutant non small cell
(2000) Tumor vascular permeability and the EPR effect in
lung cancer, Trends Cancer, 5, 677 692, doi: 10.1016/
macromolecular therapeutics: a review, J. Control. Release,
j.trecan.2019.09.008.
65, 271 284, doi: 10.1016/s0168 3659(99)00248 5.
140. Cheng, N., Cai, W., Ren, S., Li, X., Wang, Q., Pan, H.,
156. Danhier, F. (2016) To exploit the tumor microenviron
Zhao, M., Li, J., Zhang, Y., Zhao, C., Chen, X., Fei, K.,
ment: since the EPR effect fails in the clinic, what is the
Zhou, C., and Hirsch, F. R. (2015) Long non coding RNA
future of nanomedicine? J. Control. Release, 244, 108 121,
UCA1 induces non T790M acquired resistance to EGFR
doi: 10.1016/j.jconrel.2016.11.015.
TKIs by activating the AKT/mTOR pathway in EGFR
157. Golombek, S. K., May, J. N., Theek, B., Appold, L.,
mutant non small cell lung cancer, Oncotarget, 6, 23582
Drude, N., Kiessling, F., and Lammers, T. (2018) Tumor
23593, doi: 10.18632/oncotarget.4361.
targeting via EPR: strategies to enhance patient responses,
141. Lee, J. K., Lee, J., Kim, S., Kim, S., Youk, J., Park, S., An, Y.,
Adv. Drug Deliv. Rev.,
130,
1738, doi:
10.1016/
Keam, B., Kim, D. W., Heo, D. S., Kim, Y. T., Kim, J. S.,
j.addr.2018.07.007.
Kim, S. H., Lee, J. S., Lee, S. H., Park, K., Ku, J. L.,
158. Park, J., Choi, Y., Chang, H., Um, W., Ryu, J. H., and
Jeon, Y. K., Chung, D. H., Park, P. J., Kim, J., Kim, T. M.,
Kwon, I. C. (2019) Alliance with EPR effect: combined
and Ju, Y. S. (2017) Clonal history and genetic predictors
strategies to improve the EPR effect in the tumor microen
of transformation into small cell carcinomas from lung
vironment, Theranostics, 9, 8073 8090, doi: 10.7150/thno.
adenocarcinomas, J. Clin. Oncol.,
35,
30653074,
37198.
doi: 10.1200/JCO.2016.71.9096.
159. Mamot, C., Ritschard, R., Wicki, A., Stehle, G., Dieterle, T.,
142. Heitzer, E., Ulz, P., and Geigl, J. B. (2015) Circulating
Bubendorf, L., Hilker, C., Deuster, S., Herrmann, R., and
tumor DNA as a liquid biopsy for cancer, Clin. Chem., 61,
Rochlitz, C. (2012) Tolerability, safety, pharmacokinetics,
112 123, doi: 10.1373/clinchem.2014.222679.
and efficacy of doxorubicin loaded anti EGFR immunoli
143. Yohe, S., and Thyagarajan, B. (2017) Review of clinical
posomes in advanced solid tumours: a phase 1 dose escala
next generation sequencing, Arch. Pathol. Lab. Med., 141,
tion study, Lancet Oncol., 13, 1234 1241, doi: 10.1016/
1544 1557, doi: 10.5858/arpa.2016 0501 RA.
S1470 2045(12)70476 X.
144. Greaves, M., and Maley, C. C. (2012) Clonal evolution in
160. Mamot, C., Drummond, D. C., Noble, C. O., Kallab, V.,
cancer, Nature, 481, 306 313, doi: 10.1038/nature10762.
Guo, Z., Hong, K., Kirpotin, D. B., and Park, J. W. (2005)
145. McGranahan, N., and Swanton, C. (2017) Clonal hetero
Epidermal growth factor receptor targeted immunolipo
geneity and tumor evolution: past, present, and the future,
somes significantly enhance the efficacy of multiple anti
Cell, 168, 613 628, doi: 10.1016/j.cell.2017.01.018.
cancer drugs in vivo, Cancer Res., 65, 1163111638,
146. Negrini, S., Gorgoulis, V. G., and Halazonetis, T. D. (2010)
doi: 10.1158/0008 5472.CAN 05 1093.
Genomic instability - an evolving hallmark of cancer, Nat.
161. Pan, X., and Lee, R. J. (2007) Construction of anti EGFR
Rev. Mol. Cell Biol., 11, 220 228, doi: 10.1038/nrm2858.
immunoliposomes via folate folate binding protein affinity,
БИОХИМИЯ том 85 вып. 9 2020
ИСПОЛЬЗОВАНИЕ EGFR ДЛЯ ДОСТАВКИ ЛЕКАРСТВ В КЛЕТКИ
1185
Int. J. Pharm., 336, 276 283, doi: 10.1016/j.ijpharm.2006.
activity of EGFR targeted pH sensitive immunoliposomes
12.007.
encapsulating gemcitabine in A549 xenograft nude mice, J.
162. Pan, X., Wu, G., Yang, W., Barth, R. F., Tjarks, W., and
Control. Release, 140, 5560, doi: 10.1016/j.jconrel.
Lee, R. J. (2007) Synthesis of cetuximab immunolipo
2009.07.005.
somes via a cholesterol based membrane anchor for target
174. Talelli, M., Oliveira, S., Rijcken, C. J., Pieters, E. H.,
ing of EGFR, Bioconjug. Chem., 18, 101 108, doi: 10.1021/
Etrych, T., Ulbrich, K., van Nostrum, R. C., Storm, G.,
bc060174r.
Hennink, W. E., and Lammers, T. (2013) Intrinsically
163. Vazquez Becerra, H., Perez Cardenas, E., Muniz
active nanobody modified polymeric micelles for tumor
Hernandez, S., Izquierdo Sanchez, V., and Medina, L. A.
targeted combination therapy, Biomaterials, 34, 1255 1260,
(2017) Characterization and in vitro evaluation of nimo
doi: 10.1016/j.biomaterials.2012.09.064.
tuzumab conjugated with cisplatin loaded liposomes, J.
175. Gener, P., Gouveia, L. P., Sabat, G. R., de Sousa
Liposome Res., 27, 274 282, doi: 10.1080/08982104.2016.
Rafael, D. F., Fort, N. B., Arranja, A., Fernandez, Y.,
1207665.
Prieto, R. M., Ortega, J. S., Arango, D., Abasolo, I.,
164. Petrilli, R., Eloy, J. O., Saggioro, F. P., Chesca, D. L., de
Videira, M., and Schwartz, S., Jr. (2015) Fluorescent CSC
Souza, M. C., Dias, M. V. S., daSilva, L. L. P., Lee, R. J.,
models evidence that targeted nanomedicines improve
and Lopez, R. F. V. (2018) Skin cancer treatment effective
treatment sensitivity of breast and colon cancer stem cells,
ness is improved by iontophoresis of EGFR targeted lipo
Nanomedicine, 11, 1883 1892.
somes containing 5 FU compared with subcutaneous
176. Kang, S. J., Jeong, H. Y., Kim, M. W., Jeong, I. H.,
injection, J. Control. Release, 283, 151 162, doi: 10.1016/
Choi, M. J., You, Y. M., Im, C. S., Song, I. H., Lee, T. S.,
j.jconrel.2018.05.038.
and Park, Y. S. (2018) Anti EGFR lipid micellar nanopar
165. Broekgaarden, M., van Vught, R., Oliveira, S., Roovers, R. C.,
ticles co encapsulating quantum dots and paclitaxel for
van Bergen en Henegouwen, P. M. P., Pieters, R. J., Van
tumor targeted theranosis, Nanoscale, 10, 19338 19350,
Gulik, T. M., Breukink, E., and Heger, M. (2016) Site spe
doi: 10.1039/c8nr05099f.
cific conjugation of single domain antibodies to liposomes
177. Mondal, G., Almawash, S., Chaudhary, A. K., and
enhances photosensitizer uptake and photodynamic thera
Mahato, R. I. (2017) EGFR targeted cationic polymeric
py efficacy, Nanoscale, 8, 64906494, doi: 10.1039/
mixed micelles for codelivery of gemcitabine and miR 205
c6nr00014b.
for treating advanced pancreatic cancer, Mol. Pharm., 14,
166. Zalba, S., Contreras, A. M., Merino, M., Navarro, I., de
3121 3133, doi: 10.1021/acs.molpharmaceut.7b00355.
Ilarduya, C. T., Troconiz, I. F., Koning, G., and
178. Kutty, R. V., Chia, S. L., Setyawati, M. I., Muthu, M. S.,
Garrido, M. J. (2016) EGF liposomes promote efficient
Feng, S. S., and Leong, D. T. (2015) In vivo and ex vivo
EGFR targeting in xenograft colocarcinoma model,
proofs of concept that cetuximab conjugated vitamin E
Nanomedicine (Lond.), 11, 465 477, doi: 10.2217/nnm.
TPGS micelles increases efficacy of delivered docetaxel
15.208.
against triple negative breast cancer, Biomaterials, 63, 58
167. Jung, J., Jeong, S. Y., Park, S. S., Shin, S. H., Ju, E. J.,
69, doi: 10.1016/j.biomaterials.2015.06.005.
Choi, J., Park, J., Lee, J. H., Kim, I., Suh, Y. A.,
179. Jiang, J., Chen, H., Yu, C., Zhang, Y., Chen, M., Tian, S.,
Hwang, J. J., Kuroda, S., Lee, J. S., Song, S. Y., and
and Sun, C. (2015) The promotion of salinomycin delivery
Choi, E. K. (2015) A cisplatin incorporated liposome that
to hepatocellular carcinoma cells through EGFR and
targets the epidermal growth factor receptor enhances
CD133 aptamers conjugation by PLGA nanoparticles,
radiotherapeutic efficacy without nephrotoxicity, Int. J.
Nanomedicine (Lond.), 10, 18631879, doi: 10.2217/
Oncol., 46, 1268 1274, doi: 10.3892/ijo.2014.2806.
nnm.15.43.
168. Aggarwal, S., Gupta, S., Pabla, D., and Murthy, R. S.
180. Chen, J., Ouyang, J., Chen, Q., Deng, C., Meng, F.,
(2013) Gemcitabine loaded PLGA PEG immunonano
Zhang, J., Cheng, R., Lan, Q., and Zhong, Z. (2017)
particles for targeted chemotherapy of pancreatic cancer,
EGFR and CD44 dual targeted multifunctional hyaluron
Cancer Nanotechnol., 4, 145 157, doi: 10.1007/s12645
ic acid Nanogels boost protein delivery to ovarian and
013 0046 3.
breast cancers in vitro and in vivo, ACS Appl. Mater.
169. Wöll, S., Bachran, C., Schiller, S., Schröder, M., Conrad, L.,
Interfaces., 9, 24140 24147, doi: 10.1021/acsami.7b06879.
Swee, L. K., and Scherliess, R. (2018) Sortaggable lipo
181. Gao, J., Xia, Y., Chen, H., Yu, Y., Song, J., Li, W.,
somes: evaluation of reaction conditions for single domain
Qian, W., Wang, H., Dai, J., and Guo, Y. (2014) Polymer
antibody conjugation by Sortase A and targeting of
lipid hybrid nanoparticles conjugated with anti EGF
CD11b(+) myeloid cells, Eur. J. Pharm. Biopharm., 133,
receptor antibody for targeted drug delivery to hepatocellu
138 150, doi: 10.1016/j.ejpb.2018.09.017.
lar carcinoma, Nanomedicine (Lond.),
9,
279293,
170. Wang, Y. P., Liu, I. J., Chung, M. J., and Wu, H. C. (2020)
doi: 10.2217/nnm.13.20.
Novel anti EGFR scFv human antibody conjugated
182. Zhai, J., Luwor, R. B., Ahmed, N., Escalona, R., Tan, F. H.,
immunoliposomes enhance chemotherapeutic efficacy in
Fong, C., Ratcliffe, J., Scoble, J. A., Drummond, C. J.,
squamous cell carcinoma of head and neck, Oral Oncol.,
and Tran, N. (2018) Paclitaxel loaded self assembled lipid
106, 104689, doi: 10.1016/j.oraloncology.2020.104689.
nanoparticles as targeted drug delivery systems for the
171. Hsu, W. C., Cheng, C. N., Lee, T. W., and Hwang, J. J.
treatment of aggressive ovarian cancer, ACS Appl. Mater.
(2015) Cytotoxic effects of PEGylated anti EGFR
Interfaces, 10, 25174 25185, doi: 10.1021/acsami.8b08125.
immunoliposomes combined with doxorubicin and
183. Karra, N., Nassar, T., Ripin, A. N., Schwob, O., Borlak, J.,
Rhenium 188 against cancer cells, Anticancer Res., 35,
and Benita, S.
(2013) Antibody conjugated PLGA
4777 4788.
nanoparticles for targeted delivery of paclitaxel palmitate:
172. Haeri, A., Zalba, S., Ten Hagen, T. L., Dadashzadeh, S.,
efficacy and biofate in a lung cancer mouse model, Small,
and Koning, G. A. (2016) EGFR targeted thermosensitive
9, 4221 4236, doi: 10.1002/smll.201301417.
liposomes: a novel multifunctional platform for simultane
184. Sreeranganathan, M., Uthaman, S., Sarmento, B.,
ous tumor targeted and stimulus responsive drug delivery,
Mohan, C. G., Park, I. K., and Jayakumar, R. (2017) In
Colloids Surf. B Biointerfaces, 146, 657 669, doi: 10.1016/
vivo evaluation of cetuximab conjugated poly(gamma glu
j.colsurfb.2016.06.012.
tamic acid) docetaxel nanomedicines in EGFR overex
173. Kim, I. Y., Kang, Y. S., Lee, D. S., Park, H. J., Choi, E. K.,
pressing gastric cancer xenografts, Int. J. Nanomedicine,
Oh, Y. K., Son, H. J., and Kim, J. S. (2009) Antitumor
12, 7165 7182, doi: 10.2147/IJN.S143529.
4 БИОХИМИЯ том 85 вып. 9 2020
1186
РОЗЕНКРАНЦ, СЛАСТНИКОВА
185. Patel, J., Amrutiya, J., Bhatt, P., Javia, A., Jain, M., and
197. Cornelissen, B., Waller, A., Able, S., and Vallis, K. A.
Misra, A. (2018) Targeted delivery of monoclonal antibody
(2013) Molecular radiotherapy using cleavable radioim
conjugated docetaxel loaded PLGA nanoparticles into
munoconjugates that target EGFR and gammaH2AX,
EGFR overexpressed lung tumour cells, J. Microencapsul.,
Mol. Cancer Ther., 12, 2472 2482, doi: 10.1158/1535
35, 204 217, doi: 10.1080/02652048.2018.1453560.
7163.MCT 13 0369.
186. Wang, J. K., Zhou, Y. Y., Guo, S. J., Wang, Y. Y., Nie, C. J.,
198. Rosenkranz, A. A., Ulasov, A. V., Slastnikova, T. A.,
Wang, H. L., Wang, J. L., Zhao, Y., Li, X. Y., and Chen, X. J.
Khramtsov, Y. V., and Sobolev, A. S. (2014) Use of intra
(2017) Cetuximab conjugated and doxorubicin loaded sili
cellular transport processes for targeted drug delivery into a
ca nanoparticles for tumor targeting and tumor microenvi
specified cellular compartment, Biochemistry (Moscow),
ronment responsive binary drug delivery of liver cancer
79, 928 946, doi: 10.1134/S0006297914090090.
therapy, Mater. Sci. Eng. C Mater. Biol. Appl., 76, 944 950,
199. Sobolev, A. S. (2009) Modular nanotransporters of anti
doi: 10.1016/j.msec.2017.03.131.
cancer drugs conferring cell specificity and higher efficien
187. Sandoval, M. A., Sloat, B. R., Lansakara, P., Kumar, A.,
cy, Biochemistry (Moscow), 74, 1567 1574, doi: 10.1134/
Rodriguez, B. L., Kiguchi, K., Digiovanni, J., and Cui, Z.
s0006297909130094.
(2012) EGFR targeted stearoyl gemcitabine nanoparticles
200. Sobolev, A. S., Aliev, R. A., and Kalmykov, S. N. (2016)
show enhanced anti tumor activity, J. Control. Release,
Radionuclides emitting short range particles and modular
157, 287 296, doi: 10.1016/j.jconrel.2011.08.015.
nanotransporters for their delivery to target cancer cells,
188. Bouras, A., Kaluzova, M., and Hadjipanayis, C. G. (2015)
Rus. Chem. Rev., 85, 1011 1032.
Radiosensitivity enhancement of radioresistant glioblas
201. Sobolev, A. S. (2018) Modular nanotransporters for
toma by epidermal growth factor receptor antibody conju
nuclear targeted delivery of Auger electron emitters, Front.
gated iron oxide nanoparticles, J. Neurooncol., 124, 13 22,
Pharmacol., 9, 952, doi: 10.3389/fphar.2018.00952.
doi: 10.1007/s11060 015 1807 0.
202. Gilyazova, D. G., Rosenkranz, A. A., Gulak, P. V.,
189. Chen, C. H., Wu, Y. J., and Chen, J. J. (2016) Photo ther
Lunin, V. G., Sergienko, O. V., Khramtsov, Y. V.,
mal therapy of bladder cancer with Anti EGFR antibody
Timofeyev, K. N., Grin, M. A., Mironov, A. F., Rubin, A. B.,
conjugated gold nanoparticles, Front. Biosci. (Landmark
Georgiev, G. P., and Sobolev, A. S. (2006) Targeting cancer
Ed.), 21, 1211 1221, doi: 10.2741/4451.
cells by novel engineered modular transporters, Cancer
190. El Sayed, I. H., Huang, X., and El Sayed, M. A. (2006)
Res., 66, 10534 10540, doi: 10.1158/0008 5472.CAN 06
Selective laser photo thermal therapy of epithelial carcino
2393.
ma using anti EGFR antibody conjugated gold nanoparti
203. Slastnikova, T. A., Rosenkranz, A. A., Gulak, P. V.,
cles, Cancer Lett., 239, 129 135, doi: 10.1016/j.canlet.
Schiffelers, R. M., Lupanova, T. N., Khramtsov, Y. V.,
2005.07.035.
Zalutsky, M. R., and Sobolev, A. S. (2012) Modular nan
191. Rosenkranz, A. A., Slastnikova, T. A., Georgiev, G. P.,
otransporters: a multipurpose in vivo working platform for
Zalutsky, M. R., and Sobolev, A. S. (2020) Delivery systems
targeted drug delivery, Int. J. Nanomed., 7, 467 482,
exploiting natural cell transport processes of macromole
doi: 10.2147/IJN.S28249.
cules for intracellular targeting of Auger electron emitters,
204. Slastnikova, T. A., Koumarianou, E., Rosenkranz, A. A.,
Nucl. Med. Biol., 80P81, 45 56, doi: 10.1016/j.nucmedbio.
Vaidyanathan, G., Lupanova, T. N., Sobolev, A. S., and
2019.11.005.
Zalutsky, M. R. (2012) Modular nanotransporters: a versa
192. Li, L., Quang, T. S., Gracely, E. J., Kim, J. H., Emrich, J. G.,
tile approach for enhancing nuclear delivery and cytotoxi
Yaeger, T. E., Jenrette, J. M., Cohen, S. C., Black, P., and
city of Auger electron emitting 125I, EJNMMI Res., 2, 59,
Brady, L. W. (2010) A Phase II study of anti epidermal
doi: 10.1186/2191 219X 2 59.
growth factor receptor radioimmunotherapy in the treat
205. Koumarianou, E., Slastnikova, T. A., Pruszynski, M.,
ment of glioblastoma multiforme, J. Neurosurg., 113, 192
Rosenkranz, A. A., Vaidyanathan, G., Sobolev, A. S., and
198, doi: 10.3171/2010.2.JNS091211.
Zalutsky, M. R. (2014) Radiolabeling and in vitro evalua
193. Emrich, J. G., Bender, H., Class, R., Eshleman, J.,
tion of (67)Ga NOTA modular nanotransporter - a
Miyamoto, C., and Brady, L. W. (1996) In vitro evaluation
potential Auger electron emitting EGFR targeted radio
of iodine 125 labeled monoclonal antibody (MAb 425) in
therapeutic, Nucl. Med. Biol., 41, 441 449, doi: 10.1016/
human high grade glioma cells, Am. J. Clin. Oncol., 19,
j.nucmedbio.2014.03.026.
601 608, doi: 10.1097/00000421 199612000 00015.
206. Slastnikova, T. A., Rosenkranz, A. A., Morozova, N. B.,
194. Reilly, R. M., Chen, P., Wang, J., Scollard, D., Cameron, R.,
Vorontsova, M. S., Petriev, V. M., Lupanova, T. N.,
and Vallis, K. A. (2006) Preclinical pharmacokinetic, biodis
Ulasov, A. V., Zalutsky, M. R., Yakubovskaya, R. I., and
tribution, toxicology, and dosimetry studies of 111In DTPA
Sobolev, A. S. (2017) Preparation, cytotoxicity, and in vivo
human epidermal growth factor: an Auger electron emitting
antitumor efficacy of (111)In labeled modular nanotrans
radiotherapeutic agent for epidermal growth factor receptor
porters, Int. J. Nanomed., 12, 395 410, doi: 10.2147/
positive breast cancer, J. Nucl. Med., 47, 1023 1031.
IJN.S125359.
195. Panosa, C., Fonge, H., Ferrer Batalle, M., Menendez, J. A.,
207. Rosenkranz, A. A., Slastnikova, T. A., Karmakova, T. A.,
Massaguer, A., De Llorens, R., and Reilly, R. M. (2015) A
Vorontsova, M. S., Morozova, N. B., Petriev, V. M.,
comparison of non biologically active truncated EGF
Abrosimov, A. S., Khramtsov, Y. V., Lupanova, T. N.,
(EGFt) and full length hEGF for delivery of Auger elec
Ulasov, A. V., Yakubovskaya, R. I., Georgiev, G. P., and
tron emitting 111In to EGFR positive breast cancer cells
Sobolev, A. S. (2018) Antitumor activity of Auger electron
and tumor xenografts in athymic mice, Nucl. Med. Biol.,
emitter 111In delivered by modular nanotransporter for
42, 931 938, doi: 10.1016/j.nucmedbio.2015.08.003.
treatment of bladder cancer with EGFR overexpression,
196. Vallis, K. A., Reilly, R. M., Scollard, D., Merante, P.,
Front. Pharmacol., 9, 1331, doi: 10.3389/fphar.2018.
Brade, A., Velauthapillai, S., Caldwell, C., Chan, I.,
01331.
Freeman, M., Lockwood, G., Miller, N. A., Cornelissen, B.,
208. Karyagina, T. S., Ulasov, A. V., Slastnikova, T. A.,
Petronis, J., and Sabate, K. (2014) Phase I trial to evaluate
Rosenkranz, A. A., Lupanova, T. N., Khramtsov, Y. V.,
the tumor and normal tissue uptake, radiation dosimetry
Georgiev, G. P., and Sobolev, A. S. (2020) Targeted deliv
and safety of (111)In DTPA human epidermal growth fac
ery of 111In into the nuclei of EGFR overexpressing cells via
tor in patients with metastatic EGFR positive breast can
modular nanotransporters with anti EGFR affibody, Front.
cer, Am. J. Nucl. Med. Mol. Imaging, 4, 181 192.
Pharmacol., 11, 176, doi: 10.3389/fphar.2020.00176.
БИОХИМИЯ том 85 вып. 9 2020
ИСПОЛЬЗОВАНИЕ EGFR ДЛЯ ДОСТАВКИ ЛЕКАРСТВ В КЛЕТКИ
1187
209. Li, S., Goins, B., Hrycushko, B. A., Phillips, W. T., and
py, J. Pharm. Sci., 109, 104 115, doi: 10.1016/j.xphs.
Bao, A. (2012) Feasibility of eradication of breast cancer
2019.10.037.
cells remaining in postlumpectomy cavity and draining
221. Sampson, J. H., Akabani, G., Archer, G. E., Berger, M. S.,
lymph nodes following intracavitary injection of radioac
Coleman, R. E., Friedman, A. H., Friedman, H. S., Greer, K.,
tive immunoliposomes, Mol. Pharm., 9, 25132522,
Herndon, J. E., Kunwar, S., McLendon, R. E., Paolino,
doi: 10.1021/mp300132f.
A., Petry, N. A., Provenzale, J. M., Reardon, D. A.,
210. Song, H., Hedayati, M., Hobbs, R. F., Shao, C.,
Wong, T. Z., Zalutsky, M. R., Pastan, I., and Bigner, D. D.
Bruchertseifer, F., Morgenstern, A., Deweese, T. L., and
(2008) Intracerebral infusion of an EGFR targeted toxin
Sgouros, G. (2013) Targeting aberrant DNA double strand
in recurrent malignant brain tumors, Neuro Oncol., 10,
break repair in triple negative breast cancer with alpha
320 329, doi: 10.1215/15228517 2008 012.
particle emitter radiolabeled anti EGFR antibody, Mol.
222. Chandramohan, V., Pegram, C. N., Piao, H., Szafranski, S. E.,
Cancer Ther.,
12,
20432054, doi:
10.1158/1535
Kuan, C. T., Pastan, I. H., and Bigner, D. D. (2017)
7163.MCT 13 0108.
Production and quality control assessment of a GLP grade
211. Pfost, B., Seidl, C., Autenrieth, M., Saur, D.,
immunotoxin, D2C7 (scdsFv) PE38KDEL, for a phase
Bruchertseifer, F., Morgenstern, A., Schwaiger, M., and
I/II clinical trial, Appl. Microbiol. Biotechnol., 101, 2747
Senekowitsch Schmidtke, R. (2009) Intravesical alpha
2766, doi: 10.1007/s00253 016 8063 x.
radioimmunotherapy with
213Bi anti EGFR mAb
223. Zalutsky, M. R., Boskovitz, A., Kuan, C. T., Pegram, C. N.,
defeats human bladder carcinoma in xenografted nude
Ayriss, J., Wikstrand, C. J., Buckley, A. F., Lipp, E. S.,
mice, J. Nucl. Med., 50, 1700 1708, doi: 10.2967/jnumed.
Herndon, J. E., McLendon, R. E., and Bigner, D. D. (2012)
109.065961.
Radioimmunotargeting of malignant glioma by monoclonal
212. Fazel, J., Rotzer, S., Seidl, C., Feuerecker, B., Autenrieth, M.,
antibody D2C7 reactive against both wild type and variant
Weirich, G., Bruchertseifer, F., Morgenstern, A., and
III mutant epidermal growth factor receptors, Nucl. Med.
Senekowitsch Schmidtke, R. (2015) Fractionated intra
Biol., 39, 23 34, doi: 10.1016/j.nucmedbio.2011.06.005.
vesical radioimmunotherapy with 213Bi anti EGFR MAb is
224. Chandramohan, V., Bao, X., Keir, S. T., Pegram, C. N.,
effective without toxic side effects in a nude mouse model
Szafranski, S. E., Piao, H., Wikstrand, C. J., McLendon, R. E.,
of advanced human bladder carcinoma, Cancer Biol. Ther.,
Kuan, C. T., Pastan, I. H., and Bigner, D. D. (2013)
16, 1526 1534, doi: 10.1080/15384047.2015.1071735.
Construction of an immunotoxin, D2C7 (scdsFv)
213. Autenrieth, M. E., Seidl, C., Bruchertseifer, F., Horn, T.,
PE38KDEL, targeting EGFRwt and EGFRvIII for brain
Kurtz, F., Feuerecker, B., D’Alessandria, C., Pfob, C.,
tumor therapy, Clin. Cancer Res.,
19,
47174727,
Nekolla, S., Apostolidis, C., Mirzadeh, S., Gschwend, J. E.,
doi: 10.1158/1078 0432.CCR 12 3891.
Schwaiger, M., Scheidhauer, K., and Morgenstern, A.
225. Chandramohan, V., Bao, X., Yu, X., Parker, S., McDowall, C.,
(2018) Treatment of carcinoma in situ of the urinary blad
Yu, Y. R., Healy, P., Desjardins, A., Gunn, M. D.,
der with an alpha emitter immunoconjugate targeting the
Gromeier, M., Nair, S. K., Pastan, I. H., and Bigner, D. D.
epidermal growth factor receptor: a pilot study, Eur. J.
(2019) Improved efficacy against malignant brain tumors
Nucl. Med. Mol. Imaging, 45, 1364 1371, doi: 10.1007/
with EGFRwt/EGFRvIII targeting immunotoxin and
s00259 018 4003 6.
checkpoint inhibitor combinations, J. Immunother. Cancer,
214. Milenic, D. E., Baidoo, K. E., Kim, Y. S., and Brechbiel, M. W.
7, 142, doi: 10.1186/s40425 019 0614 0.
(2015) Evaluation of cetuximab as a candidate for targeted
226. Agostinis, P., Berg, K., Cengel, K. A., Foster, T. H., Girotti,
alpha particle radiation therapy of HER1 positive dissem
A. W., Gollnick, S. O., Hahn, S. M., Hamblin, M. R.,
inated intraperitoneal disease, MAbs,
7,
255264,
Juzeniene, A., Kessel, D., Korbelik, M., Moan, J., Mroz, P.,
doi: 10.4161/19420862.2014.985160.
Nowis, D., Piette, J., Wilson, B. C., and Golab, J. (2011)
215. Zidenberg Cherr, S., Parks, N. J., and Keen, C. L. (1987)
Photodynamic therapy of cancer: an update, CA Cancer J.
Tissue and subcellular distribution of bismuth radiotracer
Clin., 61, 250 281, doi: 10.3322/caac.20114.
in the rat: considerations of cytotoxicity and microdosime
227. Liang, H., Shin, D. S., Lee, Y. E., Nguyen, D. C.,
try for bismuth radiopharmaceuticals, Radiat. Res., 111,
Trang, T. C., Pan, A. H., Huang, S. L., Chong, D. H., and
119 129.
Berns, M. W. (1998) Subcellular phototoxicity of 5 amino
216. Rosenkranz, A. A., Vaidyanathan, G., Pozzi, O. R.,
laevulinic acid (ALA), Lasers Surg. Med., 22, 14 24,
Lunin, V. G., Zalutsky, M. R., and Sobolev, A. S. (2008)
doi: 10.1002/(sici)1096 9101(1998)22:1<14::aid lsm6>
Engineered modular recombinant transporters: application
3.0.co;2 #.
of new platform for targeted radiotherapeutic agents to
228. Rosenkranz, A. A., Jans, D. A., and Sobolev, A. S. (2000)
alpha particle emitting 211 At, Int. J. Radiat. Oncol. Biol.
Targeted intracellular delivery of photosensitizers to
Phys., 72, 193 200, doi: 10.1016/j.ijrobp.2008.05.055.
enhance photodynamic efficiency, Immunol. Cell. Biol., 78,
217. Simon, N., and FitzGerald, D. (2016) Immunotoxin ther
452 464, doi: 10.1046/j.1440 1711.2000.00925.x.
apies for the treatment of epidermal growth factor recep
229. Gilyazova, D. G., Rosenkranz, A. A., Gulak, P. V.,
tor dependent cancers, Toxins (Basel), 8, doi: 10.3390/tox
Lunin, V. G., Sergienko, O. V., Grin, M. A., Mironov, A. F.,
ins8050137.
Rubin, A. B., and Sobolev, A. S. (2006) Recombinant
218. Yang, Y., Tian, Z., Ding, Y., Li, X., Zhang, Z., Yang, L.,
modular transporters on the basis of epidermal growth fac
Zhao, F., Ren, F., and Guo, R. (2018) EGFR targeted
tor for targeted intracellular delivery of photosensitizers,
immunotoxin exerts antitumor effects on esophageal can
Curr. Res. Laser Use Oncol.: 2000 2004, 5973, 59730E,
cers by increasing ROS accumulation and inducing apop
doi: 10.1117/12.640049.
tosis via inhibition of the Nrf2 Keap1 pathway, J. Immunol.
230. Gillenwater, A. M., Johnson, J. M., Curry, J. M.,
Res., 2018, 1090287, doi: 10.1155/2018/1090287.
Kochuparambil, S. T., McDonald, D., Fidler, M.,
219. Deng, C., Xiong, J., Gu, X., Chen, X., Wu, S., Wang, Z.,
Stenson, K. M., Vasan, N. R., Razaq, M. A., and
Wang, D., Tu, J., and Xie, J. (2017) Novel recombinant
Campana, J. (2020) Survival following photoimmunother
immunotoxin of EGFR specific nanobody fused with cucur
apy in patients (Pts) with recurrent head and neck squa
mosin, construction and antitumor efficiency in vitro,
mous cell carcinoma (rHNSCC), Int. J. Radiat. Oncol.
Oncotarget, 8, 38568 38580, doi: 10.18632/oncotarget.16930.
Biol. Phys., 106, 1180 1180.
220. Kim, J. S., Jun, S. Y., and Kim, Y. S. (2020) Critical issues
231. Fernandes, S. R. G., Fernandes, R., Sarmento, B., Pereira,
in the development of immunotoxins for anticancer thera
P. M. R., and Tome, J. P. C. (2019) Photoimmunocon
БИОХИМИЯ том 85 вып. 9 2020
4*
1188
РОЗЕНКРАНЦ, СЛАСТНИКОВА
jugates: novel synthetic strategies to target and treat cancer
235. Bagley, S. J., and O’Rourke, D. M. (2020) Clinical investi
by photodynamic therapy, Org. Biomol. Chem., 17, 2579
gation of CAR T cells for solid tumors: lessons learned and
2593, doi: 10.1039/c8ob02902d.
future directions, Pharmacol. Ther.,
205,
107419,
232. Harvey, T. J., Burdon, D., Steele, L., Ingram, N., Hall, G. D.,
doi: 10.1016/j.pharmthera.2019.107419.
Selby, P. J., Vile, R. G., Cooper, P. A., Shnyder, S. D., and
236. Westphal, M., Maire, C. L., and Lamszus, K. (2017)
Chester, J. D. (2010) Retargeted adenoviral cancer gene
EGFR as a target for glioblastoma treatment: an unfulfilled
therapy for tumour cells overexpressing epidermal growth
promise, CNS Drugs, 31, 723 735, doi: 10.1007/s40263
factor receptor or urokinase type plasminogen activator
017 0456 6.
receptor, Gene Ther., 17, 1000 1010, doi: 10.1038/gt.
237. Xu, M. J., Johnson, D. E., and Grandis, J. R. (2017)
2010.45.
EGFR targeted therapies in the post genomic era, Cancer
233. Urnauer, S., Muller, A. M., Schug, C., Schmohl, K. A.,
Metastasis Rev., 36, 463 473, doi: 10.1007/s10555 017
Tutter, M., Schwenk, N., Rodl, W., Morys, S., Ingrisch, M.,
9687 8.
Bertram, J., Bartenstein, P., Clevert, D. A., Wagner, E.,
238. Slastnikova, T. A., Ulasov, A. V., Rosenkranz, A. A., and
and Spitzweg, C. (2017) EGFR targeted nonviral NIS
Sobolev, A. S. (2018) Targeted intracellular delivery of anti
gene transfer for bioimaging and therapy of disseminated
bodies: the state of the Art, Front. Pharmacol., 9, 1208,
colon cancer metastases, Oncotarget, 8, 92195 92208,
doi: 10.3389/fphar.2018.01208.
doi: 10.18632/oncotarget.21028.
239. Ulasov, A. V., Rosenkranz, A. A., and Sobolev, A. S. (2018)
234. Liang, Y., Peng, J., Li, N., Yu Wai Man, C., Wang, Q., Xu, Y.,
Transcription factors: time to deliver, J. Control. Release,
Wang, H., Tagalakis, A. D., and Du, Z. (2019) Smart
269, 24 35, doi: 10.1016/j.jconrel.2017.11.004.
nanoparticles assembled by endogenous molecules for
240. Jin, J. O., Kim, G., Hwang, J., Han, K. H., Kwak, M., and
siRNA delivery and cancer therapy via CD44 and EGFR
Lee, P. C. W. (2020) Nucleic acid nanotechnology for can
dual targeting, Nanomedicine, 15, 208 217, doi: 10.1016/
cer treatment, Biochim. Biophys. Acta Rev. Cancer, 1874,
j.nano.2018.09.018.
188377, doi: 10.1016/j.bbcan.2020.188377.
EPIDERMAL GROWTH FACTOR RECEPTOR:
KEY TO SELECTIVE INTRACELLULAR DELIVERY*
Review
A. A. Rosenkranz1,2** and T. A. Slastnikova2
1 Lomonosov Moscow State University, Faculty of Biology, 119234 Moscow, Russia; E mail: aar@igb.ac.ru
2 Institute of Gene Biology, Russian Academy of Sciences, 119334 Moscow, Russia
Received June 15, 2020
Revised July 23, 2020
Accepted July 23, 2020
Epidermal growth factor receptor (EGFR) is an integral surface protein mediating cellular response to a number of
growth factors. Its overexpression and increased activation due to mutations is one of the most common traits of many
types of cancer. Development and clinical use of the agents, which block EGFR activation, became a prime example
of the personalized targeted medicine. However, despite the obvious success in this area, cancer cure remains unat
tainable in most cases. Because of that, as well as the result of the search for possible ways to overcome the difficulties
of treatment, a huge number of new treatment methods relying on the use of EGFR overexpression and its changes
to destroy cancer cells. Modern data on the structure, functioning, and intracellular transport of EGFR, its natural
ligands, as well as signaling cascades triggered by the EGFR activation, peculiarities of the EGFR expression and acti
vation in oncological disorders, as well as applied therapeutic approaches aimed at blocking EGFR signaling pathway
are summarized and analyzed in this review. Approaches to the targeted delivery of various chemotherapeutic agents,
radionuclides, immunotoxins, photosensitizers, as well as the prospects for gene therapy aimed at cancer cells with
EGFR overexpression are reviewed in detail. It should be noted that increasing attention is being paid nowadays to
the development of multifunctional systems, either carrying several different active agents, or possessing several envi
ronment dependent transport functions. Potentials of the systems based on receptor mediated endocytosis of EGFR
and their possible advantages and limitations are discussed.
Keywords: epidermal growth factor receptor, overexpression, endocytosis, cancer, targeted cancer therapy, drug
delivery
БИОХИМИЯ том 85 вып. 9 2020