БИОХИМИЯ, 2020, том 85, вып. 9, с. 1213 - 1239
УДК 577.112.7
АМИЛОИДНЫЕ И АМИЛОИДОПОДОБНЫЕ АГРЕГАТЫ:
МНОГООБРАЗИЕ И КРИЗИС ТЕРМИНА*
Обзор
© 2020
А.Б. Матиив1, Н.П. Трубицина1, А.Г. Матвеенко1, Ю.А. Барбитов1,2,
Г.А. Журавлева1,3, С.А. Бондарев1,3**
1 Санкт Петербургский государственный университет, биологический факультет,
кафедра генетики и биотехнологии,199034 Санкт Петербург, Россия;
электронная почта: stanislavspbgu@gmail.com, s.bondarev@spbu.ru
2 Институт биоинформатики, 197342 Санкт Петербург, Россия
3 Санкт Петербургский государственный университет, биологический факультет,
научная лаборатория биологии амилоидов, 199034 Санкт Петербург, Россия
Поступила в редакцию 16.07.2020
После доработки 05.08.2020
Принята к публикации 05.08.2020
Активное накопление данных о новых амилоидах, которое сейчас происходит, размывает границы термина
«амилоид». В настоящий момент он чаще всего используется для обозначения агрегатов с кросс!β структу!
рой. При этом для ряда амилоидов показаны и другие необычные свойства, среди которых высокая устой!
чивость к действию детергентов и протеаз, взаимодействие со специфическими красителями, а также спо!
собность индуцировать переход некоторых белков из растворимой формы в агрегированную. Эти же черты
обнаруживают и у агрегатов, лишенных кросс!β структуры, которые принято называть амилоидоподобны!
ми и объединять в одну группу, хотя их разнообразие очень велико. Мы собрали и систематизировали ин!
формацию о свойствах более двухсот известных амилоидов и амилоидоподобных белков, уделяя особое
внимание наиболее противоречивым примерам. В частности, ряд белков в составе немембранных органелл
формирует агрегаты с кросс!β структурой, морфологически неотличимые от других амилоидов, но пол!
ностью растворяющиеся в присутствии детергентов. Такие парадоксы демонстрируют необходимость уточ!
нения существующего определения термина «амилоид». С другой стороны, демонстрация разнообразия
структур амилоидоподобных агрегатов показывает актуальность создания их классификации.
КЛЮЧЕВЫЕ СЛОВА: амилоиды, амилоидоподобные агрегаты, кросс!β структура, прионы.
DOI: 10.31857/S0320972520090043
КРАТКИЙ ОБЗОР РАЗВИТИЯ МЕТОДОВ
тельной клетки. Этот тест был первоначально
ИССЛЕДОВАНИЯ АМИЛОИДОВ
описан в 1814 г. Жан!Жак Колином и Анри!
Франсуа Готье де Клаубри и основан на реакции
Термин «амилоид» был введен в научную ли!
окрашивания в синий цвет крахмала в присут!
тературу немецким ботаником Маттиасом
ствии йода и серной кислоты. Анализируя пре!
Шлейденом. Одной из его идей было примене!
параты растений с помощью этой методики,
ние теста на крахмал в растениях для изучения
Шлейден впервые использовал термин «амило!
химического и анатомического состава расти!
ид» (от латинского слова «amylum», крахмал) в
значении «крахмалоподобный» для обозначе!
Принятые сокращения: АМП - антимикробные ния «нормальной амилозной составляющей в
пептиды; БАС - боковой амиотрофический склероз; Аβ -
растениях» [1].
амилоид β; β2M - β2!микроглобулин; CRES - cystatin!
related epididymal spermatogenic (amyloid); Ig!LC - легкая
Немецкий патологоанатом Рудольф Вирхов
цепь иммуноглобулина; LC - low!complexity (domain);
впервые применил термин «амилоид» в медицин!
PrP - прионный белок; RAC - reversible amyloid core; ской литературе. В 1854 г. он использовал слово
RHIM - Rip homotypic interaction motif; TTR - транстире!
«амилоид» для описания патологических отло!
тина.
жений в нервной системе, которые показали
* Статья на английском языке опубликована в режиме
цветную реакцию с йодом и серной кислотой.
Open Access (открытого доступа) на сайте издательства
Из!за этого Вирхов был убежден, что эти струк!
вып. 9, 2020.
туры были идентичны крахмалу [1]. Позже Вир!
** Адресат для корреспонденции.
хов применил тест с использованием йода и сер!
1213
1214
МАТИИВ и др.
ной кислоты к другим тканям с отложениями
generator), с ее помощью образование амилоид!
амилоидов [2]. Дальнейшие исследования ами!
ных агрегатов исследуемым белком оценивают
лоидов продолжались уже с применением гис!
по появлению фибрилл на поверхности клеток
тологических красителей, таких как конго крас!
бактерий [13].
ный (1922 г.) и тиофлавин (1959 г.), которые ис!
Существует ряд примеров агрегатов, для ко!
пользовали вместо йода [3].
торых показаны некоторые из описанных выше
Структурные исследования амилоидов нача!
свойств: фибриллярная морфология, взаимо!
лись в 1930!х гг. с использованием дифракции
действие с тиофлавином Т или его аналогами,
рентгеновских лучей. В 1935 г. Уильям Томас
способность индуцировать агрегацию, устойчи!
Астбери и Сильвия Дикинсон описали харак!
вость к детергентам и протеазам. Такие агрегаты
терную рентгенограмму, позже названную
мы будем далее называть амилоидоподобными,
«кросс!β». В 1959 г. Алан Коэн и Эван Калкинс с
а белки, для которых хотя бы in vitro показано
помощью электронного микроскопа наблюдали
окрашивание конго красным или наличие
в тканях кролика и человека амилоидные отло!
кросс!β структуры, - амилоидами [4, 14-17].
жения с фибриллярной структурой ~7,5-14 нм в
ширину и ~100-1600 нм в длину [3]. Позднее
удалось продемонстрировать, что β!тяжи в сос!
МНОГООБРАЗИЕ АМИЛОИДОВ
таве агрегатов ориентированы перпендикулярно
оси фибрилл и образуют межмолекулярные β!
С целью осветить многообразие белков, ко!
слои. Просвет между β!тяжами в одном β!слое
торые могут формировать амилоидные или ами!
составляет 4,7-4,8 Å, а в составе протофибрил!
лоидоподобные агрегаты, мы собрали информа!
лы присутствуют минимум два β!слоя, расстоя!
цию о свойствах более двухсот таких белков. Мы
ние между которыми порядка 10 Å. В экспери!
старались включить максимальное число при!
ментах по дифракции электронов или рентгенов!
меров, среди которых есть спорные, чтобы про!
ских лучей такая регулярная структура форми!
демонстрировать разнообразие феномена и сте!
рует характерную картину с двумя меридиональ!
пень его изученности. Полная информация о
ными и двумя экваториальными отражениями
рассмотренных белках представлена в таблице S
[4].
в Приложении. В ней собрана информация о
Позднее были описаны другие необычные
фрагментах, изоформах и заменах в анализируе!
свойства амилоидных агрегатов. Например, не!
мых белках, но в рамках анализа данных мы вы!
которые из них слабее подвержены действию
нуждены рассматривать только обобщенные
протеаз, чем тот же белок в нативной форме [5],
сведения для отдельных белков, причем без уче!
а также очень стабильны и не растворяются в
та уровня продукции в клетках и других разли!
присутствии детергентов. Для изучения амилои!
чий в модельных системах. Скорее всего, пред!
дов дрожжей были предложены методики на ос!
ставленный список может быть дополнен, но
нове разнообразных модификаций электрофо!
мы считаем эту выборку достаточно репрезента!
реза. Сегодня они успешно применяются для
тивной для того, чтобы оценить полноту описа!
демонстрации устойчивости к детергентам или
ния амилоидных свойств разных белков с мето!
протеазам у амилоидов различного происхожде!
дологической точки зрения. К амилоидным
ния [6].
свойствам мы причислили способность белка
Большинство амилоидов способно индуци!
или его фрагмента формировать агрегаты in vitro
ровать агрегацию растворимых молекул белка,
или in vivo, наличие у этих агрегатов фибрилляр!
из которого они состоят. Динамику этого про!
ной структуры, способность индуцировать агре!
цесса чаще всего анализируют in vitro с исполь!
гацию себе подобных белков, повышенную ус!
зованием очищенных белков и амилоид!специ!
тойчивость агрегатов к детергентам и протеазам,
фических красителей [7]. Эта особенность явля!
их взаимодействие с амилоид!специфическими
ется необходимой (но недостаточной) для суще!
красителями тиофлавином и конго красным, а
ствования инфекционных амилоидов, или при!
также наличие кросс!β структуры. Эти свойства
онов, первым обнаруженным примером кото!
в той или иной мере были описаны для многих
рых стал PrP [8]. Обнаружение прионов дрож!
амилоидов [17-19]. Поскольку существует мне!
жей, присутствие которых в клетке можно от!
ние, что при правильно подобранных условиях
слеживать по росту на селективных средах [9],
можно получить амилоидную форму абсолютно
позволило разработать универсальные системы
любого белка [20], в ходе анализа этих данных
для поиска белков с аналогичными свойствами
мы не рассматривали белки, агрегаты которых
in vivo [10, 11] и идентификации новых амилои!
были исследованы исключительно in vitro, то
дов [12]. Последнюю задачу также позволяет ре!
есть ни одно из перечисленных амилоидных
шать методика C!DAG (curli!dependent amyloid
свойств не было продемонстрировано в живых
БИОХИМИЯ том 85 вып. 9 2020
АМИЛОИДНЫЕ И АМИЛОИДОПОДОБНЫЕ АГРЕГАТЫ
1215
организмах. Также мы не рассматривали белки,
скольку, например агрегаты PSM3α с кросс!α
которые были выявлены в результате различных
структурой связывают этот краситель [23].
скринингов, но не были проверены адресно.
Наличие кросс!β структуры с помощью био!
Существует масса примеров агрегатов, напо!
физических подходов показано менее чем для
минающих по свойствам амилоиды. Тем не ме!
трети из проанализированных белков (27%).
нее их исследования крайне гетерогенны с точ!
Впрочем, объединение двух множеств (окраши!
ки зрения методологических подходов. Для ил!
вание конго красным и наличие кросс!β струк!
люстрации этого мы собрали информацию о
туры) включает 53% от проанализированных
восьми свойствах, характерных для белковых аг!
белков (120 из 226 примеров). Их в рамках наи!
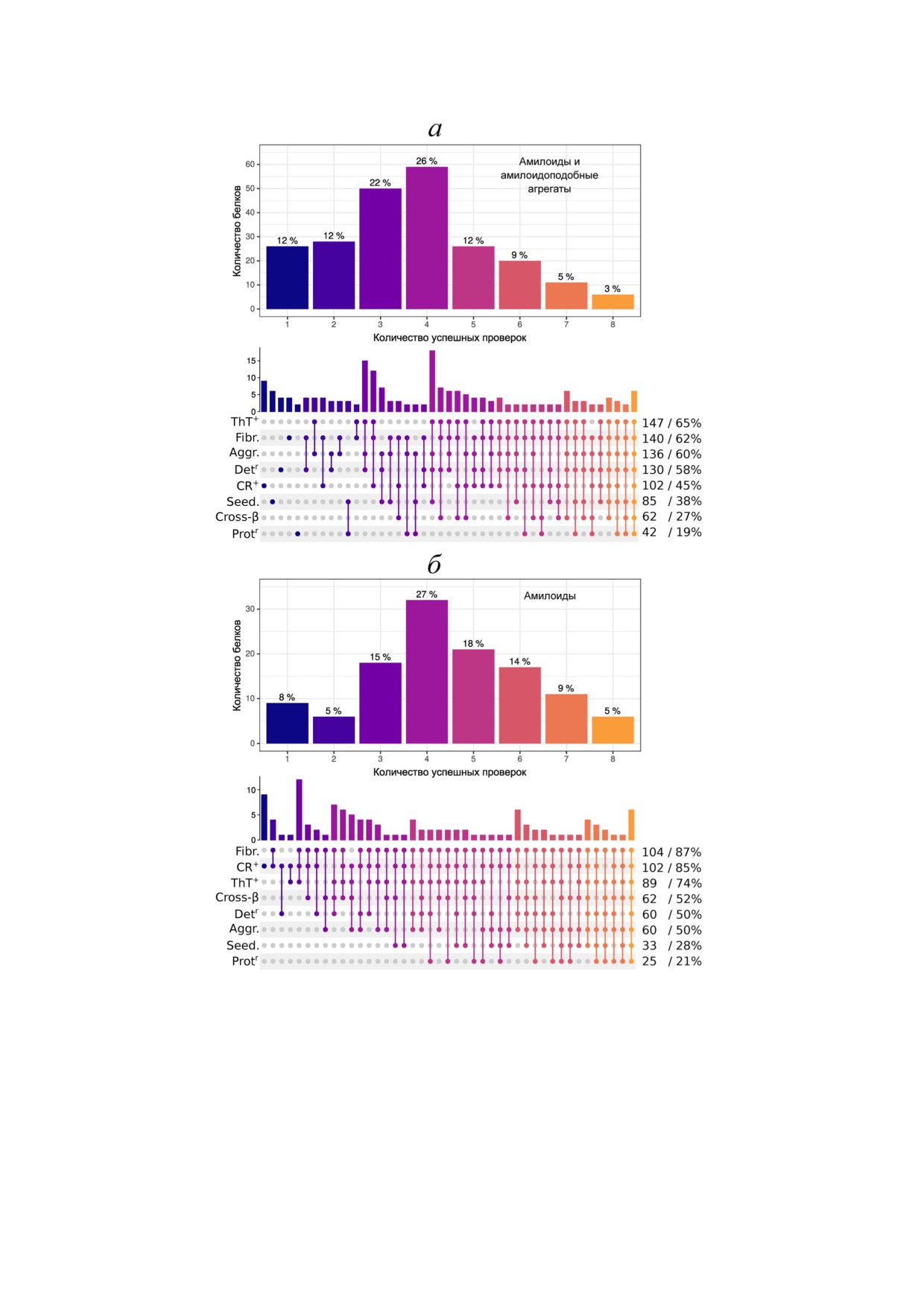
регатов, рассмотренных в этом разделе (рис. 1):
более распространенного сейчас определения
- наличие кросс!β структуры (характерная
мы можем назвать амилоидами. В этом подмно!
картина дифракции электронов или рентгенов!
жестве наиболее популярным набором прове!
ских лучей с двумя отражениями, либо опреде!
рок стало сочетание окрашивания амилоид!спе!
ление структуры агрегатов с помощью методов
цифическими красителями и демонстрация
криоэлектронной микроскопии или ядерного
фибрилл (рис. 1, б). Любопытно, что на втором
магнитного резонанса);
месте оказываются примеры, для которых пока!
- окрашивание конго красным (в том числе
зано только окрашивание конго красным. Воп!
двойное лучепреломление в поляризованном
рос о том, является ли такая проверка достаточ!
свете);
ной сама по себе, остается открытым. Также
- окрашивание тиофлавином T или аналога!
важно отметить, что большинство эксперимен!
ми;
тов выполнено на различных модельных систе!
- фибриллярная морфология агрегатов;
мах, и доказательства того, что нативный белок
- способность индуцировать агрегацию та!
формирует амилоидные агрегаты в живых орга!
кого же белка;
низмах в естественных условиях и при базовом
- устойчивость к действию протеаз;
уровне продукции, обычно отсутствуют. Такая
- устойчивость к обработке детергентами;
проблема существует даже в случае хорошо ис!
- образование агрегатов (продемонстриро!
следованных белков, например амилоидных
ванное любым способом, кроме методов, ис!
прионов дрожжей.
пользованных для демонстрации предыдущих
Для удобства описания все многообразие аг!
свойств).
регатов мы разделили на три группы: (1) патоло!
Для большинства белков, которые попали в
гические, (2) функциональные и (3) амилоиды с
наш анализ, были успешно показаны от двух до
неопределенной биологической ролью, в каж!
пяти перечисленных свойств (рис. 1, а). Приме!
дой из которых мы выделили несколько под!
чательно, что среди проверок наиболее попу!
групп. Несмотря на то что аналогичная класси!
лярной является окрашивание тиофлавином Т,
фикация используется часто, такое деление
либо его аналогами (65% от всех белков). При
очень условное, и ряд рассмотренных нами при!
этом конго красный, который в ряде работ на!
меров это демонстрирует.
зывают «золотым стандартом» для демонстра!
ции амилоидных свойств, используют гораздо
реже (45% белков). Окрашивание конго крас!
ПАТОЛОГИЧЕСКИЕ АМИЛОИДЫ
ным считается более строгим доказательством
амилоидных свойств и в том числе используется
В клинической практике термином «амило!
для демонстрации кросс!β структуры. Однако
ид» зачастую обозначают гомогенное внекле!
эта методика может давать ложноположитель!
точное отложение, которое специфически окра!
ные результаты. В частности, некоторые моно!
шивается конго красным и демонстрирует жел!
мерные белки, имеющие структуру глобулы или
то!зеленое свечение при двойном лучепрелом!
β!соленоида (один из вариантов структуры ами!
лении в поляризованном свете, а также имеет
лоидных агрегатов [4]), а также частично свер!
характерную тонко!фибриллярную ультраст!
нутые белки связывают конго красный in vitro
руктуру [15]. Вместе с этим многие авторы не де!
[3, 21]. Кроме этого, при окрашивании препара!
лают различий между внеклеточными и внут!
тов тканей краситель может взаимодействовать
риклеточными агрегатами, демонстрирующими
с волокнами коллагена, внеклеточными фиб!
амилоидные свойства. При этом даже тельца
риллами, а также белками цитоскелета и даже
включения, которые окрашиваются конго крас!
демонстрировать двойное лучепреломление [21,
ным, часто тоже называют амилоидами. Приме!
22]. Взаимодействие агрегатов с тиофлавином Т
рами таких включений являются внутриядер!
в принципе нельзя считать универсальным до!
ные агрегаты при болезни Хантингтона и тельца
казательством наличия кросс!β структуры, по!
Леви при болезни Паркинсона [24].
БИОХИМИЯ том 85 вып. 9 2020
1216
МАТИИВ и др.
Рис. 1. Методические подходы и их сочетания в исследованиях амилоидов и амилоидоподобных агрегатов (а) либо толь!
ко амилоидов (б). Учитывались только проверки, в результате которых указанные свойства были успешно продемонстри!
рованы. Cross!β - демонстрация кросс!β структуры агрегатов (на основании данных дифракции электронов или рентге!
новских лучей с двумя отражениями либо структуры агрегатов, расшифрованной методами криоэлектронной микроско!
пии или ядерного магнитного резонанса), CR+ - окрашивание конго красным и двулучепреломление в поляризованном
свете, ThT+ - окрашивание тиофлавином Т или его аналогами, Fibr. - фибриллярная морфология агрегатов, Seed. - спо!
собность индуцировать агрегацию, Protr - устойчивость к действию протеаз, Detr - устойчивость к обработке детергента!
ми, Aggr. - свидетельство способности белка к агрегации (продемонстрированное любым способом, кроме методов, ис!
пользованных для демонстрации предыдущих свойств). Эти же сокращения использованы на рис. 2-4. Ссылки на лите!
ратуру представлены в таблице S в Приложении к статье. (С цветными вариантами рис. 1-4 можно ознакомиться в элект!
БИОХИМИЯ том 85 вып. 9 2020
АМИЛОИДНЫЕ И АМИЛОИДОПОДОБНЫЕ АГРЕГАТЫ
1217
В настоящее время известно около 50 различ!
наиболее распространенной формой системно!
ных белков и пептидов, способных формировать
го амилоидоза, на долю которого приходится
амилоиды и амилоидоподобные агрегаты и свя!
около 70% всех случаев [34]. Это заболевание
занных с заболеваниями человека, среди кото!
обычно встречается у людей с моноклональной
рых болезни Альцгеймера, Хантингтона и Пар!
гаммапатией - расстройством, которое характе!
кинсона, диабет второго типа и ряд амилоидо!
ризуется пролиферацией клонов плазматичес!
зов, возникающих в результате системного или
ких клеток. Повышенная продукция Ig!LC при!
локального отложения амилоидных фибрилл во
водит к образованию амилоидов и повреждению
внеклеточных пространствах тканей и органов
органов [35]. Меньше известно о более редком
[15, 25]. Многие из этих заболеваний являются
амилоидозе легкой и тяжелой (Ig!HC) цепей и
смертельными и неизлечимыми, а риск их раз!
амилоидозе тяжелой цепи (AHL! и AH!амилои!
вития увеличивается с возрастом [26].
дозы соответственно) [36], которые по клини!
Амилоидогенные белки собираются в агрега!
ческим симптомам сходны с AL!амилоидозом.
ты, которые накапливаются в виде внеклеточ!
Стоит отметить, что для упомянутых выше забо!
ных бляшек и внутриклеточных включений [4].
леваний существуют и локализованные формы.
Наличие большого количества амилоидного ма!
Транстиретиновый амилоидоз является наи!
териала может разрушать структуру ткани и ме!
более распространенным наследственным ами!
ханически влиять на функции пораженных орга!
лоидозом, который вызван мутациями, дестаби!
нов [27]. Тем не менее есть предположение, что
лизирующими тетрамер транстиретина, отвеча!
при амилоидных заболеваниях токсичны олиго!
ющий за транспорт гормона тироксина и вита!
меры и нефибриллярные амилоидные отложе!
мина А [37]. К транстиретиновому амилоидозу
ния [28]. В качестве примеров можно привести
также относят старческий системный амилои!
тетрамеры транстиретина (TTR) [29], амилоид β
доз - приобретенное расстройство, вызванное
(Aβ) [30], легкие цепи иммуноглобулина (Ig!LC)
отложениями TTR дикого типа, проявляющееся
[31] и PrP [32], которые токсичны как в клеточ!
в основном у мужчин старше 60 лет [37]. Еще од!
ных культурах, так и в живых организмах. В ре!
ним распространенным системным амилоидо!
зультате конформационных изменений префиб!
зом является реактивный, или АА!амилоидоз -
риллярные агрегаты несут на своей поверхности
заболевание, связанное с устойчивыми высоки!
группы, которые обычно находятся внутри свер!
ми концентрациями сывороточного амилоида А
нутых белков или рассредоточены в нативно
(SAA) в плазме или специфических тканях при
неструктурированных белках. Это рассматрива!
воспалительных процессах, приводящих к вне!
ют как потенциальный фактор токсичности
клеточным отложениям белка [38]. У пациентов
амилоидов [28], и исследования in vitro подтверж!
с почечной недостаточностью или находящихся
дают эту гипотезу [33]. Внутриклеточные амило!
на диализе наличие амилоидных депозитов
идные включения могут влиять на клеточную
обусловлено повышением уровня циркулирую!
физиологию, например, препятствуя транспорту
щего в крови β2!микроглобулина (β2M) [39].
белков и РНК и нарушая функции протеасом [4].
Диализный амилоидоз вызван отложениями
Как правило, существуют различия в патоге!
полноразмерного β2M преимущественно дико!
незе между локализованными и системными
го типа. Существует и наследственная форма за!
амилоидозами: амилоидогенный белок в первом
болевания, возникающая при мутациях в гене,
случае синтезируется близко к месту отложения,
кодирующем β2M, в результате чего синтезиру!
в то время как во втором - белок синтезируется в
ется белок с повышенной склонностью к агрега!
одном или нескольких органах, а затем транспор!
ции [39].
тируется в растворимой форме плазмой крови к
Обширную группу системных амилоидозов
месту, где образуются амилоидные фибриллы
составляют расстройства, связанные с отложе!
[28]. Отдельно можно выделить обширную груп!
ниями аполипопротеинов. Например, амилои!
пу нейродегенеративных заболеваний, которые
доз, ассоциированный с аполипопротеином A!I
связаны с образованием амилоидных и амилои!
(ApoA!I), может быть представлен как в ненаслед!
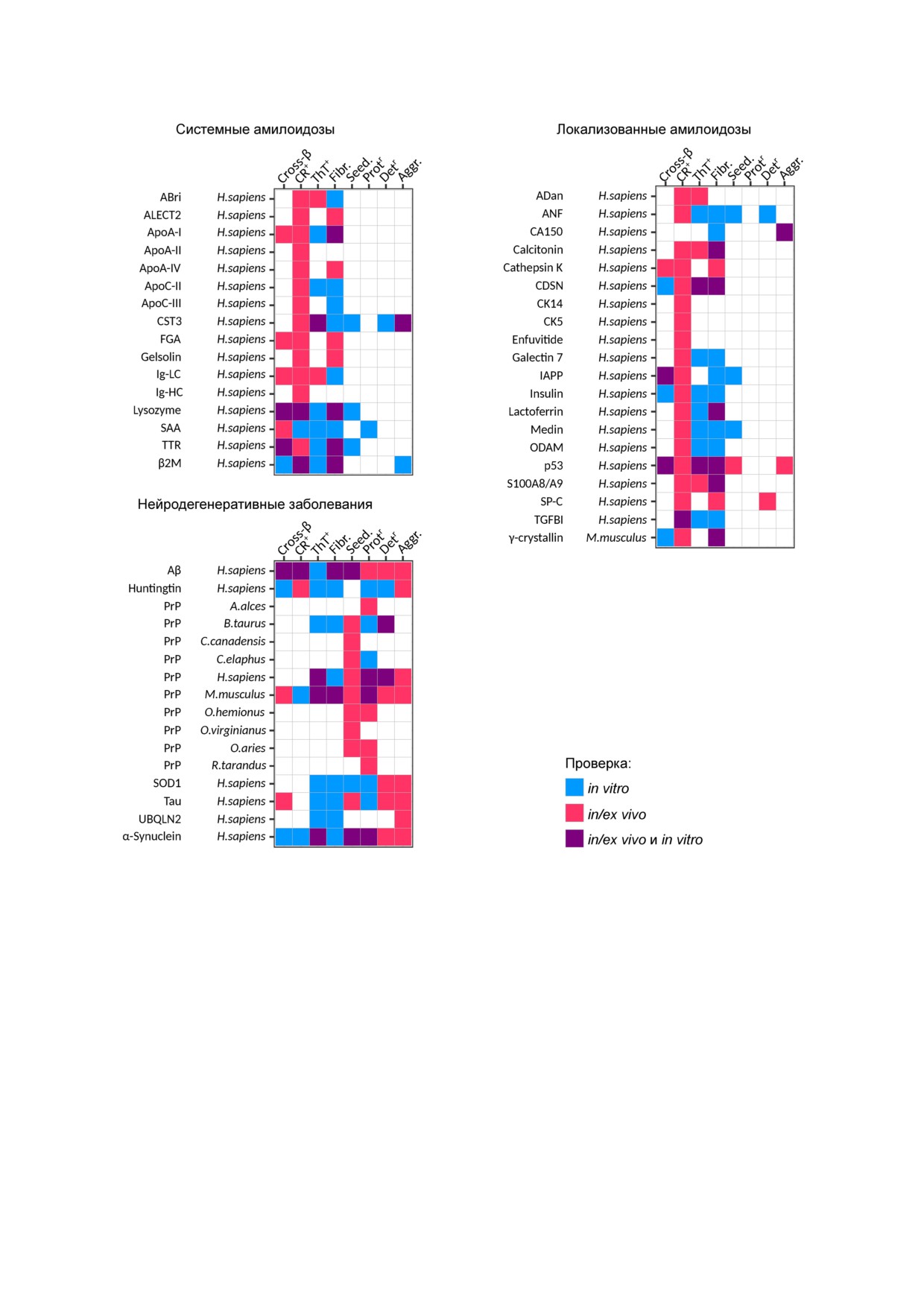
доподобных агрегатов. На рис. 2 представлен
ственной форме с отложениями белка дикого ти!
список белков, рассмотренных в этом подразде!
па в атеросклеротических бляшках, так и в виде
ле, а также информация о свойствах их агрегатов.
наследственной формы с отложениями мутант!
ных форм белка [40]. Системные наследствен!
ные амилоидозы в редких случаях могут быть
СИСТЕМНЫЕ АМИЛОИДОЗЫ
обусловлены мутантными формами гельзолина,
α!цепи фибриногена (FGA), цистатина C
Амилоидоз легкой цепи иммуноглобулина
(CST3) и лизоцима [15, 25, 28]. При преэкламп!
(AL!амилоидоз от Amyloid Light chain) является
сии отмечают агрегацию и наличие токсичных
6 БИОХИМИЯ том 85 вып. 9 2020
1218
МАТИИВ и др.
Рис. 2. Свойства патологических амилоидов и амилоидоподобных агрегатов. Обозначения аналогичны рис. 1. Ссылки на
литературу представлены в таблице S в Приложении
отложений неправильно свернутых Aβ, Ig!LC,
этого к удлинению белка [43]. Амилоидный пеп!
TTR, α!1!антитрипсина, альбумина и церуло!
тид ABri включает 34 С!концевые аминокислоты
плазмина в плаценте и физиологических жид!
мутантного предшественника белка и индуциру!
костях, однако неизвестно, какой белок играет
ет апоптотическую гибель клеток, в то время как
ключевую роль в развитии этого заболевания
белок дикого типа не токсичен для клеток [44].
[41]. Семейная британская деменция является
Интересно отметить, что другая мутация в этом
аутосомно!доминантным заболеванием, харак!
гене (дупликация 10!ти нуклеотидов непосред!
теризующимся отложениями амилоида ABri
ственно перед стоп!кодоном) приводит к обра!
[42], основным компонентом которого является
зованию амилоидного пептида ADan [45]. На!
пептид, кодируемый геном BRI2 (также извест!
копление и отложение пептида ADan связано
ный как ITM2B). Мутация в гене BRI2 приводит
уже не с системным, а с локализованным амило!
к замене стоп!кодона на аргинин и вследствие
идозом - семейной датской деменцией [46].
БИОХИМИЯ том 85 вып. 9 2020
АМИЛОИДНЫЕ И АМИЛОИДОПОДОБНЫЕ АГРЕГАТЫ
1219
ЛОКАЛЬНЫЕ АМИЛОИДОЗЫ
рый блокирует слияние ВИЧ!1 с клеткой!хозяи!
ном [61].
В этом разделе мы рассмотрим примеры ло!
кализованных амилоидозов, которые не затра!
гивают центральную нервную систему (ЦНС).
НЕЙРОДЕГЕНЕРАТИВНЫЕ
Среди них наиболее распространенным приме!
ЗАБОЛЕВАНИЯ
ром является амилоидоз аорты, связанный с аг!
регацией медина, продукта расщепления гли!
Амилоидозы, затрагивающие ЦНС, мы вы!
копротеина лактадгерина [47]. Локализованные
несли в отдельную группу, поскольку они изуче!
амилоидные и амилоидоподобные агрегаты об!
ны наиболее подробно. Пептид Aβ, фрагмент
наруживают также в опухолевых тканях. Медул!
белка!предшественника β!амилоида (APP), был
лярная карцинома щитовидной железы обус!
впервые выделен в качестве основного компо!
ловлена трансформацией парафолликулярных
нента амилоидных отложений у пациентов с бо!
С!клеток и увеличением уровня кальцитонина,
лезнью Альцгеймера. Хотя функция самого APP
гормона щитовидной железы, что приводит к
до конца не изучена, его процессинг детально
образованию амилоидных отложений этого бел!
исследован, за него отвечают β! и γ!секретазы.
ка [48]. В опухолях также идентифицируют не!
Расщепление γ!секретазой является неточным,
функциональные амилоидоподобные олигоме!
что приводит к образованию пептидов длиной
ры p53 [49], сферические депозиты пролактина
36-43 аминокислот, включая амилоидогенные
[50] и отложения одонтогенного амелобласт!ас!
Aβ40, Aβ42 и Aβ43 [51, 62]. Самую многочислен!
социированного белка (ODAM) [15]. Еще одним
ную фракцию (~80-90%) представляет вариант
гормоном, агрегация которого приводит к пато!
Aβ40, а вторую по численности - вариант Aβ42
логии, является островковый амилоидный по!
(около 5-10% всех вариантов). Aβ42 является
липептид (IAPP) или амилин, который был так
наиболее гидрофобным и более склонен к агре!
назван в честь его склонности к образованию
гации [63]. При этом пептиды Aβ проявляют
нерастворимых амилоидных фибрилл, что явля!
различную токсичность. Так, вариант Aβ43 ока!
ется особенностью островков Лангерганса у
зывается самым цитотоксичным, в то время как
большинства людей с диабетом второго типа
Aβ40 проявляет меньший токсический эффект
[51]. Примером возрастного заболевания явля!
[51]. Примечательно, что Aβ40 и Aβ42 способны
ется изолированный амилоидоз предсердия,
образовывать полиморфные фибриллы, от
обусловленный наличием амилоидных фиб!
структуры которых может зависеть скорость
рилл, основным компонентом которых служит
прогрессирования болезни Альцгеймера [64]. С
предсердный натрийуретический фактор (ANF)
этим заболеванием также связаны амилоиды,
[52]. При старческом локализованном амилои!
которые формирует Tau - нейрон!специфичес!
дозе может происходить агрегация семеногели!
кий белок [65]. В головном мозге пациентов с
на 1 (SEMG1) в эпителиальных клетках семен!
болезнью Альцгеймера Tau отделяется от мик!
ных пузырьков [53]. У мужчин среднего и стар!
ротрубочек, с которыми ассоциирован в норме,
шего возраста в предстательной железе обнару!
теряет способность их стабилизировать и обра!
живают амилоидные тельца, компонентами ко!
зует нейрофибриллярные клубки [66]. Белок α!
торых являются гетеродимеры белков S100A8 и
синуклеин формирует внутриклеточные амило!
S100A9 (S100A8/A9) [54]. К заболеваниям кожи
идные агрегаты, обнаруживаемые в тельцах Ле!
приводят амилоидные отложения корнеодесмо!
ви при болезни Паркинсона и деменции с тель!
сина (CDSN) [55], галектина!7 [56] и кератинов
цами Леви, в глиальных цитоплазматических
(CK5, СК14) [57]. Мутации в гене TGFBI, коди!
включениях у пациентов с множественной сис!
рующем кератоэпителин (TGFBI), белок вне!
темной атрофией и в аксональных сфероидах
клеточного матрикса, связывают с различными
при нейроаксональных дистрофиях [51, 67].
формами дистрофии роговицы [58]. Другим
Включения α!синуклеина также выявляют у па!
белком, агрегация которого приводит к такой
циентов с болезнью Альцгеймера [68].
же патологии, является лактоферрин - железо!
Способность амилоида индуцировать
связывающий гликопротеин [59]. Инсулин мо!
собственную сборку, передаваться от клетки к
жет образовывать амилоидные фибриллы в мес!
клетке или даже от организма к организму, вы!
те инъекций лекарств у пациентов с диабетом,
зывая распространение болезни, является ха!
вызывая инъекционный амилоидоз. При этой
рактерной чертой прионных заболеваний. У че!
патологии фибриллы инсулина образуют твер!
ловека они связаны с накоплением в ткани при!
дую подкожную массу в месте инъекции [60]. К
онной изоформы (PrPSc) клеточного прионного
похожему эффекту могут приводить инъекции
белка PrPC. К этим заболеваниям относят бо!
энфувиртида - синтетического пептида, кото!
лезнь Крейтцфельдта-Якоба, куру, фатальную
БИОХИМИЯ том 85 вып. 9 2020
6*
1220
МАТИИВ и др.
семейную бессонницу и синдром Герстма!
Saccharomyces cerevisiae. Одним из первых таких
на-Штраусслера-Шейнкера (наследственный
белков стала глюкантрансфераза Bgl2. Для это!
вариант болезни Крейтцфельдта-Якоба) [4].
го белка было показано формирование амило!
Наследственные прионные заболевания вызва!
идных фибрилл in vitro [16]. В дальнейшем было
ны мутациями в гене прионного белка (PRNP). В
обнаружено, что фибриллы также формируют и
частности, известно более 60 мутаций, которые
белки клеточной адгезии, Flo1 и Muc1. Некото!
связаны с разнообразными клиническими синд!
рые амилоидные свойства этих белков также
ромами [69]. У животных к прионным инфекци!
были продемонстрированы в системе in vivo.
ям относят скрепи овец, губчатую энцефалопа!
Протеомный скрининг на основе масс!спект!
тию крупного рогатого скота, а также хроничес!
рометрии (PSIA!LC!MALDI), направленный
кую изнуряющую болезнь оленей и лосей [4].
на поиск потенциально амилоидогенных бел!
Боковой амиотрофический склероз (БАС)
ков, позволил обнаружить и другие белки, фор!
является прогрессирующим нейродегенератив!
мирующие детергент!устойчивые агрегаты в
ным заболеванием. Известно более 180 мутаций
клеточной стенке: Gas1, Gas3, Gas5, Toh1 и
в гене, кодирующем цитоплазматическую супер!
Ygp1. Однако детально были исследованы лишь
оксиддисмутазу (SOD1) [70], которые обуслов!
три из них: Gas1, Toh1 и Ygp1. Функции белков
ливают около 20% наследственных случаев БАС
Toh1 и Ygp1 не установлены, в то время как GAS1
[51]. Токсичность мутантных форм SOD1 при
кодирует бета!1,3!глюканозилтрансферазу. Бе!
БАС объясняют неправильным сворачиванием
лок Toh1 связан с мембраной клетки благодаря
и склонностью к агрегации. Стоит отметить, что
GPI!якорю, и, предположительно, способству!
при некоторых случаях БАС также регистриру!
ет стабилизации структуры клеточной стенки за
ют присутствие цитоплазматических агрегатов
счет образования фибрилл [16]. Наконец, ами!
белков TDP!43 и FUS [51].
лоидоподобные агрегаты белков клеточной
стенки могут участвовать в адгезии клеток друг
к другу.
ФУНКЦИОНАЛЬНЫЕ АМИЛОИДЫ
Другой пример функциональных амилои!
дов, локализованных в клеточной стенке, связан
В этом разделе мы собрали информацию об
с образованием воздушных гиф клетками бакте!
агрегатах, которые демонстрируют амилоидные
рий Streptomyces coelicolor. Восемь белков, кото!
свойства и формирование которых тесно связа!
рые были первыми идентифицированы в соста!
но с выполнением той или иной функции. К со!
ве этих структур (ChpA!H), получили общее
жалению, не для всех рассмотренных примеров
название чаплины (chaplins) [71]. Для белков
нам удалось найти строгие доказательства функ!
ChpD!H доказан ряд амилоидных свойств in
циональности агрегатов, которые недавно были
vivo, однако эти результаты были получены на
предложены [16]. Тем не менее мы оставили в
смесях белков из детергент!устойчивых фрак!
этом разделе белки, для которых в литературе
ций. В формировании воздушных гиф S. coelicol
доминирует гипотеза о биологической значи!
or также участвуют белки RdlA и RdlB, которые
мости их агрегации. Информация о свойствах
образуют дополнительный белковый слой по!
функциональных амилоидов и амилоидоподоб!
верх чаплинов [71]. Несмотря на высокое сход!
ных агрегатов собрана на рис. 3.
ство последовательностей двух этих белков
(>90%), только RdlB может образовывать фиб!
риллы in vitro [71].
АМИЛОИДЫ В СОСТАВЕ КЛЕТОЧНОЙ
Амилоидные агрегаты в воздушных гифах
СТЕНКИ И ПРОЦЕССАХ
также придают их поверхности гидрофобные
КЛЕТОЧНОЙ АДГЕЗИИ
свойства. Аналогичную функцию выполняют
некоторые белки грибов, которые получили об!
Ряд белков, которые входят в состав клеточ!
щее название гидрофобины (hydrophobins). Сре!
ной стенки либо ассоциированы с ней, форми!
ди них белки EAS (у Neurospora crassa) и SC3 (у
руют амилоидные и амилоидоподобные агрега!
Schizophyllum commune) являются наиболее изве!
ты. Эти белки способствуют поддержанию
стными примерами амилоидов [16, 19]. Анало!
структуры и целостности клеточной стенки или
гичные белки (RodA, MPG1, NC2, DewA, Rep1)
иных структур оболочки клетки, а также участ!
из разных видов грибов обладают следующими
вуют в адгезии клеток друг к другу или к
свойствами: показано их участие в формирова!
субстрату.
нии фибриллярных структур на поверхности
Большое количество амилоидов и амилои!
клеток, высокая устойчивость к детергентам, а
доподобных агрегатов образуют белки, которые
также взаимодействие с тиофлавином Т [72-75].
входят в состав клеточной стенки дрожжей
Среди эукариот подобные примеры найдены
БИОХИМИЯ том 85 вып. 9 2020
АМИЛОИДНЫЕ И АМИЛОИДОПОДОБНЫЕ АГРЕГАТЫ
1221
Рис. 3. Свойства функциональных амилоидов и амилоидоподобных агрегатов. Обозначения аналогичны рис. 1. Ссылки
на литературу представлены в таблице S в Приложении
БИОХИМИЯ том 85 вып. 9 2020
1222
МАТИИВ и др.
также у Candida albicans (Als1, Als5, Eap1) [76,
β!листами, что сходно с образованием амило!
77].
идных фибрилл. Фибриллы спидроина были
На сегодняшний день известен целый ряд
обнаружены с помощью электронной микро!
белков бактерий, агрегация которых связана с
скопии у Nephila edulis [16]. Миниспидроин
формированием биопленок и адгезией к
eADF!4(C16), основанный на повторяющихся
субстрату. Наиболее известный пример - это бе!
регионах ADF!4 Araneus diadematus, образует
лок CsgA Escherichia coli, а также его многочис!
фибриллы с кросс!β структурой [16] и способен
ленные ортологи [78], которые необходимы для
запускать образование амилоидоподобных
образования фибрилл, названных керли (curli),
фибрилл in vitro [87]. Необходимо добавить, что
на поверхности клеток и формирования внекле!
REF (Hevb1) [88], один из белков латекса из ге!
точного матрикса в бактериальных биопленках
веи бразильской (каучуковое дерево, Hevea
[19, 79]. Аналогичная функция была предложе!
brasiliensis), в физиологических условиях in vitro
на и для других белков. В частности, белки TasA
образует агрегаты, обладающие амилоидными
у Bacillus subtilis, Bap у Staphylococcus aureus и
свойствами [89].
FapC у Pseudomonas fluorescens формируют на по!
верхности бактерий фибриллы, для которых по!
казаны амилоидные свойства [19, 79, 80]. Белок
АМИЛОИДЫ В ПРОЦЕССАХ
MTP также образует фибриллярные агрегаты на
СИГНАЛИНГА
поверхности Mycobacterium tuberculosis [81]. Ин!
гибирование фибриллизации белков P1, WapA и
Изменения в конформации белков лежат в
SMU_63c бактерии Streptococcus mutans препят!
основе передачи внутриклеточных сигналов.
ствует формированию биопленок [82]. Белки
Образование амилоидов - это также изменение
AgfA и AgfB формируют детергент!устойчивые
конформации, поэтому неудивительно, что бы!
агрегаты в клетках Salmonella enteritidis [83,84].
ли найдены белки, агрегация которых является
Наконец, есть предположение, что белок Sbp
неотъемлемой частью сигнальных каскадов. Хо!
Staphylococcus epidermidis также является амило!
рошо изученным примером является пара бел!
идом, поскольку он образует фибриллы, кото!
ков человека RIPK1 и RIPK3, совместная агре!
рые окрашиваются амилоид!специфическими
гация которых (коагрегация) необходима для за!
красителями [85].
пуска некроптоза [90, 91]. Для этих белков пока!
В целом, организация клеточной стенки или
заны практически все амилоидные свойства in
взаимодействий клеток друг с другом или с
vitro, а также есть доказательства их агрегации in
внешней средой является ожидаемой нишей
vivo. Участки, которые необходимы как для аг!
функциональных амилоидов. Стабильность и
регации, так и для осуществления сигнального
ригидность амилоидных фибрилл позволяет
каскада, содержат последовательности RHIM
придавать дополнительную прочность клеточ!
(от Rip homotypic interaction motif) [90].
ным покровам и межклеточным контактам.
Схожие мотивы были найдены в различных
белках большого числа организмов [92], в том
числе в хорошо изученном амилоиде HET!s
АМИЛОИДЫ В СОСТАВЕ ВОЛОКОН
Podospora anserina. Агрегаты этого белка облада!
ют инфекционными свойствами, благодаря че!
В 1968 году при использовании дифракции
му приводят к появлению приона [Het s]. Этот
рентгеновских лучей для исследования шелка
цитоплазматический фактор необходим для за!
златоглазок рода Chrysopa было показано, что
пуска реакции несовместимости гетерокарио!
расстояние между β!тяжами вдоль оси фибрил!
нов. При слиянии гиф разных организмов, один
лы составляет ~ 4,7 Å [4], что является свой!
из которых несёт этот прион, а второй - нет, мо!
ством, характерным для кросс!β структуры. Од!
жет происходить запрограммированная гибель
нако стоит отметить, что фиброин, выделяемый
клеток. Этот процесс запускается при взаимо!
тутовым шелкопрядом Bombyx mori, in vitro фор!
действии амилоидных агрегатов HET!s с моно!
мирует амилоидоподобные фибриллы с нео!
мерным белком HET!S (продукты разных алле!
бычной структурой, в которой β!тяжи парал!
лей одного гена), которые оказались в одном ге!
лельны оси фибриллы [86]. Другим примером
терокарионе после слияния клеток [93]. После!
белковых волокон являются паучьи шелка или
дующая агрегация HET!S приводит к измене!
спидроины - природные полимеры, характери!
нию его конформации, он получает возмож!
зующиеся исключительной прочностью и элас!
ность встраиваться в мембрану клетки, нарушая
тичностью. Для них был отмечен переход от
её целостность [94].
конформации на основе α!спиралей и неупоря!
Последующий поиск RHIM среди других
доченных участков к структуре, обогащенной
белков P. anserina выявил нового участника это!
БИОХИМИЯ том 85 вып. 9 2020
АМИЛОИДНЫЕ И АМИЛОИДОПОДОБНЫЕ АГРЕГАТЫ
1223
го сигнального каскада, NWD2, который может
ного иммунитета, которые обнаружены во мно!
запускать агрегацию HET!s. Впоследствии это
гих организмах. Большинство АМП представля!
приводит к гибели клеток [95]. Белки HELLP,
ют собой катионные и амфифильные α!спи!
SBP и PNT1 гриба Chaetomium globosum, также
ральные белковые молекулы. Основной меха!
несут RHIM и, возможно, являются функцио!
низм их работы - это связывание с негативно
нальными аналогами системы HET!s, HET!S,
заряженной бактериальной мембраной и нару!
NWD2 [96].
шение ее целостности [100]. Для некоторых
Скрытые RHIM (cRHIM, от cryptic RHIM)
АМП показаны амилоидные свойства, которые,
были обнаружены в белках Drosophila
предположительно, важны для их функциони!
melanogaster PGRP!LC, PGRP!LE и Imd, кото!
рования. В большинстве случаев эти свойства
рые участвуют в запуске антимикробного отве!
проанализированы только in vitro, поэтому мно!
та. Была предложена модель, согласно которой
гие из этих пептидов не представлены на рис. 3
агрегация этих белков является ключевым собы!
(см. таблицу S в Приложении).
тием в передаче сигнала [97]. Поскольку RHIM
Склонность к агрегации была показана для
найдены среди разных белков, связанных с про!
цекропинов, однако пока собрано недостаточно
цессами сигналинга [98], можно ожидать описа!
данных в пользу образования ими амилоидов
ния новых функциональных амилоидов.
[101]. Считается, что цекропин P1 образует ло!
Распознавание клеткой вирусной РНК ини!
кальную структуру наподобие ковра на мембра!
циирует каскад передачи сигнала, который при!
не патогена, приводя к деформации мембраны,
водит к запуску противовирусного ответа. Од!
а затем к разрушению, когда концентрация
ним из недавно обнаруженных участников тако!
АМП превысит критическую [102].
го сигналинга стал белок MAVS. Показано, что
LL!37 - первый открытый антимикробный
свою функцию он выполняет в агрегированной
катионный пептид человека [103]. При бактери!
форме. Молекула MAVS содержит С!терминаль!
альной инвазии он высвобождается протеазами
ный трансмембранный домен, благодаря кото!
из своего предшественника hCAP!18. LL!37 об!
рому он связан с митохондриальной мембраной,
разует волокнистые агрегаты in vitro, которые
N!терминальный каспазо!рекрутирующий при!
окрашиваются конго красным и характеризуют!
оногенный домен CARD, экспонированный
ся яблочно!зеленым свечением при двойном лу!
внутрь цитозоля, а также промежуточный учас!
чепреломлении в кросс!поляризованном свете
ток, который рекрутирует сигнальные молекулы
[103]. Фибриллы, сформированные коротким
нижележащего пути передачи сигнала. Домен
олигопептидом из последовательности LL!37,
CARD взаимодействует с таким же участком ре!
не окрашиваются тиофлавином Т и имеют неха!
цепторных белков RIG!1 и MDA5, которые рас!
рактерное для амилоида строение: они состоят
познают чужеродную РНК, запуская каскад
из плотно упакованных амфипатических α!спи!
противовирусного ответа. При этом MAVS обра!
ралей [104]. Показано, что агрегация белка LL!
зует комплексы, которые инициируют агрега!
37 может быть напрямую связана с его цитоток!
цию других молекул MAVS [99].
сичностью [103].
Агрегаты MAVS демонстрируют ряд
Дермасептины Drs S9 и aDrs PD!3!7 были
свойств, характерных для амилоидов, но обла!
изолированы из кожи лягушек. Они образуют
дают особой структурой, поэтому они не взаи!
фибриллы, обогащенные β!слоями, для кото!
модействуют с красителями конго красным и
рых показан ряд амилоидных свойств [105-107],
тиофлавином T. Белок MAVS, переходя в агре!
однако, как и для многих АМП, для них нет
гированную форму, не претерпевает конформа!
подтверждения in vivo. Магайнины были обна!
ционных переходов α!спиралей в β!листы. На
ружены в коже лягушки Xenopus laevis и облада!
основании данных криоэлектронной микро!
ют противомикробным [108, 109] и противоопу!
скопии были предложены две модели агрегатов
холевым действием [110, 111], а также демон!
этого белка. В обоих случаях филаменты MAVS
стрируют амилоидные свойства. Для них впер!
состоят из отдельных субъединиц белка, уло!
вые был предложен антимикробный механизм с
женных друг на друга и образующих централь!
образованием тороидальных пор. Магайнины
ную пору [99].
связываются с мембраной и, достигнув порого!
вой концентрации, приводят к ее деформации и
дестабилизаци. После этого пептиды встраива!
ТОКСИНЫ И АНТИМИКРОБНЫЕ
ются в мембрану, образуя тороидальную пору
ПЕПТИДЫ
[112]. АМП человека, протегрин!1 (PG!1), фор!
мирует in vitro фибриллы, которые связывают
Антимикробные пептиды (АМП) - это за!
тиофлавин Т. Протегрины находятся в нераство!
щитные пептиды, являющиеся частью врожден!
римом состоянии в гранулах нейтрофилов и
БИОХИМИЯ том 85 вып. 9 2020
1224
МАТИИВ и др.
макрофагов. Если в клетку попадает патоген,
АМИЛОИДЫ В ПРОЦЕССАХ ПАМЯТИ
гранулы сливаются с вакуолью, высвобождая
пептиды, которые образуют каналы в мембране
Присутствие амилоидов в ЦНС десятилети!
патогена, приводя к его гибели [113]. К извест!
ями ассоциировалось исключительно с патоло!
ным протегринам с амилоидными свойствами
гиями. Но всё изменилось, когда были обнару!
относят также PG!4, выделенный из лейкоци!
жены функциональные амилоиды белка CPEB у
тов свиней. Было показано, что in vitro он обра!
моллюска Aplysia californica и его гомологов:
зует фибриллярные агрегаты, которые окраши!
Orb2 у D. melanogaster и CPEB3 у мыши. Белки
ваются конго красным и тиофлавином Т. Как
CPEB являются РНК!связывающими, причём
мономеры, так и агрегаты проявляют антимик!
они лучше связывают РНК, находясь в олигоме!
робную активность против B. subtilis [114]. Мик!
ризованном состоянии [121]. В мозге исследо!
роцин Е492 является известным порообразую!
ванных животных олигомеризация белков
щим бактериальным токсином, продуцируемым
CPEB происходит в ответ на нейрональную сти!
Klebsiella pneumoniae RYC492. Показано, что он
муляцию [122, 123]. В том случае, если эти бел!
способен формировать амилоидоподобные
ки не способны формировать агрегаты, это не!
фибриллы, богатые β!слоями in vivo и in vitro
гативно сказывается на поддержании долго!
[115]. Другим примером бактериального токси!
срочной памяти, по крайней мере у A. californica
на служит белок PSMα3 S. aureus, образующий
и D. melanogaster [121, 122]. Всё это позволяет
фибриллы с кросс!α структурой, которые могут
заключить, что белки CPEB действительно
связывать тиофлавин Т. При этом есть свиде!
функциональны именно в агрегированном сос!
тельства токсичности фибрилл по отношению к
тоянии. Исследователи также называют эти бел!
клеткам человека [23].
ки функциональными прионами [123], что, ве!
Клетки Панета тонкого кишечника человека
роятно, не имеет достаточных оснований, так
продуцируют α!дефензин 6 (HD6), который
как инфекционность in vivo CPEB и CPEB3 бы!
обеспечивает защиту от инвазии патогенными
ла продемонстрирована только в дрожжевой
микроорганизмами кишечника [116]. Связыва!
системе [123, 124]. До недавнего времени не бы!
ясь с поверхностными белками бактерий, HD6
ло прямых доказательств того, что эта группа
подвергается упорядоченной самосборке с об!
белков формирует амилоидные агрегаты непос!
разованием фибрилл и наносеток, которые ок!
редственно в живых организмах без искусствен!
ружают и запутывают патогены. Это создает
ной сверхпродукции. Лишь недавно амилоид!
препятствие для физического контакта бакте!
ная природа была строго доказана для фибрилл
рий с эпителиальными клетками, необходимое
Orb2, выделенных из голов дрозофил. При этом
для прикрепления или инвазии [116].
впервые удалось воссоздать в высоком разреше!
У растений были также обнаружены амилои!
нии структуру амилоидных фибрилл ex vivo с по!
доподобные АМП. Cn!AMP2, полученный из
мощью криоэлектронной микроскопии [125].
жидкого эндосперма кокосового ореха Cocos
Фибриллы Orb2 демонстрируют сходную с изве!
nucifera, образует видимые агрегаты в водном бу!
стной структурой Aβ40 трёхлучевую симметрию
фере, которые связывают конго красный, тио!
[125]. Таким образом, очевидно, что амилоидная
флавин Т, а также имеют фибриллярную морфо!
структура сама по себе может и не являться при!
логию. Однако в настоящее время нет прямых
чиной развития патологий ЦНС, и для понима!
доказательств того, что Cn!AMP2 обладает ан!
ния реальных причин развития нейродегенера!
тибактериальным эффектом исключительно в
тивных амилоидозов необходимо глубокое изу!
агрегированной форме [117].
чение факторов, влияющих на амилоидогенез
Важно отметить, что белки, связанные с че!
того или иного белка.
ловеческими амилоидозами, могут вести себя
CPEB/Orb2 не является единственным при!
как токсины. Например, Aβ проявляет анти!
мером амилоидов, связанных с процессами па!
микробные свойства, которые нацелены на па!
мяти. Недавно было показано, что белок FXR1,
тогенные бактерии и грибы in vitro и в модель!
участвующий в развитии долгосрочной памяти
ных системах: у Caenorhabditis elegans и мыши
и эмоций, присутствует в мозге крыс в составе
[118, 119]. Антимикробные свойства продемон!
амилоидных агрегатов. Более того, его почти не!
стрированы для ряда других амилоидогенных
возможно было детектировать в мономерной
белков. Например, в дополнение к фермента!
форме. При этом обнаруженные агрегаты демон!
тивным свойствам лизоцим проявляет себя как
стрировали амилоидные свойства [126]. FXR1 -
АМП. Его антимикробная активность связана с
это РНК!связывающий белок, для которого по!
пермеабилизацией клеточной мембраны пато!
казано, что в амилоидной форме он способен
гена, предположительно через образование пор
связывать мРНК, защищая её от действия
[120].
РНКаз [126]. Вероятно, таким образом он влия!
БИОХИМИЯ том 85 вып. 9 2020
АМИЛОИДНЫЕ И АМИЛОИДОПОДОБНЫЕ АГРЕГАТЫ
1225
ет на трансляцию определённых мРНК и, как
наружу. Амилоиды, образованные белками
следствие, на дифференциальную экспрессию в
подгруппы CRES (Cystatin!related epididymal
нейронах. Тот факт, что в мозге крысы FXR1 об!
spermatogenic) - CRES, CRES2, CRES3 и цис!
наруживается исключительно в составе детер!
татин E2 (mCST E2), присутствуют в эпидиди!
гент!устойчивых агрегатов, в совокупности с
мисе мыши, в то время как у человека в этом же
данными о том, что FXR1 важен для регуляции
органе обнаруживают агрегаты цистатина С
памяти и эмоций, позволяет причислить FXR1 к
(CST3). Роль амилоидов, образуемых белками
функциональным амилоидам. Амилоидогенный
CRES, не совсем понятна, но существуют пред!
фрагмент FXR1 является высококонсерватив!
положения об их функциональной значимости.
ным у млекопитающих [126], что позволяет
Известно, что они обладает антимикробной ак!
экстраполировать полученные результаты на
тивностью, необходимы для акросомной реак!
ортологи этого белка у других организмов.
ции, нормального функционирования лизосом
Вполне вероятно, что участие амилоидов в
в эпидидимисе, а также играют роль в созрева!
процессах памяти не ограничивается животны!
нии сперматозоидов. Семенная жидкость также
ми и их нервной системой. Альтернативная
содержит амилоиды и амилоидоподобные фиб!
амилоидная конформация может нести опреде!
риллы, образованные фрагментами пептида
ленную информацию, которая может так или
фермента фосфатазы простатической кислоты
иначе быть «дешифрована» на клеточном уров!
(PAP) и белков семеногелина (SEMG1 и
не, поэтому использование подобных агрегатов
SEMG2) соответственно. Эти фибриллы, пер!
для долгосрочного хранения информации мо!
воначально идентифицированные как усилите!
жет быть универсальным механизмом, который
ли вирусной инфекции, связываются с повреж!
мог многократно и независимо реализовывать!
денными сперматозоидами и иммобилизуют
ся в эволюции. Одним из примеров похожего
их, обеспечивая их уничтожение иммунными
механизма клеточной памяти является сущест!
клетками. Амилоиды, образованные белком
вование так называемых «мнемонов». Это агре!
SEMG1, также обнаружены при некоторых па!
гаты белка Whi3 у дрожжей, которые возникают
тологиях.
в ответ на неудачное слияние клеток противо!
Ооциты большинства позвоночных содер!
положных типов спаривания и остаются в клет!
жат тела Бальбиани (Balbiani bodies). Матрикс
ках дрожжей на всю жизнь, как память о про!
этого компартмента у X. laevis состоит из фиб!
шедшем событии [127]. В отличие от прионов,
риллярной сети, образованной белком Xvelo.
мнемоны не передаются в дочерние клетки при
Эти фибриллы окрашиваются тиофлавином Т и
делениях. Тем не менее вполне возможно, что
устойчивы к обработке детергентами [128]. Ами!
известные прионы низших эукариот (см. далее)
лоидные свойства также показаны для белков,
также могут являться единицами наследования
участвующих в формировании оболочки ооцита
такой «памяти», которые однако уже переносят
у насекомых, рыб и млекопитающих. Данные
информацию, не ограничиваясь жизнью одной
экспериментов по рассеянию рентгеновских лу!
клетки, на протяжении многих клеточных по!
чей свидетельствуют, что амилоидные структу!
колений. Учитывая, что для некоторых прио!
ры присутствуют в составе хориона бабочки
нов на сегодняшний день известно, что они
Antheraea polyphemus [129]. Стоит заметить, что
способны возникать в ответ на определенные
значительная часть амилоидных свойств была
стрессовые воздействия, не исключено, что
продемонстрирована для отдельных пептидов
прионы для одноклеточных организмов - это
данных белков, соответствующих участку тан!
такая «память предков» о пережитых ими невз!
демных повторов (сА!пептидов) [130, 131]. Ин!
годах.
тересно, что сборка амилоидных фибрилл из та!
ких пептидов происходит через промежуточную
жидкокристаллическую фазу [132]. У костистых
АМИЛОИДЫ, СВЯЗАННЫЕ
рыб в составе хориона присутствуют белки груп!
С РАЗМНОЖЕНИЕМ
пы ZPB, отдельные пептиды которых также
склонны к формированию амилоидных агрега!
Функциональные амилоидные фибриллы
тов [133]. Амилоидные свойства показаны и для
были обнаружены в структурах, связанных с по!
белков в составе блестящей оболочки (zona pel!
ловым размножением, например в акросоме
lucida) ооцита млекопитающих. Так, белки в
сперматозоидов. Считается, что эти фибриллы
составе этой оболочки у мышей in vivo демон!
способствуют контролируемому высвобожде!
стрируют характерную морфологию агрегатов, а
нию белков во время акросомной реакции,
также типичный для кросс!β структуры паттерн
ключевого события в оплодотворении ооцитов,
дифракции рентгеновских лучей и связывание с
при котором содержимое акросомы изливается
амилоид!специфическими красителями [134].
БИОХИМИЯ том 85 вып. 9 2020
1226
МАТИИВ и др.
Эти же свойства были показаны для агрегатов
нина в системе in vitro [137]. Формирование
пептидных аналогов фрагментов белков ZP1-
комплексных агрегатов из амилоидных фибрилл
ZP4 человека в системе in vitro [135]. Считается,
PMel17, по!видимому, обеспечивает максималь!
что образование амилоидных фибрилл в обо!
ную эффективность синтеза меланина.
лочках ооцитов и эмбрионов у различных жи!
Кроме участия амилоидов в синтезе гормо!
вотных способствует защите от внешних воздей!
нов, было показано, что сами пептидные гормо!
ствий, таких как повышенная температура, ме!
ны могут формировать амилоиды, которые,
ханическое давление и другие.
предположительно, нужны для их хранения в
Некоторые амилоидоподобные белки
секреторных гранулах. Из 42!х исследованных in
действуют как регуляторы клеточного цикла и
vitro пептидных гормонов 10 демонстрировали
влияют на половое размножение дрожжей. Бе!
спонтанное формирование амилоидных фиб!
лок Rim4 S. cerevisiae образует детергент!устой!
рилл, а 31 гормон формировал фибриллы в при!
чивые агрегаты во время фазы G1 мейоза. Это
сутствии гликозаминогликана гепарина [142].
приводит к репрессии трансляции циклина Clb3
Пролактин формировал их в присутствии хонд!
и последующему запуску деления. Разборка аг!
роитин сульфата А - гликозаминогликана, най!
регатов Rim4 запускается путем фосфорилиро!
денного ранее в гранулах, содержащих пролак!
вания этого белка [136].
тин.
Окситоцин демонстрировал глобулярную
структуру, которая связывалась с тиофлавином
ГОРМОНЫ И АМИЛОИДЫ
T. Адренокортикотропный гормон (ACTH) не
был способен формировать амилоиды сам по
С гормонами связано обнаружение первых
себе и делал это только в присутствии агрегатов
функциональных амилоидов млекопитающих -
β!эндорфина (оба являются продуктами одного
фибрилл меланосом, сформированных белком
прогормона и локализуются вместе в секретор!
PMel17. Оказалось, что PMel17 участвует в син!
ных гранулах клеток гипофиза). Эти данные
тезе меланина именно в амилоидной форме
были получены с использованием ACTH и β!
[137]. PMel17 подвержен протеолитическому
эндорфина человека, но in vivo были подтверж!
расщеплению в меланоцитах, на первом этапе
дены амилоидные свойства этих белков, выде!
которого образуется фрагмент Mα [138]. Амило!
ленных из секреторных гранул мыши и крысы
идные свойства надёжно показаны для целого
[142].
Mα, причем его конверсия в амилоидную форму
Важное свойство, которое было обнаружено
происходит по меньшей мере на четыре порядка
у амилоидов некоторых гормонов - способ!
быстрее, чем у Aβ или α!синуклеина [137, 139].
ность отделять мономеры в условиях, соответ!
Это можно было бы объяснить тем, что, в отли!
ствующих высвобождению пептидов из секре!
чие от патологических амилоидов, PMel17 под!
торных гранул. Кроме того, амилоиды только
вергался эволюционному отбору в сторону по!
семи гормонов демонстрировали токсичность
вышения эффективности амилоидизации. Од!
для клеток [142]. Оба этих наблюдения говорят о
нако в клетках Mα подвержен дальнейшему
том, что действительно амилоиды некоторых
протеолизу и не является основным компонен!
гормонов могут выполнять запасающую функ!
том агрегатов меланосом.
цию в клетке. Влияние амилоидов глюкагона на
Существовали противоречивые данные о
токсичность оказалось в два раза сильнее Aβ40
том, какие именно домены PMel17 непосред!
[142], что подтверждает данные о том, что ами!
ственно формируют амилоидные фибриллы в
лоиды глюкагона могут быть патологическими
клетке [138-140]. Предположительно, разные
[143]. Интересно, что ещё один гормон, пролак!
продукты протеолиза PMel17 амилоидизуются
тин, обнаружен в составе амилоидов у пациен!
на разных этапах формирования меланосом.
тов с аденомой [144], однако в свете данных о
Присутствующие в клетке фибриллы, таким об!
том, что амилоиды пролактина могут быть
разом, представляют собой сложные коагрегаты
функциональными, неясно имеет ли место не!
из разных фрагментов PMel17 [141]. Мономер!
гативное влияние амилоидов пролактина при
ный предшественник меланина, индол!5,6!хи!
патологии. В предыдущем разделе мы также
нон (DHQ), напоминает по структуре тиофла!
рассмотрели белок семеногелин, агрегаты кото!
вин Т, и предполагается, что фибриллы Pmel17
рого обнаруживают как при амилоидозах, так и
могут являться затравкой для полимеризации
в нормальных сперматозоидах. Таким образом,
DHQ. О том, что амилоид может служить в каче!
не исключено что и амилоиды некоторых других
стве такого «катализатора», говорит тот факт,
белков, обнаруженные при различных патоло!
что не только Mα, но и фибриллы α!синуклеи!
гиях, в действительности могут также являться и
на или Aβ увеличивают скорость синтеза мела!
функциональными амилоидами.
БИОХИМИЯ том 85 вып. 9 2020
АМИЛОИДНЫЕ И АМИЛОИДОПОДОБНЫЕ АГРЕГАТЫ
1227
АМИЛОИДЫ С НЕОДНОЗНАЧНОЙ
[11] такие свойства были показаны для десятков
БИОЛОГИЧЕСКОЙ РОЛЬЮ
белков дрожжей, точнее, их потенциальных
прионных доменов, выявленных in silico. В боль!
В этом разделе мы собрали примеры белко!
шинстве случаев остаётся неясным, способны
вых агрегатов, чья биологическая роль является
ли выявленные белки формировать настоящие
поводом дебатов в литературе. В частности, до
прионы в дрожжах. Это связано прежде всего с
сих пор нет единого мнения по поводу назначе!
тем, что установленные свойства фрагмента
ния прионов дрожжей, так как есть аргументы
белка не всегда можно экстраполировать на
как за, так и против их возможной функцио!
полноразмерный белок.
нальности [145, 146]. Белки в составе немем!
Отдельного упоминания заслуживает фактор
бранных органелл также могут формировать
[ISP+], который, согласно генетическим дан!
амилоидные агрегаты, однако не всегда ясно,
ным, является прионной формой белка Sfp1
является ли эта особенность необходимой для
[161]. Однако его фенотип (Isp+) возникает
функционирования этих белков. Многие белки!
вследствие изменения числа копий хромосомы
резиденты немембранных органелл также связа!
II, которое происходит при сверхпродукции
ны с патогенезом таких заболеваний, как БАС и
Sfp1 [162]. При этом Sfp1 может образовывать
некоторые виды деменции. Наконец, агрегация
детергент!устойчивые агрегаты, которые, по!
показана для различных ферментов и поринов,
видимому, никак не связаны с Isp+ [163].
о функциональной значимости которой есть
История Isp+ наглядно демонстрирует, что
лишь предположения. Информация о свойствах
выводы об амилоидной природе определённого
агрегатов этих белков собрана на рис. 4.
приона, основанные на генетическом анализе,
но не подкреплённые существенными биохими!
ческими или структурными данными нельзя
АМИЛОИДНЫЕ И АМИЛОИДОПОДОБНЫЕ
считать достаточно обоснованными. Известные
ПРИОНЫ
на сегодняшний день наследственные факторы,
демонстрирующие прионоподобное поведение,
Большое количество амилоидов, которые об!
но не связанные с амилоидами, такие как
ладают инфекционными свойствами и называ!
[GAR+] [164] и [SMAUG+] [165] и другие [166],
ются прионами, найдено у дрожжей S. cerevisiae.
также подтверждают это. Кроме того, белки, для
Фенотипическое проявление большинства из
которых свойственно образование жидких ка!
них связано с формированием амилоидных аг!
пель (см. далее), часто способны формировать и
регатов того или иного белка. В большинстве
амилоиды, как, например Sup35 [167]. Наличие
случаев это приводит к утрате или ослаблению
таких примеров позволяет сделать вывод о том,
функции соответствующего белка. В качестве
что сочетание генетических данных in vivo с до!
примеров можно привести белки Sup35, Ure2,
казательством амилоидогенности белка in vitro
Swi1, Cyc8, Mot3 [93]. Из!за этого штаммы, под!
также является недостаточным для того, чтобы
держивающие определённый прион, имеют фе!
утверждать, что определённый белок способен
нотип, сходный с мутантным по гену, кодирую!
принимать амилоидную конформацию в живых
щему соответствующий белок. Но этот фенотип
организмах. Для справедливости такого утверж!
демонстрирует цитоплазматическое наследова!
дения необходимы дополнительные доказатель!
ние, так как амилоидные агрегаты локализуются
ства амилоидных свойств in vivo, которые на се!
в цитоплазме [93]. Первыми описанными прио!
годняшний день отсутствуют у большинства
нами дрожжей стали факторы [URE3], [PSI+] и
«классических» амилоидных прионов дрожжей.
[PIN+] ([RNQ+]), которые сопряжены с появле!
нием амилоидных агрегатов Ure2, Sup35 и Rnq1
соответственно [93]. Благодаря продолжитель!
НЕМЕМБРАННЫЕ ОРГАНЕЛЛЫ
ной истории исследований эти белки стали при!
И БЕЛКОВЫЕ АГРЕГАТЫ
мерами амилоидов, для которых продемонстри!
рованы практически все свойства. Позднее бы!
Немембранные органеллы - это динамичес!
ло найдено еще более десятка дрожжевых прио!
кие структуры в ядре или цитоплазме клетки,
нов (таблица).
образованные большим скоплением взаимодей!
Наличие свойств, специфичных для прио!
ствующих биологических молекул, выполняю!
нов S. cerevisiae, и удобных генетических тестов,
щих специфический набор функций. Описано
позволяющих их выявить, дало возможность
множество типов таких компартментов с разно!
проводить скрининги в дрожжах, направленные
образными клеточными функциями [168]. К
на поиск белков, проявляющих прионные и
ядерным немембранным органеллам относят
амилоидные свойства. В ходе одного скрининга
ядрышко, тельца Кахаля, ядерные спеклы или
БИОХИМИЯ том 85 вып. 9 2020
1228
МАТИИВ и др.
Рис. 4. Свойства амилоидов и амилоидоподобных агрегатов с неоднозначной биологической ролью. Обозначения анало!
гичны рис. 1. Ссылки на литературу представлены в таблице S в Приложении
БИОХИМИЯ том 85 вып. 9 2020
АМИЛОИДНЫЕ И АМИЛОИДОПОДОБНЫЕ АГРЕГАТЫ
1229
Дрожжевые прионы, связанные с появлением амилоидных или амилоидоподобных агрегатов
Прион
Структурный белок и его функция
Фенотип приона
Ссылки
[URE3]
Ure2, негативный регулятор генов ка!
ассимиляция клетками бедных источников
[9]
таболизма бедных источников азота
азота в присутствии богатых
[PSI+]
Sup35, фактор терминации трансля!
снижение эффективности терминации транс!
[9, 147, 148]
ции eRF3
ляции (нонсенс!супрессия)
[PIN+] ([RNQ+])
Rnq1, функция белка неизвестна
инициация формирования других прионов
[149, 150]
[SWI+]
Swi1, компонент хроматин!ремодели!
неспособность использовать неферментируе!
[151-153]
рующего комплекса SWI/SNF
мые источники углерода, ухудшение флокку!
ляции и псевдогифального роста; при наличии
приона [PIN+], усиление нонсенс!супрессии
(фактор [NSI+])
[MOD+]
Mod5, фермент изопентинилтрансфе!
устойчивость к ингибиторам эргостерола (нап!
[154]
раза, который модифицирует тРНК
ример, флуконазол)
[OCT+]
Cyc8, репрессор транскрипции (сов!
неспособность ассимилировать лактат, нару!
[155]
местно с Tup1)
шение скрещивания и споруляция
[MOT3+]
Mot3, транскрипционный фактор, ре!
факультативная многоклеточность, формиро!
[11, 156]
гулирует гены анаэробного метабо!
вание биопленок
лизма и гены, участвующие в биосин!
тезе клеточной стенки и эргостерола
[NUP100+]
Nup100, компонент комплекса ядер!
незначительное ускорение импорта в ядро
[157]
ной поры
[LSB2]
Lsb2 (Pin3), негативный регулятор
депонирование других белков в составе агрега!
[158, 159]
фактора сборки актиновых филамен!
тов, повышение частоты возникновения
тов
[PSI+]
[GLN3↑+]
Gln3 (только при сверхпродукции),
снижение токсичности сверхэкспрессии
[160]
регулятор генов катаболизма бедных
GLN3, устойчивость к рапамицину
источников азота
тельца гистонового локуса. Эти органеллы игра!
собность этих белков вступать в поливалентные
ют важную роль в процессах транскрипции, соз!
межмолекулярные взаимодействия, приводя!
ревания различных видов РНК, а также биоге!
щие к фазовым переходам [171-176]. Такие
незе рибосом [169]. В свою очередь, цитоплаз!
фрагменты зачастую обладают специфическим
матические немембранные органеллы зачастую
аминокислотным составом с низким разнообра!
связаны с процессингом, хранением и деграда!
зием, и поэтому их называют LC!доменами (от
цией белков и мРНК. К ним относят такие
low complexity). Участки, ответственные за фа!
структуры, как P!тельца и стресс!гранулы [168],
зовое разделение, также часто имеют аминокис!
а также недавно обнаруженные А!тельца [170].
лотный состав, характерный для прионных до!
Многие немембранные органеллы обладают
менов, вследствие чего обозначаются как прио!
жидкостными свойствами и формируются за
ноподобные [168].
счет процесса фазового перехода жидкость!
Считается, что в норме немембранные орга!
жидкость (liquid!liquid phase separation), проис!
неллы на начальных стадиях своего формирова!
ходящего при взаимодействии белковых моле!
ния не содержат агрегатов с классической ами!
кул и приводящего к формированию структур
лоидной структурой. При созревании же таких
типа жидкая капля (liquid droplet). Большое ко!
органелл в их составе могут появляться сначала
личество белков немембранных органелл взаи!
лабильные амилоидоподобные агрегаты, а затем
модействуют с РНК и несут в своей структуре
и стабильные амилоидные фибриллы [177-179].
мотивы распознавания РНК. Важную роль в
В то же время формирование амилоидных фиб!
формировании немембранных органелл играют
рилл некоторых компонентов немембранных
внутренне неупорядоченные (intrinsically disor!
органелл связано с развитием таких смертель!
dered) участки, которые предопределяют спо!
ных нейродегенеративных заболеваний челове!
БИОХИМИЯ том 85 вып. 9 2020
1230
МАТИИВ и др.
ка, как БАС и лобно!височная деменция. Оста!
лоидного кора имеется остаток аспарагиновой
ется неясным, является ли формирование ами!
кислоты, который отвечает за дестабилизацию
лоидных фибрилл необходимым или побочным
структуры. Его мутации в RAC!элементах пре!
свойством рассматриваемых белков. Кроме то!
пятствуют переходу белка из фибриллярного
го, структура агрегатов, формируемых многими
состояния в растворимое [181].
белками!резидентами немембранных органелл,
Агрегаты белка TDP!43 были обнаружены в
имеет ряд важных отличий от типичной струк!
составе включений в мозге пациентов с БАС и
туры амилоидных фибрилл (в частности, агрега!
лобно!височной лобарной дегенерацией
ты ряда таких белков чувствительны к воздей!
(ЛВЛД). Несмотря на то что существует предпо!
ствию высокой температуры и детергентов [180,
ложение об их прионоподобных свойствах, бе!
181]).
лок TDP!43 не способен формировать протя!
РНК!связывающий белок FUS, участвую!
женные амилоидные фибриллы, образуя лишь
щий в формировании P!телец, способен к агре!
небольшие олигомеры. Они способны индуци!
гации и активно взаимодействует с агрегатами
ровать агрегацию не только нормального TDP!
других белков [182], а его мутантные формы свя!
43, но и других амилоидогенных белков, таких
заны с БАС. За формирование агрегатов FUS от!
как Aβ [188]. В норме TDP!43 является РНК!
вечает его LC!домен. Данный фрагмент цели!
связывающим белком!регулятором сплайсинга
ком, как и отдельные его участки, названные
мРНК; при стрессовых воздействиях TDP!43
RAC (от Reversible Amyloid Core), способен in
входит в состав стресс!гранул. Интересно, что
vitro формировать неразветвленные амилоидные
возможна также олигомеризация TDP!43 за счет
фибриллы, связывающие амилоид!специфи!
взаимодействия мономеров через их N!конце!
ческие красители и обладающие характерной
вые участки, что препятствует взаимодействию
структурой [183,184]. В то же время структура
LC!доменов и патологической агрегации. Более
этих фибрилл имеет ряд характерных отличий
того, такая олигомеризация важна для выполне!
от традиционной кросс!β модели: так, агрегаты
ния биологической функции TDP!43 [188]. Та!
FUS!LC характеризуются единообразием струк!
ким образом, агрегация TDP!43 может происхо!
туры и отсутствием регулярных взаимодействий
дить двумя способами, но неясно является ли
между не входящими в состав амилоидного кора
каждый из них функционально важным и то как
участками [183]. RAC1!фрагмент FUS при этом
они связаны с патологическими процессами
формирует структуру на основе упорядоченных
при БАС и ЛВЛД.
петель; фибриллы, сформированные RAC2,
Еще одним важным примером обратимой
имеют обводненную поверхность взаимодей!
агрегации являются А!тельца, формируемые в
ствия β листов [184]. Предполагается, что эти
клетках при стрессовых воздействиях [170]. А!
свойства способствуют обратимому формирова!
тельца, в отличие от рассмотренных ранее немем!
нию амилоидных агрегатов (показано, что агре!
бранных органелл, являются своеобразным хра!
гаты FUS!LC не устойчивы к воздействию SDS,
нилищем амилоидных агрегатов, которые обра!
но устойчивы к иным детергентам [180, 185]).
зуются в ходе ответа клетки на стрессовые воз!
Белки hnRNPA1 и hnRNPA2B1 являются
действия (такие как закисление цитоплазмы и
ядерными рибонуклеопротеинами, играющими
тепловой шок). Эти белковые скопления окра!
большую роль в процессинге гетероядерной
шиваются конго красным in vivo, устойчивы к
РНК и регуляции экспрессии генов [186]. Их
обработке протеазами и содержат фибрилляр!
амилоидные свойства были обнаружены при ис!
ные агрегаты, которые взаимодействуют с ами!
следовании влияния мутаций в кодирующих эти
лоид!специфическими антителами. При помо!
белки генах на семейные формы БАС. Как бел!
щи методов протеомного анализа было проде!
ки дикого типа, так и их мутантные формы спо!
монстрировано, что в состав А!телец входит
собны формировать фибриллы in vitro, причем
большое количество различных белков, в част!
БАС!ассоциированные мутации в прионопо!
ности белки VHL и POLD1. В составе этих бел!
добных доменах hnRNPA1 и hnRNPA2B1 уско!
ков идентифицированы особые участки, наз!
ряют агрегацию этих белков [187]. Отдельные
ванные амилоид!конвертирующими мотивами,
участки hnRNPA1 (LC домен и RAC1/2) обрати!
которые способствуют привлечению белков в A!
мо формируют амилоидные фибриллы при тем!
тельца за счет взаимодействия с рибосомной
пературных воздействиях in vitro. За их образо!
межгенной некодирующей РНК. В системе in
вание так же, как и в случае FUS, отвечают
vitro данные участки формируют типичные ами!
RAC!элементы, которые способны формиро!
лоидные фибриллы с характерной структурой. В
вать амилоидные фибриллы самостоятельно.
то же время способность образовывать полно!
Однако их структура несколько отличается от
ценные амилоидные фибриллы для полнораз!
типичной кросс!β структуры. В середине ами!
мерных VHL и POLD1 не показана, и структур!
БИОХИМИЯ том 85 вып. 9 2020
АМИЛОИДНЫЕ И АМИЛОИДОПОДОБНЫЕ АГРЕГАТЫ
1231
ные особенности их белковых агрегатов в А!
нием термина, хотя авторы не всегда его при!
тельцах остаются неизученными [170].
держиваются, что было отмечено и ранее [17].
Недавно было показано, что белок Tau, рас!
Тем не менее стоит обратить внимание на
смотренный нами ранее, способен претерпевать
примеры белковых агрегатов с кросс!β структу!
фазовое разделение и входить в состав немем!
рой, которые термолабильны и не устойчивы к
бранных органелл в нейронах. Неясно является
детергентам. Эта структура показана in vitro для
ли нахождение Tau в составе немембранных ор!
пептидов FUS, его LC домена, а также LC фраг!
ганелл функционально важным, но показано,
мента hnRNPA2. Авторы называют такие агрега!
что фазовое разделение может способствовать
ты амилоидоподобными, но не амилоидными
формированию агрегатов Tau in vivo и in vitro
[180]. Аналогичные результаты были получены
[189].
и для полноразмерного белка hnRNPA1 [181].
Таким образом, нам кажется актуальным воп!
рос: «стоит ли называть эти агрегаты амилоида!
ПОРИНЫ И ФЕРМЕНТЫ,
ми, поскольку они обладают кросс!β структу!
СПОСОБНЫЕ К АГРЕГАЦИИ
рой?».
В случае положительного ответа, возможно,
Различные белки!порины могут формиро!
придется признать, что амилоидные агрегаты не
вать амилоидные и амилоидоподобные агрега!
обязательно должны быть стабильными. Такой
ты. Среди известных примеров большинство -
подход, предположительно, приведет к увеличе!
это белки прокариот (RopA, RopB, OmpA,
нию количества амилоидов. В случае с FUS бы!
OmpC) [190-193] и один белок эукариот (MSP2)
ло показано, что за формирование агрегатов от!
[19]. Насколько процесс агрегации поринов яв!
вечает короткий фрагмент LC!домена, назван!
ляется патологическим или функциональным
ный LARKS. Аналогичные мотивы белков
сказать сложно. Тем не менее есть вероятность,
NUP98 и hnRNPA1 также формируют термола!
что он может быть очень распространенным. На
бильные фибриллы с кросс!β структурой. Био!
основании биоинформатического анализа было
информатический поиск выявил массу сходных
высказано предположение, что фрагменты по!
последовательностей среди белков, входящих в
ринов, которые образуют внутреннюю часть по!
состав различных комплексов, образующихся
ры, способны формировать амилоидные струк!
по принципу разделения фаз [203]. Однако это
туры [194].
только предположение, наличие сходных после!
Кроме поринов известен ряд ферментов,
довательностей не может гарантировать таких
способных к агрегации. Три белка, которые по!
же свойств у полноразмерных белков. Кроме
пали в наш анализ, так или иначе физически
этого, сохранение исходного определения, ос!
взаимодействуют с нуклеиновыми кислотами,
нованного только на структуре агрегатов (без
это белки CarD, HelD и RepA [195-200]. Кроме
уточнения сведений об их стабильности), под!
этого, способность к агрегации была показана
черкивает ограничение существующих методов
для протеазы YghJ [201] и трансглутаминазы
поиска новых кандидатов в амилоиды, которые
TGZ [202].
основаны только на их устойчивости к детерген!
там [204, 205] (эти подходы не могут выявлять
нестабильные агрегаты с кросс!β структурой).
КРИЗИС ТЕРМИНА «АМИЛОИД»
Вне зависимости от выбранного пути, к сожале!
нию, остается проблема с описанием массы
Наиболее универсальным определением
амилоидоподобных агрегатов, которые очень
термина «амилоид» считается следующее: ами!
разнообразны с точки зрения структуры. Если
лоиды - это фибриллярные белковые агрегаты,
критерий структуры является ключевым для вы!
имеющие кросс!β структуру [4, 14, 17, 51] с
деления амилоидов в отдельную группу, то ами!
уточнением, что наличие яблочно!зеленого све!
лоидоподобные агрегаты также необходимо
чения при двулучепреломлении после окраши!
классифицировать аналогичным образом. В на!
вания конго красным является доказательством
шем обзоре мы рассмотрели примеры агрегатов
кросс!β структуры [15, 16]. При этом более стро!
MAVS, PSMα3, SOD1 и LL!37, которые облада!
гое определение включает также требование де!
ют частью амилоидных свойств, но обладают са!
монстрации этих свойств in vivo для нативных
мыми разными вариантами структуры, напри!
белков при естественном уровне продукции. В
мер β!штопор или кросс!α [4]. Сейчас они по!
обзоре мы не руководствовались этим уточне!
падают в единую группу амилоидоподобных аг!
нием. При сборе и анализе данных о свойствах
регатов, хотя если критерий структуры является
различных белков мы не обнаружили принци!
основополагающим, такие агрегаты должны
пиальных противоречий с указанным определе!
быть классифицированы отдельно друг от друга.
БИОХИМИЯ том 85 вып. 9 2020
1232
МАТИИВ и др.
Стоит также отметить, что некоторые крите!
левантными, поскольку отражают биофизичес!
рии, которые используют для доказательства
кое состояние определенных молекул в клетке,
амилоидных свойств, являются искусственны!
возможность их свободного перемещения и,
ми и в явном виде не отражают свойства, кото!
следовательно, участия в тех или иных процес!
рые релевантны для биологических систем.
сах.
Например, окрашивание специфическими кра!
сителями не имеет очевидного биологического
смысла, поскольку эти вещества в норме отсут!
Финансирование. Исследование выполнено
ствуют в клетке или в организме. Также нам не
при финансовой поддержке Российского фонда
известны клеточные белки или системы, кото!
фундаментальных исследований в рамках науч!
рые бы умели специфически распознавать
ного проекта № 19!14!50590.
кросс!β!структуру, но не другие варианты ук!
Благодарности. Авторы благодарят профес!
ладки агрегатов со свойствами амилоидов. Су!
сора, д.б.н. А.П. Галкина (СПбГУ и ИОГен РАН)
ществуют амилоид!специфические антитела,
за критическое прочтение рукописи.
которые, возможно, способны дифференциро!
Конфликт интересов. Авторы заявляют об от!
вать разные варианты укладок [206], но этот
сутствии конфликта интересов.
пример сложно рассматривать как универсаль!
Соблюдение этических норм. Настоящая
ный. В то же время стабильные фибриллярные
статья не содержит описания каких!либо иссле!
агрегаты часто упоминают как один из приме!
дований с участием людей или животных в каче!
ров образования различных белковых комплек!
стве объектов.
сов на основе разделения фаз [207]. В этой свя!
Дополнительные материалы. Приложение к
зи ключевыми отличиями этих агрегатов от дру!
статье на английском языке опубликовано на
гих являются их морфология (фибриллы) и ста!
сайте журнала «Biochemistry» (Moscow) (http://
бильность (слабый обмен молекул между агре!
protein.bio.msu.ru/biokhimiya/) и на сайте изда!
гатом и окружающим раствором). С биологи!
ческой точки зрения эти критерии являются ре!
10541), том 85, вып. 9, 2020.
СПИСОК ЛИТЕРАТУРЫ
1. Kyle, R. A. (2001) Amyloidosis: a convoluted story, Br. J.
and illuminates sequence features of prionogenic proteins,
Haematol., 114, 529!538.
Cell, 137, 146!158.
2. Tanskanen, M. (2013) “Amyloid” - historical aspects, in
12. Chandramowlishwaran, P., Sun, M., Casey, K. L.,
Amyloidosis (Feng, D., ed.), IntechOpen, pp. 3!24. 3.
Romanyuk, A. V., Grizel, A. V., Sopova, J. V., Rubel, A. A.,
Yakupova, E. I., Bobyleva, L. G., Vikhlyantsev, I. M., and
Nussbaum!Krammer, C., Vorberg, I. M., and Chernoff, Y.
Bobylev, A. G. (2019) Congo red and amyloids: history and
O. (2018) Mammalian amyloidogenic proteins promote
relationship, Biosci. Rep., 39, BSR20181415.
prion nucleation in yeast, J. Biol. Chem., 293, 3436!3450.
4. Iadanza, M. G., Jackson, M. P., Hewitt, E. W., Ranson, N. A.,
13. Sivanathan, V., and Hochschild, A. (2013) A bacterial
and Radford, S. E. (2018) A new era for understanding
export system for generating extracellular amyloid aggre!
amyloid structures and disease, Nat. Rev. Mol. Cell Biol.,
gates, Nat. Protoc., 8, 1381!1390.
19, 755!773.
14. Nizhnikov, A. A., Antonets, K. S., and Inge!Vechtomov, S.
5. Kushnirov, V. V., Dergalev, A. A., and Alexandrov, A. I.
G. (2015) Amyloids: from pathogenesis to function,
(2020) Proteinase K resistant cores of prions and amyloids,
Biochemistry (Moscow), 80, 1127!1144.
Prion, 14, 11!19.
15. Benson, M. D., Buxbaum, J. N., Eisenberg, D. S.,
6. Kushnirov, V. V., Alexandrov, I. M., Mitkevich, O. V.,
Merlini, G., Saraiva, M. J. M., Sekijima, Y., Sipe, J. D.,
Shkundina, I. S., and Ter!Avanesyan, M. D. (2006)
and Westermark, P. (2018) Amyloid nomenclature 2018:
Purification and analysis of prion and amyloid aggregates,
recommendations by the International Society of
Methods, 39, 50!55.
Amyloidosis (ISA) nomenclature committee, Amyloid, 25,
7. Dear, A. J., Michaels, T. C. T., Meisl, G., Klenerman, D.,
215!219.
Wu, S., Perrett, S., Linse, S., Dobson, C. M., and
16. Sergeeva, A. V., and Galkin, A. P. (2020) Functional amy!
Knowles, T. P. J. (2020) Kinetic diversity of amyloid
loids of eukaryotes: criteria, classification, and biological
oligomers, Proc. Natl. Acad. Sci. USA, 117, 12087!12094.
significance, Curr. Genet., doi: 10.1007/s00294!020!01079!
8. Prusiner, S. B. (1987) Prions and neurodegenerative dis!
7.
eases, N. Engl. J. Med., 317, 1571!1581.
17. Galkin, A. P., Velizhanina, M. E., Sopova, Y. V., Shenfeld, A. A.,
9. Wickner, R. (1994) [URE3] as an altered URE2 protein:
and Zadorsky, S. P. (2018) Prions and non!infectious amy!
evidence for a prion analog in Saccharomyces cerevisiae,
loids of mammals
- similarities and differences,
Science, 264, 566!569.
Biochemistry (Moscow), 83, 1184!1195.
10. Osherovich, L. Z., and Weissman, J. S. (2001) Multiple
18. Baxa, U. (2008) Structural basis of infectious and non!
Gln/Asn!rich prion domains confer susceptibility to
infectious amyloids, Curr. Alzheimer Res., 5, 308!318.
induction of the yeast [PSI+] prion, Cell, 106, 183!194.
19. Shewmaker, F., McGlinchey, R. P., and Wickner, R. B.
11. Alberti, S., Halfmann, R., King, O., Kapila, A., and
(2011) Structural insights into functional and pathological
Lindquist, S. (2009) A systematic survey identifies prions
amyloid, J. Biol. Chem., 286, 16533!16540.
БИОХИМИЯ том 85 вып. 9 2020
АМИЛОИДНЫЕ И АМИЛОИДОПОДОБНЫЕ АГРЕГАТЫ
1233
20.
Chiti, F., and Dobson, C. M. (2009) Amyloid formation by
37.
Ando, Y., Coelho, T., Berk, J. L., Cruz, M. W.,
globular proteins under native conditions, Nat. Chem. Biol.,
Ericzon, B.!G., Ikeda, S., Lewis, W. D., Obici, L., Planté!
5, 15!22.
Bordeneuve, V., Rapezzi, C., Said, G., and Salvi, F. (2013)
21.
Khurana, R., Uversky, V. N., Nielsen, L., and Fink, A. L.
Guideline of transthyretin!related hereditary amyloidosis
(2001) Is Congo red an amyloid!specific dye? J. Biol.
for clinicians, Orphanet J. Rare Dis., 8, 31.
Chem., 276, 22715!22721.
38.
Lu, J., Yu, Y., Zhu, I., Cheng, Y., and Sun, P. D. (2014)
22.
Westermark, G. T., Johnson, K. H., and Westermark, P.
Structural mechanism of serum amyloid A!mediated
(1999) Staining methods for identification of amyloid in
inflammatory amyloidosis, Proc. Natl. Acad. Sci., 111,
tissue, Methods Enzymol., 309, 3!25.
5189!5194.
23.
Tayeb!Fligelman, E., Tabachnikov, O., Moshe, A.,
39.
Morris, A. D., Smith, R. N., and Stone, J. R. (2019) The
Goldshmidt!Tran, O., Sawaya, M. R., Coquelle, N.,
pathology and changing epidemiology of dialysis!related
Colletier, J.!P., and Landau, M. (2017) The cytotoxic
cardiac beta!2 microglobulin amyloidosis, Cardiovasc.
Staphylococcus aureus PSMα3 reveals a cross!α amyloid!
Pathol., 42, 30!35.
like fibril, Science, 355, 831!833.
40.
Eriksson, M., Schönland, S., Yumlu, S., Hegenbart, U.,
24.
Brundin, P., Melki, R., and Kopito, R. (2010) Prion!like
von Hutten, H., Gioeva, Z., Lohse, P., Büttner, J.,
transmission of protein aggregates in neurodegenerative
Schmidt, H., and Röcken, C.
(2009) Hereditary
diseases, Nat. Rev. Mol. Cell Biol., 11, 301!307.
apolipoprotein AI!associated amyloidosis in surgical
25.
Chiti, F., and Dobson, C. M. (2017) Protein misfolding,
pathology specimens, J. Mol. Diagnostics, 11, 257!262.
amyloid formation, and human disease: a summary of
41.
Gerasimova, E. M., Fedotov, S. A., Kachkin, D. V.,
progress over the last decade, Annu. Rev. Biochem., 86, 27!
Vashukova, E. S., Glotov, A. S., Chernoff, Y. O., and
68.
Rubel, A. A. (2019) Protein misfolding during pregnancy:
26.
Knowles, T. P. J., Vendruscolo, M., and Dobson, C. M.
new approaches to preeclampsia diagnostics, Int. J. Mol.
(2014) The amyloid state and its association with protein
Sci., 20, 6183.
misfolding diseases, Nat. Rev. Mol. Cell Biol., 15, 384!396.
42.
Srinivasan, R., Jones, E. M., Liu, K., Ghiso, J., Marchant,
27.
Pepys, M. B. (2006) Amyloidosis, Annu. Rev. Med., 57,
R. E., and Zagorski, M. G. (2003) pH!dependent amyloid
223!241.
and protofibril formation by the ABri peptide of familial
28.
Chiti, F., and Dobson, C. M. (2006) Protein misfolding,
British dementia, J. Mol. Biol., 333, 1003!1023.
functional amyloid, and human disease, Annu. Rev.
43.
Ghiso, J. A., Holton, J., Miravalle, L., Calero, M., Lashley, T.,
Biochem., 75, 333!366.
Vidal, R., Houlden, H., Wood, N., Neubert, T. A.,
29.
Andersson, K., Olofsson, A., Nielsen, E. H., Svehag, S.!E.,
Rostagno, A., Plant, G., Révész, T., and Frangione, B.
and Lundgren, E. (2002) Only amyloidogenic intermedi!
(2001) Systemic amyloid deposits in familial British
ates of transthyretin induce apoptosis, Biochem. Biophys.
dementia, J. Biol. Chem., 276, 43909!43914.
Res. Commun., 294, 309!314.
44.
Srinivasan, R., Marchant, R. E., and Zagorski, M. G.
30.
Hartley, D. M., Walsh, D. M., Ye, C. P., Diehl, T., Vasquez,
(2004) ABri peptide associated with familial British
S., Vassilev, P. M., Teplow, D. B., and Selkoe, D. J. (1999)
dementia forms annular and ring!like protofibrillar struc!
Protofibrillar intermediates of amyloid β!protein induce
tures, Amyloid, 11, 10!13.
acute electrophysiological changes and progressive neuro!
45.
Coomaraswamy, J., Kilger, E., Wölfing, H., Schäfer, C.,
toxicity in cortical neurons, J. Neurosci., 19, 8876!8884.
Kaeser, S. A., Wegenast!Braun, B. M., Hefendehl, J. K.,
31.
Shi, J., Guan, J., Jiang, B., Brenner, D. A., del Monte, F.,
Wolburg, H., Mazzella, M., Ghiso, J., Goedert, M.,
Ward, J. E., Connors, L. H., Sawyer, D. B., Semigran, M. J.,
Akiyama, H., Garcia!Sierra, F., Wolfer, D. P., Mathews, P. M.,
Macgillivray, T. E., Seldin, D. C., Falk, R., and Liao, R.
and Jucker, M. (2010) Modeling familial Danish dementia
(2010) Amyloidogenic light chains induce cardiomyocyte
in mice supports the concept of the amyloid hypothesis of
contractile dysfunction and apoptosis via a non!canonical
Alzheimer’s disease, Proc. Natl. Acad. Sci. USA, 107, 7969!
p38 MAPK pathway, Proc. Natl. Acad. Sci., 107, 4188!
7974.
4193.
46.
Vidal, R., Revesz, T., Rostagno, A., Kim, E., Holton, J. L.,
32.
Simoneau, S., Rezaei, H., Salès, N., Kaiser Schulz, G.,
Bek, T., Bojsen!Moller, M., Braendgaard, H., Plant, G.,
Lefebvre Roque, M., Vidal, C., Fournier, J. G., Comte, J.,
Ghiso, J., and Frangione, B. (2000) A decamer duplication
Wopfner, F., Grosclaude, J., Schätzl, H., and Lasmézas, C. I.
in the 3′ region of the BRI gene originates an amyloid pep!
(2007) In vitro and in vivo neurotoxicity of prion protein
tide that is associated with dementia in a Danish kindred,
oligomers, PLoS Pathog., 3, e125.
Proc. Natl. Acad. Sci. USA, 97, 4920!4925.
33.
Campioni, S., Mannini, B., Zampagni, M., Pensalfini, A.,
47.
Davies, H. A., Wilkinson, M. C., Gibson, R. P., and
Parrini, C., Evangelisti, E., Relini, A., Stefani, M.,
Middleton, D. A. (2014) Expression and purification of the
Dobson, C. M., Cecchi, C., and Chiti, F. (2010) A
aortic amyloid polypeptide medin, Protein Expr. Purif., 98,
causative link between the structure of aberrant protein
32!37.
oligomers and their toxicity, Nat. Chem. Biol., 6, 140!147.
48.
Khurana, R., Agarwal, A., Bajpai, V. K., Verma, N.,
34.
Milani, P., Merlini, G., and Palladini, G. (2018) Light
Sharma, A. K., Gupta, R. P., and Madhusudan, K. P. (2004)
chain amyloidosis, Infect. Dis., 10, e2018022.
Unraveling the amyloid associated with human medullary
35.
Merlini, G., Dispenzieri, A., Sanchorawala, V.,
thyroid carcinoma, Endocrinology, 145, 5465!5470.
Schönland, S. O., Palladini, G., Hawkins, P. N., and
49.
Pedrote, M. M., Motta, M. F., Ferretti, G. D. S.,
Gertz, M. A. (2018) Systemic immunoglobulin light chain
Norberto, D. R., Spohr, T. C. L. S., Lima, F. R. S.,
amyloidosis, Nat. Rev. Dis. Prim., 4, 38.
Gratton, E., Silva, J. L., and de Oliveira, G. A. P. (2020)
36.
Nasr, S. H., Said, S. M., Valeri, A. M., Sethi, S.,
Oncogenic gain of function in glioblastoma is linked to
Fidler, M. E., Cornell, L. D., Gertz, M. A., Dispenzieri, A.,
mutant p53 amyloid oligomers, iScience, 23, 100820.
Buadi, F. K., Vrana, J. A., Theis, J. D., Dogan, A., and
50.
Levine, S. N., Ishaq, S., Nanda, A., Wilson, J. D., and
Leung, N. (2013) The diagnosis and characteristics of renal
Gonzalez!Toledo, E. (2013) Occurrence of extensive
heavy!chain and heavy/light!chain amyloidosis and their
spherical amyloid deposits in a prolactin!secreting pitu!
comparison with renal light!chain amyloidosis, Kidney
itary macroadenoma: a radiologic!pathologic correlation,
Int., 83, 463!470.
Ann. Diagn. Pathol., 17, 361!366.
7 БИОХИМИЯ том 85 вып. 9 2020
1234
МАТИИВ и др.
51.
Chuang, E., Hori, A. M., Hesketh, C. D., and Shorter, J.
68.
Goedert, M., Jakes, R., and Spillantini, M. G. (2017) The
(2018) Amyloid assembly and disassembly, J. Cell Sci., 131,
synucleinopathies: twenty years on, J. Parkinson’s Dis., 7,
jcs189928.
S51!S69.
52.
Millucci, L., Ghezzi, L., Bernardini, G., Braconi, D.,
69.
Mead, S., and Reilly, M. M. (2015) A new prion disease:
Tanganelli, P., and Santucci, A. (2012) Prevalence of iso!
relationship with central and peripheral amyloidoses, Nat.
lated atrial amyloidosis in young patients affected by con!
Rev. Neurol., 11, 90!97.
gestive heart failure, Sci. World J., 2012, 1!8.
70.
Pansarasa, O., Bordoni, M., Diamanti, L., Sproviero, D.,
53.
Linke, R. P., Joswig, R., Murphy, C. L., Wang, S., Zhou, H.,
Gagliardi, S., and Cereda, C. (2018) SOD1 in amyotroph!
Gross, U., Rocken, C., Westermark, P., Weiss, D. T., and
ic lateral sclerosis: “ambivalent” behavior connected to the
Solomon, A. (2005) Senile seminal vesicle amyloid is
disease, Int. J. Mol. Sci., 19, 1345.
derived from semenogelin I, J. Lab. Clin. Med., 145, 187!
71.
Dragoš, A., Kovács, Á. T., and Claessen, D. (2017) The
193.
role of functional amyloids in multicellular growth and
54.
Yanamandra, K., Alexeyev, O., Zamotin, V., Srivastava, V.,
development of gram!positive bacteria, Biomolecules, 7, 60.
Shchukarev, A., Brorsson, A.!C., Tartaglia, G. G., Vogl, T.,
72.
Valsecchi, I., Dupres, V., Stephen!Victor, E., Guijarro, J. I.,
Kayed, R., Wingsle, G., Olsson, J., Dobson, C. M., Bergh, A.,
Gibbons, J., Beau, R., Bayry, J., Coppee, J.!Y., Lafont, F.,
Elgh, F., and Morozova!Roche, L. A. (2009) Amyloid for!
Latgé, J.!P., and Beauvais, A. (2017) Role of hydrophobins
mation by the pro!inflammatory S100A8/A9 proteins in
in Aspergillus fumigatus, J. Fungi, 4, 2.
the ageing prostate, PLoS One, 4, e5562.
73.
Pham, C. L. L., Rey, A., Lo, V., Soulès, M., Ren, Q.,
55.
Caubet, C., Bousset, L., Clemmensen, O., Sourigues, Y.,
Meisl, G., Knowles, T. P. J., Kwan, A. H., and Sunde, M.
Bygum, A., Chavanas, S., Coudane, F., Hsu, C., Betz, R. C.,
(2016) Self!assembly of MPG1, a hydrophobin protein
Melki, R., Simon, M., and Serre, G. (2010) A new amy!
from the rice blast fungus that forms functional amyloid
loidosis caused by fibrillar aggregates of mutated cor!
coatings, occurs by a surface!driven mechanism, Sci. Rep.,
neodesmosin, FASEB J., 24, 3416!3426.
6, 25288.
56.
Miura, Y., Harumiya, S., Ono, K., Fujimoto, E., Akiyama, M.,
74.
Lo, V. C., Ren, Q., Pham, C. L. L., Morris, V. K.,
Fujii, N., Kawano, H., Wachi, H., and Tajima, S. (2013)
Kwan, A. H., and Sunde, M. (2014) Fungal hydrophobin
Galectin!7 and actin are components of amyloid deposit of
proteins produce self!assembling protein films with diverse
localized cutaneous amyloidosis, Exp. Dermatol., 22, 36!
structure and chemical stability, Nanomater., 4, 827!843.
40.
75.
Morris, V. K., Ren, Q., Macindoe, I., Kwan, A. H., Byrne, N.,
57.
Inoue, K., Takahashi, M., Hamamoto, Y., Muto, M., and
and Sunde, M. (2011) Recruitment of class I hydrophobins
Ishihara, T. (2000) An immunohistochemical study of
to the air:water interface initiates a multi!step process of
cytokeratins in skin!limited amyloidosis, Amyloid, 7, 259!
functional amyloid formation, J. Biol. Chem., 286, 15955!
265.
15963.
58.
Ozawa, D., Kaji, Y., Yagi, H., Sakurai, K., Kawakami, T.,
76.
Rauceo, J. M., Gaur, N. K., Lee, K.!G., Edwards, J. E.,
Naiki, H., and Goto, Y. (2011) Destruction of amyloid fib!
Klotz, S. A., and Lipke, P. N. (2004) Global cell surface
rils of keratoepithelin peptides by laser irradiation coupled
conformational shift mediated by a Candida albicans
with amyloid!specific thioflavin T, J. Biol. Chem., 286,
adhesin, Infect. Immun., 72, 4948!4955.
10856!10863.
77.
Otoo, H. N., Lee, K. G., Qiu, W., and Lipke, P. N. (2008)
59.
Ando, Y., Nakamura, M., Kai, H., Katsuragi, S., Terazaki, H.,
Candida albicans Als adhesins have conserved amyloid!
Nozawa, T., Okuda, T., Misumi, S., Matsunaga, N., Hata, K.,
forming sequences, Eukaryot. Cell, 7, 776!782.
Tajiri, T., Shoji, S., Yamashita, T., Haraoka, K., Obayashi, K.,
78.
Dueholm, M. S., Albertsen, M., Otzen, D., and Nielsen, P. H.
Matsumoto, K., Ando, M., and Uchino, M. (2002) A novel
(2012) Curli functional amyloid systems are phylogeneti!
localized amyloidosis associated with lactoferrin in the
cally widespread and display large diversity in operon and
cornea, Lab. Invest., 82, 757!766.
protein structure, PLoS One, 7, e51274.
60.
Gupta, Y., Singla, G., and Singla, R. (2015) Insulin!
79.
Blanco, L. P., Evans, M. L., Smith, D. R., Badtke, M. P.,
derived amyloidosis, Indian J. Endocrinol. Metab., 19, 174.
and Chapman, M. R. (2012) Diversity, biogenesis and
61.
D’Souza, A., Theis, J. D., Vrana, J. A., and Dogan, A.
function of microbial amyloids, Trends Microbiol., 20, 66!
(2014) Pharmaceutical amyloidosis associated with subcu!
73.
taneous insulin and enfuvirtide administration, Amyloid,
80.
Taglialegna, A., Navarro, S., Ventura, S., Garnett, J. A.,
21, 71!75.
Matthews, S., Penades, J. R., Lasa, I., and Valle, J. (2016)
62.
Chen, G., Xu, T., Yan, Y., Zhou, Y., Jiang, Y., Melcher, K.,
Staphylococcal Bap proteins build amyloid scaffold biofilm
and Xu, H. E. (2017) Amyloid beta: structure, biology and
matrices in response to environmental signals, PLoS
structure!based therapeutic development, Acta Pharmacol.
Pathog., 12, e1005711.
Sin., 38, 1205!1235.
81.
Alteri, C. J., Xicohténcatl Cortes, J., Hess, S., Caballero
63.
Murphy, M. P., and LeVine, H. (2010) Alzheimer′s disease
Ol n, G., Girón, J. A., and Friedman, R. L. (2007)
and the amyloid!β peptide, J. Alzheimer’s Dis., 19, 311!323.
Mycobacterium tuberculosis produces pili during human
64.
Qiang, W., Yau, W.!M., Lu, J.!X., Collinge, J., and Tycko, R.
infection, Proc. Natl. Acad. Sci. USA, 104, 5145!5150.
(2017) Structural variation in amyloid!β fibrils from
82.
Besingi, R. N., Wenderska, I. B., Senadheera, D. B.,
Alzheimer’s disease clinical subtypes, Nature, 541, 217!
Cvitkovitch, D. G., Long, J. R., Wen, Z. T., and Brady, L. J.
221.
(2017) Functional amyloids in Streptococcus mutans, their
65.
Giasson, B. I., Lee, V. M.!Y., and Trojanowski, J. Q.
use as targets of biofilm inhibition and initial characteriza!
(2003)
Interactions of amyloidogenic proteins,
tion of SMU_63c, Microbiology, 163, 488!501.
Neuromolecular Med., 4, 49!58.
83.
Collinson, S. K., Emödy, L., Müller, K. H., Trust, T. J.,
66.
Lim, S., Haque, M. M., Kim, D., Kim, D. J., and Kim, Y. K.
and Kay, W. W. (1991) Purification and characterization of
(2014) Cell!based models to investigate Tau aggregation,
thin, aggregative fimbriae from Salmonella enteritidis, J.
Comput. Struct. Biotechnol. J., 12, 7!13.
Bacteriol., 173, 4773!4781.
67.
Kim, W. S., Kågedal, K., and Halliday, G. M. (2014)
84.
Doran, J. L., Collinson, S. K., Burian, J., Sarlós, G.,
Alpha!synuclein biology in Lewy body diseases,
Todd, E. C., Munro, C. K., Kay, C. M., Banser, P. A.,
Alzheimer’s Res. Ther., 6, 73.
Peterkin, P. I., and Kay, W. W. (1993) DNA!based diagnos!
БИОХИМИЯ том 85 вып. 9 2020
АМИЛОИДНЫЕ И АМИЛОИДОПОДОБНЫЕ АГРЕГАТЫ
1235
tic tests for Salmonella species targeting agfA, the structur!
101. Lyu, Y., Fitriyanti, M., and Narsimhan, G. (2019) Nucle!
al gene for thin, aggregative fimbriae, J. Clin. Microbiol.,
ation and growth of pores in 1,2!Dimyristoyl!sn!glycero!
31, 2263!2273.
3!phosphocholine (DMPC)/cholesterol bilayer by antimi!
85. Wang, Y., Jiang, J., Gao, Y., Sun, Y., Dai, J., Wu, Y.,
crobial peptides melittin, its mutants and cecropin P1,
Qu, D., Ma, G., and Fang, X. (2018) Staphylococcus epi
Colloids Surf. B Biointerfaces, 173, 121!127.
dermidis small basic protein (Sbp) forms amyloid fibrils,
102. Gazit, E., Miller, I. R., Biggin, P. C., Sansom, M. S., and
consistent with its function as a scaffolding protein in
Shai, Y. (1996) Structure and orientation of the mam!
biofilms, J. Biol. Chem., 293, 14296!14311.
malian antibacterial peptide cecropin P1 within phospho!
86. Ling, S., Li, C., Adamcik, J., Shao, Z., Chen, X., and
lipid membranes, J. Mol. Biol., 258, 860!870.
Mezzenga, R. (2014) Modulating materials by orthogonal!
103. Sood, R., Domanov, Y., Pietiäinen, M., Kontinen, V. P.,
ly oriented β!strands: composites of amyloid and silk
and Kinnunen, P. K. J. (2008) Binding of LL!37 to model
fibroin fibrils, Adv. Mater., 26, 4569!4574.
biomembranes: insight into target vs host cell recognition,
87. Humenik, M., Smith, A. M., Arndt, S., and Scheibel, T.
Biochim. Biophys. Acta, 1778, 983!996.
(2015) Ion and seed dependent fibril assembly of a spidroin
104. Engelberg, Y., and Landau, M. (2020) The Human LL!
core domain, J. Struct. Biol., 191, 130!138.
37(17!29) Antimicrobial peptide reveals a functional
88. Berthelot, K., Lecomte, S., Estevez, Y., Coulary!Salin, B.,
supramolecular nanostructure, bioRxiv, doi: 10.1101/2020.
and Peruch, F. (2014) Homologous Hevea brasiliensis REF
02.04.933432.
(Hevb1) and SRPP (Hevb3) present different auto!assem!
105. Auvynet, C., El Amri, C., Lacombe, C., Bruston, F.,
bling, Biochim. Biophys. Acta, 1844, 473!485.
Bourdais, J., Nicolas, P., and Rosenstein, Y.
(2008)
89. Berthelot, K., Lecomte, S., Estevez, Y., Coulary!Salin, B.,
Structural requirements for antimicrobial versus chemoat!
Bentaleb, A., Cullin, C., Deffieux, A., and Peruch, F.
tractant activities for dermaseptin S9, FEBS J., 275, 4134!
(2012) Rubber elongation factor (REF), a major allergen
4151.
component in Hevea brasiliensis latex has amyloid proper!
106. Caillon, L., Killian, J. A., Lequin, O., and
ties, PLoS One, 7, e48065.
Khemtémourian, L. (2013) Biophysical investigation of the
90. Li, J., McQuade, T., Siemer, A. B., Napetschnig, J.,
membrane!disrupting mechanism of the antimicrobial and
Moriwaki, K., Hsiao, Y.!S., Damko, E., Moquin, D.,
amyloid!like peptide dermaseptin S9, PLoS One, 8,
Walz, T., McDermott, A., Chan, F. K.!M., and Wu, H.
e75528.
(2012) The RIP1/RIP3 necrosome forms a functional
107. Gössler Schöfberger, R., Hesser, G., Muik, M.,
amyloid signaling complex required for programmed
Wechselberger, C., and Jilek, A. (2009) An orphan der!
necrosis, Cell, 150, 339!350.
maseptin from frog skin reversibly assembles to amyloid!
91. Wu, X.!N., Yang, Z.!H., Wang, X.!K., Zhang, Y., Wan, H.,
like aggregates in a pH!dependent fashion, FEBS J., 276,
Song, Y., Chen, X., Shao, J., and Han, J. (2014) Distinct roles
5849!5859.
of RIP1!RIP3 hetero! and RIP3!RIP3 homo!interaction in
108. Zasloff, M. (1987) Magainins, a class of antimicrobial pep!
mediating necroptosis, Cell Death Differ., 21, 1709!1720.
tides from Xenopus skin: isolation, characterization of two
92. Kajava, A. V., Klopffleisch, K., Chen, S., and Hofmann, K.
active forms, and partial cDNA sequence of a precursor,
(2014) Evolutionary link between metazoan RHIM motif
Proc. Natl. Acad. Sci. USA, 84, 5449!5453.
and prion!forming domain of fungal heterokaryon incom!
109. Zasloff, M., Martin, B., and Chen, H. C.
(1988)
patibility factor HET!s/HET!s, Sci. Rep., 4, 7436.
Antimicrobial activity of synthetic magainin peptides and
93. Liebman, S. W., and Chernoff, Y. O. (2012) Prions in yeast,
several analogues, Proc. Natl. Acad. Sci. USA, 85, 910!913.
Genetics, 191, 1041!1072.
110. Cruciani, R. A., Barker, J. L., Zasloff, M., Chen, H. C.,
94. Seuring, C., Greenwald, J., Wasmer, C., Wepf, R.,
and Colamonici, O. (1991) Antibiotic magainins exert
Saupe, S. J., Meier, B. H., and Riek, R. (2012) The mech!
cytolytic activity against transformed cell lines through
anism of toxicity in HET!S/HET!s prion incompatibility,
channel formation, Proc. Natl. Acad. Sci. USA, 88, 3792!
PLoS Biol., 10, e1001451.
3796.
95. Loquet, A., and Saupe, S. J. (2017) Diversity of amyloid
111.
Baker, M. A., Maloy, W. L., Zasloff, M., and Jacob, L. S.
motifs in NLR signaling in fungi, Biomolecules, 7, 38.
(1993) Anticancer efficacy of Magainin2 and analogue
96. Daskalov, A., Habenstein, B., Sabaté, R., Berbon, M.,
peptides, Cancer Res., 53, 3052!3057.
Martinez, D., Chaignepain, S., Coulary!Salin, B.,
112. Ludtke, S., He, K., and Huang, H. (1995) Membrane thin!
Hofmann, K., Loquet, A., and Saupe, S. J. (2016)
ning caused by magainin 2, Biochemistry, 34, 16764!16769.
Identification of a novel cell death!inducing domain
113. Jang, H., Arce, F. T., Mustata, M., Ramachandran, S.,
reveals that fungal amyloid!controlled programmed cell
Capone, R., Nussinov, R., and Lal, R.
(2011)
death is related to necroptosis, Proc. Natl. Acad. Sci. USA,
Antimicrobial protegrin!1 forms amyloid!like fibrils with
113, 2720!2725.
rapid kinetics suggesting a functional link, Biophys. J., 100,
97. Kleino, A., Ramia, N. F., Bozkurt, G., Shen, Y., Nailwal, H.,
1775!1783.
Huang, J., Napetschnig, J., Gangloff, M., Chan, F. K.!M.,
114. Gour, S., Kumar, V., Singh, A., Gadhave, K., Goyal, P.,
Wu, H., Li, J., and Silverman, N. (2017) Peptidoglycan!
Pandey, J., Giri, R., and Yadav, J. K. (2019) Mammalian
sensing receptors trigger the formation of functional amy!
antimicrobial peptide protegrin!4 self assembles and forms
loids of the adaptor protein Imd to initiate Drosophila NF!
amyloid!like aggregates: Assessment of its functional rele!
κB signaling, Immunity, 47, 635!647.e6.
vance, J. Pept. Sci., 25, e3151.
98. Gonçalves, A. P., Heller, J., Daskalov, A., Videira, A., and
115. Bieler, S., Estrada, L., Lagos, R., Baeza, M., Castilla, J.,
Glass, N. L. (2017) Regulated forms of cell death in fungi,
and Soto, C. (2005) Amyloid formation modulates the bio!
Front. Microbiol., 8, 1837.
logical activity of a bacterial protein, J. Biol. Chem., 280,
99. Hafner!Bratkovič, I. (2017) Prions, prionoid complexes
26880!26885.
and amyloids: the bad, the good and something in between,
116. Chu, H., Pazgier, M., Jung, G., Nuccio, S.!P., Castillo, P. A.,
Swiss Med. Wkly., 147, w14424.
de Jong, M. F., Winter, M. G., Winter, S. E., Wehkamp, J.,
100. Mojsoska, B., and Jenssen, H. (2015) Peptides and pep!
Shen, B., Salzman, N. H., Underwood, M. A., Tsolis, R.
tidomimetics for antimicrobial drug design, Pharmaceuti
M., Young, G. M., Lu, W., Lehrer, R. I., Bäumler, A. J.,
cals (Basel)., 8, 366!415.
and Bevins, C. L. (2012) Human α!defensin 6 promotes
БИОХИМИЯ том 85 вып. 9 2020
7*
1236
МАТИИВ и др.
mucosal innate immunity through self!assembled peptide
132. Hamodrakas, S. J., Hoenger, A., and Iconomidou, V. A.
nanonets, Science, 337, 477!481.
(2004) Amyloid fibrillogenesis of silkmoth chorion protein
117. Gour, S., Kaushik, V., Kumar, V., Bhat, P., Yadav, S. C.,
peptide!analogues via a liquid!crystalline intermediate
and Yadav, J. K. (2016) Antimicrobial peptide (Cn!AMP2)
phase, J. Struct. Biol., 145, 226!235.
from liquid endosperm of Cocos nucifera forms amyloid!
133. Louros, N. N., Petronikolou, N., Karamanos, T.,
like fibrillar structure, J. Pept. Sci., 22, 201!207.
Cordopatis, P., Iconomidou, V. A., and Hamodrakas, S. J.
118. Wang, G. (2008) Structures of human host defense catheli!
(2014) Structural studies of “aggregation!prone” peptide!
cidin LL!37 and its smallest antimicrobial peptide KR!12
analogues of teleostean egg chorion ZPB proteins,
in lipid micelles, J. Biol. Chem., 283, 32637!32643.
Biopolymers, 102, 427!436.
119. Fahrner, R. L., Dieckmann, T., Harwig, S. S., Lehrer, R. I.,
134. Egge, N., Muthusubramanian, A., and Cornwall, G. A.
Eisenberg, D., and Feigon, J. (1996) Solution structure of
(2015) Amyloid properties of the mouse egg zona pelluci!
protegrin!1, a broad!spectrum antimicrobial peptide from
da, PLoS One, 10, e0129907.
porcine leukocytes, Chem. Biol., 3, 543!550.
135. Louros, N. N., Chrysina, E. D., Baltatzis, G. E., Patsouris,
120. De Felice, F. G., Vieira, M. N. N., Meirelles, M. N. L.,
E. S., Hamodrakas, S. J., and Iconomidou, V. A. (2016) A
Morozova!Roche, L. A., Dobson, C. M., and Ferreira, S. T.
common “aggregation!prone” interface possibly partici!
(2004) Formation of amyloid aggregates from human
pates in the self!assembly of human zona pellucida pro!
lysozyme and its disease!associated variants using hydro!
teins, FEBS Lett., 590, 619!630.
static pressure, FASEB J., 18, 1099!1101.
136. Carpenter, K., Bell, R. B., Yunus, J., Amon, A., and
121. Majumdar, A., Cesario, W. C., White!Grindley, E., Jiang, H.,
Berchowitz, L. E. (2018) Phosphorylation!mediated clear!
Ren, F., Khan, M. R., Li, L., Choi, E. M.!L., Kannan, K.,
ance of amyloid!like assemblies in meiosis, Dev. Cell, 45,
Guo, F., Unruh, J., Slaughter, B., and Si, K. (2012)
392!405.e6.
Critical role of amyloid!like oligomers of Drosophila Orb2
137. Fowler, D. M., Koulov, A. V., Alory!Jost, C., Marks, M. S.,
in the persistence of memory, Cell, 148, 515!529.
Balch, W. E., and Kelly, J. W. (2006) Functional amyloid
122. Si, K., Choi, Y.!B., White!Grindley, E., Majumdar, A.,
formation within mammalian tissue, PLoS Biol., 4, e6.
and Kandel, E. R. (2010) Aplysia CPEB can form prion!
138. Hoashi, T., Muller, J., Vieira, W. D., Rouzaud, F., Kikuchi, K.,
like multimers in sensory neurons that contribute to long!
Tamaki, K., and Hearing, V. J. (2006) The repeat domain
term facilitation, Cell, 140, 421!435.
of the melanosomal matrix protein PMEL17/GP100 is
123. Stephan, J. S., Fioriti, L., Lamba, N., Colnaghi, L., Karl, K.,
required for the formation of organellar fibers, J. Biol.
Derkatch, I. L., and Kandel, E. R. (2015) The CPEB3 pro!
Chem., 281, 21198!21208.
tein is a functional prion that interacts with the actin
139. Watt, B., van Niel, G., Fowler, D. M., Hurbain, I., Luk, K. C.,
cytoskeleton, Cell Rep., 11, 1772!1785.
Stayrook, S. E., Lemmon, M. A., Raposo, G., Shorter, J.,
124. Heinrich, S. U., and Lindquist, S. (2011) Protein!only
Kelly, J. W., and Marks, M. S. (2009) N!terminal domains
mechanism induces self!perpetuating changes in the activ!
elicit formation of functional Pmel17 amyloid fibrils, J.
ity of neuronal Aplysia cytoplasmic polyadenylation ele!
Biol. Chem., 284, 35543!35555.
ment binding protein (CPEB), Proc. Natl. Acad. Sci. USA,
140. McGlinchey, R. P., Shewmaker, F., McPhie, P.,
108, 2999!3004.
Monterroso, B., Thurber, K., and Wickner, R. B. (2009)
125. Hervas, R., Rau, M. J., Park, Y., Zhang, W., Murzin, A. G.,
The repeat domain of the melanosome fibril protein
Fitzpatrick, J. A. J., Scheres, S. H. W., and Si, K. (2020)
Pmel17 forms the amyloid core promoting melanin syn!
Cryo!EM structure of a neuronal functional amyloid
thesis, Proc. Natl. Acad. Sci. USA, 106, 13731!13736.
implicated in memory persistence in Drosophila, Science,
141. Leonhardt, R. M., Vigneron, N., Hee, J. S., Graham, M.,
367, 1230!1234.
and Cresswell, P.
(2013) Critical residues in the
126. Sopova, J. V., Koshel, E. I., Belashova, T. A., Zadorsky, S. P.,
PMEL/Pmel17 N!terminus direct the hierarchical assem!
Sergeeva, A. V., Siniukova, V. A., Shenfeld, A. A.,
bly of melanosomal fibrils, Mol. Biol. Cell, 24, 964!981.
Velizhanina, M. E., Volkov, K. V., Nizhnikov, A. A.,
142. Maji, S. K., Perrin, M. H., Sawaya, M. R., Jessberger, S.,
Kachkin, D. V., Gaginskaya, E. R., and Galkin, A. P.
Vadodaria, K., Rissman, R. A., Singru, P. S., Nilsson, K. P. R.,
(2019) RNA!binding protein FXR1 is presented in rat
Simon, R., Schubert, D., Eisenberg, D., Rivier, J.,
brain in amyloid form, Sci. Rep., 9, 18983.
Sawchenko, P., Vale, W., and Riek, R. (2009) Functional
127. Caudron, F., and Barral, Y. (2013) A super!assembly of
amyloids as natural storage of peptide hormones in pitu!
Whi3 encodes memory of deceptive encounters by single
itary secretory granules, Science, 325, 328!332.
cells during yeast courtship, Cell, 155, 1244!1257.
143. Onoue, S., Ohshima, K., Debari, K., Koh, K., Shioda, S.,
128. Boke, E., Ruer, M., Wühr, M., Coughlin, M., Lemaitre, R.,
Iwasa, S., Kashimoto, K., and Yajima, T.
(2004)
Gygi, S. P., Alberti, S., Drechsel, D., Hyman, A. A., and
Mishandling of the therapeutic peptide glucagon generates
Mitchison, T. J. (2016) Amyloid!like self!assembly of a cel!
cytotoxic amyloidogenic fibrils, Pharm. Res., 21, 1274!
lular compartment, Cell, 166, 637!650.
1283.
129. Iconomidou, V. A., Vriend, G., and Hamodrakas, S. J.
144. Gul, S., Bahadir, B., Dusak, A., Kalayci, M., Edebali, N.,
(2000) Amyloids protect the silkmoth oocyte and embryo,
and Acikgoz, B. (2009) Spherical amyloid deposition in a
FEBS Lett., 479, 141!145.
prolactin!producing pituitary adenoma, Neuropathology,
130. Iconomidou, V. A., Chryssikos, G. D., Gionis, V., Vriend, G.,
29, 81!84.
Hoenger, A., and Hamodrakas, S. J. (2001) Amyloid!like
145. Wickner, R. B., Edskes, H. K., Kryndushkin, D.,
fibrils from an 18!residue peptide analogue of a part of the
McGlinchey, R., Bateman, D., and Kelly, A. (2011) Prion
central domain of the B!family of silkmoth chorion pro!
diseases of yeast: amyloid structure and biology, Semin. Cell
teins, FEBS Lett., 499, 268!273.
Dev. Biol., 22, 469!475.
131. Iconomidou, V. A., Chryssikos, G. D., Gionis, V., Galanis,
146. Newby, G. A., and Lindquist, S. (2013) Blessings in dis!
A. S., Cordopatis, P., Hoenger, A., and Hamodrakas, S. J.
guise: biological benefits of prion!like mechanisms, Trends
(2006) Amyloid fibril formation propensity is inherent into
Cell Biol., 23, 251!259.
the hexapeptide tandemly repeating sequence of the cen!
147. Cox, B. S. (1965) ψ, a cytoplasmic suppressor of super!
tral domain of silkmoth chorion proteins of the A!family, J.
suppressor in yeast, Heredity, 20, 505 521, doi: 10.1038/
Struct. Biol., 156, 48!488.
hdy.1965.65.
БИОХИМИЯ том 85 вып. 9 2020
АМИЛОИДНЫЕ И АМИЛОИДОПОДОБНЫЕ АГРЕГАТЫ
1237
148. King, C.!Y., and Diaz!Avalos, R. (2004) Protein!only
164. Brown, J. C. S., and Lindquist, S. (2009) A heritable switch
transmission of three yeast prion strains, Nature, 428, 319!
in carbon source utilization driven by an unusual yeast
323.
prion, Genes Dev., 23, 2320!2332.
149. Sondheimer, N., and Lindquist, S. (2000) Rnq1: an epige!
165. Chakravarty, A. K., Smejkal, T., Itakura, A. K., Garcia, D. M.,
netic modifier of protein function in yeast, Mol. Cell, 5,
and Jarosz, D. F. (2020) A non!amyloid prion particle that
163!172.
activates a heritable gene expression program, Mol. Cell,
150. Derkatch, I. L., Bradley, M. E., Hong, J. Y., and Liebman, S. W.
77, 251!265.e9.
(2001) Prions affect the appearance of other prions: the
166. Chakrabortee, S., Byers, J. S., Jones, S., Garcia, D. M.,
story of [PIN+], Cell, 106, 171!182.
Bhullar, B., Chang, A., She, R., Lee, L., Fremin, B.,
151. Du, Z., Park, K.!W., Yu, H., Fan, Q., and Li, L. (2008)
Lindquist, S., and Jarosz, D. F. (2016) Intrinsically disor!
Newly identified prion linked to the chromatin!remodel!
dered proteins drive emergence and inheritance of biologi!
ing factor Swi1 in Saccharomyces cerevisiae, Nat. Genet.,
cal traits, Cell, 167, 369!381.e12.
40, 460!465.
167. Franzmann, T. M., Jahnel, M., Pozniakovsky, A.,
152. Saifitdinova, A. F., Nizhnikov, A. A., Lada, A. G.,
Mahamid, J., Holehouse, A. S., Nüske, E., Richter, D.,
Rubel, A. A., Magomedova, Z. M., Ignatova, V. V, Inge!
Baumeister, W., Grill, S. W., Pappu, R. V., Hyman, A. A.,
Vechtomov, S. G., and Galkin, A. P. (2010) [NSI+]: a novel
and Alberti, S. (2018) Phase separation of a yeast prion
non!Mendelian nonsense suppressor determinant in
protein promotes cellular fitness, Science, 359, eaao5654.
Saccharomyces cerevisiae, Curr. Genet., 56, 467!478.
168. Gomes, E., and Shorter, J. (2019) The molecular language
153. Nizhnikov, A. A., Ryzhova, T. A., Volkov, K. V., Zadorsky, S.
of membraneless organelles, J. Biol. Chem., 294, 7115!
P., Sopova, J. V., Inge!Vechtomov, S. G., and Galkin, A. P.
7127.
(2016) Interaction of prions causes heritable traits in
169. Mitrea, D. M., and Kriwacki, R. W. (2016) Phase separa!
Saccharomyces cerevisiae, PLoS Genet., 12, e1006504.
tion in biology; functional organization of a higher order,
154. Suzuki, G., Shimazu, N., and Tanaka, M. (2012) A yeast
Cell Commun. Signal., 14, 1.
prion, Mod5, promotes acquired drug resistance and cell
170. Audas, T. E., Audas, D. E., Jacob, M. D., Ho, J. J. D.,
survival under environmental stress, Science, 336, 355!359.
Khacho, M., Wang, M., Perera, J. K., Gardiner, C.,
155. Patel, B. K., Gavin!Smyth, J., and Liebman, S. W. (2009)
Bennett, C. A., Head, T., Kryvenko, O. N., Jorda, M.,
The yeast global transcriptional co!repressor protein Cyc8
Daunert, S., Malhotra, A., Trinkle!Mulcahy, L.,
can propagate as a prion, Nat. Cell Biol., 11, 344!349.
Gonzalgo, M. L., and Lee, S. (2016) Adaptation to stres!
156. Holmes, D. L., Lancaster, A. K., Lindquist, S., and
sors by systemic protein amyloidogenesis, Dev. Cell, 39,
Halfmann, R. (2013) Heritable remodeling of yeast multi!
155!168.
cellularity by an environmentally responsive prion, Cell,
171. Uversky, V. N., Kuznetsova, I. M., Turoverov, K. K., and
153, 153!165.
Zaslavsky, B. (2015) Intrinsically disordered proteins as
157. Halfmann, R., Wright, J. R., Alberti, S., Lindquist, S., and
crucial constituents of cellular aqueous two phase systems
Rexach, M. (2012) Prion formation by a yeast GLFG
and coacervates, FEBS Lett., 589, 15!22.
nucleoporin, Prion, 6, 391!399.
172. Uversky, V. N. (2017) Protein intrinsic disorder!based liq!
158. Chernova, T. A., Kiktev, D. A., Romanyuk, A. V.,
uid!liquid phase transitions in biological systems: complex
Shanks, J. R., Laur, O., Ali, M., Ghosh, A., Kim, D.,
coacervates and membrane!less organelles, Adv. Colloid
Yang, Z., Mang, M., Chernoff, Y. O., and Wilkinson, K. D.
Interface Sci., 239, 97!114.
(2017) Yeast short!lived actin!associated protein forms a
173. Uversky, V. N. (2019) Supramolecular fuzziness of intra!
metastable prion in response to thermal stress, Cell Rep.,
cellular liquid droplets: liquid!liquid phase transitions,
18, 751!761.
membrane!less organelles, and intrinsic disorder,
159. Chernova, T. A., Romanyuk, A. V., Karpova, T. S.,
Molecules, 24, 3265.
Shanks, J. R., Ali, M., Moffatt, N., Howie, R. L., O′Dell, A.,
174. Turoverov, K. K., Kuznetsova, I. M., Fonin, A. V.,
McNally, J. G., Liebman, S. W., Chernoff, Y. O., and
Darling, A. L., Zaslavsky, B. Y., and Uversky, V. N. (2019)
Wilkinson, K. D. (2011) Prion induction by the short!
Stochasticity of biological soft matter: emerging concepts
lived, stress!induced protein Lsb2 is regulated by ubiquiti!
in intrinsically disordered proteins and biological phase
nation and association with the actin cytoskeleton, Mol.
separation, Trends Biochem. Sci., 44, 716!728.
Cell, 43, 242!252.
175. Darling, A. L., Liu, Y., Oldfield, C. J., and Uversky, V. N.
160. Antonets, K. S., Belousov, M. V., Belousova, M. E., and
(2018) Intrinsically disordered proteome of human mem!
Nizhnikov, A. A. (2019) The Gln3 transcriptional regulator
brane!less organelles, Proteomics, 18, e1700193.
of Saccharomyces cerevisiae manifests prion!like properties
176. Uversky, V. N. (2017) Intrinsically disordered proteins in
upon overproduction, Biochemistry (Moscow), 84, 441!451.
overcrowded milieu: Membrane!less organelles, phase sep!
161. Rogoza, T., Goginashvili, A., Rodionova, S., Ivanov, M.,
aration, and intrinsic disorder, Curr. Opin. Struct. Biol., 44,
Viktorovskaya, O., Rubel, A., Volkov, K., and Mironova, L.
18!30.
(2010) Non!Mendelian determinant [ISP+] in yeast is a
177. Babinchak, W. M., and Surewicz, W. K. (2020) Liquid!liq!
nuclear!residing prion form of the global transcriptional
uid phase separation and its mechanistic role in pathologi!
regulator Sfp1, Proc. Natl. Acad. Sci. USA, 107, 10573!
cal protein aggregation, J. Mol. Biol., 432, 1910!1925.
10577.
178. Darling, A. L., Zaslavsky, B. Y., and Uversky, V. N. (2019)
162. Drozdova, P., Mironova, L., and Zhouravleva, G. (2016)
Intrinsic disorder!based emergence in cellular biology:
Haploid yeast cells undergo a reversible phenotypic switch
physiological and pathological liquid!liquid phase transi!
associated with chromosome II copy number, BMC Genet.,
tions in cells, Polymers (Basel), 11, 990.
17, 152.
179. De Oliveira, G. A. P., Cordeiro, Y., Silva, J. L., and
163. Matveenko, A. G., Drozdova, P. B., Belousov, M. V.,
Vieira, T. C. R. G. (2019) Liquid-liquid phase transitions
Moskalenko, S. E., Bondarev, S. A., Barbitoff, Y. A.,
and amyloid aggregation in proteins related to cancer and
Nizhnikov, A. A., and Zhouravleva, G. A. (2016) SFP1 -
neurodegenerative diseases, Adv. Protein Chem. Struct.
mediated prion!dependent lethality is caused by increased
Biol., 118, 289!331.
Sup35 aggregation and alleviated by Sis1, Genes to Cells, 21,
180. Kato, M., Han, T. W., Xie, S., Shi, K., Du, X., Wu, L. C.,
1290!1308.
Mirzaei, H., Goldsmith, E. J., Longgood, J., Pei, J.,
БИОХИМИЯ том 85 вып. 9 2020
1238
МАТИИВ и др.
Grishin, N. V., Frantz, D. E., Schneider, J. W., Chen, S.,
(OmpC) of Escherichia coli induces neurodegeneration in
Li, L., Sawaya, M. R., Eisenberg, D., Tycko, R., and
mice by acting as an amyloid, Biotechnol. Lett., 38, 689!
McKnight, S. L. (2012) Cell!free formation of RNA gran!
700.
ules: low complexity sequence domains form dynamic
194. Villain, E., Nikekhin, A. A., and Kajava, A. V. (2019)
fibers within hydrogels, Cell, 149, 753!767.
Porins and amyloids are coded by similar sequence motifs,
181. Gui, X., Luo, F., Li, Y., Zhou, H., Qin, Z., Liu, Z., Gu, J.,
Proteomics, 19, e1800075.
Xie, M., Zhao, K., Dai, B., Shin, W. S., He, J., He, L.,
195. Kaur, G., Kaundal, S., Kapoor, S., Grimes, J. M.,
Jiang, L., Zhao, M., Sun, B., Li, X., Liu, C., and Li, D.
Huiskonen, J. T., and Thakur, K. G. (2018) Mycobacterium
(2019) Structural basis for reversible amyloids of hnRNPA1
tuberculosis CarD, an essential global transcriptional regu!
elucidates their role in stress granule assembly, Nat.
lator forms amyloid!like fibrils, Sci. Rep., 8, 10124.
Commun., 10, 2006.
196. Higurashi, T., Yagi, H., Mizobata, T., and Kawata, Y.
182. Chen, C., Ding, X., Akram, N., Xue, S., and Luo, S.!Z.
(2005) Amyloid!like fibril formation of co!chaperonin
(2019) Fused in sarcoma: properties, self!assembly and
GroES: nucleation and extension prefer different degrees
correlation with neurodegenerative diseases, Molecules, 24,
of molecular compactness, J. Mol. Biol., 351, 1057!1069.
1622.
197. Giraldo, R. (2007) Defined DNA sequences promote the
183. Murray, D. T., Kato, M., Lin, Y., Thurber, K. R., Hung, I.,
assembly of a bacterial protein into distinct amyloid
McKnight, S. L., and Tycko, R. (2017) Structure of FUS
nanostructures, Proc. Natl. Acad. Sci. USA, 104, 17388!
protein fibrils and its relevance to self!assembly and phase
17393.
separation of low!complexity domains, Cell, 171, 615!
198. Gasset!Rosa, F., Coquel, A.!S., Moreno!Del Álamo, M.,
627.e16.
Chen, P., Song, X., Serrano, A. M., Fernández
184. Luo, F., Gui, X., Zhou, H., Gu, J., Li, Y., Liu, X.,
Tresguerres, M. E., Moreno D az de la Espina, S.,
Zhao, M., Li, D., Li, X., and Liu, C. (2018) Atomic struc!
Lindner, A. B., and Giraldo, R. (2014) Direct assessment
tures of FUS LC domain segments reveal bases for
in bacteria of prionoid propagation and phenotype selec!
reversible amyloid fibril formation, Nat. Struct. Mol. Biol.,
tion by Hsp70 chaperone, Mol. Microbiol., 91, 1070!
25, 341!346.
1087.
185. Fushimi, K., Long, C., Jayaram, N., Chen, X., Li, L., and
199. Fernández!Tresguerres, Moreno!D az de la Espina, S.,
Wu, J. Y. (2011) Expression of human FUS/TLS in yeast
Gasset!Rosa, F., and Giraldo, R. (2010) A DNA!promot!
leads to protein aggregation and cytotoxicity, recapitulating
ed amyloid proteinopathy in Escherichia coli, Mol.
key features of FUS proteinopathy, Protein Cell, 2, 141!
Microbiol., 77, 1456!1469.
149.
200. Torreira, E., Moreno!Del Álamo, M., Fuentes Perez, M. E.,
186. Chaudhury, A., Chander, P., and Howe, P. H. (2010)
Fernández, C., Mart n Benito, J., Moreno Herrero, F.,
Heterogeneous nuclear ribonucleoproteins (hnRNPs) in
Giraldo, R., and Llorca, O. (2015) Amyloidogenesis of
cellular processes: focus on hnRNP E1′s multifunctional
bacterial prionoid RepA!WH1 recapitulates dimer to
regulatory roles, RNA, 16, 1449!1462.
monomer transitions of RepA in DNA replication initia!
187. Kim, H. J., Kim, N. C., Wang, Y.!D., Scarborough, E. A.,
tion, Structure, 23, 183!189.
Moore, J., et al. (2013) Mutations in prion!like domains in
201. Belousov, M. V., Bondarev, S. A., Kosolapova, A. O.,
hnRNPA2B1 and hnRNPA1 cause multisystem pro!
Antonets, K. S., Sulatskaya, A. I., Sulatsky, M. I.,
teinopathy and ALS, Nature, 495, 467!473.
Zhouravleva, G. A., Kuznetsova, I. M., Turoverov, K. K.,
188. Prasad, A., Bharathi, V., Sivalingam, V., Girdhar, A., and
and Nizhnikov, A. A. (2018) M60!like metalloprotease
Patel, B. K. (2019) Molecular mechanisms of TDP!43
domain of the Escherichia coli YghJ protein forms amyloid
misfolding and pathology in amyotrophic lateral sclerosis,
fibrils, PLoS One, 13, e0191317.
Front. Mol. Neurosci., 12, 25.
202. Villar Piqué, A., Sabaté, R., Lopera, O., Gibert, J.,
189. Wegmann, S., Eftekharzadeh, B., Tepper, K., Zoltowska,
Torne, J. M., Santos, M., and Ventura, S. (2010) Amyloid!
K. M., Bennett, R. E., Dujardin, S., Laskowski, P. R.,
like protein inclusions in tobacco transgenic plants, PLoS
MacKenzie, D., Kamath, T., Commins, C., Vanderburg, C.,
One, 5, e13625.
Roe, A. D., Fan, Z., Molliex, A. M., Hernandez!Vega, A.,
203. Hughes, M. P., Sawaya, M. R., Boyer, D. R., Goldschmidt, L.,
Muller, D., Hyman, A.A., Mandelkow, E., Taylor, J. P.,
Rodriguez, J. A., Cascio, D., Chong, L., Gonen, T., and
and Hyman, B. T. (2018) Tau protein liquid!liquid phase
Eisenberg, D. S. (2018) Atomic structures of low!complex!
separation can initiate tau aggregation, EMBO J., 37,
ity protein segments reveal kinked β sheets that assemble
e98049.
networks, Science, 359, 698!701.
190. Kosolapova, A. O., Belousov, M. V., Sulatskaya, A. I.,
204. Nizhnikov, A. A., Alexandrov, A. I., Ryzhova, T. A.,
Belousova, M. E., Sulatsky, M. I., Antonets, K. S.,
Mitkevich, O. V., Dergalev, A. A., Ter!Avanesyan, M. D.,
Volkov, K. V., Lykholay, A. N., Shtark, O. Y., Vasileva, E. N.,
and Galkin, A. P. (2014) Proteomic screening for amyloid
Zhukov, V. A., Ivanova, A. N., Zykin, P. A., Kuznetsova, I. M.,
proteins, PLoS One, 9, e116003.
Turoverov, K. K., Tikhonovich, I. A., and Nizhnikov, A. A.
205. Kryndushkin, D., Pripuzova, N., Burnett, B. G., and
(2019) Two novel amyloid proteins, RopA and RopB, from
Shewmaker, F. (2013) Non!targeted identification of pri!
the root nodule bacterium Rhizobium leguminosarum,
ons and amyloid!forming proteins from yeast and mam!
Biomolecules, 9, 694.
malian cells, J. Biol. Chem., 288, 27100!27111.
191. Danoff, E. J., and Fleming, K. G. (2015) Aqueous, unfold!
206. Kayed, R., Head, E., Sarsoza, F., Saing, T., Cotman, C. W.,
ed OmpA forms amyloid!like fibrils upon self!association,
Necula, M., Margol, L., Wu, J., Breydo, L., Thompson, J. L.,
PLoS One, 10, e0132301.
Rasool, S., Gurlo, T., Butler, P., and Glabe, C. G. (2007)
192. Antonets, K. S., Volkov, K. V., Maltseva, A. L., Arshakian,
Fibril specific, conformation dependent antibodies recog!
L. M., Galkin, A. P., and Nizhnikov, A. A.
(2016)
nize a generic epitope common to amyloid fibrils and fib!
Proteomic analysis of Escherichia coli protein fractions
rillar oligomers that is absent in prefibrillar oligomers, Mol.
resistant to solubilization by ionic detergents, Biochemistry
Neurodegener., 2, 18.
(Moscow), 81, 34!46.
207. Alberti, S. (2017) The wisdom of crowds: regulating cell
193. Sahaya Rajan, J. J., Chinnappan Santiago, T., Singaravel, R.,
function through condensed states of living matter, J. Cell
and Ignacimuthu, S. (2016) Outer membrane protein C
Sci., 130, 2789!2796.
БИОХИМИЯ том 85 вып. 9 2020
АМИЛОИДНЫЕ И АМИЛОИДОПОДОБНЫЕ АГРЕГАТЫ
1239
AMYLOID AND AMYLOIDJLIKE AGGREGATES:
DIVERSITY AND TERM CRISIS*
Review
A. B. Matiiv1, N. P. Trubitsina1, A. G. Matveenko1,
Y. A. Barbitoff1,2, G. A. Zhouravleva1,3, and S. A. Bondarev1,3**
1 St. Petersburg State University, Faculty of Biology, Department of Genetics and Biotechnology,
199034 St. Petersburg, Russia; E mail: stanislavspbgu@gmail.com, s.bondarev@spbu.ru
2 Bioinformatics Institute, 197342 St. Petersburg, Russia
3 St. Petersburg State University, Faculty of Biology, Laboratory of Amyloid Biology, 199034 St. Petersburg, Russia
Received July 16, 2020
Revised August 5, 2020
Accepted August 5, 2020
Active accumulation of the data on new amyloids continuing nowadays dissolves boundaries of the term “amyloid”.
Currently, it is most often used to designate aggregates with cross!β structure. At the same time, amyloids also exhib!
it a number of other unusual properties, such as: detergent and protease resistance, interaction with specific dyes, and
ability to induce transition of some proteins from a soluble form to an aggregated one. The same features have been
also demonstrated for the aggregates lacking cross!β structure, which are commonly called “amyloid!like” and com!
bined into one group, although they are very diverse. We have collected and systematized information on the proper!
ties of more than two hundred known amyloids and amyloid!like proteins with emphasis on conflicting examples. In
particular, a number of proteins in membraneless organelles form aggregates with cross!β structure that are morpho!
logically indistinguishable from the other amyloids, but they can be dissolved in the presence of detergents, which is
not typical for amyloids. Such paradoxes signify the need to clarify the existing definition of the term amyloid. On the
other hand, the demonstrated structural diversity of the amyloid!like aggregates shows the necessity of their classifi!
cation.
Keywords: amyloids, amyloid!like aggregates, cross!β structure, prions
БИОХИМИЯ том 85 вып. 9 2020