БИОХИМИЯ, 2020, том 85, вып. 9, с. 1274 - 1284
УДК 577.12
РАЗЛИЧНЫЕ РОЛИ ИЗОФОРМ АКТИНА В ПРОЦЕССЕ
ДЕЛЕНИЯ ЭПИТЕЛИАЛЬНЫХ КЛЕТОК*
© 2020
Г.С. Шагиева1, И.Б. Алиева1,2**, К. Шапонье3, В.Б. Дугина1
1 НИИ физико химической биологии имени А.Н. Белозерского,
Московский государственный университет имени М.В. Ломоносова,
119992 Москва, Россия; электронная почта: irina_alieva@belozersky.msu.ru
2 Федеральный научно клинический центр физико химической медицины ФМБА России,
119435 Москва, Россия
3 Отделение патологии и иммунологии факультета медицины, Университет Женевы,
1205 Женева, Швейцария; электронная почта: Christine.Chaponnier@unige.ch
Поступила в редакцию 23.06.2020
После доработки 22.07.2020
Принята к публикации 25.07.2020
В данной работе методом лазерной сканирующей микроскопии были исследованы распределение и функ
ции бета и гамма цитоплазматических актинов на разных этапах деления неопухолевых эпителиальных
клеток. Было показано, что бета и гамма актины пространственно разделены в ранней профазе, анафазе,
телофазе и во время цитокинеза. Эксперименты с малыми интерференционными РНК показали, что сни
жение экспрессии как бета актина, так и гамма актина приводило к значительному сокращению популя
ции клеток. Снижение экспрессии бета актина вызывало появление большого количества многоядерных
клеток, что указывает на возможное нарушение цитокинеза в данных клетках. Подавление экспрессии гам
ма актина приводило к уменьшению количества митозов. При митозе наблюдалась взаимозависимость
между изоформами актина и системой микротрубочек: 1) cнижение экспрессии гамма актина приводило к
нарушениям организации митотического веретена; 2) подавление полимеризации тубулина приводило к
нарушениям реорганизации бета актина: инкубация с колцемидом блокировала перенос коротких бета ак
тиновых полимеров из базальной области в кортикальную. Полученные результаты позволяют сделать за
ключение: для нормального деления клеток необходимы обе изоформы актина, но каждая изоформа дает
свой специфический функциональный вклад в этот процесс.
КЛЮЧЕВЫЕ СЛОВА: цитоплазматический актин, митоз, микротрубочки, клеточное деление.
DOI: 10.31857/S0320972520090079
ВВЕДЕНИЕ
новые структуры специфически распределены и
функционально различны в фибробластах и эпи
Актин и его регуляторные белки абсолютно
телиальных клетках человека. Сократительные
необходимы для деления клеток. Актиновый ци
стресс фибриллы образованы преимущественно
тоскелет эпителиальных клеток образуют две ци
бета актином, тогда как гамма актин формирует
топлазматические изоформы актина и множест
сильно ветвящуюся кортикальную сеть в апи
во актин связывающих белков, обеспечивающих
кальной части клетки [2, 3].
формирование различных структур цитоскелета.
При переходе клеток к делению все компо
Цитоплазматические бета и гамма актины (да
ненты цитоскелета претерпевают значительные
лее - бета и гамма актины) экспрессируются во
изменения. Взаимодействие актиновых струк
всех клетках человека в разных пропорциях и от
тур и микротрубочек важно для регуляции фор
личаются только четырьмя аминокислотами на
мы и полярности клеток во время клеточного
N конце, расположенными в позициях 1, 2, 3 и 9
деления, от момента вхождения клеток в профа
[1]. Ранее мы показали, что бета и гамма акти
зу до окончания цитотомии. Под клеточным де
лением мы понимаем всю М фазу клеточного
Принятые сокращения: миРНК - малые интерфе
цикла, включая митоз (кариокинез) и цитоки
ренционные РНК, LSM - лазерная сканирующая микро
нез. Координация системы актиновых микро
скопия (laser scanning microscopy).
филаментов и микротрубочек контролируется
* Первоначально английский вариант рукописи опубли
как многочисленными белками регуляторами
msu.ru/biokhimiya, в рубрике «Papers in Press», BM20 174,
цитоскелета (например, Rho ГТФазами), так и
03.09.2020.
физическим взаимодействием разных фила
** Адресат для корреспонденции.
ментных систем (сшивки, заякоривание и меха
1274
ВЛИЯНИЕ ИЗОФОРМ АКТИНА НА ДЕЛЕНИЕ ЭПИТЕЛИАЛЬНЫХ КЛЕТОК
1275
ническое воздействие) [4]. Известно, что (1) взаи
(демеколцин; «Sigma», США) - в концентрации
модействие актиновых филаментов с системой
0,1 мкг/мл, инкубируя с ним клетки в течение 1
микротрубочек играет важную роль в сборке и
ч при 37 °C в атмосфере 5% CO2.
поддержании трехмерной клеточной структуры,
Антитела. В качестве первичных антител в ра
и (2) бета и гамма актины оказывают противо
боте использовали следующие антитела: антите
положное влияние на динамику и организацию
ла к цитоплазматическому бета актину (мыши
микротрубочек [3]. Мы попытались выяснить
ные mAb 4C2, IgG1, «Bio Rad», США; AC 74,
влияют ли микротрубочки на функционирова
IgG2a, «Sigma», США), антитела к цитоплазма
ние структур бета или гамма актина, и наобо
тическому гамма актину (мышиные mAb 2A3,
рот, влияют ли актиновые структуры на микро
IgG2b, «Bio Rad», США; кроличьи pAbs AAL20),
трубочки в процессе митотического деления.
пан актину (клон C4, «Chemicon», США), аль
Данное исследование было проведено на клет
фа тубулину (клон DM1A, IgG1,
«Sigma»,
ках эпителиальной линии HaCaT [5]. В качестве
США), кроличьи антитела против немышечного
методов исследования распределения клеточ
миозина IIA («Sigma», США), мышиные анти
ных структур, образованных различными изо
Rac1 (mAb, IgG2b, «BD Transduction», США) и
формами актина, и их функций на разных ста
кроличьи анти RhoA (mAb, «Epitomics/Abcam»,
диях деления эпителиальных клеток были ис
США). Все первичные антитела использовали в
пользованы лазерная сканирующая микроско
разведении 1/100. В качестве вторичных антител
пия (LSM), регуляция экспрессии актинов при
использовали следующие антитела: козьи анти
помощи малых интерференционных РНК
мышиные IgG1, IgG2b и IgG2a, конъюгирован
(миРНК), а также воздействие на динамику
ные с Alexa488, Alexa594 и Alexa647 («Southern
микротрубочек химическими ингибиторами.
Biotechnology Associates Inc.», США). Конъюги
рованные с TRITC или Cy 5 козьи анти кро
личьи антитела
(«Jackson Immuno Research
МАТЕРИАЛЫ И МЕТОДЫ
Laboratories Inc.», США). Все вторичные антите
ла использовали в разведении 1/500. DRAQ5
Клетки, условия культивирования и экспери6
(«Biostatus», Великобритания) и DAPI («Sigma»,
ментальные воздействия. Клеточная линия
США) применялись для выявления ДНК.
HaCaT была получена от Л. Фонтао (отделение
Белковый иммуноблоттинг. Клетки с пласти
дерматологии, Университетская клиника Жене
ковых культуральных чашек экстрагировали хо
вы, Швейцария). Клетки HaCaT являются са
лодным буфером для образцов (62,5 мМ Tris HCl,
мопроизвольно иммортализованными in vitro
рН 6,8; 2% ный додецилсульфат натрия (SDS),
кератиноцитами из хирургического образца гис
10% (v/v) глицерин, 50 мМ дитиотреитол (DTT),
тологически нормальной кожи человека [5].
0,01% бромфеноловый синий, коктейль ингиби
Клетки содержали в среде DMEM («Gibco»,
торов протеаз и фосфатаз («Sigma», США). Лиза
Швейцария), содержащей 5% фетальной бы
ты разделяли в 10% ном SDS полиакриламидном
чьей сыворотки («Seromed, Германия), 5 мМ
геле и переносили на поливинилиденфторидную
глутаминовой кислоты («PanEco», Россия), при
мембрану («Amersham GE Healthcare», США).
37 °C в атмосфере 5% CO2. Для экспериментов
После блокирования неспецифического связы
клетки культивировали при 37 °C в атмосфере
вания бычьим сывороточным альбумином мемб
5% CO2 до достижения ими конфлуэнтного мо
раны инкубировали со специфическими антите
нослоя, используя пластиковые флаконы, а за
лами. Мы использовали альфа тубулин в качест
тем рассаживали на стекла и культивировали в
ве контроля загрузки. Мембраны инкубировали
течение 3-8 часов при 37 °C в атмосфере 5% CO2
со вторичными антителами, связанными с пе
для получения отдельно расположенных мито
роксидазой хрена («Amersham GE Healthcare»,
тических клеток. После этого в среду культиви
США), в разведении 1/30 000. Мембраны были
рования добавляли один из перечисленных да
обработаны реагентами ECL («Amersham GE
лее ингибиторов: (1) селективный ингибитор
Healthcare», США) в соответствии с протоколом
немышечного миозина II блеббистатин («Biomol
производителя. Люминесцентное излучение
International», США) использовали в концент
фиксировали при помощи светочувствительной
рации 25 мкМ, инкубируя с ним клетки в тече
фотографической плёнки. Полученные пленки
ние 4 ч при 37 °C в атмосфере 5% CO2; (2) стаби
сканировали и анализировали с помощью про
лизирующий микротрубочки препарат таксол
граммного обеспечения ImageJ 1,37C (NIH,
(паклитаксел; «Sigma», США) - в концентрации
2 мкМ, инкубируя с ним клетки в течение 5 ч
сительного количества белка проводили при по
при 37 °С в атмосфере 5% CO2; (3) дестабилизи
мощи U критерия Манна-Уитни по результатам
рующий микротрубочки препарат колцемид
пяти независимых экспериментов.
БИОХИМИЯ том 85 вып. 9 2020
1276
ШАГИЕВА и др.
Иммунофлуоресцентная и конфокальная ла6
Трансфекция миРНК. Последовательности
зерная сканирующая микроскопия. Для имму
миРНК к бета цитоплазматическому актину че
нофлуоресцентного анализа клетки культивиро
ловека (NM_001101) - бета актин миРНК1, бе
вали на покровных стеклах, промывали DMEM,
та актин миРНК2, бета актин миРНК3, и к гам
содержащей 20 мМ HEPES, при 37°С в течение
ма цитоплазматическому актину человека
5 мин, фиксировали в течение 15 мин 1% ным
(NM_001614) - гамма актин миРНК1 и гамма
параформальдегидом в среде DMEM с 20 мМ
актин миРНК2 («Qiagen», Швейцария) пред
HEPES при комнатной температуре.
ставлены в таблице.
Затем клетки фиксировали/пермеабилизи
Клетки трансфицировали 50-100 нМ миРНК
ровали холодным МеОН при -20 °С в течение
с использованием Lipofectamine 2000 («Invitrogen»,
5 мин для последующей инкубации с антитела
США). Эффективность трансфекции (≥90%)
ми. Условия фиксации, используемые в этом ис
оценивали с использованием BLOCK iT ™
следовании, имеют решающее значение для луч
(«Invitrogen», США). Клетки HaCaT анализиро
шей доступности N конца изоформ актина [2].
вали на 3 й день после трансфекции миРНК.
Для иммунофлуоресцентного выявления белков
Количественную оценку клеточных популяций
RhoA и Rac1 клетки фиксировали, используя хо
после воздействия миРНК проводили путем
лодную 10% трихлоруксусную кислоту (-20° С) в
анализа общего количества клеток в суспензии
течение 15 мин. Анализ проводили с помощью
после снятия с субстрата. Для оценки доли мно
конфокального микроскопа LSM510, Zeiss
гоядерных клеток вели подсчет количества та
(«Zeiss», Германия), снабженного масляными
ких клеток среди 100 клеток популяции для
иммерсионными объективами (Plan Neofluar
каждого экспериментального условия; для
63×/1.4 и Plan Fluar 100×/1.45, Zeiss) («Zeiss»,
оценки доли митозов рассчитывали количество
Германия). Полученные изображения (одиноч
митотических клеток на 100 клеток популяции.
ные оптические срезы толщиной ~1 мкм) были
Статистический анализ. Результаты по мень
обработаны с использованием программного
шей мере трех независимых экспериментов
обеспечения конфокального микроскопа
представлены как среднее значение ± стандарт
LSM510 Zeiss («Zeiss», Германия). Количествен
ная ошибка среднего. Межгрупповые различия
ные измерения клеточной площади проводили с
анализировали с помощью U критерия Ман
использованием программного обеспечения
на-Уитни. Значения р < 0,001 (***), р < 0,01 (**) и
конфокального микроскопа LSM510 Zeiss
р < 0,05 (*) считались статистически значимыми.
(«Zeiss», Германия), анализируя данные, полу
ченные в серии из трех независимых экспери
ментов, по меньшей мере для 20 клеток для каж
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
дого экспериментального условия. Интенсив
ность флуоресцентного окрашивания бета акти
Внутриклеточная локализация бета6 и гамма6
на анализировали в программном обеспечении
актина на разных стадиях клеточного деления.
ImageJ 1,37C при помощи инструмента «множе
Тройной иммунофлуоресцентный анализ рас
ственные точки» (multi point) в отдельном цве
пределения цитоскелетных структур бета и
товом канале. Для каждой клетки получали сред
гамма актина, а также альфа тубулина в клетках
ние значения интенсивности множественных
HaCaT, находящихся на разных стадиях митоза и
измерений порядка 30 точек на кортикальную
во время цитокинеза, позволил установить, что
область или цитозольные скопления актина. Ре
системы, образованные двумя изоформами ак
зультаты представлены в виде среднего по 10-15
тина по разному локализованы в делящихся
клеткам на каждое условие по двум типам лока
эпителиальных клетках.
лизации ± стандартная ошибка среднего.
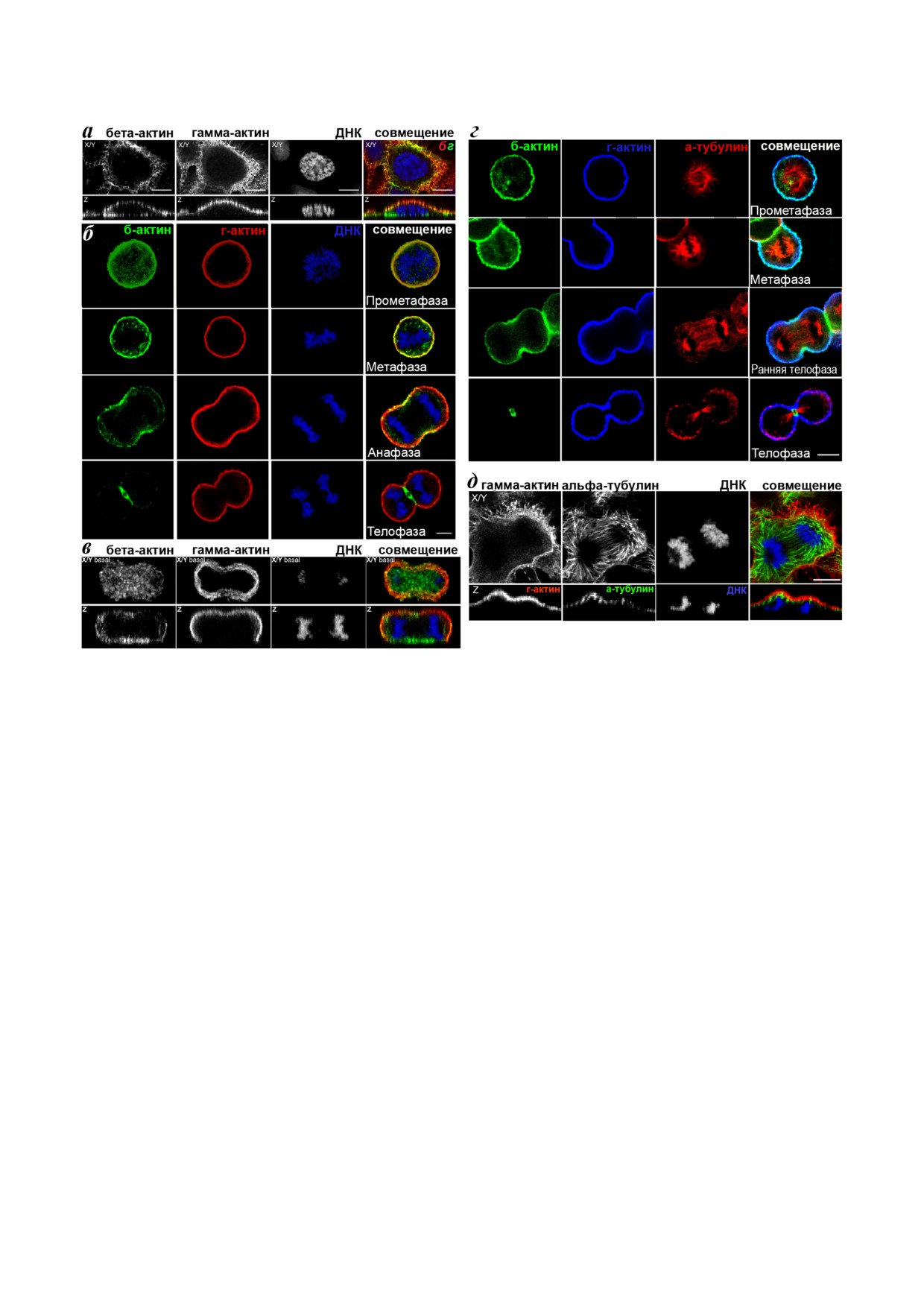
В ранней профазе структуры, образованные
цитоплазматическими актинами, были располо
жены полярно аналогично интерфазным клет
Последовательности миРНК, использованные в работе
кам [2] - бета актин был организован в вент
ральные фибриллы, а гамма актин формировал
Название миРНК
5′-3′ последовательность миРНК
дорзальную сеть (рис. 1, а). Измерения интен
сивности флуоресценции бета актина в промета
бета актин миРНК1
AATGAAGATCAAGATCATTGC
фазе выявили лишь незначительное преоблада
бета актин миРНК2
TAGCATTGCTTTCGTGTAAAT
ние в кортикальном слое (158,43 ± 16,9) по срав
бета актин миРНК3
CAAATATGAGATGCATTGTTA
нению с цитоплазмой (132,6 ± 15,8). В метафазе
гамма актин миРНК1
AAGAGATCGCCGCGCTGGTCA
оба актина концентрировались в кортикальном
слое клеток (рис. 1, б и г). В анафазе бета актин
гамма актин миРНК2
CAGCAACACGTCATTGTGTAA
концентрировался в кортикальном слое эквато
БИОХИМИЯ том 85 вып. 9 2020
ВЛИЯНИЕ ИЗОФОРМ АКТИНА НА ДЕЛЕНИЕ ЭПИТЕЛИАЛЬНЫХ КЛЕТОК
1277
Рис. 1. LSM. а - Ранняя профаза в клетках HaCaT, X/Y и Z - оптические срезы. Бета актин (зеленый), гамма актин (крас
ный), ДНК (синий) - на крайнем правом изображении. б - Распределение структур цитоплазматических актинов во вре
мя митоза (профазы, метафазы, анафазы, телофазы) и цитокинеза в клетках HaCaT: бета актин (зеленый), гамма актин
(красный), ДНК (синий). в - Локализация цитоплазматических актинов на уровне базального оптического среза в мито
тической клетке HaCaT: бета актин (зеленый), гамма актин (красный), ДНК (синий) на изображении с объединенными
цветовыми каналами. г - Распределение структур цитоплазматических актинов и тубулина во время митоза (прометафа
за, метафаза, ранняя телофаза, телофаза) и цитокинеза в HaCaT: бета актин (зеленый), гамма актин (синий), альфа тубу
лин (красный). д - Локализация гамма актина (красный), альфа тубулина (зеленый) и ДНК (синий) в анафазных клет
ках HaCaT. Оптический срез X/Y - верхний ряд, Z - нижний ряд. Масштаб - 5 мкм. (С цветными вариантами рис. 1-4
риальной зоны, где в дальнейшем он участвовал
распределение цитоплазматических актинов в
в образовании сократительного кольца во время
эпителиальных клетках HaCaT. В большинстве
телофазы и цитокинеза (рис. 1, б и г). В течение
животных клеток процесс разделения цитоплаз
деления бета актин также формировал вентраль
мы, цитокинез, начинается в анафазе и закан
ные пучки в зоне контактов клетки с субстратом
чивается вскоре после телофазы [7]. Блеббиста
(рис. 1, а и в). Гамма актин находился в корти
тин подавляет активность сократительного
кальной сети во время всех митотических фаз и
кольца, не нарушая при этом митоз (кариоки
цитокинеза (рис. 1). Взаимное расположение ци
нез) [8]. Двойное иммунофлуоресцентное окра
топлазматических актинов и альфа тубулина во
шивание показало, что в анафазных и телофаз
время митотических фаз и цитокинеза в HaCaT
ных клетках после инкубации с блеббистатином
представлено на рис. 1, в и г.
концентрация бета актина в экваториальной
Участие бета6актина в формировании сокра6
области снижена по сравнению с контролем
тительного кольца. Блеббистатин является инги
(рис. 2, а и б). Локализация гамма актина оста
битором немышечного миозина II, который
лась неизменной (данные не показаны).
блокирует взаимодействие миозина II с актином
Малые Rho ГТФазы являются регуляторами
[6]. Мы исследовали влияние блеббистатина на организации как системы микротрубочек, так и
БИОХИМИЯ том 85 вып. 9 2020
1278
ШАГИЕВА и др.
Рис. 2. LSM. а - Бета актин (зеленый), миозин IIA (красный) и ДНК (синий) в HaCaT, после инкубации с блеббистати
ном, телофаза/цитокинез. б - Бета актин (зеленый), гамма актин (красный) и ДНК (синий) в HaCaT, после инкубации с
блеббистатином, анафаза/цитокинез. в - RhoA (красный), бета актин (зеленый) и ДНК (синий) во время телофазы/ци
токинеза в HaCaT. г - Гамма актин (красный), Rac1 (зеленый) и ДНК (синий) в клетках HaCaT, телофаза. Оптические сре
зы X/Y и Z. Масштаб - 5 мкм
БИОХИМИЯ том 85 вып. 9 2020
ВЛИЯНИЕ ИЗОФОРМ АКТИНА НА ДЕЛЕНИЕ ЭПИТЕЛИАЛЬНЫХ КЛЕТОК
1279
актинового цитоскелета [9]. Известно также,
ше на третий день после трансфекции по сравне
что сборка сократительного кольца происходит
нию с контролем. Динамика снижения митоти
при пространственно временной регуляции ма
ческого индекса в результате подавления
лыми ГТФазами [10]. Для выявления возмож
экспрессии бета актина была значительно менее
ной избирательности Rho ГТФаз по отноше
выраженной: доля митотических клеток была в
нию к изоформам актина в работе проанализи
1,8 раза ниже, чем в контроле, на 2 е сутки после
ровали локализацию RhoA и Rac1 в телофазных
трансфекции, а на 3 и сутки - была такой же, как
клетках HaCaT. Мы обнаружили концентрацию
в контрольных клетках. В клетках с супрессией
RhoA в экваториальной области и сократитель
гамма актина мы обнаружили задержку в форми
ном кольце в телофазе/цитокинезе, что корре
ровании веретена деления (данные не показаны),
лирует с расположением бета актина, но не гам
блеббинг кортекса и различные ядерные дефор
ма актина (рис. 2, в). Другая Rho ГТФаза, Rac1,
мации: сильная асимметрия организации хромо
была равномерно распределена в цитоплазме с
сом (рис. 3, г) и компактизация ядер.
концентрацией в кортикальном слое, особенно
Во время интерфазы микротрубочки образу
в области полюсов телофазных клеток, где наб
ют трехмерную радиальную систему, а их плюс
людалось накопление и гамма актина (рис. 2, г).
концы находятся близко к кортикальному слою
Снижение экспрессии бета6 или гамма6актина
актина [3]. Организация астральных микротру
угнетает деление эпителиальных клеток и вызыва6
бочек и микротрубочек веретена в митотических
ет различные дефекты митоза. Учитывая сегрега
контрольных клетках и клетках с миРНК к бета
цию изоформ актина в митотических клетках
актину была схожей, однако снижение экспрес
HaCaT, мы провели трансфекцию миРНК к бе
сии гамма актина привело к нарушению систе
та актину или гамма актину, чтобы оценить
мы микротрубочек, образующих веретено деле
вклад каждого из цитоплазматических актинов в
ния (рис. 3, г).
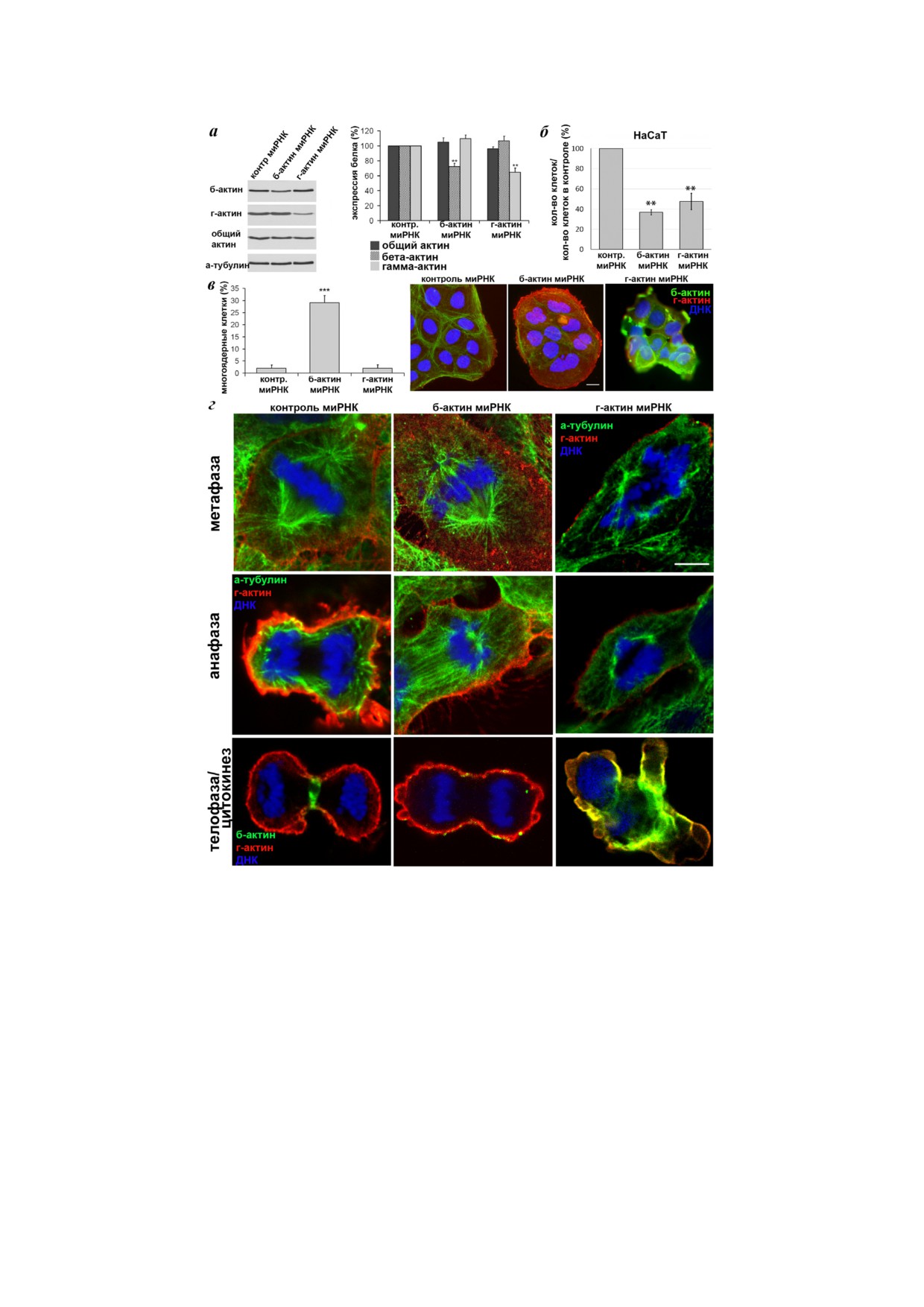
прогрессию митоза. Снижение количества бета
Взаимосвязь микротрубочек и цитоплазмати6
актина через 72 ч после трансфекции составило
ческих актинов. Взаимодействие актиновых фи
37,7 ± 4,3%, что сопровождалось небольшим
ламентов с системой микротрубочек играет важ
увеличением (на 9,5% ± 5,2%) количества гам
ную роль в сборке и поддержании трехмерной
ма актина. Снижение экспрессии гамма актина
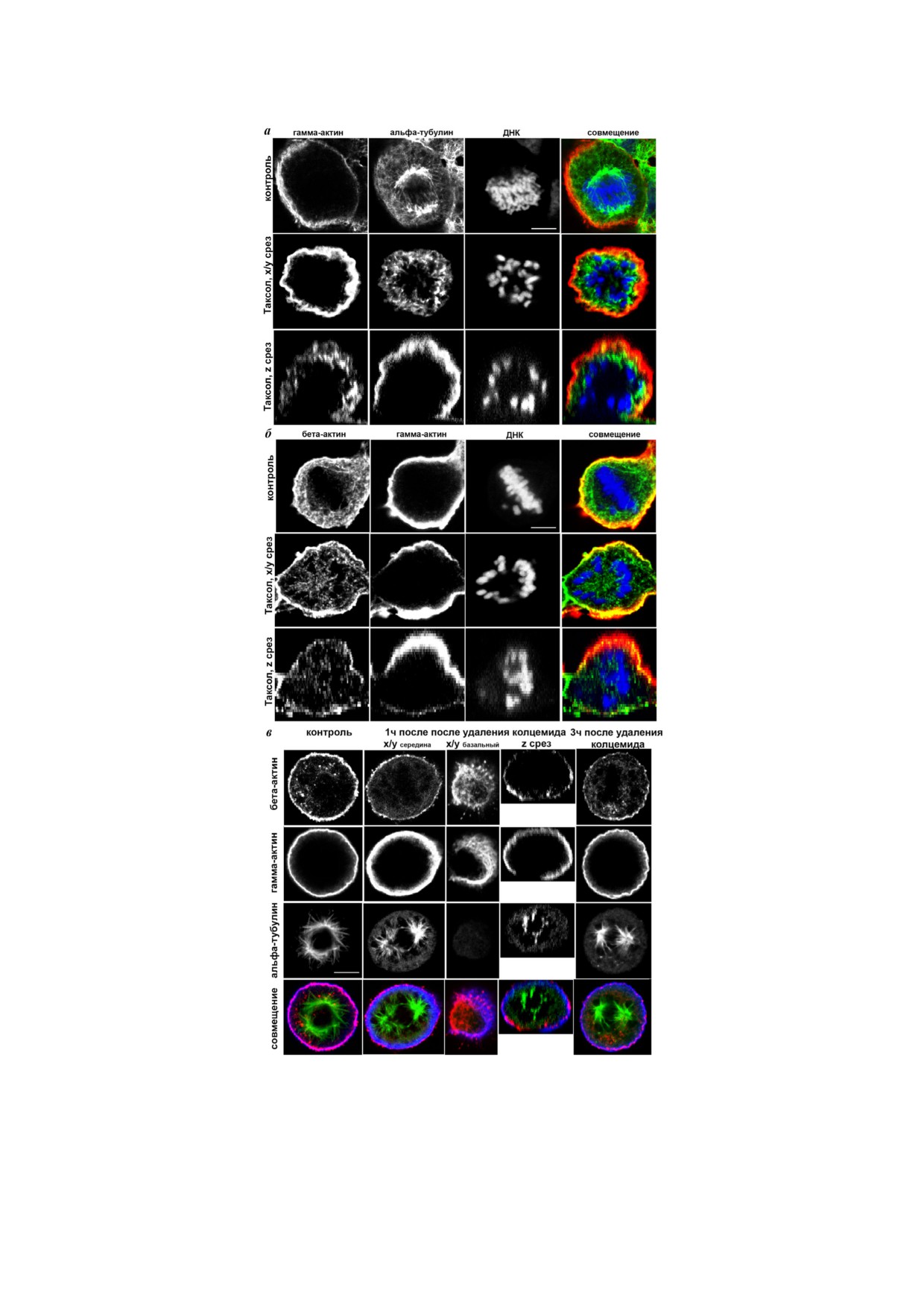
структуры клеток. Таксол - препарат, стабили
с помощью миРНК составило 35,5 ± 5,8%,
зирующий микротрубочки, - противоопухоле
экспрессия бета актина при этом практически
вый агент растительного происхождения. Так
не изменилась (рис. 3, а).
сол стехиометрически и специфически связыва
Избирательное подавление изоформ цито
ется с субъединицами бета тубулина в димерах
плазматических актинов в HaCaT приводило к
тубулина, что приводит к образованию стабиль
значительным изменениям пролиферации in
ных микротрубочек [11]. Стабилизация микро
vitro, но снижение экспрессии каждой изоформы
трубочек таксолом не нарушала локализацию
по разному влияло на процесс деления. При
бета и гамма актинов в кортексе в метафазных
супрессии как бета актина, так и гамма актина
клетках, при этом сохранялась связь микротру
число клеток на 3 и сутки после трансфекции
бочек с кортексом (рис. 4, а). Препарат, облада
было ниже по сравнению с контролем: 36,7 ±
ющий противоположным действием - колце
± 2,53% для миРНК к бета актину и 47,5 ±
мид - ингибирует полимеризацию микротрубо
± 8,2% - для миРНК к гамма актину (рис. 3, б).
чек и образование митотического веретена, бло
В экспериментах с подавлением экспрессии бе
кируя клетки на стадии метафазы [12,13]. После
та актина наблюдалось увеличение площади кле
удаления колцемида из среды культивирования
ток в метафазе, нарушения цитокинеза и появле
происходила реполимеризация микротрубочек
ние многоядерных клеток. Площадь клеток в ме
и образование митотического веретена. Через
тафазе в контроле составила 214,149 ± 31,009, с
1 ч после удаления колцемида небольшие бета
миРНК к бета актину - 496,112 ± 68,265, с
актиновые фибриллы наблюдались на базаль
миРНК к гамма актину - 157,043 ± 14,652 мкм2.
ном уровне клетки и вблизи микротрубочек ве
Снижение экспрессии бета актина приводило к
ретена (рис. 4, б). Через 4 ч после удаления кол
появлению значительного количества двуядер
цемида бета актин, помимо цитоплазматичес
ных клеток - 29 ± 2% по сравнению с 2% как в
кой и базальной локализации, вновь обнаружи
контроле, так и в клетках со сниженной экспрес
вался в клеточном кортексе. Воздействие колце
сией гамма актина (рис.
3, в). Подавление
мида не влияло на локализацию гамма актина
экспрессии гамма актина в HaCaT приводило к
(рис. 4, б). Чтобы проанализировать распределе
снижению доли митотических клеток в популя
ние бета актина после инкубации с колцемидом
ции: их количество было в 3,4 раза меньше на
с последующей отмывкой, а также после инку
второй день после трансфекции и в 2,2 раза мень
бации с таксолом, мы измерили интенсивность
БИОХИМИЯ том 85 вып. 9 2020
1280
ШАГИЕВА и др.
Рис. 3. LSM. а - Снижение количества бета и гамма актина с помощью миРНК. Белковый иммуноблоттинг. б - Влия
ние миРНК к бета актину или гамма актину на рост популяции клеток HaCaT. в - Количество многоядерных клеток
HaCaT с миРНК к бета актину увеличено по сравнению с контролем и миРНК к гамма актину. Масштаб 10 мкм. г - Ме
тафаза, анафаза и телофаза/цитокинез в клетках HaCaT со сниженной экспрессией бета или гамма актина. Два верхних
ряда: гамма актин (красный), альфа тубулин (зеленый), ДНК (синий). Нижний ряд: гамма актин (красный), бета актин
(зеленый), ДНК (синий). Масштаб - 5 мкм
флуоресцентного окрашивания бета актина в
инкубации с таксолом (5 ч) интенсивность флуо
кортексе и цитоплазме. В контрольных мета
ресценции бета актина в кортексе составила
фазных клетках интенсивность флуоресцентно
198,15 ± 14,74, в цитоплазме - 153,24 ± 20,48.
го окрашивания бета актина в кортексе состав
ляла 237,417 ± 12,257, в цитоплазме - 63,861 ±
± 18,317. Через 3 ч после удаления колцемида
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
интенсивность флуоресцентного окрашивания
бета актина в кортексе составила 136,259 ±
Результаты проведенных нами исследований
± 12,836, в цитоплазме - 92,308 ± 22,885. После позволили выявить выраженные различия в ло
БИОХИМИЯ том 85 вып. 9 2020
ВЛИЯНИЕ ИЗОФОРМ АКТИНА НА ДЕЛЕНИЕ ЭПИТЕЛИАЛЬНЫХ КЛЕТОК
1281
Рис. 4. LSM. а - Влияние таксола на распределение цитоплазматических актинов в HaCaT при митозе. Альфа тубулин
(зеленый), гамма актин (красный), ДНК (синий); б - бета актин (зеленый), гамма актин (красный), ДНК (синий) после
инкубации с таксолом клеток HaCaT; в - цитоплазматические актины и альфа тубулин в клетках HaCaT после инкубации
с колцемидом, по сравнению с одним/четырьмя часами после удаления колцемида. Альфа тубулин (зеленый), бета актин
(красный), гамма актин (синий). Масштаб - 5 мкм
10 БИОХИМИЯ том 85 вып. 9 2020
1282
ШАГИЕВА и др.
кализации клеточных структур, образованных
ких дефектов, связанных с расхождением хромо
бета и гамма цитоплазматическими изоформа
сом и повышением частоты аномалий митоти
ми актина, на разных стадиях митотического де
ческого веретена в клетках со сниженной
ления, включая цитокинез, эпителиальных кле
экспрессией гамма актина [15]. С другой сторо
ток HaCaT.
ны, оказалось, что организация системы мик
Гамма актин находился в кортексе в течение
ротрубочек также может влиять на систему мик
всех фаз митоза и во время цитокинеза и не
рофиламентов. Наши данные дают основание
участвовал в формировании сократительного
полагать, что транспорт бета актина из базаль
кольца. Снижение экспрессии гамма актина
ной части клетки в кортекс зависит от функцио
вызывало изменение формы митотических кле
нально нормальной системы микротрубочек.
ток и кортикальный блеббинг. Ранее было пока
В конце митоза в клетке происходит реорга
зано, что микроинъекции антител к гамма ак
низация актиновых структур, образуется сокра
тину (но не к бета актину) также вели к значи
тительное кольцо, разделяющее дочерние клет
тельным нарушениям формы ооцитов, дефор
ки и необходимое для прохождения цитокинеза.
мациям кортекса и блеббингу [14]. Бета актин
Сократительное кольцо представляет собой
формировал базальные фибриллы в ранней про
систему актиновых и миозиновых филаментов,
фазе, концентрировался в кортикальной облас
регулируемую RhoA ГТФазой, которая создает
ти в метафазе, концентрировался в экватори
силу, необходимую для деформации плазмати
альной зоне в анафазе и формировал сократи
ческой мембраны и образования перетяжки
тельное кольцо в телофазе и цитокинезе. Учас
между дочерними клетками [22]. Ингибитор мио
тие бета актина в формировании сократитель
зина II, блеббистатин, снижал концентрацию
ного кольца согласуется с нашими предыдущи
бета актина в экваториальной области, но не
ми данными [2] и исследованиями митоза в опу
нарушал сеть гамма актина в анафазных клет
холевых клетках SH EP и HeLa [15, 16]. Фиб
ках HaCaT. В клетках со сниженным количест
риллы бета актина локализовались в базальной
вом бета актина мы наблюдали нарушения ци
части клеток, поэтому мы предполагаем, что
токинеза, и, как следствие, высокий процент
именно бета актин обеспечивал адгезию клеток
многоядерных клеток. Недавно было показано,
к субстрату во время митоза.
что стабилизация и организация клеточной пе
Существует несколько ключевых событий
ретяжки обеспечивается, в частности, концен
митоза, где участие актина играет важную роль.
трацией бета актиновых фибрилл в зоне проте
Одним из таких событий является разделение
кания цитокинеза [16]. Также следует отметить,
центросом. Актиновый цитоскелет необходим
что бета актиновые пучки собираются непосред
для формирования веретена деления [17]. Нару
ственно в области перетяжки с помощью ани
шение функционирования акто миозиновых
лин зависимого пути. Анилин необходим для
структур, деполимеризация актиновых фила
поддержания активного миозина в экваториаль
ментов приводят к ошибкам разделения центро
ной плоскости во время цитокинеза, вероятно,
сом и сборки веретена [18-20]. Появляется все
он функционирует в качестве каркасного белка,
больше доказательств того, что при мейотичес
связывая RhoA с компонентами сократительно
ком делении актин участвует не только в пере
го кольца - актином и миозином [23, 24]. В
движении и позиционировании веретена, но так
асинхронной популяции HeLa после
24 ч
же защищает ооциты от ошибок сегрегации хро
действия миРНК к анилину 40-50% клеток яв
мосом, приводящих к анеуплоидии [21]. Ранее
ляются двуядерными [25].
мы продемонстрировали селективное взаимо
Образование стресс фибрилл и ламеллипо
действие микротрубочек и цитоплазматического
дий происходит под контролем малых ГТФаз,
гамма актина (но не бета актина), опосредован
RhoA и Rac1 соответственно [26]. Сборка и
ное плюс концевым белком микротрубочек EB1
функционирование сократительного кольца
в эпителиальных клетках опухолевых линий [3].
регулируется RhoA [27]. Накопление RhoA в
В данной работе мы показали, что даже умерен
экваториальной области клетки перед началом
ное снижение гамма актина (но не бета актина)
цитокинеза было описано ранее [25, 28]. Мы
вызывало нарушения структуры веретена деле
наблюдали аналогичное повышение концен
ния в эпителиальных клетках при митозе. Ранее
трации RhoA в митотических неопухолевых
было продемонстрировано, что частичная су
клетках HaCaT. Показано, что RhoA активирует
прессия гамма актина усиливает амплификацию
ROCK (Rho associated protein kinase), что, в
центросом в опухолевых клетках и вызывает зна
свою очередь, увеличивает силу сокращения за
чительную задержку на стадии прометафазы/ме
счет фосфорилирования легкой цепи миозина
тафазы. Длительная задержка в прометафазе/ме
[29]. Воздействие селективного ингибитора
тафазе сопровождалась появлением митотичес
ROCK, Y 27632, приводило к разрушению пуч
БИОХИМИЯ том 85 вып. 9 2020
ВЛИЯНИЕ ИЗОФОРМ АКТИНА НА ДЕЛЕНИЕ ЭПИТЕЛИАЛЬНЫХ КЛЕТОК
1283
ков бета актина, не нарушая организацию сети
ванно, через киназы ERK1/2, и управляет дви
гамма актиновых микрофиламентов [2]. Сово
жением ведущего края при расхождении дочер
купность этих данных позволяет предполо
них клеток в цитокинезе.
жить, что белок RhoA необходим для регуля
В данной работе впервые было продемон
ции бета актиновых сократимых структур, но
стрировано распределение цитоплазматических
не гамма актиновой системы микрофиламен
изоформ актина на всех стадиях митотического
тов.
деления, а также показана функциональная взаи
Известно, что малые ГТФазы семейства Rho
мосвязь бета и гамма актиновых структур с
участвуют в передаче сигналов от мембранных
системой микротрубочек в неопухолевых эпите
рецепторов к цитоскелету и адгезионным кон
лиальных клетках. Подводя итоги, оба цито
тактам. ГТФаза Rac1 способствует сборке акти
плазматических актина необходимы для нор
на на периферии клеток с образованием ламел
мального деления клеток, но особый интерес
липодий и раффлов [30]. Ингибитор Rac1,
представляет индивидуальный вклад каждой
NSC23766, подавляет образование протрузий,
изоформы в этапы этого процесса, что, несом
вызывает исчезновение ламелл и ламеллипо
ненно, требует дальнейшего изучения на раз
дий, нарушает кортикальную сеть гамма актина
личных клеточных моделях.
и усиливает образование бета и гамма актино
вых стресс фибрилл в интерфазных клетках [2].
В ооцитах млекопитающих Rac1 регулирует ста
Финансирование. Работа выполнена при фи
бильность мейотического веретена и его «заяко
нансовой поддержке Российского фонда фунда
ривание» в клеточном кортексе [31]. Во время
ментальных исследований (гранты №№ 18 29
телофазы в клетках HaCaT белок Rac1 был рав
09082 и 18 34 00047) и Программы развития
номерно распределен в цитоплазме с некоторой
МГУ (PNR 5.13).
концентрацией на периферии клетки, в районе
Конфликт интересов. Авторы заявляют об от
митотических полюсов его локализация совпа
сутствии конфликта интересов.
дала с расположением гамма актина. Учитывая
Соблюдение этических норм. Настоящая
данные наблюдения и наши предыдущие ре
статья не содержит описания каких либо иссле
зультаты [32, 33], можно предположить, что
дований с участием людей или животных в каче
Rac1 влияет на гамма актиновую сеть опосредо
стве объектов.
СПИСОК ЛИТЕРАТУРЫ
1.
Ampe, C., and Van Troys, M. (2017) Mammalian actins:
Dissecting temporal and spatial control of cytokinesis with
isoform specific functions and diseases, Handb. Exp.
a myosin II inhibitor, Science,
299,
17431747,
Pharmacol., 235, 1 37, doi: 10.1007/164_2016_43.
doi: 10.1126/science.1081412.
2.
Dugina, V., Zwaenepoel, I., Gabbiani, G., Clement, S.,
9. Etienne Manneville, S., and Hall, A. (2002) Rho GTPases
Chaponnier, C., Clément, S., and Chaponnier, C. (2009)
in cell biology, Nature, 420, 629635, doi: 10.1038/
Beta and gamma cytoplasmic actins display distinct distri
nature01148.
bution and functional diversity, J. Cell Sci., 122, 2980
10. Bement, W. M., Miller, A. L., and Von Dassow, G. (2006)
2988, doi: 10.1242/jcs.041970.
Rho GTPase activity zones and transient contractile arrays,
3.
Dugina, V., Alieva, I., Khromova, N., Kireev, I., Gunning,
BioEssays, 28, 983 993, doi: 10.1002/bies.20477.
P. W., and Kopnin, P. (2016) Interaction of microtubules
11. Xiao, H., Verdier Pinard, P., Fernandez Fuentes, N.,
with the actin cytoskeleton via cross talk of EB1 contain
Burd, B., Angeletti, R., Fiser, A., Horwitz, S. B., and Orr,
ing +TIPs and γ actin in epithelial cells, Oncotarget, 7,
G. A. (2006) Insights into the mechanism of microtubule
72699 72715, doi: 10.18632/oncotarget.12236.
stabilization by taxol, Proc. Natl. Acad. Sci. USA, 103,
4.
Dogterom, M., and Koenderink, G. H.
(2019)
10166 10173, doi: 10.1073/pnas.0603704103.
Actin-microtubule crosstalk in cell biology, Nat. Rev.
12. Borisy, G. G., and Taylor, E. W. (1967) The mechanism of
Mol. Cell Biol., 20, 3854, doi: 10.1038/s41580 018
action of colchicine. Colchicine binding to sea urchin eggs
0067 1.
and the mitotic apparatus, J. Cell Biol., 34, 535 548,
5.
Boukamp, P., Petrussevska, R. T., Breitkreutz, D.,
doi: 10.1083/jcb.34.2.535.
Hornung, J., Markham, A., and Fusenig, N. E. (1988)
13. Borisy, G. G., and Taylor, E. W. (1967) The mechanism
Normal keratinization in a spontaneously immortalized
action of colchicine. Binding of colchincine 3H to cellular
aneuploid human keratinocyte cell line, J. Cell Biol., 106,
protein, J. Cell Biol., 34, 525 533, doi: 10.1083/jcb.34.2.525.
761 771, doi: 10.1083/jcb.106.3.761.
14. Brockmann, C., Huarte, J., Dugina, V., Challet, L., Rey, E.,
6.
Kovács, M., Tóth, J., Hetényi, C., Málnási Csizmadia, A.,
Conne, B., Swetloff, A., Nef, S., Chaponnier, C., and
and Sellers, J. R. (2004) Mechanism of blebbistatin inhibi
Vassalli, J. D. (2011) Beta and gamma cytoplasmic actins
tion of myosin II, J. Biol. Chem., 279, 35557 35563,
are required for meiosis in mouse oocytes, Biol. Reprod.,
doi: 10.1074/jbc.M405319200.
85, 1025 1039, doi: 10.1095/biolreprod.111.091736.
7.
Alberts, B., Johnson, A., Lewis, J., Raff, M., Roberts, K.,
15. Po’uha, S. T., and Kavallaris, M. (2015) Gamma actin is
and Walter, P. (2008) Cytokinesis, in Molecular Biology of
involved in regulating centrosome function and mitotic
the Cell, 5th Edn., Garland Science, New York, pp. 1092
progression in cancer cells, Cell Cycle, 14, 3908 3919,
1093.
doi: 10.1080/15384101.2015.1120920.
8.
Straight, A. F., Cheung, A., Limouze, J., Chen, I.,
16. Chen, A., Arora, P. D., McCulloch, C. A., and Wilde, A.
Westwood, N. J., Sellers, J. R., and Mitchison, T. J. (2003)
(2017) Cytokinesis requires localized β actin filament pro
БИОХИМИЯ том 85 вып. 9 2020
10*
1284
ШАГИЕВА и др.
duction by an actin isoform specific nucleator, Nat.
26. Ridley, A. J., and Hall, A. (1992) The small GTP binding
Commun., 8, 1530, doi: 10.1038/s41467 017 01231 x.
protein Rho regulates the assembly of focal adhesions and
17.
Sandquist, J. C., Kita, A. M., and Bement, W. M. (2011)
actin stress fibers in response to growth factors, Cell, 70,
And the dead shall rise: actin and myosin return to the
389 399, doi: 10.1016/0092 8674(92)90163 7.
spindle, Dev. Cell, 21, 410 419, doi: 10.1016/j.devcel.
27. Wagner, E., and Glotzer, M. (2016) Local RhoA activation
2011.07.018.
induces cytokinetic furrows independent of spindle posi
18.
Uzbekov, R., Kireyev, I., and Prigent, C.
(2002)
tion and cell cycle stage, J. Cell Biol., 213, 641 649,
Centrosome separation: respective role of microtubules
doi: 10.1083/jcb.201603025.
and actin filaments, Biol. Cell, 94, 275 288, doi: 10.1016/
28. Takaishi, K., Sasaki, T., Kameyama, T., Tsukita, S.,
s0248 4900(02)01202 9.
Tsukita, S., and Takai, Y. (1995) Translocation of activated
19.
Lancaster, O., LeBerre, M., Dimitracopoulos, A.,
Rho from the cytoplasm to membrane ruffling area,
Bonazzi, D., Zlotek Zlotkiewicz, E., Picone, R., Duke, T.,
cell-cell adhesion sites and cleavage furrows, Oncogene,
Piel, M., and Baum, B. (2013) Mitotic rounding alters cell
11, 39 48.
geometry to ensure efficient bipolar spindle formation,
29. Kosako, H., Yoshida, T., Matsumura, F., Ishizaki, T.,
Dev. Cell, 25, 270 283. doi: 10.1016/j.devcel.2013.03.014.
Narumiya, S., and Inagaki, M. (2000) Rho kinase/ROCK
20.
Rosenblatt, J., Cramer, L. P., Baum, B., and McGee, K. M.
is involved in cytokinesis through the phosphorylation of
(2004) Myosin II dependent cortical movement is required
myosin light chain and not ezrin/radixin/moesin proteins
for centrosome separation and positioning during mitotic
at the cleavage furrow, Oncogene,
19,
60596064,
spindle assembly, Cell, 117, 361 372, doi: 10.1016/S0092
doi: 10.1038/sj.onc.1203987.
8674(04)00341 1.
30. Hall, A., and Nobes, C. D. (2000) Rho GTPases: molecu
21.
Mogessie, B., and Schuh, M. (2017) Actin protects mam
lar switches that control the organization and dynamics of
malian eggs against chromosome segregation errors,
the actin cytoskeleton, Philos. Trans. R. Soc. Lond. B Biol.
Science, 357, eaal1647, doi: 10.1126/science.aal1647.
Sci., 355, 965 970, doi: 10.1098/rstb.2000.0632.
22.
Jordan, S. N., and Canman, J. C. (2012) Rho GTPases in ani
31. Halet, G., and Carroll, J. (2007) Rac activity is polarized
mal cell cytokinesis: an occupation by the one percent,
and regulates meiotic spindle stability and anchoring in
Cytoskeleton (Hoboken), 69, 919 930, doi: 10.1002/cm. 21071.
mammalian oocytes, Dev. Cell,
12,
309317,
23.
Chen, X., Wang, K., Svitkina, T., and Bi, E. (2020) Critical
doi: 10.1016/j.devcel.2006.12.010.
roles of a RhoGEF anillin module in septin architectural
32. Dugina, V., Khromova, N., Rybko, V., Blizniukov, O.,
remodeling during cytokinesis, Curr. Biol., 30,
1477
Shagieva, G., Chaponnier, C., Kopnin, B., and Kopnin, P.
1490.e3, doi: 10.1016/j.cub.2020.02.023.
(2015) Tumor promotion by γ and suppression by β non
24.
Svitkina, T. (2018) The actin cytoskeleton and actin based
muscle actin isoforms, Oncotarget,
6,
1455614571,
motility, Cold Spring Harb. Perspect. Biol., 10, a018267,
doi: 10.18632/oncotarget.3989.
doi: 10.1101/cshperspect.a018267.
33. Dugina, V., Shagieva, G., Khromova, N., and Kopnin, P.
25.
Piekny, A. J., and Glotzer, M. (2008) Anillin is a scaffold
(2018) Divergent impact of actin isoforms on cell cycle reg
protein that links RhoA, actin, and myosin during cytokine
ulation, Cell Cycle, 17, 2610 2621, doi: 10.1080/15384101.
sis, Curr. Biol., 18, 30 36, doi: 10.1016/j.cub.2007. 11.068.
2018.1553337.
DIVERGENT IMPACT OF ACTIN ISOFORMS ON CELL DIVISION
OF EPITHELIAL CELLS*
G. S. Shagieva1, I. B. Alieva1,2**, C. Chaponnier3, and V. B. Dugina1
1 Belozersky Institute of Physico Chemical Biology, Lomonosov Moscow State University,
119992 Moscow, Russia; E mail: irina_alieva@belozersky.msu.ru
2 Federal Research and Clinical Center of Physical Chemical Medicine of the Federal Medical
and Biological Agency (FMBA), 119435 Moscow, Russia
3 Department of Pathology and Immunology, Faculty of Medicine, University of Geneva,
1205 Geneva, Switzerland; E mail: Christine.Chaponnier@unige.ch
Received June 23, 2020
Revised July 22, 2020
Accepted July 25, 2020
We investigated distribution and functions of beta and gamma cytoplasmic actins (CYAs) at different stages of non
neoplastic epithelial cell division using laser scanning microscopy (LSM). Here, we demonstrated that beta and
gamma CYAs are spatially segregated in the early prophase, anaphase, telophase, and cytokinesis. Small interfering
RNA (siRNA) experiments revealed that in both beta CYA and gamma CYA depleted cells, the number of cells was
significantly reduced compared with the siRNA controls. Beta CYA depletion resulted in an enlargement of the cell
area in metaphase and high percentage of polynuclear cells compared with the siRNA control, indicating a potential
failure of cytokinesis. Gamma CYA depletion resulted in a reduced percentage of mitotic cells. We also observed the
interdependence between the actin isoforms and the microtubule system in mitosis: (i) a decrease in the gamma CYA
led to impaired mitotic spindle organization; (ii) suppression of tubulin polymerization caused impaired beta CYA
reorganization, as incubation with colcemid blocked the transfer of short beta actin polymers from the basal to the
cortical compartment. We conclude that both actin isoforms are essential for proper cell division, but each isoform
has its own specific functional role in this process.
Keywords: cytoplasmic actin, mitosis, microtubules, cell division
БИОХИМИЯ том 85 вып. 9 2020