БИОХИМИЯ, 2020, том 85, вып. 9, с. 1294 - 1304
УДК 577.24
УЛЬТРАСТРУКТУРА ГЕПАТОЦИТОВ ЛАБОРАТОРНЫХ МЫШЕЙ
ПРИ СОДЕРЖАНИИ ЖИВОТНЫХ НА СТАНДАРТНОЙ
СУХОЙ ЛАБОРАТОРНОЙ ДИЕТЕ*
© 2020
В.Б. Вайс1, И.М. Вангели1, О.А. Аверина1, М.Л. Ловать2, Л.Е. Бакеева1**
1 НИИ физико химической биологии имени А.Н. Белозерского, Московский государственный университет
имени М.В. Ломоносова, 119991 Москва, Россия; электронная почта: bakeeva@belozersky.msu.ru
2 Московский государственный университет имени М.В. Ломоносова,
биологический факультет, 119234 Москва, Россия
Поступила в редакцию 07.07.2020
После доработки 07.07.2020
Принята к публикации 18.07.2020
Исследование ультраструктуры гепатоцитов печени, проведенное методом трансмиссионной электронной
микроскопии, показало, что у лабораторных мышей, содержавшихся в различных вивариях в г. Москва и
получавших питание в виде сухой лабораторной диеты отечественных производителей, не имеющей стан$
дартизации по исходным продуктам, развиваются значительные деструктивные изменения гепатоцитов.
При этом нарушения в ультраструктуре паренхимных клеток печени происходят вне зависимости от стату$
са животного (SPF или конвенциональные), условий различных вивариев, а также производителя корма. В
то же время ультраструктурное исследование гепатоцитов печени мышей, содержавшихся в питомнике
«Charles River» (Германия) и получавших корм фирмы «Altromin Spezialfutter» («GmbH&Co», Германия), ис$
пользующих входной контроль качества ингредиентов, не выявило деструктивных нарушений во внутрен$
ней ультраструктуре гепатоцитов. Однако если эти мыши в дальнейшем получали корм, произведенный в
России, нарушения структуры клеток печени развивались уже через 2 месяца. Таким образом, питание су$
хими кормами отечественных производителей неуказанного состава вызывает у контрольных животных
значительные изменения в ультраструктуре гепатоцитов, отражающие развитие патологических процессов
в организме.
КЛЮЧЕВЫЕ СЛОВА: митохондрии, гепатоциты, ультраструктура, мыши, стандартная лабораторная диета.
DOI: 10.31857/S0320972520090092
ВВЕДЕНИЕ
ра клеток печени была описана Dalton et al. [1] и
Fawcett et al. [2], однако классической считается
Печень - самая крупная железа пищевари$
работа Bruni и Porter [3], в которой, используя
тельной системы, выполняющая множество
различные методы фиксации ткани печени, ав$
важнейших функций. Ткани печени стали одни$
торами были показаны особенности ультраст$
ми из первых для широкого изучения методом
руктуры гепатоцитов, остающиеся мировым
электронной микроскопии. Благодаря быстро$
стандартом до настоящего времени. В печени
му прогрессу этого метода был накоплен огром$
различают строму и паренхиму, представленную
ный материал, касающийся ультратонкого стро$
эпителиальными клетками - гепатоцитами. Па$
ения ткани печени. Ультраструктура гепатоци$
ренхимные клетки печени млекопитающих по$
тов была подробно изучена в ряде классических
лигональной формы, на срезах они имеют неп$
работ 50-60 гг. ХХ века. Впервые ультраструкту$
равильно$гексагональную форму с нечетко вы$
раженными углами. Цитоплазматическая мемб$
рана гепатоцита образует многочисленные вы$
Принятые сокращения: ВЭК - испытательный
центр «Виварно$Экспериментальный Комплекс» ООО
росты - микроворсинки, которые увеличивают
«НИИ Митоинженерии МГУ»; ИВК - индивидуально
функционально$активную площадь клетки. На
вентилируемая клетка; НАЖБП - неалкогольная жировая рис. 1, а и б представлена ультраструктура гепа$
болезнь печени; SPF статус - животные, свободные от тоцитов в норме. Они характеризуются округ$
специфических патогенов; ЭПР - эндоплазматический
ретикулум; агЭПР - агранулярный ЭПР; грЭПР - грану$
лыми ядрами, окруженными двумембранной
лярный ЭПР.
оболочкой и прерывающими ее непрерывность
* Статья представлена главным редактором акад. В.П. Ску$
ядерными порами. Ядра имеют ядрышки и зоны
лачёвым.
гетеро$ и эухроматина. Цитоплазма содержит
** Адресат для корреспонденции.
большое количество отдельных митохондрий,
1294
УЛЬТРАСТРУКТУРА ГЕПАТОЦИТОВ МЫШЕЙ НА СУХОЙ ДИЕТЕ
1295
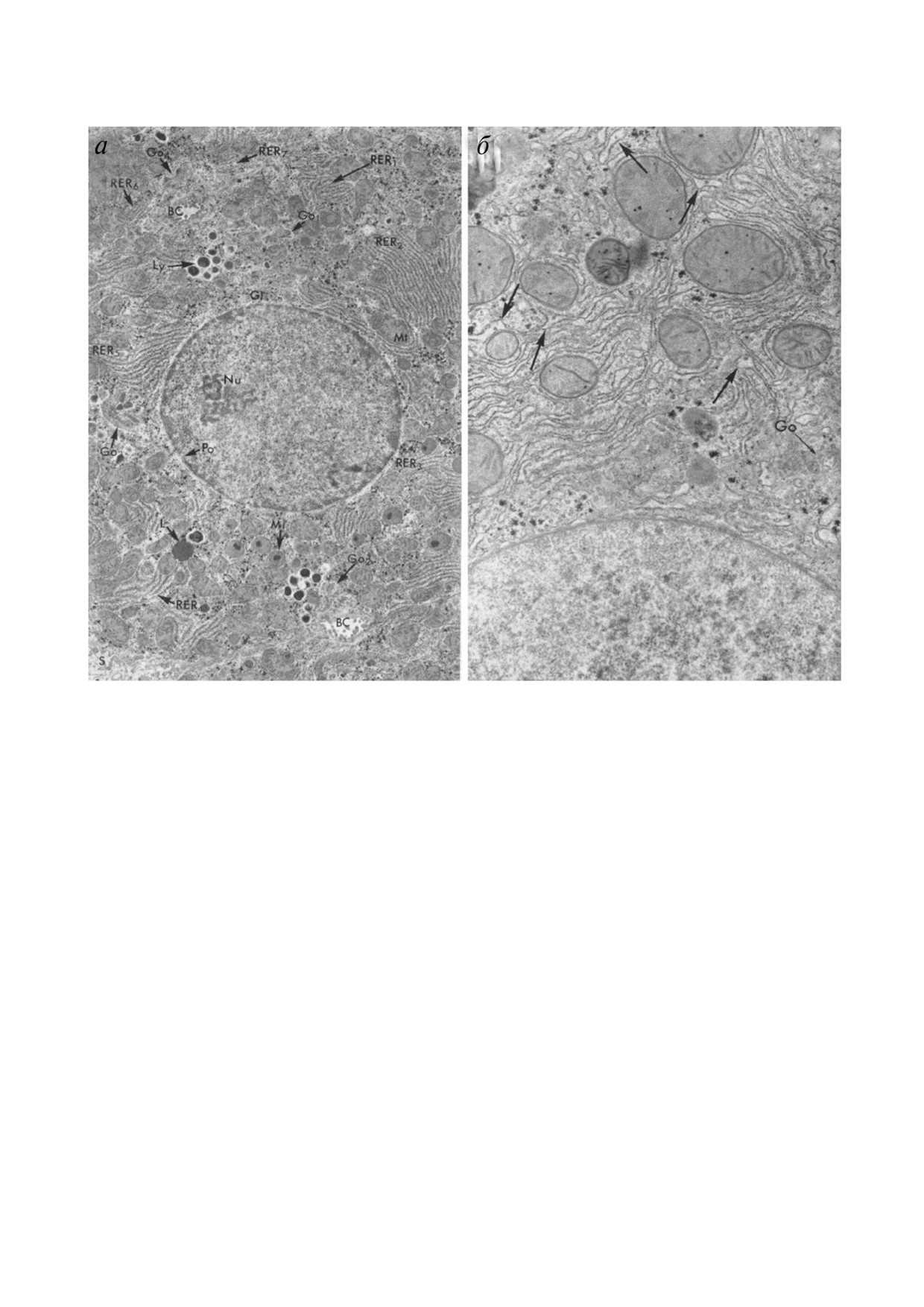
Рис. 1. Ультраструктура гепатоцитов, являющаяся общепринятым мировым стандартом (по Bruni и Porter [3]). а - Обзор$
ная картина. (Nu) - ядро с ядерной порой (Ро). В цитоплазме видны комплексы грЭПР (RER1-RER7), митохондрии (Мt),
мембраны аппарата Гольджи (Go1, Go2, Go3, Go4), частицы гликогена (Gl), лизосомы (Ly), липидные включения (L), мик$
ротельца (Mi), желчные протоки (ВС) и синусоид (S). Увеличение 10 200 ×; б - участок паренхимной клетки печени кры$
сы при большем увеличении. Стрелками показаны цистерны грЭПР. (Go) - аппарат Гольджи. Увеличение 22 000 × (по
Bruni и Porter [3])
много рибосом, гранулы гликогена и цистерны
Одна из важнейших функций гепатоцитов -
эндоплазматического ретикулума (ЭПР), прос$
детоксикация токсичных веществ - связана с
тирающиеся по всей цитоплазме. Мембраны
агЭПР. Метаболизм углеводов также связан с
ЭПР всегда окружают митохондрии, которыми
агЭПР. В цистернах грЭПР синтезируются аль$
изобилует цитоплазма гепатоцитов (их число в
бумины, фибриноген и глобулины плазмы кро$
одной клетки превышает 1000), а также контак$
ви; аппарат Гольджи отвечает за завершение
тируют с мембранами аппарата Гольджи [3].
синтетических процессов [4].
ЭПР состоит из двух частей: зернистой (грану$
Известно, что любые изменения в работе ге$
лярной) и гладкой (агранулярной). В норме гра$
патоцитов, в том числе вызванные развитием
нулярная часть ЭПР гораздо более развита, чем
патологических процессов в организме, отража$
агранулярная. Гранулярный ЭПР (грЭПР) имеет
ются на состоянии ультраструктуры гепатоци$
вид стопок (до 20) уплощенных цистерн, кото$
тов. Так, при детоксикации токсических ве$
рые по отдельности имеют слегка изогнутую
ществ, согласно литературным данным, агЭПР
форму и расположены параллельно друг другу.
сильно разрастается, заполняя собой всю ци$
ГрЭПР в клетках печени крысы непрерывен с
топлазму [4-8]. При этом после удаления токси$
агранулярным ЭПР (агЭПР). Мембраны агЭПР
ческих веществ избыток сети агЭПР уничтожа$
расположены вблизи цитоплазматической
ется путем аутофагии [7]. При внепеченочном
мембраны гепатоцитов.
холестазе [6] после введения гепатотоксических
БИОХИМИЯ том 85 вып. 9 2020
1296
ВАЙС и др.
и канцерогенных веществ, таких как фенобар$
бораторных животных, потребляющих корма
битал [4], этионин [7] и дубильная кислота [8],
российских производителей, в том числе об
наблюдается различная степень гипертрофии
ультраструктуре гепатоцитов, в литературе нет.
агЭПР. Многие из перечисленных соединений
Мы провели исследование ультраструктуры ге$
вызывают такие деструктивные изменения ге$
патоцитов лабораторных животных, питавших$
патоцитов, как увеличение просвета цистерн,
ся сухими кормами различных российских про$
потеря взаимнопараллельного расположения
изводителей в условиях различных вивариев, а
мембран грЭПР, набухание митохондрий. Пока$
также сравнение с ультраструктурой клеток пе$
зано, что гепатит С, вирусное инфекционное за$
чени мышей, получавших корм европейского
болевание, поражающее печень, может разви$
производителя.
ваться бессимптомно годами, пока поражение
печени не достигнет критического уровня [9].
При этом вирус гепатита С вызывает значитель$
МАТЕРИАЛЫ И МЕТОДЫ
ные изменения ультраструктуры гепатоцитов. В
клетках развивается «цитоплазматическая дис$
Работа выполнена на взрослых мышах сам$
социация» - дистрофические изменения гепа$
цах, потреблявших различные виды кормов. В
тоцитов: набухание клеток с разрежением ци$
работе были использованы следующие живот$
топлазмы, набухание митохондрий, гиперпла$
ные:
зия агЭПР, гипертрофия аппарата Гольджи и
- мыши гибриды F1 (C57Bl/6xCBA) SPF ста$
деструктивные изменения ядер [9, 10].
туса (животные свободные от специфических
Одним из самых широко распространенных
патогенов) в возрасте 3 мес. (n = 5), получавшие
заболеваний печени в мире в настоящее время
автоклавированный корм «Чара» (ООО «Ассор$
признан жировой гепатоз (стеатоз) или неалко$
тимент$АГРО», Россия), содержались в индиви$
гольная жировая болезнь печени (НАЖБП) -
дуально вентилируемых клетках (ИВК) по 5-8
это состояние, при котором более 5% массы пе$
голов в каждой в условиях испытательного
чени составляет жир, преимущественно тригли$
центра виварно$экспериментального комплекса
цериды. НАЖБП прогрессирует до фиброза и
ООО «НИИ Митоинженерии МГУ» (ВЭК);
цирроза печени [11]. Предполагают, что патоге$
- мыши гибриды F1 (C57Bl/6xCBA) SPF ста$
нез НАЖБП может быть связан с инсулиноре$
туса в возрасте 1 мес. (n = 5), получавшие авток$
зистентностью [12, 13]; развитие патологии воз$
лавированный корм «ЛБК$120_106104» («Тос$
можно в результате использования неправиль$
ненский комбикормовый завод», Россия), со$
ного рациона питания, в котором наблюдается
держались в ИВК по 5-8 голов в каждой в усло$
преобладание жиров и углеводов. При НАЖБП
виях ВЭК;
в клетках паренхимы печени происходят значи$
- мыши С57Bl/6 SPF статуса в возрасте
тельные нарушения ультраструктуры гепатоци$
3 мес. (n = 3), получавшие автоклавированный
тов: накопление липидных включений, набуха$
корм «Чара» (ООО «Ассортимент$АГРО», Рос$
ние митохондрий, нарушение структуры ЭПР
сия), содержались в ИВК по 5-8 голов в каждой
[14-16]. В экспериментальных условиях
в условиях вивария в лаборатории Трансляцион$
НАЖБП вызывается при кормлении лаборатор$
ной медицины факультета фундаментальной
ных животных сухими кормами с измененным
медицины МГУ имени М.В. Ломоносова;
составом - увеличенным содержанием холесте$
- мыши С57Bl/6 в возрасте 1 мес. (n = 3);
рола и (или) фруктозы [14-16].
конвенциональные животные содержались в
В настоящее время в отечественных вивари$
комнате для передержки животных кафедры
ях лабораторные животные получают стандарт$
физиологии человека и животных биологичес$
ную лабораторную диету в виде сухих кормов
кого факультета МГУ имени М.В. Ломоносова и
преимущественно российских производителей.
получали лабораторный корм OOO «Лаборатор$
Состав кормов регламентируется госстандартом
корм», Россия;
«ГОСТ Р 50258$92 от 1992 г.» [17]. В то время как
- мыши стока CD$1 SPF статуса в возрасте
в зарубежных кормах полностью регламентиру$
1 мес. (n = 5), питомник «Charles River» (Герма$
ется белковый, углеводный, жировой, микро$
ния), поставщик в Россию - ООО «ЛБИ», полу$
элементный и витаминный состав, включая сос$
чавшие корм фирмы «Altromin Spezialfutter»
тав аминокислот, российские производители
(«GmbH&Co», Германия);
указывают только сырье, из которого изготавли$
- мыши стока CD$1 SPF статуса в возрасте
вают корма. Это допускает наличие в корме не$
3 мес. (n = 5). Первый месяц жизни животные
контролируемых, не подлежащих мониторингу
содержались в условиях питомника «Charies
компонентов. При этом данных о детальных ис$
River» (Германия) и получали корм фирмы
следованиях состояния тканей контрольных ла$
«Altromin Spezialfutter» (GmbH&Co, Германия);
БИОХИМИЯ том 85 вып. 9 2020
УЛЬТРАСТРУКТУРА ГЕПАТОЦИТОВ МЫШЕЙ НА СУХОЙ ДИЕТЕ
1297
второй и третий месяцы жизни мыши содержа$
Reynolds
[18]. Исследование проводили на
лись в ИВК по 5-8 голов в каждой в условиях
электронном микроскопе JEM$1400 («Jeol»,
ВЭК, питались лабораторным кормом «ЛБК$
Япония).
120_106104» («Тосненский комбикормовый за$
вод», Россия).
Корм и вода были предоставлены в свобод$
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
ном доступе, при световом режиме 12/12 и тем$
пературе воздуха 20-24 °С. В качестве подстила
На рис. 2 представлена обзорная картина
использовали деревянную щепу Safe BK 8/15
ультраструктуры гепатоцитов мышей гибридов
(«JRS», Германия). Все материалы, поступавшие
F1 (C57Bl/6xCBA) SPF статуса в возрасте 3 мес.,
к животным, содержавшимся в ИВК, были сте$
содержавшихся в ИВК в условиях ВЭК и полу$
рилизованы. Эвтаназию мышей проводили де$
чавших автоклавированный корм «Чара». Мож$
капитацией, отбор и фиксацию тканей прово$
но видеть, что общая структура паренхимной
дили в течение 1 мин после декапитации.
ткани печени не нарушена. Отсутствуют приз$
Для электронно$микроскопического иссле$
наки набухания, мембраны клеток гепатоцитов
дования образцы фиксировали раствором глута$
плотно прилегают друг к другу, видны желчные
рового альдегида в фосфатном буфере (концент$
канальцы. В клетках присутствуют жировые
рация 3%), рН 7,4 в течение 2 ч при 4 °С; затем
капли, но их число невелико. Однако при отсут$
дофиксировали 1%$ным раствором четырёхоки$
ствии признаков нарушения общей структуры
си осмия в фосфатном буфере в течение 1,5 ч и
паренхимной ткани параметры внутренней
обезвоживали в растворах спиртов с возрастаю$
ультраструктуры гепатоцитов значительно отли$
щей концентрацией спирта - 50; 60; 70; 96 и
чались от установленных в классических рабо$
100%. Материал заливали в эпоксидную смолу
тах стандартов. На рис. 2 показаны обширные
Эпон$812. Серийные ультратонкие срезы делали
пространства внутри клеток, «свободные» от ор$
алмазным ножом на ультрамикротоме Leica
ганелл, все клеточные органеллы оказываются
ULTRACUT UCT («Leica», Германия). Срезы
зажаты между электронно$светлыми областями.
контрастировали в цитрате свинца по методу
На рис. 3 при большем увеличении видно, что
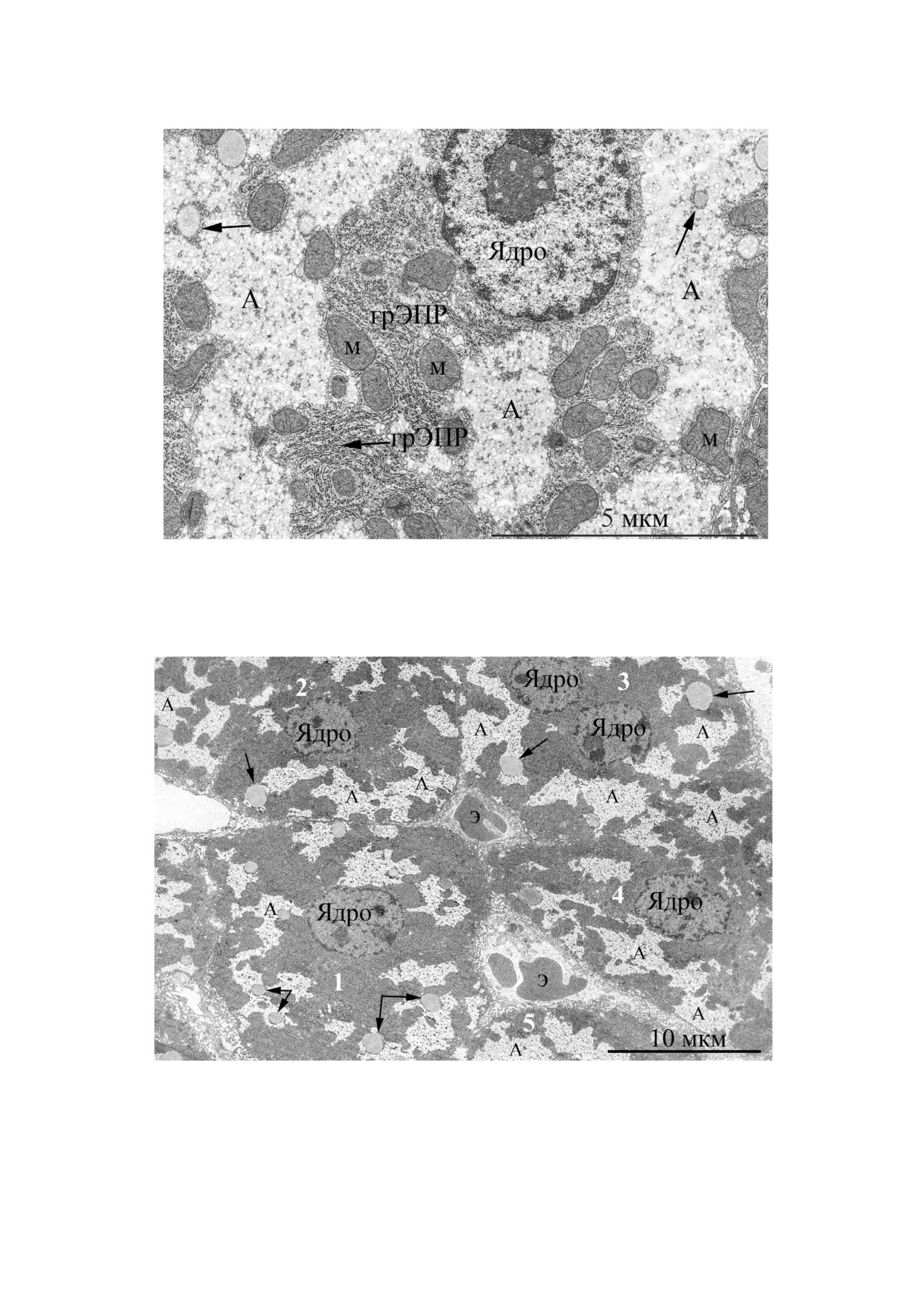
Рис. 2. Ультраструктура гепатоцитов мыши гибрида F1 (C57Bl/6xCBA) SPF статуса в возрасте 3 мес., содержавшейся в
ИВК в условиях ВЭК и получавшей автоклавированный корм «Чара». На фотографии можно видеть 4 гепатоцита (пока$
заны цифрами 1-4). Стрелками показаны жировые капли. В клетках видны обширные пространства внутри клеток, за$
полненные аморфным веществом (А); ЖК - желчный каналец
11 БИОХИМИЯ том 85 вып. 9 2020
1298
ВАЙС и др.
Рис. 3. Фрагмент паренхимной клетки печени мыши гибрида F1 (C57Bl/6xCBA) SPF статуса в возрасте 3 мес., содержав$
шейся в ИВК в условиях ВЭК и получавшей автоклавированный корм «Чара». Митохондрии продолговатой или округ$
лой формы (М), окруженные хаотично расположенными мембранами грЭПР, зажаты между электронно$светлыми облас$
тями, заполнены аморфным веществом (А). Стрелками показаны жировые капли
Рис. 4. Обзорная фотография гепатоцитов мыши С57Вl/6 SPF статуса в возрасте 3 мес., содержавшейся в условиях в ла$
боратории Трансляционной медицины факультета фундаментальной медицины МГУ имени М.В. Ломоносова и получав$
шей лабораторный корм «Чара». Видны 5 паренхимных клеток печени (показаны цифрами 1-5), расположенные между
ними капилляры с эритроцитами (Э) внутри. Во всех гепатоцитах присутствуют свободные от клеточных органелл элект$
ронно$светлые области (А). Стрелками показаны жировые капли
БИОХИМИЯ том 85 вып. 9 2020
УЛЬТРАСТРУКТУРА ГЕПАТОЦИТОВ МЫШЕЙ НА СУХОЙ ДИЕТЕ
1299
эти участки заполнены аморфным веществом и
шей SPF статуса, потреблявших корм «Чара»,
не являются результатом набухания. При этом
вне зависимости от места содержания, внутрен$
внутренняя ультраструктура цитоплазматичес$
няя ультраструктура гепатоцитов печени была
ких органелл соответствует норме: можно ви$
значительно нарушена.
деть многочисленные митохондрии продолгова$
В дальнейших исследованиях мы снизили
той или округлой формы, окруженные мембра$
возраст исследуемых мышей и изменили лабора$
нами грЭПР. Комплексы мембран грЭПР рас$
торный корм, получаемый животными. Мы взя$
положены хаотично и сконцентрированы вок$
ли образцы печени у мышей гибридов F1 (C57Bl/
руг митохондрий.
6xCBA) SPF статуса в возрасте не 3, а 1 мес., со$
Кроме мышей, содержавшихся в условиях
державшихся в ИВК в условиях ВЭК и получав$
ВЭК, мы исследовали ультраструктуру гепато$
ших автоклавированный корм «ЛБК$120_106104».
цитов мышей С57Вl/6 SPF статуса, содержав$
Также как и у предыдущих групп животных, у
шихся в условиях вивария в лаборатории Транс$
этих мышей на малом увеличении можно было
ляционной медицины факультета фундамен$
видеть, что общая структура ткани печени не на$
тальной медицины МГУ имени М.В. Ломоносо$
рушена. Как и в предыдущих группах животных,
ва и получавших тот же лабораторный корм
в ткани печени отсутствовали признаки набуха$
«Чара». На рис. 4 видно, что у этой группы жи$
ния. Однако на большем увеличении видно, что
вотных общая структура паренхимной ткани
гепатоциты мышей, получавших корм «ЛБК$
также не нарушена, хорошо видны границы со$
120_106104», также как и предыдущие группы
седних гепатоцитов, видны эндотелиальные
мышей, имеют существенные отличия от клас$
клетки капилляров. Однако и у этих животных
сических представлений о структуре паренхим$
во всех гепатоцитах присутствуют свободные от
ных клеток печени в норме (рис. 5). В гепатоци$
клеточных органелл электронно$светлые облас$
тах присутствуют свободные от органелл прост$
ти. Как и в предыдущей группе животных, все
ранства, заполненные электронно$светлым
внутриклеточные органеллы оказываются зажа$
аморфным содержимым. Митохондрии продол$
ты в узких тяжах цитоплазмы, расположенных
говатой и округлой формы с немногочисленны$
между этими обширными зонами, заполненны$
ми кристами окружены комплексами мембран
ми аморфным веществом. Таким образом, у мы$
грЭПР, не имеющими правильной упаковки.
Рис. 5. Особенности внутренней ультраструктуры гепатоцита мыши гибрида F1 (C57Bl/6xCBA) SPF статуса в возрасте
1 мес., содержавшейся в условиях ВЭК и получавшей автоклавированный корм «ЛБК$120_106104». Видны свободные от
органелл пространства, заполненные электронно$светлым аморфным содержимым (А). Митохондрии продолговатой и
округлой формы с немногочисленными кристами (М) окружены комплексами мембран грЭПР, на периферии клетки
можно видеть мембраны агЭПР. ЖК - желчный каналец
БИОХИМИЯ том 85 вып. 9 2020
11*
1300
ВАЙС и др.
У конвенциональных мышей С57Вl/6 в воз$
ренней ультраструктуре гепатоцитов. При этом
расте 1 мес., содержавшихся в комнате пере$
нарушения в ультраструктуре клеток печени
держки биологического факультета МГУ и полу$
наблюдаются вне зависимости от статуса живот$
чавших лабораторный корм OOO «Лаборатор$
ного (SPF или конвенциональные), вне зависи$
корм», выявлены значительные изменения внут$
мости от условий вивария, а также вне зависи$
ренней ультраструктуры гепатоцитов, полностью
мости от производителя корма (аналогичные
совпадающие с описанными выше (рис. 6).
результаты были получены нами и для крыс
С целью проверки предположения о влия$
Wistar). При этом ультраструктурное исследова$
нии корма на структуру гепатоцитов мы иссле$
ние гепатоцитов печени мышей, содержавших$
довали образцы печени мышей стока CD$1 SPF
ся в питомнике «Charles River» и получавших
статуса в возрасте 1 мес., полученных непосред$
корм «Altromin Spezialfutter», не выявило пато$
ственно из питомника «Charies River». Живот$
логических нарушений во внутренней ультра$
ные исследованной нами группы получали
структуре клеток. Однако если этих мышей в
только корм фирмы «Altromin Spezialfutter».
дальнейшем переводили на корм, произведен$
Ультраструктура гепатоцитов таких мышей со$
ный в России, нарушения структуры клеток пе$
ответствовала общепринятым электронно$мик$
чени развивались уже через 2 мес.
роскопическим данным. На рис. 7 представлена
Следует отметить, что в настоящее время в
ультраструктура гепатоцитов этой группы мы$
достаточном числе работ по исследованию пече$
шей на малом увеличении. Видно, что гепатоци$
ни приводятся электронно$микроскопические
ты имеют неправильно$гексагональную форму,
фотографии. При этом на контрольных фото$
равномерно заполнены цитоплазматическим
графиях гепатоцитов здоровых особей в отдель$
содержимым. Округлые ядра расположены в
ных работах можно видеть изменения, анало$
центральной части гепатоцита, цитоплазма кле$
гичные найденным нами. Более того, картина
ток изобилует органеллами. На рис. 8 - ультра$
гепатоцитов с деструктивными признаками
структура гепатоцита на большем увеличении.
приводится в качестве контроля не только в ра$
Многочисленные митохондрии овальной или
ботах, выполненных на лабораторных живот$
округлой формы равномерно расположены по
ных, но и на человеке. Так, в работе Falconet et al.
всей цитоплазме гепатоцита. Хорошо развит
проводилось исследование ультраструктуры ге$
грЭПР: видны стопки параллельно расположен$
патоцитов людей с хроническим гепатитом С
ных мембран с находящимися на наружной
[10]. Видно, что на контрольной фотографии ге$
мембране многочисленными осмиофильными
патоцита, полученного из материала биопсии
гранулами диаметром 12-15 нм - рибосомами.
здорового человека, присутствуют обширные
Мембраны агЭПР находятся вблизи плазмати$
пространства внутри клеток, «свободные» от ор$
ческой мембраны гепатоцита.
ганелл, заполненные аморфным веществом,
После прибытия из питомника «Charies
грЭПР и митохондрии оказываются зажаты в уз$
River» в возрасте 1 мес. (статус SPF) оставшиеся
ких тяжах цитоплазмы. В работе Silva et al. про$
мыши данной группы содержались в течение
водилось исследование изменений печени при
2 мес. в ИВК в условиях ВЭК, где питались ла$
развитии стеатоза у детей [19]. В качестве конт$
бораторным кормом «ЛБК$120_106104». В воз$
рольной группы также были взяты дети в возрас$
расте 3 мес. нами были взяты образцы печени
те от 1 года до 14 лет с нормальным физическим
таких животных. Как видно из рис. 9, у таких
развитием. Однако и в этом случае на представ$
животных за 2 мес. развивались значительные
ленных контрольных электронно$микроскопи$
нарушения внутренней ультраструктуры гепато$
ческих фотографиях гепатоцитов можно видеть
цитов, соответствующие деструктивным изме$
в клетках пространства свободные от органелл и
нениям, выявленным у других животных, содер$
значительные изменения цитоплазматического
жавшихся на кормах отечественных производи$
содержимого. Таким образом, даже у людей без
телей (рис. 2-6).
явных признаков патологии выявляются анало$
гичные деструктивные изменения в печени.
Можно предположить, что такие нарушения мо$
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
гут быть связаны с неправильным питанием.
Ультраструктурные нарушения гепатоцитов,
Таким образом, наше исследование показа$
соответствующие описанным нами, в литерату$
ло, что у всех групп лабораторных мышей, со$
ре встречаются в работах по исследованию
державшихся в различных вивариях в г. Москва
действия диет с высоким содержанием жиров и
и получавших питание в виде сухого корма оте$
сахара на животных. Так, в статье Dallak et al.
чественных производителей, развиваются зна$
[14], выполненной на крысах Sprague$Dawley,
чительные патологические изменения во внут$
показано, что диета с высоким содержанием хо$
БИОХИМИЯ том 85 вып. 9 2020
УЛЬТРАСТРУКТУРА ГЕПАТОЦИТОВ МЫШЕЙ НА СУХОЙ ДИЕТЕ
1301
Рис. 6. Обзорная фотография гепатоцитов конвенциональной мыши С57Вl/6 в возрасте 1 мес., содержавшейся в комнате
передержки биологического факультета МГУ и получавшей лабораторный корм OOO «Лабораторкорм». Видны 7 парен$
химных клеток печени (показаны цифрами 1-7) и расположенные между ними капилляры. Электронно$светлые области
(А) присутствуют во внутреннем пространстве всех гепатоцитов
Рис. 7. Ультраструктура гепатоцитов печени мыши стока CD$1 SPF статуса в возрасте 1 мес., содержавшейся в условиях
питомника «Charies River» и получавшей корм фирмы «Altromin Spezialfutter». 5 гепатоцитов обозначены цифрами 1-5.
Округлые ядра расположены в центральной части гепатоцита
БИОХИМИЯ том 85 вып. 9 2020
1302
ВАЙС и др.
Рис. 8. Внутренняя ультраструктура гепатоцита мыши стока CD$1 SPF статуса в возрасте 1 мес., содержавшейся в услови$
ях питомника «Charies River» и получавшей корм фирмы «Altromin Spezialfutter». Митохондрии овальной или округлой
формы (М) равномерно расположены по всей цитоплазме гепатоцита. Видны стопки параллельно расположенных мемб$
ран грЭПР. Мембраны агЭПР находятся вблизи плазматической мембраны гепатоцита. ЖК - желчный каналец
Рис. 9. Ультраструктура гепатоцитов печени мыши стока CD$1 SPF статуса в возрасте 3 мес., содержавшейся первый ме$
сяц жизни в условиях питомника «Charies River» и получавшей корм фирмы «Altromin Spezialfutter» и далее в течение
2 мес. - в условиях ВЭК, получавшей корм «ЛБК $120_106104». На фотографии 6 гепатоцитов обозначены цифрами 1-6.
Во всех гепатоцитах присутствуют свободные от клеточных органелл электронно$светлые области, заполненные аморф$
ным веществом (А)
УЛЬТРАСТРУКТУРА ГЕПАТОЦИТОВ МЫШЕЙ НА СУХОЙ ДИЕТЕ
1303
лестерола и глюкозы [20] в течение 15 недель
жала в основе питания крыс и мышей. Shichali$
приводила к значительным нарушениям в ульт$
Belouiс et al. проведено исследование, в котором
раструктуре гепатоцитов. Авторы интерпрети$
дневные песчанки (Psammomys obesus), отлов$
руют появление в клетках пространств, свобод$
ленные в дикой природе в полупустыне Алжира,
ных от органелл, как расширение (набухание)
были переведены на стандартную лабораторную
эндоплазматического ретикулума и «пузыре$
диету [23]. Авторами показано, что через 9 мес. у
ние» (blebbing) мембран клетки. Однако в нашей
таких животных развивается стеатоз, сопровож$
работе при анализе внутренней ультраструктуры
дающийся значительными деструктивными из$
гепатоцитов на больших увеличениях (рис. 3),
менениями в ультраструктуре гепатоцитов. По$
которые отсутствуют в работе Dallak et al., мы не
лученные авторами результаты заставляют заду$
видели никаких мембранных образований в
маться об общепринятых стандартах в отноше$
участках клеток, свободных от органелл, а также
нии сухих кормов, поскольку некоторые станда$
набухания клеточных органелл.
ртные лабораторные диеты могут не соответ$
В работе Silva$Veiga et al. у мышей C57Bl/6,
ствовать потребностям организма конкретного
получавших в течение 14 недель высококало$
вида животных. Таким образом, нами показано,
рийную диету (5000 ккал/кг) [16], а также в рабо$
что при кормлении лабораторных животных
те Abo El$khair et al. [15] у крыс Sprague$Dawley,
(мышей и крыс) сухими кормами отечественных
получавших высокожирную диету
[21], на
производителей, широко используемыми в на$
представленных в статьях фотографиях можно
шей стране, в клетках печени развиваются зна$
видеть изменения ультраструктуры гепатоци$
чительные деструктивные изменения.
тов, сходные с описываемыми нами. При этом в
Полученный результат выявляет необходи$
контрольных группах животных, представлен$
мость подробного и полного исследования сос$
ных в исследованиях Silva$Veiga et al. [16] и Abo
тава кормов (при параллельном контроле цито$
El$khair et al. [15], ультраструктура паренхимных
логических, физиологических, биохимических и
клеток печени соответствует классическим
других параметров тканей лабораторных живот$
представлениям [3]. Следует отметить, что при
ных, потребляющих эти корма) с целью опреде$
развитии жирового стеатоза у животных, полу$
ления корректной диеты, необходимой для пол$
чавших высокожирную диету, авторы описыва$
ноценного содержания животных в вивариях.
ли увеличение гепатоцитов в размерах, значи$
Представляется, что эти данные имеют особое
тельные повреждения ядра и митохондрий, по$
значение при экспериментальных исследовани$
явление многочисленных жировых капель. Ни
ях функциональных характеристик клеточных
одного из этих признаков в нашей работе не
органелл гепатоцитов лабораторных животных,
найдено. Анализ имеющейся литературы позво$
так как ультраструктурные перестройки, как из$
ляет предположить, что у контрольных мышей,
вестно, отражают изменения в метаболических
исследованных в нашей работе и получавших
процессах в клетке, в ткани и в целом организме.
корма российских производителей, жировой ге$
патоз не развивается, однако патологические
изменения в печени, связанные с кормом, при$
Финансирование. Работа поддержана Рос$
сутствуют. Одним из основных направлений ле$
сийским фондом фундаментальных исследова$
чения жирового гепатоза у людей является наз$
ний (грант № 19$04$00578) и выполнена при
начение предложенной Мануилом Певзнером
поддержке ЦИТИС (грант
№ АААА$А19$
диеты № 5 с содержанием животных белков до
119012490166$2).
100-120 г/сут, ограниченным количеством жи$
Конфликт интересов. Авторы заявляют об от$
ров, обогащенной лиотропными питательными
сутствии конфликта интересов.
веществами (творог, гречневая, пшеничная му$
Соблюдение этических норм. Все примени$
ка), витаминами и микроэлементами [22]. До
мые международные, национальные и/или инс$
повсеместного введения сухих кормов в рацион
титуциональные принципы ухода и использова$
лабораторных животных именно эта диета и ле$
ния животных были соблюдены.
СПИСОК ЛИТЕРАТУРЫ
1.
Dalton, A. J., Kahler, H., Striebich, M. J., and Lloyd, B.
3.
Bruni, C., and Porter, K. R. (1965) The Fine structure of
(1950) Finer structure of hepatic, intestinal and renal cells
the parenchymal cell of the normal rat liver: I. general
of the mouse as revealed by the electron microscope, J.
observations, Am. J. Pathol., 46, 691$755.
Natl. Cancer Inst., 11, 439$461.
4.
Jones, A. L., and Fawcett, D. W. (1966) Hypertrophy of the
2.
Fawcett, D. W. (1955) Observations on the cytology and
agranular endoplasmic reticulum in hamster liver induced
electron microscopy of hepatic cells, J. Natl. Cancer Inst.,
by phenobarbital (with a review on the functions of this
15, 1475$1503.
organelle in liver), J. Histochem. Cytochem., 14, 215$232.
БИОХИМИЯ том 85 вып. 9 2020
1304
ВАЙС и др.
5.
Remmer, H., and Merker, H. J. (1965) Effect of drugs on
15. Abo El$Khair, S. M., Ghoneim, F. M., Shabaan, D. A.,
the formation of smooth endoplasmic reticulum and drug$
and Elsamanoudy, A. Z. (2020) Molecular and ultrastruc$
metabolizing enzymes, Ann. NY Acad. Sci., 123, 79$97.
ture study of endoplasmic reticulum stress in hepatic
6.
Steiner, J. W., Carruthers, J. S., and Kalifat, S. R. (1962)
steatosis: role of hepatocyte nuclear factor 4α and inflam$
Observations on the fine structure of rat liver cells in extra$
matory mediators, Histochem. Cell Biol., 153, 49$62.
hepatic cholestasis, Z. Zellforsch. Mikrosk. Anat., 58, 141$159.
16. Silva$Veiga, F. M., Rachid, T. L., de Oliveira, L., Graus$
7.
Wood, R. L. (1965) The fine structure of hepatic cells in
Nunes, F., Mandarim$de$Lacerda, C. A., and Souza$
chronic ethionine poisoning and during recovery, Am. J.
Mello, V. (2018) GW0742 (PPAR$beta agonist) attenuates
Pathol., 46, 307$330.
hepatic endoplasmic reticulum stress by improving hepatic
8.
Arhelger, R. B., Broom, J. S., and Boler, R. K. (1965)
energy metabolism in high$fat diet fed mice, Mol. Cell
Ultrastructural hepatic alterations following tannic acid
Endocrinol., 474, 227$237.
administration to rabbits, Am. J. Pathol., 46, 409$434.
17. ГОСТ Р 50258$92 (1992) Комбикорма полнорацион$
9.
Wieczorek, A., St pień, P. M., Zar bska Michaluk, D.,
ные для лабораторных животных, Технические усло$
Kryczka, W., Pabjan, P., and Król, T. (2017) Megamito$
вия, Изд. стандартов, с. 8
chondria formation in hepatocytes of patient with chronic
18. Reynolds, E. S. (1963) The use of lead citrate at high pH
hepatitis C - a case report, Clin. Exp. Hepatol., 3, 169$175.
as an electron$opaque stain in electron microscopy, J. Cell
10.
Falcón, V., Acosta Rivero, N., Chinea, G., Gavilondo, J.,
Biol., 17, 208$212.
de la Rosa, M. C., Menéndez, I., Dueñas Carrera, S.,
19. Silva, G. H., Hessel, G., Coelho, K. I., and Escanhoela, C. A.
Viña, A., Garc a, W., Gra, B., Noa, M., Reytor, E.,
(2011) Steatosis of indeterminate cause in a pediatric
Barceló, M. T., Alvarez, F., and Morales$Grillo, J. (2003)
group: is it a primary mitochondrial hepatopathy? Sao
Ultrastructural evidences of HCV infection in hepatocytes
Paulo Med J., 129, 217$223.
of chronically HCV$infected patients, Biochem. Biophys.
20. Aragno, M., Tomasinelli, C. E., Vercellinatto, I., Catalano,
Res. Commun., 305, 1085$1090.
M. G., Collino, M., Fantozzi, R., Danni, O., and
11.
Zhang, X. Q., Xu, C. F., Yu, C. H., Chen, W. X., and Li, Y. M.
Boccuzzi, G. (2009) SREBP$1c in nonalcoholic fatty liver
(2014) Role of endoplasmic reticulum stress in the patho$
disease induced by Western$type high$fat diet plus fructo$
genesis of nonalcoholic fatty liver disease, World J.
sein rats, Free Radic. Biol. Med., 47, 1067$1074.
Gastroenterol., 20, 1768$1776.
21. Meli, R., MattaceRaso, G., Irace, C., Simeoli, R., Di
12.
Cali, A. M., Zern, T. L., Taksali, S. E., de Oliveira, A. M.,
Pascale, A., Paciello, O., Pagano, T. B., Calignano, A.,
Dufour, S., Otvos, J. D., and Caprio, S.
(2007)
Colonna, A., and Santamaria, R. (2013) High fat diet
Intrahepatic fat accumulation and alterations in lipopro$
induces liver steatosis and early dysregulation of iron
tein composition in obese adolescents: a perfect proathero$
metabolism in rats, PLoS One, 8, e66570.
genic state, Diabetes Care, 30, 3093$3098.
22. Певзнер М. И. (1958) Основы лечебного питания (под
13.
FonTacer, K., and Rozman, D. (2011) Nonalcoholic fatty
ред. Ачаркана А. И. и Маршака М. С.). Медгиз, Моск$
liver disease: focus on lipoprotein and lipid deregulation, J.
ва, с 582.
Lipids, 2011, 783976.
23. Sihali$Beloui, O., Aroune, D., Benazouz, F., Hadji, A., El$
14.
Dallak, M. A., Bin$Jaliah, I., Albawardi, A., Haidara, M. A.,
Aoufi, S., and Marco, S. A. (2019) A hypercaloric diet
Sakr, H. F., Eid, R. A., Hassan, W. N., and Al$Ani, B.
induces hepatic oxidative stress, infiltration of lympho$
(2018) Swim exercise training ameliorates hepatocyte
cytes, and mitochondrial reshuffle in Psammomys obesus, a
ultrastructural alterations in rats fed on a high fat and sugar
murine model of insulin resistance, C R Biol., 342, 209$
diet, Ultrastruct. Pathol., 42, 155$161.
219, doi: 10.1016/j.crvi.2019.04.003.
ULTRASTRUCTURE OF HEPATOCYTES IN LABORATORY MICE
WHEN KEEPING ANIMALS ON A STANDARD DRY LABORATORY DIET*
V. B. Vays1, I. M. Vangeli1, O. A. Averina1, M. L. Lovat2, and L. E. Bakeyeva1**
1 Belozersky Institute of Physico Chemical Biology, Lomonosov Moscow State University,
119991 Moscow, Russia; E mail: bakeeva@belozersky.msu.ru
2 Lomonosov Moscow State University, Faculty of Biology, 119234 Moscow, Russia
Received July 7, 2020
Revised July 7, 2020
Accepted July 18, 2020
The significant destructive changes in ultrastructure of hepatocytes from laboratory mice kept in different vivariums
in Moscow and fed with dry laboratory animal diets acquired from different domestic manufacturers that were not
standardized for initial products were demonstrated using electron microscopy. Furthermore, disruption in the ultra$
structure of liver parenchymal cells occurred regardless of the animal status (SPF or conventional), conditions of var$
ious vivariums, as well as the feed manufacturer. At the same time, studies on ultrastructure of liver hepatocytes from
mice kept in the Charles River Laboratory facilities in Germany and fed with the Altromin Spezialfutter laboratory
animal diet (GmbH & Co, Germany) that was produced using quality control of ingredients did not reveal destruc$
tive changes in the internal ultrastructure of hepatocytes. However, if these mice were later fed with the food produced
in local manufactures, changes in the structure of liver cells developed after 2 months. Thus, feeding with dry diet from
the domestic producers of an unspecified composition causes significant changes in the ultrastructure of hepatocytes
in control animals, reflecting the development of some pathological processes in the body.
Keywords: mitochondria, hepatocytes, ultrastructure, mice, standard laboratory diet
БИОХИМИЯ том 85 вып. 9 2020