БИОХИМИЯ, 2020, том 85, вып. 9, с. 1305 - 1320
УДК 577.152.3
ЦИСТЕИНОВАЯ ПРОТЕАЗА ИЗ СЕМЯН ЛЬНА ОБЛАДАЕТ
СИЛЬНЫМ АНТИКОАГУЛЯНТНЫМ, АНТИТРОМБОЦИТАРНЫМ
ДЕЙСТВИЕМ И СПОСОБНА РАСТВОРЯТЬ ТРОМБЫ
© 2020
Ш.К.М. Нандиш1, Дж. Кенгайя1, Чх. Рамачандрайя1, Чандрамма1,
А. Шиваия1, С.М. Сантош2, Тирунавуккарасу3, Д. Саннанингая1*
1 Department of Studies and Research in Biochemistry and Centre for Bioscience and Innovation,
Tumkur University, 572103 Tumkur, India; E mail: sdevbiochem@gmail.com
2 Department of Medicinal Biochemistry and Microbiology (IMBM),
Uppsala Biomedical Centre, 75237 Uppsala, Sweden
3 Department of Biochemistry and Molecular Biology, School of Life Sciences,
Pondicherry University, 605014 Pondicherry, Tamil Nadu, India
Поступила в редакцию 21.03.2020
После доработки 26.05.2020
Принята к публикации 29.05.2020
В настоящем исследовании была выделена, очищена и охарактеризована цистеиновая протеаза из семян
льна (FSCP - flax seed cysteine protease), которая обладает выраженными антикоагулянтными и антитром
боцитарными свойствами и способна растворять образовавшиеся сгустки крови. Эта протеаза была очище
на до гомогенного состояния с использованием комбинации методов гель фильтрации и ионообменной
хроматографии. Чистота полученного препарата была подтверждена методами SDS PAGE, RP HPLC и
MALDI TOF. Согласно результатам SDS PAGE в восстанавливающих условиях и в отсутствие восстанови
телей, в препарате FSCP присутствовала одна чётко выраженная белковая полоса с молекулярной массой
~160 кДа. Точное значение молекулярной массы FSCP, установленное с помощью метода масс спектромет
рии MALDI TOF, оказалось равным 168 кДа. Спектры кругового дихроизма белка FSCP указывают на при
сутствие в структуре этого белка 25,6% спиральных структур, 25,8% структур типа «поворот» и 48% структур
типа «случайный клубок» и на отсутствие бета складчатой структуры. FSCP гидролизует как казеин, так и
желатин с удельной активностью 3,5 и 4,2 ед./мг·мин соответственно. Протеолитическая активность FSCP
полностью отменялась при добавлении йодоуксусной кислоты, что позволяет предположить, что FSCP яв
ляется представителем семейства цистеиновых протеаз. Было обнаружено, что оптимальные значения pH и
температуры для протеолитической активности FSCP равны pH 6,0 и 30 °C соответственно. FSCP демон
стрировала сильную антикоагулянтную активность как в препаратах обогащённой тромбоцитами плазмы,
так и в случае плазмы, бедной тромбоцитами, вызывая удлинение времени образования сгустков от 222 до
1100 с и от 256 до 1210 с соответственно. FSCP вызывал деградацию фибриногена человека и фибриновых
сгустков. Конечные продукты деградации фибриногена в результате действия тромбина и FSCP были раз
ными. Более того, FSCP ингибировал агрегацию отмытых тромбоцитов, индуцируемую ADP, эпинефри
ном, тромбином, коллагеном, арахидоновой кислотой и фактором активации тромбоцитов. Было обнару
жено, что FSCP нетоксичное соединение, так как не повреждает мембрану эритроцитов и не вызывает кро
воизлияния и отеков у экспериментальных мышей.
КЛЮЧЕВЫЕ СЛОВА: цистеиновая протеаза, антикоагулянт, антитромбоцитарный, нетоксичный.
DOI: 10.31857/S0320972520090109
ВВЕДЕНИЕ
ферменты, а также липиды, углеводы и вторич
ные метаболиты, которые можно использовать
Семена льна являются хранилищем множе
для различных фармакологических целей [1]. В
ства химических соединений растительного
растениях протеолитические ферменты участ
происхождения, включая белки, в том числе и
вуют в различных процессах - от стадии про
Принятые сокращения: ADP - аденозиндифосфат; APTT - активированное частичное тромбопластиновое время;
КД - круговой дихроизм; DEAE - диэтиламиноэтил; EDTA - этилендиаминтетраацетат; FSCP -цистеиновая протеаза
семян льна; FSBE - буферный экстракт семян льна, IAA - йодоуксусная кислота; PAF - фактор активации тромбоцитов;
PMSF - фенилметилсульфонилфлуорид; PPP - плазма с низким содержанием тромбоцитов; PRP - плазма, обогащённая
тромбоцитами; PT -протромбиновое время; RP HPLC - обратно фазовая высокоэффективная жидкостная хроматогра
фия; SDS PAGE - электрофорез в полиакриламидном геле в присутствии додецилсульфата натрия; TFA - трифторуксус
ная кислота; TCA - трихлоруксусная кислота.
* Адресат для корреспонденции.
1305
1306
НАНДИШи др.
растания семян до гибели клеток [2]. Кроме то
ных взаимосвязей и предсказания его возмож
го, они имеют множество промышленных при
ного практического применения. Основной
менений в пищевой промышленности, пивова
целью настоящей работы являлась очистка
рении, при приготовлении сыров и смягчении
фермента с максимальным выходом продукта с
мяса, в хлебобулочной промышленности, ко
наивысшей каталитической активностью. Кро
жевенной и текстильной промышленностях [3].
ме того, анализ свойств полученного фермента
Однако, в отличие от действия протеолитичес
обеспечивает комплексное понимание об ал
ких ферментов из ядов змей, пчёл и пауков [4],
лостерических эффектах, возможностях белко
влияние растительных протеаз на гемостаз изу
вой инженерии и нового дизайна лекарств. В
чено слабо. Протеолитические ферменты, ко
связи с этим мы очистили и охарактеризовали
торые обладают прокоагулянтными свойствами
цистеиновую протеазу из буферного экстракта
и могут вызвать деградацию молекулы фибри
семян льна.
ногена с её N конца, образуя фибринопептиды
A и Б, сходны с тромбин подобными фермен
тами, активаторами протромбина, фактора X и
МАТЕРИАЛЫ И МЕТОДЫ
V [5]. Протеазы, которые обладают антикоагу
лянтной активностью и вызывают деградацию
Материалы. В исследованиях использовали
фибриногена с его C конца, вызывая образова
следующие реактивы: свободный от липидов ка
ние укороченного фибриногена, не способного
зеин, желатин, фенилметилсульфонилфлуорид
к полимеризации, являются как активаторами
(PMSF), этилендиаминтетрацетат (EDTA), йо
белка C, так и ингибиторами факторов IX и X
доуксусная кислота (IAA), аденозиндифосфат
[6]. Протеазы, которые способны вмешиваться
(ADP), эпинефрин, тромбин, арахидоновая
в процессы функционирования тромбоцитов,
кислота, фактор активации тромбоцитов (PAF),
действуют одновременно как активаторы и как
коллаген, Sephadex G 100, DEAE Sephadex
ингибиторы процесса агрегации тромбоцитов
A 25, фибриноген плазмы крови человека и
[7]. Также сообщалось, что ферменты, вызыва
1,10 фенантролин были приобретены в компа
ющие деградацию фибриногена, активируют
нии «Sigma», США. Набор белков маркеров мо
плазминоген и вызывают кровоизлияние у экс
лекулярной массы был приобретен в компании
периментальных животных [8]. Наиболее ши
«Bangalore Genie Pvt Ltd.», Индия. Реагенты для
роко изучены металлопротеазы и сериновые
определения активированного частичного
протеазы из ядов гадюк и кроталидов, которые
тромбопластинового
времени
(APTT)
обладают способностью деградировать фибри
(LIQUICELIN E Phospholipids preparation
ноген и фибрин и демонстрируют про и анти
derived from rabbit brain with ellagic acid) и про
коагулянтную активность [9]. В то же время
тромбинового времени (PT) (UNIPLASTIN rabbit
цистеиновые протеазы животных клеток не
brain thromboplastin) были приобретены в ком
достаточно хорошо изучены. С другой стороны,
пании «AGAPPE Diagnostic Pvt Ltd.», Индия.
несколько групп ученых описали цистеиновые
Все другие реактивы, использованные в настоя
протеазы из латекса различных видов растений,
щей работе, были аналитической чистоты. Для
таких как Asclepius curassavica, Pergularia extensa,
проведения анализа плазмы, обогащённой
Calotropis gigantean, Synadenium grantii, Wrightia
тромбоцитами (PRP), и плазмы с пониженным
tinctoria [10]. Было обнаружено, что сырой ла
содержанием тромбоцитов (PPP) использовали
текс препятствует гемостазу, проявляя прокоа
свежесобранную кровь от здоровых доноров.
гулянтные, тромбоиндуцирующие или раство
Получение буферного экстракта семян льна
ряющие сгустки свойства. Было показано, что
(FSBE - flax seed buffer extract) и определение
фуцин (цистеиновая протеаза из Ficus carica)
концентрации общего белка. Семена льна были
может активировать фактор X и вызывать обра
приобретены на местном рынке в г. Тумкур. Се
зование сгустков [11]. Папаин был первой оха
мена промывали дважды дистиллированной во
рактеризованной цистеиновой протеазой из ла
дой и обрабатывали в течение 1 ч 0,5 M NaHCO3
текса Carica papaya [12]. Однако цистеиновые
в соотношении 1 : 8 (w/v) при постоянном пере
протеазы из съедобных семян изучены в мень
мешивании. Затем удаляли клейковину, фильт
шей степени. Лишь недавно появились сооб
руя экстракт через муслиновую ткань. Семена
щения о присутствии цистеиновой протеазы в
промывали и тщательно высушивали при ком
буферном экстракте семян льна и о её антикоа
натной температуре в течение 24 ч. Далее высу
гулянтной, антитромбоцитарной и растворяю
шенные семена измельчали в порошок, кото
щей тромбы активностях [13]. Очистка и опи
рый повторно суспендировали в 50 мМ Tris HCl
сание свойств фермента имеют большое значе
буфере, рН 7,6 и центрифугировали при 8000 g в
ние для понимания структурно функциональ
течение 15 мин. Супернатант собирали и храни
БИОХИМИЯ том 85 вып. 9 2020
АНТИКОАГУЛЯНТНОЕ ДЕЙСТВИЕ ПРОТЕАЗЫ ИЗ СЕМЯН ЛЬНА
1307
ли при -20 °C до дальнейшего использования.
метрии с использованием прибора
«Bruker
Концентрацию белка определяли по методу
Daltonics MALDI TOF» («Bruker Daltonics»,
Bradford [14], используя в качестве белкового
США) в режиме положительной ионизации. В
стандарта бычий сывороточный альбумин
качестве матрикса MALDI была использована
(БСА).
α циано 4 гидроксикоричная кислота.
ГельHфильтрация на колонке с Sephadex GH100.
Метод кругового дихроизма (КД). Спектры
Колонка с Sephadex G 100 (1,0 × 62 см) была
КД белка FSCP (20 мкг/мл в дважды дистилли
предварительно уравновешена 0,1 М NaCl.
рованной воде Milli Q) получали с использова
100 мг FSBE в 1 мл 0,1 M NaCl наносили на ко
нием спектрополяриметра
«JASCO J 815»
лонку. Элюцию белка проводили с помощью
(«Bayer», Германия). Спектры регистрировали
раствора 0,1 M NaCl при скорости потока
при комнатной температуре в диапазоне
0,25 мл/мин. Мониторинг элюции проводили с
190-250 нм с использованием кварцевой кюве
помощью регистрации поглощения при 280 нм.
ты с длиной оптического пути 1 мм. Ширина
В каждой второй пробирке определяли протео
полосы 1 нм, время ответа 1 с, скорость скани
литическую активность, регистрируя поглоще
рования 100 нм/мин. Итоговый спектр является
ние при 660 нм, используя в качестве субстрата
совокупностью трех сканов. Расчет вторичной
казеин, не содержащий примесей жиров. Фрак
структуры на основе полученных спектров КД
ции с выраженной протеолитической актив
производили с помощью программы «K2d».
ностью лиофилизировали и использовали для
Электрофорез белков в SDSHPAGE и окрашиH
дальнейших анализов.
вание йодной кислотой и Шиффовым основанием
Хроматография на колонке с DEAEHSephadex
(PAS staining). Электрофорез белков в 10% ном
AH25. Фракции, соответствующие пику II (20 мг
SDS PAGE осуществляли по методу Laemmli
белка в 1 мл уравновешивающего буфера), полу
[15]. Разделение белков грубого экстракта семян
ченные во время предыдущей стадии очистки,
льна (FSBE, 100 мкг белка) и анализ чистоты
наносили на колонку с DEAE Sephadex A 25
очищенного белка FSCP (50 мкг) проводили в
(1,0 × 15 см), предварительно уравновешенную
восстанавливающих или в невосстанавливаю
10 мМ Tris HCl буфером, pH 7,5. Белки элюиро
щих условиях в Tris глициновом буфере, рН 8,3,
вали, последовательно, используя 20 мМ Tris
содержащем 0,1% SDS, в течение 2 ч при ком
HCl (pH 9,0); 20 мМ Tris HCl (pH 8,5); 30 мМ
натной температуре. После завершения элект
Tris HCl (pH 8,0); 40 мМ Tris HCl (pH 7,5);
рофореза для выявления полос белка гели окра
50 мМ Tris HCl (pH 7,0); 75 мМ Tris HCl (pH
шивали 0,1% ным красителем Coomassie brilliant
6,5); 100 мМ Tris HCl (pH 6,0); 0,5 M NaCl в
blue R 250, и затем их обесцвечивали смесью
50 мМ Tris HCl (рН 7,5) и 1 M NaCl в 50 мМ Tris
этанол/уксусная кислота/вода (40/10/50, v/v/v).
HCl (pH 7,5) при скорости потока 0,25 мл/мин.
Для определения молекулярной массы были ис
Мониторинг процесса элюции проводили под
пользованы стандарты со значениями молеку
контролем поглощения при 280 нм. Получен
лярной массы от 14,3 до 200 кДа.
ные фракции анализировали на присутствие
Окрашивание гелей с использованием йод
протеолитической активности, используя в ка
ной кислоты и основания Шиффа (PAS staining)
честве субстрата казеин и регистрируя поглоще
проводили по методу Leach [16]. После заверше
ние при 660 нм.
ния электрофореза гель фиксировали в 7,5% ук
ОбратноHфазовая высокоэффективная жидкоH
сусной кислоте и оставляли при комнатной тем
стная хроматография (RPHHPLC assay). После
пературе в течение 1 ч. Затем гель промывали
гель фильтрации на колонке с DEAE Sephadex
1% ной азотной кислотой и инкубировали в
A 25 очищенную протеазу подвергали RP
0,2% ном водном растворе йодной кислоты при
HPLC на колонке C18 (150 мм × 4,60 мм, размер
4 °C в течение 45 мин. После этого гель помеща
частиц - 5 мкм), предварительно уравновешен
ли в раствор реагента Шиффа на 24 ч при 4 °C.
ной 0,1% ной трифторуксусной кислотой (TFA)
После завершения окрашивания гель обесцве
в воде с использованием прибора «Shimadzu LC
чивали с использованием 10% ной уксусной
20AD prominence HPLC» с детектором PDA
кислоты, чтобы выявить полосы белков, окра
(«Shimadzu Corp.», Япония). Связавшиеся бел
шенные в розовый цвет.
ки элюировали линейным градиентом (0-100%)
Определение протеолитической активности.
ацетонитрила, 0,1% TFA в течение 40 мин при
Протеолитическую активность определяли, как
скорости потока 1 мл/мин. Мониторинг элю
было описано в работе Satake et al. [17]. 10 мкг
ции проводили при длине волны 280 нм.
белка FSCP инкубировали с 0,4 мл раствора сво
МассHспектрометрия MALDIHTOF. Молеку
бодного от липидов казеина (2% в 0,2 M Tris
лярную массу цистеиновой протеазы (FSCP)
HCl, pH 7,6) в общем объёме 1 мл в течение 2,5 ч
определяли с помощью метода масс спектро
при 37 °C. Непереваренный казеин осаждали
БИОХИМИЯ том 85 вып. 9 2020
1308
НАНДИШи др.
путём добавления 1,5 мл 0,44 M трихлоруксус
Определение времени рекальцификации плазH
ной кислоты (TCA) и оставляли в течение
мы. Время рекальцификации плазмы проводили
30 мин. Затем проводили центрифугирование
в соответствии с методом, описанным в работе
образцов при 2000 g в течение 10 мин. К 1 мл су
Quick et al. [19]. Вкратце, FSCP (2-14 мкг) пред
пернатанта последовательно добавляли карбо
варительно инкубировали с 0,2 мл человеческой
нат натрия (2,5 мл, 0,4 M) и реактив Folin-
плазмы цитратной крови в присутствии 20 мкл
Ciocalteu (1/2). Поглощение окрашенных об
10 мМ Tris HCl, pH 7,4, в течение 1 мин при
разцов определяли при 660 нм. За единицу ак
37 °C. Затем в реакционную смесь добавляли
тивности фермента было принято количество
20 мкл 0,25 M раствора CaCl2 и регистрировали
фермента, необходимое для увеличения погло
время образования сгустка.
щения при 660 нм на величину, равную 0,01.
Время кровотечения. Время кровотечения
Удельную активность фермента выражали в ви
определяли, как описано ранее [20]. Вкратце,
де ед./мин на мг белка. При определении влия
FSCP (0-8 мкг) в 30 мкл PBS вводили внутри
ния различных ингибиторов белок FSCP
венно в хвостовую вену (n = 5). Спустя 10 мин
(10 мкг) предварительно инкубировали в тече
мыши были анестезированы диэтиловым эфи
ние 30 мин с одним из ингибиторов (5 мм):
ром, и им делали острые надрезы на кончике
EDTA; 1,10 фенантролин; PMSF или IAA. Во
хвостовой вены длиной 3 мм. Сразу после этого
всех случаях были использованы соответствую
хвосты мышей погружали вертикально в PBS,
щие контроли.
который предварительно был нагрет до 37 °C.
Зимограмма. Зимограммы FSCP получали,
Время кровотечения фиксировалось с момента
как было описано ранее [18]. Вкратце, образцы
начала кровотечения до его полной остановки.
FSCP (5 мкг и 10 мкг), приготовленные в невос
Определение значений APTT и PT. 100 мкл
станавливающих условиях, наносили на разде
нормальной плазмы цитратной крови человека
ляющий гель, содержащий 2% ный казеин/же
предварительно инкубировали с белком FSCP
латин. После завершения электрофореза гели
(0-10 мкг) в течение 1 мин. Для проведения тес
промывали 10 мМ натрий фосфатным буфером
та на APTT добавляли 100 мкл реагента, активи
(PBS), рН 7,0, содержащим 2,5% Triton X 100,
рованного в течение 3 мин при 37 °C. Образова
при постоянном перемешивании в течение 1 ч,
ние сгустков инициировали добавлением
чтобы удалить SDS. Гель инкубировали в тече
100 мкл 0,02 M CaCl2, и регистрировали время
ние ночи при 37 °C в 50 мМ Tris HCl, pH 7,6, со
формирования сгустков. При проведении теста
держащем 50 мМ CaCl2 и 40 мМ NaCl. Затем
на PT образование сгустков запускали добавле
гель подвергали окрашиванию для выявления
нием 200 мкл реагента для определения PT. За
полупрозрачных полос, соответствующих ак
писывали время (в секундах), в течение которо
тивному ферменту.
го образовывался видимый глазом сгусток. Со
Влияние pH, температуры и продолжительности
отношение APTT и международного нормали
реакции на активность FSCP. Чтобы определить
зованного соотношения (INR - international
оптимальное значение рН для FSCP, измеряли её
normalized ratio) для PT в каждой точке рассчи
активности в диапазоне значений рН 3-9. С этой
тывали, исходя из значений контрольной плаз
целью 10 мкг фермента инкубировали с 0,4 мл
мы, инкубированной с буфером в течение оди
раствора, не содержащего примеси жиров казе
накового периода времени.
ина (2% в 0,2 M Tris HCl, рН 7,6) в общем объё
Определение фибриногенолитической активH
ме реакционной смеси 1 мл в течение 2,5 ч при
ности. Фибриногенолитическую активность оп
37 °C. Чтобы определить влияние температуры,
ределяли, как было описано ранее в работе
10 мкг белка инкубировали с 0,4 мл обезжирен
Ouyang и Teng [21]. Белок FSCP (0-10 мкг) ин
ного казеина (2% в 0,2 M Tris HCl, pH 7,6) в об
кубировали с фибриногеном плазмы крови че
щем объёме реакционной смеси 1 мл при раз
ловека (50 мкг) в общем объёме реакционной
личных температурах (5-50 °C). Изменения ак
смеси 40 мкл 10 мМ Tris HCl буфера, pH 7,4, в
тивности фермента с течением времени опреде
течение 4 ч при 37 °C. Реакцию останавливали,
ляли в результате инкубации 10 мкг белка FSCP
добавляя 20 мкл денатурирующего буфера, со
с 0,4 мл обезжиренного казеина (2% в 0,2M Tris
держащего 1 M мочевины, 4% SDS и 4% β мер
HCl, pH 7,6) в общем объёме 1 мл при 37 °C в те
каптоэтанола. Затем проводили электрофорез
чение различных интервалов времени (30-
образцов в 10% ном SDS PAGE. При проведе
240 мин). Во всех экспериментах не переварен
нии определения влияния ингибиторов FSCP
ный казеин осаждали, добавляя 1,5 мл 0,44 M
(10 мкг) предварительно инкубировали в тече
TCA и оставляя в течение 30 мин. Протеолити
ние ~20 мин с 5 мМ какого либо из следующих
ческую активность фермента определяли, как
ингибиторов: PMSF, IAA, EDTA или 1,10 фенан
было описано выше.
тролин.
БИОХИМИЯ том 85 вып. 9 2020
АНТИКОАГУЛЯНТНОЕ ДЕЙСТВИЕ ПРОТЕАЗЫ ИЗ СЕМЯН ЛЬНА
1309
Определение конечных продуктов деградации
5 мМ какого либо из использованных в работе
фибриногена с использованием HPLC. Фибриноген
ингибиторов (PMSF, EDTA, IAA или 1,10 фенан
(50 мкг) обрабатывали тромбином человека (2,5
тролин).
единиц) или очищенным FSCP (10 мкг) в 50 мМ
Деградация белков плазмы крови. Определе
Tris HCl буфере, pH 7,8, и инкубировали при
ние уровня деградации белков плазмы крови
37 °C в течение 4 ч. Затем 20 мкл реакционной
проводили по методу, ранее описанному в рабо
смеси анализировали на колонке C18 с помощью
те Kumar et al. [23]. Белок FSCP (0-10 мкг) ин
хроматографической системы «Shimadzu LC
кубировали с 100 мкг белков плазмы крови в те
Prominence HPLC system («Shimadzu Corp.»,
чение 12 ч при 37 °C в общем реакционном объ
Япония). Белковые фракции получали с по
ёме 40 мкл, в 10 мМ Tris HCl (pH 7,4), содержа
мощью градиента ацетонитрила и 0,1% TFA в во
щем 10 мМ NaCl и 0,05% азида натрия. Реакцию
де в течение 10 мин. Контроль элюции проводи
останавливали добавлением 20 мкл денатуриру
ли при 280 нм.
ющего буфера, содержащего 4% SDS, и последу
Определение фибринолитической активности.
ющим кипячением образцов в течение 5 мин.
Активность белка FSCP в отношении фибрино
Затем образцы анализировали с использовани
вых сгустков определяли, как ранее было описа
ем метода электрофореза белков в 7,5% ном
но в работе Rajesh et al. [22]. Вкратце, 100 чело
SDS PAGE в невосстанавливающих условиях.
веческой плазмы цитратной крови смешивали с
Получение отмытых тромбоцитов. Отмытые
20 мкл 0,2 M раствора CaCl2 и инкубировали в
тромбоциты получали в соответствии с мето
течение 2 ч при 37 °C. Полученный сгусток тща
дом, описанным Born [24]. 1,5 мл буфера с ли
тельно промывали 5-6 раз PBS и суспендирова
монной кислотой и декстрозой добавляли в
ли в 400 мкл 0,2 M Tris HCl (pH 8,5). Инициа
пластиковые центрифужные пробирки. Затем
цию реакции осуществляли добавлением раз
добавляли по 9 мл крови и центрифугировали в
личных количеств белка FSCP (0-10 мкг) в
течение 15 мин при 30 g. Супернатант PRP пере
100 мкл PBS и инкубировали в течение 2,5 ч при
носили в пластиковые пробирки и выдерживали
37 °C. Непереваренный сгусток осаждали, до
в инкубаторе при 37 °C в течение 15 мин и затем
бавляя 750 мкл 0,44 M TCA в течение 30 мин,
центрифугировали в течение 20 мин при 4500 g.
после чего образцы центрифугировали в тече
Собирали осадок, и суспендировали его в буфе
ние 15 мин при 1500 g. Аликвоты супернатанта
ре, содержащем раствор Тироде (Tyrode) и аль
объёмом 0,5 мл переносили в чистые стеклян
бумин, pH 6,5. После перемешивания смесь
ные пробирки, добавляли по 1,25 мл 0,4 M кар
центрифугировали при 4500 g в течение 20 мин.
боната натрия и по 0,25 мл разведенного в 2 ра
Осадок снова суспендировали в буфере, содер
за фенол содержащего реагента Folin-Ciocalteu
жащем раствор Тироде (Tyrode) и альбумин,
и оставляли на 30 мин. Образовавшиеся окра
pH 6,5 и снова центрифугировали в течение
шенные продукты реакции регистрировали при
20 мин при 4500 g. Полученный осадок суспен
660 нм. За единицу активности принимали ко
дировали в буфере, содержащем раствор Тироде
личество фермента, которое необходимо для
(Tyrode) и альбумин, pH 7,35. Полученную сус
увеличения поглощения при 660 нм на 0,01.
пензию использовали в дальнейшем для изуче
Определение фибринолитической активности
ния агрегации тромбоцитов.
с помощью SDSHPAGE электрофореза. Получе
Определение степени агрегации тромбоцитов.
ние фибриновых сгустков проводили, как опи
Агрегацию тромбоцитов оценивали с помощью
сано выше. Полученные сгустки инкубировали
турбидиметрического метода, описанного Born
с различными концентрациями белка FSCP
[24], с использованием двухканального агрего
(0-10 мкг) в 10 мМ Tris HCl (pH 7,4) в конечном
метра «Chronolog whole blood/optical lumi aggre
объёме реакционной смеси 40 мкл при 37 °C в
gation system» («CHRONO LOG CORP.», США).
течение 12 ч. Реакцию останавливали добавле
Аликвоты отмытых тромбоцитов предваритель
нием 20 мкл денатурирующего буфера для об
но инкубировали с различными концентрация
разцов, содержащего 4% SDS, 1 M мочевины и
ми белка FSCP (0-6 мкг) в общем объёме реак
4% β меркаптоэтанола. Образцы выдерживали в
ционной смеси 0,25 мл. Процесс агрегации тром
кипящей водяной бане в течение 10 мин и затем
боцитов запускали независимо друг от друга, до
подвергали центрифугированию, чтобы осадить
бавляя тот или иной агонист из следующего
обрывки сгустков плазмы. Отбирали аликвоты
списка: ADP, эпинефрин, арахидоновая кислота,
супернатанта объёмом 30 мкл и анализировали с
тромбин, коллаген или PAF, и выдерживали в те
помощью гель электрофореза в 7,5% ном SDS
чение 6 мин. В случае индуцированной ADP и
PAGE. При проведении анализа с использова
эпинефрином агрегации тромбоцитов до запуска
нием ингибиторов белок FSCP (10 мкг) предва
процесса агрегации к отмытым тромбоцитам
рительно инкубировали в течение ~15 мин с
предварительно добавляли 50 мкг фибриногена.
БИОХИМИЯ том 85 вып. 9 2020
1310
НАНДИШи др.
Определение прямой гемолитической активH
яд из Daboia russelli, являлась положительным
ности. Гемолитическую активность определяли,
контролем. Спустя 3 ч мышей подвергали анес
используя отмытые эритроциты человека.
тезии с помощью ингаляции диэтиловым эфи
Вкратце, упакованные эритроциты человека
ром. Спинной участок поверхности кожи тща
суспендировали в PBS в соотношении 1/9 (v/v).
тельно удаляли и обследовали, проводя его срав
1 мл этой суспензии инкубировали независимо
нение с картиной геморрагии у контрольных
друг от друга с различными количествами белка
мышей, которым вводили только физраствор.
FSCP (0-30 мкг) в течение 1 ч при 37 °C. Реак
Измеряли диаметр геморрагического пятна на
цию останавливали, добавляя 9 мл ледяного
внутренней поверхности кожи. Минимальную
PBS, и центрифугировали при 1000 g в течение
дозу, приводящую к кровоизлиянию, определя
10 мин при 37 °C. Количество гемоглобина в су
ли как количество белка, вызывающего образо
пернатанте измеряли при длине волны 540 нм.
вание геморрагического пятна диаметром 10 мм.
Гемолитическую активность выражали в виде
Статистическая обработка полученных реH
процента лизированных клеток. В качестве по
зультатов. Полученные результаты представле
ложительного и отрицательного контролей ис
ны в виде среднего значения ± стандартное от
пользовали лизис эритроцитов в дистиллиро
клонение (SD). Статистический анализ был про
ванной воде (100% ный лизис) и PBS соответ
веден с использованием t критерия Стьюдента.
ственно.
Различия между группами считались статисти
ОтекHиндуцирующая активность. В данном
чески достоверными, если значение р < 0,01.
случае был использован метод, описанный ра
нее Vishwanath et al. [25]. Группам мышей (n = 5
в каждой группе) независимо друг от друга в по
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
душечки правой ноги вводили различные дозы
белка FSCP (10-200 мкг) в 20 мкл физиологи
Очистка и определение свойств белка FSCP.
ческого раствора. В подушечки левой ноги вво
Для того чтобы выделить цистеиновую протеазу
дили только 20 мкл физраствора, и это служило
из FSBE нами было использовано сочетание ме
в качестве контроля. Спустя 1 ч мышей подвер
тодов колоночной хроматографии на Sephadex
гали анестезии в результате ингаляции диэтило
G 100 и DEAE Sephadex A 25. В результате
вого эфира. Задние конечности на уровне голе
фракционирования FSCP с помощью гель
ностопного сустава удаляли, и их взвешивали.
фильтрации были получены два основных пика
Увеличение веса удаленной конечности рассчи
(рис. 1, а), и только во фракциях пика II была
тывали как коэффициент отека, который был
выявлена казеин гидролизующая активность,
равен весу отечной ноги × 100/вес нормальной
указывающая на протеолитическую активность.
ноги. В качестве минимальной дозы, способной
Для очистки протеазы пик II фракционировали
вызвать появление отеков, было определено ко
методом ионообменной колоночной хроматог
личество белка, необходимое для достижения
рафии на DEAE Sephadex А 25. Было получено
значения коэффициента отека 120%.
7 пиков (рис. 1, b). Все пики были проверены на
Геморрагическая активность. Геморрагичес
наличие протеолитической активности с ис
кую активность определяли по методу, описан
пользованием казеина и желатина в качестве
ному ранее Kondo et al. [26]. Различные количе
субстратов. Только пик IV гидролизовал
ства белка FSCP (0-30 мкг) в 30 мкл физиологи
субстраты с удельной активностью
3,45 и
ческого раствора вводили мышам внутрикожно
4,20 ед./мин белка соответственно. Протеоли
(n = 5 в каждой группе). Группа мышей, которая
тическая активность пика IV была полностью
получала только физраствор, служила в качестве
отменена IAA (ингибитором цистеиновой про
отрицательного контроля, а группа, получавшая
теазы), в то время как 1,10 фенантролин, PMSF
и ЭДТА были неэффективны, что указывало на
Таблица 1. Влияние различных ингибиторов на протеоли
присутствие остатка цистеина в активном участ
тическую активность белка FSCP
ке фермента (табл. 1). На этом основании дан
Ингибитор (5 мМ)
Активность (%)
ный фермент был определен нами как цистеи
новая протеаза семян льна (FSCP - flax seed cys
Нет ингибитора
100
teine protease).
Белок FSCP является мономером, что было
PMSF
99
ранее подтверждено наличием только одной по
IAA
8
лосы с молекулярной массой ∼160 кДа при его
EDTA
99
электрофорезе в SDS PAGE в восстанавливаю
1,10 фенантролин
98
щих и невосстанавливающих условиях (рис. 2,
а). Однако точная молекулярная масса белка
БИОХИМИЯ том 85 вып. 9 2020
АНТИКОАГУЛЯНТНОЕ ДЕЙСТВИЕ ПРОТЕАЗЫ ИЗ СЕМЯН ЛЬНА
1311
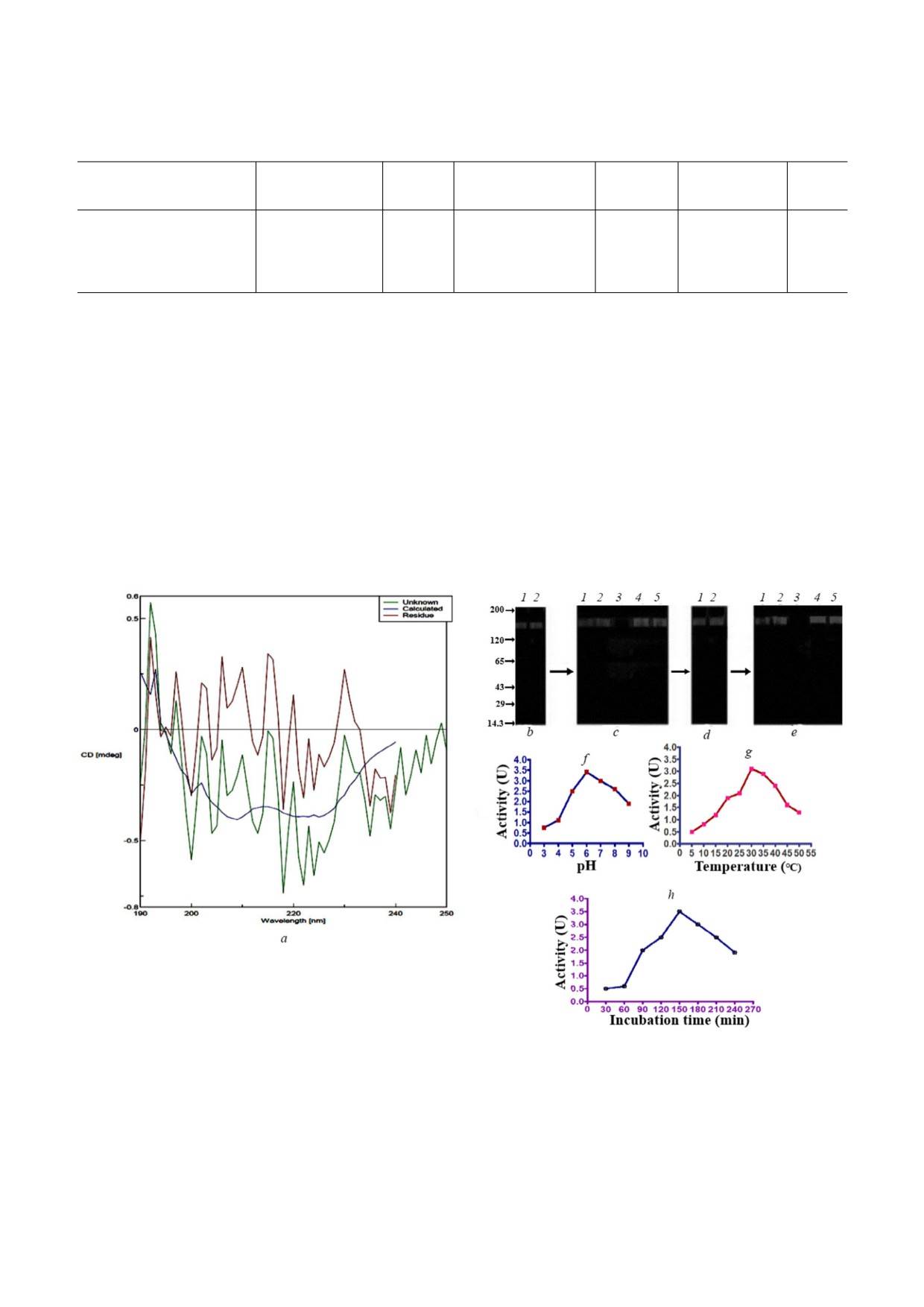
Рис. 1. а - Гель фильтрация на колонке с Sephadex G 100. Препарат FSBE (100 мг в 1 мл 0,1M NaCl) наносили на колон
ку с Sephadex G 100 (1,5 × 108 см), предварительно уравновешенную 0,1 M NaСl. Белки элюировали 0,1 M NaCl при ско
рости потока 16 мл/ч. Контроль элюции проводили при 280 нм. Каждую вторую фракцию белка (1,6 мл) анализировали
на протеолитическую активность, используя казеин в качестве субстрата (пунктиром показан профиль элюции фракций
с протеолитической активностью). b - Хроматография на колонке с DEAE Sephadex A 25. Фракции, соответствующие
пику II (Peak II), полученные на предыдущей стадии очистки белка (20 мг белка в 1 мл уравновешивающего буфера), на
носили на колонку с DEAE Sephadex A 25 (1,5 × 20 см), предварительно уравновешенную 10 мМ Tris HCl буфером, pH
8,0. Далее белки последовательно элюировали (см. раздел «Материалы и Методы») при скорости потока 15 мл/ч. Мони
торинг процесса элюции проводили при 280 нм. В каждой второй пробирке определяли протеолитическую активность,
используя в качестве субстрата казеин (пунктиром показан профиль элюции фракций с протеолитической активностью).
(С цветными вариантами рис. 2-4, 6 и 8 можно ознакомиться в электронной версии статьи на сайте: http://sciencejour
nals.ru/journal/biokhsm/.)
FSCP, определенная методом масс спектромет
подкреплена экспериментами по получению зи
рии MALDI TOF, составила 168 кДа (рис. 2, с).
мограмм. Белок FSCP показал сходную картину
Белок FSCP, в отличие от фибриногена, не обра
полупрозрачных полос активности в районе
зовывал основания Шиффа при его обработке
~168 кДа в экспериментах по зимографии казе
йодной кислотой. Это означает, что белок FSCP
ина и желатина соответственно (рис. 3, b и e).
не содержит остатки углеводов (рис. 2, b). Чис
Было установлено, что оптимальными значени
тота FSCP была подтверждена RP HPLС, был
ями pH и температуры для протеолитической
выявлен единичный острый пик со временем
активности FSCP являются pH 6,0 и 30 °C соот
удержания 7,2 мин (рис. 2, d).
ветственно. Наибольшее количество гидролизо
Во вторичной структуре белка FSCP с по
ванного субстрата наблюдается через 150 мин
мощью метода КД было выявлено ~25,6% спи
реакции (рис. 3, f-h).
ральных структур, 25,8% поворотов и
48%
FSCP демонстрирует выраженные антикоагуH
структур типа «случайный клубок». При этом
лянтные свойства, вмешиваясь во внутренние пути
бета складчатые структуры не были обнаруже
каскада свертывания крови. Препарат FSCP
ны (рис. 3, а). Белок FSCP был очищен в 19 раз
(12 мкг) показал сильную антикоагулянтную ак
(табл. 2). Гидролитическая активность белка
тивность, увеличивая время свертывания цит
FSCP в отношении казеина и желатина была
ратной крови в препаратах PRP (от 222 до 1100 с)
БИОХИМИЯ том 85 вып. 9 2020
1312
НАНДИШи др.
a
b
Рис. 2. a - Электрофорез белков в 10% ном SDS PAGE: 1 - экстракт семян льна (100 мкг), невосстанавливающие усло
вия; 2 - белок FSCP (50 мкг) в невосстанавливающих условиях; 3 - FSCP (50 мкг) в восстанавливающих условиях. b - Ок
рашивание йодной кислотой и основанием FSCP (1), 50 мкг и фибриноген (2), 50 мкг, положительный контроль; M - мар
керы молекулярной массы: H цепь миозина (200 кДа), β галактозидаза (120 кДа), бычий сывороточный альбумин
(66 кДа), овальбумин (43 кДа), карбоангидраза (29 кДа) и лизоцим (14.3 кДа). с - Масс спектрометрия MALDI TOF бел
ка FSCP (5 мкг) в режиме положительной ионизации с использованием в качестве матрикса α циано 4 гидроксикорич
ной кислоты. d - RP HPLC белка FSCP (5 мкг) на колонке C18 предварительно уравновешенной 0,1% TFA в воде. Элю
цию белка проводили с помощью увеличивающейся концентрации (0-100%, 40 мин) ацетонитрила, 0,1% TFA при ско
рости потока 1 мл/мин. Мониторинг элюции проводили при 280 нм
и PPP (от 256 до 1210 с) человека (рис. 4, а). Ан
FSCP в количестве 10 мкг полностью расщеплял
тикоагулянтная активность белка FSCP была
Aα цепь и частично Bβ цепь фибриногена в до
подтверждена in vivo с помощью теста на крово
за зависимой манере (рис. 5, а) при инкубации в
течение из хвостовой вены мыши. Внутривенная
течение 4 ч при 37 °C. С другой стороны, 5 мкг
инъекция препарата FSCP приводила к значи
FSCP при инкубации в течение 24 ч при 37 °C не
тельному доза зависимому увеличению продол
вызывали гидролиз γ цепи фибриногена (рис. 5,
жительности кровотечения. Продолжительность
b). Фибриногенoлитическая активность FSCP
кровотечения превышала 800 с (р < 0,01) при
отменялась полностью только при добавлении
инъекции 8 мкг в сравнении с 200 с при обработ
IAA. PMSF, EDTA и 1,10 фенантролин на неё не
ке контрольных мышей PBS (рис. 4, с). IAA пол
влияли (рис. 5, c). Субстратная специфичность
ностью подавляла антикоагулянтную активность
FSCP оценивалась с использованием белков
FSCP как in vitro, так и in vivo, однако другие ин
плазмы крови человека. FSCP специфически
гибиторы протеаз на неё не влияли (рис. 4, b и d).
расщеплял фибриноген, не влияя на другие бел
Кроме того, FSCP пролонгировал процесс обра
ки плазмы, при инкубации в течение 12 ч в мак
зования сгустков только в случае APTT, но не PT.
симальной дозе 10 мкг при 37 °С (в качестве по
Эти результаты позволяют предположить, что
ложительного контроля использовался только
антикоагулянтное действие FSCP может быть
фибриноген) (рис. 5, d).
связано с его вмешательством во внутренний
FSCP растворяет сгустки фибрина. FSCP
путь каскада свертывания крови (табл. 3).
растворял фибриновый сгусток с удельной ак
FSCP вызывает гидролиз только фибриноге
тивностью 4,16 ед./мин на мг белка (рис. 6, а).
на и не действует на другие белки плазмы крови. Его способность гидролизовать фибрин была
БИОХИМИЯ том 85 вып. 9 2020
АНТИКОАГУЛЯНТНОЕ ДЕЙСТВИЕ ПРОТЕАЗЫ ИЗ СЕМЯН ЛЬНА
1313
Таблица 2. Сводная таблица результатов очистки белка FSCP. Приведены значения в виде среднего трех независимых
определений
Метод
Общее количество
Выход
Удельная активность
Общая
Выход
Степень
белка (мг)
белка (%)
(U/мин·мг белка)
активность
активности (%)
очистки
Грубый буферный экстракт
100
100
0,18 ± 0,02
18
100
1,0
Sephadex G 100
20
20
0,81 ± 0,04
16
90
4,5
DEAE Sephadex A 25
1
1
3,45 ± 0,03
3
19
19
подтверждена картиной разделения белковых
FSCP расщепляет фибриноген с его CHконца.
полос в результате проведения SDS PAGE при
Чтобы определить сайты деградации фибриноге
деградации фибрина. 10 мкг FSCP за 12 ч инку
на в результате действия FSCP, конечные про
бации при 37 °C расщепляли только целый фиб
дукты деградации фибриногена в результате его
рин, а димер γ-γ, α цепь и β цепь оставались
инкубации с тромбином и FSCP анализировали
устойчивыми к протеолизу (рис. 6, b). Странно,
с помощью метода HPLC. Фибриноген элюиро
но при инкубации в течение 24 ч при 37 °C FSCP
вался с колонки в виде единственного пика с
в количестве 4 мкг расщеплял все цепи фибри
временем задержки 1,3 мин (рис. 7, а). Расщеп
на, и эффективность такого расщепления зави
ление фибриногена тромбином дало пять пиков
села от продолжительности инкубации (рис. 6,
со временем удержания 1; 1,2; 1,4; 1,6 и 2 мин со
с). Его фибринолитическая активность пол
ответственно (рис. 7, b). В то же время фибрино
ностью подавлялась IAA, но не PMSF, EDTA и
ген, обработанный FSCP, также показывал пять
1,10 фенантролином (рис. 6, d).
пиков элюции с временем задержки 1; 1,4; 1,6;
Рис. 3. а - Спектры кругового дихроизма белка FSCP (20 мкг в дважды дистиллированной воде). b - Зимограмма FSCP c
казеином: 5 мкг (1) и 10 мкг (2) FSCP. c - Зимограмма FSCP (5 мкг) с казеином в отсутствие или в присутствии ингиби
торов (5 мМ): нет ингибиторов (1); PMSF (2); IAA (3); 1,10 фенантролин (4); EDTA (5). d - Зимограмма FSCP с желати
ном: 5 мкг (1) и 10 мкг (2) белка FSCP. e - Зимограмма FSCP (5 мкг) с желатином в отсутствие или в присутствии инги
биторов (5 мМ): нет ингибиторов (1); PMSF (2); IAA (3); 1,10 фенантролин (4); EDTA (5). f - Влияние pH (3-9) на про
теолитическую активность FSCP. g - Влияние температуры (5-50°C) на протеолитическую активность FSCP. h - Влияние
продолжительности инкубации (30-240 мин) на протеолитическую активность FSCP
12 БИОХИМИЯ том 85 вып. 9 2020
1314
НАНДИШи др.
Рис. 4. а - Влияние FSCP на время рекальцификации плазмы. b - Влияние ингибиторов протеаз на антикоагулянтную ак
тивность FSCP. FSCP (4 мкг) предварительно инкубировали с 5 мМ ингибитора (PMSF, IAA, EDTA, 1,10 фенантролина) в
течение 15 мин при 37 °C. с - Влияние FSCP на продолжительность кровотечения из хвостовой вены после введения FSCP
измеряли спустя 10 мин после внутривенного введения PBS или различных количеств белка FSCP. d - Влияние ингибито
ров на продолжительность кровотечения из хвостовой вены. FSCP (4 мкг) предварительно инкубировали с 5 мМ IAA в те
чение 15 мин при 37 °C. Каждое значение представляет среднее ± SD от трех независимых определений (р < 0,01)
1,8 и 2 мин соответственно (рис. 7, c). Однако
FSCP обладает антитромбоцитарной активH
хроматограммы, полученные в обоих случаях,
ностью. FSCP (6 мкг) ингибировал агрегацию
отличались друг от друга. Было установлено, что
отмытых тромбоцитов, индуцированную раз
FSCP расщеплял фибриноген с С конца. На рис.
личными агонистами, такими как ADP, эпинеф
7, d и e представлена картина разделения белко
рин, тромбин, коллаген, арахидоновая кислота
вых полос конечных продуктов деградации фиб
и PAF. Процент ингибирования индуцирован
риногена, выявленная с помощью SDS PAGE.
ной вышеуказанными агонистами агрегации
Таблица 3. Доза зависимое влияние FSCP на время свертывания человеческой плазмы в норме
FSCP, мкг
PT, с
PT (INR)
APTT, с
Коэффициент APTT
0
11 ± 0,01
0,89 ± 0,05
34 ± 0,02
1,31 ± 0,09
2
11 ± 0,05
0,98 ± 0,02
47 ± 0,07
2,03 ± 0,01
4
12 ± 0,02
1,15 ± 0,07
71 ± 0,05
3,99 ± 0,05
6
12 ± 0,08
1,08 ± 0,03
96 ± 0,01
5,40 ± 0,01
8
11 ± 0,03
0,91 ± 0,09
127 ± 0,09
7,54 ± 0,03
10
11 ± 0,1
1,03 ± 0,04
166 ± 0,03
9,11 ± 0,02
БИОХИМИЯ том 85 вып. 9 2020
АНТИКОАГУЛЯНТНОЕ ДЕЙСТВИЕ ПРОТЕАЗЫ ИЗ СЕМЯН ЛЬНА
1315
тромбоцитов при инкубации с FSCP был равен
антикоагулянтными, антитромбоцитарными и
62%, 73%, 57%, 88%, 70% и 60% соответственно
фибринолитическими свойствами. FSCP был
(рис. 8, а). Сравнение изученных агонистов по
успешно очищен с использованием методов
казало, что FSCP ингибировал агрегацию отмы
гель фильтрации и ионообменной хроматогра
тых тромбоцитов в следующем порядке: колла
фии. FSCP является мономерным белком, по
ген > эпинефрин > арахидоновая кислота >
скольку он движется в виде одной полосы при
ADP > фактор активации тромбоцитов > тромбин.
SDS PAGE как в восстанавливающих, так и в
FSCP является нетоксичным белком. Было
невосстанавливающих условиях и элюируется в
установлено, что FSCP не токсичен, так как он
виде одного пика при RP HPLC. Эти результаты
не повреждает мембраны эритроцитов. FSCP
также указывают на гомогенность и чистоту по
также не повреждал кровеносные сосуды, что
лученного нами препарата фермента. Точная
позволяет предположить отсутствие у него ге
молекулярная масса, определенная с помощью
моррагической активности (рис. 8, b). В поду
масс спектрометрии MALDI TOF, составляет
шечках ног экспериментальных мышей не было
168 кДа. Вторичная структура FSCP содержала
выявлено накопления жидкости и поэтому мож
спиральные структуры, повороты спирали и
но считать, что белок FSCP не обладает способ
структуры типа «случайный клубок», но не име
ностью вызывать появление отеков (рис. 8, c).
ла бета складчатых структур. FSCP расщеплял
казеин и желатин с удельной активностью 3,45 и
4,20 ед./ мин на мг белка соответственно при
ОБСУЖДЕНИЕ
37 °C. Оптимальное значение pH для этого фер
мента оказалось равным 6,0. Оптимум темпера
В настоящем исследовании мы очистили и
туры был определен как 30 °C, и наибольшая
охарактеризовали FSCP - фермент с сильными степень гидролиза субстратов наблюдалась че
Рис. 5. a - Гидролиз фибриногена (50 мкг) в течение 4 ч при 37 °C в отсутствие фермента (1) и в присутствии 2 мкг (2),
4 мкг (3), 6 мкг (4), 8 мкг (5) и 10 мкг (6) белка FSCP. Продукты гидролиза после электрофореза в 10% SDS PAGE в вос
станавливающих условиях. b - Гидролиз фибриногена (50 мкг) белком FSCP (4 мкг) после инкубации в течение 0 ч (1),
4 ч (2), 8 ч (3), 12 ч (4), 16 ч (5) и 24 ч (6) при 37 °C. c - Влияние ингибиторов протеаз на фибриногенолитическую актив
ность белка FSCP. FSCP (4 мкг) предварительно инкубировали с ингибиторами протеаз (5 мM) в течение 30 мин при
37 °C. Реакцию начинали добавлением 50 мкг фибриногена и реакционную смесь инкубировали в течение 4 ч: 1 - только
фибриноген, 2 - фибриноген в присутствии FSCP, 3 - FSCP и PMSF, 4 - FSCP и IAA, 5 - FSCP и EDTA и 6 - FSCP и
1,10 фенантролин. M - маркеры молекулярной массы, кДа. d - Деградация белков плазмы крови человека. Белки плаз
мы крови (100 мкг) инкубировали в отсутствие фермента (1) или в присутствии 2 мкг (2), 4 мкг (3), 6 мкг (4), 8 мкг (5) и
10 мкг (6) белка FSCP в 40 мкл 10 мМ Tris HCl буфера (pH 7,4) при 37 °C. Затем их анализировали с помощью 7,5% SDS
PAGE в невосстанавливающих условиях. В качестве контроля использовали фибриноген (20 мкг)
БИОХИМИЯ том 85 вып. 9 2020
12*
1316
НАНДИШи др.
Рис. 6. Фибринолитическая активность FSCP. a - Колориметрическое определение фибринолитической активности. От
мытый сгусток крови инкубировали с 0-10 мкг белка FSCP в течение 2,5 ч и деградацию субстрата оценивали по погло
щению при 660 нм. b - Влияние количества белка FSCP на гидролиз сгустков крови. Промытый сгусток плазмы крови
инкубировали течение 12 ч: в отсутствие фермента (1), с 2 мкг (2), 4 мкг (3), 6 мкг (4), 8 мкг (5) и 10 мкг (6) FSCP. Продук
ты реакции анализировали с помощью метода SDS PAGE (7,5%). с - Зависимость гидролиза сгустков крови от продол
жительности инкубации. Фибриновый сгусток инкубировали при 37 °C в отсутствие фермента (1) или в присутствии бел
ка FSCP (4 мкг) в течение 0 ч (2), 6 ч (3), 12 ч (4), 18 ч (5) и 24 ч (6). d - Ингибирование активности FSCP. FSCP (4 мкг)
предварительно инкубировали с ингибиторами протеаз (5 мМ) в течение 30 мин при 37 °C. Реакцию запускали добавле
нием фибринового сгустка. Реакционную смесь инкубировали в течение 12 ч: фибриновый сгусток (1), фибриновый сгус
ток в присутствии FSCP (2), FSCP и PMSF (3), FSCP и IAA (4), FSCP и EDTA (5); FSCP и 1,10 фенантролин (6)
рез 150 мин реакции. В структуре белка FSCP
протромбин, тромбин, фибриноген, фибрино
отсутствуют углеводные остатки, так как этот
вый сгусток и фактор XIII). Активация выше
белок не образовывал основания Шиффа. IAA
указанных факторов имеет место при воздей
ингибировала активность FSCP. В то же время
ствии необычных поверхностей и/или повреж
он был малочувствителен к действию хелаторов
дении тканей через активацию зимогенов [32].
металлов (EDTA и 1,10 фенантролин) и ингиби
Антикоагулянты обычно блокируют специфи
тора сериновых протеаз (PMSF). Поэтому нами
ческие факторы внутренних, внешних и/или об
было предположено, что этот фермент принад
щих путей свертывания крови. FSCP показал
лежит к цистеиновым протеазам. В семенах со
сильную антикоагулянтную активность как in
держится удивительно большое количество про
vitro, так и in vivo. Тест APTT оценивает актив
теолитических ферментов, включая сериновые,
ность внутренних факторов пути в образовании
цистеиновые, аспартат зависимые протеазы и
сгустка, в то время как тест PT оценивает ини
металлопротеазы [27]. Были всесторонне изуче
циацию образования сгустка через внешний
ны сериновые протеазы и металлопротеазы из
путь [33]. Тот факт, что FSCP увеличивал время
латекса растений, клещей, дождевых червей, гу
образования сгустка только в тесте APTT, но не
сениц и различных ядов змей, пауков, пчел и се
в тесте PT, предполагает вмешательство этого
мян растений [28-30]. В то время как цистеино
фермента во внутренний путь свертывания кро
вые протеазы из семян растений были охаракте
ви. Однако точное место действия FSCP на
ризованы в наименьшей степени.
внутреннем пути остается неясным. Антикоагу
Гемостаз - это физиологическое явление,
лянтное действие белка FSCP in vitro и in vivo
которое играет ключевую роль в остановке кро
полностью отменялось йодоуксусной кислотой,
вотечения, возникающего при повреждении
что указывает на ключевую роль остатков цистеи
кровеносных сосудов [31]. В его поддержании
на. Протеазы, которые принимают участие в
участвуют факторы коагуляции внутреннего пу
каскаде свертывания крови, запуская про или
ти (факторы IX-XII), факторы коагуляции
антикоагулянтную активность, были обнаруже
внешнего пути (тканевой фактор и фактор VII)
ны у змей, пауков и в латексе растений [34-36].
и факторы коагуляции общего пути (фактор X,
Протеазы из змеиного яда (Ancrod) и грибов
БИОХИМИЯ том 85 вып. 9 2020
АНТИКОАГУЛЯНТНОЕ ДЕЙСТВИЕ ПРОТЕАЗЫ ИЗ СЕМЯН ЛЬНА
1317
Рис. 7. Результат HPLC 50 мкг фибриногена (a) и продуктов его деградации, вызванной тромбином человека (b) и FSCP
(c). d, e - SDS PAGE (10%) продуктов деградации фибриногена тромбином (d) и конечные продукты деградации белком
FSCP (e)
Рис. 8. а - Влияние FSCP (6 мкг) на агрегацию отмытых тромбоцитов, индуцированную аденозиндифосфатом (10 мкМ
ADP + 50 мкг фибриногена), эпинефрином (5 мкМ эпинефрина + 50 мкг фибриногена), тромбином (2 мкМ), коллагеном
(5 мкг), арахидоновой кислотой (50 мкМ) и PAF (2 мкМ). b - Влияние FSCP на гемолитическую активность: FSCP
(0-100 мкг) предварительно инкубировали в течение 30 мин с обработанными физраствором упакованными эритроцита
ми. Процент эритроцитов, подвергшихся лизису, рассчитывали по измерению свободного гемоглобина в супернатанте
при 540 нм. c - Геморрагическая активность FSCP : I - физраствор, II - положительный контроль, яд из Daboia russelli,
III - 25 мкг, IV - 50 мкг и V - 100 мкг белка FSCP в общем объеме 50 мкл вводили мышам. d - Влияние FSCP на индук
цию отеков: положительный контроль, яд из MDH (I); физраствор (II); FSCP, 50 мкг (III) и 100 мкг (IV)
БИОХИМИЯ том 85 вып. 9 2020
1318
НАНДИШи др.
Aspergillus oryzae (Brinase) были использованы
ную PAF. Это может быть обусловлено специ
для лечения тромботических заболеваний [37,
фичностью взаимодействия FSCP с рецептора
38]. Было показано, что протеазы, которые
ми тромбоцитов или с другими агонистами.
участвуют в каскаде свертывания крови, могут
FSCP может распознавать в качестве субстратов
расщеплять фибриноген и фибрин человека
рецепторы тромбоцитов и расщеплять их, вызы
[39]. FSCP расщеплял Aα и Bβ цепи и частично
вая таким образом их инактивацию, что, в свою
γ цепь фибриногена человека. Ферменты, по
очередь, может влиять на связывание агонистов
добные тромбину, расщепляют фибриноген с его
с этими рецепторами. Другое предположение
N конца с образованием так называемых фиб
заключается в том, что отдельные агонисты мо
ринопептидов A и Б, способствуя свертыванию
гут взаимодействовать с различными доменами
крови [40]. Расщепление фибриногена с C кон
FSCP и регулировать (понижать) его способ
ца вызывает образование укороченных фраг
ность ингибировать агрегацию тромбоцитов.
ментов, отличающихся от этих фибринопепти
Поэтому наблюдается снижение степени инги
дов, приводит к задержке коагуляции [41]. По
бирования агрегации тромбоцитов. Тем не менее
этому чтобы определить место действия белка
в настоящее время преждевременно говорить о
FSCP на фибриноген, нами было проведено
точном механизме действия FSCP на каскад
сравнение конечных продуктов деградации
свертывания крови и функционирование тром
фибриногена с помощью тромбина и FSCP. Ин
боцитов, опираясь на результаты изучения их
тересно, что при этом не было выявлено соответ
взаимодействия. Ранее были охарактеризованы
ствия между конечными продуктами деграда
различные антитромбоцитарные агенты из при
ции, вызванными действием тромбина и FSCP.
родных источников [46-48], включая покрытые
Поэтому можно предположить, что запускаемая
лигнином наночастицы [49], локснекрогин из
белком FSCP антикоагуляция может быть след
яда коричневого паука Loxosceles gauchor [50] и
ствием деградации фибриногена с его C конца.
сериновая протеаза из яда паука Hippasa agele
Фибриногенoлитическая активность FSCP пол
noides [34]. FSCP оказался неспособен нарушать
ностью ингибировалась только IAA, но не инги
целостность мембран эритроцитов, и поэтому
биторами сериновых протеаз и металлопротеаз,
он не вызывал высвобождение гемоглобина из
что указывает на роль остатка цистеина в актив
эритроцитов. Кроме того, он не повреждал кро
ном центре этого фермента. Цистеиновые про
веносные сосуды и не демонстрировал геморра
теазы ранее были получены из латекса Asclepias
гическую активность. Также FSCP не вызывает
curassavica L., растения семейства молочного де
появление отеков на подушечках ног экспери
рева (Asclepiadaceae) [41]. Протеаза Pergularain E
ментальных мышей, что указывает на отсутствие
I, выделенная из латекса Pergularia extensa, рас
у него токсичности.
щепляла цепи фибриногена с его N конца и бы
ла похожа по своим свойствам на тромбин [10].
В целом, в настоящей работе из буферного
Полученная нами FSCP продемонстрировала
экстракта семян льна был выделен высокомоле
фибринолитическую активность и расщепляла
кулярный (168 кДа) белок FSCP. Нами были
все цепи фибрина. Образование сгустков и их
продемонстрированы сильные антикоагулянт
последующее растворение играют основную
ные и антитромбоцитарные свойства этого бел
роль не только при заживлении ран, но и при
ка. Наблюдаемая антикоагулянтная активность
нормальном токе крови в артериях и венах
FSCP может быть связана с его участием во
[42-43]. Нарушение растворения сгустков также
внутреннем пути свертывания крови. FSCP так
является основным фактором, вносящим вклад
же специфически расщеплял фибриноген и
в патофизиологию тромбоза [44]. Так, устойчи
фибрин. Следовательно, большой интерес
вый к нагреванию низкомолекулярный глико
представляет изучение в дальнейшем механизма
протеин латекса из Synadenium grantii показывал
действия FSCP на каскад свертывания крови и
фибринолитическую активность [45]. Кроме
функционирование тромбоцитов.
фибриногена, FSCP не расщеплял белки плазмы
крови. Более того, FSCP ингибировала процесс
агрегации отмытых тромбоцитов, индуцирован
Благодарности. D.S. и S.K. выражают благо
ный различными агонистами, такими как ADP,
дарность департаменту науки и технологий,
эпинефрин, тромбин, коллаген, арахидоновая
правительству Индии, Нью Дели и группе под
кислота и PAF. Из всех изученных в настоящей
держки развития науки и технологий при прави
работе агонистов белок FSCP более всего инги
тельстве штата Карнатака, Бангалор, за оказан
бировал агрегацию тромбоцитов, индуцирован
ную финансовую поддержку.
ную коллагеном, и в наименьшей мере он инги
Конфликт интересов. Авторы заявляют об от
бировал агрегацию тромбоцитов, индуцирован
сутствии конфликта интересов.
БИОХИМИЯ том 85 вып. 9 2020
АНТИКОАГУЛЯНТНОЕ ДЕЙСТВИЕ ПРОТЕАЗЫ ИЗ СЕМЯН ЛЬНА
1319
Соблюдение этических норм. Все экспери
митетом по этике работы с лабораторными жи
менты проводились в соответствии с руковод
вотными (UOM/IAEC/02/2016), университет
ствами по этике и были одобрены институцио
штата Майсур, Майсуру, Индия. Работа с лабо
нальным комитетом по этике работы с челове
раторными животными проводилась в соответ
ком (IHEC UOM No. 47Res/2014-15), универ
ствии с руководством комитета по контролю и
ситет штата Майсур, Майсуру, Индия. Проведе
надзору за экспериментами над животными
ние экспериментов над лабораторными живот
(CPCSEA - Committee for the purpose of monitor
ными было разрешено институциональным ко
ing and supervision of experiments on animals).
СПИСОК ЛИТЕРАТУРЫ
1.
Tarpila, A., Wennberg, T., and Tarpila, S. (2005) Flaxseed
18.
Sowmyashree, G., Bhagyalakshmi, M., Girish, K. S.,
as a functional food, Curr. Top. Nutr. Res., 3, 167 188.
Kemparaju, K., Rangaiah, S. M., and Jane, H. P. (2015)
2.
Yadav, R. P., Patel, A. K., and Jagannadham, M. V. (2011)
Jackfruit (Artocarpush eterophyllus) seed extract exhibits
Purification and biochemical characterization of a chy
fibrino(geno)lytic activity, Pharmacogn. J., 7, 171 177.
motrypsin like serine protease from Euphorbia neriifolia
19.
Quick, A. J., Stanley, M., and Bancroft, F. W. (1935) A
Linn, Process Biochem., 46, 1654 1662.
study of the coagulation defect in hemophilia and in jaun
3.
Mahajan, R. T., and Chaudhary, G. M. (2014) Plant latex
dice, Am. J. Med. Sci., 190, 501 511.
as vegetable source for milk clotting enzymes and their use
20.
Bhagyalakshmi, M., Sowmyashree, G., Kesturu, G. S.,
in cheese preparation, Int. J. Adv. Res., 2, 1173 1181.
Kempaiah, K., and Sathish, J. G. (2015) Momordica charan
4.
Fox, J. W., and Serrano, S. M. (2005) Structural consider
tia seed extract exhibits strong anticoagulant effect by specifi
ations of the snake venom metalloproteinases, key mem
cally interfering in intrinsic pathway of blood coagulation and
bers of the M12 reprolysin family of metalloproteinases,
dissolves fibrin clot, Blood Coagul. Fibrin., 26, 191 199.
Toxicon, 45, 969 985.
21.
Ouyang, C., and Teng, C. M. (1976) Fibrinogenolytic
5.
Koh, D. C., Armugam, A., and Jeyaseelan, K. (2006)
enzymes of Trimeresurus mucrosquamatus venom,
Snake venom components and their applications in bio
Biochim. Biophys. Acta, 420, 298 308.
medicine, Cell. Mol. Life Sci., 63, 3030 3041.
22.
Rajesh, R., Raghavendra, C. D., and Nataraju, A. (2005)
6.
Larréché, S., Mion, G., and Goyffon, M.
(2008)
Procoagulant activity of Calotropisgigantea latex associat
Haemostasis disorders caused by snake venoms, Ann. Fr.
ed with fibrin(ogen)olytic activity, Toxicon, 46, 84 92.
Anesth. Reanim., 27, 302 309.
23.
Kumar, M. S., Devaraj, V. R., Vishwanath, V. S., and
7.
Zhu, Z. G., and Wu, S. G. (1999) Fibrinogenolytic prop
Kemparaju, K. (2010) Anti coagulant activity of a metallo
erties of natrahagin (a proteinase from cobra venom) and
protease: further characterization from the Indian cobra
its effect on human platelet aggregation, Zhongguo Yao Li
(Najanaja) venom, J. Thromb. Thrombolysis, 29, 340 348.
Xue Bao, 20, 944 947.
24.
Born, G. V. (1962) Aggregation of blood platelets by
8.
Kini, R. M., and Evans, H. J. (1991) Inhibition of platelet
adenosine diphosphate and its reversal, Nature, 194, 27 29.
aggregation by a fibrinogenase from Naja nigricollis venom
25.
Vishwanath, B. S., Kini, R. M., and Gowda, T. V. (1987)
is independent of fibrinogen degradation, Biochim.
Characterization of three edema inducing phospholipase
Biophys. Acta, 1095, 117 121.
A2 enzyme from habu (Trimeresurus flavoviridis) venom
9.
Guo, X. X., Zeng, L., and Lee, W. H. (2007) Isolation and
and their interaction with the alkaloid arisatolochic acid,
cloning of a metalloproteinase from king cobra snake
Toxicon, 25, 501 515.
venom, Toxicon, 49, 954 965.
26.
Kondo, H., Kondo, S., Itezawa, H., Murata, R., and
10.
Holenarasipur, S. V., Rajesh, R., Brigitte, F., Felix, F., and
Ohasaka, A. (1969) A study on the quantitative method
Bannikuppe, V. S. (2010) “Pergularain E I” - a plant cys
from determination of hemorrhagic activity of Habu snake
teine protease with thrombin like activity from Pergularia
venom, Jpn. J. Med. Sci. Biol., 13, 43 51.
extensa latex, Thromb. Res., 125, e100 e105.
27.
Ramachandraiah, C., Nandish, S. K. M., Kengaiah, J.,
11.
Gunter, R., Hans, P. S., and Friedrich, D. P. (2002)
Shivaiah, A., and Chandramma, S. (2017) Evaluation of
Activation and inactivation of human factor X by proteases
anticoagulant and antiplatelet activity of Pisum sativum
derived from Ficus carica, Br. J. Haematol., 119, 1042 1051.
Pod extract, J. Blood Res. Hematol. Dis., 2.
12.
Eagle, H., and Harris, T. N. (1937) Studies in blood coag
28.
Lynn, K. R., and Clevette, N. A. (1985) Two proteases
ulation: The coagulation of blood by proteolytic enzymes
from the latex of Euphorbia drupifera, Phytochemistry, 24,
(trypsin, papain), J. Gen. Physiol., 20, 543 560.
2843 2845.
13.
Nandish, M. S. K., Kengaiah, J., Ramachandraiah, C.,
29.
Yadav, S. C., Pande, M., and Jagannadham, M. V. (2006)
Shivaiah, A., Chandramma, S., and Girish, K. S. (2018)
Highly stable glycosylated serine protease from the medic
Anticoagulant, antiplatelet and fibrin clot hydrolyzing activi
inal plant Euphorbia milli, Phytochemistry, 67, 1414 1426.
ties of flax seed buffer extract, Pharmacogn. Mag., 14, 175 183.
30.
Devaraja, S., Nagaraju, S., Mahadeshwara, S. Y. H.,
14.
Bradford, M. M. (1976) Rapid and sensitive method for the
Girish, K. S., and Kemparaju, K. (2008) A low molecular
quantitation of microgram quantities of protein utilizing the
weight serine protease: purification and characterization
principle of protein dye binding, Anal. Biochem., 72, 248 54.
from Hippasa agelenoides (Funnel web) spider venom
15.
Laemmli, U. K. (1970) Cleavage of structural proteins dur
gland extract, Toxicon, 52, 130 138.
ing the assembly of the head of bacteriophage T4, Nature,
31.
Reis, C. V., Portaro, F. C. V., Andrade, A. S., Fritzen, M.,
227, 680 685.
Fernandes, B. L., and Sampaio, C. A. M. (2006) A pro
16.
Leach, B. S., Collawn, J. F., and Fish, W. W. (1980)
thrombin activator serine protease from the Lonomia obi
Behavior of glycol polypeptides with empirical molecular
qua Caterpillar venom (Lopap): biochemical characteriza
weight estimation methods in sodium dodecyl sulphate,
tion, Thromb. Res., 102, 427 436.
Biochemistry, 9, 5734 5741, doi: 10.1021/bi00566a011.
32.
Kumar, R. V., Gowda, C. D., Shivaprasad, H. V., Siddesha,
17.
Satake, M., Murata, Y., and Suzuki, Y. (1963) Studies on
J. M., Sharath, B. K., and Vishwanath, B. S. (2010)
snake venoms XIII Chromatographic separation and prop
Purification and characterization of “Trimarin” a hemor
erties of three proteinases from Agkistrodon halys
rhagic metalloprotease with factor Xa like Activity, from
blomhoffii venom, J. Biochem., 53, 483 497, doi: 10.1093/
Trimeresurus malabaricus snake venom, Thromb. Res.,
oxfordjournals.jbchem.a127720.
126, e356 e364.
БИОХИМИЯ том 85 вып. 9 2020
1320
НАНДИШи др.
33.
Gowda, C. D., Shivaprasad, H. V., Kumar, R. V., Rajesh, R.,
42. Veiga, S. S., da Sliveria, R. R., Dreyfuss, J. L., Haoach, J.,
Saikumari, Y. K., and Frey, B. M. (2011) Characteriz ation
Pereira, A. M., and Mangili, O. C. (2000) Identification of
of major zinc containing myonecrotic and Procoagulant
high molecular weight serine proteases in Loxosceles inter
metalloprotease “malabarin” from non lethal trimeresurus
media (Brown spider) venom, Toxicon, 38, 825 839.
malabaricus snake venom with thrombin like activity: its
43. Schwartz, M. L., Pizzo, S. V., Hill, R. L., and McKee, P. A.
neutralization by chelating agents, Curr. Top. Med. Chem.,
(1973) Human factor XIII from plasma and platelets: molecular
11, 2578 2588.
weights, subunit structures, proteolytic activation and cross
34.
Devaraja, S., Girish, K. S., Gowtham, Y. J. M., and
linking of fibrinogen and fibrin, J. Biol. Chem., 248, 1395 1407.
Kemparaju, K.
(2010) The Hag protease II is a
44. Lewis, S. D., Janus, T. J., Lorand, L., and Shafer, J. A.
fibrin(ogen)ase from Hippasa agelenoides spider venom
(1985) Regulation of formation of factor XIIIa by its fibrin
gland extract: purification, characterization and its role in
substrates, Biochemistry, 24, 6772 6777.
hemostasis, Toxicon., 57, 248 258.
45. Rajesh, R., Nataraju, A., Raghavendra, C. D., Frey, B. M.,
35.
Shivaprasad, H. V., Rajesh, R., Nanda, B. L., Dharmappa,
Frey, F. J., and Vishwanath, B. S. (2006) Purification and
K. K., and Vishwanath, B. S. (2009) Thrombin like activi
characterization of a 34 kDa, heat stable glycoprotein from
ty of Asclepias curassavica L. latex: action of cysteine pro
Synadenium grantii latex: action on human fibrinogen and
teases, J. Ethno Pharmacol., 123, 106 109.
fibrin clot, Biochimie, 88, 1313 1322.
36.
Asadi, H., Yan, B., Dowling, R., Wong, S., and Mitchell, P.
46. Kahn, M. L. (1998) A dual thrombin receptor system for
(2014) Advances in medical revascularisation treatment in
platelet activation, Nature, 394, 690 694.
acute ischemic stroke, Trombosis, 7, 42 48.
47. Sims, P. J., Wiedmer, T., Esmon, C. T., Weiss, H. J., and
37.
Larsson, L. J., Frisch, E. P., Törneke, K., Lindblom, T., and
Shattil, S. J. (1989) Assembly of the platelet prothrombi
Björk, I. (1988) Properties of the complex between alpha 2
nase complex is linked to vesiculation of the platelet plas
macroglobulin and brinase, a proteinase from Aspergillus
ma membrane, J. Biol. Chem., 264, 17049 17057.
oryzae with thrombolytic effect, Thromb. Res., 49, 55 68.
48. Giesen, P. L. (1999) Blood borne tissue factor: another view
38.
Drake, T. A., Morrissey, J. H., and Edgington, T. S. (1989)
of thrombosis, Proc. Natl Acad. Sci. USA, 96, 2311 2315.
Selective cellular expression of tissue factor in human tis
49. Marulasiddeshwara, M. B., Dakshayani, S. S., Sharath, K.
sues. Implications for disorders of hemostasis and throm
M. N., Chethana, R., Raghavendra, K. P., and Devaraja, S.
bosis, Am. J. Pathol., 134, 1087 1097.
(2017) Facile one pot green synthesis, antibacterial, anti
39.
Åstrup, T. (1958) The haemostatic balance, Thromb. Diath.
fungal, antioxidant and antiplatelet activities of lignin
Haemorrh., 2, 347 357.
capped silver nanoparticles: a promising therapeutic agent,
40.
Lu, Q. (2005) Snake venoms and haemostasis, J. Thromb.
Mater. Sci. Eng. C Mater. Biol. Appl., 81, 182 190, doi:
Hemostat., 3, 1791 1799.
10.1016/j.msec.2017.07.054.
41.
Shivaprasad, H. V., Riyaz, M., Venkatesh, K. R.,
50. Cunha, R. B., Barbaro, K. C., Muramatsu, D., Portaro, F.
Dharmappa, K. K., Tarannum, S., and Siddesha, J. M.
C. V., Fontes, W., and de Souza, M. V. (2003) Purification
(2009) Cysteine proteases from the Asclepiadaceae plants
and characterization of Loxnecrogin a dermonecrotic
latex exhibited thrombin and plasmin like activities, J.
toxin from Loxosceles gaucho Brown spider venom, J.
Thromb. Thrombolysis, 28, 304 308.
Protein Chem., 22, 135 146.
FLAXSEED CYSTEINE PROTEASE EXHIBITS STRONG ANTICOAGULANT,
ANTIPLATELET, AND CLOTHDISSOLVING PROPERTIES
S. K. M. Nandish1, J. Kengaiah1, Ch. Ramachandraiah1, Chandramma1, A. Shivaiah1,
S. M. Santhosh2, Thirunavukkarasu3, and D. Sannaningaiah1a*
1 Department of Studies and Research in Biochemistry and Centre for Bioscience and Innovation,
Tumkur University, 572103 Tumkur, India; E mail: sdevbiochem@gmail.com
2 Department of Medicinal Biochemistry and Microbiology (IMBM), Uppsala Biomedical Centre, 75237 Uppsala, Sweden
3 Department of Biochemistry and Molecular Biology, School of Life Sciences,
Pondicherry University, 605014 Pondicherry, Tamil Nadu, India
Received March 21, 2020
Revised May 26, 2020
Accepted May 29, 2020
In this study, we purified and characterized flaxseed cysteine protease (FSCP) with strong anticoagulant, antiplatelet,
and clot dissolving properties. The enzyme was purified to homogeneity by a combination of gel permeation and ion
exchange column chromatography techniques. The purity of the enzyme was evaluated by SDS PAGE, RP HPLC,
and MALDI TOF. FSCP was observed a single band of approximately 160 kDa in SDS PAGE under reducing and
non reducing conditions. The exact molecular mass of FSCP was found to be 168 kDa by MALDI TOF. The CD
spectra of FSCP revealed the presence of 25.6% helices, 25.8% turns, and 48% random coils with no beta sheet struc
tures. FSCP hydrolyzed both casein and gelatin with a specific activity of 3.5 and 4.2 unit/mg min respectively. The
protef olytic activity of FSCP was completely abolished by iodoacetic acid (IAA), suggesting FSCP is a cysteine pro
tease. The pH optimum for the proteolytic activity of FSCP was pH 6.0; the temperature optimum was 30°C. FSCP
exhibited strong anticoagulant effect in both platelet rich plasma (PRP) and platelet poor plasma (PPP) by extend
ing the clotting time from 222 to 1100 s and from 256 to 1210 s, respectively. FSCP degraded human fibrinogen and
fibrin clots. The products of fibrinogen degradation by thrombin and FSCP were different. Furthermore, FSCP inhib
ited aggregation of washed platelets triggered by ADP, epinephrine, thrombin, collagen, arachidonic acid, and platelet
activating factor (PAF). FSCP was found to be nontoxic as it did not damage the membrane of red blood cells (RBCs)
and did not induce hemorrhage and edema in experimental mice.
Keywords: cysteine protease, anticoagulant, antiplatelet, non toxic
БИОХИМИЯ том 85 вып. 9 2020