БИОХИМИЯ, 2021, том 86, вып. 1, с. 6 - 13
УДК 577.355
СОТРУДНИЧЕСТВО С АЛЕКСАНДРОМ КОНСТАНТИНОВЫМ
В ИССЛЕДОВАНИИ МЕХАНИЗМОВ ЭЛЕКТРОГЕННЫХ РЕАКЦИЙ
В БАКТЕРИАЛЬНЫХ ФОТОСИНТЕТИЧЕСКИХ
РЕАКЦИОННЫХ ЦЕНТРАХ
Мини обзор
© 2021
О.П. Каминская1, А.Ю. Семенов2,3*
1 Институт фундаментальных проблем биологии РАН ФИЦ «Пущинский научный центр
биологических исследований РАН», 142290 Пущино, Московская обл., Россия
2 НИИ физико/химической биологии им. А.Н. Белозерского, Московский государственный университет
имени М.В. Ломоносова, 119992 Москва, Россия; электронная почта: semenov@belozersky.msu.ru
3 Федеральный исследовательский центр химической физики им. Н.Н. Семенова РАН, 119991 Москва, Россия
Поступила в редакцию 15.10.2020
После доработки 11.11.2020
Принята к публикации 21.11.2020
Рассмотрены работы авторов 1985-1988 гг., выполненные в сотрудничестве с А.А. Константиновым, одним
из крупнейших ученых в области мембранной биоэнергетики. Работы, посвященные исследованию быст#
рой кинетики генерации мембранного потенциала в фотосинтетических реакционных центрах (РЦ) пур#
пурных бактерий в ответ на лазерную вспышку, позволили детально изучить механизмы электрогенных ре#
акций на донорном и акцепторном участках РЦ. На протеолипосомах, содержащих РЦ из несерных пурпур#
ных бактерий Rhodospirillum rubrum, была выявлена электрогенная стадия, связанная с внутрибелковым пе#
реносом электрона к фотоокисленному димеру бактериохлорофилла Р870 от экзогенных вторичных доно#
ров - редокс#красителей и растворимых цитохромов (цит) типа с. Обнаружено, что восстановление вторич#
ного хинонного акцептора электрона QB в хроматофорах из R. rubrum в ответ на четные вспышки света, со#
провождающееся протонированием хинона, имеет электрогенный характер. Были определены спектраль#
ные характеристики и окислительно#восстановительные потенциалы четырех гемов прочносвязанного
цит с в РЦ Blastochloris viridis и стадии электрогенеза, связанные с переносом электрона в комплексе РЦ.
Впервые было проведено сопоставление относительных амплитуд мембранного потенциала, генерируемо#
го в ходе отдельных электрогенных реакций, с расстояниями между редокс#кофакторами, полученными на
основе трехмерной структуры РЦ Bl. viridis.
КЛЮЧЕВЫЕ СЛОВА: бактериальные фотосинтетические реакционные центры, перенос электрона, пря#
мой электрометрический метод, мембранный потенциал, цитохром с, хинон.
DOI: 10.31857/S0320972521010012
КРАТКИЙ ОБЗОР ПРЕДШЕСТВОВАВШИХ
электрогенных реакций в хроматофорах и фото#
РАБОТ ПО ИССЛЕДОВАНИЮ
синтетических реакционных центрах (РЦ), вы#
ЭЛЕКТРОГЕННЫХ РЕАКЦИЙ
деленных из несерных пурпурных бактерий
В РЕАКЦИОННЫХ ЦЕНТРАХ
Rhodospirillum rubrum и Rhodobacter (прежнее наз#
ФОТОСИНТЕЗИРУЮЩИХ БАКТЕРИЙ
вание - Rhodopseudomonas) sphaeroides и из сер#
С ИСПОЛЬЗОВАНИЕМ ПРЯМОГО
ных пурпурных бактерий Blastochloris (прежнее
ЭЛЕКТРОМЕТРИЧЕСКОГО МЕТОДА
название
- Rhodopseudomonas) viridis
[1-6].
В 1974-1976 гг. Л.А. Драчевым, А.Д. Кауленом и
В 1985-1988 гг. авторы этой статьи сотрудни#
одним из авторов настоящего обзора (А.С.) был
чали с Александром Александровичем Констан#
разработан прямой электрометрический метод
тиновым в изучении природы и механизмов
регистрации электрической активности мемб#
Принятые сокращения: ДАД - 2,3,5,6#тетраметил#п#фенилендиамин (диаминодурен); РЦ - реакционные центры;
ТМФД - N,N,N′,N′#тетраметил#п#фенилендиамин; ФМС - феназинметосульфат; цит - цитохром; Em - среднеточечный
редокс#потенциал; Δψ - трансмембранная разность электрических потенциалов; Р870 (Р960) - димеры бактериохлорофил#
ла в РЦ; QA, QB - первичный и вторичный хинонные акцепторы электрона; τ - характерное время реакции.
* Адресат для корреспонденции.
6
ЭЛЕКТРОГЕНЕЗ В БАКТЕРИАЛЬНЫХ РЕАКЦИОННЫХ ЦЕНТРАХ
7
ранных белков [7, 8]. С помощью этого метода
[13, 14]. Было предположено, что быстрая ком#
было установлено, что в бактериальных хромато#
понента спада Δψ обусловлена рекомбинацией
форах, ассоциированных с искусственной плос#
зарядов между фотоокисленным Р+870 и восста#
кой фосфолипидной мембраной, при стацио#
новленным Q-A. Медленная компонента спа#
нарном освещении в присутствии редокс#медиа#
да Δψ с характерным временем τ ≥ 0,5 c отража#
торов наблюдается образование трансмембран#
ла процесс пассивного разряда Δψ на искус#
ной разности электрических потенциалов (Δψ)
ственной мембране и мембране хроматофора.
со знаком плюс внутри хроматофоров [9, 10].
Было обнаружено, что спад Δψ замедлялся в
Было обнаружено, что в такой системе фото#
присутствии восстановленного ФМС.
индуцированный перенос электронов ограни#
чен восстановлением первичного хинонного ак#
цептора QA, предположительно вследствие вы#
АНАЛИЗ КИНЕТИКИ СПАДА
мывания вторичного хинона QВ и эндогенного
ФОТОЭЛЕКТРИЧЕСКОГО ОТВЕТА
пула убихинона в объем липидной фазы искус#
ХРОМАТОФОРОВ R. rubrum
ственной мембраны [9-11]. Показано, что экзо#
И ПРОТЕОЛИПОСОМ С РЦ R. rubrum,
генные редокс#кофакторы - доноры и акцепто#
ВСТРОЕННЫХ В КОЛЛОДИЕВУЮ
ры электрона (аскорбат, N,N,N′,N′#тетраметил#
ФОСФОЛИПИДНУЮ МЕМБРАНУ
п#фенилендиамин (ТМФД), диаминодурен
(ДАД), феназинметосульфат (ФМС), 2,6#ди#
Работы 1985-1988 гг., выполненные нами в
хлорфенолиндофенол (ДХФИФ), метиленовый
сотрудничестве с А.А. Константиновым [1-6],
синий, искусственные хиноны) - поддержива#
посвящены детальному исследованию кинетики
ют стационарный фотопотенциал, обеспечивая
нарастания и спада мембранного потенциала,
многократное ревосстановление фотоокислен#
генерируемого фотосинтетическими РЦ пур#
ного первичного донора РЦ - димера бактерио#
пурных бактерий в ответ на лазерную вспышку.
хлорофилла Р870 - и реокисление фотовосста#
Большой вклад в экспериментальную часть этих
новленного QA [10].
работ внесли С.М. Драчева и М.Д. Мамедов.
Применение коллодиевой пленки в качестве
С использованием метода парных вспышек
каркаса для плоской фосфолипидной мембраны
нами было доказано, что быстрая компонента
позволило регистрировать кинетику генера#
спада индуцированного лазерной вспышкой
ции Δψ в ответ на лазерную вспышку с времен#
фотопотенциала с τ ~ 70 мс в хроматофорах
ным разрешением ~200 нс [12]. В работах этого
R. rubrum, ассоциированных с коллодиевой
периода, выполненных в лаборатории Л.А. Дра#
мембраной, обусловлена возвратом электрона
чева [11-15], было показано, что освещение
от Q-A к Р+870 [4]. Показано, что вклад медленной
хроматофоров пурпурных бактерий одиночной
(τ ≥ 0,5 c) компоненты в кинетику спада Δψ уве#
лазерной вспышкой вызывает быстрое, не раз#
личивается в присутствии эффективных доно#
решаемое по кинетике, образование Δψ. Пока#
ров и акцепторов электрона, способных восста#
зано, что наблюдаемая быстрая стадия обуслов#
навливать либо окислять компоненты ион#ра#
лена переносом электрона между Р870 (или Р890 -
дикальной пары Р+870Q-A и, как следствие, образо#
в случае хроматофоров из серных пурпурных
вывать долгоживущие состояния Р870Q-A и Р+870QA.
бактерий
Chromatium
minutissimum
и
Было продемонстрировано, что относительная
Ectothiorhodospira shaposhnikovii) и первичным
амплитуда медленной компоненты темнового
хинонным акцептором QA. Кроме того, в хрома#
спада Δψ может быть использована для оценки
тофорах C. minutissimum и E. shaposhnikovii, РЦ
скорости восстановления Р+870 и окисления Q-A
которых имеет в своем составе прочносвязан#
экзогенными редокс#кофакторами. Показано,
ный четырехгемовый цитохром (цит) с, наблю#
что эффективными восстановителями для Р+870
далась дополнительная стадия образования Δψ,
являются редокс#медиаторы ТМФД, ДАД,
связанная с восстановлением фотоокисленно#
ФМС, ДХФИФ, а эффективными акцепторами
го P890 от цит с. Было предположено, что вклад в
электрона от Q-A - 1,4#бензохинон, растворимые
генерацию Δψ может вносить и реакция окисле#
аналоги убихинона Q#1 и Q#2, а также убихи#
ния QA - либо при переносе электрона на внеш#
нон#10 (Q#10), добавляемый в раствор фосфо#
ний акцептор, либо при восстановлении вто#
липидов в н#декане, применявшийся для про#
ричного хинонного акцептора QВ.
питки коллодиевой пленки [4].
Исследования показали, что Δψ, генерируе#
Данные о том, что экзогенный убихинон
мая встроенными в коллодиевую фосфолипид#
способен быстро реокислять Q-A и тем самым
ную мембрану хроматофорами в ответ на еди#
предотвращать рекомбинацию ион#радикаль#
ничную вспышку, спадает с гетерогенной кине#
ной пары, указывали на реконструкцию функ#
тикой в шкале десятков миллисекунд-секунд
ции QB в системе встроенных хроматофоров.
БИОХИМИЯ том 86 вып. 1 2021
8
КАМИНСКАЯ, СЕМЕНОВ
При насыщающих концентрациях убихинона в
В работе Drachev et al. [3] впервые с высоким
коллодиевой мембране реакция Q-A → QB рекон#
разрешением была измерена быстрая кинетика
струировалась в 75% РЦ [4]. Замедление спа#
генерации мембранного потенциала в ходе вос#
да Δψ, вызванное добавлением Q#10, полностью
становления Р870 от цит с из сердца лошади и от
снималось ингибитором cайта QB о#фенантро#
цит с2, выделенного из R. rubrum. Было показа#
лином. Эти эксперименты подтвердили перво#
но, что в присутствии ≥ 0,1 мкM восстановлен#
начальное предположение о том, что ингибиро#
ного цит с в кинетике нарастания Δψ, помимо
вание переноса электрона с QA на QB в хромато#
не разрешаемой по времени быстрой стадии А
форах, встроенных в искусственную фосфоли#
(τ < 0,2 мкс), обусловленной разделением заря#
пидную мембрану, обусловлено экстракцией
дов между Р870 и QA, наблюдается дополнитель#
убихинона, связанного в сайте QB, в гидрофоб#
ная компонента с характерным временем τ в
ный объем искусственной мембраны [9, 10].
субмиллисекундной либо миллисекундной вре#
В экспериментах на хроматофорах R. rubrum
менной шкале, связанная с донированием
в качестве доноров электрона для фотоокислен#
электрона от цит с (стадия С). Было обнаруже#
ного Р870 необходимо было использовать прони#
но, что относительный вклад этой дополнитель#
кающие через мембрану восстановленные ре#
ной компоненты нарастания Δψ в суммарный
докс#медиаторы, поскольку донорный участок
электрогенез составляет 22-24% в присутствии
белкового комплекса РЦ локализован вблизи
митохондриального цит с (при его концентра#
внутренней поверхности мембраны хроматофо#
ции > 5-10 мкМ) и ~16% - в присутствии 7 мкМ
ров. Мы показали, что для исследования ре#
цит с2 из R. rubrum. Кинетический анализ ста#
докс#реакций Р+870 с непроникающими донорами
дии С свидетельствовал о насыщаемой реакции
электрона удобной моделью могут служить про#
второго порядка между цит с и Р+870 с максималь#
теолипосомы, содержащие изолированные РЦ
ным значением константы скорости kvmax =
из R. rubrum [3]. В таких протеолипосомах в от#
= 6·103 c-1 и константой Михаэлиса КМ =
вет на лазерную вспышку генерируется фотопо#
= 0,9 мкМ при низкой ионной силе. Скорость
тенциал со знаком минус внутри везикул, что
нарастания стадии С заметно снижалась при по#
указывает на локализацию Р870 вблизи от наруж#
вышении ионной силы, что соответствует
ной поверхности протеолипосомальной мемб#
представлению об ионном механизме взаимо#
раны, т.е. противоположную его локализации в
действия белка РЦ с цит с при образовании би#
хроматофорах R. rubrum. Добавление к протео#
молекулярного комплекса.
липосомам с РЦ из R. rubrum непроникающих
Важным этапом исследований электрогенеза
доноров электрона - гексааминорутения и цит с
в РЦ фотосинтезирующих бактерий явилось по#
из сердца лошади - приводило к значительному
нимание того, что электрогенный характер вос#
замедлению спада Δψ, генерируемой в ответ на
становления Р+870 не является специфичным для
лазерную вспышку. Этот факт свидетельствовал
растворимых цитохромов типа с как доноров
о быстром восстановлении фотоокисленно#
электрона, а имеет место и в случае восстанов#
го Р870 экзогенными редокс#кофакторами и по#
ленных форм редокс#медиаторов ТМФД, ДАД и
явлении долгоживущего состояния Р870Q-A.
ФМС. В присутствии высоких концентраций
ФМС и ТМФД, соответственно > 20 мкМ
и > 0,5 мМ, в шкале от сотен микросекунд до
ЭЛЕКТРОГЕННЫЕ РЕАКЦИИ
миллисекунд в хроматофорах R. rubrum в ответ
НА ДОНОРНОМ УЧАСТКЕ РЕАКЦИОННЫХ
на единичную вспышку появлялась дополни#
ЦЕНТРОВ ИЗ Rhodospirillum rubrum
тельная стадия нарастания Δψ с вкла#
дом 15-18% в суммарный электрогенез [1]. Ха#
Исследование электрогенеза, связанного с
рактерное время τ этой дополнительной компо#
переносом электрона между первичным доно#
ненты нарастания Δψ составляло ~250 мкс при
ром РЦ Р870 и растворимым цит с, затруднено в
концентрации ФМС 50 мкМ и ~2 мс - при кон#
случае хроматофоров из R. rubrum, поскольку
центрации ТМФД 4 мМ. Электрогенный харак#
эти замкнутые везикулы теряют значительную
тер восстановления Р+870 низкомолекулярными
часть эндогенного цит с2 при ультразвуковой об#
донорами электрона свидетельствовал об элект#
работке, при этом ориентированный внутрь
роизолированном расположении специальной
хроматофора донорный участок РЦ недоступен
пары в глубине белковой глобулы РЦ. Посколь#
для экзогенного цит с. Поэтому для исследова#
ку амплитуда дополнительной фазы нараста#
ния электрогенного восстановления Р+870 цито#
ния Δψ, обусловленной донированием электро#
хромами типа с мы использовали протеолипосо#
на от восстановленного ТМФД или ФМС, была
мы, содержащие изолированные комплексы
лишь немногим меньше амплитуды фазы С,
РЦ из R. rubrum.
наблюдаемой в присутствии цит с, было сделано
БИОХИМИЯ том 86 вып. 1 2021
ЭЛЕКТРОГЕНЕЗ В БАКТЕРИАЛЬНЫХ РЕАКЦИОННЫХ ЦЕНТРАХ
9
заключение, что основной вклад в электрогенез,
~10% суммарной амплитуды ответа (ста#
связанный с восстановлением Р+870, вносит век#
дия В) [2]. Эти данные явились первым свиде#
торный перенос электрона внутри белковой
тельством электрогенеза, сопряженного с про#
глобулы самого РЦ.
тонированием вторичного хинона в бактериаль#
ных РЦ.
Электрогенная стадия В, связанная с образо#
ГЕНЕРАЦИЯ Δψ ХРОМАТОФОРАМИ
ванием QBH2, характеризовалась τ 130 мкс,
R. rubrum ПРИ ПЕРЕНОСЕ
250 мкс и ~1 мс при рН 6,5, 7,5 и 9 соответствен#
ЭЛЕКТРОНА НА АКЦЕПТОРНОМ
но [2], что близко к величинам, измеренным для
УЧАСТКЕ РЦ
скорости переноса электрона от QA к QB в хро#
матофорах R. rubrum и РЦ Rba. sphaeroides [18,
Возможность реконструкции функции QB в
19] и скорости антимицин#нечувствительного
хроматофорах, ассоциированных с коллодиевой
связывания Н+ в хроматофорах Rba. sphaeroides
мембраной, позволила изучить вопрос об элект#
[20] (см. также обзоры [21, 22]). Тот факт, что
рогенезе, связанном с окислением QA вторич#
протонирование QB при образовании убихинола
ным хиноном QB [2]. Наши исследования пока#
в ответ на вторую вспышку сопряжено с генера#
зали, что перенос первого электрона от QA к QB
цией Δψ, указывает на векторный перенос Н+ из
(Q-AQB → QAQ-B) в хроматофорах R. rubrum не
внешней водной фазы к электроизолированно#
приводит к увеличению Δψ. Эти данные соответ#
му хинону QB, заглубленному внутрь белко#
ствовали заключению предшествовавшего ис#
вой глобулы РЦ.
следования электрогенеза в РЦ Rba. sphaeroides,
Рис. 1 суммирует данные по электрогенным
встроенных в плоскую бислойную мембра#
реакциям в РЦ R. rubrum, полученные в работах
ну [16] (позже была выявлена небольшая рН#за#
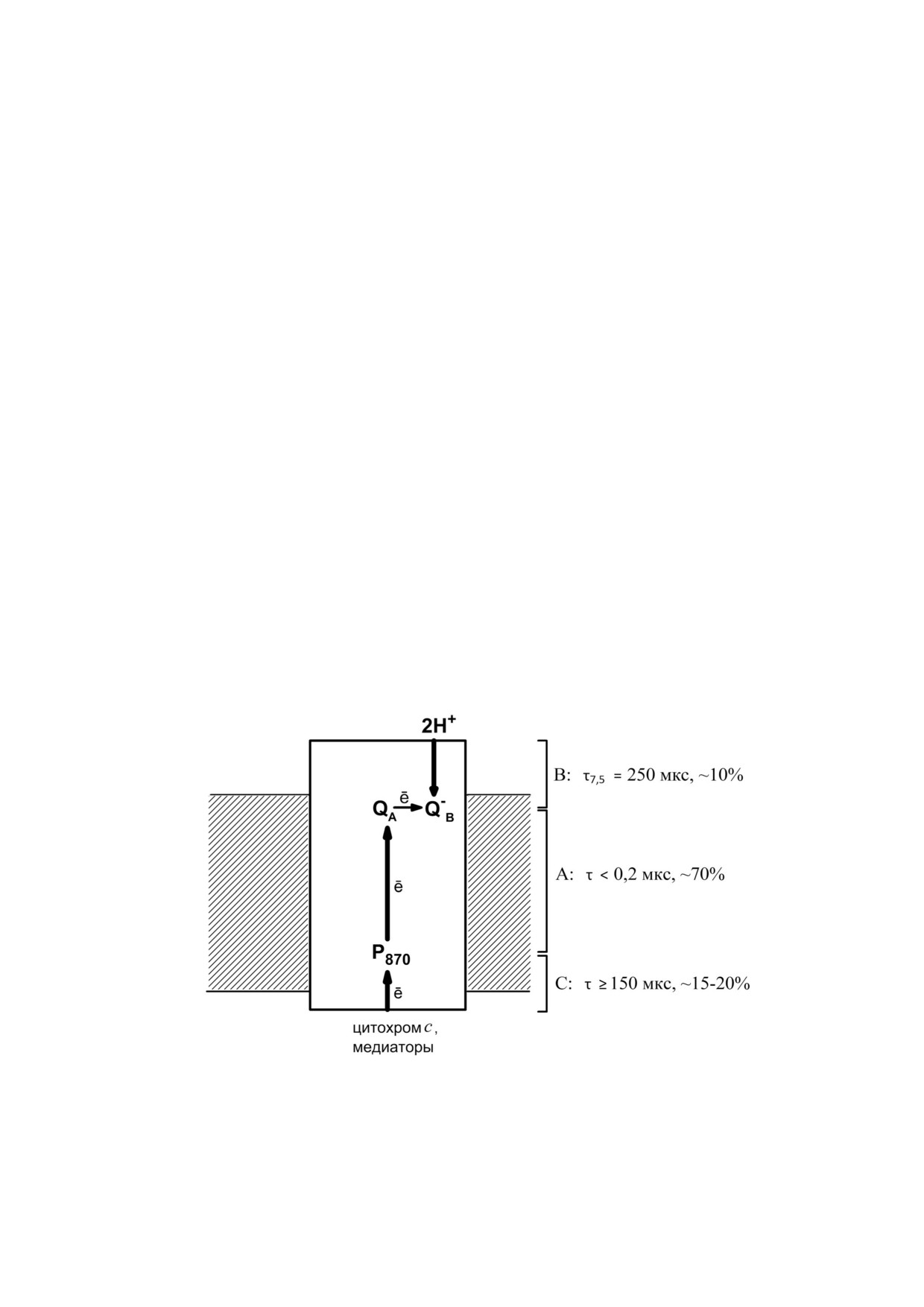
Drachev et al. [1-4]. Схема показывает три ста#
висимая электрогенная стадия, обусловленная
дии электрогенеза на мембране хроматофора,
протонированием аминокислотного остатка
сопряженного с переносом электрона в комп#
вблизи QB при образовании Q-B в ответ на еди#
лексе РЦ. Стадия А обусловлена первичным
ничную вспышку [17]). Вместе с тем мы обнару#
разделением зарядов, В - протонированием
жили, что восстановление семихинонной фор#
восстановленного QB при образовании убихино#
мы QB до убихинола связано с появлением до#
ла, С - восстановлением димера бактериохло#
полнительной компоненты Δψ, составляющей
рофилла от растворимых доноров электрона.
Рис. 1. Схема электрогенных реакций в реакционных центрах R. rubrum. Электрогенное восстановление фотоокисленно#
го Р870 от экзогенных вторичных доноров электрона наблюдается в ответ на каждую лазерную вспышку, электрогенное
протонирование вторичного хинонного акцептора QB - в ответ на четные вспышки света. Указаны характерные времена τ
(для компоненты В - при рН 7,5) и относительные вклады трех стадий генерации Δψ
БИОХИМИЯ том 86 вып. 1 2021
10
КАМИНСКАЯ, СЕМЕНОВ
ПЕРЕНОС ЭЛЕКТРОНА
были встроены в коллодиевые фосфолипидные
И ЭЛЕКТРОГЕННЫЕ РЕАКЦИИ
мембраны. Анализ фотоэлектрических сигна#
В РЕАКЦИОННЫХ ЦЕНТРАХ
лов, индуцированных лазерными вспышками,
ИЗ Blastochloris viridis
показал, что кинетика образования Δψ включа#
ет три последовательные электрогенные реак#
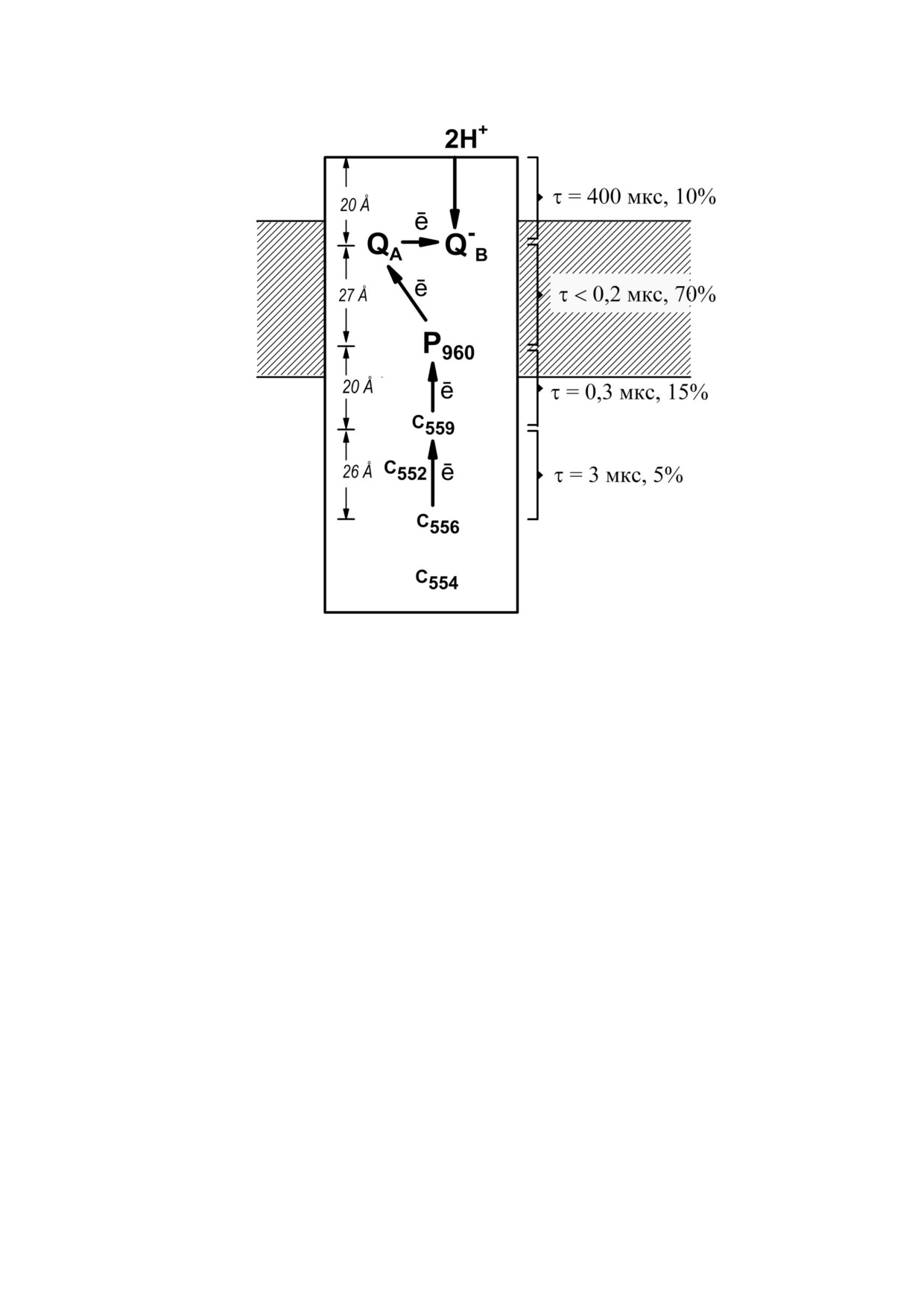
Работы Dracheva et al. [5, 6], выполненные с
ции, наблюдаемые в ответ на каждую лазерную
участием А.А. Константинова, были посвящены
вспышку: А - не разрешаемый по времени пере#
исследованию переноса электрона и электро#
нос электрона от Р960 на первичный хинонный
генных реакций в РЦ, выделенных из серных
акцептор QA (τ < 0,2 мкс), С1 - восстановление
пурпурных бактерий Bl. viridis. Интерес к изуче#
фотоокисленного Р+960 от самого высокопотен#
нию именно этих РЦ обусловлен двумя обстоя#
циального гема с2+559 (τ = 0,3 мкс), С2 - ревосста#
тельствами. Во#первых, именно для этого пиг#
новление окисленного с3+559 от второго высокопо#
мент#белкового комплекса была получена пер#
тенциального гема с2+556 (τ = 2,5 мкс), и компо#
вая трехмерная структура кристалла мембран#
ненту В, наблюдаемую в ответ на четные
ного белка с атомным разрешением [23, 24]. Во#
вспышки и связанную с протонированием
вторых, вторичным донором электрона для ди#
дважды восстановленного вторичного хинонно#
мера бактериохлорофилла в этих РЦ служит не
го акцептора QB с образованием QBН2
водорастворимый цит с2, как в РЦ из несерных
(τ = 400 мкс) [6]. Относительный вклад кинети#
бактерий R. rubrum и Rba. sphaeroides, а прочно#
ческих стадий С2, С1, А и В в суммарный элект#
связанный с РЦ четырехгемовый цит с.
рогенез составлял 5, 15, 70 и 10% соответствен#
До начала этих работ считалось, что четы#
но (рис. 2). Полученные результаты показывают,
рехгемовый цит с в РЦ Bl. viridis содержит по
что относительный вклад электрогенных стадий
два одинаковых высокопотенциальных и низ#
возрастает в центральной гидрофобной области
копотенциальных гема со среднеточечными ре#
белка и снижается на периферических участках.
докс#потенциалами Em +340 и 0 мВ и максиму#
Первые данные рентгеноструктурного анали#
мами поглощения соответственно при 558 и
за РЦ из Bl. viridis, доступные к моменту этих ис#
552-553 нм [25, 26]. Нами было показано, что
следований [23, 24], позволили сопоставить амп#
как высокопотенциальные, так и низкопотен#
литуды наблюдаемых стадий генерации Δψ с рас#
циальные гемы не идентичны и характеризуют#
стояниями между соответствующими редокс#ко#
ся различными спектральными и окислительно#
факторами. Такое сопоставление показало, что
восстановительными свойствами [5, 6]. Гемы с
относительный вклад реакций переноса заряда в
Em +380, +310, +20 и -60 мВ характеризовались
суммарный электрогенез определяется не только
максимумами поглощения при 559, 556, 552 и
расстояниями между редокс#кофакторами, но и
554 нм соответственно. Ранее было показано,
диэлектрическими свойствами соответствующих
что аксиальными лигандами гема, расположен#
участков белка [6]. Это наблюдение продемон#
ного вторым по счету от Р960 в РЦ Bl. viridis, слу#
стрировано на рис. 2, где указаны проекции рас#
жат аминокислотные остатки гистидинов, что
стояний между цитохромными гемами с556 и с559,
является характерным признаком низкопотен#
с559 и Р960, Р960 и QA, а также между QB и ближай#
циального гема [24, 27]. Измерения с помощью
шей границей белок/вода на нормаль к плоскос#
импульсной абсорбционной спектрометрии ки#
ти мембраны, определенные на основании более
нетики переноса электрона в РЦ из Bl. viridis по#
поздней публикации [28]. Указанные расстояния
казали, что в физиологических условиях (когда
составляли соответственно 27, 22, 29 и 22%
гемы с559 и с556 восстановлены) непосредствен#
от проекции расстояния между гемом с556 и бли#
ным донором электрона для фотоокисленно#
жайшей границей белок/вода на акцепторном
го Р960 служит гем с559 (τ = 0,3 мкс), в то время
участке белковой глобулы комплекса РЦ. Видно,
как гем с556, в свою очередь, восстанавливает
например, что векторный перенос электрона от
гем с559 (τ = 2,5 мкс) [5]. Поэтому мы предполо#
Р960 к QA на участке белка внутри гидрофобной
жили, что высокопотенциальные и низкопотен#
области, соответствующей центральной части
циальные гемы цит с чередуются, и ближайшим
мембраны, вносит существенно больший вклад в
к Р960 является наиболее высокопотенциальный
электрогенез, чем перенос электрона на сходное
гем с559, а второй высокопотенциальный гем с556
расстояние между гемами с556 и с559, расположен#
является третьим по счету от Р960. В этом случае
ными в области белковой глобулы, выступающей
редокс#центры должны быть расположены в
из мембраны в водную фазу.
следующей последовательности: с554 — с556 —
В заключение отметим, что рассмотренные в
с552 — с559 — Р960 [6] (рис. 2).
данном обзоре работы 1985-1988 гг., выполнен#
Для исследования электрогенных реакций
ные в сотрудничестве с А.А. Константиновым,
протеолипосомы, содержащие РЦ из Bl. viridis,
выявили важные аспекты механизмов электро#
БИОХИМИЯ том 86 вып. 1 2021
ЭЛЕКТРОГЕНЕЗ В БАКТЕРИАЛЬНЫХ РЕАКЦИОННЫХ ЦЕНТРАХ
11
Рис. 2. Схема электрогенных реакций в РЦ из Bl. viridis. Справа указаны относительные вклады в суммарный электроге#
нез (% Δψ) и характерные времена (τ) отдельных реакций переноса электрона; слева - проекции расстояний между ре#
докс#кофакторами на нормаль к плоскости мембраны
генных реакций в фотосинтетических РЦ из
относительных вкладов отдельных стадий пере#
пурпурных бактерий R. rubrum, Rba. sphaeroides и
носа зарядов в суммарный электрогенез с про#
Bl. viridis. Многие особенности электрогенеза и
екциями расстояний между редокс#кофактора#
реакций электронного транспорта в бактериаль#
ми на нормаль к плоскости мембраны позволи#
ных РЦ были описаны впервые. С высоким раз#
ло сделать вывод о неоднородности диэлектри#
решением исследована кинетика электрогенно#
ческой проницаемости внутри белка РЦ.
го переноса электрона между растворимым
Александр Константинов сыграл неоцени#
цит с и комплексом бактериального РЦ. Было
мую роль в выполнении рассмотренных в насто#
показано, что электрогенез, связанный с восста#
ящем обзоре исследований. Он был крупней#
новлением фотоокисленного P870 от цит с и ис#
шим ученым, настоящим профессионалом, це#
кусственных редокс#красителей, обусловлен пе#
нил красоту научного эксперимента, обладал
реносом электрона внутри белкового комплек#
блестящей интуицией. Стиль его работы харак#
са РЦ, а также выявлен электрогенный характер
теризовался широтой научной проблематики,
протонирования дважды восстановленного вто#
четкостью постановки задач, продуманностью
ричного хинонного акцептора QB. При исследо#
экспериментов, включающей тщательный под#
вании РЦ из Bl. viridis были определены спект#
бор оптимальных экспериментальных условий.
ральные и окислительно#восстановительные ха#
Это делало научные результаты ясными и эффект#
рактеристики четырех гемов прочносвязанного
ными. Работать с ним было интересно. При
цит с, измерены скорости восстановления Р960 и
участии А.А. Константинова, часто - при его
переноса электрона между гемами, а также заре#
непосредственном руководстве, были выполне#
гистрированы стадии электрогенеза, связанные
ны и защищены кандидатские диссертации И.А.
c электрон#транспортными реакциями в этом
Смирновой, С.М. Драчевой, О.П. Каминской,
пигмент#белковом комплексе. Сопоставление
Д.Л. Заславского, С.А. Силецкого, связанные с
БИОХИМИЯ том 86 вып. 1 2021
12
КАМИНСКАЯ, СЕМЕНОВ
использованием прямого электрометрического
Конфликт интересов. Авторы заявляют об от#
метода для изучения электрогенеза мембранных
сутствии конфликта интересов.
белков митохондрий и реакционных центров
Соблюдение этических норм. Настоящая
фотосинтезирующих бактерий.
статья не содержит каких#либо исследований с
Коллеги и сотрудники навсегда сохранят
участием людей или использованием животных
светлую память об Александре Константинове. в качестве объектов.
СПИСОК ЛИТЕРАТУРЫ
1.
Drachev, L. A., Kaminskaya, O. P., Konstantinov, A. A.,
тофорами, индуцируемая лазерной вспышкой, Докла/
Semenov, A. Yu., and Skulachev, V. P. (1985) Electrogenic
ды АН СССР, 245, 991#994.
reduction of Rhodospirillum rubrum reaction centre bacte#
13.
Drachev, L. A., Semenov, A. Yu, Skulachev, V. P.,
riochlorophyll P870+ by redox dyes. Indication of intrapro#
Smirnova, I. A., Chamorovsky, S. K., et al. (1981) Fast
tein electron transfer, FEBS Lett., 189, 45#49.
stages of photoelectric processes in biological membranes,
2.
Kaminskaya, O. P., Drachev, L. A., Konstantinov, A. A.,
Eur. J. Biochem, 117, 483#489.
Semenov, A. Yu., and Skulachev, V. P. (1986) Electrogenic
14.
Семенов А. Ю., Чаморовский С. К., Смирнова И. А.,
reduction of the secondary quinone acceptor in chro#
Драчев Л. А., Кононенко А. А., Успенская Н. Я., Ру#
matophores of Rhodospirillum rubrum. Rapid kinetic mea#
бин А. Б., Скулачев В. П. (1981) Кинетика образова#
surements, FEBS Lett., 2, 224#228.
ния фотоиндуцируемой разности электрических по#
3.
Drachev, L. A., Kaminskaya, O. P., Konstantinov, A. A.,
тенциалов хроматофорами фотосинтезирующих бак#
Kotova, E. A., Mamedov, M. D., et al. (1986) The effect of
терий, Молекулярная биология, 15, 622#635.
cytochrome c, hexaammineruthenium and ubiquinone#10
15.
Chamorovsky, S. K., Drachev, A. L., Karagulian, A. K.,
on the kinetics of photoelectric responses of Rhodospirillum
Kononenko, A. A., Rubin, A. B., et al. (1985) Fast phases
rubrum reaction centers, Biochim. Biophys. Acta, 848, 137#146.
of the generation of the transmembrane electric potential
4.
Drachev, L. A., Kaminskaya, O. P., Konstantinov, A. A.,
in chromatophores of the photosynthetic bacterium
Mamedov, M. D., Samuilov, V. D., Semenov, A. Yu., and
Ectothiorhodospira shaposhnikovii, Biochim. Biophys. Acta,
Skulachev, V. P. (1986) Effects of electron donors and
808, 201#208.
acceptors on the kinetics of the photoelectric responses in
16.
Packham, N. K., Dutton, P. L., and Mueller, P. (1982)
Rhodospirillum rubrum and Rhodopseudomonas sphaeroides
Photoelectric currents across planar bilayer membranes
chromatophores, Biochim. Biophys. Acta, 850, 1#9.
containing bacterial reaction centers. Response under
5.
Dracheva, S. M., Drachev, L. A., Zaberezhnaya, S. M.,
conditions of single electron turnover, Biophys. J., 37, 465#
Konstantinov, A. A., Semenov, A. Yu., and Skulachev, V. P.
473.
(1986) Spectral, redox and kinetic characteristics of high#
17.
Drachev, L. A., Mamedov, M. D., Mulkidjanian, A. Ya.,
potential cytochrome c hemes in Rhodopseudomonas viridis
Semenov, A. Yu., Shinkarev, V. P., and Verkhovsky, M. I.
reaction centers, FEBS Lett., 205, 41#46.
(1990) Electrogenesis associated with proton transfer in the
6.
Dracheva, S. M., Drachev, L. A., Konstantinov, A. A.,
reaction center protein of the purple bacterium, FEBS
Semenov, A. Yu., Skulachev, V. P., et al.
(1988)
Lett., 259, 324#326.
Electrogenic steps in the redox reactions catalysed by pho#
18.
Wraight, C. A. (1979) Electron acceptors of bacterial pho#
tosynthetic reaction centre complex from Rhodopseudo/
tosynthetic reaction centers II. H+ binding coupled to sec#
monas viridis, Eur. J. Biochem., 171, 253#264.
ondary electron transfer in the quinone acceptor complex,
7.
Drachev, L. A., Jasaitis, A. A., Kaulen, A. D., Kondrashin,
Biochim. Biophys. Acta, 548, 309#327.
A. A., Liberman, E. A., et al. (1974) Direct measurement
19.
Vermeglio, A. (1982) Electron transfer between primary
of electric current generation by cytochrome oxidase, H+#
and secondary electron acceptors in chromatophores and
ATPase and bacteriorhodopsin, Nature, 249, 321#324.
reaction centers of photosynthetic bacteria, in: Function of
8.
Drachev, L. A., Frolov, V. N., Kaulen, A. D., Liberman, E. A.,
quinones in energy conserving systems (Trumpower, B. L.,
Ostroumov, S. A., et al. (1976) Reconstitution of biological
ed.), Academic Press, New York, pp. l69#180.
molecular generators of electric current. Bacterio#
20.
Petty, K. M., and Dutton, P. L. (1976) Properties of the
rhodopsin, J. Biol. Chem., 251, 7059#7065.
flash#induced proton binding encountered in membranes
9.
Drachev, L. A., Frolov, V. N., Kaulen, A. D., Kondrashin,
of Rhodopseudomonas sphaeroides: a functional pK on the
A. A., Samuilov, V. D., et al. (1976) Generation of electric
ubisemiquinone? Arch. Biochem. Biophys., 172, 335#345.
current by chromatophores of Rhodospirillum rubrum and
21.
Sebban, P., Maroti, P., and Hanson, D. K. (1995) Electron
reconstitution of electrogenic function in subchro#
and proton transfer to the quinones in bacterial photosyn#
matophore pigment#protein complexes, Biochim. Biophys.
thetic reaction centers: insight from combined approaches
Acta, 440, 637#660.
of molecular genetics and biophysics, Biochimie, 77, 677#
10.
Smirnova, I. A., Konstantinov, A. A., and Skulachev, V. P.
694.
(1981) Role of cofactors in the formation of the membrane
22.
Okamura, M. Y., Paddock, M. L., Graige, M. S., and
potential by chromatophores of Rhodospirillum rubrum,
Feher, G. (2000) Proton and electron transfer in bacterial
incorporated into a Teflon filter, Biochemistry (Moscow),
reaction centers, Biochim. Biophys. Acta, 1458, 148#163.
46, 925#934.
23.
Deisenhofer, J., Epp, O., Miki, K., Huber, R., and
11.
Drachev, L. A., Dracheva, S. M., Samuilov, V. D.,
Michel, H. (1984) X#ray structure analysis of a membrane
Semenov, A. Yu, and Skulachev, V. P. (1984) Photoelectric
protein complex: electron density map at 3 Å resolution
effects in bacterial chromatophores. Comparision of spec#
and a model of the chromophores of the photosynthetic
tral and direct electrometric methods, Biochim. Biophys.
reaction center from Rhodopseudomonas viridis, J Mol.
Acta, 767, 257#262.
Biol., 180, 385#398.
12.
Драчев Л. A., Семенов А. Ю., Скулачев В. П. (1979) Ге#
24.
Deisenhofer, J., Epp, O., Miki, K., Huber, R., and
нерация разности электрических потенциалов хрома#
Michel, H. (1985) Structure of the protein subunits in the
БИОХИМИЯ том 86 вып. 1 2021
ЭЛЕКТРОГЕНЕЗ В БАКТЕРИАЛЬНЫХ РЕАКЦИОННЫХ ЦЕНТРАХ
13
photosynthetic reaction centre of Rhodopseudomonas
27. Weyer, K. A., Lottspeich, F., Gruenenberg, H., Lang, F.,
viridis at 3 Å resolution, Nature, 318, 618#624.
Oesterhelt, D., and Michel, H. (1987) Amino acid
25. Clayton, R. K., and Clayton, B. J. (1978) Molar extinction
sequence of the cytochrome subunit of the photosynthetic
coefficients and other properties of an improved reaction
reaction centre from the purple bacterium Rhodopseudo/
center preparation from Rhodopseudomonas viridis,
monas viridis, EMBO J., 6, 2197#2202.
Biochim. Biophys. Acta, 501, 478#487.
28. Deisenhofer, J., Epp, O., Sinning, I., and Michel, H.
26. Case, G. D., Parson, W. W., and Thornber, J. P. (1970)
(1995) Crystallographic refinement at 2.3 Å resolution
Photooxidation of cytochromes in reaction center prepara#
and refined model of the photosynthetic reaction centre
tions from Chromatium and Rhodopseudomonas viridis,
from Rhodopseudomonas viridis, J. Mol. Biol., 246, 429#
Biochim. Biophys. Acta, 223, 122#128.
457.
THE MECHANISMS OF ELECTROGENIC REACTIONS
IN BACTERIAL PHOTOSYNTHETIC REACTION CENTERS:
STUDIES IN COLLABORATION WITH ALEXANDER KONSTANTINOV
Mini review
O. P. Kaminskaya1 and A. Yu. Semenov2,3*
1 Institute of Basic Biological Problems, Pushchino Scientific Center for Biological Research,
Russian Academy of Sciences, 142290 Pushchino, Moscow Region
2 Belozersky Institute of Physico/Chemical Biology, Lomonosov Moscow State University,
119992 Moscow, Russia; E/mail: semenov@belozersky.msu.ru
3 Semenov Federal Research Center for Chemical Physics Russian Academy of Sciences, 119991 Moscow, Russia
In this review, we discuss our studies conducted in 1985#1988 in collaboration with A. A. Konstantinov, one of the top
scientists in the field of membrane bioenergetics. Studying fast kinetics of membrane potential generation in photo#
synthetic reaction centers (RCs) of purple bacteria in response to a laser flash has made it possible to examine in detail
the mechanisms of electrogenic reactions at the donor and acceptor sites of RCs. Electrogenesis associated with the
intraprotein electron transfer from the exogenous secondary donors, redox dyes, and soluble cytochrome (cyt) c to the
photooxidized dimer of bacteriochlorophyll P870 was studied using proteoliposomes containing RCs from the non#sul#
fur purple bacterium Rhodospirillum rubrum. It was found that reduction of the secondary quinone electron acceptor
QB accompanied by its protonation in the chromatophores from R. rubrum in response to every second light flash was
electrogenic. Spectral characteristics and redox potentials of the four hemes in the tightly bound cyt c in the RC of
Blastochloris viridis and electrogenic reactions associated with the electron transfer within the RC complex were iden#
tified. For the first time, relative amplitudes of the membrane potential generated in the course of individual electro#
genic reactions were compared with the distances between the redox cofactors determined based on the three#dimen#
sional structure of the Bl. viridis RC.
Keywords: bacterial photosynthetic reaction centers, electron transfer, direct electrometric method, membrane poten#
tial, cytochrome c, quinone
БИОХИМИЯ том 86 вып. 1 2021