БИОХИМИЯ, 2021, том 86, вып. 1, с. 14 - 29
УДК 577.121.7
МОЛЕКУЛЯРНАЯ БИОЛОГИЯ ЦИТОХРОМОВ
Bacillus subtilis НА 2020 ГОД
Обзор
© 2021
Л. Хедерштедт
The Microbiology Group, Department of Biology, Lund University,
22362 Lund, Sweden; E mail: Lars.Hederstedt@biol.lu.se
Поступила в редакцию 09.09.2020
После доработки 01.11.2020
Принята к публикации 01.11.2020
Bacillus subtilis служит моделью грамположительной бактерии и экспериментальной системой для исследо
вания дыхательных ферментов. В настоящем обзоре представлены гемовые белки, известные в настоящее
время для хорошо охарактеризованного лабораторного штамма B. subtilis 168. В обзоре основное внимание
уделяется достижениям в исследованиях, проведенных за последние три десятилетия, в отношении функ
ции и состава комплекса цитохрома bc, терминальных оксидаз и сукцинат:менахинон оксидоредуктазы.
Аэробная дыхательная система штамма 168 является типичной для вида В. subtilis, как определено по цито
хромному составу неодомашненного штамма B. subtilis NCIB 3610 и ряду сконструированных цитохром де
фицитных мутантов этого штамма. В обзоре освещены необъяснённые и нерешённые проблемы молеку
лярной биологии цитохромов дыхательной цепи B. subtilis.
КЛЮЧЕВЫЕ СЛОВА: дыхательная цепь, грамположительные бактерии, оксидоредуктазы, сукцинатдегид
рогеназа, NCIB 3610, цитохромы, Bacillus.
DOI: 10.31857/S0320972521010024
ВВЕДЕНИЕ
нию и способной выживать в течение чрезвычай
но длительных периодов времени [2].
Bacillus subtilis, Escherichia coli и Saccharomyces
Последние обзоры молекулярных аспектов
cerevisiae (пекарские дрожжи) являются экспери
цитохромов B. subtilis были опубликованы
ментально наиболее детально изученными мик
два-три десятилетия назад в виде главы книги и
роорганизмами. Эти организмы и их клеточные
журнала соответственно [3, 4]. Целью данного
компоненты служат моделями для обсуждения и
обзора является освещение текущего состояния
понимания физиологии клетки других микробов
знаний и указание на оставшиеся пробелы в по
на молекулярном уровне и даже, в перспективе, у
нимании данной темы. Штамм B. subtilis 168 со
макроорганизмов. B. subtilis - это преимущест
держит гены для, по крайней мере, 25 различных
венно аэробный организм, в отличие от E. coli и
гемовых белков (табл. 1). В этом обзоре рассмат
дрожжей, хотя он также может дышать, исполь
риваются восемь дыхательных цитохромов. Дру
зуя нитраты. На основе недавних открытий как в
гие гемовые белки B. subtilis, например фермен
случае лабораторного штамма 168, так и неодо
ты, связанные с цитохромом Р 450, водораство
машненного штамма NCIB 3610 возникает воп
римые глобины и каталазы здесь не рассматри
рос, может ли B. subtilis вообще расти в условиях
ваются. База данных SubtiWiki [5] - отличный
строгой аноксии [1]. Особенностью видов Bacillus
источник собранной информации о белках и ге
среди бактерий является то, что отдельные клет
нах B. subtilis и образцах их экспрессии.
ки могут превратиться в эндоспору, которая явля
ется спящей живой клеткой, чрезвычайно устой
чивой к теплу, химическим веществам и высыха
ДЫХАТЕЛЬНАЯ ЦЕПЬ АЭРОБНЫХ
КЛЕТОК Bacillus subtilis
Принятые сокращения:HQNO - n 2 гептил 4 гид
Мембраны B. subtilis содержат менахинон 7,
роксихинолин оксид; NSMP - питательная среда с фосфа
том для спорообразования; TBAB - триптозный кровяной который восстанавливается несколькими различ
агар; TM - трансмембранный α спиральный сегмент;
ными связанными с мембраной дегидрогеназа
TMPD - N,N,N′,N′ тетраметил п фенилендиамин; SQR -
сукцинат:менахинон оксидоредуктаза; HCOs - гем мед
ми, включая NADH дегидрогеназу типа II, сук
ные оксидоредуктазы.
цинат:менахинон оксидоредуктазу (SQR) и гли
14
МОЛЕКУЛЯРНАЯ БИОЛОГИЯ ЦИТОХРОМОВ Bacillus subtilis НА 2020 ГОД
15
Таблица 1. Гемовые белки B. subtilis 168
Гемовый белок
Функция
Содержание гема
Структурные гены
Дыхательные цитохромы
Цитохром aa3
менахинол оксидаза
2 гема A
qoxABCD
Цитохром caa3
цитохром c оксидаза
2 гема A
ctaCDEF
1 гем C
Цитохром bda
менахинол оксидаза
2 гема B
cydAB
1 гем D
Цитохром bc комплекс
менахинол:цитохром c оксидоредуктаза
2 гема B
qcrABC
2 гема C
SQR (комплекс II)
сукцинат:менахинон оксидоредуктаза
2 гема B
sdhCAB
Цитохром c 550
перенос электрона
1 гем C
cccA
Цитохром c 551
перенос электрона
1 гем C
cccB
Нитрат редуктаза
менахинол:нитрат оксидоредуктаза
2 гема B
narGHI
Цитохромы P 450
BioI
гидроксилаза жирных кислот, участвующая в синтезе биотина
1 гем B
bioI
CYP107J1
неизвестно
1 гем B
cypA
CYP134A1
синтез хелатора железа пулчерримина
1 гем B
cypX
CYP109B1
монооксигеназа
1 гем B
yjiB
CYP152A1
гидроксилирует миристиновую кислоту в присутствии H2O2
1 гем B
cypC
CYP102A2
гидроксилаза жирной кислоты
1 гем B
yetO
CYP102A3
гидроксилаза жирной кислоты
1 гем B
yrhJ
CP107K1
поликетидгидроксилаза
1 гем B
pksS
Глобины
Флавогемоглобин
предполагаемая NO диоксигеназа
1 гем B
Hmp
Усечённый гемоглобин
защита от NO, тиоловый редокс гомеостаз
1 гем B
yjbI
ГемAT
аэротактический преобразователь
1 гем B
hemAT
Каталазы
Каталаза I
каталаза вегетативной клетки
1 гем B
katA
Каталаза II
стресс индуцированная каталаза
1 гем D
katE
KatX
связанная с эндоспорой каталаза
1 гем B
katX
Другие гемовые белки
ГемA синтаза
синтез гема A из гема O
1 гем Bb
ctaA
NO синтаза
синтез NO из L аргинина
1 гем B
yflM
Примечания. a Цитохром bb′, соответствующий цитохрому bd с группой гема D, замененной гемом B, по видимому, обра
зуется у некоторых мутантов при выращивании их до низкой плотности клеток [56]. b Изолированный CtaA, продуцируе
мый в E. coli, содержит гем B, а при избыточном продуцировании в B. subtilis он может также содержать гем O и гем A [28].
церол 3 фосфатдегидрогеназу. Дыхательная сис
тохрома саа3. Небольшие цитохромы c, c 550 или
тема окисления менахинола в аэробных клетках
c 551, могут облегчать перенос электронов между
разветвлена несколькими терминальными окси
цитохром c доменом комплекса bc и цитохром с до
дазами, восстанавливающими молекулярный
меном комплекса caa3. Цитохром aa3 и цито
кислород до воды. Система включает ветвь ци
хром bd представляют собой терминальные окси
тохром с оксидазы с менахинол оксидазой ци
дазы менахинола в дыхательной цепи. Обе цито
тохрома bc в качестве донора электронов для ци
хром а содержащие оксидазы являются гем мед
БИОХИМИЯ том 86 вып. 1 2021
16
ХЕДЕРШТЕДТ
ными оксидоредуктазами (HCOs) [6] семейства A
из B. subtilis с разрешением 3,6 Å [15]. Подтвер
со сходными структурами, которые помпируют
дились предсказанные структурные особеннос
из клеток протоны за счет энергии окислительно
ти оксидазы, и появилась информация о сайтах
восстановительных реакций. Цитохром bd по
связывания менахинона 7. Фермент состоит из
своей структуре представляет собой совершенно
четырех полипептидов: субъединица I (QoxB
другой тип оксидазы: он не содержит меди и не
состоит из 649 а.о. и 15 ти трансмембранных α
помпирует протоны, но активность этой оксида
спиральных сегментов (TM)), субъединица II
зы также вносит вклад в образование трансмемб
(QoxA после обработки лидерной пептидазой II
ранного электрохимического потенциала в бак
представляет собой липопротеин из 295 а.о.
териальной клетке. Генерация АТР как таковая,
и 2 х TM), субъединица III (QoxC состоит из
по видимому, обычно не является лимитирую
204 а.о. и 5 ти TM) и субъединица IV (QoxD
щим процессом для экспоненциального рос
состоит из 124 а.о. и 3 х TM). Субъединица I со
та B. subtilis в периодической культуре [7].
держит две молекулы гема A, гем a с низким
Активные цитохром aa3 или цитохром bd яв
спином и гем a3 с высоким спином, а также
ляются необходимым условием для аэробного
один атом меди CuB (табл. 2). Гем a3 CuB явля
роста клеток B. subtilis [8]. Цитохром aa3 являет
ется частью каталитического центра, где кисло
ся преобладающей оксидазой в различных усло
род восстанавливается до воды за счет электро
виях роста [8, 9], а недостаток этой оксидазы вы
нов, переносимых при посредстве гема a из
зывает уменьшение потока метаболитов через
сайта окисления менахинола. Самый N конце
цикл Кребса [7]. При низком давлении кислоро
вой TM субъединицы I, обозначенный TM0,
да или пониженном соотношении NAD/NADH
уникален для менахинол оксидаз по сравне
в клетке и у мутантов, дефицитных по цитохро
нию с цитохром с оксидазами. Субъединица I
му aa3, индуцируется синтез цитохрома bd [10].
имеет два дополнительных TM (TM13 и TM14)
Цитохромы типа bd обладают высоким срод
на С конце, а субъединица III не имеет
ством к молекулярному кислороду и менее
двух TM, по сравнению с соответствующими
чувствительны к цианиду и другим соединени
субъединицами классических цитохром с ок
ям, известным как ингибиторы HCOs [11]. Ко
сидаз, таких как в митохондриях млекопитаю
личество цитохром с оксидазы в B. subtilis повы
щих. TM13 и TM14 субъединицы I соответству
шается на ранней стационарной фазе роста и
ют первым двум TM субъединицы III в класси
подвержено сильной катаболитной репрессии,
ческих цитохром с оксидазах, т.е. последова
например, глюкозой в питательной среде. Му
тельности этих двух TM в ходе эволюции, по
танты, лишенные как цитохрома aa3, так и caa3,
видимому, мигрировали из субъединицы III в
плохо спорулируют, однако соответствующие
субъединицу I. Это событие отражает тот факт,
мутанты, дефектные по одной из оксидаз, про
что у большинства дышащих бактерий ген
дуцируют нормальное количество эндоспор [8].
субъединицы III в хромосоме непосредственно
Важность ветви цитохромов bc-caa3 и цитохро
следует за геном субъединицы I. Части TM0,
мов c 550 и c 551 для физиологии клеток B. sub
TM1, TM2 и TM3 субъединицы I образуют по
tilis в настоящее время не понята. Цитохром c не
лость, открытую для липидного бислоя и спо
важен ни для роста, ни для спорообразования,
собную вмещать менахинон. Было показано,
как показано при использовании мутантов с
что аминокислотные остатки TM1 и TM2 взаи
множественными делециями всех генов цито
модействуют с семименахиноном и ингибито
хрома c (qcrC, ctaC, cccA и cccB) [12], а также де
ром n 2 гептил 4 гидроксихинолоноксидом
фектных по генам resABC, необходимым для син
(HQNO), который является миметиком семи
теза цитохрома c [13, 14]. Как представлено далее
хинона. Низкие микромолярные концентрации
в этом обзоре, отсутствие фенотипического про
HQNO подавляют менахинол оксидазную ак
явления у мутантов, дефектных в ветви цито
тивность цитохрома aa3 B. subtilis [15].
хром с оксидазы дыхательной системы, не связа
но с каким то нераспознанным дефектом лабо
раторного штамма 168 B. subtilis, поскольку не
ВЕТВЬ ЦИТОХРОМ c(ОКСИДАЗЫ
одомашненный штамм NCIB 3610, образующий
биопленку, обнаруживает ту же особенность.
Цитохром bc и цитохром caa3 в B. subtilis об
разуют суперкомплекс, который может катали
зировать окисление менахинола и восстановле
ЦИТОХРОМ aa3
ние кислорода [16-18]. Этот комплекс, по ви
димому, включает также цитохром с 550 или ци
Недавно с помощью рентгеноструктурного
тохром с 551, как было определено с помощью
анализа была получена структура цитохрома aa3
двумерного электрофореза солюбилизирован
БИОХИМИЯ том 86 вып. 1 2021
МОЛЕКУЛЯРНАЯ БИОЛОГИЯ ЦИТОХРОМОВ Bacillus subtilis НА 2020 ГОД
17
ных детергентами мембран с последующей
стве адаптации для восстановления менахинона
масс спектроскопией [18]. Суперкомплекс, ве
в кислородных условиях, или что гем ci участву
роятно, очень похож на таковой из Mycobacteri
ет в циклическом переносе электрона [24]. Об
um smegmatis, структура которого была опреде
разование ковалентной связи гема ci с полипеп
лена двумя исследовательскими группами с по
тидом QcrB B. subtilis происходит независимо от
мощью крио ЭМ [19, 20]. Однако у микобакте
ResABC цитохром c синтезирующих белков
рий и других актинобактерий, таких как
[13], а для комплекса b6 f, как известно, требует
Corynebacterium glutamicum, комплекс bc несет
ся специальный механизм, называемый систе
два домена цитохрома с, в то время как оксидаза
мой IV, который отсутствует в B. subtilis [25].
не содержит цитохрома с. В суперкомплексе,
QcrC (255 а.о. и 3 TM) на С конце несет домен
который катализирует эффективное менахинол
цитохрома c, расположенный на внешней сто
зависимое окисление без необходимости в экзо
роне цитоплазматической мембраны. Этот ци
генном цитохроме c, цитохром bc представляет
тохром c (c 553) имеет типичное аксиальное ли
собой димер с примыкающей с каждой стороны
гирование гемового железа с Met и His, но его
оксидазой. В суперкомплексе M. smegmatis до
аминокислотная последовательность отличает
мен цитохрома с, QcrC, был обнаружен в раз
ся от других доменов цитохрома c в
личных конформациях, менахинон присутство
B. subtilis (CccA, CccB и CtaC) и от цитохро
вал как в QD, так и в QI сайтах, а субъедини
ма c1 митохондрий.
ца III (CtaE) взаимодействовала с комплексом
Отсутствие комплекса цитохрома bc из за
цитохрома bc через молекулу кардиолипи
делеции генов qcr или отсутствие гема ci из за
на [20]. Вклад кардиолипина в стабилизацию
замены Cys43 на Ser не дает наблюдаемого фе
цитохромного bc-caa3 суперкомплекса можно
нотипа у B. subtilis [22, 23]. Попытки сверхпроду
наблюдать у B. subtilis в экспериментах с кардио
цирования комплекса bc в B. subtilis за счет по
липин дефицитными мутантами [21].
мещения оперона qcrABC в плазмиду привели
Комплекс цитохрома bc различных видов
только к двукратному увеличению содержания
Bacillus и актинобактерий имеет общие черты с
фермента [23]. Такой низкий выход может быть
цитохромом b6 f хлоропластов и цианобактерий,
связан с ограниченным количеством факторов,
а не с классическим комплексом bc1 (комп
необходимых для экспорта белка (ResA имеет
лекс III) митохондрий и многих аэробных грам
сигнальный пептид с двойным аргинином) или
отрицательных бактерий
[22]. Белок QcrA
для сборки субъединиц. Отсутствие достаточно
B. subtilis (167 а.о. и 1 TM) несет 2Fe2S железо
го экспериментального материала для биохими
серный кластер Rieske типа. QcrB (224 а.о. и
ческого анализа и фенотипа для дефектных му
4 TM) содержит две группы гексакоординиро
тантов серьезно затруднило исследования фер
ванного низкоспинового гема B, гем bH (также
ментов B. subtilis, поэтому биохимические дан
называемый bN или bD) и bL (bP), а также третий
ные небольшие (табл. 2).
гем - ci (или cn, или x), который ковалентно свя
Цитохром c 553 bc комплекса предположи
зан тиоэфирной связью с одиночным цистеино
тельно достаточен для прямого переноса элект
вым остатком (Cys43 в B. subtilis) [23]. Этот Cys
ронов на цитохром c 551 в комплексе цитохро
сохранён в цитохроме b6 f хлоропластов и циано
ма caa3, но, как обсуждается далее в данном об
бактерий [23].
зоре, цитохромы c 550 и c 551 могут опосредо
Гемы bH и bL связаны, как в классических
вать перенос электрона между двумя фермента
комплексах bc1, с четырьмя аксиальными лиган
ми или взаимодействовать с другими компонен
дами His на двух параллельных TM, чтобы обес
тами клетки. Комплекс цитохрома caa3 состоит
печивать трансмембранный перенос электро
из четырех субъединиц: CtaD (субъединица I,
нов. В отличие от канонического комплекса III
622 а.о.), CtaC (субъединица II, липопротеин из
и в соответствии с комплексами b6 f, в bc комп
336 а.о.), CtaE (субъединица III, 207 а.о.) и
лексе B. subtilis С концевые ТМ субъединицы,
CtaF (субъединица IV, 110 а.о.). Субъединица I
содержащие гем В, по всей видимости, мигри
содержит гем а и двуядерный центр гем a3 CuB.
ровали на N конец QcrC. Гем ci в QcrB располо
Субъединица II имеет в С концевой части на
жен рядом с гемом bH и сайтом восстановления
внешней стороне мембраны домен с двумя ато
менахинона близко к цитоплазматической сто
мами меди в центре CuA, за которым следует до
роне мембраны. Функция гема ci, который явля
мен цитохрома с 551. Структура цитохрома caa3,
ется высокоспиновым и имеет относительно
вероятно, очень похожа на структуру цитохро
высокий окислительно восстановительный (ре
ма aa3 M. smegmatis [19, 20]. Гены оксидазы в хро
докс) потенциал, остается загадкой. Можно
мосоме образуют кластер ctaABCDEFG, где
предположить, что пара bH гем-ci гем образует
ctaA (кодирующий гем А синтазу) транскриби
альтернативный сайт связывания хинона в каче
руется с другой цепи ДНК. Ген ctaG кодирует
2 БИОХИМИЯ том 86 вып. 1 2021
18
ХЕДЕРШТЕДТ
цитохром caa3 специфичный фактор биосинте
ны, кодирующие CccA [36] и CccB [38] в хромо
за, по видимому, необходимый для включе
соме B. subtilis, не связаны с генами с известной
ния CuB в CtaD [26]. Множество дополнитель
функцией в дыхательной системе. Экспрессия
ных белков, кодируемых генами в других частях
гена cccA подавляется катаболитом [42]. Мат
хромосомы, участвуют в биогенезе цитохро
ричная РНК cccA является моноцистронной и
ма caa3: Lgt и LspA необходимы для модифика
имеет длительный период полураспада (15 мин)
ции липопротеинов CtaC (и других белков, та
в клетке по сравнению с периодом полураспада
ких как субъединица II цитохрома aa3), бел
для cccB (7 мин) и средним периодом полурас
ки ResABC и CcdA необходимы для синтеза ци
пада (4 мин) для мРНК в B. subtilis [43].
тохрома c [27], CtaA и CtaB - для синтеза ге
Физиологическую роль (роли) двух малых
ма A [28], Sco (YpmQ) [29] и CtaK [30] - для
цитохромов c еще предстоит установить. Обна
сборки CuA, CtaM важен для синтеза как цито
ружено, что CccA и CccB связаны с суперкомп
хрома caa3, так и aa3
[30]. Факторы биогенеза
лексом цитохром bc-цитохром caa3 и, предпо
цитохрома caa3 в значительной степени были
ложительно, способствуют переносу электронов
идентифицированы посредством скрининга му
в этом комплексе. Однако нельзя исключить,
тантов, дефицитных по окислению N,N,N′,N′
что малые цитохромы c опосредуют перенос
тетраметил п фенилендиамина (TMPD). В
электронов к или от другого компонента(ов) на
клетках B. subtilis эта активность строго зависит
внешней стороне цитоплазматической мембра
от активности цитохрома caa3 [31]. Гем A в ци
ны. Не был обнаружен фенотип с недостатком
тохроме caa3 Bacillus PS3 и в цитохроме aa3
или избытком цитохромов c 550 или c 551 у
Bacillus cereus может быть заменен гемом O [32,
B. subtilis. Однако у Bacillus anthracis, который
33]. Неизвестно, может ли цитохром aa3 или caa3
эволюционно близок к B. subtilis [44], экспрес
B. subtilis включать гем О. Мутанты с заблокиро
сия гена вирулентности нарушается, если отсут
ванным синтезом гема A (из за отсутствия CtaA
ствуют как c 550 (CccA), так и c 551 (CccB) [45].
или из за мутаций в этом белке) содержат гем O,
Этот эффект наблюдается также у мутантов с
но плохо растут, что указывает на дефектный
блокированным синтезом цитохрома c и у му
цитохром aa3, и имеют фенотип, не способный
тантов, лишенных белка BAS3568 (ортолог YozB
окислять TMPD, что указывает на дефектный
у B. subtilis), но не у мутантов, дефицитных по
цитохром caa3 [34, 35].
цитохромам bc или caa3 или только по одному из
малых цитохромов c [45]. Эти данные свидетель
ствуют о том, что функции c 550 и c 551 пере
ЦИТОХРОМЫ c(550 и c(551
крываются в некоторых процессах, не завися
щих от цитохром с оксидазной ветви дыхатель
Все цитохромы c B. subtilis прочно связаны с
ной системы. Механизм связи между экспрес
мембраной. Цитохромы c 550 (CccA, 120 а.о.) и
сией генов и наличием двух малых цитохромов c
c 551 (CccB, липопротеин из 92 а.о.) имеют
остается неизвестным.
очень похожие домены цитохрома, но по разно
Очень стабильный домен цитохрома c
му прикрепляются к внешней стороне цито
B. Subtilis, CccA [37], может использоваться в ка
плазматической мембраны. CccA прикреплён с
честве красного маркера для визуализации и об
помощью одиночного TM, соответствующего
наружения мембранных белков, лишенных хро
нерасщепленной экспортной сигнальной пос
мофора, и белков с функцией, которая неизве
ледовательности белка [36, 37]. Липопроте
стна или трудна для анализа, например мемб
ин CccB удерживается в мембране диацилглице
ранных транспортных белков и шаперонов [46].
риновым фрагментом, присоединенным к N
Кроме того, домен цитохрома c, CccA, можно
концевому остатку Cys, таким образом, созрева
использовать для исследования трансмембран
ние c 551 зависит от Lgt и LspA [38]. В близком
ной топологии белков, поскольку гемилирова
ортологе, цитохроме c 551 Bacillus PS3, N кон
ние с образованием ковалентно связанного гема
цевой Cys заблокирован, предположительно
может происходить только на внешней стороне
ацетилирован, и две ацильные цепи представля
цитоплазматической мембраны у бактерий
ют собой молекулы пальмитоила [39]. Последо
(например, у E. coli и B. subtilis) из за строгой за
вательности доменов цитохрома c, CccA и CccB,
висимости от аппарата синтеза цитохрома с [27].
подобны последовательности домена цитохро
ма c CtaC, но отличаются от последовательнос
ти QcrC и митохондриального цитохрома c [22,
ЦИТОХРОМ bd
36, 40]. Структура гомологичного домена цито
хрома c Bacillus pasteruii при высоком (0,97 Å) раз
Цитохромы bd типа встречаются только у
решении показана в работе Benini et al. [41]. Ге
бактерий, и они сильно отличаются от HCOs по
БИОХИМИЯ том 86 вып. 1 2021
МОЛЕКУЛЯРНАЯ БИОЛОГИЯ ЦИТОХРОМОВ Bacillus subtilis НА 2020 ГОД
19
структуре и тем, что не зависят от меди и не яв
SDS PAGE и путём окрашивания белков. Ци
ляются протонными помпами [11, 47].
тохром bd родственной бактерии Geobacillus
Они состоят из двух белковых субъединиц,
(Bacillus) stearothermophilus K17, вероятно, содер
CydA и CydB, и часто дополнительного неболь
жит CydS, на что указывает ген orf1, следующий
шого полипептида (CydS, или CydX, или CydY,
сразу за геном cbdB (для CydB), но это не было
или CydZ). Как первоначально наблюдали
обнаружено при исходном биохимическом ана
Sakamoto et al. [48], существует два вида окси
лизе выделенного фермента
[48]. Мутанты
даз типа цитохрома bd, которые различаются
B. subtilis с делецией по cydABCD могут быть
длиной так называемой Q петли (соединяю
функционально дополнены генами cydABCD
щей ТМ V и VI) в субъединице CydA. Цитох
Enterococcus faecalis [53], что указывает на то, что
ром bd B. subtilis и большинства других грампо
цитохром bd этих бактерий не содержит других
ложительных бактерий имеет короткую Q пет
белков, кроме CydA и CydB, или что дополни
лю. Как показывает рентгеноструктурный ана
тельные функционально важные малые субъ
лиз структуры цитохрома bd грамположитель
единицы у B. subtilis и E. faecalis являются взаи
ной бактерии Geobacillus thermodenitrificans
мозаменяемыми.
K1041 [49], CydA и CydB имеют по 8 TM и в це
Экспрессия оперона cydABCD регулируется
лом являются очень похожими белками. Эта
несколькими белками [10, 54]. Она подавляет
оксидаза также содержит небольшой трансмем
ся, когда в среде роста присутствует нит
бранный спиральный белок CydS. CydA содер
рат [55], а также при связывании Rex, который
жит все простетические группы: гем b 558 (гек
определяет соотношение NAD+/NADH в клет
сакоординированный с аксиальными лиганда
ке [56]. Когда это соотношение уменьшается,
ми Met и His), гем b 595 (пентакоординирован
например в результате недостатка кислорода,
ный с аксиальным лигандом Glu или гексако
индуцируется транскрипция оперона cyd и не
ординированный с аксиальными лигандами
скольких дополнительных генов [10]. Таким
His и Glu [50]) и гем d. Три группы гемов распо
образом, содержание цитохрома bd оказывает
ложены треугольником и находятся под
ся высоким в клетках культур, выросших в сре
действием сил Ван дер Ваальса. Электроны,
де с высокой плотностью клеток (где содержа
получаемые при окислении менахинола с учас
ние кислорода низкое из за высокой дыхатель
тием петли Q на внешней стороне мембраны,
ной активности клеток). Цитохром bb′ наблю
через гем b 558 переносятся на гем d и оттуда
дается у мутантов, лишенных как цитохро
перераспределяются, чтобы также восстано
ма aa3, так и SQR, когда клетки выращивают в
вить b 595 с целью проведения ферментом че
условиях, приводящих к очень низкому содер
тырехэлектронного восстановления молеку
жанию цитохрома bd [57]. Предполагается, что
лярного кислорода с образованием воды.
цитохром bb′ соответствует CydAB, содержаще
В каждом из CydA и CydB есть по одному кана
му три группы гема B (т.е. является цитохро
лу, по которому протоны могут переходить из
мом bd с гемом D, замещенным гемом B), или
цитоплазмы к участку фермента, где происхо
является оксидазой, структурные гены которой
дит восстановление кислорода, близко к внеш
еще не идентифицированы [57]. Последняя
ней стороне мембраны [49].
возможность кажется маловероятной, посколь
Цитохром bd B. subtilis кодируется оперо
ку гены B. subtilis детально изучены [58]. Что
ном cydABCD [51]. Как и у других бактерий,
касается предпочтения сайта связывания ге
CydC и CydD не являются частью зрелой окси
мом, то в цитохроме bd G. thermodenitrificans, по
дазы, но необходимы для её биогенеза [8]. Эти
сравнению с цитохромом bd I E. coli, позиции
интегральные мембранные белки обнаружива
групп гема b 595 и гема d в CydA взаимозаменя
ют сходство с транспортерами АТР связываю
емы [50, 59].
щего типа и, вероятно, функционируют как ге
Оперон ythABC у B. subtilis, по видимому, ко
теродимер. Разностный спектр поглощения ци
дирует второй тип фермента цитохром bd с близ
тохрома bd B. subtilis (восстановленная минус
ким сходством последовательности с цитохро
окисленная формы цитохрома bd) в изолиро
мом bd B. stearothermophilus [48]. До сих пор нет
ванных мембранах при комнатной температуре
доказательств того, что белки YthAB продуциру
имеет максимумы при 563, 597 и 626 нм, а при
ются, и нет фенотипа, который ассоциировался
77 K - при 558, 563, 593 и 622 нм [51]. Из штам
бы с мутантами с делецией по ythAB [8, 57]. Од
мов B. subtilis с повышенным примерно в четыре
нако было показано, что мутант с двойной деле
раза содержанием цитохрома bd [52] было выде
цией qoxABCD ythAB продуцирует споры менее
лено небольшое количество фермента. Неизве
эффективно, чем дикий тип, однако некоторые
стно, содержит ли он в дополнение к CydAB не
одиночные мутанты спорулируют нормаль
большой белок, не обнаруживаемый с помощью
но [8].
БИОХИМИЯ том 86 вып. 1 2021
2*
20
ХЕДЕРШТЕДТ
СУКЦИНАТ:МЕНАХИНОН(
окислительно восстановительный потенциал
ОКСИДОРЕДУКТАЗА
гемов, спектры ЭПР и спектр поглощения ви
димого света незначительно различаются в за
SQR, также известный как сукцинатдегидро
висимости от того, определены ли они для свя
геназа и комплекс II, является частью как цикла
занного с мембраной SQR, для фермента, вы
Кребса, так и дыхательной цепи. Фермент ката
деленного с детергентом, или для цитохрома
лизирует окисление сукцината до фумарата,
b 558 (SdhC), выделенного с детергентом [67].
сопряжённое с восстановлением менахинона.
Редокс сопряжение между двумя гемами
Он также может действовать в обратном направ
в SdhC и между гемом bP и железосерными
лении, чтобы синтезировать сукцинат из фума
кластерами в SdhB в интактном SQR, а также
рата. Обзор исследований по SQR B. subtilis пос
взаимодействие с менахиноном и другими ли
ледний раз был опубликован в 2002 г. [60], а об
пидами, в случае мембранного фермен
зор исследований по SQR дигемного семейства,
та B. subtilis, вероятно, отражают наблюдаемые
к которому принадлежит фермент B. subtilis, был
незначительные различия в свойствах. Как по
опубликован в 2013 г. [61]. Обобщенные данные
казало исследование связывания HQNO, ря
по генетике sdhCAB B. subtilis, кодирующего три
дом с гемом bD существует сайт связывания ме
белка SQR, можно найти в обзоре Hederstedt и
нахинона [65, 68]. Основываясь на собранных
Ohnishi [62].
данных [60], можно предположить, что имида
B. subtilis SQR представляет собой гетеротри
зольная группа His28 (аксиальный лиганд ге
мер, состоящий из флавопротеина (SdhA) с ко
ма bD) и одна из пропионатных групп этого ге
валентно связанным FAD в соединении с 8α
ма напрямую взаимодействуют с менахиноном,
N(3)His железосерного белка (SdhB) с тремя
аналогично ситуации в нитратредуктазе A
железосерными кластерами
(2Fe2S,
3Fe4S,
E. coli [69]. Трансмембранный электрохимичес
4Fe4S) и интегрального мембраного цитохро
кий градиент поддерживает термодинамически
ма b 558 (SdhC) с 5 TM (I-V), содержащего две
эндергонический («uphill») перенос электронов
группы гема B (табл. 2). SdhA и SdhB связывают
в SQR B. subtilis при окислении сукцина
ся на цитоплазматической стороне мембраны с
та (+25 мВ) и переносе электронов через гем bP
цитохромом b 558. Активный центр дикарбок
(+65 мВ) на bD (-95 мВ) для восстановления
силата находится на SdhA, и электроны переда
менахинона 7 (-74 мВ) [70]. То же происходит
ются от FAD через железосерные кластеры к ге
и у других бактерий, зависимых от хинонов с
му цитохрома b 558, чтобы в конечном итоге
низким потенциалом при зависимом от сукци
восстановить менахинон. Две гемовые группы в
натоксидазы дыхании [71-73].
цитохроме b 558, как и в субъединице цитохро
Структура SQR B. subtilis, выведенная на ос
ма b комплекса bc, являются низкоспиновыми
нове множества биохимических и биофизичес
координированными с бис гистидинами и с
ких данных [60], соответствует недавно опубли
плоскостями порфирина, ориентированными
кованной крио ЭМ структуре SQR Mycobac
примерно перпендикулярно плоскости мембра
terium smegmatis (мембранный якорь содержит
ны и расположенными так, чтобы обеспечить
три полипептида SdhCDF) [74] и рентгено
трансмембранный перенос электронов. Однако
структурным данным для родственных дигемо
есть существенные различия между двумя типа
вых фумаратредуктаз Wolinella succinogenes [61,
ми дигемных, трансмембранных цитохро
75] и Desulfovibrio gigas [76]. Место связывания
мов [63]. В SQR B. subtilis четыре аксиальных ли
менахинона было обнаружено рядом с гемом bD
ганда His распределены по четырем ТМ [64],
как в структуре M. smegmatis, так и D. gigas, и ак
тогда как в комплексе bc они включают толь
тивность мутантов первого фермента подтверж
ко два ТМ [61].
дает мнение о том, что выявленный сайт свя
В SQR B. subtilis проксимальный гем (bP,
зывания важен для восстановления менахино
вблизи от мембранных периферических субъ
на. Попытки получить кристаллы SQR B. sub
единиц A и B на цитоплазматической стороне
tilis с хорошей дифракцией пока не увенчались
мембраны) и дистальный гем (bD, вблизи от
успехом [77]. Недостающую информацию, та
внешней стороны мембраны) были определе
кую как положение сайтов связывания мена
ны, как гемы с высоким и низким окислитель
хинона и динамические изменения белка фер
но восстановительным потенциалом соответ
мента в зависимости от субстратов и ингиби
ственно, с помощью методов сайт специфи
торов, можно было бы получить с помощью
ческих мутаций и спектроскопии
[65,
66]
методологии крио ЭМ. Для анализа методом
(табл. 2). Гем bP связан с His70 (TM II) и
ЯМР разработана методика получения цито
His155 (TM IV), тогда как гем bD связан с
хрома b 558 B. subtilis в E. coli с изотопной мет
His28 (TM I) и His113 (TM III). Измеряемый
кой [78].
БИОХИМИЯ том 86 вып. 1 2021
МОЛЕКУЛЯРНАЯ БИОЛОГИЯ ЦИТОХРОМОВ Bacillus subtilis НА 2020 ГОД
21
Таблица 2. Биофизические свойства простетических групп гемсодержащих компонентов аэробной респираторной
системы B. subtilis
Простетические группы a
Центры с гемом
Железосерные кластеры
Центры с медью
Фермент или
Ссылки
цитохром
EPR
α полоса
EPR
Другие
Центр
Em (mV)
сигнал
погл. макс.
Тип
Em (mV)
Центр
сигнал
(gmax)
(nm)
(gmax)
гем a
601
[102, 103,
Цитохром aa3
CuB
108]
гем a3
гем a
3,00
605
CuA
2,178
[102, 104,
Цитохром caa3
гем a3
CuB
108]
гем c
3,46
551
гем bP
+65
3,68
558b
[2Fe2S]
+80
SQR
FADcov
[65, 67, 100]
гем bD
-95
3,42
558b
[3Fe4S]
-25
[4Fe4S]
−240
гем bH
Цитохром
гем bL
bc комплекс
[2Fe2S]
[22, 23, 105]
гем ci
гем c
+250
553
Цитохром c 550
гем c
+178
3,41
550c
[37]
Цитохром c 551
гем c
> +100d
551e
[38]
гем b558
563
Цитохром bd
гем b595
597
[51]
гем d
626
Примечания. a Данные характеристики являются свойствами изолированного фермента или белкового домена. b При 77 К
гем bP имеет максимум поглощения при 558 нм, а гем bD имеет двойной пик с максимумами при 553 и 558 нм. c При 77 К
максимум поглощения приходится на 548 нм. d Цитохром Bacillus PS3 имеет среднеточечный потенциал +225 мВ [106].
e При 77 К максимум поглощения приходится на 547 нм.
ДЫХАТЕЛЬНАЯ НИТРАТРЕДУКТАЗА
сакоординированными группами гема b, гема
ми bH и bL, которые лигированы между остатка
Мембраносвязанная нитратредуктаза (NAR),
ми His на TM II и TM V, аналогично ситуации
кодируемая опероном narGHJI B. subtilis, катали
в QcrB комплекса цитохрома bc. NarI связывает
зирует окисление менахинола с восстановлени
на цитоплазматической стороне мембраны пе
ем нитрата до нитрита [79, 80]. Считается, что
риферические субъединицы NarG и NarH.
NAR B. subtilis в основном функционирует в от
NarG несет группу бис молибдоптерин гуанин
сутствие кислорода. Фермент не был очищен и
динуклеотида и один железосерный кластер
охарактеризован, но, судя по полипептидам,
4Fe4S, тогда как NarH содержит три класте
выведенным из генной последовательности,
ра 4Fe4S и один кластер 3Fe4S. Водораствори
очень похож на нитратредуктазу A E. coli, струк
мый белок NarJ является шапероном для сборки
тура которой известна [81], и подробная биохи
простетической группы молибдоптерина в
мическая информация о которой доступна [82].
NarG. Сайт окисления менахинола находится
Интегральная мембранная субъединица NarI
близко к внешней стороне мембраны у гема bL, и
представляет собой 5 TM цитохром с двумя гек
электроны сначала переносятся через мембрану
БИОХИМИЯ том 86 вып. 1 2021
22
ХЕДЕРШТЕДТ
на гем bH, затем через железосерные кластеры
штамм
3A38, который представляет собой
в NarH и наконец в NarG, где нитрат восстанав
NCIB 3610 с заменой Gln12 на Leu в ComI (ин
ливается. Таким образом, благодаря активнос
гибитор естественной генетической компетент
ти NAR возникает трансмембранный электро
ности) [85].
химический градиент.
Секвенирование полного генома подтверди
Для высокой экспрессии оперона narGHJI
ло, что штаммы NCIB 3610 и 3A38 различаются
B. subtilis необходимо наличие нитратов в пита
только точечной мутацией в гене comI [86]. При
тельной среде, а также анаэробный регулятор
конструировании мутантных штаммов (WBS1 2
ный белок FNR и двухкомпонентная регулятор
и WBS10) (табл. 3) было обнаружено, что одна
ная система ResDE [55, 80]. Две независимые
менахинол оксидаза, цитохром aa3 или цито
исследовательские группы обнаружили NAR в
хром bd, необходима для роста NCIB 3610 в кис
аэробно выращенных клетках B. subtilis и фер
лородных условиях, то есть мутанты с двойной
ментный комплекс SQR-NAR [17, 18], что ука
делецией qoxABCD cydABCD не могут быть полу
зывает на то, что NAR в некоторой степени про
чены точно так же, как в случае штамма 168 [8].
дуцируется также в аэробных условиях и что он
Штаммы WBS4, WBS5 и WBS7 лишены способ
в комплексе с SQR катализирует менахинон за
ности окислять TMPD, что свидетельствует о
висимое восстановление нитрата путём окисле
том, что эта активность в NCIB 3610 зависит от
ния сукцината.
цитохрома caa3, как и ожидалось, исходя из
свойств штамма 168 [31].
Было обнаружено, что ростовые свойства
ЯВЛЯЕТСЯ ЛИ ДЫХАТЕЛЬНАЯ СИСТЕМА
мутантов по цитохромам штамма NCIB 3610 не
ШТАММА 168 ПОКАЗАТЕЛЬНОЙ
отличимы от свойств соответствующих мутан
ДЛЯ ВИДА B. subtilis?
тов штамма 168. Т.е. условия роста в жидкой сре
де NSMP [87] или на чашках с триптозным кро
Одомашнивание изолятов дикого типа
вяным агар агаром (TBAB) («Difco Chem Co»,
B. subtilis при переносе их в лабораторные усло
США) отрицательно влияли на те мутантные
вия и легкость их генетической трансформации
штаммы, у которых отсутствовал цитохром aa3,
привели к преднамеренному и спонтанному му
тогда как те, у которых отсутствовали ферменты
тагенезу, в результате чего появилось несколько
ветви цитохрома bc-caa3 или цитохром bd, рос
штаммов, включая генетически и биохимически
ли подобно родительскому штамму. Влияние на
подробно исследованный штамм 168 [57, 83].
рост, вызванное дефицитом цитохрома aa3, за
Дыхательная система B. subtilis исследовалась
висит от добавления в питательную среду
преимущественно у этого штамма [3, 4]. Как
≥0,1% (w/v) глюкозы. Штаммы 168, NCIB 3610
упоминалось ранее в этом обзоре, делеция генов
и 3A38 не показали видимых различий в составе
цитохрома caa3 (ctaCDEF) [8, 31] или комплекса
и содержании цитохромов, что было продемон
цитохрома bc (qcrABC) [22] в лабораторном мо
стрировано на изолированных мембранах с по
дельном штамме 168 не влияет на способность к
мощью спектроскопии в видимом свете с полу
росту на различных субстратах, и также не на
чением разностных спектров (восстановленные
блюдается явных компенсаторных изменений в
аскорбатом и дитионитом минус окисленные
дыхательных ферментах. Это отсутствие фено
феррицианидом). Для анализа состава цитохро
типа (фенотипической изменчивости) у мутан
мов в мутантах бактерии выращивали на NSMP
тов интригует, но может быть объяснено некото
с добавлением 1% (w/v) глюкозы, чтобы избе
рым неизвестным нарушением в передаче
жать различий в скорости роста. Спектры
электронов от менахинола через комплекс ци
NCIB 3610 с делецией ctaCD, qoxABCD, cydABCD
тохрома bc к цитохрому caa3 в штамме 168. Что
и qcrABC соответственно и мутантов с двойной
бы определить, является ли дыхательная систе
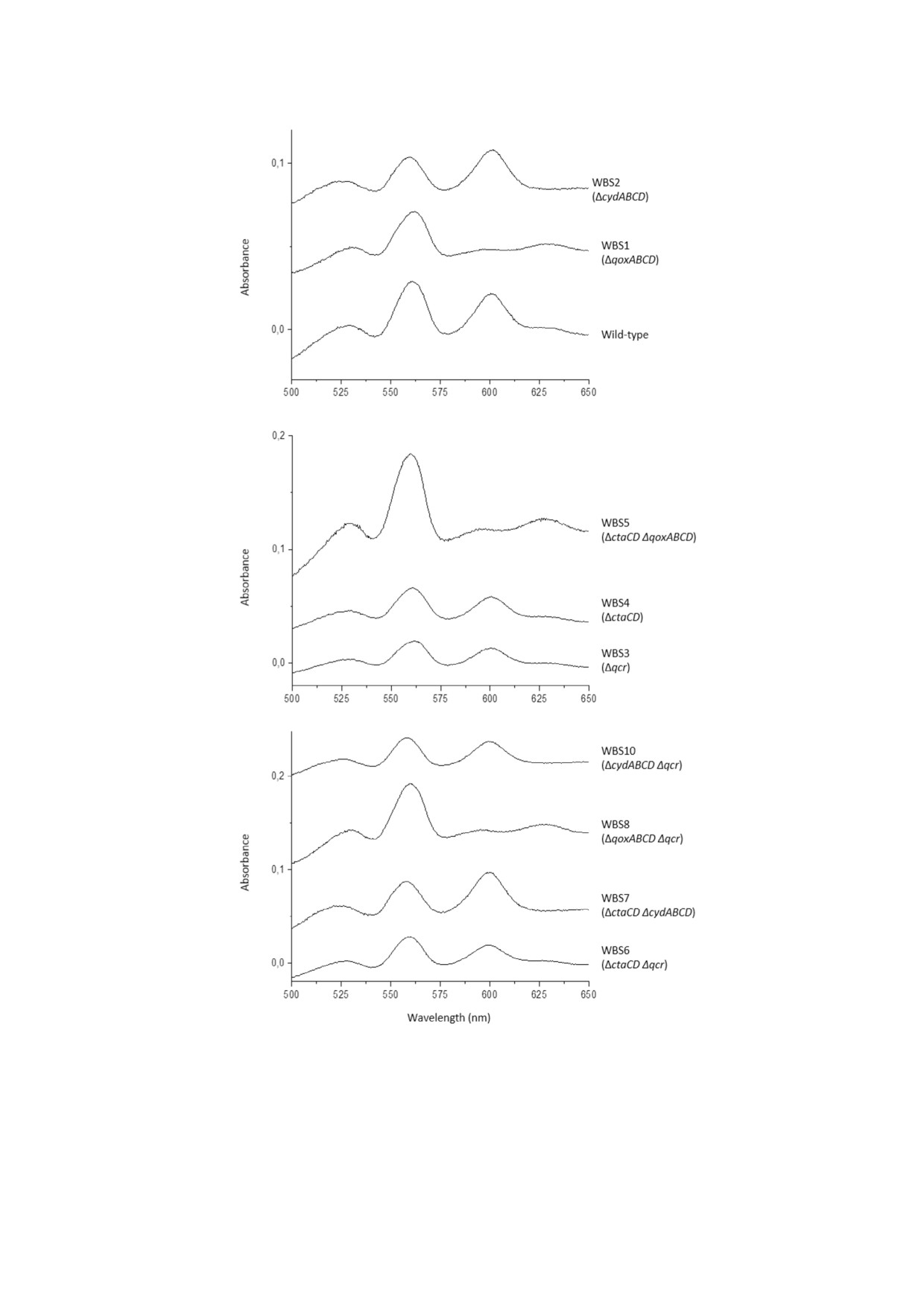
делецией (рисунок) были сходны со спектрами
ма в штамме 168 репрезентативной для клеток
соответствующих делеционных мутантов штам
B. subtilis, я провел сравнительное исследование
ма 168. Результаты показывают, что респиратор
с неодомашненным штаммом B. subtilis
ные компоненты лабораторного штамма 168 яв
NCIB 3610. По сравнению со штаммом 168 он
ляются репрезентативными для видов B. subtilis.
образует пелликулярные биопленки, большие
Суперкомплекс цитохромов bc-caa3 связы
массы, продуцирует экзополисахаридную кап
вается с KinB, и было высказано предположе
сулу, производит противомикробные препараты
ние, что KinB каким то образом может чувство
и содержит плазмиду, кодирующую бо
вать прохождение электронов через суперкомп
лее 100 белков [84]. Штамм 168 не содержит
лекс и тем самым отслеживать реальное парци
плазмид. Чтобы облегчить конструирование му
альное давление кислорода [88]. В поддержку
тантов путем трансформации, я использовал
этого сообщалось, что инактивация генов ци
БИОХИМИЯ том 86 вып. 1 2021
МОЛЕКУЛЯРНАЯ БИОЛОГИЯ ЦИТОХРОМОВ Bacillus subtilis НА 2020 ГОД
23
Таблица 3. Описание штаммов B. subtilis, использованных в работе
Название
Генотип
Источник/Ссылка
168 (1A1)
trpC2
BGSCa
NCIB 3610 (3A1)
Дикий тип
BGSCa
3A38
comI (мутант NCIB 3610)
BGSCa/[85]
LUH14
trpC2 ΔqoxABCD::kan
[8]
LUW35
trpC2 ΔcydABCD::tet
[51]
LUH60
trpC2 Δqcr::neo
[23]
LW3110
trpC2 ΔctaCD::cat
C. von Wachenfeldt
WBS1
comI trpC2 ΔqoxABCD::kan
LUH14→3A38
WBS2
comI trpC2 ΔcydABCD::tet
LUW35→3A38
WBS3
comI trpC2 Δqcr::neo
LUH60→3A38
WBS4
comI trpC2 ΔctaCD::cat
LW3110→3A38
WBS5
comI trpC2 ΔqoxABCD::kan ΔctaCD::cat
LW3110→WBS1
WBS6
comI trpC2 Δqcr::neo ΔctaCD::cat
LW3110→WBS3
WBS7
comI trpC2 ΔcydABCD::tet ΔctaCD::cat
LW3110→WBS2
WBS8
comI trpC2 Δqcr::neo ΔqoxABCD::kan
LUH14→WBS3
WBS10
comI trpC2 Δqcr::neo ΔcydABCD::tet
LUW35→WBS3
Примечание. Мутантные производные 3A38 были получены путём трансформации, как описано Hoch [107]. Стрелка ука
зывает на происхождение хромосомной ДНК и на трансформированный штамм. Трансформанты отбирали на чашках с
агаром TBAB с добавлением 1% (w/v) глюкозы и соответствующих антибиотиков в следующих концентрациях: хлорамфе
никол, 3 мкг/мл; канамицин, 7,5 мкг/мл; тетрациклин, 15 мкг/мл. a Bacillus Genetic Stock Center, Ohio, USA.
тохрома caa3 или комплекса цитохрома bc в
найти объяснение тому, что менахинон зависи
штамме NCIB 3610 влияет на продукцию био
мый перенос электронов в респираторной сис
пленок [88]. Это открытие требует дальнейшего
теме B. subtilis облегчается при энергизации
исследования. Я не обнаружил разницы в мор
мембраны, и что этот феномен проявляется не
фологии колоний между диким типом NCIB
только благодаря SQR [90], можно решить неко
3610 и его мутантными производными WBS3
торые из упомянутых проблем. Это также может
(Δqcr) и WBS4 (ΔctaCD) (табл. 3) после двухне
помочь исследовать дыхательную способность и
дельной инкубации на чашках MSgg при 37 °C.
состав цитохромов эндоспор и прорастающих
Более того, в исследованиях с Bacillus amylolique
клеток. Исследования цитохромов в эндоспорах
faciens было замечено, что мутанты с делецией
B. subtilis проводились очень давно [91], когда
генов cta или qcr имеют нормальную морфоло
большинство современных методов молекуляр
гию колоний, тогда как у мутантов с делеци
ного анализа были недоступны, а эндоспоры
ей qox, выращенных при пониженном давлении
были гораздо менее изучены на молекулярном
кислорода, было нарушено образование био
уровне [92]. Другое неизученное направление -
пленок [89].
это перемещение респираторных белков в клет
ке, то, как они динамически взаимодействуют и
распределяются вдоль цитоплазматической
ЧТО ЕЩЕ ПРЕДСТОИТ ВЫЯСНИТЬ
мембраны во время роста бактерии. Например,
О РЕСПИРАТОРНЫХ ЦИТОХРОМАХ
ферменты и суперкомплексы могут собираться в
Bacillus subtilis?
первую очередь на полюсах или на боковой сто
роне палочковидной бактерии. Во время много
Основные остающиеся загадки в отношении
часового и энергоёмкого процесса биогенеза эн
аэробной респираторной системы B. subtilis -
доспор цитохромные комплексы, возможно, не
это физиологическая роль ветви цитохром с ок
равномерно распределяются на разных мембра
сидазы, идентичность доноров и акцепторов
нах материнской клетки и будущей споры. Ис
электронов для цитохромов с 550 и с 551, иден
следования динамики субклеточного распреде
тичность цитохрома bb′, а также состав и физио
ления мембранных белков зависят от доступ
логическая роль в метаболизме YthAB. Если
ности техники с высоким визуальным разреше
БИОХИМИЯ том 86 вып. 1 2021
24
ХЕДЕРШТЕДТ
Разностные спектры поглощения видимого света (восстановленный минус окисленный) для изолированных мембран
B. subtilis NCIB 3610 дикого типа и цитохром дефицитных мутантов (табл. 3). Мембраны были выделены из указанных
штаммов, выращенных в NSMP, pH 7,0 с добавлением 1% (w/v) глюкозы. Культуры собирали в конце фазы экспоненци
ального роста и мембраны выделяли, как описано ранее [87]. Разностные спектры материала мембран (3 мг/мл мембран
ного белка в 20 мМ натриевом буфере MOPS/HCl, pH 7,4, 1 мМ KCN) - восстановленные дитионитом минус окислен
ные феррицианидом - регистрировали при комнатной температуре в кювете объемом 1 мл (световой путь 10 мм) с ис
пользованием Olis Inc. - модернизированного спектрофотометра Aminco DW 2, Германия, щель - 1 нм
БИОХИМИЯ том 86 вып. 1 2021
МОЛЕКУЛЯРНАЯ БИОЛОГИЯ ЦИТОХРОМОВ Bacillus subtilis НА 2020 ГОД
25
нием для работы с живыми дышащими клетка
лентно связанным FAD в B. subtilis, и FAD не
ми и с функционирующими флуоресцентно ме
требуется для сборки тримера SQR в мембра
ченными белками.
не [99, 100]. Предполагается найти гены, коди
Практически не изучен биогенез гем содер
рующие фактор(ы) флавинилирования SdhA,
жащих респираторных компонентов и не опре
путем скрининга мутантов B. subtilis, лишенных
делены связанные с этим факторы сборки. Од
SQR активности, на наличие мутаций, располо
нако биогенез гема А и цитохрома с B. subtilis
женных вне кластера sdhCAB в хромосоме [101],
изучен достаточно подробно [27, 28]. Путем
но о таких мутантах пока не сообщалось.
скрининга трех коллекций мутантов B. subtilis
мы недавно обнаружили два новых фактора
B. subtilis оказалась полезной модельной сис
сборки цитохром с оксидазы
- CtaK и
темой для исследования функционирования и
CtaM [30]. Таким образом, стало известно, что
сборки респираторных ферментов. Основными
для синтеза цитохрома caa3 B. subtilis требуется
причинами этого являются простота молекуляр
двенадцать различных белков. Для некоторых из
но генетических манипуляций, роста и выделе
этих факторов роль в сборке неясна или не по
ния мембран, а также то, что для аэробного рос
нятна на механистическом уровне. Функция
та не требуется ни одного белкового компонен
АТР связывающих белков CydC и CydD при
та дыхательной системы, что позволяет прово
сборке активного цитохрома bd не изучена ни у
дить эксперименты с цитохром дефицитными
одной бактерии. Что касается биосинтеза SQR,
мутантами. Очевидно, что B. subtilis в ближай
то белок SdhC в мембране, по видимому, изме
шие десятилетия станет организмом, который
няет конформацию при присоединении гема с
будет использоваться для исследования аспек
образованием цитохрома b 558, и это изменение
тов биоэнергетики, общих для аэробных клеток
позволяет связывать цитоплазматическую субъ
или специальных для грамположительных бак
единицу железосерных белков SdhB и SdhA, со
терий.
держащую ковалентно связанный FAD. Неизве
стно, как гем доставляется в SdhC, и требуются
ли определенные факторы сборки для вставки
Благодарности. Обзор написан в память об
двух групп гема. Когда три Sdh полипептида
Александре Александровиче Константинове.
B. subtilis продуцируются в клетках E. coli, цито
Наши лаборатории в Лундском Университете и
хром b 558 образуется в мембране, но SdhA не
Московском государственном университете ак
флавинилируется и остается в цитоплазме, не
тивно сотрудничали в исследованиях респира
связываясь с цитохромом b 558 [93-95]. На ос
торных цитохромов B. subtilis в период с 1993 по
новании этих фактов в то время было высказано
1999 год при поддержке грантов Шведской ко
предположение, что либо для посттрансляцион
ролевской академии наук. Это привело, кроме
ной модификации SdhA необходим специфи
прочего, к публикациям статей из списка лите
ческий фактор, отсутствующий в клетках E. coli,
ратуры [57, 68, 90]. Благодарю Андре Франка за
либо этот процесс заблокирован [94]. В даль
практическую помощь в конструировании и
нейшем белки, которые участвуют в флавини
анализе мутантных штаммов.
лировании полипепида SdhA, были обнаружены
Конфликт интересов. Автор заявляет об отсут
у нескольких организмов [96, 97], но не у B. sub
ствии конфликта интересов в финансовом или
tilis. Примечательно, что 6 гидрокси D никотин
ином аспекте.
оксидаза Arthrobacter oxydans, которая име
Соблюдение этических норм. Настоящая
ет FAD, ковалентно связанный таким же обра
статья не содержит описания выполненных ав
зом, как и в SQR, флавинилируется в B. sub
тором исследований с участием людей или ис
tilis [98]. SdhA - это единственный белок с кова
пользованием животных в качестве объектов.
СПИСОК ЛИТЕРАТУРЫ
1.
Arjes, H. A., Vo, L., Dunn, C. M., Willis, L., DeRosa, C. A.,
3.
Von Wachenfeldt, C., and Hederstedt, L. (1992) Molecular
et al. (2020) Biosurfactant mediated membrane depolar
biology of Bacillus subtilis cytochromes, FEMS Microbiol.
ization maintains viability during oxygen depletion in
Lett., 100, 91 100.
Bacillus subtilis, Curr. Biol., 30, 1 12, doi: 10.1016/j.cub.
4.
Von Wachenfeldt, C., and Hederstedt, L.
(2002)
2020.01.073.
Respiratory cytochromes, other heme proteins, and
2.
Nicholson, W. N., Munakata, N., Horneck, G., Melosh,
heme biosynthesis, in Bacillus subtilis and its closest rela
H. J., and Setlow, P. (2000) Resistance of Bacillus endo
tives. From genes to cells. (Sonenshein, A. L., Hoch, J. A.,
spores to extreme terrestrial and extraterrestrial environ
and Losick, R. eds) ASM Press, Washington DC, pp. 63
ments, Microbiol. Mol. Biol. Rev., 64, 548 572.
179.
БИОХИМИЯ том 86 вып. 1 2021
26
ХЕДЕРШТЕДТ
5.
Zhu, B., and Stülke, J. (2018) SubtiWiki in 2018: from
22.
Yu, J., Hederstedt, L., and Piggot, P. J. (1995) The
genes and proteins to functional network annotation of the
cytochrome bc complex (menaquinone:cytochrome c
model organism Bacillus subtilis, Nucleic Acids Res., 46,
reductase) in Bacillus subtilis has a nontraditional subunit
D743 D748, doi: 10.1093/nar/gkx908.
organization, J. Bacteriol., 177, 6751 6760.
6.
Garcia Horsman, J. A., Barquera, B., Rumbley, J., Ma, J.,
23.
Yu, J., and Le Brun, N. E. (1998) Studies of the
and Gennis, R. B. (1994) The superfamily of heme copper
cytochrome subunits of menaquinone:cytochrome c
respiratory oxidases, J. Bacteriol., 176, 5587 5600.
reductase (bc complex) of Bacillus subtilis. Evidence for the
7.
Zamboni, N., and Sauer, U. (2003) Knockout of the high
covalent attachment of heme to the cytochrome b subunit,
coupling cytochrome aa3 oxidase reduces TCA cycle fluxes
J. Biol. Chem., 273, 8860 8866.
in Bacillus subtilis, FEMS Microbiol. Lett., 226, 121 126,
24.
Baniulis, D., Yamashita, E., Zhang, H., Hasan, S. S., and
doi: 10.1016/S0378 1097(03)00614 1.
Cramer, W A. (2008) Structure function of the cytochrome
8.
Winstedt, L., and von Wachenfeldt, C. (2000) Terminal
b6 f complex, Photochem. Photobiol., 84, 1349 1350.
oxidases of Bacillus subtilis strain 168: one quinol oxidase,
25.
De Vitry, C. (2011) Cytochrome c maturation system on
cytochrome aa3 or cytochrome bd, is required for aerobic
the negative side of bioenergetic membranes: CCB or sys
growth, J. Bacteriol., 182, 6557 6564.
tem IV, FEBS J., 278, 4189 4197.
9.
Santana, M., Kunst, F., Hullo, M. F., Rapoport, G.,
26.
Bengtsson, J., von Wachenfeldt, C., Winstedt, L., Nygaard, P.,
Danchin, A., and Glaser, P. (1992) Molecular cloning,
and Hederstedt, L. (2004) CtaG is required for formation
sequencing, and physiological characterization of the qox
of active cytochrome c oxidase in Bacillus subtilis,
operon from Bacillus subtilis encoding the aa3 600 quinol
Microbiology, 150, 415 425.
oxidase, J. Biol. Chem., 267, 10225 10231.
27.
Simon, J., and Hederstedt, L. (2011) Composition and
10.
Larsson, J. T., Rogstam, A., and von Wachenfeldt, C.
function of cytochrome c biogenesis system II, FEBS J.,
(2005) Coordinated patterns of cytochrome bd and lactate
278, 4179 4188, doi: 10.1111/j.1742 4658.2011.08374.x.
dehydrogenase expression in Bacillus subtilis, Microbiology,
28.
Hederstedt, L. (2012) Heme A biosynthesis, Biochim.
151, 3323 3335.
Biophys. Acta, 1817, 920 927, doi: 10.1016/j.bbabio.2012.
11.
Borisov, V., Gennis, R. B., Hemp, J., and Verkhovsky, M. I.
03.025.
(2011) The cytochrome bd respiratory oxygen reductases,
29.
Mattatall, N. R., Jazairi, J., and Hill, B. C.
(2000)
Biochim. Biophys. Acta, 1807, 1398 1413.
Characterization of YpmQ, an accessory protein required
12.
Schiott, T., and Hederstedt, L. (2000) Efficient spore syn
for the expression of cytochrome c oxidase in Bacillus sub
thesis in Bacillus subtilis depends on the CcdA protein,
tilis, J. Biol. Chem., 275, 28802 28809.
J. Bacteriol., 182, 2845 2854.
30.
Von Wachenfeldt, C., Hallgren, J., and Hederstedt, L.
13.
Le Brun, N. E., Bengtsson, J., and Hederstedt, L. (2000)
(2020) Cytochrome c oxidase biosynthesis factors in
Genes required for cytochrome c synthesis in Bacillus sub
Bacillus subtilis: Discovery of YtkA (CtaK) and YozB
tilis, Mol. Microbiol., 36, 638 650.
(CtaM), in press.
14.
Erlendsson, L. S., Acheson, R. M., Hederstedt, L., and Le
31.
Van der Oost, J., von Wachenfeldt, C., Hederstedt, L., and
Brun, N. E. (2003) Bacillus subtilis ResA is a thiol disulfide
Saraste, M. (1991) Bacillus subtilis cytochrome oxidase
oxidoreductase involved in cytochrome c synthesis, J. Biol.
mutants: biochemical analysis and genetic evidence for two
Chem., 278, 17852 17858, doi: 10.1074/jbc.M300103200.
aa3 type oxidases, Mol. Microbiol., 5, 2063 2072.
15.
Xu, J., Ding, Z., Liu, B., Yi, S. M., Li, J., et al. (2019)
32.
Contreras Zentella, M., Mendoza, G., HMembrillo
Structure of the cytochrome aa3 600 heme copper
Hernández, J., and Escamilla, J. E. (2003) A novel double
menaquinol oxidase bound to inhibitor HQNO shows
heme substitution produces a functional bo3 variant of the
TM0 is part of the quinol binding site, Proc. Natl. Acad. Sci.
quinol oxidase aa3 of Bacillus cereus, J. Biol. Chem., 278,
USA, 117, 872 876.
31473 31478.
16.
Melo, A. P. M., and Teixeira, M. (2016) Supramolecular
33.
Sone, N., and Fujiwara, Y. (1991) Haem O can replace
organizaton of bacterial aerobic respiratory chains: from
haem A in the active site of cytochrome c oxidase from
cells and back, Biochim. Biophys. Acta, 1857, 190 197.
thermophilic bacterium PS3, FEBS Lett., 288, 154 158.
17.
Sousa, P. M. F., Videira, M. A. M., Santos, F. A. S., Hood,
34.
Svensson, B., Lubben, M., and Hederstedt, L. (1993)
B. L., Conrads, T. P., and Melo, A. M. P. (2013) The
Bacillus subtilis CtaA and CtaB function in haem A biosyn
bc:caa3 supercomplexes from the Gram positive bacterium
thesis, Mol. Microbiol., 10, 193 201.
Bacillus subtilis respiratory chain: a megacomplex organi
35.
Hederstedt, L., Lewin, A., and Throne Holst, M. (2005)
zation? Arch. Biochem. Biophys., 537, 153 160.
Heme A synthase enzyme functions dissected by mutagen
18.
Montes de Oca, L. Y. J. G., Chagolla Lopez, A., de la Vara,
esis of Bacillus subtilis CtaA, J. Bacteriol., 187, 8361 8369,
L., Cabellos Alevar, T., Gomez Lojero, C., and Gutierrez
doi: 10.1128/JB.187.24.8361 8369.2005.
Cirlos, E. B. (2012) The composition of the Bacillus subtilis
36.
Von Wachenfeldt, C., and Hederstedt, L. (1990) Bacillus
aerobic respiratory chain supercomplexes, J. Bioenerg.
subtilis 13 kilodalton cytochrome c 550 encoded by cccA
Biomembr., 44, 473 486.
consists of a membrane anchor and a heme domain,
19.
Gong, H., Li, J., Xu, A., Tang, Y., Ji, W., Gao, R., et al.
J. Biol. Chem., 265, 13939 13948.
(2018) An electron transfer path connects subunits of a
37.
Von Wachenfeldt, C., and Hederstedt, L. (1993) Physico
mycobacterial respiratory supercomplex, Science, 362,
chemical characterisation of membrane bound and water
eaat8923, doi: 10.1126/science.aat8923.
soluble forms of Bacillus subtilis cytochrome c 550, Eur. J.
20.
Wiseman, B., Nitharwal, R. G., Fedotovskaya, O., Schäfer, J.,
Biochem., 212, 499 509.
Guo, H., et al. (2018) Structure of a functional obligate
38.
Bengtsson, J., Rivolta, C., Hederstedt, L., and Karamata, D.
complex III2IV2 respiratory supercomplex from Mycobac
(1999) Bacillus subtilis contains two small c type cyto
terium smegmatis, Nature Struct. Mol. Biol., 25, 1128 1136,
chromes with homologous heme domains but different
doi: 10.1038/s41594 018 0160 3.
types of membrane anchors, J. Biol. Chem., 274, 26179
21.
Montes de Oca, L. Y. J. G., Avelar, T. C., Picón Garrido,
26184.
G. I., Chagoya López, A., González de la Vara, L., et al.
39.
Fujiwara, Y., Oka, M., Hamamoto, T., and Sone, N.
(2016) Cardiolipin deficiency causes a dissociation of the
(1993) Cytochrome c 551 of the thermophilic bacterium
b6c:caa3
megacomplex in B. subtilis membranes,
PS3, DNA sequence and analysis of the mature
J. Bioenerg. Biomembr., 48, 451 467.
cytochrome, Biochim. Biophys. Acta, 1144, 213 218.
БИОХИМИЯ том 86 вып. 1 2021
МОЛЕКУЛЯРНАЯ БИОЛОГИЯ ЦИТОХРОМОВ Bacillus subtilis НА 2020 ГОД
27
40.
Sone, N., and Toh, H. (1994) Membrane bound Bacillus
properties of the Bacillus subtilis transcriptional repressor
cytochromes c and their phylogenetic position among bac
Rex, Mol. Microbiol., 69, 466 478.
terial class I cytochromes c, FEMS Microbiol. Lett., 122,
57.
Azarkina, N., Siletsky, S., Borisov, V., von Wachenfeldt, C.,
203 210.
Hederstedt, L., and Konstantinov, A. A. (1999) A
41.
Benini, S., Gonzales, A., Rypniewski, W. R., Wilson, K. S.,
cytochrome bb’ type quinol oxidase in Bacillus subtilis
van Beeumen, J. J., and Ciurli, S. (2000) Crystal structure
strain 168, J. Biol. Chem., 274, 32810 32817.
of oxidized Bacillus pasteurii cytochrome c553 at 0.97 Å
58.
Borriss, R., Danchin, A., Harwood, C. R., Médigue, C.,
resolution, Biochemistry, 39, 13115 13126, doi: 10.1021/
Rocha, E. P. C., Sekowska, A., and Vallenet, D. (2017)
bi000402j.
Bacillus subtilis, the model Gram positive bacterium: 20
42.
Monedero, V., Boël, G., and Deutscher, J.
(2001)
years of annotation refinement, Microbial biotechnol., 11,
Catabolite regulation of the cytochrome c550 encoding
3 17.
Bacillus subtilis cccA gene, J. Mol. Biol. Biotech., 3, 433
59.
Thebeling, A., Rasmussen, T., Burschel, S., Wohlwend, D.,
438.
Kägi, J., et al. (2019) Homologous bd oxidases share the
43.
Hambraeus, G., von Wachenfeldt, C., and Hederstedt, L.
same architecture but differ in mechanism, Nat. Comm.,
(2003) Genome wide survey of mRNA half lives in
10, 5138, doi: 10.1038/s41467 019 13122 4.
Bacillus subtilis identifies extremely stable mRNAs, Mol.
60.
Hederstedt, L. (2002) Succinate:quinone oxidoreductase
Genet. Genomics, 269, 706 714, doi: 10.1007/s00438 003
in the bacteria Paracoccus denitrificans and Bacillus subtilis,
0883 6.
Biochim. Biophys. Acta, 1553, 74 83.
44.
Anderson, I., Sorokin, A. K., Kapatral, V., Reznik, G.,
61.
Lancaster, C. R. D. (2013) The di heme family of respira
Bhattacharya, A., Mikhailova, N., et al.
(2005)
tory complex II enzymes, Biochim. Biophys. Acta, 1827,
Comparative genome analysis of Bacillus cereus group
679 687.
genomes with Bacillus subtilis, FEMS Microbiol. Lett., 250,
62.
Hederstedt, L., and Ohnishi, T. (1992) Progress in succi
175 184, doi: 10.1016/j.femsle.2005.07.008.
nate:quinone oxidoreductase research, in Molecular
45.
Wilson, A. C., Hoch, J., and Perego, M. (2009) Two small
Mechanisms in Bioenergetics (Ernster, L., ed.), Elsevier,
c type cytochromes affect virulence gene expression in
Amsterdam, pp. 163 198.
Bacillus anthracis, Mol. Microbiol., 72, 109 123.
63.
Berry, E. A., and Walker, F. A. (2008) Bis histidine coordi
46.
Gustavsson, T., Trane, M., Moparthi, V. K., Miklovyte, E.,
nated hemes in four helix bundels: how the geometry of the
Mopharti, L., Gorecki, K., et al. (2010) A cytochrome c
bundle controls the axial imidazole plane orientations in
fusion protein domain for convenient detection, quantifi
transmembrane cytochromes of mitochondrial Complexes
cation, and enhanced production of membrane proteins in
II and III and related proteions, J. Biol. Inorg. Chem., 13,
Escherichia coli expression and characterization of
481 498.
cytochrome tagged complex I subunits, Protein Sci., 19,
64.
Hägerhäll, C., and Hederstedt, L. (1996) A structural
1445 1460, doi: 10.1002/pro.424.
model for the membrane integral domain of suc
47.
Forte, E., Borisov, V. B., Vicente, J. B., and Giuffé, A.
cinate:quinone oxidoreductases, FEBS Lett., 389, 25 31.
(2017) Cytochrome bd and gaseous ligands in bacterial
65.
Matsson, M., Tolstoy, D., Aasa, R., and Hederstedt, L.
physiology, Adv. Microbial. Physiol., 71, 171 234.
(2000) The distal heme center in Bacillus subtilis succi
48.
Sakamoto, J., Koga, E., Mizuta, T., Sato, C., Noguchi, S.,
nate:quinone reductase is crucial for electron transfer to
and Sone, N. (1999) Gene structure and quinol oxidase
menaquinone, Biochemistry, 39, 8617 8624.
activity of a cytochrome bd type oxidase from Bacillus
66.
Hägerhäll, C., Friden, H., Aasa, R., and Hederstedt, L.
stearothermophilus, Biochim. Biophys. Acta, 1411, 147 158,
(1995) Transmembrane topology and axial ligands to
doi: 10.1016/s0005 2728(99)00012 2.
hemes in the cytochrome b subunit of Bacillus subtilis suc
49.
Safarian, S., Rajendran, C., Müller, H., Preu, J., Langer,
cinate:menaquinone reductase, Biochemistry, 34, 11080
J. D., et al. (2016) Structure of a bd oxidase indicates sim
11089.
ilar mechanisms for membrane integrated oxygen reduc
67.
Hägerhäll, C., Aasa, R., von Wachenfeldt, C., and
tases, Science, 352, 583 586.
Hederstedt, L. (1992) Two hemes in Bacillus subtilis succi
50.
Safarian, S., Hahn, A., Mills, D. J., Radloff, M., Eisinger,
nate:menaquinone oxidoreductase (complex II),
M. L., et al. (2019) Active site rearrangement and structur
Biochemistry, 31, 7411 7421.
al divergence in prokaryotic respiratory oxidases, Science,
68.
Smirnova, I. A., Hägerhäll, C., Konstantinov, A. A., and
366, 100 104.
Hederstedt, L.
(1995) HOQNO interaction with
51.
Winstedt, L., Yoshida, K., Fujita, Y., and von
cytochrome b in succinate:menaquinone oxidoreductase
Wachenfeldt, C. (1998) Cytochrome bd biosynthesis in
from Bacillus subtilis, FEBS Lett., 359, 23 26.
Bacillus subtilis: characterization of the cydABCD operon,
69.
Fedor, J. G., Rothery, R. A., Giraldi, K. S., and Weiner,
J. Bacteriol., 180, 6571 6580.
J. H. (2014) Q site occupancy defines heme heterogenity
52.
Kjelgaard, P. (2007) Studies on Haemproteins of Gram posi
in Escherichia coli nitrate reductase A (NarGHI),
tive Bacteria, PhD thesis, Lund University, Lund, Sweden.
Biochemistry, 53, 1733 1741.
53.
Winstedt, L., Frankenberg, L., Hederstedt, L., and
70.
Schnorpfeil, M., Janausch, I. G., Biel, S., Kröger, A., and
Wachenfeldt, C. V. (2000) Enterococcus faecalis V583 con
Unden, G. (2001) Generation of a proton potential by suc
tains a cytochrome bd type respiratory oxidase,
cinate dehydrogenase of Bacillus subtilis functioning as a
J. Bacteriol., 182, 3863 3866.
fumarate reductase, Eur. J. Biochem., 268, 3069 3074.
54.
Puri Taneja, A., Schau, M., Chen, Y., and Hulett, F. M.
71.
Madej, M. G., Nasiri, H. R., Hilgendorff, N. S., Schwalbe, H.,
(2007) Regulators of the Bacillus subtilis cydABCD operon:
Unden, G., and Lancaster, C. R. D. (2006) Experimental
identification of a negative regulator, CcpA, and a positive
evidence for proton motive force dependent catalysis by
regulator, ResD, J. Bacteriol.,
189,
33483358,
the diheme containing succinate:menaquinone oxidore
doi: 10.1128/JB.00050 07.
ductase from the gram positive bacterium Bacillus licheni
55.
Reents, H., Münch, R., Dammeyer, T., Jahn, D., and
formis, Biochemistry, 45, 15049 15055.
Härtig, E. (2006) The Fnr regulon of Bacillus subtilis,
72.
Schirawski, J., and Unden, G. (1998) Menaquinone
J. Bacteriol., 188, 1103 1112.
dependent succinate dehydrogenase of bacteria catalyzes
56.
Wang, E., Bauer, M., Rogstam, A., Linse, S., Logan, D.,
reversed electron transport driven by the proton potential,
and Von Wachenfeldt, C. (2008) Structure and functional
Eur. J. Biochem., 257, 210 215.
БИОХИМИЯ том 86 вып. 1 2021
28
ХЕДЕРШТЕДТ
73.
Zaunmüller, T., Kelly, D. J., Glöckner, F. O., and Unden, G.
ratory chain of Bacillus subtilis by membrane erergization,
(2006) Succinate dehydrogenase functioning by reverse
J. Bacteriol., 184, 5339 5347.
redox loop mechanism and fumarate reductase in sulphate
91. Tochikubo, K. (1971) Changes in terminal respiratory
reducing bacteria, Microbiology, 152, 2443 2453.
pathways of Bacillus subtilis during germination, outgrowth
74.
Gong, H., Gao, Y., Zhou, X., Xiao, Y., Wang, W., et al.
and vegetative growth, J. Bacteriol., 108, 652 661.
(2020) Cryo EM structure of trimeric Mycobacterium
92. Tan, I. S., and Ramamurthi, K. S. (2014) Spore formation
smegmatis succinate dehydrogenase with a membrane
in Bacillus subtilis, Environ. Microbiol. Rep., 6, 212 225,
anchor SdhF, Nat. Comm., 11, 4245, doi: 10.1038/s41467
doi: 10.1111/1758 2229.12130.
020 18011 9.
93. Magnusson, K., Hederstedt, L., and Rutberg, L. (1985)
75.
Lancaster, C. R. D., Kröger, A., Auer, M., and Michel, H.
Cloning and expression in Escherichia coli of sdhA, the
(1999) Structure of fumarate reductase from Wolinella suc
structural gene for cytochrome b558 of the Bacillus subtilis
cinogenes at 2.2 Å resolution, Nature, 402, 377 385.
succinate dehydrogenase complex, J. Bacteriol., 162, 1180
76.
Guan, H. H., Hsieh, Y. C., Lin, P. J., Huang, Y. C.,
1185.
Yoshimura, M., et al. (2018) Structural insights into the
94. Hederstedt, L., Bergman, T., and Jörnvall, H.
(1987)
electron/proton transfer pathways in the quinol:fumarate
Processing of Bacillus subtilis succinate dehydrogenase and
reductase from Desulfovibrio gigas, Sci. Rep., 8, 14935,
cytochrome b 558 polypeptides. Lack of covalently bound
doi: 10.1038/s41598 018 33193 5.
flavin in the Bacillus enzyme expressed in Escherichia coli,
77.
Wöhri, A. B., Johansson, L. C., Wadsten Hindrichsen, P.,
FEBS Lett., 213, 385 390.
Wahlghren, W. Y., Fisher, G., et al. (2008) A lipidic sponge
95. Phillips, M. K., Hederstedt, L., Hasnain, S., Rutberg, L.,
phase screen for membrane protein crystallization,
and Guest, J. R. (1987) Nucleotide sequence encoding the
Structure, 16, 1003 1009, doi: 10.1016/j.str.2008.06.003.
flavoprotein and iron sulfur protein subunits of the Bacillus
78.
Baureder, M., and Hederstedt, L. (2011) Production,
subtilis PY79 succinate dehydrogenase complex,
purification and detergent exchange of isotopically labeled
J. Bacteriol., 169, 864 873.
Bacillus subtilis cytochrome b558 (SdhC), Protein Expr.
96. Moosavi, B., Berry, E. A., Zhu, X. L., and Yang, W. C.
Purif., 80, 97 101, doi: 10.1016/j.pep.2011.05.013.
(2019) The assembly of succinate dehydrogenase: a key
79.
Hoffman, T., Troup, B., Szabo, A., Hungerer, C., and
enzyme in bioenergetics, Cell. Mol. Life Sci., 76, 4023 4042.
Jahn, D. (1995) The anaerobic life of Bacillus subtilis:
97. Sharma, P., Maklashina, E., Cecchini, G., and Iverson,
cloning of the genes encoding the respiratory nitrate reduc
T. M. (2019) Maturation of the respiratory complex II
tase system, FEMS Microbiol. Lett., 131, 219 225.
flavoprotein, Curr. Opin. Struct. Biol., 59, 38 46.
80.
Richardson, D. J., Berks, B. C., Rusell, D. A., Spiro, S.,
98. Brandsch, R., and Hederstedt, L. (1989) Expression and
and Taylor, C. J. (2001) Functional, biochemical and
flavinylation of Arthrobacter oxydans 6 hydroxy D nico
genetic diversity of prokaryotic nitrate reductases, Cell.
tine oxidase in Bacillus subtilis, J. Gen. Microbiol., 135,
Mol. Life Sci., 58, 165 178.
1093 1099.
81.
Bertero, M. G., Rothery, R. A., Palak, M., Hou, C., Lim, D.,
99. Hederstedt, L. (1983) Succinate dehydrogenase mutants of
et al. (2003) Insight into the respiratory electron transfer
Bacillus subtilis lacking covalently bound flavin in the flavo
pathway from the structure of nitrate reductase A, Nat.
protein subunit, Eur. J. Biochem., 132, 589 593.
Struct. Biol., 10, 681 686.
100. Maguire, J., Magnusson, K., and Hederstedt, L. (1986)
82.
Blasco, D., Guigliarelli, B., Magalon, A., Asso, M.,
Bacillus subtilis mutant succinate dehydrogenase lacking
Giordano, G., and Rothery, R. A. (2001) The coordination
covalently bound flavin: identification of the primary
and function of the redox centers of membrane bound
defect and studies on the iron sulfur clusters in mutated
nitrate reductases, Cell. Mol. Life Sci., 58, 179 193.
and wild type enzyme, Biochemistry, 25, 5202 5208.
83.
Zeigler, D. R., Prágai, Z., Rodriguez, S., Chevreux, B.,
101. Hederstedt, L., Magnusson, K., and Rutberg, L. (1982)
Muffler, A., et al. (2008) The Origins of 168, W23, and other
Reconstitution of succinate dehydrogenase in Bacillus sub
Bacillus subtilis legacy strains, J. Bacteriol., 190, 6983 6995.
tilis by protoplast fusion, J. Bacteriol., 152, 157 165.
84.
Burton, A. T., and Kearns, D. B. (2020) The large
102. Lauraeus, M., Haltia, T., Saraste, M., and Wikstrom, M.
pBS32/pLS32c plasmid of ancestral Bacillus subtilis,
(1991) Bacillus subtilis expresses two kinds of haem A con
J. Bacteriol., 202, e00290 20, doi: 10.1128/JB 00290 20.
taining terminal oxidases, Eur. J. Biochem., 197, 699 705.
85.
Konkol, M. A., Blair, K. M., and Kearns, D. B. (2013)
103. Lauraeus, M., Wikström, M., Varotsis, C., Tecklenburg,
Plasmid encoded ComI inhibits competence in the ancestral
M. J., and Babcock, G. T. (1992) Optical and resonance
3610 strain of Bacillus subtilis, J. Bacteriol., 195, 4085 4093.
raman spectroscopy of the heme groups of the quinol oxi
86.
Nye, T. M., Schroeder, J. W., Kearns, D. B., and Simmons,
dizing cytochrome aa3 of Bacillus subtilis, Biochemistry, 31,
L. A. (2017) Complete genome sequence of undomesticat
10054 10060.
ed Bacillus subtilis strain NCIB 3610, Genome Announc., 5,
104. Von Wachenfeldt, C., de Vries, S., and van der Oost, J.
e00364 e00317, doi: 10.1128/genomeA.00364 17.
(1994) The CuA site of the caa3 type oxidase of Bacillus
87.
Hederstedt, L. (1986) Molecular properties, genetics, and
subtilisis a mixed valence binuclear copper centre, FEBS
biosynthesis of Bacillus subtilis succinate dehydrogenase
Lett., 340, 109 113.
complex, Methods Enzymol., 126, 399 414.
105. De Vrij, W., van der Burg, B., and Konings, W. N. (1987)
88.
Kolodkin Gal, I., Elsholz, A. K. W., Muth, C., Girguis,
Spectral and potentiometric analysis of cytochromes from
P. R., Kolter, R., and Losick, R. (2013) Respiration control
Bacillus subtilis, Eur. J. Biochem., 166, 589 595.
of multicellularity in Bacillus subtilis by a complex of the
106. Sone, N., Kutoh, E., and Yanagita, Y. (1989) Cyto
cytochrome chain with a membrabe embedded histidine
chrome c 551 from the thermophilic bacterium PS3 grown
kinase, Genes Dev., 27, 887 899.
under air limited conditions, Biochim. Biophys. Acta, 977,
89.
Zhou, X., Zhang, N., Xia, L., Li, Q., Shao, J., Shen, Q.,
329 334.
and Zhang, R. (2018) ResDE two component regulatory
107. Hoch, J. A. (1991) Genetic analysis in Bacillus subtilis,
system mediates oxygen limitaton induced biofilm forma
Methods Enzymol., 204, 305 320.
tion by Bacillus amyloliquefaciens SQR9, App. Environ.
108. Henning, W., Vo, L., Albanese, J., and Hill, B. C. (1995)
Microbiol., 84, e02744 02717.
High yield purification of cytochrome aa3 and cytochrome
90.
Azarkina, N., and Konstantinov, A. A. (2002) Stimulation
caa3 oxidases from Bacillus subtilis plasma membranes,
of menaquinone dependent electron transfer in the respi
Biochem. J., 309, 279 283.
БИОХИМИЯ том 86 вып. 1 2021
МОЛЕКУЛЯРНАЯ БИОЛОГИЯ ЦИТОХРОМОВ Bacillus subtilis НА 2020 ГОД
29
MOLECULAR BIOLOGY OF Bacillus subtilis CYTOCHROMES anno 2020
Review
L. Hederstedt
The Microbiology Group, Department of Biology, Lund University,
22362 Lund, Sweden; E mail: Lars.Hederstedt@biol.lu.se
Bacillus subtilis serves as a model Gram positive bacterium and an experimental system for research on respiratory
enzymes. This review presents the heme proteins currently known for the well characterized laboratory strain B. sub
tilis 168. It focuses on advances in research made during the last three decades concerning the function and compo
sition of the cytochrome bc complex, terminal oxidases, and succinate:menaquinone oxidoreductase. The aerobic res
piratory system of strain 168 seems representative for the species B. subtilis, as determined by the cytochrome com
position of the undomesticated strain B. subtilis NCIB 3610 and a set of constructed cytochrome deficient mutants of
this strain. Unexplained and unsettled aspects of the molecular biology of respiratory cytochromes in B. subtilis are
highlighted in the review.
Keywords: respiratory chain, Gram positive bacteria, oxygen reductases, succinate dehydrogenase, NCIB 3610,
cytochromes, Bacillus
БИОХИМИЯ том 86 вып. 1 2021