БИОХИМИЯ, 2021, том 86, вып. 1, с. 30 - 42
УДК 577.151.63
ТЕРМИНАЛЬНАЯ ОКСИДАЗА ЦИТОХРОМ bd ЗАЩИЩАЕТ
БАКТЕРИИ ОТ ТОКСИЧЕСКОГО ВОЗДЕЙСТВИЯ СЕРОВОДОРОДА
Обзор
© 2021
В.Б. Борисов1*, Е. Форте2
1 НИИ физико химической биологии им. А.Н. Белозерского, Московский государственный университет
имени М.В. Ломоносова, 119991 Москва, Россия; электронная почта: bor@belozersky.msu.ru
2 Римский университет Ла Сапиенца, Отдел биохимических наук, I 00185 Рим, Италия
Поступила в редакцию 15.09.2020
После доработки 15.09.2020
Принята к публикации 26.10.2020
Сероводород (H2S) называют третьим (после окиси азота и окиси углерода) «газотрансмиттером» или эндо
генной газообразной сигнальной молекулой. Эта молекула играет важную роль в организмах различных
таксономических групп - от бактерий до животных и людей. В клетках млекопитающих H2S в наномоляр
ных концентрациях обладает цитопротекторным действием, однако в более высоких концентрациях он ци
тотоксичен. Первичной мишенью действия H2S являются митохондрии. В субмикромолярных концентра
циях H2S ингибирует митохондриальную гем медную цитохром с оксидазу, тем самым блокируя аэробное
дыхание и окислительное фосфорилирование, что приводит к гибели клеток. Поскольку концентрация H2S
в кишечнике чрезвычайно высока, возникает вопрос: как населяющие его бактерии могут поддерживать
функционирование своих кислород зависимых дыхательных цепей переноса электронов в таких условиях?
В обзоре дается ответ на этот вопрос: в свете недавно полученных экспериментальных данных рассматри
вается ключевая роль неканонических терминальных оксидаз типа bd в поддержании аэробного дыхания и
роста энтеробактерии Escherichia coli, входящей в состав кишечной микробиоты, в присутствии H2S в ток
сичных концентрациях.
КЛЮЧЕВЫЕ СЛОВА: дыхательная цепь, терминальная оксидаза, гем медная оксидаза, цитохром bd, гем.
DOI: 10.31857/S0320972521010036
СЕРОВОДОРОД:
фидом (HS-) и сульфидом (S2-), в соответствии с
СВОЙСТВА, ОБРАЗОВАНИЕ
уравнением, приведенным на рис. 1. Используя
И ФИЗИОЛОГИЧЕСКОЕ ЗНАЧЕНИЕ
значение pKa1 при 25 °C, которое в эксперимен
тальных статьях варьируется в пределах
H2S - бесцветный, ядовитый, легковоспла
6,97-7,06 [3], можно рассчитать, что при физио
меняющийся и едкий газ, пахнущий тухлыми
логическом pH 7,4 69-73% общего пула сульфи
яйцами. Он способен свободно диффундиро
дов в растворе существует как HS-, а 27-31%
вать через мембраны [1]. Вслед за окисью азота
присутствует в форме H2S. Большая величина
(NO) и окисью углерода (CO), H2S считается
pKa2 (12,2-19) предполагает, что количество S2- в
третьим «газотрансмиттером» или эндогенной
растворе пренебрежимо мало. В литературе
газообразной сигнальной молекулой [2]. Это со
«H2S» часто используется для обозначения об
единение играет важную роль в организмах раз
щего пула сульфидов (H2S + HS- + S2-), если не
личных таксономических групп - от бактерий
указано иное.
до растений, животных и людей. Будучи слабой
В клетках млекопитающих эндогенная гене
кислотой, H2S в водном растворе находится в
рация H2S происходит как неферментативны
равновесии со своими анионами - гидросуль
ми, так и ферментативными путями. Нефермен
тативно H2S образуется в реакциях тиолов или
производных тиолов с другими соединениями,
Принятые сокращения: DTT-дитиотреитол; 3 MST-
3 меркаптопируват серотрансфераза; CBS - цистатио
например при гидролизе неорганических суль
нин β синтаза; CSE - цистатионин γ лиаза; EhOASS - O
фидных солей либо восстановлении пищевых
ацетилсерин сульфгидрилаза из Entamoeba histolytica;
OAS - O ацетил L серин; OASS - O ацетилсерин сульф
неорганических полисульфидов глутатионом
гидрилаза; Q1 - 2,3 диметокси 5 метил 6 (3 метил 2 бу
[4, 5]. Интересно, что образование H2S из цисте
тенил) 1,4 бензохинон.
ина, предпочтительного для неферментативно
* Адресат для корреспонденции.
го пути субстрата, катализируется пиридоксаль
30
ЦИТОХРОМ bd И СЕРОВОДОРОД
31
ной модификации остатков цистеина белка с
образованием персульфидов белка [9]. Первич
ной мишенью передачи сигналов посредством
H2S являются митохондрии. В клетках млекопи
тающих H2S проявляет двухфазный, зависимый
от концентрации способ действия. При низких
концентрациях H2S обладает цитопротектор
ным действием, тогда как при более высоких
концентрациях он цитотоксичен. В митохонд
Рис. 1. Диссоциация H2S в водном растворе. Значения pKa
взяты из обзора Li и Lancaster [3]. (С цветными варианта
риях H2S в наномолярных концентрациях
ми рис. 1-7 можно ознакомиться в электронной версии
действует как цитопротектор: он поддерживает
энергетический метаболизм, являясь субстра
том для дыхательной цепи, предотвращает
апоптоз, увеличивает митохондриальный биоге
фосфатом и свободным или связанным с гемом
нез [4]. В более высоких концентрациях H2S по
железом [6]. Ферментативная генерация H2S у
давляет дыхательную цепь за счет прямого свя
млекопитающих в основном обеспечивается
зывания с цитохром с оксидазой и ее ингибиро
цистатионин β синтазой (CBS), цистатионин
вания [10]. Это приводит к диссипации транс
γ лиазой (CSE) и 3 меркаптопируват серотранс
мембранного потенциала митохондрий, инги
феразой (3 MST) [4, 5, 7]. CBS и CSE являются
бированию аэробного синтеза АТФ и усилению
важными ферментами в пути транссульфура
производства активных форм кислорода [11].
ции, и оба используют пиридоксальфосфат в ка
В токсичных концентрациях H2S также вызыва
честве кофактора. Каноническая реакция β за
ет апоптоз клеток через канонический путь кас
мещения, катализируемая CBS, представляет
пазного каскада [4].
собой конденсацию гомоцистеина и серина с
В растительных клетках эндогенно генери
образованием цистатионина и воды. Однако в
руемый H2S ослабляет окислительное повреж
присутствии цистеина CBS может катализиро
дение клеток, вызванное стрессовыми фактора
вать конденсацию гомоцистеина и цистеина с
ми (тяжелыми металлами, экстремальными
образованием цистатионина и H2S. CSE обычно
температурами, засухой, засолением почв) за
катализирует превращение цистатионина в цис
счет активации антиоксидантных систем. Кро
теин и α кетобутират. Вдобавок этот фермент
ме того, H2S способствует регуляции созревания
способен генерировать H2S посредством реак
плодов, прорастания семян, движения устьиц и
ции α , β элиминирования с цистеином либо
других физиологических функций [12].
реакции γ замещения между двумя молекулами
Бактерии обладают ортологами ферментов
гомоцистеина. 3 MST образует H2S из 3 мер
млекопитающих CBS, CSE и 3 MST для продук
каптопирувата во взаимодействии с цистеина
ции H2S. Кроме того, сульфатредуцирующие
минотрансферазой или оксидазой D аминокис
бактерии (SRB) образуют H2S, задействуя путь
лот. Последние два фермента синтезируют 3
так называемого диссимиляционного восста
меркаптопируват с использованием цистеина в
новления сульфата. В этом метаболическом пу
качестве субстрата [7, 8]. CBS обнаруживает вы
ти анаэробного дыхания сульфат используется
сокий уровень экспрессии в астроцитах голов
как конечный акцептор электронов с образова
ного мозга, репродуктивных органах, поджелу
нием H2S в качестве основного конечного про
дочной железе. CSE в основном присутствует в
дукта [13]. У бактерий физиологические функ
печени, гладких мышцах, макрофагах, нейронах
ции H2S еще предстоит установить. Тем не менее
и почках. 3 MST преимущественно экспресси
сообщалось, что по крайней мере у Escherichia
руется в кишечнике, почках, клетках сердечной
coli, Pseudomonas aeruginosa, Staphylococcus aureus
мышцы, печени и нейронах [4].
и Bacillus anthracis обладание способностью ге
H2S вовлечен в регуляцию ряда физиологи
нерировать H2S повышает устойчивость к анти
ческих процессов в нервной, сердечно сосудис
биотикам за счет смягчения окислительного
той, желудочно кишечной и дыхательной сис
стресса, вызванного антибиотиками [14]. Эти
темах. H2S передает сигналы тремя различными
данные свидетельствуют о том, что цитопротек
механизмами. Во первых, он действует как ан
торное действие H2S является универсальным
тиоксидант, утилизируя активные формы кис
защитным механизмом для всех форм жизни -
лорода и азота. Во вторых, это соединение свя
от бактерий до людей [15].
зывается с гемами и/или восстанавливает их. В
В большинстве тканей млекопитающих ста
третьих, H2S участвует в персульфидировании
ционарные внутриклеточные концентрации
(S сульфгидратации), то есть посттрансляцион
H2S находятся в низком наномолярном диапа
БИОХИМИЯ том 86 вып. 1 2021
32
БОРИСОВ, ФОРТЕ
зоне. Например, концентрация H2S, измерен
микробы, живущие в обогащенной H2S среде,
ная в тканях печени и мозга мышей, оказалась
например в кишечном тракте млекопитающих,
равна ~15 нМ [16]. Уровень H2S в желудочно
обладают терминальной оксидазой, нечувстви
кишечном тракте намного выше, чем в любом
тельной к ингибированию этим соединением
другом отделе тела млекопитающего. Кишечник
даже при токсичных микромолярных концент
млекопитающих заселяется бактериями на са
рациях. Эта гипотеза была проверена на
мых ранних этапах жизни. В толстой кишке
E. coli [25]. E. coli - важный член кишечного
«среднестатистического» мужчины весом 70 кг
микробиома человека и других теплокровных
содержится 3,8 × 1013 бактерий [17]. Они пред
животных. Толстая кишка человека обычно со
ставлены 2172 различными видами 12 различных
держит несколько штаммов E. coli в любой мо
типов [18]. В отличие от других отделов тела, в
мент времени [26]. E. coli имеет разветвленную
кишечнике H2S продуцируется не только CBS,
аэробную дыхательную цепь, которая состоит из
CSE и 3 MST хозяина, но и в метаболизме ами
двух разных NADH:хинон оксидоредуктаз
нокислот резидентной микробиоты кишечника,
(NDH I и NDH II) и трех терминальных хи
а также путем диссимиляционного восстановле
нол:O2 оксидоредуктаз (цитохромов bd I, bd II и
ния сульфатов SRB [13]. Поэтому неудивитель
bo3) [27-32] (рис. 2).
но, что уровень H2S в кишечнике чрезвычайно
высок. Например, у взрослых мышей средние
концентрации H2S составляют 1, 0,2 и 0,4 мМ в
ОБЩАЯ ХАРАКТЕРИСТИКА
слепой кишке, проксимальном и дистальном
ЦИТОХРОМА bo3
отделах толстой кишки соответственно [19].
В кале человека эти значения находятся в диапа
Цитохром bo3 принадлежит к семейству А су
зоне 0,3-3,4 мМ [20]. Сообщалось, что концент
персемейства гем медных терминальных окси
рация свободного газа H2S в просвете кишечни
даз [33-35] и катализирует следующую реак
ка у крыс и людей составляет 40-60 мкМ
цию:
[21-23].
Хорошо известно, что H2S в субмикромоляр
2QH2 + 8H+in + O2 → 2Q + 2H2O + 8H+out,
ных концентрациях подавляет каталитическую
активность цитохром с оксидазы, блокируя та
где QH2 и Q представляют собой полностью вос
ким образом аэробное дыхание [24]. Но тогда
становленную и полностью окисленную формы
неясно, как бактерии, обитающие в кишечнике
убихинона 8 соответственно [28].
людей и животных, могут поддерживать функ
Для того, чтобы восстановить одну молекулу
ционирование аэробной дыхательной цепи в ус
O2 до двух молекул H2O, необходимы четыре
ловиях очень высокого содержания H2S. Недав
электрона и четыре протона. Четыре электрона
но Forte et al. [25] выдвинули гипотезу о том, что
извлекаются при окислении двух QH2 до двух Q.
Окисление двух QH2 сопровождается выделени
ем четырех H+ в периплазму (рис. 3). Четыре
протона (так называемые «химические» прото
ны) забираются из цитоплазмы. Эта окисли
тельно восстановительная реакция также со
пряжена с перемещением еще четырех протонов
(так называемых «перекачиваемых» протонов)
из цитоплазмы в периплазму поперек цитоплаз
матической мембраны - процесс, называемый
«перекачкой» протонов. Для переноса всех про
тонов, взятых из цитоплазмы, оксидаза bo3 ис
пользует два входных протонных канала, D и K
(рис. 3). Предполагается, что в бактериальных
гем медных оксидазах семейства A D канал ис
пользуется для транспортировки всех «перека
Рис. 2. Схема аэробной дыхательной цепи Escherichia coli.
чиваемых» протонов и части «химических» про
Две NADH:хинон оксидоредуктазы (NDH I и NDH II)
переносят электроны от NADH на убихинон 8 (Q). Затем
тонов, тогда как K канал служит для переноса
три терминальные хинол:O2
оксидоредуктазы (цитохромы
остальных «химических» протонов [36]. Таким
) переносят электроны от восстановленно
bd I, bd II и bo3
образом, в течение одного каталитического цик
го убихинона 8 (убихинола 8) на молекулярный кислород
ла фермента восемь протонов (8H+
) захватыва
) с образованием воды. Для простоты сукцинат:хинон
in
(O2
оксидоредуктаза и другие субстрат специфичные дегидро
ются из цитоплазмы и восемь протонов (8H+out)
геназы на рисунке не показаны
высвобождаются в периплазму. В результате пе
БИОХИМИЯ том 86 вып. 1 2021
ЦИТОХРОМ bd И СЕРОВОДОРОД
33
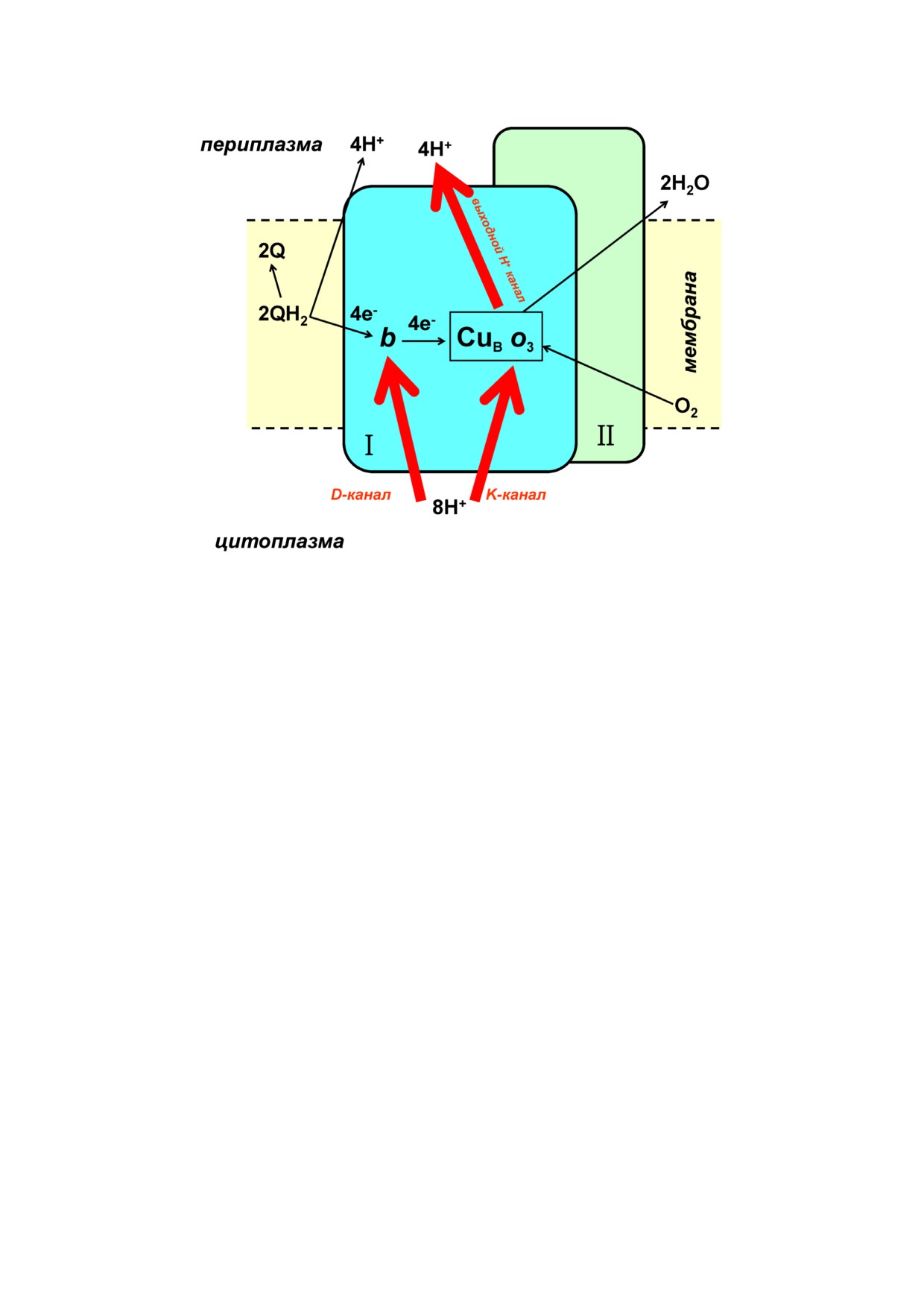
Рис. 3. Схематическое изображение структуры цитохрома bo3 Escherichia coli. Показаны две основные субъединицы - I и
II. Субъединица I содержит сайт связывания убихинола, в котором убихинол 8 (QH2) окисляется до убихинона 8 (Q),
гем b и биядерный активный сайт, состоящий из гема o3 и иона меди (CuB), в котором O2 восстанавливается четырьмя
электронами до 2H2O. Кроме того, показаны два входных протонных канала - D канал и K канал, а также предполагае
мый выходной протонный канал
реноса зарядов поперек мембраны E. coli цито
> 0,3 мМ [41]) по сравнению с цитохромом bd I
хром bo3 генерирует протон движущую силу.
(KD = 0,28 мкМ [42]).
Получена трехмерная структура bo3 оксида
зы E. coli с разрешением 3,5 Å [37]. Фермент
состоит из четырех различных субъединиц:
ОБЩАЯ ХАРАКТЕРИСТИКА ЦИТОХРОМА bd
I-IV. Субъединицы I, II и III являются гомоло
гами соответствующих субъединиц как митохон
Цитохромы bd I и bd II E. coli являются чле
дриальных, так и бактериальных цитохром с
нами подсемейства L семейства терминальных
оксидаз aa3 типа [38]. Субъединица I несет на
оксидаз bd типа [32, 43]. Ферменты катализиру
себе все редокс активные металлосодержащие
ют следующую реакцию [44-48]:
кофакторы: низкоспиновый гем b и биядерный
активный центр, состоящий из близко распо
2QH2 + 4H+in + O2 → 2Q + 2H2O + 4H+out,
ложенного высокоспинового гема o3 и иона ме
ди, называемого CuB (рис. 3). Долгое время
где QH2 и Q представляют собой соответственно
считалось, что цитохром bo3 содержит два сайта
полностью восстановленную и полностью окис
связывания убихинола. Однако недавно было
ленную формы хинона (убихинона 8 либо мена
установлено, что эта оксидаза имеет только
хинона 8).
один сайт связывания убихинола [39]. Электро
Цитохромы bd не содержат иона меди и не
ны, извлеченные из убихинола 8, переносятся
обнаруживают гомологии аминокислотных пос
на гем b, а затем в биядерный сайт (рис. 3). В
ледовательностей с цитохромом bo3 или любыми
биядерном сайте O2 связывается с гемом o3 и
другими гем медными оксидазами
[34,
35,
восстанавливается четырьмя электронами до
49-53]. Оксидазы bd создают протон движущую
2H2O.
силу путем трансмембранного разделения заря
Оксидаза bo3 экспрессируется в E. coli, когда
дов [54, 55]. Однако, в отличие от гем медных ок
клетки растут при высокой аэрации [40]. Ци
сидаз, которые являются истинными протонны
тохром bo3 имеет низкое сродство к O2 (KD >
ми насосами [36, 56], цитохромы bd не способны
3 БИОХИМИЯ том 86 вып. 1 2021
34
БОРИСОВ, ФОРТЕ
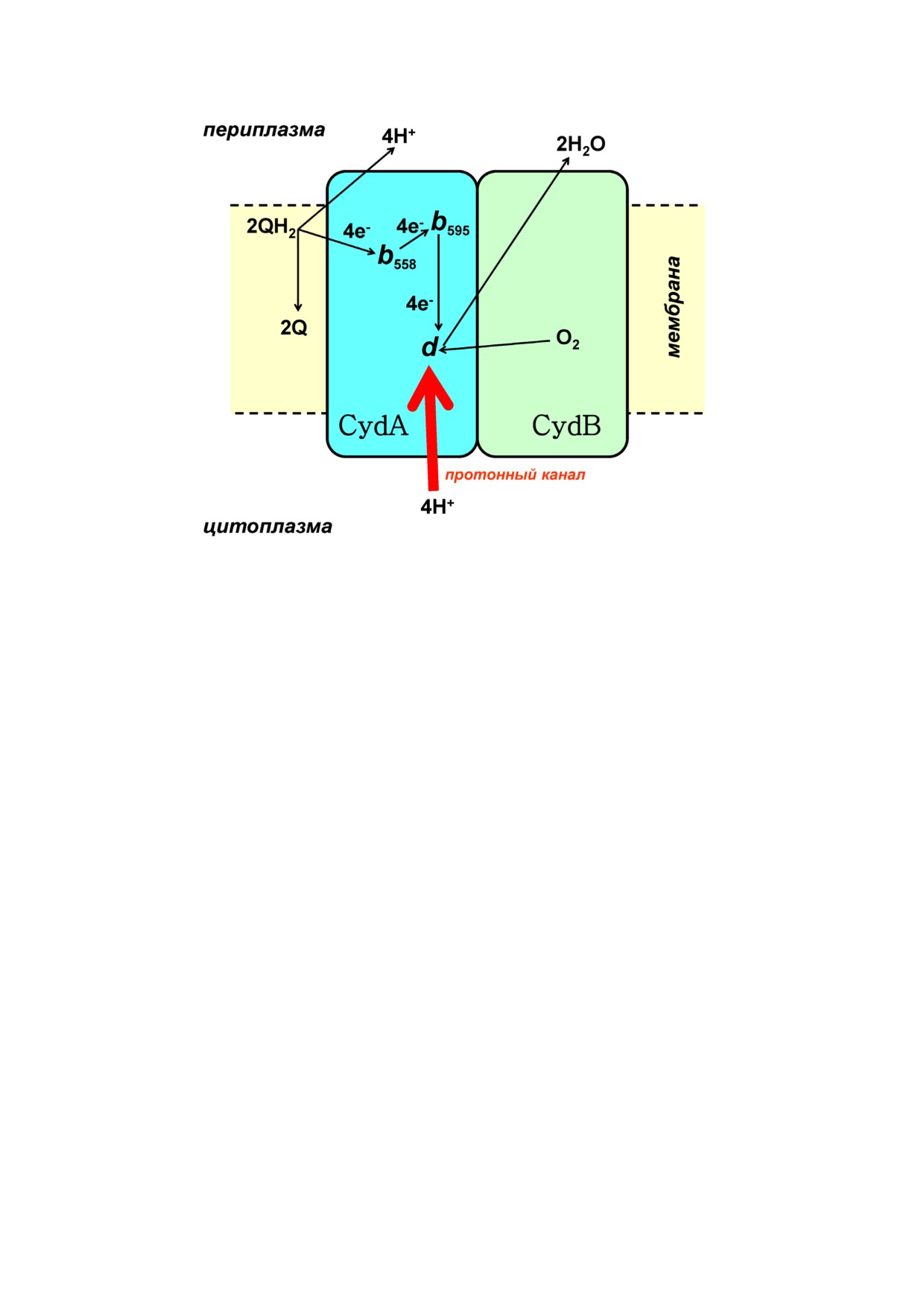
Рис. 4. Схематическое изображение структуры цитохрома bd I Escherichia coli. Показаны две основные субъединицы -
CydA и CydB. Субъединица CydA несет на себе сайт связывания хинола, в котором QH2 (убихинол 8 или менахинол 8)
окисляется до Q (убихинона 8 или менахинона 8), гем b558, гем b595 и гем d. Последний является сайтом, в котором O2 вос
станавливается четырьмя электронами до 2H2O. Также показан один входной протонный канал
перекачивать протоны [57-59]. По этой причине
действуют как функциональный двухгемовый
отношение H+/e- (количество протонов, достав
активный центр [71-84].
ленных на периплазматическую сторону мемб
В дополнение к запасанию свободной энер
раны на один электрон) равно 1 как для цитохро
гии, высвобождаемой в экзергонической ре
ма bd I [54, 60], так и для цитохрома bd II [60],
докс реакции восстановления O2, цитохром bd
тогда как в случае цитохрома bo3 оно равно 2 [54].
I играет важную физиологическую роль [85-88].
Получена трехмерная структура цитохрома
В частности, было показано, что оксидаза bd I
bd I E. coli с разрешением 2,7 [61] и 3,3 Å [62]. Из
участвует в защите E. coli от перекиси водорода
структуры видно, что оксидаза bd I состоит из
[89-94], пероксинитрита [86, 95] и NO [96-100].
четырех субъединиц: двух больших - CydA и
Однако ни одна из двух bd оксидаз E. coli, по
CydB, и двух малых - CydX и CydH. Наличие
видимому, не защищает бактерию от CO [101].
субъединиц CydA и CydB в ферменте известно
Цитохром bd I экспрессируется в E. coli в ус
давно [63, 64]. Субъединица CydX была обнару
ловиях дефицита кислорода [40, 102]. Переход
жена совсем недавно [65-70]. О существовании
клеток E. coli в стационарную фазу роста, рост
субъединицы CydH (также называемой CydY) в
бактерий в анаэробных условиях и фосфатное
цитохроме bd I стало известно только из трех
голодание приводят к индукции цитохрома bd
мерной структуры [61, 62]. Субъединица CydA
II [103, 104]. Вследствие высокого сродства к O2
содержит сайт окисления хинола и все три ре
[42, 105] bd фермент образует стабильный окси
докс активных металлосодержащих кофактора:
комплекс, в котором O2 связан с восстановлен
низкоспиновый гем b558, высокоспиновый
ным гемом d [106-109].
гем b595 и высокоспиновый гем d (рис. 4). Элект
роны, высвобождаемые при окислении хинола,
переносятся на гем b558, а затем на гем b595 и
ВЛИЯНИЕ H2S НА ПОТРЕБЛЕНИЕ O2
гем d. Последний связывает O2 и восстанавлива
ТЕРМИНАЛЬНЫМИ ОКСИДАЗАМИ E. coli.
ет его четырьмя электронами до 2H2O (рис. 4).
Многочисленные экспериментальные исследо
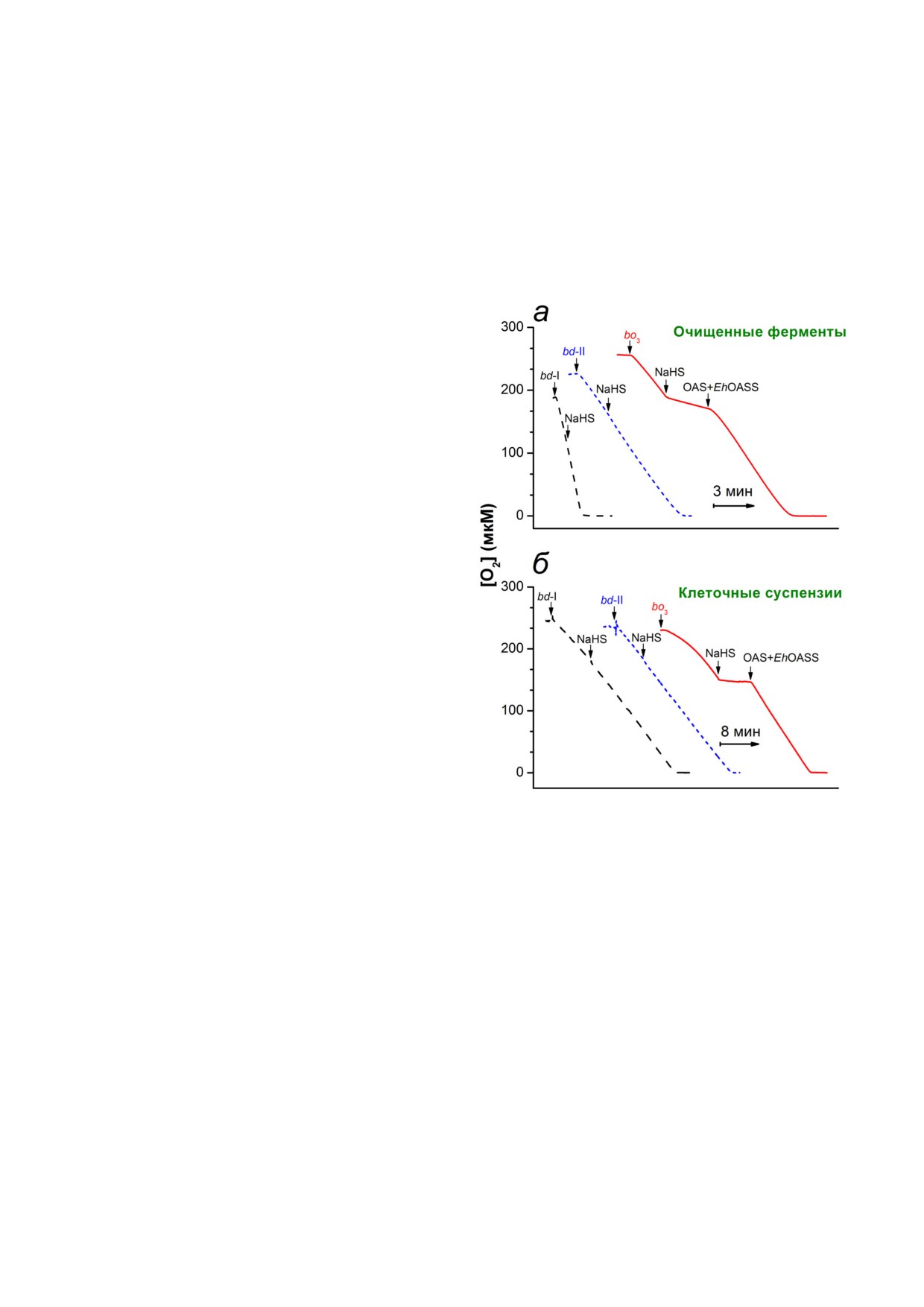
Forte et al. [25] исследовали влияние H2S на
вания указывают на то, что гем b595 и гем d
скорость потребления O2 изолированными очи
БИОХИМИЯ том 86 вып. 1 2021
ЦИТОХРОМ bd И СЕРОВОДОРОД
35
щенными цитохромами bd I, bd II и bo3 с по
(рис. 5, б). Подобно тому, что наблюдали в слу
мощью метода респирометрии с высоким разре
чае изолированной оксидазы bo3, добавление
шением. O2 редуктазная активность этих дыха
EhOASS и OAS приводило к быстрому и полно
тельных терминальных оксидаз поддерживалась
му возобновлению потребления O2 клетками
добавленными в избытке восстанавливающими
(рис. 5, б). Никакого ингибирования потребле
агентами: 2,3 диметокси 5 метил 6 (3 метил
ния O2 не обнаруживали, если 50 мкМ NaHS
2 бутенил) 1,4 бензохиноном (Q1) и дитиотреи
добавляли к мутантным клеткам, экспрессиру
толом (DTT). Как показано на рис. 5, а, добав
ющим в качестве единственной дыхательной
ление NaHS в концентрации ~7 мкМ к цитохро
му bo3 приводит к быстрому и эффективному
ингибированию активности фермента. Кажу
щаяся концентрация полумаксимального инги
бирования (IC50), измеренная при pH 7,4, соста
вила 1,1 мкМ NaHS [25]. Это значение согласу
ется с величиной кажущейся константы инги
бирования (Ki) для митохондриальной цитохром
с оксидазы - 0,2-0,45 мкМ H2S при pH 7,4 [10,
110-112]. Чтобы определить, является ли инги
бирование цитохрома bo3 обратимым либо необ
ратимым, после внесения NaHS был добавлен
расщепляющий H2S фермент O ацетилсерин
сульфгидрилаза (OASS) из Entamoeba histolytica
(EhOASS) вместе с O ацетил L серином (OAS).
Известно, что OASS катализирует реакцию β за
мещения, в которой β ацетокси группа OAS за
меняется на HS- с образованием L цистеина и
ацетата [113]. Как видно из рис. 5, а, добавление
EhOASS и OAS приводит к быстрому и полному
восстановлению O2 редуктазной активности
фермента bo3. Таким образом, было обнаружено,
что ингибирование изолированного очищенно
го цитохрома bo3 H2S полностью обратимо. На
против, в тех же экспериментальных условиях
было показано, что как цитохром bd I, так и ци
тохром bd II нечувствительны к присутствию
NaHS вплоть до ~60 мкМ этого соедине
ния (рис. 5, а).
Чтобы убедиться, что наблюдаемая разница
в чувствительности к H2S между ферментами
Рис. 5. Влияние H2S на потребление O2 терминальными
оксидазами Escherichia coli. а - Потребление O2 изолиро
bo3 и bd типов не является следствием солюби
ванными очищенными цитохромами bd I, bd II и bo3 в
лизации либо очистки цитохромов, было также
присутствии избытка восстановителей (10 мМ DTT и
изучено влияние H2S на потребление O2 сус
0,25 мМ Q1). Добавление 7,2 мкМ NaHS вызывает быстрое
пензиями клеток E. coli. В этом случае O2 ре
ингибирование активности цитохрома bo3. Дальнейшее до
дуктазная активность терминальных оксидаз
бавление расщепляющего H2S фермента O ацетилсерин
сульфгидрилазы из Entamoeba histolytica (EhOASS) вместе с
поддерживалась эндогенными субстратами, а
его субстратом O ацетил L серином (OAS) приводит к
не искусственной электрон донорной систе
быстрому и полному восстановлению O2 редуктазной ак
мой (DTT и Q1). Были протестированы три му
тивности цитохрома bo3. Добавление 58 мкМ NaHS, на
тантных штамма, каждый из которых имел
против, не ингибирует потребление O2 ни цитохромом bd I,
ни цитохромом bd II. б - Потребление O2 клеточными сус
только одну терминальную оксидазу: цитохром
пензиями мутантных штаммов, которые содержат цито
bd I, цитохром bd II или цитохром bo3. Данные,
хром bd I, цитохром bd II или цитохром bo3 в качестве
полученные на бактериальных клетках, оказа
единственной дыхательной терминальной оксидазы. По
лись очень похожими на результаты с изолиро
требление O2 клетками, полагающимися на bo3 как един
ванными очищенными ферментами [25]. По
ственную оксидазу, быстро ингибируется 50 мкМ NaHS.
Однако это ингибирование снимается сразу после добав
требление O2 мутантными клетками, содержа
ления EhOASS и OAS. Добавление 50 мкМ NaHS не влияет
щими цитохром bo3 в качестве единственной
на потребление O2 клетками, имеющими bd I или bd II в
терминальной оксидазы, быстро и полностью
качестве единственной оксидазы. Рисунок взят из работы
ингибировалось NaHS в концентрации 50 мкМ
Forte et al. [25] с изменениями
БИОХИМИЯ том 86 вып. 1 2021
3*
36
БОРИСОВ, ФОРТЕ
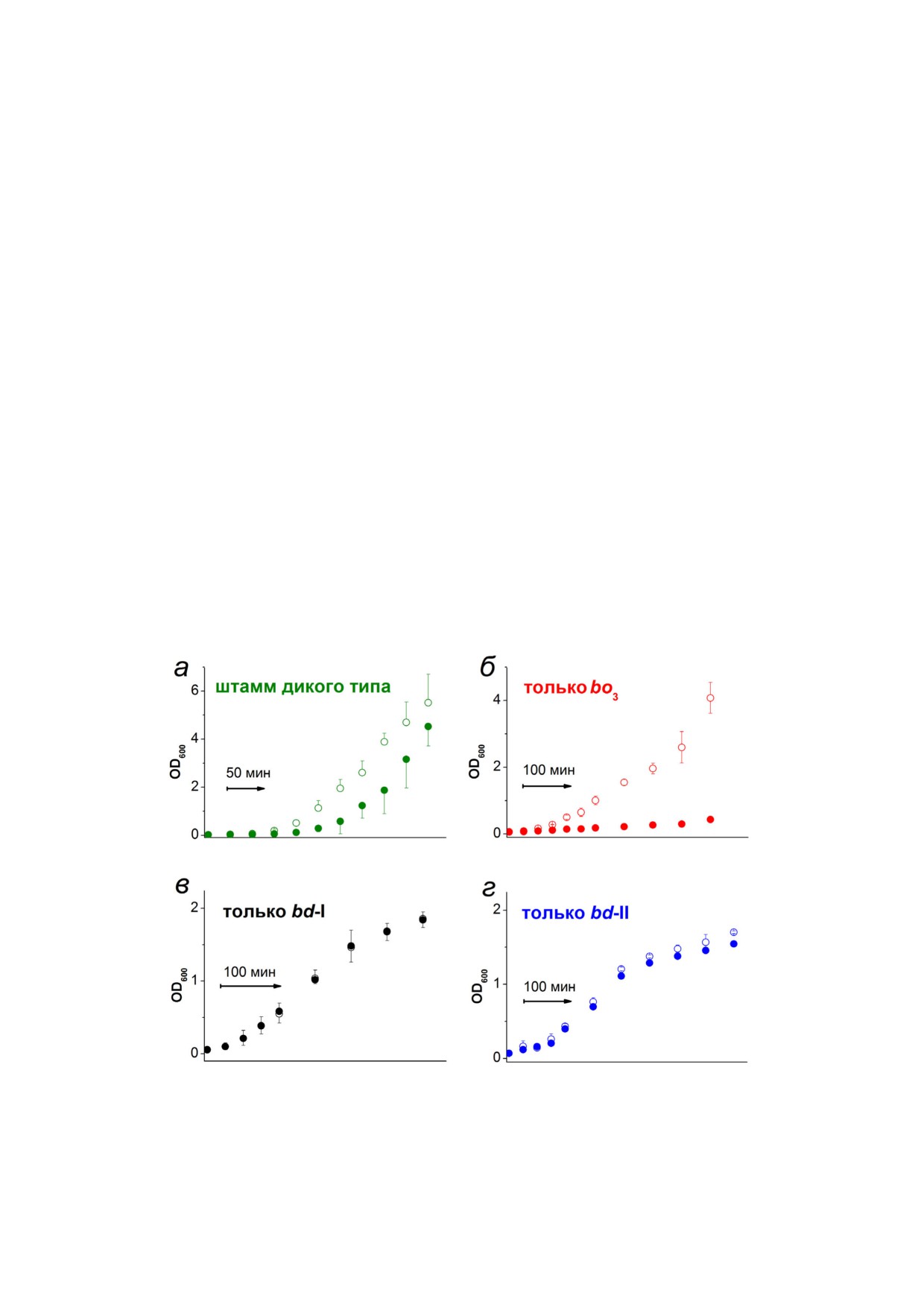
оксидазы либо цитохром bd I, либо цитохром
клеток дикого типа (рис. 6, а). 200 мкМ NaHS
bd II (рис. 5, б).
резко подавляет рост клеток мутантного штам
Похожие результаты были получены
ма, содержащего только цитохром bo3 (рис. 6, б).
Korshunov et al. [114], которые исследовали вли
Напротив, после добавления NaHS в той же
яние Na2S на активность трех цитохромов в
концентрации к клеткам мутантных штаммов,
мембранных везикулах E. coli. Совокупность по
имеющих в качестве единственной оксидазы
лученных данных позволяет сделать вывод о
либо bd I, либо bd II, кривая роста бактерий
том, что ферменты bd типа делают возможным
вовсе не изменяется (рис. 6, в) или изменяется
функционирование аэробной дыхательной цепи
очень мало (рис. 6, г).
E. coli в присутствии H2S.
Таким образом, можно сделать вывод о том,
что, в отличие от цитохрома bo3 E. coli, как ци
тохром bd I, так и цитохром bd II этой бактерии
ВЛИЯНИЕ H2S НА РОСТ КЛЕТОК E. coli
способны поддерживать аэробное дыхание и
рост клеток в присутствии H2S. Это также может
Ввиду того, что активность оксидаз bd I и bd
относиться и к другим бактериям, которые со
II, в отличие от цитохрома bo3, оказалась нечув
держат терминальную оксидазу bd типа в своих
ствительной к H2S, Forte et al. [25] решили про
аэробных дыхательных цепях. Действительно,
верить, поддерживают ли один или оба цитохро
Saini et al. [115] недавно обнаружили, что H2S
ма bd E. coli также и рост бактерий в присутствии
стимулирует дыхание и рост Mycobacterium tuber
H2S в культуральной среде. Влияние H2S на рост
culosis, Mycobacterium bovis BCG и Mycobacterium
клеток было протестировано на четырех штам
smegmatis. Согласно их интерпретации получен
мах E. coli: штамме дикого типа, в котором при
ных результатов, индуцированное H2S ингиби
сутствуют все три терминальные оксидазы, и
рование суперкомплекса цитохрома bcc aa3
трех мутантных штаммах, каждый из которых
(служащего одной из двух терминальных окси
обладает только одной оксидазой - bd I, bd II
даз в дыхательной цепи микобактерий) приво
или bo3 [25]. Было обнаружено, что добавление
дит к перенаправлению электронов от менахи
NaHS в концентрации 200 мкМ замедляет рост
нола на цитохром bd, тем самым стимулируя ды
Рис. 6. Влияние H2S на рост клеток Escherichia coli. Показаны кривые роста штамма дикого типа (а) и мутантных штам
мов, обладающих цитохромом bo3 (б), цитохромом bd I (в) или цитохромом bd II (г) в качестве единственной дыхатель
ной терминальной оксидазы. Закрашенные и открытые круглые символы указывают на присутствие или отсутствие
200 мкМ NaHS в среде роста соответственно. Рисунок взят из работы Forte et al. [25] с изменениями
БИОХИМИЯ том 86 вып. 1 2021
ЦИТОХРОМ bd И СЕРОВОДОРОД
37
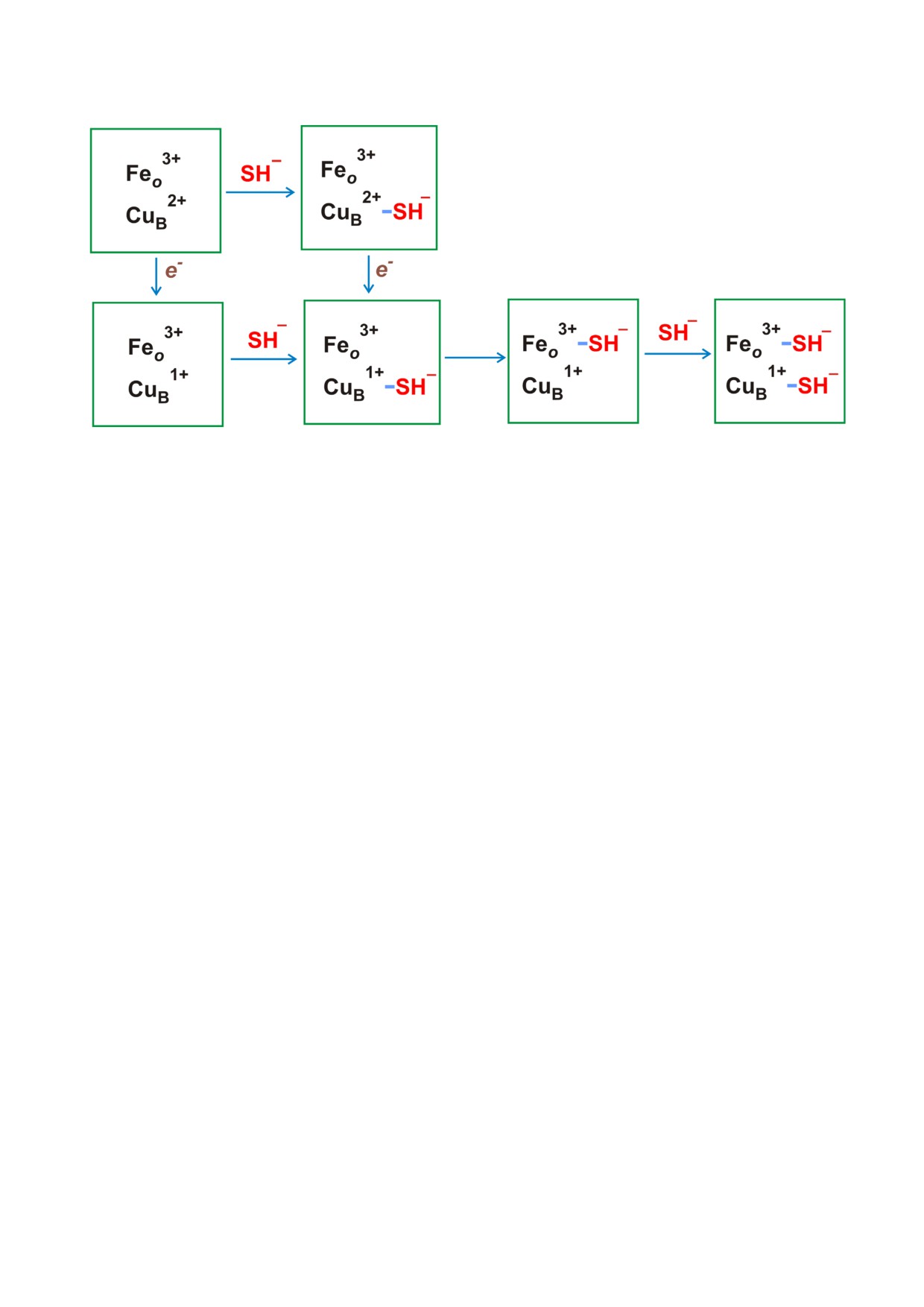
Рис. 7. Возможный механизм ингибирования гем медной оксидазы цитохрома bo3 Escherichia coli H2S. Различные состо
яния каталитического биядерного сайта, состоящего из гема o3 (показано железо гема o3 - Feo) и меди CuB. Третий ре
докс активный металлосодержащий кофактор - гем b, который не является частью биядерного сайта, на рисунке не по
казан
хание микобактерий [115]. Это согласуется с об
По аналогии с моделью ингибирования ми
суждаемыми выше данными о нечувствитель
тохондриальной цитохром с оксидазы H2S [10],
ности оксидаз bd типа E. coli к H2S [25, 114].
можно предложить следующую модель H2S
опосредованного ингибирования цитохрома bo3
E. coli (рис. 7). В ходе оборотов bo3 оксидазы в
ВОЗМОЖНЫЙ МЕХАНИЗМ
стационарном состоянии молекула H2S (HS-)
ИНГИБИРОВАНИЯ
промежуточно связывается с окисленной или
ЦИТОХРОМА bo3 E. coli H2S
восстановленной CuB, а затем переносится на
окисленный гем o3, тем самым блокируя реак
Ранее было показано, что H2S обратимо ин
цию этого высокоспинового гема с молекуляр
гибирует поглощение кислорода цитохром с
ным кислородом. В конечном состоянии фер
оксидазой из сердца быка [110, 111]. Ингибиро
мента bo3, заингибированного H2S, CuB восста
вание этого митохондриального гем медного
новлен и, возможно, связан со второй молеку
фермента с помощью H2S является неконкуре
лой H2S (HS-) (рис. 7), а низкоспиновый гем b,
нтным по отношению к цитохрому с и O2 [110]
вероятно, находится в восстановленной форме.
и зависит от pH [116]. Начальная скорость
инактивации изолированной цитохром с окси
дазы пропорциональна концентрации H2S, при
Финансирование. Работа выполнена при фи
этом начальная константа скорости (kon) при
нансовой поддержке Российского научного
pH 7,4 равна 2,2 × 104 M-1 · с-1 [10]. Значения Ki,
фонда (проект № 19 14 00063).
измеренные при pH 7,4, оказались в интервале
Благодарности. В.Б. Борисов благодарит
0,2-0,45 мкМ [10, 110-112]. H2S (вероятно, в
В.П. Скулачева и А.Д. Виноградова за интерес к
форме HS-) может связываться с CuB в любом
работе и полезное обсуждение. В.Б. Борисов
из ее редокс состояний (как с CuB1+, так и с
также выражает глубокую признательность
CuB2+), а с гемом a3 - только в его окисленной
А.А. Константинову (скончался 1 мая 2020 г.).
форме [10]. Предполагается, что конечный
А.А. Константинов в 1993 году предложил
комплекс фермент-ингибитор представляет
В.Б. Борисову начать изучение цитохрома bd,
собой форму «смешанной валентности», в ко
когда автор был аспирантом.
торой CuA и гем a восстановлены, тогда как
Конфликт интересов. Авторы заявляют, что у
гем a3 окислен и связан с H2S [111, 117]. CuB в
них нет конфликта интересов.
такой форме восстановлена и, возможно, также
Соблюдение этических норм. Настоящая
связана с H2S, на что указывают данные спект
статья не содержит каких либо исследований с
роскопии электронного парамагнитного резо
участием людей или использованием животных
нанса [24].
в качестве объектов.
БИОХИМИЯ том 86 вып. 1 2021
38
БОРИСОВ, ФОРТЕ
СПИСОК ЛИТЕРАТУРЫ
1.
Cuevasanta, E., Denicola, A., Alvarez, B., and Moller,
toire of prokaryotic species identified in human beings,
M. N. (2012) Solubility and permeation of hydrogen sul
Lancet Infect. Dis., 15, 1211 1219, doi: 10.1016/S1473
fide in lipid membranes, PLoS One,
7, e34562,
3099(15)00293 5.
doi: 10.1371/journal.pone.0034562.
19.
Deplancke, B., Finster, K., Graham, W. V., Collier, C. T.,
2.
Forte, E., and Giuffrè, A. (2016) How bacteria breathe in
Thurmond, J. E., and Gaskins, H. R. (2003) Gastro
hydrogen sulphide rich environments, Biochem. J., 38, 8
intestinal and microbial responses to sulfate supplemented
11, doi: 10.1042/BIO03805008.
drinking water in mice, Exp. Biol. Med. (Maywood), 228,
3.
Li, Q., and Lancaster, J. R., Jr. (2013) Chemical founda
424 433, doi: 10.1177/153537020322800413.
tions of hydrogen sulfide biology, Nitric Oxide, 35, 21 34,
20.
Attene Ramos, M. S., Wagner, E. D., Gaskins, H. R., and
doi: 10.1016/j.niox.2013.07.001.
Plewa, M. J. (2007) Hydrogen sulfide induces direct radi
4.
Murphy, B., Bhattacharya, R., and Mukherjee, P. (2019)
cal associated DNA damage, Mol. Cancer Res., 5, 455
Hydrogen sulfide signaling in mitochondria and disease,
459, doi: 10.1158/1541 7786.MCR 06 0439.
FASEB J., 33, 13098 13125, doi: 10.1096/fj.201901304R.
21.
Levitt, M. D., Springfield, J., Furne, J., Koenig, T., and
5.
Powell, C. R., Dillon, K. M., and Matson, J. B. (2018) A
Suarez, F. L. (2002) Physiology of sulfide in the rat colon:
review of hydrogen sulfide (H2S) donors: chemistry and
use of bismuth to assess colonic sulfide production, J. Appl.
potential therapeutic applications, Biochem. Pharmacol.,
Physiol.,
92,
16551660, doi:
10.1152/japplphysiol.
149, 110 123, doi: 10.1016/j.bcp.2017.11.014.
00907.2001.
6.
Yang, J., Minkler, P., Grove, D., Wang, R., Willard, B.,
22.
Suarez, F., Furne, J., Springfield, J., and Levitt, M. (1998)
Dweik, R., and Hine, C. (2019) Non enzymatic hydrogen
Production and elimination of sulfur containing gases in
sulfide production from cysteine in blood is catalyzed by
the rat colon, Am. J. Physiol.,
274, G727 G733,
iron and vitamin B6, Commun. Biol., 2, 194, doi: 10.1038/
doi: 10.1152/ajpgi.1998.274.4.G727.
s42003 019 0431 5.
23.
Jorgensen, J., and Mortensen, P. B. (2001) Hydrogen sul
7.
Kabil, O., and Banerjee, R. (2014) Enzymology of H2S
fide and colonic epithelial metabolism: implications for
biogenesis, decay and signaling, Antioxid. Redox Signal.,
ulcerative colitis, Dig. Dis. Sci.,
46,
17221732,
20, 770 782, doi: 10.1089/ars.2013.5339.
doi: 10.1023/A:1010661706385.
8.
Shibuya, N., Koike, S., Tanaka, M., Ishigami Yuasa, M.,
24.
Hill, B. C., Woon, T. C., Nicholls, P., Peterson, J.,
Kimura, Y., et al. (2013) A novel pathway for the produc
Greenwood, C., and Thomson, A. J. (1984) Interactions of
tion of hydrogen sulfide from D cysteine in mammalian
sulphide and other ligands with cytochrome c oxidase. An
cells, Nat. Commun., 4, 1366, doi: 10.1038/ncomms2371.
electron paramagnetic resonance study, Biochem. J., 224,
9.
Filipovic, M. R., Zivanovic, J., Alvarez, B., and Banerjee, R.
591 600, doi: 10.1042/bj2240591.
(2018) Chemical biology of H2S signaling through persulfi
25.
Forte, E., Borisov, V. B., Falabella, M., Colaco, H. G.,
dation, Chem. Rev., 118, 1253 1337, doi: 10.1021/acs.
Tinajero Trejo, M., Poole, R. K., et al. (2016) The termi
chemrev.7b00205.
nal oxidase cytochrome bd promotes sulfide resistant bac
10.
Nicholls, P., Marshall, D. C., Cooper, C. E., and Wilson,
terial respiration and growth, Sci. Rep.,
6,
23788,
M. T. (2013) Sulfide inhibition of and metabolism by
doi: 10.1038/srep23788.
cytochrome c oxidase, Biochem. Soc. Trans., 41, 1312
26.
Karami, N., Nowrouzian, F., Adlerberth, I., and Wold, A. E.
1316, doi: 10.1042/BST20130070.
(2006) Tetracycline resistance in Escherichia coli and per
11.
Szabo, C., Ransy, C., Modis, K., Andriamihaja, M.,
sistence in the infantile colonic microbiota, Antimicrob.
Murghes, B., et al. (2014) Regulation of mitochondrial
Agents Chemother., 50, 156 161, doi: 10.1128/AAC.50.1.
bioenergetic function by hydrogen sulfide. Part I.
156 161.2006.
Biochemical and physiological mechanisms, Br. J.
27.
Borisov, V. B., Siletsky, S. A., Paiardini, A., Hoogewijs, D.,
Pharmacol., 171, 2099 2122, doi: 10.1111/bph.12369.
Forte, E., et al. (2020) Bacterial oxidases of the cyto
12.
Corpas, F. J., and Palma, J. M. (2020) H2S signaling in
chrome bd family: redox enzymes of unique structure,
plants and applications in agriculture, J. Adv. Res., 24, 131
function and utility as drug targets, Antioxid. Redox Signal.,
137, doi: 10.1016/j.jare.2020.03.011.
doi: 10.1089/ars.2020.8039.
13.
Carbonero, F., Benefiel, A. C., Alizadeh Ghamsari, A. H.,
28.
Borisov, V. B., and Verkhovsky, M. I. (2015) Oxygen as
and Gaskins, H. R. (2012) Microbial pathways in colonic
Acceptor, EcoSal Plus, 6, doi: 10.1128/ecosalplus.ESP
sulfur metabolism and links with health and disease, Front.
0012 2015.
Physiol., 3, 448, doi: 10.3389/fphys.2012.00448.
29.
Jünemann, S. (1997) Cytochrome bd terminal oxidase,
14.
Shatalin, K., Shatalina, E., Mironov, A., and Nudler, E.
Biochim. Biophys. Acta, 1321, 107 127, doi: 10.1016/
(2011) H2S: a universal defense against antibiotics in bacte
S0005 2728(97)00046 7.
ria, Science, 334, 986 990, doi: 10.1126/science.1209855.
30.
Azarkina, N., Borisov, V., and Konstantinov, A. A. (1997)
15.
Kimura, H. (2014) Production and physiological effects of
Spontaneous spectral changes of the reduced
hydrogen sulfide, Antioxid. Redox Signal., 20, 783 793,
cytochrome bd, FEBS Lett., 416, 171 174, doi: 10.1016/
doi: 10.1089/ars.2013.5309.
S0014 5793(97)01196 4.
16.
Furne, J., Saeed, A., and Levitt, M. D. (2008) Whole tissue
31.
Gavrikova, E. V., Grivennikova, V. G., Borisov, V. B.,
hydrogen sulfide concentrations are orders of magnitude
Cecchini, G., and Vinogradov, A. D. (2009) Assembly of a
lower than presently accepted values, Am. J. Physiol. Regul.
chimeric respiratory chain from bovine heart submito
Integr. Comp. Physiol., 295, R1479 R1485, doi: 10.1152/
chondrial particles and cytochrome bd terminal oxidase of
ajpregu.90566.2008.
Escherichia coli, FEBS Lett., 583, 1287 1291, doi: 10.1016/
17.
Sender, R., Fuchs, S., and Milo, R. (2016) Revised estimates
j.febslet.2009.03.022.
for the number of human and bacteria cells in the body, PLoS
32.
Borisov, V. B., Gennis, R. B., Hemp, J., and Verkhovsky,
Biol., 14, e1002533, doi: 10.1371/journal.pbio.1002533.
M. I. (2011) The cytochrome bd respiratory oxygen reduc
18.
Hugon, P., Dufour, J. C., Colson, P., Fournier, P. E.,
tases, Biochim. Biophys. Acta,
1807,
13981413,
Sallah, K., and Raoult, D. (2015) A comprehensive reper
doi: 10.1016/j.bbabio.2011.06.016.
БИОХИМИЯ том 86 вып. 1 2021
ЦИТОХРОМ bd И СЕРОВОДОРОД
39
33.
Sousa, F. L., Alves, R. J., Ribeiro, M. A., Pereira Leal,
47.
Forte, E., Borisov, V. B., Vicente, J. B., and Giuffrè, A.
J. B., Teixeira, M., and Pereira, M. M. (2012) The super
(2017) Cytochrome bd and gaseous ligands in bacterial
family of heme copper oxygen reductases: types and evolu
physiology, Adv. Microb. Physiol.,
71,
171234,
tionary considerations, Biochim. Biophys. Acta, 1817, 629
doi: 10.1016/bs.ampbs.2017.05.002.
637, doi: 10.1016/j.bbabio.2011.09.020.
48.
Borisov, V. B. (2020) Effect of membrane environment on
34.
Siletsky, S. A., Borisov, V. B., and Mamedov, M. D. (2017)
ligand binding properties of the terminal oxidase cytochrome
Photosystem II and terminal respiratory oxidases: molecu
bd I from Escherichia coli, Biochemistry (Moscow), 85, 1603
lar machines operating in opposite directions, Front. Biosci.
1612, doi: 10.1134/S0006297920120123.
(Landmark Ed.), 22, 1379 1426, doi: 10.2741/4550.
49.
Pereira, M. M., Gomes, C. M., and Teixeira, M. (2002)
35.
Borisov, V. B., and Siletsky, S. A. (2019) Features of organi
Plasticity of proton pathways in haem copper oxygen
zation and mechanism of catalysis of two families of terminal
reductases, FEBS Lett., 522, 14 18, doi: 10.1016/S0014
oxidases: heme copper and bd type, Biochemistry (Moscow),
5793(02)02920 4.
84, 1390 1402, doi: 10.1134/S0006297919110130.
50.
Yoshikawa, S., and Shimada, A. (2015) Reaction mecha
36.
Konstantinov, A. A., Siletsky, S., Mitchell, D., Kaulen, A.,
nism of cytochrome c oxidase, Chem. Rev., 115, 1936
and Gennis, R. B. (1997) The roles of the two proton input
1989, doi: 10.1021/cr500266a.
channels in cytochrome c oxidase from Rhodobacter
51.
Papa, S., Capitanio, G., and Papa, F. (2018) The mecha
sphaeroides probed by the effects of site directed mutations
nism of coupling between oxido reduction and proton
on time resolved electrogenic intraprotein proton transfer,
translocation in respiratory chain enzymes, Biol. Rev.
Proc. Natl. Acad. Sci. USA, 94, 9085 9090, doi: 10.1073/
Camb. Philos. Soc., 93, 322 349, doi: 10.1111/brv.12347.
pnas.94.17.9085.
52.
Borisov, V. B. (2002) Defects in mitochondrial respiratory
37.
Abramson, J., Riistama, S., Larsson, G., Jasaitis, A.,
complexes III and IV, and human pathologies, Mol. Aspects
Svensson Ek, M., et al. (2000) The structure of the
Med., 23, 385 412, doi: 10.1016/s0098 2997(02)00013 4.
ubiquinol oxidase from Escherichia coli and its ubiquinone
53.
Borisov, V. B. (2004) Mutations in respiratory chain com
binding site., Nat. Struct. Biol., 7, 910 917, doi: 10.1038/
plexes and human diseases, Ital. J. Biochem., 53, 34 40.
82824.
54.
Puustinen, A., Finel, M., Haltia, T., Gennis, R. B., and
38.
Chepuri, V., Lemieux, L. J., Au, D. C. T., and Gennis,
Wikström, M. (1991) Properties of the two terminal oxi
R. B. (1990) The sequence of the cyo operon indicates sub
dases of Escherichia coli, Biochemistry, 30, 3936 3942,
stantial structural similarities between the cytochrome o
doi: 10.1021/bi00230a019.
ubiquinol oxidase of Escherichia coli and the aa3 type fam
55.
Jasaitis, A., Borisov, V. B., Belevich, N. P., Morgan, J. E.,
ily of the cytochrome c oxidases, J. Biol. Chem., 265,
Konstantinov, A. A., and Verkhovsky, M. I.
(2000)
11185 11192.
Electrogenic reactions of cytochrome bd, Biochemistry, 39,
39.
Choi, S. K., Schurig Briccio, L., Ding, Z., Hong, S., Sun, C.,
13800 13809, doi: 10.1021/bi001165n.
and Gennis, R. B. (2017) Location of the substrate binding
56.
Wikström, M., Morgan, J. E., and Verkhovsky, M. I. (1997)
site of the cytochrome bo3 ubiquinol oxidase from
Proton and electrical charge translocation by cytochrome
Escherichia coli, J. Am. Chem. Soc., 139, 8346 8354,
c oxidase, Biochim. Biophys. Acta,
1318,
299306,
doi: 10.1021/jacs.7b03883.
doi: 10.1016/S0005 2728(96)00152 1.
40.
Cotter, P. A., Chepuri, V., Gennis, R. B., and Gunsalus,
57.
Belevich, I., Borisov, V. B., Zhang, J., Yang, K.,
R. P. (1990) Cytochrome o (cyoABCDE) and d (cydAB) oxi
Konstantinov, A. A., et al. (2005) Time resolved electro
dase gene expression in Escherichia coli is regulated by oxy
metric and optical studies on cytochrome bd suggest a
gen, pH, and the fnr gene product, J. Bacteriol., 172, 6333
mechanism of electron proton coupling in the di heme
6338, doi: 10.1128/jb.172.11.6333 6338.1990.
active site, Proc. Natl. Acad. Sci. USA, 102, 3657 3662,
41.
Svensson, M., and Nilsson, T. (1993) Flow flash study of
doi: 10.1073/pnas.0405683102.
the reaction between cytochrome bo and oxygen,
58.
Belevich, I., Borisov, V. B., and Verkhovsky, M. I. (2007)
Biochemistry, 32, 5442 5447, doi: 10.1021/bi00071a021.
Discovery of the true peroxy intermediate in the catalytic
42.
Belevich, I., Borisov, V. B., Konstantinov, A. A., and
cycle of terminal oxidases by real time measurement, J. Biol.
Verkhovsky, M. I.
(2005) Oxygenated complex of
Chem., 282, 28514 28519, doi: 10.1074/jbc. M705562200.
cytochrome bd from Escherichia coli: stability and photola
59.
Borisov, V. B., Belevich, I., Bloch, D. A., Mogi, T., and
bility, FEBS Lett., 579, 4567 4570, doi: 10.1016/j.febslet.
Verkhovsky, M. I. (2008) Glutamate 107 in subunit I of
2005.07.011.
cytochrome bd from Escherichia coli is part of a transmem
43.
Arutyunyan, A. M., Sakamoto, J., Inadome, M.,
brane intraprotein pathway conducting protons from the
Kabashima, Y., and Borisov, V. B. (2012) Optical and mag
cytoplasm to the heme b595/heme d active site,
neto optical activity of cytochrome bd from Geobacillus
Biochemistry, 47, 7907-7914, doi: 10.1021/bi800435a.
thermodenitrificans, Biochim. Biophys. Acta, 1817, 2087
60.
Borisov, V. B., Murali, R., Verkhovskaya, M. L., Bloch, D. A.,
2094, doi: 10.1016/j.bbabio.2012.06.009.
Han, H., et al. (2011) Aerobic respiratory chain of
44.
Borisov, V. B. (1996) Cytochrome bd: structure and proper
Escherichia coli is not allowed to work in fully uncoupled
ties, Biochemistry (Moscow), 61, 565 574.
mode, Proc. Natl. Acad. Sci. USA, 108, 17320 17324,
45.
Azarkina, N., Siletsky, S., Borisov, V., von Wachenfeldt, C.,
doi: 10.1073/pnas.1108217108.
Hederstedt, L., and Konstantinov, A. A. (1999) A
61.
Safarian, S., Hahn, A., Mills, D. J., Radloff, M., Eisinger,
cytochrome bb’ type quinol oxidase in Bacillus subtilis
M. L., et al. (2019) Active site rearrangement and structur
strain 168, J. Biol. Chem., 274, 32810 32817, doi: 10.1074/
al divergence in prokaryotic respiratory oxidases, Science,
jbc.274.46.32810.
366, 100 104, doi: 10.1126/science.aay0967.
46.
Yang, K., Borisov, V. B., Konstantinov, A. A., and Gennis,
62.
Theßeling, A., Rasmussen, T., Burschel, S., Wohlwend, D.,
R. B. (2008) The fully oxidized form of the cytochrome bd
Kagi, J., et al. (2019) Homologous bd oxidases share the
quinol oxidase from E. coli does not participate in the cat
same architecture but differ in mechanism, Nat. Commun.,
alytic cycle: direct evidence from rapid kinetics studies,
10, 5138, doi: 10.1038/s41467 019 13122 4.
FEBS Lett.,
582,
37053709, doi:
10.1016/j.febslet.
63.
Miller, M. J., and Gennis, R. B. (1983) The purification
2008.09.038.
and characterization of the cytochrome d terminal oxidase
БИОХИМИЯ том 86 вып. 1 2021
40
БОРИСОВ, ФОРТЕ
complex of the Escherichia coli aerobic respiratory chain,
toselection study using femtosecond spectroscopy,
J. Biol. Chem., 258, 9159 9165.
Biochemistry, 41, 1654 1662, doi: 10.1021/bi0158019.
64.
Kita, K., Konishi, K., and Anraku, Y. (1984) Terminal oxi
77.
Arutyunyan, A. M., Borisov, V. B., Novoderezhkin, V. I.,
dases of Escherichia coli aerobic respiratory chain. II.
Ghaim, J., Zhang, J., et al. (2008) Strong excitonic inter
Purification and properties of cytochrome b558 d complex
actions in the oxygen reducing site of bd type oxidase: the
from cells grown with limited oxygen and evidence of
Fe to Fe distance between hemes d and b595 is 10 A,
branched electron carrying systems, J. Biol. Chem., 259,
Biochemistry, 47, 1752 1759, doi: 10.1021/bi701884g.
3375 3381.
78.
Borisov, V. B. (2008) Interaction of bd type quinol oxidase
65.
Sun, Y. H., de Jong, M. F., den Hartigh, A. B., Roux,
from Escherichia coli and carbon monoxide: heme d binds
C. M., Rolan, H. G., and Tsolis, R. M. (2012) The small
CO with high affinity, Biochemistry (Moscow), 73, 14 22,
protein CydX is required for function of cytochrome bd
doi: 10.1134/S0006297908010021.
oxidase in Brucella abortus, Front. Cell. Infect. Microbiol., 2,
79.
Bloch, D. A., Borisov, V. B., Mogi, T., and Verkhovsky, M. I.
47, doi: 10.3389/fcimb.2012.00047.
(2009) Heme/heme redox interaction and resolution of
66.
VanOrsdel, C. E., Bhatt, S., Allen, R. J., Brenner, E. P.,
individual optical absorption spectra of the hemes in
Hobson, J. J., et al. (2013) The Escherichia coli CydX pro
cytochrome bd from Escherichia coli, Biochim. Biophys.
tein is a member of the CydAB cytochrome bd oxidase
Acta, 1787, 1246 1253, doi: 10.1016/j.bbabio.2009.05.003.
complex and is required for cytochrome bd oxidase activi
80.
Rappaport, F., Zhang, J., Vos, M. H., Gennis, R. B., and
ty, J. Bacteriol., 195, 3640 3650, doi: 10.1128/JB.00324
Borisov, V. B. (2010) Heme heme and heme ligand inter
13.
actions in the di heme oxygen reducing site of cytochrome
67.
Hoeser, J., Hong, S., Gehmann, G., Gennis, R. B., and
bd from Escherichia coli revealed by nanosecond absorption
Friedrich, T. (2014) Subunit CydX of Escherichia coli
spectroscopy, Biochim. Biophys. Acta, 1797, 1657 1664,
cytochrome bd ubiquinol oxidase is essential for assembly
doi: 10.1016/j.bbabio.2010.05.010.
and stability of the di heme active site, FEBS Lett., 588,
81.
Borisov, V. B., and Verkhovsky, M. I. (2013) Accommod
1537 1541, doi: 10.1016/j.febslet.2014.03.036.
ation of CO in the di heme active site of cytochrome bd
68.
Chen, H., Luo, Q., Yin, J., Gao, T., and Gao, H. (2015)
terminal oxidase from Escherichia coli, J. Inorg. Biochem.,
Evidence for requirement of CydX in function but not
118, 65 67, doi: 10.1016/j.jinorgbio.2012.09.016.
assembly of the cytochrome bd oxidase in Shewanella onei
82.
Siletsky, S. A., Zaspa, A. A., Poole, R. K., and Borisov,
densis, Biochim. Biophys. Acta,
1850,
318328,
V. B. (2014) Microsecond time resolved absorption spec
doi: 10.1016/j.bbagen.2014.10.005.
troscopy used to study CO compounds of cytochrome bd
69.
Hobson, J. J., Gallegos, A. S., Atha, B. W., 3rd, Kelly, J. P.,
from Escherichia coli, PLoS One, 9, e95617, doi: 10.1371/
Lein, C. D., et al. (2018) Investigation of amino acid speci
journal.pone.0095617.
ficity in the CydX small protein shows sequence plasticity
83.
Siletsky, S. A., Rappaport, F., Poole, R. K., and Borisov,
at the functional level, PLoS One,
13, e0198699,
V. B. (2016) Evidence for fast electron transfer between the
doi: 10.1371/journal.pone.0198699.
high spin haems in cytochrome bd I from Escherichia coli,
70.
Duc, K. M., Kang, B. G., Lee, C., Park, H. J., Park, Y. M.,
PLoS One, 11, e0155186, doi: 10.1371/journal.pone.
et al. (2020) The small protein CydX is required for
0155186.
cytochrome bd quinol oxidase stability and function in
84.
Siletsky, S. A., Dyuba, A. V., Elkina, D. A., Monakhova,
Salmonella Typhimurium: a phenotypic study, J. Bacteriol.,
M. V., and Borisov, V. B. (2017) Spectral kinetic analysis of
202, e00348 19, doi: 10.1128/JB.00348 19.
recombination reaction of heme centers of bd type quinol
71.
Hill, J. J., Alben, J. O., and Gennis, R. B.
(1993)
oxidase from Escherichia coli with carbon monoxide,
Spectroscopic evidence for a heme heme binuclear center
Biochemistry (Moscow), 82, 13541366, doi: 10.1134/
in the cytochrome bd ubiquinol oxidase from Escherichia
S000629791711013X.
coli, Proc. Natl. Acad. Sci. USA,
90,
58635867,
85.
Forte, E., Borisov, V. B., Konstantinov, A. A., Brunori, M.,
doi: 10.1073/pnas.90.12.5863.
Giuffrè, A., and Sarti, P. (2007) Cytochrome bd, a key oxi
72.
Tsubaki, M., Hori, H., Mogi, T., and Anraku, Y. (1995)
dase in bacterial survival and tolerance to nitrosative stress,
Cyanide binding site of bd type ubiquinol oxidase from
Ital. J. Biochem., 56, 265 269.
Escherichia coli, J. Biol. Chem., 270, 2856528569,
86.
Borisov, V. B., Forte, E., Siletsky, S. A., Arese, M.,
doi: 10.1074/jbc.270.48.28565.
Davletshin, A. I., Sarti, P., and Giuffrè, A.
(2015)
73.
Borisov, V., Arutyunyan, A. M., Osborne, J. P., Gennis,
Cytochrome bd protects bacteria against oxidative and
R. B., and Konstantinov, A. A. (1999) Magnetic circular
nitrosative stress: a potential target for next generation
dichroism used to examine the interaction of Escherichia
antimicrobial agents, Biochemistry (Moscow), 80, 565 575,
coli cytochrome bd with ligands, Biochemistry, 38, 740 750,
doi: 10.1134/S0006297915050077.
doi: 10.1021/bi981908t.
87.
Giuffrè, A., Borisov, V. B., Mastronicola, D., Sarti, P., and
74.
Vos, M. H., Borisov, V. B., Liebl, U., Martin, J. L., and
Forte, E. (2012) Cytochrome bd oxidase and nitric oxide:
Konstantinov, A. A. (2000) Femtosecond resolution of lig
From reaction mechanisms to bacterial physiology, FEBS
and heme interactions in the high affinity quinol oxidase
Lett., 586, 622-629, doi: 10.1016/j.febslet.2011.07.035.
bd: A di heme active site? Proc. Natl. Acad. Sci. USA, 97,
88.
Giuffrè, A., Borisov, V. B., Arese, M., Sarti, P., and Forte, E.
1554 1559, doi: 10.1073/pnas.030528197.
(2014) Cytochrome bd oxidase and bacterial tolerance to
75.
Borisov, V. B., Sedelnikova, S. E., Poole, R. K., and
oxidative and nitrosative stress, Biochim. Biophys. Acta,
Konstantinov, A. A. (2001) Interaction of cytochrome bd
1837, 1178-1187, doi: 10.1016/j.bbabio.2014.01.016.
with carbon monoxide at low and room temperatures: evi
89.
Borisov, V., Gennis, R., and Konstantinov, A. A. (1995)
dence that only a small fraction of heme b595 reacts with
Peroxide complex of cytochrome bd: kinetics of generation
CO, J. Biol. Chem., 276, 22095 22099, doi: 10.1074/jbc.
and stability, Biochem. Mol. Biol. Int., 37, 975 982.
M011542200.
90.
Borisov, V. B., Gennis, R. B., and Konstantinov, A. A.
76.
Borisov, V. B., Liebl, U., Rappaport, F., Martin, J. L.,
(1995) Interaction of cytochrome bd from Escherichia coli
Zhang, J., et al. (2002) Interactions between heme d and
with hydrogen peroxide, Biochemistry (Moscow), 60, 231
heme b595 in quinol oxidase bd from Escherichia coli: a pho
239.
БИОХИМИЯ том 86 вып. 1 2021
ЦИТОХРОМ bd И СЕРОВОДОРОД
41
91. Borisov, V. B., Davletshin, A. I., and Konstantinov, A. A.
operon and the appY gene, which encodes a transcription
(2010) Peroxidase activity of cytochrome bd from
al activator of Escherichia coli, J. Bacteriol., 178, 1556
Escherichia coli, Biochemistry (Moscow), 75, 428 436,
1564, doi: 10.1128/jb.178.6.1556 1564.1996.
doi: 10.1134/S000629791004005X.
105. Belevich, I., Borisov, V. B., Bloch, D. A., Konstantinov,
92. Borisov, V. B., Forte, E., Davletshin, A., Mastronicola, D.,
A. A., and Verkhovsky, M. I. (2007) Cytochrome bd from
Sarti, P., and Giuffrè, A. (2013) Cytochrome bd oxidase
Azotobacter vinelandii: evidence for high affinity oxygen
from Escherichia coli displays high catalase activity: An
binding, Biochemistry, 46, 11177 11184, doi: 10.1021/
additional defense against oxidative stress, FEBS Lett., 587,
bi700862u.
2214 2218, doi: 10.1016/j.febslet.2013.05.047.
106. Poole, R. K., Kumar, C., Salmon, I., and Chance, B.
93. Forte, E., Borisov, V. B., Davletshin, A., Mastronicola, D.,
(1983) The 650 nm chromophore in Escherichia coli is an
Sarti, P., and Giuffrи, A. (2013) Cytochrome bd oxidase and
“Oxy ” or oxygenated compound, not the oxidized form
hydrogen peroxide resistance in Mycobacterium tuberculosis,
of cytochrome oxidase d: A hypothesis, J. Gen.
mBio, 4, e01006 01013, doi: 10.1128/mBio.01006 13.
Microbiol., 129, 1335 1344, doi: 10.1099/00221287 129
94. Al Attar, S., Yu, Y., Pinkse, M., Hoeser, J., Friedrich, T.,
5 1335.
Bald, D., and de Vries, S. (2016) Cytochrome bd displays
107. Kahlow, M. A., Loehr, T. M., Zuberi, T. M., and Gennis,
significant quinol peroxidase activity, Sci. Rep., 6, 27631,
R. B. (1993) The oxygenated complex of cytochrome d ter
doi: 10.1038/srep27631.
minal oxidase: direct evidence for Fe O2 coordination in a
95. Borisov, V. B., Forte, E., Siletsky, S. A., Sarti, P., and
chlorin containing enzyme by Resonance Raman spec
Giuffrè, A. (2015) Cytochrome bd from Escherichia coli
troscopy, J. Am. Chem. Soc.,
115,
58455846,
catalyzes peroxynitrite decomposition, Biochim. Biophys.
doi: 10.1021/ja00066a071.
Acta, 1847, 182 188, doi: 10.1016/j.bbabio.2014.10.006.
108. Borisov, V. B., Smirnova, I. A., Krasnosel’skaya, I. A., and
96. Borisov, V. B., Forte, E., Konstantinov, A. A., Poole, R. K.,
Konstantinov, A. A. (1994) Oxygenated cytochrome bd
Sarti, P., and Giuffrè, A. (2004) Interaction of the bacteri
from Escherichia coli can be converted into the oxidized
al terminal oxidase cytochrome bd with nitric oxide, FEBS
form by lipophilic electron acceptors, Biochemistry
Lett., 576, 201 204, doi: 10.1016/j.febslet.2004.09.013.
(Moscow), 59, 437 443.
97. Borisov, V. B., Forte, E., Sarti, P., Brunori, M.,
109. Borisov, V. B., Forte, E., Sarti, P., and Giuffrè, A. (2011)
Konstantinov, A. A., and Giuffrè, A. (2006) Nitric oxide
Catalytic intermediates of cytochrome bd terminal oxidase
reacts with the ferryl oxo catalytic intermediate of the
at steady state: Ferryl and oxy ferrous species dominate,
CuB lacking cytochrome bd terminal oxidase, FEBS Lett.,
Biochim. Biophys. Acta, 1807, 503 509, doi: 10.1016/
580, 4823 4826, doi: 10.1016/j.febslet.2006.07.072.
j.bbabio.2011.02.007.
98. Borisov, V. B., Forte, E., Sarti, P., Brunori, M.,
110. Petersen, L. C. (1977) The effect of inhibitors on the oxy
Konstantinov, A. A., and Giuffrè, A. (2007) Redox control
gen kinetics of cytochrome c oxidase, Biochim. Biophys.
of fast ligand dissociation from Escherichia coli cytochrome
Acta, 460, 299 307, doi: 10.1016/0005 2728(77)90216 X.
bd, Biochem. Biophys. Res. Commun., 355, 97102,
111.
Nicholls, P. (1975) The effect of sulphide on cytochrome
doi: 10.1016/j.bbrc.2007.01.118.
aa3. Isosteric and allosteric shifts of the reduced α peak,
99. Mason, M. G., Shepherd, M., Nicholls, P., Dobbin, P. S.,
Biochim. Biophys. Acta, 396, 24 35, doi: 10.1016/0005
Dodsworth, K. S., et al. (2009) Cytochrome bd confers
2728(75)90186 3.
nitric oxide resistance to Escherichia coli, Nat. Chem. Biol.,
112. Cooper, C. E., and Brown, G. C. (2008) The inhibition of
5, 94 96, doi: 10.1038/nchembio.135.
mitochondrial cytochrome oxidase by the gases carbon
100. Borisov, V. B., Forte, E., Giuffrè, A., Konstantinov, A., and
monoxide, nitric oxide, hydrogen cyanide and hydrogen
Sarti, P. (2009) Reaction of nitric oxide with the oxidized
sulfide: chemical mechanism and physiological signifi
di heme and heme copper oxygen reducing centers of ter
cance, J. Bioenerg. Biomembr., 40, 533 539, doi: 10.1007/
minal oxidases: Different reaction pathways and end prod
s10863 008 9166 6.
ucts, J. Inorg. Biochem., 103, 1185 1187, doi: 10.1016/
113. Rabeh, W. M., and Cook, P. F. (2004) Structure and mech
j.jinorgbio.2009.06.002.
anism of O acetylserine sulfhydrylase, J. Biol. Chem., 279,
101. Forte, E., Borisov, V. B., Siletsky, S. A., Petrosino, M., and
26803 26806, doi: 10.1074/jbc.R400001200.
Giuffrè, A. (2019) In the respiratory chain of Escherichia
114. Korshunov, S., Imlay, K. R., and Imlay, J. A. (2016) The
coli cytochromes bd I and bd II are more sensitive to car
cytochrome bd oxidase of Escherichia coli prevents respira
bon monoxide inhibition than cytochrome bo3, Biochim.
tory inhibition by endogenous and exogenous hydrogen
Biophys. Acta (Bioenerg.), 1860, 148088, doi: 10.1016/
sulfide, Mol. Microbiol.,
101,
6277, doi:
10.1111/
j.bbabio.2019.148088.
mmi.13372.
102. Alexeeva, S., Hellingwerf, K. J., and Teixeira de Mattos,
115. Saini, V., Chinta, K. C., Reddy, V. P., Glasgow, J. N.,
M. J. (2003) Requirement of ArcA for redox regulation in
Stein, A., et al. (2020) Hydrogen sulfide stimulates
Escherichia coli under microaerobic but not anaerobic or
Mycobacterium tuberculosis respiration, growth and patho
aerobic conditions, J. Bacteriol.,
185,
204209,
genesis, Nat. Commun., 11, 557, doi: 10.1038/s41467 019
doi: 10.1128/jb.185.1.204 209.2003.
14132 y.
103. Atlung, T., and Brøndsted, L. (1994) Role of the transcrip
116. Nicholls, P., and Kim, J. K. (1982) Sulphide as an inhibitor
tional activator AppY in regulation of the cyx appA operon
and electron donor for the cytochrome c oxidase system,
of Escherichia coli by anaerobiosis, phosphate starvation,
Can. J. Biochem., 60, 613 623, doi: 10.1139/o82 076.
and growth phase, J. Bacteriol.,
176,
54145422,
117. Nicholls, P., Petersen, L. C., Miller, M., and Hansen, F. B.
doi: 10.1128/jb.176.17.5414 5422.1994.
(1976) Ligand induced spectral changes in cytochrome c
104. Brøndsted, L., and Atlung, T. (1996) Effect of growth con
oxidase and their possible significance, Biochim. Biophys.
ditions on expression of the acid phosphatase (cyx appA)
Acta, 449, 188 196, doi: 10.1016/0005 2728(76)90132 8.
БИОХИМИЯ том 86 вып. 1 2021
42
БОРИСОВ, ФОРТЕ
TERMINAL OXIDASE CYTOCHROME bd PROTECTS BACTERIA
AGAINST HYDROGEN SULFIDE TOXICITY
Review
V. B. Borisov1* and E. Forte2
1 Lomonosov Moscow State University, Belozersky Institute of Physico Chemical Biology,
119991 Moscow, Russia; E mail: bor@belozersky.msu.ru
2 Department of Biochemical Sciences, Sapienza University of Rome, I 00185 Rome, Italy
Hydrogen sulfide (H2S) is often called the third gasotransmitter (after nitric oxide and carbon monoxide), or endoge
nous gaseous signaling molecule. This compound plays important roles in organisms from different taxonomic groups,
from bacteria to animals and humans. In mammalian cells, H2S has a cytoprotective effect at nanomolar concentra
tions, but becomes cytotoxic at higher concentrations. The primary target of H2S is mitochondria. At submicromolar
concentrations, H2S inhibits mitochondrial heme copper cytochrome c oxidase, thereby blocking aerobic respiration
and oxidative phosphorylation and eventually leading to cell death. Since the concentration of H2S in the gut is
extremely high, the question arises - how can gut bacteria maintain the functioning of their oxygen dependent res
piratory electron transport chains under such conditions? This review provides an answer to this question and dis
cusses the key role of non canonical bd type terminal oxidases of the enterobacterium Escherichia coli, a component
of the gut microbiota, in maintaining aerobic respiration and growth in the presence of toxic concentrations of H2S
in the light of recent experimental data.
Keywords: respiratory chain, terminal oxidase, heme copper oxidase, cytochrome bd, heme
БИОХИМИЯ том 86 вып. 1 2021