БИОХИМИЯ, 2021, том 86, вып. 1, с. 43 - 55
УДК 577.152.191
МОЛЕКУЛЯРНЫЕ И ФУНКЦИОНАЛЬНЫЕ ПОСЛЕДСТВИЯ
УТРАТЫ СУБЪЕДИНИЦЫ 8А ЦИТОХРОМ c ОКСИДАЗЫ
© 2021
Д. Ротко1,2, А.П. Кудин1, Г. Цурска1,3,
Б. Кулавяк2, А. Шевчык2, В.С. Кунц1,3*
1 Institute of Experimental Epileptology and Cognition Research, Life & Brain Center,
University of Bonn, 53127 Bonn, Germany; E mail: wolfram.kunz@ukbonn.de
2 Laboratory of Intracellular Ion Channels, Nencki Institute of Experimental Biology,
Polish Academy of Sciences, 02 093 Warsaw, Poland
3 Department of Epileptology, University Bonn Medical Center, 53127 Bonn, Germany
Поступила в редакцию 02.11.2020
После доработки 23.11.2020
Принята к публикации 23.11.2020
В настоящей работе нами был на молекулярном уровне изучен эффект отсутствия наименьшей, кодируемой
ядерным геномом субъединицы COX8A цитохром с$оксидазы (COX) в фибробластах пациентов с гомози$
готной мутацией сайта сплайсинга и в клетках HEK293T, чей геном был отредактирован с помощью мето$
да CRISPR/Cas9. В обеих клеточных модельных системах было обнаружено 20-30% остаточной фермента$
тивной активности СОХ. В иммуноблотах белковых комплексов митохондрий, выделенных из обеих кле$
точных моделей, разделенных с помощью метода нативного электрофореза, почти полностью отсутствова$
ли мономеры или димеры нативной формы COX. Интересно, что суперкомплексы COX, образованные с
участием комплекса III, а также с комплексами I и III, сохраняли значительную иммунореактивность, в то
время как почти никакой иммунореактивности, приписываемой подструктурам, найдено не было. Это оз$
начает, что COX, у которой отсутствует субъединица 8A, стабилизируется в составе суперкомплексов, в то
время как её мономеры и димеры подвергаются быстрой деградации. При проведении в исследуемых кле$
точных моделях дефицита субъединицы COX8A транскриптомного анализа с помощью метода секвениро$
вания 3′RNA нам не удалось обнаружить изменения уровня транскрипции генов, участвующих в процессе
накопления развернутых белков в матриксе митохондрий, а также в интегрированном ответе на стресс. Та$
ким образом, наши данные убедительно свидетельствуют о том, что для поддержания структурной стабиль$
ности мономеров и димеров COX необходима наименьшая субъединица цитохром с$оксидазы - COX8A.
КЛЮЧЕВЫЕ СЛОВА: цитохром с$оксидаза, субъединица 8A, суперкомплексы дыхательной цепи.
DOI: 10.31857/S0320972521010048
ВВЕДЕНИЕ
емых белковыми комплексами I-IV дыхательной
цепи (RC - respiratory chain). Падение окисли$
Окислительное фосфорилирование (OXPHOS,
тельно$восстановительного потенциала комп$
оxidative phosphorylation) в клетках млекопитаю$
лексов I, III и IV облегчает перенос протонов че$
щих является метаболическим путем, в котором
рез IMM, а генерируемый трансмембранный
участвуют пять белковых комплексов, располо$
протонный градиент используется комплексом V
женных во внутренней митохондриальной мем$
для хемиосмотической продукции АТP. Если в
бране (IMM, inner mitochondrial membrane). По$
ранней модели «жидкой» мембраны предполага$
ток электронов от NADН или сукцината на моле$
лось, что комплексы дыхательной цепи случай$
кулу кислорода протекает через серию окисли$
ным образом диффундируют в IMM в виде от$
тельно$восстановительных реакций, катализиру$
дельных образований [1], то в недавних работах
было показано, что комплексы RC могут также
Принятые сокращения: BN$PAGE - нативный
находиться в виде определенных супрамолеку$
электрофорез в полиакриламидном геле; COX - цито$
хром с$оксидаза; IMM - внутренняя митохондриальная
лярных ансамблей [2, 3]. Была определена раз$
мембрана; ISR - интегрированный ответ на стресс;
личная стехиометрия таких белковых суперкомп$
mtDNA - митохондриальная DNA; MTS - последователь$ лексов (SC, supercomplex) дыхательной цепи: ди$
ность митохондриального таргетирования; mtUPR - ми$ мер комплекса III, взаимодействующий с одним
тохондриальный развернутый белковый ответ; OXPHOS -
или двумя комплексами IV (III2 + IV или
окислительное фосфорилирование; RC - дыхательная
цепь; 3′RNA$Seq - секвенирование 3′RNA; SC - суперком$
III2 + IV2); комплекс I в ассоциации с димером
плекс дыхательной цепи.
комплекса III (I + III2) и респирасомы, состоя$
* Адресат для корреспонденции.
щие из комплекса I, димера комплекса III и раз$
43
44
РОТКО и др.
личного числа копий комплекса IV (I + III2 + IVn)
ных от пациента с гомозиготной сплайсинговой
[4, 5]. Однако потенциальное преимущество су$
мутацией по COX8A (клинические и генетичес$
перкомплекса в плане катализа благодаря
кие данные см. в работе Hallmann et al. [16]), и
субстратным каналам [6] было оспорено [7], и бы$
на соответствующих по возрасту контрольных
ло предположено, что структура респирасом мо$
фибробластах и клетках почек эмбрионов чело$
жет способствовать стабилизации отдельных
века HEK293T (любезно предоставлены проф.
комплексов дыхательной цепи [8-10], чтобы из$
Майком Райном (Университет Монаша, Австра$
бежать нежелательных белок$белковых взаимо$
лия) и доктором Давидом Страудом (в настоя$
действий в насыщенной белками IMM [11] и сни$
щее время, университет Мельбурна, Австра$
зить образование активных форм кислорода [12].
лия)). Все клетки культивировали в увлажнен$
Цитохром с$оксидаза является терминаль$
ной инкубационной среде, содержащей 5% CO2,
ным акцептором электронов RC, катализирую$
при 37 °C. Культуральная среда состояла из
щим восстановление молекулярного кислорода
модифицированной Дульбекко среды Игла
до воды, которое связано с перекачкой прото$
(DMEM), дополненной 10% (v/v) фетальной
нов в межмембранное пространство (IMS). В
бычьей сывороткой, 2 мМ глутамина, 100 U/мл
клетках млекопитающих мультибелковый комп$
пенициллина, 100 мкг/мл стрептомицина и
лекс COX состоит из 14 субъединиц [13]. Ката$
50 мкг/мл уридина. Каждые три дня (по дости$
литический центр COX образуется пронизываю$
жении 95% слияния) клетки пересевали.
щими IMM субъединицами COX1, COX2
Получение COX8A дефицитных клеток с по
и COX3. Эти высокогидрофобные белки коди$
мощью конструкций CRISPR/Cas9. Редактирова$
руются митохондриальной DNA (mtDNA), в то
ние генов клеток HEK293T проводили с по$
время как другие 11 субъединиц COX (COX4,
мощью конструкций CRISPR/Cas9, несу$
COX5A, COX5B, COX6A, COX6B, COX6C,
щих gRNA, нацеленную на экзон 1 гена COX8A.
COX7A, COX7B, COX7C, COX8A и NDUFA4)
Для отбора последовательностей gRNA для
кодируются ядерным геномом. Кодируемые
конструкций CRISPR/Cas9 использовали алго$
ядерным геномом субъединицы COX участвуют
в сборке этого фермента, стабилизации структу$
lic/analysis$tools/sgrna$design) дизайна gRNA
ры и в его взаимодействии с белковыми партне$
Института Брода (Broad Institute). Олигонуклео$
рами в SC дыхательной цепи, а также в процес$
тиды dsDNA, кодируюшие gRNA, были клони$
се регуляции активности цитохром с$оксидазы с
рованы в pSpCas9(BB)$2A$GFP
(«Addgene»,
участием АТP и тироидных гормонов [14].
США), как было описано ранее [17]. Клетки
Белок COX8A является самой маленькой
HEK293T были трансфицированы плазмидой,
субъединицей COX, кодируемой ядерным гено$
содержащей конструкцию CRISPR/Cas9 с ис$
мом. В клетках человека этот белок заменен на
пользованием реагента для трансфекции
белок COX8B (COXVIIIH), который обычно
GeneJuice («Sigma», США), в соответствии с
экспрессируется в большинстве клад приматов,
инструкциями производителя. Через 24 ч после
повсеместная экспрессия COX8A считается
трансфекции определяли количество жизнеспо$
адаптивным эволюционным изменением в ме$
собных клеток, их разводили и рассевали в 96$
ханизме антропоидной RC для оптимизации аэ$
луночные культуральные планшеты для получе$
робного энергетического метаболизма [15]. Од$
ния клонов отдельных клеток. После образова$
нако молекулярная роль субъединицы COX8A в
ния клональных колоний отдельные колонии
функционировании COX до сих пор не выясне$
собирали для проведения скрининга с исполь$
на. Была одна публикация, посвященная иссле$
зованием метода секвенирования по Сэнгеру.
дованию случая дефицита субъединицы COX8A
Препараты общей DNA получали с использова$
у больного с синдромом Лея [16], при котором
нием набора QIAamp DNA Mini Kit («Qiagen»,
наблюдалась недостаточность функционирова$
Германия).
ния COX. В этом исследовании мы изучили
Выделение митохондрий. Выделение митохон$
функциональное влияние потери COX8A на био$
дрий проводили, как описано ранее [18]. Вкрат$
генез COX как индивидуального белкового
це, клетки собирали и осаждали при 800 g. Оса$
комплекса электротранспортной цепи и как
док клеток ресуспендировали в ледяном раство$
компонента SC дыхательной цепи.
ре A (250 мМ сахароза, 5 мМ HEPES, pH 7,2) и
гомогенизировали в стеклянном гомогенизато$
ре. Полученный гомогенат центрифугировали
МАТЕРИАЛЫ И МЕТОДЫ
при 780 g в течение 10 мин при 4 °C. Суперна$
танты объединяли и центрифугировали в ледя$
Культура клеток. Эксперименты были прове$
ном растворе A при 9200 g в течение 10 мин при
дены на фибробластах кожи человека, получен$
4 °C. Осадок промывали, ресуспендировали в
БИОХИМИЯ том 86 вып. 1 2021
ПОСЛЕДСТВИЯ ОТСУТСТВИЯ COX8A
45
ледяном растворе A и центрифугировали при
сидазой хрена, а именно с овечьими анти$мы$
9200 g в течение 10 мин при 4 °C. Осадок, содер$
шиными антителами («GE Healthcare», США,
жащий митохондрии, ресуспендировали в ледя$
NA931V). Визуализацию белкового сигнала про$
ном растворе B (150 мМ KCl, 10 мМ HEPES,
водили с использованием ECL Prime («GE
pH 7,2) и хранили во льду.
Healthcare», США), в соответствии с инструкци$
Электрофоретическое разделение белков и им
ями производителя.
мунодетекция. Концентрацию белка в образцах
Выделение RNA. Общую РНК выделяли из
определяли с помощью набора Pierce BCA
фибробластов и клеток HEK293T фенол$хлоро$
Protein Assay Kit («Thermo Scientific», США).
формной экстракцией с последующей очисткой
Для проведения голубого нативного электрофо$
на кремнеземно$мембранных колонках, исполь$
реза в полиакриламидном геле (BN$PAGE, blue
зуя RNeasy Mini Kit («Qiagen», США). Сначала
native polyacrylamide gel electrophoresis) аликво$
клетки лизировали с использованием реаген$
ты суспензии митохондрий солюбилизировали
та TRIzolt («Invitrogen», США), и лизат гомоге$
раствором, содержащим дигитонин (10% (v/v)
низировали с помощью QIAshredder («Qiagen»,
глицерин, 1% (v/v) дигитонин, 50 мМ NaCl,
США). Диссоциацию нуклеопротеиновых ком$
20 мМ Tris$HCl, 0,1 мМ ЭДТА, 1 мМ фенилме$
плексов проводили в результате инкубации ли$
тилсульфонилфлюорид, pH 7,4). Образцы ос$
зата в течение 5 мин. Разделение фаз проводили
тавляли во льду в течение 15 мин. Солюбилизи$
с использованием хлороформа и последующим
рованные митохондрии центрифугировали в те$
центрифугированием в течение 15 мин при
чение 10 мин при 9200 g и 4 °C и затем собирали
12 000 g при 4 °C. Собирали водную фазу и осаж$
супернатант. Раствор красителя (1,5 M амино$
дали RNA 70%$ным этанолом. Препараты, со$
капроевая кислота, 50 мМ Bis$Tris$HCl, 5% Ку$
держащее RNA, затем наносили на колонки
масси бриллиантовый голубой, pH 7,0) добавля$
RNeasy Mini Kit spin columns («Qiagen», США) и
ли в супернатант до конечной концентрации 1/3
проводили выделение RNA, в соответствии с
от общего объема пробы. Образцы, содержащие
инструкциями производителя. Количество RNA
белки митохондриальных белковых комплек$
и её чистоту в конечном растворе определяли
сов, наносили на голубой нативный градиент$
спектрофотометрически с помощью Nanodrop
ный (4-10%) PААG (100 мкг белка на дорожку),
2000 («Thermo Scientific», США).
и проводили разделение митохондриальных
Секвенирование 3′RNA (3′RNA Seq). Для оп$
белковых комплексов методом электрофоре$
ределения уровня экспрессии митохондриаль$
за при 4 °C.
ных белков, кодируемых митохондриальным и
В случае электрофореза белков в полиакри$
ядерным геномом, проводили 3′RNA$секвени$
ламидном геле в присутствии SDS (SDS$PAGE)
рование выделенной общей RNA. Число целост$
аликвоты митохондриального препарата солю$
ности RNA (RNA integrity number) препарата
билизировали в 4× буфере для образов Лэм$
общей RNA контролировалось с помощью
мли («Bio$Rad», США), содержащем 1% β$мер$
Agilent TapeStation
(«Agilent Technologies»,
каптоэтанол, при 60 °C в течение 15 мин. Образ$
США), и это значение превышало 7 во всех об$
цы наносили вместе с предварительно окрашен$
разцах. На основе препарата общей RNA с по$
ным набором белков$маркеров PageRuler
мощью набора QuantSeq 3′mRNA$Seq Library
ladder («Thermo Scientific», США) на 12,5% SDS$
Prep Kit («Illumina», США) была приготовлена
PAGE и разделяли методом электрофореза.
библиотека комплементарных DNA (cDNA,
После разделения в BN$PAGE или SDS$PAGE
lementary DNA). В результате эта библиотека
белки из гелей переносили на поливинилиден$
cDNA была обогащена последовательностями,
фторидные мембраны (PVDF - polyvinylidene fluo$
находящимися в непосредственной близости к
ride) с помощью электроблоттинга. Эти мембра$
3′$концу транскрибированной полиаденилиро$
ны обрабатывали первичными антителами про$
ванной RNA. Секвенирование проводили на
тив конкретных белков: COX1 («Invitrogen»,
платформе для секвенирования HiSeq
2500
США, 1D6E1A8), COX2 («Invitrogen», США,
(«Illumina», США) в режиме высокого выхода.
12C4F12), COX4 («Cell Signaling», США, 4844S),
Обработка данных секвенирования RNA. Вы$
NDUFA9 («Abcam», Великобритания, ab14713),
ходные файлы секвенирования FASTQ были со$
SDHA («Abcam», Великобритания, ab137040),
поставлены с геномной сборкой Homo sapiens
CORE2 («Abcam», Великобритания, ab14745),
GRCh38
(hg38), полученной от Genome
субъединицы с АТP$синтазы («Abcam», Вели$
Reference Consortium с использованием файла
кобритания, ab181243), HSP75 («Abcam», Вели$
аннотаций генов UCSC. Была использована
кобритания, ab182775). Обнаружение первич$
программа «RNA STAR aligner» в режиме двух
ных антител на мембране проводили с помощью
операций в соответствии с инструкциями по
вторичных антител, конъюгированных с перок$
применению программы. Сопоставленные счи$
БИОХИМИЯ том 86 вып. 1 2021
46
РОТКО и др.
тывания были количественно оценены с по$
таны антителами против субъединиц NDUFA9,
мощью алгоритма подсчета признаков
CORE2, COX4 комплексов I, III и IV дыхатель$
(featureCounts). Нормализацию результатов ри$
ной цепи. Для солюбилизации мембранных бел$
дов и статистическую обработку полученных
ков использовали неионный мягкий детергент
данных производили с помощью программного
дигитонин, который сохраняет исходную стехио$
пакета «R/Bioconductor DESeq2» на платформе
метрию SC дыхательной цепи.
Galaxy.
В контрольных фибробластах субъединица
Определение ферментативной активности.
COX4 обнаруживалась в четырех отдельных
Спектрофотометрическое определение актив$
полностью собранных комплексах COX (рис. 1).
ности комплекса IV и цитратсинтазы проводили
Большинство этого белка было в равной мере
с помощью стандартных методов, которые были
распределено между мономером COX и респи$
описаны ранее [19].
расомами, в то время как также присутствовало
меньшее количество белка в димерной форме и
в SC, содержащем CIII2 + CIV. В фибробластах
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
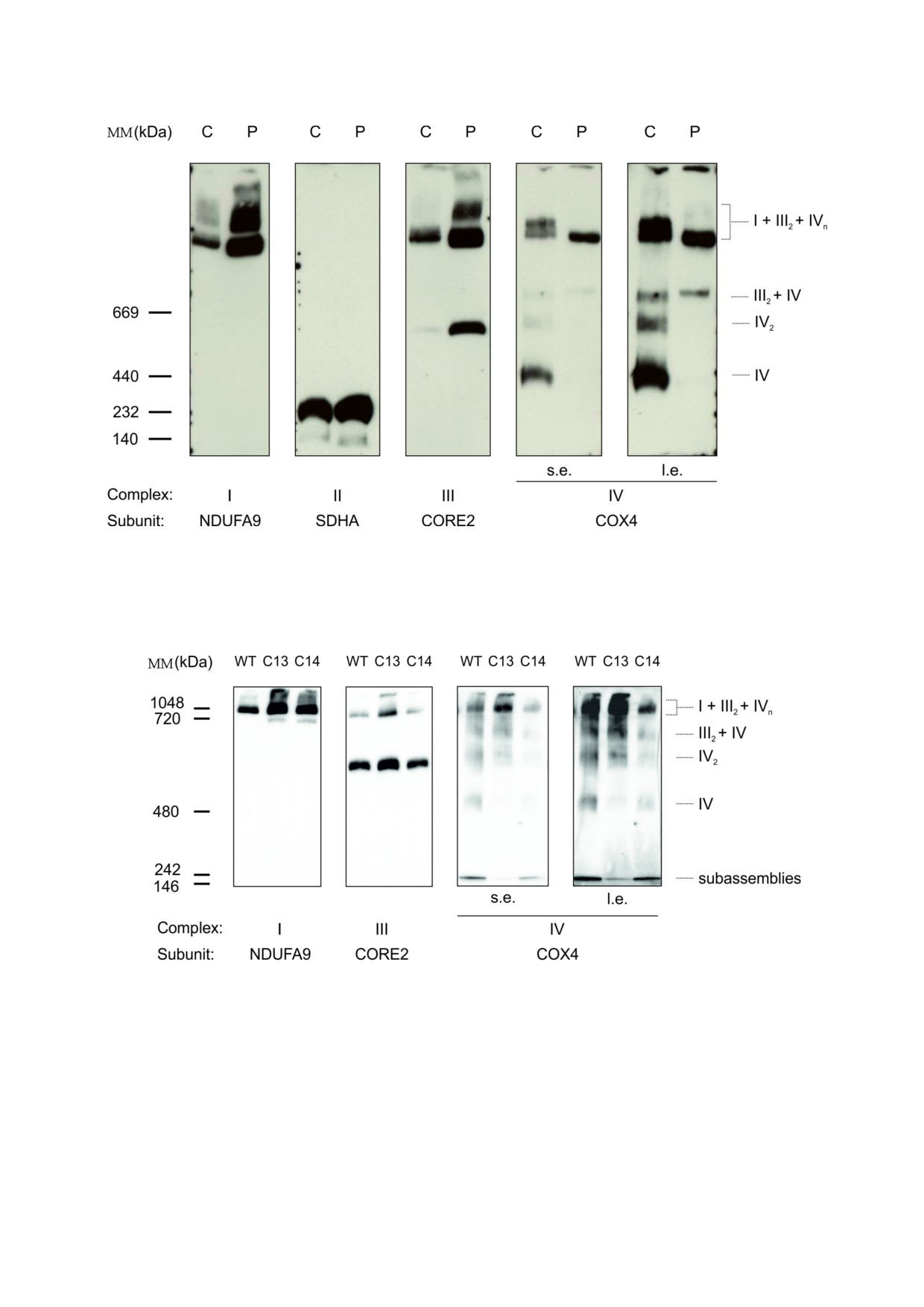
пациента остаточная активность COX была в ос$
новном обнаружена в респирасомах, и эта ак$
Активность COX в фибробластах и COX8A де
тивность не была выявлена ни в мономере COX,
фицитных клетках HEK293T. Было проведено
ни в её димерной форме. Меньшее количество
определение активности COX в препаратах ми$
цитохром с$оксидазы также было выявлено в
тохондрий фибробластов и клеток HEK293T с
белковом комплексе с молекулярной массой
дефицитом COX8A и в соответствующих конт$
>669 кДа. Интересно, что в COX8A$дефицитных
ролях (таблица). Чтобы провести определение
фибробластах наблюдалось повышение количе$
активности COX независимо от содержания ми$
ства комплексов дыхательной цепи I и III, со$
тохондрий, активность фермента рассчитывали
держащих субъединицы NDUFA9 и CORE2.
относительно активности цитратсинтазы (CS,
В клетках HEK293T дикого типа сигнал
citrate synthase) [19]. Во всех линиях клеток с де$
COX4 был распределен между четырьмя пол$
фицитом COX8A ферментативная активность
ностью сформированными белковыми комп$
комплекса IV была снижена, однако остаточная
лексами, такими как мономеры COX, димеры
активность COX все же сохранялась. Соотноше$
COX, CIII2 + CIV и респирасомы (рис. 2). Одна$
ние активности COX/CS в фибробластах с дефи$
ко стехиометрия отличалась от таковой, выяв$
цитом COX8A было снижено в 5 раз. В каждом
ленной в фибробластах, поскольку наибольшее
из клонов клеток HEK293T (#13 и #14) с различ$
количество COX было включено в респирасомы,
ными делециями последовательности митохон$
а мономер COX был наименее распространен$
дриального таргетинга (MTS - mitochondrial tar$
ной формой. В COX8A$дефицитном клоне #13
geting sequence, рис. 1 в Приложении) соотно$
клеток HEK293T с более короткой делецией в
шение активности COX и CS было снижено
области MTS COX8A наибольшее количест$
примерно в 3 раза. Подробные результаты сек$
во COX находилось в составе респирасом. Одна$
венирования по Сэнгеру двух изученных в рабо$
ко значительная часть COX также содержалась
те клонов клеток, редактированных по COX8A,
внутри SC CIII2 + CIV и в меньшей мере - в ди$
приведены на рис. 1а в Приложении.
мерах COX. При этом практически не наблюда$
Комплексы дыхательной цепи в линиях кле
лась мономерная форма COX. Количество бел$
ток, дефицитных по COX8A. Белковые комплек$
ковых комплексов, содержащих COX в COX8A$
сы митохондрий, выделенных из фибробластов
дефицитном клоне #14 клеток HEK293T, было
и клеток HEK293T, были разделены с использо$
значительно меньше, чем в клетках дикого типа
ванием метода BN$PAGE и затем были обрабо$
или в клетках клона #13. Большинство остаточ$
Активность ферментов COX8A$дефицитных линий клеток
Ферментативная активность
Контрольные
Мутантные
HEK293T
HEK293T COX8A$
HEK293T COX8A$
(мЕ/мг белка)
фибробласты
по COX8A
дикого типа
дефицитный
дефицитный
фибробласты
клон #13
клон #14
Цитратсинтаза
61 ± 2
80 ± 5
167 ± 11
189 ± 5
173 ± 6
Цитохром с$оксидаза
81 ± 8
21 ± 2
84 ± 4
32 ± 1
27 ± 4
Комплекс IV/цитратсинтаза
1,32
0,27
0,51
0,17
0,16
БИОХИМИЯ том 86 вып. 1 2021
ПОСЛЕДСТВИЯ ОТСУТСТВИЯ COX8A
47
Рис. 1. Стабилизация COX в составе суперкомплексов в COX8A$дефицитных фибробластах. BN$PAGE с последующим
иммуноокрашиванием, 1% дигитонин. Препараты митохондрий из контрольных фибробластов (С) и фибробластов паци$
ента с дефицитом COX8A (P), 100 мкг белка на дорожку. s.e. и l.e. - короткая (short) и долгая (long) экспозиции. Справа -
белковые комплексы, содержащие COX: IV - мономер COX, IV2 - димер COX, III2 + IV - SC, содержащий COX и димер
комплекса III, I + III2 + IVn - респирасомы
Рис. 2. Структура дыхательной цепи в индуцированных CRISPR/Cas9 COX8A$дефицитных клетках HEK293T. BN$PAGE
с последующим иммуноокрашиванием, 1% дигитонин. Препараты митохондрий клеток HEK293T дикого ти$
па (clone #13, C13) и дефицитных по COX8A (clone #14, C14), 100 мкг белка на дорожку. s.e. и l.e. - короткая и долгая экс$
позиция. Справа - COX$содержащие белковые комплексы: IV - мономер COX, IV2 - димер COX, III2 + IV - SC, содер$
жащий COX и димер комплекса III, I + III2 + IVn - респирасомы
ных белков COX обнаруживались внутри респи$
Стационарные уровни белков. Стационарные
расом, в то время как в SC CIII2 + CIV или в мо$
уровни белков отдельных субъединиц дыхатель$
номерных и димерных формах COX были обна$
ной цепи были определены с помощью метода
ружены только их следовые количества.
SDS$PAGE и последующего окрашивания бел$
БИОХИМИЯ том 86 вып. 1 2021
48
РОТКО и др.
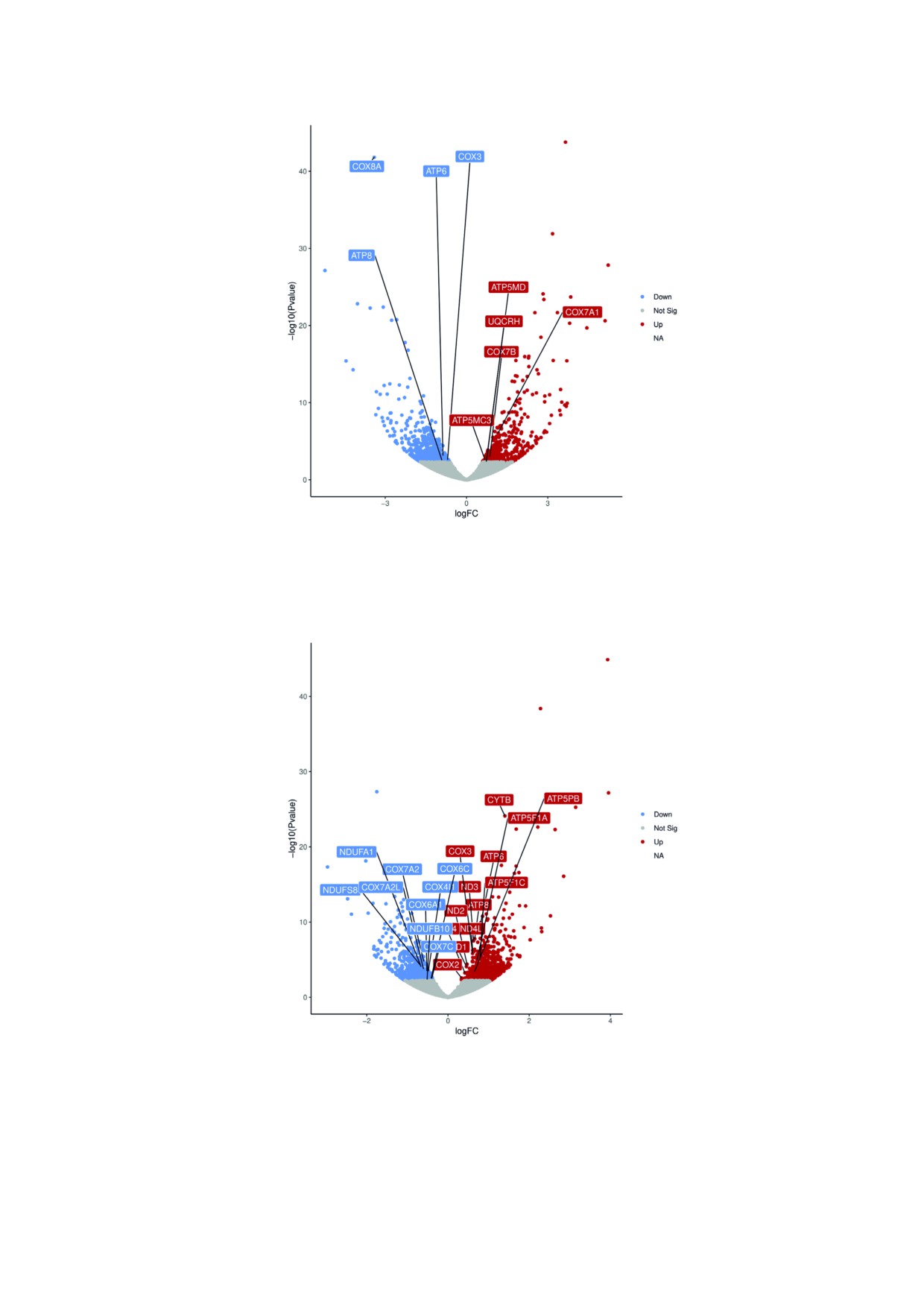
ков с использованием антител. В соответствии с
скрипции, с использованием метода 3′RNA$
наблюдаемым снижением уровня белковых
секвенирования было изучено влияние дефици$
комплексов COX в COX8A$дефицитных фиб$
та COX8A на экспрессию генов, кодирующих
робластах больного, количество белковых субъ$
белки OXPHOS. Анализ транскриптома фиб$
единиц COX1, COX2, COX4 и COX5A в различ$
робластов, дефицитных по COX8A, выявил не$
ной степени тоже было снижено (рис. 3, a). В
сколько дифференциально экспрессируемых ге$
частности, сигналы белков COX 1 и COX5A бы$
нов белков RC (рис. 4). В частности, наблюда$
ли едва различимы, в то время как субъединица
лось небольшое снижение уровня транскрип$
COX4 была наименее подавленной. Экспрессия
ции кодируемой mtDNA субъединицы COX3 и
других субъединиц других комплексов дыха$
субъединиц A6L и A АТP$синтазы (log2(FC):
тельной цепи не была нарушена. Также наблю$
-0,91, -0,87; p$value: 0,03, 0,01 соответственно).
далось повышение количества CORE2, соответ$
В то же время незначительно повышался уро$
ствующее повышению количества белка комп$
вень экспрессии кодируемых ядерным геномом
лекса III, выявленное при проведении BN$
субъединиц COX7A1 и COX7B и количество
PAGE.
транскриптов, кодирующих субъединицу
6
В линиях клеток HEK293T с меньшей
комплекса цитохром b-c1, а также субъедини$
(клон #13) или большей (клон #14) делецией в
цы C3 и DAPIT комплекса V (log2(FC): 1.16, 0.86,
MTS гена COX8A уровни белка COX были также
0,73, 0,68, 0,74; p$value: 6⋅10-5, 0,02, 0,04, 0,03,
значительно снижены (рис. 3, b). Как и в случае
0,04 соответственно).
с фибробластами, наибольшее снижение уровня
Анализ изменений уровня транскрипции в
белка наблюдалось в случае субъединиц COX1 и
COX8A$дефицитном клоне #14 клеток HEK293T
COX5A, в то время уровень субъединицы COX4
выявил несколько генов, кодирующих субъеди$
был снижен незначительно. Следует отметить,
ницы комплексов дыхательной цепи, которые
что снижение количества субъединиц COX было
были дифференцированно экспрессирова$
более выражено в клетках клона #14 с большей
ны (рис. 5). В частности, была повышена
делецией в MTS COX8A. Однако не было обна$
экспрессия всех генов mtДНК, кодирую$
ружено повышения уровня белка в случае субъ$
щих RC$белки, кроме одного: субъединиц ND1,
единиц других комплексов RC.
ND2, ND3, ND4, ND4L комплекса I (log2(FC):
Транскриптомный анализ на основе метода
0,45; 0,47; 0,63; 0,42; 0,61; p$value: 2⋅10-3, 1⋅10-3,
3′RNA секвенирования (3′RNA Seq). Чтобы вы$
4⋅10-6, 0,01, 4⋅10-5 соответственно), цитохрома b
яснить, являются ли изменения уровня бел$
комплекса III (log2(FC): 1,4; p$value: 1⋅10-21 соот$
ков RC результатом регуляции на уровне тран$
ветственно), субъединиц A и A6L комплек$
Рис. 3. Стационарные уровни отобранных субъединиц комплексов дыхательной цепи в COX8A$дефицитных клетках. SDS$
PAGE и последующее окрашивание с использованием антител: a - препарат митохондрий контрольных фибробластов (C)
и фибробластов больного с дефицитом COX8A (P), 50 мкг белка на дорожку. b - Препарат митохондрий из клеток HEK293T
дикого типа и клеток HEK293T, дефицитных по COX8A - клон #14 (C14) и клон #13 (C13), 50 мкг белка на дорожку
БИОХИМИЯ том 86 вып. 1 2021
ПОСЛЕДСТВИЯ ОТСУТСТВИЯ COX8A
49
Рис. 4. Дифференциально экспрессируемые гены, кодирующие комплексы OXPHOS в COX8A$дефицитных фибробластах.
Вулканический график экспрессии генов в фибробластах пациента с дефицитом COX8A в сравнении с контрольными фиб$
робластами. Каждая идентифицированная последовательность гена представлена на графике в виде одной точки. Выявлен$
ные дифференциально экспрессируемые гены, кодирующие субъединицы комплекса RC, показаны прямоугольниками. По
горизонтальной оси отложены значения log2 (кратное изменение) между значениями образцов, по вертикальной оси отло$
жены log10 (значения P). Точки серого цвета обозначают статистически недостоверные различия (p > 0,05), красным показа$
ны гены с повышенной экспрессией (p < 0,05), и синим цветом показаны гены с пониженной экспрессией (p < 0,05)
Рис. 5. Дифференциально экспрессируемые гены, кодирующие комплексы OXPHOS в клетках HEK293T COX8A$дефицитно$
го клона #14. Вулканический график экспрессии генов в COX8A$дефицитном клоне #14 клеток HEK293T в сравнении с клет$
ками HEK293T дикого типа. Каждая идентифицированная последовательность гена представлена на графике в виде одной точ$
ки. Выявлены дифференциально экспрессируемые гены, кодирующие субъединицы комплексов RC, показаны прямоугольни$
ками. По горизонтальной оси отложены значения log2 (кратное изменение) между значениями образцов, по вертикальной оси
отложены log10 (значения P). Точки серого цвета обозначают статистически недостоверные различия (p > 0,05), красным пока$
заны гены с повышенной экспрессией (p < 0,05), и синим цветом показаны гены с пониженной экспрессией (p < 0,05)
4 БИОХИМИЯ том 86 вып. 1 2021
50
РОТКО и др.
са V (log2(FC): 0,8, 0,65; p$value: 3⋅10-8, 2⋅10-6 со$
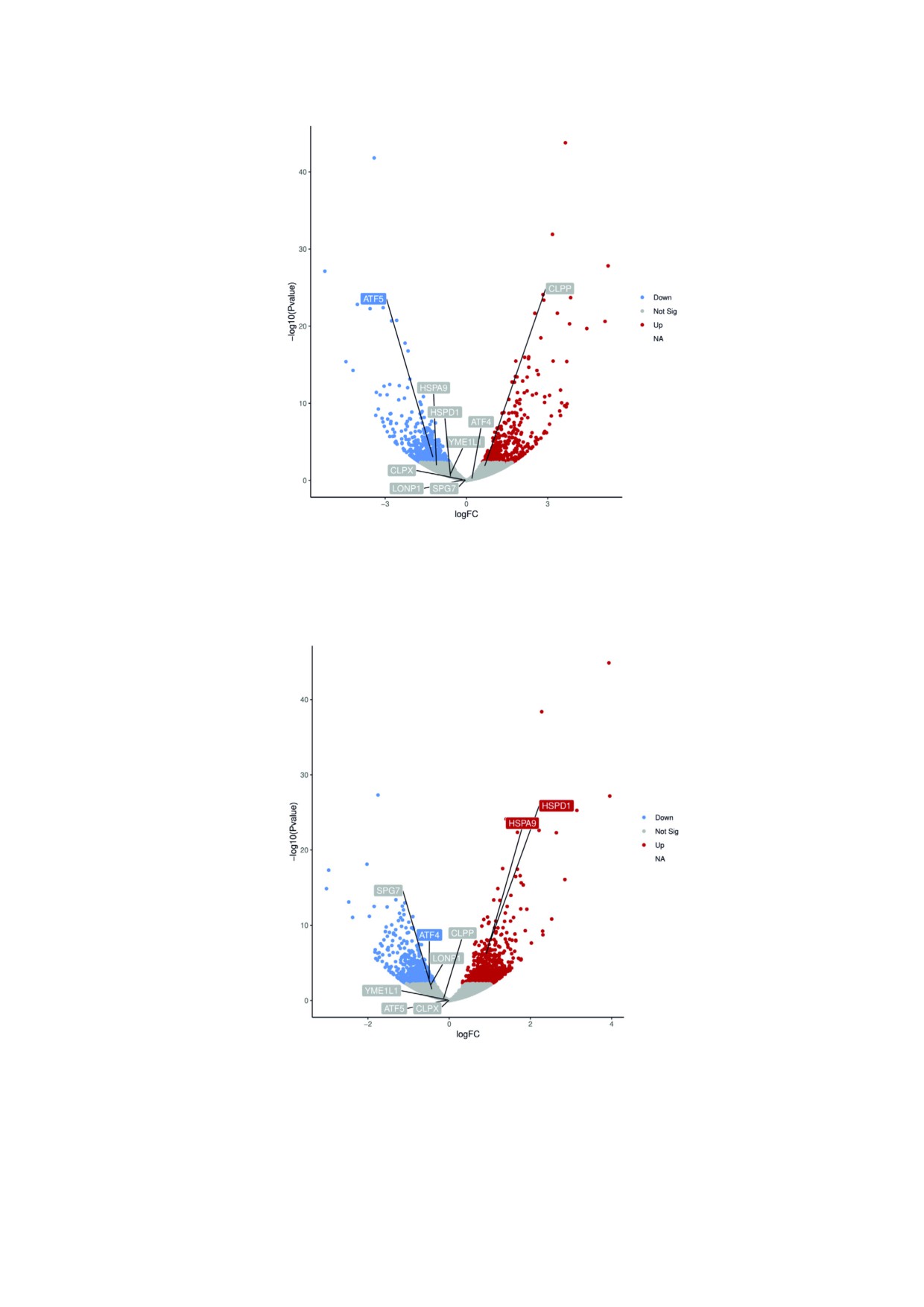
го для митохондрий UPR [23, 24]. Как и в случае
ответственно), а также COX2 и COX3 комплек$
генов, характерных mtUPR, не было обнаруже$
са IV (log2(FC): 0,34, 0,61; p$value: 0,03, 9⋅10-5 со$
но повышения экспрессии ATF5 в COX8A$де$
ответственно). Экспрессия кодируемых ядер$
фицитных фибробластах и клоне #14 клеток
ным геномом субъединиц A, B1 и γ$комплекса V
HEK293T (рис. 6 и 7).
была также повышена (log2(FC): 0,72, 0,66, 0,79;
Интегрированная реакция на стресс - это
p$value: 4⋅10-4, 7⋅10-3, 2⋅10-4 соответственно).
еще одна форма митохондриального ретроград$
Однако количество транскриптов кодируемых
ного сигнального пути стресс$ответа, который
ядерным геномом субъединиц COX4I1, COX6A1,
характеризуется снижением общего синтеза
COX6C, COX7A2, COX7A2L, COX7C (log2(FC):
белка и активацией экспрессии определенных
-0,48, -0,52, -0,41, -0,6, -0,6, -0,4; p$value:
генов комплексного ответа на стресс [25]. Этот
6⋅10-3, 6⋅10-3, 0,03, 6⋅10-4, 4⋅10-3, 0,03 соответ$
процесс может быть инициирован в результате
ственно) и субъединиц NDUFA1, NDUFS8,
фосфорилирования фактора транскрип$
NDUFB10 комплекса I было понижено (log2(FC):
ции eIF2α четырьмя протеинкиназами, чувству$
-0,67, -0,7, -0,51; p$value: 2⋅10-3, 1⋅10-3, 0,04 со$
ющими стресс эндоплазматического ретику$
ответственно).
лум (ER stress), mtUPR, нехватку аминокислот и
Накопление собранных неправильным об$
гема [26]. Фосфорилированный фактор eIF2α
разом промежуточных структур комплекса
индуцирует экспрессию центральных регулято$
OXPHOS может индуцировать в митохондриях
ров транскрипции и ISR - ATF4 и его канони$
протеотоксичный стресс и последующую акти$
ческую мишень CHOP [25, 27, 28]. Однако с по$
вацию путей передачи сигнала о стрессе от ми$
мощью метода секвенирования 3′ RNA не было
тохондрий в ядро [20]. Чтобы выяснить, приво$
установлено повышение экспрессии ATF4 и
дит ли недостаточность субъединицы COX8A к
CHOP в COX8A$дефицитных фибробластах и
запуску митохондриальных ретроградных сиг$
клоне #14 клеток HEK293T (рис. 6 и 7).
нальных путей, экспрессии ключевых регулято$
ров транскрипции и их нижестоящих мишеней
митохондриального развернутого белкового от$
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
вета (mtUPR, mitochondrial unfolded protein
response) и интегрированного ответа на стресс
В настоящем исследовании мы изучали влия$
(ISR - integrated stress response) оценивали с по$
ние потери субъединицы COX8A на биогенез
мощью 3′RNA$seq. Активация mtUPR включает
цитохром с$оксидазы как индивидуального бел$
в себя повышенную регуляцию экспрессии ми$
кового комплекса электротранспортной цепи и
тохондриальных протеаз контроля качества, та$
как компонента SC дыхательной цепи. Для вы$
ких как ClpP, ClpX, Lonp1, paraplegin и
яснения молекулярной и функциональной роли
YME1L [21]. Кроме того, при mtUPR происходит
потери COX8A в фибробластах пациента с дефи$
индукция экспрессии митохондриальных шапе$
цитом COX8A и в клетках HEK293T с
ронов, таких как Hsp70 и Hsp60, приводящая к
CRISPR/Cas9$индуцированным дефицитом
повышению вероятности правильного сверты$
COX8A мы провели измерения активности
вания белков [22]. Однако в профиле тран$
COX, BN$PAGE и SDS$PAGE с последующей
скрипции фибробластов с недостаточностью
иммунодетекцией отдельных субъединиц комп$
COX8A и клона #14 клеток HEK293T не наблю$
лексов RC. Кроме того, с помощью метода сек$
далось усиления регуляции генов, кодирующих
венирования 3′RNA была проведена оценка из$
перечисленные выше митохондриальные проте$
менений транскриптома в COX8A$дефицитных
азы (CLPP, CLPX, LONP1, SPG7 и YME1L соот$
клетках.
ветственно) (рис. 6 и 7). Экспрессия генов
Биогенез холофермента COX является высо$
HSPA9 и HSPD1, кодирующих митохондриаль$
ко регулируемым процессом с постепенной
ные шапероны, в фибробластах пациента с де$
сборкой кодируемых mtDNA и ядерной DNA
фицитом COX8A не изменялась (рис. 6), в то
субъединиц COX, которому способствуют ~30
время как она увеличивалась в COX8A$дефи$
факторов, кодируемых ядерным геномом [29].
цитном клоне #14 клеток HEK293T (рис. 7)
Согласно текущей модульной модели сборки
(log2(FC): 0,92, 1,03; p$value: 4⋅10-5, 1⋅10-6 соответ$
мономера COX, COX8A присоединяется к про$
ственно), в которых такое повышение экспрес$
межуточным формам собираемого комплекса
сии шаперонов может быть проявлением адап$
COX только на поздней стадии в модуле субъ$
тации к повышению экспрессии генов HSPA9 и
единицы, содержащей COX2 [30]. Однако недав$
HSPD1, кодируемых митохондриальной DNA
нее исследование предполагает существование
субъединиц RC. Фактор транскрипции ATF5
альтернативных способов сборки COX в составе
считается ключевым регулятором специфично$
респирасом с возможностью прямого включе$
БИОХИМИЯ том 86 вып. 1 2021
ПОСЛЕДСТВИЯ ОТСУТСТВИЯ COX8A
51
Рис. 6. Экспрессия генов, участвующих в ретроградных сигнальных путях митохондрий в COX8A$дефицитных фибро$
бластах. Вулканический график экспрессии генов в фибробластах пациента с дефицитом COX8A в сравнении с контроль$
ными фибробластами. Каждая идентифицированная последовательность гена представлена на графике в виде одной точ$
ки. Названия отобранных генов показаны в прямоугольниках. По горизонтальной оси отложены значения log2 (кратное
изменение) между значениями образцов, по вертикальной оси отложены log10 (значения P). Точки серого цвета обознача$
ют статистически недостоверные различия (p > 0,05), красным показаны гены с повышенной экспрессией (p < 0,05), и си$
ним цветом показаны гены с пониженной экспрессией (p < 0,05)
Рис. 7. Экспрессия генов, вовлеченных в митохондриальные ретроградные сигнальные пути COX8A$дефицитного кло$
на #14 клеток HEK293T. Вулканический график экспрессии генов в клетках COX8A$дефицитного клона #14 HEK293T в
сравнении с клетками HEK293T дикого типа. Каждая идентифицированная последовательность гена представлена на
графике в виде одной точки. Названия отобранных генов показаны в прямоугольниках. По горизонтальной оси отложе$
ны значения log2 (кратное изменение) между значениями образцов, по вертикальной оси отложены log10 (значения P).
Точки серого цвета обозначают статистически недостоверные различия (p > 0,05), красным показаны гены с повышенной
экспрессией (p < 0,05), и синим цветом показаны гены с пониженной экспрессией (p < 0,05)
БИОХИМИЯ том 86 вып. 1 2021
4*
52
РОТКО и др.
ния субъединиц COX в неканонические модули
ности респирасом для стабилизации оставшего$
неполной сборки [31]. В соответствии с нашими
ся COX. Компенсаторное повышение уровня
предыдущими данными [16], в фибробластах
комплексов I и III RC наблюдалось также в фиб$
пациента с дефицитом COX8A вызванная нон$
робластах с мутациями в белках SURF1 и COA6
сенс$мутацией деградация mRNA приводила к
[32, 33].
резкому снижению уровня транскрипта COX8A.
Выявленное с помощью метода BN$PAGE
В этих клетках наблюдалось выраженное сниже$
понижение количества COX соответствовало
ние активности COX, приближающееся к ~20%
результатам SDS$PAGE, продемонстрировав$
от контрольных значений. В обоих клонах
ших пониженные стационарные уровни всех
HEK293T (#13 и #14), содержащих делеции в
тестированных субъединиц COX (COX1, COX2,
MTS COX8A, остаточная активность COX сос$
COX5A, COX4) в COX8A$дефицитных линиях
тавляла примерно 30% от контрольных значе$
клеток. Стационарные уровни комплекса III
ний, что указывает на то, что потеря COX8A
были повышены в фибробластах пациента, что
оказывает пагубное воздействие на фермента$
соответствовало увеличению общего количества
тивную активность COX. Однако наличие под$
комплекса III, содержащего SC. Репрезентатив$
дающейся измерению остаточной активности
ные субъединицы других комплексов остались
COX означает, что сборка связанного с респира$
без изменений.
сомами холофермента COX может протекать и
Чтобы выяснить, могут ли изменения уровня
без участия субъединицы COX8A.
белков быть вызваны изменениями экспрессии
С помощью метода BN$PAGE было показа$
генов, был проведен транскриптомный анализ.
но, что снижение ферментативной активности
В фибробластах с дефицитом COX8A результаты
COX связано с пониженным общим количест$
3′RNA$секвенирования не показали системного
вом COX$содержащих белковых комплексов. В
увеличения транскрипции генов, кодирующих
митохондриях фибробластов пациента с дефи$
RC$белки. Это означает, что компенсаторное
цитом COX8A и клеток HEK293T клона #14 (со$
увеличение количества субъединиц комплек$
держащих бóльшую делецию в MTS COX8A) ос$
сов I и III дыхательной цепи в COX8A$дефицит$
таточный белок COX был в значительной степе$
ных фибробластах происходит, скорее всего, на
ни ассоциирован с респирасомами, в то время
пост$трансляционном уровне. Так, в COX8A$де$
как мономерная форма практически не обнару$
фицитных клетках HEK293T клона #14 повы$
живалась. Это говорит о том, что стабильность
шена экспрессия почти всех митохондриальных
мономеров COX была сильно нарушена в случае
белок$кодирующих генов, в то время как
потери COX8A, в то время как остаточная актив$
экспрессия нескольких кодируемых ядерным
ность COX, содержащаяся внутри SC, была за$
геномом субъединиц, участвующих в сборке
щищена от деградации белка. Примечательно,
COX на её поздней стадии, понижена. Это гово$
что аналогичные наблюдения были сделаны в
рит о сложном характере регуляции генной
случае клеток, содержащих мутации в факторах
экспрессии в этой клеточной линии.
сборки COX, а именно в SURF1 и COA6. Общее
Далее мы исследовали, может ли нарушен$
количество COX было снижено и большая часть
ная сборка COX, вызванная мутациями в
остаточного COX была включена в респирасо$
COX8A, индуцировать протеотоксический
мы, в то время как мономерная форма COX с
стресс вследствие накопления орфанных про$
трудом обнаруживалась [32, 33]. Миссенс$вари$
межуточных продуктов сборки COX. mtUPR яв$
ант структурной субъединицы COX5A, кодируе$
ляется ретроградным сигнальным путем, кото$
мой ядерным геномом, привел к дефициту COX
рый инициируется с целью восстановления бел$
и сниженной стабильности мономеров COX, но
кового гомеостаза в митохондриях [36]. Его ак$
уровень COX внутри респирасом оставался без
тивация происходит с целью исправления не$
изменений [34]. Эти результаты поддерживают
правильно свернутых или неправильно собран$
предположение о том, что одна из ключевых
ных митохондриальных белков. Активация
физиологических ролей респирасом заключает$
mtUPR включает в себя повышенную регуля$
ся в стабилизации индивидуальных белковых
цию экспрессии митохондриальных AAA$про$
комплексов, что особенно актуально в случае их
теаз: ClpP, ClpX и Lonp1, локализованных внут$
неправильной сборки и снижения стабильнос$
ри митохондриального матрикса, и параплегина
ти [35].
и YME1L, которые заякорены в IMM [21]. Кро$
Структура комплексов дыхательной цепи I
ме того, mtUPR индуцирует повышение регуля$
и III не была нарушена в клетках с дефицитом
ции экспрессии митохондриальных шаперонов
COX8A, и их количество оказалось даже повы$
для содействия свертыванию вновь транслиро$
шенным, что может возникать как компенса$
ванных пептидов [20]. Однако в транскриптоме
торный феномен с целью увеличения доступ$
COX8A$дефицитных фибробластов нет измене$
БИОХИМИЯ том 86 вып. 1 2021
ПОСЛЕДСТВИЯ ОТСУТСТВИЯ COX8A
53
ний экспрессии генов, ассоциированных с акти$
COX8A приводит к дефициту COX, который
вацией mtUPR. Экспрессия протеаз, осущест$
выражается в снижении количества белковых
вляющих контроль качества митохондрий, в
комплексов COX и снижению его фермен$
клетках HEK293T также остается без измене$
тативной активности. Остаточный COX в
ний. Повышение количества транскриптов ми$
COX8A$дефицитных клетках стабилизируется
тохондриальных шаперонов в клетках HEK293T
внутри респирасом, и при этом не происходит
клона #14 можно объяснить скоординирован$
активации mtUPR, вызванного неправильно
ной экспрессией ядерных и митохондриальных
собранными промежуточными структурами
геномов для увеличения способности шаперона
мономера COX.
сворачивать белок.
Интегрированный ответ на стресс - еще
один митохондриальный ретроградный сиг$
Финансирование. Выполнение данной рабо$
нальный путь, инициируемый активацией четы$
ты поддержано Deutsche Forschungsgemeinschaft
рех протеинкиназ (Gcn2, HRI, Prk и Perk), кото$
(гранты №№ KU 911/21$2 и KU 911/22$1, пре$
рые активируются в ответ на широкий спектр
доставлены W.S.K.; и гранты №№ ZS 99/3$2 и
стрессовых состояний, включая нехватку ами$
ZS 99/4$1, предоставлены GZ). Эта работа также
нокислот и гема, mtUPR и стресс эндоплазмати$
была поддержана Польским национальным на$
ческого ретикулума (ER stress) [26]. Их сигналь$
учным центром (грант № 2019/34/A/NZ1/00352,
ные пути сходятся на фосфорилировании фак$
предоставлен AS; и грант № 2015/18/E/NZ1/
тора транскрипции eIF2α, которое приводит к
00737, предоставлен BK) и исследовательской и
глобальному снижению трансляции белка и се$
инновационной программой Европейского Со$
лективной активации генов стресс$ответа [25].
юза Horizon 2020 имени Марии Склодовской$
ATF4 является нижележащей мишенью фосфо$
Кюри (грант № 665735 (Bio4Med)).
рилированного eIF2α и основным транскрип$
Благодарности. Авторы хотят выразить бла$
ционным регулятором ISR. Одной из его кано$
годарность проф. Майку Райяну и доктору Дэ$
нических мишеней является фактор транскрип$
виду Страуду за предоставленную линию клеток
ции CHOP [27, 28]. Поскольку в транскриптоме
HEK293T.
обоих COX8A$дефицитных типах клеток не наб$
Конфликт интересов. Авторы заявляют об
людалось изменений, ассоциированных с ISR,
отсутствии конфликта интересов.
вполне вероятно, что дефицит COX из$за мута$
Соблюдение этических норм. Все процедуры,
ций в COX8A не приводит к инициации ISR. В
выполненные в настоящей работе с участием
целом отсутствие активации митохондриальной
людей, соответствовали этическим стандартам
ретроградной передачи сигнала в обоих COX8A$
Национального комитета по этике научных ис$
дефицитных типах клеток предполагает отсут$
следований и Хельсинкской Декларации 1964 г.
ствие вредного накопления неправильно соб$
ее последующим изменениям или сопостави$
ранных промежуточных структур COX либо из$за
мым нормам этики. От каждого участника ис$
быстрого обмена неправильно собранных про$
следования было получено информированное
межуточных структур, либо из$за включения не$
добровольное согласие.
обычных модулей COX в респирасомы.
Дополнительные материалы. Приложение к
статье на английском языке опубликовано на
Таким образом, полученные нами результа$
сайте журнала «Biochemistry» (Moscow) (http://
ты предполагают, что субъединица COX8A не$
protein.bio.msu.ru/biokhimiya/) и на сайте изда$
обходима для поддержания структурной ста$
бильности мономеров и димеров COX. Потеря
10541), том 86, вып. 1, 2021.
СПИСОК ЛИТЕРАТУРЫ
1.
Hackenbrock, C. R., Chazotte, B., and Gupte, S. S. (1986)
4.
Schägger, H., and Pfeiffer, K. (2001) The ratio of oxidative
The random collision model and a critical assessment of
phosphorylation complexes I$V in bovine heart mitochon$
diffusion and collision in mitochondrial electron transport,
dria and the composition of respiratory chain supercom$
J. Bioenerg. Biomembr., 18, 331$368, doi: 10.1007/
plexes, J. Biol. Chem., 276, 37861$37867, doi: 10.1074/jbc.
BF00743010.
M106474200.
2.
Schägger, H., and Pfeiffer, K. (2000) Supercomplexes in the
5.
Greggio, C., Jha, P., Kulkarni, S. S., Lagarrigue, S.,
respiratory chains of yeast and mammalian mitochondria,
Broskey, N. T., et al. (2017) Enhanced respiratory chain
EMBO J., 19, 1777$1783, doi: 10.1093/emboj/19.8.1777.
supercomplex formation in response to exercise in human
3.
Ac n Pérez, R., Fernández Silva, P., Peleato, M. L.,
skeletalm, Cell Metab., 25, 301$311, doi: 10.1016/j.cmet.
Pérez Martos, A., and Enriquez, J. A. (2008) Respiratory
2016.11.004.
active mitochondrial supercomplexes, Mol. Cell, 32, 529$
6.
Lapuente$Brun, E., Moreno$Loshuertos, R., Ac n Pérez, R.,
539, doi: 10.1016/j.molcel.2008.10.021.
Latorre$Pellicer, A., Colaś, C., et al. (2013) Supercomplex
БИОХИМИЯ том 86 вып. 1 2021
54
РОТКО и др.
assembly determines electron flux in the mitochondrial
22.
Fiorese, C. J., and Haynes, C. M. (2017) Integrating the
electron transport chain, Science,
340,
1567$1570,
UPRmt into the mitochondrial maintenance network, Crit.
doi: 10.1126/science.1230381.
Rev. Biochem. Mol. Biol., 52, 304$313, doi: 10.1080/
7.
Fedor, J. G., and Hirst, J. (2018) Mitochondrial supercom$
10409238.2017.1291577.
plexes do not enhance catalysis by quinone channeling, Cell
23.
Wang, Y. T., Lim, Y., McCall, M. N., Huang, K. T.,
Metab., 28, 525$531.e4, doi: 10.1016/j.cmet.2018.05.024.
Haynes, C. M., Nehrke, K., and Brookes, P. S. (2019)
8.
Calvaruso, M. A., Willems, P., Van den Brand, M.,
Cardioprotection by the mitochondrial unfolded protein
Valsecchi, F., Kruse, S., et al. (2012) Mitochondrial com$
response requires ATF5, Am. J. Physiol., 317, H472$H478,
plex III stabilizes complex I in the absence of NDUFS4 to
doi: 10.1152/ajpheart.00244.2019.
provide partial activity, Hum. Mol. Genet., 21, 115$120,
24.
Fiorese, C. J., Schulz, A. M., Lin, Y. F., Rosin, N.,
doi: 10.1093/hmg/ddr446.
Pellegrino, M. W., and Haynes, C. M. (2016) The transcrip$
9.
Schägger, H., De Coo, R., Bauer, M. F., Hofmann, S.,
tion factor ATF5 mediates a mammalian mitochondrial
Godino, C., and Brandt, U. (2004) Significance of respira$
UPR, Curr. Biol., 26, 2037$2043, doi: 10.1016/j.cub.2016.06.002.
somes for the assembly/stability of human respiratory
25.
Harding, H. P., Zhang, Y., Zeng, H., Novoa, I., Lu, P. D.,
chain complex I, J. Biol. Chem., 279, 36349$36353,
et al. (2003) An integrated stress response regulates amino
doi: 10.1074/jbc.M404033200.
acid metabolism and resistance to oxidative stress, Mol.
10.
Tropeano, C. V., Aleo, S. J., Zanna, C., Roberti, M.,
Cell, 11, 619$633, doi: 10.1016/S1097$2765(03)00105$9.
Scandiffio, L., et al. (2020) Fine$tuning of the respiratory
26.
Taniuchi, S., Miyake, M., Tsugawa, K., Oyadomari, M.,
complexes stability and supercomplexes assembly in cells
and Oyadomari, S. (2016) Integrated stress response of ver$
defective of complex III, Biochim. Biophys. Acta Bioenerg.,
tebrates is regulated by four eIF2α kinases, Sci. Rep., 6,
1861, 148133, doi: 10.1016/j.bbabio.2019.148133.
32886, doi: 10.1038/srep32886.
11.
Hirst, J. (2018) Open questions: respiratory chain super$
27.
Palam, L. R., Baird, T. D., and Wek, R. C. (2011) Phos$
complexes$why are they there and what do they do? BMC
phorylation of eIF2 facilitates ribosomal bypass of an inhib$
Biol., 16, 5$8, doi: 10.1186/s12915$018$0577$5.
itory upstream ORF to enhance CHOP translation, J. Biol.
12.
Maranzana, E., Barbero, G., Falasca, A. I., Lenaz, G., and
Chem., 286, 10939$10949, doi: 10.1074/jbc.M110. 216093.
Genova, M. L. (2013) Mitochondrial respiratory super$
28.
Fessler, E., Eckl, E. M., Schmitt, S., Mancilla, I. A.,
complex association limits production of reactive oxygen
Meyer$Bender, M. F., et al. (2020) A pathway coordinated
species from complex I, Antioxid. Redox Signal., 19, 1469$
by DELE1 relays mitochondrial stress to the cytosol,
1480, doi: 10.1089/ars.2012.4845.
Nature, 579, 433$437, doi: 10.1038/s41586$020$2076$4.
13.
Zong, S., Wu, M., Gu, J., Liu, T., Guo, R., and Yang, M.
29.
Timón Gómez, A., Nývltová, E., Abriata, L. A., Vila, A. J.,
(2018) Structure of the intact
14$subunit human
Hosler, J., and Barrientos, A. (2018) Mitochondrial
cytochrome c oxidase, Cell Res.,
28,
1026$1034,
cytochrome c oxidase biogenesis: recent developments,
doi: 10.1038/s41422$018$0071$1.
Semin. Cell Dev. Biol., 76, 163$178, doi: 10.1016/j.semcdb.
14.
Sinkler, C. A., Kalpage, H., Shay, J., Lee, I., Malek, M. H.,
2017.08.055.
Grossman, L. I., and Hüttemann, M. (2017) Tissue$ and
30.
Bourens, M., Boulet, A., Leary, S. C., and Barrientos, A.
condition$specific isoforms of mammalian cytochrome c
(2014) Human COX20 cooperates with SCO1 and SCO2
oxidase subunits: from function to human disease, Oxid. Med.
to mature COX2 and promote the assembly of cytochrome
Cell. Longev., 2017, 1534056, doi: 10.1155/2017/1534056.
c oxidase, Hum. Mol. Genet., 23, 2901$2913, doi: 10.1093/
15.
Goldberg, A., Wildman, D. E., Schmidt, T. R.,
hmg/ddu003.
Hüttemann, M., Goodman, M., Weiss, M. L., and
31.
Lobo$Jarne, T., Pérez Pérez, R., Fontanesi, F., Timón
Grossman, L. I. (2003) Adaptive evolution of cytochrome c
Gómez, A., Wittig, I., et al. (2020) Multiple pathways
oxidase subunit VIII in anthropoid primates, Proc. Natl. Acad.
coordinate assembly of human mitochondrial complex IV
Sci. USA, 100, 5873$5878, doi: 10.1073/pnas.0931463100.
and stabilization of respiratory supercomplexes, EMBO J.,
16.
Hallmann, K., Kudin, A. P., Zsurka, G., Kornblum, C.,
39, e103912, doi: 10.15252/embj.2019103912.
Reimann, J., et al. (2016) Loss of the smallest subunit of
32.
Kovářová, N., Č žková Vrbacká, A., Pecina, P., Stránecký, V.,
cytochrome c oxidase, COX8A, causes Leigh$like syndrome
Pronicka, E., Kmoch, S., and Houštěk, J.
(2012)
and epilepsy, Brain, 139, 338$345, doi: 10.1093/brain/awv357.
Adaptation of respiratory chain biogenesis to cytochrome c
17.
Ran, F. A., Hsu, P. D., Wright, J., Agarwala, V., Scott, D. A.,
oxidase deficiency caused by SURF1 gene mutations,
and Zhang, F. (2013) Genome engineering using the
Biochim. Biophys. Acta, 1822, 1114$1124, doi: 10.1016/
CRISPR$Cas9 system, Nat. Protoc.,
8,
2281$2308,
j.bbadis.2012.03.007.
doi: 10.1038/nprot.2013.143.
33.
Baertling, F., van den Brand, M. A. M., Hertecant, J. L.,
18.
Bednarczyk, P., Wieckowski, M. R., Broszkiewicz, M.,
Al$Shamsi, A., van den Heuvel, L. P., et al.
(2015)
Skowronek, K., Siemen, D., and Szewczyk, A. (2013)
Mutations in COA6 cause cytochrome c oxidase deficiency
Putative structural and functional coupling of the mito$
and neonatal hypertrophic cardiomyopathy, Hum. Mutat.,
chondrial BKCa channel to the respiratory chain, PLoS
36, 34$38, doi: 10.1002/humu.22715.
One, 8, e68125, doi: 10.1371/journal.pone.0068125.
34.
Baertling, F., Al$Murshedi, F., Sánchez$Caballero, L., Al$
19.
Wiedemann, F. R., Vielhaber, S., Schröder, R., Elger, C. E.,
Senaidi, K., Joshi, N. P., et al. (2017) Mutation in mito$
and Kunz, W. S. (2000) Evaluation of methods for the
chondrial complex IV subunit COX5A causes pulmonary
determination of mitochondrial respiratory chain enzyme
arterial hypertension, lactic acidemia, and failure to
activities in human skeletal muscle samples, Anal.
thrive, Hum. Mutat., 38, 692$703, doi: 10.1002/humu.
Biochem., 279, 55$60, doi: 10.1006/abio.1999.4434.
2321035.
20.
Pellegrino, M. W., Nargund, A. M., and Haynes, C. M.
35.
Schäfer, E., Seelert, H., Reifschneider, N. H., Krause, F.,
(2013) Signaling the mitochondrial unfolded protein
Dencher, N. A., and Vonck, J. (2006) Architecture of active
response, Biochim. Biophys. Acta,
1833,
410$416,
mammalian respiratory chain supercomplexes, J. Biol.
doi: 10.1016/j.bbamcr.2012.02.019.
Chem., 281, 15370$15375, doi: 10.1074/jbc.M513525200.
21.
Quirós, P. M., Langer, T., and López Ot n, C. (2015) New
36.
Qureshi, M. A., Haynes, C. M., and Pellegrino, M. W.
roles for mitochondrial proteases in health, ageing and dis$
(2017) The mitochondrial unfolded protein response:
ease, Nat. Rev. Mol. Cell Biol., 16, 345$359, doi: 10.1038/
Signaling from the powerhouse, J. Biol. Chem., 292, 13500$
nrm3984.
13506, doi: 10.1074/jbc.R117.791061.
БИОХИМИЯ том 86 вып. 1 2021
ПОСЛЕДСТВИЯ ОТСУТСТВИЯ COX8A
55
MOLECULAR AND FUNCTIONAL EFFECTS OF LOSS
OF CYTOCHROME c OXIDASE SUBUNIT 8A
D. Rotko1,2, A. P. Kudin1, G. Zsurka1,3, B. Kulawiak2, A. Szewczyk2, and W. S. Kunz1,3*
1 Institute of Experimental Epileptology and Cognition Research, Life & Brain Center,
University of Bonn, 53127 Bonn, Germany; E mail: wolfram.kunz@ukbonn.de
2 Laboratory of Intracellular Ion Channels, Nencki Institute of Experimental Biology,
Polish Academy of Sciences, 02 093 Warsaw, Poland
3 Department of Epileptology, University Bonn Medical Center, 53127 Bonn, Germany
In this work we studied molecular and functional effects of the loss of the smallest nuclear encoded subunit of
cytochrome c oxidase COX8A in fibroblasts from a patient with a homozygous splice site mutation and in
CRISPR/Cas9 genome$edited HEK293T cells. In both cellular model systems, between 20 to 30% of the residual
enzymatic activity of cytochrome c oxidase (COX) was detectable. In immunoblots of BN$PAGE separated mito$
chondria from both cellular models almost no monomers and dimers of the fully assembled COX could be visualized.
Interestingly, supercomplexes of COX formed with complex III and also with complexes I and III retained consider$
able immunoreactivity, while nearly no immunoreactivity attributable to subassemblies was found. That indicates that
COX lacking subunit 8A is stabilized in supercomplexes, while monomers and dimers are rapidly degraded. With tran$
scriptome analysis by 3′$RNA sequencing we failed to detect in our cellular models of COX8A deficiency transcrip$
tional changes of genes involved in the mitochondrial unfolded protein response (mtUPR) and the integrated stress
response (ISR). Thus, our data strongly suggest that the smallest subunit of cytochrome c oxidase COX8A is required
for maintenance of the structural stability of COX monomers and dimers.
Keywords: mitochondria, cytochrome c oxidase, subunit 8A, respiratory chain super complexes
БИОХИМИЯ том 86 вып. 1 2021