БИОХИМИЯ, 2021, том 86, вып. 1, с. 73 - 88
УДК 577.121.7
СПЕЦИФИЧЕСКИЕ ЭФФЕКТЫ АНИОНОВ
НА ЩЕЛОЧНОЕ СОСТОЯНИЕ ЦИТОХРОМА c
© 2021
Е. Седлак1,2, Т. Кожар2, Р. Вархач1, А. Мусатов3, Н. Томашкова1*
1 Department of Biochemistry, Faculty of Science, P. J. Šafárik University,
04154 Košice, Slovakia; e mail: natasa.tomaskova@upjs.sk
2 Centre for Interdisciplinary Biosciences, P. J. Šafárik University, 04154 Košice, Slovakia
3 Department of Biophysics, Institute of Experimental Physics, Slovak Academy of Sciences, 04001 Košice, Slovakia
Поступила в редакцию 28.08.2020
После доработки 10.11.2020
Принята к публикации 10.11.2020
Изучено специфическое влияние анионов на структуру и термостабильность, а также на пероксидазную ак
тивность нативного (состояние III) и щелочного (состояние IV) цитохрома с (cyt c) с помощью методов УФ
абсорбционной спектроскопии, собственной флуоресценции триптофана и кругового дихроизма. Терми
ческая и изотермическая денатурация, контролируемая, соответственно, по флуоресценции триптофана и
методом кругового дихроизма, предполагают более низкую стабильность cyt c в состоянии IV по сравнению
с состоянием III. Значения pKa щелочной изомеризации cyt c зависят от присутствующих солей, в соответ
ствии с эффектом Хофмейстера на стабильность белка, т.е. космотропные анионы увеличивают, а хаотроп
ные анионы уменьшают его значение. Пероксидазная активность cyt c в состоянии III, измеренная путём
окисления гваякола, показывает четкую зависимость от положения солей в ряду Хофмейстера, в то время
как cyt c в щелочном состоянии не проявляет пероксидазной активности независимо от типа анионов, при
сутствующих в растворе. Щелочная изомеризация cyt c в присутствии 8 М мочевины, измеренная по флуо
ресценции Trp59, предполагает существование высокоаффинного не природного для гемового железа ли
ганда даже при частично денатурированной конформации белка. Конформация cyt c в щелочном состоянии
в 8 М мочевине заметно модулируется специфическим эффектом анионов. Основываясь на снижении флуо
ресценции Trp59 при титровании до щелочного значения рН в 8 М мочевине и используя метод молекуляр
ной динамики, мы предполагаем, что Lys79 конформер является, скорее всего, доминирующим щелочным
конформером cyt c. Высокое сродство шестого лиганда к гемовому железу, вероятно, является причиной от
сутствия пероксидазной активности у cyt c в щелочной среде.
КЛЮЧЕВЫЕ СЛОВА: щелочная изомеризация, анионы Хофмейстера, псевдо пероксидазная активность.
DOI: 10.31857/S0320972521010061
ВВЕДЕНИЕ
рован как партнер взаимодействия для более
чем 250 различных биомакромолекул [8, 9]. Та
Цитохром c (cyt c) - это многофункциональ
кая многофункциональность cyt c, по видимо
ный гемопротеин, расположенный преимуще
му, возможна благодаря конформационной гиб
ственно на внешней стороне внутренней мито
кости его окисленного нативного складчатого
хондриальной мембраны, где он выполняет
состояния [10-13], что позволяет структуре бел
свою функциональную роль в качестве мобиль
ка существовать в различных альтернативных
ного переносчика электронов между комплек
конформациях, зависящих от условий окружаю
сом III и комплексом IV в дыхательной цепи.
щей среды (значения рН, локальных электри
Кроме того, cyt c способен катализировать пе
ческих полей и т.д.). Эти ненативные конформа
роксидазо подобные реакции [1], может функ
ции могут различаться в шестой аксильной ко
ционировать как ловушка супероксида [2-4] и
ординации (differ in sixth axial coordination), по
участвовать в инициации апоптоза после выхода
окислительно восстановительным параметрам,
в цитоплазму [5-7]. Более того, во внемитохон
сродству связывания и каталитической актив
дриальном пространстве cyt c был идентифици
ности белка [11, 14, 15].
Возможно одной из наиболее изученных не
нативных конформаций cyt c является так на
Принятые сокращения: cyt c - цитохром с; GdmCl -
гуанидинхлорид; КД - круговой дихроизм; МД - молеку
зываемое щелочное состояние или состоя
лярная динамика.
ние IV, которое характеризуется потерей шесто
* Адресат для корреспонденции.
го аксиального лиганда Met80 гемового железа
73
74
СЕДЛАК и др.
без существенного влияния на третичную и вто
Несмотря на интенсивные исследования,
ричную структуры белка [16-18]. Щелочная
функциональная роль щелочных состояний
трансформация cyt c представляет собой кон
cyt c до сих пор неизвестна. Эти не природные
формационное изменение, которое происходит
конфигурации cyt c, по видимому, похожи на
спонтанно в природном cyt c в интервале значе
более поздний промежуточный продукт, распо
ний рН 8,5-11 [19, 20]. В митохондриальном
ложенный вдоль складок [30, 36-38], но были
cyt c исследования рекомбинантной экспрес
также указания на то, что снижение окислитель
сии [21] при сочетании методов ЯМР [22] и ре
но восстановительного потенциала цитохрома c
зонансной Рамановской спектроскопии [23]
является следствием более открытой структу
показали, что Lys73 и Lys79, а также, возможно,
ры гемовой щели, что важно для работы cyt c как
Lys72 [24] в составе Ω петли фолдона, состоя
в цепи переноса электронов [23, 25, 39], так и в
щей из а.о. 70-85, заменяют нативный ли
апоптозе в связи с усилением активности перок
ганд Met80. Эта неоднородность щелочного
сидазы [11, 40-43]. Дискуссия о функциональ
состояния, представленная несколькими про
ной роли щелочно подобных состояний была
странственными конфигурациями, вероятно,
подогрета недавними открытиями некоторых
является причиной трудности получения его
посттранскрипционных модификаций cyt c
кристаллической структуры. Однако структуры
млекопитающих и некоторыми естественными
двойных и тройных мутантов cyt c дрожжей с
точечными мутациями, которые запускают кон
Lys73 в шестом аксиальном положении гемово
формацию белка, аналогичную состоянию IV,
го железа были определены методами ЯМР и
даже при физиологическом значении рН. Му
рентгеновской кристаллографии и представля
тант cyt c Gly41Ser [44, 45], а также Tyr48His [46]
ют собой хорошие структурные модели состоя
в гене cyt c человека индуцируют ранние щелоч
ния IV [6, 25].
ные переходы при нейтральном рН, которые
Результаты, полученные в экспериментах с
способствуют увеличению динамики Ω пет
использование кинетических методов останов
ли (40-57 а.о.), диссоциации Met80 и повыше
ленной струи и в экспериментах по обмену во
нию пероксидазной активности cyt c [43, 45].
дорода с использование ЯМР [10, 14, 23, 27-30]
Эти мутанты проявляли повышенную апопто
позволяют предположить, что механизм щелоч
тическую активность, вероятно, за счет усиле
ного перехода включает как минимум два этапа:
ния связывания и активации Apaf 1 или способ
ствуя реокислению cyt c, сборке апоптосом и их
Cyt3+ H (состояние III) ↔
активации [44]. Посттрансляционная модифи
кация cyt c, например нитрованием (остаток Tyr
↔ Cyt3+ (состояние III) + H ↔
в положении 74) и фосфорилированием (напри
мер, Tyr48), которая возникает при окислитель
↔ Cyt3+ (состояние IV).
ном стрессе, приводит к ослаблению аксиаль
ной связи Fe Met80. Таким образом, эта моди
Результатом первого шага является одново
фикация позволяет осуществлять щелочной пе
дородное депротонирование триггерной груп
реход при физиологическом рН, что, вероятно,
пы, приводящее к нативному депротонирован
связано с повышением пероксидазной актив
ному состоянию III cyt c с экспериментально
ности [15, 41, 47]. Несмотря на возникновение
определенной константой равновесия KH для
повышенной активности пероксидазы, эти мо
диссоциации протонов (pKH ~ 11) [27]. Эта ста
дификации оказывали антиапоптотическое воз
дия депротонирования связана со вторым эта
действие за счет снижения способности активи
пом, ограничивающим скорость конформаци
ровать каспазу 9 [41, 47]. Эти данные подтверж
онным изменением cyt c (с константой равнове
дают гипотезу о важной функции щелочной
сия KC для структурных изменений, pKC ~ -2),
конформации cyt c in vivo [17, 41, 43, 47-49].
что приводит к лигандному обмену Met80 на
С этой позиции возникает вопрос, связан
другой сильный лиганд [30]. Депротонирование
ный с пероксидазной активностью щелочной
триггерной группы в cyt c дикого типа с pKH ~ 11
конформации cyt c. Diederich et al. [50, 51] для
говорит в пользу остатков
72,
73 и/или
cyt c сердца лошади и McClelland et al. [52] для
79 [23, 31], но точная идентичность триггерной
tmK72 cyt c и cyt c 550 из Saccharomyces cerevisiae
группы все еще находится в стадии обсужде
показали, что пероксидазная активность белка
ния [15, 28, 32-34]. Следует отметить, что более
снижается с увеличением рН из за заме
поздние исследования указывают на то, что ще
ны Met80 аксиальным лигандом с сильным по
лочной переход является более сложным про
лем, который ингибирует его пероксидазную
цессом, состоящим из нескольких последующих
активность. С другой стороны, было сообщено,
и/или параллельных переходов [31, 35].
что cyt c с Lys в качестве шестого аксиального
БИОХИМИЯ том 86 вып. 1 2021
ЭФФЕКТ ХОФМЕЙСТЕРА ПРИ ЩЕЛОЧНОМ СОСТОЯНИИ ЦИТОХРОМА c
75
лиганда обладает повышенной пероксидазной
щению при 274 нм (ε ≈ 2550 M-1⋅см-1) [65]. Все
активностью [17, 48, 53, 54], что согласуется с
остальные химикаты были закуплены у компа
активностью cyt c при определенных естествен
ний «Fluka», Германия и «Sigma», США. Исход
ных мутациях и посттрансляционных модифи
ные растворы солей перед использованием
кациях [15, 41, 43, 45, 47].
фильтровали.
Общепризнано, что каталитическая перок
Флуоресцентно/эмиссионная спектроскопия.
сидазная активность cyt c коррелирует с наличи
Измерения флуоресценции проводили с по
ем популяции пятикоординатных высокоспи
мощью 10 мм кюветы на спектрофлуориметре
новых видов [17, 48, 55], которые являются
Varian Cary Eclipse («Varian», США), снабжён
следствием присущей этой популяции динами
ном Пельтье элементом. Щелочное титрование
ки в области гема [11, 56, 57]. Мы и другие ис
проводили путем добавления очень небольших
следователи ранее показали, что динамика
количеств концентрированного NaOH в раст
структуры белка может быть модулирована из
вор, содержащий либо 5 мМ какодилатный бу
менением физико химических свойств раство
фер, либо буфер с 8 М мочевиной и 0,5 М солью.
рителя солями, за счет эффекта, известного как
Температура в кюветах поддерживалась посто
эффект Хофмейстера, или специфический со
янной на уровне 20,0 ± 0,5 °С с помощью эле
левой эффект [58-61]. Модуляция динамики
мента Пельтье. При титровании регистрирова
структуры белка может оказывать влияние на
лись спектры эмиссионной флуоресценции cyt c
глобальную и локальную стабильность, конфор
в диапазоне 310-400 нм при длине волны воз
мационные переходы и активность фермен
буждения 290 нм. Концентрация cyt c в кювете
тов [57, 58, 62-64].
составляла 9 мкМ. В качестве эталона был взят
В настоящей работе мы проанализировали
спектр при рН 6,0.
структуру и термическую стабильность, а также
Кривые щелочной изомеризации строили в
пероксидазную активность, щелочного cyt c в
виде зависимости значений флуоресценции
присутствии анионов Хофмейстера. Показано,
при 350 нм от рН. Значения pKa кривых щелоч
что щелочное состояние cyt c имеет (i) компакт
ной изомеризации определяли по следующему
ную структуру с несколько меньшей изотерми
уравнению:
ческой стабильностью по сравнению с его натив
ным состоянием, и (ii) практически отсутствует
,
(1)
пероксидазная активность независимо от типа
аниона Хофмейстера, присутствующего в раство
рителе. Наши эксперименты предполагают силь
где f - фракция cyt c в щелочном состоянии, AN
ное сродство не природного лиганда к гемовому
и AD - интенсивность флуоресценции в точке
железу даже в присутствии высокой концентра
350 нм нативной и денатурированной форм, а
ции денатуранта. Моделирование молекулярной
n - число протонов, участвующих в переходе.
динамики (МД) в сочетании с эксперименталь
Значения рН измеряли непосредственно в кю
ными результатами свидетельствует о чрезвычай
ветах с помощью стеклянного микроэлектрода
но высоком сродстве лизина к гемовому железу.
Sensorex (до и после регистрации спектров).
Измерения термической стабильности. Терми
ческую денатурацию cyt c регистрировали при
МАТЕРИАЛЫ И МЕТОДЫ
длине волны возбуждения 290 нм и излучения -
350 нм, при постоянной скорости сканирова
Цитохром с из сердца лошади («Sigma»,
ния 1 °С/мин и в присутствии 0,5 М солей в
США) использовали без дополнительной очист
50 мМ натрий фосфатном буфере, рН 7,0, и
ки. Перед измерениями белок полностью окис
0,5 М солей в 50 мМ глицин NaOH буфере,
ляли добавлением 1 мкл 10 мМ K3[Fe(CN)6] к
рН 10,0. Конечная концентрация белка состав
2,5 мл образца. Концентрацию окисленно
ляла 9 мкМ. Кривые термической денатурации
го cyt c определяли спектрофотометрически по
cyt c были проанализированы с использованием
поглощению при 410 нм (ε ≈ 106 100 M-1⋅см-1)
следующего уравнения, описывающего двух
при рН 7,0 в 10 мМ натрий фосфатном буфере.
фазный переход:
Концентрацию 35% ного водного раствора пе
рекиси водорода без добавок («Centrachem»,
Словакия) определяли спектрофотометрически
по поглощению при 240 нм (ε ≈ 40 M-1⋅см-1) в
, (2)
дистиллированной воде. Концентрацию гваяко
ла (>99%) («Sigma», США) в исходном растворе
определяли спектрофотометрически по погло
БИОХИМИЯ том 86 вып. 1 2021
76
СЕДЛАК и др.
где Iobs - наблюдаемая интенсивность флуорес
водили в 10 мм кварцевой кювете. Использова
ценции при температуре T, IN и IU, а также
ли свежеприготовленный исходный раст
mN и mU представляют собой пересечения и на
вор H2O2, и его концентрацию проверяли спект
клоны (intercepts and slopes) нативных (предена
рофотометрически (ε240 = 40 M-1⋅cм-1). Реакцию
турированных) и развившихся (постденатури
образования тетрагуаякола контролировали
рованных) исходных линий соответственно,
при 470
нм с помощью спектрофотометра
а ΔHtrs - энтальпия при температуре перехо
Specord S300 UV VIS diode array («Analytik Jena
да Ttrs.
AG», Германия), оснащенного элементом
Измерения методом кругового дихроизма
Пельтье. Реакции измеряли при 20 °С в присут
(КД). После изотермической денатурации cyt c
ствии и в отсутствие 0,5 М солей в 10 мМ нат
гуанидинхлоридом (GdmCl) проводили измере
рий фосфатном буфере при рН
7,0-7,5;
ние КД в дальней УФ области при 220 нм в 1 мм
10 мМ Tris HCl при рН 8,0-8,5 и 10 мМ глицин
кювете с помощью спектрополяриметра JASCO
NaOH буфере при рН 9,0-10,0. Реакционные
J 810 («Jasco», Япония). Измерения КД прово
смеси содержали 1,8 мкМ cyt c, 1 мМ гваякола и
дили в растворе, содержавшем 25 мкМ cyt c в
соответствующую концентрацию (5-20 мМ) пе
5 мМ буфере натрий какодилат рН 6 и в 10 мМ
рекиси водорода. Реакцию запускали добавле
буфере натрий фосфатном/NaOH рН 11. Изме
нием H2O2, как сообщалось ранее [57].
рения проводили при 20 °C.
Моделирование методом молекулярной дина/
Свободная энергия разворачивания Гиббса
мики (МД). Конформации cyt c с шестым лиган
(ΔG), которая выражает стабильность белка, и
дом Lys72, Lys73 и Lys79 были построены вруч
величина m, которая зависит от площади поверх
ную с помощью визуализатора BIOVIA Discovery
ности белка, подвергнутого воздействию рас
Studio 2020 г. выпуска [68]. Нативная структура
творителя при разворачивании [66], были оце
cyt c, основанная на экспериментальной геомет
нены с применением нелинейного анализа наи
рии cyt c с разрешением 1,9 Å (PDB ID:
меньших квадратов, используемого в рассмат
1HRC) [69], была использована для построения
риваемой модели [67].
вышеупомянутых конформационных форм.
Комбинация программ Maestro/Desmond вы
. (3)
пуска 2020 г. [70] была использована для модели
рования различных конформационных состоя
В этой модели отражена наблюдаемая эл
ний cyt c, которые были сольватированы в каж
липтичность (θ) и концентрация денатуран
дом сайте связывания, используя программу
та [D], с входящими в неё параметрами ΔθN, ΔθU,
Maestro. На этом этапе была использована SPC
mN, mU, m и ΔG, соответствующими модели.
water Model [71] с молекулами воды в 1 нм буфе
Здесь ΔθN и ΔθU представляют собой пересече
ре вокруг конформеров cyt c. Полученные
ния базовых кривых преденатурации и постде
структуры были минимизированы и уравнове
натурации соответственно, а mN и mU представ
шены при первом 5 нс запуске NPT (давле
ляют собой наклоны исходных линий предена
ние 1,01325 бар) моделирования при 10 К. Для
турации и постденатурации соответственно.
проведения исследований моделирования ис
Значения ΔG и m представляют собой пересече
пользовалось силовое поле OPLS 2005 (совре
ние и наклон линейной экстраполяции проис
менная версия семейства силовых полей
ходящих изменений свободной энергии в зави
OPLS [72, 73]). Окончательные структуры были
симости от концентрации денатуранта. Это
подвергнуты в течение 10 нс NPT моделирова
уравнение учитывает линейную зависимость
нию (давление 1,01325 бар) с помощью прог
преденатурационной и постденатурационной
раммы Desmond при 300 К. Кроме того, веб сер
областей развернувшейся кривой [67].
вис ChExVis [74] был использован для прогнози
Измерения методом абсорбционной спектро/
рования внутримолекулярных каналов всех че
скопии. Спектры поглощения измеряли в 10 мм
тырех конформационных форм cyt c.
кювете на спектрофотометре Varian Cary Bio
100 («Varian», США), оснащенном элементом
Пельтье. Спектры поглощения измеряли в диа
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
пазоне 600-800 нм в присутствии и в отсутствие
8 М мочевины и 0,5 М солей (Na2HPO4, NaCl и
Специфическое влияние анионов на щелочную
NaSCN) в 10 мМ натрий фосфатном буфере при
изомеризацию и термостабильность cyt c. Тот
рН 7, 10 и 12. Концентрация cyt c составляла
факт, что соли влияют на щелочной пере
100 мкм.
ход cyt c, был недавно продемонстрирован на
Кинетические исследования пероксидазной
ряде солей Хофмейстера [62]. В данной работе,
активности цитохрома c. Анализ активности про
по сравнению с предыдущей, мы еще больше
БИОХИМИЯ том 86 вып. 1 2021
ЭФФЕКТ ХОФМЕЙСТЕРА ПРИ ЩЕЛОЧНОМ СОСТОЯНИИ ЦИТОХРОМА c
77
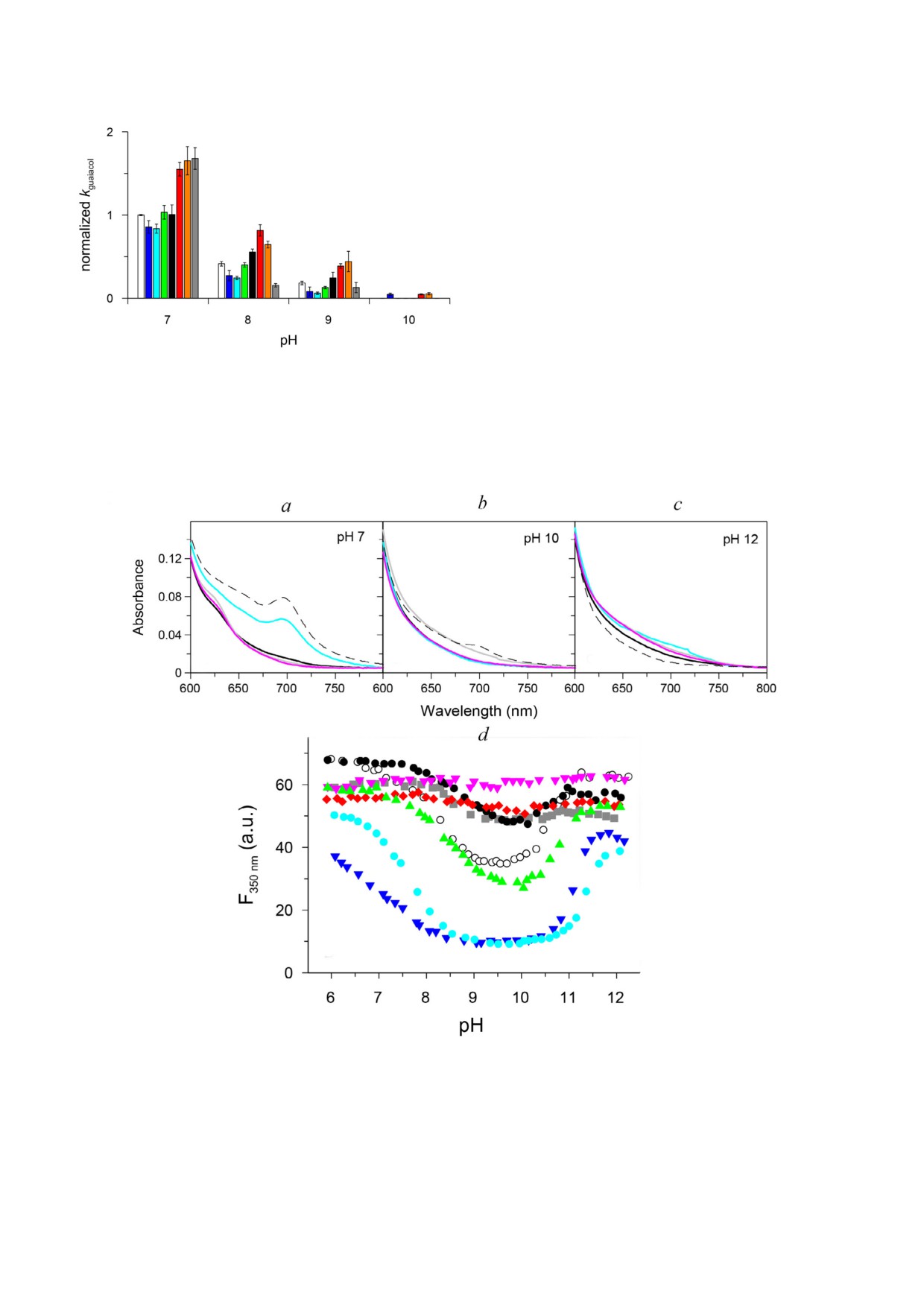
Рис. 1. Температурная денатурация cyt c в отсутствие соли (белые кружки) и в присутствии 0,5 М солей: Na2HPO4 (голу
бые кружки), Na2SO4 (синие перевернутые треугольники), CH3COONa (зеленые треугольники), NaCl (черные кружки),
NaBr (красные ромбы), NaClO4 (серые квадраты) и NaSCN (пурпурные перевернутые треугольники) в 50 мМ натрий фос
фатном буфере, рН 7 (а) и в 50 мМ глицин NaOH буфере, рН 10 (b). Интенсивность флуоресценции контролировалась
при длине волны излучения 350 нм после возбуждения при длине волны 290 нм. с - Корреляция между значениями pKa
и Tm, полученными в присутствии исследуемых солей (коэффициент корреляции линейной зависимости равен 0,8895).
journal/biokhsm/.)
расширили количество изученных солей. Полу
ценции при рН 7 и 10 (рис. 1, a и b), и получен
ченные значения pKa щелочной изомеризации
ные значения Tm приведены в табл. S2 Прило
cyt c (табл. S1 в Приложении) наглядно демон
жения. Тепловые переходы цитохрома с при всех
стрируют специфическое действие анионов в
исследованных условиях делают очевидным
зависимости от их положения в ряду Хофмейс
двойной характер его состояний. Температуры
тера. Фактически, щелочное состояние, состоя
перехода определяли путем внесения экспери
ние IV, стабилизируется хаотропными анионами
ментальных данных в уравнение 2. При низкой
по мере уменьшения значений pKa в процессе
ионной силе температура перехода cyt c при
перехода, т.е. состояние III cyt c дестабилизиру
рН 10 (79,5 °C) была примерно на 6 °C ниже по
ется в направлении от космотропных к хаотроп
сравнению с температурой при рН 7 (85,6 °C).
ным анионам.
Такая же тенденция наблюдалась и в присут
Специфическое влияние анионов на термо
ствии 0,5 М анионов. Значения температур пе
стабильность cyt c в состояниях III и IV изучали
рехода cyt c при рН 10 были во всех солях, кроме
путем мониторинга интенсивности флуорес
того, в присутствии хаотропного перхлората и
БИОХИМИЯ том 86 вып. 1 2021
78
СЕДЛАК и др.
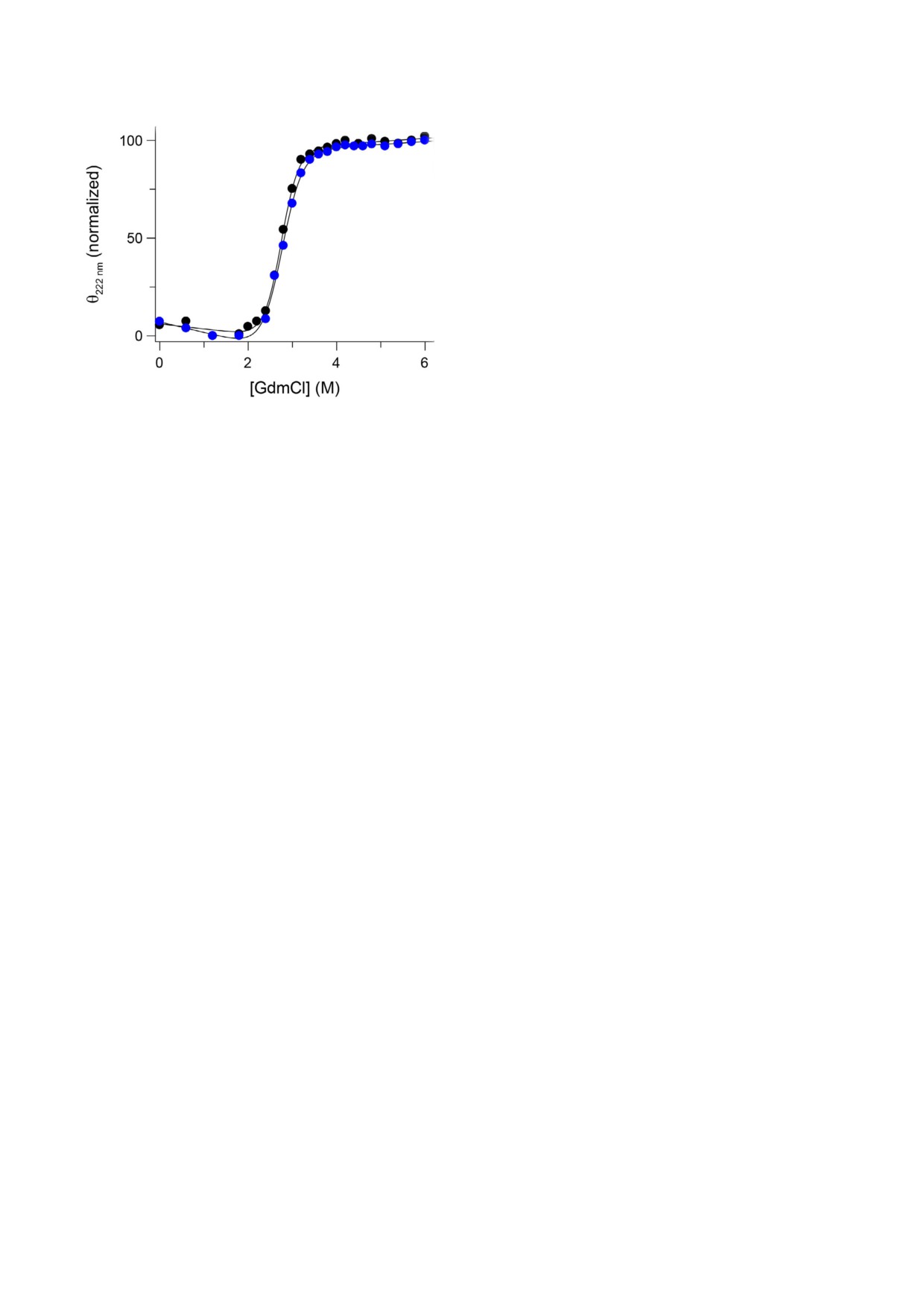
термодинамических параметров для нативного
цитохрома с при рН 6 (m = 12,7 ± 0,7 кДж/моль/м
и ΔG = 34,9 ± 2,1 кДж/моль) и щелочного цито
хрома с при рН 11 (m = 10,9 ± 0,6 кДж/моль/м
и ΔG = 29,9 ± 1,6 кДж/моль). Эти результаты
свидетельствуют о том, что в нативном состоя
нии cyt c имеет более высокую стабиль
ность ~5 кДж/моль, чем в щелочном состоянии,
что согласуется с результатами термической де
натурации. Полученные значения m, пропорци
ональные площади поверхности белка, обра
щённой в растворитель [66], позволяют предпо
ложить, что развернутая конформация обоих
состояний III и IV аналогична, а структура ще
лочного состояния несколько более открыта по
сравнению с нативным состоянием cyt c.
Рис.
2. Изотермическая денатурация cyt c в присут
Пероксидазная активность щелочного цито/
ствии GdmCl в 5 мМ натрий какодилате, рН 6 (чёрный) и
хрома с в присутствии анионов. Пероксидазную
в 10 мМ натрий фосфат/NaOH, рН 11 (синий), сопровож
активность cyt c в диапазоне рН 7-10 определя
дающаяся эллиптичностью при 222 нм
ли при окислении гваякола, как было описано
ранее [57]. При рН 7 у cyt c равномерно увеличи
тиоцианата они были ниже по сравнению со
валась пероксидазная активность, начиная от
значениями при рН 7 (табл. S2 в Приложении).
присутствия космотропных и до хаотропных
При обоих рН термостабильность cyt c плавно
анионов. Действительно, константа скорости
снижается от космотропных к хаотропным ани
второго порядка пероксидазной активности
онам (рис. 1, а и b; табл. S2 в Приложении) в со
cyt c увеличивалась в 2,5 раза в присутствии ха
ответствии с известным эффектом Хофмейстера
отропных анионов по сравнению с таковой в
на стабильность белка [75].
присутствии космотропных анионов или в отсу
Отметим, что интенсивность флуоресцен
тствие солей (рис. 3, табл. S3 в Приложении).
ции при термической денатурации при рН 10
Однако при постепенном увеличении рН конс
была примерно в два раза ниже, чем при рН 7,
танта скорости второго порядка пероксидазной
что свидетельствует о более компактном состоя
активности cyt c снижалась независимо от типа
нии термически денатурированного цитохро
аниона, и при рН 10 пероксидазная активность
ма с при щелочном рН, чем при нейтраль
cyt c не обнаруживалась. Отметим, что в присут
ном рН (рис. 1, а и b). График зависимости вели
ствии 0,5 М перхлората пероксидазная актив
чины pKa от температуры перехода цитохрома с
ность cyt c наиболее высока при рН 6, но эта ак
в присутствии исследуемых солей демонстриру
тивность исчезает уже при рН 8. Это наблюде
ет корреляцию, указывающую на взаимосвязь
ние ясно показывает, что пероксидазная актив
между этими параметрами (рис. 1, c).
ность cyt c исчезает при переходе его в состоя
Изотермическая денатурация цитохрома с в
ние IV (pKa щелочной изомеризации cyt c в при
нативном и щелочном состояниях. Для сравнения
сутствии 0,5 М NaClO4 составляет ~7,5), что со
стабильности нативного и щелочного состоя
гласуется с ингибированной пероксидазной ак
ний cyt c мы также провели эксперименты по
тивностью cyt c в присутствии всех исследуемых
изотермической денатурации, контролируя зна
солей при рН 10.
чения эллиптичности при 220 нм в присутствии
Влияние анионов на щелочную изомеризацию
гуанидинхлорида (рис. 2). GdmCl индуциро
денатурированного cyt c. Анализ щелочной изо
ванное разворачивание нативного и щелочного
меризации cyt c в присутствии 8 М мочевины
состояний cyt c было обратимым, что позволило
позволил проверить гипотезу о том, что срод
применить равновесный термодинамический
ство Lys к гемовому железу при щелочном зна
анализ. Значения эллиптичности, измеренные
чении рН сохраняется даже в таких суровых ус
при 220 нм, были нормированы по минималь
ловиях. При инкубации cyt c в 8 М мочевине на
ным и максимальным значениям эллиптичнос
тивный лиганд гемового железа в cyt c, Met80,
ти в исследуемом диапазоне концентраций де
заменяется другим сильным лигандом, His33,
натуранта. Экспериментальные данные эллип
при этом небольшая часть cyt c находится в не
тичности, в зависимости от концентра
упорядоченном состоянии, похожем на пента
ции GdmCl, были получены в соответствии с
координированное [76]. Фактически, именно на
уравнением 3. В результате был получен набор
это указывает спектр поглощения cyt c в 8 М мо
БИОХИМИЯ том 86 вып. 1 2021
ЭФФЕКТ ХОФМЕЙСТЕРА ПРИ ЩЕЛОЧНОМ СОСТОЯНИИ ЦИТОХРОМА c
79
чевине в области 600-700 нм (рис. 4, а): (i) поло
са 695 нм отсутствует и (ii) присутствует слабая
полоса 620 нм (показатель высокоспинового
состояния гемового железа), соответствую
щая ~5% от высокоспинового состояния cyt c,
наблюдаемого при низкой ионной силе при
рН 2. Щелочную изомеризацию в 8 М мочевине
можно проследить с помощью другой характе
ристики cyt c - собственной флуоресценции
триптофана. Cyt c содержит только один остаток
триптофана (Trp59), который погружён в гемо
вую щель вблизи гема и отражает малейшие из
менения своего (Trp59) расстояния от гема [77].
Рис. 3. Зависимость нормированного коэффициента конс
В нативной конформации cyt c флуоресцентное
танты скорости второго порядка пероксидазной активнос
излучение триптофана гасится за счет переноса
ти cyt c, измеренного при окислении гваякола, от рН в гемом энергии Фестера [55], но при рН 7 в
присутствии и в отсутствие разного рода солей: без со
8 М мочевине интенсивность флуоресценции
ли (белый), Na2HPO4 (голубой), Na2SO4 (синий),
CH3COONa (зеленый), раствор NaCl (черный),
cyt c достигает
~60-65% от флуоресцен
NaBr (красный), NaNO3 (оранжевый) и NaClO4 (серый)
ции NATA (N ацетил L триптофанамида) -
Рис. 4. Спектры поглощения cyt c в области 600-800 нм, измеренные при рН 7 (а), рН 10 (b) и РН 12 (c) в буфере (пунк
тирная линия) и в присутствии 8 М мочевины при рН 7, 10 и 12 в отсутствие солей (серая линия) и в присутствии
0,5 М Na2HPO4 (голубая линия), 0,5 М NaCl (черная линия) и 0,5 М NaSCN (пурпурная линия). d - Зависимости интен
сивности флуоресценции cyt c при 350 нм в 8 М мочевине в отсутствие соли в 5 мМ какодилатном буфере (белые кружки)
и в присутствии 0,5 М натриевых солей: Na2HPO4 (голубые кружки), Na2SO4 (синие перевернутые треугольники),
CH3COONa (зеленые треугольники), NaCl (черные кружки), NaBr (красные ромбы), NaClO4 (серые квадраты) и
NaSCN (пурпурные перевернутые треугольники)
БИОХИМИЯ том 86 вып. 1 2021
80
СЕДЛАК и др.
аналога остатка триптофана (данные не приве
Анионы Хофмейстера существенно влияют
дены).
на pH переходы cyt c в 8 М мочевине. В присут
Щелочная изомеризация cyt c в 8 М мочеви
ствии космотропных анионов (фосфатов и суль
не в интервале рН 6-12 явно указывает на три
фатов) снижение флуоресценции наиболее вы
переходные состояния (рис. 4): (i) первый пере
ражено, в то время как в присутствии хаотро
ход состоит в неожиданном снижении флуорес
пов (тиоцианата и перхлората) изменения флуо
ценции почти во всех условиях (кроме присут
ресценции триптофана довольно незначитель
ствия тиоцианата) со значением pKa 7,7-9,1
ны (рис. 4, d).
(табл. S4 в Приложении), а значение n ~1 гово
Основываясь на анионзависимом снижении
рит о том, что депротонированию подверглась
флуоресценции триптофана, мы предполагаем,
одна группа. Эти переходы отражают изменение
что анионы в щелочном состоянии не стабили
конформации молекул, находящихся в состоя
зируют одинаково все возможные состояния ли
нии низкоспинового гемового железа (рис. 4, а),
гирования. Для решения этой гипотезы мы ис
и небольшой популяции молекул с высокоспи
следовали молекулярную динамику cyt c в раз
новым гемом железа (в случае хаотропов) в дру
личных лигированных состояниях: Met80,
гое низкоспиновое состояние гемового железа
Lys79, Lys73 и Lys72.
(рис. 4, b); (ii) второй переход заключается в уве
Моделирование МД различных лигированных
личении флуоресценции триптофана до исход
состояний cyt c. Моделирование МД различных
ного, т.е. на уровне рН
6, со значения
связанных состояний cyt c предсказывает раз
ми pKa 11,0 ± 0,4 и значениями n ~(2-3), подра
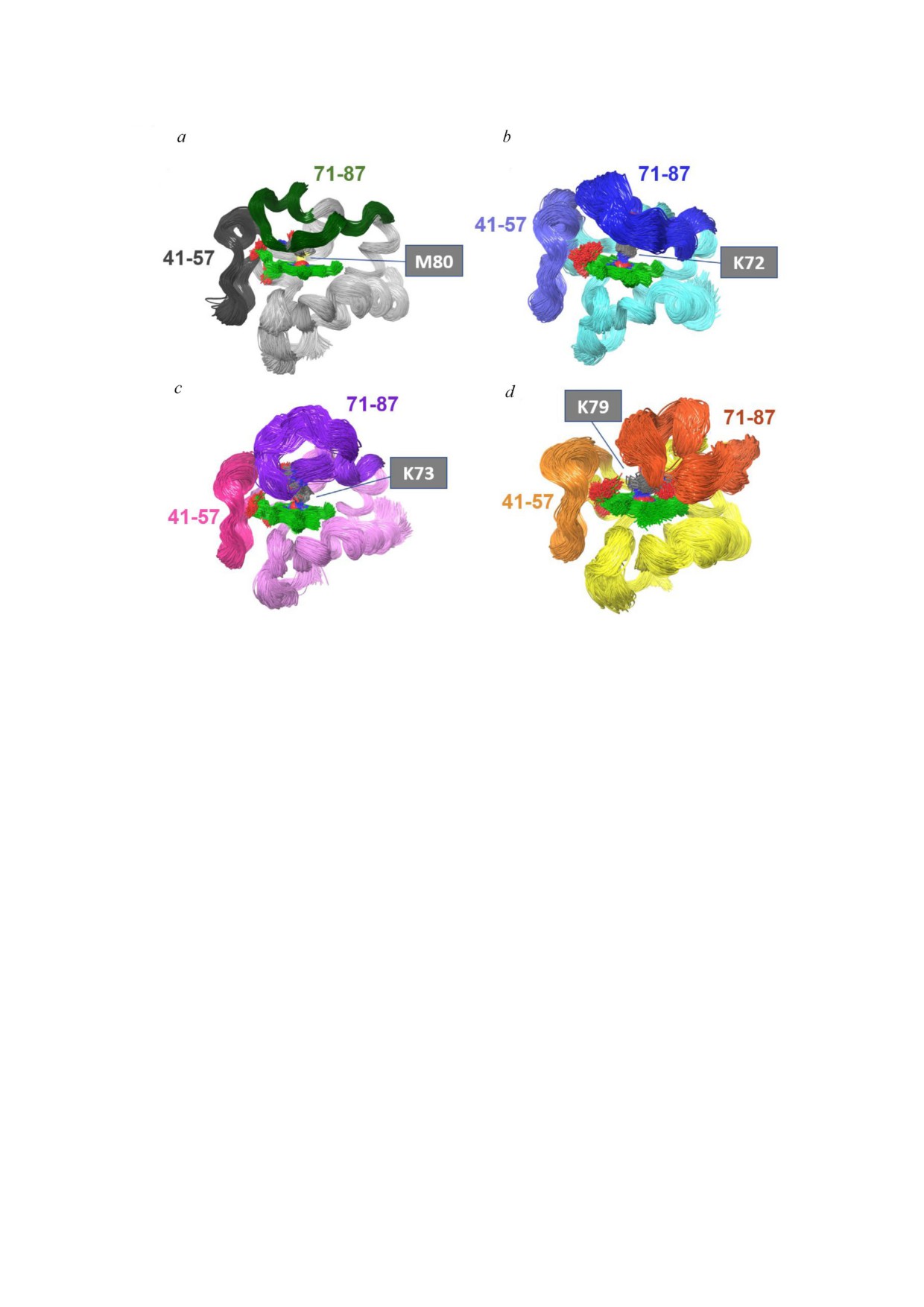
личную ориентацию (рис. 5) и различную гиб
зумевающими более чем одну группу, подверга
кость конформации петель (рис. 6). На рис. 5
ющуюся депротонированию (табл. S4 в Прило
показана исходная геометрия для моделирова
жении). Окончательная конформация cyt c во
ния. Желтым цветом выделены конформации
втором переходе представлена низкоспиновым
петель (71-87 а.о.), содержащих Met80, Lys72,
гемом железа (рис. 4, с). Эти переходы, скорее
Lys73 и Lys79. В то время как небольшие кон
всего, представляют собой щелочно подобные
формационные изменения необходимы для ко
переходы к конформации Lys гемового железа
ординационного обмена Met80 на Lys79, боль
при более низких значениях рН (6-10), т.е. в IV
ший конформационный сдвиг необходим для
подобное состоянию, и переход в V подобное
того, чтобы Lys72 или Lys73 взаимодействовали
состояние в диапазоне pH 10-12.
с гемовым железом. Этот конформационный
сдвиг связан с большей гибкостью этой петли по
сравнению с нативной формой cyt c. Более зна
чительная гибкость петли (71-87 а.о.), когда
Lys72, Lys73 или Lys79 координационно связы
ваются с гемовым железом, проиллюстрирована
на рис. 6, b-d на схемах петель различной окрас
ки. Эти результаты хорошо согласуются с дан
ными Oviedo Rouco et al. [78], которые предска
зали, что сегменты петли (71-87 а.о.) и пет
ли (41-57 а.о.) будут более гибкие для конфор
меров, содержащих Lys в положении шестого
лиганда. Сравнение гибкости петель показано
на рис. 6, где cyt c представлен в виде ленты с от
меченными аминокислотами, координационно
связывающимися с атомом гемового железа.
Визуализируется около 1000 конформаций для
всех форм cyt c, которые были сохранены при
10
нс МД моделировании в водной среде
(рис. S1 и S2 в Приложении).
Координационная связь Fe S, возникающая
в случае Met80 и нативного cyt c (рис. 6, а), веро
Рис. 5. Суперпозиция нативной структуры цитохрома c, а
ятно, приводит к более высокой стабилизации
также различных конформаций, в которых различные ли
геометрии петли, чем координационная связь
зины образуют координационную связь с гемовым желе
Fe N, которая имеется в случае Lys72, Lys73 и
зом. Гибкость петли выделена светло оранжевым цветом, а
Lys79. Как следствие, в случае конформеров Lys
стрелки иллюстрируют движение петли, облегчающее взаи
модействие K72, К73 или К79 с гемовым железом. (Обо
гибкость петли, по видимому, выше (рис. 6, b-d).
значения: K - остаток Lys, М - Met, W - Trp)
Интересно, что аминокислоты сегмента пет
БИОХИМИЯ том 86 вып. 1 2021
ЭФФЕКТ ХОФМЕЙСТЕРА ПРИ ЩЕЛОЧНОМ СОСТОЯНИИ ЦИТОХРОМА c
81
Рис. 6. Конформационные ансамбли различных форм cyt c по отношению к координации гема железо-сера (для случая
Met80) и координации азот-железо (в случае Lys72, Lys73 и Lys79). Различными цветами обозначены петли (41-57 а.о.) и
(71-87 а.о.). При координационном связывании Lys с гемовым железом была обнаружена бóльшая гибкость петель, чем
при координационной связи с серой нативного cyt c. (Обозначения: K - остаток Lys, М - Met)
ли (41-57 а.о.), которые не находятся в прямом
и IV в однонаправленного транспортёра элект
взаимодействии с гемовым железом, также об
рона (к комплексу IV) с возможной регулятор
ладают более высокой гибкостью в случае Lys
ной ролью in vivo [19, 81]. Однако только недав
конформеров по сравнению с нативным состоя
но было обнаружено, что некоторые естествен
нием cyt c.
ные мутации [43, 45, 82, 83] и посттрансляцион
ные модификации [15, 41, 47, 84] смещают ще
лочную изомеризацию в нейтральную, близкую
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
к физиологической, область значений рН.
Предполагается, что щелочное состояние играет
Щелочное состояние cyt c, включающее в се
определенную роль в проапоптотических собы
бя смесь по меньшей мере двух конформаций с
тиях, во время которых cyt c повышает свою
ненативными лигандами гемового железа, явля
способность катализировать пероксидазную ре
ется единственным из пяти различных состоя
акцию [17, 26, 41, 49, 52]. Систематически сооб
ний, кроме нативного, в диапазоне рН 0-14, с
щалось, что в условиях, благоприятствующих
низкоспиновым состоянием гемового желе
состоянию IV, как образца аксиального взаимо
за [79]. Цитохром c в состояниях III и IV имеет в
действия, cyt c обладает повышенной перокси
целом сходные свойства, которые суммированы
дазной активностью по сравнению с состояни
в таблице. Однако пониженный восстановитель
ем III [48, 53, 54]. Интересно, что в cyt c как в
ный потенциал в состоянии IV, по сравнению с
состоянии III, так и в состоянии IV, присутству
состоянием III, привлёк большое внимание.
ют низкоспиновые формы гемового железа, что
Действительно, более низкий (на 0,3-0,5 В) вос
означает наличие сильного шестого аксиально
становительный потенциал cyt c в состоя
го лиганда и, следовательно, отсутствие перок
нии IV [53, 80] превращал cyt c из обратимого
сидазной активности. Гемовый белок, способ
переносчика электрона между комплексами III
ный катализировать пероксидазные реакции,
6 БИОХИМИЯ том 86 вып. 1 2021
82
СЕДЛАК и др.
должен находиться в пента координированном
Из за сопоставимости стабильности состоя
состоянии с вакантным шестым сайтом, что яв
ний III и IV (рис. 2) мы предположили анало
ляется неизбежным условием доступности ак
гичное влияние анионов Хофмейстера на пе
тивного участка для субстрата. Действительно,
роксидазную активность состояния IV, как это
было показано, что пероксидазная активность
наблюдалось для состояния III. Однако во всех
cyt c является результатом временно формирую
изученных условиях, с солями или без них, cyt c
щегося пента координированного состояния
в состоянии IV обладает незначительной перок
гема. Это считается следствием присущей дан
сидазной активностью. Наше объяснение этого
ной области гема динамики - обратимого раз
наблюдения состоит в том, что Met80, шестой
ворачивания наименее стабильных фолдонов
лиганд состояния III, находится в относительно
cyt c [57], т.е. так называемых инфракрасных и
лабильном положении, конкурируя с другими
красных фолдонов, состоящих из а.о. 41-57 и
аминокислотными остатками (Lys) за связь с ге
71-87 соответственно [85]. Это предположение
мовым железом, как это следует из детального
основано на экспериментальных наблюдениях
анализа спектральных свойств cyt c, выполнен
связывания малых лигандов, таких как циа
ного группой Schweitzer Stenner [97, 98]. По
нид [60, 86, 87] или имидазол [88], с гемовым
видимому, следствием этой конкуренции за ге
железом. Основываясь на наших выводах о том,
мовое железо является существование популя
что анионы Хофмейстера влияют на динамику в
ции в пента координированном состоянии,
области гема, как показано на анионной зависи
способной катализировать пероксидазные ре
мости константы скорости связывания цианида
акции. С другой стороны, несмотря на анало
с гемовым железом [60], мы предположили, что
гичную гетерогенность щелочного состояния
эффект Хофмейстера должен влиять также на
cyt c, представленную наличием двух гем же
пероксидазную активность cyt c в состоянии III.
лезных лигандов, Lys73 и Lys79 [31], перокси
Фактически, полученные результаты перокси
дазная активность этого состояния ингибирует
дазной активности cyt c, контролируемой окис
ся. По видимому, координационная связь Lys73
лением гваякола (рис. 3), подтверждают эту ги
и Lys79 с гемовым железом при щелочном зна
потезу. Показано, что пероксидазная актив
чении рН прочна и ограничена в диссоциации,
ность cyt c в присутствии солей возрастает в
препятствуя таким образом образованию пен
направлении от космотропных к хаотропным
та координированного состояния. Мы прове
анионам в соответствии с повышенной динами
рили прочность этой координационной свя
кой в области гема. Это согласуется с нашей
зи(ей) титрованием cyt c до щелочного значе
предыдущей работой, в которой мы наблюдали
ния рН в присутствии 8 М мочевины с солями
повышенную окислительную модификацию
Хофмейстера и без них (рис. 4). Russell и Bren
cyt c перекисью водорода в присутствии хаот
[76] показали, что cyt c в присутствии 8 М моче
ропных, по сравнению с космотропными, анио
вины существует в трёх (по крайней мере) попу
нов [89]. Однако в то время, при измерении ме
ляциях, где шестой лиганд свободен либо занят
тодом FOX2, мы не наблюдали разницы в перок
Lys79 или His 33. При титровании до щелочного
сидазной активности cyt c, что свидетельствует о
значения рН равновесие этих популяций, веро
его меньшей чувствительности по сравнению с
ятно, смещается в сторону лиганда(ов) Lys.
методом, основанном на окислении гваякола.
Действительно, мы наблюдали снижение флуо
В наших исследованиях, посвященных эф
ресценции Trp59 при рН 10 в отсутствие солей,
фекту Хофмейстера, мы отмечали, что анионы
что свидетельствует о более компактном состо
влияют не только на динамику cyt c в области ге
янии со значением pKa, сопоставимым со зна
ма, но и на значения pKa в его щелочном состо
чениями щелочной изомеризации cyt c в присут
янии [62]. Этот вывод согласуется с наблюдени
ствии хаотропных солей в отсутствии моче
ями локальной дестабилизации Ω пет
вины.
ли (70-85 а.о.) в результате мутаций [90-93],
Компактность такого щелочно подобного
посттрансляционной модификации [41, 43, 47,
состояния (в 8 М мочевине) cyt c, по видимому,
49, 55], физико химических факторов, таких как
может модулироваться солями Хофмейстера. В
повышенная концентрация денатурантов [76]
присутствии космотропных сульфатных и фос
или температура [94-96], что снижает значе
фатных солей снижение наиболее выражено, в
ния pKa щелочной изомеризации cyt c. Наши
то время как в присутствии хаотропных солей,
результаты подтверждают этот вывод, как видно
таких как тиоцианат натрия, щелочной переход
из корреляции между стабильностью в целом,
не наблюдается (рис. 4, d). Это говорит о том,
представленной значениями Tm, и значения
что соли хаотропа дестабилизируют координа
ми pKa, наблюдаемыми в присутствии со
ционную связь в щелочно подобном состоянии
лей (рис. 1, с).
cyt c в присутствии 8 M мочевины, в отличие от
БИОХИМИЯ том 86 вып. 1 2021
ЭФФЕКТ ХОФМЕЙСТЕРА ПРИ ЩЕЛОЧНОМ СОСТОЯНИИ ЦИТОХРОМА c
83
Сравнение структурных свойств, аксиального лигирования, спинового состояния, физического и термодинамического,
а также активности в нативном (состояние III) и щелочном (состояние IV) состояниях cyt c
Феррицитохром c
Нативное состояние III
Щелочное состояние IV
третичный
глобулярная упаковка [69, 102, 103]
глобулярная упаковка [25, 26]
вторичный
пять α спиралей и два коротких β
то же, что и нативное состояние III (не повлияло) [16, 18]
слоя, взаимосвязанных Ω петлями
[69, 102, 104-106]
щель гема
• закрытая форма [107]
• закрытая форма [104], более 20% выявленного гема,
• широкая сеть водородных связей
чем в нативном состоянии [25]
[69, 108, 109]
• искажение в сети H связей между складками Ω петли
(70-85 и 40-57) [15, 83, 110]
Шестой аксиальный
Met80 [69, 102, 111]
Lys73/79/72 [21-23, 27, 90, 112-115]
лиганд
Спиновое состояние
низкое [69, 116, 117]
низкое [20, 118]
гемового железа
Восстановительный
+255 мВ при pH 7 [115, 119-122]
• +120 мВ при pH 10 [27, 123]
потенциал
• на 0,3-0,5 В ниже, чем состояние III [53, 80]
Стабильность
• изотермальная денатурация:
• изотермальная денатурация: ~ 30 кДж/моль [данная
~ 34-35 кДж/моль [124, данная работа]
работа]
• температурная денатурация:
• температурная денатурация: 79,5 ± 0,3 °C [данная
85,6 ± 0,1 °C (данная работа)
работа]
• основанное на редокс потенциале
состояние III на ~42 кДж/моль более
стабильно, чем состояние IV [80]
Пероксидазная
низкая пероксидазная активность [7]
• повышенная пероксидазная активность [48, 53, 54]
активность
• нет пероксидазной активности [50-52, данная работа]
космотропных солей, которые оказывают силь
носительно связи железо Met80 гораздо боль
ное стабилизирующее действие на эту связь.
шее структурное нарушение происходит для ге
Предполагая, что разные лиганды в щелочно
мового лиганда в положении 73, чем для лиган
подобном состоянии обладают разной стабиль
да в положении 79, когда он замещает Met80.
ностью по аналогии с ситуацией при нейтраль
Наше МД моделирование показало, что струк
ном значении pH [99], мы попытались опреде
турные возмущения во время щелочной изоме
лить наиболее стабильный конформер щелоч
ризации были связаны с одним специфическим
ного состояния на основе расстояния меж
фолдоном Ω петли (70-85 а.о., красный фол
ду Trp59 и гемовым железом. МД моделирова
дон) в сочетании с фолдоном Ω петли
ние показало, что самое короткое расстояние
(40-57 а.о., черный, называемый также инфрак
между Trp59 и гемовым железом, соответствую
расным, фолдон), что согласуется с теорией
щее наиболее компактному состоянию, было
фолдона Englander [100, 101] и работами Oviedo
получено для Lys79 конформера
(~8,9
Å)
Rouco et al. [15, 78].
(рис. 6). Расстояние для нативного состояния с
лигандом Met80 составляет ~9,2 Å, а для кон
В заключение мы показываем, что образова
формеров Lys72 и Lys73 - это ~9,3 Å. Хотя эти
ние щелочного состояния цитохрома c коррели
задачи не обязательно должны соответствовать
рует со стабильностью белка и может модулиро
ситуации в случае щелочного состояния, иден
ваться солями Хофмейстера посредством спе
тификация Lys79, как наиболее стабильного
цифического анионного эффекта. Мы пришли к
конформера щелочного состояния, согласуется
выводу, что конформационная стабильность
с работой Maity et al. [14]. Работа Nelson и
состояний III и IV сравнима, но, в отличие от
Bowler [29] с изоформой 1 cyt c также свидетель
состояния III, щелочное состояние не обладает
ствует в пользу роли Lys79 как наиболее ста
пероксидазной активности, что указывает на
бильной щелочной формы cyt c. Они показали,
присутствие сильного лиганда, скорее всего,
что из за структурной близости Lys73 и Lys79 от
Lys79.
БИОХИМИЯ том 86 вып. 1 2021
6*
84
СЕДЛАК и др.
Финансирование. Эта работа была поддержа
Конфликт интересов. Авторы заявляют об от
на исследовательским грантом, предоставлен
сутствии прямого или потенциального конф
ным Словацким агентством исследований и
ликта интересов, связанного с публикацией
разработок (грант № APVV 15 0069) и гранто
этой статьи.
вым агентством Министерства образования, на
Соблюдение этических норм. Эта статья не
уки, исследований и спорта Словацкой Респуб
содержит описания исследований, выполнен
лики (грант № VEGA 2/0009/17). Данная публи
ных авторами с участием человека или живот
кация является результатом реализации проек
ных в качестве объектов.
та: Открытое научное сообщество для современ
Дополнительные материалы. Приложение к
ных междисциплинарных исследований в меди
статье на английском языке опубликовано на
цине (Акроним: OPENMED), ITMS2014 +:
сайте журнала «Biochemistry» (Moscow) (http://
313011V455 при поддержке Интегрированной
protein.bio.msu.ru/biokhimiya/) и на сайте изда
инфраструктуры операционной программы,
финансируемой ЕФРР.
journal/10541), том 86, вып. 1, 2021.
СПИСОК ЛИТЕРАТУРЫ
1.
Radi, R., Turrens, J. F., and Freeman, B. A. (1991) Cyto
12.
Schweitzer Stenner, R. (2018) Relating the multi func
chrome c catalyzed membrane lipid peroxidation by
tionality of cytochrome c to membrane binding and struc
hydrogen peroxide, Arch. Biochem. Biophys., 288, 118 125,
tural conversion, Biophys. Rev.,
10,
11511185,
doi: 10.1016/0003 9861(91)90172 f.
doi: 10.1007/s12551 018 0409 4.
2.
Atlante, A., Calissano, P., Bobba, A., Azzariti, A., Marra, E.,
13.
Milorey, B., Schweitzer Stenner, R., Kurbaj, R., and
and Passarella, S. (2000) Cytochrome c is released from
Malyshka, D. (2019) pH induced switch between different
mitochondria in a reactive oxygen species (ROS) depen
modes of cytochrome c binding to cardiolipin containing
dent fashion and can operate as a ROS scavenger and as a
liposomes, ACS Omega, 4, 1386 14000, doi: 10.1021/
respiratory substrate in cerebellar neurons undergoing
acsomega.8b02574.
excitotoxic death, J. Biol. Chem., 275, 3715937166,
14.
Maity, H., Rumbley, J. N., and Englander, S. W. (2006)
doi: 10.1074/jbc.M002361200.
Functional role of a protein foldon - an Ω loop foldon
3.
Paradies, G., Petrosilio, G., Pistolese, M., and Ruggiero,
controls the alkaline transition in ferricytochrome c,
F. M. (2000) The effect of reactive oxygen species generat
Proteins, 63, 349 355, doi: 10.1002/prot.20757.
ed from the mitochondrial electron transfer chain on the
15.
Oviedo Rouco, S., Castro, M. A., Alvarez Paggi, D,
cytochrome c oxidase activity and on the cardiolipin con
Spedalieri, C., Tortora, V., et al. (2019) The alkaline tran
tent in bovine heart submitochondrial particles, FEBS
sition of cytochrome c revisited: effects of electrostatic
Lett., 466, 323 326, doi: 10.1016/s0014 5793(00)01082 6.
interactions and tyrosine nitration on the reaction dynam
4.
Pereverzev, M. O., Vygodina, T. V., Konstantinov, A. A., and
ics, Arch. Biochem. Biophys., 665, 96 106, doi: 10.1016/
Skulachev, V. P. (2003) Cytochrome c, an ideal antioxidant,
j.abb.2019.02.016.
Biochem. Soc. Trans., 31, 1312 1315, doi: 10.1042/bst0311312.
16.
Oellerich, S., Waxckerbarth, H., and Hildebrandt, P.
5.
Liu, X., Kim, C. N., Yang, J., Jemmerson, R., and
(2002) Spectroscopic characterization of nonnative con
Wang, X. (1996) Induction of apoptotic program in cell
formational states of cytochrome c, J. Phys. Chem. B, 106,
free extracts: requirement for dATP and cytochrome c,
6566 6580, doi: 10.1021/jp013841g.
Cell, 86, 147 157, doi: 10.1016/s0092 8674(00)80085 9.
17.
Alvarez Paggi, D., Hannibal, L., Castro, M. A., Oviedo
6.
Jiang, X., and Wang, X. (2004) Cytochrome c mediated
Rouco, S., Demicheli, V., et al. (2017) Multifunctional
apoptosis, Annu. Rev. Biochem., 73, 87 106, doi: 10.1146/
cytochrome c: learning new tricks from an old dog, Chem.
annurev.biochem.73.011303.073706.
Rev., 117, 13382 13460, doi: 10.1021/acs.chemrev.7b00257.
7.
Kagan, V. E., Tyurin, V. A., Jiang, J., Tyurina, Y. Y., Ritov,
18.
Milazzo, L., Tognaccini, L., Howes, B. D., and
V. B., et al. (2005) Cytochrome c acts as a cardiolipin oxy
Smulevich, G. (2018) Probing the non native states of
genase required for release of proapoptotic factors, Nat.
cytochrome c with resonance Raman spectroscopy: a tool
Chem. Biol., 1, 223 232, doi: 10.1038/nchembio727.
for investigating the structure function relationship,
8.
Chapple, C. E., Robisson, B., Spinelli, L., Guien, C.,
J. Raman. Spectrosc., 49, 1041 1055, doi: 10.1002/jrs.5315.
Becker, E., and Brun, C. (2015) Extreme multifunctional
19.
Osheroff, N., Borden, D., Koppenol, W. H., and
proteins identified from a human protein interaction net
Margoliash, E.
(1980) Electrostatic interactions in
work, Nat. Commun., 6, 7412, doi: 10.1038/ncomms8412.
cytochrome c. The role of interactions between residues 13
9.
González Arzola, K., Velázquez Cruz, A., Guerra
and 90 and residues 79 and 47 in stabilizing the heme
Castellano, A., Casado Combreras, M. A., Pérez Mej as,
crevice structure, J. Biol. Chem., 255, 1689 1697.
G., et al. (2019) New moonlighting functions of mitochon
20.
Moore, G. R., and Pettigrew, G. W. (1990) Cytochromes c:
drial cytochrome c in the cytoplasm and nucleus, FEBS
Evolutionary, Structural and Physicochemical Aspects,
Lett., 593, 3101 3119, doi: 10.1002/1873 3468.13655.
Springer Verlag, New York.
10.
Cherney, M. M., and Bowler, B. E. (2011) Protein dynam
21.
Pollock, W. B., Rosell, F. I., Twitchett, M. B., Dumont,
ics and function: making new strides with an old warhorse,
M. E., and Mauk, A. G. (1998) Bacterial expression of a
the alkaline transition of cytochrome c, Coord. Chem. Rev.,
mitochondrial cytochrome c. Trimethylation of lys72 in yeast
255, 664 677, doi: 10.1016/j.ccr.2010.09.014.
iso 1 cytochrome c and the alkaline conformational transi
11.
Hannibal, L., Tomasina, F., Capdevila, D. A., Demicheli, V.,
tion, Biochemistry, 37, 6124 6131, doi: 10.1021/bi972188d.
Tortora, V., et al. (2016) Alternative conformations of cyto
22.
Rosell, F. I., Ferrer, J. C., and Mauk, A. G. (1998) Proton
chrome c: structure, function, and detection, Biochemistry,
linked protein conformational switching: definition of the
55, 407 428, doi: 10.1021/acs.biochem.5b01385.
alkaline conformational transition of yeast iso 1 ferricy
БИОХИМИЯ том 86 вып. 1 2021
ЭФФЕКТ ХОФМЕЙСТЕРА ПРИ ЩЕЛОЧНОМ СОСТОЯНИИ ЦИТОХРОМА c
85
tochrome c, J. Am. Chem. Soc., 120, 1123411245,
38.
Nelson, C. J., LaConte, M. J., and Bowler, B. E. (2001)
doi: 10.1021/ja971756.
Direct detection of heat and cold denaturation for partial
23.
Döpner, S., Hildebrandt, P., Rosell, F. I., and Mauk, A. G.
unfolding of a protein, J. Am. Chem. Soc., 123, 7453 7454,
(1998) Alkaline conformational transitions of ferricyt
doi: 10.1021/ja016144a.
cohrome c studied by Resonance Raman spectroscopy,
39.
Weber, C., Michael, B., and Bosshard, H. R. (1987) Spectro
J. Am. Chem. Soc., 120, 1124611255, doi: 10.1021/
scopic analysis of the cytochrome c oxidase cytochrome c
ja9717572.
complex: circular dichroism and magnetic circular dichro
24.
Krishna, M. M. G., Maity, H., Rumbley, J. N., Lin, Y., and
ism measurements reveal change of cytochrome c heme
Englander, S. W. (2006) Order of steps in the cytochrome c
geometry imposed by complex formation, Proc. Natl. Acad.
folding pathway: evidence for a sequential stabilization
Sci. USA, 84, 6687 669, doi: 10.1073/pnas.84.19.6687.
mechanism, J. Mol. Biol., 359, 1410 1419, doi: 10.1016/
40.
Jemmerson, R., Liu, J., Hausauer, D., Lam, K. P.,
j.jmb.2006.04.035.
Mondino, A., and Nelson, R. D. (1999) A conformational
25.
Assfalg, M., Bertini, I., Dolfi, A., Turano, P., Mauk, A. G.,
change in cytochrome c of apoptotic and necrotic cells is
Rosell, F. I., and Gray, H. B. (2003) Structural model for
detected by monoclonal antibody binding and mimicked
an alkaline form of ferricytochrome c, J. Am. Chem. Soc.,
by association of the native antigen with synthetic phos
125, 2913 2922, doi: 10.1021/ja027180s.
pholipid vesicles, Biochemistry,
38,
35993609,
26.
Amacher, J. F., Zhong, F., Lisi, G. P., Zhu, M. Q., Alden,
doi: 10.1021/bi9809268.
S. L., et al. (2015) A compact structure of cytochrome c
41.
Abriata, L. A., Cassina, A., Tortora, V., Marin, M., Souza,
trapped in a lysine ligated state: loop refolding and func
J. M., et al. (2009) Nitration of solvent exposed tyrosine 74
tional implications of a conformational switch, J. Am.
on cytochrome c triggers heme iron methionine 80 bond
Chem. Soc., 137, 8435 8449, doi: 10.1021/jacs.5b01493.
disruption. Nuclear magnetic resonance and optical spec
27.
Davis, L. A., Schejter, A., and Hess, G. P. (1974) Alkaline
troscopy studies, J. Biol. Chem., 284, 17 26, doi: 10.1074/
isomerization of oxidized cytochrome c. Equilibrium and
jbc.M807203200.
kinetic measurements, J. Biol. Chem., 249, 2624 2632.
42.
Santucci, R., Sinibaldi, F., Patriarca, A., Santucci, D., and
28.
Gadsby, P. M., Peterson, J., Foote, N., Greenwood, C., and
Fiorucci, L. (2010) Misfolded proteins and neurodegener
Thomson, A. J. (1987) Identification of ligand exchange
ation: role of non native cytochrome c in cell death, Expert
process tn the alkaline transition of horse cytochrome c,
Rev. Proteomics, 7, 507 5017, doi: 10.1586/epr.10.50.
Biochem. J., 246, 43 54, doi: 10.1042/bj2460043.
43.
Josephs, T. M., Liptak, M. D., Hughes, G., Lo, A., Smith,
29.
Nelson, C. J., and Bowler, B. E. (2000) pH dependence of
R. M., et al. (2013) Conformational change and human
formation of a partially unfolded state of a Lys 73 → His
cytochrome c function: mutation of residue 41 modulates
variant of iso 1 cytochrome c: implications for the alkaline
caspase activation and destabilizes Met 80 coordination,
conformational transition of cytochrome c, Biochemistry,
J. Biol. Inorg. Chem., 18, 289 297, doi: 10.1007/s00775
39, 13584 13594, doi: 10.1021/bi0017778.
012 0973 1.
30.
Hoang, L., Maity, H., Krishna, M. M. G., Lin, Y., and
44.
Liptak, M. D., Fagerlund, R. D., Ledgerwood, E. C.,
Englander, S. W.
(2003) Folding units govern the
Wilbanks, S. M., and Bren, K. L. (2011) The proapoptotic
cytochrome c alkaline transition, J. Mol. Biol., 331, 37 43,
G41S mutation to human cytochrome c alters the heme
doi: 10.1016/s0022 2836(03)00698 3.
electronic structure and increases the electron self
31.
Weinkam, P., Zimmermann, J., Sagle, L. B., Matsuda, S.,
exchange rate, J. Am. Chem. Soc., 133, 11531155,
Dawson, P. E., Wolynes, P. G., and Romesberg, F. E.
doi: 10.1021/ja106328k.
(2008) Characterization of alkaline transitions in ferricy
45.
Karsisiotis, A. I., Deacon, O. M., Wilson, M. T.,
tochrome c using carbon deuterium infrared probes,
Macdonald, C., Blumenschein, T. M. A., et al. (2016)
Biochemistry, 47, 13470 13480, doi: 10.1021/bi801223n.
Increased dynamics in the 40 57 Ω loop of the G41S vari
32.
Hartshorn, R. T., and Moore, G. R. (1989) A denatura
ant of human cytochrome c promote its pro apoptotic con
tion induced proton uptake study of horse cytochrome c,
formation, Sci. Rep., 6, 30447, doi: 10.1038/srep30447.
Biochem. J., 258, 595 598, doi: 10.1042/bj2580595.
46.
De Rocco, D., Cerqua, C., Goffrini, P., Russo, G.,
33.
Rosell, F. I., Harris, T. R., Hildebrand, D. P., Döpner, S.,
Pastore, A., et al. (2014) Mutations of cytochrome c iden
Hildebrandt, P., and Mauk, A. G. (2000) Characterization
tified in patients with thrombocytopenia THC4 affect both
of an alkaline transition intermediate stabilized in the
apoptosis and cellular bioenergetics, Biochim. Biophys.
Phe82Trp variant of yeast iso 1 cytochrome c,
Acta, 1842, 269 274, doi: 10.1016/j.bbadis.2013.12.002.
Biochemistry, 39, 9047 9054, doi: 10.1021/bi001095k.
47.
Garcia Heredia, J. M., Diaz Quintana, A., Salzano, M.,
34.
Silkstone, G. G., Cooper, C. E., Svistunenko, D., and
Orzaez, M., Perez Paya, E., et al. (2011) Tyrosine phos
Wilson, M. T. (2005) EPR and optical spectroscopic stud
phorylation turns alkaline transition into a biologically rel
ies of Met80X mutants of yeast ferricytochrome c. Models
evant process and makes human cytochrome c behave as an
for inter mediates in the alkaline transition, J. Am. Chem
ant apoptotic switch, J. Biol. Inorg. Chem., 16, 1155 1168,
Soc., 127, 92 99, doi: 10.1021/ja045719b.
doi: 10.1007/s00775 011 0804 9.
35.
Verbaro, D., Hagarman, A., Soffer, J., and Schweitzer
48.
Capdevila, D., Alvarez Paggi, D., Castro, M., Tortora, V.,
Stenner, R. (2009) The pH dependence of the 695 nm
Demicheli, V., et al. (2014) Coupling of tyrosine deproto
charge transfer band reveals the population of an interme
nation and axial ligand exchange in nitrocytochrome c,
diate state of the alkaline transition of ferricytochrome c at
Chem. Commun., 50, 2592 2594, doi: 10.1039/c3cc47207h.
low ion concentrations, Biochemistry, 48, 29902996,
49.
Josephs, T. M., Morison, I. M., Day, C. L., Wilbanks,
doi: 10.1021/bi802208f.
S. M., and Ledgerwood, E. C. (2014) Enhancing the per
36.
Bai, Y., Sosnick, T. R., Mayne, L., and Englander, S. W.
oxidase activity of cytochrome c by mutation of residue 41:
(1995) Protein folding intermediates: native state hydrogen
implications for peroxidase mechanism any cytochrome c
exchange, Science,
269,
192197, doi:
10.1126/sci
release, Biochem. J.,
458,
259265, doi:
10.1042/
ence.7618079.
BJ20131386.
37.
Godbole, S., and Bowler, B. E. (1999) Effect of pH on for
50.
Diederix, R. E., Ubbink, M., and Canters, G. W. (2001)
mation of a nativelike intermediate on the unfolding path
The peroxidase activity of cytochrome c 550 from
way of a Lys 73→His variant of yeast iso 1 cytochrome c,
Paracoccus versutus, Eur. J. Biochem., 268, 4207 4216,
Biochemistry, 38, 487 495, doi: 10.1021/bi981698k.
doi: 10.1046/j.1432 1327.2001.02335.x.
БИОХИМИЯ том 86 вып. 1 2021
86
СЕДЛАК и др.
51.
Diederix, R. E., Ubbink, M., and Canters, G. W. (2002)
and other phenolic compounds, J. Am. Chem. Soc., 69,
Peroxidase activity as a tool for studying the folding of c
2998 3000, doi: 10.1021/ja01204a018.
type cytochromes, Biochemistry,
41,
1306713077,
66.
Myers, J. K., Pace, C. N., and Scholtz, J. M. (1995)
doi: 10.1021/bi0260841.
Denaturant m values and heat capacity changes: relation to
52.
McClelland, L. J., Mou, T. Ch., Jeakins Cooley, M. E.,
changes in accessible surface areas of protein unfolding,
Sprang, S. R., and Bowler, B. E. (2014) Structure of mito
Protein Sci., 4, 2138 2148.
chondrial cytochrome c conformer competent for peroxi
67.
Santoro, M. M., and Bolen, D. W. (1988) Unfolding free
dase activity, Proc. Natl. Acad. Sci. USA, 111, 6648 6653,
energy changes determined by the linear extrapolation
doi: 10.1073/pnas.1323828111.
method. 1. Unfolding of phenylmethanesulfonyl alpha
53.
Battistuzzi, G., Borsari, M., Sola, M., and Francia, F.
chymotrypsin using different denaturants, Biochemistry,
(1997) Redox thermodynamics of the native and alkaline
27, 8063 8068, doi: 10.1021/bi00421a014.
forms of eukaryotic and bacterial class I cytochrome c,
68.
Biochemistry, 36, 16247 16258, doi: 10.1021/bi971535g.
(Dassault Systems BIOVIA; Discovery Studio Client; San
54.
Millo, D., Bonifacio, A., Raineri, A., Borsari, M., Gooijer, C,
Diego, USA (2020) Dassault Systems BIOVIA; Discovery
and Van Der Zwan, G. (2007) pH induced changes in
Studio 2020 Client; San Diego, USA.)
absorbed cytochrome c. Voltammetric and surface
69.
Bushnell, G. W., Louie, G. V., and Brayer, G. D. (1990)
enhanced resonance Raman characterization performed
High resolution three dimensional structure of horse heart
simultaneously at chemically modified silver electrodes,
cytochrome c, J. Mol. Biol., 214, 585 595, doi: 10.1016/
Langmuir, 23, 9898 9904, doi: 10.1021/la701751r.
0022 2836(90)90200 6.
55.
Capdevila, D. A., Oviedo Rouco, S., Tomasina, F.,
70.
Bowers, K. J., Sacerdoti, F. D., Salmon, J. K., Shan, Y.,
Torora, V., Demicheli, V., et al. (2015) Active site structure
Shaw, D. E., et al. (2006) Molecular dynamics - Scalable
and peroxidase activity of oxidatively modified cytochrome
algorithms for molecular dynamics simulations on com
c species in complexes with cardiolipin, Biochemistry, 54,
modity clusters, Proceedings of the 2006 ACM/IEEE confer
7491 7504, doi: 10.1021/acs.biochem.5b00922.
ence on Supercomputing SC ‘06, ACM Press.
56.
Deacon, O. M., Karsisiotis, A. I., Moreno Chicano, T.,
71.
Berendsen, H. J. C., Grigera, J. R., and Straatsma, T. P.
Hough, M. A., Macdonald, C., et al. (2017) Heightened
(1987) The missing term in effective pair potentials,
dynamics of the oxidized Y48H variant of human
J. Phys. Chem., 91, 6269 6271, doi: 10.1021/j100308a038.
cytochrome c increases its peroxidatic activity,
72.
Jorgensen, W. L., and Tirado Rives, J. (1988) The OPLS
Biochemistry, 56, 6111 6124, doi: 10.1021/acs.biochem.
[optimized potentials for liquid simulations] potential
7b00890.
functions for proteins, energy minimizations for crystals of
57.
Tomášková, N., Varhač, R., Lysáková, V., Musatov, A., and
cyclic peptides and crambin, J. Am. Chem. Soc., 110, 1657
Sedlák, E. (2018) Peroxidase activity of cytochrome c in its
1666, doi: 10.1021/ja00214a001.
compact state depends on dynamics of the heme region,
73.
Jorgensen, W. L., Tirado Rives, J. (2005) Potential energy
Biochim. Biophys. Acta Proteins Proteom., 1866, 1073 1083,
functions for atomic level simulations of water and organ
doi: 10.1016/j.bbapap.2018.09.003.
ic and biomolecular systems, Proc. Natl. Acad. Sci. USA,
58.
Žoldák, G., Sprinzl, M., and Sedlák, E.
(2004)
102, 6665 6670, doi: 10.1073/pnas.0408037102.
Modulation of activity of NADH oxidase from Thermus
74.
Masood, T. B., Sandhya, S., Chandra, N., and
thermophilus through change in flexibility in the enzyme
Natarajan, V. (2015) CHEXVIS: a tool for molecular channel
active site induced by Hofmeister series anions, Eur. J.
extraction and visualization, BMC Bioinformatics, 16, 119.
Biochem.,
271,
4857, doi:
10.1046/j.1432 1033.
75.
Baldwin, R. L. (1996) How Hofmeister ion interactions
2003.03900.x.
affect protein stability, Biophys. J.,
71,
20562063,
59.
Dér, A., Kelemen, L., Fábián, L., Taneva, S. G., Fodor, E.,
doi: 10.1016/S0006 3495(96)79404 3.
et al. (2007) Interfacial water structure controls protein
76.
Russell, B. S., and Bren, K. L. (2002) Denaturant depen
conformation, J. Phys. Chem. B.,
111,
53445350,
dence of equilibrium unfolding intermediates and dena
doi: 10.1021/jp066206p.
tured state structure of horse ferricytochrome c, J. Biol.
60.
Varhač, R., Tomášková, N., Fabián, M., and Sedlák, E.
Inorg. Chem., 7, 909 916, doi: 10.1007/s00775 002 0381 z.
(2009) Kinetics of cyanide binding as a probe of local sta
77.
Tsong, T. Y. (1974) The Trp 59 fluorescence of ferricy
bility/flexibility of cytochrome c, Biophys. Chem., 144, 21
tochrome c as a sensitive measure of the over all protein
26, doi: 10.1016/j.bpc.2009.06.001.
conformation, J. Biol. Chem., 249, 1988 1990.
61.
Bogár, F., Bartha, F., Násztor, Z., Fábián, L., Leitgeb, B.,
78.
Oviedo Rouco, S., Perez Bertoldi, J. M., Spedalieri, C,
and Dér, A. (2014) On the Hofmeister effect: fluctuations at
Castro, M. A., Tomasina, F., et al. (2020) Electron transfer
the protein water interface and the surface tension, J. Phys.
and conformational transitions of cytochrome c are modu
Chem. B., 118, 8496 8504, doi: 10.1021/jp502505c.
lated by the same dynamical features, Arch. Biochem.
62.
Tomášková, N., Varhač, R., Žoldák, G., Olekšáková, L.,
Biophys., 680, 108243, doi: 10.1016/j.abb.2019.108243.
Sedláková, D., and Sedlák, E. (2007) Conformational sta
79.
Theorell, H., and Åkesson, Å.
(1941) Studies on
bility and dynamics of cytochrome c affect its alkaline iso
cytochrome c. II. The optical properties of pure
merization, J. Biol. Inorg. Chem.,
12,
257266,
cytochrome c and some of its derivatives, J. Am. Chem.
doi: 10.1007/s00775 006 0183 9.
Soc., 63, 1804 1811, doi: 10.1021/ja01852a005.
63.
Garajová, K., Balogová, A., Dušeková, E., Sedláková, D,
80.
Barker, P. D., and Mauk, A. G. (1992) pH Linked confor
Sedlák, E., and Varhač, R. (2017) Correlation of lysozyme
mational regulation of a metalloprotein oxidation reduc
activity and stability in the presence of Hofmeister series
tion equilibrium: electrochemical analysis of the alkaline
anions, Biochim. Biophys. Acta Proteins Proteom., 1865,
form of cytochrome c, J. Am. Chem. Soc., 114, 3619 3624,
281 288, doi: 10.1016/j.bbapap.2016.11.016.
doi: 10.1021/ja00036a006.
64.
Dušeková, E., Garajová, K., Yavaşer, R., Varhač, R., and
81.
Lambeth, D. O., Campbell, K. L., Zand, R., and
Sedlák, E. (2018) Hofmeister effect on catalytic properties
Palmer, G. (1973) The appearance of transient species of
of chymotrypsin is substrate dependent, Biophys. Chem.,
cytochrome c upon rapid oxidation or reduction at alkaline
243, 8 16, doi: 10.1016/j.bpc.2018.10.002.
pH, J. Biol. Chem., 248, 8130 8136.
65.
Lemon, H. W. (1947) The effect of alkali on the ultraviolet
82.
Deacon, O. M., White, R. W., Moore, G. R., Wilson,
absorption spectra of hydroxyaldehydes, hydroxyketones,
M. T., and Worrall, J. A. R. (2020) Comparison of the
БИОХИМИЯ том 86 вып. 1 2021
ЭФФЕКТ ХОФМЕЙСТЕРА ПРИ ЩЕЛОЧНОМ СОСТОЯНИИ ЦИТОХРОМА c
87
structural dynamic and mitochondrial electron transfer
perturbations of the heme chromophore in cytochrome C
properties of the proapoptotic human cytochrome c vari
at room temperature probed by visible electronic circular
ants, G41S, Y48H and A51V, J. Inorg. Biochem., 203,
dichroism spectroscopy, Biophys. J.,
92,
989998,
110924, doi: 10.1016/j.jinorgbio.2019.110924.
doi: 10.1529/biophysj.106.095976.
83.
Deacon, O. M., Svistusenko, D. A., Moore, G. R., Wilson,
98. Shah, R., and Schweitzer Stenner, R. (2008) Structural
M. T., and Worrall, J. A. R. (2018) Naturally occurring dis
changes of horse heart ferricytochrome c induced by
ease related mutations in the 40 57 Ω loop of human
changes of ionic strength and anion binding, Biochemistry,
cytochrome c control triggering of the alkaline isomeriza
47, 5250 5257, doi: 10.1021/bi702492n.
tion, Biochemistry, 57, 42764288, doi: 10.1021/acs.
99. Schweitzer Stenner, R., Shah, R., Hagarman, A., and
biochem.8b00520.
Dragomir, I. (2007) Conformational substates of horse
84.
Guerra Castellano, A., D az Quintana, A., Moreno
heart cytochrome c exhibit different thermal unfolding of
Beltrán, B., López Prados, J., Nieto, P. M., et al. (2015)
the heme cavity, J. Phys. Chem. B, 111, 96039607,
Mimicking tyrosine phosphorylation in human
doi: 10.1021/jp069022j.
cytochrome c by the evolved tRNA synthetase technique,
100. Maity, H., Maity, M., and Englander, S. W. (2004) How
Chemistry,
21,
1500415012, doi:
10.1002/chem.
cytochrome c folds, and why: submolecular foldon units
201502019.
and their stepwise sequential stabilization, J. Mol. Biol.,
85.
Tsai, M. Y., Morozov, A. N., Chu, K. Y., and Lin, S. H.
343, 223 233, doi: 10.1016/j.jmb.2004.08.005.
(2009) Molecular dynamics insight into the role of tertiary
101. Hu, W., Kan, Z. Y., Mayne, L., and Englander, S. W. (2016)
(foldon) interactions on unfolding in cytochrome c, Chem.
Cytochrome c folds through foldon dependent native like
Phys. Lett., 475, 111115, doi: 10.1016/j.cplett.2009.
intermediates in an ordered pathway, Proc. Natl. Acad. Sci.
05.027.
USA, 113, 3809 3814, doi: 10.1073/pnas.1522674113.
86.
George, P., and Tsou, C. L. (1952) Reaction between
102. Dickerson, R. E., Takano, T., Eiseberg, D., Kallai, O. B.,
hydrocyanic acid, cyanide ion and ferricytochrome c,
Samson, L., Cooper, A., and Margoliash, E.
(1971)
Biochem. J., 50, 440 448, doi: 10.1042/bj0500440.
Ferricytochrome c. I. General features of the horse and
87.
Sutin, N., and Yandell, J. K. (1972) Mechanisms of the
bonito proteins at 2.8 Å resolution, J. Biol. Chem., 246,
reactions of cytochrome c. Rate and equilibrium constants
1511 1535.
for ligand binding to horse heart ferricytochrome c, J. Biol.
103. Louie, G. V., Hutcheon, W. L., and Brayer, G. D. (1988)
Chem., 247, 6932 6936.
Yeast iso 1 cytochrome c. A 2.8 Å resolution three dimen
88.
Dumortier, C., Meyer, T. E., and Cusanovich, M. A.
sional structure determination, J. Mol. Biol., 199, 295 314,
(1999) Protein dynamics: imidazole binding to class I C
doi: 10.1016/0022 2836(88)90315 4.
type cytochromes, Arch Biochem Biophys., 371, 142 148,
104. Levin, Ö.
(1963) Electron micrographs of bovine
doi: 10.1006/abbi.1999.1440.
cytochrome c, J. Mol. Biol., 6, 137 140, doi: 10.1016/
89.
Tomášková, N., Varinská, L., and Sedlák, E. (2010) Rate of
S0022 2836(63)80129 1.
oxidative modification of cytochrome c by hydrogen per
105. Margoliash, E., Needleman, S. B., and Stewart, J. W.
oxide is modulated by Hofmeister anions, Gen. Physiol.
(1963) A comparison of the amino acid sequences of the
Biophys., 29, 254 264, doi: 10.4149/gpb_2010_03_255.
cytochrome c of several vertebrates, Acta Chem. Scand., 17,
90.
Pearce, L. L., Gärtner, A. L., Smith, M., and Mauk, A. G.
S250 S256.
(1989) Mutation induced perturbation of the cyto
106. Zand, R., and Vinogradov, S. (1968) Circular Dichroism
chrome c alkaline transition, Biochemistry, 28, 3152 3156,
Studies II. The far ultraviolet circular dichroism of
doi: 10.1021/bi00434a006.
cytochrome c, Arch. Biochem. Biophys., 125, 9497,
91.
Nall, B. T., Zuniga, E. H., White, T. B., Wood, L. C., and
doi: 10.1016/0003 9861(68)90642 5.
Ramdas, L. (1989) Replacement of a conserved proline
107. Margoliash, E., Schejter, A. (1966) Cytochrome c, Adv.
and the alkaline conformational change in iso 2
Protein Chem.,
21,
113286, doi:
10.1016/s0065
cytochrome c, Biochemistry, 28, 9834 9839, doi: 10.1021/
3233(08)60128 x.
bi00451a043.
108. Takano, T., and Dickerson, R. E. (1981) Conformation
92.
Sinibaldi, F., Piro, M. C., Howes, B. D., Smulevich, G.,
change of cytochrome c. I. Ferricytochrome c refinement
Ascoli, F., and Santucci, R. (2003) Rupture of the hydro
at 1.8 Å and comparison with the ferrocytochrome struc
gen bond linking two Omega loops induces the molten
ture, J. Mol. Biol., 153, 95115, doi: 10.1016/0022
globule state at neutral pH in cytochrome c, Biochemistry,
2836(81)90529 5.
42, 7604 7610, doi: 10.1021/bi034132r.
109. Berghuis, A. M., and Brayer, G. D. (1992) Oxidation state
93.
Baddam, S., and Bowler, B. E. (2006) Mutation of
dependent conformational changes in cytochrome c,
asparagine 52 to glycine promotes the alkaline form of iso
J. Mol. Biol.,
223,
959976, doi:
10.1016/0022
1 cytochrome c and causes loss of cooperativity in acid
2836(92)90255 i.
unfolding, Biochemistry, 45, 4611 4619, doi: 10.1021/
110. Lei, H., Bowler, B. E. (2019) Naturally occurring A51V
bi0524971.
variant of human cytochrome c destabilizes the native state
94.
Taler, G., Schejter, A., Navon, G., Vig, I., and
and enhances peroxidase activity, J. Phys. Chem. B, 123,
Margoliash, E. (1995) The nature of the thermal equilibri
8939 8953, doi: 10.1021/acs.jpcb.9b05869.
um affecting the iron coordination of ferric cytochrome c,
111.
Harbury, H. A., Cronin, J. R., Fanger, M. W., Hettinger,
Biochemistry, 34, 14209 14212, doi: 10.1021/bi00043a027.
T. P., Murphy, A. J., et al. (1965) Complex formation
95.
Banci, L., Bertini, I., Spyroulias, G. A., and Turano, P.
between methionine and a heme peptide from
(1998) The conformational flexibility of oxidized
cytochrome c, Proc. Natl. Acad. Sci. USA, 54, 1658 1664,
cytochrome c studied through its interaction with NH3 and
doi: 10.1073/pnas.54.6.1658.
at high temperatures, Eur. J. Inorg. Chem., 1998, 583 591.
112. Wilgus, H., and Stellwagen, E. (1974) Alkaline isomeriza
96.
Varhač, R., Sedláková, D., Stupák, M., and Sedlák, E.
tion of ferricytochrome c: identification of the lysine lig
(2015) Non two state thermal denaturation of ferricy
and, Proc. Natl. Acad. Sci. USA,
71,
28922894,
tochrome c at neutral and slightly acidic pH values, Biophys.
doi: 10.1073/pnas.71.7.2892.
Chem., 203 204, 41 50, doi: 10.1016/j.bpc.2015.05.002.
113. Brautigan, D. L., Feinberg, B. A., Hoffman, B. M.,
97.
Dragomir, I., Hagarman, A., Wallace, C., and Schweitzer
Margoliash, E., Preisach, J., and Blumberg, W. E. (1977)
Stenner, R. (2007) Optical band splitting and electronic
Multiple low spin forms of the cytochrome c ferrihe
БИОХИМИЯ том 86 вып. 1 2021
88
СЕДЛАК и др.
mochrome. EPR spectra of various eukaryotic and
119. Paul, K. G. (1947) Oxidation reduction potential of
prokaryotic cytochromes c, J. Biol. Chem., 252, 574 582.
cytochrome c, Arch. Biochem., 12, 441 450.
114. Ferrer, J. C., Guillemette, J. G., Bogumil, R., Inglis, S. C.,
120. Henderson, R. W., and Rawlinson, W. A.
(1956)
Smith, M., and Mauk, A. G. (1993) Identification of Lys79
Oxidation reduction potential od modified cytochrome c,
as an iron ligand in one form of alkaline state yeast iso 1
Nature, 177, 1180 1181, doi: 10.1038/1771180b0.
cytochrome c, J. Am. Chem. Soc., 115, 75077508,
121. Theodorakis, J. L., Garber, E. A., McCracken, J., Peisach, J.,
doi: 10.1021/ja00069a062.
Schejter, A., and Margoliash, E. (1995) A chemical modi
115. Moore, G. R., and Williams, R. J. P. (1977) Structural basis
fication of cytochrome c lysines leading to changes in
for the variation in redox potential of cytochromes, FEBS
heme iron ligation, Biochim. Biophys. Acta, 1252, 103 113,
Lett., 79, 229 232, doi: 10.1016/0014 5793(77)80793 x.
doi: 10.1016/0167 4838(95)00097 e.
116. Eaton, W. A., and Hochstrasser, R. M. (1967) Electric
122. Lemberg, R., and Barrett, J.
(1973) Cytochromes,
spectrum of single crystals of ferricytochrome c, J. Chem.
Academic Press, New York.
Phys., 46, 2533 2539, doi: 10.1063/1.1841081.
123. Rodkey, F. L., and Ball, E. G. (1950) Oxidation reduction
117. Pettigrew, G. W., and Moore, G. R. (1987) Cytochromes c
potentials of the cytochrome c system, J. Biol. Chem., 182,
Biological Aspects, Springer Verlag, Berlin Heidelberg,
17 28.
doi: 10.1007/978 3 642 72698 9.
124. Shejter, A., Luntz, T. L., Koshy, T. I., and Margoliash, E.
118. Brandt, K. G., Parks, P. C., Czerlinski, G. H., and Hess,
(1992) Relationship between local and global stabilities of
G. P. (1966) On the elucidation of the pH dependence of
proteins: site directed mutants and chemically modified
the oxidation reduction potential of cytochrome c at alka
derivatives of cytochrome c, Biochemistry, 31, 8336 8343,
line pH, J. Biol. Chem., 241, 4180 4185.
doi: 10.1021/bi00150a030.
ANIONS SPECIFIC EFFECTS ON ALKALINE STATE OF CYTOCHROME c
E. Sedlák1,2, T. Kožár2, R. Varhač1, A. Musatov3, and N. Tomášková1*
1 Department of Biochemistry, Faculty of Science, P. J. Šafárik University,
04154 Košice, Slovakia; E mail: natasa.tomaskova@upjs.sk
2 Centre for Interdisciplinary Biosciences, P. J. Šafárik University, 04154 Košice, Slovakia
3 Department of Biophysics, Institute of Experimental Physics, Slovak Academy of Sciences, 04001 Košice, Slovakia
Specific effects of anions on the structure, thermal stability, and peroxidase activity of native (state III) and alkaline
(state IV) cytochrome c (cyt c) have been studied by the UV VIS absorbance spectroscopy, intrinsic tryptophan fluo
rescence, and circular dichroism. Thermal and isothermal denaturation monitored by the tryptophan fluorescence
and circular dichroism, respectively, implied lower stability of cyt c state IV in comparison with the state III. The pKa
value of alkaline isomerization of cyt c depended on the present salts, i.e., kosmotropic anions increased and
chaotropic anions decreased pKa (Hofmeister effect on protein stability). The peroxidase activity of cyt c in the
state III, measured by oxidation of guaiacol, showed clear dependence on the salt position in the Hofmeister series,
while cyt c in the alkaline state lacked the peroxidase activity regardless of the type of anions present in the solution.
The alkaline isomerization of cyt c in the presence of 8 M urea, measured by Trp59 fluorescence, implied an existence
of a high affinity non native ligand for the heme iron even in a partially denatured protein conformation. The con
formation of the cyt c alkaline state in 8 M urea was considerably modulated by the specific effect of anions. Based on
the Trp59 fluorescence quenching upon titration to alkaline pH in 8 M urea and molecular dynamics simulation, we
hypothesize that the Lys79 conformer is most likely the predominant alkaline conformer of cyt c. The high affinity of
the sixth ligand for the heme iron is likely a reason of the lack of peroxidase activity of cyt c in the alkaline state.
Keywords: alkaline isomerization, Hofmeister anions, pseudo peroxidase activity
БИОХИМИЯ том 86 вып. 1 2021