БИОХИМИЯ, 2021, том 86, вып. 1, с. 89 - 99
УДК 577.152.123
ТЕРМОДИНАМИКА ФЕРРИЛЬНОЙ ФОРМЫ Р ТИПА
ЦИТОХРОМ c ОКСИДАЗЫ БЫКА
© 2021
Л. Микулова1, И. Пекова2, Д. Янкура2, М. Ступак3, М. Фабиан1*
1 Center for Interdisciplinary Biosciences, Technology and Innovation Park,
University of P. J. Šafárik, 04154 Košice, Slovak Republic; E mail: marian.fabian@upjs.sk
2 Department of Biophysics, Faculty of Science, University of P. J. Šafárik, 04154 Košice, Slovak Republic
3 Department of Medical and Clinical Biochemistry, Faculty of Medicine, 04011 Košice, Slovak Republic
Поступила в редакцию 28.08.2020
После доработки 25.11.2020
Принята к публикации 25.11.2020
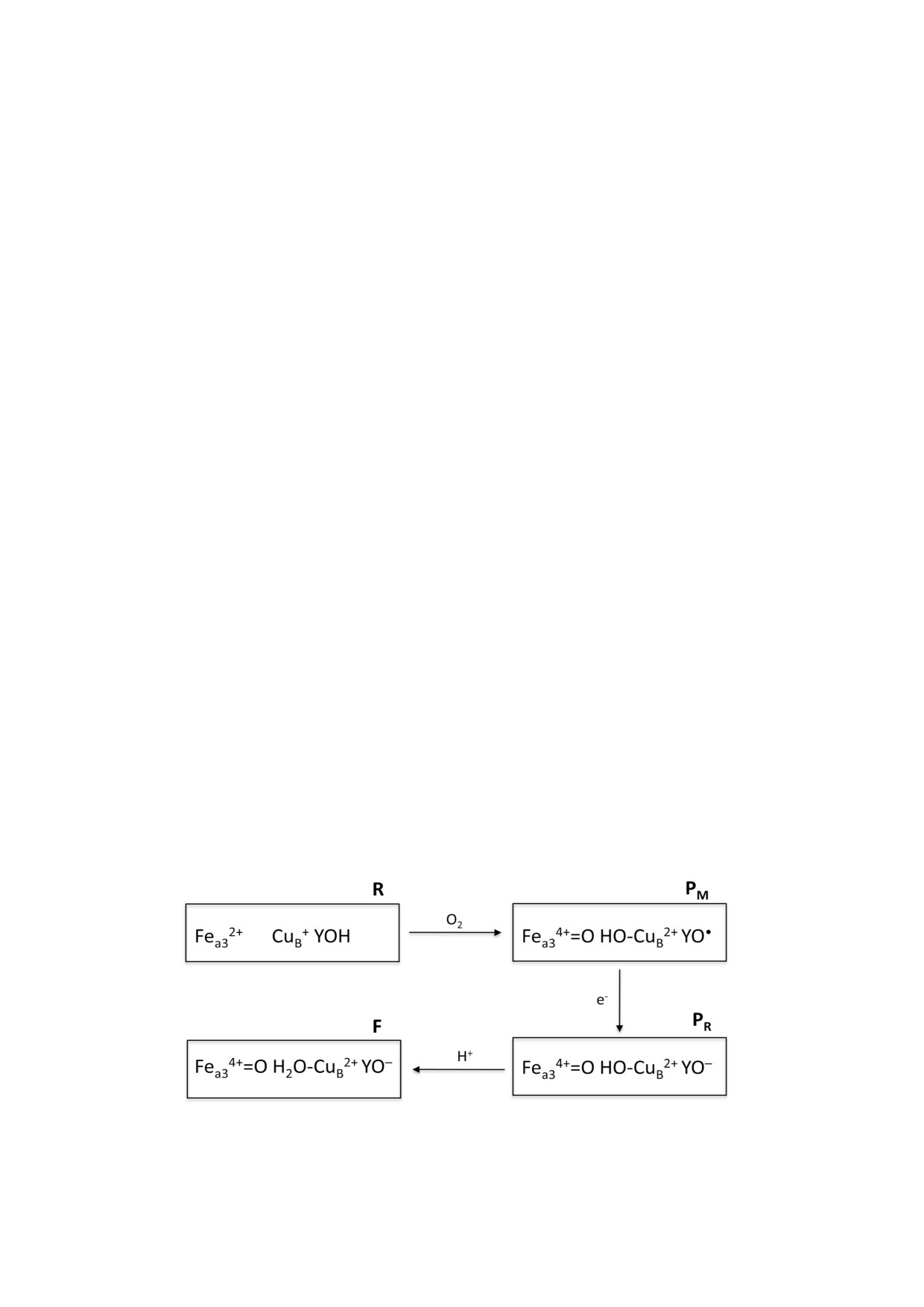
Во время восстановления молекулы O2 до H2O наблюдаются несколько феррильных состояний каталити
ческого центра гема a3 CuB цитохром c оксидазы (CcO) дыхательной цепи. Одна из феррильных форм P ти
па, PM, образуется в результате реакции двухэлектронного восстановленного CcO с O2. В этом состоянии
железо гема a3 находится в феррильном состоянии. Также в каталитическом центре присутствует свободный
радикал. Однако до сих пор экспериментально не установлена энергетика образования PM. В настоящей ра
боте с помощью метода изотермической титрационной калориметрии и UV Vis абсорбционной спектрофо
тометрии в оптическом диапазоне длин волн с примыкающей к нему ультрафиолетовой областью спектра
было изучено образование состояния PM в реакции взаимодействия окисленной бычьей цитохром с окси
дазы (O) с одной молекулой H2O2. С помощью обоих методов были разделены две кинетические фазы, от
носящиеся к образованию PM, и его эндогенная конверсия обратно в состояние O. Величина ΔH всего про
цесса (-66 ккал/моль H2O2) превышала значение выделившегося тепла (-50,8 ккал/моль O2) в реакции вос
становления O2 ферроцитохромом с (pH 8,25 °C). Интересно, что значение ΔH (-32 ккал/моль феррильно
го состояния), представляющее первую фазу, намного превышает энтальпию образования PM. Полученные
данные показывают, что во время первой фазы радикал в состоянии PM фактически гасится и образуется
спектрально аналогичная феррильная форма второго P типа (PR). Кроме того, было показано, что вклад
энтропии в изменения энергии Гиббса (ΔG = -46 ккал/моль O2) во время каталитического восстановления
молекулы O2 ферроцитохромом c минимален (-0,7 кал/моль K).
КЛЮЧЕВЫЕ СЛОВА: цитохром с оксидаза, перекись водорода, феррильное состояние, калориметрия изо
термического титрования.
DOI: 10.31857/S0320972521010073
ВВЕДЕНИЕ
Tyr локализуется очень близко к каталитическо
му центру фермента. Этот Tyr ковалентно связан
У аэробных организмов преобразование
с одним His, связывающим ион меди в катали
энергии происходит в дыхательных цепях, со
тическом центре фермента. HCO подразделяют
стоящих из организованных трансмембранных
на три подкласса: A, B и C. К оксидазам типа А
ферментативных комплексов. Терминальный
относятся оксидазы цитохрома с (CcO) в мито
комплекс в большинстве этих цепей принадле
хондриях и некоторых типах бактерий. Гем мед
жит к суперсемейству гем медных оксидаз
ные оксидазы B и C типа обнаружены только у
(HCO, heme copper oxidases), которые восста
бактерий и архей [1, 2].
навливают молекулярный кислород до воды.
Энергия, выделяемая оксидазой в процессе
Это суперсемейство выделяется наличием низ
восстановления молекулы O2 до воды, преобра
коспинового гема и каталитического центра,
зуется в трансмембранный протонный градиент.
состоящего из высокоспинового гема и иона ме
Этот градиент создается двумя различными ме
ди [1, 2]. Кроме того, редокс активный остаток
ханизмами [3, 4]. Один механизм включает
окисление цитохрома c на одной стороне мемб
Принятые сокращения: CcO - цитохром с оксида
раны (P сторона, митохондриальное межмемб
за; c2+ - ферроцитохром с, восстановленный цитохром с; ранное пространство или периплазма у бакте
Fea - ион железа цитохрома a; Fea3 - ион железа цитохро
ма a3; HCO - гем медные оксидазы; ITC - изотермическая
рий) и потребление протонов для синтеза моле
титрационная калориметрия; KPi - калий фосфатный бу
кулы воды на другой стороне мембраны (N сто
фер; TX - Triton X 100.
рона, митохондриальный матрикс или цито
* Адресат для корреспонденции.
плазма у бактерий). Второй механизм - это пе
89
90
МИКУЛОВА и др.
рекачка протонов, которая связывает окисли
(рис. 1). Непосредственным продуктом этой ре
тельно восстановительную реакцию (окисли
акции является первое феррильное состояние, в
тельные реакции) Ссо с трансмембранным пе
силу исторических причин называемое «peroxy»
реносом протонов с N на P сторону мембраны.
(PM). Хотя всего два «внешних» электрона дос
Эффективность перекачки протонов зависит от
тупны для образования состояния PM, в
типа HCO. В оксидазах А типа на каждый
действительности происходит четырехэлект
электрон, перенесенный в каталитический
ронное восстановление O2. В результате этого
центр фермента, в среднем накачивается один
восстановления происходит расщепление связи
протон [3, 5]. Однако оксидазы B и C типа не
между атомами кислорода [15-17]. Один из двух
столь эффективны и перекачивают H+ с более
дополнительных электронов, необходимых для
низкой стехиометрией [6, 7].
четырехэлектронного восстановления O2, по
Митохондриальная CcO катализирует окис
ступает от иона железа цитохрома a3 (Fea3)
ление ферроцитохрома с молекулярным кисло
[15, 17], а второй электрон, скорее всего - от
родом. В CcO перенос электрона от ферроци
Tyr244 (нумерация остатков по последователь
тохрома с на O2 облегчается четырьмя редокс
ности CcO быка) [18, 19], расположенного вбли
центрами: CuA, цитохром a, цитохром a3 и CuB.
зи от каталитического центра.
Двуядерный центр меди CuA является первым
Перенос другого электрона от цитохрома a в
акцептором электронов от ферроцитохрома c.
каталитические центры PM должен привести к
Эти электроны быстро распределяются меж
восстановлению радикала Tyr (YO•) и образова
ду CuA и ионом железа цитохрома a (Fea) [8-10].
нию тирозината (YO-) [4, 19]. Поскольку фер
Затем межбелковый перенос электронов про
рильное состояние имеет те же спектральные
должается от Fea на окисленный каталитичес
характеристики, что и PM, оно было назва
кий двуядерный центр гема a3 CuB. В этом цент
но PR [20, 21] (более подробно о различиях
ре происходит восстановление кислорода до во
см. Einarsdóttir et al. [22]). Образование PR со
ды, а также ингибирование активности CcO эк
провождается поглощением 2 H+ с N стороны
зогенными лигандами (например, цианидом и
мембраны, и второй тип феррильного промежу
азидом).
точного продукта, тип F, производится без како
Процесс восстановления O2 осуществляется
го либо переноса электронов. Один из двух аб
последовательностью спектрально различимых
сорбированных протонов используется для об
интермедиатов
каталитического
цент
разования воды в каталитическом центре
ра Fea3-CuB [4, 11, 12]. Наиболее загадочными и
Fea3-CuB, а другой протон подлежит перекач
важными в процессе превращения энергии яв
ке (рис. 1) [23-26]. Каталитический цикл завер
ляются два вида феррильных интермедиатов: P
шается одноэлектронным восстановлением F
и F [13, 14]. Эти феррильные состояния образу
формы. Переход F формы в окисленное состоя
ются определенным числом электронов и про
ние CcO (O) также сопровождается захватом
тонов, поставляемых в каталитический центр
двух протонов на N стороне. И снова один H+
фермента во время превращения O2 в H2O.
используется для синтеза воды, а второй - пере
Восстановление O2 начинается, когда оба
качивается [23-26].
металла в каталитическом центре находятся в
Аналогичные феррильные интермедиаты
восстановленном состоянии (R состояние)
были также идентифицированы в НСО B и C
Рис. 1. Предполагаемая структура феррильных интермедиатов каталитического центра, образующихся в ходе реакции
восстановленной цитохром c оксидазы с O2
БИОХИМИЯ том 86 вып. 1 2021
ФЕРРИЛЬНЫЙ ИНТЕРМЕДИАТ ЦИТОХРОМ c ОКСИДАЗЫ
91
типа и даже в неканонических цитохром bd ок
ниями в 10 мМ Tris HCl, pH 7,6, 50 мМ K2SO4
сидазах. Наличие форм PM [27], PR [28-30]
и 0,1% (w/v) TX. Препарат очищенной CcO за
и F [30] было показано для НСО B типа, ис
мораживали в жидком азоте и хранили
пользующего ba3 оксидазу из Thermus ther
при -80 °C. Концентрацию CcO определяли по
mophilus. Для семейства HCO С типа вычисли
спектру поглощения окисленного фермента в
тельные исследования, проведенные для cbb3
ближнем ультрафиолете и видимой области
оксидазы Pseudomonas strutzeri, показали, что
(UV Vis), используя коэффициент экстинкции
состояние, эквивалентное PM, является энерге
ε (424 нм), равный 156 мМ-1⋅см-1 [36].
тически неблагоприятным, и оно не должно об
Изотермическая титрационная калориметрия
разовываться. Связь в молекуле кислорода раз
(ITC). Метод ITC был использован для опреде
рывается на уровне феррильного интермедиа
ления значений энтальпии двух реакций. Пер
та F типа в тот момент, когда три внешних
вое значение - это ΔH окисления ферроцито
электрона и протона поступают в каталитичес
хрома с (c2+) молекулой O2, катализируе
кий центр [31].
мое CcO; второе - энтальпия образования фер
Феррильное состояние с π катион радика
рильного состояния PM в реакции между окис
лом гема d (Fed4+ =O π•+) было обнаружено во
ленной CcO (O) и H2O2.
время реакции полностью восстановленной bd
Энтальпию реакции окисления c2+ (21 мкМ)
оксидазы с молекулой O2 [32]. Эта форма анало
цитохром с оксидазой (51 нМ) измеряли в на
гична соединению I пероксидазы хрена или PM
сыщенном воздухом буфере (40 мМ калий фос
форме бычьей CcO. Последующее одноэлект
фатный буфер (KPi), pH 8,0, 0,1% (w/v) TX,
ронное восстановление (Fed4+=O π•+) приводит
0,5 мкМ каталазы). Кювету ITC (0,2 мл) запол
к образованию феррильного состояния без об
няли раствором восстановленного цитохро
разования радикала (Fed4+=O). Однако, по ви
ма с (c2+), и запускали реакцию его окисления
димому, состояние (Fed4+=O π•+) не может яв
добавлением 2 мкл раствора цитохром с оксида
ляться физиологическим интермедиатом, по
зы (5,22 мкМ) в течение 2 с. Цитохром c и цито
скольку оно не обнаруживается в стационарных
хром с оксидаза находились в одном и том же
условиях. Во время оборота bd оксидазы опре
буфере. Значение энтальпии реакции определя
делялись только феррильная (Fed4+=O) и ферро
ли как отношение количества выделившего теп
оксо (Fed2+ O2) формы [33, 34].
ла (мккал) к количеству c2+ (моль) в кювете.
Несмотря на ключевую роль феррильных
При измерении энтальпии образования
состояний в каталитическом центре и перекачи
формы PM с помощью метода ITC очищен
вании протонов цитохром с оксидазой, термо
ную CcO (150-250 мкМ) полностью окисляли
динамические характеристики их образования и
при инкубации с 10 мМ феррицианида калия в
взаимные превращения экспериментально не
течение 5 мин при комнатной температуре. За
определены. В настоящей работе нами был ис
тем феррицианид калия удаляли при пропуска
пользован метод изотермической титрационной
нии образцов через обессоливающую колон
калориметрии, чтобы определить энтальпию
ку PD 10 («Amersham Biosciences Inc.», Шве
процесса образования состояния PM в ходе ре
ция), используя 40 мМ (KPi), pH 8,0, содержа
акции окисленной цитохром с оксидазы с H2O2.
щий 0,1% TX. Этот препарат окисленной CcO
Кроме того, нами было показано, что каталити
далее использовали в измерениях ITC.
ческое восстановление O2 в CcO четырьмя моле
Образование PM при ITC запускалось одно
кулами ферроцитохрома c в основном обуслов
кратным введением 2,5 мкл H2O2 (431 мкМ) в
лено изменением энтальпии.
течение 2 с в кювету (200 мкл), заполненную
раствором окисленной CcO (54 мкМ). Как CcO,
так и раствор перекиси водорода были приго
МАТЕРИАЛЫ И МЕТОДЫ
товлены на одном и том же буфере (40 мМ KPi,
pH 8,0, 0,1 % TX). Все измерения ITC проводи
Реактивы. Hepes (4 (2 hydroxyethyl) 1 piper
ли на приборе MicroCal ITC
200
(«GE
azineethanesulfonic acid), Trizma (2 amino 2
Healthcare», США) при 25 °C.
(hydroxymethyl) 1,3 propanediol) и феррицианид
Кинетическая кривая реакции перекиси во
калия («Sigma Aldrich», США); Triton X 100
дорода с окисленной СсО состоит из двух фаз,
(TX) поступил от Roche Diagnostics («Roche»,
относящихся к быстрому образованию PM с по
Швейцария); раствор перекиси водорода
следующим более медленным эндогенным пе
(~30%) («Fluka», США).
реходом в состояние O. Чтобы определить коли
Цитохром c оксидаза сердца быка была очи
чество выделенного тепла в первой фазе, обра
щена из митохондрий с использованием ранее
зование феррильного состояния, вся кинетика
описанного метода [35] с небольшими измене
ITC была разбита на кривую, представляющую
БИОХИМИЯ том 86 вып. 1 2021
92
МИКУЛОВА и др.
образование PM и кривую, представляющую его
личеством сухого дитионита и последующим
эндогенный распад (см. «Результаты исследова
обессоливанием образца на колонке PD
ния»). Поскольку площадь под кривой ITC
10 («Amersham Biosciences Inc.», Швеция), урав
представляет выделенную теплоту, то площадь
новешенной 40 мМ KPi, pH 8,0. Концентра
под кривой первой фазы была определена путем
цию c2+ определяли по дифференциальному
интегрирования с использованием графической
спектру: восстановленный минус окисленный
программы Igor («WaveMetrics», США). Тогда
цитохром с с использованием значения
отношение этой теплоты к количеству ферриль
Δε (550-542 нм) = 20 мМ-1⋅см-1 [40].
ных форм (PM + F), определенное в ходе парал
лельных измерений с помощью метода УФ
спектроскопии поглощения (UV Vis), представ
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
ляет изменения энтальпии для образования этих
феррильных состояний.
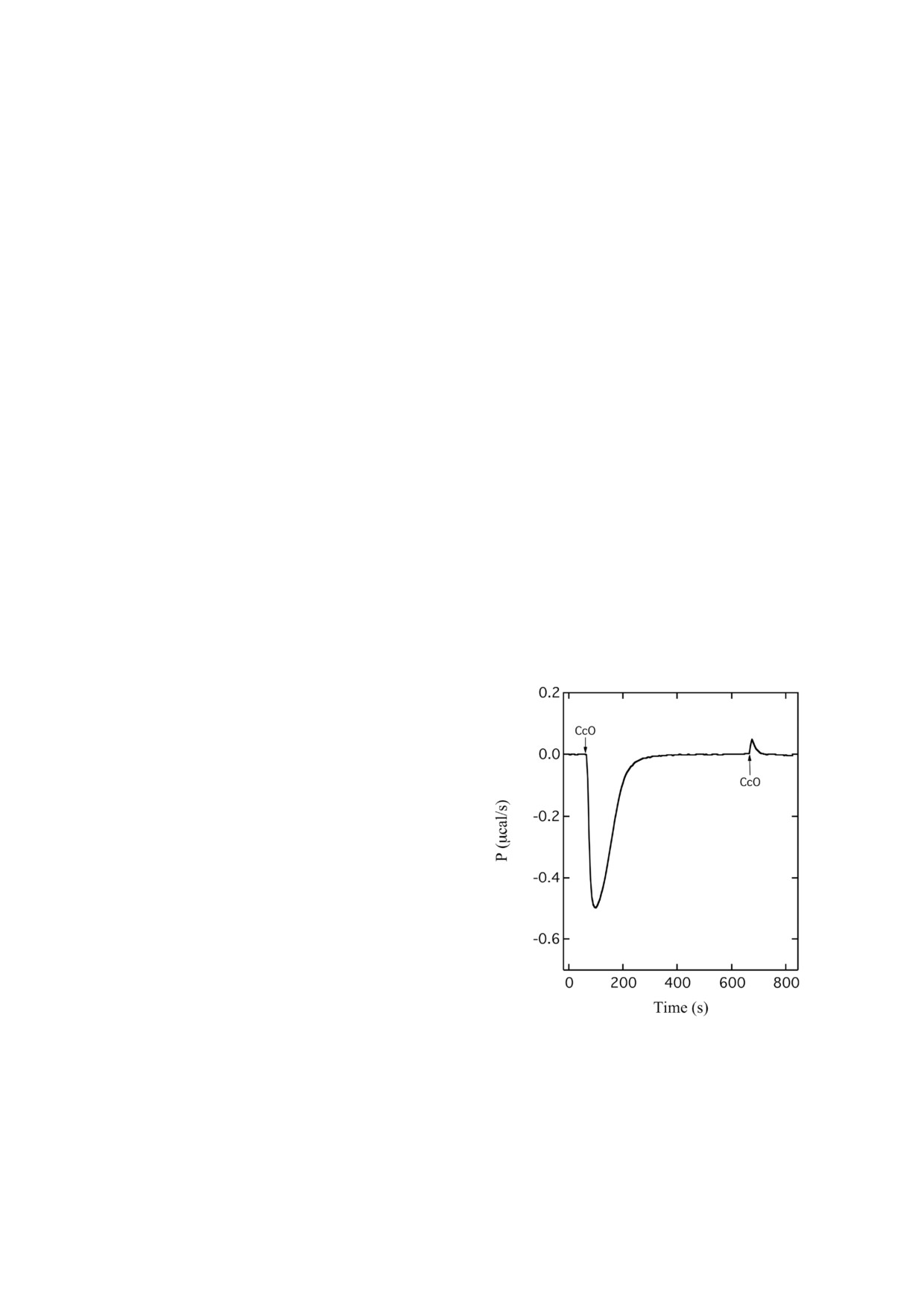
Термодинамика каталитического оборота CcO.
Абсорбционная UV Vis спектроскопия. Оцен
Как можно было ожидать, окисление ферроци
ка реакции между окисленной формой CcO и
тохрома с (c2+) с помощью СcO сопровождается
H2O2 также была произведена с использованием
высвобождением теплоты (рис. 2). Об этом сви
спектрометра с диодной матрицей Specord S600
детельствуют отрицательные значения скорости
(«Analytik Jena», Германия). После смешивания
нагрева, наблюдаемые после первого введе
перекиси водорода и окисленной СсО каж
ния CcO в кювету ITC, заполненную c2+. После
дые 10 с регистрировали спектры поглощения в
дующее идентичное введение CcO после полно
диапазоне 400-700 нм. На основе накопленных
го завершения окисления c2+ было использова
спектров далее были получены данные кинети
но для определения комбинированной теплоты
ки спектральных изменений (ΔA 607-630 нм) и
для смешивания, разведения и, возможно, для
абсолютные спектры CcO в определенные мо
связывания окисленного цитохрома c с CcO. Ве
менты времени протекания реакции.
личина поглощенной теплоты в этих контролях
Несмотря на то, что подобранные экспери
составляла ~3% от теплоты, высвобожденной в
ментальные условия благоприятствуют образо
ходе окисления c2+. Тем не менее это небольшое
ванию состояния PM, реакция окисленной CcO
количество было добавлено к количеству тепло
с H2O2 приводит также к образованию второго
ты, выделившегося в процессе окисления c2+.
типа феррильной формы - состоянию F [37].
Состав продукта реакции, выраженный в виде
концентраций PM и F, можно определить по
дифференциальному спектру поглощения UV
Vis [38]. Этот дифференциальный спектр был
получен путем вычитания спектра исходной
окисленной формы CcO из спектра CcO, обра
ботанной H2O2. Концентрацию PM рассчитыва
ли по этому дифференциальному спектру с ис
пользованием Δε (607-630 нм) = 11 мМ-1⋅см-1
[12]. Общее количество CcO, вступившей в
реакцию с H2O2, и сумму PM и F определяли
по тому же спектру с использованием
Δε (438-413 нм) = 67 мМ-1⋅см-1 [38].
Приготовление реактивов. Приобретенный
препарат H2O2 разводили деионизированной
водой и определяли концентрацию полученного
раствора по значению оптического поглощения
при 240 нм с использованием ε (240 нм) =
= 40 мМ-1⋅см-1 [39]. Из разведенного раствора
перекиси водорода приготавливали аликво
ты (100 мкл (431 мкМ) H2O2 в 40 мМ KPi,
Рис. 2. Выделение теплоты во время оборота цитохром с
pH 8,0), которые замораживали в жидком азоте
оксидазы. Окисление ферроцитохрома с (21 мкМ) с по
и хранили при -80 °C. Для проведения каждой
мощью CcO (51 нМ) регистрировалось с использованием
калориметра изотермического титрования при 25 °C. Две
реакции с CcO использовали новую аликвоту
стрелки (CcO) показывают время введения 2 мкл окислен
замороженного раствора H2O2.
ной CcO (5,22 мкM) в реакционную кювету, заполненную
Ферроцитохром с (c2+) получали восстанов
цитохромом с. Использован буфер, содержащий
лением феррицитохрома с (c3+) небольшим ко
40 мМ KPi, pH 8,0, 0,1% TX и 0,5 мкM каталазы
БИОХИМИЯ том 86 вып. 1 2021
ФЕРРИЛЬНЫЙ ИНТЕРМЕДИАТ ЦИТОХРОМ c ОКСИДАЗЫ
93
С этой поправкой была определена энтальпия
реакции ΔH = -11,5 ± 0,3 ккал/моль c2+.
Однако окисление одной молекулы c2+ мо
лекулой O2 связано с извлечением одного про
тона из фосфатного буфера для образования
молекулы воды. Таким образом, значение
ΔH = -11,5 ккал/моль необходимо скорректи
ровать с учетом энтальпии ионизации буфе
ра (ΔH = +1,22 ккал/моль) [41]. После этой кор
ректировки энтальпия окисления c2+ молеку
лой O2 составляет -12,7 ккал/моль c2+ (-0,55 эВ).
Тогда ΔH - 50,8 ккал/моль (-2,2 эВ) соответ
ствует общему восстановлению O2 четырьмя c2+
при pH 8,0 и 25 °C. ΔH = -16,7 ккал/моль c2+ бы
ло определено в более ранних исследованиях с
применением метода ITC в немного отличаю
щихся условиях (pH 7,4, 23 °C) [41].
Определив ΔH, есть возможность рассчитать
величину изменения энтропии реакции (ΔS) с
помощью известной формулы расчета измене
ний энергии Гиббса (ΔG = ΔH - TΔS). Значе
ние ΔG может быть рассчитано по форму
ле ΔG = -nxFxΔEm, где n - это число электро
нов, перенесенных в окислительно восстанови
тельной реакции (n = 4), F - это постоянная Фа
радея (96 485 Дж/(моль В)) и ΔEm представляет
разность потенциалов средней точки между ак
цептором электронов (пара O2/H2O) и донором
электронов (c3+/c2+). Пара O2/H2O имеет потен
циал средней точки при pH
8,0, рав
ный +755 мВ (Em,8) при летучести кислорода
в 1 атм., что соответствует 1,2 мМ O2 в растворе
при 25 °C. Поскольку наши измерения были
проведены в насыщенном воздухом буфере при
концентрации O2 ~0,25 мМ, этот потенциал
должен понизиться на 10 мВ [4]. Таким образом,
в этих условиях (pH 8,0, 0,25 мМ O2, 25 °C) по
тенциал средней точки пары O2/H2O составля
ет +745 мВ. Принимая во внимание значе
ние +245 мВ для Em цитохрома c [40], значе
ние ΔEm будет равно +500 мВ. Эта разница со
ставляет ΔG ~46 ккал/моль O2 (-2,0 эВ). Следо
вательно, вклад энтропии в энергию Гиббса бу
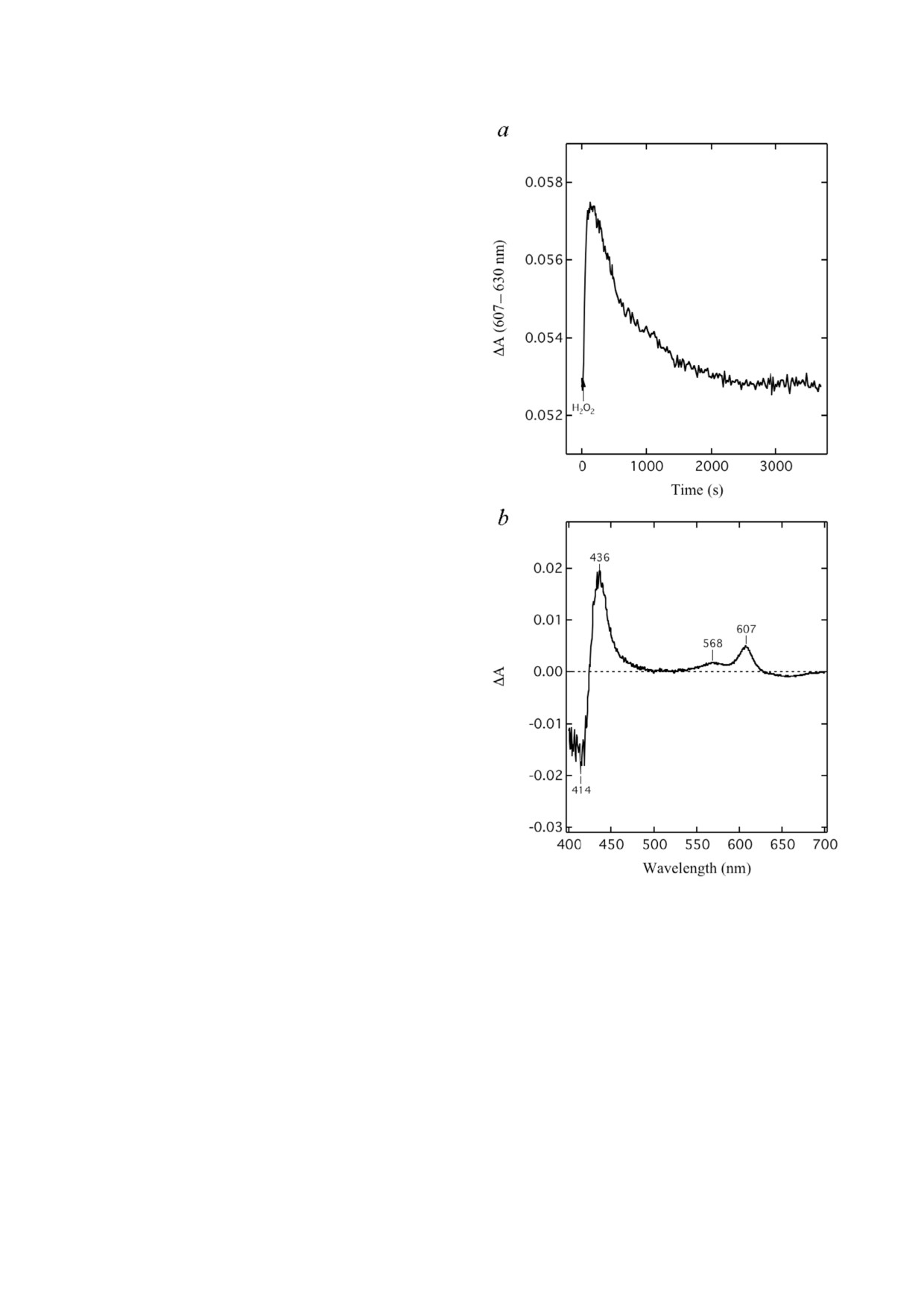
Рис. 3. Получение феррильного состояния PM цитохром c
дет равен всего +4,8 ккал/моль O2 (~10%), что
оксидазы в реакции с перекисью водорода: спектральные
соответствует изменению энтропии ΔS
=
измерения. a - Кинетика образования и эндогенного рас
пада PM, образованного в реакции окислен
= -0,7 кал/моль-1⋅K-1. Малая величина ΔS озна
ной CcO (54 мкМ) с H2O2 (5,3 мкМ) при 25 °C. Стрел
чает, что изменение энтальпии является основ
ка (H2O2) показывает время добавления перекиси водорода.
ной движущей силой процесса восстановления
b - Дифференциальный спектр, полученный в результате
молекулы O2 ферроцитохромом c.
вычитания спектра исходной окисленной CcO из спектра,
полученного в тот момент времени (180 с), когда изменение
При физиологических условиях оборот ци
величины поглощения ΔA (607-630 нм) достигло своего
тохром c оксидазы, погруженной в мембрану,
максимума. Состав буфера такой же, как указано на рис. 2
связан с генерацией трансмембранного гради
ента H+. Этот градиент образуется в результате
абсорбции протонов с одной стороны мембраны
образом изменением энтальпии в ходе восста
и их высвобождением на другой стороне мемб
новления O2.
раны. Наши данные предполагают, что форми
Термодинамика феррильной формы PM. Взаи
рование этого градиента обусловлено главным
модействие окисленной CcO с одной молеку
БИОХИМИЯ том 86 вып. 1 2021
94
МИКУЛОВА и др.
лен на рис. 3, а, на котором ход реакции показан
в виде изменения спектра поглощения ΔA
(607-630 нм) с течением времени. Спектраль
ные изменения происходили в двух различных
фазах. Первоначальное увеличение значения ΔA
(607-630 нм) после добавления 5,3 мкМ H2O2 к
окисленной форме CcO (54 мкМ) отражает обра
зование формы PM. Затем PM эндогенно распада
ется с образованием снова формы O. Этот пере
ход, представленный снижением поглоще
ния ΔA (607-630 нм), в данных условиях проис
ходит в течение примерно одного часа.
Доминирующее образование состояния PM
подтверждено дифференциальными спектрами
CcO (рис. 3, b). Эти спектры получали в резуль
тате вычитания спектра окисленной СсО из
спектра, полученного в момент времени, когда
значение ΔA (607-630 нм) достигло своего мак
симума (180 с после добавления H2O2).
По спектральному изменению полосы Соре
было установлено, что всего 5,2 мкМ CcO всту
пило в реакцию с H2O2 (сумма концентраций PM
и F). По дифференциальному спектру ΔA
(607-630 нм) установлено, что 4,7 мкМ CcO на
ходится в состоянии PM. Таким образом, про
дукт реакции состоит из двух феррильных
форм [~90% формы PM (4,7 мкМ) и ~10% фор
мы F (0,5 мкМ)].
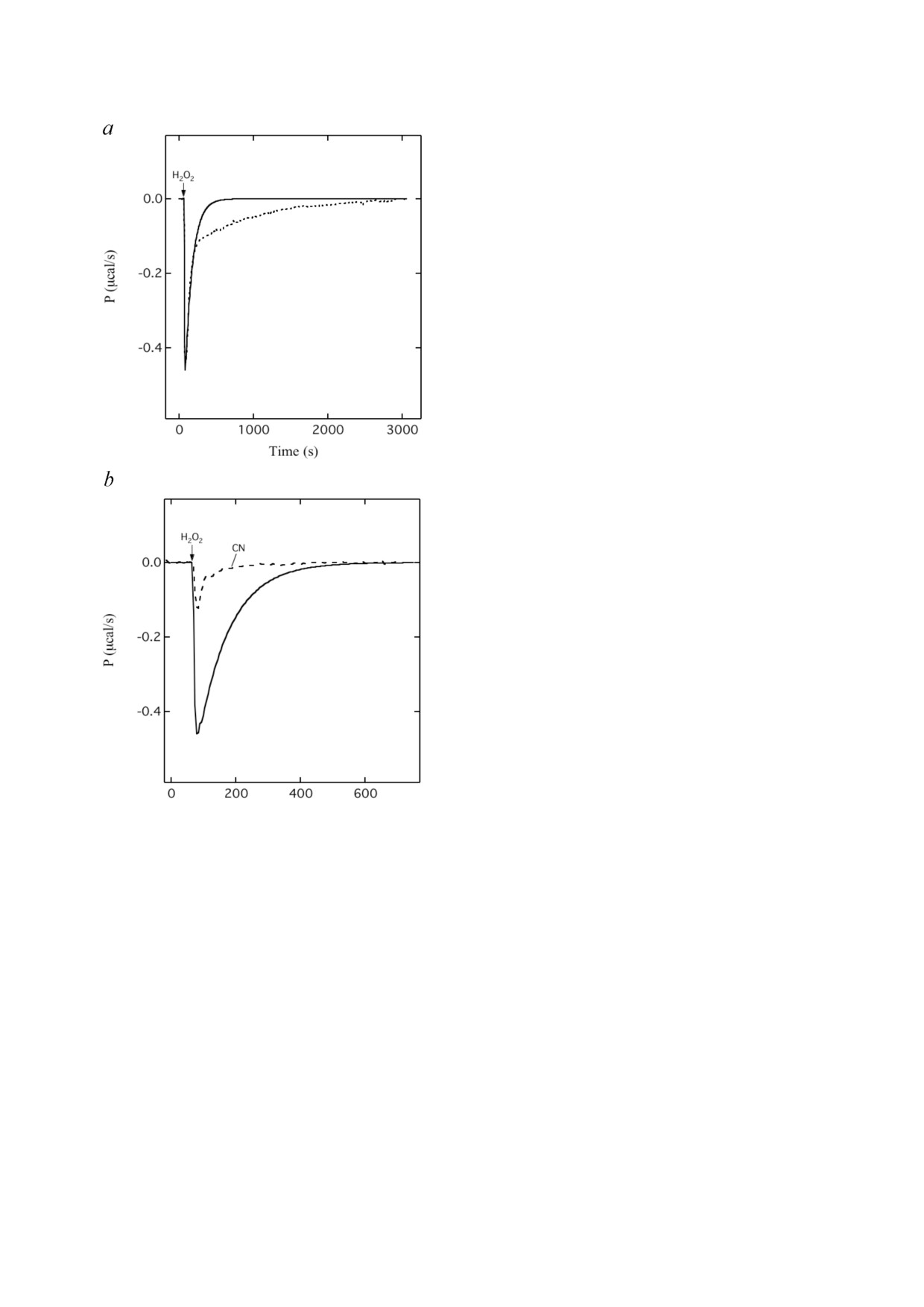
Эта реакция также была проведена на кало
риметре для изотермического титрования
(рис. 4). Зависимость скорости тепловыделения
от времени также показывает две фазы. Отрица
тельные значения скорости, которые наблюда
лись во время всего процесса в целом, показали,
что тепло выделяется в обеих фазах. Общее ко
личество выделившегося тепла, представленно
го площадью под всей кривой, составля
ет -66 ккал/моль H2O2.
Очевидно, быстрая фаза наблюдаемого про
Рис. 4. Образование феррильного состояния PM цито
хром c оксидазы перекисью водорода: калориметрические
цесса соответствует образованию феррильных
измерения. а - Временная зависимость скорости тепловы
состояний, а более медленная фаза - их возвра
деления после введения перекиси водорода (5,3 мкМ) в ре
щению результате распада в состояние O. Сразу
акционную кювету с окисленной СсО (54 мкМ) при 25 °C.
Пунктирная линия - измеренная кинетическая кривая
после введения H2O2, скорость тепловыделения
полного тепловыделения. Сплошная линия - тепловыде
возрастает до максимума, поскольку она про
. b
- Кинетическая
ление, связанное с образованием PM
порциональна скорости образования ферриль
кривая образования PM, приведенная выше (сплошная ли
ных состояний, которая находится на максиму
ния) вместе со скоростью тепловыделения, наблюдаемой
при реакции цианид лигированного CcO с H2O2 (пунктир
ме в начале реакции. Следующее снижение
ная линия). Цианидный комплекс (54 мкМ CcO-CN) реа
между 60 и 180 с связано со снижением скорос
гировал с 9,6 мкМ H2O2
в буфере, содержащем 2 мМ KCN.
ти образования этих феррильных форм. Если
) показано время введения перекиси во
Стрелками (H2O2
реакция останавливается на стадии образования
дорода (2,5 мкл в течение 2 с). Состав буфера такой же, как
феррильных состояний, то её скорость должна
указано на рис. 2
упасть от максимума до нуля в моноэкспонен
циальном процессе. Однако такое резкое сни
лой H2O2 при щелочных значениях pH приводит
жение не наблюдается, так как есть вклад второ
к образованию феррильного состояния катали
го процесса, связанного с выделением тепла в
тического центра, которое эквивалентно фор
результате эндогенного распада феррильных
ме PM [38, 42]. Это процесс при pH 8,0 представ
состояний обратно в состояния O. Поэтому что
БИОХИМИЯ том 86 вып. 1 2021
ФЕРРИЛЬНЫЙ ИНТЕРМЕДИАТ ЦИТОХРОМ c ОКСИДАЗЫ
95
бы получить кривую ITC, касающуюся только
Существует несколько предполагаемых
образования феррильных форм, данные кине
структур каталитического центра в случае состо
тики в диапазоне 60-180 с были обработаны с
яний PM и F [4, 12, 45, 46]. Общую реакцию O
помощью моноэкспоненциальной функции.
с H2O2 в каталитическом центре можно проил
Также была построена полная кривая, состоя
люстрировать следующей схемой:
щая из двух сегментов, представляющая образо
вание феррильных состояний в диапазоне от ну
ля до 3000 с. Первый сегмент представлял
действительные данные ITC вплоть до 180 с.
Второй сегмент включал данные, полученные в
диапазоне 180-3000 с, и содержал данные моно
экспоненциальной функции.
Кривая ITC для образования PM представле
на в виде пунктирной линии на рис. 4. Площадь
под этой кривой означает изменение энтальпии,
равное -34,6 ккал/моль феррильных состояний
в этом конкретном случае. Среднее значение,
где первая стадия (A) - обратимое связыва
равное -35,0 ± 3,2 ккал/моль феррильных со
ние H2O2 с окисленным каталитическим цент
стояний, было получено в результате трех неза
ром (интермедиат P0) [12]. Этот комплекс очень
висимых измерений с использованием двух раз
нестабилен и в ходе окислительно восстанови
личных препаратов CcO. Эта разница значения
тельной реакции дает начало феррильной фор
энтальпии представляет комбинированную теп
ме PM и радикалу остатка Tyr (YO•) (B). После
лоту образования PM (~90%) и F (~10%).
двухэлектронного эндогенного восстановле
Контрольные измерения ITC показали, что
ния PM окисленный каталитический центр CcO
тепловыделение существенно ингибируется,
регенерируется и пероксид полностью восста
если в реакции с H2O2 используется комплекс
навливается до воды (C).
окисленной СсО с цианидом (CcO-CN)
Представленная выше схема общей реакции
(рис. 4, b). Для цианид лигированного CcO бы
в каталитическом центре создает впечатление
ло определено изменение энтальпии, равное
полного восстановления окисленной CcO. Од
примерно -3,0 ккал/моль H2O2. Таким обра
нако ранее мы показали, что обработка CcO суб
зом, после вычитания этой неспецифической
миллимолярными концентрациями H2O2 вызы
теплоты конечное изменение энтальпии
вает снижение её каталитической активности.
ΔH = -32 ккал/моль феррильных состояний
Таким образом, внутренняя пероксидазная ак
обусловлено образованием феррильных состо
тивность связана с необратимой модификаци
яний, а значение ΔH, равное -34 ккал/моль,
ей CcO [47].
соответствует их эндогенному превращению в
Изменение энтальпии для эндогенного вос
О состояние.
становления H2O2 (ΔH = -66 ккал/моль H2O2
(-2,9 эВ)) превышает значение энтальпии, оп
ределенной для общей реакции восстановле
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
ния O2 четырьмя молекулами ферроцитохро
мов (ΔH = -50,8 ккал/моль O2 (-2,2 эВ)). Боль
Феррильные интермедиаты, полученные ре
шее абсолютное значение ΔH, полученное в
акцией окисленной СсО с H2O2, часто использу
случае восстановления H2O2 до воды, скорее
ются для изучения естественных каталитичес
всего, является результатом участия в этих двух
ких интермедиатов этого фермента [42-45].
процессах различных доноров электронов. При
В настоящей работе для получения феррильного
эндогенном восстановлении H2O2 конечные до
состояния PM была использована реакция субс
норы электронов должны иметь более низкие
техиометрического количества H2O2 с окислен
потенциалы средней точки, чем у цитохро
ной СсО при щелочных значения pH. Чтобы
ма c (+245 мВ). Например, остатки Cys [48] и
исключить множественные взаимодействия од
Met с потенциалами средней точки око
ной молекулы CcO с перекисью водорода, ис
ло -250 мВ удовлетворяют этому требованию.
пользовали низкие концентрации H2O2 относи
Из общего изменения энтальпии (-66 ккал/
тельно концентрации фермента. Как показыва
моль H2O2) значение ΔH = -32 ккал/моль про
ет измерение поглощения UV Vis (рис. 3, b),
реагировавшей CcO ассоциировано с образова
после обработки перекисью водорода и образо
нием двух феррильных состояний: PM (90%) и
вания феррильных форм CcO снова возвраща
F (10%). Меньшая фракция F, вероятно, обус
ется в полностью окисленное состояние.
ловлена реакцией P со второй молеку
БИОХИМИЯ том 86 вып. 1 2021
96
МИКУЛОВА и др.
лой H2O2 [37, 42, 47, 49, 50]. Было высказано
также тепло, высвобождаемое в ходе нескольких
предположение, что превращение PM, стимули
дополнительных реакций. В результате много
руемое H2O2, является окислительно восстано
численных экспериментальных наблюдений
вительной реакцией (D) [51, 52]:
можно предположить, что радикал Tyr в катали
тическом центре CcO, образующийся при реак
ции окисленной СсО с H2O2, менее стабилен,
чем феррильное состояние. Это предположение
основано на наблюдениях различных типов и
В этом случае происходит перенос атома во
количеств свободных радикалов [38, 61-64],
дорода от H2O2 на радикал Tyr244 и высвобожда
изучении миграции радикалов и модификации
ется супероксид. Теплоту, выделяющуюся при
нескольких находящихся на удалении остат
переносе атома водорода, можно рассчитать из
ков Trp и связанных с ними фосфолипи
разницы между значениями ΔH диссоциации
дов [65-67] при взаимодействии окисленно
связи H-O в H2O2 (~88 ккал/моль) и фено
го CcO с H2O2. Кроме того, наше предыдущее
лах (~90 ккал/моль) [53]. Исходя из этих значе
исследование показало, что через несколько ми
ний, перенос атома H должен привести к высво
нут (~5 мин) после образования PM при 4 °C
бождению примерно -2 ккал/моль H2O2. Тогда
большая часть радикалов (~70%) удаляется из
вклад этого превращения в определяемое значе
каталитического центра [68].
ние ΔH пренебрежительно мал (-0,2 ккал/моль),
Такое поведение радикала Tyr, обладающего
поскольку только 10% PM превращается в F.
меньшей стабильностью по сравнению с желе
Следовательно, наблюдаемое значение ΔH
зом в феррильном состоянии, очень похоже на
(-32 ккал/моль прореагировавшей CcO) в ос
поведение первичных радикалов в миоглоби
новном представляет энтальпию, связанную с
нах [69-71], гемоглобинах [72-75], цитохром c
переходом из O состояния в PM.
пероксидазе [76], аскорбатпероксидазе [77], пе
Значение ΔH (-32 ккал/моль для PM) можно
роксидазе хрена [78] и простагландин Н синта
рассматривать как результат протекания, по
зе [79]. Поэтому мы пришли к выводу, что боль
крайней мере, двух процессов. Одним из них яв
шая величина ΔH (-32 ккал/моль из PM) являет
ляется обратимое связывание H2O2 с каталити
ся следствием комбинированной теплоты реак
ческим центром Fea3-CuB и образование P0.
ции образования состояния PM и миграции ра
Второй процесс - это окислительно восстано
дикалов из каталитического центра Fea3-CuB,
вительная реакция. Насколько нам известно,
вероятно, также связанной с его тушением. Воз
пока нет экспериментальных данных по энталь
можно, часть радикалов может быть восстанов
пии реакции для какого либо из этих двух про
лена в результате обычного переноса электро
цессов или энтальпии всей реакции CcO с H2O2.
нов, поступивших из следов примесей в буфер
Однако теоретические рассчеты показали, что
ных растворах.
превращение P0 в PM состояние должно быть
Радикал Tyr также играет ключевую роль в
связано с изменением энергии Гиббса менее чем
некоторых предложенных механизмах перекач
на -10 ккал/моль [54, 55]. Так как предполагае
ки протонов с участием CcO [4, 46, 80-82]. Ка
мые изменения энтропии при этом переходе
талитическое восстановление Tyr• в цитохроме a
минимальны [56], значения ΔH и ΔG должны
приводит к состоянию PR и должно обеспечить
быть очень близки. Основываясь на этом допу
энергию для перемещения одного протона внут
щении, величина ΔH связывания перекиси во
ри белка к так называемой протонной ловушке
дорода с окисленной CcO должна состав
или месту загрузки протонов [4, 83]. Можно
лять -22 ккал/моль. Однако и знак, и величина
предположить, что в отсутствие внешних доно
этого ΔH не согласуется с опубликованными
ров электронов, способность СсО перекачи
данными, полученными для связывания H2O2 с
вать H+ за счет восстановления радикалов может
различными гемовыми белками. Измерения с
быть утрачена через несколько минут после об
использованием мутанта человеческого миогло
разования PM. Эта потеря может быть следстви
бина (His64Gly) [57], Mn восстановленного мио
ем нефизиологического редокс пути, который
глобина [58], пероксидазы хрена при минусовых
используется для аннигиляции радикалов Tyr.
температурах [59] и Mn восстановленной пе
В целом это исследование показало, как с по
роксидазы хрена [60] показали только положи
мощью абсорбционной спектроскопии UV Vis,
тельные величины ΔH со значениями от нуля
так и с помощью изотермической титрационной
до +4 ккал/моль.
калориметрии, что переход окисленной бычьей
Чтобы устранить это несоответствие, мы
цитохром с оксидазы в феррильное состояние PM
предположили, что наблюдаемая большая вели
с помощью H2O2 сопровождается выделением
чина ΔH (-32 ккал/моль PM) включает в себя
большого количества тепла (-32 ккал/моль фер
БИОХИМИЯ том 86 вып. 1 2021
ФЕРРИЛЬНЫЙ ИНТЕРМЕДИАТ ЦИТОХРОМ c ОКСИДАЗЫ
97
рильного состояния). Это составляет ~64% обще
которые вносят вклад в наблюдаемое изменение
го изменения ΔH, наблюдаемого при каталити
энтальпии в ходе реакции окисленной СсО с
ческом восстановлении молекулы O2 четырьмя
H2O2.
ферроцитохромами c. Избыток выделенного теп
ла означает, что во время генерации формы PM
также протекают какие то другие побочные ре
Благодарности. Эта работа посвящается па
акции. На основании наших и других опублико
мяти А.А. Константинова, выдающегося учено
ванных данных, реакцию окисленной СсО с
го, вдохновляющего коллегу и дорогого друга.
H2O2 можно обобщить следующей схемой (E):
Финансирование. Настоящая работа была
выполнена в рамках проекта «Открытое научное
сообщество для проведения современных меж
дисциплинарных исследований в медицине»
(«Open scientific community for modern interdisci
plinary research in medicine (OPENMED)
ITMS2014+: 313011V455»), проводимого Operat
где действительно образуются два феррильных
ional Program Integrated Infrastructure и финан
состояния P типа, PM и PR, для которых харак
сируемого ERDF и Грантовым Агентством Сло
терны идентичные спектры в видимой области
вакии (Slovak Grant Agency) (VEGA 1/0464/18).
спектра. Сначала H2O2 вызывает образование
Конфликт интересов. Авторы заявляют об от
феррильного железа и радикала в каталитичес
сутствии конфликта интересов в финансовой
ком центре (PM). Однако в то время, когда эта
или какой либо иной сфере.
форма окисленного железа P типа спектрально
Соблюдение этических норм. В настоящей ра
полностью развита, радикал уже мигрировал из
боте нет описания работ, выполненных автора
каталитического центра и сформировалось со
ми статьи и проведенных с участием людей или
стояние PR. Эта миграция радикала и его веро
использованием в качестве объектов исследова
ятное тушение - очевидно, побочные реакции,
ния лабораторных животных.
СПИСОК ЛИТЕРАТУРЫ
1. Pereira, M. M., Santana, M., and Teixeira, M. A (2001)
transfer in cytochrome oxidase, Method Enzymol., 456,
Novel scenario for the evolution of haem copper oxygen
507 520.
reductases, Biochim. Biophys. Acta Bioenerg., 1505, 185 208.
11. Wikstrom, M. (2012) Active site intermediates in the
2. Sousa, F. L., Alves, R. J., Ribeiro, M. A., Pereira Leal,
reduction of O2 by cytochrome oxidase, and their deriva
J. B., Teixeira, M., et al. (2012) The superfamily of
tives, Biochim. Biophys. Acta, 1817, 468 475.
heme-copper oxygen reductases: types and evolutionary
12. Konstantinov, A. A. (2012) Cytochrome c oxidase:
considerations, Biochim. Biophys. Acta, 1817, 629 637.
Intermediates of the catalytic cycle and their energy cou
3. Wikstrom, M. K. (1977) Proton pump coupled to
pled interconversion, FEBS Lett., 586, 630 639.
cytochrome c oxidase in mitochondria, Nature, 266, 271
13. Wikstrom, M. (1981) Energy dependent reversal of the
273.
cytochrome oxidase reaction, Proc. Natl. Acad. Sci. USA,
4. Wikstrom, M., Krab, K., and Sharma, V. (2018) Oxygen
78, 4051 4054.
activation and energy conservation by cytochrome c oxi
14. Wikstrom, M., and Morgan, J. E. (1992) The dioxygen
dase, Chem. Rev., 118, 2469 2490.
cycle. Spectral, kinetic, and thermodynamic characteris
5. Kim, Y. C., Wikstrom, M., Hummer, G. (2007) Kinetic
tics of ferryl and peroxy intermediates observed by reversal
models of redox coupled proton pumping, Proc. Natl.
of the cytochrome oxidase reaction, J. Biol. Chem., 267,
Acad. Sci. USA, 104, 2169 2174.
10266 10273.
6. Rauhamaki, V., and Wikstrom, M. (2014) The causes of
15. Proshlyakov, D. A., Pressler, M. A., and Babcock, G. T.
reduced proton pumping efficiency in type B and C respi
(1998) Dioxygen activation and bond cleavage by mixed
ratory heme copper oxidases, and in some mutated vari
valence cytochrome c oxidase, Proc. Natl. Acad. Sci. USA,
ants of type A, Biochim. Biophys. Acta Bioenerg., 1837, 999
95, 8020 8025.
1003.
16. Fabian, M., Wong, W. W., Gennis, R. B., and Palmer, G.
7. Han, H., Hemp, J., Pace, L. A., Ouyang, H., Ganesan, K.,
(1999) Mass spectrometric determination of dioxygen
et al. (2011) Adaptation of aerobic respiration to low O2
bond splitting in the
“peroxy” intermediate of
environments, Proc. Natl. Acad. Sci. USA, 108, 14109
cytochrome c oxidase, Proc. Natl. Acad. Sci. USA, 96,
14114.
13114 13117.
8. Pan, L. P., Hibdon, S., Liu, R. Q., Durham, B., and
17. Pinakoulaki, E., Daskalakis, V., Ohta, T., Richter, O. M.,
Millett, F. (1993) Intracomplex electron transfer between
Budiman, K., et al. (2013) The protein effect in the struc
ruthenium cytochrome c derivatives and cytochrome c
ture of two ferryl oxo intermediates at the same oxidation
oxidase, Biochemistry, 32, 8492 8498.
level in the heme copper binuclear center of cytochrome c
9. Szundi, I., Cappuccio, J. A., Borovok, N., Kotlyar, A. B.,
oxidase, J. Biol. Chem., 288, 20261 20266.
and Einarsdottir, O. (2001) Photoinduced electron transfer
18. Proshlyakov, D. A., Pressler, M. A., DeMaso, C., Leykam,
in the cytochrome c/cytochrome c oxidase complex using
J. F., DeWitt, D. L., and Babcock, G. T. (2000) Oxygen
thiouredopyrenetrisulfonate labeled cytochrome c optical
activation and reduction in respiration: involvement of
multichannel detection, Biochemistry, 40, 2186 2193.
redox active tyrosine 244, Science, 290, 1588 1591.
10. Geren, L., Durham, B., and Millett, F. (2009) Use of
19. Gorbikova, E. A., Belevich, I., Wikstrom, M., and
ruthenium photoreduction techniques to study electron
Verkhovsky, M. I. (2008) The proton donor for OO bond
7 БИОХИМИЯ том 86 вып. 1 2021
98
МИКУЛОВА и др.
scission by cytochrome c oxidase, Proc. Natl. Acad. Sci.
ton coupling at cytochrome a by the ligation of the oxidized
USA, 105, 10733 10737.
catalytic center in bovine cytochrome c oxidase, Biochim.
20.
Morgan, J. E., Verkhovsky, M. I., and Wikstrom, M. (1996)
Biophys. Acta Bioenerg., 1861, 148237.
Observation and assignment of peroxy and ferryl interme
41.
Morin, P. E., and Freire, E. (1991) Direct calorimetric
diates in the reduction of dioxygen to water by
analysis of the enzymatic activity of yeast cytochrome c
cytochrome c oxidase, Biochemistry, 35, 12235 12240.
oxidase, Biochemistry, 30, 8494 8500.
21.
Björck, M. L., and Brzezinski, P. (2018) Control of trans
42.
Junemann, S., Heathcote, P., and Rich, P. R. (2000) The
membrane charge transfer in cytochrome c oxidase by the
reactions of hydrogen peroxide with bovine cytochrome c
membrane potential, Nat. Commun., 9, 1 8.
oxidase, Biochim. Biophys. Acta, 1456, 56 66.
22.
Einarsdóttir, O., Szundi, I., Van Eps, N., and Sucheta, A.
43.
Siletsky, S., Kaulen, A. D., and Konstantinov, A. A. (1999)
(2002) PM and PR forms of cytochrome c oxidase have dif
Resolution of electrogenic steps coupled to conversion of
ferent spectral properties, J. Inorg. Bioch., 91, 87 93.
cytochrome c oxidase from the peroxy to the ferryl oxo
23.
Belevich, I., Verkhovsky, M. I., and Wikstrom, M. (2006)
state, Biochemistry, 38, 4853 4861.
Proton coupled electron transfer drives the proton pump
44.
Yu, M. A., Egawa, T., Shinzawa Itoh, K., Yoshikawa, S.,
of cytochrome c oxidase, Nature, 440, 829 832.
Guallar, V., et al. (2012) Two tyrosyl radicals stabilize high
24.
Faxen, K., Gilderson, G., Ädelroth, P., and Brzezinski,
oxidation states in cytochrome c oxidase for efficient ener
P. A. (2005) Mechanistic principle for proton pumping by
gy conservation and proton translocation, J. Am. Chem.
cytochrome c oxidase, Nature, 437, 286 289.
Soc., 134, 4753 4761.
25.
Bloch, D., Belevich, I., Jasaitis, A., Ribacka, C.,
45.
Shimada, A., Etoh, Y., Kitoh Fujisawa, R., Sasaki, A.,
Puustinen, A., Verkhovsky, M. I., and Wikstrom, M. (2004)
Shinzawa Itoh, K., et al. (2020) X ray structures of cat
The catalytic cycle of cytochrome c oxidase is not the sum
alytic intermediates of cytochrome c oxidase provide
of its two halves, Proc. Natl. Acad. Sci. U.S.A, 101, 529 533.
insights into its O2 activation and unidirectional proton
26.
Verkhovsky, M. I., Jasaitis, A., Verkhovskaya, M. L.,
pump mechanisms, J. Biol. Chem., 295, 5818 5833.
Morgan, J. E., and Wikstrom, M. (1999) Proton transloca
46.
Kaila, V. R., Verkhovsky, M. I., and Wikstrom, M. (2010)
tion by cytochrome c oxidase, Nature, 400, 480 483.
Proton coupled electron transfer in cytochrome oxidase,
27.
Szundi, I., Funatogawa, C., Soulimane, T., and
Chem. Rev., 110, 7062 7081.
Einarsdóttir, O. (2020) The reactions of O2 and NO with
47.
Jancura, D., Stanicova, J., Palmer, G., and Fabin, M.
mixed valence ba3 cytochrome c oxidase from Thermus
(2014) How hydrogen peroxide is metabolized by oxidized
thermophilus, Biophys. J., 118, 386 395.
cytochrome c oxidase, Biochemistry, 53, 3564 3575.
28.
Siletsky, S. A., Belevich, I., Jasaitis, A., Konstantinov,
48.
Chen, Y. R., Gunther, M. R., and Mason, R. P. (1999) An
A. A., Wikström, M., et al. (2007) Time resolved single
electron spin resonance spin trapping investigation of the
turnover of ba3 oxidase from Thermus thermophilus,
free radicals formed by the reaction of mitochondrial
Biochim. Biophys. Acta, 1767, 1383 1392.
cytochrome c oxidase with H2O2, J. Biol. Chem., 274,
29.
Smirnova, I. A., Zaslavsky, D., Fee, J. A., Gennis, R. B.,
3308 3314.
and Brzezinski, P. (2008) Electron and proton transfer in
49.
Weng, L. C., and Baker, G. M. (1991) Reaction of hydro
the ba3 oxidase from Thermus thermophilus, J. Bioenerg.
gen peroxide with the rapid form of resting cytochrome
Biomem., 40, 281 287.
oxidase, Biochemistry, 30, 5727 5733.
30.
Poiana, F., von Ballmoos, C., Gonska, N., Blomberg,
50.
Brittain, T., Little, R. H., Greenwood, C., and Watmough,
M. R. A., Ädelroth, P., and Brzezinski, P. (2017) Splitting
N. J. (1996) The reaction of Escherichia coli cytochrome bo
of the O-O bond at the heme copper catalytic site of res
with H2O2: evidence for the formation of an oxyferryl
piratory oxidases, Sci. Adv., 3, e1700279.
species by two distinct routes, FEBS Lett., 399, 21 25.
31.
Blomberg, M. R. A. (2020) The mechanism for oxygen
51.
Konstantinov, A. A., Capitanio, N., Vygodina, T. V., and
reduction in the C family cbb3 cytochrome c oxidases -
Papa, S. (1992) pH changes associated with cytochrome c
implications for the proton pumping stoichiometry,
oxidase reaction with H2O2. Protonation state of the peroxy
J. Inorg. Biochem., 203, 11086.
and oxoferryl intermediates, FEBS Lett., 312, 71 74.
32.
Paulus, A., Rossius, S. G. H., Dijk, M., and de Vries, S.
52.
Ksenzenko, M., Vygodina, T. V., Berka, V., Ruuge, E. K.,
(2012) Oxoferryl porphyrin radical catalytic intermediate
and Konstantinov, A. A. (1992) Cytochrome oxidase cat
in cytochrome bd oxidases protects cells from formation of
alyzed superoxide generation from hydrogen peroxide,
reactive oxygen species, J. Biol. Chem., 287, 8830 8838.
FEBS Lett., 297, 63 66.
33.
Borisov, V. B., Forte, E., Sarti, P., and Giuffrè, A. (2011)
53.
Luo, Y. R. (2007) Comprehensive Handbook of Chemical
Catalytic intermediates of cytochrome bd terminal oxidase
Bond Energies, CRC Press, Boca Raton.
at steady state: ferryl and oxy ferrous species dominate,
54.
Blomberg, M. R. A., Siegbahn, P. E. M., Babcock, G. T.,
Biochim. Biophys. Acta, 1807, 503 509.
and Wikstrom, M. (2000) Modeling cytochrome oxidase: a
34.
Borisov, V. B., and Siletsky, S. A. (2019) Features of orga
quantum chemical study of the O O bond ceavage mecha
nization and mechanism of catalysis of two families of ter
nism, J. Am. Chem. Soc., 122, 12848 12858.
minal oxidases: heme copper and bd type, Biochemistry
55.
Blomberg, M. R., Siegbahn, P. E., and Wikstrom, M.
(Moscow), 84, 1390 1402.
(2003) Metal bridging mechanism for O-O bond cleavage
35.
Soulimane, T., and Buse, G. (1995) Integral cytochrome
in cytochrome c oxidase, Inorg. Chem., 42, 5231 5243.
c oxidase - preparation and progress towards a 3 dimen
56.
Blomberg, M. R. A. (2019) Active site midpoint potentials
sional crystallization, Eur. J. Biochem., 227, 588 595.
in different cytochrome c cxidase families: a computation
36.
Liao, G. L., and Palmer, G. (1996) The reduced minus oxi
al comparison, Biochemistry, 58, 2028 2038.
dized difference spectra of cytochromes a and a(3),
57.
Khan, K. K., Mondal, M. S., Padhy, L., and Mitra, S.
Biochim. Biophys. Acta Bioenerg., 1274, 109 111.
(1998) The role of distal histidine in peroxidase activity of
37.
Vygodina, T. V., and Konstantinov, A. A. (1988) H2O2
myoglobin-transient kinetics study of the reaction of
induced conversion of cytochrome c oxidase peroxy com
H2O2 with wild type and distal histidine mutanted recom
plex to oxoferryl state, Ann. NY Acad. Sci., 550, 124 138.
binant human myoglobin, Eur. J. Biochem., 257, 547 555.
38.
Fabian, M., and Palmer, G. (1995) The interaction of
58.
Mondal, M. S., and Mitra, S. (1996) Kinetic studies of the
cytochrome oxidase with hydrogen peroxide: the relation
two step reactions of H2O2 with manganese reconstituted
ship of compounds P and F, Biochemistry, 34, 13802 13810.
myoglobin, Biochim. Biophys. Acta, 1296, 174 180.
39.
Bergmayer, H. U., Gawehn, K., and Grassl, M. (1970)
59.
Baek, H. K., and Van Wart, H. E. (1989) Elementary steps
Methoden der Enzymatischen Analyze (Bergmayer, H. U.,
in the formation of horseradish peroxidase compound I:
ed.), 1, 440.
direct observation of compound 0, a new intermediate with
40.
Kopcova, K., Mikulova, L., Pechova, I., Sztachova, T.,
a hyperporphyrin spectrum, Biochemistry, 28, 5714 5719.
Cizmar, E., et al. (2020) Modulation of the electron pro
60.
Khan, K. K., Mondal, M. S., and Mitra, S. (1996) Kinetic
БИОХИМИЯ том 86 вып. 1 2021
ФЕРРИЛЬНЫЙ ИНТЕРМЕДИАТ ЦИТОХРОМ c ОКСИДАЗЫ
99
studies of the reaction of hydrogen peroxide with man
72. Witting, P. K., Douglas, D. J., and Mauk, A. G. (2000)
ganesereconstituted horseradish peroxidase, J. Chem. Soc.,
Reaction of human myoglobin and H2O2. Involvement of a
Dalton Trans., 1059 1062.
thiyl radical produced at cysteine 110, J. Biol. Chem., 275,
61.
Rigby, S. E., Junemann, S., Rich, P. R., and Heathcote, P.
20391 20398.
(2000) Reaction of bovine cytochrome c oxidase with hydro
73. Reeder, B. J., Svistunenko, D. A., Cooper, C. E., and
gen peroxide produces a tryptophan cation radical and a
Wilson, M. T. (2004) The radical and redox chemistry of
porphyrin cation radical, Biochemistry, 39, 5921 5928.
myoglobin and hemoglobin: from in vitro studies to human
62.
Budiman, K., Kannt, A., Lyubenova, S., Richter, O. M.,
pathology, Antioxid. Redox Signal., 6, 954 966.
Ludwig, B., et al. (2004) Tyrosine 167: the origin of the
74. Svistunenko, D. A., Dunne, J., Fryer, M., Nicholls, P.,
radical species observed in the reaction of cytochrome c
Reeder, B. J., et al. (2002) Comparative study of tyrosine
oxidase with hydrogen peroxide in Paracoccus denitrificans,
radicals in hemoglobin and myoglobins treated with hydro
Biochemistry, 43, 11709 11716.
gen peroxide, Biophys. J., 83, 2845 2855.
63.
MacMillan, F., Kannt, A., Behr, J., Prisner, T., and
75. Svistunenko, D. A. (2001) An EPR study of the peroxyl
Michel, H. (1999) Direct evidence for a tyrosine radical in
radicals induced by hydrogen peroxide in the haem pro
the reaction of cytochrome c oxidase with hydrogen perox
teins, Biochim. Biophys. Acta, 1546, 365 378.
ide, Biochemistry, 38, 9179 9184.
76. Erman, J. E., and Yonetani, T. (1975) A kinetic study of the
64.
Rich, P. R., Rigby, S. E., and Heathcote, P. (2002) Radicals
endogenous reduction of the oxidized sites in the primary
associated with the catalytic intermediates of bovine
cytochrome c peroxidase hydrogen peroxide compound,
cytochrome c oxidase, Biochim. Biophys. Acta, 1554, 137 146.
Biochim. Biophys. Acta, 393, 350 357.
65.
Musatov, A., Hebert, E., Carroll, C. A., Weintraub, S. T.,
77. Hiner, A. N., Martinez, J. I., Arnao, M. B., Acosta, M.,
and Robinson, N. C. (2004) Specific modification of two
Turner, D. D., et al. (2001) Detection of a tryptophan rad
tryptophans within the nuclear encoded subunits of bovine
ical in the reaction of ascorbate peroxidase with hydrogen
cytochrome c oxidase by hydrogen peroxide, Biochemistry,
peroxide, Eur. J. Biochem., 268, 3091 3098.
43, 1003 1009.
78. Miller, V. P., Goodin, D. B., Friedman, A. E.,
66.
Musatov, A., and Robinson, N. C. (2012) Susceptibility of
Hartmann, C., and Ortiz de Montellano, P. R. (1995)
mitochondrial electron transport complexes to oxidative
Horseradish peroxidase Phe172→Tyr mutant. Sequential
damage. Focus on cytochrome c oxidase, Free Radic. Res.,
formation of compound I with a porphyrin radical cation
46, 1313 1326.
and a protein radical, J. Biol. Chem., 270, 18413 18419.
67.
Lemma Gray, P., Weintraub, S. T., Carroll, C. A., Musatov,
79. Wu, G., Rogge, C. E., Wang, J. S., Kulmacz, R. J.,
A., and Robinson, N. C. (2007) Tryptophan 334 oxidation
Palmer, G., and Tsai, A. L. (2007) Oxyferryl heme and not
in bovine cytochrome c oxidase subunit I involves free rad
tyrosyl radical is the likely culprit in prostaglandin H syn
ical migration, FEBS Lett., 581, 437 442.
thase 1 peroxidase inactivation, Biochemistry, 46, 534 542.
68.
Fabian, M., and Palmer, G. (1999) Redox state of peroxy
80. Blomberg, M. R. A., and Siegbahn, P. E. M. (2014) Proton
and ferryl intermediates in cytochrome c oxidase catalysis,
pumping in cytochrome c oxidase: energetic requirements
Biochemistry, 38, 6270 6275.
and the role of two proton channels, Biochim. Biophys.
69.
King, N. K., and Winfield, M. E. (1963) The mechanism of
Acta, 1837, 1165 1177.
metmyoglobin oxidation, J. Biol. Chem., 238, 1520 1528.
81. Sharpe, M. A., and Ferguson Miller, S. (2008) A chemically
70.
Wilks, A., and Ortiz de Montellano, P. R.
(1992)
explicit model for the mechanism of proton pumping in
Intramolecular translocation of the protein radical formed
heme-copper oxidases, J. Bioenerg. Biomembr., 40, 541 549.
in the reaction of recombinant sperm whale myoglobin
82. Brzezinski, P., and Gennis, R. B. (2008) Cytochrome c
with H2O2, J. Biol. Chem., 267, 8827 8833.
oxidase: exciting progress and remaining mysteries,
71.
Tew, D., and Ortiz de Montellano, P. R. (1988) The myo
J. Bioenerg. Biomembr., 40, 521 531.
globin protein radical. Coupling of Tyr 103 to Tyr 151 in
83. Rich, P. R. (2017) Mitochondrial cytochrome c oxidase:
the H2O2 mediated cross linking of sperm whale myoglo
catalysis, coupling and controversies, Biochem. Soc. Trans.,
bin, J. Biol. Chem., 263, 17880 17886.
45, 813 829.
THERMODYNAMICS OF THE P TYPE FERRYL FORM
OF BOVIN CYTOCHROME c OXIDASE
L. Mikulova1, I. Pechova2, D. Jancura2, M. Stupak3, and M. Fabian1*
1 Center for Interdisciplinary Biosciences, Technology and Innovation Park,
University of P. J. Šafárik, 04154 Košice, Slovak Republic; E mail: marian.fabian@upjs.sk
2 Department of Biophysics, Faculty of Science, University of P. J. Šafárik, 04154 Košice, Slovak Republic
3 Department of Medical and Clinical Biochemistry, Faculty of Medicine, 04011 Košice, Slovak Republic
Several ferryl states of the catalytic heme a3 CuB center of the respiratory cytochrome c oxidases (CcOs) are observed
during the reduction of O2 to H2O. One of the P type ferryl forms, PM, is produced by the reaction of the two elec
tron reduced CcO with O2. In this state, the heme a3 iron is in the ferryl state and a free radical should be also present
at the catalytic center. However, the energetics of the PM formation has not been experimentally established yet. Here,
the generation of PM by the reaction of oxidized bovine CcO (O) with one molecule of H2O2 was investigated by the
isothermal titration calorimetry and UV Vis absorption spectroscopy. Two kinetic phases, corresponding to the for
mation of PM and its endogenous conversion back to O, were resolved by both methods. The ΔH of the entire process
(-66 kcal/mol H2O2) was larger than the heat (-50.8 kcal/mol O2) liberated during O2 reduction by ferrocy
tochrome c (pH 8, 25°C). Interestingly, ΔH of the first phase (-32 kcal/mol ferryl state) far exceeds the enthalpy of
the PM production. The data indicate that during the first phase, the radical in PM is quenched and spectrally similar
second P type ferryl form (PR) is produced. Additionally, it was shown that the entropy contribution to the Gibbs
energy change (ΔG = -46 kcal/mol O2) during the catalytic reduction of O2 by ferrocytochrome c is negligible
(-0.7 cal·mol-1·K-1).
Keywords: cytochrome c oxidase, hydrogen peroxide, ferryl state, isothermal titration calorimetry
БИОХИМИЯ том 86 вып. 1 2021
7*