БИОХИМИЯ, 2021, том 86, вып. 1, с. 100 - 108
УДК 577.152.193
ЗАГАДКА 2 Cys ПЕРОКСИРЕДОКСИНОВ:
КАКОВА ИХ РОЛЬ В КЛЕТКЕ?
Обзор
© 2021
A.В. Пескин*, К.С. Уинтерборн
Centre for Free Radical Research, University of Otago Christchurch,
8140 Christchurch, New Zealand; E mail: alexander.peskin@otago.ac.nz
Поступила в редакцию 02.09.2020
После доработки 09.10.2020
Принята к публикации 09.10.2020
2 Cys пероксиредоксины являются широко распространенными белками, содержащими активную тиоль
ную группу, которые эффективно вступают в реакции с различными пероксидами. В отличие от других фер
ментов, их исключительно высокая реакционная способность не зависит от кофакторов. Механизм окисле
ния и восстановления пероксиредоксинов представляет этим белкам хорошую возможность действовать
как антиоксиданты, а кроме того, участвовать в редокс путях передачи сигнала. Понимание тонкостей
функционирования пероксиредоксинов необходимо для трансляционной медицины.
КЛЮЧЕВЫЕ СЛОВА: пероксиредоксин, тиолы, редокс, сигнальные пути, пероксид.
DOI: 10.31857/S0320972521010085
«Защищать и служить»
Девиз LAPD
ИСТОРИЧЕСКИЙ АСПЕКТ
стресса, экспрессируют повышенное количест
во TSA. В то же время мутантные дрожжевые
Пероксиредоксины являются широко рас
клетки, которые не продуцировали TSA, с тру
пространенными тиол содержащими белками.
дом росли в аэробных условиях [2, 3]. Позже по
Их открытие не было одномоментным событи
добный белок был очищен из ткани мозга крыс
ем и было растянуто во времени. Отправной
[4]. Дальнейший прогресс был достигнут при
точкой в этом открытии стало обнаружение не
исследовании бактерий, у которых их алкил
известного фактора, который защищал глута
гидропероксид редуктазная активность приво
минсинтетазу дрожжей от окисления тиол зави
дила к восстановлению перекиси водорода за
симым образом [1]. Белок, который был ответ
счет NADPH [5]. Оказалось, что очищенная
ственен за эту защиту, был очищен и охаракте
ферментативная активность была связана с дву
ризован как тиол специфичный антиоксидант
мя белками - AphC и AphF. Секвенирование ко
(TSA - thiol specific antioxidant). Первоначаль
дирующих эти белки генов показало, что белок
ная гипотеза заключалась в том, что этот защит
AphF является гомологом тиоредоксинредукта
ный эффект мог быть результатом реакции бел
зы, и после периода некоторого замешательства
ка с реакционноспособными формами серы.
стало ясным, что в белке AphC имеются высоко
Было показано, что дрожжевые клетки, которые
консервативные последовательности, характер
культивировались в условиях окислительного
ные также для TSA [6, 7].
В последующих работах было показано, что
эти ферменты являются представителями боль
Принятые сокращения: CPSH - пероксидативный
остаток цистеина; CP
SOH - сульфеновая кислота; шого семейства белков, присутствующих в клет
CPSO2H - сульфиновая кислота; CR
SH -результирующий ках всех биологических видов. В 1994 г. они бы
остаток цистеина; Grx - глутаредоксин; GSH - глутатион;
ли названы пероксиредоксинами, и это оказа
Prdx -пероксиредоксин; Srx - сульфиредоксин; Trx - тио
редоксин; TrxR - тиоредоксинредуктаза; TSA - тиол спе
лось удивительным предвидением. К тому вре
цифичный антиоксидант.
мени уже было известно 46 белков из различных
* Адресат для корреспонденции.
биологических видов, для которых была уста
100
РОЛЬ 2 Cys ПЕРОКСИРЕДОКСИНОВ
101
новлена гомология с TSA и AphC, но при этом
их участие в биохимических путях оставалось
невыясненным [7]. Для сокращенного обозна
чения пероксиредоксинов исходно использова
лись термины Prx и Prdx, но недавно они были
рационализированы до единого обозначения -
Prdx.
Число структурно охарактеризованных пе
роксиредоксинов (Prdx) постоянно растет. Ос
новываясь на аминокислотных последователь
ностях, находящихся вблизи активного центра,
пероксиредоксины можно разделить на шесть
групп [8]. Все Prdx имеют высокореактивный
остаток цистеина (пероксидативный, CPSH),
который при реакции с пероксидом образует
сульфеновую кислоту (CPSOH). В соответствии
с каталитическим механизмом для восстановле
ния CPSOH, эти белки можно разделить на три
подсемейства [9].
1. Типичный 2 Cys Prdx. Сульфеновая кис
лота реагирует с результирующим остатком цис
Рис. 1. Декамер Prdx2. Стрелками обозначены положения
теина (CRSH) другой субъединицы конститутив
активных центров пероксидативного (CP) и результирую
щего (CR) остатков цистеина в димерной единице, сплош
ного нековалентного гомодимера.
ные стрелки для одной пары CP и CR, а пунктирные - для
2. Нетипичный 2 Cys Prdx. Образование
другой. Расстояние между CP и CR составляет 14 Å. Адапти
дисульфида происходит с участием CRSH, нахо
ровано из статьи, doi: 10.2210/pdb1QMV/pdb, http://
дящегося на одной и той же субъединице.
3.
1 Cys Prdx. CRSH отсутствует, и другие
сунка можно ознакомиться в электронной версии статьи
тиолы участвуют в реакции с CPSOH.
Отличительной особенностью 2 Cys перок
сиредоксинов является их способность образо
вывать высокомолекулярные комплексы, состо
ми единицами. Активный центр фермента с
ящие, в зависимости от конкретного белка, из 5
CPSH высоко консервативен для всех предста
или 6 димеров. Поскольку молекулярная масса
вителей семейства пероксиредоксинов. Непо
мономеров составляет примерно 22 кДа, дека
средственным продуктом реакции с перокси
мер Prdx2 (рис. 1) человека имеет молекулярную
дом является сульфеновая кислота, CPSOH.
массу 220 кДа.
Структура активного центра этих ферментов
Эти регулярные структуры имеют пончико
организована уникальным образом для осущес
образную форму, и они могут быть визуализиро
твления нуклеофильной атаки на связь перок
ваны с помощью метода трансмиссионной
сил-O-O- [11-13]. Пероксиредоксины рас
электронной микроскопии (TEM - transmission
щепляют эту связь в перекиси водорода [4, 7,
electron microscopy). С помощью метода TEM
14], алкил пероксидах (7, 15, 16), пероксинит
пероксиредоксин эритроцитов выявлялся в виде
рите [17-21] и гидропероксидах аминокислот и
единого торического белка, состоящего из 10
белков [22]. В клетках млекопитающих выявле
субъединиц и названного торином еще до того,
ны четыре изоформы 2 Cys пероксиредокси
как были обнаружены TSA и установлена ката
нов - цитозольные белки Prdx1 и Prdx2, мито
литическая активность пероксиредоксинов [10].
хондриальный белок Prdx3 и Prdx4, локализо
В настоящем обзоре будут подробно рас
ванный в эндоплазматическом ретикулуме.
смотрены 2 Cys пероксиредоксины (Prdxs).
В типичных 2 Cys Prdx консервативный оста
ток цистеина CR на C конце не может конкури
ровать с CPSH за пероксид, но способен эффек
2 Cys ПЕРОКСИРЕДОКСИНЫ
тивно восстанавливать CPSOH на другой субъе
динице с образованием дисульфида. Кроме
Каталитический цикл 2 Cys пероксиредокси
участия в реакции образования дисульфидной
нов. 2 Cys Prdxs существуют как обязательные
связи, CPSOH также может вступить в реакцию
нековалентные гомодимеры, соединённые меж
с другой молекулой пероксида и подвергаться
ду собой в положении «голова хвост»; эти ди
гиперокислению с образованием сульфиновой
меры являются минимальными каталитически
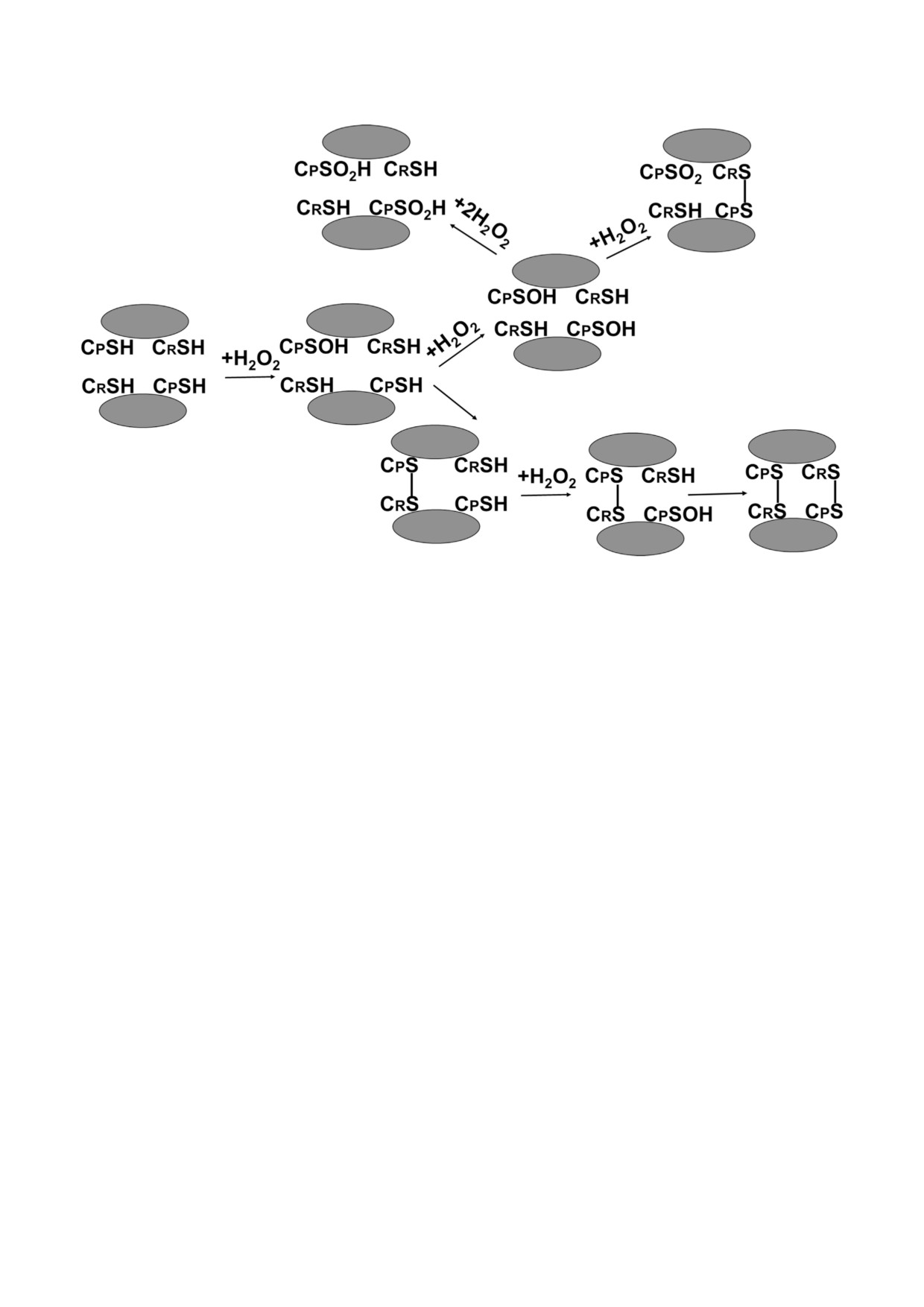
кислоты, CPSO2H (рис. 2).
БИОХИМИЯ том 86 вып. 1 2021
102
ПЕСКИН, УИНТЕРБОРН
Рис. 2. Схема поэтапного окисления нековалентного димера 2 Cys Prdx
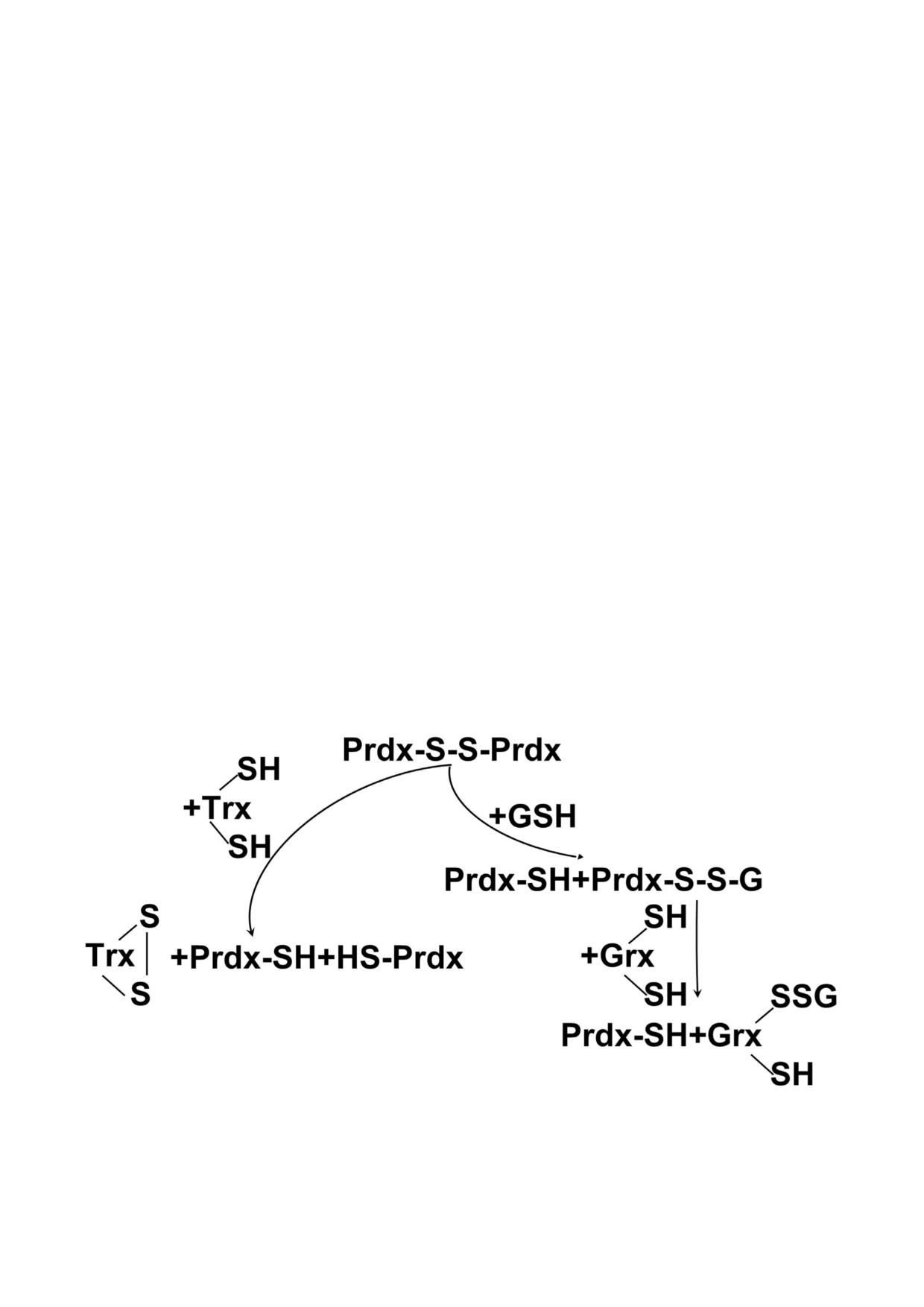
Дисульфид может быть эффективно восста
тивность, измеренная в то время, была на два по
новлен тиоредоксином (Trx) и тиоредоксинре
рядка ниже, чем у каталазы или глутатионперок
дуктазой (TrxR) [7] или системой глутатиона
сидаз, содержащих селеноцистеин [15]. Дей
(GSH) и глутаредоксина (Grx) [23]. Ранее обра
ствительно, в то время была выдвинута точка
зование CPSO2H считалось необратимым про
зрения, что «идея о том, что они могут быть чем
цессом, однако открытие сульфиредоксина
то иным, чем антиоксидантами, поддерживаю
(Srx) выявило сложный механизм полного, хотя
щими глутатионпероксидазу или каталазу, веро
и медленного, восстановления функционально
ятно, может быть проигнорирована. Ситуация,
активного белка [24]. Эффективность гипер
когда любой из пероксиредоксинов может кон
окисления различных 2 Cys пероксиредоксинов
курировать с каталазой за общий субстрат, H2O2,
регулируется С концевой аминокислотной пос
по видимому, не существует» [15].
ледовательностью, в которой содержится CRSH
К середине нулевых годов расчет константы
[25]. Так, бактериальный пероксиредоксин
скорости второго порядка для реакции Prdx с
AhpC чрезвычайно устойчив к гиперокислению.
H2O2 производился с использованием системы,
Эукариотический цитозольный Prdx2 очень
в которой восстановление H2O2 пероксиредок
чувствителен, а устойчивость к гиперокислению
сином было сопряжено с Trx, TrxR и NADPH.
митохондриального белка Prdx3 находится по
Следовательно, измерение проходило по цепоч
середине [26].
ке следующих реакций: 1) окисление Prdx пере
Реакционная способность пероксиредоксина.
кисью водорода, 2) восстановление Prdx тиоре
Первый представитель пероксиредоксинов был
доксином, 3) восстановление тиоредоксина тио
обнаружен как белок, который защищает другой
редоксинредуктазой и 4) окисление NADPH ти
белок от окислительного повреждения [1]. Даль
оредоксинредуктазой. Поэтому измеряемая ак
нейшие исследования кристаллической структу
тивность отражала, скорее, скорость наиболее
ры, энзимологические и генетические данные
медленной реакции в этой системе, а не
дали ясно понять, что Prdxs являются антиокси
собственно скорость реакции Prdx с H2O2.
дантными белками, действие которых направле
Измерение скорости прямой реакции оказа
но на пероксиды [4, 7, 11, 12, 14]. Однако было
лось непростой задачей. Очищенный Prdx после
трудно понять, как Prdxs могут проявлять защит
восстановления и удаления восстановителя
ное действие, так как их каталитическая эффек
быстро возвращался в окисленное состояние.
БИОХИМИЯ том 86 вып. 1 2021
РОЛЬ 2 Cys ПЕРОКСИРЕДОКСИНОВ
103
Оказалось, что виновником был случайный пе
тивного центра в полностью свернутом состоя
роксид, присутствующий в буферных растворах.
нии (FF - fully folded state). После образования
Когда эта проблема была обозначена, и были
CPSOH в результате окисления он может всту
применены соответствующие технологии, поз
пать в реакцию с другой молекулой H2O2, и об
воляющие работать с очищенными препаратами
разующийся CPO2H остается в состоянии FF.
пероксиредоксина в отсутствие восстановите
В противном случае CPSOH смещается из кар
лей, константа скорости прямой реакции второ
мана активного центра в направлении CRSH и
го порядка Prdx с H2O2 оказалась намного выше.
приобретает локально развернутую структуру
В конкурентных опытах с пероксидазой хрена
(LU) в ходе образования дисульфидной свя
или каталазой её величина оказалась равной
зи [39].
2-4 × 107 M-1⋅с-1 [19, 27, 28]. Измерения, осно
Пероксидативные тиолы димеров
2 Cys
ванные на потере внутренней флуоресценции
Prdxs демонстрируют положительное коопера
Prdx в результате окисления H2O2, дали значе
тивное действие. В том случае, когда первый
ние ~108 M-1⋅с-1 [29]. Такой уровень эффектив
CPSH находится в виде сульфеновой кислоты,
ности фермента позволяет внести пероксире
второй CPSH быстрее, чем первый, вступает в
доксины не только в список первоoсновных ан
реакцию с H2O2. Кооперативность отсутствует,
тиоксидантов, а также в ряд самых быстродей
если уже был образован дисульфид CPS-SCR
ствующих ферментов, но и выделить их в от
[40].
дельный класс. В отличие от других ферментов
Влияние С конца на окисление Prdx. Началь
исключительно высокая реакционная способ
ная реакция всех 2 Cys пероксиредоксинов с
ность Prdx не зависит от кофакторов.
H2O2 происходит одинаково быстро, в то время
Пероксидативный остаток цистеина в актив
как восприимчивость к гипероксидации сильно
ном центре Prdx необходим для реакции с пе
варьируется. Возможность для остатка CPSOH
роксидом. Способность остатков цистеина всту
быстро вступать в реакцию с другой молекулой
пать в реакцию зависит от степени их иониза
H2O2 исчезает, как только он выходит из карма
ции [30], и значение pKa для CPSH оказалось
на активного центра и приобретает конформа
равным 6 [27, 31], что поддерживает его в иони
ционное состояние LU. Структура C концевого
зированном состоянии при физиологических
хвостового участка, на котором располагается
значениях pH. Однако реакционная способ
CRSH, оказывает влияние на чувствительность к
ность пероксиредоксинов на много порядков
гиперокислению. 2 Cys пероксиредоксины мле
превышала значения, определенные для других
копитающих, которые в отличие от бактериаль
тиол зависимых ферментов [32]. Исключитель
ных ферментов намного более чувствительны к
ная реакционная способность CPSH обусловле
гиперокислению, имеют дополнительную C
на высокоорганизованной сетью водородных
концевую петлю, содержащую мотив GGLG и
связей в активном центре фермента и нахожде
спираль, содержащую мотив YF. Эти последова
нием в непосредственной близости консерва
тельности присутствуют только у пероксид
тивных остатков пролина, аргинина и треонина
чувствительных Prdx, и они замедляют способ
[11-13, 33, 34]. Их координированное действие
ность CRSH реагировать с CPSOH. В результате
стабилизирует переходное состояние со связан
появляется повышенная возможность для
ным субстратом, ослабляет связь -O-O- и
CPSOH вступать в реакцию с другой молеку
приближает проксимальный атом кислорода к
лой H2O2 [39].
CPSH. По видимому, даже более отдаленные от
Кроме того, 2 Cys пероксиредоксины мле
CPSH аминокислоты участвуют в поддержании
копитающих отличаются друг от друга по их
его высокой реактивности, поскольку их мута
чувствительности к гиперокислению. Так, ци
ции резко снижают скорость реакции [35-37].
топлазматический белок Prdx2 в 10 раз более
Положение CPSH в активном центре фер
подвержен гиперокислению, чем митохондри
мента позволяет проведение агрессивной нуклео
альный белок Prdx3 [26], а Prdx1 располагается
фильной атаки на широкий спектр субстратов
между ними [41]. Мутации с заменой аминокис
типа ROOH. В то же время высокая реакцион
лотных остатков в C концевом хвостовом участ
ная способность Prdx в отношении пероксидов
ке могут делать Prdx2 менее чувствительным, а
не проявляется в отношении других электрофи
Prdx3 более чувствительным к гиперокисле
лов. Типичные тиоловые реагенты, такие как
нию [42].
иодоацетамид и хлорамины, взаимодействуют с
Восстановление 2 Cys Prdx. Показано, что
CPSH намного медленнее, чем с другими тиола
тиоредоксин эффективно восстанавливает ди
ми с низкими значениями pKa [27, 38].
сульфидные связи в 2 Cys пероксиредоксинах
Структурные исследования показали, что
(рис. 2). Для поддержания пероксиредоксинов в
CPSH располагается в основании кармана ак
восстановленной форме их рециклизует Trx с
БИОХИМИЯ том 86 вып. 1 2021
104
ПЕСКИН, УИНТЕРБОРН
помощью тиоредоксинредуктазы с использова
этапов. Сначала Srx катализирует фосфорили
нием NADPH в качестве источника восстанови
рование CPSO2H за счет ATP. Затем под воздей
тельных эквивалентов [7]. Следовательно, ката
ствием Srx эфир сульфиновой кислоты и фос
литическое восстановление ROOH Prdx в клетке
форила подвергается гидролизу с образованием
зависит от поддержки других тиол содержащих
тиосульфината c Prdx. На следующем этапе при
соединений и общего состояния метаболизма,
участии GSH образуются глутатионилирован
которое обеспечивает клетку достаточным ко
ные Srx и CPSOH. Для полного восстановления
личеством восстанавливающих эквивалентов.
далее необходимо вернуть сульфенилирован
Так, синдром дефицита глюкозо 6 фосфатде
ный Prdx в его восстановленное состояние, а
гидрогеназы ограничивает продукцию NADPH
также привлечь дополнительную молекулу GSH
по пентозофосфатному пути и препятствует эф
для рециклизации Srx [24, 46]. Очевидно, что
фективному восстановлению уровня Prdx2 в
энергетические затраты на восстановление ги
эритроцитах в условиях окислительного стрес
перокисленных Prdx высоки, что говорит о важ
са [43].
ности этого процесса.
Кроме системы Trx, рециклизация также мо
Исследования структуры гиперокисленного
жет быть осуществлена системой GSH и Grx
Prdx2 показали, что CPSO2H погружен в актив
[23], как это показано на рис. 3. Эти две системы
ный центр. Поэтому было неясно, как чисто ме
могут дополнять друг друга, например в эритро
ханически Srx может получить к нему доступ.
цитах. В условиях пониженной активности TrxR
Анализ кристаллической структуры комплекса
[44] GSH и Grx могут взять на себя бремя рецик
Prdx-Srx показал, что белки тесно переплетены
лизации белков Prdx.
с полностью развернутой структурой C конце
Также был обнаружен эффект кооператив
вого участка Prdx, располагающегося на обрат
ности в процессе восстановления двух дисуль
ной стороне Srx вдали от активного центра Srx
фидов в полностью окисленных димерах Prdx.
[47]. Такое изощрённое взаимодействие белков
Оказалось, что дитиотрейтол зависимое восста
предполагает, что Srx эволюционировал у эука
новление второго дисульфида протекает при
риот строго специфично для восстанoвления
мерно в 2 раза быстрее [40].
сульфиновой кислоты в Prdx.
Гиперокисление 2 Cys Prdx. Гиперокисление,
Для того чтобы произошло гиперокисление,
которое исходно рассматривалось как инакти
CPSOH должен вступить в реакцию со второй
вация пероксиредоксинов, может быть повер
молекулой H2O2 вместо того, чтобы вместе с
нуто вспять сульфиредоксином [45]. Эта реак
CRSH образовать дисульфид (рис. 1). Это можно
ция проходит медленно и состоит из нескольких
наблюдать в экспериментах in vitro при непре
Рис. 3. Схематическое изображение восстановления дисульфидной связи в подвергшемся окислению димере Prdx. Для
упрощения показан один активный центр. Восстановление может происходить под действием тиоредоксина (Trx) или
глутатиона (GSH) с участием глутаредоксина (Grx)
БИОХИМИЯ том 86 вып. 1 2021
РОЛЬ 2 Cys ПЕРОКСИРЕДОКСИНОВ
105
рывном определении пероксидазной активнос
жен механизм «шлюза», основанный на чувстви
ти, когда Prdx смешивается с H2O2 в присут
тельности Prdx млекопитающих к гиперокисле
ствии Trx, TrxR и NADPH и регистрируется ско
нию. В своей первоначальной форме теория
рость окисления NADPH. При каждом обороте
предполагала, что Prdx потребляет H2O2 до тех
цикла происходит окисление части CPSOH. По
пор, пока окислитель не накапливается до доста
этому со временем процесс окисления NADPH
точно высокого уровня, чтобы подвергнуть Prdx
замедляется из за накопившихся гиперокислен
гиперокислению, и в этот момент другие менее
ных Prdx [20, 48]. С другой стороны, в экспери
реактивные мишени способны подвергаться
ментах с очищенными восстановленными Prdx
окислению [39]. Теория «шлюза» также может
было показано, что оборот не является необхо
быть интерпретирована как механизм, который
димым для гиперокисления, и при значитель
освобождает Trx от восстановления Prdx, что
ной концентрации H2O2 процесс гиперокисле
приводит к увеличению активности Trx, доступ
ния в единичном цикле может одержать верх
ной для восстановления других мишеней [49].
над образованием CPS-SCR [26]. В гиперокисле
Другим объяснением окисления тиоловых
нии пероксиредоксинов в клетках могут быть
белков, медленно реагирующих с H2O2, может
задействованы оба механизма. Однако остаются
быть то, что пероксиредоксины действуют как
некоторые моменты, которые необходимо про
сенсоры H2O2 и направляют окислительные эк
яснить, - почему в присутствии Trx, TrxR и
виваленты к соответствующим белкам, таким
NADPH степень гиперокисления Prdx меньше,
как фосфатазы и факторы транскрипции при
чем предсказываемая на основе констант ско
помощи механизма эстафеты (relay) [50]. Роль
рости реакции второго порядка, полученных в
пероксиредоксинов в H2O2 опосредованной пе
экспериментах с очищенными белками.
редаче сигнала нашла строгое эксперименталь
Функции пероксиредоксинов. В клетках Prdx
ное подтверждение. Кроме того, были обнару
не ограничены одной физиологической ролью.
жены смешанные дисульфидные связи перок
Скорее они являются центральными фигурами
сиредоксинов и белков мишеней в клетках, об
в редокс метаболизме и могут выполнять раз
работанных H2O2 [51-53]. В отдельных случаях
личные функции.
доказать, что такие эстафеты существуют до
Высокая реакционная способность, а также
вольно непросто. Например, при обработке кле
высокой уровень экспрессии белка в клетках
ток низкими дозами H2O2 (i) видно синхронное
позволяет считать, что в первую очередь с пере
окисление Prdx2 и CRMP2 (collapsin response
кисями реагируют Prdxs [32]. В этой связи их
mediator protein 2), (ii) иммунопреципитация
можно рассматривать как антиоксидантные
Prdx2 происходит совместно с CRMP2, (iii) в
ферменты наряду с супероксиддисмутазами
клетках можно наблюдать ко локализацию этих
(SOD), глутатионпероксидазами (Gpxs) и ката
двух белков. Однако смешанного дисульфида
лазами.
обнаружено не было. В клеточной среде такие
Помимо их эффективности, широкий круг
смешанные дисульфиды могут быть слишком
их субстратов, включая пероксинитрит, делает
короткоживущими из за быстрого восстановле
Prdxs незаменимыми антиоксидантами. Так,
ния, кроме того, их можно не увидеть in vitro, ес
гидроперекиси свободных аминокислот и бел
ли для объединения партнеров необходим дру
ков представляют серьезную угрозу для клеток,
гой (скаффолд) белок [54].
и Prdxs являются единственными известными
Чисто механически эта эстафета может про
белками, способными удалять их [22]. Еще одна
исходить через (i) обмен тиольными группами
важная особенность заключается в том, как
между дисульфидной связью в Prdx и восстанов
Prdxs удаляют H2O2. В отличие от каталаз, они
ленным белком мишенью или (ii) образование
не выделяют кислород в качестве продукта реак
смешанной дисульфидной связи в том случае,
ции и, следовательно, полностью подавляют об
если белок мишень реагирует с CPSOH, вытес
разование активных форм кислорода.
няя CRSH. Аргументы против механизма обмена
Результаты расчетов реакционной способ
могут быть следующие: (i) относительно низкая
ности и количества Prdx показывают, что другие
скорость обмена тиольных групп и (ii) конку
тиол содержащие мишени, медленно реагирую
ренция с GSH, Trx и другими белками, содержа
щие с H2O2, внутри клеток не должны подвер
щими тиольную группу. Однако механизмы об
гаться окислению. Однако в действительности
мена нельзя сбрасывать со счетов, поскольку,
обработка клеток Н2О2 приводит к окислению
теоретически, они могут быть облегчены с по
этих тиоловых белков, чего, исходя из их низкой
мощью скафолда. С другой стороны, особен
реакционной способности, теоретически, не
ности энзимологии 2 Cys Prdx делают возмож
должно было произойти [32]. Для описания роли
ной реакцию белка мишени с CPSOH. Скорость
Prdx в регуляции редокс гомеостаза был предло
димеризации пероксиредоксинов относительно
БИОХИМИЯ том 86 вып. 1 2021
106
ПЕСКИН, УИНТЕРБОРН
мала (2 с-1 - в случае Prdx2), в то время как об
сохраняя целостность структуры белков. Они
разование CPSOH протекает в течение микросе
также могут обнаруживать пероксиды и переда
кунд [21, 26]. Относительно небольшая скорость
вать окислительно восстановительные сигналы
конденсации с CRSH обеспечивает возможность
другим белкам. Неудивительно, что такие уни
для CPSOH вступать в реакцию с другой ми
версальные белки вовлечены в различные пато
шенью. Это может быть дополнительно усилено
логии [58, 59]. Например, в раковых клетках
тем, что имеется эффект отрицательной коопе
наблюдается повышение экспрессии перокси
ративности, который вдвое снижает скорость
редоксинов [60]. Естественно, идёт поиск спе
конденсации второго активного центра, когда
цифичного ингибитора Prdx. Однако это не
один дисульфид уже образован [40].
простая задача: найти ингибитор, который мо
Функция шаперона, защищающая другие
жет целенаправленно воздействовать на тиоль
белки от инактивации, была признана в качест
ные группы в белке Prdx и при этом не действо
ве физиологической роли пероксиредоксинов
вать на тиольные группы в других белках. Так,
еще до того момента, когда стала известна их
биологический эффект аденантина (дитерпено
высокая реакционная способность в отношении
ида, выделенного из листьев, который индуци
ROOH [55]. Нековалентные димеры Prdx орга
рует дифференцировку клеток острой промие
низованы в регулярные пончикообразные
лоцитической лейкемии) исходно был ассоци
структуры. Эти декамеры (или додекамеры) мо
ирован с его целенаправленным воздействием
гут защищать другие белки от инактивации и аг
на 2 Cys пероксиредоксины [61]. Однако оказа
регации. Образование дисульфидов в димерах
лось, что аденантин также реагирует с другими
Prdx снижает стабильность этих тороидов, в то
тиолами и гораздо более избирателен для селе
время как гиперокисление делает их более ста
ноцистеин зависимой TrxR, вызывая таким об
бильными. Таким образом, Prdxs в их восстанов
разом накопление окисленного Prdx путем ин
ленном и гиперокисленном состояниях могут
гибирования рециркуляции Trx [62].
осуществлять функцию шаперонов [56]. Шапе
Определенно может показаться, что есть про
роновая активность Prdx может не только защи
тиворечие в том, что один и тот же белок выпол
щать белки от инактивации и агрегации, но и
няет две роли: и выявление, и разрушение окси
способствовать восстановлению неправильно
дантa. Можно предположить, что сочетание вы
свернутых белков. Гиперокисленный Prdx вмес
сокой реакционной способности, сложного ме
те с Hsp70 образует комплексы с неправильно
ханизма рециркуляции, положительной коопе
свернутыми белками с последующим рекрути
ративности в начальной реакции с окислителем и
рованием Hsp104. Затем Srx присоединяется к
отрицательной кооперативности в димеризации
комплексу, и после восстановления CPSO2H
позволяет 2 Cys Prdxs сочетать эти задачи.
происходит разрушение комплекса с высвобож
дением восстановленного нативного белка [57].
Конфликт интересов. Авторы заявляют об от
сутствии конфликта интересов.
ЗАКЛЮЧЕНИЕ
Соблюдение этических норм. Настоящая
статья не содержит описания выполненных ав
2 Cys пероксиредоксины способны защи
торами исследований с участием людей или ис
щать клетки эффективно инактивируя ROOH и
пользованием животных в качестве объектов.
СПИСОК ЛИТЕРАТУРЫ
1.
Kim, K. H., Lee, K. Y., Kim, I. H., Rhee, S. G., and
hydroperoxide reductase and thiol specific antioxidant
Stadtman, E. R. (1988) The Isolation and purification of a
define a large family of antioxidant enzymes, Proc. Natl.
specific protector protein which inhibits enzyme inactiva
Acad. Sci. USA, 91, 7017 7021.
tion by a thiol/Fe(III)/O2 mixed function oxidation sys
5.
Jacobson, F. S., Morgan, R. W., Christman, M. F., and
tem, J. Biol. Chem., 263, 4704 4711.
Ames, B. N. (1989) An alkyl hydroperoxide reductase from
2.
Kim, I. H., Kim, K., and Rhee, S. G. (1989) Induction of
Salmonella typhimurium involved in the defense of DNA
an antioxidant protein of Saccharomyces cerevisiae by O2,
against oxidative damage. Purification and properties,
Fe3+, or 2 mercaptoethanol, Proc. Natl. Acad. Sci. USA,
J. Biol. Chem., 264, 1488 1496.
86, 6018 6022.
6.
Tartaglia, L. A., Storz, G., Brodsky, M. H., Lai, A., and
3.
Chae, H. Z., Kim, I. H., Kim, K., and Rhee, S. G. (1993)
Ames, B. N. (1990) Alkylhydroperoxide reductase from
Cloning, sequencing, and mutation of thiol specific
Salmonella typhimurium. Sequence and homology to
antioxidant gene of Saccharomyces cerevisiae, J. Biol.
thioredoxin reductase and other flavoprotein disulfideoxi
Chem., 268, 16815 16821.
doreductases, J. Biol. Chem., 265, 10535 10540.
4.
Chae, H. Z., Robison, K., Poole, L. B., Church, G.,
7.
Chae, H. Z., Chung, S. J., and Rhee, S. G. (1994)
Storz, G., and Rhee, S. G. (1994) Cloning and sequencing
Thioredoxin dependent peroxide reductase from yeast,
of thiol specific antioxidant from mammalian brain: alkyl
J. Biol. Chem., 269, 27670 27678.
БИОХИМИЯ том 86 вып. 1 2021
РОЛЬ 2 Cys ПЕРОКСИРЕДОКСИНОВ
107
8.
Poole, L. B., and Nelson, K. J. (2016) Distribution and fea
(2013) Hyperoxidation of peroxiredoxins 2 and 3: rate con
tures of the six classes of peroxiredoxins, Mol. Cells, 39, 53 59.
stants for the reactions of the sulfenic acid of the peroxi
9.
Knoops, B., Loumaye, E., and Van Der Eecken, V. (2007)
datic cysteine, J. Biol. Chem., 288, 14170 14177.
Evolution of the peroxiredoxins, in Peroxiredoxin systems.
27.
Peskin, A. V., Low, F. M., Paton, L. N., Maghzal, G. J.,
Subcellular biochemistry, vol 44, (Flohé, L., and Harris,
Hampton, M. B., and Winterbourn, C. C. (2007) The high
J. R., eds.) Springer, Dordrecht.
reactivity of peroxiredoxin 2 with H2O2 is not reflected in
10.
Harris, J. R. (1969) Some negative staining features of a
its reaction with other oxidants and thiol reagents, J. Biol.
protein from erythrocyte ghosts, J. Mol. Biol., 46, 329 335.
Chem., 282, 11885 11892.
11.
Wood, Z. A., Schröder, E., Harris, J. R., and Poole, L. B.
28.
Winterbourn, C. C., and Peskin, A. V. (2016) Kinetic
(2003) Structure, mechanism and regulation of peroxire
approaches to measuring peroxiredoxin reactivity, Mol.
doxins, Trends Biochem. Sci., 28, 32 40.
Cells, 39, 26 30.
12.
Hall, A., Parsonage, D., Poole, L. B., and Karplus, P. A.
29.
Carvalho, L. A. C., Truzzi, D. R., Fallani, T. S., Alves,
(2010) Structural evidence that peroxiredoxin catalytic
S. V., Toledo, J. C., et al. (2017) Urate hydroperoxide oxi
power is based on transition state stabilization, J. Mol.
dizes human peroxiredoxin 1 and peroxiredoxin 2, J. Biol.
Biol., 402, 194 209.
Chem., 292, 8705 8715.
13.
Pedre, B., van Bergen, L. V., Pallo, A., Rosado, L. A.,
30.
Winterbourn, C. C., and Metodiewa, D. (1999) Reactivity
Dufe, V. T., et al. (2016) The active site architecture in per
of biologically important thiol compounds with superoxide
oxiredoxins: a case study on Mycobacterium tuberculosis
and hydrogen peroxide, Free Radic. Biol. Med., 27, 322
AhpE, Chem. Commun., 52, 10293 10296.
328.
14.
Netto, L. E. S., Chae, H. Z., Kang, S. W., Rhee, S. G.,
31.
Nelson, K. J., Parsonage, D., Hall, A., Karplus, P. A., and
and Stadtman, E. R. (1996) Removal of hydrogen peroxide
Poole, L. B. (2008) Cysteine pKa values for the bacterial
by thiol specific antioxidant enzyme (Tsa) is involved with
peroxiredoxin AhpC, Biochemistry, 47, 12860 12868.
its antioxidant properties: Tsa possesses thiol peroxidase
32.
Winterbourn, C. C. (2008) Reconciling the chemistry and
activity, J. Biol. Chem., 271, 15315 15321.
biology of reactive oxygen species, Nat. Chem. Biol., 4, 278
15.
Hofmann, B., Hecht, H. J., and Flohe, L.
(2002)
286.
Peroxiredoxins, Biol. Chem., 383, 347 364.
33.
Schröder, E., Littlechild, J. A., Lebedev, A. A.,
16.
Dietz, K. J. (2003) Plant peroxiredoxins, Annu. Rev. Plant
Errington, N., Vagin, A. A., and Isupov, M. N. (2000)
Biol., 54, 93 107.
Crystal structure of decameric 2 Cys peroxiredoxin from
17.
Bryk, R., Griffin, P., and Nathan, C. (2000) Peroxynitrite
human erythrocytes at 1.7 Å resolution, Structure, 8, 605
reductase activity of bacterial peroxiredoxins, Nature, 407,
615.
211 221.
34.
Hall, A., Nelson, K., Poole, L. B., and Karplus, P. A.
18.
Wong, C. M., Zhou, Y., Ng, R. W. M., Kung, H. F., and
(2011) Structure based insights into the catalytic power
Jin, D. Y. (2002) Cooperation of yeast peroxiredoxins
and conformational dexterity of peroxiredoxins, Antioxid.
Tsa1p and Tsa2p in the cellular defense against oxidative
Redox Signal., 15, 795 815.
and nitrosative stress, J. Biol. Chem., 277, 5385 5394.
35.
Parsonage, D., Youngblood, D. S., Sarma, G. N., Wood,
19.
Ogusucu, R., Rettori, D., Munhoz, D. C., Netto, L. E.,
Z. A., Karplus, P. A., and Poole, L. B. (2005) Analysis of
and Augusto, O. (2007) Reactions of yeast thioredoxin per
the link between enzymatic activity and oligomeric state in
oxidases I and II with hydrogen peroxide and peroxynitrite:
AhpC, a bacterial peroxiredoxin, Biochemistry, 44, 10583
rate constants by competitive kinetics, Free Radic. Biol.
10592.
Med., 42, 326 334.
36.
Nagy, P., Karton, A., Betz, A., Peskin, A. V., Pace, P., et al.
20.
Manta, B., Hugo, M., Ortiz, C., Ferrer Sueta, G.,
(2011) Model for the exceptional reactivity of peroxiredox
Trujillo, M., and Denicola, A. (2009) The peroxidase and
ins 2 and 3 with hydrogen peroxide: a kinetic and compu
peroxynitrite reductase activity of human erythrocyte per
tational study, J. Biol. Chem., 286, 18048 18055.
oxiredoxin 2, Arch. Biochem. Biophys., 484, 146 154.
37.
Yewdall, N. A., Peskin, A. V., Hampton, M. B., Goldstone,
21.
De Armas, M. I., Esteves, R., Viera, N., Reyes, A. M.,
D. C., Pearce, F. G., and Gerrard, J. A. (2018) Quaternary
Mastrogiovanni, M., et al. (2019) Rapid peroxynitrite
structure influences the peroxidase activity of peroxiredox
reduction by human peroxiredoxin 3: implications for the
in 3, Biochem. Biophys. Res. Commun., 497, 558 563.
fate of oxidants in mitochondria, Free Radic. Biol. Med.,
38.
Stacey, M. M., Peskin, A. V., Vissers, M. C., and
130, 369 378.
Winterbourn, C. C. (2009) Chloramines and hypochlorous
22.
Peskin, A. V., Cox, A. G., Nagy, P., Morgan, P. E.,
acid oxidize erythrocyte peroxiredoxin 2, Free Radic. Biol.
Hampton, M. B., and Winterbourn, C. C. (2010) Rapid
Med., 47, 1468 1476.
removal of amino acid, peptide and protein hydroperoxides
39.
Wood, Z. A., Poole, L. B., and Karplus, P. A (2003)
by reaction with peroxiredoxins 2 and 3, Biochem. J., 432,
Peroxiredoxin evolution and the regulation of hydrogen
313 321.
peroxide signaling, Science, 300, 650 653.
23.
Peskin, A. V., Pace, P. E., Behring, J. B., Paton, L. N.,
40.
Peskin, A. V., Meotti, F. C., de Souza, L. F., Anderson,
Soethoudt, M., Bachschmid, M. M., and Winterbourn,
R. F., Winterbourn, C. C., and Salvador, A. (2020) Intra
C. C. (2016) Glutathionylation of the active site cysteines
dimer cooperativity between the active site cysteines during
of peroxiredoxin 2 and recycling by glutaredoxin, J. Biol.
the oxidation of peroxiredoxin 2, Free Radic. Biol. Med.,
Chem., 291, 3053 3062.
158, 115 125.
24.
Chang, T. S., Jeong, W., Woo, H. A., Lee, S. M., Park, S.,
41.
Bolduc, J. A., Nelson, K. J., Haynes, A. C., Lee, J., Reisz,
and Rhee, S. G. (2004) Characterization of mammalian
J. A., et al. (2018) Novel hyperoxidation resistance motifs
sulfiredoxin and its reactivation ofhyperoxidized peroxire
in 2 Cys peroxiredoxins, J. Biol. Chem., 293, 11901 11912.
doxin through reduction of cysteine sulfinic acid in the
42.
Poynton, R. A., Peskin, A. V., Haynes, A. C., Lowther,
active site to cysteine, J. Biol. Chem., 279, 50994 51001.
W. T., Hampton, M. B., and Winterbourn, C. C. (2016)
25.
Perkins, A., Poole, L. B., and Karplus, P. A. (2014) Tuning
Kinetic analysis of structural influences on the susceptibil
of peroxiredoxin catalysis for various physiological roles,
ity of peroxiredoxins
2 and
3 to hyperoxidation,
Biochemistry, 53, 7693 7705.
Biochem. J., 473, 411 421.
26.
Peskin, A. V., Dickerhof, N., Poynton, R. A., Paton, L. N.,
43.
Cheah, F. C., Peskin, A. V., Wong, F. L., Ithnin, A.,
Pace, P. E., Hampton, M. B., and Winterbourn, C. C.
Othman, A., and Winterbourn, C. C. (2014) Increased
БИОХИМИЯ том 86 вып. 1 2021
108
ПЕСКИН, УИНТЕРБОРН
basal oxidation of peroxiredoxin 2 and limited peroxire
53. Sobotta, M. C., Liou, W., Stocker, S., Talwar, D.,
doxin recycling in glucose 6 phosphate dehydrogenase
Oehler, M., et al. (2015) Peroxiredoxin 2 and STAT3 form a
deficient erythrocytes from newborn infants, FASEB J., 28,
redox relay for H2O2 signaling, Nat. Chem. Biol., 11, 64 70.
3205 3210.
54. Pace, P. E., Peskin, A. V., Konigstorfer, A., Jasoni, C. J.,
44.
Low, F. M., Hampton, M. B., Peskin, A. V., and
Winterbourn, C. C., and Hampton, M. B.
(2018)
Winterbourn, C. C. (2007) Peroxiredoxin 2 functions as a
Peroxiredoxin interaction with the cytoskeletal regulatory
noncatalytic scavenger of low level hydrogen peroxide in
protein CRMP2: investigation of a putative redox relay,
the erythrocyte, Blood, 109, 2611 2617.
Free Radic. Biol. Med., 129, 383 393.
45.
Woo, H. A., Chae, H. Z., Hwang, S. C., Yang, K. S.,
55. Jang, H. H., Lee, K. O., Chi, Y. H., Jung, B. G., Park,
Kang, S. W., et al. (2003) Reversible oxidation of the cat
S. K., et al. (2004) Two enzymes in one; two yeast perox
alytic site of cysteine of peroxiredoxins to cysteine sulfinic
iredoxins display oxidative stress dependent switching
acid in mammalian cells, Science, 300, 653 656.
from a peroxidase to a molecular chaperone function, Cell,
46.
Biteau, B., Labarre, J., and Toledano, M. B. (2003) ATP
117, 625 635.
dependent reduction of cysteine sulphinic acid by S. cere
56. Teixeira, F., Castro, H., Cruz, T., Tse, E., Koldewey, P.,
visiae sulphiredoxin, Nature, 425, 980 984.
et al. (2015) Mitochondrial peroxiredoxin functions as cru
47.
Jönsson, T. J., Lynnette, C., Johnson, L. C., and Lowther,
cial chaperone reservoir in Leishmania infantum, Proc.
W. T. (2008) Structure of the sulphiredoxin-peroxiredoxin
Natl. Acad. Sci. USA, 112, E616 E624.
complex reveals an essential repair embrace, Nature, 451,
57. Hanzén, S., Vielfort, K., Yang, J., Roger, F., Andersson, V.,
98 101.
et al. (2016) Lifespan control by redox dependent recruitment
48.
Chae, H. Z., Kim, H. J., Kang, S. W., and Rhee, S. G.
of chaperones to misfolded proteins, Cell, 166, 140 151.
(1999) Characterization of three isoforms of mammalian
58. Kisucka, J., Chauhan, A. K., Patten, I. S., Yesilaltay, A.,
peroxiredoxin that reduce peroxides in the presence of
Neumann, C., et al. (2008) Peroxiredoxin1 prevents exces
thioredoxin, Diabetes Res. Clin. Pract., 45, 101 112.
sive endothelial activation and early atherosclerosis, Circ.
49.
Veal, E. A., Underwood, Z. E., Tomalin, L. E., Morgan,
Res., 103, 598 605.
B. A., and Pillay, C. S. (2018) Hyperoxidation of peroxire
59. Radyuk, S. N., and Orr, W. C. (2018) The multifaceted
doxins: gain or loss of function? Antioxid. Redox Signal.,
impact of peroxiredoxins on aging and disease, Antioxid.
28, 574 590.
Redox Signal., 29, 1293 1311.
50.
Winterbourn, C. C., and Hampton, M. B.
(2015)
60. Forshaw, T. E., Holmila, R., Nelson, K. J., Lewis, J. E.,
Signalling via a peroxiredoxin sensor, Nature Chem. Biol.,
Kemp, M. L., et al. (2019) Peroxiredoxins in cancer and
11, 5 6.
response to radiation therapies, Antioxidants, 8, 11.
51.
Cao, J., Schulte, J., Knight, A., Leslie, N. R.,
61. Liu, C. X., Yin, Q. Q., Zhou, H. C., Wu, Y. L., Pu, J. X., et al.
Zagozdzon, A., et al. (2009) Prdx1 inhibits tumorigenesis
(2012) Adenanthin targets peroxiredoxin I and II to induce
via regulating PTEN/AKT activity, EMBO J., 28, 1505
differentiation of leukemic cells, Nat. Chem. Biol., 8, 486 493.
1517.
62. Soethoudt, M., Peskin, A. V., Dickerhof, N., Paton, L. N.,
52.
Jarvis, R. M., Hughes, S. M., and Ledgerwood, E. C.
Pace, P. E., and Winterbourn, C. C. (2014) Interaction of
(2012) Peroxiredoxin 1 functions as a signal peroxidase to
adenanthin with glutathione and thiol enzymes: Selectivity
receive, transduce, and transmit peroxide signals in mam
for thioredoxin reductase and inhibition of peroxiredoxin
malian cells, Free Radic. Biol. Med., 53, 1522 1530.
recycling, Free Radic. Biol. Med., 77, 331 339.
THE ENIGMA OF 2 Cys PEROXIREDOXINS: WHAT ARE THEIR ROLES?
Review
A. V. Peskin* and C. C. Winterbourn
Centre for Free Radical Research, University of Otago Christchurch, 8140 Christchurch,
New Zealand, E mail: alexander.peskin@otago.ac.nz
2 Cys peroxiredoxins are abundant thiol proteins that react efficiently with a wide range of peroxides. Unlike other
enzymes, their exceptionally high reactivity does not rely on cofactors. The mechanism of oxidation and reduction of
peroxiredoxins places them in a good position to act as antioxidants as well as key players in redox signaling.
Understanding of the intimate details of peroxiredoxin functioning is important for translational research.
Keywords: peroxiredoxin, thiols, redox, signaling, peroxide
БИОХИМИЯ том 86 вып. 1 2021