БИОХИМИЯ, 2021, том 86, вып. 1, с. 109 - 124
УДК 577.355.3
СТРУКТУРНО ФУНКЦИОНАЛЬНЫЕ АСПЕКТЫ
ТЕРМОРЕГУЛЯЦИИ ЭЛЕКТРОННОГО ТРАНСПОРТА
И СИНТЕЗА АТР В ХЛОРОПЛАСТАХ
Обзор
© 2021
А.В. Вершубский, А.Н. Тихонов*
Московский государственный университет имени М.В. Ломоносова, физический факультет,
119991 Москва, Россия; электронная почта: an_tikhonov@mail.ru
Поступила в редакцию 28.10.2020
После доработки 29.11.2020
Принята к публикации 05.12.2020
Обзор посвящен анализу механизмов температурной регуляции электронного транспорта и синтеза АТР в
хлоропластах высших растений. Функциональное значение терморегуляции фотосинтеза определяется тем,
что растения являются эктотермными организмами, у которых собственная температура зависит от темпе'
ратуры окружающей среды. В обзоре рассмотрено влияние температуры на следующие процессы, протека'
ющие в тилакоидных мембранах: 1) активность фотосистемы 2 и восстановление пластохинона; 2) перенос
электронов от пластохинола (через цитохромный b6 f'комплекс и пластоцианин) к фотосистеме 1; 3) транс'
мембранный перенос протонов; 4) синтез АТР. Приведены данные о взаимосвязи между функциональны'
ми свойствами (фотосинтетический перенос электронов и протонов, функционирование АТР'синтазы) и
структурными характеристиками хлоропластов (микровязкость липидного бислоя тилакоидной мембра'
ны), полученными методом электронного парамагнитного резонанса.
КЛЮЧЕВЫЕ СЛОВА: фотосинтез, хлоропласты, электронный транспорт, тилакоидные мембраны, регу'
ляция.
DOI: 10.31857/S0320972521010097
ВВЕДЕНИЕ
носятся к NADP+, терминальному акцептору
электронов ФС1, восстанавливаемому до
У растений фотосинтез происходит в хлоро'
NADPH (NADP+ + 2е- + Н+ → NADPH). Пере'
пластах - энергопреобразующих органеллах рас'
нос электронов по ЦЭТ сопряжен с созданием
тительной клетки, которые, используя энергию
транс'тилакоидной разности электрохимичес'
∼
света, поглощаемого светособирающими антен'
Н+ (называемой
нами фотосистемы
1
(ФС1) и фотосисте'
«протон'движущей силой»), являющейся источ'
мы 2 (ФС2), усваивают углекислый газ (CO2) и
ником энергии для работы АТР'синтазы [3, 4].
выделяют молекулярный кислород (O2). Энер'
В хлоропластах основной вклад в генера'
∼
гия поглощенных квантов света мигрирует к фо'
Н+ вносит транс'тилакоидная раз'
тореакционным центрам ФС1 и ФС2, в которых
ность рН, ΔрН = pHout - pHin, где pHout и pHin -
происходит разделение зарядов и инициируется
значения рН стромы и внутритилакоидного
перенос электронов по цепи электронного
пространства. NADPН и АТP - макроэргичес'
транспорта (ЦЭТ) [1, 2]. От молекул воды, разла'
кие продукты светоиндуцированных стадий фо'
гаемых водоокисляющим комплексом (ВОК)
тосинтеза - используются в реакциях цикла
ФС2 (2Н2О → О2 + 4е- + 4Н+), электроны пере'
Кальвина-Бенсона (ЦКБ) для фиксации CO2 [5].
Электрон'транспортные комплексы (ФC1,
Принятые сокращения: ФС1 и ФС2 - фотосистемы
ФC2) и АТР'синтазы (CF0-CF1) неравномерно
1 и 2; Р700 и Р680 - первичные доноры электрона в ФС1 и
распределены между гранальными и стромаль'
ФС2; ЦЭТ - цепь электронного транспорта; ЭПР - ными тилакоидами [6, 7]. Тилакоиды гран обо'
электронный парамагнитный резонанс; Chl - хлорофил;
гащены комплексами ФС2; большинство ФC1 и
DGDG - дигалактозилдиацилглицерин; Fd - ферред'
оксин; ISP - железо'серный белок; MGDG - моно'
CF0-CF1 комплексов сосредоточено в межгран'
галактозилдиацилглицерин; Pc - пластоцианин; Phe -
ных тилакоидах, на краях и торцах гран, экспо'
- пластохинол.
феофитин; PQ - пластохинон; PQH2
нированных в строму. Цитохромные b6 f'комп'
* Адресат для корреспонденции.
лексы распределены равномерно вдоль тилако'
109
110
ВЕРШУБСКИЙ, ТИХОНОВ
идных мембран [8]. В работе цепи переноса
с другом посредством межгранных тилакоидов,
электронов между ФС2 и ФС1 участвуют мо'
выступающих из тилакоидов гран. Тилакоидные
бильные переносчики - пластохинон (PQ) и
мембраны плотно насыщены белковыми комп'
пластоцианин (Pc), которые обеспечивают связь
лексами, которые составляют ~70% от общей
между удаленными электрон'транспортными
массы мембран. Физико'химические свойства
комплексами. Молекулы пластохинола (PQH2),
мембранного бислоя определяются составом ли'
образующиеся в ФС2, переносят электроны к
пидов [9, 10]. В мембранах хлоропластов присут'
b6 f'комплексам, которые, в свою очередь, вос'
ствует β'токоферол, который повышает структу'
станавливают молекулы пластоцианина. Вос'
рированность мембран и их устойчивость к сво'
становленные молекулы пластоцианина (Pc-)
боднорадикальным процессам. Липиды тилако'
диффундируют во внутреннем пространстве ти'
идов представлены галактолипидами (нейтраль'
лакоидов, называемом люменом, обеспечивая
ными липидами), фосфолипидами и сульфоли'
перенос электронов от b6 f'комплекса к окис'
пидами. В тилакоидах имеются липиды четырех
ленным центрам ФС1 (P+700).
основных типов: моногалактозилдиацилглице'
Перенос электронов по ЦЭТ между ФС2 и
рин (MGDG), дигалактозилдиацилглицерин
ФС1 и реакции синтеза АТР чувствительны к
(DGDG), сульфохиновозилдиацилглицерин
структурным изменениям в тилакоидных
(SQDG) и фосфатидилглицерин (PG). Глицеро'
мембранах хлоропластов, вызванных измене'
липиды содержат два жирнокислотных остатка,
ниями температуры. Важное функциональное
связанных с глицерином. MGDG и DGDG - ос'
значение терморегуляции фотосинтетических
новные «строительные блоки» тилакоидной
процессов в хлоропластах определяется тем,
мембраны, которые формируют матрицу, в кото'
что растения являются пойкилотермными (эк'
рую встроены белковые комплексы. Липидный
тотермными) организмами, у которых их
бислой служит не только «изолятором», отделя'
собственная температура зависит от температу'
ющим внутреннее пространство тилакоидов
ры окружающей среды. Термоиндуцированные
(люмен) от стромы, но также является средой, в
структурные перестройки тилакоидных мемб'
которой диффундируют молекулы пластохино'
ран влияют на активность фотосинтетических
на. Липиды (прежде всего, MGDG и SQDG)
белковых комплексов, подвижность мобиль'
участвуют в поддержании димерной структуры
ных переносчиков электрона и генерацию
пигмент'белковых комплексов ФС1 и ФС2. Они
∼
Н+. Для выяснения взаимосвязи между струк'
также обнаружены в полости цитохромного b6 f'
турными изменениями тилакоидных мембран и
комплекса, внутри которой находится хинон'
функциональными свойствами хлоропластов
связывающий центр [11].
представляется интересным сравнить влияние
Цепь электронного транспорта в хлороплас
температуры на физическое состояние («теку'
тах. На рис. 1 показана схема, иллюстрирующая
честь») тилакоидных мембран и на процессы
расположение электрон'транспортных комп'
электронного транспорта и синтеза АТР в хло'
лексов в тилакоидной мембране и их взаимо'
ропластах. В обзоре приведены данные о роли
действие, обеспечивающее перенос электронов
тилакоидных мембран в терморегуляции фото'
от Н2О к NADP+ (нециклический электронный
синтеза и о взаимосвязи между функциональ'
транспорт) или к О2 (псевдоциклический элект'
ными свойства хлоропластов (фотосинтетичес'
ронный транспорт). Транспорт электронов меж'
кий перенос электронов и протонов и работа
ду ФC2 и ФC1 включает следующие стадии:
АТР'синтазы) и структурным состоянием
1) перенос электронов из ФC2 к b6 f'комплексу
мембранных липидов.
за счет диффузии в мембране молекул пластохи'
нола и 2) перенос электронов от b6 f'комплекса к
ФC1 за счет пластоцианина, диффундирующего
СТРУКТУРНО ФУНКЦИОНАЛЬНАЯ
внутри люмена. Скорость переноса электронов
ОРГАНИЗАЦИЯ ФОТОСИНТЕТИЧЕСКОГО
между фотосистемами определяется временем
АППАРАТА ХЛОРОПЛАСТОВ
оборота пластохинона, взаимодействующего с
ФC2 и b6 f'комплексом [11-15]. Пластохинон'
Липидный бислой тилакоидной мембраны. В
зависимые процессы включают в себя: 1) фото'
хлоропластах пигмент'белковые комплексы
индуцированное восстановление PQ до PQH2 в
ФС1 и ФС2 встроены в тилакоидные мембраны,
ФС2, 2) диффузию PQH2 в мембране и его про'
образующие систему замкнутых везикул - тила'
никновение внутрь b6 f'комплекса, 3) окисление
коидов. Тилакоиды окружены двуслойной обо'
PQH2 в «o»'центре и восстановление PQ в «i»'
лочкой, отделяющей хлоропласт от цитоплазмы
центре b6 f'комплекса. В широком диапазоне ус'
растительной клетки. Стопки уплощенных ти'
ловий (рН, температура) образование PQH2 и
лакоидов образуют граны, которые связаны друг
его диффузия в мембране происходят быстрее,
БИОХИМИЯ том 86 вып. 1 2021
ТЕРМОРЕГУЛЯЦИЯ В ХЛОРОПЛАСТАХ
111
чем окисление PQH2 внутри b6 f'комплекса
ра FA и FB к молекуле ферредоксина, находящей'
[16, 17].
ся в строме (FX → FA → FВ → Fd). Восстановлен'
Фотосистема 1 обеспечивает перенос элект'
ные молекулы ферредоксина (Fd-) передают
ронов от восстановленного пластоцианина (Pc-)
электроны ферредоксин'NADP'редуктазе (FNR),
к расположенным в строме молекулам ферре'
обеспечивая восстановление NADP+ до NADPH.
доксина (Fd) [1, 2, 13, 18, 19]. Индуцированное
Окисленный центр P+700 принимает электрон
светом возбуждение Р700 (первичный донор
от Рс-, восстановленного b6 f'комплексом. Диф'
электрона) инициирует разделение зарядов: воз'
фундируя во внутритилакоидном пространстве,
бужденный центр P*700 быстро отдает электрон
Рс- обеспечивает перенос электронов между
первичному акцептору электрона. Акцепторы
удаленными комплексами b6 f и ФC1. При опре'
электрона расположены в виде двух квазисим'
деленных условиях (например, в хлоропластах,
метричных ветвей: две молекулы хлорофил'
адаптированных к темноте) стерические огра'
ла (Chl2A и Chl3A) и одна молекула филлохино'
ничения могут препятствовать перемещению
на (A1A) принадлежат к ветви А; две другие моле'
молекул Рс- внутри узкого (~ 4-5 нм) простран'
кулы Chl (Chl2B и Chl3B) и вторая молекула фил'
ства люмена [22]. Толщина люмена увеличива'
лохинона (A1B) принадлежат к ветви B. Ветви А
ется при освещении хлоропластов, благодаря
и B сходятся вблизи акцептора FX (клас'
чему латеральная диффузия Pc- перестает лими'
тер [FeS]4). Индуцированный светом перенос
тировать перенос электронов от b6 f'комплексов
электрона в ФС1 не требует пространственного
к ФС1 [22]. Латеральная диффузия Pc- и его
перемещения переносчиков и может происхо'
окисление за счет ФC1 происходят быстрее
дить даже при низких (криогенных) температу'
(τ1/2 < 200 мкс при комнатной температуре [13]),
рах по механизму квантово'механического тун'
чем перенос электронов от ФC2 к пластохинону
нелирования [20, 21]. Восстановленный акцеп'
и его взаимодействие с b6 f'комплексом
тор FX передает электрон через два редокс'цент'
(τ1/2 ≥ 4-20 мс) [23, 24].
Центр «i»
Центр «o»
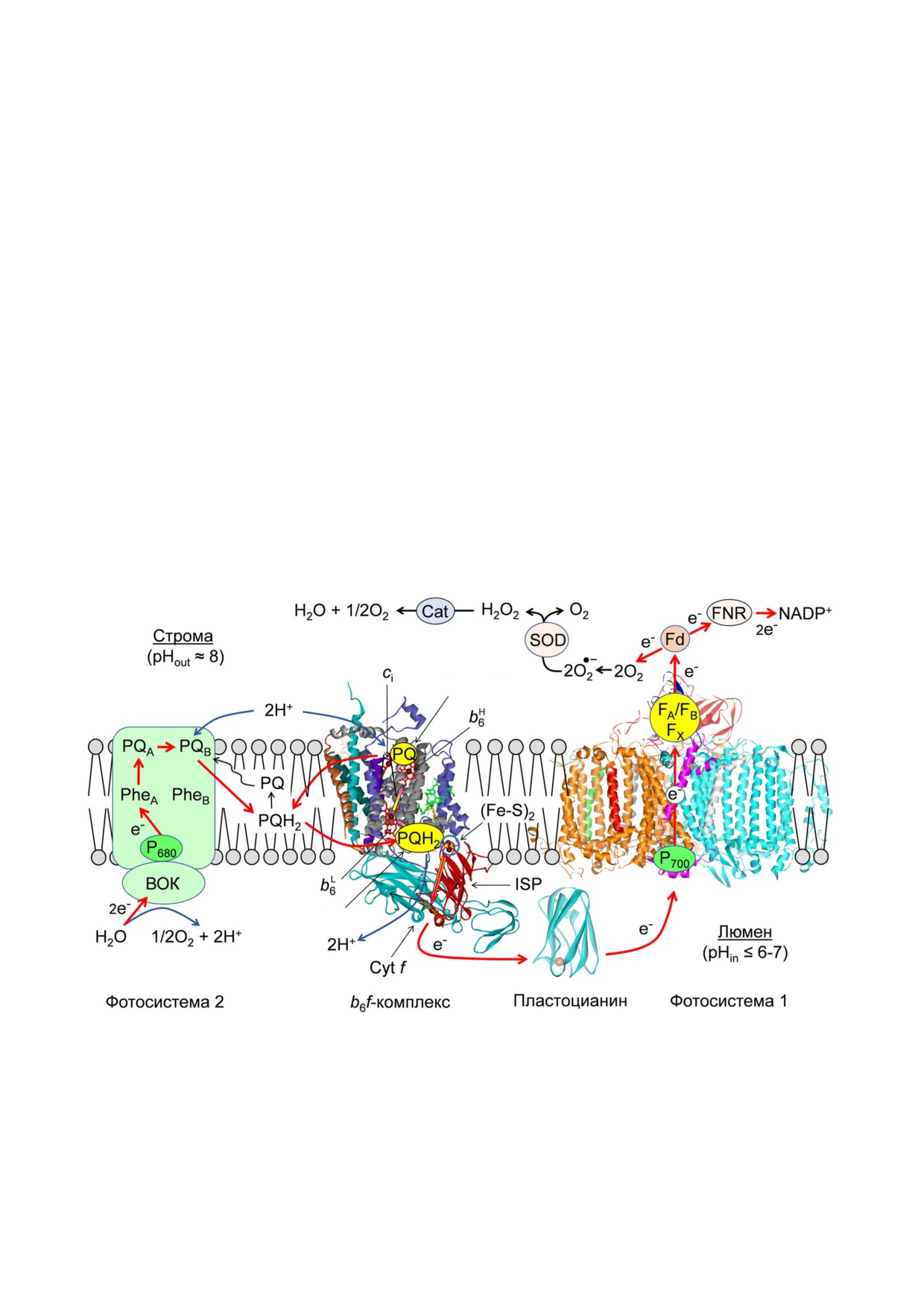
Рис. 1. Cхема расположения ФС1, ФС2 и b6 f'комплекса в тилакоидной мембране. Красными и синими стрелками пока'
заны пути переноса электронов и протонов. FX, FA и FB - железо'серные центры в ФС1; PheA и PheB - молекулы феофи'
тина; PQ и PQH2 - окисленная и полностью восстановленная формы пластохинона; PQA и PQB - молекулы первичного
и вторичного пластохинона, связанного с ФС2 (см. также список сокращений и пояснения в тексте). Центр связывания
PQH2 «o» расположен между гемом bL и (Fe'S)2'кластером белка Риске. Центр связывания PQ «i» расположен между ге'
мом b6H и гемом ci. Изображения молекулярных структур b6 f'комплекса (PDB код 1Q90, [70]) и ФС1 (PDB код 1JB0, [88])
построены с помощью пакета программ Accelrys DV (http://www.accelrys.com). (С цветными вариантами рис. 1, 2, 4 мож'
БИОХИМИЯ том 86 вып. 1 2021
112
ВЕРШУБСКИЙ, ТИХОНОВ
Фотосистема 2 работает как вода/пластохи'
пластоцианину (через цитохром f): PQH2 →
нон'оксидоредуктаза: два электрона переносят'
→ ISP → Cyt f → Pc. Другой электрон поступает
ся от H2O к PQ, восстанавливаемому до PQH2,
от PQH2 к низкопотенциальному гему bL, а за'
при этом два иона водорода поглощаются из
тем переносится на высокопотенциальный
стромы и два иона водорода выделяются в лю'
гем bH, который, в свою очередь, восстанавлива'
мен в результате разложения воды (H2O →
ет молекулу PQ в хинон'связывающем цент'
→ ЅO2 + 2H+in + 2e-) [25-27]. Специальная пара
ре «i», расположенном на стромальной стороне
молекул Chl a, встроенная в ядро белкового
b6 f'комплекса (bL → bH → PQ) [29, 30]. Двукрат'
комплекса ФC2, образует первичный донор
ное восстановление молекулы PQ до PQH2 в Qi'
электрона, P680. На акцепторной стороне ФC2
центре сопровождается присоединением двух
имеются две ветви кофакторов электронного
протонов из стромы (PQ + 2e- + 2H+out → PQH2).
переноса, ветви А и В. Возбужденный центр P*680
Образовавшаяся молекула PQH2 уходит из Qi'
передает электрон первичному акцептору элект'
центра и перемещается к вакантному Qo'центру,
рона A'ветви (ChlD1), который восстанавливает
где происходит ее окисление, сопровождающе'
вторичный акцептор электрона
- феофи'
еся выделением двух протонов в люмен. Таким
тин (Phe): P*680 → ChlD1 → PheA. Восстановлен'
образом, b6 f'комплекс функционирует как про'
ный PheA передает электрон первичному плас'
тонный насос, осуществляющий перенос прото'
-
тохинону PQA, прочно связанному с ФC2; PQA
нов из стромы в люмен. Благодаря этому в лю'
восстанавливает вторичный пластохинон PQВ
мен закачивается два протона в расчете на один
(PQ−PQB → PQAPQ−). Следующий электрон, до'
электрон, перенесенный к ФC1, H+/e- = 2
нируемый возбужденным центром P*680, перехо'
[28-31]. Имеются веские основания считать,
дит к PQ−, обеспечивая полное восстановле'
что скорость окисления PQН2 определяется
ние PQВ до PQ2-. После протонирования PQ2- за
первой стадией окисления PQH2 [32-35]. В
счет ионов водорода, поступающих из стромы
частности, квантово'химические расчеты пока'
(PQ2- + 2H+out → PQВH2), молекула пластохинола
зывают [36], что энергетический барьер этой ре'
диссоциирует в липидную фазу тилакоидной
акции Ea ≈ 60 кДж/моль близок к эффективной
мембраны, а ее место занимает окисленная мо'
энергии активации для переноса электрона от
лекула PQ (PQВH2 + PQ → PQВ + PQH2).
PQH2 на P+700. Депротонирование восстановлен'
Цитохромный b6 f комплекс (пластохинол'
ного железо'серного белка (ISPredH+ → ISPred +
пластоцианин'оксиредуктаза) - связующее зве'
+ H+in) и перенос электрона от ISPred к цитохро'
но, обеспечивающее перенос электронов между
му f обеспечивают условия для циклического
ФC2 и ФC1 [11, 17]. Диффундируя в мембране,
функционирования b6 f'комплекса.
молекула PQH2 достигает b6 f'комплекс и связы'
Липиды тилакоидной мембраны играют
вается с каталитическим участком Qo, располо'
важную роль в функционировании b6 f'комп'
женным внутри этого комплекса. Цитохромный
лекса. В тилакоидах большинство липидов
b6 f'комплекс организован как функциональный
представлено галактолипидами, которые содер'
димер. Каталитические функции каждого из мо'
жат полиненасыщенные жирные кислоты [9, 10,
номеров осуществляются за счет четырех окис'
37, 38]. Изменения в содержании ненасыщен'
лительно'восстановительных центров: железо'
ных жирных кислот являются одним из ключе'
серного кластера (Fe'S)2 белка Риске (ISP), двух
вых факторов, контролирующих фотосинтети'
гемов цитохрома b6 (низко' и высокопотенци'
ческую активность хлоропластов [39-41]. Внут'
альные гемы b6L и b6H), а также цитохрома f. Мо'
ри b6 f'комплекса имеется полость (30 Å × 15 Å ×
лекула PQH2 проникает в хинол'связывающий
× 25 Å), в которую проникает молекула пласто'
портал каталитического сайта Qo, расположен'
хинола [11]. Внутри этой полости имеются
ный между субъединицами цитохрома b6 и желе'
23 липид'связывающих участка в расчете на
зо'серного белка. Центр Qo ориентирован в на'
один мономер димерного b6 f'комплекса из
правлении люменальной стороны тилакоидной
Noctos PCC 7120 [42]. Предполагается, что эти
мембраны. Молекула PQH2 отдает два электрона
липиды могут определять повышенную кон'
b6 f'комплексу, при этом два протона диссоци'
формационную гибкость мобильного доме'
ируют во внутритилакоидное пространство.
на ISP, несущего (Fe'S)2'кластер. Как было
Согласно механизму Q'цикла Митчел'
предположено ранее [17, 30], влияние липидов
ла [28-30], окисление PQH2 представляет собой
на скорость окисления пластохинола может
«бифуркационную» реакцию. В хинон'связыва'
быть опосредовано тем, что скорость диссоциа'
ющем центре «o», расположенном ближе к лю'
ции протонов и их выход в люмен контролиру'
менальной стороне мембраны, один электрон от
ется состоянием липидного слоя, примыкающе'
молекулы PQH2 переносится на (Fe'S)2'кластер
го к b6 f'комплексу. «Затвердевание» или «раз'
белка Риске. Затем этот электрон поступает к
жижение» липидного бислоя, зависящее от со'
БИОХИМИЯ том 86 вып. 1 2021
ТЕРМОРЕГУЛЯЦИЯ В ХЛОРОПЛАСТАХ
113
става липидов и температуры, может влиять на
размеры которых составляют
~
4
×
3
×
скорость диссоциации протонов в люмен, бла'
× 3 нм. Для эффективной диффузии Рс зазор
годаря чему будет изменяться скорость окисле'
между противоположными краями выступаю'
ния PQH2. Уменьшение барьера, препятствую'
щих из мембран водорасщепляющих комплек'
щего диссоциации протонов, должно способ'
сов должен быть не менее 3 нм. После набухания
ствовать окислению PQH2 и тем самым ускорять
тилакоидов, происходящего при освещении хло'
перенос электронов к ФC1.
ропластов, просвет люмена может увеличиваться
Диффузионно контролируемые стадии перено
вдвое, при этом наблюдается заметное ускоре'
са электронов. Диффузия пластохинола в мемб'
ние окисления цитохрома f, обусловленное уско'
ране и перемещение пластоцианина во внутри'
рением диффузии Рс внутри люмена [22].
тилакоидном пространстве - ключевые стадии
рН Зависимая регуляция электронного транс
переноса электронов между удаленными белко'
порта. Скорость окисления PQH2 цитохромным
выми комплексами: ФC2 → PQH2 → b6 f →
комплексом контролируется значением pH лю'
→ Pc → ФС1. Окисление PQH2 цитохромным
мена (pHin). Светоиндуцируемое закисление
b6 f'комплексом - самая медленная стадия в це'
люмена, как известно [16, 45, 46], замедляет по'
пи переноса электронов от ФС2 к ФС1 [12, 13].
ток электронов между ФC2 и ФC1. Хорошо изу'
В широком диапазоне экспериментальных ус'
чены два механизма рН'зависимой регуляции
ловий (рН, ионная сила, температура) процессы
электронного транспорта в хлоропластах: 1) за'
восстановления PQ до PQH2 в ФС2 и диффу'
медление окисления PQH2 b6 f'комплексом,
зия PQH2 к b6 f'комплексу происходят быстрее,
вызванное понижением рНin [16, 45-47], и 2) ос'
чем окисление PQH2, протекающее после про'
лабление активности ФC2 за счет усиления теп'
никновения PQH2 внутрь цитохромного комп'
лового рассеяния энергии в светособирающей
лекса и его связывания с хинон'связывающим
антенне ФС2, известного как нефотохимичес'
центром «о» [16, 17, 23, 24]. Несмотря на то, что
кое тушение возбуждения хлорофилла [48-50].
перенос электронов к b6 f'комплексу может за'
С механизмом рН'зависимой регуляции элект'
трудняться из'за стерических ограничений в
ронного транспорта связано явление «метабо'
мембране, препятствующих диффузии PQH2
лического» контроля, заключающееся в том, что
[14], имеются веские основания считать, что ла'
поток электронов между фотосистемами зави'
теральная диффузия PQH2 не лимитирует об'
сит от «фосфатного потенциала», P = [ATP]/
щую скорость переноса электронов между фо'
/([ADP] × [Pi]), где [ATP], [ADP] и [Pi] - концен'
тосистемами. Несмотря на то, что комплексы
трации ATP, ADP и Pi. В зависимости от фосфат'
ФC2 и ФС1 могут быть удалены друг от друга,
ного потенциала АТР'синтаза функционирует в
большинство из них находится вблизи от b6 f'
режиме синтеза АТР либо в режиме АТРазы
комплексов, равномерно распределенных вдоль
(гидролиз АТР). В состоянии «фотосинтетичес'
тилакоидной мембраны [8]. Близкое расположе'
кого контроля» («состояние 4» по Chance и
ние ФC2 и b6 f'комплексов, локализованных в
Williams [51]), когда исчерпаны пулы молекул
тилакоидных мембранах гран, минимизирует
ADP и/или Pi, скорость синтеза АТР и поток
среднее расстояние, пройденное молекулами
протонов через CF0-CF1 ослабевают, а потому
пластохинона, обеспечивая быстрый обмен
происходит достаточно сильное закисление лю'
PQH2 и PQ между ФС2 и b6 f'комплексами [14].
мена (pHin < 6), вызывающее замедление элект'
Диффузия Pc- внутри люмена, как известно,
ронного транспорта между ФС2 и ФС1 [16, 47].
в большинстве случаев также не лимитирует об'
В «состоянии 3» (интенсивный синтез АТР) ско'
щую скорость переноса электронов между фото'
рость переноса электронов транспорта высока.
системами: перенос электронов от b6 f'комплек'
В этом случае функционирование АТР'синтазы
сов к Рс- и диффузия Рс- к ФC1 происходят за'
сопровождается выходом протонов из люмена в
метно быстрее по сравнению с окислени'
строму, а потому не происходит столь сильного
ем PQH2 цитохромным b6 f'комплексом [12, 13,
закисления люмена (pHin ≥ 6), которое могло бы
43, 44]. Как было показано в работе Kirchhoff
вызывать торможение электронного транспорта
et al. [22], при определенных условиях (напри'
между фотосистемами [16, 47].
мер, в хлоропластах, адаптированных к темноте)
стерические ограничения, затрудняющие диф'
фузию Рс в узком просвете люмена, могут замед'
ВЛИЯНИЕ ТЕМПЕРАТУРЫ
лять перенос электронов между удаленными b6 f'
НА ФОТОСИНТЕТИЧЕСКИЕ
комплексом и ФC1. Плотно расположенные
ПРОЦЕССЫ В ХЛОРОПЛАСТАХ
комплексы ФC2 с водорасщепляющими домена'
ми, выступающими в просвет люмена, ограни'
Фотосинтетический аппарат растений
чивают пространство для миграции молекул Рс,
чувствителен к изменениям окружающей среды.
8 БИОХИМИЯ том 86 вып. 1 2021
114
ВЕРШУБСКИЙ, ТИХОНОВ
Важную роль в адаптации фотосинтетического
строек в мембранах [59-61]. Неоднозначные
аппарата растений к изменениям условий окру'
оценки энергий активации процессов электрон'
жающей среды играют явления, связанные с
ного транспорта, встречающиеся в литературе,
«краткосрочными» и «долгосрочными» измене'
могут быть обусловлены неоднородностью био'
ниями свойств хлоропластов в ответ на измене'
логического материала (например, разные виды
ния температуры [50, 52, 53]. Структурные пере'
растений или неодинаковые условия их культи'
стройки липидных областей тилакоидных мемб'
вирования).
ран - один из ключевых факторов, определяю'
Влияние температуры на электронный транс
щих адаптацию фотосинтетического аппарата
порт между фотосистемами и структурное состоя
при изменениях температуры. Особую роль в
ние тилакоидной мембраны. На рис. 2, а изобра'
терморегуляции энергетических процессов в хло'
жена схема цепи переноса электронов от ФС2 к
ропластах играют изменения свойств тилакоид'
ФС1 и показаны температурные зависимости
ных мембран (соотношение насыщенных и нена'
ключевых процессов, определяющих функцио'
сыщенных липидов), которые определяют мик'
нирование ЦЭТ между фотосистемами - сраба'
ровязкость липидных доменов тилакоидных
тывание ФС2 и перенос электронов от PQH2
мембран [54, 55]. MGDG и DGDG - основные
к P+700. На рис. 2, б-г изображены температурные
липиды тилакоидных мембран - содержат боль'
зависимости процессов, отражающих фотохи'
шое количество полиненасыщенных жирных
мическую активность ФС2 (б), перенос электро'
кислот, что определяет пониженную микровяз'
нов от ФС2 к PQ (в) и перенос электронов от
кость (высокую «текучесть») липидного бислоя.
PQH2 к ФС1 (через цитохромный комплекс
Адаптация фотосинтетического аппарата к низ'
и Рc) (г). Эти зависимости были получены на ос'
ким (или высоким) температурам может проис'
новании исследований кинетики фотоиндуци'
ходить за счет увеличения (или уменьшения) сте'
рованных редокс'превращений Р700 в изолиро'
пени десатурации жирных кислот в галактолипи'
ванных хлоропластах бобов класса Б, функцио'
дах [39-41, 54, 55]. Изменения состава липидов
нирующих в условиях псевдоциклического
проявляются в температурных зависимостях фи'
транспорта электронов: H2О → ФС2 → PQH2 →
зических характеристик липидных мембран [56].
→ b6 f → Pc → ФC1 → O2 → H2O. Результаты
Соотношение между липидами разного со'
этих исследований подробно описаны ранее [24,
става - один из ключевых факторов, определя'
47, 62-65].
ющих микровязкость мембранных липидов и их
Использование метода электронного пара'
подвижность [57]. Мембраны с более высокой
магнитного резонанса (ЭПР) для изучения
долей липидов, содержащих ненасыщенные
электронного транспорта в хлоропластах осно'
жирные кислоты, имеют более низкую темпера'
вано на том, что окисленные центры P+700 дают
туру «плавления» по сравнению с мембранами,
характерный сигнал ЭПР, по интенсивности ко'
содержащими насыщенные жирные кислоты.
торого можно следить за кинетикой окисли'
Соотношение насыщенных и ненасыщенных
тельно'восстановительных превращений Р700.
жирных кислот изменяется в зависимости от ус'
Дальний красный свет (λ > 700 нм), возбуждаю'
ловий культивирования растений [58]. Микро'
щий преимущественно ФС1, индуцирует окис'
вязкость мембранных липидов является своеоб'
ление P700. О работе ФС2 можно судить, измеряя
разным «датчиком», который запускает ретро'
количество электронов, поступающих в ЦЭТ в
градные сигналы, контролирующие, например,
ответ на действие импульсов света различной
экспрессию десатураз, тем самым адаптируя
длительности [24, 47, 62-66]. Относительное
мембрану к температуре окружающей среды и
число электронов, поступающих в ЦЭТ в ответ
оптимизируя преобразование энергии в фото'
на вспышки белого света, возбуждающего обе
синтезирующих организмах [39-41].
фотосистемы, характеризует активность ФС2.
При анализе температурных зависимостей
Короткий импульс света (τЅ = 7 мкс) обеспечи'
различных фотосинтетических процессов часто
вает однократное срабатывание ФС2. Так мож'
сравнивают данные кинетических и структур'
но оценить влияние температуры на эффектив'
ных исследований в координатах Аррениуса (за'
ность функционирования ФС2. Как видно из
висимость логарифма измеряемой величины от
рис. 2, б, активность ФС2 слабо зависит от тем'
обратной температуры, Т-1), на основании кото'
пературы в области 0-25 °С, но падает до нуля с
рых определяют эффективные значения энер'
повышением температуры до 45 °С.
гии активации. Примечательно, что большин'
Длительный импульс белого света
ство графиков Аррениуса, характеризующих
(τЅ = 750 мкс) вызывает многократное срабаты'
различные реакции фотосинтеза, имеют харак'
вание ФС2, что позволяет оценить скорость пе'
терные изломы или разрывы, которые интер'
реноса электронов от ФС2 к PQ. В качестве па'
претируются как показатели структурных пере'
раметра, характеризующего перенос электронов
БИОХИМИЯ том 86 вып. 1 2021
ТЕРМОРЕГУЛЯЦИЯ В ХЛОРОПЛАСТАХ
115
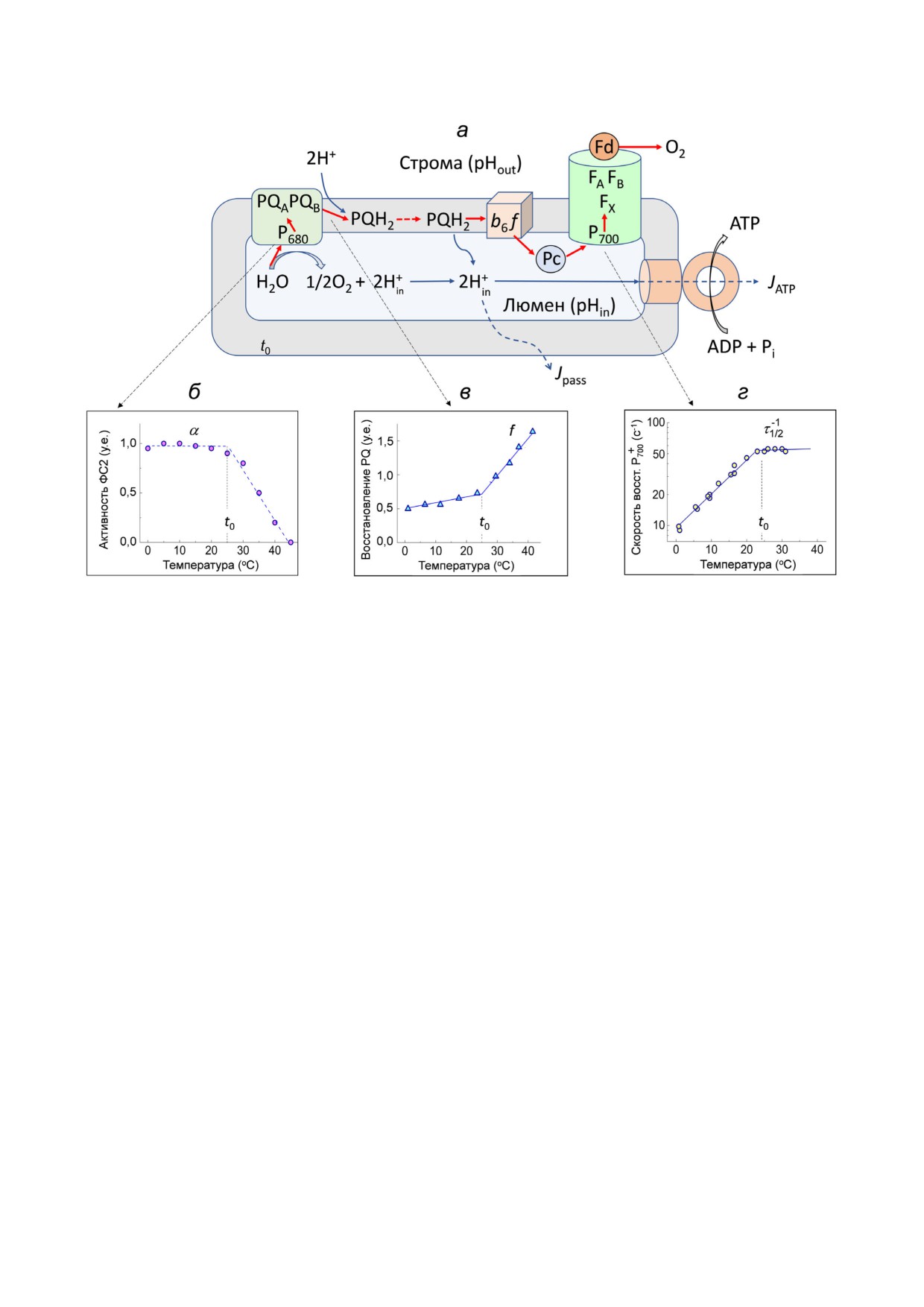
Рис. 2. Схема фотосинтетических процессов переноса электронов и протонов и расположения четырех основных белко'
вых комплексов (фотосистемы 1, фотосистемы 2, цитохрома b6 f и АТP'синтазы) в тилакоидной мембране (а). Красными
стрелками показаны реакции переноса электронов, синими - пути переноса протонов. б-г - Показывает влияние темпе'
ратуры на разные реакции переноса электронов по ЦЭТ: активность ФС2 (б), скорость восстановления PQ (в) и скорость
переноса электронов от PQH2 к ФС1 (г). Графики построены по материалам исследований электронного транспорта в
хлоропластах бобов класса Б, функционирующих в условиях псевдоциклического транспорта электронов:
Н2О → ФС2 → ФС1 → метилвиологен → О2 → Н2О. Условия проведения экспериментов описаны ранее [24, 47, 62-65]
к PQ, можно использовать величину f = W2/W1,
можно утверждать, что температурная зависи'
равную отношению количества электронов,
мость параметра τ-11/2 отражает влияние темпера'
поступающих в ЦЭТ за время действия длитель'
туры на скорость окисления PQH2. Обращает на
ной (W2) и короткой (W1) вспышек света [47, 62,
себя внимание тот факт, что эта зависимость
63, 66]. Из рис. 2, в видно, что относительное
также имеет характерный излом при 25 °С. Од'
число молекул PQH2, образующихся в ответ на
нако, в отличие от температурной, зависимость
длительные вспышки, увеличивается с ростом
для скорости образования PQH2 (рис. 2, в), па'
температуры. Это означает, что скорость восста'
раметр τ-11/2 заметно возрастает с ростом темпера'
новления PQ, оцениваемая по величине f, воз'
туры до 25 °С, но слабо изменяется при темпера'
растает с повышением температуры. Обращает
турах выше 25 °С (рис. 2, г).
на себя внимание характерный излом темпера'
Трансмембранный перенос протонов. Наличие
турной зависимости параметра f, четко выра'
характерных «изломов» на температурных зави'
женный при 25 °С.
симостях параметров, характеризующих пере'
На рис. 2, г показана температурная зависи'
нос электронов по ЦЭТ между фотосистемами
мость кинетического параметра τ-11/2, характери'
(рис. 2), служит отражением влияния темпера'
зующего скорость переноса электронов от PQH2
туры на состояние липидной мембраны. Об
к окисленным центрам P+700 (τ1/2 - время полувос'
этом, в частности, свидетельствует тот факт, что
становления P+700 после окончания действия бе'
подобные особенности проявляются также при
лого света). Видно, что с ростом температуры
изучении переноса протонов через тилакоид'
до 25 °С скорость восстановления P+700 возраста'
ную мембрану. Рассмотрим в качестве иллюст'
ет, затем τ-11/2 изменяется сравнительно слабо.
рации данные по кинетике фотоиндуцирован'
Учитывая, что скорость восстановления P+700 оп'
ного поглощения протонов хлоропластами и их
ределяется скоростью окисления PQH2 [67],
выхода наружу из хлоропластов в темноте. На
БИОХИМИЯ том 86 вып. 1 2021
8*
116
ВЕРШУБСКИЙ, ТИХОНОВ
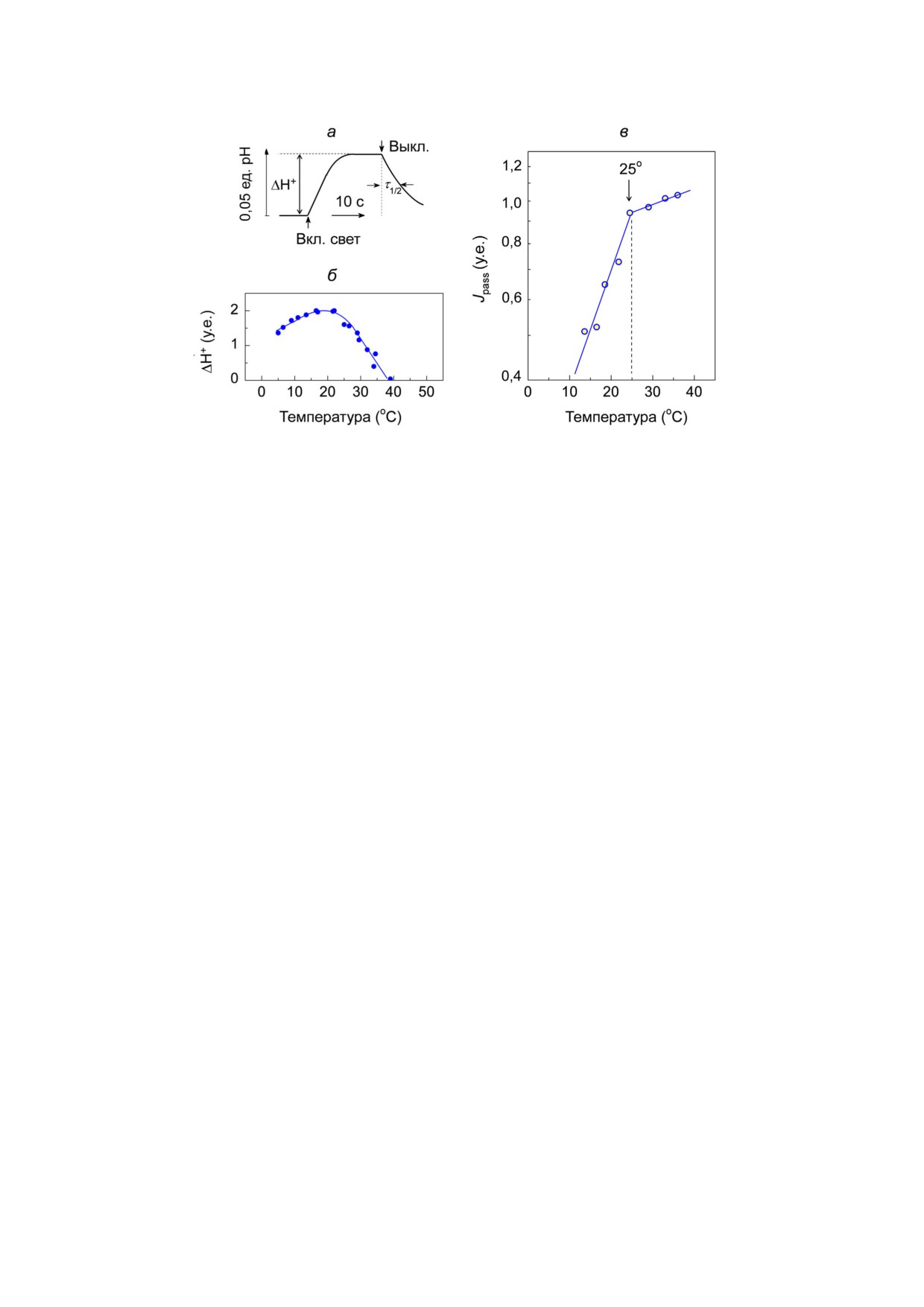
Рис. 3. Пассивный перенос протонов через тилакоидную мембрану хлоропластов. а - Кинетика фотоиндуцированных из'
менений рН в суспензии хлоропластов в метаболическом состоянии 4; б - температурная зависимость поглощения про'
тонов (параметр ΔН+); в - температурная зависимость пассивного потока протонов. Экспериментальные значения кине'
тических параметров, использованные для построения графиков, заимствованы из ранее опубликованной работы [64]
рис. 3, а показана кинетика фотоиндуцирован'
это процесс, сопряженный с высвобождением
ного защелачивания (pHout ↑) суспензии хлоро'
двух протонов во внутритилакоидное простран'
пластов бобов в «состоянии 4», когда не проис'
ство. Ускорение или замедление диссоциации
ходит синтеза АТР [64]. Из рис. 3, б видно, что
протонов от PQH2 в люмен должно влиять на
поглощение протонов (ΔH+) растет с повыше'
скорость окисления PQH2.
нием температуры в диапазоне 0-25 °C, но затем
Окисление пластохинола определяет скорость
монотонно уменьшается. Такая зависимость
переноса электронов между фотосистемами. Экс'
объясняется наложением двух эффектов: (1) ак'
периментальные данные показывают, что в диа'
тивацией процессов переноса протонов в люмен
пазоне температур 0-45 °С время переноса
вследствие работы ЦЭТ и (2) ускорением утечки
электронов между фотосистемами определяется
протонов из люмена вследствие «разрыхления»
главным образом процессами окисления PQH2 в
тилакоидной мембраны при достаточно высо'
b6 f'комплексе, в то время как скорость образо'
ких температурах. На рис. 3, в показана темпе'
вания PQH2 и его диффузии к b6 f'комплексу ос'
ратурная зависимость скорости утечки прото'
таются более быстрыми, чем перенос электронов
нов из тилакоидов (параметр Jpass). Значения Jpass
от PQH2 к b6 f'комплексу и далее к P+700. Это сле'
были определены как Jpass ~ 1/τ1/2, где τ1/2 - вре'
дует из сравнения температурных зависимостей
мя полуспада pHout после выключения света
кинетических параметров, отражающих образо'
(рис. 3, а). Видно, что температурная зависи'
вание PQH2 и его диффузию к b6 f'комплексу, с
мость Jpass имеет характерный излом при 25 °C:
одной стороны, и скорость переноса электронов
выход протонов из тилакоидов заметно ускоря'
от PQH2 к ФС1, с другой стороны (рис. 4). Дан'
ется с ростом температуры до 25 °C, при более
ные зависимости были получены при изучении
высоких температурах скорость утечки прото'
кинетики восстановления P+700 в ответ на вспыш'
нов возрастает, но значительно слабее.
ки белого света, подаваемые на фоне дальнего
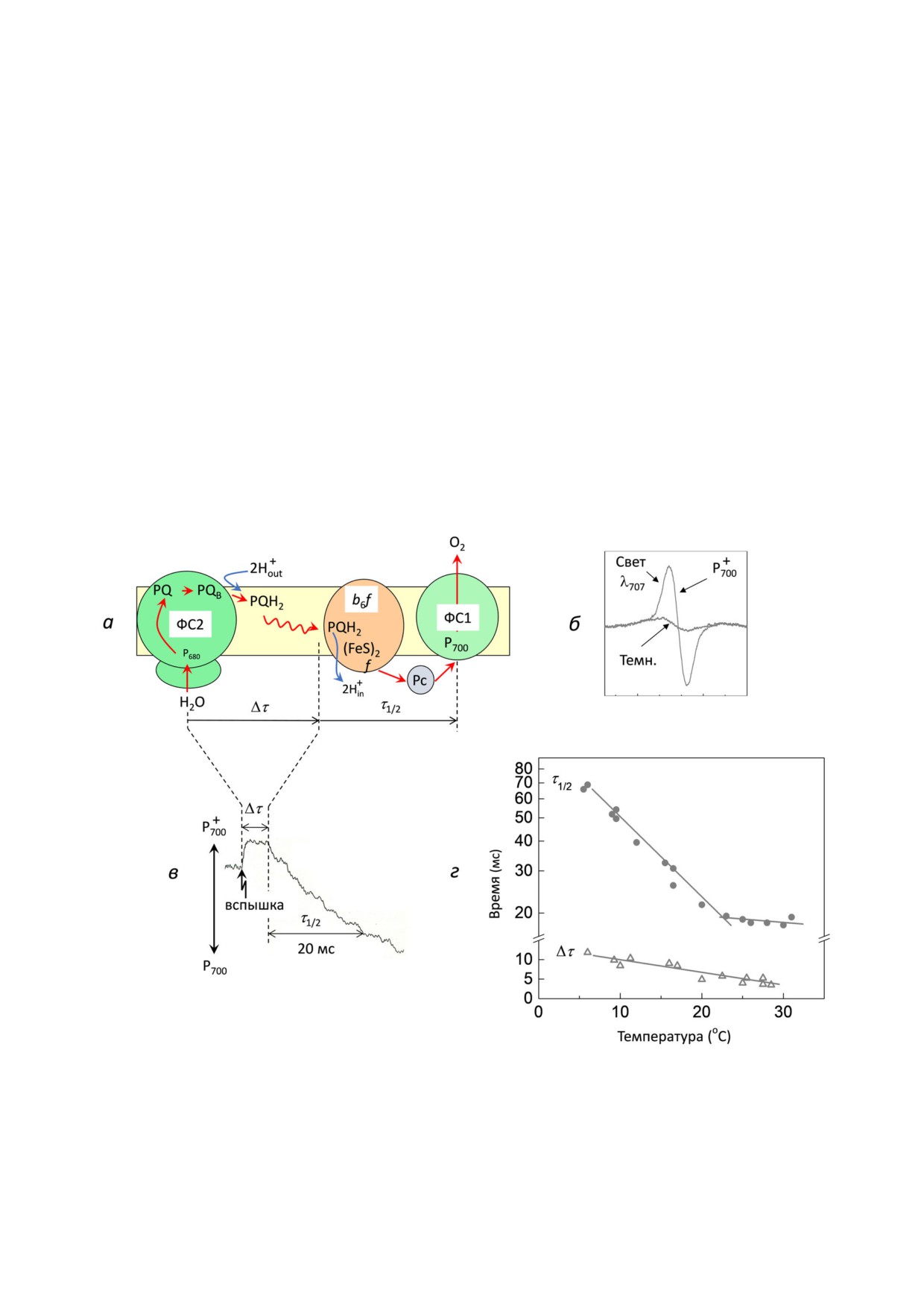
Влияние температуры на работу ЦЭТ и про'
красного света с длиной волны λмакс = 707 нм
цессы трансмембранного переноса протонов
(см. схему опыта на рис. 4, а). Видно, что восста'
может быть связано со структурными изменени'
новление P+700 после действия вспышки света
ями в липидных областях тилакоидной мембра'
происходит с задержкой (рис. 4, б). Длитель'
ны. Изменение температуры может влиять на
ность лаг'фазы (параметр Δτ) определяется вре'
микровязкость липидных областей мембраны,
менем образования пластохинола в ФС2 и его
ускоряя (или замедляя) диффузию молекул PQ
диффузии к b6 f'комплексу (рис. 4, в). Пара'
и PQH2 в липидной части мембраны. Скорость
метр Δτ возрастает с понижением температуры,
окисления PQH2 внутри b6 f'комплекса также
что свидетельствует о замедлении этих процес'
может контролироваться состоянием тилакоид'
сов при охлаждении хлоропластов. Важно отме'
ной мембраны, поскольку окисление PQH2 -
тить, однако, что во всем интервале исследуемых
БИОХИМИЯ том 86 вып. 1 2021
ТЕРМОРЕГУЛЯЦИЯ В ХЛОРОПЛАСТАХ
117
температур длительность лаг'фазы была заметно
ния активности ФС2 (рис. 2, б). Поток электро'
короче характерного времени восстановле'
нов к P+700 ослабевает с уменьшением концентра'
ния P+700 (параметр τ1/2), определяемого перено'
ции PQH2. При температурах выше 25-30 °C
сом электронов от PQH2 к b6 f'комплексу. Таким
концентрация PQH2 снижается и замедляется
образом, мы можем утверждать, что именно ско'
приток электронов к P+700, что проявляется как
рость окисления PQH2, связанного с b6 f'комп'
уменьшение кажущейся энергии активации.
лексом, является стадией, лимитирующей пере'
Другая причина снижения Ea в диапазоне
нос электронов между фотосистемами.
температур, лежащих выше 25 °C, может быть
Температурная зависимость кинетического
связана с термоиндуцированными структурны'
параметра τ1/2, как видно из рис. 4, г, имеет ха'
ми изменениями в тилакоидах. Мембранные
рактерный излом при температуре t0 ≈ 22-25 °C.
липиды - среда для латеральной диффузии мо'
При температурах ниже t0 ускорение переноса
лекул PQH2. Липиды, расположенные внутри
электронов характеризуется энергией активации
цитохромного b6 f'комплекса, способствуют
Ea(1) ~ 60 кДж⋅моль-1. При температурах выше t0
проникновению PQH2 в хинон'связывающий
стимулирующий эффект температуры незначи'
портал [11, 42]. «Затвердевание» мембранных
телен (Ea(2) ≤ 3 кДж⋅моль-1). Две ветви темпера'
липидов, вызванное снижением температуры
турной зависимости параметра τ1/2 отражают су'
(≤20-25 °С), будет препятствовать проникнове'
перпозицию двух эффектов: (1) ускорения окис'
нию молекулы PQH2 в хинон'связывающий
ления PQH2 с ростом температуры и (2) умень'
портал, тем самым замедляя окисление пласто'
шения концентрации PQH2 (донор электронов)
хинола. Наоборот, «разжижение» мембранных
при температурах выше t0 вследствие ослабле'
липидов с повышением температуры должно ус'
Рис. 4. Окислительно'восстановительные превращения PQ и Р700. а - Показывает схему опыта по измерению характер'
ных времен образования и окисления PQH2. б - Спектры ЭПР хлоропластов в темноте и при действии дальнего красно'
го света (λ707); в - кинетика изменений величины сигнала ЭПР от окисленных центров P+700 в ответ на вспышку белого све'
та (τ1/2 = 750 мс), подаваемую на фоне дальнего красного света (λ707). г - Показаны температурные зависимости кинети'
ческих параметров Δτ (длительность лаг'фазы) и τ1/2 (время полувосстановления P+700). Графики построены на основе дан'
ных, представленных ранее [24]
БИОХИМИЯ том 86 вып. 1 2021
118
ВЕРШУБСКИЙ, ТИХОНОВ
корять окисление PQH2, поскольку увеличение
ным временем ≈ 2-4 мс [75, 76]), которое коро'
подвижности PQH2 в мембране будет способ'
че времени окисления PQH2 (τ1/2 ≥ 5-20 мс [13,
ствовать образованию субстрат'ферментного
23, 24, 67]). Это означает, что скорость окисле'
комплекса (PQH2-b6 f) и тем самым ускорять
ния PQH2 определяется стадией переноса элект'
окисление PQH2. После перехода большей части
рона от PQH2 к окисленному редокс'центру
мембранных липидов в жидкокристаллическое
((Fe'S)2'кластер) после образования субстрат'
состояние, стимулирующее влияние температу'
ферментного комплекса PQH2-ISPox.
ры на скорость переноса электронов, будет мас'
Синтез АТР, сопряженный с потоком элект
кироваться снижением концентрации PQH2
ронов. При изучении закономерностей работы
вследствие подавления активности ФС2. С фе'
фотосинтетического аппарата хлоропластов ис'
номенологической точки зрения, это проявля'
пользование метода ЭПР дает несомненное пре'
ется как снижение активационного барьера ре'
имущество, связанное с тем, что наряду с изме'
акции восстановления P+700.
рениями редокс'превращений Р700 в тех же са'
Рассмотрим механизмы, определяющие ско'
мых экспериментальных условиях методом ЭПР
рость окисления PQH2 внутри b6 f'комплекса.
можно изучать структурные перестройки в тила'
Окисление PQH2 сопровождается выделением
коидных мембранах [64, 77]. Для этого обычно
протонов в люмен. Согласно модели окисления
используют парамагнитные молекулярные зон'
хинола (пластохинола в b6 f'комплексе или уби'
ды («спиновые зонды»), которые служат инди'
хинола в bс1'комплексе), предложенной в опуб'
каторами, сигнализирующими о происходящих
ликованных ранее исследованиях [33, 68, 69],
в мембранах структурных перестройках. Ниже
перенос электрона на окисленный железо'сер'
мы рассмотрим пример того, как с помощью ли'
ный белок (ISPox) сопряжен с депротонировани'
пидорастворимых спиновых зондов можно сле'
ем PQH2. При этом электрон и протон перено'
дить за термоиндуцированными структурными
сятся согласованно («концертно») на (Fe'S)2'
перестройками в липидных областях тилакоид'
кластер и на гистидиновый остаток, координи'
ных мембран.
рованный с (Fe'S)2'кластером [34, 35, 70-72].
Рассмотрим температурные зависимости
Вследствие того, что окисление PQH2 сопряже'
скорости фотофосфорилирования (синтез АТР)
но c диссоциацией ионов H+, можно предполо'
в хлоропластах бобов класса Б. Температурные
жить, что облегчение переноса протонов в лю'
зависимости скорости образования АТР (VATP)
мен с ростом температуры должно способство'
имеют колоколообразный вид (рис. 5, а). Это
вать ускорению окисления PQH2. После перехо'
объясняется суперпозицией двух эффектов,
да большей части липидов в «жидкокристалли'
вызванных увеличением температуры: 1) уско'
ческое» состояние эффект термоиндуцирован'
рением переноса электронов и ростом ΔpH, с
ного ускорения окисления PQH2 будет выражен
одной стороны, и 2) уменьшением потока
слабее. Последнее будет проявляться как умень'
электронов и усилением пассивной утечки про'
шение энергии активации реакции окисле'
тонов через мембрану в обход АТР'синтазы, с
ния PQH2, проявляющееся в уменьшении на'
другой стороны. Поэтому с ростом температуры
клона температурной зависимости параметра
синтез АТР сначала ускоряется, а затем спадает.
τ-11/2 при температурах выше 25 °С (рис. 2, г).
Температура, при которой наблюдается макси'
Фактором, контролирующим скорость окис'
мальное значение VATP, варьирует для хлоро'
ления PQH2, могли бы служить конформацион'
пластов, выделенных из листьев растений, вы'
ные перестройки ISP [73, 74]. После восстанов'
ращенных в разных условиях [64]. Следует отме'
ления ISP его подвижный домен, содержащий
тить закономерность, имеющую общий харак'
(Fe'S)2'кластер, смещается к гему f и передает
тер: с повышением температуры, при которой
ему электрон. После окисления ISP мобильный
растут растения, температура максимума зави'
домен возвращается в исходное положение.
симости VATP(t) увеличивается, с понижением
Увеличение подвижности этого домена должно
температуры - снижается. «Физиологический
сокращать время оборота b6 f'комплекса. Одна'
смысл» такой закономерности очевиден. Фото'
ко структурные и кинетические данные свиде'
синтетический аппарат растений адаптируется к
тельствуют, что при комнатных температурах
условиям выращивания, «приспосабливаясь» к
подвижность мобильного домена ISP не являет'
температуре окружающей среды. При этом, как
ся стадией, лимитирующей скорость переноса
было показано ранее [64, 78], существует четкая
электрона внутри b6 f'комплекса. Значительные
корреляция между температурными зависимос'
смещения редокс'центра ISP происходят быст'
тями параметров, характеризующих функцио'
ро по сравнению со скоростью окисления PQH2.
нальные свойства хлоропластов (электронный
При комнатных температурах перенос электро'
транспорт, синтез АТР) и структурные особен'
на от ISPred к цитохрому f протекает с характер'
ности тилакоидных мембран.
БИОХИМИЯ том 86 вып. 1 2021
ТЕРМОРЕГУЛЯЦИЯ В ХЛОРОПЛАСТАХ
119
Корреляция между температурными зависи'
спектр ЭПР спин'меченой стеариновой кисло'
мостями «функциональных» и «структурных»
ты (5'SASL), к которой ковалентно прикреплен
показателей тилакоидов четко прослеживается
нитроксильный радикал. С ростом температу'
при сравнении температурных зависимостей
ры, по мере «разрыхления» липидных доменов
скорости синтеза АТР (VATP) и параметров
мембраны, происходит разупорядочивание спи'
спектров ЭПР липидорастворимых спиновых
новых зондов и ускоряется их вращение, что
зондов, встроенных в тилакоидные мембра'
проявляется в изменении формы спектров ЭПР.
ны (рис. 5). Спектры ЭПР спиновых зондов, ло'
Из рис. 5, в видно, что параметр 2T′II, равный
кализованных в мембране (рис. 5, б), отражают
расстоянию между внешними экстремумами
подвижность и упорядоченность в расположе'
спектра ЭПР, уменьшается с ростом температу'
нии их парамагнитных фрагментов (нитроксиль'
ры. Это свидетельствует об увеличении подвиж'
ных радикалов) относительно мембранных ли'
ности молекул спинового зонда и понижении
пидов
[77,
79,
80]. На рис.
5, в показан степени упорядоченности молекул липидов, ко'
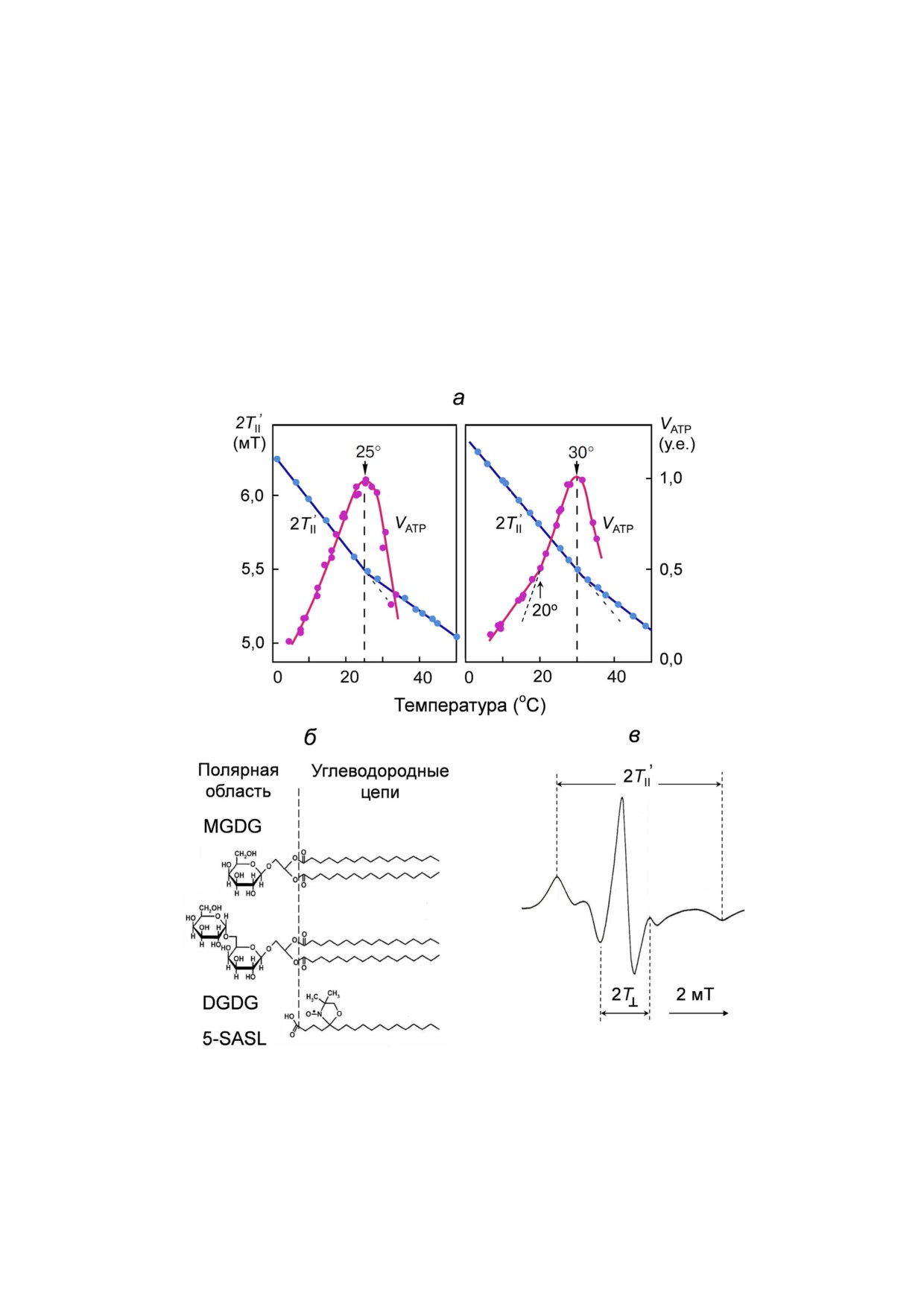
Рис. 5. Структурно'функциональные корреляции в тилакоидных мембранах. а - Температурные зависимости скорости
образования АТР (VATP) в двух различных препаратах хлоропластов бобов класса Б, функционирующих в условиях псев'
доциклического транспорта электронов, и сравнение их с температурными зависимостями «структурного» параметра 2T′II
(по материалам работы Тихонова с соавт. [64]). Значения 2T′II определяли из спектра ЭПР спинового зонда 5'SASL, встро'
енного в тилакоидную мембрану. б - Показаны структуры MGDG, DGDG и 5'SASL. в - Спектр ЭПР спинового зонда
5'SASL, встроенного в мембрану, измеренный при комнатной температуре (22-24 °С)
БИОХИМИЯ том 86 вып. 1 2021
120
ВЕРШУБСКИЙ, ТИХОНОВ
торые окружают зонд [79]. Отметим, что темпе'
транспорта в хлоропластах, выполненное в рам'
ратурные зависимости параметра 2T′II, получен'
ках развитой нами модели [82, 83], позволило
ные для разных препаратов хлороплас'
адекватно описать рассмотренные выше про'
тов (рис. 5, а, левая и правая панели), имеют
цессы и оценить вклад различных факторов в
«изломы» при тех же температурах, при которых
температурную регуляцию фотосинтеза [84].
скорость синтеза АТР максимальна, при 25 и
30 °С соответственно. Наличие характерного
«излома» на графике температурной зависимос'
ЗАКЛЮЧЕНИЕ
ти параметра 2T′II является отражением струк'
турного перехода в мембране, обусловленного
Фотосинтетический транспорт электронов в
ее «плавлением» - переходом большей части
хлоропластах регулируется на двух участках це'
липидов из упорядоченного в разупорядоченное
пи электронного транспорта: между ФC2 и
состояние [79].
ФC1 [16, 17, 45, 46] и на стадии оттока электро'
Конкретное значение температуры t0, при
нов от ФC1 в цикл Кальвина-Бенсона [5, 85,
которой скорость синтеза АТР максимальна, за'
86]. В настоящем обзоре мы рассмотрели про'
висит от условий выращивания растений [64,
цессы температурно'зависимой регуляции
78]. Такая вариабельность может быть вызвана
электрон'транспортных процессов на участ'
изменениями в составе мембранных липидов,
ке ЦЭТ между двумя фотосистемами. Основное
например изменениями соотношения между
внимание было уделено анализу функциониро'
ненасыщенными и насыщенными жирными
вания пластохинонового участка между ФC2 и
кислотами [10, 39-41]. Важно подчеркнуть, что
цитохромным b6 f'комплексом, поскольку
при этом сохраняется корреляция между темпе'
окисление PQH2 является лимитирующей ста'
ратурными зависимостями «структурного» па'
дией переноса электронов в ЦЭТ между ФС2 и
раметра 2T′II и скорости синтеза АТР. Тот факт,
ФС1. Скорость этого процесса определяется
что температуры, при которых скорости синтеза
временем окисления PQH2 в пластохинол'свя'
АТР максимальны, совпадают с температурами
зывающем центре (Qo) b6 f'комплекса, ориенти'
точек перегиба на графиках «структурного» па'
рованном в сторону люмена. Близкое располо'
раметра 2T′II (рис. 5, а), можно рассматривать
жение ФC2 и b6 f'комплексов в тилакоидах гран
как свидетельство в пользу роли физического
и достаточно высокая подвижность пластохи'
состояния («текучести») тилакоидной мембра'
нона в тилакоидной мембране способствуют
ны в регуляции фотосинтетических процессов в
образованию комплекса «субстрат-фермент»
хлоропластах. Можно предположить, что уста'
(PQH2-b6 f), ускоряя перенос электронов между
новление определенного баланса между липи'
ФС2 и b6 f'комплексом.
дами с насыщенными и ненасыщенными угле'
Результаты исследований термоиндуциро'
водородными цепями обеспечивает поддержа'
ванных структурных переходов в тилакоидных
ние оптимальных условий для эффективной ра'
мембранах методом спиновых зондов согласу'
боты фотосинтетического аппарата при дан'
ются с представлением о том, что адаптация фо'
ной температуре.
тосинтетического аппарата высших растений к
В литературе имеются данные, свидетель'
температуре окружающей среды может происхо'
ствующие о том, что состав мембранных липи'
дить за счет изменения физико'химических
дов может влиять на эффективность сопряже'
свойств липидных доменов тилакоидных мемб'
ния электронного транспорта и синтеза АТР в
ран. Соответствие температурных зависимостей
хлоропластах. В качестве меры эффективности
функциональным и структурным характеристи'
энергетического сопряжения в биоэнергетике
кам тилакоидных мембран ранее было показано
обычно используется отношение P/2е, показы'
методом ЭПР для различных препаратов хло'
вающее, сколько молекул АТР образуется в рас'
ропластов бобов [64]. Изменения микровязкости
чете на два электрона, перенесенных по цепи
липидных областей тилакоидных мембран могут
электронного переноса [31]. Отношение Р/2е,
происходить за счет изменения соотношения
как известно [81], варьирует в зависимости от
между липидами с ненасыщенными и насыщен'
условий получения хлоропластов. В хлороплас'
ными углеводородными цепями [40, 41]. Сосу'
тах бобов это отношение увеличивается с рос'
ществование «жидкой» и «кристаллической» фаз
том температуры, достигая значения Р/2е в диа'
в фотосинтетических мембранах [87] может
пазоне 0,8-1,2 при 22-25 °С (в зависимости от
обеспечивать оптимальные условия для функцио'
условий эксперимента) и остается постоянным
нирования фотосинтетического аппарата, когда
при более высоких температурах [65]. Компью'
высокая скорость электронного транспорта со'
терное моделирование температурных зависи'
четается со способностью тилакоидной мембра'
мостей процессов электронного и протонного
ны поддерживать необходимый уровень ΔpH.
БИОХИМИЯ том 86 вып. 1 2021
ТЕРМОРЕГУЛЯЦИЯ В ХЛОРОПЛАСТАХ
121
С повышением температуры могут ускоряться
Благодарности. Мы посвящаем нашу работу
диффузия пластохинона и образование
светлой памяти Александра Александровича
субстрат'ферментного комплекса PQH2-b6 f,
Константинова, совместно с которым одному из
возрастать ΔpH и скорость синтеза АТР. Однако
авторов (А.Н.Т.) посчастливилось заниматься
при значительном повышении температуры уси'
изучением электронного транспорта в дыха'
ливается пассивная утечка протонов из люмена в
тельной цепи митохондрий, используя метод
строму в обход АТР'синтазы, что вызывает паде'
ЭПР.
ние ΔpH и уменьшение скорости синтеза АТР.
Авторы признательны Э.К. Рууге, А.А. Ти'
По нашим наблюдениям, изменения внешних
мошину и Г.Б. Хомутову, совместно с которыми
условий (например, сезонные изменения темпе'
были получены данные, на которые мы ссыла'
ратуры) вызывают однотипные смещения точек
емся в настоящем обзоре. Авторы благодарны
перегиба на графиках функциональных пара'
анонимному рецензенту за полезные коммента'
метров хлоропластов (скорость восстановле'
рии и замечания.
ния P+700, синтез АТР) и параметров спектров
Финансирование. Работа выполнена при фи'
ЭПР спиновых зондов, встроенных в тилакоид'
нансовой поддержке Российского фонда фунда'
ные мембраны [64]. Это может быть обусловлено
ментальных исследований (грант № 18'04'
варьированием соотношения липидов с насы'
00214).
щенными и ненасыщенными углеводородными
Конфликт интересов. Авторы заявляют об от'
цепями, влияющим на физико'химические
сутствии конфликта интересов.
свойства тилакоидных мембран. Такие измене'
Соблюдение этических норм. Настоящая
ния могут обеспечивать устойчивое функциони'
статья не содержит описания каких'либо иссле'
рование фотосинтетического аппарата при коле'
дований с участием людей или животных в каче'
баниях температуры окружающей среды.
стве объектов.
СПИСОК ЛИТЕРАТУРЫ
1. Nelson, N., and Yocum, C. F. (2006) Structure and func'
Complexes: Evolution, Structures, Energy Transduction, and
tion of photosystems I and II, Annu. Rev. Plant Biol., 57,
Signaling (Cramer, W. A, and Kallas, T., eds.), Springer
521'565.
Link, pp. 177'207.
2. Mamedov, M., Govindjee, G., Nadtochenko, V., and
12. Witt, H. T. (1979) Energy conversion in the functional mem'
Semenov, A. (2015) Primary electron transfer processes in
brane of photosynthesis. Analysis by light pulse and electric
photosynthetic reaction centers from oxygenic organisms,
pulse methods, Biochim. Biophys. Acta, 505, 355'427.
Photosynth. Res., 125, 51'63.
13. Haehnel, W. (1984) Photosynthetic electron transport in
3. Boyer, P. D. (1997) The ATP synthase - a splendid molec'
higher plants, Annu. Rev. Plant Physiol., 35, 659'693.
ular machine, Annu. Rev. Biochem., 66, 717'749.
14. Kirchhoff, H., Horstmann, S., and Weis, E. (2000) Control
4. Walker, J. E. (2013) The ATP synthase: the understood, the
of the photosynthetic electron transport by PQ diffusion
uncertain and the unknown, Biochem. Soc. Trans., 41, 1'16.
microdomains in thylakoids of higher plants, Biochim.
5. Edwards, G., and Walker, D. (1983) C3, C4: Mechanisms,
Biophys. Acta, 1459, 148'168.
and Cellular and Environmental Regulation, of Photosyn'
15. Cardona, T., Sedoud, A., Cox, N., and Rutherford, A. W.
thesis, Univ. of California Press, Berkeley.
(2012) Charge separation in photosystem II: a comparative
6. Staehelin, L. A. (2003) Chloroplast structure: from chloro'
and evolutionary overview, Biochim. Biophys. Acta, 1817,
phyll granules to supra'molecular architecture of thylakoid
26'43.
membranes, Photosynth. Res., 76, 185'196.
16. Tikhonov, A. N. (2013) pH'Dependent regulation of elec'
7. Dekker, J. P., and Boekema, E. J. (2005) Supermolecular
tron transport and ATP synthesis in chloroplasts,
organization of the thylakoid membrane proteins in green
Photosynth. Res., 116, 511'534.
plants, Biochim. Biophys. Acta, 1706, 12'39.
17. Tikhonov, A. N. (2014) The cytochrome b6 f complex at the
8. Anderson, J. M. (1982) Distribution of the cytochromes of
crossroad of photosynthetic electron transport pathways,
spinach chloroplasts between the appressed membranes of
Plant. Physiol. Biochem., 81, 163'183.
grana stacks and stroma'exposed thylakoid regions, FEBS
18. Brettel, K. (1997) Electron transfer and arrangement of the
Lett., 138, 62'66.
redox cofactors in photosystem I, Biochim. Biophys. Acta,
9. Boudiere, L., Michaud, M., Petroutsos, D., Rébeillé, F.,
1318, 322'373.
Falconet, D., et al. (2014) Glycerolipids in photosynthesis:
19. Fromme, P., Jordan, P., and Krauss, N. (2001) Structure of
composition, synthesis and trafficking, Biochim. Biophys.
photosystem I, Biochim. Biophys. Acta, 1507, 5'31.
Acta, 1837, 470'480.
20. DeVault, D. (1980) Quantum mechanical tunnelling in
10. He, M., and Ding, N.'Z. (2020) Plant unsaturated fatty
biological systems, Q. Rev. Biophys., 13, 387'564.
acids: multiple roles in stress response, Front. Plant Sci.,
21. Page, C. C, Moser, C. C., Chen, X., and Dutton, P. L.
11, 562785, doi: 10.3389/fpls.2020.562785.
(1999) Natural engineering principles of electron tun'
11. Cramer, W. A, and Hasan, S. S. (2016) Structure'function
nelling in biological oxidation'reduction, Nature, 402, 47'
of the cytochrome b6 f lipoprotein complex, in Cytochrome
52.
БИОХИМИЯ том 86 вып. 1 2021
122
ВЕРШУБСКИЙ, ТИХОНОВ
22.
Kirchhoff, H., Hall, C., Wood, M., Herbstová, M.,
39.
Los, D. A., and Murata, N. (2004) Membrane fluidity and
Tsabari, O., et al. (2011) Dynamic control of protein diffu'
its role in the perception of environmental signals, Biochim.
sion within the granal thylakoid lumen, Proc. Natl. Acad.
Biophys. Acta, 1666, 142-157.
Sci. USA, 108, 20248'20253.
40.
Los, D. A., Mironov, K. S., and Allakhverdiev, S. I. (2013)
23.
Haehnel, W. (1976) The reduction kinetics of chlorophyll
Regulatory role of membrane fluidity in gene expression
a1 as an indicator of for proton uptake between the light
and physiological functions, Photosynth. Res., 116, 489'
reactions in chloroplasts, Biochim. Biophys. Acta, 440, 506'
509.
521.
41.
Maksimov, E. G., Mironov, K. S., Trofimova, M. S.,
24.
Tikhonov, A. N., Khomutov, G. B., and Ruuge, E. K.
Nechaeva, N. L., Todorenko, D. A., et al.
(2017)
(1984) Electron transport control in chloroplasts. Effects of
Membrane fluidity controls redox'regulated cold stress
magnesium ions on the electron flow between two photo'
responses in cyanobacteria, Photosynth. Res., 133, 215'223.
systems, Photobiochem. Photobiophys., 8, 261'269.
42.
Hasan, S. S., and Cramer, W. A. (2014) Internal lipid
25.
Zouni, A., Witt, H.T., Kern, J., Fromme, P., Krauss, N.,
architecture of the hetero'oligomeric cytochrome b6 f
Saenger, W., and Orth, P. (2001) Crystal structure of pho'
complex, Structure, 22, 1'8.
tosystem II from Synechococcus elongatus at 3.8 Å resolu'
43.
Hope, A. B. (2000) Electron transfers amongst cytochrome
tion, Nature, 409, 739'743.
f, plastocyanin and photosystem I: kinetics and mecha'
26.
Allakhverdiev, S. I. (2011) Recent progress in the studies of
nisms, Biochim. Biophys. Acta, 1456, 5'26.
structure and function of photosystem II, J. Photochem.
44.
Santabarbara, S., Redding, K. E., and Rappaport, F.
Photobiol. B, 104, 1'8.
(2009) Temperature dependence of the reduction of P+700 by
27.
Müh, F., Glöckner, C., Hellmich, J., and Zouni, A. (2012)
tightly bound plastocyanin in vivo, Biochemistry, 48,
Light'induced quinone reduction in photosystem II,
10457'10466.
Biochim. Biophys. Acta, 1817, 44'65.
45.
Kramer, D. M., Sacksteder, C. A., and Cruz, J. A. (1999)
28.
Mitchell, P. (1976) Possible molecular mechanisms of the
How acidic is the lumen? Photosynth. Res., 60, 151'163.
protonmotive function of cytochrome systems, J. Theor.
46.
Foyer, C. H., Neukermans, J., Queval, G., Noctor, G., and
Biol., 62, 327'367.
Harbinson, J. (2012) Photosynthetic control of electron
29.
Cramer, W. A., Hasan, S. S., and Yamashita, E. (2011) The
transport and the regulation of gene expression, J. Exp.
Q cycle of cytochrome bc complexes: a structure perspec'
Bot., 63, 1637'1661.
tive, Biochim. Biophys. Acta, 1807, 788'802.
47.
Tikhonov, A. N., Khomutov, G. B., Ruuge, E. K., and
30.
Tikhonov, A. N. (2018) The cytochrome b6 f complex: bio'
Blumenfeld, L. A. (1981) Electron transport control in
physical aspects of its functioning in chloroplasts, Subcell.
chloroplasts. Effects of photosynthetic control monitored
Biochem., 87, 287'328, doi: 10.1007/978'981'10'7757'
by the intrathylakoid pH, Biochem. Biophys. Acta, 637,
9_10.
321'333.
31.
Ivanov, B. (1993) Stoichiometry of proton uptake by thy'
48.
Li, Z., Wakao, S., Fischer, B. B., and Niyogi, K. K. (2009)
lakoids during electron transport in chloroplasts, in:
Sensing and responding to excess light, Annu. Rev. Plant
Photosynthesis: Photoreactions to Plant Productivity (Abrol,
Biol., 60, 239'260.
Y. P., Mohanty, P., Govindjee, G., eds.) Springer,
49.
Demmig'Adams, B., Cohu, C. M., Muller, O., and
Dordrecht, pp. 108'128.
Adams, W. W., 3rd (2012) Modulation of photosynthetic
32.
Hong, S. J., Ugulava, N., Guergova'Kuras, M., and
energy conversion efficiency in nature: from seconds to
Crofts, A. R. (1999) The energy landscape for ubihydro'
seasons, Photosynth. Res., 113, 75'88.
quinone oxidation at the Qo'site of the bc1 complex in
50.
Horton, P. (2012) Optimization of light harvesting and
Rhodobacter sphaeroides, J. Biol. Chem., 274, 33931'
photoprotection: molecular mechanisms and physiological
33944.
consequences, Phil. Trans. R. Soc. B, 367, 3455'3465.
33.
Crofts, A. R, Guergova'Kuras, M., Kuras, R.,
51.
Chance, B., and Williams, G. R. (1956) The respiratory
Ugulava, N., Li, J., and Hong, S. (2000) Proton'coupled
chain and oxidative phosphorylation, Adv. Enzymol., 17,
electron transfer at the Qo'site: what type of mechanism
65'134.
can account for the high activation barrier? Biochim.
52.
Berry, J., and Björkman, O. (1980) Photosynthetic
Biophys. Acta, 1459, 456'466.
response and adaptation to temperature in higher plants,
34.
Crofts, A. R. (2004) Proton'coupled electron transfer at the
Annu. Rev. Plant Physiol., 31, 491'543.
Qo'site of the bc1 complex controls the rate of ubihydro'
53.
Hu, S., Ding, Y., and Zhu, C. (2020) Sensitivity and
quinone oxidation, Biochim. Biophys. Acta, 1655, 77'92.
responses of chloroplasts to heat stress in plants, Front.
35.
Crofts, A. R., Hong, S., Wilson, C., Burton, R.,
Plant Sci., 11, 375'385, doi: 10.3389/fpls.2020.00375.
Victoria, D., et al. (2013) The mechanism of ubihydro'
54.
Quinn, P. J., and Williams, W. P. (1978) Plant lipids and
quinone oxidation at the Qo'site of the cytochrome bc1
their role in membrane function, Progr. Biophys. Mol. Biol.,
complex, Biochim. Biophys. Acta, 1827, 1362'1377.
34, 107'173.
36.
Ustynyuk, L. Yu., and Tikhonov, A. N. (2018) The
55.
Wallis, J. G., and Browse, J. (2002) Mutants of Arabidopsis
cytochrome b6 f complex: DFT modeling of the first step of
reveal many roles for membrane lipids, Prog. Lipid Res., 41,
plastoquinol oxidation by the iron'sulfur protein,
254'278.
J. Organomet. Chem., 867, 290'299.
56.
Margolis, L. B., Tikhonov, A. N., and Vasilieva, E. Yu.
37.
Wada, H., and Murata, N. (2009) Lipids in Photosynthesis:
(1980) Platelet adhesion to fluid and solid phospholipid
Essential and Regulatory Functions, Springer, Dordrecht.
membranes, Cell, 19, 189'194.
38.
Zhou, Y., vom Dorp, K., Dörman, P., and Hölzl, G. (2016)
57.
Ford, R. C., and Barber, J. (1983) Incorporation of sterol
Chloroplast lipids, in Chloroplasts. Current Research and
into chloroplast thylakoid membranes and its effect on flu'
Future Trends, Caister Academic Press, pp. 1'24.
idity and function, Planta, 158, 35'41.
БИОХИМИЯ том 86 вып. 1 2021
ТЕРМОРЕГУЛЯЦИЯ В ХЛОРОПЛАСТАХ
123
58.
Sawada, S., and Miyachi, S. (1974) Effects of growth tem'
Rieske clusters: importance of the coupling between oxida'
perature on photosynthetic carbon metabolism in green
tion state and histidine protonation state, Biochemistry, 42,
plants. I. Photosynthetic activities of various plants accli'
12400'12408.
matized to varied temperatures, Plant Cell Physiol., 15,
73.
Zhang, Z., Huang, L., Shulmeister, V. M., Chi, Y. I., Kim,
111'120.
K. K., et al. (1998) Electron transfer by domain movement
59.
Murata, N., and Fork, D. C. (1977) Temperature depen'
in cytochrome bc1, Nature, 392, 677'684.
dence of the light'induced spectral shift of carotenoids in
74.
Hasan, S. S., Stofleth, J. T., Yamashita, E., and Cramer,
Cvanidium caldarium and higher plant leaves. Evidence for
W. A. (2013) Lipid'induced conformational changes with'
an effect of the physical phase of chloroplast membrane
in the cytochrome b6 f complex of oxygenic photosynthesis,
lipids on the permeability of the membranes to ions,
Biochemistry, 52, 2649'2654.
Biochim. Biophys. Acta, 461, 365'378.
75.
Gong, X.'S., Chung, S., and Fernandez'Velasco, J. G.
60.
Nolan, W. G. (1980) Effect of temperature on electron
(2001) Electron transfer and stability of the cytochrome b6 f
transport activities of isolated chloroplasts, Plant Physiol.,
complex in a small domain deletion mutant of
66, 234'237.
cytochrome f, J. Biol. Chem., 276, 24365'24371.
61.
Nolan, W. G. (1981) Effect of temperature on proton efflux
76.
Yan, J., and Cramer, W. A. (2003) Functional insensitivity
from isolated chloroplast thylakoids, Plant Physiol., 67,
of the cytochrome b6 f complex to structure changes in the
1259'1263.
hinge region of the Rieske iron-sulfur protein, J. Biol.
62.
Тихонов А. Н., Хомутов Г. Б., Рууге Э. К. (1980) Иссле'
Chem., 278, 20926-20933.
дование электронного транспорта в фотосинтетичес'
77.
Tikhonov, A. N., and Subczynski, W. K. (2005) Application
ких системах. IХ. Температурная зависимость кинети'
of spin labels to membrane bioenergetics (photosynthetic
ки окислительно'восстановительных превращений
systems of higher plants), in Biological Magnetic Resonance
Р700 при освещении хлоропластов вспышками света
(Eaton, S. S., Eaton, G. R., and Berliner, L. J., eds.)
различной длительности, Молек. биология, 14, 157'171.
Kluwer Academic/Plenum Publishers, New York, pp. 147'
63.
Хомутов Г. Б., Тихонов А. Н., Рууге Э. К. (1981) Иссле'
194.
дование электронного транспорта в фотосинтетичес'
78.
Кукушкин А. К., Тихонов А. Н. (1988) Лекции по био'
ких системах. ХI. Эффекты фотосинтетического
физике фотосинтеза высших растений, Изд'во МГУ,
контроля: влияние энергизации тилакоидной мембра'
Москва.
ны на скорость электронного транспорта в хлороплас'
79.
Griffith, O. H., and Jost, P. C. (1976) Lipid spin labels in
тах бобов, Молек. биология, 15, 182'198.
biological membranes, in Spin Labeling: Theory and
64.
Тихонов А. Н., Тимошин А. А., Блюменфельд Л. А.
Applications, Academic Press, New York'London, pp. 456'
(1983) Кинетика электронного транспорта, перенос
524.
протонов и фотофосфорилирование в хлоропластах и
80.
Ligeza, A., Tikhonov, A. N., Hyde, J. S., and Subczynski,
их связь термоиндуцированными структурными пере'
W. K. (1998) Oxygen permeability of thylakoid mem'
стройками тилакоидной мембраны, Молек. биология,
branes: electron paramagnetic resonance spin labeling
17, 1236'1248.
study, Biochim. Biophys. Acta, 1365, 453'463.
65.
Тимошин А. А., Тихонов А. Н., Блюменфельд Л. А.
81.
Heise, K.'P., and Harnischfeger, G. (1978) Correlation
(1984) Термоиндуцированный структурный переход
between photosynthesis and plant lipid composition,
АТФ'синтетазы - фактор, регулирующий энергетичес'
Z. Naturforsch., 33, 537'546.
кое сопряжение в хлоропластах, Биофизика, 29, 338'349.
82.
Tikhonov, A. N., and Vershubskii, A. V. (2014) Computer
66.
Tikhonov, A. N., and Vershubskii, A. V.
(2017)
modeling of electron and proton transport in chloroplasts,
Connectivity between electron transport complexes
BioSystems, 121, 1'21.
and modulation of photosystem II activity in chloroplasts,
83.
Vershubskii, A. V., Trubitsin, B. V., Priklonskii, V. I., and
Photosynth. Res., 133, 103'114.
Tikhonov, A. N. (2017) Lateral heterogeneity of the proton
67.
Stiehl, H. H., and Witt, H. T. (1969) Quantitative treat'
potential along the thylakoid membranes of chloroplasts,
ment of the function of plastoquinone in photosynthesis, Z.
Biochim. Biophys. Acta, 1859, 388'401.
Naturforsch. B, 24, 1588'1598.
84.
Tikhonov, A. N., and Vershubskii, A. V. (2020) Temper'
68.
Brandt, U. (1996) Bifurcated ubihydroquinone oxidation
ature'dependent regulation of electron transport and ATP
in the cytochrome bc1 complex by proton'gated charge
synthesis in chloroplasts in vitro and in silico, Photosynth.
transfer, FEBS Lett., 387, 1'6.
Res., 146, 299'329.
69.
Link, T. A. (1997) The role of the “Rieske” iron sulfur pro'
85.
Рыжиков С. Б., Тихонов А. Н. (1988) Регуляция ско'
tein in the hydroquinone oxidation (Qp) site of the
рости переноса электрона в фотосинтетических мемб'
cytochrome bc1 complex: the “proton'gated affinity
ранах высших растений, Биофизика, 33, 642'646.
change” mechanism, FEBS Lett., 412, 257'264.
86.
Tikhonov, A. N. (2015) Induction events and short'term
70.
Stroebel, D., Choquet, Y., Popot, J.'L., and Picot, D.
regulation of electron transport in chloroplasts: an
(2003) An atypical heam in the cytochrome b6 f complex,
overview, Photosynth. Res., 125, 65'94.
Nature, 426, 413'418.
87.
Schneider, A. R., and Geissler, P. L. (2013) Coexistance of
71.
Kurisu, G., Zhang, H., Smith, J. L., and Cramer, W. A.
fluid and crystalline phases of proteins in photosynthetic
(2003) Structure of the cytochrome b6 f complex of oxy'
membranes, Biophys. J., 105, 1161'1170.
genic photosynthesis: tuning the cavity, Science, 302, 1009'
88.
Jordan, P., Fromme, P., Witt, H. T., Klukas, O.,
1014.
Saenger, W., and Krauss, N. (2001) Three'dimensional
72.
Zu, Y., Manon, M'J., Couture, M. M.'J., Kolling,
structure of cyanobacterial photosystem I at 2.5 Å resolu'
D. R. J., Crofts, A. R., et al. (2003) Reduction potentials of
tion, Nature, 411, 909'917.
БИОХИМИЯ том 86 вып. 1 2021
124
ВЕРШУБСКИЙ, ТИХОНОВ
STRUCTURAL AND FUNCTIONAL ASPECTS
OF ELECTRONIC TRANSPORT THERMOREGULATION
AND ATP SYNTHESIS IN CHLOROPLASTS
Review
A. V. Vershubskii, and A. N. Tikhonov*
Faculty of Physics, Lomonosov Moscow State University, 119991 Moscow, Russia; E'mail: an_tikhonov@mail.ru
The review is focused on analysis of the mechanisms of temperature'dependent regulation of electron transport and
ATP synthesis in chloroplasts of higher plants. Importance of photosynthesis thermoregulation is determined by the
fact that plants are ectothermic organisms, whose own temperature depends on the ambient temperature. The review
discusses the effects of temperature on the following processes in thylakoid membranes: (i) photosystem 2 activity and
plastoquinone reduction; (ii) electron transfer from plastoquinol (via the cytochrome b6 f complex and plastocyanin)
to photosystem 1; (iii) transmembrane proton transfer; and (iv) ATP synthesis. The data on the relationship between
the functional properties of chloroplasts (photosynthetic transfer of electrons and protons, functioning of ATP syn'
thase) and structural characteristics of membrane lipids (fluidity) obtained by electron paramagnetic resonance stud'
ies are presented.
Keywords: photosynthesis, chloroplasts, electron transport, thylakoid membranes, temperature'dependent regulation
БИОХИМИЯ том 86 вып. 1 2021