БИОХИМИЯ, 2021, том 86, вып. 1, с. 125 - 144
УДК 576.311; 571.27
ЭЛЕКТРОМЕТРИЧЕСКОЕ ИЗУЧЕНИЕ С ВРЕМЕННЫМ
РАЗРЕШЕНИЕМ ПЕРЕХОДА F→O ЦИТОХРОМ c ОКСИДАЗЫ.
ВЛИЯНИЕ ИОНОВ Zn2+ НА ПОЛОЖИТЕЛЬНОЙ
СТОРОНЕ МЕМБРАНЫ
© 2021
С.A. Силецкий1*, Р.Б. Геннис2
1 НИИ физико химической биологии им. А.Н. Белозерского, Московский государственный университет
имени М.В. Ломоносова, 119991 Москва, Россия; электронная почта: siletsky@belozersky.msu.ru
2 Университет Иллинойса, факультет биохимии, Урбана Шампэйн, 61801 Иллинойс, США
Поступила в редакцию 05.10.2020
После доработки 12.12.2020
Принята к публикации 12.12.2020
Влияние ионов Zn2+ на P сторону протеолипосом, содержащих встроенную в мембрану цитохром c окси
дазу из Rhodobacter sphaeroides, было изучено с помощью метода электрометрии с временным разрешением
при введении одного электрона в фермент, переведенный предварительно в состояние F. Вместе с фермен
том дикого типа также были изучены две его мутантные формы: N139D и D132N. Все полученные данные
свидетельствуют о том, что первичное влияние Zn2+, добавленного на P сторону мембраны, заключается в
ингибировании скорости высвобождения перекачиваемого протона из сайта загрузки протонов (PLS) в
объемную водную фазу на P стороне мембраны. Эти результаты позволяют определенно говорить о том, что
есть два пути, по которым перекачиваемый протон может покинуть белок из PLS, а также то, что есть два
отдельных сайта связывания ионов Zn2+. Представлена модель, объясняющая влияние Zn2+ на кинетику об
разования мембранного потенциала СОХ дикого типа, а также её мутантных форм N139D и D132N.
КЛЮЧЕВЫЕ СЛОВА: цитохром c оксидаза, ионы цинка, протеолипосомы, электрогенный, протонный
насос, цитохром aa3, Rhodobacter sphaeroides.
DOI: 10.31857/S0320972521010103
ВВЕДЕНИЕ
ложен глубоко в гидрофобном ядре белка и об
разуется при участии высокоспинового иона
Цитохром c оксидаза (COX) является ре
железа гема a3 и иона меди, CuB.
∼
докс зависимым протонным насосом, который
Н+ цитохром с окси
трансформирует энергию высоко экзергоничес
дазой включает электрогенный перенос элект
кого процесса восстановления молекулярного
ронов и «химических» протонов в биядерный
кислорода до молекулы воды в генерацию
центр гем a3/CuB с противоположных сторон
трансмембранной разности электрохимических
мембраны, приводя в итоге к образованию воды
∼
Н+
из молекулярного кислорода. Кроме поглоще
[1-3]. Этот фермент имеет четыре редокс цент
ния химических протонов, один протон допол
ра, содержащих металлы. Два входных цент
нительно перекачивается через мембрану на
ра (CuA и гем a) переносят электроны от природ
каждый электрон, перенесенный цитохром с
ного донора (цитохром c) на конечный катали
оксидазой от цитохрома c на молекулярный
тический сайт, где кислород восстанавливается
кислород [4].
до воды. Сайт восстановления кислорода распо
С помощью метода рентгеновской кристал
лографии были получены трехмерные кристал
лические структуры четырех представителей се
Принятые сокращения: BNC - биядерный центр;
COX - цитохром с оксидаза (cytochrome c oxidase); ΔΨ -
мейства A цитохром с оксидаз [5-7], в которых
изменение трансмембранного потенциала; F, O и P - со
были выявлены 3 предполагаемых протон про
стояния цитохром с оксидазы (states of cytochrome c oxi
водящих пути (K , D и H каналы) для переноса
dase); P и N фазы -положительно и отрицательно заря
протонов из внутренней водной фазы в ходе ка
женные водные фазы, разделенные сопрягающей мембра
талитического цикла. Работы с бактериальными
ной; PLS - сайт загрузки протонов (proton loading site);
Rubpy - Tris бипиридиновый комплекс рутения (Tris
оксидазами в значительной степени были облег
bipyridyl complex of ruthenium (II)); WT - СОХ дикого типа.
чены возможностью получения мутантных форм
* Адресат для корреспонденции.
фермента с нарушенной активностью [8-11].
125
126
СИЛЕЦКИЙ, ГЕННИС
Каталитический цикл COX можно описать в
не обнаруживаются в присутствии KCN. Ион
виде четырех одноэлектронных переносов от
цианида (CN-) связывается с BNC.
цитохрома c на биядерный центр, приводящих к
На многие вопросы, касающиеся механизма
восстановлению O2 до H2O. Каждый из этих че
действия СОХ, до сих пор нет ответов. В насто
тырех одноэлектронных этапов сопряжен с пе
ящей работе нами было использовано преиму
рекачкой одного протона через мембрану. Ката
щество, которое дает ингибирование активнос
литический цикл начинается с окисленной фор
ти COX при добавлении Zn2+ на электрически
мы фермента (состояние O). Последовательное
положительную сторону мембраны, и монито
добавление электронов в присутствии молеку
ринг перехода F→O с использованием электро
лярного кислорода приводит к образованию се
метрических методов. Ингибиторы часто явля
рии промежуточных состояний фермента, обоз
ются полезными инструментами для изучения
начаемых как состояния E, R, PM и F:
механизма действия ферментов. Большинство
ингибиторов COX направлены на BNC (актив
O→E→R→PM→F→O.
ный центр фермента) или входные сайты про
тон проводящих каналов на N стороне мембра
После восстановления фермента двумя
ны. Есть несколько ингибиторов, которые ока
электронами с образованием восстановленного
зывают воздействие на P сторону мембраны.
одним электроном (состояния E) и двумя элект
Кроме Zn2+, изученного в настоящей работе, за
ронами (состояния R) происходит связывание
якоренные на мембране пептиды, возможно,
молекулы O2 и затем расщепление связи O-O с
также могут ингибировать фермент с P стороны
образованием состояния PM, в котором один
мембраны [15].
атом кислорода связан с феррильной (Fe4+) фор
Помимо того, что Zn2+ является полезным
мой гема a3, а второй атом кислорода связан с
лабораторным инструментом, высокие концен
CuB в виде гидроксильной группы (OH-). Для
трации Zn2+ вызывают гибель нервных кле
расщепления связи O-O необходимы 4 электро
ток [16]. Также было показано присутствие Zn2+
на. Два необходимых дополнительных электро
в межмембранном пространстве митохонд
на обеспечиваются ионом Fe3+ гема a3, перехо
рий [17]. Когда цитозоль клетки перегружен
дящим в гипервалентное состояние Fe4+, и ре
Zn2+, его можно изолировать в межмембранном
докс активным модифицированным остатком
пространстве митохондрий [17] - месте, кото
тирозина в активном центре [12]. Переносы
рое крайне важно для реакций окислительного
электронов при переходах PM→F и F→O, по су
фосфорилирования. Свободные радикалы, об
ществу, приводят к восстановлению двух элект
разующиеся в виде токсичных побочных про
ронов, «заимствованных» для расщепления свя
дуктов, могут способствовать высвобождению
зи O-O. Можно предварительно перевести COX
Zn2+ из металлотионеина, приводя к повыше
в состояния PM и F и затем изучать перехо
нию концентрации свободных ионов Zn2+ в
ды PM→F и F→O в виде изолированных одно
межмембранном пространстве по сравнению с
электронных переходов с использованием Tris
цитозолем [17]. Высокие концентрации Zn2+
бипиридинового комплекса рутения (Rubpy)
ингибируют образование энергии в клетке. Ми
как фотоактивируемого одноэлектронного вос
шенью действия Zn2+ в гликолизе является гли
становителя [13].
церальдегид 3 фосфатдегидрогеназа [18], а в
За изменениями трансмембранного потен
цикле трикарбоновых кислот ионы Zn2+ нацеле
циала, ΔΨ, в результате фотоинъекции одного
ны на α кетоглутаратдегидрогеназу [19]. В дыха
электрона в состояния PM и F, можно наблюдать
тельной цепи Zn2+ оказывает воздействие на ос
с использованием электрометрических методов.
новные генераторы протондвижущей силы пу
Такие эксперименты привели к выявлению не
тем ингибирования восстановления и протони
скольких фаз с временным разрешением процес
рования хинона и/или транслокации протонов в
са генерации напряжения при переходах PM→F
митохондриальных комплексах I и III [20-21],
и F→O в случае СОХ из клеток млекопитаю
ингибирует активность NADН дегидрогеназы в
щих (из сердца быка), а также COX aa3 из бакте
клетках Escherichia coli [22], митохондриальной
риальных источников, таких как Paracoccus den
COX и бактериальных цитохромоксидаз aa3
itrificans и Rhodobacter sphaeroides [2, 13-14]. Эти
и cbb3 типа [23-25].
фазы включают быстрые (микросекундные)
Влияние Zn2+ на активность COX было ис
компоненты, которые не чувствительны к при
следовано в нескольких лабораториях. Aagaard и
сутствию KCN, блокирующему реакции с учас
Brzezinski [26] изучили влияние Zn2+ на солюби
тием кислорода в биядерном центре гем a3/CuB
лизированную детергентами COX aa3 из
(BNC), и следующие за ними более медлен
R. sphaeroides с помощью метода «флоу флэш».
ные (миллисекундные) компоненты, которые
Было показано, что Zn2+ ингибирует как пере
БИОХИМИЯ том 86 вып. 1 2021
ЭЛЕКТРОМЕТРИЧЕСКОЕ ИЗУЧЕНИЕ ВЛИЯНИЯ Zn2+ НА ЦИТОХРОМОКСИДАЗУ
127
ход PR→F, так и переход F→O в ходе одного обо
высвобождения протона только во время пере
рота фермента после добавления O2 к пол
хода PR→F и не оказывает действия при перехо
ностью восстановленному ферменту. Было
де F→O. Однако условия метода флоу флэш не
предположено, что сайты связывания Zn2+ рас
воспроизводят условия присутствия слабого
полагаются на входе в протонный D канал на
восстановителя или влияние ΔΨ, которые наи
N стороне COX, и это затем было подтверждено
более тесно связаны с естественными условия
структурными данными [27].
ми внутри митохондрий. В настоящей работе с
Также было проведено изучение COX, вклю
использованием фотовведения одного электро
ченной в протеолипосомы, содержащие Zn2+ на
на с помощью Rubpy в СОХ из R. sphaeroides, ре
внутренней (N стороне) мембраны [28]. Присут
конструированной в протеолипосомах, было
ствие Zn2+ на N стороне COX приводило к сни
проведено детальное изучение того, как связы
жению стехиометрии перекачивания прото
вание Zn2+ с Р стороной COX изменяет электро
на (на электрон) и замедлению скоростей ста
генные стадии во время перехода F→O. В отли
дий переноса зарядов, относимых к переносу
чие от работ с использованием метода флоу
протонов через D и K каналы. В этих работах
флэш [31], полученные нами результаты пока
было проведено изучение влияния Zn2+ в усло
зывают, что связывание Zn2+ с Р стороной COX
виях стационарных измерений оборотов фер
приводит к ингибированию высвобождения
мента и во время перехода F→O с временным
протонов во время перехода F→O.
разрешением. В целом, результаты, полученные
Aagaard и Brzezinski [26], соответствуют резуль
татам Kannt et al. [28].
МАТЕРИАЛЫ И МЕТОДЫ
Влияние Zn2+, добавленного на Р сторону
COX, было впервые изучено на митохондри
Получение фермента. COX aa3 была выделена
ях [29] и затем на СОХ из R. sphaeroides, вклю
из мембран клеток R. sphaeroides, как было опи
ченных в протеолипосомы [23]. В обоих случаях
сано ранее [32].
стационарная активность COX ингибировалась
Включение COX в состав протеолипосом. Ве
Zn2+, добавленным к внешней стороне мембра
зикулы, содержащие COX (COVs), получали с
ны (P сторона), и только при наличии трансмем
помощью стандартного метода диализа холата,
бранной ΔΨ. Было показано, что в присутствии
который ранее был использован при работе с
разобщителей, которые разрушают протондви
COX быка [33], цитохром ba3 оксидазой из
жущую силу, Zn2+, добавленный с Р стороны, не
Thermus thermophilus [34] и aa3 оксидазой из
вызывает ингибирование фермента. Однако
R. sphaeroides [9]. Очищенный препарат азолек
было обнаружено, что добавление Zn2+ на Р
тина в концентрации 40 мг/мл суспендировали в
сторону бычьей COX, реконструированной в
75 мМ HEPES KOH, pH 7,4, содержащем 2% хо
протеолипосомах в присутствии разобщителей,
лата, раствор озвучивали до достижения его
приводит к значительному ингибированию, но
прозрачности. Солюбилизированную цитохром
при этом фермент должен совершать обороты в
оксидазу инкубировали во льду в 75 мМ HEPES
присутствии восстановителя, и ингибирование
KOH, pH 7,4, содержащем 2% холата, в течение
ионами Zn2+ при этом может происходить в те
1 ч, затем смешивали с озвученным азолекти
чение многих минут или часов [24]. Было пред
ном с конечной концентрацией 4 мкМ оксидазы
положено, что данное ингибирование может
и 40 мг/мл липида.
быть связано с замедлением скорость лимити
Спектрофотометрические измерения с времен
рующего перехода F→O каталитического цик
ным разрешением при проведении экспериментов
ла, и для него не требуется трансмембран
по фотовосстановлению. Фотоиндуцированные
ной ΔΨ. Предположительно, сайт связывания
разрешенные во времени изменения величины
Zn2+ на Р стороне не доступен в окисленном
оптического поглощения измеряли с помощью
состоянии фермента, но становится доступным
однолучевого спектрофотометра с микросекунд
для катиона в некоторых частично восстанов
ным временным разрешением. Подробности та
ленных состояниях оксидазы. Было предполо
ких измерений были ранее опубликованы [9,
жено, что это может быть связано с восстанов
35-39]. Реакция запускалась вспышкой, на
лением CuB [30].
правленной от лазера («Spectra Physics», США) с
С использованием метода флоу флэш [31]
удвоенной частотой (frequency doubled neodymi
было показано, что Zn2+, добавленный к Р сто
um YAG laser; Lab 170 10; λ = 532 нм; 9 нс;
роне СОХ из R. sphaeroides, реконструированной
200-300 мДж). Образец помещали в прямоу
в липосомах, не вызывает изменений скоростей
гольную полумикрокювету с длиной оптическо
внутренних реакций переноса электронов, но
го пути 4 мм («Starna Cells», США). Сигнал фо
при этом он избирательно нарушает процесс
тоумножителя был оцифрован с помощью кар
БИОХИМИЯ том 86 вып. 1 2021
128
СИЛЕЦКИЙ, ГЕННИС
ты PC installed Gage 8012A card («GaGe», США)
временной шкале (примерно 10 и 31 мкс), про
(временная шкала - 2 000 000 точек с запро
межуточная фаза (~0,49 мс) и медленная фаза
граммированным распределением; шкала по
(~1,53 мс). Их относительные амплитуды пред
оси ординат - 12 бит). 15-30 кривых, снятых че
ставлены в табл. 1 и хорошо согласуются с пре
рез каждые 3-5 с, были усреднены для каждой
дыдущими измерениями [9, 11]. Микросекунд
кривой поглощения.
ные компоненты этого ответа нечувствительны
Регистрация образования электрического по
к действию KCN. Первая быстрая фаза ассоци
тенциала с временным разрешением. Генерация
ирована с переносом электрона от CuA на гем a;
разности электрических потенциалов на мем
минорная, 2 я быстрая фаза, связана с перено
бране везикул регистрировалась методом элект
сом положительного заряда или протона (изнут
рометрии [40], адаптированным для проведения
ри наружу), добавляя электрогенность стадии
экспериментов с COX с временным разрешени
переноса электрона.
ем [41-42]. Подробности приготовления образ
Более медленные миллисекундные фазы
цов и использованного метода были приведены
(~0,4 и ~1,5 мс) фотоэлектрического ответа
в предыдущих статьях [9, 33, 43-44].
чувствительны к KCN и находятся в зависимос
Анализ полученных данных. Эксперименталь
ти от функционального состояния D канала
ные кинетические кривые были обработаны с
входа протонов [8]. Эти фазы регистрируют дви
помощью программ Origin
7
(«OriginLab
жение как перекачиваемых, так и химических
Corporation», США), PLUK
[45], MATLAB
протонов через фермент.
(«Mathworks», США). Характеристические зна
На рис. 1 наглядно показано, что добавление
чения времен и относительные величины (амп
Zn2+ в раствор (Р сторона COX) приводит к за
литуды) электрогенных стадий были получены
медлению миллисекундных составляющих фо
разложением электрометрических кривых на
тоэлектрического ответа, но не влияет на его
индивидуальные экспоненты, как это было сде
микросекундную составляющую. Качественно
лано ранее при изучении фотоэлектрических
сходные результаты были получены ранее при
ответов цитохромоксидазы и других электроген
изучении COX из митохондрий быка [24]. Эф
ных белков [33-34, 46-49]. Если электрогенные
фект добавления Zn2+ носит обратимый харак
фазы обладают близкими значениями констант
тер, что было показано в экспериментах с добав
скорости и ассоциированы с последовательны
лением ЭДТА (рис. 1, а), где обеспечивается
ми, а не с параллельными процессами, то ис
изоляция Zn2+ из раствора и восстанавливается
тинные амплитуды фаз могут сильно различать
фотоэлектрический ответ до такой степени, ко
ся в зависимости от того, какая кинетическая
торая наблюдается в отсутствие Zn2+.
модель была использована [50]. Исходя из этого,
На рис. 1, б показано, что если вместо Zn2+
относительные величины промежуточных и
добавить Ni2+, то изменений в фотоэлектричес
медленных электрогенных протонных фаз были
ком ответе не наблюдается. Это согласуется с
пересчитаны, согласно последовательной моде
сообщениями Mills et al. [23] о том, что ингиби
ли [13, 51].
рование двухвалентными металлами, добавляе
мыми на Р сторону, специфично для ионов
Zn2+, что контрастирует с ингибированием, ког
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
да двухвалентные металлы добавляются на N
сторону COX. Ni2+, Cd2+ и другие ионы оказыва
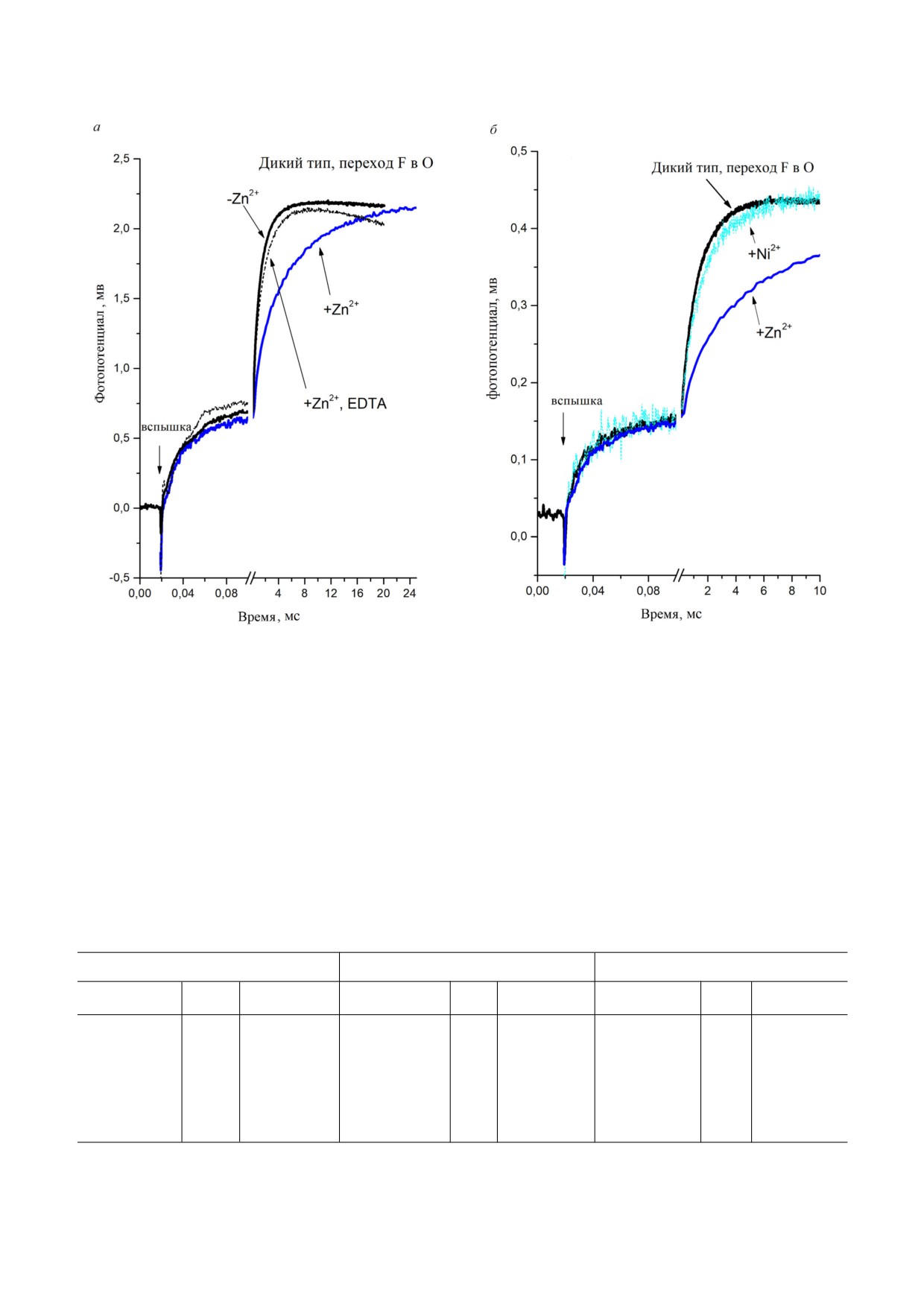
Влияние Zn2+ на индуцированную светом
ют такой же ингибирующий эффект, как и Zn2+.
быструю кинетику образования мембранного по
Следовательно, эти данные определенно гово
тенциала цитохром с оксидазой дикого типа из
рят о том, что ингибирующее действие Zn2+, о
R. sphaeroides (WT). На рис. 1 представлен инду
котором говорится в настоящей работе, не свя
цированный светом электрогенный ответ с вре
зано с его проникновением через липосомную
менным разрешением, полученный в результате
мембрану и связыванием с D протонным кана
измерения событий переноса заряда, сопряжен
лом с N стороны.
ных с переходом F→O цитохром с оксидазы из
В табл. 1 и на рис. 2 представлен мультиэкс
R. sphaeroides. Перед введением электрона COX
поненциальный анализ электрогенного ответа в
была переведена в состояние F путем обработки
присутствии ионов цинка. Полученные экспери
перекисью водорода встроенного в липосому
ментальные данные были проанализированы с
окисленного фермента, как это было описано
использованием 5 экспоненциальной (рис. 2, а)
ранее [52]. В результате были разделены во вре
и 4 экспоненциальной аппроксимации (рис. 2, б).
мени четыре основных электрогенных процес
Графики остаточных величин в каждом случае
са, что соответствовало предыдущим результа
показывают, что использование пяти экспонент
там [11]: две быстрые фазы в микросекундной
оправдано для анализа кинетических кривых.
БИОХИМИЯ том 86 вып. 1 2021
ЭЛЕКТРОМЕТРИЧЕСКОЕ ИЗУЧЕНИЕ ВЛИЯНИЯ Zn2+ НА ЦИТОХРОМОКСИДАЗУ
129
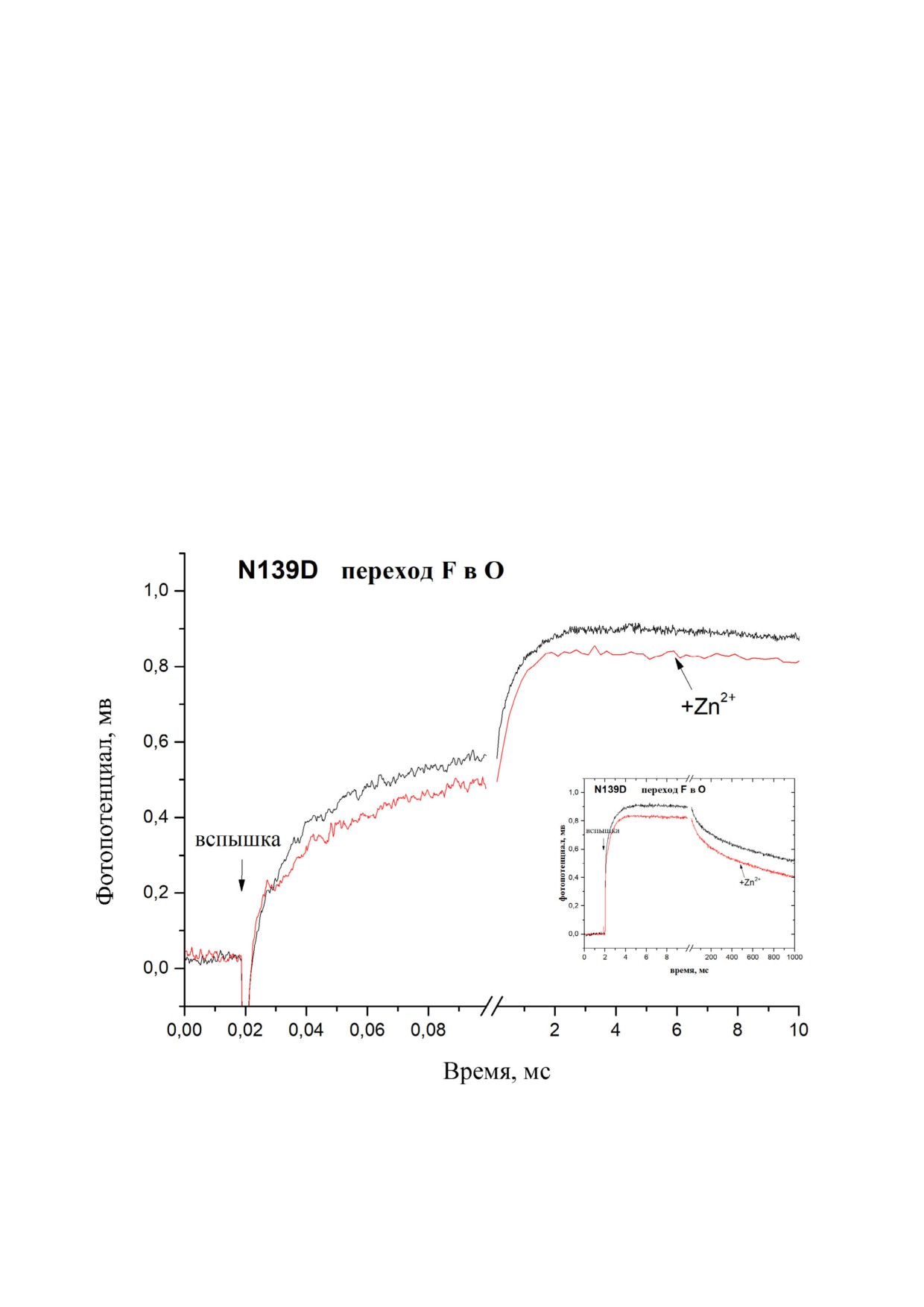
Рис. 1. Влияние добавления Zn2+ на кинетику образования мембранного потенциала цитохром с оксидазой из
R. sphaeroides. а - COX дикого типа после добавления Zn+2 и после добавления EDTA. б - Те же условия, что в панели (а),
но при этом вместо Zn2+ был добавлен Ni2+. Для сравнения, также показана кинетика из рис. 1, а, полученная после до
бавления Zn2+, и она нормализована относительно полного значения. Условия: 5 мМ Tris ацетат, pH 8,0, 10 мМ анилин,
40 мкМ Rubpy, 4 мМ Н2О2 (40 мкМ Zn2+, 100 мкМ Ni2+ и 0,2 мМ ЭДТА были добавлены, если указано)
Константы времени и относительные амплиту
сутствие Zn2+ приводит к дополнительной мед
ды фаз представлены в табл. 1, в которой также
ленной миллисекундной фазе, которая не на
есть результаты, полученные ранее [8, 9, 11] для
блюдается в отсутствие ингибитора.
кинетики генерации потенциала в отсутствии
Как показано в табл. 1, основное влияние
Zn2+. В отсутствии Zn2+ данные хорошо описы
40 мкМ Zn2+ и 320 мкМ Zn2+ оказывается на
ваются 4 экспоненциальной аппроксимацией.
медленную фазу, которая разбивается на два
Полученные результаты говорят о том, что при
компонента, «медленная 1» и «медленная 2».
Таблица 1. Кинетические фазы, наблюдаемые с использованием электрометрических методов, после фотоинъекции
электрона для запуска перехода F→O в реконструированной в протеолипосомах СОХ дикого типа (WT) из R. sphaeroides
при отсутствии Zn2+, в присутствии 40 мкМ Zn2+ и в присутствии 320 мкМ Zn2+
WT
WT + 40 мкМ Zn2+
WT + 320 мкМ Zn2+
Фаза
τ, мс
Амплитуда, %
Фаза
τ, мс
Амплитуда, %
Фаза
τ, мс
Амплитуда, %
1 я быстрая
0,01
18
1 я быстрая
0,011
19
1 я быстрая
0,01
18
2 я быстрая
0,031
12,5
2 я быстрая
0,03
11
2 я быстрая
0,049
16
промежуточная
0,49
22
промежуточная
0,94
16
промежуточная
0,84
18
медленная
1,53
46,5
1 я медленная
4,7
35
1 я медленная
5,9
11
2 я медленная
18,9
19
2 я медленная
21,9
39
9 БИОХИМИЯ том 86 вып. 1 2021
130
СИЛЕЦКИЙ, ГЕННИС
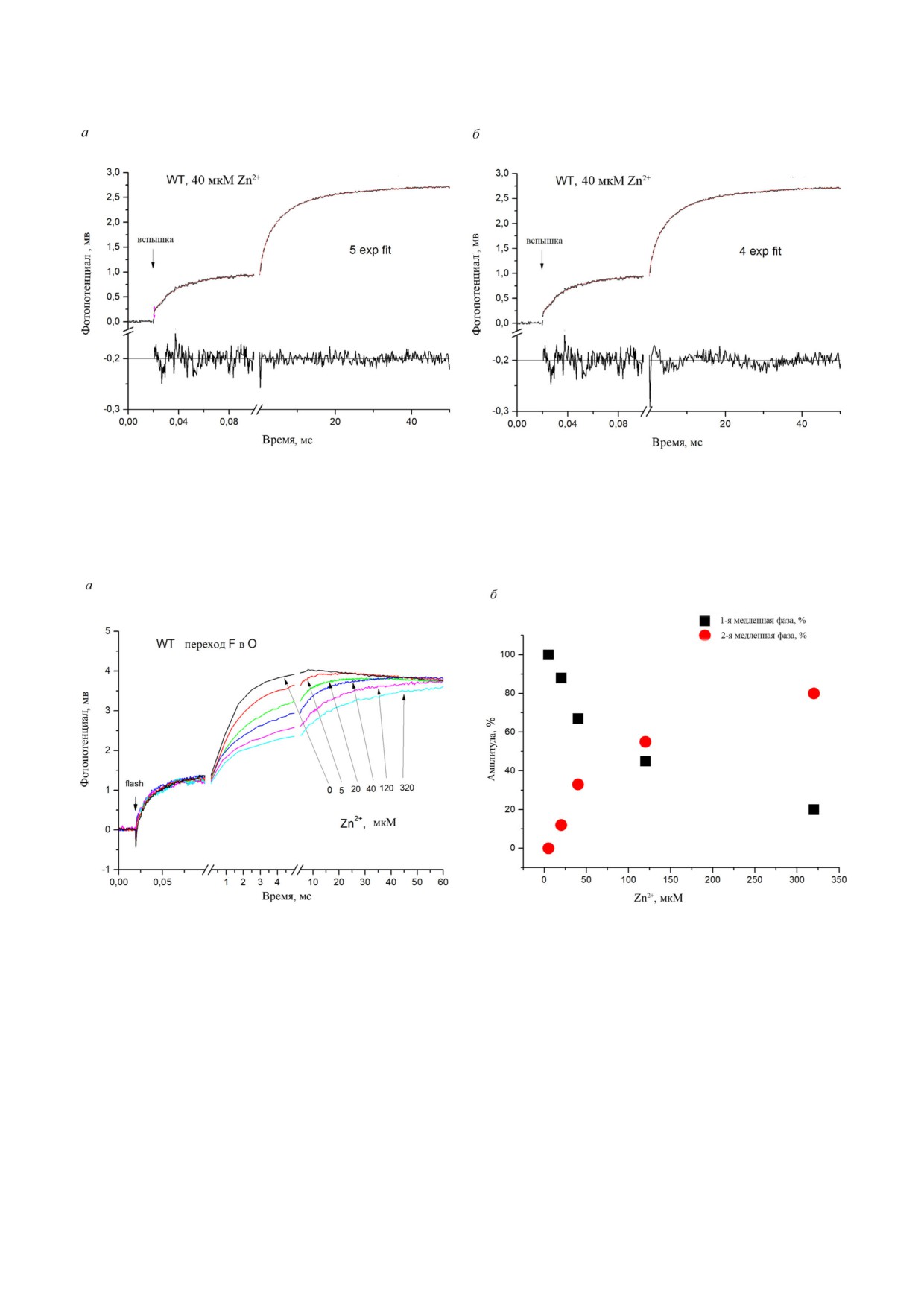
Рис. 2. Кинетика образования мембранного потенциала при переходе F→O СОХ из R. sphaeroides COX в присутствии Zn2+.
а - Полученные данные были проанализированы с помощью 5 экспоненциальной аппроксимации. б - Данные были
проанализированы с использованием 4 экспоненциальной аппроксимации. Графики остаточных значений свидетель
ствуют, что в присутствии Zn2+ «медленная» миллисекундная фаза кинетики подразделяется на две фазы (подробности см.
в тексте статьи и табл. 1). Условия показаны на рис. 1
Рис. 3. а - Кинетика образования мембранного потенциала во время перехода COX из R. sphaeroides из состояния F в со
стояние O при различных концентрациях Zn2+, добавленного к протеолипосомам. б - Зависимость величины 1 й и 2 й
медленных протонных фаз от концентрации Zn2+. Условия приведены на рис. 1
Сумма величин двух медленных составляющих,
изменяет константы времени для 1 й и 2 й мед
наблюдаемая в присутствии Zn2+ (табл. 1), соот
ленных фаз, но изменяет их амплитуды (обсуж
ветствует величине медленного компонента,
дается в следующем разделе). Изменение конс
наблюдаемого в отсутствии Zn2+. Постоянные
танты времени наиболее медленного компонен
времени 1 й и 2 й медленных фаз значительно
та, наблюдаемого в присутствии и при отсут
длиннее, чем у медленной фазы, наблюдаемой
ствии Zn2+, согласуется со снижением стацио
при отсутствии Zn2+. Следует отметить, что по
нарного количества оборотов, которое было от
вышение концентрации Zn2+ с 40 до 320 мкМ не
мечено при добавлении Zn2+ [23-24].
БИОХИМИЯ том 86 вып. 1 2021
ЭЛЕКТРОМЕТРИЧЕСКОЕ ИЗУЧЕНИЕ ВЛИЯНИЯ Zn2+ НА ЦИТОХРОМОКСИДАЗУ
131
Таблица 2. Зарегистрированная спектроскопически кине
переноса электрона от CuA. Последующее сни
тика реокисления гема a в СОХ дикого типа (WT) из
жение величины поглощения при 444 нм связа
R. sphaeroides COX в присутствии или при отсутствии
но с переносом электрона от гема a в гем мед
120 мкМ Zn2+
ный биядерный центр, приводящее к восста
WT
WT + 120 мкМ Zn2+
новлению оксиферрильной формы ге
ма a3 (Fe4+=O2-) с образованием окисленного
Фаза
τ, мс
Величина, %
τ, мс
Величина, %
состояния гема a3 (состояние O).
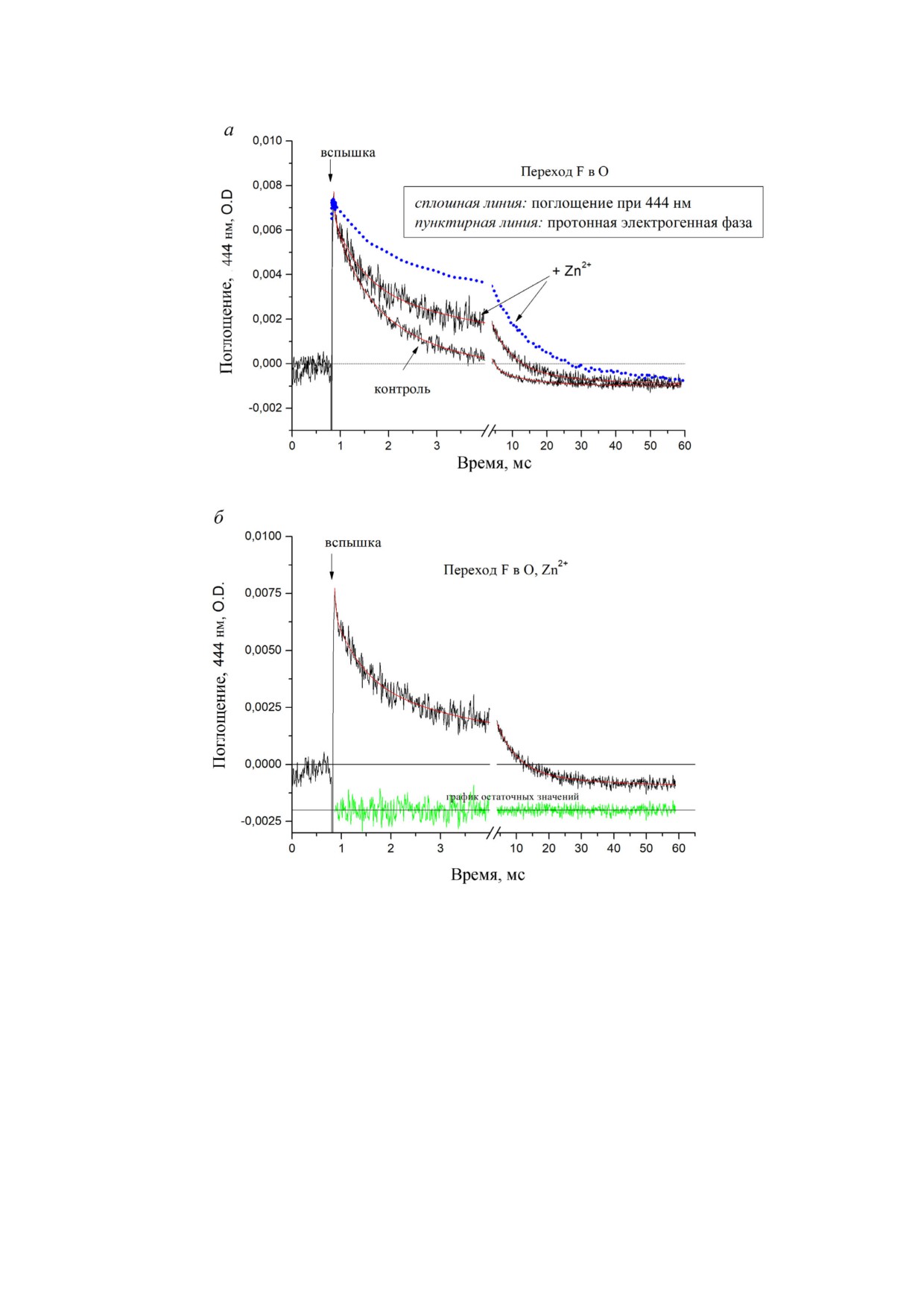
В кинетике реокисления гема a в отсутствии
1
0,4
33
0,61
42
Zn2+ (рис. 4, а, «контроль») разрешены две фазы
2
1,6
55
6,2
48
с τ ~0,4 и 1,6 мс (см. табл. 2), совпадающие по
3
9
12
30,9
10
времени с промежуточной и медленной элект
рогенными протонными фазами. Небольшая
третья фаза (~(5-15)% от общей величины) с
Концентрационная зависимость влияния Zn2+
τ ~10 мс (см. табл. 2) ассоциирована с реокисле
на кинетику образования мембранного потенциа
нием гема а в небольшой популяции молекул
ла. На рис. 3, а показаны фотоэлектрические от
фермента, которые не способны осуществлять
веты COX в присутствии различных концентра
ферментативную реакцию [11]. В присутствии
ций Zn2+ (вплоть до 320 мкМ). Кривые были
120 мкМ Zn2+ реокисление гема a существенно
нормализованы с использованием амплитуды
замедляется (рис. 4, а) и хорошо описывается
микросекундной части (1 я быстрая + 2 я быст
двумя экспоненциальными фазами с τ ~0,6 и
рая фазы) кинетических кривых, которая не из
~6,2 мс (табл. 2), которые соответствуют проме
меняется при добавлении Zn2+. Мультиэкспо
жуточной фазе и медленной фазе 1, наблюдае
ненциальный анализ (рис. 2) показывает, что
мым в электрометрических измерениях. Также
повышение концентрации Zn2+ от
40 до
обнаруживается третья минорная фаза (~10% от
320 мкМ изменяет амплитуду 1 й и 2 й медлен
общей величины) с τ ~30 мс, ассоциированная с
ных фаз без заметного изменения временных
небольшой популяцией молекул фермента, ко
констант (табл. 1). На рис. 3, б представлена за
торые не способны осуществлять ферментатив
висимость амплитуд 1 й и 2 й медленных фаз от
ную реакцию. Наиболее заметным является от
концентрации Zn2+. Очевидно, что по мере по
сутствие компонента оптических данных, кото
вышения концентрации Zn2+ амплитуда 1 й
рый соответствует медленной фазе 2 в присут
медленной фазы уменьшается, в то время как
ствии Zn2+ (рис. 4, б). Медленная электрогенная
амплитуда 2 й медленной фазы становится до
фаза 2 является оптически «молчащей».
минирующей.
Влияние ионов Zn2+ на P стороне мембраны на
Влияние Zn2+ на кинетику перехода F→O, ре
кинетику образования мембранного потенциала в
гистрируемую на основе изменений оптического
мутантных формах СОХ (N139D и D132N) на вхо
поглощения гема. Кинетика событий, происхо
де протон проводящего D канала. Аминокислот
дящих после индуцированного светом ввода
ная замена N139D в СОХ из R. sphaeroides, лока
электрона от Rubpy в COX, предварительно пе
лизованная немного выше входа в протон про
реведенную в F состояние, также регистрирова
водящий D канал, устраняет перекачивание
лась по изменениям величины оптического по
протонов через мембрану, но не влияет на спо
глощения гемовых центров. Увеличение значе
собность COX восстанавливать кислород [9].
ния поглощения при 444 нм (не разрешенный
Как ранее было показано, электрометрические
по времени скачок вверх на кривых, рис. 4, а)
измерения перехода F→O мутантной формы
вызвано восстановлением гема a в результате
СОХ N139D свидетельствуют об отсутствии ки
Таблица 3. Кинетические фазы, наблюдаемые при использовании электрометрических методов после фотоинъекции
электрона, приводящего к переходу F→O в реконструированной в протеолипосомах мутантной форме N139D COX из
R. sphaeroides в отсутствие Zn2+ и в присутствии 100 мкМ Zn2+
N139D
N139D + 100 мкМ Zn2+
Фаза
τ, мс
Величина, %
Фаза
τ, мс
Величина, %
1
1 я быстрая
0,0094
35
1
1 я быстрая
0,014
32
2
2 я быстрая
0,058
30
2
2 я быстрая
0,071
29
3
медленная
0,85
35
3
медленная
0,62
39
БИОХИМИЯ том 86 вып. 1 2021
9*
132
СИЛЕЦКИЙ, ГЕННИС
Рис. 4. Влияние Zn2+ на кинетику изменений оптического поглощения гемов R. sphaeroides COX во время перехода F→O
после введения электрона в фермент в состоянии F. а - Кинетика изменения значений поглощения при 444 нм в отсут
ствии Zn2+ и после добавления Zn2+ (черные сплошные линии - это измеренные кривые, красные сплошные линии - об
работанные данные). Также показана (синяя пунктирная линия) кинетика такого же перехода F→O, зарегистрированная
с помощью электрометрии на основе измерения скорости образования мембранного потенциала. б - Обработка экспери
ментальных данных с помощью двуэкспоненциальной модели кинетики перехода F→O, регистрируемой по изменению
величины оптического поглощения при 444 нм в присутствии Zn2+, также внизу показан график остаточных значений.
Условия: конечный образец содержал COX (~20 мкМ) в 5 мМ Tris ацетатном буфере и 0,05-0,1% додецилмальтозида,
40 мкМ Rubpy, 10 мМ анилина и 2 мМ H2O2. Две кривые оптического поглощения на панели (а) показаны после их нор
мализации относительно величины фотовосстановления гема a
нетической фазы, соответствующей переносу
за (с τ ~0,6 мс), соответствующая переносу про
протонов из водной фазы c N стороны в сайт
тонов из водной фазы с N стороны мембраны
загрузки протонов (PLS), но при этом сохраня
в BNC (рис. 5). Электрогенная фаза, соответ
ются как быстрые фазы (1 я и 2 я), так и фа
ствующая переносу протонов из водной фазы
БИОХИМИЯ том 86 вып. 1 2021
ЭЛЕКТРОМЕТРИЧЕСКОЕ ИЗУЧЕНИЕ ВЛИЯНИЯ Zn2+ НА ЦИТОХРОМОКСИДАЗУ
133
с N стороны в PLS, отсутствует в случае этого не
рый микросекундный электрогенный ответ му
перекачивающего мутанта. Добавление Zn2+ не
тантной формы D132N сходен с ответом фер
оказывало заметного влияния на электрогенную
мента WT (табл. 4). Наиболее заметный эффект
фазу, наблюдаемую в отсутствии Zn2+ (рис. 5,
аминокислотной замены D132N заключается в
табл. 3). На вставке в рис. 5 показано, что нет эф
низкой величине амплитуд протонных
фектов на пассивную разрядку мембранного по
фаз (~0,73 и ~3,7 мс) (табл. 4) [8]. Поскольку за
тенциала в присутствии Zn2+ в течение секунд.
мена D132N эффективно блокирует вход в ка
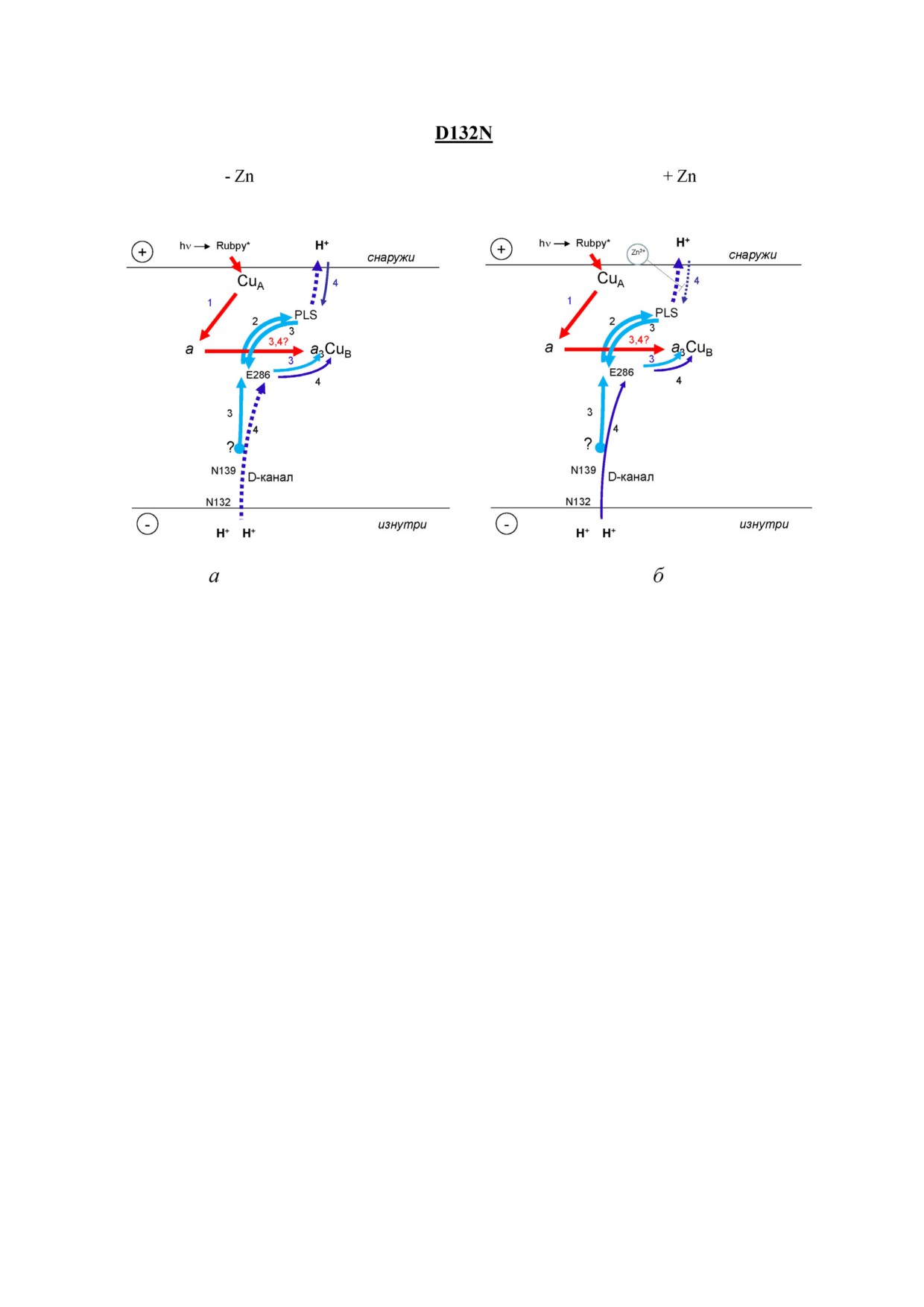
Аминокислотная замена D132N во входном
нал, это замедление протонных миллисекунд
участке D канала, в отличие от замены N139D,
ных фаз должно быть связано с движением
вызывает значительное подавление способнос
внутренних протонов внутри D канала. Сниже
ти фермента восстанавливать кислород, также
ние со временем величины микросекундной
как и способности перекачивать протоны.
части кинетики (рис. 6, а), вероятно, является
На рис. 6 представлена кинетика образования
следствием увеличения степени восстановлен
мембранного потенциала мутантной формой
ности гема a перед вспышкой из за сниженной
D132N в отсутствии Zn2+ и в присутствии Zn2+
стационарной активности мутантной формы
как после 5, так и после 10 мин инкубации пе
D132N, которая еще более снижается в присут
ред проведением измерений. На рис. 6, а пока
ствии Zn2+.
заны экспериментальные кривые, нормализо
Основной эффект добавления Zn2+ на Р сто
ванные по максимальной амплитуде, в то время
рону мутанта D132N проявляется в появлении
как на рис. 6, б кривые были нормализованы с
очень медленной фазы (147 мс, табл. 4). Для ста
использованием амплитуд быстрых фаз. Быст
ционарной активности мутантной формы
Рис. 5. Влияние Zn2+, добавленного к Р стороне мутантной формы N139D COX из R. sphaeroides, на кинетику образова
ния мембранного потенциала во время перехода F→O. Во вставке показаны те же данные, отложенные против более
крупной временной шкалы. Условия описаны на рис. 1
БИОХИМИЯ том 86 вып. 1 2021
134
СИЛЕЦКИЙ, ГЕННИС
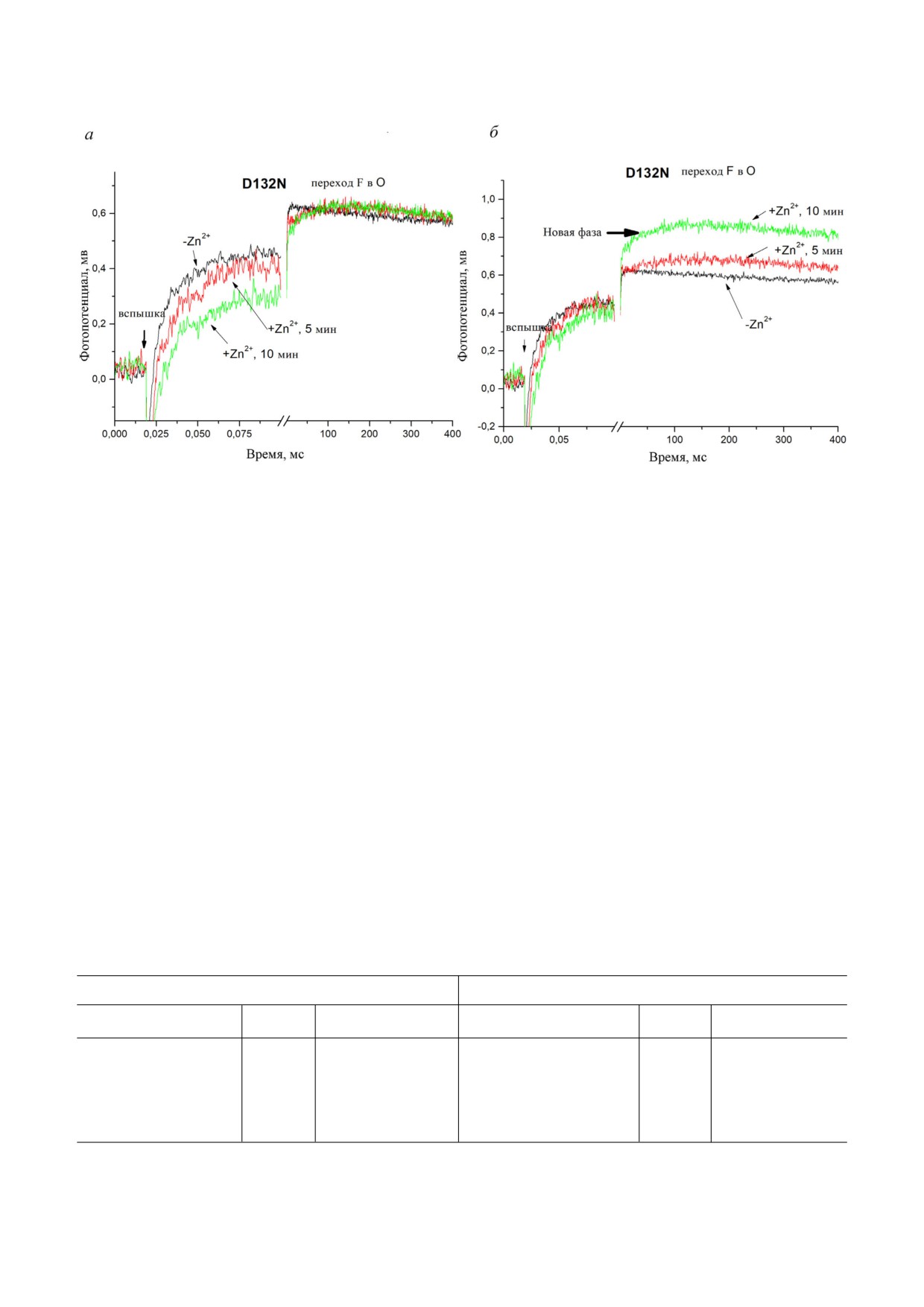
Рис. 6. Влияние Zn2+ на кинетику образования мембранного потенциала мутантной формой D132N. а - Кривые были
нормализованы с использованием общей величины. б - Кривые были нормализованы с использованием амплитуды
быстрых фаз (в точке ~0,1 мс). Условия описаны на рис. 1. Показано время инкубации
D132N характерен «обратный» дыхательный
чае множественных оборотов фермента, кото
контроль, что указывает на то, что значительная
рые основываются на потоке протонов с Р сто
часть протонов, поступивших в BNC, приходят
роны мембраны, так как вход в D канал на N
с Р стороны, а не с N стороны, как в случае
стороне в результате аминокислотной замены
СOX WT. Однако в одноэлектронных измерени
D132N блокирован. 2) В качестве альтернативы
ях в режиме одного оборота фермента не наблю
перенос протона с Р стороны в BNC может быть
дается отрицательный электрометрический эф
очень медленным (сотни миллисекунд) и не мо
фект. Его отсутствие возможно по двум причи
жет быть разрешен из за слияния с пассивной
нам. 1) В отсутствие Zn2+ протон в мутантной
разрядкой мембраны (τ ~ 0,5 с).
форме D132N переносится в BNC как с Р сто
Если связывание Zn2+ вызывает блокировку
роны через PLS в части фермента, так и из внут
доступа с Р стороны в биядерный центр, для
реннего источника внутри D канала, но в не
протонов единственным путем достижения
много большей части фермента. Это согласуется
BNC является путь с N стороны мембраны че
с низкой электрометрической амплитудой мил
рез D канал. Однако в связи с заменой D132N
лисекундной фазы, а также с положительным
доставка протонов через D канал с N стороны
знаком, указывающим на суммарный положи
сильно заингибирована, что приводит к замет
тельный заряд, движущийся изнутри наружу.
ной, но очень медленной электрогенной фазе,
Это не могло бы происходить постоянно в слу
наблюдаемой в присутствии Zn2+.
Таблица 4. Кинетические фазы, наблюдаемые с помощью электрометрических методов, после фотоинъекции одного
электрона для инициации перехода F→O в мутантной форме D132N COX из R. sphaeroides в отсутствии Zn2+ и в присут
ствии 100 мкМ Zn2+
D132N
D132N + 100 мкМ Zn2+, 5 минут инкубации
Фаза
τ, мс
Амплитуда, %
Фаза
τ, мс
Амплитуда, %
1
1 я быстрая
0,01
58
1
1 я быстрая
0,011
26
2
2 я быстрая
0,035
18
2
2 я быстрая
0,030
19
3
промежуточная
0,734
17
3
промежуточная
0,53
16
4
медленная
3,7
7
4
медленная
147
39
БИОХИМИЯ том 86 вып. 1 2021
ЭЛЕКТРОМЕТРИЧЕСКОЕ ИЗУЧЕНИЕ ВЛИЯНИЯ Zn2+ НА ЦИТОХРОМОКСИДАЗУ
135
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
После лазерной вспышки CuA восстанавли
вается под действием Rubpy в течение 1 мкс.
Результаты, представленные в настоящей ра
Микросекундная нечувствительная к действию
боте, подтверждают, что Zn2+ связывается с Р
KCN электрогенная часть кинетики перехо
стороной COX, и это вызывает ингибирование
да F→O в COX из R. sphaeroides состоит из двух
фермента. Эффекты ингибирования фермента с
компонентов [11]. Первая быстрая фаза (ста
Р стороны ионами Zn2+ можно резюмировать в
дия 1 на рис. 7) относится к переносу электрона
следующем виде.
от CuA на гем a. Происхождение второй быстрой
1. Основное воздействие на фермент дикого
фазы неизвестно. Среди её возможных источни
типа заключается в разделении медленной
ков [11]: а) перенос протона от E286 на PLS,
электрогенной фазы на два компонента: 1 ю и
обозначенный как стадия 2 на рис. 7; б) переме
2 ю медленные фазы. Обе фазы замедлены по
щение протона внутри каналов D или K; в) вы
сравнению с медленной фазой в отсутствии
свобождение протона из кластера
[-OH
Zn2+. Повышение концентрации Zn2+ от 20 до
Mg2+-(E254) H3O+] в объемную водную фазу на
320 мкМ не вызывает изменений констант вре
P стороне, запускаемое переносом электрона
мени 1 й и 2 й медленных фаз. Сумма величин
от CuA на гем a. Вариант (в) может быть исклю
1 й и 2 й медленных фаз остается постоянной,
чен отсутствием влияния Zn2+ на 2 ю быструю
поскольку при повышении концентрации Zn2+
фазу. Мы предполагаем, что 2 я быстрая фаза
происходит увеличение амплитуды 2 й медлен
соответствует переносу протона от E286 на PLS
ной фазы, и в то же время величина 1 й медлен
(стадия 2 на рис. 7).
ной фазы уменьшается. Вторая медленная фаза
За быстрыми фазами следуют две KCN
не связана с переносом электронов от гема a на
чувствительные электрогенные компонен
BNC, в то время как промежуточная и 1 я мед
ты (0,5 и 1,5 мс), которые связаны с этапами пе
ленная фаза сопровождаются окислением ге
реноса электрона от гема a на BNC. «Промежу
ма a.
точная» электрогенная фаза (стадия 3 на рис. 7)
2. Zn2+ не оказывает влияния на электроген
связана с переносом протона из N фазы для
ные фазы, наблюдаемые в несопряженной мута
репротонирования E286. Медленная фаза (ста
нтной форме N139D.
дия 4 на рис. 7) соответствует выбросу перекачи
3. Связывание Zn2+ с Р стороной мутантной
ваемого протона из PLS и сопряженному элект
формы D132N приводит к появлению очень
рогенному поглощению из N фазы химическо
медленной фазы.
го протона в BNC.
Электрогенные эффекты в ферменте WT. Что
Влияние Zn2+ можно объяснить с помощью
бы обсудить влияние Zn2+, сначала необходимо
модели, в которой эффект связывания Zn2+ с Р
обсудить кинетику перехода F→O в отсутствии
стороной COX обусловлен ингибированием
Zn2+. Подробности в табл. 5 и на рис. 7.
скорости выхода протонов из PLS в объемную
Таблица 5. Электрогенные фазы, наблюдаемые во время перехода F→O СОХ дикого типа из R. sphaeroides
Заряды
Фаза
τ
Амплитуда *
поперек
Основные перемещения зарядов
мембраны**
1
1 я быстрая
10 мкс
18%
0,33
перенос электрона: CuA → гем a
2
2 я быстрая
31 мкс
12,5%
0,23
неотнесенный перенос H+
3
промежуточная
0,68
1. поглощение перекачиваемого протона в PLS;
0,49 мс
37%
2. перенос электрона: гем a → гем a3 (30-35%).
4
медленная
1,53 мс
32,5%
0,6
1. поглощение химического протона в BNC;
2. высвобождение перекачиваемого протона из PLS на P сторону;
3. перенос электрона: гем a → гем a3 (55-60%).
Σ = 1,84
* Вклад промежуточной и медленной протонной фаз рассчитан на основе значений из табл. 1, предполагая последова
тельную модель двух протонных фаз [51].
** При проведении расчетов предполагается, что перенос электрона от CuA на гем a соответствует транслокации одного
элементарного заряда через 1/3 изолирующего диэлектрического слоя.
БИОХИМИЯ том 86 вып. 1 2021
136
СИЛЕЦКИЙ, ГЕННИС
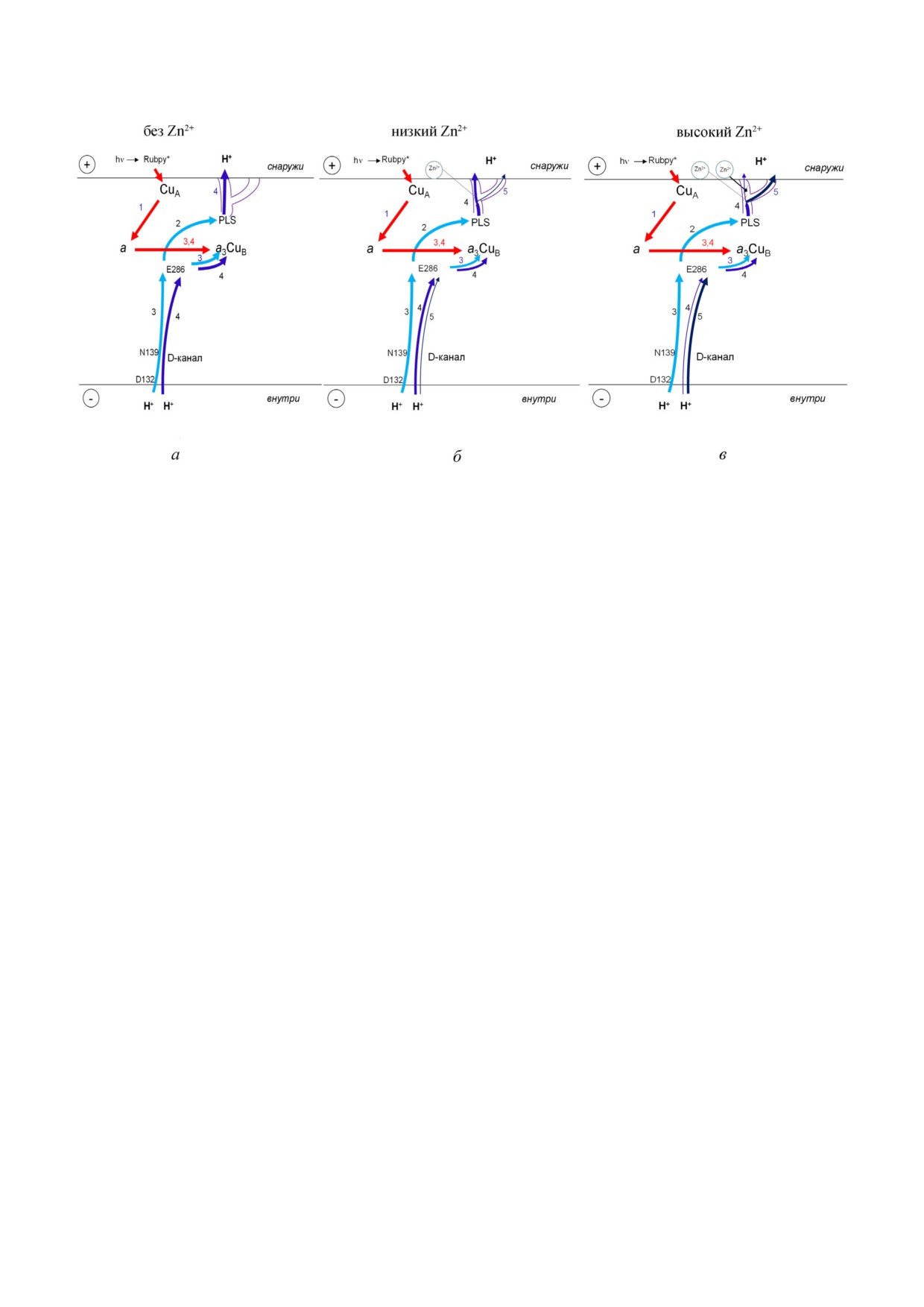
Рис. 7. Электрогенные стадии, сопряженные с переходом F→O в результате переноса одного электрона, инициирован
ного светом, в COX из R. sphaeroides в отсутствии или в присутствии Zn2+. Электрогенные стадии обозначены стрелками:
красные стрелки - перенос электронов; синие стрелки - транслокация протонов. Показан разветвленный канал выхо
да протонов. Диаграммы, расположенные слева, в центре и справа, показывают 3 состояния фермента: без Zn2+ (а), в
присутствии низких (б) или высоких (в) концентраций Zn2+ соответственно. На рис. 7, б и в показана не специфическая
локализация Zn2+ связывающих сайтов, а электрогенные стадии, на которые влияет Zn2+. Ионы цинка в низкой конце
нтрации замедляют транспорт протонов по основному протон высвобождающему пути (4). В результате действия высо
кой концентрации Zn2+ медленный протон высвобождающий путь (5) преобладает над основным. См. подробнос
ти в тексте
водную фазу на P стороне. Ингибирующее
ной водной фазы на Р стороне мембраны. Это
действие Zn2+ в отношении фермента WT явно
согласуется с результатами ранее опубликован
указывает на то, что должно быть два различных
ной работы по молекулярному моделированию
сайта связывания, приводящих к ингибирова
путей переноса молекул воды в объемную вод
нию. Этот вывод основан на влиянии изменения
ную фазу на P стороне, которые, в принципе,
концентрации Zn2+. При низких концентрациях
могут также служить для переноса протонов
Zn2+ (например, <20 мкМ) медленная фаза раз
[53]. В отличие от входных протон проводящих
бивается на 1 ю и 2 ю медленные фазы. Конс
каналов (каналы D и K) с четко определенной
танты времени для промежуточной и 1 й и 2 й
локализацией пути, каналы выхода протона не
медленных фаз остаются неизменными при воз
имеют четкой локализации. Это сеть водород
растании концентрации Zn2+. Однако повыше
ных связей. Она соединяет различными путями
ние концентрации Zn2+ вызывает изменение
пропионатные группы гемов a и a3 с внешней
амплитуды 1 й и 2 й медленных фаз, и при этом
стороной молекулы фермента [7]. Есть доста
сумма амплитуд этих двух фаз поддерживается на
точные основания предположить, что может
одном уровне. Поэтому мы предположили при
быть более одного пути выхода протона с раз
сутствие высокоаффинного сайта (Kd < 20 мкМ)
личными внутренними скоростями прохода
и низкоаффинного сайта (Kd ~ 100 мкМ) для
протона и с участием различных аминокислот
ионов Zn2+, которым характерны различные ин
ных остатков. Использование параллельных пу
гибиторные эффекты в отношении фермента.
тей движения протонов с различными внутрен
Сайт с высокой аффинностью, наиболее веро
ними скоростями не редкость для регуляции
ятно, похож на сайт, наблюдаемый при стацио
протон проводящих путей в белках. Например,
нарных измерениях тока электронов в фермент,
протеородопсин из Exiguobacterium sibiricum, у
индуцированный слабыми восстановителя
которого есть два пути переноса протонов на
ми [30].
шиффово основание с различными внутренни
Чтобы объяснить влияние Zn2+, мы высказа
ми скоростями, равными примерно
0,6 и
ли предположение о том, что есть два пути вы
4 мс [47-48].
хода протонов, высвобождающихся из PLS, с
Полученные данные согласуются с двумя ка
помощью которых они могут достигнуть объем налами выхода протонов в СОХ из R. sphaeroides,
БИОХИМИЯ том 86 вып. 1 2021
ЭЛЕКТРОМЕТРИЧЕСКОЕ ИЗУЧЕНИЕ ВЛИЯНИЯ Zn2+ НА ЦИТОХРОМОКСИДАЗУ
137
которые имеют внутренние константы времени,
вы, сумма их амплитуд остается постоянной при
ассоциированные с высвобождением протонов,
различных концентрациях Zn2+.
равные
1,5 и
18,9
мс. Они показаны на
Перенос электрона от гема a в BNC может
рис. 7, б и в. В отсутствии Zn2+ используется
происходить до доставки протона от E286
только один путь, для которого характерна
до BNC за счет использования локально доступ
быстрая кинетика (τ = 1,5 мс). Высвобождение
ного протона. При отсутствии Zn2+ процесс пе
протона из PLS сопряжено с доставкой другого
реноса электрона в BNC является двухфазным,
(химического) протона в BNC, и это соответ
и он наблюдается во время промежуточной и
ствует медленной фазе в отсутствии Zn2+ (ста
медленной фаз. Доставка протона от E286 в
дия 4, рис. 7, а). Связывание Zn2+ с высокоаф
BNC, однако, откладывается до депротонирова
финным сайтом замедляет перенос протона из
ния PLS. В присутствии Zn2+ процесс переноса
быстрого пути до 4,7 мс, и протоны, использую
электрона в BNC также является двухфазным и
щие этот путь при низких концентрациях Zn2+,
наблюдается во время промежуточной и 1 й
ответственны за 1 ю медленную фазу (ста
медленной фазы. Однако доставка протона от
дия 4, рис. 7, б).
Е286 в BNC происходит и в 1 й, и во 2 й медлен
При повышении концентрации Zn2+ загру
ных фазах, совпадая со скоростью высвобожде
женность низкоаффинного сайта связывания
ния протона из PLS через два пути. Перенос
(Kd ~ 100 мкМ) возрастает, и мы предполагаем,
электрона в BNC завершается до 2 й медленной
что связывание Zn2+ с этим сайтом полностью
фазы, которая, следовательно, оптически «бес
блокирует вклад 4,7 миллисекундного пути, де
шумна». В табл. 6 представлены части 1 й и 2 й
лая скорость переноса протона через этот путь
медленных фаз в виде функции от концентра
более медленной, чем через медленный протон
ции Zn2+, а также оценки количества перенесен
проводящий путь. Вследствие этого высвобож
ного заряда относительно доли мембранного
дение протона может протекать только через
диэлектрика. Для подсчета перенесенного заря
18,9 миллисекундный путь, соответствующий
да были использованы две различные модели.
2 й медленной фазе (стадия 5, рис. 7, в). При
При этом предполагалось, что промежуточная и
40 мкМ Zn2+ преобладает выход протона через
медленные (1 я и 2 я) фазы протекают либо па
4,7 миллисекундный путь (рис. 3, б), но по мере
раллельно, либо последовательно друг за дру
увеличения концентрации Zn2+ повышенная
гом. При высоких концентрациях Zn2+ доля 1 й
загруженность низкоаффинного сайта увеличи
медленной фазы не стремится к нулю, но оста
вается и, следовательно, для высвобождения
ется равной ~20%. Это соответствует электро
протона из PLS должен использоваться 18,9
генному переносу заряда на расстояние пример
миллисекундный путь. В этом случае преобла
но 0,19 и 0,16 мембранного диэлектрика в па
дает 2 я медленная фаза (рис. 7, в). Поскольку
раллельной и последовательной моделях соот
передвижения заряда, ассоциированные с 1 й и
ветственно (табл. 6). По всей видимости, ампли
2 й медленными фазами, по существу, одинако
туда 1 й медленной фазы при высокой концент
Таблица 6. Зависимость 1 й и 2 й медленных фаз транслокации зарядов, сопряженных с переходом из состояния F в со
стояние O СОХ дикого типа из R. sphaeroides, от концентрации Zn2+
[Zn2+]
F1, 1 я
F1, заряды через
F1, заряды через
F2, 2 я медленная
F2, заряды через
F2, заряды через
мкМ
медленная фаза*
мембрану**
мембрану***
фаза*
мембрану**
мембрану***
5
100%
0,94
0,75
0%
0
0
20
88%
0,83
0,66
12%
0,11
0,11
40
65%
0,61
0,49
35%
0,33
0,31
120
45%
0,42
0,34
55%
0,52
0,49
320
20%
0,19
0,16
80%
0,75
0,71
* F1 = 100% × ампл. (1 я медленная)/(ампл.(1 я медленная)+ампл. (2 я медленная)).
* F2 = 100% × ампл. (1 я медленная)/(ампл.(1 я медленная)+ампл. (2 я медленная)).
** При проведении расчетов предполагается, что перенос электрона от CuA на гем a соответствует транслокации одного эле
ментарного заряда через 1/3 изолирующего диэлектрического слоя. Вклад 2 й медленной протонной фазы был рассчитан на
основе кажущихся значений с учетом параллельных процессов, протекающих в промежуточной, 1 й и 2 й медленных фазах.
*** При проведении расчетов предполагается, что перенос электрона от CuA на гем a соответствует транслокации одного
элементарного заряда через 1/3 изолирующего диэлектрического слоя. Вклад протонных фаз был рассчитан на основе ка
жущихся значений с учетом проходящих последовательно друг за другом промежуточной и 1 й медленной фаз, а также
промежуточной и 2 й медленной протонных фаз, как было описано ранее [51].
БИОХИМИЯ том 86 вып. 1 2021
138
СИЛЕЦКИЙ, ГЕННИС
рации Zn2+ (~0,19 или ~0,16 от мембранного ди
ния [53]. Чтобы выйти за рамки предположе
электрика) включает электрогенный перенос
ний, необходимы дальнейшие исследования с
протона от E286 в BNC (~0,06, принимая во
привлечением методов биоинформатики и му
внимание электрогенную дистанцию ~0,12 от
тагенеза.
мембранного диэлектрика [11] и вклад кинети
Электрогенные эффекты в отношении мутант
ки реокисления гема a в 1 й медленной фазе,
ных форм N139D и D132N. Высвобождение про
равный ~0,48 (табл. 2)) и какой то дополнитель
тона из PLS в водную фазу с Р стороны не на
ный электрогенный процесс. Мы связываем
блюдается в несопряженной мутантной форме
этот дополнительный электрогенный процесс с
СОX N139D. Следовательно, связывание Zn2+ с
переносом протона от PLS к развилке двух пу
Р стороной не оказывает влияния на протека
тей выхода протонов, что определяет скорость
ние электрогенных фаз, наблюдаемых в случае
1 й медленной фазы. Этот процесс происходит в
этой мутантной формы. Это подтверждает вы
обеих популяциях фермента и непосредственно
вод о том, что все эффекты Zn2+ могут быть от
связан с переносом электронов в BNC. На этой
несены к его влиянию на скорость выхода про
точке разделения (развилке) могут находиться
тона из PLS (рис. 8).
несколько возможных аминокислотных остат
Блокировка D канала в результате замены
ков. Например, возможно, это могут быть H411,
D132N достаточно сильна, чтобы при стационар
D407 и D412, как показано на рис. 1 в статье
ном обороте протоны достигали BNC, используя
Mills et al. [23]. Еще предстоит выяснить, как эти
в обратном направлении путь между объемной
два пути выхода протона могут быть связаны с
водной фазой с Р стороны и PLS. Однако в нас
каналами R и T выхода воды, предсказанными с
тоящей работе, в которой использовался метод
помощью метода молекулярного моделирова
фотоинициированной «инъекции» электрона в
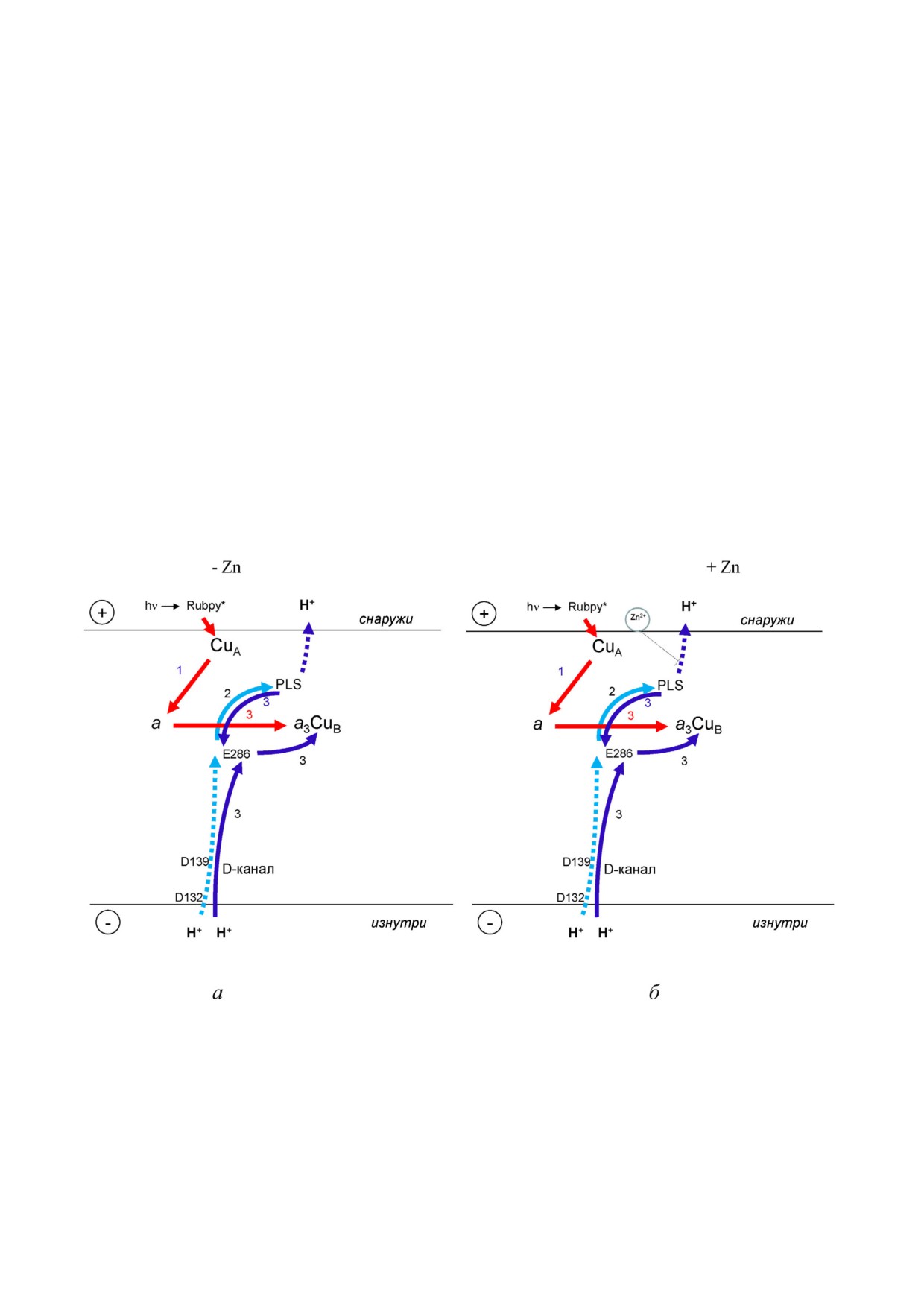
Рис. 8. Электрогенные стадии, сопряженные с фотоинициированным переносом одного электрона и переходом F→O му
тантной формы N139D СОХ из R. sphaeroides при отсутствии (а) и в присутствии (б) ионов Zn2+. Электрогенные стадии
обозначены стрелками: красные стрелки - перенос электрона; голубые и синие стрелки - транслокация протона. Стадия
переноса перекачиваемого протона, связанная с «промежуточной» протонной электрогенной фазой в ферменте WT, отсут
ствует в случае несопряженной мутантной формы N139D [9]. Эта стадия показана пунктирной линией. Также предпола
гается перенос протона от E286 на PLS, но он происходит одновременно с переносом протона в обратном направлении
(сплошные линии, стадия 3). Высвобождение протона из PLS в P фазу показано в виде пунктирной линии. Отсутствие
значительного эффекта ионов Zn2+ на медленную фазу мутантной формы N139D указывает на то, что именно перенос
протонов из PLS в P фазу ингибируется Zn2+ в СОХ дикого типа
БИОХИМИЯ том 86 вып. 1 2021
ЭЛЕКТРОМЕТРИЧЕСКОЕ ИЗУЧЕНИЕ ВЛИЯНИЯ Zn2+ НА ЦИТОХРОМОКСИДАЗУ
139
Рис. 9. Электрогенные стадии, сопряженный с фотоиницированным переносом одного электрона при переходе F→O му
тантного D132N белка СОХ из R. sphaeroides в отсутствии (а) и в присутствии (б) Zn2+. Электрогенные стадии обозначены
стрелками: красные стрелки - перенос электронов; голубые и синие стрелки - транслокация протонов. Внутренний до
нор протонов в D канале точно не известен, и он выделен кругом
режиме одного оборота фермента, обратный
депротонирования) или очень низка (исходно
электрогенный ответ, который можно было ожи
протонирован не полностью). Этот эффект (не
дать, основываясь на измерениях в стационар
очень подходящее значение pKa, частичный пе
ных условиях [23], прямо не наблюдается (рис. 9).
ренос протонов в BNC) будет незаметен, если
Одним возможным объяснением для наблю
произойдет быстрое репротонирование этого
даемых электрогенных фаз является то, что в
донора из D канала. Однако быстрый перенос
мутантной форме D132N COX перенос электро
протона из N фазы запрещен мутацией (пунк
на от гема a в BNC индуцирует перенос протона
тирная линия фазы 4 на рис. 9, а). Популяция
с P стороны в BNC у части популяции фермен
молекул фермента, для которых протон не был
та (тонкая сплошная линия в фазе 4 на рис. 9, а).
доставлен в BNC от внутреннего донора внутри
Однако в другой части фермента протон достав
D канала, могут получить протон с P стороны.
ляется из внутреннего источника внутри D ка
Однако, если перенос протона с P стороны про
нала с такой же скоростью, но с противополож
исходит очень медленно (сотни миллисекунд),
ным знаком, поскольку протоны перемещаются
то это не должно обнаруживаться на фоне пас
в противоположных направлениях (фаза
3
сивной разрядки мембраны. В обоих случаях в
на рис. 9, а). Так как эти два процесса протекают
присутствии Zn2+ транспорт протона с Р сторо
одновременно, но с противоположными элект
ны заблокирован, и наблюдается очень медлен
рогенными эффектами, итоговая амплитуда
ный перенос протона через D канал (тонкая
очень мала.
сплошная линия в фазе 4 на рис. 9, б).
Другим объяснением является то, что элект
Связь с предыдущими наблюдениями о влия
рогенная фаза 3 (рис. 9) отражает быструю до
нии Zn2+ на транслокацию протонов в цитохром
ставку протона в BNC от внутреннего донора
оксидазе. Физический механизм и вероятные сай
внутри D канала, однако этот процесс переноса
ты высвобождения протонов, ингибируемые иона
протона является неполным, так как pKa внут
ми Zn2+. В отличие от результатов исследований
реннего донора либо очень высока (нет полного
с использованием метода флоу флэш [31], полу
БИОХИМИЯ том 86 вып. 1 2021
140
СИЛЕЦКИЙ, ГЕННИС
ченные нами результаты свидетельствуют о том,
функционально связана (и влиять на свойства) с
что связывание Zn2+ с СОХ на её Р стороне сни
сайтом загрузки протонов PLS, который участ
жает скорость перехода F→O и ингибирует выс
вует в высвобождении перекачиваемого протона
вобождение протонов во время этого перехода.
во внешнюю водную фазу [30].
При измерении методом флоу флэш полностью
Нужно отметить, что переход из состояния F
восстановленный фермент реагирует с молеку
в состояние O, который разрешается при изуче
лярным кислородом в режиме одного оборота.
нии с помощью метода флоу флэш, отличается
Сетап данного метода не предполагает ни нали
от экспериментов по инъекции электрона от
чия мембранного потенциала на липосомах, ни
Rubpy тем, что в состоянии F цитохромоксидаза
слабого потока электронов через фермент, чье
уже содержит дополнительный электрон, поде
присутствие необходимо для проявления инги
ленный между входными редокс центрами (CuA
бирующего эффекта ионов цинка c P стороны
и гем a). В то же время при проведении экспери
мембраны при субмиллимолярных концентра
ментов по инъекции электрона от Rubpy в со
циях.
стояние F происходят полные последователь
Эффект замедления перехода F→O, который
ные окислительно восстановительные превра
был изучен в настоящей работе в слабых восста
щения CuA и гема a. В то же время предполага
новительных условиях (Rubpy/анилин [24, 30]),
ется, что один из возможных путей высвобожде
вызван действием Zn2+ на наиболее медленную
ния протона и воды сформирован вблизи
стадию каталитического цикла, каковой являет
CuA [55-56], что может указывать на значимость
ся скорость лимитирущая реакция всего цикла
в развитии ингибиторного действия ионов цин
цитохромоксидазы. Степень замедления хоро
ка также и редокс превращений CuA.
шо коррелирует с ингибированием в этих усло
Специфический механизм наблюдаемого за
виях активности цитохромоксидазы (85-90%)
медления этапов переноса протонов ионами
[30]. В слабо восстаналивающих условиях пред
Zn2+ может иметь различную физическую при
полагается, что ингибирующий эффект может
роду. Поскольку скорость обмена ионов Zn2+ в
быть обусловлен избирательным взаимодей
сайте/ ах их связывания, вероятно, намного вы
ствием ионов цинка с одним или несколькими
ше, чем разрешенные по времени электроген
частично восстановленными промежуточными
ные фазы, ионы Zn2+ вряд ли работают как на
состояниями каталитического цикла или про
стоящие блокаторы переноса протонов. Однако
межуточными состояниями СОХ, возникающи
связывание ионов Zn2+ с аминокислотными ос
ми в течение короткого периода во время пере
татками H, E или D может оказывать прямое
хода одного относительно стабильного проме
или косвенное воздействие на пути переноса
жуточного состояния в другое [24].
протонов. Это может быть реализовано путем
Было также предположено, что так называе
связывания с а.о., которые непосредственно
мый «невидимый» ион меди (CuB) в центре свя
вовлечены в высвобождение протонов, или с ос
зывания кислорода в молекуле COX может быть
татками, которые могут электростатически уве
тем компонентом, чье восстановление ответ
личивать потенциальную энергию для переноса
ственно за связывание Zn2+ на внешней стороне
протонов через путь. Связывание а.о. из различ
при слабых восстановительных услови
ных спиральных структур, в принципе, может
ях [24, 30]. Восстановление CuB связано с значи
препятствовать конформационным изменени
тельной перестройкой образованной тремя ос
ям белка, сопряженным с высвобождением про
татками гистидина координационной сферы
тонов. Помимо воздействия электростатических
этого редокс центра, что может вызвать струк
сил на а.о., мы также не исключаем того, что
турные изменения в белке, приводящие к увели
Zn2+ может прямо ограничивать водные цепоч
чению активности связывающей группы по от
ки, которые формируют путь выхода протонов.
ношению к иону Zn2+ [54]. Следует отметить,
На основании этой работы мы предполагаем
что аминокислотный остаток E286, основной
существование, по крайней мере, двух функци
донор протонов для PLS и BNC в «реакционном
онально различных сайтов связывания ионов
боксе» цитохромоксидазы, входит в состав пет
Zn2+ с P стороны мембраны и двух функцио
ли со связанными между собой ковалентной
нально различных путей высвобождения пере
связью остатками Y288-H284, которые, в свою
качиваемого протона. Влияние низких или вы
очередь, взаимодействуют с гемом a3/CuB (H284
соких концентраций ионов цинка может быть
является одним из лигандов CuB), и с помощью
результатом, например: 1) ингибирования кон
этого взаимодействия могут отслеживать ре
формационных изменений во время перекачи
докс изменения в активном центре во время
вания в связи со связыванием Zn2+ с остатками
восстановления кислорода [55]. С другой сторо
близлежащих спиральных участков; 2) связыва
ны, Zn2+ связывающая группа может быть
ния Zn2+ вблизи или внутри протон проводяще
БИОХИМИЯ том 86 вып. 1 2021
ЭЛЕКТРОМЕТРИЧЕСКОЕ ИЗУЧЕНИЕ ВЛИЯНИЯ Zn2+ НА ЦИТОХРОМОКСИДАЗУ
141
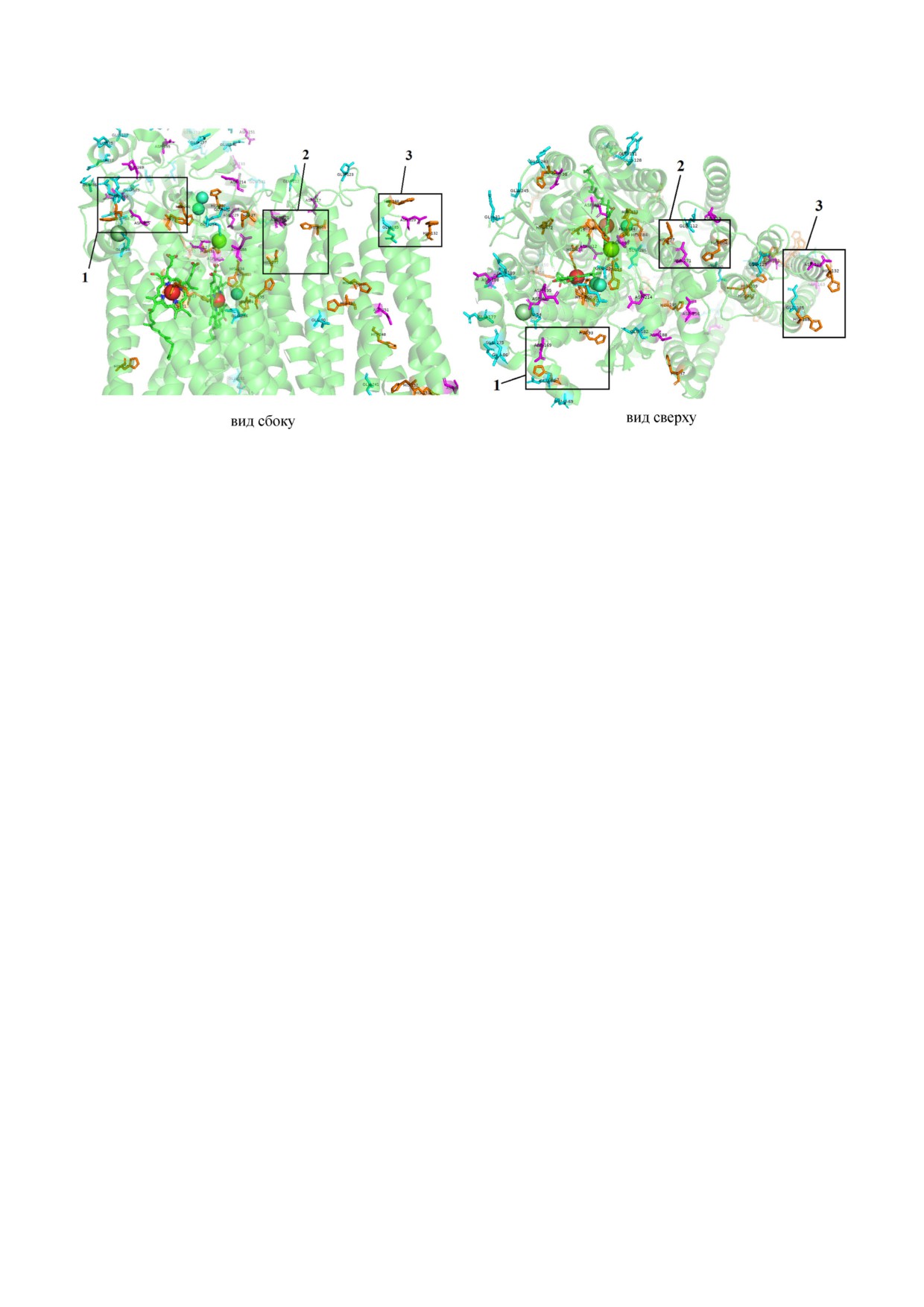
Рис. 10. Вероятные сайты связывания ионов цинка на P стороне мембраны в 3D структуре aa3 цитохромоксидазы из
R. sphaeroides (а и б - вид сбоку и сверху соответственно). Показаны боковые цепи и металлсодержащие центры (CuA, CuB,
Mg и гемы). Гемы показаны в виде зеленого проволочного каркаса. Fe, Cu и Mg - круги, раскрашенные в красный, голу
бой и зеленый цвет соответственно. Остатки H (His), D (Asp), E (Glu) показаны различным цветом: оливковый, марджен
та и сине зеленый соответственно. Три потенциальных сайта связывания ионов Zn2+ на P стороне мембраны обведены
квадратами: 1) His93, His67, Glu66; 2) His104, His277, Asp271; 3) His132, His188, Asp129, Glu185. Обозначения аминокис
лотных остатков, используемые на рисунке: H - His; D - Asp; E - Glu. Значения координат цитохром aa3 оксидазы из
R. sphaeroides взяты из архива PDB [7]. Для визуализации использовали программу PyMol
го пути и изменения барьера для переноса про
них находится сильно в стороне (3); один или
тона.
два других (1 и 2 на рис. 10) расположены неда
По нашему мнению, одним из наиболее
леко от центров CuA и Mg, а также предполагае
простых и логичных объяснений является пред
мых, исходя из молекулярно динамического ис
положение, что замедление 1 й медленной фазы
следования митохондриальной цитохромокси
по сравнению с медленной фазой фермента ди
дазы [53] R и T выводящих воду путей, соеди
кого типа происходит в результате опосредован
няющих полость иона Mg2+ с внешней стороной
ного влияния Zn2+ (это, возможно, ингибирова
фермента. Описанные выше участки представ
ние изменения конформации белка, если связы
ляют собой сайты в дополнение к тем остаткам
вание ионов цинка происходит не в непосред
H и карбоксильным группам, которые являются
ственной близости к протон проводящему пути),
непосредственно лигандами CuA и атома Mg, и
в то время как появление 2 й медленной фазы оз
вблизи которых может быть организован один
начает более непосредственное ингибирующее
из предполагаемых путей выделения прото
действие Zn2+ на выход протона через основной
на [55]. Очевидно, что существуют несколько
(осуществляемый в ферменте WT) путь и, по всей
потенциальных сайтов связывания Zn2+, распо
вероятности, является результатом связывания
ложенных над биядерным центром и, следова
ионов цинка вблизи или внутри протон прово
тельно, вблизи потенциальных путей высвобож
дящего пути. В результате высвобождение прото
дения протонов. Необходимы дальнейшие рабо
на протекает через более медленный путь. Пос
ты, чтобы найти корреляцию между этими сай
кольку 1 я медленная фаза не исчезает пол
тами и двумя Zn2+ связывающими сайтами, об
ностью даже при высоких концентрациях ионов
наруженными в кристаллах митохондриальной
цинка, это говорит о том, что два режима
цитохромоксидазы, обработанной миллимоляр
действия Zn2+ не могут протекать параллельно
ными концентрациями Zn2+ [57], с Zn2+ связы
из за связывания Zn2+ в одном и том же сайте.
вающими сайтами на N стороне COX [58], с
В качестве предварительных результатов на
Zn2+ связывающими сайтами в комплек
ми были обнаружены три потенциальных сайта
се bc1 [59-60], бактериальных реакционных
связывания ионов цинка на P стороне мембра
центрах [61] и др. Биоинформатические и моле
ны в 3D структуре цитохром aa3 оксидазы из
кулярно биологические исследования этих эф
R. sphaeroides (каждый из который включает по
фектов в цитохромоксидазе необходимы и могут
два остатка H и остатки E/D) (рис. 10). Один из
быть запланированы в будущем.
БИОХИМИЯ том 86 вып. 1 2021
142
СИЛЕЦКИЙ, ГЕННИС
ВЫВОДЫ
товлении рисунка 10. Авторы выражают благо
дарность анонимным рецензентам, особенно
Ингибирование Zn2+ с Р стороны мембраны
рецензенту 2 и рецензенту 3.
было четко продемонстрировано при изучении
Примечание. Эта работа посвящена памяти
электрогенных фаз в переходе F→O цитохром
профессора А.А. Константинова, выдающегося
оксидазы с использованием фотоинициируемо
ученого, вдохновляющего коллеги, учителя и
го введения электрона от Rubpy. Полученные
очень хорошего друга.
результаты показывают, что должно быть два
Работы по изучению влияния ионов цинка
различных сайта связывания Zn2+ с различным
на активность цитохромоксидазы и образова
действием на фермент. Согласно полученным
ние мембранного потенциала были начаты в ла
результатам, определенно должны быть два пути
боратории A.A. Kонстантинова в начале 2000 х
выхода для протона, высвобождаемого из PLS,
годов. Влияние Zn2+ на митохондриальную ци
чтобы он мог перейти в водную фазу с Р сторо
тохромоксидазу описано в работах A.A. Конс
ны мембраны, причем каждый путь обладает
тантинова и соавторов [24, 30], его вклад и дос
своей внутренней скоростью высвобождения
тижения в этой области были высоко оценены,
протона. Эти данные согласуются с ранее полу
они мотивировали и вдохновляли нас в этой ра
ченными результатами молекулярного модели
боте.
рования и обеспечивают экспериментальные
A.A. Константинов любил и науку и музыку
возможности для дальнейшего изучения того,
и обогащал жизнь всех, с кем общался. Он сыг
как протоны высвобождаются из PLS на Р сто
рал большую роль в расшифровке механизма ге
рону мембраны.
нерации мембранного потенциала цитохром с
оксидазой, используя различные умные страте
гии. Его мышление было ясным и критичным.
Финансирование. Выполнение данной рабо
Научные дискуссии с его участием были очень
ты было поддержано Российским Научным
яркими и полезными.
Фондом (грант № 19 14 00063).
Р.Б. Геннис выражает глубокую признатель
Конфликт интересов. Авторы заявляют об от
ность и благодарность Саше за посещение его
сутствии конфликта интересов в финансовой и
лаборатории в Урбане, штат Иллинойс (США) и
какой либо иной области.
дальнейшие продолжительные визиты. Он был
Соблюдение этических норм. В настоящей
желанным гостем у нас дома и мои дети его
статье нет описания работ, проведенных автора
очень любили, у них тоже остались очень теп
ми с участием людей или использованием жи
лые воспоминания о Саше. Мы также разделяли
вотных в качестве объектов исследования.
общий интерес к фильмам и книгам. После его
Благодарности. Авторы благодарны Илье
ухода в наших душах образовалась большая пус
Олейникову за техническое содействие в изго тота, и его очень нам не хватает.
СПИСОК ЛИТЕРАТУРЫ
1.
Ferguson Miller, S., and Babcock, G. T. (1996) Heme/
8. Konstantinov, A. A., Siletsky, S., Mitchell, D., Kaulen, A.,
copper terminal oxidases, Chem. Rev., 7, 2889 2907.
and Gennis, R. B. (1997) The roles of the two proton input
2.
Siletsky, S. A. (2013) Steps of the coupled charge translo
channels in cytochrome c oxidase from Rhodobacter
cation in the catalytic cycle of cytochrome c oxidase, Front.
sphaeroides probed by the effects of site directed muta
Biosci. (Landmark Ed), 18, 36 57.
tions on time resolved electrogenic intraprotein proton
3.
Borisov, V. B., and Siletsky, S. A. (2019) Features of organi
transfer, Proc. Natl. Acad. Sci. USA, 94, 9085 9090.
zation and mechanism of catalysis of two families of terminal
9. Siletsky, S. A., Pawate, A. S., Weiss, K., Gennis, R. B., and
oxidases: heme copper and bd type, Biochemistry (Moscow),
Konstantinov, A. A. (2004) Transmembrane charge separa
84, 1390 1402, doi: 10.1134/S0006297919110130.
tion during the ferryl oxo → oxidized transition in a non
4.
Wikstrom, M. (1977) Proton pump coupled to cyto
pumping mutant of cytochrome c oxidase., J. Biol. Chem.,
chrome c oxidase in mitochondria, Nature, 266, 271 273.
279, 52558 52565.
5.
Iwata, S., Ostermeier, C., Ludwig, B., and Michel, H.
10. Han, D., Namslauer, A., Pawate, A. S., Morgan, J. E.,
(1995) Structure at 2.8 Å resolution of cytochrome c oxi
Nagy, S., et al. (2006) Replacing Asn207 by aspartate at the
dase from Paracoccus denitrificans, Nature, 376, 660 669.
neck of the D channel in the aa3 type cytochrome c oxi
6.
Tsukihara, T., Aoyama, H., Yamashita, E., Takashi, T.,
dase from Rhodobacter sphaeroides results in decoupling
Yamaguichi, H., et al. (1996) The whole structure of the
the proton pump, Biochemistry, 45, 14064 14074.
13 subunit oxidized cytochrome c oxidase at
2.8
Å,
11. Siletsky, S. A., Zhu, J., Gennis, R. B., and Konstantinov,
Science, 272, 1136 1144.
A. A. (2010) Partial steps of charge translocation in the
7.
Svensson Ek, M., Abramson, J., Larsson, G.,
nonpumping N139L mutant of Rhodobacter sphaeroides
Tornroth, S., Brzezinski, P., and Iwata, S. (2002) The X
cytochrome c oxidase with a blocked D channel,
ray crystal structures of wild type and EQ(I 286) mutant
Biochemistry, 49, 3060 3073, doi: 10.1021/bi901719e.
cytochrome c oxidases from Rhodobacter sphaeroides.,
12. Proshlyakov, D. A., Pressler, M. A., DeMaso, C., Leykam,
J. Mol. Biol., 321, 329 339.
J. F., DeWitt, D. L., and Babcock, G. T. (2000) Oxygen
БИОХИМИЯ том 86 вып. 1 2021
ЭЛЕКТРОМЕТРИЧЕСКОЕ ИЗУЧЕНИЕ ВЛИЯНИЯ Zn2+ НА ЦИТОХРОМОКСИДАЗУ
143
activation and reduction in respiration: involvement of
29.
Nicholls, P., and Singh, A. P. (1988) Effect of zinc on pro
redox active tyrosine 244, Science, 290, 1588 1591.
teoliposomal cytochrome oxidase. Life Sci. Adv.
13.
Siletsky, S. A., and Konstantinov, A. A.
(2012)
(Biochemistry, Delhi), 7, 321 326.
Cytochrome c oxidase: charge translocation coupled to
30.
Vygodina, T. V., Zakirzyanova, W., and Konstantinov, A. A.
single electron partial steps of the catalytic cycle, Biochim.
(2008) Inhibition of membrane bound cytochrome c oxi
Biophys. Acta, 1817, 476 488, doi: 10.1016/j.bbabio.2011.
dase by zinc ions: High affinity Zn(2+) binding site at the
08.003.
P side of the membrane, FEBS Lett., 582, 4158 4162.
14.
Siletsky, S. A., Borisov, V. B., and Mamedov, M. D. (2017)
31.
Faxen, K., Salomonsson, L., Adelroth, P., and
Photosystem II and terminal respiratory oxidases: molecu
Brzezinski, P. (2006) Inhibition of proton pumping by zinc
lar machines operating in opposite directions, Front. Biosci.
ions during specific reaction steps in cytochrome c oxidase,
(Landmark Ed), 22, 1379 1426.
Biochim. Biophys. Acta, 1757, 388 394.
15.
Shirey, K., Stover, K. R., Cleary, J., Hoang, N., and
32.
Mitchell, D. M., and Gennis, R. B. (1995) Rapid purifica
Hosler, J. (2016) Membrane anchored cyclic peptides as
tion of wildtype and mutant cytochrome c oxidase from
effectors of mitochondrial oxidative phosphorylation,
Rhodobacter sphaeroides by Ni2+ NTA affinity chromatog
Biochemistry, 55, 2100 2111, doi: 10.1021/acs.biochem.
raphy, FEBS Lett., 368, 148 150.
5b01368.
33.
Siletsky, S., Kaulen, A. D., and Konstantinov, A. A. (1999)
16.
Frederickson, C. J., and Bush, A. I. (2001) Synaptically
Resolution of electrogenic steps coupled to conversion of
released zinc: physiological functions and pathological effects,
cytochrome c oxidase from the peroxy to the ferryl oxo
Biometals, 14, 353 366, doi: 10.1023/a:1012934207456.
state, Biochemistry, 38, 4853 4861.
17.
Fudge, D. H., Black, R., Son, L., LeJeune, K., and Qin, Y.
34.
Siletskiy, S., Soulimane, T., Azarkina, N., Vygodina, T. V.,
(2018) Optical recording of Zn(2+) dynamics in the mito
Buse, G., et al. (1999) Time resolved generation of mem
chondrial matrix and intermembrane space with the
brane potential by ba3 cytochrome c oxidase from Thermus
GZnP2 sensor, ACS Chem. Biol.,
13,
18971905,
thermophilus. Evidence for reduction induced opening of
doi: 10.1021/acschembio.8b00319.
the binuclear centre, FEBS Lett., 457, 98 102.
18.
Sheline, C. T., Behrens, M. M., and Choi, D. W. (2000)
35.
Azarkina, N., Siletsky, S., Borisov, V., von Wachenfeldt, C.,
Zinc induced cortical neuronal death: contribution of
Hederstedt, L., and Konstantinov, A. A. (1999) A
energy failure attributable to loss of NAD(+) and inhibi
cytochrome bb’ type quinol oxidase in Bacillus subtilis
tion of glycolysis, J. Neurosci., 20, 3139 3146.
strain 168, J. Biol. Chem., 274, 32810 32817.
19.
Gazaryan, I. G., Krasnikov, B. F., Ashby, G. A., Thorneley,
36.
Siletsky, S. A., Belevich, I., Wikstrom, M., Soulimane, T.,
R. N., Kristal, B. S., and Brown, A. M. (2002) Zinc is a
and Verkhovsky, M. I. (2009) Time resolved OH→EH tran
potent inhibitor of thiol oxidoreductase activity and stimu
sition of the aberrant ba3 oxidase from Thermus ther
lates reactive oxygen species production by lipoamide
mophilus, Biochim. Biophys. Acta, 1787, 201 205.
dehydrogenase, J. Biol. Chem.,
277,
1006410072,
37.
Siletsky, S. A., Belevich, I., Belevich, N. P., Soulimane, T.,
doi: 10.1074/jbc.M108264200.
and Verkhovsky, M. I. (2011) Time resolved single
20.
Sharpley, M. S., and Hirst, J. (2006) The inhibition of
turnover of caa3 oxidase from Thermus thermophilus. Fifth
mitochondrial complex I (NADH:ubiquinone oxidoreduc
electron of the fully reduced enzyme converts OH into EH
tase) by Zn2+, J. Biol. Chem.,
281,
3480334809,
state, Biochim. Biophys. Acta,
1807,
11621169,
doi: 10.1074/jbc.M607389200.
doi: 10.1016/j.bbabio.2011.05.006.
21.
Link, T. A., and von Jagow, G. (1995) Zinc ions inhibit the
38.
Siletsky, S. A., Zaspa, A. A., Poole, R. K., and Borisov,
QP center of bovine heart mitochondrial bc1 complex by
V. B. (2014) Microsecond time resolved absorption spec
blocking a protonatable group, J. Biol. Chem., 270, 25001
troscopy used to study CO compounds of cytochrome bd
25006, doi: 10.1074/jbc.270.42.25001.
from Escherichia coli, PLoS One,
9, e95617,
22.
Schulte, M., Mattay, D., Kriegel, S., Hellwig, P., and
doi: 10.1371/journal.pone.0095617.
Friedrich, T. (2014) Inhibition of Escherichia coli respira
39.
Siletsky, S. A., Rappaport, F., Poole, R. K., and Borisov,
tory complex I by Zn(2+), Biochemistry, 53, 6332 6339,
V. B. (2016) Evidence for fast electron transfer between the
doi: 10.1021/bi5009276.
high spin haems in cytochrome bd I from Escherichia coli,
23.
Mills, D. A., Schmidt, B., Hiser, C., Westley, E., and
PLoS One, 11, e0155186, doi: 10.1371/journal.pone.
Ferguson Miller, S. (2002) Membrane potential con
0155186.
trolled inhibition of cytochrome c oxidase by zinc, J. Biol.
40.
Drachev, L. A., Jasaitis, A. A., Kaulen, A. D., Kondrashin,
Chem., 277, 14894 14901.
A. A., Liberman, E. A., et al. (1974) Direct measurement
24.
Kuznetsova, S. S., Azarkina, N. V., Vygodina, T. V.,
of electric current generation by cytochrome oxidase, H+
Siletsky, S. A., and Konstantinov, A. A. (2005) Zink ions as
ATPase and bacteriorhodopsin, Nature, 249, 321 324.
cytochrome c oxidase inhibitors: two sites of action,
41.
Zaslavsky, D., Kaulen, A., Smirnova, I. A., Vygodina, T. V.,
Biochemistry (Moscow), 70, 128 136.
and Konstantinov, A. A. (1993) Flash induced membrane
25.
Lee, H. J., and Adelroth, P. (2013) The heme copper oxi
potential generation by cytochrome c oxidase, FEBS Lett.,
dase superfamily shares a Zn2+ binding motif at the
336, 389 393.
entrance to a proton pathway, FEBS Lett., 587, 770 774,
42.
Zaslavsky, D. L., Smirnova, I. A., Siletsky, S. A., Kaulen,
doi: 10.1016/j.febslet.2013.01.069.
A. D., Millett, F., and Konstantinov, A. A. (1995) Rapid
26.
Aagaard, A., and Brzezinski, P. (2001) Zinc ions inhibit
kinetics of membrane potential generation by
oxidation of cytochrome c oxidase by oxygen, FEBS Lett.,
cytochrome c oxidase with the photoactive Ru(II) tris
494, 157 160.
bipyridyl derivative of cytochrome c as electron donor,
27.
Francia, F., Giachini, L., Boscherini, F., Venturoli, G.,
FEBS Lett., 359, 27 30.
Capitanio, G., et al. (2007) The inhibitory binding site(s)
43.
Siletsky, S. A., Belevich, I., Jasaitis, A., Konstantinov,
of Zn2+ in cytochrome c oxidase, FEBS Lett., 581, 611 616.
A. A., Wikstrom, M., Soulimane, T., and Verkhovsky, M. I.
28.
Kannt, A., Ostermann, T., Muller, H., and Ruitenberg, M.
(2007) Time resolved single turnover of ba3 oxidase from
(2001) Zn2+ binding to the cytoplasmic side of Paracoccus
Thermus thermophilus, Biochim. Biophys. Acta, 1767, 1383
denitrificans cytochrome c oxidase selectively uncouples
1392, doi: 10.1016/j.bbabio.2007.09.010.
electron transfer and proton translocation, FEBS Lett.,
44.
Siletsky, S. A., Belevich, I., Soulimane, T., Verkhovsky,
503, 142 146.
M. I., and Wikstrom, M. (2013) The fifth electron in the
БИОХИМИЯ том 86 вып. 1 2021
144
СИЛЕЦКИЙ, ГЕННИС
fully reduced caa(3) from Thermus thermophilus is com
53. Sugitani, R., and Stuchebrukhov, A. A. (2009) Molecular
petent in proton pumping, Biochim. Biophys. Acta, 1827, 1
dynamics simulation of water in cytochrome c oxidase
9, doi: 10.1016/j.bbabio.2012.09.013.
reveals two water exit pathways and the mechanism of
45.
Kalaidzidis, Y. L., Gavrilov, A. V., Zaitsev, P. V., Korolev,
transport, Biochim. Biophys. Acta, 1787, 1140 1150.
E. V., and Kalaidzidis, A. L. (1997) PLUK an environ
54. Yoshikawa, S., Shinzawa Itoh, K., Nakashima, R.,
ment for software development, Progr. Comp. Soft., 23,
Yaono, R., Inoue, N., et al. (1998) Redox coupled crystal
206 211.
structural changes in bovine heart cytochrome c oxidase,
46.
Mamedov, M. D., Tyunyatkina, A. A., Siletsky, S. A., and
Science, 280, 1723 1729.
Semenov, A. Y. (2006) Voltage changes involving photosys
55. Mills, D. A., and Ferguson Miller, S. (2002) Influence of
tem II quinone iron complex turnover, Eur. Biophys. J., 35,
structure, pH and membrane potential on proton move
647 654.
ment in cytochrome oxidase, Biochim. Biophys. Acta, 1555,
47.
Siletsky, S. A., Mamedov, M. D., Lukashev, E. P., Balashov,
96 100.
S. P., Dolgikh, D. A., et al. (2016) Electrogenic steps of
56. Popovic, D. M., and Stuchebrukhov, A. A. (2005) Proton
light driven proton transport in ESR, a retinal protein from
exit channels in bovine cytochrome c oxidase, J. Phys.
Exiguobacterium sibiricum, Biochim. Biophys. Acta, 1857,
Chem. B, 109, 1999 2006, doi: 10.1021/jp0464371.
1741 1750, doi: 10.1016/j.bbabio.2016.08.004.
57. Muramoto, K., Hirata, K., Shinzawa Itoh, K., Yoko o, S.,
48.
Siletsky, S. A., Mamedov, M. D., Lukashev, E. P., Balashov,
Yamashita, E., et al. (2007) A histidine residue acting as a
S. P., Dolgikh, D. A., et al. (2019) Elimination of proton
controlling site for dioxygen reduction and proton pump
donor strongly affects directionality and efficiency of pro
ing by cytochrome c oxidase, Proc. Natl. Acad. Sci. USA,
ton transport in ESR, a light driven proton pump from
104, 7881 7886.
Exiguobacterium sibiricum, Biochim. Biophys. Acta
58. Qin, L., Mills, D. A., Hiser, C., Murphree, A. R.,
Bioenerg., 1860, 1 11, doi: 10.1016/j.bbabio.2018.09.365.
Garavito, M., et al. (2007) Crystallographic location and
49.
Siletsky, S. A., Belevich, I., Belevich, N. P., Soulimane, T.,
mutational analysis of Zn and Cd inhibitory sites and role
and Wikstrom, M. (2017) Time resolved generation of
of lipidic carboxylates in rescuing proton path mutants in
membrane potential by ba3 cytochrome c oxidase from
cytochrome c oxidase, Biochemistry, 46, 6239 6248.
Thermus thermophilus coupled to single electron injection
59. Klishin, S. S., Junge, W., and Mulkidjanian, A. Y. (2002)
into the O and OH states, Biochim. Biophys. Acta, 1858,
Flash induced turnover of the cytochrome bc1 complex in
915 926, doi: 10.1016/j.bbabio.2017.08.007.
chromatophores of Rhodobacter capsulatus: binding of
50.
Medvedev, D. M., Medvedev, E. S., Kotelnikov, A. I., and
Zn2+ decelerates likewise the oxidation of cytochrome b,
Stuchebrukhov, A. A. (2005) Analysis of the kinetics of the
the reduction of cytochrome c1 and the voltage generation,
membrane potential generated by cytochrome c oxidase
Biochim. Biophys. Acta, 1553, 177 182, doi: 10.1016/
upon single electron injection., Biochim. Biophys. Acta,
s0005 2728(01)00250 x.
1710, 47 56.
60. Mulkidjanian, A. Y. (2005) Ubiquinol oxidation in the
51.
Siletsky, S. A., Han, D., Brand, S., Morgan, J. E.,
cytochrome bc1 complex: reaction mechanism and preven
Fabian, M., et al. (2006) Single electron photoreduction of
tion of short circuiting, Biochim. Biophys. Acta, 1709, 5
the PM intermediate of cytochrome c oxidase, Biochim.
34, doi: 10.1016/j.bbabio.2005.03.009.
Biophys. Acta, 1757, 1122 1132, doi: 10.1016/j.bbabio.
61. Axelrod, H. L., Abresch, E. C., Paddock, M. L., Okamura,
2006.07.003.
M. Y., and Feher, G. (2000) Determination of the binding
52.
Vygodina, T. V., and Konstantinov, A. A. (1988) H2O2
sites of the proton transfer inhibitors Cd2+ and Zn2+ in bac
induced conversion of cytochrome c oxidase peroxy com
terial reaction centers, Proc. Natl. Acad. Sci. USA, 97,
plex to oxoferryl state, Ann. NY Acad. Sci., 550, 124 138.
1542 1547, doi: 10.1073/pnas.97.4.1542.
TIME RESOLVED ELECTROMETRIC STUDY OF F→O TRANSITION
IN CYTOCHROME c OXIDASE. THE EFFECT OF Zn2+ IONS
ON THE POSITIVE SIDE OF THE MEMBRANE
S. A. Siletsky1* and R. B. Gennis2
1 Belozersky Institute of Physico Chemical Biology, Moscow State University,
119991 Moscow, Russia; E mail: siletsky@belozersky.msu.ru
2 Department of Biochemistry, University of Illinois at Urbana Champaign, Urbana, Illinois 61801, USA
The effect of Zn2+ on the P side of proteoliposomes containing membrane incorporated Rhodobacter sphaeroides
cytochrome c oxidase was investigated by the time resolved electrometrics following a single electron injection into
the enzyme prepared in the F state. The wild type enzyme was examined along with the two mutants, N139D and
D132N. All obtained data indicate that the primary effect of Zn2+ added from the P side of the membrane is slowing
of the pumped proton release from the proton loading site (PLS) to the bulk aqueous phase on the P side of the mem
brane. The results strongly suggest the presence of two pathways by which the pumped proton can exit the protein
from the PLS and of two separate binding sites for Zn2+. A model is presented to explain the influence of Zn2+ on the
kinetics of membrane potential generation by the wild type COX, as well as by the N139D and D132N mutants.
Keywords: cytochrome c oxidase, zinc ions, proteoliposomes, electrogenic, proton pump, cytochrome aa3,
Rhodobacter sphaeroides
БИОХИМИЯ том 86 вып. 1 2021