БИОХИМИЯ, 2021, том 86, вып. 10, с. 1433 - 1448
УДК 577.214.43
ИЗМЕНЕНИЯ ЭКСПРЕССИИ ГЕНА АПОЛИПОПРОТЕИНА A I
В МАКРОФАГАХ ЧЕЛОВЕКА ПРИ ЗАХВАТЕ ИМИ ОКИСЛЕННЫХ
ЛИПОПРОТЕИНОВ НИЗКОЙ ПЛОТНОСТИ
© 2021
Е.В. Некрасова1, Е.Е. Ларионова1, К. Данько2, Д.О. Кузьмина2,
В.С. Шавва1, И.В. Кудрявцев1, С.В. Орлов1,2*
1 Институт экспериментальной медицины, 197376 Санкт!Петербург, Россия;
электронная почта: serge@iem.sp.ru
2 Санкт!Петербургский государственный университет, 199034 Санкт!Петербург, Россия;
электронная почта: s.orlov@spbu.ru
Поступила в редакцию 01.07.2021
После доработки 18.07.2021
Принята к публикации 23.07.2021
Аполипопротеин А I (ApoA I) является ключевым компонентом системы обратного транспорта
холестерина человека. В предыдущих исследованиях мы показали экспрессию гена apoA!I в моноцитах и
макрофагах человека на уровне мРНК и белка. В отличие от гепатоцитов и энтероцитов, где регуляция
экспрессии гена apoA!I изучена достаточно подробно, данных о регуляции эспрессии apoA!I в макрофагах
крайне мало. Ничего не известно о динамике экспрессии гена apoA!I в макрофагах при захвате
модифицированных липопротеинов низкой плотности (ЛПНП) - одном из ключевых процессов на
ранних стадиях атерогенеза, приводящего к образованию пенистых клеток. В данной работе мы
показываем сложный характер динамики экспрессии гена apoA!I в макрофагах человека при захвате
окисленных ЛПНП (oксЛПНП). В первые 24 ч инкубации макрофагов с оксЛПНП наблюдается индукция
экспрессии гена apoA!I на уровне мРНК и белка, тогда как через 48 ч экспрессия apoA!I оказывается
подавленной. Оба эффекта зависят от взаимодействия оксЛПНП c рецептором TLR4 и не связаны
непосредственно с захватом оксЛПНП макрофагами. Подавление экспрессии apoA!I после инкубации с
оксЛПНП в течение 48 ч зависит от активации MAP киназных каскадов ERK1/2 и JNK, а также фактора
транскрипции NF κB.
КЛЮЧЕВЫЕ СЛОВА: атеросклероз, оксЛПНП, макрофаги, THP 1, пенистые клетки, рецептор TLR4,
регуляция экспрессии генов, ген apoA!I.
DOI: 10.31857/S0320972521100031
ВВЕДЕНИЕ
теинов в интиме сосудов [1]. Аполипопроте
ин А I (ApoA I) является ключевым компонен
Атеросклероз представляет собой хроничес
том системы обратного транспорта холестерина
кое системное заболевание артерий эластичес
человека. Этот белок, будучи главным компо
кого и мышечно эластического типа, возника
нентом липопротеинов высокой плотнос
ющее вследствие нарушения липидного и бел
ти (ЛПВП), способствует выходу холестерина
кового обмена и сопровождающееся отложени
из тканей, поступлению его в печень для после
ем холестерина и некоторых фракций липопро
дующего окисления и выведения из организ
ма [2]. Помимо участия в обратном транспорте
Принятые сокращения: ApoA I - аполипопротеин
холестерина, ApoA I функционирует в качестве
A I; ЛПВП
- липопротеины высокой плотности;
кофактора лецитин холестеринацилтрансфера
ЛПНП - липопротеины низкой плотности; оксЛПНП - зы
[3], проявляет антиоксидантные свой
окисленные липопротеины низкой плотности; ЭПР -
ства [4], а также способен ограничивать воспа
эндоплазматический ретикулум; BSA
- бычий
сывороточный альбумин; FCS - эмбриональная телячья
лительные реакции. В частности, показана спо
сыворотка; LPS - липополисахарид; PBS - фосфатно
собность ApoA I блокировать активацию мак
солевой буфер; PMA - форбол 12 миристат 13 ацетат рофагов T лимфоцитами и ограничивать про
(используется в моделях канцерогенеза как активатор дукцию TNFα и интерлейкина 1β (IL 1β) [5-6].
дифференцирования и/или апоптоза); TBARS
-
ApoA I угнетает также другой провоспалитель
соединения, реагирующие с тиобарбитуровой кислотой;
THP 1
- клеточная линия острой моноцитарной
ный фактор - C реактивный белок [7]. С дру
лейкемии человека; TNFα - фактор некроза опухоли α.
гой стороны, ApoA I является негативным по
* Адресат для корреспонденции.
казателем острой фазы воспалительного отве
3
1433
1434
НЕКРАСОВА и др.
та - при развитии воспаления экспрессия ге
Таким образом, имеющиеся в литературе дан
на apoA!I в печени и тонком кишечнике резко
ные указывают на важную антиатерогенную
снижается, а циркулирующий в плазме крови
роль обнаруженной нами экспрессии гена
белок ApoA I вытесняется из ЛПВП сыворо
apoA!I в макрофагах.
точным амилоидом и разрушается сывороточ
Ген ароА!I имеет три промотора. Структура
ными протеазами [5]. К настоящему времени
классического промотора содержит TATA box,
также установлено, что главным транспортёром
находящийся в положении -39 п.н. от начала
холестерина к местам синтеза стероидных гор
транскрипции. Собственно промотор распола
монов в стероидогенные ткани и органы млеко
гается в положении от -41 до +1 по отношению
питающих (включая человека) являются
к месту начала транскрипции [17, 18]. Прокси
ЛПВП, а белок, контролирующий этот про
мальный альтернативный промотор имеет точку
цесс - ApoA I [8].
начала транскрипции в положении -153 п.н., а
Основными местами синтеза ApoA I у чело
дистальный альтернативный промотор - в по
века являются печень и тонкий кишечник [9].
ложении -353 п.н. по отношению к точке нача
В предыдущих исследованиях мы показали
ла транскрипции с классического промото
экспрессию гена apoA!I в моноцитах и макро
ра apoA!I [19]. Гепацитарный энхансер контро
фагах человека на уровне мРНК и белка, одна
лирует экспрессию гена apoA!I в печени. Он
ко вопрос о функциях ApoA I в этих клетках ос
имеет координаты (-222; -110) [17] и включает
таётся открытым [10-12]. Установлено, что эн
в себя три сайта: A (-214; -192), B (-169; -146)
догенный ApoA I макрофагов обладает анти
и C (-134; -119) [18]. В гепатоцитах сайты А и С
воспалительной активностью - блокирование
связывают репрессоры активности гена apoA!I
синтеза ApoA I методом РНК интерференции
LXRα, LXRβ [20], ARP1 [21], PPARγ [22] и акти
приводило к усилению синтеза и секре
ваторы экспрессии гена apoA!I HNF4α [23],
ции TNFα, повышению уровня экспрессии ре
RXRα [24], PPARα [25]. HNF3β (FOXA2) [26] и
цептора липополисахарида (LPS) TLR4 и уси
FOXO1 [27, 28] связываются с сайтом В.
лению воспалительного ответа макрофагов на
В отличие от гепатоцитов и энтероцитов, где
LPS [10]. Кроме того, в отличие от гепатоцитов,
регуляция экспрессии гена apoA!I изучена до
где секреция ApoA I приводит к формирова
статочно подробно, данных о регуляции экс
нию ЛПВП плазмы крови, в макрофагах секре
прессии apoA!I в макрофагах крайне мало.
тируемый ApoA I остаётся связанным с внеш
В макрофагах активен только классический
ней поверхностью цитоплазматической мемб
промотор гена apoA!I [10]. Ранее мы показали,
раны (поверхностный ApoA I макрофагов). Это
что TNFα и условия гипоксии вызывают индук
связывание в значительной степени обусловле
цию транскрипции гена apoA!I в макрофагах
но взаимодействием ApoA I с кассетным транс
как на уровне РНК, так и на уровне бел
портёром ABCA1. Более того, уровень ABCA1 в
ка [10-12]. Интересно, что по сравнению с ге
макрофагах сильно коррелирует с уровнем по
патоцитами в макрофагах наблюдалcя «зер
верхностного ApoA I, и блокирование синте
кальный» характер регуляции - позитивный в
за ApoA I приводит к снижению уровня
гепатоцитах регулятор транскрипции apoA!I,
ABCA1 [10]. Существенный интерес представ
PPARα, в макрофагах действует как репрессор,
ляют литературные данные об антиатерогенной
тогда как другие ядерные рецепторы (LXRα
роли экспрессии гена apoA!I человека после его
и LXRβ), угнетающие транскрипцию гена apoA!I
переноса в макрофаги мыши с помощью вирус
в гепатоцитах, в макрофагах активируют экс
ных векторов. В экспериментах на нокаутных
прессию apoA!I [11].
по гену apoA!I (apoA!I-/-) мышах было показа
Повышенная концентрация липопротеинов
но, что доставка в макрофаги вектора экспрес
низкой плотности (ЛПНП) и связанного с ни
сии гена apoA!I человека уменьшает развитие
ми холестерина в плазме крови является одним
жировых полосок на стенках артерий и увели
из основных факторов риска развития ишеми
чивает обратный транспорт холестерина из
ческой болезни сердца - клинического прояв
макрофагов в печень [13]. Доставка apoA!I-/-
ления атеросклероза [29]. Попадая в интиму ар
мышам клеток костного мозга, дефицитных по
терий, ЛПНП задерживаются там благодаря
гену apoE (apoE-/-) и инфицированных ретро
взаимодействию с отрицательно заряженными
вирусным вектором экспрессии гена apoA!I че
компонентами внеклеточного матрикса (гепа
ловека, приводила к значительному уменьше
рансульфатами) и подвергаются окислению под
нию площади атеросклеротических поражений
действием свободных радикалов, ферментов
аорты [14-15]. Аналогичные данные получены
миелопероксидаз и липоксигеназ, что приводит
при доставке лентивирусных векторов экспрес
к образованию окисленных форм ЛПНП
сии apoA!I человека в макрофаги мышей [16].
(оксЛПНП) [30]. Появление в интиме оксЛПНП
БИОХИМИЯ том 86 вып. 10 2021
оксЛПНП РЕГУЛИРУЮТ apoA!I В МАКРОФАГАХ ЧЕЛОВЕКА
1435
активирует эндотелий [31], что ведёт к усиле
лекции клеточных культур позвоночных Ин
нию миграции в интиму моноцитов, где они
ститута цитологии РАН. Клетки культивирова
дифференцируются в макрофаги и активно за
ли в атмосфере 5% СO2 при 37 °С в среде RPMI
хватывают оксЛПНП с помощью скевенджер
1640 («Биолот», Россия), содержащей 10% те
рецепторов, таких как SR A, CD36, SR B1,
лячьей эмбриональной сыворотки (FCS,
LOX1 и др. Неконтролируемый захват оксЛПНП
«HyClone Laboratories», США). Дифференци
макрофагами приводит к накоплению в клетках
ровку моноцитов THP 1 в макрофаги индуци
липидных вакуолей (расширений эндоплазма
ровали, добавляя в культуральную среду фор
тического ретикулума (ЭПР)), содержащих
бол 12 миристат 13 ацетат (PMA) до концен
эфиры холестерина, и превращению макрофа
трации 50 нг/мл (81 нM) на 24 ч. Затем клетки
гов в пенистые клетки - основной клеточный
отмывали от PMA, меняли среду на свежую
элемент атеросклеротических бляшек [32, 33].
RPMI 1640, содержащую 10% FCS, и продол
Помимо захвата макрофагами, оксЛПНП обла
жали дифференцировку в течение 48 ч. Таким
дают и сигнальными функциями. В литературе
образом, общее время дифференцировки мак
имеются противоречивые данные о способнос
рофагов ТHР 1 составляло трое суток для экс
ти оксЛПНП запускать сигнальные каскады в
периментов по инкубации с оксЛПНП в тече
моноцитах и макрофагах. Ряд исследователей
ние 24 ч и четверо суток - для экспериментов
утверждает, что оксЛПНП взаимодействуют с
по инкубации с оксЛПНП в течение 48 ч.
комплексом рецепторов CD36-TLR2-TLR4
Консервированную донорскую кровь непри
[34], или CD36-TLR6-TLR4 [35], или TLR4-
годную для переливания закупали на станции
DC-SIGN [36], и это взаимодействие приводит
переливания крови в охлаждённом виде (Санкт
к запуску воспалительного ответа в макрофагах
Петербург, Россия). Доноры подписывали ин
и к усилению захвата макрофагами оксЛПНП.
формированное добровольное согласие. Для по
С другой стороны, существуют данные, соглас
лучения первичных макрофагов производили
но которым провоспалительная активность
выделение мононуклеаров из крови человека с
оксЛПНП объясняется примесями эндотокси
помощью центрифугирования в градиенте плот
на, тогда как свободные от эндотоксина
ности фиколла, как описано ранее [39]. Для это
оксЛПНП, наоборот, угнетают синтез провос
го в пробирки (50 мл) наливали 15 мл раствора
палительных цитокинов макрофагами [37, 38].
фиколла плотностью 1,077 («Биолот»), сверху
Ничего не известно о регуляции гена apoA!I
наслаивали 35 мл крови и центрифугировали
в макрофагах при захвате оксЛПНП - одном из
(30 мин, 2000 об./мин., 18 °С), используя цент
ключевых процессов на ранних стадиях атеро
рифугу Z400K («Hermle Labortechnik», Герма
генеза, приводящих к образованию пенистых
ния). Далее на границе фаз отбирали слой, со
клеток. В данной работе мы показываем слож
держащий мононуклеарные клетки, и дважды
ный характер динамики экспрессии гена apoA!I
отмывали раствором Хенкса. Осадок ресуспен
в макрофагах человека при захвате окисленных
дировали в культуральной среде RPMI 1640,
ЛПНП. В первые 24 ч инкубации макрофагов
содержащей 10% FCS, разливали по лункам
THP 1 (клеточная линия острой моноцитарной
планшетов (по 100 тыс. клеток в лунку 96 лу
лейкемии человека) с оксЛПНП наблюдается
ночного планшета) и инкубировали при 37 °С в
индукция экспрессии гена apoA!I на уровне
атмосфере 5% CO2 в течение 2 ч для адгезии мо
мРНК и белка, тогда как через 48 ч экспрессия
ноцитов. Далее проводили отмывку моноцитов
apoA!I оказывается подавленной. Оба эффекта
от не прикрепившихся к субстрату клеток (лим
зависят от взаимодействия оксЛПНП c рецеп
фоциты) в растворе Хенкса, к отмытым моно
тором TLR4 и не связаны непосредственно с
цитам добавляли свежую культуральную сре
захватом оксЛПНП макрофагами. Подавление
ду RPMI 1640, содержащую 10% FCS, и прово
экспрессии apoA!I после инкубации с
дили дифференцировку моноцитов в макрофа
оксЛПНП в течение 48 ч зависит от активации
ги при 37 °С в атмосфере 5% CO2 в течение 5 (в
MAP киназных каскадов ERK1/2 и JNK, но
экспериментах по инкубации с оксЛПНП в те
не p38, а также фактора транскрипции NF κB.
чение 24 ч) или 6 (в экспериментах по инкуба
ции с оксЛПНП в течение 48 ч) суток.
Антитела, ингибиторы. Для детекции поверх
МАТЕРИАЛЫ И МЕТОДЫ
ностного белка АроА I использовали мышиные
моноклональные антитела против АроА I чело
Клеточные культуры и макрофаги, дифферен
века («Bio Rad», США) и вторичные кроличьи
цированные из моноцитов периферической крови
антитела F(ab′)2 против IgG мыши, меченые
человека. Клеточная линия острой моноцитар
флуорофором Alexa 647 («Abcam», Великобри
ной лейкемии человека THP 1 получена из кол
тания). Блокирование рецептора TLR4 прово
БИОХИМИЯ том 86 вып. 10 2021
3*
1436
НЕКРАСОВА и др.
дили с помощью козьих поликлональных анти
кости измеряли при длине волны 532 нм. Ка
тел против TLR4 человека («R&D Systems»,
либровочную кривую строили с использовани
США). В работе использованы ингибиторы ос
ем малональдегида бис(диметил ацеталя) в ка
новных MAP киназных каскадов и NF κB
честве источника малонового альдегида, как
(«Biomol», Германия): U0126, ингибитор
описано в работе Esterbauer и Cheeseman [43].
MEK1/2; SB203580, ингибитор киназ p38;
Для использованных в работе препаратов
SP600125, ингибитор киназ JNK; QNZ, ингиби
оксЛПНП значения TBARS находились в диа
тор фактора транскрипции NF κB и TO901317,
пазоне 30-45 нмоль/мг белка (TBARS для на
синтетический агонист ядерных рецепторов
тивных ЛПНП составлял 7-15 нмоль/мг белка).
LXRα и LXRβ.
Флуоресцентное мечение ЛПНП проводили до
Выделение, окисление и флуоресцентное ме
окисления с помощью тетрафторфенилового
чение ЛПНП. Человеческие ЛПНП выделяли
эфира фотостабильного гидрофильного краси
из плазмы, полученной из консервированной
теля Alexa 488 («Thermo Fisher Scientific», США)
донорской крови. Для исключения возможной
в соответствии с инструкциями фирмы произ
контаминации клеток экзогенным человечес
водителя.
ким ApoA I в работе также использовали
Для исключения эффектов возможной бак
ЛПНП, выделенные из сыворотки крови круп
териальной контаминации использованных
ного рогатого скота. Выделение проводили с
препаратов оксЛПНП во всех экспериментах c
помощью последовательного препаративного
оксЛПНП к клеткам добавляли полимик
ультрацентрифугирования, как описано ра
син B («Sigma», США) - агент, связывающий и
нее
[40]. Использовали ультрацентрифугу
инактивирующий бактериальный LPS.
Beckman Coulter Optima LE80K
(«Beckman
Контроль формирования пенистых клеток.
Coulter», США). К человеческой плазме либо к
Макрофаги THP 1 трижды промывали PBS, фик
сыворотке крови крупного рогатого скота («Био
сировали в растворе 4% ного формальдегида на
лот») добавлялся NaBr до плотности 1,019.
PBS в течение 10 мин, промывали 60% ным
Плазму либо сыворотку центрифугировали 18 ч
изопропанолом, окрашивали 10 мин в 3% ном
при температуре 12 °С в роторе 50.3 Ti при
растворе Oil Red O («Sigma»), приготовленном
40 000 об./мин, после чего верхнюю фазу, состо
на 60% ном изопропаноле. После отмывки
ящую из липопротеинов очень низкой плотнос
60% ным изопропанолом клетки дополнитель
ти, удаляли. Плотность доводили до 1,064 до
но окрашивали гематоксилином в течение
бавлением NaBr. Образец центрифугировали
2 мин. Далее клетки трижды отмывали в PBS и
22 ч при тех же условиях, после чего верхнюю
оценивали число липидных вакуолей в клетках
фазу, состоящую из ЛПНП, изолировали. По
на микроскопе Zeiss Axiovert 40CFL («Zeiss»,
лученные ЛПНП диализовали против фосфат
Германия).
но солевого буфера (PBS, pH 7,6) 24 ч при 4 °С.
Выделение РНК, обратная транскрипция и
Концентрацию белка измеряли по методу Лоу
ПЦР в реальном времени. Тотальную РНК из
ри [40]. Окисление ЛПНП проводили, как опи
культивируемых клеток выделяли с использова
сано в работе Jialal и Chait [41]. К раствору
нием реагента RNA STAT 60 («Tel Test», США)
ЛПНП в PBS добавляли раствор CuSO4 до ко
в соответствии с инструкциями изготовителя.
нечной концентрации 5 мкМ и инкубировали в
Остатки геномной ДНК удаляли обработкой
условиях доступа кислорода воздуха при 37 °С в
ДНКазой I, свободной от РНКаз
(«Roche
течение 18 ч. Далее последовательно проводили
Applied Science», Швейцария) в течение 30 мин
два диализа против PBS по 24 ч при 4 °С. При
при 37 °С. Реакцию останавливали добавлением
втором диализе для удаления остаточных сле
ЭДТА до конечной концентрации 2 мМ с по
дов ионов меди к PBS добавляли хелатирующий
следующей инактивацией ДНКазы I прогрева
агент ЭДТА до концентрации 0,5 мМ. Степень
нием при 70 °С в течение 15 мин. Концентра
окисления ЛПНП определяли методом измере
цию и чистоту РНК определяли с помощью
ния концентраций соединений, реагирующих с
планшетного спектрофотометра Synergy
2
тиобарбитуровой кислотой (TBARS)
[42].
(«BioTek», США). Отношение поглощения при
Образцы
(100
мкл, концентрация белка
длинах волн 260 и 280 нм было выше 2, и отно
2-4 мг/мл) инкубировали с 0,5 мл 20% ной ук
шение поглощения при 260 и 230 нм было вы
сусной кислоты, pH 3,5 и 0,5 мл 0,78% ного
ше 1,7. Отсутствие деградации РНК проверяли
водного раствора тиобарбитуровой кислоты.
электрофорезом в 1% ном агарозном геле по
После нагревания при 95 °С в течение 45 мин
сохранению целостности рибосомных РНК.
образцы центрифугировали
(4000
об./мин,
Для проведения реакции обратной транскрип
5 мин («Eppendorf», США)). Поглощение полу
ции брали равное количество РНК для всех то
ченного красного пигмента надосадочной жид
чек. Реакцию обратной транскрипции (c 1 мкг
БИОХИМИЯ том 86 вып. 10 2021
оксЛПНП РЕГУЛИРУЮТ apoA!I В МАКРОФАГАХ ЧЕЛОВЕКА
1437
тотальной РНК) проводили с использованием
нов мыши, конъюгированными с пероксидазой
праймеров oligo dT и специфических 3′ прай
хрена, в течение 1 ч при комнатной температу
меров к генам apoA!I, ABCA1 и GRP78. Для про
ре. Иммунореактивные полосы выявляли с по
ведения реакции использовались реактивы
мощью усиленной хемолюминесценции (ECL)
компании «Promega», США.
на Chemidoc XRS+ System («Bio Rad»). Оциф
ПЦР в реальном времени (qRT PCR) прово
ровку полученных изображений проводили с
дили по технологии Taqman или по интеркаля
помощью денситометрии в программе ImageJ
ции SYBR Green с использованием амплифика
тора CFX 96 («Bio Rad»). Компоненты реакци
Проточная цитофлуорометрия. Клетки фик
онной смеси были приобретены у компании
сировали в 4% ном формальдегиде в течение
«Синтол», Россия. Праймеры и флуоресцент
10 мин при 22 °С, отмывали 3 раза PBS, содер
ные пробы для apoA!I, ABCA1 и референсных ге
жащим 0,1 M глицина, и инкубировали 40 мин
нов, кодирущих белки RPLP0, циклофилин A и
при 22 °C в блокирующем буфере (PBS, содержа
β актин, были описаны ранее [44, 10, 22, 28].
щий 1% BSA, 3% FCS, неспецифические чело
Для детекции мРНК гена GRP78 использовали
веческие IgG (1 мкг/мл) и 0,02% (v/v) Tween 20).
следующие праймеры и зонд: прямой прай
Клетки инкубировали с мышиными монокло
мер - 5′ GTTCTTGCCGTTCAAGGTG 3′; об
нальными антителами против человеческого
ратный праймер - 5′ TTTCCCAAATAAGCCT
ApoA I (разведение 1/250) в PBS, содержащем
CA GC 3′; зонд - 5′ Cy5.5 TGCTCCTGAAG
1% BSA и 0,02% (v/v) Tween 20, в течение 2 ч при
AAATTTCTGCCATGG RTQ2 3′. Подбор прай
22 °C, отмывали 3 раза PBS и инкубировали со
меров и зонда проводили с помощью програм
вторичными кроличьими антителами F(ab′)2
против IgG мыши, мечеными флуорофором
ные уровни мРНК гена apoA!I оценивали путём
Alexa 647 (разведение 1/1000) в PBS, содержа
детекции референсных генов в той же реак
щем 1% BSA и 0,02% (v/v) Tween 20, в течение
ции (multiplex PCR). Нормализацию результа
1 ч при 22 °C. Затем клетки отмывали 3 раза в PBS
тов проводили по геометрическому среднему из
и фиксировали в PBS, содержащем 1% фор
трёх референсных генов, как описано ра
мальдегид, для проточной цитофлуорометрии.
нее [45]. Число циклов PCR для каждого гена,
Клетки, обработанные вторичными антитела
при котором уровень флуоресценции превышал
ми, но не инкубированные с антителами против
в 10 раз значения стандартного отклонения
ApoA I, использовали в качестве контроля спе
флуктуаций в фоновой флуоресценции, опреде
цифичности иммунной окраски (изотип конт
ляли с помощью CFX 96 RealTime PCR
роль). Проточная цитофлуорометрия и клеточ
System («Bio Rad»). Относительные значения
ный сортинг были проведены, используя Epics
уровня мРНК apoA!I (в процентах относитель
Altra flow cytofluorimeter («Beckman Coulter») и
но контрольного образца) определяли по фор
муле:
projects/fcsalyzer/).
Статистическая обработка. Результаты
2(Ct(control)- Ct(опыт))*100.
представлены как среднее ± стандартная ошиб
ка среднего. Нормальность распределения про
Вестерн блоттинг. Клетки лизировали в бу
веряли с помощью критерия Шапиро-Уилка.
фере RIPA 50 (50 мМ Tris HCl, 150 мМ NaCl,
Статистический анализ различий между срав
1% NP 40, 1 мМ Na2ЭДТА, 0,1% SDS, 0,01%
ниваемыми группами выполняли с использова
NaN3, 1 мМ PMSF, pH 7,4). Белки разделяли
нием t критерия Стьюдента (непарный t тест).
диск электрофорезом в 12% ном денатурирую
Множественные сравнения проводили с по
щем полиакриламидном геле, переносили с по
мощью критерия Даннета. Различия считались
мощью электроблоттинга на нитроцеллюлозную
статистически значимыми при p < 0,05. Статис
мембрану Hybond C c размером пор 0,45 мкм
тическая обработка данных проводилась с по
(«Amersham», Великобритания). После перено
мощью программы Microsoft Excel.
са мембрану блокировали в 5% ном обезжирен
ном молоке, приготовленном на PBS с добавле
нием 0,02% (v/v) Tween 20 в течение 1 ч при
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
комнатной температуре. Далее мембрану инку
бировали с мышиными моноклональными ан
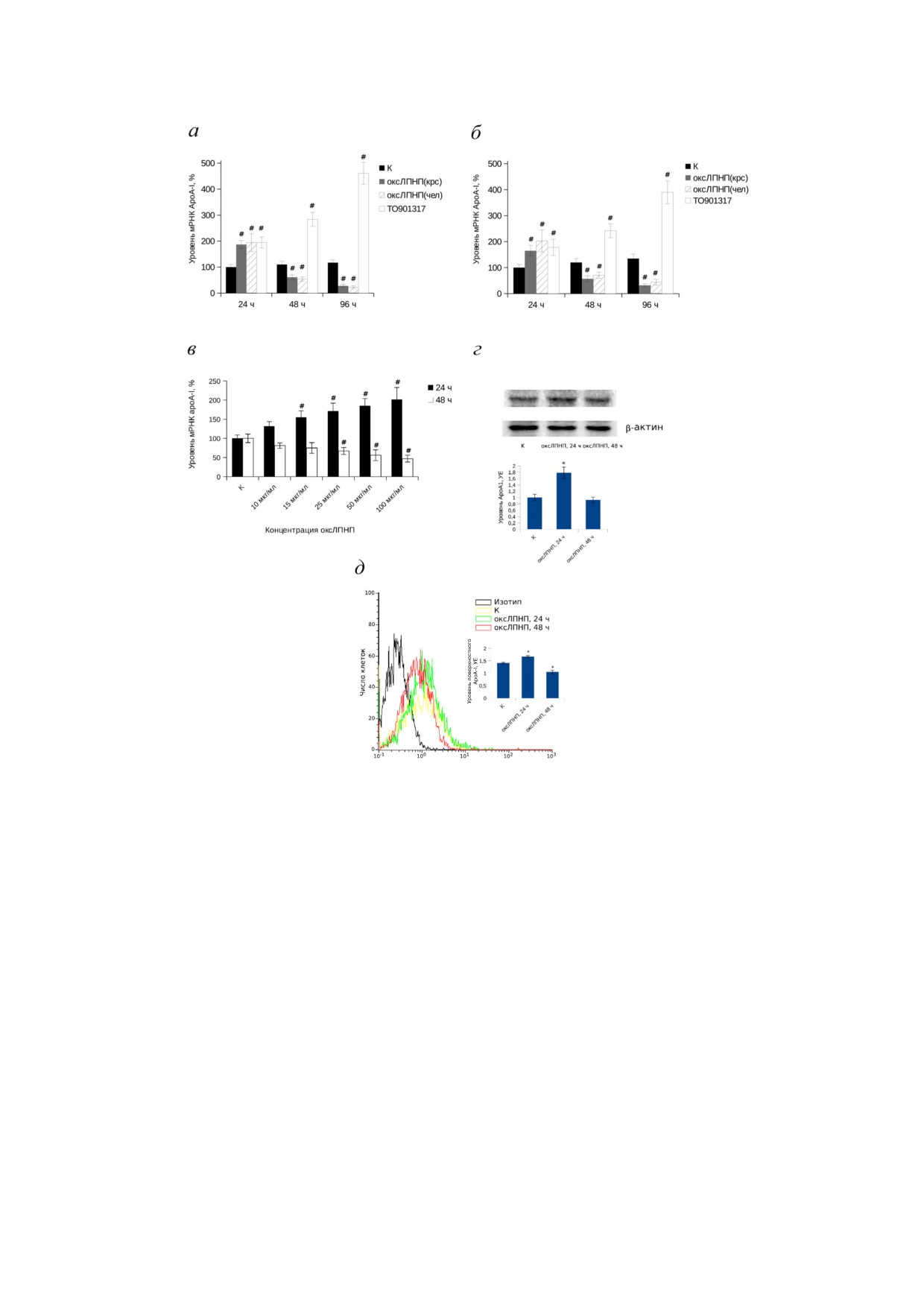
Инкубация макрофагов с оксЛПНП стимули
тителами против ApoA I человека в течение 12 ч
рует экспрессию гена apoA I через 24 ч и подавля
при 4 °С, трижды отмывали в PBS с добавлени
ет через 48 и 72 ч. Центральным процессом при
ем 0,02% (v/v) Tween 20, инкубировали со вто
образовании атеросклеротической бляшки яв
ричными антителами против иммуноглобули
ляется усиленный захват макрофагами модифи
БИОХИМИЯ том 86 вып. 10 2021
1438
НЕКРАСОВА и др.
цированных ЛПНП, сопровождающийся обра
сравнимая с индукцией, вызванной лиганда
зованием так называемых пенистых клеток [1,
ми LXR, уже через 48 ч инкубации с оксЛПНП
32, 33]. Представлялось интересным исследо
происходит подавление синтеза мРНК ApoA I.
вать изменение динамики экспрессии гена
Через 96 ч инкубации репрессорный эффект
apoA!I при формировании пенистых клеток.
усиливается. При этом действие агониста LXR
Образование пенистых клеток в результате за
прогрессивно нарастает в течение всего време
хвата оксЛПНП макрофагами THP 1 контроли
ни инкубации.
ровали окраской клеток липидофильным кра
Препараты оксЛПНП, полученные из плаз
сителем Oil Red O и гематоксилином (рис. 1).
мы крови человека, могут содержать примеси
Инкубация макрофагов с оксЛПНП (50 мкг/мл)
экзогенного ApoA I человека. Учитывая отно
в течение 24 и 48 ч приводила к последователь
сительный низкий уровень синтеза ApoA I в
ному накоплению в цитоплазме липидных ва
макрофагах, примеси экзогенного ApoA I могут
куолей, характерных для пенистых клеток.
серьёзно исказить результаты анализа уровня
Вместе с тем использованные концентрации
белка ApoA I при инкубации макрофагов с
оксЛПНП и сроки инкубации не приводили к
оксЛПНП. Для предотвращения подобной кон
окончательному заполнению цитоплазмы мак
таминации можно использовать препараты
рофагов липидными вакуолями и к некротичес
ЛПНП, выделенные из сыворотки крупного ро
кому распаду, характерному для поздних стадий
гатого скота [10]. С другой стороны, нельзя ис
формирования пенистых клеток (рис. 1).
ключить видоспецифическое действие оксЛПНП
оксЛПНП являются источником окислен
на макрофаги. Для проверки возможных видо
ных форм холестерина, природных лигандов
специфических эффектов оксЛПНП были по
ядерных рецепторов LXR. В предыдущих иссле
ставлены параллельные эксперименты по инку
дованиях мы показали, что активация рецепто
бации макрофагов THP 1 и макрофагов, диф
ров LXR в моноцитах и макрофагах сопровож
ференцированных из моноцитов периферичес
дается усилением экспрессии гена apoA!I. Учи
кой крови человека, с человеческими оксЛПНП
тывая вышесказанное, ожидалось, что захват
и оксЛПНП крупного рогатого скота (рис. 2,
макрофагами оксЛПНП будет сопровождаться
а и б). Существенных отличий в действии
активацией экспрессии apoA!I за счёт накопле
оксЛПНП человека и оксЛПНП крупного рога
ния в клетке лигандов LXR. Для проверки дан
того скота на уровень мРНК ApoA I не выявле
ного предположения макрофаги линии THP 1
но на всех сроках инкубации. Дальнейшие экс
(рис. 2, а) или первичные макрофаги, диффе
перименты проводили с оксЛПНП крупного
ренцированные из моноцитов периферической
рогатого скота. На рис. 2, в представлены дан
крови человека (рис. 2, б), инкубировали с
ные экспериментов по изучению дозозависи
оксЛПНП (50 мкг/мл) в течение 24, 48 и 96 ч.
мости эффектов оксЛПНП на уровень мРНК
Для сравнения клетки в течение тех же сроков
ApoA I. Установлено, что стимулирующее
инкубировали с синтетическим агонистом ре
действие оксЛПНП начинается с концентра
цепторов LXR. Методом qRT PCR установле
ции 15 мкг/мл, а угнетающее - с 25 мкг/мл с
но, что хотя через 24 ч инкубации с оксЛПНП
последующим дозозависимым нарастанием
наблюдается индукция экспрессии гена apoA!I
обоих эффектов. Стимуляция экспрессии ге
Рис. 1. Формирование пенистых клеток при инкубации макрофагов THP 1 с оксЛПНП в течение 24 и 48 ч. После инку
бации с оксЛПНП человека (50 мкг/мл) макрофаги THP 1 окрашивали Oil Red O и гематоксилином, как описано в «Ма
териалах и Методах», и выявляли липидные вакуоли световой микроскопией (окрашены красным). BSA - контрольные
клетки, инкубированные с бычьим сывороточным альбумином (50 мкг/мл)
БИОХИМИЯ том 86 вып. 10 2021
оксЛПНП РЕГУЛИРУЮТ apoA!I В МАКРОФАГАХ ЧЕЛОВЕКА
1439
ApoA I
ApoA I
Рис. 2. Зависимость уровня экспрессии apoA!I в макрофагах THP 1 (a, в-д) или в первичных макрофагах, дифференци
рованных из моноцитов периферической крови человека (б), от времени инкубации макрофагов с оксЛПНП
(50 мкг/мл): a, в-д - клетки THP 1 дифференцировали индукцией PMA как описано в разделе «Материалы и Методы»,
далее добавляли оксЛПНП, выделенные из плазмы крови человека (оксЛПНП(чел)), либо оксЛПНП, выделенные из
сыворотки крови крупного рогатого скота (оксЛПНП(крс)), до концентрации
50
мкг/мл, либо агонист
LXR (TO901317) (5 мкM) и инкубировали указанное время; б - моноциты, выделенные из периферической крови здо
ровых доноров, дифференцировали 4 дня, далее добавляли оксЛПНП, выделенные из плазмы крови человека
(оксЛПНП(чел)), либо оксЛПНП, выделенные из сыворотки крови крупного рогатого скота (оксЛПНП(крс)), до кон
центрации 50 мкг/мл, либо агонист LXR (TO901317) (5 мкM) и инкубировали указанное время. в - Зависимость
действия оксЛПНП на уровень мРНК ApoA I при инкубации в течение 24 и 48 ч от концентрации оксЛПНП. а-в - Из
клеток выделяли РНК и проводили определение уровня мРНК AроА I методом qRT PCR. Выравнивание образцов про
водили по трём референсным генам (циклофилин А, β!актин и rplp0). Представлены результаты среднего значения из трёх
независимых экспериментов, планки погрешности соответствуют стандартной ошибке среднего. Статистическая досто
верность различий опытных групп с контрольными проверялась с использованием t критерия Стьюдента, # соответ
ствуют p < 0,05. г - Анализ уровня клеточного ApoA I в макрофагах THP 1 после инкубации с оксЛПНП (50 мкг/мл) в
течение 24 или 48 ч методом Вестерн блота. Диаграмма содержит данные, полученные в ходе оцифровки трёх иммуно
блотов с помощью денситометрии. Значения по оси Y соответствуют относительному уровню белка ApoA I (1 условная
единица (УЕ) в необработанных клетках). Проведена нормализация значений по уровню β актина. д - Результаты про
точной цитофлуорометрии. К макрофагам THP 1 добавляли оксЛПНП до концентрации 50 мкг/мл и инкубировали 24
или 48 ч. Клетки фиксировали и обрабатывали антителами против ApoA I человека. В качестве вторичных антител ис
пользовали антимышиные антитела (Fab’)2, меченые Alexa 647. Изотип контроль представлен клетками, обработанны
ми только вторичными флуоресцентно меченными антителами. В контрольные образцы, не содержащие оксЛПНП, до
бавляли BSA в концентрации 50 мкг/мл. На диаграмме представлены средние значения (X mean) интенсивности флуо
ресценции, планки погрешностей соответствуют стандартной ошибке среднего. Достоверность различий проверяли с
использованием t критерия Стьюдента, * соответствует p < 0,05
БИОХИМИЯ том 86 вып. 10 2021
1440
НЕКРАСОВА и др.
на apoA!I через 24 ч после инкубации макрофа
таболизма оксЛПНП, часть из которых могут
гов THP 1 с оксЛПНП сопровождается также
выполнять функции лигандов ядерных рецеп
повышением в клетках уровня белка ApoA I
торов, способных связываться с 5′ регулятор
(рис. 2, г). Интересно, что через 48 ч инкубации
ной областью гена apoA!I и регулировать его
с оксЛПНП, в отличие от мРНК ApoA I, чьё
экспрессию, таких как PPARα, PPARγ, LXRα,
количество падает относительно контрольного,
LXRβ. Если гипотезу о роли LXR в оксЛПНП
уровень клеточного ApoA I возвращается к зна
опосредованном подавлении синтеза ApoA I
чению, характерному для нестимулированных
можно отвергнуть на основании данных, пред
клеток (рис. 2, г). В предыдущих исследовани
ставленных на рис. 2, то вопрос об участии дру
ях, посвящённых выяснению функций ApoA I
гих ядерных рецепторов остается открытым. В
в макрофагах, было установлено, что сущест
третьих, оксЛПНП могут выполнять сигналь
венную роль играет не столько общее содержа
ные функции. В литературе имеются данные о
ние ApoA I в клетках, сколько уровень поверх
способности оксЛПНП взаимодействовать с
ностного ApoA I, связанного с наружной пове
рецептором TLR4, что приводит к активации в
рхностью плазматической мембраны
[10].
клетке ряда воспалительных сигнальных каска
В связи с этим представлялось интересным оце
дов [48]. Кроме того, интернализация оксЛПНП
нить влияние оксЛПНП на поверхностный
такими скевенджер рецепторами, как CD36 и
ApoA I. Результаты представлены на рис. 2, д.
LOX1, также сопровождается инициацией ряда
Установлено, что после инкубации макрофа
сигнальных каскадов в макрофагах [49, 50]. Для
гов THP 1 c оксЛПНП в течение 24 ч наблюда
проверки участия второго механизма в подавле
ется повышение уровня поверхностного ApoA I.
нии синтеза ApoA I при продолжительной ин
Через 48 ч инкубации уровень поверхностного
кубации оксЛПНП с макрофагами мы провели
ApoA I падает ниже значений, характерных для
сортировку макрофагов THP 1 методом про
нестимулированных клеток. Полученные ре
точной цитофлуорометрии после 48 ч инкуба
зультаты указывают на то, что, хотя на ранних
ции с флуоресцентно меченными оксЛПНП.
стадиях образования пенистых клеток
В данных условиях эксперимента только
оксЛПНП действительно стимулируют экспрес
~65% макрофагов приобретают фенотип пенис
сию apoA!I, возможно, через накопление в клет
тых клеток (рис. 3, б). Из макрофагов ЛПНП+ и
ках лигандов LXR, уже на вторые сутки после на
ЛПНП- выделяли РНК, и методом qRT PCR
чала эксперимента происходит обращение эф
оценивали уровень мРНК гена apoA!I в сравне
фекта.
нии с клетками, не инкубировавшимися с
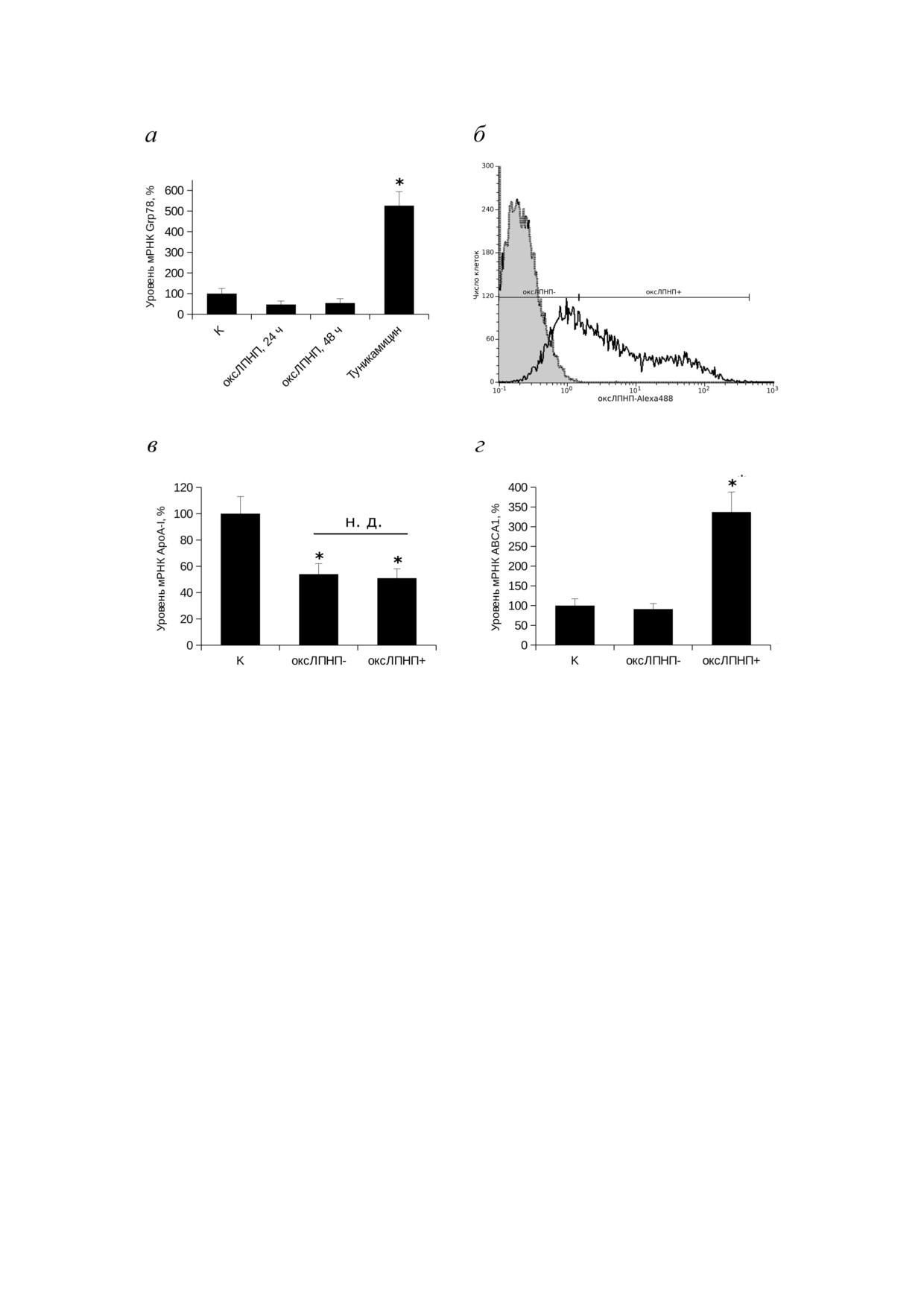
Подавление эспрессии гена apoA I при дли
оксЛПНП (рис. 3, в). Контроль эффективности
тельной инкубации макрофагов с оксЛПНП не
сортировки проводили, оценивая уровень
связано с развитием стресса ЭПР или накоплени
экспрессии гена ABCA1 (рис. 3, г), для которого
ем в клетках липидов. Подавление экспрессии
известна положительная связь уровня тран
гена apoA!I может быть обусловлено тремя ме
скрипции с захватом оксЛПНП [51]. Установ
ханизмами. Во первых, формирование пенис
лено, что уровень мРНК ABCA1 в клет
тых клеток может быть сопряжено с развитием
ках ЛПНП- не отличался от контрольного
стресса эндоплазматического ретикулума [46,
уровня. Вместе с тем в клетках ЛПНП+, в соот
47] и приводить к репрессии генов секреторных
ветствии с литературными данными, наблюда
белков, содержащих сигнальные пептиды и
лась существенная индукция синтеза мРНК
транслирующихся в просвет ЭПР. Развитие
ABCA1. Полученные результаты подтверждают
стресса ЭПР в макрофагах после инкубации в
эффективность выбранного методического
течение 48 ч с оксЛПНП оценивали, измеряя
подхода. В тех же условиях эксперимента уро
уровень экспрессии гена GRP78 - одного из ша
вень мРНК ApoA I был одинаков в клет
перонов ЭПР, чья экспрессия резко возрастает
ках ЛПНП- и ЛПНП+ и составлял ~50% от
при стрессе ЭПР. В качестве положительного
контрольного уровня. Следовательно, подавле
контроля стресса ЭПР использовали стимуля
ние экспрессии гена apoA!I при длительной ин
цию макрофагов THP 1 туникамицином - ве
кубации оксЛПНП с макрофагами не связано с
ществом, блокирующим N гликозилирование
накоплением в макрофагах липидных компо
белков в ЭПР, что приводит к стрессу (рис. 3, а).
нентов. Полученные результаты поддерживают
Установлено, что в наших условиях экспери
сигнальный механизм подавления экспрессии
мента стресс ЭПР не развивался, так как инку
гена apoA!I при продолжительной инкубации
бация макрофагов с оксЛПНП не приводила к
макрофагов с оксЛПНП.
индукции экспрессии GRP78.
Роль рецептора TLR4 в регуляции экспрессии
Во вторых, на экспрессию гена apoA!I мо
гена apoA I в макрофагах при инкубации с
жет влиять накопление в клетках продуктов ме
оксЛПНП. Наиболее вероятным кандидатом на
БИОХИМИЯ том 86 вып. 10 2021
оксЛПНП РЕГУЛИРУЮТ apoA!I В МАКРОФАГАХ ЧЕЛОВЕКА
1441
Рис. 3. Влияние захвата макрофагами оксЛПНП на уровень экспрессии гена apoA!I: a - инкубация макрофагов THP 1 с
оксЛПНП не приводит к стрессу ЭПР. Клетки THP 1 дифференцировали индукцией PMA как описано в разделе «Ма
териалы и Методы», далее добавляли оксЛПНП до концентрации 50 мкг/мл и инкубировали в течение 24 или 48 ч либо
добавляли туникамицин (1 мкг/мл) с последующей инкубацией 24 ч. К контрольным образцам добавляли BSA до кон
центрации 50 мкг/мл. Из клеток выделяли РНК и проводили определение уровня мРНК Grp78 методом qRT PCR.
б-г - Зависимость экспрессии генов apoA!I и ABCA1 от захвата макрофагами THP 1 оксЛПНП. Клетки THP 1 диффе
ренцировали индукцией PMA как описано в разделе «Материалы и Методы», далее добавляли флуоресцентно меченные
(Alexa 488) оксЛПНП до концентрации 50 мкг/мл и инкубировали в течение 48 ч. б - Анализ захвата макрофагами THP 1
меченых оксЛПНП с последующей сортировкой методом проточной цитофлуорометрии. Точечной линией с серой за
ливкой показано распределение флуоресценции клеток, инкубированных с BSA (отрицательный контроль), черной
сплошной линией - распределение флуоресценции клеток после инкубации с оксЛПНП-Alexa 488. Показаны гей
ты (оксЛПНП- и оксЛПНП+), использованные при сортировке клеток по уровню захвата меченых оксЛПНП. Из от
сортированных клеток выделяли РНК и проводили анализ экспрессии генов apoA!I (в) и ABCA1 (г) методом qRT PCR.
оксЛПНП- соответствует РНК, выделенной из клеток, не поглотивших значительные количества оксЛПНП (гейт
оксЛПНП-), оксЛПНП+ соответствует РНК, выделенной из нагруженных оксЛПНП макрофагов (гейт оксЛПНП+).
Выравнивание образцов проводили по трём референсным генам (циклофилин А, β!актин и rplp0). Представлены резуль
таты среднего значения из трёх независимых экспериментов, планки погрешности соответствуют стандартной ошибке
среднего. Статистическая достоверность различий между необработанными клетками (K) и макрофагами, инкубировав
шимися с оксЛПНП, проверялась с использованием t критерия Стьюдента, * соответствуют p < 0,05; н.д. - отсутствие
статистически достоверных различий между макрофагами, захватившими (оксЛПНП+) и не захватившими
(оксЛПНП-) значительные количества оксЛПНП
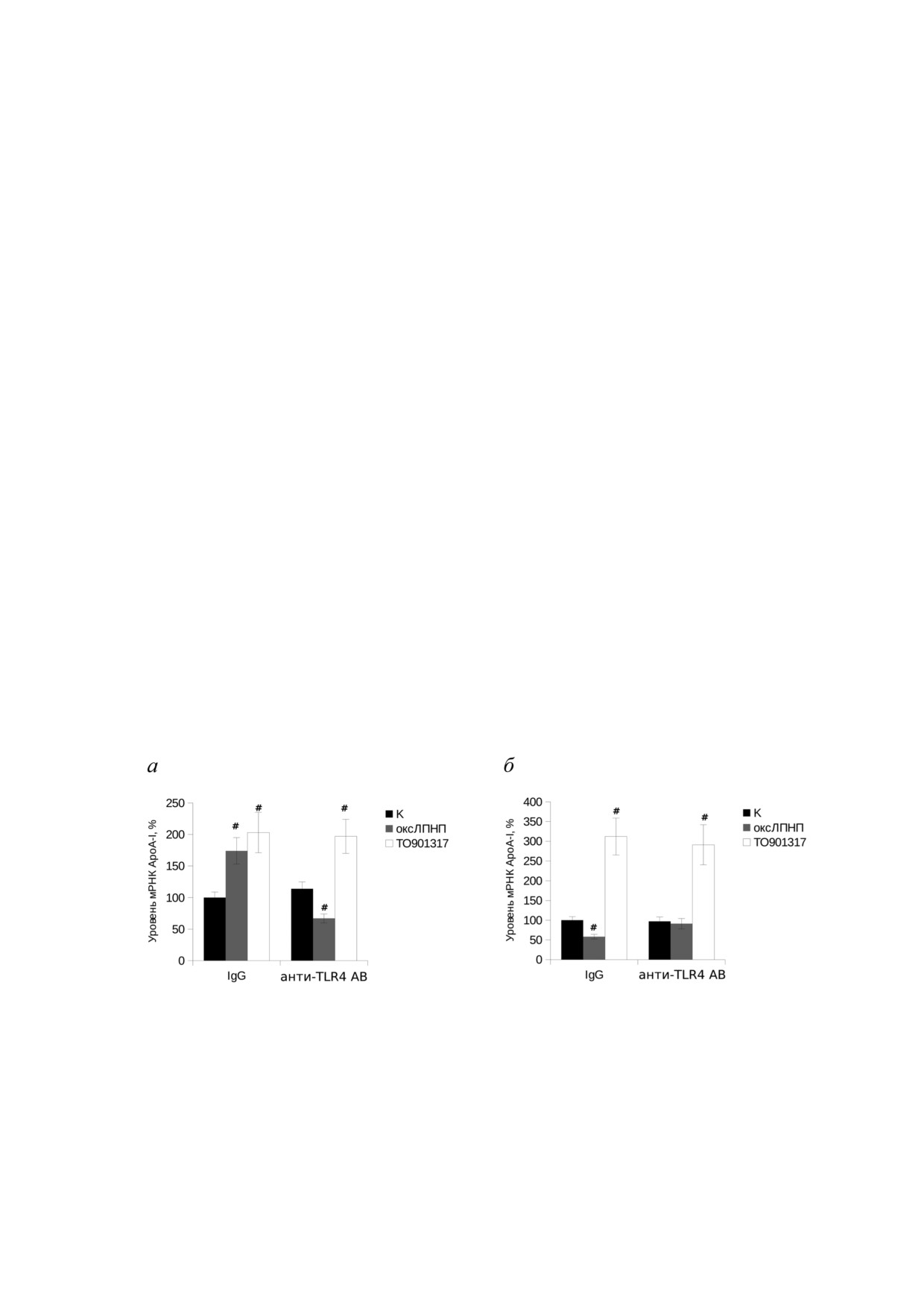
роль сигнального рецептора оксЛПНП являет
ем ЛПНП использовали блокирующие антите
ся белок TLR4, чей основной лиганд - LPS.
ла к рецептору TLR4. Результаты представлены
При этом взаимодействие оксЛПНП с этим ре
на рис. 4. При инкубации в течение 24 ч блоки
цептором также приводит к активации соответ
рование рецептора TLR4 приводило к инверти
ствующих провоспалительных сигнальных кас
рованию стимулирующего эффекта оксЛПНП
кадов. Для проверки возможной роли TLR4 в
(рис. 4, а). Исследование роли рецептора TLR4
регуляции экспрессии гена apoA!I под действи
в подавлении активности гена ароА!I при инку
БИОХИМИЯ том 86 вып. 10 2021
1442
НЕКРАСОВА и др.
бации макрофагов с оксЛПНП в течение 48 ч
блокирование сигнальных каскадов NF κB,
показало, что предварительная инкубация мак
JNK и ERK1/2 приводит к угнетению экспрес
рофагов с блокирующими антителами к рецеп
сии гена apoA!I в макрофагах THP 1, что свиде
тору TLR4 приводила к полной отмене эффекта
тельствует о важности соответствующих сиг
оксЛПНП, но не к отмене эффекта лиган
нальных путей в регуляции активности данного
да LXR (рис. 4, б). Таким образом, полученные
гена. На этом фоне инкубация макрофагов с
результаты позволяют утверждать, что как сти
оксЛПНП не приводила к дальнейшему сниже
мулирующий (инкубация 24 ч), так и подавляю
нию уровня мРНК ApoA I в клетках. Следова
щий (инкубация 48 ч) эффекты оксЛПНП на
тельно, оксЛПНП зависимое угнетение синте
уровень мРНК AроА I в макрофагах обусловле
за ApoA I в макрофагах реализуется с участием
ны взаимодействием оксЛПНП с рецепто
MAP киназных каскадов ERK1/2 и JNK (но
ром TLR4 и активацией соответствующих сиг
не p38), а также фактора транскрипции NF
нальных каскадов.
κB (в противном случае, если бы оксЛПНП
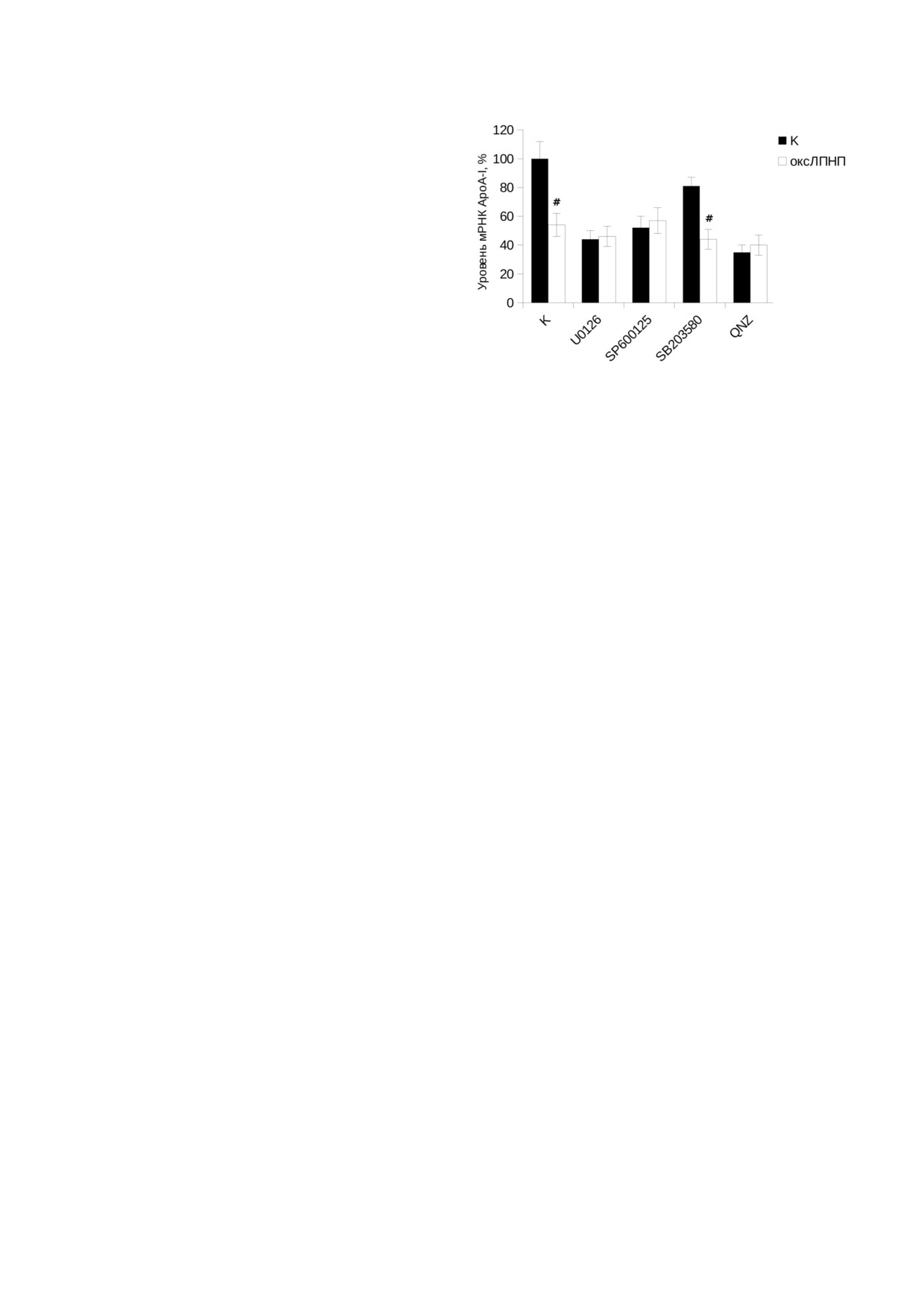
Роль сигнальных каскадов MAP киназ и фак
действовали независимо от данных сигнальных
тора транскрипции NF κB в TLR4 опосредован
цепочек, подавляющие действия ингибиторов и
ной регуляции гена apoA I. Известно, что актива
оксЛПНП на уровень мРНК ApoA I суммиро
ция TLR4 запускает в макрофагах ряд сигналь
вались бы, что противоречит результатам экс
ных каскадов: основные MAP киназные каска
перимента). Таким образом, можно утверждать,
ды (p38, ERK1/2, JNK1/2/3) и каскад, ведущий
что за подавление экспрессии гена ароА!I при
к индукции провоспалительного фактора тран
48 часовой инкубации с оксЛПНП отвечает
скрипции NF κB [52]. Изучение роли провос
TLR4 зависимая активация NF κB, JNK и
палительных каскадов проводили на 48 часо
ERK1/2, но не р38.
вой модели макрофагов THP 1, инкубирован
ных с оксЛПНП, для того чтобы исключить
возможную интерференцию с дополнительны
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
ми сигнальными цепочками, действующими
независимо от рецептора TLR4. Для проверки
Вопросы о функциях эндогенного ApoA I в
возможной роли этих каскадов в подавлении
макрофагах, детали регуляции экспрессии это
гена ароА!I при инкубации макрофагов с
го гена, возможное участие эндогенного ApoA I
оксЛПНП в течение 48 ч были использованы
в процессах атерогенеза до сих пор во многом
ингибиторы соответствующих сигнальных пу
остаются открытыми. Показанная нами ранее
тей. На рис. 5 представлены результаты соответ
антивоспалительная активность ApoA I в мак
ствующих экспериментов. Установлено, что
рофагах, его способность стабилизировать кас
Рис. 4. Роль рецептора TLR4 в регуляции экспрессии гена ароА!I при инкубации макрофагов человека с оксЛПНП в тече
ние 24 (а) и 48 (б) часов. Клетки THP 1 дифференцировали индукцией PMA как описано в разделе «Материалы и Методы»,
далее добавляли блокирующие антитела против TLR4 человека (анти TLR4 AB) в концентрации 5 мкг/мл. В контрольные
образцы добавляли неспецифические IgG человека в той же концентрации. Через 15 мин инкубации с антителами к клет
кам добавляли оксЛПНП до концентрации 50 мкг/мл либо агонист LXR TO901317 (5 мкМ) и инкубировали в течение 24
или 48 ч. В контрольные точки вносили BSA (50 мкг/мл). Из клеток выделяли РНК и проводили определение уровня
мРНК AроА I методом qRT PCR. Выравнивание образцов проводили по трём референсным генам (циклофилин А, β!актин
и rplp0). Представлены результаты среднего значения из трёх независимых экспериментов, планки погрешности соответ
ствуют стандартной ошибке среднего. Статистическая достоверность различий обработанных оксЛПНП или TO901317
макрофагов с контрольными необработанными клетками проверялась по критерию Даннета, # соответствуют p < 0,05
БИОХИМИЯ том 86 вып. 10 2021
оксЛПНП РЕГУЛИРУЮТ apoA!I В МАКРОФАГАХ ЧЕЛОВЕКА
1443
сетный транспортёр ABCA1 [10], а также ряд
данных по влиянию экспрессии экзогенного ге
на apoA!I человека в макрофагах мыши на раз
витие атеросклеротических повреждений
[13-16] позволяют уверенно говорить об анти
атерогенном действии ApoA I в макрофагах.
В настоящей работе впервые изучена динамика
экспрессии гена apoA!I в макрофагах человека в
процессе захвата ими оксЛПНП - процессе,
приводящем к формированию пенистых кле
ток. Накопление липидов и, в частности, холес
терина в макрофагах приводит к активации ге
нов белков, участвующих в обратном транспор
те холестерина, таких как кассетные транспор
тёры ABCA1 и ABCG1. Ключевую роль в этом
Рис. 5. Роль сигнальных каскадов рецептора TLR4 в по
давлении экспрессии гена ароА!I в макрофагах при инку
процессе играют ядерные рецепторы PPARγ и
бации с оксЛПНП в течение 48 ч: клетки THP 1 диффе
LXR, чьи агонисты накапливаются в клетке при
ренцировали индукцией PMA как описано в разделе «Ма
поглощении оксЛПНП [51]. Гены ABCA1 и
териалы и Методы», далее добавляли ингибитор p38
ABCG1 являются прямыми мишенями факторов
MAPK SB203580
(25
мкМ), ингибитор JNK1/2/3
SP600125 (10 мкМ), ингибитор MEK1/2 U0126 (10 мкМ) и
транскрипции LXR (регуляторные районы
ингибитор NF κB QNZ (10 нМ). Инкубацию проводили в
ABCA1 и ABCG1 содержат сайты связывания
течение 1 ч. Далее добавляли оксЛПНП (50 мкг/мл) или
LXR), а ген LXRβ активируется рецептором
BSA (50 мкг/мл, контроль) и инкубировали в течение 48 ч.
PPARγ [51]. Регуляторная область гена apoA!I
Анализ экспрессии apoA!I проводили методом qRT PCR.
человека также содержит сайт связывания для
Выравнивание образцов проводили по трём референсным
генам (циклофилин А, β!актин и rplp0). Представлены ре
ядерных рецепторов LXR (сайт С в составе ге
зультаты среднего значения из трёх независимых экспери
патоцитарного энхансера) [20]. Более того, в ге
ментов, планки погрешности соответствуют стандартной
патоцитах факторы транскрипции LXR взаимо
ошибке среднего. Статистическую достоверность разли
действуют с этим сайтом и подавляют актив
чий между инкубировавшимися и неинкубировавшимися
с оксЛПНП макрофагами проверяли по критерию Данне
ность гена apoA!I [20, 32]. Ранее мы показали,
та, # соответствуют p < 0,05
что в макрофагах LXR сохраняют способность
взимодействовать с сайтом C гепатоцитарного
энхансера гена apoA!I, но в отличие от гепато
цитов в макрофагах LXR являются активатора
а и б), следовательно, если бы усиление
ми экспрессии гена apoA!I [11]. Таким образом,
экспрессии после 24 часовой инкубации с
можно было ожидать, что захват макрофагами
оксЛПНП было действительно вызвано накоп
оксЛПНП будет сопровождаться не только ин
лением в клетке лигандов LXR, то можно было
дукцией экспрессии генов кассетных транспор
бы ожидать, что блокирование TLR4 либо вооб
тёров ABCA1 и ABCG1, но и активацией ге
ще не окажет влияния на действие оксЛПНП,
на apoA!I по сходному, LXR зависимому меха
либо приведёт к ослаблению стимулирующего
низму. Проведённая в рамках этой статьи про
действия. В реальности блокирование рецепто
верка данного предположения выявила гораздо
ра TLR4 приводило к инвертированию эффекта
более сложные механизмы изменения актив
оксЛПНП на уровень мРНК ApoA I - в таких
ности гена apoA!I при захвате макрофагами
условиях наблюдалось подавление экспрессии
оксЛПНП. Хотя инкубация макрофагов с
гена apoA!I уже через 24 ч после инкубации
оксЛПНП в течение 24 ч действительно приво
макрофагов с оксЛПНП. Полученные результа
дила к усилению экспрессии гена apoA!I как на
ты можно объяснить разнонаправленным ха
уровне мРНК, так и на уровне белка, данный
рактером воздействия оксЛПНП на активность
процесс не зависел от накопления в клетках ли
гена ароА!I. Наряду со стимулирующим
гандов для ядерных рецепторов LXR. Вывод о
действием через рецептор TLR4, индуцируются
независимости усиления экспрессии apoA!I от
дополнительные сигнальные пути, негативно
накопления в клетках лигандов ядерных рецеп
регулирующие ген ароА!I. Эффект от актива
торов LXR поддерживается результатами экспе
ции рецептора TLR4 оказывается более выра
римента, представленными на рис. 4, а - бло
женным, поэтому негативная регуляция выяв
кирование рецептора TLR4 приводит к инвер
ляется только при блокировании TLR4. Сиг
сии действия оксЛПНП на ген apoA!I. В макро
нальные цепочки, которые лежат в основе этой
фагах LXR являются активаторами гена apoA!I
негативной регуляции, остаются неизвестны
(см. эффект агониста LXR TO901317, рис. 2,
ми, для их выявления требуется проведение до
БИОХИМИЯ том 86 вып. 10 2021
1444
НЕКРАСОВА и др.
полнительных исследований. В литературе
результаты однозначно свидетельствуют в поль
имеются противоречивые данные о способнос
зу сигнального механизма действия оксЛПНП.
ти оксЛПНП инициировать сигнальные каска
Эксперименты по блокировке рецептора TLR4
ды через взаимодействие с рецептором
окончательно подтвердили данное предполо
TLR4 (см. раздел «Введение»). В частности, в
жение. В этих условиях подавляющее действие
ряде работ утверждается, что регистрируемая
оксЛПНП не проявлялось. Следовательно, за
активация сигнальных путей обусловлена при
подавление активности гена apoA!I при дли
месями эндотоксина в препаратах оксЛПНП,
тельной инкубации макрофагов с оксЛПНП от
который, связываясь с TLR4, ответственен за
ветственны сигнальные каскады, инициируе
наблюдаемые эффекты [37, 38]. Для исключе
мые на рецепторе TLR4. Интересным фактом в
ния возможной активации рецептора TLR4
данном случае является то, что стимуляция од
примесным эндотоксином в наших экспери
ного и того же рецептора одним и тем же лиган
ментах ко всем экспериментальным точкам до
дом в зависимости от сроков инкубации оказы
бавляли полимиксин B - вещество, связываю
вает диаметрально противоположное действие
щее и инактивирующее эндотоксин. Таким об
на экспрессию гена мишени. Подобный эф
разом, совокупность представленных данных
фект при активации рецептора TLR4 на
позволяет сделать вывод, что усиление синтеза
экспрессию генов в макрофагах уже описывали
ApoA I в макрофагах человека в результате
ранее. Экспрессия генов, например Ctnnb1,
24 часовой инкубации макрофагов с оксЛПНП
Maff, Zfp36l1, Dnaja4, MOUSE UPF04 и Slbp, при
обусловлено инициацией в клетках сигнальных
связывании с LPS рецептора TLR4 возрастала в
каскадов при взаимодействии оксЛПНП с
первые 2-4 ч, но далее подавлялась в течение
TLR4.
8 ч [53]. Ингибиторный анализ позволил выя
Изучение долговременных эффектов
вить важную роль MAP киназных каскадов
оксЛПНП на активность гена apoA!I также
ERK1/2 и JNK, а также фактора транскрипции
привело к неожиданным результатам. В отли
NF κB в подавлении гена apoA!I при длитель
чие от лиганда LXR, стимулирующее действие
ной инкубации макрофагов с оксЛПНП. Ранее
которого на активность гена apoA!I только уси
было показано, что данные MAP киназные
ливалось с течением времени, оксЛПНП, начи
каскады участвуют в активации гена apoA!I в
ная с 48 ч инкубации, прогрессивно подавляли
макрофагах человека под действием TNFα [11],
активность данного гена. Возможным объясне
а также в условиях гипоксии [12], причём в этом
нием подобной инверсии могло бы быть разви
процессе важную роль играют факторы тран
тие в макрофагах стресса ЭПР, описанное ранее
скрипции LXR. В случае репрессорного
при захвате макрофагами оксЛПНП [46, 47].
действия оксЛПНП участие LXR представляет
Тем не менее в наших экспериментах стресс
ся маловероятным, возможно, в данном про
ЭПР зафиксирован не был. Причинами подоб
цессе задействованы такие факторы транскрип
ных расхождений, возможно, являются недос
ции, как FOXO1-3, взаимодействующие с сай
таточные сроки инкубации и концентрации
том B гепатоцитарного энхансера гена apoA!I
оксЛПНП. Косвенным подтверждением данно
[27, 28]. Интересно, что эффекты ингибиторов
го предположения является низкий уровень
MAP киназ и NF κB на уровень активности ге
апоптоза (менее 10%) среди макрофагов, куль
на apoA!I в макрофагах человека зависят, по ви
тивировавшихся в присутствии оксЛПНП, что
димому, от степени дифференцировки макро
свидетельствует о начальных стадиях формиро
фагов. В моноцитах блокирование любого из
вания пенистых клеток, достигнутых в наших
трёх основных MAP киназных каскадов, а так
экспериментах, при которых стресс ЭПР ещё не
же блокирование фактора транскрипции NF
развивается (данные не приведены).
κB приводит к повышению уровня
Подавляющее действие оксЛПНП при дли
мРНК ApoA I [11]. По мере дифференцировки
тельных сроках инкубации на активность ге
стимулирующие эффекты ингибиторов ослабе
на apoA!I нельзя также объяснить накоплением
вают и меняются на противоположные [11, 12].
в клетках липидов и их производных. Экспери
Учитывая индивидуальность скорости диффе
менты по сортировке макрофагов после инкуба
ренцировки моноцитов в макрофаги в каждом
ции с флуоресцентно мечеными оксЛПНП по
эксперименте, общее нарастание уровня
казали, что в отличие от гена ABCA1, чья индук
мРНК ApoA I в макрофагах по мере дифферен
ция наблюдалась исключительно в клетках, за
цировки [10], а также разделение в ходе диффе
хвативших значительные количества оксЛПНП,
ренцировки макрофагов на ApoA I бедные и
экспрессия гена apoA!I оказалась одинаково
ApoA I богатые [10, 11], сравнивать между со
снижена как в липид нагруженных, так и в ли
бой данные по влиянию ингибиторов на базо
пид ненагруженных макрофагах. Полученные
вый уровень мРНК ApoA I, полученные в раз
БИОХИМИЯ том 86 вып. 10 2021
оксЛПНП РЕГУЛИРУЮТ apoA!I В МАКРОФАГАХ ЧЕЛОВЕКА
1445
ных экспериментах, довольно затруднительно.
ствием с позитивным регулятором экспрессии
Тем не менее данное обстоятельство не являет
гена apoA!I в печени - ядерным рецепто
ся препятствием для применения ингибиторно
ром PPARα. Такое взаимодействие приводит к
го анализа с целью выяснения роли сигнальных
взаимному ингибированию обоих факторов
каскадов в действиях каких либо внешних сти
транскрипции (механизм транс репрессии) [55].
мулов на уровень активности гена apoA!I в мак
Интересно, что в макрофагах человека PPARα
рофагах человека. Ещё одним потенциальным
также регулирует экспрессию apoA!I, но в отли
подводным камнем при интерпретации резуль
чие от гепатоцитов действует в качестве репрес
татов ингибиторного анализа может быть не
сора транскрипции [11]. Возможно, что меха
специфическая активность использованных
низмы действия NF κB на уровень экспрессии
ингибиторов. Так, например, имеются данные о
apoA!I в макрофагах и гепатоцитах сходны, дан
способности использованного нами ингибито
ный вопрос требует проведения дополнитель
ра киназ семейства p38, SB203580, угнетать в
ных исследований.
высоких концентрациях также киназы JNK
[54]. Хотя наши результаты свидетельствуют об
Суммируя, в настоящей работе впервые по
отсутствии подобного перекрестного действия
казаны изменения экспрессии гена apoA!I в
(в противном случае обработка клеток
макрофагах человека при начальных этапах
SB203580 приводила бы к такому же эффекту,
формирования пенистых клеток. Выявлена
как и применение специфического ингибитора
сложная, имеющая разнонаправленный харак
киназ JNK SP600125, что не соответствует полу
тер динамика экспрессии, в частности, показа
ченным результатам), нельзя исключить влия
но, что исходная индукция синтеза ApoA I в те
ния использованных в работе ингибиторов на
чение первых суток через 48 ч сменяется подав
какие то другие сигнальные пути в клетках. Ис
лением экспрессии гена apoA!I. При этом как
ходя из вышесказанного, представленные в
стимуляция, так и подавление экспрессии
настоящей работе данные о роли MAP киназ
apoA!I не связаны с накоплением в макрофагах
ных каскадов в оксЛПНП опосредованном по
липидов, а обусловлены взаимодействием
давлении экспрессии гена apoA!I в макрофагах
оксЛПНП с рецептором TLR4.
человека следует рассматривать как предвари
тельные, окончательные доказательства потре
буют проведения дополнительных эксперимен
Финансирование. Данная работа была под
тов, например, с использованием РНК интер
держана Российским научным фондом (грант
ференции.
№ 17 15 01326).
Регуляторные районы гена apoA!I человека
Конфликт интересов. Авторы заявляют об от
не содержат сайт связывания для фактора тран
сутствии конфликта интересов.
скрипции NF κB. Тем не менее данный фактор
Соблюдение этических норм. Все процедуры,
транскрипции принимает участие в LPS и
выполненные в исследовании с участием лю
TNFα опосредованном подавлении экспрессии
дей, соответствуют этическими стандартами
гена apoA!I в гепатоцитах [55, 43], а также в ин
институционального и/или национального ко
дукции экспрессии apoA!I в макрофагах под
митета по исследовательской этике и Хельсин
действием TNFα [11] и в условиях гипоксии [12].
кской декларации 1964 года и её последующим
Эффекты NF κB обусловлены его взаимодей
изменениям или сопоставимым нормам этики.
СПИСОК ЛИТЕРАТУРЫ
1.
Wolf, D., and Ley, K. (2019) Immunity and Inflammation
lipoprotein and its apolipoproteins: an idea whose time for
in Atherosclerosis, Circ. Res., 124, 315 327, doi: 10.1161/
testing is coming, Circulation,
104,
23762383,
CIRCRESAHA.118.313591.
doi: 10.1161/hc4401.098467.
2.
Zannis, V. I., Chroni, A., and Krieger, M (2006) Role of
5.
Hyka, N., Dayer, J. M., Modoux, C., Kohno, T., Edwards,
apoA I, ABCA1, LCAT, and SR BI in the biogenesis of
C. K. 3rd, et al. (2001) Apolipoprotein A I inhibits the pro
HDL, J. Mol. Med., 84, 276 294, doi: 10.1007/s00109
duction of interleukin 1beta and tumor necrosis factor
005 0030 4.
alpha by blocking contact mediated activation of mono
3.
Никифорова А. А., Хейфец Г. М., Алкснис Е. Г., Парфе
cytes by T lymphocytes, Blood,
97,
23812389,
нова Н. С., Климов А. Н. (1988) Акцепция холестерина
doi: 10.1182/blood.v97.8.2381.
из мембран эритроцитов подфракцией ЛПВП2, роль
6.
Burger, D., and Dayer, J. M. (2002) High density lipo
лецитин холестерин ацилтрансферазы в этом процес
protein associated apolipoprotein A I: the missing
се, Биохимия, 53, 1334 1338.
link between infection and chronic inflammation?
4.
Shah, P. K., Kaul, S., Nilsson, J., and Cercek, B. (2001)
Autoimmun Rev.,
1,
111117, doi:
10.1016/s1568
Exploiting the vascular protective effects of high density
9972(01)00018 0.
БИОХИМИЯ том 86 вып. 10 2021
1446
НЕКРАСОВА и др.
7.
Wadham, C., Albanese, N., Roberts, J., Wang, L., Bagley,
19.
Mogilenko, D. A., Shavva, V. S., Dizhe, E. B., and Orlov,
C. J., et al. (2004) High density lipoproteins neutralize
S. V. (2019) Characterization of distal and proximal alter
C reactive protein proinflammatory activity, Circulation,
native promoters of the human ApoA!I gene, Mol. Biol.
109, 2116 2122, doi: 10.1161/01.CIR.0000127419.45975.26.
(Mosk.), 53, 485 496, doi: 10.1134/S0026898419030121.
8.
Connelly, M. A., and Williams, D. L. (2004) SR BI and
20.
Huuskonen, J., Vishnu, M., Chau, P., Fielding, P. E., and
HDL cholesteryl ester metabolism, Endocr. Res., 30, 697
Fielding, C. J. (2006) Liver X receptor inhibits the synthe
703, doi: 10.1081/erc 200043979.
sis and secretion of apolipoprotein A1 by human liver
9.
Walsh, A., Ito, Y., and Breslow, J. L. (1989) High levels of
derived cells, Biochemistry, 45, 15068 15074, doi: 10.1021/
human apolipoprotein A I in transgenic mice result in
bi061378y.
increased plasma levels of small high density lipoprotein
21.
Ge, R., Rhee, M., Malik, S., and Karathanasis, S. K.
(HDL) particles comparable to human HDL3, J. Biol.
(1994) Transcriptional repression of apolipoprotein AI
Chem., 264, 6488 6494.
gene expression by orphan receptor ARP 1, J. Biol. Chem.,
10.
Mogilenko, D. A., Orlov, S. V., Trulioff, A. S., Ivanov,
269, 13185 13192.
A. V., Nagumanov, V. K., et al. (2012) Endogenous
22.
Shavva, V. S., Mogilenko, D. A., Bogomolova, A. M.,
apolipoprotein A I stabilizes ATP binding cassette trans
Nikitin, A. A., Dizhe, E. B., et al. (2016) PPARγ repress
porter A1 and modulates Toll like receptor 4 signaling in
es apolipoprotein A I gene but impedes TNFalpha medi
human macrophages, FASEB J.,
26,
20192030,
ated ApoA I downregulation in HepG2 cells, J. Cell.
doi: 10.1096/fj.11 193946.
Biochem., 117, 2010 2022, doi: 10.1002/jcb.25498.
11.
Shavva, V. S., Mogilenko, D. A., Nekrasova, E. V.,
23.
Chan, J., Nakabayashi, H., and Wong, N. C. (1993)
Trulioff, A. S., Kudriavtsev, I. V., et al. (2018) Tumor
HNF4 increases activity of the rat ApoA1 gene, Nucleic
necrosis factor alpha stimulates endogenous apolipopro
Acids Res., 21, 1205 1211, doi: 10.1093/nar/21.5.1205.
tein A I expression and secretion by human monocytes
24.
Rottman, J. N., Widom, R. L., Nadal Ginard, B.,
and macrophages: role of MAP kinases, NF κB, and
Mahdavi, V., and Karathanasis, S. K. (1991) A retinoic
nuclear receptors PPARα and LXRs, Mol. Cell. Biochem.,
acid responsive element in the apolipoprotein AI gene
448, 211 223, doi: 10.1007/s11010 018 3327 7.
distinguishesbetween two different retinoic acid response
12.
Bogomolova, A. M., Shavva, V. S., Nikitin, A. A.,
pathways, Mol. Cell. Biol., 11, 3814 3820, doi: 10.1128/
Nekrasova, E. V., Dizhe, E. B., et al. (2019) Hypoxia as a
mcb.11.7.3814.
factor involved in the regulation of the apoA 1, ABCA1,
25.
Martin, C., Duez, H., Blanquart, C., Berezowski, V.,
and complement C3 gene expression in human
Poulain, P., et al. (2001) Statin induced inhibition of the
macrophages, Biochemistry (Moscow),
84,
529539,
Rho signaling pathway activates PPARα and induces
doi: 10.1134/S0006297919050079.
HDL apoA I, J. Clin. Invest.,
107,
14231432,
13.
Major, A. S., Dove, D. E., Ishiguro, H., Su, Y. R., Brown,
doi: 10.1172/JCI10852.
A. M., et al. (2001) Increased cholesterol efflux in
26.
Harnish, D. C., Malik, S., Kilbourne, E., Costa, R., and
apolipoprotein AI (ApoAI) producing macrophages as a
Karathanasis, S. K. (1996) Control of apolipoprotein AI
mechanism for reduced atherosclerosis in ApoAI((-/-))
gene expression through synergistic interactions between
mice, Arterioscler. Thromb. Vasc. Biol., 21, 1790 1795,
hepatocyte nuclear factors 3 and 4, J. Biol. Chem., 271,
doi: 10.1161/hq1101.097798.
13621 13628, doi: 10.1074/jbc.271.23.13621.
14.
Ishiguro, H., Yoshida, H., Major, A. S., Zhu, T., Babaev,
27.
Shavva, V. S., Bogomolova, A. M., Nikitin, A. A., Dizhe,
V. R., et al. (2001) Retrovirus mediated expression of
E. B., Oleinikova, G. N., et al. (2017) FOXO1 and LXRα
apolipoprotein A I in the macrophage protects against
downregulate the apolipoprotein A I gene expression dur
atherosclerosis in vivo, J. Biol. Chem., 276, 36742 36748,
ing hydrogen peroxide induced oxidative stress in HepG2
doi: 10.1074/jbc.M106027200.
cells, Cell Stress Chaperones, 22, 123 134, doi: 10.1007/
15.
Su, Y. R., Ishiguro, H., Major, A. S., Dove, D. E.,
s12192 016 0749 6.
Zhang, W., et al. (2003) Macrophage apolipoprotein A I
28.
Shavva, V. S., Bogomolova, A. M., Nikitin, A. A., Dizhe,
expression protects against atherosclerosis in ApoE defi
E. B., Tanyanskiy, D. A., et al. (2017) Insulin mediated
cient mice and up regulates ABC transporters, Mol. Ther.,
downregulation of apolipoprotein A I gene in human
8, 576 583, doi: 10.1016/s1525 0016(03)00214 4.
hepatoma cell line HepG2: the role of interaction between
16.
Su, Y. R., Blakemore, J. L., Zhang, Y., Linton, M. F., and
FOXO1 and LXRβ transcription factors, J. Cell. Biochem.,
Fazio, S. (2008) Lentiviral transduction of apoAI into
118, 382 396, doi: 10.1002/jcb.25651.
hematopoietic progenitor cells and macrophages: applica
29.
Libby, P., and Theroux, P. (2005) Pathophysiology of
tions to cell therapy of atherosclerosis, Arterioscler.
coronary artery disease, Circulation, 111, 34813488,
Thromb. Vasc. Biol., 28, 1439 1446, doi: 10.1161/ATVBAHA.
doi: 10.1161/CIRCULATIONAHA.105.537878.
107.160093.
30.
Parthasarathy, S., Raghavamenon, A., Garelnabi, M. O.,
17.
Higuchi, K., Law, S. W., Hoeg, J. M., Schumacher, U. K.,
and Santanam, N. (2010) Oxidized low density lipopro
Meglin, N., and Brewer, H. B. Jr. (1988) Tissue specific
tein, Methods Mol. Biol., 610, 403 417, doi: 10.1007/978
expression of apolipoprotein A I (ApoA I) is regulated by
1 60327 029 8_24.
the 5′ flanking region of the human ApoA!I gene, J. Biol.
31.
Feng, Y., Cai, Z. R., Tang, Y., Hu, G., Lu, J., et al. (2014)
Chem., 263, 18530 18536.
TLR4/NF κB signaling pathway mediated and oxLDL
18.
Widom, R. L., Ladias, J. A., Kouidou, S., and
induced up regulation of LOX 1, MCP 1, and VCAM 1
Karathanasis, S. K.
(1991) Synergistic interactions
expressions in human umbilical vein endothelial cells,
between transcription factors control expression of the
Genet. Mol. Res., 13, 680 695, doi: 10.4238/2014.
apolipoprotein AI gene in liver cells, Mol. Cell. Biol., 11,
32.
Yu, X. H., Fu, Y. C., Zhang, D. W., Yin, K., and
677 687, doi: 10.1128/mcb.11.2.677.
Tang, C K. (2013) Foam cells in atherosclerosis, Clin.
БИОХИМИЯ том 86 вып. 10 2021
оксЛПНП РЕГУЛИРУЮТ apoA!I В МАКРОФАГАХ ЧЕЛОВЕКА
1447
Chim. Acta, 424, 245 252, doi: 10.1016/j.cca.2013.06.
44.
Mogilenko, D. A., Dizhe, E. B., Shavva, V. S., Lapikov,
006.
I. A., Orlov, S. V., and Perevozchikov, A. P. (2009) Role of
33.
Chistiakov, D. A., Melnichenko, A. A., Myasoedova, V.
the nuclear receptors HNF4α, PPARα, and LXRs in the
A., Grechko, A. V., and Orekhov, A. N.
(2017)
TNFα mediated inhibition of human apolipoprotein A I
Mechanisms of foam cell formation in atherosclerosis,
gene expression in HepG2 cells, Biochemistry, 48, 11950
J. Mol. Med. (Berl)., 95, 1153 1165, doi: 10.1007/s00109
11960, doi: 10.1021/bi9015742.
017 1575 8.
45.
Mogilenko, D. A., Kudriavtsev, I. V., Shavva, V. S., Dizhe,
34.
Chávez Sánchez, L., Garza Reyes, M. G., Espinosa
E. B., Vilenskaya, E. G., et al. (2013) Peroxisome prolifer
Luna, J. E., Chávez Rueda, K., Legorreta Haquet, M. V.,
ator activated receptor alpha positively regulates comple
and Blanco Favela, F. (2014) The role of TLR2, TLR4
ment C3 expression but inhibits tumor necrosis factor α
and CD36 in macrophage activation and foam cell forma
mediated activation of C3 gene in mammalian hepatic
tion in response to oxLDL in humans, Hum. Immunol.,
derived cells, J. Biol. Chem., 288, 1726 1738, doi: 10.1074/
75, 322 329, doi: 10.1016/j.humimm.2014.01.012.
jbc.M112.437525.
35.
Stewart, C. R., Stuart, L. M., Wilkinson, K., van Gils,
46.
Yao, S., Miao, C., Tian, H., Sang, H., Yang, N., et al.
J. M., Deng, J., et al. (2010) CD36 ligands promote ster
(2014)
Endoplasmic reticulum stress promotes
ile inflammation through assembly of a Toll like receptor
macrophage derived foam cell formation by up regulating
4 and 6 heterodimer, Nat. Immunol., 11, 155161,
cluster of differentiation 36 (CD36) expression, J. Biol.
doi: 10.1038/ni.1836.
Chem., 289, 4032 4042, doi: 10.1074/jbc.M113.524512.
36.
Yang, K., Liu, X., Liu, Y., Wang, X., Cao, L., et al. (2017)
47.
Sanda, G. M., Deleanu, M., Toma, L., Stancu, C. S.,
DC SIGN and Toll like receptor 4 mediate oxidized low
Simionescu, M., and Sima, A. V. (2017) Oxidized LDL
density lipoprotein induced inflammatory responses in
exposed human macrophages display increased MMP 9
macrophages, Sci. Rep., 3296, 1 11, doi: 10.1038/s41598
expression and secretion mediated by endoplasmic reticulum
017 03740 7.
stress, J. Cell. Biochem., 118, 661 669, doi: 10.1002/jcb.25637.
37.
Kannan, Y., Sundaram, K., Narasimhulu, C. A.,
48.
Bae, Y. S., Lee, J. H., Choi, S. H., Kim, S., Almazan, F.,
Parthasarathy, S., and Wewers, M. D. (2012) Oxidatively
et al. (2009) Macrophages generate reactive oxygen species
modified low density lipoprotein (LDL) inhibits TLR2
in response to minimally oxidized low density lipoprotein:
and TLR4 cytokine responses in human monocytes but
toll like receptor 4 and spleen tyrosine kinase dependent
not in macrophages, J. Biol. Chem., 287, 23479 23488,
activation of NADPH oxidase 2, Circ. Res., 104, 210 218,
doi: 10.1074/jbc.M111.320960.
doi: 10.1161/CIRCRESAHA.108.181040.
38.
Bzowska, M., Nogieć, A., Skrzeczyńska Moncznik, J.,
49.
Park, Y. M. (2014) CD36, a scavenger receptor implicated
Mickowska, B., Guzik, K., and Pryjma, J.
(2012)
in atherosclerosis, Exp. Mol. Med., 46, e99, doi: 10.1038/
Oxidized LDLs inhibit TLR induced IL 10 production by
emm.2014.38.
monocytes: a new aspect of pathogen accelerated athero
50.
Yang, H. Y., Bian, Y. F., Zhang, H. P., Gao, F., Xiao, C. S.,
sclerosis, Inflammation, 35, 15671584, doi: 10.1007/
et al. (2015) LOX 1 is implicated in oxidized low density
s10753 012 9472 3.
lipoprotein induced oxidative stress of macrophages in
39.
Bennett, S, and Breit, S. N. (1994) Variables in the isola
atherosclerosis, Mol. Med. Rep.,
12,
53355341,
tion and culture of human monocytes that are of particu
doi: 10.3892/mmr.2015.4066.
lar relevance to studies of HIV, J. Leukoc. Biol., 56, 236
51.
Chawla, A., Boisvert, W. A., Lee, C. H., Laffitte, B. A.,
240, doi: 10.1002/jlb.56.3.236.
Barak, Y., et al. (2001) A PPARγ LXR ABCA1 pathway in
40.
Khan, B. V., Parthasarathy, S. S., Alexander, R. W., and
macrophages is involved in cholesterol efflux and athero
Medford, R. M. (1995) Modified low density lipoprotein
genesis, Mol. Cell, 7, 161171, doi: 10.1016/s1097
and its constituents augment cytokine activated vascular
2765(01)00164 2.
cell adhesion molecule 1 gene expression in human vascu
52.
Hopkins, P. N. (2013) Molecular biology of atherosclero
lar endothelial cells, J. Clin. Invest., 95, 12621270,
sis, Physiol. Rev., 93, 1317 1542, doi: 10.1152/physrev.
doi: 10.1172/JCI117776.
00004.2012.
41.
Jialal, I., and Chait, A. (1989) Differences in the metabo
53.
Eichelbaum, K., and Krijgsveld, J. (2014) Rapid temporal
lism of oxidatively modified low density lipoprotein and
dynamics of transcription, protein synthesis, and secretion
acetylated low density lipoprotein by human endothelial
during macrophage activation, Mol. Cell. Proteomics, 13,
cells: inhibition of cholesterol esterification by oxidatively
792 810, doi: 10.1074/mcp.M113.030916.
modified low density lipoprotein, J. Lipid Res., 30, 1561
54.
Clerck, A., and Sugden, P. H. (1998) The p38 MAPK
1568.
inhibitor, SB203580, inhibits cardiac stress activated protein
42.
Scoccia, A. E., Molinuevo, M. S., McCarthy, A. D., and
kinases/c Jun N terminal kinases (SAPKs/JNKs), FEBS
Cortizo, A. M. (2001) A simple method to assess the
Lett., 426, 93 96, doi: 10.1016/s0014 5793(98)00324 x.
oxidative susceptibility of low density lipoproteins, BMC
55.
Morishima, A., Ohkubo, N., Maeda, N., Miki, T., and
Clin. Pathol., 1, 1, doi: 10.1186/1472 6890 1 1.
Mitsuda, N.
(2003) NFkappaB regulates plasma
43.
Esterbauer, H., and Cheeseman, K. H. (1990) Determina
apolipoprotein A I and high density lipoprotein choles
tion of aldehydic lipid peroxidation products: malonalde
terol through inhibition of peroxisome proliferator acti
hyde and 4 hydroxynonenal, Methods Enzymol., 186, 407
vated receptor alpha, J. Biol. Chem., 278, 38188 38193,
421, doi: 10.1016/0076 6879(90)86134 h.
doi: 10.1074/jbc.M306336200.
БИОХИМИЯ том 86 вып. 10 2021
1448
НЕКРАСОВА и др.
REGULATION OF THE APOLIPOPROTEIN A I GENE EXPRESSION
IN HUMAN MACROPHAGES BY OXIDATED LOW DENSITY LIPOPROTEIN
E. V. Nekrasova1, E. E. Larionova1, K. Danko2, D. O. Kuzmina2,
V. S. Shavva1, I. V. Kudriavtsev1, and S. V. Orlov1,2*
1 Institute of Experimental Medicine, 197376 St. Petersburg, Russia; E!mail: serge@iem.sp.ru
2 St. Petersburg State University, 199034 St. Petersburg, Russia; E!mail: s.orlov@spbu.ru
Apolipoprotein A I (ApoA I) is a key component of reverse cholesterol transport in humans. In the previous stud
ies, we demonstrated expression of the apoA!I gene in human monocytes and macrophages; however, little is known
on the regulation of the apoA!I expression in macrophages during the uptake of modified low density lipopro
tein (LDL), which is one of the key processes in the early stages of atherogenesis leading to formation of foam cells.
Here, we demonstrate a complex nature of the apoA!I regulation in human macrophages during the uptake of oxi
dized LDL (oxLDL). Incubation of macrophages with oxLDL induced expression of the apoA!I gene within the first
24 h, but suppressed it after 48 h. Both effects depended on the interaction of oxLDL with the TLR4 receptor, rather
than on the oxLDL uptake by the macrophages. The oxLDL mediated downregulation of the apoA!I gene depend
ed on the ERK1/2 and JNK cascades, as well as on the NF κB cascade.
Keywords: atherosclerosis, oxLDL, macrophages, THP 1, foam cells, TLR4 receptor, apoA!I gene
БИОХИМИЯ том 86 вып. 10 2021