БИОХИМИЯ, 2021, том 86, вып. 10, с. 1531 - 1549
УДК 57.05;57.021:612.66;612.67;57.022
ВЛИЯНИЕ ОГРАНИЧЕНИЯ ПИТАНИЯ НА СТАРЕНИЕ:
ИСПРАВЛЕНИЕ ПРОБЛЕМ С «СЕНСОРАМИ ПИТАНИЯ»
У ПОСТМИТОТИЧЕСКИХ КЛЕТОК?
Обзор
© 2021
Г.В. Моргунова*, Г.А. Шиловский, А.Н. Хохлов
Московский государственный университет имени М.В. Ломоносова, биологический факультет,
119234 Москва, Россия; электронная почта: morgunova@mail.bio.msu.ru
Поступила в редакцию 12.07.2021
После доработки 25.07.2021
Принята к публикации 26.07.2021
В обзоре рассматривается вопрос о роли нарушений метаболизма (в частности, инсулинорезистентности) в
формировании возрастных болезней и в «нормальном» старении с акцентом на изменения в постмитоти
ческих клетках высших организмов. Ограничение калорийности питания помогает бороться с такими мета
болическими нарушениями, с чем, вероятно, и связана его способность продлевать жизнь лабораторным
животным. Поддержание метаболического гомеостаза особенно важно для высокодифференцированных
долгоживущих клеток организма, продолжительность жизни которых сопоставима с продолжительностью
жизни организма. Нормальное функционирование этих клеток можно обеспечить лишь при условии адек
ватно работающей системы очистки их цитоплазмы, а также обеспечения этих клеток всеми необходимы
ми питательными веществами и энергией. Одной из центральных проблем в геронтологии является нару
шение с возрастом метаболизма глюкозы, ведущее к соответствующим патологиям - ожирению, диабету,
метаболическому синдрому и др. Скелетная мускулатура наряду с жировой тканью является основным пот
ребителем инсулина, поэтому физическая активность мышц, поддерживающая их энергетический метабо
лизм, позволяет отсрочить возникновение инсулинорезистентности. Развившись, она нарушает, в частнос
ти, метаболизм кардиомиоцитов, которые оказываются в среде, богатой питательными веществами, но не
могут использовать их для выполнения своих функций. Это способствует возникновению сердечно сосу
дистых возрастных болезней. Метаболические патологии также изменяют чувствительность к питательным
веществам нейронов, вследствие чего нарушается действие инсулина в центральной нервной системе. Кро
ме того, есть основания полагать, что в нейронах также может развиваться инсулинорезистентность. Пред
полагается, что воздействия на сенсоры питания (например, AMPK) в постмитотических клетках могут по
ложительно влиять на многоклеточный организм, замедляя его старение и увеличивая продолжительность
жизни.
КЛЮЧЕВЫЕ СЛОВА: ограничение калорийности питания, метаболизм, AMPK, аутофагия, кардиомиоци
ты, миоциты, нейроны.
DOI: 10.31857/S0320972521100092
ВВЕДЕНИЕ
рантности к глюкозе приводит к развитию мета
болического синдрома. Ограничение калорий
Возрастная деградация так или иначе связа
ности питания помогает бороться с метаболи
на с метаболическими нарушениями и сбоями
ческими нарушениями, с чем, вероятно, и свя
систем регуляции обмена веществ на всех уров
зана его способность продлевать жизнь лабора
нях организации - от клеток до регулирующих
торным животным [1-5]. Основными участни
систем многоклеточного организма. В частнос
ками сигнальных путей, чувствительных к коле
ти, развивающееся с возрастом нарушение толе
баниям концентрации питательных веществ,
Принятые сокращения: ИР - инсулинорезистентность; ИРец - инсулиновый рецептор; СДII - сахарный диабет
второго типа; СЖК - свободные жирные кислоты; ЦНС - центральная нервная система; AMPK - 5′ АМФ актвируемая
протеинкиназа, 5′ AMP activated protein kinase; AS160 - субстрат Akt массой 160 кДа, Akt substrate of 160 kDa; DAG - ди
ацилглицерин, diacylglycerol; GLUT - переносчик глюкозы, glucose transporter; IGF 1 - инсулиноподобный фактор рос
та 1 (insulin like growth factor 1); IRS - субстраты инсулинового рецептора (insulin receptor substrate); mTOR - mechanistic
target of rapamycin; mTORC1 - механистическая мишень рапамицина - комплекс 1 (mechanistic target of rapamycin com
plex 1); p70S6K - рибосомная p70S6 киназа (70 kDa ribosomal protein S6 kinase); PI3K - фосфоинозитол 3 киназа (phos
phoinositide 3 kinase); PKB - протеинкиназа B; PKC - протеинкиназа C; TOR - target of rapamycin.
* Адресат для корреспонденции.
1531
9*
1532
МОРГУНОВА и др.
являются инсулин, TOR (target of rapamycin),
заметное, но постепенно набирающее скорость.
5′ АМФ активируемая протеинкиназа (AMPK,
Уменьшение числа потребляемых калорий или
5′ AMP activated protein kinase). Метаболичес
физическая нагрузка, которая помогает расхо
кие сбои начинаются на уровне этих сигнальных
довать лишние калории, могут нормализовать
путей. Так, ухудшение функционирования
показатели нервной и сердечно сосудистой сис
AMPK приводит ко множественным расстрой
тем, ухудшающиеся с возрастом.
ствам регуляции - например, к развитию инсу
Все указанные сигнальные пути являются
линорезистентности (ИР) [6]. Активация или
высококонсервативными, а потому могут изу
подавление некоторых метаболических сенсо
чаться на самых разных объектах. Для модели
ров помогают продлевать жизнь самым разным
рования старения постмитотических клеток
организмам и улучшать возрастные показатели у
широко используется модель хронологического
людей.
старения дрожжей и реже - модель «стационар
Одним из следствий поломок метаболизма
ного» старения бактерий и клеток млекопитаю
является развитие нарушений в протеолизе и
щих («возрастная» деградация клеток при огра
энергетическом обмене клеток. Высокодиффе
ничении их пролиферации и дальнейшем пре
ренцированные клетки в значительной мере
бывании в стационарной фазе роста) [9-14].
страдают из за таких нарушений. Продолжи
Известно, что активация аутофагии и AMPK
тельность жизни нейронов и миоцитов доволь
(у дрожжей - SNF1, от sucrose nonfermenting)
но велика и сопоставима с продолжительностью
или ингибирование TOR также помогают прод
жизни организма, нормальное функционирова
левать жизнь клеткам в культуре, что подтверж
ние этих клеток можно обеспечить лишь при ус
дает адекватность использования таких моде
ловии адекватно работающей системы очистки
лей [15-17].
их цитоплазмы и обеспечения этих клеток все
Несмотря на большое количество работ, пос
ми необходимыми питательными веществами и
вящённых теме ограничения калорийности пи
энергией. Поломки в системе протеолиза и ау
тания, многие вопросы всё ещё остаются в рам
тофагии, а также нарушение регулирующей ро
ках дискуссии. Могут ли в борьбе со старением
ли AMPK в конечном счёте приводят к деграда
полностью заменить ограничение калорийнос
ции и гибели постмитотических клеток. У таких
ти питания его миметики? Какие могут быть
клеток есть свои способы борьбы с развитием
последствия у избыточной активации сигналь
различных развивающихся при старении дефек
ных путей, положительно влияющих на жизне
тов - например, мышечные волокна первого ти
способность? Как продлить жизнь активно
па могут использовать для снижения производ
функционирующим «стареющим» высокодиф
ства активных форм кислорода «мягкое» разоб
ференцированным клеткам, которые обязатель
щение [7]. При частичном разобщении дыхания
но должны потреблять большое количество
и окислительного фосфорилирования происхо
энергии? На эти и многие другие вопросы у ис
дит некоторое снижение производства АТФ, но
следователей ещё нет однозначных ответов. Хо
в гораздо большей степени снижается количест
тя бы на некоторые из них мы постарались отве
во образующихся активных форм кислорода.
тить в настоящем обзоре.
По видимому, «мягкое» разобщение по своему
действию сходно с ограничением калорийности
питания, так как в обоих случаях отмечается
МЕТАБОЛИЧЕСКИЕ НАРУШЕНИЯ
уменьшение количества АТФ в организме [8].
При ограничении питания меньше АТФ образу
В клетке существует сложная метаболичес
ется из за недостатка калорий, а при «мягком»
кая сеть, которая обеспечивает получение энер
разобщении - из за того, что часть протонов
гии и строительных элементов из источников,
проходит через мембрану митохондрий вхолос
поступающих из окружающей среды или крово
тую, а не используется АТФ синтазой для про
тока. Основными такими источниками являют
изводства АТФ.
ся глюкоза, глутамин и жирные кислоты.
Развитие дисбаланса в системе регуляции
Спектр метаболических сенсоров довольно ши
метаболизма, вероятно, является побочным
рок, среди них даже такие неочевидные, как
продуктом процесса развития организма и воз
сенсоры внеклеточных нуклеотидов и сенсоры
никает закономерно. Завершение развития
на основе РНК [18].
опорно двигательной и нервной системы у че
Метаболизму глюкозы и связанным с нару
ловека происходит к 21-23 годам. После неко
шениями в системе восприятия глюкозы про
торого периода оптимальной работы этих сис
цессами (ИР, ожирением, диабетом и метаболи
тем наблюдается уменьшение количества мы
ческим синдромом) посвящены многочислен
шечных волокон и нейронов, сначала почти не
ные геронтологические исследования. Роль
БИОХИМИЯ том 86 вып. 10 2021
МЕТАБОЛИЧЕСКИЕ СЕНСОРЫ В ПОСТМИТОТИЧЕСКИХ КЛЕТКАХ
1533
глюкозы в жизнедеятельности клетки и орга
Важную роль в регуляции метаболизма игра
низма сложно переоценить. Глюкоза - не толь
ют AMPK и TOR, в том числе и у организмов, у
ко необходимый источник энергии, но и важ
которых нет инсулина. AMPK активируется,
ный стимулятор клеточной пролиферации.
когда повышается отношение АМФ/АТФ (от
У человека формирование метаболических пу
сюда и название «АМФ активируемая»), и явля
тей, регулирующих энергетическое обеспече
ется, таким образом, основным сенсором недос
ние, а также созревание соответствующих нерв
татка энергии [29]. Основная задача AMPK -
ных структур происходят на поздних сроках бе
отключить анаболические процессы и запустить
ременности [19]. Этот процесс необходим для
катаболические. Её регуляторная роль затраги
перехода плода от питания через плаценту к са
вает работу всех органов и тканей, вызывая ос
мостоятельному эндогенному производству
тановку липогенеза, глюконеогенеза, синтеза
глюкозы. В связи с этим сильно недоношенные
холестерина, триглицеридов, жирных кислот,
дети испытывают нехватку энергии, которая
белков и гликогена, а также активируя потреб
приводит к снижению уровня инсулиноподоб
ление глюкозы и жирных кислот с их последую
ного фактора роста 1 (IGF 1, insulin like growth
щим окислением. AMPK является серин/трео
factor 1) и нарушению метаболизма глюко
ниновой протеинкиназой и представляет собой
зы [20]. Низкий уровень IGF 1 становится од
гетеротример, состоящий из трёх субъединиц,
ной из основных причин недоразвития многих
каждая из которых имеет несколько изоформ.
систем/органов и в первую очередь - централь
Существуют две изоформы каталитической аль
ной нервной системы (ЦНС). Кроме того, голо
фа субъединицы (α1 и α2), две изоформы регу
дание матери или нарушения в передаче пита
ляторной бета субъединицы (β1 и β2) и три изо
тельных веществ через плаценту на внутриут
формы регуляторной гамма субъединицы (γ1, γ2
робном этапе могут наложить отпечаток на всю
и γ3). Подробно структура и многочисленные
последующую жизнь и даже определить её про
функции AMPK описаны в большом числе об
должительность [21-26]. Избыточное питание
зорных работ [29-31]. Действие AMPK во мно
матери также приводит к нарушению метабо
гом противоположно действию комплекса
лизма глюкозы и влияет на развитие ЦНС и дру
mTOR (mechanistic target of rapamycin).
гих структур у плода [27]. При ИР у матери с гес
mTOR активируется, когда энергии много (есть
тационным диабетом материнский инсулин не
глюкоза), и запускает анаболические процессы.
проникает через плаценту, но глюкоза транс
Как и AMPK, mTOR является серин/треонино
портируется, вследствие чего плод подвергается
вой протеинкиназой из семейства киназ,
воздействию гипергликемии и реагирует на по
родственных PI3K (phosphoinositide 3 kinase,
вышенный уровень глюкозы повышенным выс
фосфоинозитол 3 киназа), и регулирует боль
вобождением инсулина [28]. Можно полагать,
шое количество ключевых метаболических ми
что глюкоза является одним из важных метабо
шеней в клетке. mTOR входит в состав двух бел
лических факторов, определяющих развитие ор
ковых комплексов - mTORC1 (состоит из бел
ганизма.
ков mTOR, Raptor и mLST8; очень чувствителен
Когда глюкоза поступает в организм, проис
к рапамицину) и mTORC2 (состоит из белков
ходит секреция инсулина β клетками поджелу
mTOR, Rictor, Sin1 и mLst8). Оба комплекса уп
дочной железы. Инсулин стимулирует поглоще
равляют ростом и выживанием клеток, но толь
ние клетками глюкозы, аминокислот и других
ко первый регулирует метаболические реак
веществ, увеличивает интенсивность синтеза
ции [32]. mTORC1 как раз и является централь
гликогена и жирных кислот, активирует глико
ным узлом, который координирует рост клеток с
лиз, подавляет глюконеогенез, липолиз и гидро
доступностью питательных веществ, энергии и
лиз белков. Таким образом, все эффекты инсу
факторов роста [33]. Передача сигналов mTOR
лина настроены на усиление анаболизма и тор
вовлечена в процесс старения у различных орга
можение катаболизма. У наиболее активно изу
низмов и хорошо изучена на модельных герон
чаемых в геронтологии модельных объектов, та
тологических объектах (Saccharomyces cerevisiae,
ких как дрозофила, нематода и дрожжи, нет ин
Caenorhabditis elegans, Drosophila melanogaster,
сулина, но есть IGF 1. Сигнальные пути инсу
грызуны); ингибитор mTOR, рапамицин, прод
лина/IGF 1 эволюционно консервативны и от
левает продолжительность их жизни [15, 34-36].
ветственны за рост и развитие. Инсулин в орга
В то же время возникающая с возрастом избы
низме человека также частично влияет на мито
точная активация пути mTORC, вероятно, ста
генные процессы, но мы будем рассматривать
новится причиной старения, а также усугубляет
преимущественно его метаболическое влияние,
течение онкологических заболеваний и диабе
а потому почти не будем касаться IGF 1 и пути
та [37]. Положительное влияние ограничения
инсулина/IGF 1.
калорийности питания связывают с активаци
БИОХИМИЯ том 86 вып. 10 2021
1534
МОРГУНОВА и др.
ей AMPK и со снижением активности пу
сигнальных путей - PI3K-PKB/Akt (PKB/Akt -
ти mTORC1.
protein kinase B, протеинкиназа B) и Ras-MAPK
Инсулинорезистентность. ИР - это снижение
(mitogen activated protein kinase, митоген акти
тканевого ответа на стимуляцию инсулином.
вируемая протеинкиназа) [28]. IRS 1 особенно
Она характеризуется нарушением поглощения и
важен в скелетных мышцах, жировой ткани и
окисления глюкозы, снижением синтеза глико
коре головного мозга, IRS 2 - в печени и гипо
гена и, в меньшей степени, способностью по
таламусе. Активированный IRS стимулирует пе
давлять окисление липидов [38].
редачу сигналов через путь PI3K-PKB/Akt.
Хотя в развитии ИР принимает участие сра
PKB/Akt регулирует фосфорилирование многих
зу несколько органов и тканей, мы хотим в боль
внутриклеточных белков, в том числе mTORC1,
шей мере сконцентрироваться на нейронах,
GSK3β (glycogen synthase kinase 3β; киназа гли
кардиомиоцитах и миоцитах скелетной муску
когенсинтазы 3β), SREBP1c (белок, связываю
латуры, клетки которых с некоторыми оговор
щий регуляторный элемент стерола 1c; sterol
ками существуют столько же, сколько и сам ор
regulatory element binding protein 1c); через фос
ганизм (за исключением таких ситуаций, как
форилирование AS160 (субстрат Akt массой
появление новых нервных клеток в гиппокампе
160 кДа, или TBC1D4 - член четвёртого семей
и обонятельном мозге или отмирание миоцитов
ства доменов TBC1, TBC1 domain family mem
при саркопении). При этом важно отметить, что
ber 4) она стимулирует перемещение переносчи
роль нервной и мышечной ткани в метаболизме
ков глюкозы в мембрану [39-42]. IGF 1 также
глюкозы разная.
может связывать и активировать рецепторы ин
Инсулин является пептидным гормоном,
сулина, а рецепторы как инсулина, так и IGF
вырабатываемым β клетками поджелудочной
могут инициировать сходные трофические про
железы. Он воздействует на рецепторы, связан
цессы [40].
ные с плазматической мембраной в клетках ми
В настоящее время доминирует гипотеза о
шенях, чтобы управлять комплексным анаболи
том, что причиной типичной ИР, связанной с
ческим ответом на поступление питательных ве
ожирением, являются дефекты передачи инсу
ществ [39]. Инсулин синтезируется при увели
линового сигнала, а не снижение связывания
чении уровня глюкозы в циркулирующей крови,
с ИРец. Однако в действительности и понижен
однако его синтез и высвобождение в кровь мо
ное содержание поверхностного ИРец, и нару
гут происходить и при изменении уровня ами
шение передачи инсулинового сигнала вносят
нокислот, ацетилхолина, холецистокинина
вклад в типичную ИР, связанную с ожирени
и др. [40]. Как анаболический гормон, инсулин
ем [39]. Контроль уровня глюкозы в крови в зна
способствует накоплению энергии (усвоению
чительной степени зависит от баланса между
глюкозы, аминокислот и жирных кислот), росту
инсулином и противоположными по действию
клеток и подавляет катаболические процессы -
гормонами, которые связываются с соответству
гликолиз, липолиз, протеолиз. Он оказывает на
ющими рецепторами в мышечной и жировой
ткани мишени как прямое, так и косвенное воз
ткани, а также в печени.
действие. Косвенные эффекты инсулина трудно
ИР способствует не только гипергликемии,
моделировать, так как они в значительной сте
но также гиперлипидемии [40]. Так как каждая
пени переплетаются с другими эффектами и за
из этих тем заслуживает отдельного обзора, в
висят от многих факторов. Изучены они хуже,
данной работе мы преимущественно сконцент
чем клеточно автономные проявления действия
рировались на нарушении метаболизма глюко
гормона, которые можно моделировать на кле
зы и развитии ИР (которые, в свою очередь,
точных культурах [39].
способствуют нарушению жирового и белково
Упрощённая схема метаболического
го обмена) и лишь коротко - на других видах
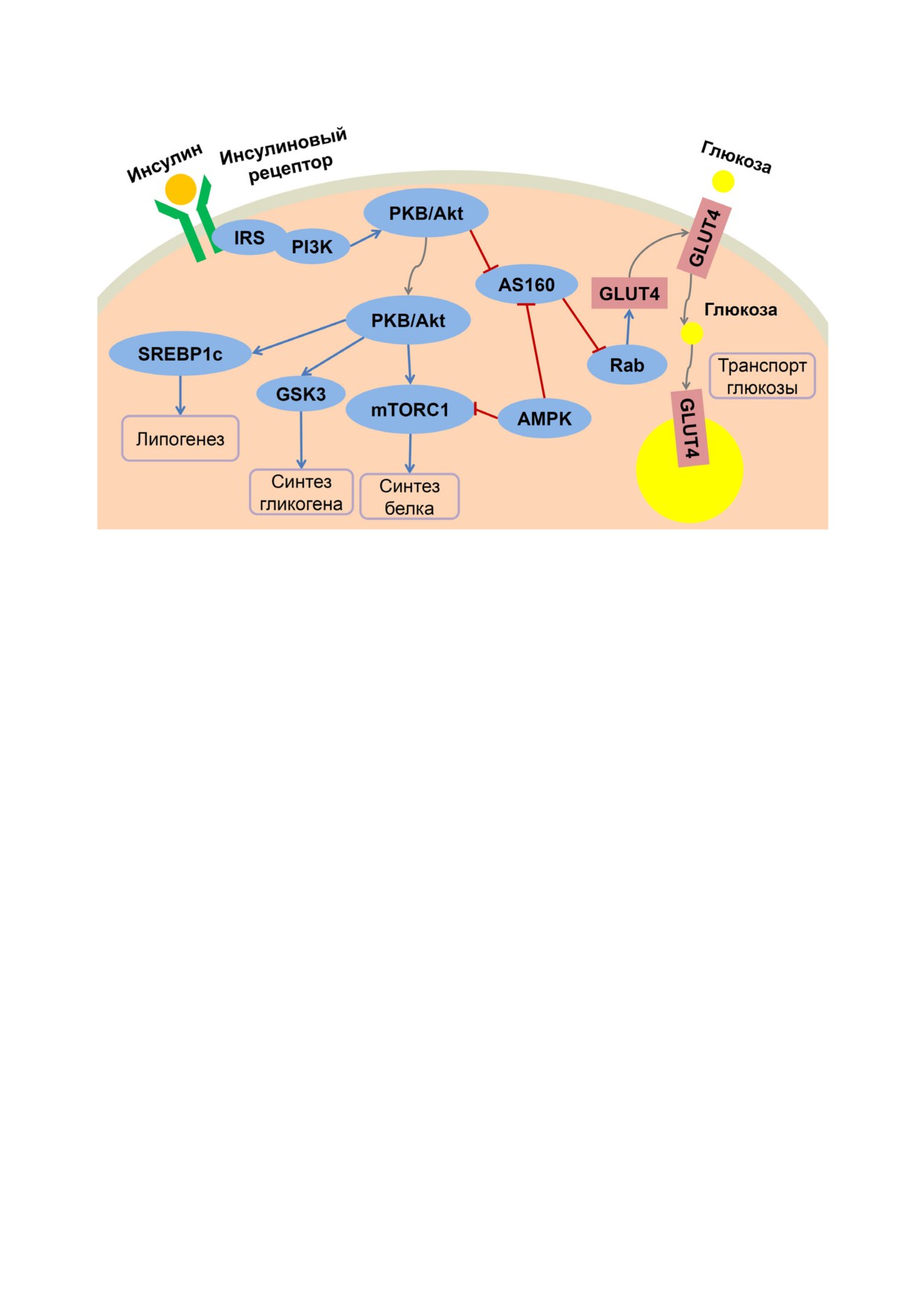
действия инсулина представлена на рисунке.
метаболических нарушений.
Инсулиновый рецептор (ИРец) состоит их двух
внеклеточных альфа субъединиц и двух внут
риклеточных бета субъединиц. ИРец за счёт
ВОЗРАСТНЫЕ МЕТАБОЛИЧЕСКИЕ
своей тирозинкиназной активности фосфори
НАРУШЕНИЯ В МИОЦИТАХ
лирует остатки тирозина на адаптерных белках
ПОПЕРЕЧНО4ПОЛОСАТЫХ МЫШЦ
из семейства субстратов ИРец (IRS, insulin
receptor substrate) и активирует PI3K. Из шести
Скелетная мускулатура наряду с жировой
членов семейства IRS, идентифицированных на
тканью играет крайне важную роль во многих
сегодняшний день, IRS 1 и IRS 2 ответственны
метаболических процессах, в том числе в регу
за большинство многочисленных эффектов ин
лировании уровня глюкозы в крови, определе
сулина, связанных с активацией двух основных
нии скорости метаболизма в покое, поддержа
БИОХИМИЯ том 86 вып. 10 2021
МЕТАБОЛИЧЕСКИЕ СЕНСОРЫ В ПОСТМИТОТИЧЕСКИХ КЛЕТКАХ
1535
Сигнальные пути инсулина. Метаболическая ветвь передачи сигнала инсулина осуществляется через активацию IRS
(субстратов инсулинового рецептора). После связывания со своим рецептором инсулин активирует IRS, а они, в свою
очередь, стимулируют активацию пути PI3K-PKB/Akt. Быстрые эффекты включают активацию синтеза гликогена и бел
ка, медленные эффекты - стимуляцию липогенеза. Стимуляция поглощения глюкозы инсулином происходит за счёт пе
ремещения содержащих GLUT4 запасных везикул к плазматической мембране. В случае активации AMPK тормозит син
тез белка и активирует транспорт глюкозы. Синие стрелки - активация, красные линии - ингибирование, серые стрел
ки - перемещение. AMPK - 5′ АМФ активируемая протеинкиназа; AS160 - субстрат Akt массой 160 кДа; GLUT4 - пе
реносчик глюкозы 4; GSK3β - киназа гликогенсинтазы 3β; IRS - субстраты инсулинового рецептора; mTORC1 - меха
нистическая мишень рапамицина - комплекс 1; PI3K - фосфоинозитол 3 киназа; PKB - протеинкиназа B; Rab - ГТФ
связывающий белок; SREBP1c - белок, связывающий регуляторный элемент стерола 1c
нии внутренней температуры тела и т.д. [43].
глощение большей части глюкозы после приёма
Мышцы составляют 40% от массы тела [44] и
пищи [46].
обеспечивают опосредованное поглощение
Как гормон хранения энергии, инсулин сти
60-70% инсулина, производимого организ
мулирует в миоцитах в первую очередь синтез
мом [45], поэтому неудивительно, что развитие
гликогена и, в меньшей степени, - глико
возрастных метаболических патологий во мно
лиз [39]. Нарушение способности клеток ске
гом связано с этой тканью. При появлении глю
летных мышц поглощать под воздействием ин
козы в крови инсулин стимулирует синтез гли
сулина глюкозу является основным компонен
когена в мышцах. Перенос глюкозы как в мы
том типичной ИР, связанной с ожирением и са
шечных, так и в жировых клетках осуществляет
харным диабетом второго типа (СДII). Индуци
ся с помощью GLUT4 [45]. GLUT4 зависит от
рованный инсулином синтез мышечного глико
инсулина и начинает работать только тогда, ког
гена почти на 50% нарушен у пациентов с СДII
да глюкозы достаточно, чтобы можно было на
и у худых здоровых инсулинорезистентных по
чать производство запасных метаболитов.
томков пациентов с СДII [39]. ИР в скелетных
Инсулинорезистентность в скелетных мышеч4
мышцах связана с дефектами на самых прокси
ных клетках. ИР в скелетных мышцах характе
мальных уровнях передачи сигналов инсулина -
ризуется сниженным инсулин стимулирован
ИРец, IRS 1, PI3K и PKB/Akt. При ИР мышеч
ным захватом глюкозы из за ухудшения переда
ных клеток одновременно обнаруживаются так
чи сигналов инсулина и подавления транслока
же дистальные дефекты, но всё ещё не вполне
ции GLUT4. ИР скелетных миоцитов способ
понятно, имеют ли такие дефекты независимое
ствует повышению постпрандиальных уровней
происхождение или являются просто вторичны
глюкозы и снижению толерантности к ней, так
ми по отношению к проксимальным дефек
как скелетная мускулатура ответственна за по
там [39]. Известно, что в патогенез ИР в печени
БИОХИМИЯ том 86 вып. 10 2021
1536
МОРГУНОВА и др.
и скелетных мышцах вовлечены также некото
мом пищи [54, 55]. Молекулярные часы скелет
рые липидные фрагменты
- диацилглице
ных мышц синхронизируются физической ак
рин (DAG, diacylglycerol), церамиды, ацилкар
тивностью [56, 57]. Метаболическое здоровье
нитины [47, 48].
является оптимальным, когда различные суточ
Проксимальные дефекты. В скелетных мыш
ные ритмы (включая поведенческие ритмы го
цах экспрессируются и IRS 1, и IRS 2. Однако
лодания питания и сна бодрствования), ритмы
на первичных мышечных трубках человека [49]
гормональной системы и вегетативной нервной
и на мышечных трубках L6 крыс [50] было по
системы, а также ритмы центральных и перифе
казано, что нокдаун только IRS'1 приводит к
рических часов колеблются синхронно друг с
нарушению инсулин стимулированного транс
другом. Напротив, несоответствие между неко
порта глюкозы. В скелетных мышцах экспрес
торыми компонентами этой системы - напри
сируются обе основные изоформы каталитичес
мер, между поведенческими и тканевыми рит
кой субъединицы PI3K и обе формы Akt. Так как
мами часов - может привести к нарушению
РНК интерференция Akt2 в первичных мышеч
циркадных ритмов и развитию ИР и СДII [46].
ных трубках человека отменяет стимулирован
Однако ещё не вполне понятно, нарушение ка
ные инсулином захват глюкозы и синтез глико
ких именно часов, центральных или перифери
гена, а нокдаун Akt1 не влияет на эти парамет
ческих, вызывает ИР на тканевом уровне. Кро
ры [49], можно предположить, что Akt2 более
ме того, могут быть задействованы оба механиз
важна для стимулированного инсулином мета
ма.
болизма глюкозы. Важность Akt2 для нормаль
Пролиферация в скелетной мускулатуре и свя4
ного действия инсулина подчёркивается иден
занная с возрастом потеря миоцитов. Миоциты
тификацией мутации частичной потери функ
скелетных мышц срастаются в многоядерное
ции в Akt2 (p.Pro50Thr), которая за редкими
мышечное волокно и уже не могут делиться.
исключениями встречается только у финского
У взрослого человека может пролиферировать
населения: частота
1,1% у финнов против
лишь небольшая популяция мышечных сател
0,02% у европейцев нефиннов. Мутация нару
литных клеток. Обычно покоящиеся сателлит
шает стимулируемое инсулином поглощение
ные клетки при повреждении мышцы активиру
глюкозы в мышечной и жировой ткани, увели
ются, после этого они делятся, дифференциру
чивает выработку эндогенной глюкозы и повы
ются и превращаются в новые миоядра, которые
шает, таким образом, риск развития СДII [51].
сливаются с уже существующими волокна
Ещё в 90 х гг. прошлого века с помощью магнит
ми [58]. Важную роль в обеспечении жизнеспо
но резонансной спектроскопии с использова
собности покоящихся сателлитных клеток и их
нием изотопов13C и31P было неоднократно по
подготовке к выходу из состояния покоя играет
казано, что транспорт глюкозы ответственен за
аутофагия [59]. Только при условии, что меха
снижение индуцированного инсулином синтеза
низм аутофагии не нарушен, возможна проли
гликогена в мышцах у пациентов с диабе
ферация в мышцах.
том [39]. Таким образом, дефекты затрагивают
Более высокая мышечная масса (относи
связывание инсулина с ИРец и транслока
тельно массы тела) связана с лучшей чувстви
цию GLUT4. Важно отметить, что в скелетных
тельностью к инсулину и меньшим риском раз
мышцах людей с ожирением или СДII не разви
вития преддиабета или явного СДII [60]. Мно
вается ИР к передаче митогенных сигналов че
гочисленные исследования показывают, что у
рез MAPK [52].
лиц, склонных к СДII, отсрочить развитие забо
Надо отметить, что печень и мышцы погло
левания можно за счёт физической нагруз
щают циркулирующие свободные жирные кис
ки [61-65], а у людей с уже развившимся диабе
лоты плазмы, из за чего происходит эктопичес
том с помощью физических тренировок удаётся
кое накопление липидов, которое также способ
улучшить ряд показателей, включая чувстви
ствует развитию ИР в печени и мышцах [53].
тельность к инсулину [66-68]. Существует об
В развитии ИР могут играть важную роль
ратная связь между силой мышц и смертностью
циркадные ритмы (и центральные, и перифери
от всех причин [69]. Также известно, что смерт
ческие), так как они координируют метаболизм
ность от всех причин снижают силовые трени
глюкозы [46]. В частности, периферические ча
ровки [70]. Мышечные масса и сила являются
сы в мышцах, жировой ткани и печени регули
важными защитными факторами против разви
руют их чувствительность к инсулину. Так как
тия одного из самых тяжёлых последствий ИР -
эти периферические часы не получают инфор
метаболического синдрома [71-73]. Вместе с
мацию о прямом освещении, они чувствитель
тем развитие атрофии и саркопении, напротив,
ны к другим синхронизаторам - например, к
способствует развитию ИР. Саркопения, не за
метаболическим сигналам, связанным с приё
висящая от ожирения, связана с нарушением
БИОХИМИЯ том 86 вып. 10 2021
МЕТАБОЛИЧЕСКИЕ СЕНСОРЫ В ПОСТМИТОТИЧЕСКИХ КЛЕТКАХ
1537
метаболизма глюкозы (важно, что особенно
ется за счёт подавления путей, активирующих
сильна эта связь у людей в возрасте до 60 лет).
митогенные эффекты (это приводит к умень
Это позволяет предположить, что низкая мы
шению вероятности развития рака), то в клини
шечная масса может быть ранним предиктором
ческих исследованиях мы видим, что качество и
предрасположенности к диабету [74]. У челове
продолжительность жизни людей зависят от ак
ка период пиковой активности опорно двига
тивности мышц и их массы, что не совместимо
тельной системы приходится на 20-30 лет, пос
с подавлением митогенных эффектов и сокра
ле этого мышцы начинают терять волокна [75],
щением потребления количества калорий. Вни
но это не так сильно отражается на их абсолют
мание этой проблеме уделили в своём обзоре
ной силе до 60 лет [43]. Пожилым людям свой
McLeod et al. [76]. Рапамицин тормозит анабо
ственна старческая саркопения, которая харак
лические процессы в мышцах молодых здоро
теризуется как снижением числа мышечных во
вых людей [86, 87]. Следовательно, он будет
локон (и типа I, и типа II), так и уменьшением
препятствовать сохранению здоровой мышеч
их размера и особенно - атрофией волокон вто
ной массы. Таким образом, данные, которые
рого типа [76, 77]. С возрастом уменьшается не
мы получаем в экспериментах на животных,
только количество, но и качество волокон. Так,
подвергнутых воздействию ингибиторов анабо
в лонгитудинальном исследовании на выборке,
лизма, не позволяют говорить о высоком каче'
состоящей из людей 70-79 лет, было показано,
стве их жизни. К тому же есть основания пола
что возрастное снижение силы мышц в этой
гать, что все существующие антимитогенные
возрастной группе может быть в несколько раз
эффекты способствуют ослаблению особей.
больше, чем снижение их массы [78].
В то же время снизить вероятность развития ра
Развитие ИР в мышцах, вероятно, также свя
ка у человека можно с помощью аэробных и си
зано с нарушением работы AMPK. Базальная
ловых физических нагрузок [88, 89]. Проверку
активность этой киназы в мышцах старых крыс
влияния тренировок можно также проводить и
ниже, чем в мышцах молодых [79]. Хотя в тка
на животных, как, например, в исследовании
нях пожилых людей повышено отношение
датских учёных, установивших, что у старых
АМФ/АТФ, чувствительность AMPK с возрас
мышей произвольный бег в колесе с высоким
том ухудшается [80]. AMPK активируется в мио
сопротивлением способствует сохранению мы
цитах при физической нагрузке. Низкомолеку
шечной массы на уровне, характерном для мы
лярные активаторы AMPK вызывают усиленное
шей среднего возраста, при этом волокна в
поглощение глюкозы и окисление жирных кис
мышцах по составу становятся более «окисли
лот как in vitro, так и на животных моделях [6, 81].
тельными» [90]. Животные модели должны
Важно отметить, что прямая фармакологичес
быть подобраны так, чтобы в них можно было
кая активация AMPK в печени не может вызвать
изучать влияние развития скелетных мышц на
резкое снижение уровня глюкозы в плазме, в то
продолжительность жизни. Хорошим приме
время как прямая её активация в мышцах способ
ром могут служить работы И.А. Аршавского, в
ствует усилению утилизации глюкозы. Это дела
которых путём целого ряда последовательных
ет AMPK перспективной мишенью для поиска
воздействий достигалась высокая степень раз
антидиабетических препаратов [6].
вития скелетных мышц у кроликов и других ла
Передача сигналов mTORC1 (но не mTORC2
бораторных животных, что способствовало уве
[82, 83]) очень важна для стимуляции роста
личению продолжительности и качества их
мышц. При этом краткосрочная активация при
жизни [91, 92]. По видимому, с учётом нынеш
водит к развитию мышечной гипертрофии [84],
них знаний о возрастных метаболических нару
а долгосрочная, напротив, способствует атро
шениях требуется проводить больше исследова
фии из за того, что такая активация подавляет
ний такого рода.
аутофагию [85]. Таким образом, для оптималь
Так как скелетная мускулатура является од
ного функционирования мышц необходимо че
ним из важных потребителей значительной час
редование периодов высокой и низкой актив
ти поступающей в организм энергии, её актив
ности mTORC1 (и, вероятно, AMPK), как это
ность (действующая так же, как ограничение ка
происходит при нормальном цикле питания го
лорийности питания) является необходимым
лодания [37].
условием для увеличения продолжительности
Наконец, существует некоторое противоре
жизни. Недостаточная же физическая актив
чие между тем, что мы получаем в эксперимен
ность приводит к накоплению избытка пита
тах на модельных животных объектах, и тем,
тельных веществ в организме, неизбежно прев
что видим в результатах эпидемиологических и
ращающегося в жир. Во избежание накопления
клинических исследований. Если у лаборатор
избыточного веса наряду с потреблением энер
ных животных продление жизни часто вызыва
гии необходим её постоянный расход.
БИОХИМИЯ том 86 вып. 10 2021
1538
МОРГУНОВА и др.
К сожалению, разобраться в возрастных ме
низме, оно тем не менее является инсулин
таболических нарушениях не так просто из за
чувствительным органом [101]. При нормальной
сложных причинно следственных связей, но
рабочей нагрузке этот орган вырабатывает энер
нам кажется, что более перспективным будет уг
гию в основном за счёт окисления жирных кис
лубление в изучение «антивозрастного» влия
лот, а точнее
- свободных жирных кис
ния физических нагрузок, а не миметиков огра
лот (СЖК); в меньшей степени - за счёт глико
ничения калорийности питания.
лиза, а также окисления пирувата и других
Другие метаболические нарушения в скелет4
субстратов, что изначально было показано на
ных мышцах. Необходимо отметить, что сарко
перфузируемых препаратах сердца крысы при
пения характеризуется нарушением протеолиза
аэробной перфузии [102]. В сердце взрослого че
и, как следствие, аберрантным обменом белков,
ловека СЖК также являются преобладающим
ухудшением функций митохондрий, воспалени
субстратом для производства АТФ (50-70% не
ями, нервно мышечной дегенерацией и т.д.
обходимого организму количества), но возмож
Кроме ИР существуют и другие метаболические
но использование и других субстратов - глюко
нарушения, которые приводят к развитию таких
зы и лактата (25-30%), аминокислот и кетоно
последствий. Например, было показано, что не
вых тел [38]. Интересно, что до 40% глюкоза
обходимый для стимулирования мышечных
опосредованного производства АТФ в сердце
стволовых клеток и восстановления повреждён
обеспечивается за счёт гликогена [103]. СЖК на
ных мышц простагландин E2 расщепляется под
рушают опосредованное инсулином потребле
воздействием 15 гидроксипростагландиндегид
ние глюкозы, ингибируют гликолиз и окисление
рогеназы в скелетных мышцах старых мышей.
пирувата, поэтому их высокий уровень тормозит
Избыточная экспрессия этого фермента у моло
передачу сигнала инсулина [101]. В кардиомио
дых мышей вызывает потерю мышечной массы,
цитах основным переносчиком глюкозы, как и в
а кратковременное его ингибирование у старых
миоцитах скелетной мускулатуры, является
мышей предотвращает истощение мышц [93].
GLUT4 [104], существует также базальное пог
Кроме метаболизма глюкозы для скелетных
лощение глюкозы сердцем через GLUT1, но оно
мышц также важен и обмен аминокислот. Заме
второстепенно [38]. Инсулин через PI3K и
нимые аминокислоты не стимулируют синтез
AMPK [101] стимулирует транслокацию GLUT4
мышечного белка [94], поэтому среди аминокис
в сарколемме кардиомиоцитов и одновременно
лот, оказывающих особое влияние на мышцы, в
ингибирует высвобождение СЖК из жировой
первую очередь важны незаменимые, особен
ткани. Таким образом, уровень потребления
но - лейцин. Он является одним из самых глав
глюкозы тесно связан с концентрацией цирку
ных стимулирующих факторов для активации
лирующих в крови СЖК. Специфическая диабе
пути mTORC1 - инициатора трансляции бел
тическая кардиомиопатия развивается на основе
ка [94, 95]. Он активирует синтез мышечного
дисбаланса между окислением липидов и окис
белка инсулинзависимым и инсулиннезависи
лением глюкозы. Этим объясняется и тот факт,
мым способом [96]. С возрастом мышцы стано
что довольно часто диабетическая дислипиде
вятся менее чувствительными к анаболическим
мия опережает СДII на несколько лет, т.е. нару
свойствам аминокислот [97], у пожилых людей
шение липидного обмена является ранним со
развивается так называемая анаболическая ре
бытием в развитии сердечно сосудистых заболе
зистентность к синтезу мышечного белка [98].
ваний при таком типе диабета [105]. В связи с
В связи с этим для достижения положительного
этим наиболее перспективным подходом к лече
эффекта тренировок пожилым людям необходи
нию диабетической кардиомиопатии, возможно,
мо принимать не только белковую пищу, но и до
будет восстановление баланса между окислени
полнительное количество лейцина [94, 95, 97].
ем липидов и окислением глюкозы [106].
Метаболические нарушения в кардиомиоци4
Чувствительность к инсулину значительно
тах. Сердце млекопитающих должно сокра
снижается в сердце при диабете как типа I, так и
щаться непрерывно, поэтому оно нуждается в
типа II [107]. При ИР сердце находится в среде
большом количестве энергии [99]. Кардиомио
богатой жирными кислотами и глюкозой, дос
циты являются клетками с самым высоким со
тупность субстратов превышает потребность в
держанием митохондрий (они занимают одну
синтезе АТФ [38, 99]. Однако использовать глю
треть объёма клетки) [100]. В сердце человека за
козу миоциты не могут, вследствие чего накап
один день перерабатывается количество АТФ,
ливаются промежуточные гликолитические
которое в 15-20 раз превышает его собственный
продукты и развивается глюкотоксичность [38].
вес [99].
Избыток инсулина при ИР способствует усиле
Хотя сердце представляет собой лишь вто
нию поглощения СЖК за счёт стимуляции про
ростепенное место утилизации глюкозы в орга
изводства белка CD36 (белок кластерной диф
БИОХИМИЯ том 86 вып. 10 2021
МЕТАБОЛИЧЕСКИЕ СЕНСОРЫ В ПОСТМИТОТИЧЕСКИХ КЛЕТКАХ
1539
ференцировки 36), способствующего их перено
на инсулин путём ингибирования этой петли от
су [108]. Сердце снижает свою способность ис
рицательной обратной связи [121]. Однако здесь
пользовать СЖК, но активизируется их достав
следует также разделить митогенные и метабо
ка и происходит накопление внутримиокарди
лические эффекты. На кардиомиоцитах было
альных липидов (церамидов, DAG, ацилкарни
показано, что ингибирование mTOR-p70S6K
тинов) [109]. В сердце накапливается большое
опосредованной петли отрицательной обратной
количество липидов [110], из за чего развивают
связи недостаточно для повышения чувстви
ся липотоксическая кардиомиопатия и сердеч
тельности к инсулину; и в сердце, вероятно, су
ная недостаточность, нарушаются функции ми
ществуют другие неизвестные пока что механиз
тохондрий, развиваются сократительные дис
мы повышения такой чувствительности и сти
функции и гипертрофия сердца [111-113].
муляции поглощения глюкозы под воздействи
Сердечно сосудистые осложнения, которые
ем AMPK [122]. Кроме того, AMPK может на
возникают при диабете, вызваны повышенной
прямую стимулировать поглощение глюкозы
активностью протеинкиназы C (PKC, protein
путём фосфорилирования и инактивации AS160
kinase C) [107]. Правильно будет говорить о це
[123], который является точкой пересечения
лом семействе изоферментов, различающихся
между сигнальными путями инсулина и AMPK
по функциям, особенностям активации и ткане
(рисунок).
вому распределению. В печени, мышцах и жи
ИР является фактором риска развития сер
ровой ткани PKC являются посредниками и ин
дечно сосудистых заболеваний, но и сердечная
гибиторами действия инсулина [107, 114]. Пере
недостаточность также может провоцировать
дачу сигналов рецептора инсулина подавляют
ИР (из за потери массы скелетных мышц и ма
DAG чувствительные изоформы PKC. Вероят
лоподвижного образа жизни, о которых мы пи
но, именно этот биохимический механизм свя
сали выше, а также из за гиперактивности сим
зывает резистентность к инсулину в мышцах с
патической нервной системы и ухудшения эн
нарушением регуляции метаболизма липи
дотелиальной функции). Таким образом, запус
дов [107, 114].
кается порочный круг, в котором сердечная не
СЖК могут подавлять передачу сигналов ин
достаточность и ИР усугубляют друг друга [38].
сулина через церамид на уровне PKB [115]. Ин
Также надо отметить, что, кроме всего прочего,
тересно, что дефекты мышечного ИРец, IRS,
дисфункция сердца при ожирении и сахарном
PI3K, PKB или aтипичных PKC вряд ли могут
диабете связана с повышенным потреблением
являться причиной наследственной мышеч
кислорода миокардом, снижением эффектив
ной ИР, так как отдельные дефекты в этих эле
ности работы сердца и повышенным окисли
ментах становятся причиной лишь редких слу
тельным стрессом [99].
чаев диабета. Искать причину необходимо, ве
Сердце обладает очень гибкой метаболичес
роятно, в специфических дефектах инсулин
кой системой, оно легко приспосабливается к
стимулированной транслокации GLUT4 [101].
потреблению тех субстратов, которые есть в
AMPK увеличивает чувствительность инсу
крови в изобилии. При физической нагрузке
лина к потреблению глюкозы в сердце. Она ре
увеличивается производство лактата скелетны
гулирует различные компоненты пути передачи
ми мышцами, в таких случаях сердце переклю
сигналов инсулина [116-118]. Подобно инсули
чается на его использование для получения
ну, AMPK стимулирует поглощение глюкозы и
энергии [124]. В свою очередь, продолжитель
гликолиз в сердце через регуляцию транслока
ное голодание или кетогенная диета увеличива
ции GLUT4 [116], но при этом противодейству
ют уровень кетоновых тел в крови, что приводит
ет стимулирующему влиянию инсулина на син
к усиленному использованию сердцем этого ис
тез белка, ингибируя mTOR и PKB/Akt опосре
точника энергии [99]. Кроме того, кетоновые
дованную активацию рибосомной киназы
тела используются сердцем в качестве источни
p70S6K (p70S6 kinase) и фосфорилирование эу
ка для аэробного производства АТФ при сердеч
кариотического фактора элонгации 2 [41, 119].
но сосудистых заболеваниях [125]. Считается,
Инсулин, в свою очередь, также противодей
что кетоновые тела не могут обеспечить сердце
ствует передаче сигналов AMPK. Активирован
необходимым количеством энергии, однако бы
ная PKB/Akt может фосфорилировать AMPK и
ло показано, что циклическая кетогенная диета
таким образом подавлять индуцированную
помогает старым мышам сохранять «молодой
ишемией активацию AMPK [120].
фенотип» сердца [126]. Кетогенная диета (с низ
После активации инсулином mTOR-p70S6K
ким содержанием углеводов и высоким содер
фосфорилирует IRS 1 по остаткам серина, что
жанием жиров и белков) увеличивает продол
приводит к его ингибированию и ухудшению
жительность жизни мышей [127]. У людей крат
передачи сигналов инсулина. AMPK действует
косрочная и среднесрочная низкокалорийная
БИОХИМИЯ том 86 вып. 10 2021
1540
МОРГУНОВА и др.
кетогенная диета помогает бороться с избыточ
ротрофическое влияние на периферические
ным весом и снижает факторы риска сердечно
нейроны [134]. ИРец экспрессируются во всех
сосудистых и нейродегенеративных заболева
типах клеток головного мозга, но неравномер
ний, однако неизвестно, какие последствия мо
но. Наиболее высокая плотность ИРец наблю
гут быть у такой диеты в долгосрочной перспек
дается в обонятельной луковице, гипоталамусе,
тиве и подобных данных пока что мало [128].
гиппокампе, коре головного мозга (верхние об
Эффект кетогенной диеты может быть опосре
ласти коры особенно чувствительны к инсули
дован подавлением передачи сигналов инсулина
ну), полосатом теле, мозжечке и промежуточ
и пути mTOR [129].
ной доле гипофиза [135-137]. В нейронах ИРец
и IRS экспрессируются и в теле клетки, и на ак
сонах [42]. ИРец в большом количестве содер
МЕТАБОЛИЧЕСКИЕ НАРУШЕНИЯ
жатся на пресинаптической и постсинаптичес
В НЕЙРОНАХ
кой мембране [40] (особенно высока концентра
ция рецепторов в постсинаптической мембра
Проявления возрастных патологий, связанных
не [138]). Количество ИРец в головном мозге
с инсулинорезистентностью, в нейронах. Инсулин
уменьшается с возрастом [139].
вызывает множество метаболических, синапти
В нейронах основным переносчиком глюко
ческих, нейрональных и поведенческих эффек
зы является независимый от инсулина GLUT3,
тов в мозге. Эти эффекты влияют на пищевое
а в сосудах гематоэнцефалического барьера и
поведение (ИР в мозге, вероятно, может способ
глие - базальный переносчик GLUT1, оба обла
ствовать увеличению веса [130]), периферичес
дают высоким сродством к глюкозе, что позво
кий метаболизм и даже когнитивные способ
ляет обеспечивать мозг глюкозой, даже когда её
ности [28, 131]. Старение, ожирение, СДII и де
уровень в крови низкий [45]. При гипогликемии
менция приводят к нарушениям действия инсу
клетки глии поглощают глюкозу через GLUT1,
лина в ЦНС. СДII существенно увеличивает
перерабатывают её до лактата и уже этот альтер
риск нейродегенеративных деменций позднего
нативный источник энергии транспортируют к
возраста и особенно болезни Альцгеймера [40].
нейронам («лактатный челнок») [140, 141]. Счи
Кроме того, есть основания полагать, что в ней
тается, что данный процесс запускается, когда
ронах, наряду с миоцитами и адипоцитами, раз
мозгу нужно много энергии, однако его вклад в
вивается индуцированная гиперинсулинемией
обеспечение мозга питательными веществами
ИР [42, 132]. Таким образом, ИР в ЦНС может
всё ещё не определён [40]. Помимо GLUT3, в
быть патологическим признаком, а в некоторой
мозге также экспрессируется регулируемый ин
степени и причиной метаболических и когни
сулином GLUT4. Считается, что GLUT4 есть в
тивных дисфункций.
тех областях мозга, которые отвечают за когни
Наблюдается общая тенденция к снижению
тивные способности (передний мозг, гиппо
с возрастом модулирующих влияний предшест
камп, миндалина, кора головного мозга и моз
вующего приёма пищи на активность различ
жечок [142]), так как в таких областях требуется
ных областей мозга, вызванную пищевыми сиг
больший приток глюкозы из за высокой мета
налами [133]. На пищевое поведение влияют
болической потребности, развивающейся при
мозговые сети, отвечающие за аппетит, гедо
обучении [40].
низм, настроение и память, они сопоставляют
Циркулирующий в крови инсулин связыва
внешние раздражители и внутренние физиоло
ется с рецепторами на эндотелиальных клетках
гические потребности. Исследования пищевого
гематоэнцефалического барьера, откуда он да
поведения показывают, что введение инсулина в
лее транспортируется в интерстициальную
желудочки мозга препятствует потреблению пи
жидкость головного мозга [143]. При ИР сни
щи и снижает массу тела. Вероятно, множество
жается активность транспорта инсулина через
поведенческих и метаболических эффектов ин
гематоэнцефалический барьер, также на транс
сулина в мозге связано с его влиянием на систе
порт инсулина влияют сахарный диабет, ожире
му подкрепления, гомеостатический и когни
ние, воспаление, гликемия и уровни циркули
тивный контроль [28].
рующих в крови триглицеридов [40]. Инсулин
Нейроны чувствительны к инсулину, при
связывается со своими многочисленными ре
этом в головном мозге, как и в поджелудочной
цепторами, расположенными в разных разделах
железе, уровень экспрессии инсулиновых ре
головного мозга, в том числе обонятельной лу
цепторов намного ниже, чем в типичных инсу
ковице, коре головного мозга, гиппокампе, ги
лин чувствительных тканях, а действие инсули
поталамусе, миндалине и др. [28]. После связы
на на эти органы обычно не метаболичес
вания со своим рецептором, как и в перифери
кое [131]. В частности, инсулин оказывает ней
ческих тканях, инсулин индуцирует тирозинки
БИОХИМИЯ том 86 вып. 10 2021
МЕТАБОЛИЧЕСКИЕ СЕНСОРЫ В ПОСТМИТОТИЧЕСКИХ КЛЕТКАХ
1541
назную активность, вследствие чего происходит
[117, 147], за счёт чего увеличиваются скорость
аутофосфорилирование рецептора, а также
утилизации глюкозы и продукция АТФ.
фосфорилирование тирозиновых остатков IRS.
Как и в случае с мышцами, для нервных кле
IRS 1 и IRS 2 активируют метаболический и
ток важен метаболизм аминокислот. Например,
митогенный сигнальные пути. Обе формы IRS
незаменимая аминокислота триптофан является
экспрессируются в нейронах и в астроци
единственным предшественником серотонина.
тах [40]. ИР в нейронах может развиваться через
Метаболизм этой аминокислоты может иметь
гиперинсулинемию и нарушение PKB/Akt пу
большое значение для пожилых людей, даже
ти [132]. Снижение передачи сигналов PKB/Akt
несмотря на то, что для синтеза белка использу
является общим признаком нейрональной дис
ется менее 1% пищевого триптофана [148]. По
функции. Существует гипотеза, согласно кото
требление этой аминокислоты является яркой
рой ИР ускоряет появление дисфункции ней
иллюстрацией тесной связи мышечной и нерв
ронов, не позволяя им реагировать на нейрот
ной систем. Умеренные физические упражне
рофическое действие инсулина и делая их более
ния стимулируют метаболизм триптофана, по
восприимчивыми к различным повреждающим
тому что мышцы активно используют амино
стимулам [42].
кислоты с разветвлённой цепью, вследствие че
Так как исследований, посвящённых ИР
го он становится более доступным для моз
нейронов, очень мало, ещё многое в этой облас
га [75]. Регулярные упражнения на выносли
ти непонятно. Очень сложно разделить ИР в
вость могут быть рекомендованы даже лицам с
нейронах и в глие [42]. Глия может оказывать
депрессивными расстройствами, так как они
значительное влияние на ИР нейронов.
вызывают увеличение экспрессии кинуренин
Другие возрастные метаболические нарушения
аминотрансферазы в скелетных мышцах, что
в нейронах. Если для развития мышц важен
переключает метаболизм кинуренина на произ
только mTORC1, то для развития мозга важны
водство кинурениновой кислоты, которая не
оба комплекса [37]. mTOR участвует в самых
проходит через гематоэнцефалический барьер.
разных процессах в мозге, например, в нейрон
Это предотвращает нарушение нервной плас
ном контроле питания, а дисфункция пути
тичности. Что же касается ограничения энер
mTOR может привести к развитию нейродегене
гии, то оно, напротив, приводит к низкому
ративных заболеваний, аутизму и эпилеп
уровню триптофана, а это влечёт за собой нару
сии [144].
шения в метаболизме серотонина [149]. Одной
AMPK является крайне важным метаболи
только диетой с высоким содержанием белка
ческим датчиком в ЦНС. В мозге она активиру
нельзя получить больше триптофана, так как в
ется в условиях нехватки энергии, вызванных
этом случае его доступность для мозга окажется
гипоксией, голоданием и ишемическим инсуль
парадоксальным образом сниженной из за кон
том. AMPK участвует в регуляции энергетичес
куренции с другими крупными нейтральными
кого баланса не только отдельных клеток (авто
аминокислотами за транспорт через гематоэн
номная регуляция), она также может оказывать
цефалический барьер [148]. Таким образом, вы
влияние на пищевое поведение через гипотала
сокое потребление белка без тренировок огра
мус (системная регуляция), так как её актива
ничивает доступность триптофана, что может
цию могут вызывать не только физиологические
дополнительно влиять на синтез серотонина и
стимулы, но и гормональные сигналы. Систем
нарушать познавательные способности, память,
ная регуляция работает в том числе и у беспоз
настроение и сон, а это, в конечном итоге, уве
воночных; например, тканеспецифичная ней
личивает риск развития деменции [148].
рональная активация AMPK у дрозофилы не
Возрастная потеря нейронов. Количество
только индуцирует аутофагию в мозге, но и
нервных клеток, как и мышечных волокон,
улучшает гомеостаз тканей кишечника
[5].
уменьшается c возрастом. Более того, потеря
Действие AMPK направлено на защиту клеток
мышечных волокон связана с потерей иннерви
мозга от нехватки энергии, однако избыточная
рующих их моторных нейронов [43]. Несмотря
или чрезмерная её активация может приводить к
на постоянную гибель нейронов, заметным со
негативным последствиям [31, 145]. Некоррект
кращение их числа становится только в поздние
ная регуляция AMPK связана с такими заболе
возрастные периоды, когда начинают прояв
ваниями головного мозга, как болезнь Альцгей
ляться функциональные нарушения
[150].
мера, болезнь Паркинсона, болезнь Хантингто
В вентральных корешках спинного мозга у чело
на, боковой амиотрофический склероз и ин
века обнаруживается уменьшение не только ко
сульт [146]. Одним из метаболических эффектов
личества миелинизированных нервных воло
AMPK в мозге может быть её свойство способ
кон, но и их диаметра [151, 152]. Уменьшение
ствовать экспрессии GLUT4 или GLUT1
количества миелинизированных волокон со
БИОХИМИЯ том 86 вып. 10 2021
1542
МОРГУНОВА и др.
ставляет около 5% за десятилетие [151]. Количе
ние клеточного старения, при котором изучают
ство двигательных нейронов в пояснично
так называемые «сенесцентные» клетки (модель
крестцовых сегментах спинного мозга здоровых
Хейфлика [167] и модель стресс индуцирован
людей после 60 лет может составлять пример
ного преждевременного старения [168]), крайне
но 50% от этого показателя в молодом и среднем
полезно для изучения старения клеток организ
возрасте [153]. Возрастная потеря нейронов
ма, способных к пролиферации и обновлению в
происходит также в отдельных ганглиях (напри
течение всей жизни организма. К ним примени
мер, в вестибулярном ганглии [154, 155]) и в раз
ма концепция Campisi [169] о том, что клетки
ных отделах головного мозга (например, в гип
переходят в сенесцентное состояние, чтобы не
покампе [156], в стволе мозга и мозжечке [155],
стать раковыми. Высокодифференцированные
в коре больших полушарий [157, 158], в минда
нейроны и миоциты во взрослом организме не
левидном теле [159] и в таламусе [160]). В опытах
способны делиться и не превращаются в рако
на крысах было установлено, что прогрессирую
вые, поэтому для моделирования их старения
щая потеря нейронов во всех структурах начи
должна, вероятно, существовать другая модель.
нается не в позднем возрасте, а после 3 мес. жиз
Считается, что старение таких тканей можно
ни, когда происходит завершение подростково
изучать с помощью модели хронологического
го периода у крыс [150].
старения (преимущественно на дрожжах) или
Надо отметить, что в разных отделах голов
«стационарного» старения применительно к
ного мозга потери различаются: какие то из них
клеткам животных или человека
[9,
14,
почти не теряют клетки, в то время как в других
170-173], которое изучается в течение долгого
такие потери могут быть весьма большими. До
времени в нашей лаборатории. Хронологичес
вольно часто встречаются работы, в которых со
кое старение подразумевает остановку пролифе
общается о том, что у людей и животных без
рации тем или иным способом и последующее
нейродегенеративных заболеваний возрастная
определение выживаемости клеток при дли
потеря нейронов преувеличена, а уменьшение
тельном их пребывании в стационарной фазе.
объёма тех или иных отделов может происхо
Конечно же, у такого подхода очень много не
дить лишь из за сокращения числа отростков
достатков, но лучший вариант пока не приду
нервных клеток и межклеточных контак
ман, и, кроме того, с помощью этих моделей
тов [161-164]. В некоторых работах даже сооб
действительно получают данные [15-17], соот
щается, что с возрастом погибает гораздо боль
ветствующие данным на животных. Наиболее
ше глиальных клеток, чем нервных [165], одна
адекватными, на наш взгляд, станут такие моде
ко в других исследованиях обнаруживают, что
ли, в которых будут использованы клетки жи
глиальных клеток с возрастом может стать боль
вотных и человека с вызванной у них терми
ше [166]. Методическая сложность количест
нальной дифференцировкой, хотя это потребует
венной оценки, а также сложность устройства
больших финансовых затрат. Таким образом, се
мозга и необходимость сравнения лишь данных
несцентные клетки могут влиять на выживае
поперечных исследований (а в случае с людь
мость высокодифференцированных клеток, но
ми - ещё и недостаточно большие выборки), ве
последние стареют, вероятно, не так, как пер
роятно, пока не позволяют определить очень
вые, хотя общие черты, скорее всего, будут
точно, как всё таки меняется количество нейро
прослеживаться. Для высокодифференцирован
нов и глиальных клеток в мозге. Однако даже ес
ных клеток большое значение имеет аутофагия,
ли падает количество нейронов лишь в некото
так как обновление компонентов клетки воз
рых отделах и частях мозга, то это всё равно на
можно только за счёт неё [77, 174]. Популяция
рушает его работу и способствует развитию ког
же делящихся клеток может избегать накопле
нитивных нарушений.
ния дефектов, которые появляются со временем
в постмитотических дифференцированных
клетках, за счёт замены накопивших поврежде
О КЛЕТОЧНЫХ МОДЕЛЯХ
ния старых клеток новыми (как, например, в
ДЛЯ ИЗУЧЕНИЯ СТАРЕНИЯ
эпителии кишечника). Видимо, с этим и связан
ПОСТМИТОТИЧЕСКИХ КЛЕТОК
тот факт, что липофусцин наиболее заметно
откладывается в постмитотических высокодиф
Хотелось бы также кратко коснуться герон
ференцированных клетках - нервных и мышеч
тологических исследований метаболических
ных [175], но не в активно пролиферирующих
процессов в экспериментах на культивируемых
(исключение составляют клетки кожи). Однако
клетках. Существует несколько моделей клеточ
в случае со скелетными мышцами обнаружива
ного старения, и все они имеют свои преимуще
ется, что пролиферирующим сателлитным клет
ства и недостатки. На наш взгляд, моделирова
кам мышц также нужна аутофагия (о чём уже
БИОХИМИЯ том 86 вып. 10 2021
МЕТАБОЛИЧЕСКИЕ СЕНСОРЫ В ПОСТМИТОТИЧЕСКИХ КЛЕТКАХ
1543
было сказано выше), что может свидетельство
нарушение эндотелий зависимой вазодилата
вать о некотором сходстве процессов деграда
ции, увеличение жёсткости сосудов, избыточ
ции клеток в моделях пролиферативного и хро
ное влияние симпатической нервной системы,
нологического/стационарного старения.
изменения метаболического или миогенного
контроля, снижение эффективности насоса ске
летных мышц [178]. Понять, что первично, а что
ЗАКЛЮЧЕНИЕ
вторично, и установить причинно следствен
ные связи очень сложно. Судя по всему, все эти
Всё изложенное выше тем не менее ничего
нарушения связаны между собой и могут разви
не говорит нам о том, что первично - наруше
ваться параллельно. Нам кажется, что рассмот
ния в самих постмитотических клетках или на
ренные в настоящем обзоре геронтологические
рушения в окружении этих клеток и принося
аспекты возникновения ИР и её последствий
щих кровь сосудах. Влияние на нейроны и мио
являются хорошей иллюстрацией очень слож
циты могут оказывать сенесцентные клетки из
ного характера взаимосвязи различных возраст
окружающих обновляющихся тканей. Пробле
ных метаболических нарушений.
мы могут возникать в органах, состоящих из
постмитотических клеток, вторично: из за ате
росклероза сосудов нарушается кровоснабже
Финансирование. Работа выполнена при фи
ние мозга, из за кальцификации - перфузия
нансовой поддержке Российского фонда фунда
скелетных мышц [176] и т.п. Известно, что нару
ментальных исследований в рамках научного
шение кровообращения головного мозга явля
проекта № 20 14 50394.
ется фактором, предрасполагающим к развитию
Конфликт интересов. Авторы заявляют об от
болезни Альцгеймера [177]. Кровообращение в
сутствии конфликта интересов.
мышцах ухудшается с возрастом, а именно: на
Соблюдение этических норм. Работа выпол
рушается способность сосудов расширяться.
нена без использования животных и без привле
Это может происходить по разным причинам:
чения людей в качестве испытуемых.
СПИСОК ЛИТЕРАТУРЫ
1.
McCay, C. M., Crowell, M. F., and Maynard, L. A. (1935)
pan, Mech. Ageing Dev., 131, 463 472, doi: 10.1016/j.mad.
The effect of retarded growth upon the length of life span
2010.03.010.
and upon the ultimate body size, J. Nutr., 10, 63 79,
9. Leontieva, O. V., and Blagosklonny, M. V. (2011) Yeast like
doi: 10.1093/jn/10.1.63.
chronological senescence in mammalian cells: pheno
2.
Lane, M. A., Ingram, D. K., and Roth, G. S. (1997)
menon, mechanism and pharmacological suppression,
Beyond the rodent model: calorie restriction in rhesus
Aging (Albany N.Y.), 3, 1078 1091, doi: 10.18632/aging.
monkeys, Age, 20, 45 56, doi: 10.1007/s11357 997 0004
100402.
2.
10. Morgunova, G. V., Klebanov, A. A., Marotta, F., and
3.
Martin Montalvo, A., Mercken, E. M., Mitchell, S. J.,
Khokhlov, A. N. (2017) Culture medium pH and stationary
Palacios, H. H., Mote, P. L., et al. (2013) Metformin
phase/chronological aging of different cells, Moscow Univ.
improves healthspan and lifespan in mice, Nat. Commun.,
Biol. Sci. Bull., 72, 47 51, doi: 10.3103/S0096392517020109.
4, 2192, doi: 10.1038/ncomms3192.
11. Khokhlov, A. N. (2018) Cell kinetic approaches to the
4.
Colman, R. J., Beasley, T. M., Kemnitz, J. W., Johnson,
search for anti aging drugs: Thirty years after, Moscow
S. C., Weindruch, R., and Anderson, R. M. (2014) Caloric
Univ. Biol. Sci. Bull.,
73,
185190, doi:
10.3103/
restriction reduces age related and all cause mortality in
S0096392518040041.
rhesus
monkeys, Nat. Commun.,
5,
3557,
12. Khokhlov, A. N., Morgunova, G. V., and Klebanov, A. A.
doi: 10.1038/ncomms4557.
(2019) Demographic approaches to the study of aging on
5.
Ulgherait, M., Rana, A., Rera, M., Graniel, J., and
cell cultures, Moscow Univ. Biol. Sci. Bull., 74, 262 267,
Walker, D. W. (2014) AMPK modulates tissue and organis
doi: 10.3103/S0096392519040060.
mal aging in a non cell autonomous manner, Cell Rep., 8,
13. Sampaio Marques, B., Burhans, W. C., and Ludovico, P.
1767 1780, doi: 10.1016/j.celrep.2014.08.006.
(2019) In Yeasts in biotechnology and human health.
6.
Cokorinos, E. C., Delmore, J., Reyes, A. R.,
Progress in molecular and subcellular biology (Sá Correia I.,
Albuquerque, B., Kjøbsted, R., et al. (2017) Activation of
ed.) Vol. 58, Springer, Cham, pp. 217 242.
skeletal muscle AMPK promotes glucose disposal and glu
14. Yang, Y., Santos, A. L., Xu, L., Lotton, C., Taddei, F., and
cose lowering in non human primates and mice, Cell
Lindner, A. B. (2019) Temporal scaling of aging as an adap
Metab., 25, 1147 1159, doi: 10.1016/j.cmet.2017.04.010.
tive strategy of Escherichia coli, Sci. Adv., 5, eaaw2069,
7.
Amara, C. E., Shankland, E. G., Jubrias, S. A., Marcinek,
doi: 10.1126/sciadv.aaw2069.
D. J., Kushmerick, M. J., and Conley, K. E. (2007) Mild
15. Powers, R. W., Kaeberlein, M., Caldwell, S. D., Kennedy,
mitochondrial uncoupling impacts cellular aging in human
B. K., and Fields, S. (2006) Extension of chronological life
muscles in vivo, Proc. Natl. Acad. Sci. USA, 104, 1057
span in yeast by decreased TOR pathway signaling, Genes
1062, doi: 10.1073/pnas.0610131104.
Dev., 20, 174 184, doi: 10.1101/gad.1381406.
8.
Mookerjee, S. A., Divakaruni, A. S., Jastroch, M., and
16. Alvers, A. L., Wood, M. S., Hu, D., Kaywell, A. C., Dunn,
Brand, M. D. (2010) Mitochondrial uncoupling and lifes
Jr, W. A., and Aris, J. P. (2009) Autophagy is required for
БИОХИМИЯ том 86 вып. 10 2021
1544
МОРГУНОВА и др.
extension of yeast chronological life span by rapamycin,
33.
Sarbassov, D. D., Ali, S. M., and Sabatini, D. M. (2005)
Autophagy, 5, 847 849, doi: 10.4161/auto.8824.
Growing roles for the mTOR pathway, Curr. Opin. Cell
17.
Wierman, M. B., Maqani, N., Strickler, E., Li, M., and
Biol., 17, 596 603, doi: 10.1016/j.ceb.2005.09.009.
Smith, J. S. (2017) Caloric restriction extends yeast
34.
Harrison, D. E., Strong, R., Sharp, Z. D., Nelson, J. F.,
chronological lifespan by optimizing the Snf1 (AMPK) sig
Astle, C. M., et al. (2009) Rapamycin fed late in life
naling pathway, Mol. Cell Biol.,
37, e00562 16,
extends lifespan in genetically heterogeneous mice,
doi: 10.1128/MCB.00562 16.
Nature, 460, 392 395, doi: 10.1038/nature08221.
18.
Krejč , A. (2012) Metabolic sensors and their interplay with
35.
Bjedov, I., Toivonen, J. M., Kerr, F., Slack, C.,
cell signalling and transcription, Biochem. Soc. Trans., 40,
Jacobson, J., et al. (2010) Mechanisms of life span exten
311 323, doi: 10.1042/BST20110767.
sion by rapamycin in the fruit fly Drosophila melanogaster,
19.
Sperling, M. A., Ganguli, S., Leslie, N., and Landt, K.
Cell Metab., 11, 35 46, doi: 10.1016/j.cmet.2009.11.010.
(1984) Fetal perinatal catecholamine secretion: role in peri
36.
Robida Stubbs, S., Glover Cutter, K., Lamming, D. W.,
natal glucose homeostasis, Am. J. Physiol. Endocrinol. Metab.,
Mizunuma, M., Narasimhan, S. D., et al. (2012) TOR sig
247, E69 E74, doi: 10.1152/ajpendo.1984.247.1.E69.
naling and rapamycin influence longevity by regulating
20.
Hellström, A., Ley, D., Hansen Pupp, I., Hallberg, B.,
SKN 1/Nrf and DAF 16/FoxO, Cell Metab., 15, 713 724,
Ramenghi, L. A., et al. (2016) Role of insulinlike growth
doi: 10.1016/j.cmet.2012.04.007.
factor 1 in fetal development and in the early postnatal life
37.
Saxton, R. A., and Sabatini, D. M. (2017) mTOR signaling
of premature infants, Am. J. Perinatol., 33, 1067 1071,
in growth, metabolism, and disease, Cell, 168, 960 976,
doi: 10.1055/s 0036 1586109.
doi: 10.1016/j.cell.2017.02.004.
21.
Jousse, C., Parry, L., Lambert Langlais, S., Maurin, A. C.,
38.
Ormazabal, V., Nair, S., Elfeky, O., Aguayo, C.,
Averous, J., et al. (2011) Perinatal undernutrition affects
Salomon, C., and Zuñiga, F. A. (2018) Association
the methylation and expression of the leptin gene in adults:
between insulin resistance and the development of cardio
implication for the understanding of metabolic syndrome,
vascular disease, Cardiovasc. Diabetol.,
17,
122,
FASEB J., 25, 3271 3278, doi: 10.1096/fj.11 181792.
doi: 10.1186/s12933 018 0762 4.
22.
Li, Y., Jaddoe, V. W., Qi, L., He, Y., Wang, D., et al. (2011)
39.
Petersen, M. C., and Shulman, G. I. (2018) Mechanisms
Exposure to the Chinese famine in early life and the risk of
of insulin action and insulin resistance, Physiol. Rev., 98,
metabolic syndrome in adulthood, Diabetes Care, 34,
2133 2223, doi: 10.1152/physrev.00063.2017.
1014 1018, doi: 10.2337/dc10 2039.
40.
Arnold, S. E., Arvanitakis, Z., Macauley Rambach, S. L.,
23.
Marciniak, A., Patro Małysza, J., Kimber Trojnar, Ż.,
Koenig, A. M., Wang, H. Y., et al. (2018) Brain insulin
Marciniak, B., Oleszczuk, J., and Leszczyńska
resistance in type 2 diabetes and Alzheimer disease: con
Gorzelak, B. (2017) Fetal programming of the metabolic
cepts and conundrums, Nat. Rev. Neurol., 14, 168 181,
syndrome, Taiwan. J. Obstet. Gynecol., 56, 133138,
doi: 10.1038/nrneurol.2017.185.
doi: 10.1016/j.tjog.2017.01.001.
41.
Bertrand, L., Horman, S., Beauloye, C., and
24.
Zabuga, O. G., and Vaiserman, A. M. (2017) Malnutrition
Vanoverschelde, J. L. (2008) Insulin signalling in the heart,
in early life and risk of type 2 diabetes: theoretical frame
Cardiovasc. Res., 79, 238 248, doi: 10.1093/cvr/cvn093.
work and epidemiological evidence, Moscow Univ. Biol.
42.
Kim, B., and Feldman, E. L. (2012) Insulin resistance in
Sci. Bull., 72, 37 46, doi: 10.3103/S0096392517020067.
the nervous system, Trends Endrocrinol. Metab., 23, 133
25.
Vaiserman, A. M. (2018) Birth weight predicts aging trajec
141, doi: 10.1016/j.tem.2011.12.004.
tory: a hypothesis, Mech. Ageing Dev., 173, 6170,
43.
Vandervoort, A. A. (2002) Aging of the human neuromus
doi: 10.1016/j.mad.2018.04.003.
cular
system,
Muscle
Nerve,
25,
1725,
26.
Yan, S., Hou, W., Wu, H., Jiang, W., Li, Y., et al. (2020)
doi: 10.1002/mus.1215.
Prenatal exposure to the Chinese famine and the risk of
44.
Frontera, W. R., and Ochala, J. (2015) Skeletal muscle: a
metabolic syndrome in adulthood across consecutive gen
brief review of structure and function, Calcif. Tissue Int.,
erations, Eur. J. Clin. Nutr., 74, 1229 1236, doi: 10.1038/
96, 183 195, doi: 10.1007/s00223 014 9915 y.
s41430 020 0561 3.
45.
Wilcox, G. (2005) Insulin and insulin resistance, Clin.
27.
Vogt, M. C., Paeger, L., Hess, S., Steculorum, S. M.,
Biochem. Rev., 26, 19 39.
Awazawa, M., et al. (2014) Neonatal insulin action impairs
46.
Stenvers, D. J., Scheer, F. A., Schrauwen, P., la Fleur,
hypothalamic neurocircuit formation in response to mater
S. E., and Kalsbeek, A. (2019) Circadian clocks and insulin
nal high fat feeding, Cell, 156, 495 509, doi: 10.1016/
resistance, Nat. Rev. Endocrinol., 15, 75 89, doi: 10.1152/
j.cell.2014.01.008.
physrev.00032.2015.
28.
Kullmann, S., Heni, M., Hallschmid, M., Fritsche, A.,
47.
Chavez, J. A., and Summers, S. A. (2012) A ceramide cen
Preissl, H., and Häring, H. U. (2016) Brain insulin resis
tric view of insulin resistance, Cell Metab., 15, 585 594,
tance at the crossroads of metabolic and cognitive disorders
doi: 10.1016/j.cmet.2012.04.002.
in humans, Physiol. Rev., 96, 1169 1209, doi: 10.1152/
48.
Muoio, D. M., and Neufer, P. D. (2012) Lipid induced
physrev.00032.2015.
mitochondrial stress and insulin action in muscle, Cell
29.
Hardie, D. G., Schaffer, B. E., and Brunet, A. (2016)
Metab., 15, 595 605, doi: 10.1016/j.cmet.2012.04.010.
AMPK: an energy sensing pathway with multiple inputs
49.
Bouzakri, K., Zachrisson, A., Al Khalili, L., Zhang, B. B.,
and outputs, Trends Cell Biol., 26, 190 201, doi: 10.1016/
Koistinen, H. A., et al. (2006) siRNA based gene silencing
j.tcb.2015.10.013.
reveals specialized roles of IRS 1/Akt2 and IRS 2/Akt1 in
30.
Jeon, S. M. (2016) Regulation and function of AMPK in
glucose and lipid metabolism in human skeletal muscle,
physiology and diseases, Exp. Mol. Med., 48, e245,
Cell Metab., 4, 89 96, doi: 10.1016/j.cmet.2006.04.008.
doi: 10.1038/emm.2016.81.
50.
Huang, C., Thirone, A. C., Huang, X., and Klip, A. (2005)
31.
Morgunova, G. V., and Klebanov, A. A. (2019) Age related
Differential contribution of insulin receptor substrates 1
AMP activated protein kinase alterations: from cellular
versus 2 to insulin signaling and glucose uptake in l6
energetics to longevity, Cell Biochem. Funct., 37, 169 176,
myotubes, J. Biol. Chem., 280, 19426 19435, doi: 10.1074/
doi: 10.1002/cbf.3384.
jbc.M412317200.
32.
González, A., and Hall, M. N. (2017) Nutrient sensing and
51.
Latva Rasku, A., Honka, M. J., Stančáková, A.,
TOR signaling in yeast and mammals, EMBO J., 36, 397
Koistinen, H. A., Kuusisto, J., et al. (2018) A partial loss
408, doi: 10.15252/embj.201696010.
of function variant in AKT2 is associated with reduced
БИОХИМИЯ том 86 вып. 10 2021
МЕТАБОЛИЧЕСКИЕ СЕНСОРЫ В ПОСТМИТОТИЧЕСКИХ КЛЕТКАХ
1545
insulin mediated glucose uptake in multiple insulin sensi
tions. A review of the evidence, Br. J. Sports Med., 51,
tive tissues: a genotype based callback positron emission
1533 1538, doi: 10.1136/bjsports 2016 096724.
tomography study, Diabetes, 67, 334 342, doi: 10.2337/
67.
Jarvie, J. L., Pandey, A., Ayers, C. R., McGavock, J. M.,
db17 1142.
Sénéchal, M., et al. (2019) Aerobic fitness and adherence
52.
Cusi, K., Maezono, K., Osman, A., Pendergrass, M., Patti,
to guideline recommended minimum physical activity
M. E., et al. (2000) Insulin resistance differentially affects
among ambulatory patients with type 2 diabetes mellitus,
the PI 3 kinase and MAP kinase mediated signaling in
Diabetes Care, 42, 1333 1339, doi: 10.2337/dc18 2634.
human muscle, J. Clin. Invest., 105, 311 320, doi: 10.1172/
68.
Yang, D., Yang, Y., Li, Y., and Han, R. (2019) Physical
JCI7535.
exercise as therapy for type 2 diabetes mellitus: from mech
53.
Unger, R. H. (2003) Minireview: weapons of lean body
anism to orientation, Ann. Nutr. Metab., 74, 313 321,
mass destruction: the role of ectopic lipids in the metabol
doi: 10.1159/000500110.
ic syndrome, Endocrinology, 144, 5159 5165, doi: 10.1210/
69.
Volaklis, K. A., Halle, M., and Meisinger, C.
(2015)
en.2003 0870.
Muscular strength as a strong predictor of mortality: a nar
54.
Reppert, S. M., and Weaver, D. R. (2002) Coordination of
rative review, Eur. J. Intern. Med.,
26,
303310,
circadian timing in mammals, Nature, 418, 935 941,
doi: 10.1016/j.ejim.2015.04.013.
doi: 10.1038/nature00965.
70.
Kraschnewski, J. L., Sciamanna, C. N., Poger, J. M.,
55.
Dibner, C., Schibler, U., and Albrecht, U.
(2010)
Rovniak, L. S., Lehman, E. B., et al. (2016) Is strength
The mammalian circadian timing system: organization and
training associated with mortality benefits? A 15 year
coordination of central and peripheral clocks, Annu. Rev.
cohort study of US older adults, Prev. Med., 87, 121 127,
Physiol., 72, 517549, doi: 10.1146/annurev physiol
doi: 10.1016/j.ypmed.2016.02.038.
021909 135821.
71.
Atlantis, E., Martin, S. A., Haren, M. T., Taylor, A. W., and
56.
Yamanaka, Y., Honma, S., and Honma, K. I. (2008)
Wittert, G. A. (2009) Inverse associations between muscle
Scheduled exposures to a novel environment with a run
mass, strength, and the metabolic syndrome, Metabolism,
ning wheel differentially accelerate re entrainment of
58, 1013 1022, doi: 10.1016/j.metabol.2009.02.027.
mice peripheral clocks to new light dark cycles, Genes
72.
Kim, G., Lee, S. E., Jun, J. E., Lee, Y. B., Ahn, J., et al.
Cells, 13, 497 507, doi: 10.1111/j.1365 2443.2008.01183.x.
(2018) Increase in relative skeletal muscle mass over time
57.
Wolff, G., and Esser, K. A. (2012) Scheduled exercise
and its inverse association with metabolic syndrome devel
phase shifts the circadian clock in skeletal muscle, Med.
opment: a 7 year retrospective cohort study, Cardiovasc.
Sci. Sports Exerc.,
44,
16631670, doi:
10.1249/
Diabetol., 17, 23, doi: 10.1186/s12933 018 0659 2.
MSS.0b013e318255cf4c.
73.
Nomura, K., Eto, M., Ogawa, S., Kojima, T., Iijima, K.,
58.
Hawke, T. J., and Garry, D. J. (2001) Myogenic satellite
et al. (2020) Association between low muscle mass and
cells: physiology to molecular biology, J. Appl. Physiol., 91,
metabolic syndrome in elderly Japanese women, PLoS
534 551, doi: 10.1152/jappl.2001.91.2.534.
One, 15, e0243242, doi: 10.1371/journal.pone.0243242.
59.
Campanario, S., Ram rez Pardo, I., Hong, X., Isern, J.,
74.
Srikanthan, P., Hevener, A. L., and Karlamangla, A. S.
and Muñoz Cánoves, P. (2021) Assessing autophagy in
(2010) Sarcopenia exacerbates obesity associated insulin
muscle stem cells, Front. Cell Dev. Biol., 8, 620409,
resistance and dysglycemia: findings from the National
doi: 10.3389/fcell.2020.620409.
Health and Nutrition Examination Survey III, PLoS One,
60.
Srikanthan, P., and Karlamangla, A. S. (2011) Relative
5, e10805, doi: 10.1371/journal.pone.0010805.
muscle mass is inversely associated with insulin resistance
75.
Strasser, B., and Fuchs, D. (2015) Role of physical activity
and prediabetes. Findings from the third National Health
and diet on mood, behavior, and cognition, Neurol.
and Nutrition Examination Survey, J. Clin. Endocrinol.
Psychol. Brain Res., 21, 118 126, doi: 10.1016/j.npbr.2015.
Metab., 96, 2898 2903, doi: 10.1210/jc.2011 0435.
07.002.
61.
Brito, E. C., Lyssenko, V., Renström, F., Berglund, G.,
76.
McLeod, M., Breen, L., Hamilton, D. L., and Philp, A.
Nilsson, P. M., et al. (2009) Previously associated type 2
(2016) Live strong and prosper: the importance of skeletal
diabetes variants may interact with physical activity to
muscle strength for healthy ageing, Biogerontology, 17,
modify the risk of impaired glucose regulation and type 2
497 510, doi: 10.1007/s10522 015 9631 7.
diabetes: a study of 16,003 Swedish adults, Diabetes, 58,
77.
De Mario, A., Gherardi, G., Rizzuto, R., and
1411 1418, doi: 10.2337/db08 1623.
Mammucari, C. (2021) Skeletal muscle mitochondria in
62.
Waller, K., Kaprio, J., Lehtovirta, M., Silventoinen, K.,
health and disease, Cell Calcium,
94,
102357,
Koskenvuo, M., and Kujala, U. M. (2010) Leisure time
doi: 10.1016/j.ceca.2021.102357.
physical activity and type 2 diabetes during a 28 year fol
78.
Goodpaster, B. H., Park, S. W., Harris, T. B., Kritchevsky,
low up in twins, Diabetologia,
53,
25312537,
S. B., Nevitt, M., et al. (2006) The loss of skeletal muscle
doi: 10.1007/s00125 010 1875 9.
strength, mass, and quality in older adults: the health, aging
63.
InterAct Consortium (2012) Physical activity reduces the
and body composition study, J. Gerontol. A Biol. Sci. Med.
risk of incident type 2 diabetes in general and in abdomi
Sci., 61, 1059 1064, doi: 10.1093/gerona/61.10.1059.
nally lean and obese men and women: the EPIC InterAct
79.
Qiang, W., Weiqiang, K., Qing, Z., Pengju, Z., and Yi, L.
Study, Diabetologia, 55, 1944 1952, doi: 10.1007/s00125
(2007) Aging impairs insulin stimulated glucose uptake in
012 2532 2.
rat skeletal muscle via suppressing AMPKα, Exp. Mol.
64.
Kujala, U. M., Mäkinen, V. P., Heinonen, I., Soininen, P.,
Med., 39, 535 543, doi: 10.1038/emm.2007.59.
Kangas, A. J., et al. (2013) Long term leisure time physi
80.
Salminen, A., and Kaarniranta, K. (2012) AMP activated
cal activity and serum metabolome, Circulation, 127, 340
protein kinase (AMPK) controls the aging process via an
348, doi: 10.1161/CIRCULATIONAHA.112.105551.
integrated signaling network, Ageing Res. Rev., 11, 230
65.
DiMenna, F. J., and Arad, A. D. (2018) Exercise as ‘preci
241, doi: 10.1016/j.arr.2011.12.005.
sion medicine’ for insulin resistance and its progression to
81.
Lai, Y. C., Kviklyte, S., Vertommen, D., Lantier, L.,
type 2 diabetes: a research review, BMC Sports Sci. Med.
Foretz, M., et al. (2014) A small molecule benzimidazole
Rehabilitation, 10, 21, doi: 10.1186/s13102 018 0110 8.
derivative that potently activates AMPK to increase glu
66.
Zanuso, S., Sacchetti, M., Sundberg, C. J., Orlando, G.,
cose transport in skeletal muscle: comparison with effects
Benvenuti, P., and Balducci, S. (2017) Exercise in type 2
of contraction and other AMPK activators, Biochem. J.,
diabetes: genetic, metabolic and neuromuscular adapta
460, 363 375, doi: 10.1042/BJ20131673.
10 БИОХИМИЯ том 86 вып. 10 2021
1546
МОРГУНОВА и др.
82.
Bentzinger, C. F., Romanino, K., Cloëtta, D., Lin, S.,
96. Leenders, M., and van Loon, L. J. (2011) Leucine as a
Mascarenhas, J. B., et al. (2008) Skeletal muscle specific
pharmaconutrient to prevent and treat sarcopenia and type
ablation of raptor, but not of rictor, causes metabolic
2 diabetes, Nutr. Rev., 69, 675 689, doi: 10.1111/j.1753
changes and results in muscle dystrophy, Cell Metab., 8,
4887.2011.00443.x.
411 424, doi: 10.1016/j.cmet.2008.10.002.
97. Wall, B. T., Hamer, H. M., de Lange, A., Kiskini, A.,
83.
Risson, V., Mazelin, L., Roceri, M., Sanchez, H.,
Groen, B. B., Senden, J. M., et al. (2013) Leucine co
Moncollin, V., et al. (2009) Muscle inactivation of mTOR
ingestion improves post prandial muscle protein accretion
causes metabolic and dystrophin defects leading to severe
in elderly men, Clin. Nutr., 32, 412 419, doi: 10.1016/
myopathy, J. Cell Biol., 187, 859 874, doi: 10.1083/jcb.
j.clnu.2012.09.002.
200903131.
98. Rennie, M., and Wilkes, E. A. (2005) Maintenance of the
84.
Bodine, S. C., Stitt, T. N., Gonzalez, M., Kline, W. O.,
musculoskeletal mass by control of protein turnover: the
Stover, G. L., et al. (2001) Akt/mTOR pathway is a crucial
concept of anabolic resistance and its relevance to the
regulator of skeletal muscle hypertrophy and can prevent
transplant recipient, Ann. Transplant., 10, 31 34.
muscle atrophy in vivo, Nat. Cell Biol., 3, 1014 1019,
99. Kolwicz, Jr., S. C., Purohit, S., and Tian, R.
(2013)
doi: 10.1038/ncb1101 1014.
Cardiac metabolism and its interactions with contraction,
85.
Castets, P., Lin, S., Rion, N., Di Fulvio, S.,
growth, and survival of cardiomyocytes, Circ. Res., 113,
Romanino, K., Guridi, M., et al. (2013) Sustained activa
603 616, doi: 10.1161/CIRCRESAHA.113.302095.
tion of mTORC1 in skeletal muscle inhibits constitutive
100. Schaper, J., Meiser, E., and Stämmler, G.
(1985)
and starvation induced autophagy and causes a severe,
Ultrastructural morphometric analysis of myocardium
late onset myopathy, Cell Metab.,
17,
731744,
from dogs, rats, hamsters, mice, and from human hearts,
doi: 10.1016/j.cmet.2013.03.015.
Circ. Res., 56, 377 391, doi: 10.1161/01.RES.56.3.377.
86.
Drummond, M. J., Fry, C. S., Glynn, E. L., Dreyer, H. C.,
101. Taegtmeyer, H., McNulty, P., and Young, M. E. (2002)
Dhanani, S., et al. (2009) Rapamycin administration in
Adaptation and maladaptation of the heart in diabetes: Part
humans blocks the contraction induced increase in skele
I: general concepts, Circulation,
105,
17271733,
tal muscle protein synthesis, J. Physiol., 587, 1535 1546,
doi: 10.1161/01.CIR.0000012466.50373.E8.
doi: 10.1113/jphysiol.2008.163816.
102. Taegtmeyer, H., Hems, R., and Krebs, H. A. (1980)
87.
Dickinson, J. M., Fry, C. S., Drummond, M. J.,
Utilization of energy providing substrates in the isolated
Gundermann, D. M., Walker, D. K., et al.
(2011)
working rat heart, Biochem. J., 186, 701 711, doi: 10.1042/
Mammalian target of rapamycin complex 1 activation is
bj1860701.
required for the stimulation of human skeletal muscle pro
103. Henning, S. L., Wambolt, R. B., Schönekess, B. O.,
tein synthesis by essential amino acids, J. Nutr., 141, 856
Lopaschuk, G. D., and Allard, M. F. (1996) Contribution of
862, doi: 10.3945/jn.111.139485.
glycogen to aerobic myocardial glucose utilization,
88.
Mazzilli, K. M., Matthews, C. E., Salerno, E. A., and
Circulation, 93, 1549 1555, doi: 10.1161/01.CIR.93.8.1549.
Moore, S. C. (2019) Weight training and risk of 10 com
104. Tian, R., and Abel, E. D. (2001) Responses of GLUT4
mon types of cancer, Med. Sci. Sports Exerc., 51, 1845
deficient hearts to ischemia underscore the importance of
1851, doi: 10.1249/MSS.0000000000001987.
glycolysis, Circulation, 103, 2961 2966, doi: 10.1161/01.
89.
Rezende, L. F., Lee, D. H., Keum, N., Wu, K., Eluf
CIR.103.24.2961.
Neto, J., et al. (2020) Resistance training and total and
105. Ginsberg, H. N., Zhang, Y. L., and Hernandez Ono, A.
site specific cancer risk: a prospective cohort study of
(2006) Metabolic syndrome: focus on dyslipidemia,
33,787 US men, Br. J. Cancer, 123, 666 672, doi: 10.1038/
Obesity, 14, 41S 49S, doi: 10.1038/oby.2006.281.
s41416 020 0921 8.
106. Ram rez, E., Picatoste, B., González Bris, A., Oteo, M.,
90.
Olesen, A. T., Malchow Møller, L., Bendixen, R. D.,
Cruz, F., et al. (2018) Sitagliptin improved glucose assimi
Kjær, M., Svensson, R. B., et al. (2021) Age related
lation in detriment of fatty acid utilization in experimental
myofiber atrophy in old mice is reversed by ten weeks vol
type II diabetes: role of GLP 1 isoforms in Glut4 receptor
untary high resistance wheel running, Exp. Gerontol., 143,
trafficking, Cardiovasc. Diabetol., 17, 12, doi: 10.1186/
111150, doi: /10.1016/j.exger.2020.111150.
s12933 017 0643 2.
91.
Аршавский И. А. (1982) Физиологические механизмы и
107. Davidoff, A. J., Davidson, M. B., Carmody, M. W., Davis,
закономерности индивидуального развития. Основы не'
M. E., and Ren, J. (2004) Diabetic cardiomyocyte dys
гэнтропийной теории онтогенеза. Наука, Москва,
function and myocyte insulin resistance: role of glucose
270 с.
induced PKC activity, Mol. Cell. Biochem., 262, 155 163,
92.
Kurismaa, A. (2021) The negentropic theory of ontogeny:
doi: 10.1023/B:MCBI.0000038231.68078.4b.
a new model of eutherian life history transitions?
108. Su, X., and Abumrad, N. A. (2009) Cellular fatty acid
Biosemiotics, doi: 10.1007/s12304 021 09408 0.
uptake: a pathway under construction, Trends Endocrinol.
93.
Palla, A. R., Ravichandran, M., Wang, Y. X.,
Metab., 20, 72 77, doi: 10.1016/j.tem.2008.11.001.
Alexandrova, L., Yang, A. V., et al. (2021) Inhibition of
109. D’Souza, K., Nzirorera, C., and Kienesberger, P. C. (2016)
prostaglandin degrading enzyme 15 PGDH rejuvenates
Lipid metabolism and signaling in cardiac lipotoxicity,
aged muscle mass and strength, Science, 371, eabc8059,
Biochim. Biophys. Acta Mol. Cell Biol. Lipids, 1861, 1513
doi: 10.1126/science.abc8059.
1524, doi: 10.1016/j.bbalip.2016.02.016.
94.
Churchward Venne, T. A., Holwerda, A. M., Phillips,
110. Szczepaniak, L. S., Victor, R. G., Orci, L., and Unger,
S. M., and van Loon, L. J. (2016) What is the optimal
R. H. (2007) Forgotten but not gone: the rediscovery of fatty
amount of protein to support post exercise skeletal muscle
heart, the most common unrecognized disease in America,
reconditioning in the older adult? Sports Med., 46, 1205
Circ. Res., 101, 759 767, doi: 10.1161/CIRCRESAHA.
1212, doi: 10.1007/s40279 016 0504 2.
107.160457.
95.
Dickinson, J. M., Gundermann, D. M., Walker, D. K.,
111.
Goldberg, I. J., Trent, C. M., and Schulze, P. C. (2012)
Reidy, P. T., Borack, M. S., et al. (2014) Leucine enriched
Lipid metabolism and toxicity in the heart, Cell Metab., 15,
amino acid ingestion after resistance exercise prolongs
805 812, doi: 10.1016/j.cmet.2012.04.006.
myofibrillar protein synthesis and amino acid transporter
112. Fricovsky, E. S., Suarez, J., Ihm, S. H., Scott, B. T.,
expression in older men, J. Nutr., 144, 16941702,
Suarez Ramirez, J. A., et al. (2012) Excess protein
doi: 10.3945/jn.114.198671.
O GlcNAcylation and the progression of diabetic car
БИОХИМИЯ том 86 вып. 10 2021
МЕТАБОЛИЧЕСКИЕ СЕНСОРЫ В ПОСТМИТОТИЧЕСКИХ КЛЕТКАХ
1547
diomyopathy, Am. J. Physiol. Regul. Integr. Comp. Physiol.,
longevity and healthspan in adult mice, Cell Metab., 26,
303, R689 R699, doi: 10.1152/ajpregu.00548.2011.
539 546, doi: 10.1016/j.cmet.2017.08.005.
113. Liu, Y., Neumann, D., Glatz, J. F., and Luiken, J. J. (2018)
128. Caprio, M., Infante, M., Moriconi, E., Armani, A.,
Molecular mechanism of lipid induced cardiac insulin
Fabbri, A., et al. (2019) Very low calorie ketogenic diet
resistance and contractile dysfunction, Prostaglandins
(VLCKD) in the management of metabolic diseases: sys
Leukot. Essent. Fatty Acids, 136, 131 141, doi: 10.1016/
tematic review and consensus statement from the Italian
j.plefa.2016.06.002.
Society of Endocrinology (SIE), J. Endocrinol. Investig.,
114. Idris, I., Gray, S., and Donnelly, R. (2001) Protein
42, 1365 1386, doi: 10.1007/s40618 019 01061 2.
kinase C activation: isozyme specific effects on metabo
129. Sengupta, S., Peterson, T. R., Laplante, M., Oh, S., and
lism and cardiovascular complications in diabetes,
Sabatini, D. M. (2010) mTORC1 controls fasting induced
Diabetologia, 44, 659 673, doi: 10.1007/s001250051675.
ketogenesis and its modulation by ageing, Nature, 468,
115. Schmitz Peiffer, C., Craig, D. L., and Biden, T. J. (1999)
1100 1104, doi: 10.1038/nature09584.
Ceramide generation is sufficient to account for the inhibi
130. Stockhorst, U., de Fries, D., Steingrueber, H. J., and
tion of the insulin stimulated PKB pathway in C2C12
Scherbaum, W. A. (2004) Insulin and the CNS: effects on
skeletal muscle cells pretreated with palmitate, J. Biol.
food intake, memory, and endocrine parameters and the
Chem., 274, 24202 24210, doi: 10.1074/jbc.274.34.24202.
role of intranasal insulin administration in humans, Physiol.
116. Dolinsky, V. W., and Dyck, J. R. (2006) Role of AMP acti
Behav., 83, 47 54, doi: 10.1016/j.physbeh.2004.07.022.
vated protein kinase in healthy and diseased hearts,
131. Belfiore, A., Frasca, F., Pandini, G., Sciacca, L., and
Am. J. Physiol. Heart Circ. Physiol., 291, H2557 H2569,
Vigneri, R. (2009) Insulin receptor isoforms and insulin
doi: 10.1152/ajpheart.00329.2006.
receptor/insulin like growth factor receptor hybrids in
117. Dyck, J. R., and Lopaschuk, G. D. (2006) AMPK alter
physiology and disease, Endocr. Rev., 30, 586623,
ations in cardiac physiology and pathology: enemy or ally?
doi: 10.1210/er.2008 0047.
J. Physiol., 574, 95112, doi: 10.1113/jphysiol.2006.
132. Kim, B., McLean, L. L., Philip, S. S., and Feldman, E. L.
109389.
(2011) Hyperinsulinemia induces insulin resistance in dor
118. Towler, M. C., and Hardie, D. G. (2007) AMP activated
sal root ganglion neurons, Endocrinology, 152, 3638 3647,
protein kinase in metabolic control and insulin signaling,
doi: 10.1210/en.2011 0029.
Circ. Res.,
100,
328341, doi:
10.1161/01.RES.
133. Cheah, Y. S., Lee, S., Ashoor, G., Nathan, Y., Reed, L. J.,
0000256090.42690.05.
et al. (2014) Ageing diminishes the modulation of human
119. Chan, A. Y., Soltys, C. L. M., Young, M. E., Proud, C. G.,
brain responses to visual food cues by meal ingestion, Int. J.
and Dyck, J. R. (2004) Activation of AMP activated pro
Obes., 38, 1186 1192, doi: 10.1038/ijo.2013.237.
tein kinase inhibits protein synthesis associated with hyper
134. Xu, Q. G., Li, X. Q., Kotecha, S. A., Cheng, C., Sun,
trophy in the cardiac myocyte, J. Biol. Chem., 279, 32771
H. S., and Zochodne, D. W. (2004) Insulin as an in vivo
32779, doi: 10.1074/jbc.M403528200.
growth factor, Exp. Neurol., 188, 43 51, doi: 10.1016/
120. Kovacic, S., Soltys, C. L. M., Barr, A. J., Shiojima, I.,
j.expneurol.2004.03.008.
Walsh, K., and Dyck, J. R. (2003) Akt activity negatively
135. Marks, J. L., Porte Jr, D., Stahl, W. L., and Baskin, D. G.
regulates phosphorylation of AMP activated protein
(1990) Localization of insulin receptor mRNA in rat brain
kinase in the heart, J. Biol. Chem., 278, 39422 39427,
by in situ hybridization, Endocrinology, 127, 3234 3236,
doi: 10.1074/jbc.M305371200.
doi: 10.1210/endo 127 6 3234.
121. Takano, A., Usui, I., Haruta, T., Kawahara, J., Uno, T.,
136. Zhao, W., Chen, H., Xu, H., Moore, E., Meiri, N., et al.
et al. (2001) Mammalian target of rapamycin pathway reg
(1999) Brain insulin receptors and spatial memory: corre
ulates insulin signaling via subcellular redistribution of
lated changes in gene expression, tyrosine phosphoryla
insulin receptor substrate 1 and integrates nutritional sig
tion, and signaling molecules in the hippocampus of water
nals and metabolic signals of insulin, Mol. Cell. Biol., 21,
maze trained rats, J. Biol. Chem., 274, 34893 34902,
5050 5062, doi: 10.1128/MCB.21.15.5050 5062.2001.
doi: 10.1074/jbc.274.49.34893.
122. Ginion, A., Auquier, J., Benton, C. R., Mouton, C.,
137. van der Heide, L. P., Ramakers, G. M., and Smidt, M. P.
Vanoverschelde, J. L., et al. (2011) Inhibition of the
(2006) Insulin signaling in the central nervous system:
mTOR/p70S6K pathway is not involved in the insulin sen
learning to survive, Prog. Neurobiol.,
79,
205221,
sitizing effect of AMPK on cardiac glucose uptake, Am. J.
doi: 10.1016/j.pneurobio.2006.06.003.
Physiol. Heart Circ. Physiol.,
301, H469 H477,
138. Abbott, M. A., Wells, D. G., and Fallon, J. R. (1999) The
doi: 10.1152/ajpheart.00986.2010.
insulin receptor tyrosine kinase substrate p58/53 and the
123. Kramer, H. F., Witczak, C. A., Fujii, N., Jessen, N., Taylor,
insulin receptor are components of CNS synapses,
E. B., et al. (2006) Distinct signals regulate AS160 phos
J. Neurosci., 19, 7300 7308, doi: 10.1523/JNEUROSCI.
phorylation in response to insulin, AICAR, and contrac
19 17 07300.
tion in mouse skeletal muscle, Diabetes, 55, 2067 2076,
139. Frölich, L., Blum Degen, D., Bernstein, H. G.,
doi: 10.2337/db06 0150.
Engelsberger, S., Humrich, J., et al. (1998) Brain insulin
124. Goodwin, G. W., and Taegtmeyer, H. (2000) Improved
and insulin receptors in aging and sporadic Alzheimer’s
energy homeostasis of the heart in the metabolic state of
disease, J. Neural Transm., 105, 423 438, doi: 10.1007/
exercise, Am. J. Physiol. Heart Circ. Physiol., 279, H1490
s007020050068.
H1501, doi: 10.1152/ajpheart.2000.279.4.H1490.
140. Gladden, L. B. (2004) Lactate metabolism: a new para
125. Aubert, G., Martin, O. J., Horton, J. L., Lai, L., Vega,
digm for the third millennium, J. Physiol., 558, 5 30,
R. B., et al. (2016) The failing heart relies on ketone bod
doi: 10.1113/jphysiol.2003.058701.
ies as a fuel, Circulation, 133, 698 705, doi: 10.1161/
141. Morgunova, G. V. (2020) Chinese hamster cells in biotech
CIRCULATIONAHA.115.017355.
nological and gerontological research, Moscow Univ. Biol.
126. Newman, J. C., Covarrubias, A. J., Zhao, M., Yu, X.,
Sci. Bull., 75, 199 205, doi: 10.3103/S0096392520040069.
Gut, P., et al. (2017) Ketogenic diet reduces midlife mor
142. Apelt, J., Mehlhorn, G., and Schliebs, R. (1999) Insulin
tality and improves memory in aging mice, Cell Metab., 26,
sensitive GLUT4 glucose transporters are colocalized with
547 557, doi: 10.1016/j.cmet.2017.08.004.
GLUT3 expressing cells and demonstrate a chemically
127. Roberts, M. N., Wallace, M. A., Tomilov, A. A., Zhou, Z.,
distinct neuron specific localization in rat brain,
Marcotte, G. R., et al. (2017) A ketogenic diet extends
J. Neurosci. Res., 57, 693 705.
БИОХИМИЯ том 86 вып. 10 2021
10*
1548
МОРГУНОВА и др.
143. Rhea, E. M., and Banks, W. A. (2019) Role of the blood
of the thalamus, pons, and cortex, Neurobiol. Aging, 25,
brain barrier in central nervous system insulin resistance,
185 192, doi: 10.1016/S0197 4580(03)00044 7.
Front. Neurosci., 13, 521, doi: 10.3389/fnins.2019.00521.
161. Peters, A., Rosene, D. L., Moss, M. B., Kemper, T. L.,
144. Lipton, J. O., and Sahin, M. (2014) The neurology of
Abraham, C. R., et al. (1996) Neurobiological bases of age
mTOR, Neuron, 84, 275 291, doi: 10.1016/j.neuron.
related cognitive decline in the rhesus monkey,
2014.09.034.
J. Neuropathol. Exp. Neurol., 55, 861 874, doi: 10.1097/
145. Ramamurthy, S., and Ronnett, G. V. (2006) Developing a
00005072 199608000 00001.
head for energy sensing: AMP activated protein kinase as a
162. Merrill, D. A., Roberts, J. A., and Tuszynski, M. H.
multifunctional metabolic sensor in the brain, J. Physiol.,
(2000) Conservation of neuron number and size in
574, 85 93, doi: 10.1113/jphysiol.2006.110122.
entorhinal cortex layers II, III, and V/VI of aged primates,
146. Liu, Y. J., and Chern, Y. (2015) AMPK mediated regula
J. Comp. Neurol., 422, 396401, doi: 10.1002/1096
tion of neuronal metabolism and function in brain diseases,
9861(20000703)422:3<396::AID CNE6>3.0.CO;2 R.
J. Neurogenet., 29, 50 58, doi: 10.3109/01677063.2015.
163. Scheff, S. W., Price, D. A., and Sparks, D. L. (2001)
1067203.
Quantitative assessment of possible age related change in
147. Chen, M., Huang, N., Liu, J., Huang, J., Shi, J., and
synaptic numbers in the human frontal cortex, Neurobiol.
Jin, F. (2020) AMPK: a bridge between diabetes mellitus
Aging, 22, 355 365, doi: 10.1016/S0197 4580(01)00222 6.
and Alzheimer’s disease, Behav. Brain Res., 400, 113043,
164. Freeman, S. H., Kandel, R., Cruz, L., Rozkalne, A.,
doi: 10.1016/j.bbr.2020.113043.
Newell, K., et al. (2008) Preservation of neuronal number
148. Strasser, B., Volaklis, K., Fuchs, D., and Burtscher, M.
despite age related cortical brain atrophy in elderly subjects
(2018) Role of dietary protein and muscular fitness on
without Alzheimer’s disease, J. Neuropathol. Exp. Neurol.,
longevity and aging, Aging Dis., 9, 119 132, doi: 10.14336/
67, 1205 1212, doi: 10.1097/NEN.0b013e31818fc72f.
AD.2017.0202.
165. Pakkenberg, B., Pelvig, D., Marner, L., Bundgaard, M. J.,
149. Strasser, B., Berger, K., and Fuchs, D (2014) Effects of a
Gundersen, H. J. G., et al. (2003) Aging and the human
caloric restriction weight loss diet on tryptophan metabo
neocortex, Exp. Gerontol., 38, 95 99, doi: 10.1016/S0531
lism and inflammatory biomarkers in overweight adults,
5565(02)00151 1.
Eur. J. Nutr., 54, 101 107, doi: 10.1007/s00394 014
166. Zhang, C., Hua, T., Zhu, Z., and Luo, X. (2006) Age relat
0690 3.
ed changes of structures in cerebellar cortex of cat,
150. Morterá, P., and Herculano Houzel, S. (2012) Age related
J. Biosci., 31, 55 60.
neuronal loss in the rat brain starts at the end of adoles
167. Hayflick, L., and Moorhead, P. S. (1961) The serial culti
cence, Front. Neuroanat., 6, 45, doi: 10.3389/fnana.2012.
vation of human diploid cell strains, Exp. Cell Res., 25,
00045.
585 621, doi: 10.1016/0014 4827(61)90192 6.
151. Kawamura, Y., Okazaki, H., O’Brien, P. C., and Dyck, P. J.
168. Von Zglinicki, T., Wan, T., and Miwa, S. (2021) Senescence
(1977) Lumbar motoneurons of man: I) number and diam
in post mitotic cells: a driver of aging? Antioxid. Redox
eter histogram of alpha and gamma axons of ventral root,
Signal., 34, 308 323, doi: 10.1089/ars.2020.8048.
J. Neuropathol. Exp. Neurol., 36, 853 860, doi: 10.1097/
169. Campisi, J. (2013) Aging, cellular senescence, and cancer,
00005072 197709000 00009.
Annu. Rev. Physiol., 75, 685 705, doi: 10.1146/annurev
152. Mittal, K. R., and Logmani, F. H. (1987) Age related
physiol 030212 183653.
reduction in 8th cervical ventral nerve root myelinated fiber
170. Longo, V. D., and Fabrizio, P. (2011) In Aging Research in
diameters and numbers in man, J. Gerontol., 42, 8 10,
Yeast (Breitenbach, M., Jazwinski, S., Laun, P., eds)
doi: 10.1093/geronj/42.1.8.
Springer, Dordrecht, pp. 101 121.
153. Tomlinson, B. E., and Irving, D. (1977) The numbers of
171. Khokhlov, A. N., Klebanov, A. A., and Morgunova, G. V.
limb motor neurons in the human lumbosacral cord
(2018) On choosing control objects in experimental geron
throughout life, J. Neurol. Sci., 34, 213 219, doi: 10.1016/
tological research, Moscow Univ. Biol. Sci. Bull., 73, 59 62,
0022 510X(77)90069 7.
doi: 10.3103/S0096392518020049.
154. Park, J. J., Tang, Y., Lopez, I., and Ishiyama, A. (2001)
172. Morgunova, G. V., and Klebanov, A. A. (2018) Impairment
Age related change in the number of neurons in the
of the viability of transformed Chinese hamster cells in a
human vestibular ganglion, J. Comp. Neurol., 431, 437
nonsubcultured culture under the influence of exogenous
443, doi: 10.1002/1096 9861(20010319)431:4<437::AID
oxidized guanoside is manifested only in the stationary
CNE1081>3.0.CO;2 P.
phase of growth, Moscow Univ. Biol. Sci. Bull., 73, 124 129,
155. Allen, D., Ribeiro, L., Arshad, Q., and Seemungal, B. M.
doi: 10.3103/S0096392518030136.
(2017) Age related vestibular loss: current understanding
173. Morgunova, G. V., Karmushakov, A. F., Klebanov, A. A.,
and future research directions, Front. Neurol., 7, 231,
and Khokhlov, A. N. (2019) Studies into the effect of
doi: 10.3389/fneur.2016.00231.
“mild” uncoupling with 2, 4 dinitrophenol on the growth
156. West, M. J. (1993) Regionally specific loss of neurons in the
of Chinese hamster cell culture and its subsequent dying
aging human hippocampus, Neurobiol. Aging, 14, 287 293,
out in the stationary phase, Moscow Univ. Biol. Sci. Bull.,
doi: 10.1016/0197 4580(93)90113 P.
74, 163 169, doi: 10.3103/S0096392519030088.
157. Devaney, K. O., and Johnson, H. A. (1980) Neuron loss in
174. Morgunova, G. V., Klebanov, A. A., and Khokhlov, A. N.
the aging visual cortex of man, J. Gerontol., 35, 836 841,
(2016) Some remarks on the relationship between
doi: 10.1093/geronj/35.6.836.
autophagy, cell aging, and cell proliferation restriction,
158. Pakkenberg, B., and Gundersen, H. J. G.
(1997)
Moscow Univ. Biol. Sci. Bull.,
71,
207211,
Neocortical neuron number in humans: effect of sex and
doi: 10.3103/S0096392516040088.
age, J. Comp. Neurol., 384, 312 320.
175. Moreno Garc a, A., Kun, A., Calero, O., Medina, M.,
159. Mu, Q., Xie, J., Wen, Z., Weng, Y., and Shuyun, Z. (1999)
and Calero, M. (2018) An overview of the role of lipofuscin
A quantitative MR study of the hippocampal formation,
in age related neurodegeneration, Front. Neurosci., 12,
the amygdala, and the temporal horn of the lateral ventri
464, doi: 10.3389/fnins.2018.00464.
cle in healthy subjects 40 to 90 years of age, Am. J.
176. Jeon, Y. K., Shin, M. J., Saini, S. K., Custodero, C.,
Neuroradiol., 20, 207 211.
Aggarwal, M., et al. (2020) Vascular dysfunction as a
160. Sullivan, E. V., Rosenbloom, M., Serventi, K. L., and
potential culprit of sarcopenia, Exp. Gerontol., 145,
Pfefferbaum, A. (2004) Effects of age and sex on volumes
111220, doi: 10.1016/j.exger.2020.111220.
БИОХИМИЯ том 86 вып. 10 2021
МЕТАБОЛИЧЕСКИЕ СЕНСОРЫ В ПОСТМИТОТИЧЕСКИХ КЛЕТКАХ
1549
177. De la Torre, J. C. (2012) Cerebral hemodynamics and vas
178. Proctor, D. N., and Parker, B. A. (2006) Vasodilation and
cular risk factors: setting the stage for Alzheimer’s disease,
vascular control in contracting muscle of the aging human,
J. Alzheimer’s Dis., 32, 553 567, doi: 10.3233/JAD 2012
Microcirculation, 13, 315 327.
120793.
EFFECT OF CALORIE RESTRICTION ON AGING: THE CORRECTION
OF PROBLEMS WITH NUTRIENT SENSORS IN POSTMITOTIC CELLS?
Review
G. V. Morgunova*, G. A. Shilovsky, and A. N. Khokhlov
School of Biology, Lomonosov Moscow State University, 119234 Moscow, Russia; E'mail: morgunova@mail.bio.msu.ru
In the review, the role of metabolic disorders (in particular, insulin resistance) in the development of age related dis
eases and in “normal” aging with an emphasis on changes in postmitotic cells of higher organisms is considered.
Calorie restriction helps to prevent such metabolic disturbances, which could probably explain its ability to prolong
the life of laboratory animals. Maintaining metabolic homeostasis is especially important for highly differentiated
long lived cells of the body, whose life span is comparable to life span of the whole organism. Normal functioning of
these cells can be ensured only if their cytoplasm cleaning system works correctly, as well as all necessary nutrients and
energy sources are available. One of the central problems in gerontology is the disruption of glucose metabolism with
age, leading to related pathologies - obesity, diabetes, metabolic syndrome, etc. Skeletal muscles, along with adipose
tissue, are the main consumers of insulin, so physical activity of the muscles, which supports their energy metabolism,
helps to delay the onset of insulin resistance. After arising it disrupts, in particular, the metabolism of cardiomyocytes,
which are surrounded with nutrient rich environments, but do not use them to perform their functions. This con
tributes to the occurrence of age related cardiovascular diseases. Metabolic pathologies also alter the nutrient sensi
tivity of neurons, thereby impairing the action of insulin in the central nervous system. In addition, there is evidence
that insulin resistance can also develop in neurons themselves. It is assumed that the impact on nutritional sensors
(e.g., AMPK) in postmitotic cells can positively affect the multicellular organism, slowing its aging and increasing
life span.
Keywords: calorie restriction, metabolism, AMPK, autophagy, cardiomyocytes, myocytes, neurons
БИОХИМИЯ том 86 вып. 10 2021