БИОХИМИЯ, 2021, том 86, вып. 11, с. 1635 - 1653
УДК 577.12
РОЛЬ ГЛУТАТИОНПЕРОКСИДАЗ И ПЕРОКСИРЕДОКСИНОВ
ПРИ СВОБОДНОРАДИКАЛЬНЫХ ПАТОЛОГИЯХ
Обзор
© 2021
М.Г. Шарапов1*, С.В. Гудков2,3,4, В.З. Ланкин5, В.И. Новоселов1
1 Институт биофизики клетки ФИЦ ПНЦБИ РАН, 142290 Пущино, Московская обл., Россия;
электронная почта: sharapov.mars@gmail.com
2 Институт общей физики им. А.М. Прохорова РАН, 119991 Москва, Россия
3 Нижегородский государственный университет им. Н.И. Лобачевского,
Институт биологии и биомедицины, 603022 Нижний Новгород, Россия
4 Всероссийский научно>исследовательский институт фитопатологии, 143050 Большие Вяземы, Россия
5 ФГБУ «НМИЦ кардиологии» Минздрава России, 121552 Москва, Россия
Поступила в редакцию 27.05.2021
После доработки 19.09.2021
Принята к публикации 19.09.2021
В обзоре рассмотрен патогенез заболеваний, сопряжённых с развитием окислительного стресса, таких как:
атеросклероз, диабет и лучевая болезнь. Обсуждаются возможности терапевтического использования низ"
комолекулярных природных и синтетических антиоксидантов для коррекции свободнорадикальных пато"
логий. Основное внимание в обзоре уделено роли двух филогенетически близких семейств гидропероксид"
восстанавливающих антиоксидантных ферментов: пероксиредоксинов и глутатионпероксидаз. Обсуждает"
ся роль этих ферментов в противодействии окислительному стрессу, а также рассматривается их участие в
предупреждении свободнорадикальных патологий. Представлены примеры успешного применения экзо"
генных рекомбинантных ферментов"антиоксидантов в качестве терапевтических агентов при лечении па"
тологических состояний, связанных со свободнорадикальными процессами. Обсуждаются перспективы
дальнейших исследований экзогенных ферментов"антиоксидантов, а также способы улучшения их тера"
певтических свойств.
КЛЮЧЕВЫЕ СЛОВА: активные формы кислорода, дикарбонилы, лучевая болезнь, атеросклероз, диабет,
пероксиредоксины, глутатионпероксидазы.
DOI: 10.31857/S0320972521110038
СВОБОДНОРАДИКАЛЬНЫЕ ПАТОЛОГИИ
ративные болезни и т.д. [1, 2]. Для всех указан"
ных патологий характерны следующие призна"
В настоящее время общепринято, что мно"
ки: 1) увеличение концентрации в клетках и тка"
гие заболевания связаны с нарушением окисли"
нях свободных радикалов (СР), активных форм
тельно"восстановительного гомеостаза, в част"
кислорода (АФК) и активных форм азота (АФА,
ности, с активацией свободнорадикальных про"
которые также обозначаются как РФА - реак"
цессов в тканях. К патологиям такого рода мож"
тивные формы азота); 2) повышенный уровень
но отнести: лучевую болезнь, сердечно"сосудис"
содержания продуктов свободнорадикального
тые заболевания (гипертония, инсульт, ин"
окисления биомакромолекул; 3) интенсифика"
фаркт), диабет, бронхолёгочные патологии, зло"
ция собственной биолюминесценции тканей и
качественные новообразования, нейродегене"
клеток; 4) уменьшение содержания в клетках и
тканях тушителей (скавенджеров) радикалов и
антиоксидантов (включая снижение активности
Принятые сокращения: АФА - активные формы
азота; АФК - активные формы кислорода; ЛНП - липо"
антиоксидантных ферментов); 5) наличие ха"
протеины низкой плотности; МДА - малоновый диальде"
рактерных клинических синдромов (снижение
гид; ПОЛ - перекисное окисление липидов; СР - свобод" фертильности, хрупкость сосудов, ослабление
ный радикал; CHO - клетки яичника китайского хомячка; реакции на внешние раздражители, вялость,
GPx - глутатионпероксидаза; LOOH - липогидроперок"
сниженная гемолитическая устойчивость эри"
сид; NO• - оксид азота; Prx (Prdx) - пероксиредоксин;
RCS - активные карбонильные соединения; SOD - супе"
троцитов, преобладание катаболических про"
роксиддисмутаза.
цессов над анаболическими, преждевременное
* Адресат для корреспонденции.
старение и т.п.); 6) возможность моделирования
1635
1636
ШАРАПОВ и др.
СР"патологии за счёт индукции генерации СР,
пидов
[5]. Таким образом, окислительный
АФК/АФА в биологической системе; 7) при СР"
стресс с неизбежностью переходит в карбониль"
патологии выраженный профилактический или
ный стресс. По сравнению с АФК карбониль"
лечебный эффекты оказывают препараты анти"
ные соединения относительно стабильны. Отсут"
оксидантного действия. Таким образом, основ"
ствие заряда на молекуле RCS и относительно
ным признаком свободнорадикальной патоло"
большое время жизни (часы) позволяют им
гии является нарушение регуляции СР"процес"
диффундировать через клеточную мембрану и
сов в клетке, а именно: дисбаланс в системах ге"
атаковать мишени далеко от места продукции.
нерации и утилизации АФК/АФА [3].
RCS обладают высокой реакционной способ"
Окислительный стресс. Окислительный
ностью, атакуя в биологических макромолеку"
стресс - нарушение окислительно"восстанови"
лах аминогруппы, гуанидины, тиолы, имидазо"
тельного гомеостаза в биологических системах,
лы, гидроксильные группы, пуриновые и пири"
в результате которого уровень образующихся
мидиновые основания. Воздействие RCS приво"
окислителей (в первую очередь - АФК) превос"
дит к необратимым изменениям в структуре
ходит возможности антиоксидантной системы.
белков, нуклеиновых кислот и фосфолипидов,
Образующиеся в ходе окислительного стресса
вызывая нарушение их функции в клетке [5].
АФК способны модифицировать все важней"
Карбонильные соединения, по аналогии
шие макромолекулы (нуклеиновые кислоты,
с АФК, играют двойную роль в клетке: в норме
белки и липиды), что приводит к нарушению их
они участвуют в сигнальных и защитных про"
структуры и функции и в конечном счёте - ги"
цессах, а при повышенном уровне приводят к
бели клетки [4]. Окислительный стресс сопро"
необратимым повреждениям [6]. Например,
вождается образованием не только АФК, но и
нейтрофилы (с участием миелопероксидазы)
некоторых других «побочных» продуктов СР"
продуцируют ненасыщенные альдегиды, такие
окисления, таких как: нитрозилы (АФА) и кар"
как гликолевый альдегид, 2"гидроксипропаналь
бонилы, которые, в свою очередь, при превы"
и акролеин, которые подавляют рост патоген"
шении предельной концентрации вызывают
ных микроорганизмов [7]. Метилглиоксаль мо"
развитие нитрозивного и карбонильного стрес"
жет подавлять рост злокачественных клеток и
са соответственно [5]. Таким образом, окисли"
ряда патогенных бактерий [8]. В клетках суще"
тельный стресс можно считать триггером каска"
ствует специализированная система катаболиз"
да патологических процессов и связующим зве"
ма RCS, включающая следующие классы фер"
ном карбонильного и нитрозивного стрессов.
ментов: альдегиддегидрогеназы, альдегидредук"
Карбонильный стресс. Карбонильный стресс
тазы и глутатион"S"трансферазы. Вероятно, наи"
представляет собой острое или хроническое уве"
большее значение во внутриклеточной нейтра"
личение количества активных карбонильных
лизации альдегидов имеет процесс их фермента"
соединений (reactive carbonyl species - RCS), ве"
тивной конъюгации с глутатионом в глутатион"
дущее к повреждению/гибели клетки. Природ"
S"трансферазной реакции. Однако экстремаль"
ные RCS представлены широким спектром сое"
ное накопление RCS (возникающее при дли"
динений, которые содержат одну или несколько
тельном карбонильном стрессе), превышающее
карбонильных групп. На сегодняшний день
возможности
«антикарбонильной» защиты,
идентифицировано более двух десятков RCS,
приводит к цитотоксическим и генотоксичес"
участвующих в развитии карбонильного стрес"
ким эффектам и является причиной развития
са. К наиболее известным RCS относятся: α", β"
множества патологических состояний, таких
ненасыщенные альдегиды (акролеин, кротоно"
как сахарный диабет, атеросклероз, сердечно"
вый альдегид), диальдегиды (малоновый диаль"
сосудистые и нейродегенеративные заболева"
дегид (МДА), глиоксаль) и кето"альдегиды (ме"
ния, хроническая обструктивная болезнь лёгких
тилглиоксаль, рибозон, глюкозон, 3"дезокси"
и др. [5, 6].
глюкозон). Эндогенные RCS образуются в каче"
Нитрозивный стресс. Нитрозивный и окис"
стве промежуточных продуктов в ферментатив"
лительный стресс тесно связаны, и их разделе"
ных процессах гликолиза, окисления аминокис"
ние может быть достаточно условным. Образую"
лот в результате гликирования (сахароаминная
щиеся в ходе окислительного стресса АФК реа"
конденсация или реакция Майяра) и липидной
гируют с оксидом азота (NO•) с образовани"
пероксидации. Следует отметить, что дикарбо"
ем АФА. По аналогии с АФК превышение поро"
нилы (такие как малоновый диальдегид) образу"
гового уровня АФА приводит к повреждениям
ются в качестве вторичных продуктов окисле"
клетки и развитию нитрозивного стресса.
ния, при окислительной деструкции липогидро"
В биологических системах NO• образуется
пероксидов (LOOH) - первичных молекуляр"
из аминокислоты L"аргинина в результате реак"
ных продуктов СР"окисления полиеновых ли"
ции (L"аргинин + NADPH2 + O2 → NO• +
БИОХИМИЯ том 86 вып. 11 2021
РОЛЬ ГИДРОПЕРОКСИДАЗ ПРИ СР"ПАТОЛОГИЯХ
1637
+ L"цитруллин), которую катализируют фер"
кулами. Пероксинитрит способен окислять ли"
менты NO"синтазы [9]. У млекопитающих изве"
пиды, белки (преимущественно остатки Cys, Met
стно 3 изоформы NO"синтаз (2 конститутивных
и Tyr) и нуклеиновые кислоты (атакуя как осно"
и 1 индуцибельная), которые отличаются расп"
вания, так и сахаро"фосфатный остов, что при"
ределением в тканях/клетках, особенностями
водит к одноцепочечным разрывам). Кинетичес"
активации и ингибирования. Конститутивные
кие исследования показали, что пероксинитрит
изоферменты называют по типу ткани, в кото"
окисляет молекулы посредством двух механиз"
рой они впервые были обнаружены: нейрональ"
мов. Во"первых, пероксинитрит и его протони"
ная NO"синтаза (nNOS) и эндотелиальная NO"
рованная форма - пероксиазотистая кислота
синтаза (eNOS). nNOS содержится во многих
(ONOOH), время полураспада которой около 1 с
тканях, но в большем количестве она представ"
[12], напрямую окисляют молекулы посредством
лена в тканях центральной и периферической
одно" или двухэлектронного окисления. Второй
нервной системы [9]. Изофермент eNOS присут"
механизм опосредован образованием высокоре"
ствует преимущественно в клетках эндотелия
активных радикалов [13]. Пероксинитрит может
кровеносных сосудов. Конститутивные nNOS и
образовывать гидроксильный радикал (HO•) и
eNOS присутствуют в цитоплазме клеток, их ак"
радикал диоксида азота (NO•) при гомолитичес"
тивность зависит от уровня кальция в цитоплаз"
ком разложении пероксиазотистой кислоты
ме. В ответ на стимуляцию конститутивные
(ONOO- + Н+ → ONOOH → HO• + NO•). Одна"
nNOS и eNOS синтезируют небольшое количе"
ко образование HO• по этому механизму, вероят"
ство NO• (пикомоли). Индуцибельная iNOS в
но, играет лишь незначительную роль in vivo из"
нормальных условиях практически не экспрес"
за особенно быстрой реакции пероксинитрита с
сируется и обнаруживается только после стиму"
диоксидом углерода (CO2). Прямая реакция пе"
ляции провоспалительными цитокинами (IL"1,
роксинитрита с CO2 даёт нестабильный продукт
TNFα, INFγ и др.) или в условиях окислитель"
нитрозопероксикарбонат (ONOOCO−), который
ного стресса. В отличие от конститутивных изо"
быстро распадается на CO•- (карбонатный ради"
форм iNOS продуцирует NO• на 3 порядка боль"
кал) и NO•. Поскольку содержание углекислого
ше (наномоли), и её активность не зависит от
газа в клетках составляет около 1 мМ (примерно
ионов Са2+ [9].
в 10 000 раз больше, чем количество ионов водо"
NO• не имеет заряда, однако легко окисляет"
рода), образование карбонатных радикалов про"
ся или восстанавливается с образованием NO+ и
исходит in vivo с большей вероятностью, чем гид"
NO- соответственно. NO хорошо растворим в
роксильного радикала из ONOOH. Карбонатный
воде (при 20 °С растворимость 46 мл в 1 литре во"
радикал более селективен, чем гидроксильный
ды), его молекулы легко диффундируют в биоло"
радикал, но инициирует многие повреждающие
гических средах. Радиус диффузии свободного
реакции, обычно приписываемые гидроксиль"
NO (вне комплекса) около 0,1 мм. Среднее время
ному радикалу в биологической литературе, и,
жизни NO• в биологических тканях 5-6 с, в фи"
возможно, более значим как биологический
зиологическом растворе - 6-30 с, в деоксигени"
окислитель [10].
рованной воде NO• сохраняется в течение не"
В норме пероксинитрит образуется макрофа"
скольких суток. Кроме того, NO• образует ста"
гами (с участием iNOS и NAD(P)H"оксидаз) и
бильные комплексы с гемоглобином и сыворо"
участвует в антимикробной и противоопухоле"
точным альбумином и таким образом может
вой активности иммунной системы [14]. В насто"
транспортироваться в организме, причём время
ящее время только для пероксиредоксинов и се"
существования таких комплексов в организме
лен"содержащих глутатионпероксидаз показана
млекопитающих может достигать десятков ми"
способность нейтрализовать пероксинитрит [15].
нут [10, 11]. Повреждающее действие NO• во
Таким образом, окислительный, карбониль"
многом зависит от образования таких его мета"
ный и нитрозивный стрессы тесно взаимосвяза"
болитов, как: диоксида (NO2) и триоксида азота
ны, так или иначе участвуя в стимуляции некро"
(N2O3), нитрита (NO−), нитрата (NO−) и перок"
за и апоптоза клеток. По"видимому, в реальных
синитрита (ONOO-). Продукция высоких конце"
условиях процессы окисления, карбонилирова"
нтраций NO• (продуцируемая iNOS) в условиях
ния и нитрозилирования протекают одновре"
окислительного стресса приводит к образованию
менно.
высокотоксичного пероксинитрита (O•- + NO• →
→ ONOO-). Период полураспада пероксинитри"
та короткий (~10-20 мс), но достаточен для пе"
ЛУЧЕВАЯ БОЛЕЗНЬ
ресечения биологических мембран, диффузии от
одного до двух диаметров клеток и обеспечения
Лучевая болезнь является наиболее извест"
взаимодействия с наиболее важными биомоле"
ной и хорошо изученной свободнорадикальной
БИОХИМИЯ том 86 вып. 11 2021
1638
ШАРАПОВ и др.
патологией. Под лучевой болезнью понимают
электронов на кислород и генерация суперок"
определенный комплекс проявлений поражаю"
сидного анион"радикала O•-) и активацией ряда
щего действия ионизирующих излучений на ор"
оксидаз: NAD(P)H"оксидаз (NOX), моноами"
ганизм в дозе свыше 1 Гр. Симптоматика луче"
ноксидаз (MAO), ксантиноксидаз (XO), цикло"
вой болезни зависит от нескольких факторов:
оксигеназ (COX), миелопероксидазы (MPO),
вида ионизирующего излучения (рентгеновское
NO"синтаз (NOS) и др. Рост уровня СР и
излучение, γ"излучение, β"излучение, α"части"
АФК/АФА (вызванный как экзогенными, так и
цы и т.д.), локализации облучаемого участка те"
эндогенными факторами) приводит к развитию
ла (общее/тотальное или местное), локализации
окислительного стресса в облучённых тканях.
источника излучения (внешнее или инкорпори"
Развитие окислительного стресса сопровожда"
рованное), равномерности облучения (равно"
ется массовой гибелью активно делящихся кле"
мерное или неравномерное) и времени облуче"
ток (особенно клеток костного мозга, половых
ния (однократное, повторное, пролонгирован"
желёз, эпителия кишечника и бронхов), причём
ное, хроническое облучение) [16, 17]. В 1954 г.
это может быть как программируемая гибель
Gerschman et al. [18] предположили, что токси"
(апоптоз, пироптоз), так и некроз в зависимости
ческое действие кислорода и радиоактивного
от дозы облучения [21].
излучения имеют общий механизм действия,
При действии ионизирующей радиации ско"
который обусловлен образованием свободнора"
рость образования АФК и вторичных продуктов
дикальных молекул. Позже исследование меха"
СР"окисления зачастую значительно превыша"
низмов лучевой болезни явилось первым дока"
ет способность живых клеток к их элиминации,
зательством патофизиологического эффекта
что приводит к массовому повреждению нуклеи"
свободных радикалов in vivo [19]. В настоящее
новых кислот, белков и липидов. Повреждение
время угроза лучевой болезни сохраняется на
биомакромолекул является одной из основных
объектах, связанных с техногенными источни"
причин пострадиационной гибели. На практике
ками ионизирующих излучений (АЭС, ускори"
для предотвращения пагубных последствий
тели и т.п.) и при лучевой терапии рака (при об"
действия ионизирующей радиации используют
лучении опухолей могут поражаться соседние
радиозащитные препараты. По способу приме"
здоровые ткани пациента).
нения и механизму действия можно выделить
Механизм действия ионизирующего излуче@
три основных класса радиозащитных соедине"
ния. Ионизирующее излучение - это потоки
ний: 1) соединения, предотвращающие радиа"
фотонов, элементарных частиц или осколков
ционное поражение - радиопротекторы (при"
деления атомов, способных ионизировать веще"
меняются до облучения); 2) соединения, стиму"
ство. Ионизация сопровождается превращени"
лирующие пострадиационное восстановление -
ем нейтральных атомов или молекул в ионы или
радиомитигаторы (применяются после облуче"
радикалы (рис. 1).
ния на ранних стадиях до клинических проявле"
Ионизирующее излучение имеет прямое и
ний острого лучевого поражения); 3) терапевти"
непрямое воздействие на живые организмы.
ческие соединения, которые применяются пос"
Прямое воздействие включает повреждение био"
ле проявления первых клинических признаков
логических молекул за счёт непосредственного
острой лучевой болезни. К 1"му классу можно
контакта c квантом или частицей ионизирую"
отнести низкомолекулярные антиоксиданты
щего излучения. Непрямое воздействие ионизи"
(полифенолы, некоторые витамины, сульфгид"
рующего излучения связано с образованием в
рильные соединения и т.п.), ферменты"антиок"
клетке продуктов радиолиза воды (СР, АФК) и
сиданты, индукторы синтеза антиоксидантов,
различных вторичных продуктов СР"окисления
соединения, вызывающие гипоксию и т.д. Ко
(гидропероксиды, нитрозилы, дикарбонилы
2"му и 3"му классам относятся большое количе"
и др.). На 100 электрон"вольт поглощённой
ство соединений, влияющих на пострадиацион"
энергии ионизирующего излучения в водной
ное восстановление: стимуляторы гемопоэза,
среде в среднем образуется: 2,4 гидроксильных
иммуномодуляторы и т.д. (преимущественно
радикала HО•, 2,8 сольватированных электро"
цитокины, гормоны) [22]. Радиозащитные со"
нов, 0,4 атома водорода, 0,8 молекул H2O2 и дру"
единения представлены достаточно гетероген"
гих соединений [20]. Примечательно, что поми"
ной группой соединений, которые отличаются
мо генерирования СР и АФК, вызванного иони"
по структуре, механизму действия и эффектив"
зирующим излучением (экзогенный источник),
ности. Более подробно с основными классами
после облучения наблюдается рост эндогенных
радиозащитных соединений можно ознако"
АФК (преимущественно митохондриальных),
миться в обзорных работах [23-25]. Также сле"
который связан с нарушением функции элект"
дует отметить, что наиболее чувствительны к
рон"транспортной цепи митохондрий (утечка
воздействию ионизирующего излучения актив"
БИОХИМИЯ том 86 вып. 11 2021
РОЛЬ ГИДРОПЕРОКСИДАЗ ПРИ СР"ПАТОЛОГИЯХ
1639
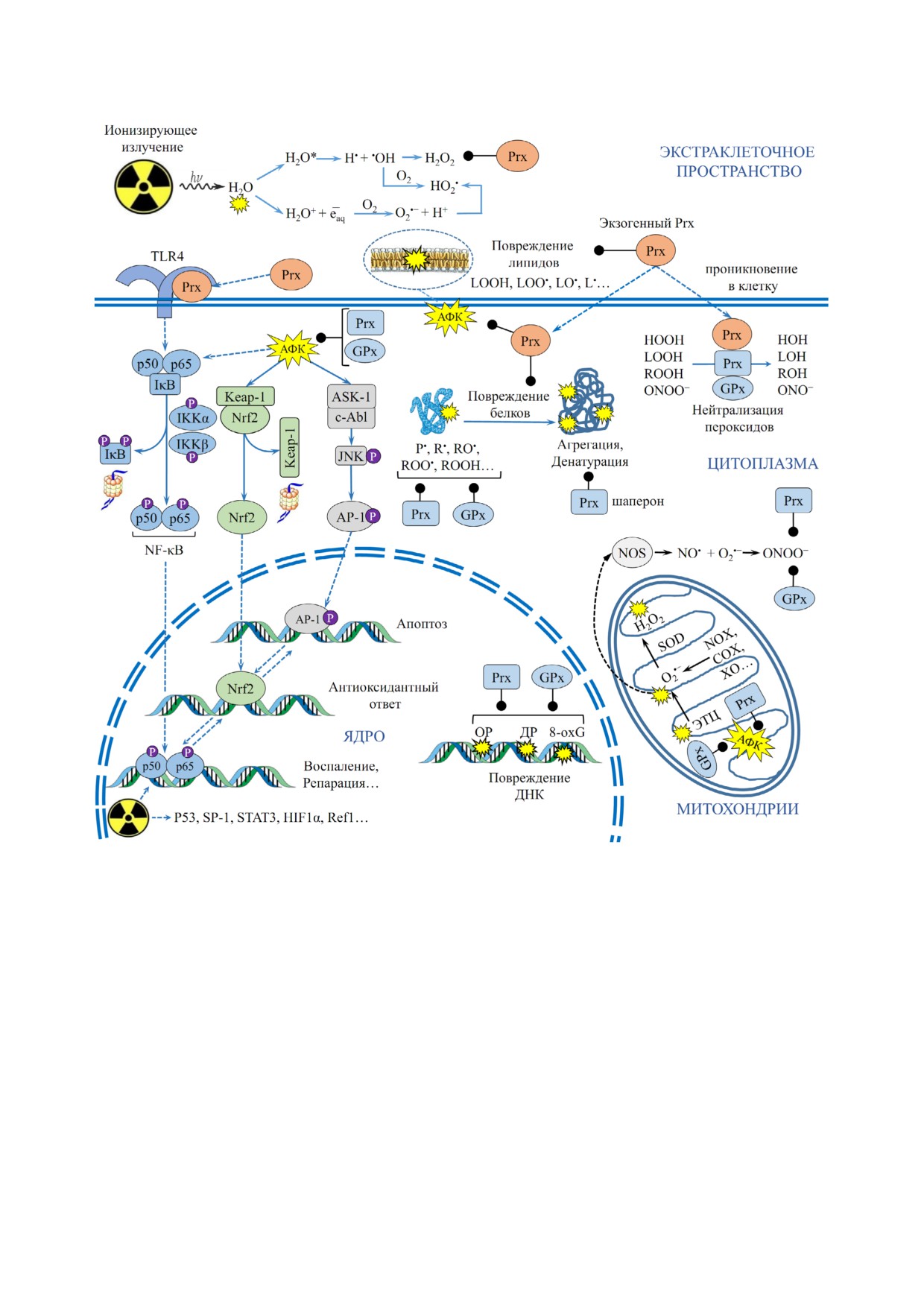
Рис. 1. Механизм действия ионизирующего излучения: прямое (ионизация макромолекул) и непрямое воздействие (гене"
рация АФК). Радиозащитная роль пероксиредоксинов - Prx (эндогенных и экзогенных) и глутатионпероксидаз - GPx, ко"
торые представлены во всех компартментах клетки, осуществляется через подавление свободнорадикальных реакций (от"
мечено линией с точкой). Стимулирующий эффект отмечен стрелкой. Опосредованный эффект (стимуляция сигнального
каскада, пересечение плазматической мембраны) отмечен пунктирной стрелкой. Представлена реакция радиолиза воды, а
также основные продукты радиолиза органических молекул: липидные радикалы (LOO•, LO•, L•), алкильные радика"
лы (R•), алкоксильные радикалы (RO•), гидропероксильные радикалы (ROO•) и радикалы белков (P•). Основные субстра"
ты GPx и Prx: липогидропероксиды (LOOH), алкилгидропероксиды (ROOH), пероксид водорода (H2O2), пероксинит"
рит (ONOO-). В условиях окислительного стресса 2"Cys Prx (Prx1-4) проявляют шаперонную активность, которая препят"
ствует денатурации и агрегации белков. Повреждения ДНК: ОР - одноцепочечные разрывы, ДР - двуцепочечные разры"
вы, 8"oxG - 8 оксо"гуанин. ЭТЦ - электрон"транспортная цепь митохондрий. NAD(P)H"оксидазы (NOX), циклооксиге"
назы (COX), ксантиноксидазы (XO), NO"синтазы (NOS). Отмечены основные сигнальные пути клетки (TLR4/NF"κB,
Keap"1/Nrf2, ASK"1/AP"1), которые активируются при действии ионизирующего излучения и на которые влияют Prx и GPx
но делящиеся клетки (эпителиальные, стволо"
ных радиозащитных препаратов, направленных
вые и эмбриональные), поэтому именно этот
в первую очередь на сохранение этих типов тка"
тип клеток особенно нуждается в радиозащите.
ней, остаётся важной и актуальной задачей. При
В настоящее время разработка новых эффектив"
этом особый интерес вызывает направление по
БИОХИМИЯ том 86 вып. 11 2021
1640
ШАРАПОВ и др.
созданию радиопротекторов на основе фермен"
клетках глиобластомы человека U251 актив"
тов"антиоксидантов [22], т.к. они отличаются
ность GPx примерно в 4 раза выше, чем в исход"
низкой токсичностью и высокой эффектив"
ных глиальных клетках [33]. Тем не менее роль
ностью (см. далее).
глутатионпероксидаз в канцерогенезе неодно"
Роль глутатионпероксидаз в радиозащитном
значна, т.к. для некоторых изоформ (GPx1,
ответе. В ответ на действие ионизирующего из"
GPx3, GPx4) показана онкосупрессорная, а для
лучения и рост уровня АФК в клетке происходит
других (GPx2) онкогенная роль [32].
адаптивная индукция синтеза ферментов"анти"
Роль пероксиредоксинов в радиозащитном от@
оксидантов. В частности, в клетках яичника ки"
вете. Высокая радиозащитная способность се"
тайского хомячка (CHO) после облучения наб"
мейства пероксиредоксинов была показана в се"
людается мощная индукция экспрессии генов
рии экспериментов на животных и клеточных
супероксиддисмутаз (Mn"SOD, Cu/Zn"SOD) и
моделях. Установлено, что при воздействии
глутатионпероксидаз (GPx). Суперэкспрессия
рентгеновского излучения на кожу крыс проис"
указанных генов (достигаемая трансфекцией
ходит рост уровня пероксиредоксинов в клет"
клеток экспрессирующими векторами с соответ"
ках [34]. Рентгеновское облучение семенников
ствующими генами) приводит к росту радиоре"
мыши приводит к многократному усилению
зистентности клеток. Так, после облучения
экспрессии генов PRDX1 и PRDX2 [35]. Кроме
рентгеновскими лучами дозой 10 Гр выживае"
того, было показано, что у облучённых мышей
мость трансфецированных клеток CHO (с супер"
значительно возрастает уровень Prx1 и Prx2 в
экспрессией GPx) выросла на 40% по сравне"
мозгу [36], а в печени и селезёнке значительно
нию с исходными клетками [26]. Кроме того, в
возрастает уровень Prx6 [37].
экспериментах с клетками CHO AA8 было обна"
Было обнаружено, что многие линии рако"
ружено, что внесение соединений селена в куль"
вых клеток, обладающие высокой устойчи"
туральную среду приводило к существенному
востью к действию ионизирующего излучения,
росту (в 4 раза) активности GPx, увеличению ра"
имеют высокий уровень экспрессии пероксире"
диорезистентности клеток и снижению уровня
доксинов. Например, установлена ведущая роль
радиационно"индуцированных мутаций [27, 28].
Prx2 в радиоустойчивости клеток рака прямой
В то же время в других экспериментах было по"
кишки (HCT116, Caco"2, T84 и LoVo) и молоч"
казано, что рост экспрессии GPx в клетках лим"
ной железы (MCF+FIR3) человека [38, 39]. При
фобластомы человека (Sup"T1) и китайского хо"
агрессивной радиорезистентной форме рака
мячка (CHO AA8) приводит к увеличению ак"
мозга (глиобластоме) наблюдается высокий
тивности этого фермента в 8 и 30 раз соответ"
уровень экспрессии PRDX4. Значительное повы"
ственно, но радиорезистентность при этом ме"
шение уровня Prx6 обнаружено при различных
няется незначительно [29]. Снижение уровня
формах рака (мозга, лёгких, молочной железы
эндогенных глутатионпероксидаз до 17% (выз"
и т.д.), многие из которых обладают высокой ра"
ванное диетой с дефицитом селена) и глутатио"
диоустойчивостью [40].
на до 3-4% (вызванное комбинацией ингибито"
В экспериментах in vitro и in vivo было показа"
ров бутионинсульфоксимина и диэтилмалеата)
но, что подавление экспрессии генов PRDX1-6 в
снижает радиорезистентность клеток почек мы"
раковых клетках приводило к потере их радио"
ши примерно в 1,4 раза [28, 30].
резистентности [38, 41-45], что позволяет рас"
Таким образом, глутатионпероксидазы, не"
ценивать их в качестве потенциальных мишеней
сомненно, играют важную роль в радиорезистент"
при радиотерапии рака [46]. Так, подавление
ности клеток животных, которая в первую оче"
экспрессии PRDX2 существенно снижало устой"
редь связана с их антиоксидантной актив"
чивость раковых клеток Caco"2 и MCF+FIR3 к
ностью. Для GPx показана высокая пероксидаз"
действию радиации [38, 39]. Нокдаун PRDX4 в
ная активность и наиболее эффективный меха"
раковых клетках приводит к повышению
низм катализа среди пероксидаз (особенно для
чувствительности клеток к действию ионизиру"
селен"содержащих GPx), позволяющий восста"
ющего излучения, подавлению роста и метаста"
навливать пероксид водорода или органические
зирования опухолей [47]. Нокдаун PRDX6 подав"
гидропероксиды до воды или соответствующих
ляет рост клеток (A549 и NCI"H460) и стимули"
спиртов (рис. 1), в широком диапазоне концент"
рует апоптоз [48], а нокдаун PRDX6 в клетках
раций [31]. Cуперэкспрессия GPx позволяет эф"
эмбриональных фибробластов мыши 3Т3 сни"
фективно элиминировать возникшие после об"
жает их устойчивость к действию рентгеновско"
лучения гидропероксиды и зачастую приводит к
го излучения на 40-50% [49].
росту радиорезистентности клеток, что особен"
Радиозащитное действие эндогенных перок"
но характерно для различных форм раковых
сиредоксинов реализуется благодаря их способ"
клеток [32]. Например, в радиорезистентных
ности восстанавливать широкий спектр неорга"
БИОХИМИЯ том 86 вып. 11 2021
РОЛЬ ГИДРОПЕРОКСИДАЗ ПРИ СР"ПАТОЛОГИЯХ
1641
нических и органических пероксидов, а также их
плотности (ЛНП). Гиперлипидемия, сопровож"
участию в сигнально"регуляторных путях клет"
дающая развитие атеросклероза, создает усло"
ки, опосредованных гидропероксидами и через
вия для значительного увеличения содержания
образование межмолекулярных дисульфидных
субстрата окисления - полиеновых липидов в
связей с регуляторными белками [40]. Кроме то"
крови, что неизбежно должно приводить к уве"
го, в условиях окислительного стресса 2"Cys пе"
личению скорости их СР"окисления [50, 51].
роксиредоксины (Prx1-4) проявляют шаперон"
В работах, выполненных в Кардиологическом
ную активность, которая препятствует инакти"
центре РАМН, впервые было показано, что в
вации и агрегации белков, тем самым сохраняя
крови и атеросклеротически поврежденной
жизненно важные функции клетки [40].
стенке сосудов больных атеросклерозом обнару"
живается существенное увеличениe содержания
молекулярных продуктов СР"окисления - ли"
СВОБОДНОРАДИКАЛЬНЫЕ ПАТОЛОГИИ
погидропероксидов, преимущественно 13"гид"
СЕРДЕЧНО@СОСУДИСТОЙ СИСТЕМЫ
ропероксилинолеата [51]. При детальном ана"
лизе методом ВЭЖХ на колонке с хиральной
Болезни системы кровообращения являются
фазой по соотношению стереоизомеров удалось
главной причиной смертности от неинфекци"
установить, что выявляемые при атеросклерозе
онных болезней в различных странах. В России
LOOH в тканях образуются исключительно в ре"
её показатели составляют в среднем 55% от об"
зультате неферментативного ПОЛ [50, 51]. Од"
щей смертности, при этом в 90% случаев причи"
новременно у больных атеросклерозом было об"
ной являются ишемическая болезнь серд"
наружено снижение активности утилизирующе"
ца (ИБС) и инсульт мозга. Известно, что как с
го LOOH фермента - эритроцитарной Se"содер"
морфологической, так и с патогенетической
жащей глутатионпероксидазы (GPx), причём в
точки зрения решающую роль в формировании
повреждённой при атеросклерозе стенке сосу"
ИБС и инсульта играет атеросклероз. К настоя"
дов также наблюдали уменьшение активности
щему моменту накоплены многочисленные дан"
GPx и Cu/Zn"супероксиддисмутазы (Cu/Zn"
ные, указывающие на ведущую роль процесса
SOD), прогрессирующее с нарастанием степени
перекисного окисления липидов (ПОЛ) в ини"
атеросклеротического повреждения [5]. Было
циации и развитии сердечно"сосудистых забо"
показано, что у больных атеросклерозом ЛНП
леваний атеросклеротического генеза [50].
значительно более окислены, чем частицы ЛНП
Атеросклероз. Атеросклероз - хроническое
практически здоровых людей [50]. Окисление
заболевание артерий, сопровождающееся обра"
ЛНП в плазме крови может происходить как пу"
зованием атероматозных бляшек на стенке сосу"
тём многоступенчатой активации различных
дов, суживающих их просветы и способствую"
оксидаз (NAD(P)H"оксидазы, ксантиноксида"
щих тромбообразованиям и нарушениям крово"
зы, NO"синтазы, липоксигеназы и миелоперок"
тока. Предположение о том, что свободноради"
сидазы), так и за счёт автоокисления при ката"
кальные процессы играют важную роль в пато"
лизе ионами металлов переменной валентности
генезе атеросклероза были высказаны ещё в
на фоне снижения антиоксидантной защиты.
конце 50"х годов прошлого века, тем не менее
Известно, что СР"окисление углеводородов
конкретные данные, подтверждающие увеличе"
протекает двухстадийно, причём на первой ста"
ние содержания первичных молекулярных про"
дии образуются первичные молекулярные про"
дуктов СР"окисления (гидропероксидов) в со"
дукты СР"окисления - нестойкие гидроперок"
судистой стенке при атерогенезе, были получе"
сиды, которые подвергаются дальнейшей окис"
ны лишь через два десятилетия [50, 51]. В насто"
лительной деструкции с образованием карбо"
ящее время общепринято, что атеросклероз яв"
нильных соединений. Таким образом, окисли"
ляется свободнорадикальной патологией [52].
тельный стресс при атерогенезе, характеризую"
Было показано, что активация СР"процессов
щийся резким увеличением содержания LOOH
после тотального облучения мышей рентгеновс"
в тканях, неизбежно переходит в карбонильный
ким излучением приводит к образованию в со"
стресс, сопровождающийся накоплением вто"
судах бляшек, подобных атеросклеротичес"
ричных продуктов ПОЛ, таких как гидроксино"
ким [53]. Применение антиоксидантов в экспе"
ненали и МДА [5]. Альдегидные группы МДА
риментальных моделях предотвращало образо"
способны легко реагировать с аминогруппами
вание атеросклеротических бляшек и снижало
биополимеров (включая нуклеиновые кисло"
риск возникновения заболевания [52]. Одним
ты), вследствие чего МДА может проявлять
из ведущих факторов, играющих важную роль в
свойства природного мутагена. МДА также мо"
этиологии и патогенезе атеросклероза, является
жет вызывать модификацию белков, образуя
накопление окисленных липопротеинов низкой
внутри" и межмолекулярные сшивки в их моле"
3 БИОХИМИЯ том 86 вып. 11 2021
1642
ШАРАПОВ и др.
кулах. В частности, было показано, что МДА
ЛНП in vivo [19]. Коэнзим Q, следовательно, иг"
способен модифицировать аполипопротеин
рает ведущую роль в защите частиц ЛНП от СР"
В"100 частиц ЛНП [5]. Окислительно модифи"
окисления, причём восстановление образую"
цированные частицы ЛНП, взаимодействуя со
щихся семихинонных радикалов обеспечивает"
скавенджер"рецепторами макрофагов стенки
ся при их взаимодействии с аскорбатом, присут"
сосудов, эффективно захватываются этими
ствующим в плазме крови в высокой концен"
клетками и накапливаются в их липидных вакуо"
трации [50]. Эта система биорегенерации на"
лях. Вследствие этого макрофаги превращаются
столько эффективна, что для обеспечения за"
в так называемые «пенистые клетки», образуя
щиты ЛНП от окисления достаточно присут"
липидные кластеры (зоны липоидоза) - первич"
ствия всего нескольких молекул коэнзима Q на
ные предатеросклеротические повреждения
частицу липопротеина. Поскольку биорегенера"
стенки сосудов. Было установлено, что фермен"
ция фенолов осуществляется неферментативно,
тативное окисление полиеновых ацилов фосфо"
очевидно, что эта система может участвовать
липидов наружного слоя частиц ЛНП не вызы"
также и в регенерации синтетических феноль"
вает увеличения скорости захвата ЛНП культи"
ных антиоксидантов. Действительно, показано,
вируемыми макрофагами, тогда как МДА"моди"
что в присутствии аскорбиновой кислоты про"
фицированные ЛНП поглощаются этими клет"
исходит эффективное восстановление радика"
ками с экстремально высокой эффективностью.
лов синтетического антиоксиданта пробукола
Из этого следует, что ведущую роль в атероген"
in vitro и in vivo [56]. Необходимо подчеркнуть,
ном повреждении стенки сосудов играют не
что, хотя витамин Е транспортируется в орга"
окисленные ЛНП (обогащённые LOOH"произ"
низме частицами ЛНП, он не участвует в защи"
водными фосфолипидов в наружном слое час"
те ЛНП от окисления, поскольку витамин Е
тиц), а частицы ЛНП, включающие МДА"моди"
(как и другие жирорастворимые витамины) пе"
фицированный апопротеин В"100 [54]. Кроме
реносится в гидрофобном ядре частицы и не мо"
того, в последние годы стало понятно, что окис"
жет восстанавливать гидропероксильные ради"
ленные ЛНП (по всей видимости, карбонил"мо"
калы (ROO•), образующиеся в полиеновых аци"
дифицированные ЛНП) играют важную роль в
лах фосфолипидов, т.к. окисленные ацилы вслед"
развитии дисфункции эндотелия [55]. Скавенд"
ствие увеличения полярности «выдвигаются» в
жер"рецептор эндотелиоцитов LOX"1 может
водную фазу [57]. Отсутствие влияния высоких
взаимодействовать с частицами окислительно"
доз введённого витамина Е на окисляемость
модифицированных ЛНП, и этот комплекс вы"
частиц ЛНП in vivo подтверждена нами экспери"
зывает экспрессию NAD(P)H"оксидазы, кото"
ментально [58]. Таким образом, исследования
рая генерирует O•-, вызывая повреждение эндо"
по использованию антиоксидантов (преимуще"
телиальных клеток, выстилающих внутреннюю
ственно витамина Е) при атеросклерозе, исхо"
поверхность сосудов. Следовательно, началь"
дившие из правильной установки о необходи"
ные стадии дисфункции эндотелия сосудов -
мости подавления окислительной модифика"
процесса, играющего ведущую роль в атерогене"
ции ЛНП, не могли увенчаться успехом, и разо"
зе, напрямую зависят от образования окисли"
чарование в результатах этих исследований
тельно"модифицированных ЛНП. Следует от"
вполне понятно, поскольку проекты по исполь"
метить, что широкое использование в послед"
зованию антиоксидантов были весьма трудоём"
ние годы антиатерогенных холестерин"снижаю"
кими и затратными [41]. На основании вышеиз"
щих препаратов из класса ингибиторов β"гид"
ложенного можно утверждать, что перспективы
рокси"β"метилглутарил"коэнзим А редуктазы
использования низкомолекулярных фенольных
(статинов) вызывает необходимость дополни"
антиоксидантов (включая синтетические) в кар"
тельной защиты ЛНП от окисления [19]. Стати"
диологии далеко не исчерпаны, однако будущие
ны ингибируют не только биосинтез холестери"
исследования в этой области должны опираться
на, но и синтез коэнзима Q, восстановленная
на теоретические знания об окислительном ме"
форма которого защищает наружный фосфоли"
таболизме биофенолов в организме.
пидный монослой частиц ЛНП от окисления,
В конечном итоге O•-"зависимое поврежде"
таким образом, при терапии статинами защита
ние эндотелиоцитов провоцирует стимуляцию
частиц ЛНП от окисления должна быть ослаб"
апоптоза и гибель клеток эндотелия, что, в свою
лена. Увеличение окисляемости ЛНП при тера"
очередь, облегчает проникновение окислитель"
пии статинами было подтверждено нами экспе"
но"модифицированных ЛНП в стенку сосудов,
риментально [19], причём дотации коэнзима Q
вызывая их предатерогенное (липоидозное)
или синтетического фенольного антиоксиданта
повреждение [55]. Таким образом, можно утверж"
пробукола полностью нивелировали негативное
дать, что развитие окислительного и последую"
действие статинов по индукции СР"окисления
щего карбонильного стресса при атерогенезе
БИОХИМИЯ том 86 вып. 11 2021
РОЛЬ ГИДРОПЕРОКСИДАЗ ПРИ СР"ПАТОЛОГИЯХ
1643
приводит к нарушению сбалансированности
атеросклеротического поражения, в то время
процессов образования и утилизации физиоло"
как у трансгенных животных с повышенной
гически активных липогидропероксидов и явля"
экспрессией GPx1 наблюдали улучшение состо"
ется ключевым фактором, вызывающим преда"
яния эндотелия [60]. Следует отметить, что ак"
терогенные повреждения стенки сосудов и по"
тивность GPx (как и большинства других фер"
следующее формирование атеросклеротических
ментов) может ингибироваться дикарбонилами,
бляшек (рис. 2) [59].
образующимися в ходе ПОЛ. Дикарбонилы, об"
Роль глутатионпероксидаз в атеросклерозе.
разуя межмолекулярные сшивки в белках, при"
Известно, что основную функцию по нейтрали"
водят к конформационным изменениям, что не"
зации липогидропероксидов, являющихся пус"
гативно влияет на активность ферментов [61].
ковым механизмом атерогенеза, выполняют два
Роль пероксиредоксинов в атеросклерозе. Ве"
семейства пероксидаз: глутатионпероксидазы и
роятно, пероксиредоксины играют ключевую
пероксиредоксины. Среди глутатионпероксидаз
роль в ферментативной антиоксидантной защи"
наиболее изученной в отношении атерогенеза
те эндотелиоцитов, на что указывает их высокий
является широко распространенная изоформа
уровень экспрессии, на порядки превосходя"
GPx1. Нарушение экспрессии гена GPx1 прово"
щий уровень экспрессии других ферментов"ан"
цирует повышенную восприимчивость эндоте"
тиоксидантов [62]. Показано, что дефицит Prx1
лиоцитов к окислительным агентам. У мышей,
приводит к развитию воспалительных процес"
нокаутных по ApoE и GPx1, ускорялся процесс
сов, а также к повреждению сосудов и росту
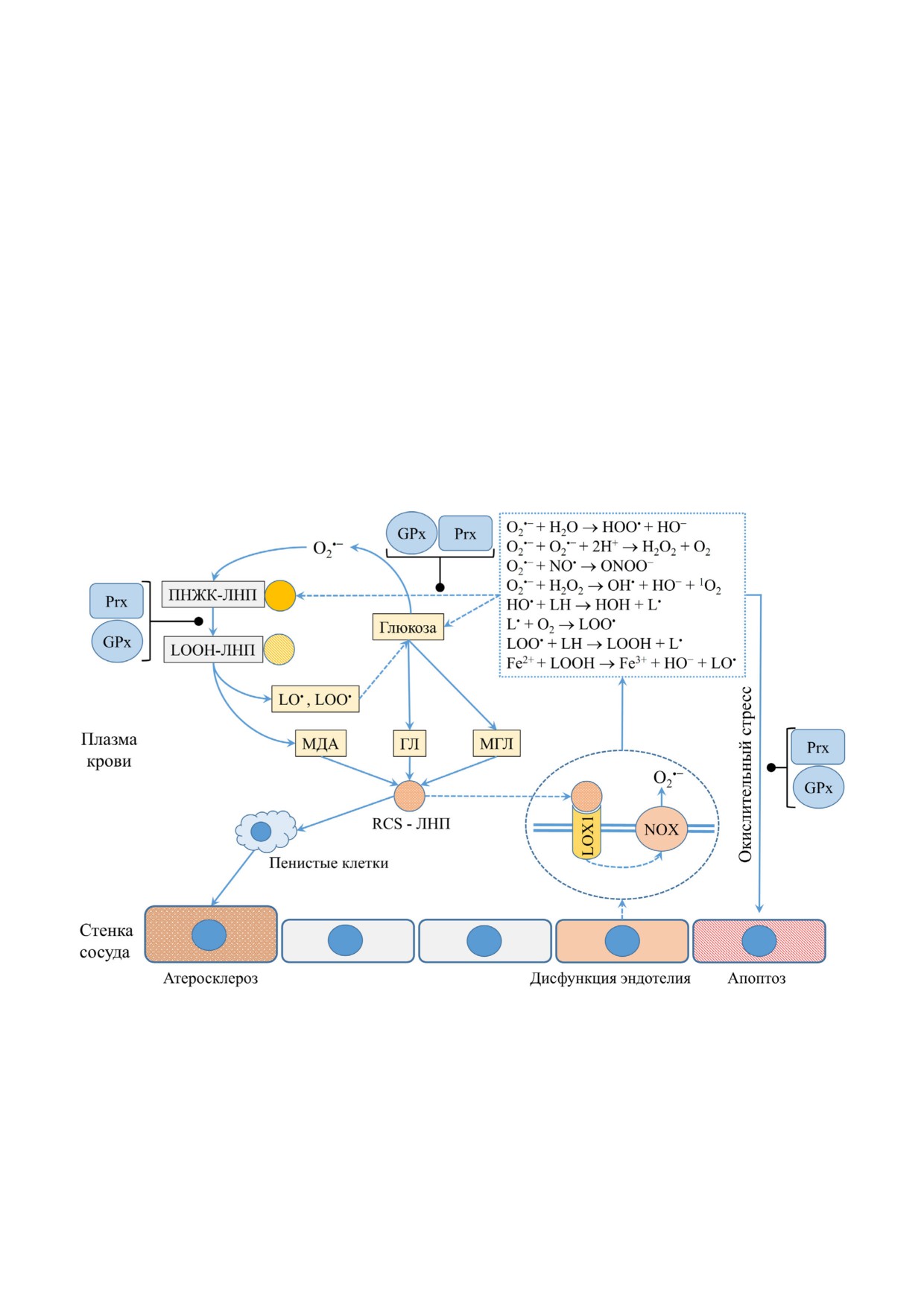
Рис. 2. Механизм развития атеросклероза, роль пероксиредоксинов (Prx) и глутатионпероксидаз (GPx) в этом процессе.
Подавление свободнорадикальных реакций под действием Prx и GPx отмечено линией с точкой. Стимулирующий эффект
отмечен обычной стрелкой, опосредованный эффект отмечен пунктирной стрелкой. LOX"1 (lectin"type oxidized LDL
receptor 1) - рецептор окисленных липопротеинов низкой плотности; NOX - NAD(P)H"оксидаза; ПНЖК - полинена"
сыщенные жирные кислоты; ЛНП - липопротеины низкой плотности; МДА - малоновый диальдегид; ГЛ - глиоксаль;
МГЛ - метилглиоксаль; RCS"ЛНП - карбонил"модифицированные ЛНП. Представлены основные продукты окисления
в плазме крови при атеросклерозе под действием супероксидного анион"радикала: гидроксильный радикал (HO•), липо"
алкильный радикалы (L•), липоксильный радикалы (LO•), липопероксильный радикалы (LOO•) и липогидроперокси"
ды (LOOH), пероксид водорода H2O2), пероксинитрит (ONOO-). GPx и Prx осуществляют восстановление H2O2, ONOO-
и LOOH, тем самым препятствуя развитию окислительного стресса и прогрессированию атеросклероза
БИОХИМИЯ том 86 вып. 11 2021
3*
1644
ШАРАПОВ и др.
тромбообразований [63]. Мыши, нокаутирован"
гезии, факторов роста), которые нарушают
ные по генам PRDX1 и ApoE, имеют более об"
функцию эндотелия сосудов.
ширные атеросклеротические поражения сосу"
Кроме того, интенсивное гликирование бел"
дов, нежели мыши, нокаутированные только по
ков приводит к активации ряда оксидаз
одному гену - ApoE [63]. Кроме того, нока"
(NAD(P)H"оксидазы, глюкооксидазы), в ре"
ут PRDX1 приводит к развитию дефектов гладко"
зультате чего возрастает продукция СР, АФК и
мышечных клеток сосудов (VSMC) [64]. Недо"
АФА в клетке. На модели аллоксанового диабе"
статок Prx2 также усугубляет атеросклероз у мы"
та, основанной на повышенном генерировании
шей, нокаутных по ApoE [65]. Экстраклеточная
О2•- в β"клетках поджелудочной железы, было
форма Prx4 связывается с поверхностью эндоте"
установлено, что гипоинсулинемия и гипергли"
лиальных клеток (через гепарансульфат) и обес"
кемия у животных в этих условиях непосред"
печивает защиту клеток от внеклеточных АФК.
ственно связаны со свободнорадикальным по"
Суперэкспрессия человеческого PRDX4 у транс"
вреждением и снижением активности Cu/Zn"
генных мышей, нокаутных по ApoE-/-, значи"
SOD и GPx. В связи с этим показательно, что у
тельно подавляет развитие атеросклероза, пре"
морских свинок (в отличие от крыс, резистент"
пятствует развитию воспаления, окислительно"
ных к действию аллоксана) активность Cu/Zn"
го стресса и некротической гибели клеток [66].
SOD и GPx в поджелудочной железе в несколь"
Мыши, нокаутные по гену PRDX6, имеют значи"
ко раз выше, чем у крыс. Вместе с тем индукция
тельно большее количество атеросклеротичес"
синтеза Cu/Zn"SOD и GPx в β"клетках подже"
ких поражений аорты, чем мыши дикого ти"
лудочной железы крыс делает этих животных
па [67, 68]. Таким образом, многие эксперимен"
резистентными к действию аллоксана, подобно
тальные данные указывают на важную антиате"
морским свинкам [73]. Рост уровня окислитель"
рогенную роль Prx1"6 в клетках эндотелия [69].
ных процессов, подавление активности антиок"
Следует также отметить, что пероксиредоксины
сидантных ферментов, приводит к развитию
(как и в случае глутатионпероксидаз) ингибиру"
окислительного стресса, который снижает эф"
ются низкомолекулярными дикарбонила"
фективность сигнально"регуляторной функции
ми [70]. Очевидно, что подавление активности
инсулина, что способствует ещё большему росту
Prx1-6 ослабляет антиоксидантную защиту эн"
уровня глюкозы в крови. При диабете наблюда"
дотелиальных клеток, способствуя прогрессиро"
ется увеличение окислительной модификации
ванию окислительного стресса и дальнейшему
ЛНП, что происходит вследствие соокисления
повреждению эндотелия, приводящему к его
глюкозы с полиеновыми липидами, которое
дисфункции.
сопровождается образованием О2•- и липидных
Диабет. Диабет - это системное заболевание,
радикалов. Кроме того, у больных диабетом
связанное с нарушением в обмене углеводов.
происходит увеличение окислительной деструк"
Диабет 1"го типа (инсулин"зависимый диабет)
ции молекул ДНК, характеризующееся умень"
связан с деструкцией β"клеток островков Лан"
шением длины теломер в ядерных клетках кро"
герганса, что влечёт за собой недостаточную
ви с одновременным увеличением уровня ко"
секрецию инсулина. Диабет 2"го типа (инсулин"
нечного продукта окислительного катаболизма
независимый диабет) связан с изменением
ДНК - 8"гидроксигуанина, в крови и моче, что
чувствительности клеток к инсулину. Одним из
сопряжено со вторичной индукцией окисли"
признаков диабета является кетоз и/или ацидоз.
тельного стресса у этих больных [59].
В свою очередь, и кетоз, и большая часть случа"
Активация окислительных процессов приво"
ев развития ацидоза связаны с развитием окис"
дит к интенсификации ПОЛ и автоокислению
лительного стресса [71].
сахаров, что способствует росту уровня дикар"
При дефиците инсулина развивается гипер"
бонилов (МДА, глиоксаля и метилглиоксаля) и
гликемия. При гипергликемии существенно по"
развитию карбонильного стресса. Диабетичес"
вышается концентрация свободной глюкозы в
кая гипергликемия сопровождается интенсифи"
крови и тканях, что приводит к более интенсив"
кацией автоокисления глюкозы, в результате че"
ному гликированию белков, в первую очередь
го образуется дикарбонил - глиоксаль (гомо"
гемоглобина, альбуминов, коллагена, кристал"
лог МДА). Активация гликолиза при гипергли"
линов и апопротеина ЛНП. К наиболее распро"
кемии приводит к накоплению триозофосфа"
странённым конечным продуктам гликирова"
тов, при ферментативном превращении кото"
ния относятся карбоксиметиллизин, карбокси"
рых образуется изомер МДА - метилглиок"
этиллизин и аргпиримидин [72]. При взаимо"
саль [74]. Кроме того, свободные радикалы, об"
действии продуктов гликирования с рецептора"
разующиеся при разложении органических гид"
ми увеличивается продукция провоспалитель"
ропероксидов могут индуцировать нефермента"
ных цитокинов (TNFα, IL"1, IL"6, молекул ад"
тивное образование метилглиоксаля при ради"
БИОХИМИЯ том 86 вып. 11 2021
РОЛЬ ГИДРОПЕРОКСИДАЗ ПРИ СР"ПАТОЛОГИЯХ
1645
кальной атаке промежуточных продуктов глико"
мина активность эритроцитарной Cu/Zn"SOD
лиза - фосфорилированных производных глю"
значительно возрастала [77].
козы [75]. У больных сахарным диабетом 2"го ти"
Роль глутатионпероксидаз в диабете. Несом"
па обнаруживается значительное увеличение
ненно, глутатионпероксидазы являются важ"
глиоксаля и метилглиоксаля в плазме крови. Эти
нейшими антиоксидантами, однако их роль в
дикарбонилы, подобно МДА, могут вызывать
диабете неоднозначна. Например, нокаут GPx1 у
модификацию апопротеина В"100 ЛНП, которая
мышей вызывает диабетоподобный фенотип
опознаётся скавенджер"рецепторами макрофа"
1"го типа, в то время как его суперэкспрессия
гов и тем самым индуцирует накопление ЛНП в
приводит к фенотипу диабета 2"го типа [78].
стенке сосудов с последующим развитием липо"
В другом исследовании было показано, что по"
идозных повреждений. Метформин, применяе"
вышенный уровень GPx1 препятствует патологи"
мый сегодня при терапии сахарного диабета
ческому ремоделингу левого желудочка, вызван"
2"го типа, позволяет существенно снизить уро"
ному диабетом [79]. Недостаток GPx3 ассоци"
вень окисления и карбонильной модификации
ирован с ростом уровня пероксидов в крови и
ЛНП [5]. Метформин относится к бигуанидам,
снижением сигнальной функции инсулина [78].
т.е. его структура включает две гуанидиновых
У трансгенных мышей с суперэкспрессией GPx4
группы (H2N(NH)С"HN"C(NH)NH2), которые
(в 2-3 раза выше нормы) наблюдался рост устой"
«охотно» атакуются глиоксалем/метилглиокса"
чивости β"клеток к длительным повышениям
лем с образованием гуанидин"дикарбонильных
уровня свободных жирных кислот в крови, вызы"
продуктов, благодаря чему концентрация сво"
вающим поражение поджелудочной железы [80].
бодных карбонилов в крови снижается.
Роль пероксиредоксинов в диабете. Совсем не"
Известно, что МДА, глиоксаль и метилгли"
давно было показано, что Prx1 является важней"
оксаль легко проникают через мембрану клеток
шим антиоксидантным ферментом β"клеток
и способны ингибировать внутриклеточные ан"
поджелудочной железы. Нокдаун гена PRDX1 с
тиоксидантные ферменты. Примечательно, что
помощью короткой интерферирующей РНК
глиоксаль и метилглиоксаль, накапливающиеся
(siRNA) или ингибирование фермента Prx1 с по"
при диабетической гипергликемии, являются
мощью коноидина А увеличивало чувствитель"
более эффективными ингибиторами большин"
ность β"клеток к действию H2O2 и пероксинит"
ства антиоксидантных ферментов по сравнению
рита. Напротив, суперэкспрессия PRDX1 увели"
с МДА [75]. Интересно, что несмотря на струк"
чивала резистентность β"клеток крыс к окисли"
турное сходство МДА, глиоксаль и метилглиок"
тельному стрессу [81]. Суперэкспрессия PRDX4
саль оказывают разное влияние на физико"хи"
также увеличивала выживаемость β"клеток у
мические характеристики белков. Например,
трансгенных мышей, нормализовала морфо"
метилглиоксаль в большей степени, чем глиок"
функциональное состояние поджелудочной же"
саль и другие карбонильные соединения, влияет
лезы в ответ на действие стрептозотоцина, часто
на кинетические параметры катализируе"
используемого для моделирования диабета у
мой GPx реакции восстановления пероксида
животных [82]. У нокаутных по гену PRDX6 мы"
водорода. Было показано, что при взаимодей"
шей развивался фенотип, сходный с ранней ста"
ствии аминокислот и белков с метилглиоксалем
дией диабета, вызванный как сниженной глю"
образуется супероксидный радикал и другие
козозависимой секрецией инсулина, так и по"
СР"интермедиаты, которые могут усиливать мо"
вышенной инсулинорезистентностью. Наруше"
дифицирующее действие метилглиоксаля. По"
ние сигнализации инсулина у таких мутантных
видимому, основное ингибирующее действие
животных приводило к снижению поглощения
дикарбонилов на ферменты связано с модифи"
глюкозы мышцами, наблюдались морфологи"
кацией структуры белков. В результате взаимо"
ческие и ультраструктурные изменения остров"
действия дикарбонилов с аминогруппами бел"
ков Лангерганса, печени, а также рост ПОЛ и
ков (реакция Майяра) образуются межмолеку"
уровня провоспалительных цитокинов в тка"
лярные сшивки, меняющие конформацию и на"
нях [83].
тивную структуру ферментов. Благодаря этим
Общность диабета и атеросклероза. Наруше"
свойствам активные карбонильные соедине"
ния углеводного обмена при диабете могут сти"
ния (RCS) по сравнению с гидропероксидами
мулировать развитие карбонильного стресса и
являются более сильными модификаторами.
интенсификацию атерогенной модифика"
Было показано, что у больных сахарным диабе"
ции ЛНП. Это объясняет известный факт про"
том 2"го типа наблюдается резкое падение ак"
грессирования атеросклероза при наличии диа"
тивности эритроцитарных антиоксидантных
бета, причём, в соответствии с полученными на"
ферментов: каталазы, Cu/Zn"SOD и GPx [76],
ми данными, можно высказать гипотезу о еди"
причём при терапии с использованием метфор"
ном молекулярном механизме повреждения
БИОХИМИЯ том 86 вып. 11 2021
1646
ШАРАПОВ и др.
стенки сосудов при атеросклерозе и сахарном
в высоких концентрациях, что также не всегда
диабете с участием карбонил"модифицирован"
возможно из"за проявления токсичных свойств
ных ЛНП. Следовательно, молекулярный меха"
в этих дозах [25, 84, 85]. Более того, некоторые
низм повреждения стенки сосудов при атеро"
из низкомолекулярных антиоксидантов (напри"
склерозе и сахарном диабете сходен и состоит в
мер, аскорбиновая кислота) в определённых ус"
увеличении окислительной модификации ЛНП,
ловиях (гипероксия, присутствие ионов метал"
вызванной низкомолекулярными карбониль"
лов переменной валентности и т.д.) могут про"
ными продуктами СР"окисления липидов при
являть прооксидантную функцию или же, про"
атеросклерозе или автоокисления молекул глю"
реагировав с первичными радикалами, превра"
козы при сахарном диабете (рис. 2). Таким обра"
титься во вторичный радикал. Ферменты лише"
зом, выдвигаемая нами гипотеза удовлетвори"
ны такого недостатка, например, одна молекула
тельно объясняет возможность индукции атеро"
каталазы способна восстановить несколько
генеза при диабете, а также тот факт, что нали"
миллионов молекул H2O2 за 1 мин, не теряя сво"
чие диабета сильно увеличивает риск возникно"
их каталитических свойств. Кроме того, фер"
вения атеросклероза [74].
менты не обладают цитотоксичностью, как
Приведённые данные позволяют полагать,
большинство низкомолекулярных соединений
что образование окислительно"модифициро"
(особенно синтетического происхождения) [25,
ванных ЛНП является ключевым фактором ате"
84, 85]. В этой связи создание терапевтических
рогенеза и дисфункции эндотелия - процессов,
препаратов антиоксидантного действия на ос"
играющих ключевую роль в развитии атероскле"
нове ферментов представляется перспективным
роза и диабета. Антиоксидантная терапия, как
направлением. Ранее мы рассматривали основ"
способ противодействия развитию окислитель"
ные типы ферментов"антиоксидантов в орга"
ного стресса у диабетических пациентов, была
низме млекопитающих: супероксиддисмута"
предложена более десяти лет назад. Однако
зы (SOD), каталаза (CAT), тиоредоксины (Trx),
опыт показывает, что классические антиокси"
глутатионпероксидазы (GPx), глутатион"S"
данты (типа витаминов E и C) недостаточно эф"
трансферазы (GST), пероксиредоксины (Prx)
фективны для нейтрализации окислительных
и др. [86]. Мы отмечали, что восстановление
процессов у больных диабетом [71]. Очевидно,
гидропероксидов с участием ферментов"перок"
что необходимо применение препаратов, спо"
сидаз может играть ключевую роль в предотвра"
собных нейтрализовать не только окислитель"
щении окислительного стресса, поскольку гид"
ный, но и карбонильный стресс.
ропероксиды (Н2О2, ROOH) при их разложе"
нии (гомолизе) служат основными источниками
активных свободных радикалов (HO•, RO•),
ПРИМЕНЕНИЕ ЭКЗОГЕННЫХ
способных инициировать/продолжить цепное
ФЕРМЕНТОВ@АНТИОКСИДАНТОВ ПРИ
СР"окисление биомолекул, тем самым усиливая
СВОБОДНОРАДИКАЛЬНЫХ ПАТОЛОГИЯХ
окислительный стресс [86]. В настоящее время с
практической точки зрения наибольший инте"
Вышеописанные свободнорадикальные па"
рес вызывают супероксиддисмутазы (восстанав"
тологии, несмотря на различия в клинических
ливающие супероксидный анион"радикал:
проявлениях, имеют общий механизм инициа"
2O•- + 2Н+ → Н2О2 + О2), а также каталаза (вос"
ции - активация СР"процессов и последующее
станавливающая пероксид водорода: 2Н2О2 →
развитие окислительного стресса. После пони"
2Н2О + О2) и другие пероксидазы, способные
мания механизмов развития окислительного
восстанавливать органические и неорганичес"
стресса, начиная с 50"х годов XX века начались
кие гидропероксиды (ROOH + 2R′SH → ROH +
активные работы по созданию препаратов анти"
R′SSR′ + Н2О) [86].
оксидантного действия. На сегодняшний день
Супероксиддисмутазы и их производные. Пос"
изучено несколько тысяч соединений как при"
ле открытия McCord и Fridovich [87] в 1969 г. но"
родного, так и синтетического происхождения,
вого класса ферментов - супероксиддисмутаз, и
обладающих антиоксидантной активностью [24,
понимания их важной антиоксидантной функ"
25, 84]. Низкомолекулярные препараты антиок"
ции, начались работы по их использованию в
сидантного действия широко используются в
качестве антиоксидантных агентов. Уже спустя
современной медицине. Однако они не всегда
5 лет после открытия SOD была проведена пер"
эффективны, что связано с их быстрой инакти"
вая работа, посвящённая исследованию радио"
вацией, т.к. прореагировав с АФК, они зачастую
защитных свойств Cu/Zn"SOD из эритроцитов
необратимо окисляются и исключаются из пула
быка. Внутривенное введение супероксиддис"
антиоксидантов. Такие свойства низкомолеку"
мутаз (Mn"SOD, Cu/Zn"SOD) до воздействия
лярных антиоксидантов требуют их применения
радиации уменьшает уровень радиационных
БИОХИМИЯ том 86 вып. 11 2021
РОЛЬ ГИДРОПЕРОКСИДАЗ ПРИ СР"ПАТОЛОГИЯХ
1647
повреждений геномной ДНК, защищает клетки
стно, что химическая сшивка белков происхо"
костного мозга, снижает степень поражения
дит случайным образом, что может приводить к
слизистых и способствует росту выживаемости
экранированию активных центров ферментов и
животных [25]. Внутрибрюшинное введение
снижению их активности; для решения этой
мышам рекомбинантной Mn"SOD человека (в
проблемы были получены химерные рекомби"
дозе 0,08 мг/кг) защищает животных от леталь"
нантные белки. Например, был получен химер"
ных доз радиации. Более того, рекомбинантная
ный фермент (Mn"SOD-VHb), совмещающий в
Mn"SOD защищает нормальные клетки от ради"
себе человеческую Mn"SOD и бактериальный
ации, но радиосенсибилизирует раковые, что
гемоглобин (VHb) грамотрицательных аэроб"
может найти применение в лучевой терапии ра"
ных бактерий рода Vitreoscilla [95]; химерный ре"
ка [88]. Подкожное введение рекомбинант"
комбинантный белок, совмещающий в себе че"
ной Mn"SOD эффективно защищает клетки
ловеческую глутатионпероксидазу GPx"1 и су"
мозга от действия гамма"излучения и потока
пероксиддисмутазу SOD термофильного глубо"
нейтронов, имитирующих уровни излучения,
ководного червя Alvinella pompejana [96]; а также
которым могут подвергаться космонавты во вре"
рекомбинантный химерный белок PSH, состоя"
мя длительных миссий в дальний космос. Ней"
щий из Prx6 человека и Mn"SOD E. coli [95].
ропротекторный эффект рекомбинантной Mn"
Благодаря широкой субстратной специфичнос"
SOD, помимо антиоксидантного действия,
ти химерные антиоксидантные ферменты демон"
обусловлен активацией сфингомиелиназы
стрируют высокий терапевтический потенциал,
(SMase) [89]. Кроме того, была показана неф"
что делает их весьма привлекательными в прак"
ропротекторная активность рекомбинантной
тическом применении.
Mn"SOD человека на животной модели острого
Пероксиредоксины и их производные. Ранее
почечного поражения, что проявлялось в сохра"
мы отмечали важную роль пероксиредоксинов в
нении их нормального морфофункционального
нейтрализации окислительного стресса при раз"
состояния [90]. Рекомбинантная Cu/Zn"содер"
личных СР"патологиях. Мы предположили, что
жащая супероксиддисмутаза человека (SOD3),
применение экзогенных пероксиредоксинов
применяется в настоящее время в качестве
позволит существенно скорректировать течение
лекарственного препарата (глазных капель и
болезней, связанных с окислительным стрес"
раствора для инфузий) при открытоугольной
сом. Проведёно исследование радиозащитного
глаукоме, аденовирусном поражении глаз и вто"
действия рекомбинантных пероксиредоксинов
ричных кератопатиях, а также в комплексной
(Prx1, Prx2, Prx6 и химерного белка PSH) на мо"
профилактике развития интраоперационных
дели тотального облучения мышей сублеталь"
осложнений при эндопротезировании крупных
ными и летальными дозами (5-11 Гр) рентгенов"
суставов. Применение рекомбинантной SOD3
ского излучения. Внутривенное введение жи"
человека подавляет СР"процессы, окисление
вотным рекомбинантных пероксиредоксинов и
белков и липидов, нормализует окислительно"
их модифицированных форм незадолго до облу"
восстановительный статус тканей и предупреж"
чения существенно снижает костномозговой
дает гибель клеток [91].
(лейкопения и тромбопения) и кишечный (по"
Несмотря на важную антиоксидантную роль
ражение слизистой) синдромы острой лучевой
супероксиддисмутаз, у этих ферментов есть су"
болезни [97, 98]. Фактор изменения дозы для ре"
щественное ограничение, связанное с тем, что
комбинантных пероксиредоксинов равен при"
они нейтрализуют только супероксидный ани"
мерно 1,3-1,4, что является хорошим показате"
он"радикал, тогда как в общем пуле АФК/АФА
лем для природных субстанций [22, 98-101].
при окислительном стрессе значительная часть
Важно отметить, что радиозащитный эффект
представлена гидропероксидами, которые супер"
проявляла даже мутантная форма пероксире"
оксиддисмутаза не способна нейтрализовать.
доксина, не обладающая пероксидазной актив"
Это побудило исследователей модифицировать
ностью (Prx6"C47S), что обусловлено сигналь"
SOD с целью расширения её субстратной специ"
но"регуляторной функцией белка. Показано,
фичности путём химической сшивки SOD с пе"
что радиозащитный эффект пероксиредоксинов
роксидазами. Например, были получены конъ"
может быть опосредован стимуляцией Toll"по"
югаты Cu/Zn"SOD дрожжей и Mn"SOD
добного рецептора 4 (TLR4) и активацией NF"κB,
Escherichia coli с каталазой быка, которые сохра"
фосфорилированного по Ser536 [49], что приво"
няли как пероксидазную, так и супероксиддис"
дит к реализации антиапоптотического эффек"
мутазную активности [92]. Были получены хи"
та. Кроме того, было показано, что экзогенный
мические конъюгаты супероксиддисмутазы и
Prx6 может проникать в клетки 3Т3 (по"видимо"
каталазы из печени быка, которые обладали вы"
му, благодаря фосфолипазной активности
сокой терапевтической активностью [93]. Изве"
iPLA2), тем самым повышая их антиоксидант"
БИОХИМИЯ том 86 вып. 11 2021
1648
ШАРАПОВ и др.
ный статус и непосредственно оказывая влия"
нием сердца [106, 107], кишечника [108, 109] и
ние на сигнально"регуляторные пути клет"
почек [110, 111] увеличивает выживаемость жи"
ки [49]. На рис. 1 представлены основные сиг"
вотных, подавляет окислительные процессы и
нальные пути клетки (TLR4/NF"κB, ASK"1/AP"1,
способствует сохранению морфофункциональ"
KEAP"1/Nrf2), в которые может быть вовлечён
ного состояния ишемизированных тканей на
экзогенный Prx6. Следует отметить, что эти сиг"
стадии реперфузии. Помимо нейтрализации
нальные каскады тесно связаны друг с другом.
гидропероксидов, экзогенные пероксиредокси"
Несмотря на то что транскрипционные факторы
ны вызывают индукцию экспрессии NO"синтаз
NF"κB, Nrf2 и AP"1 регулируют различные про"
(eNOS, iNOS) в ишемизированных тканях и
цессы клетки и их активация приводит к разным
последующий рост уровня NO в крови, что при"
последствиям, они зачастую активируются од"
водит к вазодилатации сосудов, подавлению
ними и теми же стимулами. Во многих исследо"
тромбообразования и быстрой нормализации
ваниях было показано, что эти транскрипцион"
микроциркуляции кровотока при ишемии"ре"
ные факторы могут как взаимно подавлять, так
перфузии [108, 109].
и активировать друг друга [102]. Например,
Перспективы применения ферментов@антиок@
экспрессия многих генов требует одновремен"
сидантов. Основными недостатками препаратов
ного присутствия AP"1 и NF"κB [103]. По"види"
на основе ферментов"антиоксидантов является
мому, в зависимости от физиологического сос"
их ограниченная биодоступность и недостаточ"
тояния клетки и уровня внутриклеточных СР"
ная стабильность. В настоящее время с по"
повреждений, клетка определяет, какой из сиг"
мощью генно"инженерных и биохимических
нальных путей будет преобладать. Причём в
методов активно ведутся работы по устранению
этом процессе важную роль играют пероксире"
этих проблем. Например, инкапсуляция фер"
доксины в качестве редокс"переключате"
ментов в наночастицы, гидрогели или липосо"
лей [40]. Введение экзогенного Prx6 корректи"
мы позволяет увеличить время их действия, а
рует окислительно"восстановительный статус
также защитить белки от деградации [112]. По"
клетки, а также направляет её по сигнально"ре"
мимо инкапсуляции, эффективным способом
гуляторному пути, опосредованному NF"κB,
доставки ферментов является их сорбция на по"
что в комплексе приводит к подавлению апоп"
верхности наночастиц, которые сами могут слу"
тоза и выживанию клетки в условиях окисли"
жить терапевтическими агентами [113]. Напри"
тельного стресса [49].
мер, сорбция каталазы и Cu/Zn"SOD на поверх"
Совсем недавно нами были проведены экс"
ности наночастиц диоксида церия (CeO2) позво"
перименты по исследованию противодиабети"
лила получить частицы с большим антиоксидант"
ческого действия пероксиредоксинов на мышах
ным потенциалом, чем при использовании фер"
(модель аллоксан"индуцированного диабета) и
ментов по отдельности [114]. Стабилизация
β"клетках инсулиномы крысы (модель гипер"
ферментов и пролонгирование времени их
гликемии) [104, 105]. Было установлено, что вве"
действия (циркуляции в организме) достигается
дение рекомбинантного Prx6 вызывает сниже"
благодаря конъюгированию ферментов с поли"
ние уровня АФК и защищает β"клетки RIN"m5F
этиленгликолем (ПЭГ) или сахарами (галакто"
от гипергликемии, снижая их гибель по сравне"
зой или маннозой). Было показано, что конъю"
нию с контролем в несколько раз. Более того,
гирование каталазы с ПЭГ практически не ока"
экзогенный Prx6 стимулирует секрецию инсу"
зывает влияния на её активность, но при этом
лина β"клетками, что, вероятно, обусловлено
увеличивает время её выведения из кровотока
регуляцией активности сигнального каскада
(спустя 60 мин после введения модифицирован"
NF"κB, в частности, через активацию фосфори"
ной каталазы её уровень в крови примерно в
лирования RelA/p65 по Ser536 (по аналогии с
2 раза выше, чем исходного фермента) и в
TLR4"опосредованным радиозащитным действи"
3-4 раза увеличивает устойчивость конъюгата к
ем Prx6). Было показано, что экзогенный Prx6
действию протеаз, что позволяет достичь боль"
предотвращает гипергликемию, снижает уро"
шего терапевтического эффекта [115].
вень смертности, восстанавливает нормальный
Эффективность терапевтического действия
профиль цитокинов в плазме крови, подавляет
антиоксидантного фермента зависит от его спо"
апоптоз клеток селезёнки и снижает разруше"
собности достигать места образования СР или
ние β"клеток в островках Лангерганса у мышей
АФК/АФА и длительности его нахождения в
с тяжёлой формой диабета, индуцированного
этом месте. Иммобилизация супероксиддисму"
аллоксаном [104, 105].
тазы и каталазы на суперпарамагнитных нано"
Кроме того, внутривенное введение перок"
частицах оксида железа (SPION) размером око"
сиредоксинов и их модифицированных форм
ло 400 нм, последующее введение в организм и
перед ишемически"реперфузионным пораже"
удержание с помощью внешнего магнитного
БИОХИМИЯ том 86 вып. 11 2021
РОЛЬ ГИДРОПЕРОКСИДАЗ ПРИ СР"ПАТОЛОГИЯХ
1649
поля в зоне поражения позволяет значительно
клеток эмбриональных фибробластов 3Т3 при"
повысить терапевтическую активность этих ан"
водит к частичному проникновению белка в
тиоксидантных ферментов. Конъюгация SOD и
клетки [49]. Таким образом, благодаря своим
каталазы с частицами SPION незначительно
уникальным антиоксидантным и сигнально"
влияет на ферментативную активность, что поз"
регуляторным свойствам Prx6 является пер"
воляет надеяться на возможность применения
спективным объектом исследования при разра"
подобного подхода для широкого спектра фер"
ботке препаратов на основе ферментов"анти"
ментов [116].
оксидантов.
Для адресной доставки антиоксидантных
ферментов также используется генно"инженер"
ный подход, позволяющий получать ферменты
Финансирование. Работа выполнена при фи"
с PTD"пептидами (PTD - protein transduction
нансовой поддержке Российского фонда фунда"
domen), которые обеспечивают проникновение
ментальных исследований (гранты №№ 19"04"
белка через плазматическую мембрану клетки.
00080 и 20"34"70037).
Например, таким образом были получены
Конфликт интересов. Авторы заявляют об от"
PTD"модифицированные пероксиредоксины
сутствии конфликта интересов.
[117, 118]. Следует отметить, что некоторые пе"
Соблюдение этических норм. Настоящая
роксиредоксины способны проникать в клетки
статья не содержит каких"либо исследований с
без PTD"пептидов. Нами было обнаружено,
участием людей или использованием животных
что введение рекомбинантного Prx6 в культуру в качестве объектов исследований.
СПИСОК ЛИТЕРАТУРЫ
1.
Ланкин В. З., Тихазе А. К. (2016) Важная роль свобод"
context of inflammation, diabetes and cardiovascular dis"
норадикальных процессов в этиологии и патогенезе
eases, Int. J. Mol. Sci., 22, 56, doi: 10.3390/ijms22010056.
атеросклероза и сахарного диабета, Кардиология, 56,
10. Augusto, O., Bonini, M. G., Amanso, A. M., Linares, E.,
97"105.
Santos, C. C. X., and De Menezes, S. L. (2002) Nitrogen
2.
Forman, H. J., Zhang, H. (2021) Targeting oxidative stress
dioxide and carbonate radical anion: two emerging radicals
in disease: promise and limitations of antioxidant therapy,
in biology, Free Radic. Biol. Med.,
32,
841"859,
Nat. Rev. Drug Discov., 20, 689"709, doi: 10.1038/s41573"
doi: 10.1016/s0891"5849(02)00786"4.
021"00233"1.
11. Aicardo, A., Martinez, D. M., Campolo, N.,
3.
Sies, H., Berndt, C., and Jones, D. P. (2017) Oxidative
Bartesaghi, S., and Radi, R. (2016) Biochemistry of nitric
stress, Annu. Rev. Biochem., 86, 715"748, doi: 10.1146/
oxide and peroxynitrite: sources, targets and biological
annurev"biochem"061516"045037.
implications, Biochem. Oxid. Stress, 49"77, doi: 10.1007/
4.
Sies, H., and Jones, D. P. (2020) Reactive oxygen species
978"3"319"45865"6_5.
(ROS) as pleiotropic physiological signalling agents, Nat.
12. Gupta, D., Harish, B., Kissner, R., and Koppenol, W. H.
Rev. Mol. Cell Biol., 21, 363"383, doi: 10.1038/s41580"020"
(2009) Peroxynitrate is formed rapidly during decomposi"
0230"3.
tion of peroxynitrite at neutral pH, Dalt. Trans., 29, 5730"
5.
Lankin, V. Z., Tikhaze, A. K., Kapel’ko, V. I.,
5736, doi: 10.1039/b905535e.
Shepel’kova, G. S., Shumaev, K. B., et al.
(2007)
13. Phaniendra, A., Jestadi, D. B., and Periyasamy, L. (2015)
Mechanisms of oxidative modification of low density
Free radicals: properties, sources, targets, and their impli"
lipoproteins under conditions of oxidative and carbonyl
cation in various diseases, Ind. J. Clin. Biochem., 30, 11"26,
stress, Biochemistry (Moscow), 72, 1081"1090, doi: 10.1134
doi: 10.1007/s12291"014"0446"0.
s0006297907100069.
14. Xue, Q., Yan, Y., Zhang, R., and Xiong, H.
(2018)
6.
Altomare, A., Baron, G., Gianazza, E., Banfi, C.,
Regulation of iNOS on immune cells and its role in dis"
Carini, M., and Aldini, G. (2021) Lipid peroxidation
eases, Int. J. Mol. Sci.,
19,
3805, doi:
10.3390/
derived reactive carbonyl species in free and conjugated
ijms19123805.
forms as an index of lipid peroxidation: limits and perspec"
15. Radi, R. (2013) Peroxynitrite, a stealthy biological oxidant,
tives, Redox Biol., 42, 101899, doi: 10.1016/j.redox.2021.
J. Biol. Chem., 288, 26464"26472, doi: 10.1074/jbc.R113.
101899.
472936.
7.
Anderson, M. M., Hazen, S. L., Hsu, F. F., Heinecke, J. W.
16. Ярмоненко С. П., Вайнсон А. А. (2004) Радиобиология
(1997) Human neutrophils employ the myeloperoxidase"
человека и животных, Высшая школа, Москва.
hydrogen peroxide"chloride system to convert hydroxy"
17. Mu, H., Sun, J., Li, L., Yin, J., Hu, N., et al. (2018)
amino acids into glycolaldehyde, 2"hydroxypropanal, and
Ionizing radiation exposure: hazards, prevention, and bio"
acrolein: a mechanism for the generation of highly reactive
marker screening, Environ. Sci. Pollut. Res. Int., 25, 15294"
α"hydroxy and α,β"unsaturated aldehydes by phagocytes
15306, doi: 10.1007/s11356"018"2097"9.
at sites of inflammation, J. Clin. Invest., 99, 424"432,
18. Gerschman, R., Gilbert, D. L., Nye, S. W., Dwyer, P., and
doi: 10.1172/JCI119176
Fenn, W. O. (1954) Oxygen poisoning and X"irradiation: a
8.
Talukdar, D., Chaudhuri, B. S., Ray, M., and Ray, S.
mechanism in common, Science,
119,
623"626,
(2009) Critical evaluation of toxic versus beneficial effects
doi: 10.1126/science.119.3097.623.
of methylglyoxal, Biochemistry (Moscow), 74, 1059"1069,
19. Bernheim, F. (1963) Biochemical implications of pro"oxi"
doi: 10.1134/s0006297909100010.
dants and antioxidants, Radiat. Res., Suppl 3, 17"32.
9.
Król, M., Kepinska, M. (2020) Human nitric oxide syn"
20. Ward, J.F. (1988) DNA damage produced by ionizing radi"
thase - its functions, polymorphisms, and inhibitors in the
ation in mammalian cells: identities, mechanisms of for"
БИОХИМИЯ том 86 вып. 11 2021
1650
ШАРАПОВ и др.
mation, and reparability, Prog. Nucleic Acid Res. Mol. Biol.,
radiation adaptive response, J. Biochem., 142, 145"155,
35, 95"125, doi: 10.1016/s0079"6603(08)60611"x.
doi: 10.1093/jb/mvm118.
21.
Dong, S., Lyu, X., Yuan, S., Wang, S., Li, W., et al. (2020)
37.
An, J. H., Seong, J. S., Proteomics, R., and
Oxidative stress: a critical hint in ionizing radiation
Radiosusceptibility, A. (2006) Proteomics analysis of apop"
induced pyroptosis, Radiat. Med. Prot., 1, 179"185,
tosis"regulating proteins in tissues with different radiosen"
doi: 10.1016/j.radmp.2020.10.001.
sitivity, J. Radiat. Res., 47, 147"155, doi: 10.1269/jrr.47.
22.
Sharapov, M. G., Novoselov, V. I., and Gudkov, S. V.
147.
(2019) Radioprotective role of peroxiredoxin
6,
38.
Cerda, M.B., Lloyd, R., Batalla, M., Giannoni, F.,
Antioxidants (Basel), 8, 15, doi: 10.3390/antiox8010015.
Casal, M., and Policastro, L. (2017) Silencing peroxire"
23.
Vasin, M. V., and Ushakov, I. B. (2020) Radiomodulators
doxin"2 sensitizes human colorectal cancer cells to ioniz"
as agents of biological protection against oxidative stress
ing radiation and oxaliplatin, Cancer Lett., 388, 312"319,
under the influence of ionizing radiation, Biol. Bull. Rev.,
doi: 10.1016/j.canlet.2016.12.009.
10, 251"265, doi: 10.1134/S2079086420040106.
39.
Diaz, A.J.G., Tamae, D., Yen, Y., Li, J., and Wang, T.
24.
Legeza, V. I., Grebenyuk, A. N., and Drachev, I. S. (2019)
(2013) Enhanced radiation response in radioresistant
Radiomitigators: classification, pharmacological proper"
MCF"7 cells by targeting peroxiredoxin II, Breast Cancer
ties, and application prospects, Biol. Bull., 46, 1625"1632,
Targets Ther., 5, 87"101, doi: 10.2147/BCTT.S51378.
doi: 10.1134/S1062359019120045.
40.
Sharapov, M. G., and Novoselov, V. I. (2019) Catalytic and
25.
Gudkov, S. V., Popova, N. R., and Bruskov, V. I. (2015)
signaling role of peroxiredoxins in carcinogenesis,
Radioprotective substances: history, trends and prospects,
Biochemistry (Moscow),
84,
79"100, doi:
10.1134/
Biophysics, 60, 659"667, doi: 10.1134/S0006350915040120.
S0006297919020019.
26.
Sun, J., Chen, Y., Li, M., and Ge, Z. (1998) Role of
41.
Chen, M."F., Keng, P. C., Shau, H., Wu, C."T., Hu, Y."C.,
antioxidant enzymes on ionizing radiation resistance, Free
et al. (2006) Inhibition of lung tumor growth and augmen"
Radic. Biol. Med., 24, 586"593, doi: 10.1016/s0891"
tation of radiosensitivity by decreasing peroxiredoxin I
5849(97)00291"8.
expression, Int. J. Radiat. Oncol. Biol. Phys., 64, 581"591,
27.
Diamond, A. M., Murray, J. L., Dale, P., Tritz, R.,
doi: 10.1016/j.ijrobp.2005.10.012.
Sandstrom, P. A., and Grdina, D. J. (1995) Effects of sele"
42.
Li, G., Xie, B., Li, X., Chen, Y., Xu, Y., et al. (2015)
nium on glutathione peroxidase activity and radioprotec"
Downregulation of peroxiredoxin"1 by β"elemene
tion in mammalian cells, Radiat. Oncol. Invest., 3, 383"386.
enhances the radiosensitivity of lung adenocarcinoma
28.
Verma, P., Kunwar, A., Arai, K., Iwaoka, M., and
xenografts, Oncol. Rep., 33, 1427"1433, doi: 10.3892/or.
Priyadarsini, K. I. (2018) Mechanism of radioprotection by
2015.3732.
dihydroxy"1"selenolane (DHS): effect of fatty acid conju"
43.
Kwee, J. K. (2014) A paradoxical chemoresistance and
gation and role of glutathione peroxidase (GPx),
tumor suppressive role of antioxidant in solid cancer cells:
Biochimie, 144, 122"133, doi: 10.1016/j.biochi.2017.
a strange case of Dr. Jekyll and Mr. Hyde, Biomed Res. Int.,
10.021.
2014, 209845, doi: 10.1155/2014/209845.
29.
Mansur, D. B., Kataoka, Y., Grdina, D. J., Diamond,
44.
Song, I."S., Kim, H."K., Jeong, S."H., Lee, S."R.,
A. M. (2001) Radiosensitivity of mammalian cell lines
Kim, N., et al. (2011) Mitochondrial peroxiredoxin III is a
engineered to overexpress cytosolic glutathione peroxidase,
potential target for cancer therapy, Int. J. Mol. Sci., 12,
Radiat. Res.,
155,
536"542, doi:
10.1667/0033"
7163"7185, doi: 10.3390/ijms12107163.
7587(2001)155[0536:romcle]2.0.co;2.
45.
Chen, W. C., McBride, W. H., Iwamoto, K. S., Barber,
30.
Stevens, G. N., Joiner, M. C., Joiner, B., Johns, H., and
C. L., Wang, C. C., et al. (2002) Induction of radioprotec"
Stratford, M. R. (1989) Role of glutathione peroxidase in
tive peroxiredoxin"I by ionizing irradiation, J. Neurosci.
the radiation response of mouse kidney, Int. J. Radiat.
Res., 70, 794"798, doi: 10.1002/jnr.10435.
Oncol. Biol. Phys., 16, 1213"1217, doi: 10.1016/0360"
46.
Zhang, B., Wang, Y., and Su, Y. (2009) Peroxiredoxins, a
3016(89)90286"1.
novel target in cancer radiotherapy, Cancer Lett., 286, 154"
31.
Toppo, S., Flohé, L., Ursini, F., Vanin, S., and
160, doi: 10.1016/j.canlet.2009.04.043.
Maiorino, M. (2009) Catalytic mechanisms and specifici"
47.
Jia, W., Chen, P., and Cheng, Y. (2019) PRDX4 and its
ties of glutathione peroxidases: variations of a basic
roles in various cancers, Technol. Cancer Res. Treat., 18,
scheme, Biochim. Biophys. Acta Gen. Subj., 1790, 1486"
1533033819864313, doi: 10.1177/1533033819864313.
1500, doi: 10.1016/j.bbagen.2009.04.007.
48.
Ho, J. N., Lee, S. B., Lee, S. S., Yoon, S. H., Kang, G. Y.,
32.
Jiao, Y., Wang, Y., Guo, S., and Wang, G.
(2017)
et al. (2010) Phospholipase A2 activity of peroxiredoxin 6
Glutathione peroxidases as oncotargets, Oncotarget, 8,
promotes invasion and metastasis of lung cancer cells, Mol.
80093"80102, doi: 10.18632/oncotarget.20278.
Cancer Ther., 9, 825"832, doi: 10.1158/1535"7163.MCT"
33.
Lee, H. C., Kim, D. W., Jung, K. Y., Park, I. C., Park,
09"0904.
M. J., et al. (2004) Increased expression of antioxidant
49.
Sharapov, M. G., Glushkova, O. V., Parfenyuk, S. B.,
enzymes in radioresistant variant from U251 human
Gudkov, S. V., Lunin, S. M., and Novoselova, E. G. (2021)
glioblastoma cell line, Int. J. Mol. Med., 13, 883"887.
The role of TLR4/NF"κB signaling in the radioprotective
34.
Zhang, S., Wang, W., Gu, Q., Xue, J., Cao, H., et al.
effects of exogenous Prdx6, Arch. Biochem. Biophys., 702,
(2014) Protein and miRNA profiling of radiation"induced
108830, doi: 10.1016/j.abb.2021.108830.
skin injury in rats: the protective role of peroxiredoxin"6
50.
Lankin, V. Z., and Tikhaze, A. K. (2016) Role of oxidative
against ionizing radiation, Free Radic. Biol. Med., 69, 96"
stress in the genesis of atherosclerosis and diabetes mellitus:
107, doi: 10.1016/j.freeradbiomed.2014.01.019.
a personal look back on 50 years of research, Curr. Aging Sci.,
35.
Lee, K., Park, J. S., Kim, Y. J., Soo Lee, Y., Sook Hwang, T.,
10, 18"25, doi: 10.2174/1874609809666160926142640.
et al. (2002) Differential expression of Prx I and II in mouse
51.
Lankin, V. Z., Tikhaze, A. K. (2003) Free Radicals, Nitric
testis and their up"regulation by radiation, Biochem.
Oxide, and Inflammation: Molecular, Biochemical, and
Biophys. Res. Commun., 296, 337"342, doi: 10.1016/s0006"
Clinical Aspects, IOS Press, NATO Science Series,
291x(02)00801"x.
Amsterdam.
36.
Miura, Y., Kano, M., Yamada, M., Nishine, T., Urano, S.,
52.
Mushenkova, N. V., Bezsonov, E. E., Orekhova, V. A.,
et al. (2007) Proteomic study on X"irradiation"responsive
Popkova, T. V., Starodubova, A. V., and Orekhov, A. N.
proteins and ageing: search for responsible proteins for
(2021) Recognition of oxidized lipids by macrophages and
БИОХИМИЯ том 86 вып. 11 2021
РОЛЬ ГИДРОПЕРОКСИДАЗ ПРИ СР"ПАТОЛОГИЯХ
1651
its role in atherosclerosis development, Biomedicines, 9,
67.
Wang, X., Phelan, S. A., Forsman"Semb, K., Taylor, E. F.,
915, doi: 10.3390/biomedicines9080915.
Petros, C., et al. (2003) Mice with targeted mutation of
53.
Tribble, D. L., Barcellos"Hoff, M. H., Chu, B. M., and
peroxiredoxin 6 develop normally but are susceptible to
Gong, E. L. (1999) Ionizing radiation accelerates aortic
oxidative stress, J. Biol. Chem.,
278,
25179"25190,
lesion formation in fat"fed mice via SOD"inhibitable
doi: 10.1074/jbc.M302706200.
processes, Arterioscler. Thromb. Vasc. Biol., 19, 1387"1392,
68.
Wang, X., Phelan, S. A., Petros, C., Taylor, E. F.,
doi: 10.1161/01.atv.19.6.1387.
Ledinski, G., et al. (2004) Peroxiredoxin 6 deficiency and
54.
Lankin, V. Z., Tikhaze, A. K., and Kumskova, E. M.
atherosclerosis susceptibility in mice: significance of genet"
(2012) Macrophages actively accumulate malonyldialde"
ic background for assessing atherosclerosis, Atherosclerosis,
hyde"modified but not enzymatically oxidized low density
177, 61"70, doi: 10.1016/j.atherosclerosis.2004.06.007.
lipoprotein, Mol. Cell. Biochem., 365, 93"98, doi: 10.1007/
69.
Burillo, E., Jorge, I., Mart nez López, D., Camafeita, E.,
s11010"012"1247"5.
Blanco"Colio, L. M., et al. (2016) Quantitative HDL pro"
55.
Chistiakov, D. A., Orekhov, A. N., and Bobryshev, Y. V.
teomics identifies peroxiredoxin"6 as a biomarker of
(2016) LOX"1"mediated effects on vascular cells in athero"
human abdominal aortic aneurysmm, Sci. Rep., 6, 38477,
sclerosis, Cell. Physiol. Biochem.,
38,
1851"1859,
doi: 10.1038/srep38477.
doi: 10.1159/000443123.
70.
Lankin, V. Z., Sharapov, M. G., Goncharov, R. G.,
56.
Shumaev, K. B., Ruuge, E. K., Dmitrovsky, A. A.,
Tikhaze, A. K., and Novoselov, V. I. (2019) Natural dicar"
Bykhovsky V. Ya., and Kukharchuk, V. V. (1997) Effect of
bonyls inhibit peroxidase activity of peroxiredoxins, Dokl.
lipid peroxidation products and antioxidants on the forma"
Biochem. Biophys.,
485,
132"134, doi:
10.1134/
tion of probucol radical in low density lipoproteins,
S1607672919020157.
Biochemistry (Moscow), 62, 657"660.
71.
Maruhashi, T., and Higashi, Y. (2021) Pathophysiological
57.
Lankin, V. Z., Tikhaze, A. K., and Osis, Y. G. (2002)
Association between diabetes mellitus and endothelial dys"
Modeling the cascade of enzymatic reactions in liposomes
function, Antioxidants (Basel), 10, 1306, doi: 10.3390/
including successive free radical peroxidation, reduction,
antiox10081306.
and hydrolysis of phospholipid polyenoic acyls for studying
72.
Vladimirov, Y. A., and Proskurnina, E. V. (2009) Free rad"
the effect of these processes on the structural"dynamic
icals and cell chemiluminescence. Biochemistry (Moscow),
parameters of the membranes, Biochemistry (Moscow), 67,
74, 1545"1566, doi: 10.1134/s0006297909130082.
566"574, doi: 10.1023/a:1015502429453.
73.
Lankin, V. Z., Antonovsky, V. L., and Tikhaze, A. K. (2004)
58.
Lankin, V. Z., Tikhaze, A. K., Kukharchuk, V. V.,
Regulation of free radical lipoperoxidation and organic
Konovalova, G. G., Pisarenko, O. I., et al.
(2003)
peroxides metabolism during normal station and patholo"
Antioxidants decreases the intensification of low density
gies, in Peroxides at the Beginning of the Third Millennium,
lipoprotein in vivo peroxidation during therapy with
Nova Sci. Publ., p. 85"111.
statins, Mol. Cell. Biochem., 249, 129"140.
74.
Lankin, V., Konovalova, G., Tikhaze, A., Shumaev, K.,
59.
Lankin, V. Z., Tikhaze, A. K., Konovalova, G. G.,
Kumskova, E., and Viigimaa, M. (2014) The initiation of
Odinokova, O. A., Doroshchuk, N. A., and Chazova, I. E.
free radical peroxidation of low"density lipoproteins by
(2018) Oxidative and carbonyl stress as a factors of the
glucose and its metabolite methylglyoxal: a common mol"
modification of proteins and DNA destruction in diabetes,
ecular mechanism of vascular wall injure in atherosclerosis
Ter. Arkh., 90, 46"50, doi: 10.26442/terarkh201890104"50.
and diabetes, Mol. Cell. Biochem.,
395,
241252,
60.
Sena, C. M., Pereira, A. M., and Seiça, R. (2013) Endo"
doi: 10.1007/s11010"014"2131"2.
thelial dysfunction - a major mediator of diabetic vascular
75.
Lankin, V. Z., Shadyro, O. I., Shumaev, K. B., Shumaev,
disease, Biochim. Biophys. Acta Mol. Basis Dis., 1832, 2216"
K. B., Tikhaze, A. K., and Sladkova, A. A. (2019) Non"
2231, doi: 10.1016/j.bbadis.2013.08.006.
enzymatic methylglyoxal formation from glucose metabo"
61.
Lankin, V. Z., Shumaev, K. B., Tikhaze, A. K., and
lites and generation of superoxide anion radical during
Kurganov, B. I. (2017) Influence of dicarbonyls on kinetic
methylglyoxal"dependent cross"links reaction, J. Antioxid.
characteristics of glutathione peroxidase, Dokl. Biochem.
Act., 1, 33"45, doi: 10.14302/issn.2471"2140.jaa"19"2997.
Biophys., 475, 287"290, doi: 10.1134/S1607672917040123.
76.
Lankin, V. Z., Konovalova, G. G., Tikhaze, A. K.,
62.
Sharapov, M. G., Goncharov, R. G., Gordeeva, A. E.,
Shumaev, K. B., Belova Kumskova, E. M., et al. (2016)
Novoselov, V. I., Antonova, O. A., et al. (2016) Enzymatic
Aldehyde inhibition of antioxidant enzymes in the blood of
antioxidant system of endotheliocytes, Dokl. Biochem.
diabetic patients, J. Diabetes, 8, 398"404, doi: 10.1111/
Biophys., 471, 410"412, doi: 10.1134/S1607672916060090.
1753"0407.12309.
63.
Kisucka, J., Chauhan, A. K., Patten, I. S., Yesilaltay, A.,
77.
Oberley, L. W. (1988) Free radicals and diabetes, Free
Neumann, C., et al. (2008) Peroxiredoxin1 prevents exces"
Radic. Biol. Med.,
5,
113"124, doi:
10.1016/0891"
sive endothelial activation and early atherosclerosis, Circ.
5849(88)90036"6.
Res.,
103,
598"605, doi:
10.1161/CIRCRESA"
78.
Huang, J. Q., Zhou, J. C., Wu, Y. Y., Ren, F. Z., and Lei,
HA.108.174870.
X. G. (2018) Role of glutathione peroxidase 1 in glucose
64.
Ihida"Stansbury, K., Ames, J., Chokshi, M., Aiad, N.,
and lipid metabolism"related diseases, Free Radic. Biol.
Sanyal, S., et al. (2015) Role played by Prx1"dependent
Med., 127, 108"115, doi: 10.1016/j.freeradbiomed.2018.
extracellular matrix properties in vascular smooth muscle
05.077.
development in embryonic lungs, Pulm. Circ., 5, 382"397,
79.
Matsushima, S., Kinugawa, S., Ide, T., Matsusaka, H.,
doi: 10.1086/681272.
Inoue, N., et al. (2006) Overexpression of glutathione per"
65.
Park, J."G., Yoo, J."Y., Jeong, S."J., Choi, J."H., Lee, M."
oxidase attenuates myocardial remodeling and preserves
R., et al. (2011) Peroxiredoxin 2 deficiency exacerbates
diastolic function in diabetic heart, Am. J. Physiol. Hear.
atherosclerosis in apolipoprotein E"deficient mice, Circ.
Circ. Physiol., 291, 2237"2245, doi: 10.1152/ajpheart.
Res., 109, 739"749, doi: 10.1161/CIRCRESAHA.111.
00427.2006.
245530.
80.
Koulajian, K., Ivovic, A., Ye, K., Desai, T., Shah, A., et al.
66.
Jeong, S. J., Park, J. G., and Oh, G. T.
(2021)
(2013) Overexpression of glutathione peroxidase 4 prevents
Peroxiredoxins as potential targets for cardiovascular dis"
β"cell dysfunction induced by prolonged elevation of lipids
ease, Antioxidants (Basel),
10,
1244, doi:
10.3390/
in vivo, Am. J. Physiol. Endocrinol. Metab., 305, 254"262,
antiox10081244.
doi: 10.1152/ajpendo.00481.2012.
БИОХИМИЯ том 86 вып. 11 2021
1652
ШАРАПОВ и др.
81.
Stancill, J. S., Happ, J. T., Broniowska, K. A., Hogg, N.,
Med., 110, 188"195, doi: 10.1016/j.freeradbiomed.2017.
and Corbett, J. A. (2020) Peroxiredoxin 1 plays a primary
06.005.
role in protecting pancreatic β"cells from hydrogen perox"
96. Sharapov, M. G., Novoselov, V. I., Ravin, and V. K. (2016)
ide and peroxynitrite, Am. J. Physiol. Regul. Integr. Comp.
Construction of a fusion enzyme exhibiting superoxide dis"
Physiol., 318, R1004"R1013, doi: 10.1152/ajpregu.00011.
mutase and peroxidase activity, Biochemistry (Moscow), 81,
2020.
420"427, doi: 10.1134/S0006297916040131.
82.
Ding, Y., Yamada, S., Wang, K. Y., Shimajiri, S., Guo, X.,
97. Sharapov, M. G., Gudkov, S. V., Gordeeva, A. E., Karp,
et al. (2010) Overexpression of peroxiredoxin 4 protects
O. E., Ivanov, V. E., et al. (2016) Peroxiredoxin 6 is a nat"
against high"dose streptozotocin"induced diabetes by sup"
ural radioprotector, Dokl. Biochem. Biophys., 467, 110"112,
pressing oxidative stress and cytokines in transgenic mice,
doi: 10.1134/S1607672916020095.
Antioxidants Redox Signal., 13, 1477"1490, doi: 10.1089/
98. Sharapov, M. G., Novoselov, V. I., Fesenko, E. E., Bruskov,
ars.2010.3137.
V. I., and Gudkov, S. V. (2017) The role of peroxiredoxin 6
83.
Pacifici, F., Arriga, R., Sorice, G. P., Capuani, B., Scioli,
in neutralization of X"ray mediated oxidative stress: effects
M. G., et al. (2014) Peroxiredoxin 6, a novel player in the
on gene expression, preservation of radiosensitive tissues
pathogenesis of diabetes, Diabetes,
63,
3210"3220,
and postradiation survival of animals, Free Radic. Res., 51,
doi: 10.2337/db14"0144.
148"166, doi: 10.1080/10715762.2017.1289377.
84.
Меньщикова Е. Б., Ланкин В. З., Зенков Н. К., Бон"
99. Sharapov, M. G., Novoselov, V. I., Samygina, V. R.,
дарь И. А., Круговых Н. Ф., Труфакин В. А. (2006)
Konarev, P. V., Molochkov, A. V., et al. (2020) A chimeric
Окислительный стресс. Прооксиданты и антиоксидан>
recombinant protein with peroxidase and superoxide dis"
ты, Слово, Москва, с. 556.
mutase activities: physico"chemical characterization and
85.
Vasin, M. V., and Ushakov, I. B. (2019) Potential ways to
applicability to neutralize oxidative stress caused by ioniz"
increase body resistance to damaging action of ionizing
ing radiation, Biochem. Eng. J., 159, 107603, doi: 10.1016/
radiation with radiomitigators, Biol. Bull. Rev., 9, 503"519,
j.bej.2020.107603.
doi: 10.1134/S2079086419060082
100. Sharapov, M. G., and Gudkov, S. V. (2021) Peroxiredoxin
86.
Sharapov, M. G., Gudkov, S. V., and Lankin, V. Z. (2021)
1 - Multifunctional antioxidant enzyme, protects from
Hydroperoxide"reducing enzymes in the regulation of free"
oxidative damages and increases the survival rate of mice
radical processes, Biochemistry (Moscow), 86, 1256"1274,
exposed to total body irradiation, Arch. Biochem. Biophys.,
doi: 10.1134/S0006297921100084.
697, 108671, doi: 10.1016/j.abb.2020.108671.
87.
McCord, J. M., and Fridovich, I. (1969) Superoxide dis"
101. Sharapov, M. G., Novoselov, V. I., Penkov, N. V., Fesenko,
mutase. An enzymic function for erythrocuprein (hemo"
E. E., Vedunova, M. V., et al. (2019) Protective and adap"
cuprein), J. Biol. Chem., 244, 6049"6055, doi: 10.1016/
togenic role of peroxiredoxin 2 (Prx2) in neutralization of
S0021"9258(18)63504"5.
oxidative stress induced by ionizing radiation, Free Radic.
88.
Borrelli, A., Schiattarella, A., Mancini, R., Morrica, B.,
Biol. Med., 134, 76"86, doi: 10.1016/j.freeradbiomed.
Cerciello, V., et al. (2009) A recombinant MnSOD is
2018.12.032.
radioprotective for normal cells and radiosensitizing for
102. Hellweg, C. E., Spitta, L. F., Henschenmacher, B.,
tumor cells, Free Radic. Biol. Med.,
46,
110"116,
Diegeler, S., and Baumstark"Khan, C.
(2016)
doi: 10.1016/j.freeradbiomed.2008.
Transcription factors in the cellular response to charged
89.
Cataldi, S., Borrelli, A., Ceccarini, M. R., Nakashidze, I.,
particle exposure, Front. Oncol., 6, 61, doi: 10.3389/
Codini, M., et al. (2019) Neutral sphingomyelinase modu"
fonc.2016.00061
lation in the protective/preventive role of rMnSOD from
103. Ji, Z., He, L., Regev, A., and Struhl, K. (2019) Inflam"
radiation"induced damage in the brain, Int. J. Mol. Sci.,
matory regulatory network mediated by the joint action of
20, 5431, doi: 10.3390/ijms20215431.
NF"kB, STAT3, and AP"1 factors is involved in many
90.
Pisani, A., Sabbatini, M., Riccio, E., Rossano, R.,
human cancers, Proc. Natl. Acad. Sci. USA, 116, 9453"
Andreucci, M., et al. (2014) Effect of a recombinant man"
9462, doi: 10.1073/pnas.1821068116
ganese superoxide dismutase on prevention of contrast"
104. Novoselova, E. G., Glushkova, O. V, Lunin, S. M.,
induced acute kidney injury, Clin. Exp. Nephrol., 18, 424"
Khrenov, M. O., Parfenyuk, S. B., et al.
(2020)
431, doi: 10.1007/s10157"013"0828"2.
Peroxiredoxin 6 attenuates alloxan"induced type 1 diabetes
91.
Жариков А. А., Терехов О. В., Пасов В. В. (2013) Лече"
mellitus in mice and cytokine"induced cytotoxicity in
ние больных с поздними лучевыми повреждениями
RIN"m5F Beta cells, J. Diabetes Res., 2020, 7523892,
органов малого таза с применением препарата рексод,
doi: 10.1155/2020/7523892.
Онкология, 5, 26"30.
105. Novoselova, E. G., Glushkova, O. V., Parfenuyk, S. B.,
92.
Guo Dong Mao, Thomas, P. D., Lopaschuk, G. D., and
Khrenov, M. O., Lunin, S. M., et al. (2019) Protective
Poznansky, M. J. (1993) Superoxide dismutase (SOD)"cata"
effect of peroxiredoxin 6 against toxic effects of glucose and
lase conjugates. Role of hydrogen peroxide and the Fenton
cytokines in pancreatic RIN"m5F β"cells, Biochemistry
reaction in SOD toxicity, J. Biol. Chem., 268, 416"420.
(Moscow), 84, 637"643, doi: 10.1134/S0006297919060063.
93.
Maksimenko, A. V. (2016) Widening and elaboration of
106. Karaduleva, E. V., Mubarakshina, E. K., Sharapov, M. G.,
consecutive research into therapeutic antioxidant enzyme
Volkova, A. E., Pimenov, O. Y., et al. (2016) Cardiopro"
derivatives. Oxidative medicine and cellular longevity,
tective effect of modified peroxiredoxins in retrograde per"
2016, 3075695, doi: 10.1155/2016/3075695.
fusion of isolated rat heart under conditions of oxidative
94.
Isarankura"Na"Ayudhya, C., Yainoy, S., Tantimongcolwat, T.,
stress, Bull. Exp. Biol. Med., 160, 639"642, doi: 10.1007/
Bülow, L., and Prachayasittikul, V. (2010) Engineering of a
s10517"016"3237"1.
novel chimera of superoxide dismutase and Vitreoscilla
107. Grudinin, N. V., Bogdanov, V. K., Sharapov, M. G.,
Hemoglobin for rapid detoxification of reactive oxygen
Bunenkov, N. S., Mozheiko, N. P., et al. (2020) Use of per"
species, J. Biosci. Bioeng., 110, 633"637, doi: 10.1016/
oxiredoxin for preconditioning of heterotopic heart trans"
j.jbiosc.2010.07.001.
plantation in a rat, Vestn. Transplantologii i Iskusstv.
95.
Guan, T., Song, J., Wang, Y., Guo, L., Yuan, L., et al.
Organov, 22, 132"136, doi: 10.15825/1995"1191"2020"2"
(2017) Expression and characterization of recombi"
158"164.
nant bifunctional enzymes with glutathione peroxidase
108. Sharapov, M. G., Gordeeva, A. E., Goncharov, R. G.,
and superoxide dismutase activities, Free Radic. Biol.
Tikhonova, I. V., Ravin, V. K., et al. (2017) The effect of
БИОХИМИЯ том 86 вып. 11 2021
РОЛЬ ГИДРОПЕРОКСИДАЗ ПРИ СР"ПАТОЛОГИЯХ
1653
exogenous peroxiredoxin 6 on the state of mesenteric ves"
targeted toxin for synergistic nanotheranostics of cancer,
sels and the small intestine in ischemia-reperfusion injury,
Proc. Natl. Acad. Sci. USA, 115, 9690"9695, doi: 10.1073/
Biophysics, 62, 998"1008, doi: 10.1134/S0006350917060239.
pnas.1809258115.
109. Gordeeva, A. E., Temnov, A. A., Charnagalov, A. A.,
114. Gil, D., Rodriguez, J., Ward, B., Vertegel, A., Ivanov, V., and
Sharapov, M. G., Fesenko, E. E., and Novoselov, V. I.
Reukov, V. (2017) Antioxidant activity of SOD and catalase
(2015) Protective effect of peroxiredoxin 6 in ischemia/
conjugated with nanocrystalline ceria, Bioengineering
reperfusion"induced damage of small intestine, Dig. Dis.
(Basel), 4, 18, doi: 10.3390/bioengineering4010018.
Sci., 60, 3610"3619, doi: 10.1007/s10620"015"3809"3.
115. Simone, E. A., Dziubla, T. D., Arguiri, E., Vardon, V.,
110. Goncharov, R. G., Rogov, K. A., Temnov, A. A.,
Shuvaev, V. V., et al. (2009) Loading PEG"catalase into fil"
Novoselov, V. I., and Sharapov, M. G. (2019) Protective
amentous and spherical polymer nanocarriers, Pharm.
role of exogenous recombinant peroxiredoxin 6 under
Res., 26, 250"260, doi: 10.1007/s11095"008"9744"7.
ischemia"reperfusion injury of kidney, Cell Tissue Res.,
116. Lacramioara, L., Diaconu, A., Butnaru, M., and
378, 319"332, doi: 10.1007/s00441"019"03073"z.
Verestiuc, L. (2016) Biocompatible SPIONs with superox"
111.
Sharapov, M. G., Goncharov, R. G., Filkov, G. I.,
id dismutase/catalase immobilized for cardiovascular
Trofimenko, A. V., Boyarintsev, V. V., and Novoselov, V. I.
applications, IFMBE Proc., 55, 323"326, doi: 10.1007/
(2020) Comparative study of protective action of exoge"
978"981"287"736"9_78.
nous 2"cys peroxiredoxins (Prx1 and Prx2) under renal
117. Novoselov, V. I., Ravin, V. K., Sharapov, M. G., Sofin,
ischemia"reperfusion injury, Antioxidants (Basel), 9, 680,
A. D., Kukushkin, N. I., and Fesenko, E. E. (2011)
doi: 10.3390/antiox9080680.
Modified peroxiredoxins as prototypes of drugs with pow"
112. Li, Z., Wang, F., Roy, S., Sen, C. K., and Guan, J. (2009)
erful antioxidant action, Biophysics,
56,
836"842,
Injectable, highly flexible, and thermosensitive hydrogels
doi: 10.1134/S0006350911050137.
capable of delivering superoxide dismutase, Biomacromol>
118. Chhunchha, B., Kubo, E., Kompella, U. B., and Singh,
ecules, 10, 3306"3316, doi: 10.1021/bm900900e.
D. P. (2021) Engineered sumoylation"deficient prdx6
113. Guryev, E. L., Volodina, N. O., Shilyagina, N. Y., Gudkov,
mutant protein"loaded nanoparticles provide increased
S. V., Balalaeva, I. V., et al. (2018) Radioactive (90Y)
cellular defense and prevent lens opacity, Antioxidants
upconversion nanoparticles conjugated with recombinant
(Basel), 10, 1245, doi: 10.3390/antiox10081245.
THE ROLE OF GLUTATHIONE PEROXIDASES AND PEROXYREDOXINS
IN FREE@RADICAL PATHOLOGIES
Review
M. G. Sharapov1*, S. V. Gudkov2,3,4, V. Z. Lankin5, and V. I. Novoselov1
1 Institute of Cell Biophysics, Federal Research Center PSCBI RAS, 142290 Pushchino,
Moscow region, Russia; E>mail: sharapov.mars@gmail.com
2 Institute of General Physics named after A.M. Prokhorov Russian Academy of Sciences, 119991 Moscow, Russia
3 Institute of Biology and Biomedicine, Lobachevsky State University of Nizhni Novgorod,
603022 Nizhny Novgorod, Russia
4 All>Russian Research Institute of Phytopathology, 143050 Bolshiye Vyazemy, Russia
5 FGBU “National Medical Research Center of Cardiology” of the Ministry of Health of Russia; 121552 Moscow, Russia
In a review of the development of modern concepts of the molecular mechanisms of free radical pathologies. The
pathogenesis of some socially significant diseases associated with the development of oxidative stress, such as athero"
sclerosis, diabetes and radiation sickness, is considered. The possibilities of the therapeutic use of low molecular
weight natural and synthetic antioxidants for the correction of free radical pathologies are discussed. The main focus
of the review is the role of two phylogenetically close families of hydroperoxide"reducing antioxidant enzymes: per"
oxiredoxins and glutathione peroxidases. The role of these enzymes in counteracting oxidative stress is discussed.
Examples of the use of exogenous recombinant antioxidant enzymes as therapeutic agents in the treatment of patho"
logical conditions associated with free radical processes are presented. Further studies of exogenous enzymes -
antioxidants, as well as ways to improve their therapeutic properties are discussed.
Keywords: reactive oxygen species, dicarbonyls, peroxiredoxins, glutathione peroxidases, radiation sickness, athero"
sclerosis, diabetes
БИОХИМИЯ том 86 вып. 11 2021