БИОХИМИЯ, 2021, том 86, вып. 12, с. 1766 - 1781
УДК 577.24
СУЩЕСТВУЮТ ЛИ ДОКАЗАТЕЛЬСТВА В ПОЛЬЗУ
СУБТЕЛОМЕРНО ТЕЛОМЕРНОЙ ТЕОРИИ СТАРЕНИЯ?
Обзор
© 2021
G. Libertini1,2*, О. Shubernetskaya3, G. Corbi4,5, and N. Ferrara2,6
1 Member of the Italian Society for Evolutionary Biology (SIBE), 14100 Asti, Italy; e mail: giacinto.libertini@yahoo.com
2 Department of Translational Medical Sciences, Federico II University of Naples, 80131 Naples, Italy
3 Shemyakin-Ovchinnikov Institute of Bioorganic Chemistry, 117997 Moscow, Russia
4 Department of Medicine and Health Sciences, University of Molise, 86100 Campobasso, Italy
5 Italian Society of Gerontology and Geriatrics (SIGG), 50129 Firenze, Italy
6 Istituti Clinici Scientifici Maugeri SPA - Società Benefit, IRCCS, 82037 Telese Terme (BN), Italy
Поступила в редакцию 16.06.2021
После доработки 30.07.2021
Принята к публикации 02.09.2021
Теломерная теория описывает механизм клеточного старения, согласно которому старение происходит в
основном за счет укорочения теломер при каждой дупликации клеток. Субтеломерно теломерная теория
лишена ряда недостатков первой теории и постулирует значительную роль субтеломерной ДНК в механиз
мах старения. В настоящей работе проведен углубленный анализ соответствия между положениями и след
ствиями субтеломерно теломерной теории и результатами экспериментов. В частности, проанализированы
данные касательно взаимосвязи между старением и i) эпигенетическими модификациями; ii) окислением и
воспалением; iii) защитой теломеры; iv) теломерным гетерохроматиновым кэпом; v) постепенным клеточ
ным старением; vi) клеточным старением; vii) угасанием организма по мере укорочения теломер. В целом,
приведенные в работе данные свидетельствуют в пользу субтеломерно теломерной теории или, по крайней
мере, ей не противоречат. Вкратце, феномен клеточного старения, которое через различные пути в конеч
ном итоге обусловливает старение всего организма, в значительной степени зависит от эпигенетических мо
дификаций, регулируемых системой субтеломера-теломера-теломерный кэп-теломераза. Процессы,
опосредующие клеточное старение, по видимому, не являются случайными, неизбежными и необратимы
ми, а, скорее, вызываются и регулируются генетически предопределенными механизмами, соответственно,
они подвержены изменениям и могут быть обратимы соответствующими способами. В целом, приведенные
данные поддерживают тезис о том, что старение является генетически запрограммированным и регулируе
мым феноптотическим явлением и свидетельствуют против предположения, что старение вызвано случай
ным и неизбежным действием дегенеративных факторов.
КЛЮЧЕВЫЕ СЛОВА: старение, феноптоз, теломера, субтеломера, эпигенетические изменения, постепен
ное клеточное старение, клеточное старение, теломерный гетерохроматиновый кэп.
DOI: 10.31857/S0320972521120022
ВВЕДЕНИЕ
Многие теории принадлежат к первой пара
дигме [3]. В первой большой группе теорий вы
В этом разделе будет представлен набор кон
сказывается предположение, что старение явля
цепций и фактов, уже рассмотренных в недавно
ется неизбежным следствием накопления по
опубликованных работах [1-3], и для краткости
вреждений различного типа. На сегодняшний
большинство ссылок будут опущены.
день многие теории из этой группы представля
Для объяснения феномена старения исполь
ют интерес только с исторической точки зрения.
зуются две противоположные парадигмы. В слу
Они берут начало в XIX и первой половине
чае первой парадигмы, «непрограммированного
XX века и объясняют старение «износом» кле
или неадаптивного старения», последнее обус
ток, механохимическим разрушением клеточ
ловлено случайным накоплением эффектов раз
ных коллоидов, неизбежными тканеспецифич
личных дегенеративных факторов, которым не
ными изменениями (нервной, эндокринной,
было оказано достаточного противостояния в
сосудистой и соединительнотканной систем),
ходе естественного отбора.
токсичными продуктами жизнедеятельности
кишечных бактерий, накоплением «метаплаз
* Адресат для корреспонденции.
мы» или метаболитов и др. К этой группе также
1766
СУБТЕЛОМЕРНО ТЕЛОМЕРНАЯ ТЕОРИЯ СТАРЕНИЯ
1767
относятся различные модернизированные по
i) У хомяков и мышей теломеры обладают
пулярные теории и современные концепции,
большей длиной по сравнению с человеком, но
которые связывают старение с накоплением хи
при этом продолжительность их жизни намного
мических повреждений из за ошибок тран
короче [6]. При сравнении различных видов не
скрипции ДНК, пагубными последствиями
было обнаружено соответствия между продол
окисления, воздействием свободных радикалов
жительностью жизни и длиной теломеры [7].
на весь организм в целом, а также на митохон
Более того, в различных экспериментах было
дрии или ДНК, воспалительными явлениями и
продемонстрировано аналогичное отсутствие
возраст зависимыми нарушениями работы им
соответствия у индивидов одного вида, но с раз
мунной системы (инфламейджинг, «inflamm
личной длиной теломеры в первых зародыше
aging»). Отдельные работы, посвященные этим
вых клетках (например, между донором и кло
теориям, процитированы ниже в разделе «Ста
нированным животным [8, 9]; другие примеры и
рение, окисление и воспаление».
более подробные обсуждения см. в работе [10],
В других популярных теориях непрограмми
стр. 59-61).
рованного старения, таких как гипотеза накоп
ii) Elizabeth Blackburn обнаружила [11], что в
ления мутаций, гипотеза антагонистической
синхронно делящихся культурах клеток клеточ
плейотропии и гипотеза одноразовой сомы, все
ное старение достигается не после определенно
же в какой то мере учитываются механизмы
го числа дупликаций, а уже с первых дуплика
эволюции.
ций наблюдается прогрессивно возрастающая
Несмотря на огромное разнообразие этих
вероятность активации процесса клеточного
теорий, всех их объединяет одна фундаменталь
старения [12, 13]. Таким образом, запуск про
ная концепция. Поскольку старение определен
граммы клеточного старения инициируется не
но вредно для индивида, то естественный отбор
при достижении теломерой определенной кри
может работать только на то, чтобы противосто
тической длины - существует лишь вероятност
ять старению. Следовательно, недопустимо или
ная связь между активацией клеточного старе
неприемлемо существование адаптивных физио
ния и уменьшением длины теломеры.
логических механизмов любого рода, которые
Указанные несоответствия теломерной тео
могут определять старение.
рии, которая на самом деле представляет собой
В случае второй парадигмы, «программиро
чрезмерно и неприемлемо упрощенное видение
ванного или адаптивного старения», оно пре
клеточного старения, могут быть устранены пу
допределено и модулируется генами, которым
тем инкорпорирования в нее влияния укороче
на супраиндивидуальном уровне благоприят
ния теломеры на субтеломеру [10], что было
ствует естественный отбор, даже в том случае,
сформулировано как «субтеломерно теломер
когда они имеют негативный эффект на уровне
ная теория» [1-3]. Эту теорию мы вкратце обсу
индивида и принадлежат к категории фенопто
дим ниже со ссылкой на оригинальные работы,
тического феномена (принесение в жертву ин
содержащие большую часть свидетельств в
дивида согласно механизмам супраиндивиду
пользу этой теории:
ального отбора) [4, 5].
1) теломеры представляют собой концевые
Теорий, принадлежащих ко второй парадиг
участки молекул хромосомной ДНК, и, следова
ме, немного [3], и они требуют существования
тельно, число теломер в два раза превышает
специфических механизмов, опосредующих ста
число таких молекул, поскольку каждая хромо
рение. Следовательно, эмпирические данные,
сома имеет два конца. В половых клетках длина
демонстрирующие существование таких меха
каждой теломеры варьирует, и этот признак нас
низмов, решительно поддерживают обоснован
ледуется [14-16];
ность теорий, принадлежащих второй парадиг
2) в первой клетке организма каждая теломе
ме, и выступают против допустимости первой
ра должна быть покрыта гетерохроматиновым
парадигмы и соответствующих ей теорий.
капюшоном или кэпом (англ. «cap»), который
В течение определенного периода в основ
соответствует длине теломеры (предположе
ном в контексте и в поддержку второй парадиг
ние);
мы считалось, что прогрессирующее укороче
3) длина кэпа при каждой последующей дуп
ние теломер при каждой дупликации клеток мо
ликации не изменяется (предположение), даже
жет быть прямым и достаточным объяснением
если при каждой дупликации происходит уко
старения (данное положение можно сформули
рочение теломеры, обусловленное механизмом
ровать как «теломерная теория старения»). Тем
работы ДНК полимеразы (если укорочение не
не менее выводы, следующие из этой теории,
полностью компенсируется теломеразой - фер
оказались в противоречии с различными факта
ментом, активность которого зависит от типа
ми, например:
клетки);
БИОХИМИЯ том 86 вып. 12 2021
1768
LIBERTINI и др.
4) в случае укорочения теломеры кэп, кото
шинство сайтов связывания последовательнос
рый, согласно предположению, имеет фиксиро
тей TERRA было обнаружено за пределами те
ванную длину, скользит по участку молекулы
ломерных участков в основном в отдаленных
ДНК, прилегающему к теломере, называемому
межгенных и интронных участках генома, где
«субтеломера R»
(«R» означает регулятор
эти последовательности регулируют экспрессию
ный) [2], который содержит последовательнос
генов. При этом важно то, что деплеция тран
ти TERRA, кодирующие первичные регулятор
скриптов TERRA в эмбриональных стволовых
ные последовательности РНК (транскрипты
клетках (ЭСК, ESС - embryonic stem cells) также
TERRA), а не белки. Известны два типа после
была ассоциирована со снижением уровня за
довательностей TERRA (TelBam3.4 и TelSau2.0)
щиты теломер, указывая на то, что TERRA все
[17, 18], однако не исключено, что существуют и
же необходимы для целостности теломер мы
другие типы таких последовательностей;
ши…» [19]; v) деплеция транскриптов TERRA,
5) последовательности TERRA характерны
по видимому, ассоциирована со снижением за
для эукариотических клеток и эволюционно
щиты теломер [20, 21];
консервативны [19];
7) вероятно, существует огромное множест
6) последовательности TERRA могут быть
во регуляторных последовательностей второго
охарактеризованы как «регуляторные последо
уровня («В геноме эмбриональных стволовых
вательности первого уровня», а регулируемые
клеток мыши мы идентифицировали тысячи cis
ими последовательности - как «регуляторные
и trans хроматин связывающих сайтов» [20]),
последовательности второго уровня», поскольку
которые влияют на функционирование огром
транскрипты TERRA оказывают три типа регу
ного числа генов и других предположительных
ляторных эффектов, включающих: (a) воздей
регуляторных последовательностей;
ствие (повышение экспрессии) на участок моле
8) в связи с нарастающей степенью репрес
кулы ДНК, прилегающий к субтеломере R, наз
сии последовательностей TERRA происходит
ванный «субтеломера A» («A» - амплифика
постепенное изменение клеточных функций,
тор) [2], на той же теломере и других, содержа
которое определяется как «постепенное клеточ
щих регуляторные последовательности второго
ное старение» [2], снижение уровня защиты те
уровня, способствующих усилению и амплифи
ломер и повышение риска запуска процесса кле
кации эффектов TERRA транскриптов; б) воз
точного старения, «фундаментальной клеточной
действие (повышение или понижение уровня
программы» [22], которая характеризуется стерео
экспрессии) других регуляторных последова
типными модификациями (изменение клеточ
тельностей второго уровня и локализованных на
ных функций в высшей степени, т.е. постепен
других (не субтеломерных участках) как на той
ное клеточное старение, секреторный фенотип,
же самой молекуле ДНК, так и на других моле
ассоциированный с клеточным старением
кулах ДНК в клетке; в) регуляторное влияние
(SASP - senescence associated secretory pheno
системы защиты теломеры с использованием
type), повышающий риск возникновения онко
кэпа. Были получены экспериментальные дан
логических заболеваний [23], блокирование спо
ные, подтверждающие, что: i) «TERRA связыва
собности к репликации, иначе - репликативное
ется с мишенями на хроматине по всему геному
клеточное старение [22, 24], устойчивость к
...TERRA связывается с теломерами как в cis ,
апоптозу [25, 26]). Усиливающееся подавление
так и в trans положении в последовательностях
транскрипции последовательностей TERRA
генов или вблизи них» [20]; ii) продемонстриро
обусловливает увеличение доли клеток, находя
ваны
«…значительные изменения уровня
щихся в состоянии: 1) постепенного клеточного
экспрессии мишеней TERRA относительно
старения или 2) клеточного старения, т.е. изме
участков, не являющихся мишенями, после деп
нения клеточных функций, включая SASP. На
леции TERRA…, что указывает на то, что гены
копление этих двух типов клеток с измененными
мишени TERRA с большей вероятностью стра
функциями и снижающееся число пролифери
дают от деплеции TERRA… Интересно, что
рующих клеток в процессе клеточного старения
экспрессия субтеломерных генов мишеней
приводит к усилению изменений во всех органах
всегда снижалась…Экспрессия внутренних ге
и тканях, определяемое как «синдром атрофии»,
нов мишеней может при этом как повышаться,
и далее - к снижению уровня физического сос
так и понижаться…» [20]; iii) «TERRA связыва
тояния (формы), т.е. к старению [3];
ется со многими локусами, расположенными
9) в итоге первоначальные наблюдения
вне теломер, в которых некодирующие последо
Blackburn были ею подтверждены в соответ
вательности ДНК, по видимому, играют важ
ствии с функциями, которые в дальнейшем бы
ную регуляторную роль, связанную с генной
ли приписаны последовательностям TERRA
экспрессией [19-21]»; iv) «Подавляющее боль
(см. выше), что приводило к следующим поло
БИОХИМИЯ том 86 вып. 12 2021
СУБТЕЛОМЕРНО ТЕЛОМЕРНАЯ ТЕОРИЯ СТАРЕНИЯ
1769
жениям: 1) теломера слабо ассоциирована с кэ
ганизма. В частности, метилирование ДНК (ме
пом и может находиться в двух состояниях («ко
тилирование остатка цитозина по 5 му положе
лебаться» между ними), закрытом и открытом
нию в динуклеотиде CpG) является предметом
(«capped» и «uncapped»); 2) в открытом состоя
растущего числа исследований, показывающих,
нии она подвергается активации блокирования
среди прочего, что в эмбриональных и индуци
способности к репликации (т.е. клеточному ста
рованных плюрипотентных стволовых клетках
рению); 3) по мере укорочения теломеры доля
(иПСК, iPSCs - induced pluripotent stem cells)
открытого состояния увеличивается. Поэтому
оно близко к нулю и коррелирует с числом пас
клетки, вероятно, существуют в двух состояни
сажей клеток [28, 29]. Эпигенетические характе
ях: клетки, которые проходят клеточный цикл
ристики ДНК различаются в зависимости от ти
(cycling cells) и клетки, вышедшие из клеточного
па клеток и тканей [30, 31], аналогичные вариа
цикла. С самого начала пассирования отдель
ции наблюдаются в случае возрастных измене
ные клетки случайным образом выпадают из по
ний [32, 33].
пуляции клеток, проходящих клеточный цикл.
Метилирование ДНК, связанное с возрас
Частота выпадения из клеточного цикла посто
том, в отдельных случаях представляет собой ги
янно увеличивается до тех пор, пока популяция
перметилирование, а в других - гипометилиро
как целое не перестанет удваиваться … полага
вание [32, 34-36].
ют, что даже в начале пассирования теломеры,
Помимо эпигенетических вариаций, связан
хотя и относительно длинные, имеют конечную
ных с типом клеток и тканей, полом и наличием
(хотя исходно низкую) вероятность декэпирова
заболеваний, существуют последовательности
ния… декэпированная теломера подает сигнал
CpG, для которых также характерны возрастные
клетке выйти из клеточного цикла… случайная
изменения профиля метилирования ДНК [35-40].
и увеличивающаяся вероятность переключения
Для генома человека были предложены ин
в декэпированное состояние и перехода клетки
дикаторы, предсказывающие возраст с исполь
в состояние вне клеточного цикла. Такие поло
зованием только этих типов метилирования
жения могли бы объяснить ряд наблюдений. В
ДНК [28, 40, 41]. Самым надежным оказался
культурах клеток человека две митотические
индикатор, предложенный Horvath, который де
сестринские клетки могут обладать сильно раз
монстрирует корреляцию с возрастом, равную
личающимися возможностями пролиферации
0,96, и ошибку, равную 3,6 года [28]. Существо
[13], даже если они имеют сходные по длине те
вание сходных эпигенетических модификаций
ломеры… у нокаутированных по теломеразе мы
было продемонстрировано и для млекопитаю
шей слияние теломер и влияние недостатка те
щих в целом в работе на 59 типах тканей, при
ломеразы возрастают неуклонно по частоте и
надлежащих 128 видам из 15 филогенетических
тяжести с увеличением числа последующих по
родов (с максимальной продолжительностью
колений, а не проявляются внезапно только в
жизни от 3,8 до 211 лет и весом взрослых особей
поздних поколениях… У дрожжей клеточное
от 0,004 до 100 кг). Были смоделированы эпиге
старение также стохастично и прогрессирует в
нетические часы «с превосходной точностью
клеточной популяции… новая модель избавляет
(r > 0,96)» и со «средней относительной ошиб
от необходимости в определении «критической»
кой менее 3,5%» [29].
длины теломеры» [11].
Помимо метилирования ДНК, существуют и
Указанные положения представлены в крат
другие возрастные эпигенетические изменения,
ком виде на рис. 1.
которые включают снижение уровня ремодел
Что касается длительноживущих клеток, то
линга гетерохроматина, нуклеосом, изменение
ухудшение их состояния объясняется сокраще
гистоновых меток [42, 43], метилирование гис
нием числа сателлитных клеток, что обсуждает
тонов [44, 45], «снижение общего уровня основ
ся в других работах [27].
ных гистонов, изменение паттерна посттранс
В настоящей работе мы попытались прове
ляционной модификации гистонов…, замену
рить, противоречат ли имеющиеся эксперимен
канонических гистонов на их различные моди
тальные данные субтеломерно теломерной тео
фикации, а также изменение уровня экспрессии
рии (или хотя бы являются совместимыми с
некодирующих РНК» [46]. Тем не менее надеж
ней) или же, напротив, они её подтверждают.
ных индексов для предсказания возраста на ос
нове таких эпигенетических модификаций, по
добных индексам, описанным для метилирова
МЕТИЛИРОВАНИЕ ДНК ПРИ СТАРЕНИИ
ния ДНК, предложено не было [28, 29].
Эти данные легли в основу концепции, за
Эпигенетические модификации ДНК непо
ключающейся в том, что на клеточном уровне
средственным образом связаны с возрастом ор
старение представляет собой эпигенетическое
3 БИОХИМИЯ том 86 вып. 12 2021
1770
LIBERTINI и др.
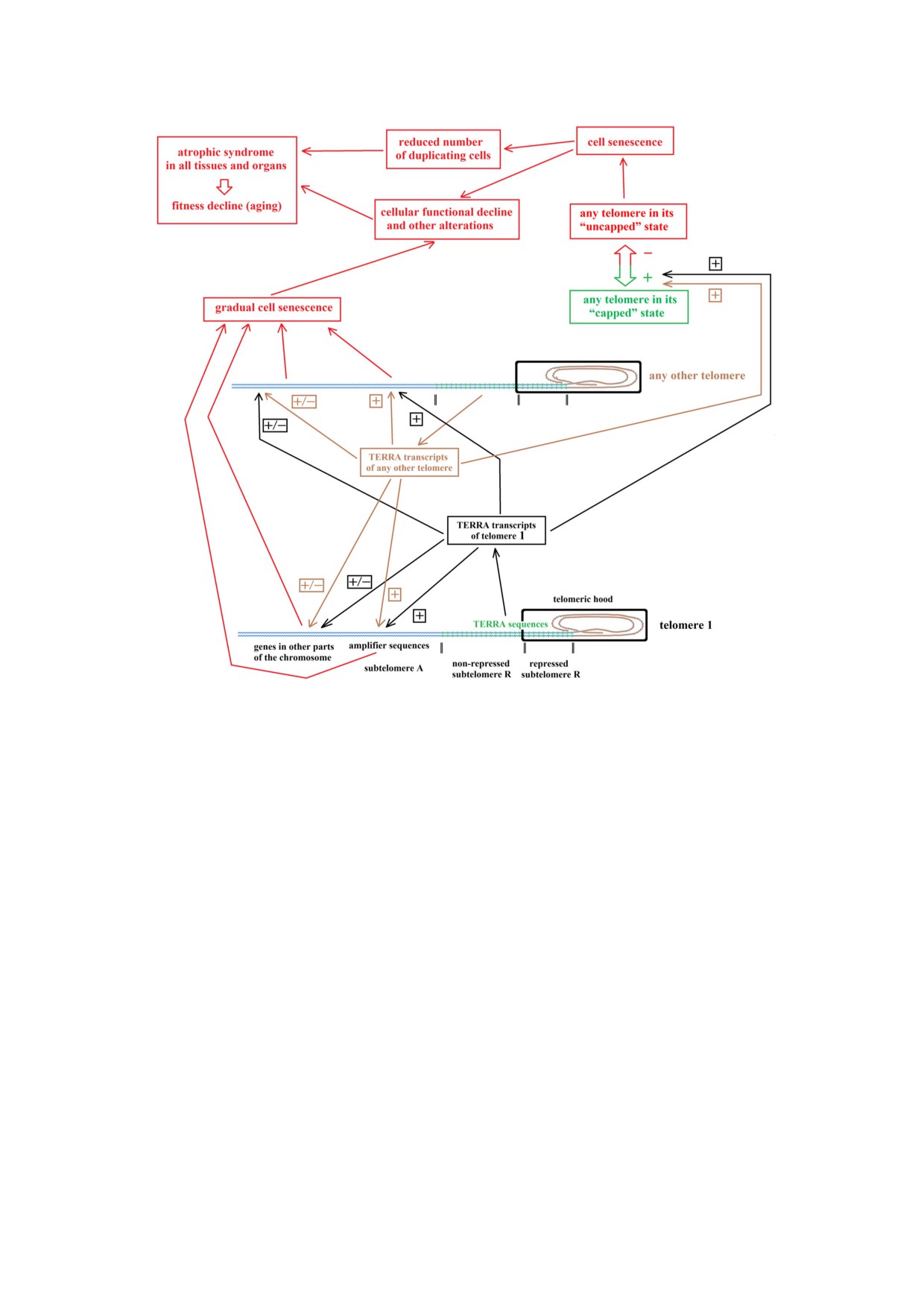
Рис. 1. Транскрипция последовательностей TERRA в субтеломере R приводит к появлению транскриптов TERRA, которые
вызывают повышение или понижение уровня экспрессии других регуляторных последовательностей в субтеломере A или
других участках, расположенных на той же самой хромосоме или на других хромосомах. Скольжение теломерного гетеро
хроматинового кэпа вызывает прогрессирующее подавление субтеломеры R. В то же время происходит укорочение тело
меры. Снижение уровня транскрипции последовательностей TERRA определяет постепенное клеточное старение и увели
чивающуюся вероятность клеточной сенесцентности. В тканях и органах это приводит к снижению средней функциональ
ности клеток и числа делящихся клеток, вызывая ухудшение физического состояния всего организма, т.е. старение; [+] и
[-] означают повышение и понижение экспрессии соответственно, в отношении других последовательностей или состоя
ния теломеры; черным цветом показано действие последовательностей TERRA или транскриптов на другие последова
тельности на той же молекуле ДНК (обозначенной как теломера 1); коричневым цветом показано действие транскриптов
TERRA на последовательности любой другой молекулы ДНК; красным цветом показано действие в контексте сложных ме
ханизмов, приводящих к ухудшению физического состояния организма; нетеломерная ДНК, теломерная ДНК и петля
концевого участка теломеры на графике различаются по дизайну и цвету без каких либо дополнительных уточнений
явление (например, [47]), приводящей к поло
тид CpG (примерно 1 раз на 10 пар оснований
жению о том, что старение всего организма так
(п.о.); эти участки были названы CpG остров
же зависит от клеточных эпигенетических мо
ками или CGIs), при том что эти структуры сос
дификаций. Тем не менее, несмотря на то что
тавляют только 2% от всей последовательности
эта идея основана на хорошо документирован
ДНК [31]. CpG островки часто соответствуют
ных данных, это не обязательно означает, что
сайтам инициации транскрипции генов [48].
эпигенетические изменения являются первич
Метилирование CpG островков коррелирует с
ными и не имеют отношения к другим механиз
сайленсингом любых промоторов, присутству
мам. Во первых, следует отметить, что эпигене
ющих в них [49], в то время как их деметилиро
тические изменения ограничиваются специфи
вание приводит к восстановлению функциони
ческими участками ДНК. Метилирование ДНК:
рования промотора [50];
- затрагивает те участки ДНК, в последова
- происходит в конкретных точках, которые
тельности которых часто встречается динуклео настолько эволюционно консервативны, что
БИОХИМИЯ том 86 вып. 12 2021
СУБТЕЛОМЕРНО ТЕЛОМЕРНАЯ ТЕОРИЯ СТАРЕНИЯ
1771
позволяют определить надежный индекс, кото
- у мышей также показана связь между уко
рый работает для всех млекопитающих [29];
рочением теломеры и метилированием субтело
- обратимо за счет трансформации зрелых
мерной ДНК [53]. «Кроме того, отсутствие
соматических клеток в иПСК. При определении
функционирования основных эпигенетических
возраста на основе профиля метилирования
регуляторов, таких как метилтрансферазы гис
ДНК (DNAm age) в ЭСК и в иПСК эти значения
тоновых белков и ДНК метилтрансферазы,
оказываются близки к нулевым [28];
коррелирует с утратой контроля над длиной те
- число предыдущих дупликаций клеток
ломеры и ее укорочением до критических значе
коррелирует со значениями метилирования
ний, что оказывает влияние на эпигенетический
ДНК [28].
статус теломер и субтеломер» [53];
Эти данные не соответствуют теории о слу
- в лейкоцитах человека «…более короткие
чайных изменениях и означают, что существуют
теломеры ассоциированы с пониженным уров
точные генетически предопределенные, регули
нем метилирования множественных сайтов ци
руемые и эволюционно консервативные меха
тозина, локализованных на расстоянии до
низмы, опосредующие такие модификации. Как
4 млн п.о. от теломеры…значительное концент
следствие, возрастные эпигенетические моди
рирование положительно ассоциированных ме
фикации не выступают в качестве основного
тилированных сайтов CpG в субтеломерных ло
фактора, определяющего старение, напротив,
кусах (до
4
млн п.о. вблизи теломеры)
они могут быть фундаментальной частью более
(p < 0,01)» [54]. Более короткие теломеры влия
общего механизма, который определяет и регу
ют на экспрессию генов, и с ними ассоциирован
лирует процесс старения. Эта концепция была
повышенный риск возникновения возрастных
прямо заявлена в следующем виде: «Старение
заболеваний [54].
часто воспринимается как дегенеративный про
Описанные выше результаты свидетельству
цесс, вызванный случайным накоплением пов
ют о том, что происходит повышение или пони
реждений клеток с течением времени. Несмотря
жение экспрессии регуляторных последователь
на это, возраст может быть точно определен с
ностей первого уровня (последовательности
помощью эпигенетических часов, основанных
TERRA, чьими промоторами являются последо
на профилях метилирования ДНК, полученных
вательности CpG) и регуляторных последова
почти из любой ткани организма. Поскольку ра
тельностей второго уровня (расположенных
бота таких эпигенетических часов в различных
вблизи теломер и других участков ДНК) с учас
тканях была продемонстрирована для несколь
тием эпигенетических механизмов, таких как
ких биологических видов, трудно игнорировать
метилирование и деметилирование. При этом
высокую вероятность того, что в основе процес
указанные данные не дают информации о том,
са старения лежит определенный общий меха
как происходит повышение или понижение
низм» [29].
уровня экспрессии возможных регуляторных
Давайте оценим, насколько эпигенетичес
последовательностей третьего или высших
кие модификации совместимы с механизмами,
уровней, даже если они действительно могут на
предлагаемыми субтеломерно теломерной тео
ходиться под действием схожих эпигенетичес
рией:
ких механизмов. В дополнение к этим пробе
- «CpG богатые островки ДНК, характер
лам, которые обязательно должны быть охваче
ные для многих концов хромосом человека,
ны соответствующими исследованиями, не су
способствуют
транскрипции
молекул
ществует также данных о том, что последова
TERRA» [18];
тельности, контролируемые последовательнос
- «Уровень метилирования субтеломерной
тями TERRA через многоуровневые регулятор
ДНК…понижается пропорционально укороче
ные механизмы, совпадают с теми, которые об
нию теломеры у мышей Terc-/-» [51];
суждались выше, чей эпигенетический статус
- «У здоровых людей из контрольной груп
изменяется с возрастом.
пы, а также у больных саркоидозом было по
Важным моментом может стать исследова
казано снижение доли длинных теломер
ние сенесцентных клеток, в которых ожидается
(> 9,4 тыс. п.о.) и увеличение доли коротких те
максимальная репрессия последовательностей
ломер (< 4,4 тыс. п.о.) при старении, что сопро
TERRA.
вождалось относительным увеличением доли
В одной работе было показано, что в случае
длинных теломер с гиперметилированием субте
мезенхимальных стволовых клеток (МСК,
ломеры и коротких теломер с гипометилирова
MSCs - mesenchymal stem cells) клеточное ста
нием субтеломеры. Это дает основание полагать,
рение ассоциировано с метилированием ДНК в
что возрастное укорочение теломеры связано с
специфических CpG сайтах, а также с гистоно
гипометилированием её субтеломеры» [52];
выми маркерами старения, такими как тримети
БИОХИМИЯ том 86 вып. 12 2021
3*
1772
LIBERTINI и др.
лирование специфических мишеней [55], и что
мер, окислительное влияние свободных радика
«экспансия [наращивание, размножение] МСК
лов и активных форм кислорода на весь орга
оказывает определенное влияние на профили
низм [63, 64], митохондрии [65, 66] или ДНК
метилирования ДНК»; «в 517 сайтах CpG было
[67, 68]; инфламейджинг и возрастные измене
продемонстрировано дифференциальное мети
ния иммунной системы [69, 70]).
лирование при сравнении ранних и поздних
Эти теории непрограммированного старе
пассажей»; «Было показано, что картина мети
ния основываются на положении, что старение
лирования ДНК ассоциирована с определенны
является последствием кумулятивного действия
ми модификациями гистонов - в особенности с
этих веществ и в неявном виде исключает идею
метилированием гистона H3» [55].
о том, что оно возникает в результате действия
В стареющих МСК было продемонстрирова
других механизмов, а накопление указанных
но как гипометилирование, так и гиперметили
выше веществ и производимые ими эффекты
рование: «В почти трети CpG сайтов были вы
являются вторичными.
явлены возрастные изменения профиля мети
Субтеломерно теломерная теория старения
лирования ДНК, из которых при старении 60%
подразумевает прямо противоположное: что ме
сайтов становятся гипометилированными и
ханизмы, сосредоточенные в системе теломера-
40% - гиперметилированными» [56].
субтеломера-теломераза, являются первопри
Все эти данные, несмотря на существующие
чиной всех перечисленных выше изменений.
пробелы, которые необходимо заполнить, ука
Помимо других аргументов и эмпирических
зывают на то, что метилирование ДНК и в це
доказательств, направленных против теорий
лом возрастные эпигенетические модификации
непрограммированного старения, которые об
находятся в тесной корреляции с механизмами
суждались в работе [71] и не являются предме
репрессии последовательностей TERRA и опос
том обсуждения в настоящей статье, о том, что
редованы работой системы, состоящей из субте
указанные выше изменения являются вторич
ломеры, теломеры, теломерного кэпа, теломера
ными, а не первичными, мы имеем несколько
зы, других регуляторных последовательностей и
важных свидетельств:
соответствующих регуляторных белков. Таким
- перенос ядра из дифференцированной
образом, представленные выше эксперимен
клетки в лишенный ядра неоплодотворенный
тальные данные, касающиеся метилирования
ооцит приводит к образованию недифференци
ДНК и других возрастных эпигенетических из
рованной яйцеклетки, из которой можно полу
менений, вероятно, подтверждают или, по
чить новый индивид, который представляет со
крайней мере, соответствуют положениям суб
бой клон донора дифференцированной клет
теломерно теломерной теории. Следовательно,
ки [72];
правомерным было бы утверждение о том, что
- слияние эмбриональных стволовых клеток
клеточное старение представляет собой эпиге
человека с соматическими клетками (фиброблас
нетический феномен с дополнением, что этот
ты человека) приводит к образованию гибридных
феномен, вероятно, регулируется системой суб
тетраплоидных клеток с характеристиками эм
теломеры-теломеры.
бриональных стволовых клеток: «Анализ тран
скрипционной активности на уровне генома, ак
тивации репортерных генов, экспрессии специ
СТАРЕНИЕ, ОКИСЛЕНИЕ И ВОСПАЛЕНИЕ
фичных аллелей генов и метилирования ДНК
показал, что соматический геном был репро
Многочисленные статьи подчеркивают кор
граммирован в эмбриональное состояние» [73];
реляцию между старением и накоплением ве
- трансформация (репрограммирование)
ществ, вызывающих окисление (свободные ра
фибробластов взрослого организма в иПСК пу
дикалы [57], активные формы кислорода и азо
тем действия четырех факторов (Oct3/4, c Myc,
та [58, 59]), или молекул, окисленных/повреж
Sox2 и Klf4) приводит к восстановлению спо
денных такими веществами (окисленные бел
собности к росту и экспрессии генов маркеров
ки [60], поврежденные или укороченные тело
эмбриональных стволовых клеток [74].
меры [61]), или хроническим состоянием воспа
Эти явления указывают на то, что указанные
ления и изменения работы иммунной системы,
выше изменения не являются неизбежным
получившим название инфламейджинг (inflam
следствием функционирования биохимических
maging) [62].
механизмов или результатом случайного и необ
Обнаружение этих корреляций дало начало
ратимого накопления различных видов повреж
различным теориям, в которых отмеченные вы
дений с акцентом на вызванные воздействием
ше вещества или их эффекты были рассмотрены
активных форм кислорода. Напротив, похоже,
в качестве основной причины старения (напри
что они являются результатом четких, генети
БИОХИМИЯ том 86 вып. 12 2021
СУБТЕЛОМЕРНО ТЕЛОМЕРНАЯ ТЕОРИЯ СТАРЕНИЯ
1773
чески предопределенных и подверженных регу
ностью экспрессии последовательностей TERRA
ляции механизмов, которые могут быть обраще
и защитой теломеры, т.е. с ограничением веро
ны в результате соответствующих генетических
ятности активации программы клеточного ста
манипуляций. Более того, баланс между окис
рения. Тем не менее подробности того, как
лительным и восстановительным потенциалом
транскрипты TERRA обеспечивают такую за
внутри клеток и тканей, по видимому, тщатель
щиту, объяснены лишь частично. И все же поло
но регулируется и, в свою очередь, эмиссия
жение субтеломерно теломерной теории о связи
окислительных агентов является частью сиг
между укорочением теломеры, снижением уров
нальной системы, действующей как эффектор
ня экспрессии TERRA и уровнем защиты тело
как в клетках, так и в организме в целом, и отве
меры в общих чертах было подтверждено экспе
чающей на внутренние или внешние регулятор
риментальными данными.
ные стимулы [75, 76]. Все эти утверждения пол
ностью соответствуют положениям субтеломер
но теломерной теории.
ТЕЛОМЕРНЫЙ
ГЕТЕРОХРОМАТИНОВЫЙ КЭП
ЗАЩИТА ТЕЛОМЕРЫ
Согласно субтеломерно теломерной теории
требуется, чтобы в период жизни клетки, кото
Субтеломерно теломерная теория утвержда
рый можно определить как «фаза перезагрузки
ет, что защита теломеры, т.е. ограничение риска
(reset phase)» [79], в первой клетке живого орга
того, что незащищенная теломера может акти
низма (или даже в случае трансформации сома
вировать процесс клеточного старения, зависит
тических клеток в иПСК) каждая теломера
от системы субтеломеры-теломеры, в частнос
должна быть укрыта гетерохроматиновым кэ
ти, от активности последовательностей TERRA:
пом, по размеру пропорциональным исходной
- в эмбриональных стволовых клетках мы
длине теломеры. Эта длина различается от вида
ши снижение числа транскриптов TERRA кор
к виду, от хромосомы к хромосоме и даже между
релирует со снижением уровня защиты теломе
двумя плечами хромосомы («…значения длины
ры [20, 21]. Снижение уровня TERRA ассоци
теломеры внутри одной клетки различны, и
ировано с «дефектами кэпирования теломеры.
конкретные плечи хромосомы обычно имеют
С помощью теломера специфичных проб ана
или короткую, или длинную теломеру» [14]). В
лиз ДНК в метафазных пластинках методом
результате множества последующих дупликаций
FISH продемонстрировал нарушение целост
половой клетки и образующихся из нее клеток,
ности теломеры спустя
24
ч нокдауна
когда происходит укорачивание теломеры до ве
TERRA…» [20];
личины, определяемой уровнем репрессии ак
- транскрипты TERRA противодействуют
тивности теломеразы, кэп не адаптируется к но
белку ATRX (alpha thalassemia mental retardation
вой длине теломеры, а вместо этого сохраняет
X related syndrome) и защищают теломеры. «У
свою длину и оказывает репрессирующее
TERRA и ATRX сотни общих генов мишеней, в
действие на субтеломерный участок.
этих локусах они работают как антагонисты: ес
Согласно теории, необходимо существова
ли TERRA активирует, то ATRX подавляет экс
ние теломерного кэпа с определенным молеку
прессию соответствующего гена. В теломерах
лярным составом, обусловливающим специфи
TERRA конкурирует с теломерной ДНК за свя
ческие молекулярные механизмы:
зывание белка ATRX, подавляет cкопление
- в фазе перезагрузки - для адаптации дли
ATRX и обеспечивает стабильность теломе
ны кэпа относительно длины теломеры;
ры» [20];
- при каждой дупликации клетки для вос
- снижение уровня транскрипции последо
производства кэпа определенного размера без
вательностей TERRA с помощью различных ме
учета сокращения длины теломеры;
тодик инициирует активацию ответа на повреж
- при укорочении теломеры при каждой
дения ДНК на участках теломер [77];
дупликации для регуляции степени активации
- делеция локуса 20q вызывает резкое сни
теломеразного комплекса, координирующей
жение уровня TERRA и индуцирует усиленный
длину восстановления теломеры.
ответ на повреждения ДНК. Этот факт был ин
В основном эти фундаментальные вопросы
терпретирован как «демонстрация важной роли
субтеломерно теломерной теории либо не име
TERRA в стабилизации теломер в любом орга
ют ответа, либо он неоднозначен. Тем не менее
низме» [78].
известны некоторые важные моменты:
Таким образом, различные работы демон
- теломера покрыта несколькими копиями
стрируют наличие корреляции между актив
шелтеринового белкового комплекса с четко оп
БИОХИМИЯ том 86 вып. 12 2021
1774
LIBERTINI и др.
ределенными основными компонентам (белки
ограничены и недостаточны. Тем не менее необ
TRF1, TRF2, RAP1, TIN2, TPP1 и POT1
ходимо учитывать, что для любой альтернатив
[80, 81]), а также их расположением [80];
ной теории существует еще меньше доказа
- гетерохроматиновый кэп может быть об
тельств и больше вопросов без ответа. Действи
разован цепью шелтериновых комплексов, свя
тельно, если не рассматривать механизм старе
занных друг с другом за счет биохимической
ния в контексте существования теломерных кэ
связи между белком POT1 из одного комплекса
пов с фиксированной длиной, то нужен будет
и белков TRF1 и TIN2 из последующего комп
альтернативный механизм объяснения того, ка
лекса, как показано на рис. 2;
ким образом различия в длине теломер сохраня
- в случае, если кэп состоит из одной цепи
ются после каждого деления клеток [15]. Необ
шелтеринового комплекса и имеет фиксирован
ходимо будет также объяснить наследуемость
ный размер, который не изменяется при каждой
длины теломеры от родителей (например, высо
дупликации даже при укорочении теломеры, то
кое ее сходство у монозиготных близнецов и от
общее количество шелтериновых белков не
сутствие такового у дизиготных [15, 16]).
должно изменяться, начиная от зародышевых
Вне контекста субтеломерно теломерной тео
клеток вплоть до клеток с укороченными тело
рии для зародышевых клеток был бы необходим
мерами. Напротив, если размер кэпа пропорци
гипотетический регистр с записями обо всех
онален длине теломеры, общее количество шел
длинах теломер. Более того:
териновых белков должно снижаться по мере
i) в клетках с активной теломеразой для каж
укорочения теломеры. Было исследовано коли
дой теломеры должен существовать конкретный
чество шелтериновых белков в клетках с теломе
механизм компенсации ее длины, использую
рами различной длины и получены интересные
щий информацию, содержащуюся в гипотети
результаты: «Чтобы определить число и стехио
ческом регистре для определения того, до какой
метрию белков шелтеринового комплекса в бел
степени необходимо удлинить теломеру, чтобы
ковой фракции хроматина клеток человека мы
восстановить её первоначальную длину. Кроме
использовали метод количественного иммуно
того, в случае излишнего удлинения теломеры
блоттинга. Количество шелтериновых компо
теломеразой другой механизм должен с исполь
нентов было сходным в первичных и трансфор
зованием этой информации из регистра привес
мированных клетках и не коррелировало с дли
ти к удалению излишнего материала;
ной теломеры» [82]. Эти данные позднее были
ii) в клетках со сниженной активностью те
подтверждены и в других работах: «Определение
ломеразы аналогичный механизм с использова
уровня белков шелтерина показывает, что раз
нием информации об исходной длине теломе
мер этого комплекса не изменяется соответ
ры, содержащейся в гипотетическом регистре,
ственно длине теломеры» [82, 83]. В той же рабо
должен способствовать частичному восстанов
те показано, что белок TZAP удаляет избыточ
лению исходной длины пропорционально сте
ные участки теломеры в случае «низкой конце
пени активности теломеразы;
нтрации шелтеринового комплекса», т.е. низко
iii) должны существовать различные меха
го соотношения количества шелтериновых
низмы, которые будут сравнивать начальную
комплексов к длине теломеры и, как подчерки
длину с длиной, записанной в гипотетическом
вают авторы, это означает наличие постоянного
регистре с учетом позиционирования теломеры,
числа шелтериновых комплексов [83]. Эти дан
и рассчитывать вероятность запуска процесса
ные свидетельствуют в пользу контролирования
клеточного старения пропорционально укороче
определенной длины теломеры, как правило, ог
нию теломеры относительно начальной длины.
раниченной фиксированным размером кэпа.
При этом такой регистр кажется очень гро
Что касается теломерного кэпа, то эти дан
моздким и сложным, и нет никаких доказа
ные, по видимому, свидетельствуют в пользу
тельств его существования. Концепция этого ре
субтеломерно теломерной теории, однако они
гистра может быть заменена на концепцию, со
Рис. 2. Возможная структура цепи комплексов шелтерина. a-f -TIN2, TPP1, POT1, TRF1, TRF2 и RAP1 соответственно
БИОХИМИЯ том 86 вып. 12 2021
СУБТЕЛОМЕРНО ТЕЛОМЕРНАЯ ТЕОРИЯ СТАРЕНИЯ
1775
гласно которой теломерные кэпы обладают оп
грессирующее репрессирование субтеломер, т.е.
ределенной длиной в первой клетке организма,
репрессия последовательностей TERRA ассоци
и их размер остается фиксированным при всех
ирована с последовательным изменением кле
последующих дупликациях клеток. Таким обра
точных функций. Эти изменения, охарактери
зом, теломерные кэпы могут функционировать
зованные как «прогрессирующее [постепенное]
как «регистры», специфичные для каждой тело
старение клеток» [71], нужно отличать от акти
меры и опосредующие механизм реализации
вации процесса клеточного старения в контекс
пунктов i), ii) и iii) (т.е. положения субтеломер
те
«фундаментальной клеточной програм
но теломерной теории). Таким образом, мы по
мы» [22], которая инициирует общие стереотип
лучаем достаточно реалистичную картину, хотя и
ные изменения функций клеток [87], или своего
с некоторыми неясными моментами, которые
рода прогрессирующее до высшей степени кле
еще предстоит экспериментально прояснить.
точное старение, ассоциированное с реплика
Вкратце, гипотеза, предложенная субтело
тивным клеточным старением и устойчивостью
мерно теломерной теорией касательно опреде
к апоптозу.
лённой длины теломерного кэпа, которая не ме
И хотя всегда необходимо учитывать возмож
няется при дупликациях клеток, а также все яв
ность того, что при изучении клеточных культур
ления, связанные с этой гипотезой, похоже, не
старение части клеток может симулировать со
имеют альтернативы, которая была бы достаточ
стояние частичного старения всех клеток, тем не
но правдоподобной и подтверждалась эмпири
менее в поддержку этого предположения имеют
ческими доказательствами.
ся некоторые свидетельства постепенного кле
Например, в качестве альтернативной или
точного старения как состояния, отличающего
частично альтернативной гипотезы может быть
ся от классического клеточного старения:
предложена ситуация, когда сдвиг баланса меж
- У дрожжей, одноклеточных организмов, в
ду количеством белков шелтеринового комп
которых теломераза всегда активна, и поэтому
лекса и доступными теломерами или субтело
теломеры обладают постоянной длиной [88],
мерными участками в случае чрезмерного уко
клетка делится на две, из которых первая клетка
рочения теломеры может напрямую влиять на
определяется как «мать», в которой к субтеломе
регуляцию дистальных участков генома, вклю
ре добавляются специфические внехромосом
чая последовательности, расположенные далеко
ные кольцевые рибосомные ДНК (ERCs - extra
от концов хромосом [84], без усиления репрес
chromosomal ribosomal DNA circles), в то время
сии TERRA. Такие процессы могут быть основа
как во второй клетке, определяемой как «дочь»,
ны на связывании компонентов шелтеринового
эти внехромосомные элементы отсутствуют.
комплекса с последовательностями на неконце
Вследствие накопления ERCs клетки материнс
вых участках хромосом, имеющими меньшее
кой линии с увеличением числа дупликаций де
сродство по сравнению с теломерами [85]. Такие
монстрируют наращивание функциональных
участки могут включать интерстициальные те
изменений и подверженность клеточному ста
ломерные повторы и элементы регуляции, так
рению, которое приводит к апоптозу дрожже
же содержащие теломерные повторы и поэтому
вых клеток [89, 90]. Более того, в мутантных
доступные для связывания, хотя с меньшим
штаммах с неактивной теломеразой (мутан
сродством, чем теломеры [86]. Такие взаимодей
ты tlc1Δ) укорочение теломер происходит при
ствия должны обусловливать совместное функ
каждой дупликации и в клетках дочерней ли
ционирование системы субтеломеры-теломеры
нии, в которых не происходит накопления
с другими глобальными регуляторами генома,
ERCs; их транскриптом сходен с клетками мате
побуждая их действовать согласованно на всем
ринской линии с равным количеством дуплика
протяжении сложного процесса развития и осо
ций [91]. Это явление в мутантных клетках мо
бенно при регуляции процесса старения. Одна
жет быть следствием соскальзывания теломер
ко это предположение не объясняет схожее ко
ного кэпа на субтеломеру и ее последующего
личество шелтериновых белков в первичных и
репрессирования, в то время как в клетках мате
трансформированных клетках, «не коррелирую
ринской линии дикого типа репрессия субтело
щее с длиной теломеры» [82].
меры вызвана накоплением ERCs [10, 92]. У
дрожжей ввиду того, что клеточное старение вы
зывает апоптоз и гибель индивида, угасание
ПРОГРЕССИРУЮЩЕЕ
клеточных функций (постепенное старение
КЛЕТОЧНОЕ СТАРЕНИЕ
клетки) нельзя спутать с клеточным старени
ем/сенесцентностью.
Согласно субтеломерно теломерной теории,
- «По мере укорочения теломеры кэп сколь
по мере укорочения теломеры происходит про
зит вниз по хромосоме (размер гетерохромати
БИОХИМИЯ том 86 вып. 12 2021
1776
LIBERTINI и др.
нового кэпа постоянен, и кэп просто сдвигается
ляется постепенным процессом, по крайней ме
с укорачивающимся концом)… в результате
ре, до того момента, когда запускается процесс
происходит изменение транскрипции на участ
перехода в необратимое состояние, именуемое
ках хромосомы, непосредственно прилегающих
клеточной сенесцентностью.
к теломерному комплексу, что обычно приводит
- При изучении феномена, определенного
к сайленсингу транскрипции…Эти подвергшие
как эффект позиционирования теломер
ся сайленсингу гены могут в свою очередь моду
(TPE OLD - telomere position effect over long dis
лировать другие, находящиеся на удалении гены
tance), было подчеркнуто, что: «Наши результа
(или комплекс генов). Существует несколько
ты свидетельствуют о том, что экспрессия части
прямых доказательств такой модуляции в после
субтеломерных генов зависит от длины теломе
довательностях субтеломеры… но в целом, в то
ры и что значительные изменения экспрессии
время как экспериментальные данные свиде
генов индуцируются укорочением теломеры за
тельствуют о существовании некой неопреде
долго до того, как теломеры становятся ско
ленной… но прямой причинно следственной
рость лимитирующим фактором для деления
связи между укорочением теломеры и измене
клетки, или короткие теломеры инициируют
нием профиля экспрессии генов, механизмы
передачу сигнала, вызванную повреждением
этой связи остаются неясными и спорны
ДНК. Эти изменения включают как повыше
ми…» [10].
ние, так и понижение уровня экспрессии ге
- Мезенхимальные стволовые клетки демон
нов [99]», хотя авторы статьи интерпретируют
стрируют постоянные изменения профиля ме
эти данные как результат невозможности фор
тилирования ДНК (гипометилирование или ги
мирования теломерных петель на относительно
перметилирование) в процессе последователь
далеко расположенных участках хромосомы при
ных пассажей, которые могут быть использова
укорочении теломеры.
ны в качестве надежных маркеров количества
пассажей клеточной культуры in vitro [93-95];
«Определение профиля экспрессии мРНК выя
УКОРОЧЕНИЕ ТЕЛОМЕРЫ И УГАСАНИЕ
вило последовательную картину изменений гло
ЖИВОГО ОРГАНИЗМА
бальной экспрессии генов в МСК при пассиро
вании. Эти изменения не ограничены более
В контексте субтеломерно теломерной тео
поздними пассажами, они возникают постоян
рии (как и теломерной теории) возможно сде
но с увеличением числа пассажей» [96].
лать следующие выводы:
- МСК демонстрируют некоторые «дефек
- активно дуплицирующиеся клетки орга
ты», ассоциированные с числом предшествую
низма должны демонстрировать сходное укоро
щих дупликаций, которые могут быть устране
чение длин теломер, связанное с ритмами дуп
ны путем их репрограммирования в иПСК [97].
ликации, и в пожилом организме теломеры
Затем из иПСК можно получить функциональ
должны быть критично короткими;
ные МСК, называемые индуцированными
- клетки тканей с более высокими скоростя
МСК (иМСК, iMSCs - induced MSCs), с незна
ми дупликации должны демонстрировать кри
чительными эпигенетическими изменениями и
тически укороченные теломеры и более выра
повышенной выживаемостью клеток [98]. «В
женные признаки старения, в то время как для
сравнении со взрослыми МСК и независимо от
типов клеток с низкой скоростью дупликации
возраста донора или источника клеток, иМСК
укорочение теломеры и признаки клеточного
демонстрируют омоложенный профиль [97].
старения должны быть намного более ограни
При этом метилирование ДНК, ассоциирован
ченными;
ное с возрастом, полностью «стирается», и в
- в долгоживущих клетках укорочение тело
процессе культивирования in vitro иМСК вновь
мер будет нулевым, поэтому старение нельзя
приобретают ассоциированную с клеточным
объяснить укорочением теломер.
старением картину метилирования ДНК» [56].
Эти положения требуют некоторого обсуж
Процитированные выше работы свидетельству
дения.
ют о том, что с помощью соответствующих ма
В обзоре, посвященном снижению длины
нипуляций можно достигать переключения
теломеры с возрастом, исследуемой в образцах
между различными клеточными состояниями с
от новорожденных до долгожителей, было по
разной степенью клеточного старения. Это
казано ежегодное сокращение длины теломер
подтверждает, что клеточное старение: 1) не яв
во многих типах клеток, кроме клеток с мини
ляется следствием неизбежных и необратимых
мальным обновлением или вообще без него.
повреждений и представляет собой обратимое и
При этом лишь в некоторых типах клеток сни
изменяемое эпигенетическое состояние; 2) яв
жение длины теломер можно было назвать кри
БИОХИМИЯ том 86 вып. 12 2021
СУБТЕЛОМЕРНО ТЕЛОМЕРНАЯ ТЕОРИЯ СТАРЕНИЯ
1777
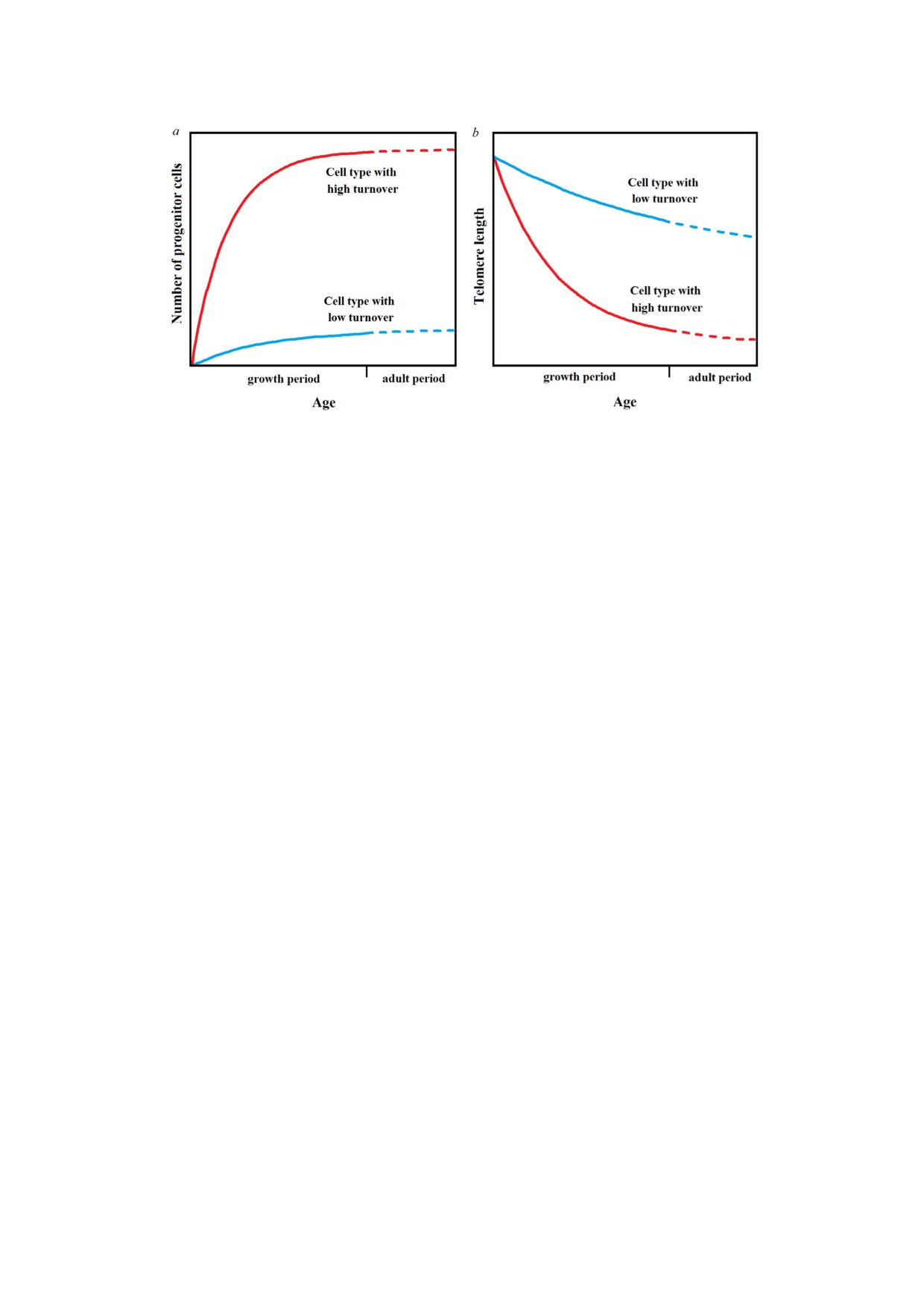
Рис. 3. a -Предшественники клеток с высокой скоростью обновления (например, гемопоэтические клетки) в период рос
та демонстрируют активную экспансию, в то время как предшественники клеток с медленным обновлением (напри
мер, клетки скелетных мышц) демонстрируют скромный прирост. b - В период роста укорочение теломер пропорцио
нально величине экспансии, в то время как в последующие периоды жизни скорость укорочения теломер обоих типов
клеток становится равной (на основе рис. 4 из работы [101])
тичным (например, в клетках печени скорость
снижалась как функция степени экспансии, в
укорочения составила 120 п.о./год; длина тело
то время как на более поздних - укорочение те
меры 1,7 ± 2,5 тыс. п.о. у новорожденных и
ломер происходило с постоянной скоростью
8,7 ± 1,4 - у долгожителей) [100]. Кроме того,
[101] (рис. 3).
помимо клеток с незначительным снижением
Давайте теперь посмотрим, как эти данные
длины теломеры (кора головного мозга и сер
могут объяснить старение организма в контекс
дечная мышца), годовая скорость укорочения
те субтеломерно теломерной теории:
теломер была значительно ниже и демонстри
i) укорочение теломеры приводит к общему
ровала значения в диапазоне 20-60 п.о. в
снижению функционирования клетки (посте
год [100]). Данные, объясняющие (приблизи
пенное клеточное старение). В частности, для
тельную) однородность процесса старения все
МСК, помимо того, что их экспансия ограниче
го организма, также отсутствуют. Более того,
на числом возможных дупликаций относитель
механизм старения долгоживущих клеток также
но числа предыдущих дупликаций, она также
требует объяснения.
инициирует постепенные эпигенетические из
При изучении четырех типов клеток/тканей
менения [55];
с сильно различающимися скоростями обновле
ii) учитывая полную или частичную неактив
ния клеток (лейкоциты, скелетные мышцы,
ность теломеразы в клетках предшественниках,
подкожный жир и кожа) выяснилось, что ско
стволовых и соматических клетках, всегда есть
рости укорочения теломер сходны друг с дру
вероятность их перехода в состояние клеточной
гом [101].
сенесцентности, т.е. блокировке репликативной
В той же работе было показано, что несмот
способности [11]. Этот процесс постепенно
ря на то что длины теломер в различных органах
снижает потенциал клеток к обновлению, в
плода человека сходны [102], длина теломеры в
частности, за счет снижения числа стволовых
гемопоэтических стволовых клетках была коро
клеток предшественников;
че, чем в клетках соматических тканей с низким
iii) в тканях/органах увеличивающееся число
уровнем обновления. Исходя из этого, авторы
клеток, находящихся в состоянии клеточной се
сделали вывод, что стволовые клетки предше
несцентности, и их аномальный секреторный
ственники различных типов клеток в период
фенотип (SASP) снижают общее функциональ
роста пролиферируют соответственно ритмам
ное состояние. Действительно, избирательная
клеточного обновления (например, активное
элиминация сенесцентных клеток является ра
размножение клеток с высокой скоростью об
зумным и реалистичным средством снижения
новления, таких как гемопоэтические, и значи
некоторых проявлений процесса старения [1];
тельно менее активное - у клеток с медленным
iv) в случае многолетних или не обновляю
обновлением, как в случае скелетных мышц). В
щихся клеток и структур (включая большинство
фазе активного размножения длина теломер
нейронов центральной нервной системы, фото
БИОХИМИЯ том 86 вып. 12 2021
1778
LIBERTINI и др.
рецепторные клетки сетчатки и волокна хруста
средована эпигенетическими модификация
лика глаза) влияние ассоциированных со старе
ми [104].
нием явлений (обсуждались в предыдущих
Следовательно, можно считать общим пра
пунктах) на незаменимые обновляющиеся са
вилом, что клеточные функции как для одиноч
теллитные или трофические клетки (глиоциты
ной клетки любого одноклеточного или многок
различных типов, пигментные клетки сетчатки,
леточного организма, так и в целом для многок
клетки эпителия хрусталика) определяет их ста
леточных организмов, касающиеся развития и
рение [27].
организации индивида, являются эпигенетичес
Эти явления приводят к состоянию, опреде
кими явлениями.
ляемому как «атрофический синдром», что яв
Из этого следует, что если в основе процесса
ляется полностью совместимым с субтеломер
старения лежат конкретные механизмы, то они
но теломерной теорией и представляет собой
будут эпигенетическими, что согласуется с ре
результат старения организма [3, 103].
зультатами экспериментальных исследований и
положениями субтеломерно теломерной теории.
Помимо этого общего соображения, субте
ВЫВОДЫ
ломерно теломерная теория находит значитель
ное число подтверждений, а факты, несовмес
«Проекты Human Genome и ENCODE пока
тимые с ее положениями, отсутствуют.
зали, что белок кодирующий потенциал генома
Следует подчеркнуть, что для любой теории в
млекопитающих чрезвычайно ограничен… Хотя
контексте парадигмы программированного или
лишь 2% генома приходится на кодирующую
адаптивного старения, необходимо существова
часть, в итоге транскрибируется более > 90% ге
ние генетически детерминированных и регулиру
нома. Эта транскрипционная активность в ос
емых механизмов, которые определяют различ
новном приводит к образованию длинных неко
ные характеристики процесса старения. Механиз
дирующих РНК (lncRNA - long noncoding
мы, предложенные согласно субтеломерно тело
RNAs), чьи функции по большей части остают
мерной теории, по видимому, удовлетворяют этой
ся неизвестными» [20].
потребности и соответствуют имеющимся данным.
У сильно отличающихся друг от друга видов
Напротив, для любой теории, принадлежа
число белок кодирующих генов тем не менее
щей к противоположной парадигме непрограм
сходно. «Научное сообщество было удивлено
мированного или неадаптированного старения,
тому, что количество генов человека равно ко
существование таких механизмов доказывает ее
личеству генов у довольно простого организ
необоснованность при условии, что не будут
ма - нематоды» [104]. Таким образом, огром
найдены альтернативные объяснения с точки
ные различия между видами, предположитель
зрения эволюции.
но, в большей мере зависят от не кодирующих
белки последовательностей. Транскрипция
большой части генома, которая не кодирует
Конфликт интересов. Авторы заявляют об от
белки, в основном приводит к формированию
сутствии конфликта интересов.
регуляторных элементов для других участков
Соблюдение этических норм. В работе не со
генома, например, для других сегментов с регу
держатся результаты каких либо работ с участи
ляторными функциями и белок кодирующих
ем людей или животных, выполненные кем ли
участков, и эта регуляция в основном опо
бо из авторов статьи.
СПИСОК ЛИТЕРАТУРЫ
1.
Libertini, G., Ferrara, N., Rengo, G., and Corbi, G. (2018)
systems: biochemical evidence in support of Weismann’s
Elimination of senescent cells: prospects according to the
hypothesis, Biochemistry (Moscow), 62, 1191 1195.
subtelomere-telomere theory, Biochemistry (Moscow), 83,
5.
Libertini, G. (2012) Classification of phenoptotic phe
1477 1488, doi: 10.1134/S0006297918120064.
nomena, Biochem (Moscow), 77, 707 715, doi: 10.1134/
2.
Libertini, G., Corbi, G., and Ferrara, N. (2020) Impor
S0006297912070024.
tance and meaning of TERRA sequences for aging mecha
6.
Slijepcevic, P., and Hande, M. P. (1999) Chinese hamster
nisms, Biochemistry (Moscow), 85, 1505 1517, doi: 10.1134/
telomeres are comparable in size to mouse telomeres,
S0006297920120044.
Cytogenet. Cell Genet.,
85,
196199, doi:
10.1159/
3.
Libertini, G., Corbi, G., Conti, V., Shubernetskaya, O.,
000015292.
and Ferrara, N. (2021) Evolutionary Gerontology and geri
7.
Gorbunova, V., Bozzella, M. J., and Seluanov, A. (2008)
atrics - why and how we age, Advances in Studies of Aging
Rodents for comparative aging studies: from mice to
and Health, 2, Switzerland, Springer, doi: 10.1007/978 3
beavers, Age (Dordr.), 30, 111 119, doi: 10.1007/s11357
030 73774 0.
008 9053 4.
4.
Skulachev, V. P. (1997) Aging is a specific biological func
8.
Kubota, C., Yamakuchi, H., Todoroki, J., Mizoshita, K.,
tion rather than the result of a disorder in complex living
Tabara, N., et al. (2000) Six cloned calves produced from
БИОХИМИЯ том 86 вып. 12 2021
СУБТЕЛОМЕРНО ТЕЛОМЕРНАЯ ТЕОРИЯ СТАРЕНИЯ
1779
adult fibroblast cells after long term culture, Proc. Natl.
paradigm, Age (Dordr.), 38, 35, doi: 10.1007/s11357 016
Acad. Sci. USA, 97, 990995, doi: 10.1073/pnas.97.
9895 0.
3.990.
28.
Horvath, S. (2013) DNA methylation age of human tissues
9.
Lanza, R. P., Cibelli, J. B., Faber, D., Sweeney, R. W.,
and cell types, Gen. Biol., 14, R115, doi: 10.1186/gb 2013
Henderson, B., et al. (2001) Cloned cattle can be healthy
14 10 r115.
and normal, Science, 294, 1893 1894, doi: 10.1126/science.
29.
Mammalian Methylation Consortium (2021) Universal
1063440.
DNA methylation age across mammalian tissues, bioRxiv,
10.
Fossel, M. B. (2004) Cells, aging and Human Disease,
doi: 10.1101/2021.01.18.426733.
Oxford University Press, New York.
30.
Bernstein, B. E., Stamatoyannopoulos, J. A., Costello,
11.
Blackburn, E. H. (2000) Telomere states and cell fates,
J. F., Ren, B., Milosavljevic, A., et al. (2010) The NIH
Nature, 408, 53 56, doi: 10.1038/35040500.
roadmap epigenomics mapping consortium, Nat.
12.
Pontèn, J., Stein, W. D., and Shall, S. (1983) A quantita
Biotechnol., 28, 1045 1048, doi: 10.1038/nbt1010 1045.
tive analysis of the aging of human glial cells in culture,
31.
Illingworth, R., Kerr, A., Desousa, D., Jørgensen, H.,
J. Cell Phys., 117, 342 352, doi: 10.1002/jcp.1041170309.
Ellis, P., et al. (2008) A novel CpG island set identifies tis
13.
Jones, R. B., Whitney, R. G., and Smith, J. R. (1985)
sue specific methylation at developmental gene loci, PLoS
Intramitotic variation in proliferative potential: stochastic
Biol., 6, e22, doi: 10.1371/journal.pbio.0060022.
events in cellular aging, Mech. Ageing Dev., 29, 143 149,
32.
Christensen, B. C., Houseman, E. A., Marsit, C. J.,
doi: 10.1016/0047 6374(85)90014 4.
Zheng, S., Wrensch, M. R., et al. (2009) Aging and envi
14.
Londoño Vallejo, J. A., DerSarkissian, H., Cazes, L., and
ronmental exposures alter tissue specific DNA methylation
Thomas, G. (2001) Differences in telomere length between
dependent upon CpG island context, PLoS Genet., 5,
homologous chromosomes in humans, Nucleic Acids Res.,
e1000602, doi: 10.1371/journal.pgen.1000602.
29, 3164 3171, doi: 10.1093/nar/29.15.3164.
33.
Thompson, R. F., Atzmon, G., Gheorghe, C., Liang,
15.
Graakjaer, J., Bischoff, C., Korsholm, L., Holstebroe, S.,
H. Q., Lowes, C., et al. (2010) Tissue specific dysregula
Vach, W., et al. (2003) The pattern of chromosome specif
tion of DNA methylation in aging, Aging Cell, 9, 506 518,
ic variations in telomere length in humans is determined by
doi: 10.1111/j.1474 9726.2010.00577.x.
inherited, telomere near factors and is maintained
34.
Bollati, V., Schwartz, J., Wright, R., Litonjua, A.,
throughout life, Mech. Aging Dev.,
124,
629640,
Tarantini, L., et al. (2009) Decline in genomic DNA methy
doi: 10.1016/s0047 6374(03)00081 2.
lation through aging in a cohort of elderly subjects, Mech.
16.
Hjelmborg, J. B., Dalgård, C., Möller, S., Steenstrup, T.,
Ageing Dev., 130, 234 239, doi: 10.1016/j.mad.2008.12.003.
Kimura, M., et al. (2015) The heritability of leucocyte
35.
Bell, J. T., Tsai, P. C., Yang, T. P., Pidsley, R., Nisbet, J.,
telomere length dynamics, J. Med. Genet., 52, 297 302,
et al. (2012) Epigenome wide scans identify differentially
doi: 10.1136/jmedgenet 2014 102736.
methylated regions for age and age related phenotypes in a
17.
Brown, W. R., MacKinnon, P. J., Villasanté, A., Spurr, N.,
healthy ageing population, PLoS Genet., 8, e1002629,
Buckle, V. J., and Dobson, M. J. (1990) Structure and
doi: 10.1371/journal.pgen.1002629.
polymorphism of human telomere associated DNA, Cell,
36.
Horvath, S., Zhang, Y., Langfelder, P., Kahn, R.,
63, 119 132, doi: 10.1016/0092 8674(90)90293 n.
Boks, M., et al. (2012) Aging effects on DNA methylation
18.
Nergadze, S. G., Farnung, B. O., Wischnewski, H.,
modules in human brain and blood tissue, Genome Biol.,
Khoriauli, L., Vitelli, V., et al. (2009) CpG island promot
13, R97, doi: 10.1186/gb 2012 13 10 r97.
ers drive transcription of human telomeres, RNA, 15, 2186
37.
Rakyan, V. K., Down, T. A., Maslau, S., Andrew, T., Yang,
2194, doi: 10.1261/rna.1748309.
T. P., et al. (2010) Human aging associated DNA hyper
19.
Diman, A., and Decottignies, A. (2018) Genomic origin
methylation occurs preferentially at bivalent chromatin
and nuclear localization of TERRA telomeric repeat con
domains, Genome Res.,
20,
434439, doi:
10.1101/
taining RNA: from Darkness to Dawn, FEBS J., 285,
gr.103101.109.
1389 1398, doi: 10.1111/febs.14363.
38.
Teschendorff, A. E., Menon, U., Gentry Maharaj, A.,
20.
Chu, H. P., Cifuentes Rojas, C., Kesner, B., Aeby, E.,
Ramus, S. J., Weisenberger, D. J., et al. (2010) Age depen
Lee, H. G., et al. (2017) TERRA RNA antagonizes ATRX
dent DNA methylation of genes that are suppressed in stem
and protects telomeres, Cell, 170, 86 101, doi: 10.1016/
cells is a hallmark of cancer, Genome Res., 20, 440 446,
j.cell.2017.06.017.
doi: 10.1101/gr.103606.109.
21.
Chu, H. P., Froberg, J. E., Kesner, B., Oh, H. J., Ji, F.,
39.
Hernandez, D. G., Nalls, M. A., Gibbs, J. R., Arepalli, S.,
et al. (2017) PAR TERRA directs homologous sex chro
van der Brug, M., et al. (2011) Distinct DNA methylation
mosome pairing, Nat. Struct. Mol. Biol., 24, 620 631,
changes highly correlated with chronological age in the
doi: 10.1038/nsmb.3432.
human brain, Hum. Mol. Genet.,
20,
11641172,
22.
Ben Porath, I., and Weinberg, R. (2005) The signals
doi: 10.1093/hmg/ddq561.
and pathways activating cellular senescence, Int. J.
40.
Koch, C. M., and Wagner, W. (2011) Epigenetic aging sig
Biochem. Cell Biol., 37, 961 976, doi: 10.1016/j.biocel.
nature to determine age in different tissues, Aging (Albany
2004.10.013.
NY), 10, 1018 1027, doi: 10.18632/aging.100395.
23.
Coppé, J. P., Patil, C. K., Rodier, F., Sun, Y., Muñoz,
41.
Bocklandt, S., Lin, W., Sehl, M. E., Sánchez, F. J.,
D. P., et al. (2008) Senescence associated secretory pheno
Sinsheimer, J. S., et al. (2011) Epigenetic predictor of age,
types reveal cell nonautonomous functions of oncogenic
PLoS One, 6, e14821, doi: 10.1371/journal.pone.0014821.
Russian Academy of Sciences and the p53 tumor suppres
42.
Booth, L. N., and Brunet, A. (2016) The aging epigenome,
sor, PLoS Biol., 6, 2853 2868, doi: 10.1371/journal.pbio.
Mol. Cell, 62, 728 744, doi: 10.1016/j.molcel.2016.05.013.
0060301.
43.
Kane, A. E., and Sinclair, D. A. (2019) Epigenetic changes
24.
Cristofalo, V. J., and Pignolo, R. J. (1993) Replicative
during aging and their reprogramming potential, Crit. Rev.
senescence of human fibroblast like cells in culture,
Biochem. Mol. Biol., 54, 61 83, doi: 10.1080/10409238.
Physiol. Rev., 73, 617 638, doi: 10.1152/physrev.1993.73.3.
2019.1570075.
617.
44.
Greer, E. L., and Shi, Y. (2012) Histone methylation: a
25.
Wang, E. (1995) Senescent human fibroblasts resist pro
dynamic mark in health, disease and inheritance, Nat. Rev.
grammed cell death, and failure to suppress bcl2 is
Genet., 13, 343 357, doi: 10.1038/nrg31730.
involved, Cancer Res., 55, 2284 2292.
45.
McCauley, B. S., and Dang, W. (2014) Histone methyla
26.
Kirkland, J. L., and Tchkonia, T. (2017) Cellular senes
tion and aging: lessons learned from model systems,
cence: a translational perspective, EBioMedicine, 21, 21
Biochim. Biophys. Acta, 1839, 1454 1462, doi: 10.1016/
28, doi: 10.1016/j.ebiom.2017.04.013.
j.bbagrm.2014.05.008.
27.
Libertini, G., and Ferrara, N. (2016) Aging of perennial
46.
Pal, S., and Tyler, J. K. (2016) Epigenetics and aging, Sci.
cells and organ parts according to the programmed aging
Adv., 2, e1600584, doi: 10.1126/sciadv.1600584.
БИОХИМИЯ том 86 вып. 12 2021
1780
LIBERTINI и др.
47.
Ashapkin, V. V., Kutueva, L. I., and Vanyushin, B. F. (2017)
idant defense of mitochondria, Biochemistry (Moscow), 74,
Aging as an epigenetic phenomenon, Curr. Genomics, 18,
1400 1403, doi: 10.1134/s0006297909120165.
385 407, doi: 10.2174/1389202918666170412112130.
67.
Bohr, V. A., and Anson, R. M. (1995) DNA damage, muta
48.
Bird, A. (2002) DNA methylation patterns and epigenetic
tion and fine structure DNA repair in aging, Mutat. Res.,
memory, Genes Dev., 16, 6 21, doi: 10.1101/gad.947102.
338, 25 34, doi: 10.1016/0921 8734(95)00008 t.
49.
Stein, R., Razin, A., and Cedar, H. (1982) In vitro methy
68.
Weinert, B. T., and Timiras, P. S. (2003) Invited review:
lation of the hamster adenine phosphoribosyltransferase
theories of aging, J. Appl. Physiol., 95, 17061716,
gene inhibits its expression in mouse L cells, Proc. Natl.
doi: 10.1152/japplphysiol.00288.2003.
Acad. Sci. USA, 79, 3418 3422, doi: 10.1073/pnas.79.11.
69.
Franceschi, C., Bonafè, M., Valensin, S., Olivieri, F., De
3418.
Luca, M., et al. (2000) Inflamm aging. An evolutionary
50.
Hansen, R. S., and Gartler, S. M. (1990) 5 Azacytidine
perspective on immunosenescence, Ann. NY Acad. Sci.,
induced reactivation of the human X chromosome linked
908, 244 254, doi: 10.1111/j.1749 6632.2000.tb06651.x.
PGK1 gene is associated with a large region of cytosine
70.
Fülöp, T. (2017) Immunosenescence and inflammaging:
demethylation in the 5′ CpG island, Proc. Natl. Acad. Sci.
an intricate connection, Innov. Aging, 1 (Suppl 1), 961,
USA, 87, 4174 4178, doi: 10.1073/pnas.87.11.4174.
doi: 10.1093/geroni/igx004.3465.
51.
Benetti, R., Garcнa Cao, M., and Blasco, M. A. (2007)
71.
Libertini, G. (2015) Non programmed versus programmed
Telomere length regulates the epigenetic status of mam
aging paradigm, Curr. Aging Sci., 8, 56 68, doi: 10.2174/
malian telomeres and subtelomeres, Nat. Genet., 39, 243
1874609808666150422111623.
250, doi: 10.1038/ng1952.
72.
Wilmut, I., Schnieke, A. E., McWhir, J., Kind, A. J., and
52.
Maeda, T., Guan, J. Z., Higuchi, Y., Oyama, J., and
Campbell, K. H. (1997) Viable offspring derived from fetal
Makino, N. (2009) Aging related alterations of subtelom
and adult mammalian cells, Nature, 385, 810813,
eric methylation in sarcoidosis patients, J. Gerontol. A Biol.
doi: 10.1038/385810a0.
Sci. Med. Sci., 64, 752 760, doi: 10.1093/gerona/glp049.
73.
Cowan, C. A., Atienza, J., Melton, D. A., and Eggan, K.
53.
Blasco, M. A. (2007) The epigenetic regulation of mam
(2005) Nuclear reprogramming of somatic cells after fusion
malian telomeres, Nat. Rev. Genet.,
8,
299309,
with human embryonic stem cells, Science, 309, 1369
doi: 10.1038/nrg2047.
1373, doi: 10.1126/science.1116447.
54.
Buxton, J. L., Suderman, M., Pappas, J. J., Borghol, N.,
74.
Takahashi, K., and Yamanaka, S. (2006) Induction of
McArdle, W., et al. (2014) Human leukocyte telomere
pluripotent stem cells from mouse embryonic and adult
length is associated with DNA methylation levels in multi
fibroblast cultures by defined factors, Cell, 126, 663 676,
ple subtelomeric and imprinted loci, Sci. Rep., 4, 4954,
doi: 10.1016/j.cell.2006.07.024.
doi: 10.1038/srep04954.
75.
D’Autrйaux, B., and Toledano, M. B. (2007) ROS as sig
55.
Schellenberg, A., Lin, Q., Schüler, H., Koch, C. M.,
nalling molecules: mechanisms that generate specificity in
Joussen, S., et al. (2011) Replicative senescence of
ROS homeostasis, Nat. Rev. Mol. Cell Biol., 8, 813 824,
mesenchymal stem cells causes DNA methylation changes
doi: 10.1038/nrm2256.
which correlate with repressive histone marks, Aging
76.
Schieber, M., and Chandel, N. S. (2014) ROS function in
(Albany NY), 3, 873 888, doi: 10.18632/aging.100391.
redox signaling and oxidative stress, Curr. Biol., 24, R453
56.
Zhou, X., Hong, Y., Zhang, H., and Li, X. (2020)
462, doi: 10.1016/j.cub.2014.03.034.
Mesenchymal stem cell senescence and rejuvenation: cur
77.
Bettin, N., Oss Pegorar, C., and Cusanelli, E. (2019) The
rent status and challenges, Front. Cell. Dev. Biol., 8, 364,
emerging roles of TERRA in telomere maintenance and
doi: 10.3389/fcell.2020.00364.
genome stability, Cells, 8, 246, doi: 10.3390/cells8030246.
57.
Harman, D. (1956) Aging: a theory based on free radical
78.
Montero, J. J., Lopez de Silanes, I., Grana, O., and
and radiation chemistry, J. Gerontol.,
11,
298300,
Blasco, M. A. (2016) Telomeric RNAs are essential to
doi: 10.1093/geronj/11.3.298.
maintain telomeres, Nat. Commun., 7, 12534, doi: 10.1038/
58.
Höhn, A., Weber, D., Jung, T., Ott, C., Hugo, M., et al.
ncomms12534.
(2017) Happily (n)ever after: Aging in the context of oxida
79.
Libertini, G., and Ferrara, N. (2016) Possible interventions
tive stress, proteostasis loss and cellular senescence, Redox
to modify aging, Biochemistry (Moscow), 81, 1413 1428,
Biol., 11, 482 501, doi: 10.1016/j.redox.2016.12.001.
doi: 10.1134/S0006297916120038.
59.
Liguori, I., Russo, G., Curcio, F., Bulli, G., Aran, L., et al.
80.
Stewart, J. A., Chaiken, M. F., Wang, F., and Price, C. M.
(2018) Oxidative stress, aging, and diseases, Clin. Interv.
(2012) Maintaining the end: roles of telomere proteins in
Aging, 13, 757 772, doi: 10.2147/CIA.S158513.
end protection, telomere replication and length regula
60.
Reeg, S., and Grune, T. (2015) Protein oxidation in aging:
tion, Mutat. Res., 730, 12 19, doi: 10.1016/j.mrfmmm.
does it play a role in aging progression? Antioxid. Redox
2011.08.011.
Signal., 23, 239 255, doi: 10.1089/ars.2014.6062.
81.
Jones, M., Bisht, K., Savage, S. A., Nandakumar, J.,
61.
Barnes, R. P., Fouquerel, E., and Opresko, P. L. (2019)
Keegan, C. E., and Maillard, I. (2016) The shelterin com
The impact of oxidative DNA damage and stress on telom
plex and hematopoiesis, J. Clin. Invest., 126, 1621 1629,
ere homeostasis, Mech. Ageing Dev.,
177,
3745,
doi: 10.1172/JCI84547.
doi: 10.1016/j.mad.2018.03.013.
82.
Takai, K. K., Hooper, S., Blackwood, S., Gandhi, R., and
62.
Zuo, L., Prather, E. R., Stetskiv, M., Garrison, D. E.,
de Lange, T. (2010) In vivo stoichiometry of shelterin com
Meade, J. R., et al. (2019) Inflammaging and oxidative
ponents, J. Biol. Chem., 285, 1457 1467, doi: 10.1074/
stress in human diseases: from molecular mechanisms to
jbc.M109.038026.
novel treatments, Int. J. Mol. Sci., 20, 4472, doi: 10.3390/
83.
Li, J. S. Z., Fusté, J. M., Simavorian, T., Bartocci, C.,
ijms20184472.
Tsai, J., et al. (2017) TZAP: A telomere associated protein
63.
Beckman, K. B., and Ames, B. N. (1998) The free radical
involved in telomere length control, Science, 355, 638 641,
theory of aging matures, Physiol. Rev., 78, 547581,
doi: 10.1126/science.aah6752.
doi: 10.1152/physrev.1998.78.2.547.
84.
De Lange, T. (2005) Shelterin: the protein complex that
64.
Oliveira, B. F., Nogueira Machado, J. A., and Chaves,
shapes and safeguards human telomeres, Genes Dev., 19,
M. M. (2010) The role of oxidative stress in the aging process,
2100 2110, doi: 10.1101/gad.1346005.
ScientificWorldJournal,
10,
1121 1128, doi:
10.1100/
85.
Aksenova, A. Y., and Mirkin, S. M. (2019) At the beginning
tsw.2010.94.
of the end and in the middle of the beginning: structure and
65.
Sanz, A., and Stefanatos, R. K. (2008) The mitochondrial
maintenance of telomeric DNA repeats and interstitial
free radical theory of aging: a critical view, Curr. Aging Sci.,
telomeric sequences, Genes, 10, 118, doi: 10.3390/
1, 10 21, doi: 10.2174/1874609810801010010.
genes10020118.
66.
Skulachev, V. P. (2009) New data on biochemical mecha
86.
Simonet, T., Zaragosi, L. E., Philippe, C., Lebrigand, K.,
nism of programmed senescence of organisms and antiox
Schouteden, C., et al. (2011) The human TTAGGG repeat
БИОХИМИЯ том 86 вып. 12 2021
СУБТЕЛОМЕРНО ТЕЛОМЕРНАЯ ТЕОРИЯ СТАРЕНИЯ
1781
factors 1 and 2 bind to a subset of interstitial telomeric
mesenchymal stromal cells, Stem Cell Rep., 14, 201 209,
sequences and satellite repeats, Cell Res., 21, 1028 1038,
doi: 10.1016/j.stemcr.2019.12.012.
doi: 10.1038/cr.2011.40.
96. Wagner, W., Horn, P., Castoldi, M., Diehlmann, A.,
87.
Kwon, S. M., Hong, S. M., Lee, Y. K., Min, S., and
Bork, S., et al. (2008) Replicative senescence of mesenchy
Yoon, G. (2019) Metabolic features and regulation in cell
mal stem cells: a continuous and organized process, PLoS
senescence, BMB Rep., 52, 5 12, doi: 10.5483/BMBRep.
One, 3, e2213, doi: 10.1371/journal.pone.0002213.
2019.52.1.291.
97. Spitzhorn, L. S. (2019) Human iPSC derived MSCs
88.
D’Mello, N. P., and Jazwinski, S. M. (1991) Telomere
(iMSCs) from aged individuals acquire a rejuvenation sig
length constancy during aging of Saccharomyces cerevisiae,
nature, Stem Cell Res. Ther., 10, 100, doi: 10.1186/s13287
J. Bacteriol., 173, 6709 6713, doi: 10.1128/jb.173.21.6709
019 1209 x.
6713.1991.
98. Hynes, K. (2013) Mesenchymal stem cells from iPS cells
89.
Laun, P., Pichova, A., Madeo, F., Fuchs, J., Ellinger, A.,
facilitate periodontal regeneration, J. Dent. Res., 92, 833
et al. (2001) Aged mother cells of Saccharomyces cerevisiae
839, doi: 10.1177/0022034513498258.
show markers of oxidative stress and apoptosis,
99. Robin, J. D., Ludlow, A. T., Batten, K., Magdinier, F.,
Mol. Microbiol., 39, 11661173, doi: 10.1111/j.1365
Stadler, G., et al. (2014) Telomere position effect: regula
2958.2001.02317.x.
tion of gene expression with progressive telomere shorten
90.
Herker, E., Jungwirth, H., Lehmann, K. A., Maldener, C.,
ing over long distances, Genes Dev., 28, 24642476,
Fröhlich, K. U., et al. (2004) Chronological aging leads to
doi: 10.1101/gad.251041.114.
apoptosis in yeast, J. Cell Biol.,
164,
501507,
100. Takubo, K., Aida, J., Izumiyama Shimomura, N.,
doi: 10.1083/jcb.200310014.
Ishikawa, N., Sawabe, M., et al. (2010) Changes of telom
91.
Lesur, I., and Campbell, J. L. (2004) The transcriptome of
ere length with aging, Geriatr. Gerontol. Int., 10, S197
prematurely aging yeast cells is similar to that of telom
S206, doi: 10.1111/j.1447 0594.2010.00605.x.
erase deficient cells, MBC Online,
15,
12971312,
101. Daniali, L., Benetos, A., Susser, E., Kark, J. D., Labat, C.,
doi: 10.1091/mbc.e03 10 0742.
et al. (2013) Telomeres shorten at equivalent rates in
92.
Libertini, G. (2009) The role of telomere telomerase system
somatic tissues of adults, Nat. Commun.,
4,
1597,
in age related fitness decline, a tameable process, in Telo
doi: 10.1038/ncomms2602.
meres: Function, Shortening and Lengthening (Mancini, L.,
102. Okuda, K., Bardeguez, A., Gardner, J. P., Rodriguez, P.,
ed.) Nova Science Publ., New York, pp. 77 132.
Ganesh, V., et al. (2002) Telomere length in the newborn,
93.
Koch, C. M. (2012) Monitoring of cellular senescence by
Pediatr. Res.,
52,
377381, doi:
10.1203/00006450
DNA methylation at specific CpG sites, Aging Cell, 11,
200209000 00012.
366 369, doi: 10.1111/j.1474 9726.2011.00784.x.
103. Libertini, G. (2014) Programmed aging paradigm: how we
94.
Schellenberg, A. (2014) Proof of principle: quality control
get old, Biochemistry (Moscow),
79,
10041016,
of therapeutic cell preparations using senescence associat
doi: 10.1134/S0006297914100034.
ed DNA methylation changes, BMC Res. Notes, 7, 254,
104. Moraes, F., and Góes, A. (2016) A decade of human
doi: 10.1186/1756 0500 7 254.
genome project conclusion: Scientific diffusion about our
95.
Fernandez Rebollo, E. (2020) Senescence associated
genome knowledge, Biochem. Mol. Biol. Educ., 44, 215
metabolomic phenotype in primary and iPSC derived
223, doi: 10.1002/bmb.20952.
IS EVIDENCE SUPPORTING THE SUBTELOMERE TELOMERE
THEORY OF AGING?
Review
Giacinto Libertini1,2*, Olga Shubernetskaya3, Graziamaria Corbi4,5, and Nicola Ferrara2,6
1 Member of the Italian Society for Evolutionary Biology (SIBE), 14100 Asti, Italy;
E mail: giacinto.libertini@yahoo.com
2 Department of Translational Medical Sciences, Federico II University of Naples, 80131 Naples, Italy
3 Shemyakin-Ovchinnikov Institute of Bioorganic Chemistry, 117997 Moscow, Russia
4 Department of Medicine and Health Sciences, University of Molise, 86100 Campobasso, Italy
5 Italian Society of Gerontology and Geriatrics (SIGG), 50129 Firenze, Italy
6 Istituti Clinici Scientifici Maugeri SPA - Società Benefit, IRCCS, 82037 Telese Terme (BN), Italy
The telomere theory tries to explain cellular mechanisms of aging as mainly caused by telomere shortening at each
duplication. The subtelomere-telomere theory overcomes various shortcomings of telomere theory by highlighting
the essential role of subtelomeric DNA in aging mechanisms. The present work illustrates and deepens the corre
spondence between assumptions and implications of subtelomere-telomere theory and experimental results. In par
ticular, it is investigated the evidence regarding the relationships between aging and (i) epigenetic modifications;
(ii) oxidation and inflammation; (iii) telomere protection; (iv) telomeric heterochromatin hood; (v) gradual cell
senescence; (vi) cell senescence; and (vii) organism decline with telomere shortening. The evidence appears broadly
in accordance or at least compatible with the description and implications of the subtelomere-telomere theory. In
short, phenomena of cellular aging, by which the senescence of the whole organism is determined in various ways,
appear substantially dependent on epigenetic modifications regulated by the subtelomere-telomere-telomeric
hood-telomerase system. These phenomena appear to be not random, inevitable, and irreversible but rather induced
and regulated by genetically determined mechanisms, and modifiable and reversible by appropriate methods. All this
supports the thesis that aging is a genetically programmed and regulated phenoptotic phenomenon and is against the
opposite thesis of aging as caused by random and inevitable degenerative factors.
Keywords: aging, phenoptosis, telomere, subtelomere, epigenetic changes, gradual cell senescence, cell senescence,
telomeric heterochromatin hood
БИОХИМИЯ том 86 вып. 12 2021