БИОХИМИЯ, 2021, том 86, вып. 12, с. 1840 - 1852
УДК 577.152.193;616.379 008.64
РОЛЬ СИСТЕМЫ ВРОЖДЁННОГО ИММУНИТЕТА
И ОКИСЛИТЕЛЬНОГО СТРЕССА В РАЗВИТИИ САХАРНОГО
ДИАБЕТА 1 ТИПА. ПЕРОКСИРЕДОКСИН 6 КАК НОВЫЙ
АНТИДИАБЕТИЧЕСКИЙ ПРЕПАРАТ
Обзор
© 2021
Е.Г. Новосёлова*, О.В. Глушкова, М.О. Хренов,
С.М. Лунин, Т.В. Новосёлова, С.Б. Парфенюк
Институт биофизики клетки РАН, 142290 Пущино, Московская обл., Россия;
электронная почта: elenanov_06@mail.ru
Поступила в редакцию 04.08.2021
После доработки 20.10.2021
Принята к публикации 03.11.2021
В обзоре обсуждаются сведения о развитии сахарного диабета 1 типа (Д1Т) как системного аутоиммунного
и воспалительного заболевания. Основное внимание уделено роли системы врождённого иммунитета,
включая активацию некоторых сигнальных каскадов, цитокиновый ответ и активность Toll подобных ре
цепторов в развитии Д1Т. Нарушение функций врождённого иммунитета является причиной атаки Т лим
фоцитов на бета клетки поджелудочной железы собственного организма и приводит к гибели этих, проду
цирующих инсулин, клеток. Недостаток инсулина вызывает гипергликемию и необходимость пожизнен
ных инъекций инсулина пациентам с Д1Т, что тем не менее не исключает повреждения многих органов и
тканей, учитывая особенную уязвимость кровеносных сосудов в условиях гипергликемии. В обзоре обсуж
дается роль окислительного стресса как фактора, играющего основную роль в повреждении сосудистой сис
темы и ткани поджелудочной железы при развитии Д1Т. С учётом особой уязвимости панкреатических
бета клеток к действию активных форм кислорода (АФК) обсуждается возможность использования анти
оксидантов для снижения уровня патологических последствий развития Д1Т. Обсуждаются новые сведения
об антидиабетической активности экзогенного фермента антиоксиданта, пероксиредоксина 6, способного
проникать в клетки, стимулировать продукцию инсулина в бета клетках, снижать уровень АФК, а также
снижать активацию некоторых сигнальных каскадов, продукцию цитокинов и экспрессию Toll подобных
рецепторов в бета клетках и в иммунных клетках в условиях Д1Т.
КЛЮЧЕВЫЕ СЛОВА: пероксиредоксин 6, гипергликемия, цитокины, бета клетки RIN m5F, продукция
инсулина, сигнальные каскады NF κB и JNK.
DOI: 10.31857/S0320972521120083
ВВЕДЕНИЕ. СТРУКТУРА ОБЗОРА
болеваемости во всем мире, что негативно влия
ет на качество жизни людей с Д1Т, увеличивая
Обзор посвящён анализу имеющихся сведе
инвалидность и смертность. В частности, ос
ний о закономерностях развития сахарного диа
ложнения Д1Т классифицируются как микросо
бета 1 го типа (Д1Т), который относится к тяжё
судистые (например, ретинопатия, нефропатия
лым социально значимым заболеваниям с еже
и невропатия) или макрососудистые (например,
годно увеличивающимся числом пациентов в
сердечно сосудистые заболевания, нарушения
мире. Известно, что осложнения, связанные с
мозгового кровообращения и заболевания пери
Д1Т, являются одной из причин повышения за
ферических сосудов).
Сахарный диабет 1 го типа является аутоим
Принятые сокращения: АФК - активные формы
мунным заболеванием, которое возникает из за
кислорода; Д1Т и Д2Т - диабет 1 и 2 типа; GPx - глута
деструкции инсулин продуцирующих панкреа
тионпероксидаза; IL - интерлейкин; JNK - c Jun N тер
тических бета клеток, которые атакуются ауто
минальная киназа; NF κB - ядерный фактор κВ; Prdx 6 - реактивными клонами Т лимфоцитов. Недоста
пероксиредоксин 6; PRR - паттерн распознающие ре
ток инсулина ведёт к гипергликемии, которая
цепторы; RIN m5F - линия клеток инсулиномы крыс;
STZ - стрептозотоцин; TLR - Toll подобные рецепторы;
вызывает, несмотря на ежедневные инъекции
TNF α - фактор некроза опухолей.
инсулина, многие осложнения, главным обра
* Адресат для корреспонденции.
зом на уровне сосудов ряда органов. Число ис
1840
PRDX6 СНИЖАЕТ УРОВЕНЬ АФК В БЕТА КЛЕТКАХ ПРИ Д1Т
1841
точников научной литературы, посвящённой ис
новые данные об антидиабетических эффектах
следованию закономерностей возникновения,
пероксиредоксина 6 (Prdx6) как малоизученного
развития и новых подходов к лечению Д1Т, сос
фермента антиоксиданта, перспективного при
тавляет более 100 тысяч (не считая чисто меди
разработке новых препаратов для профилактики
цинских работ), что означает серьёзное внима
и лечения сахарного диабета 1 типа.
ние исследователей к изучению закономернос
тей и последствий этого тяжёлого заболевания.
Учитывая многофакторность Д1Т и большое
ДИАБЕТ 1 ТИПА КАК АУТОИММУННОЕ
число работ, посвящённых его изучению, насто
СОСТОЯНИЕ
ящий обзор структурирован таким образом, что
бы акцентировать внимание на ключевых меха
Сахарный диабет 1 типа называют инсули
низмах развития Д1Т и обсудить современные
нозависимым диабетом, в отличие от диабета
подходы, предпринимаемые для снижения нега
2 типа (Д2Т). Хотя на Д1Т приходится не более
тивных последствий этого заболевания. В пер
5-10% всех случаев сахарного диабета, это забо
вом разделе «Диабет 1 типа как аутоиммунное
левание относится к разряду очень тяжёлых па
состояние» анализируются различные аспекты
тологий и развивается в основном у детей и лиц
развития Д1Т, сравниваются разные модели диа
юного возраста. У больных Д1Т масштабные из
бета у животных, разработанные для изучения
менения наступают быстро, что сопровождается
закономерностей возникновения и разви
резким ухудшением состояния здоровья. Редко
тия Д1Т, обсуждаются условия аутоиммунной
сахарный диабет 1 типа развивается у взрослых
«атаки» Т лимфоцитов на бета клетки поджелу
людей после сорока лет, у них болезнь протека
дочной железы собственного организма. На ос
ет скрыто.
новании этого анализа делается вывод о том, что
Сахарный диабет 1 го типа является аутоим
аутоиммунная реакция возникает из за дефек
мунным заболеванием, которое возникает из за
тов функционирования системы врождённого
разрушения инсулин продуцирующих бета
иммунитета. Следующий раздел обзора «Систе
клеток поджелудочной железы в результате ата
ма врождённого иммунитета и диабет 1 типа»
ки на них аутореактивных клонов цитотокси
посвящён анализу активности некоторых сиг
ческих Т лимфоцитов. Клинически это заболе
нальных каскадов (NF κB и JNK), роли цитоки
вание проявляется в том случае, когда гибнет
нов, а также участию Toll подобных рецепторов
большинство инсулин продуцирующих панкреа
(Toll like receptors, TLR) в ответах против
тических бета клеток через механизм активации
собственных антигенов при диабете 1 типа.
аутореактивных Т клеток. Массовая гибель
Следует отметить, что в результате аутоиммун
продуцирующих инсулин бета клеток, которую
ной реакции, сопровождающей развитие Д1Т,
вызывают мигрирующие в поджелудочную же
повреждаются бета клетки поджелудочной же
лезу собственные цитотоксические Т лимфоци
лезы, что является основным признаком разви
ты, приводит к накоплению глюкозы в крови,
тия сахарного диабета 1 типа. Раздел «Апоптоз
что вызывает необходимость регулярного по
бета клеток поджелудочной железы и диабет
жизненного применения инсулина больными с
1 типа» содержит анализ роли апоптоза панкреа
Д1Т. Даже при компенсаторном введении инсу
тических бета клеток как одного из стартовых
лина диабет первого типа вызывает ряд серьёз
событий в развитии Д1Т. Делается заключение,
ных поражений многих систем и органов, вклю
что одним из ключевых инструментов для разви
чая сердечно сосудистую систему [1], почки [2],
тия диабета 1 типа является окислительный
глаза [3] и др. Известно, что при диабете особен
стресс. Раздел «Окислительный стресс и диабет
но сильно повреждаются кровеносные сосуды,
1 типа» содержит анализ современных источни
поэтому среди больных Д1Т смертность от ин
ков литературы с доказательствами окислитель
сультов и инфарктов в 3 раза выше, чем у других
ного стресса при развитии Д1Т. Анализ сведений
категорий населения. Эпидемиологические ис
из мировой литературы показал, что всё больше
следования сахарного диабета регулярно прово
данных свидетельствуют о том, что образование
дятся Всемирной организацией здравоохране
АФК играет центральную роль как в поврежде
ния (ВОЗ) и Международной федерацией диа
нии сосудистой системы, так и ткани поджелу
бета (International Diabetes Federation, IDF).
дочной железы при развитии Д1Т. Следующий
В 1998 г. исследователи предсказывали, что чис
раздел обзора посвящён анализу подходов ис
ло заболевших диабетом 1 го и 2 го типа увели
пользования антиоксидантов для снижения па
чится с 135 млн в 1995 г. до 300 млн - к 2025 г. [4].
тологических последствий Д1Т. Наконец, в раз
В конце 2019 г. опубликованы данные исследо
деле «Защитные эффекты пероксиредоксина 6 в
ваний IDF, согласно которым в 2019 г. в мире
разных моделях диабета 1 типа» обсуждаются
453 млн человек болели сахарным Д1Т и Д2Т, а
БИОХИМИЯ том 86 вып. 12 2021
1842
НОВОСЁЛОВА и др.
по прогнозам, к 2045 г. эта цифра вырастет до
изучения молекулярно клеточных механизмов,
700 млн человек. Действительно, все исследова
участвующих в развитии этой патологии [10].
тели отмечают тенденцию ежегодного прироста
Диабет обычно вызывается у грызунов с исполь
случаев диагностированного диабета. При этом
зованием химических агентов: стрептозотоци
следует иметь в виду, что не все заболевания диа
на (streptozotocin, STZ) или аллоксана (alloxan)
бетом диагностируются. Например, в ходе ис
[11, 12], которые разрушают панкреатические
следования россиян в 2013-2015 гг., проведён
бета клетки, продуцирующие инсулин, и таким
ного ФГБУ ЭНЦ (Эндокринологический науч
образом вызывают развитие диабета 1 го типа.
ный центр МЗ РФ), выяснилось, что 50% боль
Самой известной животной моделью Д1Т явля
ных диабетом не знали о своём заболевании (ис
ются мыши линии NOD (Non Obese Diabetes
следовали 26 000 человек в возрасте от 20 до
mice). Использование NOD мышей обеспечило
79 лет из 63 регионов России).
значительный прогресс в понимании Д1Т у че
В настоящее время в мировой практике са
ловека, потому что эта модель «истинного» диа
мым распространённым методом лечения ауто
бета открыла перспективы для изучения кине
иммунного сахарного диабета является замести
тики и инициации диабета. У этих мышей диа
тельная инсулинотерапия. Тем не менее в мире
бет развивается спонтанно, при этом генетичес
проводятся исследования, направленные на по
кие и патологические последствия аналогичны
иск других подходов, способных уменьшить сте
таковым у человека [13]. Известно, что Д1Т у че
пень разрушения бета клеток поджелудочной
ловека часто является наследственным, что свя
железы или даже стимулировать их дифференци
зано с изменёнными генами, обеспечивающими
ровку. Кроме метода трансплантации островков
восприимчивость к Д1Т [14]. Генетический ло
Лангерганса, который способен возмещать поте
кус HLA, который определяет селекцию Т лим
рю массы бета клеток [5], ведётся поиск и дру
фоцитов в тимусе, наиболее вероятно, связан с
гих, неинвазивных методов, направленных на
развитием Д1Т [15]. Существуют и другие гены,
стимуляцию неогенеза этих инсулин продуциру
которые в меньшей степени могут ассоцииро
ющих клеток. Следует отметить, что для этой це
ваться с развитием Д1Т [16]. Тем не менее во
ли используются вещества растительного проис
многих странах число диагностируемых случаев
хождения, которые обладают антиоксидантной
Д1Т нарастает с большой скоростью, которую
активностью, например, свертизин (swertisin) [6].
нельзя объяснить только генетической предрас
В настоящее время в большинстве работ,
положенностью - это свидетельствует о важ
посвящённых исследованию патогенеза сахар
ности внешних факторов [17]. Действительно,
ного диабета 1 го типа, основное внимание нап
исследования однояйцевых близнецов с наслед
равлено на изучение панкреатических бета кле
ственным «семейным» Д1Т показали, что толь
ток, которые являются мишенями аутоиммун
ко примерно половина из них заболевает диабе
ной атаки. Между тем первопричиной заболева
том [18], что указывает на роль неблагоприят
ния, как правило, становятся нарушения в им
ных факторов окружающей среды для риска
мунной системе, которые приводят к возникно
развития Д1Т [19].
вению клонов Т лимфоцитов, атакующих пан
Механизм развития Д1Т у человека остаётся
креатические бета клетки собственного организ
во многом неясным. Можно выделить по край
ма. В течение последующих воспалительных ре
ней мере 3 очевидных стадии возникновения
акций провоспалительные цитокины, включая
Д1Т: активация аутореактивных клонов Т лим
IL 1β, TNF α и интерферон γ (IFN γ), высво
фоцитов, направленных на разрушение бета
бождаются в окружение бета клеток активиро
клеток поджелудочной железы, провоспали
ванными макрофагами и Т клетками, вызывая
тельный ответ организма и, наконец, наруше
дисфункцию и гибель инсулин продуцирующих
ние иммунной регуляции аутоиммунных отве
клеток [7]. Обычно провоспалительный ответ
тов. Следует отметить, что каждая из этих сос
защищает организм млекопитающих от чуже
тавляющих развития Д1Т изучена в разной сте
родных патогенов, он направлен на сохранение
пени, но очевидно, что именно возникновение
целостности тканей и клеточных систем. С дру
иммунного дисбаланса является определяющим
гой стороны, «дефектный» провоспалительный
в патофизиологии этого заболевания.
ответ может вызвать обратный эффект, индуци
руя риск возникновения аутоиммунных патоло
гий, к которым относится и Д1Т [8, 9].
СИСТЕМА ВРОЖДЁННОГО
Поскольку исследование патогенеза диабета
ИММУНИТЕТА И ДИАБЕТ 1 ТИПА
у человека имеет большой ряд ограничений,
разработаны модели диабета у животных, кото
Система врождённого иммунитета представ
рые являются удобными инструментами для
ляет собой первую линию защиты от патогенов
БИОХИМИЯ том 86 вып. 12 2021
PRDX6 СНИЖАЕТ УРОВЕНЬ АФК В БЕТА КЛЕТКАХ ПРИ Д1Т
1843
и чужеродных молекул. В эту систему входит не
быть обнаружены во внутриклеточных органел
изменный набор распознающих молекул, кото
лах, могут секретироваться через систему цир
рые способны узнавать определённые молеку
куляции крови и локализоваться на поверхнос
лярные паттерны чужеродных агентов, попада
ти клеток [28].
ющих в организм, причём распознаваемые пат
Среди PRR особое место занимают Toll по
терны могут быть растворимыми, связанными с
добные рецепторы, которые могут распознавать
мембранами или цитозольными [20]. Система
широкий набор патогенов. Установлено, что
врождённого иммунитета включает множество
TLR являются эволюционно сохраненным
клеточных популяций: макрофаги, дендритные
классом PRR, стимуляция которых непременно
клетки, естественные киллеры и нейтрофилы,
приводит к активации иммунной системы [29].
причём каждая из этих групп клеток несёт свою
Связываясь с лигандом и активируясь, TLR ин
функцию в формирование иммунного ответа,
дуцируют каскад провоспалительных ответов,
при этом важная роль врождённого иммунитета
что вызывает, прежде всего, усиленную продук
при развитии Д1Т не вызывает сомнений [21].
цию цитокинов и хемокинов [30, 31]. На осно
Развитие аутоиммунного диабета 1 типа вклю
вании исследований, проведённых с использо
чает провоспалительный ответ, одним из важ
ванием моделей Д1Т, было сделано предположе
ных участников которого является ядерный
ние, что семейство TLR играет важную роль в
фактор κВ (NF κB). Действительно, ранее была
инициировании аутоиммунного процесса, при
проведена оценка роли конститутивной актива
водящего к разрушению островков Лангерганса
ции NF κB и были обсуждены стратегии предот
поджелудочной железы [32].
вращения продолжительной активации пути
Однако роль системы врождённого иммуни
NF κB при Д1Т у человека [22].
тета и, в частности, TLR в развитии сахарного
Семейство NF κB состоит из ДНК связыва
диабета 1 типа у человека пока остаётся мало
ющих белковых факторов, которые необходимы
изученной. Некоторые авторы предполагали,
для транскрипции большинства провоспали
что аутоактивные процессы против собственных
тельных молекул, включая молекулы адгезии,
антигенов при Д1Т могут объясняться неоправ
ферменты, цитокины и хемокины. Исследова
данно сильным адаптивным иммунным ответом
ния, проведённые на различных клеточных и
при участии TLR [33].
животных экспериментальных системах, позво
Было показано, что стимуляция или ингиби
ляют предположить, что активация NF κB в им
рование TLR в моноцитах периферической кро
мунных клетках и в панкреатических бета клет
ви (PBMC) пациентов со вновь диагностируе
ках является ключевым событием для старта
мым Д1Т изменяет соотношение дендритных
развития Д1Т [23]. По этой причине очевидной
клеток и моноцитов, при этом наблюдается зна
целью кажется применение усилий по сниже
чительное изменение цитокинового профи
нию чрезмерной активации этого ключевого
ля [34]. О важной роли сигнальных путей, регу
сигнального каскада для снижения последствий
лируемых TLR4, в развитии сердечных анома
развития Д1Т. Действительно, семейство NF κB
лий, связанных с жировой инфильтрацией сер
состоит из группы индуцибельных транскрип
дечной мышцы, свидетельствовали данные по
ционных факторов, которые регулируют им
исследованию NOD мышей, дефицитных по
мунные и воспалительные реакции и защищают
TLR4 [35].
клетки от апоптоза в ответ на клеточный стресс.
Ранее было показано участие TLR2 и TLR4 в
Следует добавить, что c Jun N терминальная
развитии Д1Т и у человека. Так, результаты ис
киназа (JNK) также участвует в патогенезе диа
следования пациентов с диагностированным
бета, особенно для модели Д1Т, вызванного
Д1Т показали увеличение экспрессии TLR2 и
STZ [24, 25], при этом ингибиторы JNK, вклю
TLR4 в моноцитах крови этих людей [36]. Меж
чая ингибиторы поли(АДФ рибозы), способны
ду тем имеются сведения о том, что разные чле
снижать патологические последствия Д1Т [26].
ны семейства TLR играют неодинаковую роль в
Интересно, что антиангиогенный эффект бло
развитии диабета 1 типа. Так, при использова
катора кальциевых каналов, тетрандрина, на
нии NOD мышей было установлено, что TLR3
кровеносные сосуды у крыс со стрептозотоцин
не участвует в механизме аутоиммунного ответа,
индуцированным диабетом также был связан с
тогда как у мышей, дефицитных по TLR9, была
понижением уровней TNF α и NF κB [27].
значительно снижена заболеваемость диабе
Система врождённого иммунитета отвечает
том [37]. Таким образом, участие системы врож
на чужеродные агенты и эндогенные патогены с
дённого иммунитета с учётом роли TLR в насто
помощью группы рецепторов, известных как
ящее время не вызывает сомнений, что, по мне
паттерн распознающие рецепторы (pattern
нию многих исследователей, может быть осно
recognition receptors, PRR). Эти рецепторы могут
ванием для разработки новых стратегий для ле
БИОХИМИЯ том 86 вып. 12 2021
1844
НОВОСЁЛОВА и др.
чения и/или предотвращения сахарного диабета
макрофагах через сигнальный путь TLR2. Позд
1 типа [38].
ние апоптотические клетки также индуцирова
ли TLR2 зависимое созревание дендритных
клеток, а затем активацию аутореактивных Т
АПОПТОЗ БЕТА КЛЕТОК
клеток [47]. У мышей с нокаутом TLR2 было об
ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
наружено дефектное праймирование диабето
И ДИАБЕТ 1 ТИПА
генных Т клеток апоптозными бета клетками в
лимфатических узлах поджелудочной железы.
Важная роль врождённого иммунитета, свя
Кроме того, недостаточность TLR2 усиливала
занная с патогенезом Д1Т, была подтверждена
защиту от диабета 1 типа в моделях Д1Т у жи
результатами исследования апоптоза бета кле
вотных [48]. Эти данные свидетельствуют о том,
ток поджелудочной железы при диабете. Извест
что апоптоз панкреатических бета клеток явля
но, что апоптоз инсулин продуцирующих кле
ется одним из стартовых событий в разви
ток поджелудочной железы является последним
тии Д1Т.
этапом развития Д1Т, приводит к критическому
Активное изучение патогенеза Д1Т в течение
уменьшению массы бета клеток и клиническо
последних десятилетий позволило выявить гете
му проявлению Д1Т [39, 40]. На момент поста
рогенность этого заболевания как в отношении
новки диагноза Д1Т островки Лангерганса ин
клинического фенотипа, так и в ответе на тера
фильтрированы иммунными клетками (инсу
пию для предотвращения или рецидива диабета.
лит) [41], и в этот момент около 70-80% общей
Эта неоднородность не только ограничивает
массы бета клеток уже потеряно, поэтому так
усилия по точному прогнозированию клиничес
важно раннее прогнозирование и предотвраще
кой картины, но также отражается в отсутствии
ние развития диабета. Некоторые исследования
прогнозированных ответов на иммуномодули
показали, что индукция инсулита может быть
рующую терапию [49]. Таким образом, сущест
вызвана также неспецифической вирусной ин
вует потребность в надёжных биомаркёрах не
фекцией [42, 43].
благополучия бета клеток, которые могли бы
В начале 2000 х гг. было опубликовано нес
обеспечить понимание патофизиологических
колько работ, посвящённых сравнению динами
различий в течение заболевания, улучшить
ки развития апоптоза бета клеток с появлением
прогнозирование заболевания и успешность
аутоиммунитета у молодых NOD мышей, кото
применения иммуномодулирующих техноло
рые являются классической моделью Д1Т. Было
гий [50].
установлено, что в возрасте 2-3 недели у NOD
мышей наблюдается пик развития поджелудоч
ной железы, и это совпадает с появлением диа
ОКИСЛИТЕЛЬНЫЙ СТРЕСС
бетогенных Т клеток, особенно в лимфатичес
И ДИАБЕТ 1 ТИПА
ких узлах поджелудочной железы мышей. При
этом авторы показали, что одновременно с эти
Известно, что гипергликемия приводит не
ми событиями у новорождённых NOD мышей
только к продукции АФК, но также снижает эф
происходит увеличение уровня апоптоза бета
фективность эндогенной антиоксидантной сис
клеток [44, 45]. Известно, что обычно апоптоз
темы защиты при сахарном диабете [51]. Анти
ные клетки быстро утилизируются макрофага
оксидантные механизмы защиты включают в
ми, однако при нарушении этого процесса клет
себя как ферментативные, так и не фермента
ки могут подвергаться вторичному некрозу, что
тивные системы. Имеются весомые доказатель
может вызывать негативные последствия. Такие
ства окислительного стресса при сахарном диа
события могут возникать у NOD мышей, клет
бете 1 го и 2 го типов [52-54]. При этом повы
ки которых имеют дефекты в фагоцитарной
шение продукции активных форм кислорода
способности [46]. Эти данные показали, что в
или азота увеличивает расходование эндоген
некоторых случаях физиологический апоптоз
ных ферментов антиоксидантов (супероксид
может фактически инициировать возникнове
дисмутаза, глутатионпероксидаза (GPx) и ката
ние аутоиммунитета. Таким образом, можно
лаза) и снижает концентрацию некоторых низ
сделать парадоксальное заключение о том, что
комолекулярных антиоксидантов, например ви
ускорение апоптоза бета клеток у животных с
тамина D [55].
Д1Т является триггером для возникновения ау
Воспаление - важный компонент патогене
тоиммунитета, направленного на бета клетку.
за Д1Т, который гистологически охарактеризо
С другой стороны, было показано, что позд
ван наличием инфильтрирующих лейкоцитов и
ние апоптотические бета клетки со вторичным
циркулирующих антиостровковых антител. Ис
некрозом вызывали воспалительные реакции в
следования с использованием эксперименталь
БИОХИМИЯ том 86 вып. 12 2021
PRDX6 СНИЖАЕТ УРОВЕНЬ АФК В БЕТА КЛЕТКАХ ПРИ Д1Т
1845
ных моделей Д1Т доказывают, что окислитель
ся тем, что гипергликемия при сахарном диабе
ный стресс может инициировать или ускорить
те также снижает уровень эндогенной антиокси
воспалительный процесс через активацию сосу
дантной системы защиты, включающей фер
дистых эндотелиальных клеток, способствуя
менты антиоксиданты и низкомолекулярные
экспрессии множества провоспалительных ци
соединения, обладающие антиоксидантной ак
токинов и хемокинов. Интересно, что всё боль
тивностью [62].
ше доклинических данных свидетельствуют о
В мировой литературе имеются сведения о
том, что образование АФК играет центральную
применении антиоксидантов, в основном низ
роль как в повреждении сосудистой системы,
комолекулярных природных и синтетических
так и ткани поджелудочной железы [51].
веществ, для лечения различных патологий,
Особенно значительный повреждающий эф
сопряжённых с сахарным диабетом [63, 64].
фект окислительного стресса, нарушающего ба
Клинические испытания, изучающие влияние
ланс между свободными формами кислорода и
витаминов антиоксидантов на прогрессирова
антиоксидантной системой, был отмечен в от
ние осложнений сахарного диабета, к сожале
ношении сердечной мышцы. Действительно,
нию, чаще всего дают отрицательные или неубе
кардиологические патологии наряду с другими
дительные результаты [65]. По этой причине
часто отягощают течение инсулин зависимо
целью исследователей является поиск новых со
го Д1Т. Гипергликемия, вызывая выработку и
единений, обладающих антиоксидантной ак
накопление АФК, вызывает сократительную
тивностью, которые способны нейтрализовать
дисфункцию сердечной мышцы при диабе
окислительный стресс, связанный с развити
те [56]. При этом накопление АФК вызывает
ем Д1Т. При этом есть все основания полагать,
каскад патофизиологических событий, в том
что ферменты антиоксиданты могут быть более
числе нарушение кальциевого гомеостаза, уве
эффективными по своей способности нейтра
личение окислительного стресса, дисфункцию
лизовать АФК по сравнению с низкомолекуляр
митохондрий и других факторов, вызывающих
ными антиоксидантами. Действительно, было
диабетическую кардиомиопатию [57]. В услови
показано, что ингибирование АФК с использо
ях диабета хроническая гипергликемия посте
ванием имитатора супероксиддисмутазы задер
пенно подавляет активность бета клеток и уси
живает развитие экспериментального диабе
ливает инсулинорезистентность. Этот процесс,
та [66]. Другие авторы, изучая влияние антиок
типичный для Д2Т, называется «токсичностью
сиданта, эбселена (пероральный миметик глута
глюкозы». В таких условиях провоцируется
тионпероксидазы), на изменение уровня инсу
окислительный стресс и активируется путь JNK,
лина в крови молодых крыс по мере их взросле
который участвует в дисфункции бета клеток
ния, показали, что к 14 й неделе приема эбселе
поджелудочной железы и резистентности к ин
на количество инсулина у животных с Д2Т, по
сулину [58].
лучающих антиоксидант, достоверно возраста
ло [67].
РОЛЬ АНТИОКСИДАНТОВ
ДЛЯ ПРЕДОТВРАЩЕНИЯ
ЗАЩИТНЫЕ ЭФФЕКТЫ
ПОСЛЕДСТВИЙ ДИАБЕТА
ПЕРОКСИРЕДОКСИНА 6
В РАЗНЫХ МОДЕЛЯХ ДИАБЕТА 1 ТИПА
Окислительный стресс, который возникает
при развитии Д1Т, рассматривается как один из
Исследования по использованию фермента
главных патофизиологических факторов сахар
пероксиредоксина 6, обладающего пероксидаз
ного диабета [59]. Считается, что для предотвра
ной и фосфолипазной активностями, показали,
щения повреждения клеток, вызванного АФК,
что экзогенный рекомбинантный Prdx6 прояв
антиоксиданты действуют по одному из трёх ме
ляет терапевтический эффект при различных
ханизмов: они могут уменьшить образование
патологиях, связанных с окислительным стрес
АФК, утилизировать их или препятствовать па
сом, например, при механических и термичес
тологическим изменениям, вызванным АФК.
ких травмах кожи, химических ожогах дыха
Особенно подробно были исследованы кардио
тельных путей, гипоксии реперфузии кишечни
патологические последствия сахарного диабета
ка [68-70]. Более того, среди пероксиредокси
1 го типа. Было доказано существование тесной
нов млекопитающих (Prdx1-6) особый интерес
связи между ослаблением передачи сигналов
представляет именно Prdx6, который способен
инсулина и изменением функции сердца через
восстанавливать самый широкий спектр перок
подавление механизма эндогенной антиоксидант
сидов, включая гидропероксиды фосфолипидов
ной защиты [56, 60, 61]. Положение усугубляет
[71, 72]. Кроме пероксидазной активности,
БИОХИМИЯ том 86 вып. 12 2021
1846
НОВОСЁЛОВА и др.
Prdx6 обладает Ca2+ независимой активностью
рукцию бета клеток в островках Лангерганса
фосфолипазы A2 (aiPLA2), которая обычно про
поджелудочной железы мышей [79]. Кроме то
является только в кислых условиях (в лизосомах
го, в условиях in vitro Prdx6 защищает бета клет
и ламеллярных тельцах при pH 4-5) и играет
ки RIN m5F, культивированные с TNF α и IL 1β,
важную роль в метаболизме фосфолипидов и во
уменьшая продукцию АФК и гибель клеток че
внутриклеточной/межклеточной передаче сиг
рез апоптоз. Исследование механизма защитной
налов [73].
активности фермента показало, что Prdx6 пре
Нокаут гена PRDX6 приводил к повышению
дотвращает активацию сигнальных каскадов
чувствительности животных к окислительному
NF κB и JNK в бета клетках RIN m5F, культи
стрессу. В частности, было показано, что живот
вируемых с цитокинами [80].
ные с нокаутом PRDX6 (PRDX6-/-) чувствитель
Поскольку патологический эффект гипер
ны к гипероксии (в атмосфере 100% кислорода).
гликемии опосредуется в значительной степени
Примечательно, что у таких животных наблюда
через образование АФК, кажется резонным, что
лось окислительное повреждение лёгких и
Prdx6 способен в значительной степени редуци
уменьшение продолжительности жизни [74].
ровать окислительный стресс у мышей с Д1Т.
Сравнение мышей с нокаутом гена, кодирующе
Действительно, прямые эксперименты по влия
го глутатионпероксидазу 1 (GPX1-/-), и мышей с
нию Prdx6 на уровень АФК в клетках RIN m5F в
нокаутом PRDX6 (PRDX6-/-) показало, что Prdx6
присутствии повышенного содержания глюко
является основным ферментом для элиминации
зы доказали значительное снижение АФК при
гидропероксидов фосфолипидов в лёгких [75].
добавлении Prdx6 в среду культивирования
Таким образом, Prdx6 является важным фер
панкреатических бета клеток [80]. Интересно,
ментом антиоксидантом, участвующим в регу
что в соответствии с этими результатами ранее
ляции окислительно восстановительного гоме
было обнаружено, что у пациентов с Д2Т имен
остаза клеток.
но колебания уровня глюкозы коррелировали с
Мы предположили, что Prdx6 может быть эф
запуском окислительного стресса в большей
фективным в качестве агента, подавляющего
степени, чем хроническая устойчивая гипергли
уровень окислительного стресса при сахарном
кемия [81].
диабете 1 типа. Действительно, в сравнении с
Более того, мы показали значительный сти
другими тканями млекопитающих в бета клет
мулирующий эффект Prdx6 на инсулин проду
ках поджелудочной железы содержатся более
цирующую активность бета клеток поджелу
низкие уровни ферментов антиоксидантов, та
дочной железы. Интересно, что стимулирующая
ких как супероксиддисмутаза, каталаза и GPx,
активность Prdx6 была обнаружена как при
что делает эти клетки более уязвимыми к пов
культивировании бета клеток RIN m5F в нор
реждающему действию АФК [76, 77]. Ещё более
мальных условиях, так и в неблагоприятных ус
30 лет назад было показано, что активность GPx
ловиях, вызывающих гибель клеток. Действи
и резистентность к пероксиду примерно в 20 раз
тельно, и в присутствии провоспалительных ци
выше в печени и почках, чем в поджелудочной
токинов, и в условиях гипергликемии добавле
железе [78]. Таким образом, изучая защитные
ние Prdx6 в среду культивирования резко увели
эффекты Prdx6 при Д1Т, сопровождающемся
чивало сниженную инсулин продуцирующую
разрушением бета клеток, следует обратить вни
активность клеток RIN m5F [80]. Полагаем, что
мание на конститутивную уязвимость клеток
сам факт инсулин стимулирующего влияния
поджелудочной железы к повреждающим воз
Prdx6 в отношении панкреатических бета кле
действиям. Естественно, что в условиях пони
ток заслуживает повышенного внимания в пла
женной активности эндогенных ферментов анти
не использования этого белка антиоксиданта
оксидантов возрастает интерес к использованию
для профилактики диабета у лиц, предрасполо
новых белков, таких как Prdx6, обладающих ан
женных к этому заболеванию.
тиоксидантной активностью и, возможно, спо
Наши исследования с использованием инду
собных защитить бета клетки поджелудочной
цированной стрептозотоцином модели Д1Т у
железы при развитии диабета первого типа.
мышей также показали защитный эффект
Были проведены системные исследования
Prdx6 [82]. Благодаря клиническому примене
участия Prdx6 в защите от последствий Д1Т в ус
нию STZ в качестве химиотерапевтического
ловиях in vivo и in vitro. Используя аллоксановую
средства известно больше подробностей о меха
модель тяжёлой формы диабета у мышей, мы
низмах его действия [83]. Из за своей структу
показали, что внутривенное введение рекомби
ры, похожей на глюкозу, он проникает в бета
нантного Prdx6 предотвращает гипергликемию,
клетки таким же образом, как глюкоза и аллок
снижает смертность мышей, восстанавливает
сан, при этом в отличие от аллоксана стрептозо
цитокиновый профиль плазмы и снижает дест
тоцин относительно стабилен [84]. Известно,
БИОХИМИЯ том 86 вып. 12 2021
PRDX6 СНИЖАЕТ УРОВЕНЬ АФК В БЕТА КЛЕТКАХ ПРИ Д1Т
1847
что наиболее важным механизмом гибели бета
ших детальных исследований, однако, наиболее
клеток, вызванным STZ, является не окисли
вероятно, что проникновение Prdx6 в клетки
тельный стресс, а алкилирование ДНК [22, 85].
осуществляется благодаря его фосфолипазной
Несмотря на то что образование АФК при
активности.
использовании STZ индуцированного диабета
Ранее была установлена важность для разви
не играет центральной роли, результаты доказы
тия Д1Т ещё одного сигнального каскада - c Jun
вают несомненную защитную эффективность
N терминальной киназы, который активи
Prdx6. Так, Prdx6 защищает от гибели бета клет
руется в условиях клеточного стресса и участву
ки поджелудочной железы, снижает гипергли
ет в различных типах клеточной гибели. Было
кемию, нормализует уровень TNF α в плазме,
показано, что введение мышам стрептозотоци
активность каскада NF κB и уровень Hsp90 в
на вызывает резкую активацию JNK, что также
клетках у мышей с Д1Т, индуцированным
считается очень важным фактором гибели бета
STZ [82]. Возможно, эффективность Prdx6 мож
клеток при Д1Т [24]. Кроме того, было показа
но объяснить не только антиоксидантными
но, что JNK также участвует в развитии диабета
свойствами, но и его фосфолипазной актив
1 го и 2 го типов [23]. Именно в STZ индуциро
ностью. Кроме того, ранее мы доказали участие
ванной модели Д1Т повышение активности
NF κB, а именно RelA/p65, в защите бета кле
JNK каскада является решающим фактором в
ток поджелудочной железы у мышей с аллок
гибели бета клеток [24]. Используя бета клетки
сан индуцированным диабетом после введения
RIN m5F, мы показали, что Prdx6 предотвращал
животным ингибитора активности NF κB (IKK
активацию не только каскада NF κB, но и акти
Inhibitor XII) [86]. В другой работе было проде
вацию JNK в бета клетках, культивируемых с
монстрировано, что нокдаун PRDX6 увеличивает
провоспалительными цитокинами; кроме того,
восприимчивость бета клеток RIN m5F к пов
Prdx6 значительно снижал апоптоз этих кле
реждающему воздействию провоспалительных
ток [80].
цитокинов и к окислительному стрессу [87]. Ра
Известно, что в клеточном ответе на диабет
нее было установлено, что среди пероксиредок
1 типа участвуют белки теплового шока, напри
синов, экспрессирующихся в клетках RIN m5F,
мер белок Hsp90α. Можно предположить, что
только уровень Prdx6 модулируется провоспали
Hsp90α является одним из маркёров Д1Т.
тельными цитокинами, а подавление активнос
Действительно, в условиях in vitro в бета клетках
ти Prdx6 зависит от кальпаина, протеасомных
RIN m5F [92], а также в иммунных клетках мы
систем и передачи сигналов JNK [88]. Более то
шей с STZ индуцированным Д1Т наблюдали
го, связь между Prdx6 и NF κB, который являет
резкое повышение экспрессии белка Hsp90α
ся одним из наиболее заметных редокс зависи
[82], при этом Prdx6 полностью нормализовал
мых провоспалительных регуляторов, ранее
уровни Hsp90α в иммунных и бета клетках. Важ
наблюдалась в гипоксических клетках гиппо
но отметить, что уровень этого белка незначи
кампа мышей [89]. Кроме того, было показано,
тельно повышался в условиях предиабета, но
что экспрессия Prdx6 обратно коррелирует с ак
именно при развитом диабете наблюдали пик
тивацией NF κB во время заражения Clonorchis
продукции Hsp90α [86].
sinensis [90]. Доказанный защитный эффект
Известно, что субстратами для Hsp90 явля
Prdx6 в условиях Д1Т и с использованием бета
ются сигнальные белки, некоторые из которых
клеток RIN m5F поднимает вопрос о возмож
активно продуцируются при Д1Т, как было пока
ности проникновения эндогенного фермента
зано нами ранее [93]. Исследования роли отдель
внутрь клетки. Для выяснения этого вопроса
ных Т клеточных популяций для формирования
был получен рекомбинантный Prdx6, меченный
аутоиммунного воспаления, свойственного
флуоресцеин 5 изотиоцианатом (FITC). Куль
для Д1Т, позволили выявить особую функцию
тивирование эмбриональных фибробластов 3Т3
Treg лимфоцитов, которые в кооперации с бел
с Prdx6-FITC показало, что в нормальных усло
ками теплового шока регулируют противовоспа
виях белок связывается с поверхностью кле
лительную активность в условиях хронического
ток 3Т3, а также способен проникать внутрь
воспаления [94, 95]. В нашей предыдущей рабо
клеток, при этом количество белка, проникаю
те сравнивали изменения иммунного статуса у
щего в клетку, возрастало при увеличении вре
мышей с аллоксан индуцированном диабетом
мени культивирования и концентрации добав
на двух стадиях его развития - при предиабете и
ленного комплекса Prdx6-FITC [91]. Таким об
развитом диабете. Доказали, что для предиабета
разом, рекомбинантный Prdx6 может проникать
характерно снижение активности Th2 и Treg по
в клетки и оказывать непосредственное влияние
пуляций Т клеток, но не Th1 лимфоцитов. На
на антиоксидантный статус клеток. Механизм
против, при развитом диабете наблюдали сниже
проникновения Prdx6 в клетки требует дальней
ние активностей Th1 и Treg , но не Th2 лимфо
БИОХИМИЯ том 86 вып. 12 2021
1848
НОВОСЁЛОВА и др.
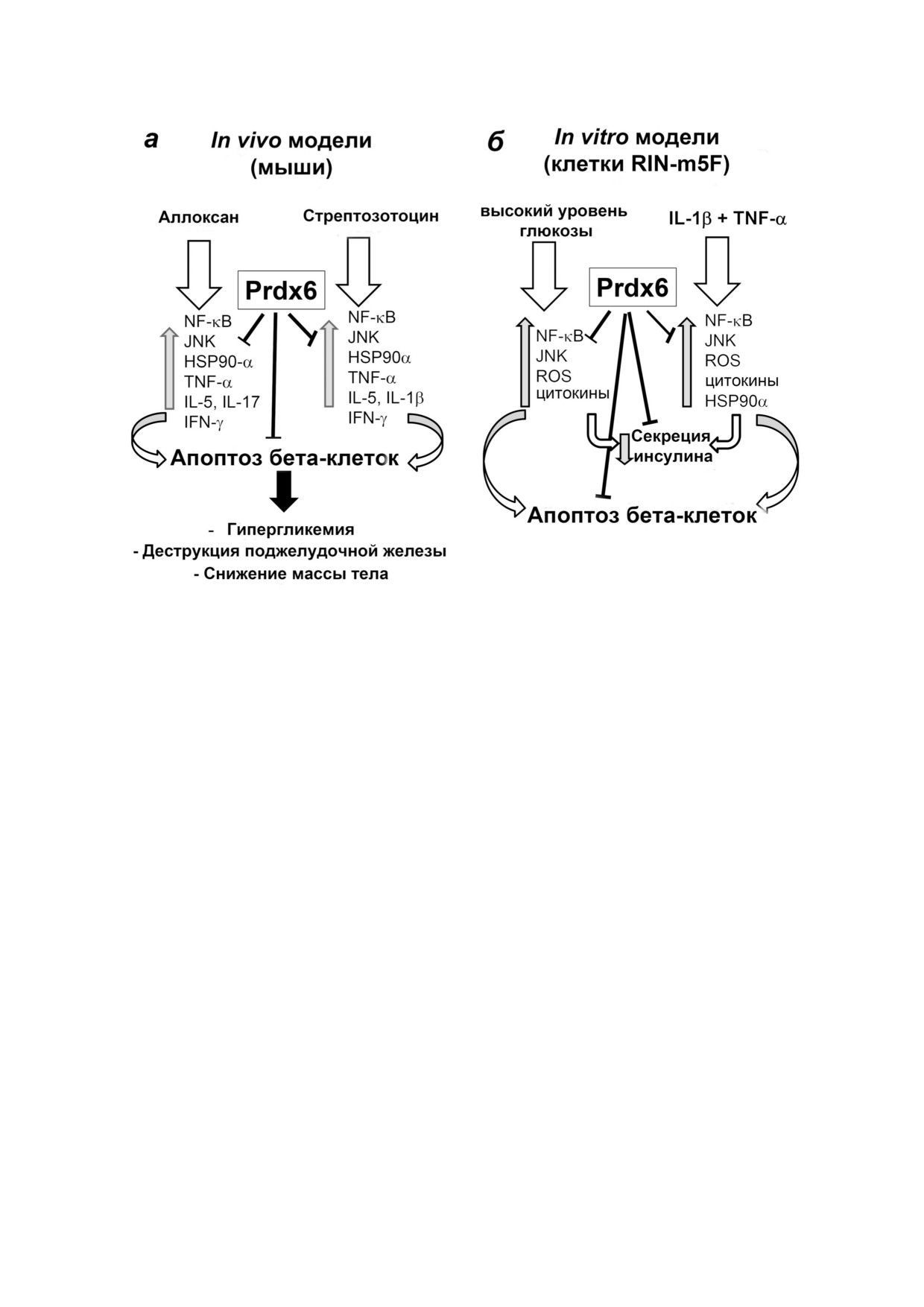
Пероксиредоксин 6 (Prdx 6) снижает иммунный дисбаланс организма и апоптоз панкреатических бета клеток при сахар
ном диабете 1 типа, а также вызывает стимуляцию секреции инсулина в бета клетках RIN m5F. Показаны основные ми
шени сигнальной системы, подвергнутые воздействию Prdx 6 в условиях Д1Т (по результатам работ [79, 80, 82, 86, 92, 93]).
а - Диабет 1 типа, индуцированный у мышей BALB/c введением аллоксана или стрептозотоцина; б - бета клетки RIN
m5F, культивированные с добавлением глюкозы или провоспалительных цитокинов (IL 1β и TNF α)
цитов [86]. С учётом этих сведений можно сде
вета через подавление активности сигнальных
лать предположение о том, что вся сложная кон
каскадов NF κB и JNK, уменьшение продукции
фигурация вовлечённости белков теплового шо
провоспалительных цитокинов и стрессовых
ка в реализацию аутоиммунных процессов
белков, редукцию образования АФК, снижение
при Д1Т находится в прямой зависимости от пе
апоптоза бета клеток и восстановление секре
риода развития и степени тяжести этого хрони
ции инсулина в панкреатических бета клетках.
ческого воспалительного процесса.
На уровне организма введение Prdx6 приводит к
Интересно, что группа авторов из Италии с
снижению концентрации глюкозы в крови жи
использованием мышей, нокаутных по PRDX6,
вотных с Д1Т, уменьшает смертность при тяжё
доказала, что этот ген участвует в патогенезе Д2Т,
лой форме диабета 1 типа и снижает степень
который был индуцирован как сниженной глю
деструкции островков Лангерганса поджелудоч
козозависимой секрецией инсулина, так и повы
ной железы. Эти закономерности представлены
шенной инсулинорезистентностью [96, 97]. По
на рисунке. Полагаем, что требуются дальней
лагаем, что эти результаты можно объяснить
шие исследования антидиабетической актив
способностью Prdx6 стимулировать продукцию
ности Prdx6 - перспективного препарата при
инсулина в панкреатических бета клетках [80],
разработке новых лекарств для лечения и про
что, очевидно, должно влиять на степень инсу
филактики сахарного диабета 1 типа.
линорезистентности, характерной для Д2Т.
В заключение следует отметить, что исполь
Конфликт интересов. Авторы заявляют об от
зование рекомбинантного белка Prdx6 для раз
сутствии конфликта интересов.
ных моделей диабета первого типа in vivo и
Соблюдение этических норм. Все примени
in vitro вызывает очевидный антидиабетический
мые международные, национальные и/или инс
эффект. Механизм защитного действия Prdx6
титуциональные принципы ухода и использова
включает снижение уровня аутоиммунного от
ния животных были соблюдены.
БИОХИМИЯ том 86 вып. 12 2021
PRDX6 СНИЖАЕТ УРОВЕНЬ АФК В БЕТА КЛЕТКАХ ПРИ Д1Т
1849
СПИСОК ЛИТЕРАТУРЫ
1.
Cokkinos, D. V., and Pantos, C. (2011) Type 1 diabetes
17.
Imkampe, A. K., and Gulliford, M. C. (2011) Trends in
impairs compensatory response after myocardial infarc
type 1 diabetes incidence in the UK in 0 to 14 year olds
tion; role of tissue hypothyroidism and effects of thyroid
and in 15 to 34 year olds, 1991 2008, Diabet. Med., 28,
hormone administration, Bull. Acad. Natl. Med., 195, 151
811 814, doi: 10.1111/j.1464 5491.2011.03288.x.
164.
18.
Adams, D. D., Adams, Y. J., Knight, J. G., McCall, J.,
2.
Perlman, A. S., Chevalier, J. M., Wilkinson, P., Liu, H.,
White, P., et al. (1984) A solution to the genetic and envi
Parker, T., et al. (2015) Serum inflammatory and immune
ronmental puzzles of insulin dependent diabetes mellitus,
mediators are elevated in early stage diabetic nephropathy,
Lancet, 323, 420 424, doi: 10.1016/s0140 6736(84)91753 7.
Ann. Clin. Lab. Sci., 45, 256 263.
19.
Rewers, M., and Ludvigsson, J. (2016) Type 1 diabetes.
3.
Wang, S., Du, S., Wu, Q., Hu, J., and Li, T. (2015)
Environmental risk factors for type 1 diabetes, Lancet, 387,
Decorin prevents retinal pigment epithelial barrier break
2340 2348, doi: 10.1016/S0140 6736(16)30507 4.
down under diabetic conditions by suppressing p38 MAPK
20.
Pietropaolo, M., Surhigh, J. M., Nelson, P. W., and
activation, Invest. Ophthalmol. Vis. Sci., 56, 2971 2979,
Eisenbarth, G. S. (2008) Primer: immunity and autoim
doi: 10.1167/iovs.14 15874.
munity, Diabetes, 57, 2872 2882, doi: 10.2337/db07 1691.
4.
King, H., Aubert, R. E., and Herman, W. H. (1998) Global
21.
Zipris, D. (2008) Innate immunity and its role in type 1
burden of diabetes, 1995 2025: prevalence, numerical esti
diabetes, Curr. Opin. Endocrinol. Diabetes Obes., 15, 326
mates, and projections, Diabetes Care, 21, 1414 1431,
331, doi: 10.1097/MED.0b013e3283073a46.
doi: 10.2337/diacare.21.9.1414.
22.
Delaney, C. A., Dunger, A., Di Matteo, M, Cunningham,
5.
Shapiro, A. M., Lakey, J. R., Ryan, E. A., Korbutt, G. S.,
J. M., Green, M. H., et al. (1995) Comparison of inhibi
Toth, E., et al. (2000) Islet transplantation in seven patients
tion of glucose stimulated insulin secretion in rat islets of
with type 1 diabetes mellitus using glucocorticoid free
Langerhans by streptotocin and methyl and ethyl
immunosuppressive regimen, N. Engl. J. Med., 343, 230
nitrosoureas and methanesulphonates. Lack of correlation
238, doi: 10.1056/NEJM200007273430401.
with nitric oxide releasing or O6 alkylating ability,
6.
Dadheech, N., Srivastava, A., Paranjape, N., Gupta, S.,
Biochem. Pharmacol., 50, 2015 2020, doi: 10.1016/0006
Dave, A., et al. (2015) Swertisin an anti diabetic com
2952(95)02102 7.
pound facilitate islet neogenesis from pancreatic
23.
Jaeschke, A., Rincón, M., Doran, B., Reilly, J.,
stem/progenitor cells via p 38 MAP Kinase SMAD path
Neuberg, D., et al. (2005) Disruption of the Jnk2 (Mapk9)
way: an in vitro and in vivo study, PLoS One, 10, e0128244,
gene reduces destructive insulitis and diabetes in a mouse
doi: 10.1371/journal.pone.0128244.
model of type I diabetes, Proc. Natl. Acad. Sci. USA, 102,
7.
Eizirik, D. L., and Mandrup Poulsen, T. (2001) A choice
6931 6935, doi: 10.1073/pnas.0502143102.
of death - the signal transduction of immune mediated
24.
Cheon, H., Cho, J. M., Kim, S., Baek, S. H., Lee, M. K.,
beta cell apoptosis, Diabetologia,
44,
21152133,
et al. (2010) Role of JNK activation in pancreatic beta cell
doi: 10.1007/s001250100021.
death by streptotocin, Mol. Cell. Endocrinol., 321, 131 137,
8.
Cone, J. B. (2001) Inflammation, Am. J. Surg., 182, 558
doi: 10.1016/j.mce.2010.02.016.
562, doi: 10.1016/s0002 9610(01)00822 4.
25.
Akira, S., Uematsu, S., and Takeuchi, O. (2006) Pathogen
9.
Eizirik, D. L., Colli, M. L., and Ortis, F. (2009) The role of
recognition and innate immunity, Cell, 124, 783 801,
inflammation in insulitis and beta cell loss in type 1 dia
doi: 10.1016/j.cell.2006.02.015.
betes, Nat. Rev. Endocrinol., 5, 219 226, doi: 10.1038/
26.
Takeda, K., Kaisho, T., and Akira, S. (2003) Toll like
nrendo.2009.21.
receptors, Annu. Rev. Immunol., 21, 335 376, doi: 10.1146/
10.
Kleinert, M., Clemmensen, C., Hofmann, S. M., Moore,
annurev.immunol.21.120601.141126.
M. C., Renner, S., et al. (2018) Animal models of obesity
27.
Medzhitov, R., and Janeway, Jr. C. A. (1997) Innate immu
and diabetes mellitus, Nat. Rev. Endocrinol., 14, 140 162,
nity: impact on the adaptive immune response, Curr. Opin.
doi: 10.1038/nrendo.2017.161.
Immunol., 9, 4 9, doi: 10.1016/s0952 7915(97)80152 5.
11.
Furman, B. L. (2015) Streptozotocin induced diabetic
28.
De Nardo, D. (2015) Toll like receptors: activation, sig
models in mice and rats, Curr. Protoc. Pharmacol., 70,
nalling and transcriptional modulation, Cytokine, 74, 181
5.47.1 5.47.20, doi: 10.1002/0471141755.ph0547s70.
189, doi: 10.1016/j.cyto.2015.02.025.
12.
Diab, R. A., Fares, M., Abedi Valugerdi, M., Kumagai
29.
Lien, E., and Zipris, D. (2009) The role of toll like recep
Braesch, M., Holgersson, J., et al. (2015) Immunotoxi
tor pathways in the mechanism of type 1 diabetes, Curr.
cological effects of streptozotocin and alloxan: in vitro and
Mol. Med., 9, 52 68, doi: 10.2174/156652409787314453.
in vivo studies, Immunol. Lett., 163, 193 198, doi: 10.1016/
30.
Morran, M. P., Omenn, G. S., and Pietropaolo, M. (2008)
j.imlet.2014.12.006.
Immunology and genetics of type 1 diabetes, Mt. Sinai.
13.
Pearson, J. A., Wong, F. S., and Wen, L. (2016) The impor
J. Med., 75, 314 327, doi: 10.1002/msj.20052.
tance of the Non Obese Diabetic (NOD) mouse model in
31.
Meyers, A. J., Shah, R. R., Gottlieb, P. A., and Zipris, D.
autoimmune diabetes, J. Autoimmun.,
66,
7688,
(2010) Altered Toll like receptor signaling pathways in
doi: 10.1016/j.jaut.2015.08.019.
human type 1 diabetes, J. Mol. Med. (Berl), 88, 1221 1231,
14.
Bergholdt, R., Nerup, J., and Pociot, F. (2005) Fine map
doi: 10.1007/s00109 010 0666 6.
ping of a region on chromosome 21q21.11 q22.3 showing
32.
Dong, B., Qi, D., Yang, L., Huang, Y., Xiao, X., et al.
linkage to type 1 diabetes, J. Med. Genet., 42, 17 25,
(2012) TLR4 regulates cardiac lipid accumulation and dia
doi: 10.1136/jmg.2004.022004.
betic heart disease in the nonobese diabetic mouse model
15.
Steck, A. K., and Rewers, M. J. (2011) Genetics of type 1
of type 1 diabetes, Am. J. Physiol. Heart. Circ. Physiol., 303,
diabetes, Clin. Chem., 57, 176 185, doi: 10.1373/clinchem.
H732 742, doi: 10.1152/ajpheart.00948.2011.
2010.148221.
33.
Xie, Z., Huang, G., Wang, Z., Luo, S., Zheng, P., and
16.
Barret, J. C., Clayton, D. G., Concannon, P., Akolkar, B.,
Zhou, Z. (2018) Epigenetic regulation of Toll like recep
Cooper, J. D., et al. (2009) Genome wide association
tors and its roles in type 1 diabetes, J. Mol. Med. (Berl), 96,
study and meta analysis find that over 40 loci affect risk of
741 751, doi: 10.1007/s00109 018 1660 7.
type 1 diabetes, Nat. Genet., 41, 703 707, doi: 10.1038/
34.
Devaraj, S., Dasu, M. R., Rockwood, J., Winter, W.,
ng.381.
Griffen, S. C., et al. (2008) Increased toll like receptor
8 БИОХИМИЯ том 86 вып. 12 2021
1850
НОВОСЁЛОВА и др.
(TLR) 2 and TLR4 expression in monocytes from patients
50.
Lankin, V. Z., and Tikhaze, A. K. (2017) Role of oxidative
with type 1 diabetes: further evidence of a proinflammato
stress in the genesis of atherosclerosis and diabetes mellitus:
ry state, J. Clin. Endocrinol. Metab.,
93,
578583,
a personal look back on 50 years of research, Curr. Aging.
doi: 10.1210/jc.2007 2185.
Sci., 10, 18 25, doi: 10.2174/1874609809666160926142640.
35.
Wong, F. S., Hu, C., Zhang, L., Du, W., Alexopoulou, L.,
51.
Miranda D az, A. G., Pazar n Villaseñor, L.,Yanowsky
et al. (2008) The role of Toll like receptors 3 and 9 in the
Escatell, F. G., and Andrade Sierra, J. (2016) Oxidative
development of autoimmune diabetes in NOD mice, Ann. N.
stress in diabetic nephropathy with early chronic kidney
Y. Acad. Sci., 1150, 146 148, doi: 10.1196/annals.1447.039.
disease, J. Diabetes Res., 2016, 7047238, doi: 10.1155/
36.
Tai, N., Wong, F. S., and Wen, L. (2016) The role of the
2016/7047238.
innate immune system in destruction of pancreatic beta
52.
Maise, K. (2015) New insights for oxidative stress and dia
cells in NOD mice and humans with type I diabetes,
betes mellitus, Oxid. Med. Cell. Longev., 2015, 875961,
J. Autoimmun., 71, 26 34, doi: 10.1016/j.jaut.2016.03.006.
doi: 10.1155/2015/875961.
37.
Kim, Y. H., Kim, S., Kim, K. A., Yagita, H.,
53.
Savastio, S., Cadario, F., Genoni, G., Bellomo, G.,
Kayagaki, N., et al. (1999) Apoptosis of pancreatic beta
Bagnati, M., et al. (2016) Vitamin D deficiency and
cells detected in accelerated diabetes of NOD mice: no
glycemic status in children and adolescents with type1 dia
role of Fas Fas ligand interaction in autoimmune diabetes,
betes mellitus, PLoS One, 11, e0162554, doi: 10.1371/journal.
Eur. J. Immunol., 29, 455 465, doi: 10.1002/(SICI)1521
pone.0162554.
4141(199902)29:02<455::AID IMMU455>3.0. CO;2 A.
54.
Ceriello, A. (2003) New insights on oxidative stress and
38.
O’Brien, B. A., Harmon, B. V., Cameron, D. P., and Allan,
diabetic complications may lead to a ‘‘causal’’ antioxidant
D. J. (1997) Apoptosis is the mode of beta cell death
therapy, Diabetes Care, 26, 15891596, doi: 10.2337/
responsible for the development of IDDM in the non
diacare.26.5.1589.
NLRP3 obese diabetic (NOD) mouse, Diabetes, 46, 750
55.
Boudina, S., and Abel, E. D. (2007) Diabetic cardiomyo
757, doi: 10.2337/diab.46.5.750.
pathy revisited, Circulation, 115, 3213 3223, doi: 10.1161/
39.
Gepts, W. (1965) Pathologic anatomy of the pancreas in
CIRCULATIONAHA.106.679597.
juvenile diabetes mellitus, Diabetes,
14,
619633,
56.
Kaneto, H., Matsuoka, T. A., Katakami, N.,
doi: 10.2337/diab.14.10.619.
Kawamori, D., Miyatsuka, T., et al. (2007) Oxidative stress
40.
Drescher, K. M., and Tracy, S. (2008) The CVB and
and the JNK pathway are involved in the development of
Etiology of Type 1 Diabetes, in Group B Coxsackieviruses.
type 1 and type 2 diabetes, Curr. Mol. Med., 7, 674 686,
Current Topics in Microbiology and Immunology (Tracy, S.,
doi: 10.2174/156652407782564408.
Oberste, M. S., and Drescher, K. M., eds.) Vol 323,
57.
Brownlee, M. (1995) Advanced protein glycosylation in
Springer, Berlin, Heidelberg, pp. 259 274, doi: 10.1007/
diabetes and aging, Annu. Rev. Med., 46, 223234,
978 3 540 75546 3_12.
10.1146/annurev.med.46.1.223.
41.
Hosokawa, Y., Hanafusa, T., and Imagawa, A. (2019)
58.
Dallak, M. M., Mikhailidis, D. P., Haidara, M. A., Bin
Pathogenesis of fulminant type 1 diabetes: Genes, viruses
Jaliah, I. M., Tork, O. M., et al. (2008) Oxidative stress as
and the immune mechanism, and usefulness of patient
a common mediator for apoptosis induced cardiac damage
derived induced pluripotent stem cells for future research,
in diabetic rats, Open Cardiovasc. Med. J., 2, 70 78,
J. Diabetes. Invest., 10, 1158 1164, doi: 10.1111/jdi.13091.
doi: 10.2174/1874192400802010070.
42.
Trudeau, J. D., Dutz, J. P., Arany, E., Hill, D. J., Fieldus,
59.
Johansen, J. S., Harris, A. K., Rychly, D. J., and Ergul, A.
W. E., et al. (2000) Neonatal beta cell apoptosis: a trigger
(2005) Oxidative stress and the use of antioxidants in dia
for autoimmune diabetes? Diabetes, 49, 1 7, doi: 10.2337/
betes: linking basic science to clinical practice, Cardiovasc.
diabetes.49.1.1.
Diabetol., 4, 5 11, doi: 10.1186/1475 2840 4 5.
43.
Turley, S., Poirot, L., Hattori, M., Benois, C., and
60.
Forstermann, U. (2008) Oxidative stress in vascular dis
Mathis, D. (2003) Physiological beta cell death triggers
ease: causes, defence mechanisms and potential therapies,
priming of self reactive T cells by dendritic cells in a type
Nat. Clin. Pract. Cardiovasc. Med.,
5,
338349,
1 diabetes model, J. Exp. Med.,
198,
15271537,
doi: 10.1038/ncpcardio1211.
doi: 10.1084/jem.20030966.
61.
Karunakaran, U., and Park, K. G. (2013) A systematic
44.
O’Brien, B. A., Huang, Y., Geng, X., Dutz, J. P., and
review of oxidative stress and safety of antioxidants in dia
Finegood, D. T. (2002) Phagocytosis of apoptotic cells by
betes: focus on islets and their defense, Diabetes Metab. J.,
macrophages from NOD mice is reduced, Diabetes, 51,
37, 106 112, doi: 10.4093/dmj.2013.37.2.106.
2481 2488, doi: 10.2337/diabetes.51.8.2481.
62.
Wojnar, W., Zych, M., and Kaczmarczyk Sedlak, I. (2018)
45.
Kim, H. S., Han, M. S., Chung, K. W., Kim, S., Kim, E.,
Antioxidative effect of flavonoid naringenin in the lenses of
et al. (2007) Toll like receptor 2 senses beta cell death and
type 1 diabetic rats, Biomed. Pharmacother., 108, 974 984,
contributes to the initiation of autoimmune diabetes,
doi: 10.1016/j.biopha.2018.09.092.
Immunity, 27, 321 333, doi: 10.1016/j.immuni.2007.06.010.
63.
Czerwińska, M. E., G sińska, E., Leśniak, A., Krawczyk,
46.
Lee, M. S., Kim, D. H., Lee, J. C., Kim, S., and Kim,
P., Kiss, A. K., et al. (2018) Inhibitory effect of Ligustrum
H. S. (2011) Role of TLR2 in the pathogenesis of autoim
vulgare leaf extract on the development of neuropathic
mune diabetes and its therapeutic implication, Diabetes
pain in a streptozotocin induced rat model of diabetes,
Metab. Res. Rev., 27, 797 801, doi: 10.1002/dmrr.1231.
Phytomedicine, 49, 75 82, doi: 10.1016/j.phymed.2018.
47.
Sims, E. K., Evans Molina, C., Tersey, S. A., Eizirik,
06.006.
D. L., and Mirmira, R. G. (2018) Biomarkers of islet beta
64.
Rochette, L., Zeller, M., Cottin, Y., and Vergely, C. (2014)
cell stress and death in type 1 diabetes, Diabetologia, 61,
Diabetes, oxidative stress and therapeutic strategies,
2259 2265, doi: 10.1007/s00125 018 4712 1.
Biochim. Biophys. Acta., 1840, 2709 2729, doi: 10.1016/
48.
Mirmira, R. G., Sims, E. K., Syed, F., and Evans
j.bbagen.2014.05.017.
Molina, C. (2016) Biomarkers of β cell stress and death in
65.
Thakur, P., Kumar, A., and Kumar, A. (2018) Targeting
type 1 diabetes, Curr. Diab. Rep., 16, 95, doi: 10.1007/
oxidative stress through antioxidants in diabetes mellitus,
s11892 016 0783 x.
J. Drug. Target., 26, 766 776, doi: 10.1080/1061186X.
49.
Brownlee, M. (2001) Biochemistry and molecular cell
2017.1419478.
biology of diabetic complications, Nature, 414, 813 820,
66.
Piganelli, J. D., Flores, S. C., Cruz, C., Koepp, J.,
doi: 10.1038/414813a.
Batinic Haberle, I., Crapo, J., et al. (2002) A metallopor
БИОХИМИЯ том 86 вып. 12 2021
PRDX6 СНИЖАЕТ УРОВЕНЬ АФК В БЕТА КЛЕТКАХ ПРИ Д1Т
1851
phyrin based superoxide dismutase mimic inhibits adop
81.
Monnier, L., Mas, E., Ginet, C., Michel, F., Villon, L.,
tive transfer of autoimmune diabetes by a diabetogenic T
et al. (2006) Activation of oxidative stress by acute glucose
cell clone, Diabetes, 51, 347 355, doi: 10.2337/diabetes.
fluctuations compared with sustained chronic hyper
51.2.347.
glycemia in patients with type 2 diabetes, JAMA, 295, 1681
67.
Mahadevan, J., Parazzoli, S., Oseid, E., Hertzel, A. V.,
1687, doi: 10.1001/jama.295.14.1681.
Bernlohr, D. A., et al. (2013) Ebselen treatment prevents
82.
Novoselova, E. G., Glushkova, O. V., Lunin, S. M.,
islet apoptosis, maintains intranuclear Pdx1 and MafA lev
Khrenov, M. O., Parfenyuk, S. B., et al. (2021) Thymulin
els, and preserves β cell mass and function in ZDF rats,
and peroxiredoxin 6 have protective effects against strepto
Diabetes, 62, 3582 3588, doi: 10.2337/db13_0357.
zotocin induced type
1 diabetes in mice, Int. J.
68.
Gordeeva, A. E., Sharapov, M. G., Tikhonova, I. V.,
Immunopathol. Pharmacol.,
35,
1 10, doi:
10.1177/
Chemeris, N. K., Fesenko, E. E., et al. (2017) Vascular
20587384211005645.
pathology of ischemia/reperfusion injury of rat small intes
83.
Radenković, M., Stojanović, M., and Prostran, M. (2016)
tine, Cells Tissues Organs, 203, 353 364, doi: 10.1159/
Experimental diabetes induced by alloxan and streptozo
000455830.
tocin: the current state of the art, J. Pharmacol. Toxicol.
69.
Sharapov, M. G., Goncharov, R. G., Gordeeva, A. E.,
Methods, 78, 13 31, doi: 10.1016/j.vascn.2015.11.004.
Novoselov, V. I., Antonova, O. A., et al. (2016) Enzymatic
84.
Lenzen, S. (2008) The mechanisms of alloxan and strep
antioxidant system of endotheliocytes, Dokl. Biochem.
tozotocin induced diabetes, Diabetologia, 51, 216 226,
Biophys., 471, 410 412, doi: 10.1134/S1607672916060090.
doi: 10.1007/s00125 007 0886 7.
70.
Karaduleva, E. V., Mubarakshina, E. K., Sharapov, M. G.,
85.
Elsner, M., Guldbakke, B., Tiedge, M., Munday, R., and
Volkova, A. E., Pimenov, O. Y., et al. (2016) Cardiopro
Lenzen, S. (2000) Relative importance of transport and
tective effect of modified peroxiredoxins in retrograde per
alkylation for pancreatic beta cell toxicity of streptozo
fusion of isolated rat heart under conditions of oxidative
tocin, Diabetologia,
43,
15281533, doi:
10.1007/
stress, Bull. Exp. Biol. Med., 160, 639 642, doi: 10.1007/
s00125005156.
s10517 016 3237 1.
86.
Novoselova, E. G., Glushkova, O. V., Lunin, S. M.,
71.
Fisher, A. B., Vasquez Medina, J. P., Dodia, C., Sorokina,
Khrenov, M. O., Novoselova, T. V., et al. (2016) Signaling,
E. M., Tao, J. Q., et al. (2018) Peroxiredoxin 6 phospho
stress response and apoptosis in pre diabetes and diabetes:
lipid hydroperoxidase activity in the repair of peroxidized
restoring immune balance in mice with alloxan induced
cell membranes, Redox Biol., 14, 41 46, doi: 10.1016/
type 1 diabetes mellitus, Int. Immunopharmacol., 31, 24
j.redox.2017.08.008.
31, doi: 10.1016/j.intimp.2015.11.007.
72.
Fisher, A. B. (2017) Peroxiredoxin 6 in the repair of perox
87.
Katunuma, N., Matsui, A., Le, Q. T., Utsumi, K.,
idized cell membranes and cell signaling, Arch. Biochem.
Salvesen, G., et al. (2001) Novel procaspase 3 activating
Biophys., 617, 68 83, doi: 10.1016/j.abb.2016.12.003.
cascade mediated by lysoapoptasesand its biological signif
73.
Wang,Y., Feinstein, S. I., Manevich, Y., Ho, Y. S., and
icances in apoptosis, Adv. Enzyme Regul., 41, 237 250,
Fisher, A. B. (2004) Lung injury and mortality with hyper
doi: 10.1016/S0065 2571(00)00018 2.
oxia are increased in peroxiredoxin 6 gene targeted mice,
88.
Paula, F. M., Ferreira, S. M., Boschero, A. C., and Souza,
Free Radic. Biol. Med., 37, 1736 1743, doi: 10.1016/
K. L. (2013) Modulation of the peroxiredoxin system by
j.freeradbiomed.2004.09.006.
cytokines in insulin producing RINm5F cells: down regu
74.
Liu, G., Feinstein, S. I., Wang, Y., Dodia, C., Fisher, D.,
lation of PRDX6 increases susceptibility of beta cells to
et al. (2010) Comparison of glutathione peroxidase 1 and
oxidative stress, Mol. Cell. Endocrinol., 374, 5664,
peroxiredoxin 6 in protection against oxidative stress in the
doi: 10.1016/j.mce.2013.04.009.
mouse lung, Free Radic. Biol. Med., 49, 11721181,
89.
Chhunchha, B., Fatma, N., Kubo, E., Rai, P., Singh, S. P.,
doi: 10.1016/j.freeradbiomed.2010.07.002.
et al. (2013) Curcumin abates hypoxia induced oxidative
75.
Kaneto, H., Kajimoto, Y., Miyagawa, J., Matsuoka, T.,
stress based ER stress mediated cell death in mouse hip
Fujitani, Y., et al. (1999) Beneficial effects of antioxidants
pocampal cells (HT22) by controlling Prdx6 and NF
in diabetes - possible protection of pancreatic beta cells
kappaB regulation, Am. J. Physiol. Cell. Physiol., 304, 636
against glucose toxicity, Diabetes,
48,
23982406,
655, doi: 10.1152/ajpcell.00345.2012.
doi: 10.2337/diabetes.48.12.2398.
90.
Pak, J. H., Son, W. C., Seo, S. B., Hong, S. J., Sohn,
76.
Lei, X. G., and Vatamaniuk, M. Z. (2011) Two tales of
W. M., et al. (2016) Peroxiredoxin 6 expression is inversely
antioxidant enzymes on β cells and diabetes, Antioxid.
correlated with nuclear factor kappaB activation during
Redox. Signal., 14, 489 503, doi: 10.1089/ars.2010.3416.
Clonorchis sinensis infestation, Free Radic. Biol. Med., 99,
77.
Miki, A., Ricordi, C., Sakuma, Y., Yamamoto, T.,
273 285, doi: 10.1016/j.freeradbiomed.2016.08.016.
Misawa, R., et al. (2018) Divergent antioxidant capacity of
91.
Sharapov, M. G., Glushkova, O. V., Parfenyuk, S. B.,
human islet cell subsets: a potential cause of beta cell vul
Gudkov, S. V., Lunin, S. M., et al. (2021) The role of
nerability in diabetes and islet transplantation, PLoS One,
TLR4/ NF κB signaling in the radioprotective effects of
13, e0196570, doi: 10.1371/journal.pone.0196570.
exogenous Prdx6, Arch. Biochem. Biophys., 702, 108830,
78.
Malaisse, W. J., Malaisse Lagae, F., Sener, A., and
doi: 10.1016/j.abb.2021.108830.
Pipeleers, D. G. (1982) Determinants of the selective toxi
92.
Novoselova, E. G., Glushkova, O. V., Khrenov, M. O.,
city of alloxan to the pancreatic B cell, Proc. Natl. Acad.
Parfenyuk, S. B., Lunin, S. M., et al. (2020) Participation of
Sci. USA, 79, 927 930, doi: 10.1073/pnas.79.3.927.
Hsp70 and Hsp90α heat shock proteins in stress response in
79.
Novoselova, E. G., Glushkova, O. V., Lunin, S. M., Khrenov,
the course of type 1 diabetes mellitus, Dokl. Biol. Sci., 493,
M. O., Parfenyuk, S. B., et al. (2020) Peroxiredoxin 6 atten
124 127, doi: 10.1134/S0012496620040079.
uates alloxan induced type 1 diabetes mellitus in mice and
93.
Novoselova, E. G., Khrenov, M. O., Parfenyuk, S. B.,
cytokine induced cytotoxicity in RIN m5F beta cells,
Novoselova, T. V., Lunin, S. M., et al. (2014) The NF κB,
J. Diabetes Res., 2020, 7523892, doi: 10.1155/2020/7523892.
IRF3, and SAPK/JNK signaling cascades of animal
80.
Novoselova, E. G., Glushkova, O. V., Parfenuyk, S. B.,
immune cells and their role in the progress of type 1 dia
Khrenov, M. O., Lunin, S. M., et al. (2019) Protective
betes mellitus, Dokl. Biol. Sci., 457, 255 257, doi: 10.1134/
effect of peroxiredoxin 6 against toxic effects of glucose and
S0012496614040073.
cytokines in pancreatic RIN m5F β cells, Biochemistry
94.
Wieten, L., Broere, F., van der Zee, R., Koerkamp,
(Moscow), 84, 637 643, doi: 10.1134/S0006297919060063.
E. K., Wagenaar, J., et al. (2007) Cell stress induced HSP
БИОХИМИЯ том 86 вып. 12 2021
8*
1852
НОВОСЁЛОВА и др.
are targets of regulatory T cells: a role for HSP inducing
96. Pacifici, F., Arriga, R., Sorice, G. P., Capuani, B.,
compounds as anti inflammatory immuno modulators,
Scioli, M. G., et al. (2014) Peroxiredoxin 6, a novel player
FEBS Lett., 581, 3716 3722, doi: 10.1016/j.febslet.2007.
in the pathogenesis of diabetes, Diabetes, 63, 3210 3220,
04.082.
doi: 10.2337/db14 0144.
95. Van Eden, W., Wick, G., Albani, S., and Cohen, I. (2007)
97. Arriga, A., Pacifici, F., Capuani, B., Coppola, A.,
Stress, heat shock proteins, and autoimmunity: how
Orlandi, A., et al. (2019) Peroxiredoxin 6 is a key antioxi
immune responses to heat shock proteins are to be used for
dant enzyme in modulating the link between glycemic and
the control of chronic inflammatory diseases, Ann. N. Y.
lipogenic metabolism, Oxid. Med. Cell. Longev., 2019,
Acad. Sci., 1113, 217 237, doi: 10.1196/annals.1391.020.
9685607, doi: 10.1155/2019/9685607.
THE ROLE OF INNATE IMMUNITY AND OXIDATIVE STRESS
IN THE DEVELOPMENT OF TYPE 1 DIABETES MELLITUS.
PEROXIREDOXIN 6 AS A NEW ANTI DIABETIC AGENT
Review
E. G. Novoselova*, O. V. Glushkova, M. O. Khrenov,
S. M. Lunin, T. V. Novoselova, and S. B. Parfenuyk
Institute of Cell Biophysics, Russian Academy of Sciences, 142290 Pushchino,
Moscow Region, Russia; E mail: elenanov_06@mail.ru
The review discusses information on the development of type 1 diabetes mellitus (T1D) as a systemic autoimmune
and inflammatory disease. The review focuses on the role of the innate immune system, including the activation of
some signaling cascades, cytokine response, and the activity of Toll like receptors in the development of T1D.
Dysfunction of innate immunity is the cause of the attack of T lymphocytes on the own pancreatic beta cells and leads
to the death of pancreatic beta cells that produce insulin. Lack of insulin causes hyperglycemia and the need for life
long injections of insulin in patients with T1D, which, nevertheless, does not exclude damage to many organs and tis
sues, given the particular vulnerability of blood vessels in conditions of hyperglycemia. The review discusses the role
of oxidative stress as a factor that plays a major role in damage to the vascular system and pancreatic tissue during the
development of T1D. Taking into account the special vulnerability of pancreatic beta cells to the action of ROS, the
possibility of using antioxidants to reduce the level of pathological consequences of the development of T1D is dis
cussed. New information on the anti diabetic activity of the exogenous antioxidant enzyme peroxiredoxin 6, which is
capable of penetrating cells, activating insulin production in beta cells, reducing ROS levels, as well as decreasing the
activation of some signaling cascades, the production of pro inflammatory cytokines, and the expression of Toll like
receptors in beta cells and in immune cells under T1D development is discussed.
Keywords: peroxiredoxin 6, hyperglycemia, cytokines, RIN m5F beta cells, insulin production, NF κB and JNK sig
naling cascades
БИОХИМИЯ том 86 вып. 12 2021