БИОХИМИЯ, 2021, том 86, вып. 12, с. 1853 - 1864
УДК 577.355; 577.115.3
ДЕЙСТВИЕ НИЗКИХ ПОЛОЖИТЕЛЬНЫХ ТЕМПЕРАТУР
НА ФОТОСИНТЕТИЧЕСКИЙ АППАРАТ
МИКРОВОДОРОСЛИ Lobosphaera incisa IPPAS С 2047
© 2021
В.В. Птушенко1,2*, Г.Н. Бондаренко3, Е.Н. Виноградова4,5, Е.С. Глаголева4,
О.В. Карпова4, О.С. Птушенко4, А.Е. Соловченко4, Б.В. Трубицин6,
О.Б. Чивкунова4, К.А. Шибзухова4, П.Н. Щербаков4
1 НИИ физико химической биологии имени А.Н. Белозерского, Московский государственный университет
имени М.В. Ломоносова, 119992 Москва, Россия; электронная почта: ptush@belozersky.msu.ru
2 Институт биохимической физики имени Н.М. Эмануэля РАН, 119334 Москва, Россия
3 Московский государственный университет имени М.В. Ломоносова, химический факультет, 119991 Москва, Россия
4 Московский государственный университет имени М.В. Ломоносова,
биологический факультет, 119991 Москва, Россия
5 Национальный исследовательский центр «Курчатовский институт», 123182 Москва, Россия
6 Московский государственный университет имени М.В. Ломоносова, физический факультет, 119991 Москва, Россия
Поступила в редакцию 25.09.2021
После доработки 04.11.2021
Принята к публикации 10.11.2021
Фотосинтезирующие организмы обладают рядом механизмов для предотвращения фотоокислительных ре
акций, инициированных в фотосинтетическом аппарате (ФСА) избыточным освещением. Причиной раз
вития фотоокислительных реакций может служить не только увеличение интенсивности освещения, но и
другие стрессовые воздействия, в частности, действие низких положительных температур. В настоящей ра
боте мы исследовали индукцию фотозащитных механизмов у инкубируемой при пониженной освещённос
ти (50 мкмоль фотонов × м-2 × с-1) зеленой почвенной микроводоросли Lobosphaera incisa IPPAS С 2047 пос
ле воздействия температуры 0 °C в течение 4 сут. Мы наблюдали снижение фотохимической активности фо
тосистемы II (ФСII) и эффективности фотосинтетического транспорта электронов на фоне существенного
увеличения теплового рассеяния в фотосинтетической антенне поглощённой световой энергии. При этом
большинство параметров, отражающих акклимацию ФСА к избыточному освещению (содержание хлоро
филла и каротиноидов, доля пигментов виолаксантинового цикла в общем пуле каротиноидов и уровень их
деэпоксидации, соотношение содержания фотосинтетических антенн и комплексов ФСII и фотосистемы I
(ФСI)), практически не изменилось. Изменений в содержании основных ненасыщенных жирных кислот,
кроме арахидоновой, также выявлено не было; концентрация последней возрастала на 40%, что может спо
собствовать активации виолаксантиндеэпоксидазы. Уровень экспрессии защитного белка LhcSR повышал
ся в 4-7 раз по сравнению с его уровнем непосредственно перед началом низкотемпературной акклимации
клеток. Предварительная инкубация клеток при +5 °С оказывала положительный эффект на показатели фо
тохимической активности ФСА при последующем действии температуры 0 °С. Полученные данные пока
зывают, что акклимация L. incisa IPPAS C 2047 в течение 4 сут. к низкой положительной температуре на фо
не низкой плотности светового потока приводит к формированию адаптивной реакции ФСА, отчасти ха
рактерной для условий светового стресса. Основным механизмом защиты ФСА в этих условиях является бе
лок (LhcSR) зависимое тушение возбуждения в фотосинтетической антенне.
КЛЮЧЕВЫЕ СЛОВА: cветовой стресс, низкотемпературная акклимация, десатурация жирных кислот, ара
хидоновая кислота, тепловая диссипация энергии света, LhcSR, микроводоросли.
DOI: 10.31857/S0320972521120095
ВВЕДЕНИЕ
щения энергии света для осуществления энер
гоакцепторных биохимических реакций [1-4],
Фотосинтезирующие организмы характери
однако поглощение избыточной энергии света
зуются наличием эффективной системы погло может инициировать фотоокислительные реак
Принятые сокращения: АК - арахидоновая кислота; Ант - антераксантин; ВДЭ - виолаксантиндеэпоксидаза;
ВАЗ - пигменты виолаксантинового цикла (Вио, Ант, Зеа); Вио - виолаксантин; ЖК - жирные кислоты; Зеа - зеаксан
тин; Кар - каротиноиды; Лют - лютеин; НЖК - ненасыщенные жирные кислоты; НФТ - нефотохимическое тушение;
СБМ - сухая биомасса; ФСII (ФСI) - фотосистема II (I); ФСА - фотосинтетический аппарат; Хл - хлорофилл; DE - ко
эффициент деэпоксидации.
* Адресат для корреспонденции.
1853
1854
ПТУШЕНКО и др.
ции в фотосинтетическом аппарате (ФСА), при
кислородсодержащих форм в обеспечении
водящие к повреждению организма [5]. Для
НФТ, способны дезактивировать активные фор
предотвращения их развития фототрофы выра
мы кислорода, возникающие в ФСА в условиях
ботали ряд защитных механизмов. Важнейшим
избыточного освещения [21, 22]. Поэтому для
механизмом защиты ФСА от светового стресса
растений характерно увеличение содержания
является тушение возбужденных форм хлоро
каротиноидов по отношению к хлорофиллу при
филла с рассеянием энергии в виде тепла. Этот
длительной акклимации к интенсивному све
процесс сопровождается легко детектируемым
ту [23-27].
снижением интенсивности флуоресценции хло
Индукция механизмов защиты от избыточ
рофилла, поэтому его часто называют также не
ного освещения возникает не только в условиях
фотохимическим тушением флуоресценции
высокой инсоляции. В неблагоприятных усло
(НФТ). Ключевыми детерминантами НФТ яв
виях, снижающих интенсивность протекания
ляются состав и содержание пигментов, в пер
метаболических процессов в организме, ФСА не
вую очередь, деэпоксидированных форм ксан
в состоянии полностью утилизировать погло
тофиллов (зеаксантина, Зеа, и лютеина, Лют
щаемую световую энергию, что также может
[6, 7]), а также содержание фотопротекторного
привести к фотоокислительному повреждению
белка LhcSR, родственного белкам светособи
клетки и организма [5]. К таким неблагоприят
рающей антенны. Этот белок присутствует пре
ным условиям относится понижение температу
имущественно у низших растений [8, 9]. У сосу
ры окружающей среды, вызывающее снижение
дистых растений он замещается своим функци
текучести мембран клеток, подавляющее фото
ональным аналогом - белком PsbS, являющим
синтетический метаболизм, и вовлечение про
ся компонентом фотосистемы II (ФСII), а у
дуктов ассимиляции в процессы роста и морфо
представителей промежуточных групп (из кото
генеза растения. В результате развивается свето
рых наиболее изученным является мох
вой стресс и ответ ФСА на него. При действии
Physcomitrella patens) функционируют оба белка
низких температур на фоне интенсивного осве
[10]. Показано, что содержание универсальных
щения у растений отмечали накопление зеак
для растительного мира каротиноидов Лют, Зеа
сантина [28, 29]. Наряду с индукцией общих фо
и Ант [11, 12], а также нескольких характерных
топротекторных реакций в ФСА, направленных
для водорослей дополнительных деэпоксидиро
на снижение возбуждения хлорофилла [30],
ванных ксантофиллов [13] коррелирует с индук
происходит также специфическая акклимация
цией НФТ, в то время как эпоксидированный
организма к низкой температуре, в первую оче
ксантофилл виолаксантин либо не участвует в
редь, снижение вязкости мембраны за счёт деса
НФТ [14], либо ингибирует его индукцию [15].
турации жирных кислот (ЖК) мембранных ли
Получены доказательства непосредственного
пидов [31, 32]. До сих пор не до конца ясно, ка
участия зеаксантина в НФТ как необходимого
кова роль общих фотопротекторных и специфи
фотохимического компонента [16], хотя в неко
ческих для условий низкой температуры реак
торых работах высказываются сомнения в необ
ций фототрофного организма на условия свето
ходимости зеаксантина для индукции НФТ [17].
вого стресса, спровоцированного понижением
LhcSR может связывать зеаксантин и осущест
температуры. Очевидно, это зависит от вида са
влять как зеаксантин зависимое, так и зеаксан
мого организма (видоспецифичность), а также
тин независимое НФТ в фотосинтетической
от интенсивности и продолжительности воздей
антенне [18]. Нарушение экспрессии LhcSR в
ствия стрессовых факторов.
результате мутагенеза приводит к заметному
Удобной моделью для исследования этого
снижению НФТ и жизнеспособности клеток
вопроса может служить факультативная психро
при интенсивном освещении [8].
фильная микроводоросль Lobosphaera incisa
НФТ служит механизмом «быстрого реаги
IPPAS С 2047. Штамм был изолирован из почв
рования» ФСА на световой стресс. На более
Дальнего Востока России. Климат региона ха
длительных промежутках времени в процесс ак
рактеризуется существенными сезонными из
климации организма к избыточному освеще
менениями интенсивности инсоляции, темпе
нию включаются и другие механизмы. К ним от
ратуры, формированием снежного покрова.
носят изменения в соотношении пигмент бел
Микроводоросли данного таксона были отмече
ковых комплексов обеих фотосистем (ФСI и
ны также на заснеженных горных склонах [33].
ФСII) и фотосинтетических антенных (светосо
Учитывая характеристики мест распростране
бирающих) комплексов (ССК), а также измене
ния этой водоросли, можно ожидать высокую
ния общего содержания компонентов ФСА в
физиологическую пластичность их клеток, спо
клетке [19, 20]. Каротиноиды, в дополнение к
собность адаптироваться к резким изменениям
упомянутой выше роли их деэпоксидированных
условий обитания и формировать специфичес
БИОХИМИЯ том 86 вып. 12 2021
АККЛИМАЦИЯ ФОТОСИНТЕТИЧЕСКОГО АППАРАТА L. incisa
1855
кие механизмы защиты ФСА от стрессовых воз
мом служит белок (LhcSR) зависимое НФТ, а
действий.
среди НЖК наиболее существенно возрастает
Существенную роль в этих механизмах, со
содержание АК.
гласно исследованиям последних лет, играют
синтез и накопление полиненасыщенных ЖК, а
также каротиноидных пигментов виолаксанти
МАТЕРИАЛЫ И МЕТОДЫ
нового цикла [34]. Более того, эти две компонен
ты (специфическая и неспецифическая) ответа
Условия культивирования микроводорослей и
на стресс, по видимому, оказываются функцио
отбор проб. В качестве модельного объекта была
нально связанными друг с другом. Ранее один из
выбрана Lobosphaera incisa IPPAS С 2047 - поч
авторов этой работы высказал предположение,
венная зелёная микроводоросль из класса
что образование и накопление одной из полине
Trebouxiophyceae (Chlorophyta). Суспензионную
насыщенных ЖК - арахидоновой кислоты (АК) -
культуру микроводорослей объёмом 600 мл вы
не только приводит к понижению вязкости
ращивали в фотобиореакторе в 0,7 литровой
мембраны, но и способствует повышению ак
стеклянной колонне (внутренний диаметр
тивности мембранного фермента виолаксантин
45 мм) при температуре 25-26 °C, постоянном
деэпоксидазы (ВДЭ) за счёт создания подходя
барботировании среды отфильтрованным ат
щего липидного микроокружения [34]. В свою
мосферным воздухом и непрерывном освеще
очередь, ВДЭ обеспечивает относительно быст
нии (50 мкмоль фотонов × м-2 × с-1) светодиод
рое (в минутной шкале времени) образование
ными панелями, оснащёнными нейтральными
антераксантина и зеаксантина, участвующих в
белыми светодиодами SMD 2835 («Arlight», Рос
НФТ, из предшественника виолаксантина. Од
сия). По достижении оптической плотности
нако пока остаётся неясным, является ли реша
OD678 = 0,4-0,5 производили отбор проб культу
ющим фактором активация синтеза АК в клетке
ры для проведения физиологического и биохи
в ответ на понижение температуры или же доста
мического анализов, затем культуру охлаждали
точно её постоянного присутствия в клетке. Не
до 0 °C со скоростью 0,4-0,8 °C/мин. Инкуба
ясно также, за какие характерные времена про
цию при температуре около 0 °C продолжали в
исходит индукция НФТ и других фотопротек
течение следующих 4 сут., после чего снова про
торных механизмов и какие из перечисленных
водили отбор проб. Одновременно отбирали
выше механизмов играют наиболее существен
пробы из контрольной культуры, не подвергав
ную роль при акклимации микроводорослей к
шейся воздействию низкой температуры.
низкой температуре в течение нескольких суток.
Для другой части экспериментов культуру
В настоящей работе была поставлена цель
сначала охлаждали до 5 °C и инкубировали при
выяснить, какую роль играют перечисленные
5 °C в течение 4 сут., затем охлаждали до 0 °C и
ваше механизмы защиты ФСА в акклимации
инкубировали при 0 °C ещё 4 сут., после чего
микроводоросли L. incisa IPPAS С 2047 к низ
проводили отбор проб. Пробы для биохимичес
кой температуре за времена порядка нескольких
кого анализа подвергали центрифугированию
суток. Для этого необходимо было решить сле
для осаждения клеток, полученный осадок за
дующие задачи: 1) охарактеризовать активацию
мораживали при -80 °C и использовали затем
НФТ и изменения активности ФСА микроводо
для измерений (кроме измерений фотохимичес
росли L. incisa IPPAS С 2047 в результате аккли
кой активности ФСА). Для термостатирования
мации к низкой температуре; 2) определить из
культуры использовали охлаждающую циркуля
менения пигментного состава и соотношения
ционную баню термостат SC100/A10 («Thermo
содержания пигмент белковых комплексов
Fisher Scientific», США), сопряжённую с культи
ФСА, которые влияют на активность НФТ;
вационной колонной с помощью тонкого (не
3) оценить изменение активности защитного
мешающего освещению культуры) змеевика,
белка LhcSR, ответственного за индукцию НФТ;
погружённого в суспензионную культуру.
4) выяснить характерные изменения содержа
Измерение фотохимической активности фото
ния ненасыщенных ЖК (НЖК) в клетках
синтетического аппарата и теплового рассеяния
L. incisa IPPAS С 2047 при действии низкой тем
энергии света в фотосинтетической антенне. Ука
пературы. Время наблюдения, 4 сут., было вы
занные измерения выполняли непосредственно
брано малым по сравнению с характерной дли
после отбора проб с помощью JIP теста [35] на
тельностью экспоненциальной фазы роста
импульсно модулированном хлорофилл флуо
культуры, но достаточным для индукции всех
риметре Fluor Pen FP 100 («Photon Systems
рассмотренных механизмов акклимации. Полу
Instruments», Чехия). Суспензию помещали в
ченные результаты позволяют утверждать, что в
кварцевую кювету и адаптировали к темноте в
наших условиях основным защитным механиз
течение 5 мин при 0 или 25 °C (для опытных и
БИОХИМИЯ том 86 вып. 12 2021
1856
ПТУШЕНКО и др.
контрольных образцов соответственно), после
ной культуры растирали в ацетоне, осаждали
чего проводили измерение. Фотохимическую
центрифугированием. Супернатант, содержа
активность ФСА оценивали с помощью пара
щий экстракт хлорофиллов и каротиноидов из
метров Fv/Fm и ET0/RC, характеризующих мак
клеток микроводорослей, инкубировали в тече
симальную квантовую эффективность разделе
ние 30 мин при 0 °C и непрерывном перемеши
ния зарядов в ФСII и интенсивность транспорта
вании с хроматографическим сорбентом
электронов в расчёте на один реакционный
Ambersep 900 («Merck», Германия) для омыле
центр ФСII соответственно. Интенсивность
ния хлорофилла [39]. Обработанный таким об
теплового рассеяния энергии света в фотосин
разом экстракт анализировали с помощью хро
тетической антенне в расчёте на один реакцион
матографа Smartline («Knauer», Германия) с ка
ный центр оценивали с помощью параметра
ротиноидной колонкой YMC30, идентифика
DI0/RC [35].
цию осуществляли на основе хроматографичес
Измерение сухой биомассы (СБМ). В ходе
ких стандартов («CaroteNature», Швейцария).
культивирования гравиметрически выполняли
Определяли содержание каждого каротиноида
измерение СБМ. Клеточную суспензию
по отношению к общему содержанию кароти
(2-3 мл) осаждали на стекловолоконных фильт
ноидов, в том числе суммарное содержание пиг
рах GF/F диаметром 25 мм («Whatman», США),
ментов виолаксантинового цикла (ВАЗ):
предварительно высушенных в микроволновой
печи до постоянной массы. Фильтры с осаждён
ВАЗ = Вио + Ант + Зеа.
(1)
ными клетками повторно высушивались. СБМ
клеток в образце определяли как разность массы
Коэффициент деэпоксидации пула ВАЗ рассчи
фильтра до и после осаждения клеток.
тывали по формуле:
Измерение содержания хлорофилла и кароти
ноидов, анализ профиля жирных кислот. Состав
DE = (Зеа + 0,5 × Ант)/(Зеа + Ант + Вио). (2)
жирных кислот суммарных липидов анализиро
вали методом газовой хроматографии и масс
Измерение содержания ФСI. Осадок клеточ
спектрометрии с использованием газового хро
ной суспензионной культуры ресуспендировали
матографа Agilent 7890A («Agilent Technologies»,
в дистиллированной воде, помещали суспензию
США), оснащенного капиллярной колонкой
в пластиковую (TFE) трубку и регистрировали
HP5MS UI, соединенной с масс селективным
спектр электронного парамагнитного резонанса
детектором Agilent 5970 («Agilent Technologies»).
(ЭПР) с помощью спектрометра ЭПР 3 санти
Экстракцию липидов проводили согласно мето
метрового диапазона Varian E4 («Varian», США)
ду Фолча [36]. Осажденную клеточную суспен
в темноте и при освещении интенсивным
зию гомогенизировали в смеси хлороформ : ме
(1500 мкмоль фотонов × м-2 × с-1) белым светом,
танол (2 : 1) с предварительным охлаждением в
который позволял полностью окислить реакци
жидком азоте. Внутренний стандарт - 50 мкг
онные центры ФСI. Измеряли светозависимый
маргариновой кислоты («Sigma», США) - до
сигнал ЭПР с g фактором 2,0023 и шириной
бавляли в экстракты перед трансметилировани
около 0,9 мТл, известный в литературе как сиг
ем. Трансметилирование жирных кислот липи
нал ЭПРI, который соответствует окисленному
дов проводили путем инкубации с 2% ной сер
первичному донору ФСI, P700+ [40]. Оценивали
ной кислотой в метаноле [37]. Метиловые эфи
содержание ФСI в суспензии на основании ве
ры жирных кислот экстрагировали гексаном.
личины сигнала ЭПРI при освещении. Для оп
Относительное содержание жирных кислот оп
ределения абсолютной концентрации ФСI оп
ределяли в весовых процентах (вес. %) от сум
ределяли двойной интеграл сигнала ЭПРI и
марного содержания в пробе.
сравнивали его с двойным интегралом спектра
Содержание пигментов (хлорофиллы a и b,
спинового зонда TEMPOamine, записанного
суммарные каротиноиды) определяли в хлоро
при тех же настройках резонатора ЭПР спект
формном экстракте спектрофотометрически.
рометра.
Регистрацию спектров поглощения экстрактов
Выделение РНК и количественная ПЦР в ре
пигментов проводили в кварцевых кюветах с
альном времени. Суммарная РНК была выделена
длиной оптического пути 1 см на спектрофото
из клеток с помощью набора GeneJet Plant RNA
метре Agilent Cary
300 UV Vis
(«Agilent
purification («Thermo Fisher Scientific») или
Technologies»). Концентрацию хлорофиллов и
RNeasy Mini («Qiagen», Германия). Заморожен
каротиноидов рассчитывали по уравнениям сог
ный осадок клеточной суспензионной культуры
ласно работе [38].
(~ 100 мг) растирали в жидком азоте либо из
Анализ состава каротиноидов методом ВЭЖХ.
мельчали в гомогенизаторе Fastprep 24 5g («MP
Замороженный осадок клеточной суспензион
Biomedicals», США) со скоростью 6 м/с в тече
БИОХИМИЯ том 86 вып. 12 2021
АККЛИМАЦИЯ ФОТОСИНТЕТИЧЕСКОГО АППАРАТА L. incisa
1857
ние 40 с в лизирующем буфере с гранулами ти
ожидания нормальной выборки с уровнем дове
па A («MP Biomedicals»). Клеточный лизат ос
рия p = 95%.
ветляли центрифугированием (10 000 g, 10 мин)
и далее осуществляли процедуру выделения
РНК в соответствии с протоколом производите
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
ля. Синтез одноцепочечной кДНК проводили с
использованием набора для обратной тран
В ходе работы была выполнена оценка пока
скрипции Maxima 1 st strand cDNA («Thermo
зателей активности ФСА (фотохимическая ак
Fisher Scientific») или MMLV RT c обратной
тивность ФСII, эффективность фотосинтетичес
транскриптазой Mint («Евроген», Россия) в со
кого транспорта электронов и теплового рассея
ответствии с протоколом производителя. Для
ния поглощённой световой энергии), а также ха
синтеза кДНК использовали 250 нг РНК каждо
рактеристик ФСА, связанных с акклимацией к
го из образцов. Полученную кДНК хранили при
избыточному освещению (содержание разных
-20 °C.
форм хлорофилла и каротиноидов, в том числе
Подбор праймеров был выполнен с исполь
уровень деэпоксидации пула ксантофиллов, а
зованием программного обеспечения RealTime
также уровень экспрессии гена LhcSR). Также
PCR Tool
(«Integrated DNA Technologies»,
был выполнен анализ содержания НЖК в клет
ке. Измерения были выполнены непосредствен
com/scitools/Applications/RealTimePCR/, с пара
но перед и через 4 сут. после начала непрерывной
метрами по умолчанию в контигах собранного
акклимации к 0 °C; далее везде приведено изме
de novo генома L. incisa IPPAS C 2047, предполо
нение каждого показателя в результате акклима
жительно содержащих целевые гены. Присут
ции по отношению к состоянию до акклимации.
ствие целевых генов было установлено на осно
Время, в течение которого культуру клеток
вании выравнивания контигов из собранного
подвергали воздействию низкой температуры,
de novo генома L. incisa IPPAS C 2047 с целевы
было выбрано достаточно большим, чтобы дать
ми генами близкородственных водорослей
возможность проявиться всем исследуемым в
(BLAST NCBI).
работе механизмам акклимации. Тем не менее
ПЦР в реальном времени (qPCR) проводили
оно является меньшим, чем характерная дли
с использованием амплификатора QuantStudio 7
тельность экспоненциальной фазы роста сус
Flex («Applied Biosystems», США) или Agilent
пензионной культуры клеток L. incisa IPPAS
AriaMx Real time PCR System
(«Agilent
C 2047 для минимизации влияния роста культу
Technologies») и набора для qPCR QuantiTect
ры на измеряемые параметры. Изменение СБМ
SYBR Green («Qiagen») или qPCRmix HS SYBR
контрольной суспензии за время наблюдения
(«Евроген») в соответствии с рекомендациями
составляло (30 ± 12)%. В то же время рост опыт
производителя. Для анализа результатов ис
ной суспензии был существенно замедлен, или
пользовали онлайн приложение «Thermo Fisher
даже происходила незначительная потеря био
Scientific» для приборов серии «QuantStudio».
массы, и в среднем за время наблюдения изме
Содержание специфических транскриптов рас
нений СБМ не наблюдалось, значения прироста
считывали относительно уровня актина и уби
СБМ составляли (0 ± 20)%.
квитинлигазы (эндогенный контроль) в той же
Кроме того, были получены культуры клеток
культуре до начала низкотемпературной аккли
L. incisa IPPAS C 2047, охлаждённые до 0 °C не
мации.
сразу, а предварительно инкубированные при
Статистическая обработка данных. Все экс
температуре +5 °C в течение 4 сут. В этом случае
перименты выполнены с трёхкратной биологи
для описания изменений состояния ФСА в ре
ческой повторностью. JIP тест и ПЦР в реаль
зультате акклимации к 0 °C также использовали
ном времени выполнены с трёхкратной, осталь
отношение каждого показателя в конце аккли
ные измерения - с двукратной аналитической
мации к его значению непосредственно перед
повторностью. Все результаты представляют
началом охлаждения.
среднее значение (M) ± стандартное отклоне
Характеристики культуры перед охлаждени
ние (SD). Усреднение проводили сначала по
ем приведены в таблице.
аналитическим, затем по биологическим пов
Активность фотосинтетического аппарата. К
торностям. SD оценивали по разбросу биологи
концу 4 х сут. инкубации суспензии при темпе
ческих повторностей, т.к. он существенно пре
ратуре 0 °C наблюдалось снижение фотохими
восходил разброс между аналитическими. До
ческой потенциальной активности ФСII,
стоверность отличия изменений измеряемых
Fv/Fm, приблизительно в 2 раза по сравнению с
параметров от единицы оценивали на основе
исходной активностью (рис. 1). При этом кван
доверительных интервалов для математического
товый выход фотоиндуцированного транспор
БИОХИМИЯ том 86 вып. 12 2021
1858
ПТУШЕНКО и др.
Характеристики суспензионной культуры L. incisa IPPAS
та электронов, ET0/RC, падал ещё более значи
C 2047 перед началом охлаждения
тельно. Эти изменения сопровождались воз
СБМ (мг/мл)
0,61 ± 0,38
растанием теплового рассеяния поглощённой
энергии света в фотосинтетической антенне,
Fv/F
m
0,50 ± 0,05
DI0/RC, в 4 раза. Необходимо подчеркнуть, что
DI0/RC
2,9 ± 0,7
все эти характеристики были измерены на
ET0/RC
0,82 ± 0,24
клетках, адаптированных к темноте. Иными
словами, они не связаны с динамической, ин
НЖК (% от суммарных ЖК)
дуцируемой светом активацией теплового рас
сеяния световой энергии, а представляют со
18 : 1
17 ± 2
бой постоянный (длительно релаксирующий)
18 : 2
21 ± 5
компонент защиты ФСА, сформировавшийся в
18 : 3
11 ± 5
ходе акклимации к низкой температуре. При
20 : 4
11 ± 4
этом в контрольной суспензии, постоянно ин
кубируемой при температуре 25 °C, значения
Хл и Кар
Fv/Fm, ET0/RC и DI0/RC оставались практичес
ки неизменными в течение того же време
Хл/СБМ
0,018 ± 0,006
ни (рис. 2).
Кар/Хл
0,53 ± 0,05
Состав пигментов и содержание пигмент бел
Лют/Кар
50 ± 11
ковых комплексов фотосинтетического аппарата.
Большинство параметров, отражающих аккли
ВАЗ/Кар
38 ± 10
мацию ФСА к избыточному освещению, оста
DE
21 ± 11
лись практически неизменными. Так, общее со
Примечание. Приведены средние значения ± стандартное
держание хлорофилла в клетках в расчёте на
отклонение (n = 6-8).
единицу сухого веса, Chl/DW, через 4 сут. инку
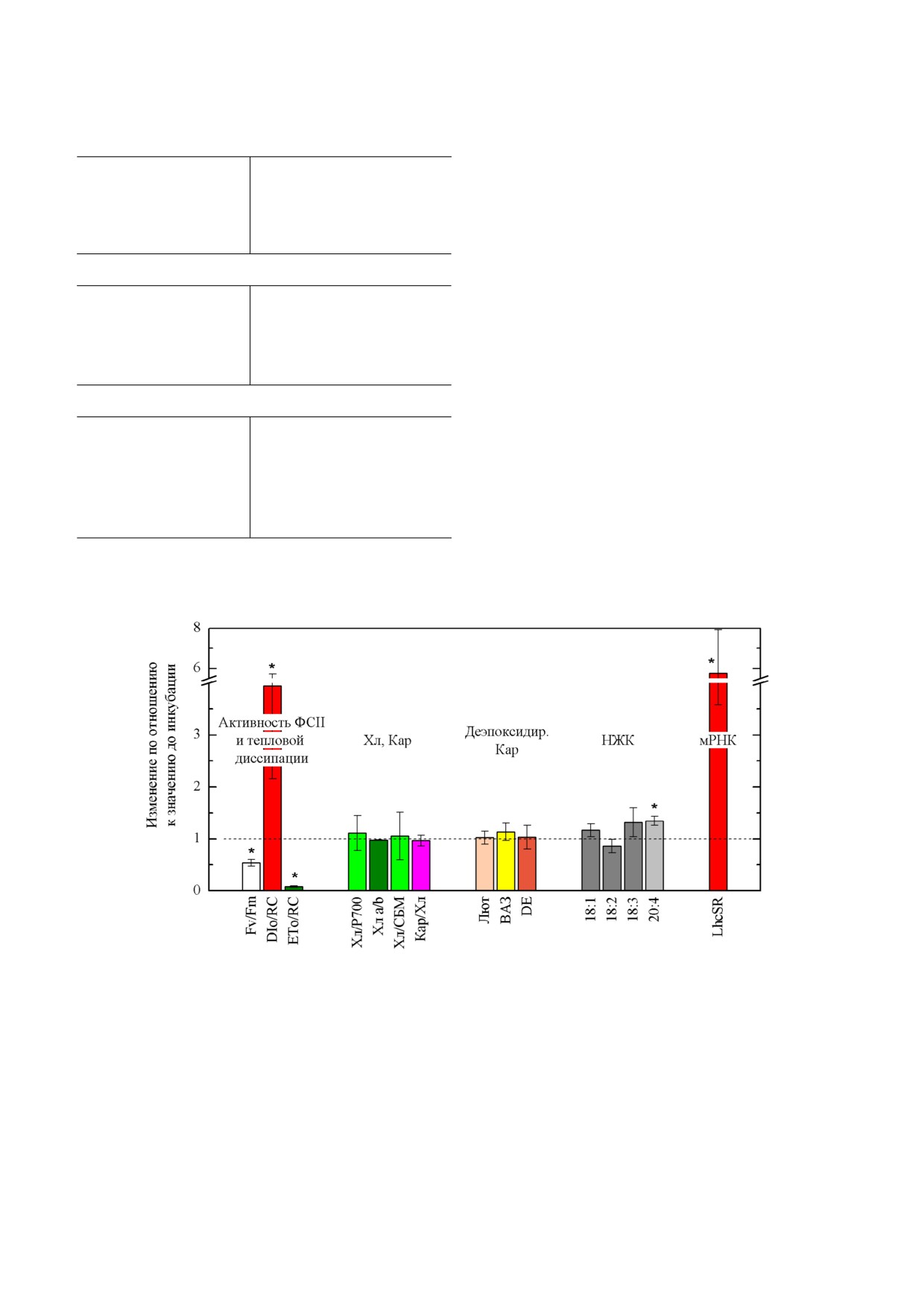
Рис. 1. Изменение показателей теплового рассеяния энергии света в фотосинтетической антенне (DI0/RC) и фотохими
ческой активности ФСII (Fv/Fm и ET0/RC), содержания и состава хлорофилла, каротиноидов и ненасыщенных жирных
кислот (НЖК), а также активности экспрессии LhcSR в клетках L. incisa IPPAS C 2047 в результате акклимации к темпе
ратуре 0 °C (значение каждого параметра перед началом низкотемпературной акклимации принято за единицу). Хл/P700
и Хл/СБМ - суммарное содержание хлорофилла (Хл) a и b в расчёте на содержание реакционных центров ФСI (P700) или
на сухую биомассу соответственно; Кар/Хл - содержание каротиноидов в расчёте на суммарное содержание Хл; Хл a/b -
соотношение содержания Хл a и b; Лют и ВАЗ - доля лютеина и пигментов виолаксантинового цикла среди всех кароти
ноидов соответственно. DE - коэффициент деэпоксидации пула ВАЗ. 18 : x и 20 : 4 - доля соответствующих НЖК среди
всего пула ЖК клетки. Горизонтальной пунктирной линией отмечен уровень, соответствующий отсутствию изменений.
Приведены средние значения ± стандартное отклонение (n = 3). Звёздочки над столбцами указывают, что изменение со
ответствующего показателя в ходе акклимации клеток к низкой температуре достоверно отличается от единицы с уров
нем доверия p = 95%
БИОХИМИЯ том 86 вып. 12 2021
АККЛИМАЦИЯ ФОТОСИНТЕТИЧЕСКОГО АППАРАТА L. incisa
1859
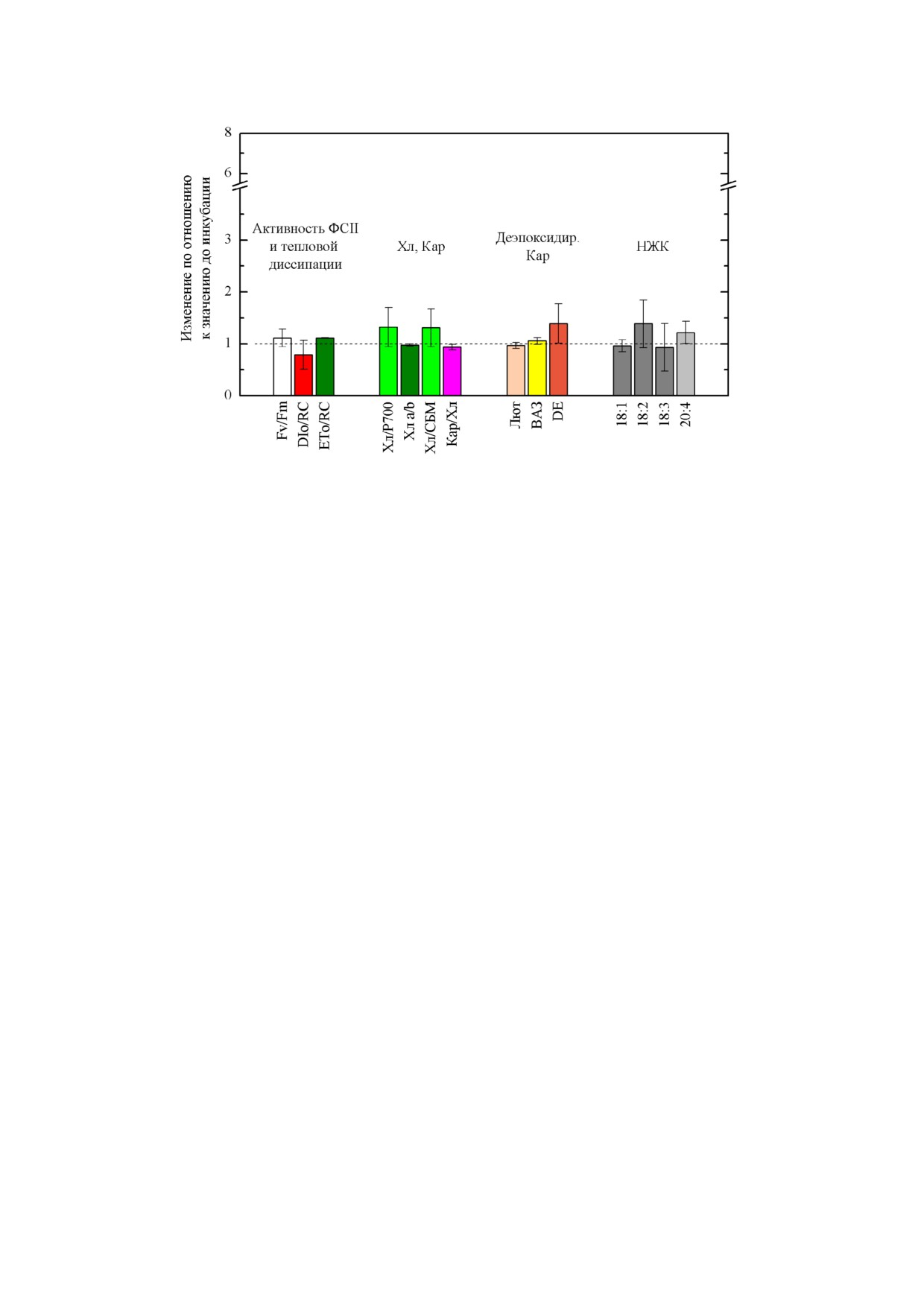
Рис. 2. Изменение показателей теплового рассеяния энергии света в фотосинтетической антенне и фотохимической ак
тивности ФСII, содержания и состава хлорофилла, каротиноидов и НЖК, а также активности экспрессии LhcSR в клет
ках L. incisa IPPAS C 2047 на 4 е сут. инкубации при нормальной температуре (25 °C) по сравнению с их значениями пе
ред началом инкубации. Обозначения - как на рис. 1. Горизонтальной пунктирной линией отмечен уровень, соответству
ющий отсутствию изменений. Приведены средние значения ± стандартное отклонение (n = 3)
бации при низкой температуре оставалось на
светового стресса [23, 44, 45]. Хроматографи
том же уровне, что и до начала низкотемпера
ческий анализ состава каротиноидов показал,
турной акклимации (рис. 1). Также не измени
что он также оказался нечувствительным к рас
лось соотношение содержания хлорофилла a и
сматриваемым нами стрессовым условиям. Так,
b, Chl a/b, которое характеризует соотношение
ни содержание пигментов виолаксантинового
фотосинтетических антенн (преимущественно
пула (включающего виолаксантин, антераксан
комплексов внешней антенны ФСII, LHCII) и
тин и зеаксантин, VAZ), ни доля деэпоксидиро
комплексов ФСII и ФСI. Поскольку комплексы
ванных форм ксантофиллов среди пула VAZ,
LHCII содержат значительно большую долю
выражаемая коэффициентом деэпоксидации,
хлорофилла b, чем все остальные фотосинтети
DE, не проявляла достоверных изменений. Ещё
ческие пигмент белковые комплексы [41], то
одной фотопротекторной деэпоксидированной
вышеуказанное соотношение комплексов, как
формой ксантофиллов, хотя и неспособной к
правило, служит маркером адаптации фотосин
быстрой конверсии в/из эпоксидированных
тезирующего организма к интенсивности осве
предшественников, считают Лют [12]; однако
щения [42, 43]. Измерения содержания комп
изменений содержания Лют мы также не на
лексов ФСI, сделанные на основе сигнала ЭПР
блюдали.
полностью окисленного первичного донора
В контрольной суспензии мы также не на
ФСI, P700, также не показали достоверных из
блюдали достоверных изменений содержания и
менений содержания ФСI по отношению к об
состава фотосинтетических пигментов, хотя
щему содержанию хлорофилла, Chl/P700. Таким
можно заметить некоторую тенденцию к изме
образом, как общее содержание ФСА в клетках
нениям содержания хлорофилла и коэффици
L. incisa IPPAS C 2047, так и соотношение клю
ента деэпоксидации, что может быть обусловле
чевых фотосинтетических комплексов ФСI,
но акклимацией к изменяющимся условиям
ФСII и LHCII оказалось нечувствительным к
роста из за накопления биомассы и увеличения
низкотемпературной акклимации выбранной
оптической плотности среды (рис. 2). Заметим,
нами продолжительности.
что, в отличие от контрольной суспензии, рост
Неизменным оставалось и общее содержа
опытной суспензии практически отсутствует и
ние каротиноидов в расчёте на хлорофилл
не осложняет картину акклимации культуры к
(Car/Chl), изменение (как правило, рост) кото
низкой температуре.
рого часто рассматривают в качестве одной из
Экспрессия гена фотопротекторного белка
наиболее заметных реакций ФСА на условия LhcSR. Согласно общепринятому на нынешний
БИОХИМИЯ том 86 вып. 12 2021
1860
ПТУШЕНКО и др.
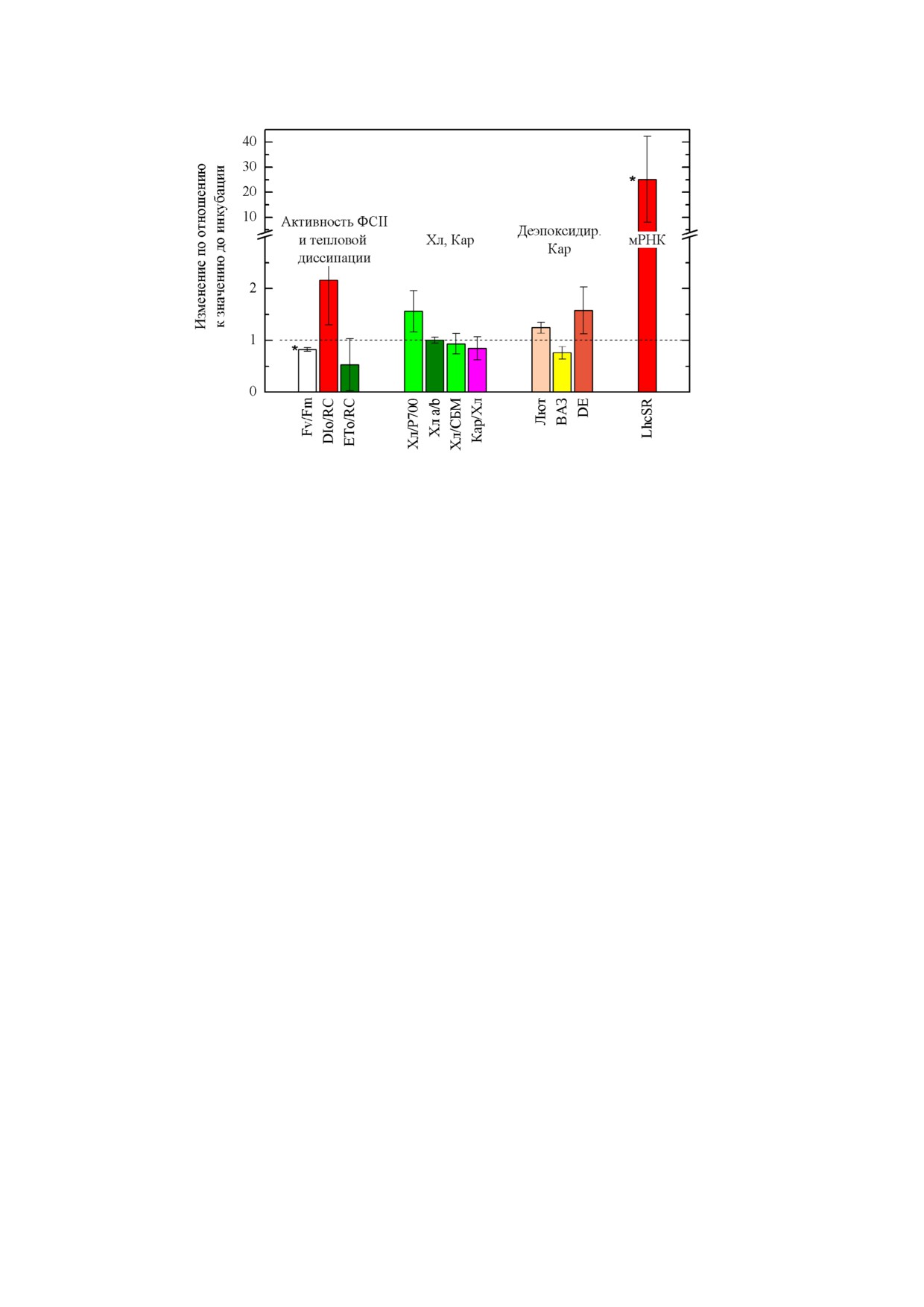
Рис. 3. Изменение показателей теплового рассеяния энергии света в фотосинтетической антенне и фотохимической ак
тивности ФСII, содержания и состава хлорофилла, каротиноидов и НЖК, а также активности экспрессии LhcSR в клет
ках L. incisa IPPAS C 2047 на 4 е сут. инкубации при низкой температуре (0 °C) после предварительной акклимации к 5 °C
(опытная суспензия) по сравнению с их значениями перед началом инкубации при пониженной температуре. Обозначе
ния - как на рис. 1. Горизонтальной пунктирной линией отмечен уровень, соответствующий отсутствию изменений.
Приведены средние значения ± стандартное отклонение (n = 3). Звёздочки над столбцами указывают, что изменение со
ответствующего показателя в ходе акклимации клеток к низкой температуре достоверно отличается от единицы с уров
нем доверия p = 95%
момент представлению, для низших растений
Тепловое рассеяние световой энергии в фото
ключевым компонентом защиты ФСА от избы
синтетической антенне, DI0/RC, хотя и возрас
точного освещения является LhcSR, вызываю
тало, но тоже не столь значительно, как в случае
щий индукцию НФТ и принадлежащий к се
быстрого охлаждения клеток до 0 °C. При этом,
мейству хлорофилл связывающих белков, по
однако, наблюдалось возрастание коэффициен
добных белкам антенны. Мы наблюдали суще
та деэпоксидации, DE, и более значительный
ственный рост уровня экспрессии гена LhcSR в
рост уровня экспрессии гена LhcSR.
ходе низкотемпературной акклимации культуры
клеток L. incisa IPPAS C 2047 (рис. 1), что свиде
тельствует в пользу накопления белка LhcSR в
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
ФСА.
Изменение содержания ненасыщенных жир
Фотоавтотрофная клетка обладает рядом ме
ных кислот. Основную долю пула ЖК (до
ханизмов, позволяющих ей снизить повреждаю
60-70% в сумме), входящих в состав липидов
щее действие избыточного освещения. В зави
L. incisa, составляют НЖК: олеиновая (18 : 1),
симости от условий (интенсивности стрессовых
линолевая (18 : 2), α и γ линоленовые кислоты
факторов, времени их действия и т.п.) разные
(18 : 3), АК (20 : 4). Относительное (по отноше
механизмы могут включаться в общую защит
нию ко всему пулу ЖК) содержание АК в клет
ную реакцию организма. У психротолерантной
ках заметно возрастало (на 40%) в результате
микроводоросли L. incisa IPPAS С 2047, иссле
низкотемпературной акклимации, в то время
дуемой в настоящей работе, реакция ФСА на
как для других перечисленных ЖК достоверных
понижение температуры включала накопление
изменений их относительного содержания в
АК и повышение уровня экспрессии гена LhcSR
клетке не наблюдали.
(которое, как можно предполагать, отражает
Характеристики ФСА клеток L. incisa IPPAS
рост содержания фотопротекторного белка
C 2047, предварительно акклимированных к 5 °C.
LhcSR в хлоропластах L. incisa), но практически
В результате акклимации клеток к температуре
не затрагивала состав пигментов и пигмент бел
0 °C после их предварительной инкубации при
ковых комплексов ФСА. Наблюдаемые нами
5 °C также наблюдалось снижение Fv/Fm и
изменения характерны для ответа клетки на
ET0/RC, однако не столь драматическое (рис. 3).
стрессовые воздействия, независимо от приро
БИОХИМИЯ том 86 вып. 12 2021
АККЛИМАЦИЯ ФОТОСИНТЕТИЧЕСКОГО АППАРАТА L. incisa
1861
ды стрессового фактора, причём накопление АК
Большинство реакций ФСА, участвующих в
характерно для L. incisa, а синтез LhcSR - для
акклимации фотосинтетического организма к
большинства изученных к настоящему времени
условиям светового стресса, не наблюдалось
зелёных водорослей (включая Chlorophyta и
при низкотемпературной акклимации L. incisa
Streptophyta) и многих других таксономических
IPPAS С 2047. Так, ни общее содержание ФСА
групп водорослей [46]. LhcSR является одним из
(в расчёте на вес СБМ), ни соотношение разных
ключевых участников индукции НФТ у низших
пигмент белковых комплексов ФСА (в том чис
растений в ответ на стрессовые воздействия,
ле соотношение антенных комплексов и реакци
причём его высокая активность достигается за
онных центров ФСII и ФСI, которое, как прави
счёт накопления белка путём значительного по
ло, является наиболее заметной реакцией фото
вышения активности транскрипции его гена [8].
синтетической клетки на изменение доступнос
LhcSR зависимый ответ на стресс в ходе эволю
ти световой энергии) не претерпевали достовер
ции наземных растений был замещён PsbS за
ных изменений. Можно предположить, что это
висимым НФТ [9, 47].
связано с относительно низкой интенсивностью
Синтез АК происходит через реакцию деса
освещения (50 мкмоль фотонов × м-2 × с-1), при
турации её предшественника, дигомо γ линоле
которой происходила инкубация культуры кле
новой кислоты (20 : 3). Эта реакция активирует
ток L. incisa в наших экспериментах. Свет такой
ся понижением температуры и лежит в русле об
интенсивности в благоприятных условиях не яв
щей реакции организма на низкую температу
ляется стрессовым фактором и не вызывает пов
ру - десатурации ЖК [48, 49]. Однако в L. incisa
реждений ФСА или активации заметного НФТ
АК является компонентом не только структур
[50]. Однако при охлаждении культуры клеток
ных, но и запасных липидов, и накопление АК в
мы, несомненно, наблюдали световой стресс, о
L. incisa происходит в ответ на разнообразные
чём говорит как снижение фотохимической ак
стрессовые воздействия, препятствующие деле
тивности ФСII и квантового выхода фотоинду
нию клеток и эффективному использованию
цированного транспорта электронов (рис. 1,
световой энергии в ФСА [34]. В результате на
Fv/Em и ET0/RC), так и значительный рост теп
копление АК и других запасных ЖК способ
лового рассеяния поглощённой энергии света в
ствует разгрузке фотосинтетической цепи
фотосинтетической антенне (DI0/RC). С другой
электронного транспорта на её акцепторной
стороны, данные условия действительно могут
стороне и тем самым активирует фотохимичес
быть относительно «мягкими» для клеток водо
кое тушение возбуждённого хлорофилла в фото
росли, и использование лишь одного LhcSR за
синтетической антенне (т.е. тушение за счёт ак
висимого механизма акклимации ФСА (однов
тивации фотохимической реакции разделения
ременно с характерной для низкой температуры
зарядов в реакционном центре ФСII). Следует
десатурацией ЖК) может оказаться наиболее
отметить, что ранее было высказано предполо
«экономным» способом приспособления клет
жение о том, что наряду с этим неспецифичес
ки к стрессовым условиям. В самом деле, синтез
ким влиянием на устойчивость ФСА в условиях
LhcSR, хотя и менее эффективен по сравнению
стресса АК в качестве структурного компонента
с эволюционно более поздним PsbS зависимым
тилакоидной мембраны способствует также по
НФТ, может обойтись гораздо «дешевле» для
вышению активности мембранного фермента
клетки, чем редукция всего ФСА или каких то
виолаксантиндеэпоксидазы (ВДЭ) за счёт соз
его компонентов (например, фотосинтетичес
дания подходящего липидного микроокруже
кой антенны) с их последующим ресинтезом
ния [34]. В свою очередь, ВДЭ обеспечивает от
после прекращения действия стрессоров.
носительно быстрое (в минутной шкале време
ни) образование каротиноида зеаксантина, од
ного из ключевых участников НФТ - универ
ЗАКЛЮЧЕНИЕ
сального механизма защиты от избыточного ос
вещения у оксигенных фототрофных организ
Инкубация микроводоросли L. incisa IPPAS
мов. Несмотря на то что мы не наблюдали за
С 2047 при низкой температуре (0 °C) приводит
метного роста содержания зеаксантина в резуль
к существенному замедлению роста культуры.
тате низкотемпературной акклимации, можно
При неизменной интенсивности света это неиз
предположить, что «превентивное» повышение
бежно должно сопровождаться снижением ско
активности ВДЭ играет роль в быстром накоп
рости расходования продуктов световых реак
лении зеаксантина при более длительной аккли
ций фотосинтеза, перевосстановлением кофак
мации к низкой температуре и (или) происходя
торов фотосинтетической цепи переноса элект
щих на фоне её всплесках интенсивности осве
ронов, возрастанием времени жизни возбуждён
щения.
ных состояний хлорофилла в фотосинтетичес
БИОХИМИЯ том 86 вып. 12 2021
1862
ПТУШЕНКО и др.
кой антенне. Такие изменения в ФСА характер
должительного воздействия стрессовых условий.
ны для светового стресса, т.е. реакции ФСА на
В связи с этим можно предположить возрастание
избыточное освещение. Несмотря на относи
роли других защитных механизмов в ходе более
тельно низкую интенсивность освещения
длительной акклимации культуры клеток
(50 мкмоль фотонов × м-2 × с-1) при инкубации
L. incisa к низкой температуре. С другой сторо
культуры микроводоросли в наших эксперимен
ны, высокая эффективность LhcSR зависимого
тах, она проявляла некоторые характерные чер
НФТ, позволяющая L. incisa хотя бы при относи
ты светового стресса при воздействии низкой
тельно мягких стрессовых условиях обходиться
температуры: снижение активности ФСII, рост
без других, более «дорогостоящих» для клетки
НФТ, повышение уровня экспрессии гена
мер, может являться одной из тех адаптаций, ко
LhcSR. Кроме того, происходило накопление
торые обусловливают её толерантность к низкой
АК, характерное для L. incisa при воздействии
температуре. Эти предположения отчасти под
стрессовых факторов различной природы. В то
тверждаются нашими данными по индукции за
же время при акклимации L. incisa IPPAS С 2047
щитных механизмов у клеток, которые перед ин
к низкой температуре не наблюдалось заметных
кубацией при температуре 0 °C предварительно
изменений в составе пигментов и пигмент бел
были акклимированы к 5 °C и у которых начина
ковых комплексов ФСА, которые можно было
ют проявляться и другие механизмы акклимации
бы ожидать в ответ на изменения интенсивнос
ФСА к низкой температуре.
ти света при неизменной температуре.
Можно предположить наличие следующей
стратегии ответа клетки на воздействие низкой
Финансирование. Работа выполнена при фи
(0 °C) температуры на фоне освещения низкой
нансовой поддержке Российского фонда фунда
интенсивности. Изменение состава пигмент
ментальных исследований (грант № 19 04
белковых комплексов ФСА (в частности, редук
00509).
ция антенных комплексов LHCII) потребовало
Благодарности. Спектрофотометрические
бы деградации значительной части белков ФСА
измерения были выполнены с использованием
при стрессе и их ресинтеза при последующей
оборудования ЦКП «Фенотипирование фото
нормализации условий. Вместо этого более пред
трофных организмов» МГУ имени М.В. Ломо
почтительным путём для клетки может быть со
носова. Авторы благодарны В.А. Макарову и
хранение основной массы белков ФСА в расчёте
К.В. Скулачеву за помощь в техническом обес
на их эффективное использование после норма
печении работы, М.Д. Логачевой и Р.А. Зинов
лизации условий, а обеспечение защиты ФСА -
кину за советы и помощь с обеспечением реак
преимущественно за счёт синтеза лишь одного
тивами и оборудованием.
компонента ФСА, защитного белка (LhcSR),
Конфликт интересов. Авторы заявляют об от
снижающего содержание возбуждённых состоя
сутствии конфликта интересов в финансовой
ний хлорофилла в фотосинтетической антенне.
или какой либо иной сфере.
Такая стратегия может быть результативной в
Соблюдение этических норм. Настоящая
случае: i) высокой эффективности LhcSR зави
статья не содержит описания выполненных ав
симого НФТ, не требующего «помощи» со сторо
торами исследований с участием людей или ис
ны других механизмов, и ii) относительно непро
пользованием животных в качестве объектов.
СПИСОК ЛИТЕРАТУРЫ
1.
Osborne, B. A., and Raven, J. A. (1986) Light absorption
5.
Demmig Adams, B., Cohu, C. M., Muller, O., and
by plants and its implications for photosynthesis,
Adams, III, W. W. (2012) Modulation of photosynthetic
Biol. Rev., 61, 1 60.
energy conversion efficiency in nature: from seconds to
2.
Croce, R., and Van Amerongen, H. (2014) Natural strate
seasons, Photosynth. Res., 113, 75 88.
gies for photosynthetic light harvesting, Nat. Chem. Biol.,
6.
Demmig Adams, B. (1990) Carotenoids and photoprotec
10, 492 501.
tion in plants: a role for the xanthophyll zeaxanthin,
3.
Walla, P. J., Holleboom, C. P., and Fleming, G. R. (2014)
Biochim. Biophys. Acta, 1020, 1 24.
Electronic carotenoid chlorophyll interactions regulating
7.
Garc a Plazaola, J. I., Esteban, R., Fernández Mar n, B.,
photosynthetic light harvesting of higher plants and green
Kranner, I., and Porcar Castell, A. (2012) Thermal energy
algae, Non Photochemical Quenching and Energy Dissipation
dissipation and xanthophyll cycles beyond the Arabidopsis
in Plants, Algae and Cyanobacteria, Springer, p. 229 243.
model, Photosynth. Res., 113, 89 103.
4.
Amarnath, K., Bennett, D. I. G., Schneider, A. R., and
8.
Peers, G., Truong, T. B., Ostendorf, E., Busch, A.,
Fleming, G. R. (2016) Multiscale model of light harvesting
Elrad, D., et al. (2009) An ancient light harvesting protein
by photosystem II in plants, Proc. Natl. Acad. Sci. USA,
is critical for the regulation of algal photosynthesis, Nature,
113, 1156 1161.
462, 518 521.
БИОХИМИЯ том 86 вып. 12 2021
АККЛИМАЦИЯ ФОТОСИНТЕТИЧЕСКОГО АППАРАТА L. incisa
1863
9.
Pinnola, A. (2019) The rise and fall of light harvesting
Parietochloris incisa (Chlorophyta, Trebouxiophyceae),
complex stress related proteins as photoprotection agents
Algal Res., 2, 175 182.
during evolution, J. Exp. Bot., 70, 5527 5535.
27.
Solovchenko, A., Khozin Goldberg, I., Recht, L., and
10.
Verhoeven, A. (2014) Sustained energy dissipation in win
Boussiba, S. (2011) Stress induced changes in optical
ter evergreens, New Phytologist, 201, 57 65.
properties, pigment and fatty acid content of
11.
Jahns, P., and Holzwarth, A. R. (2012) The role of the xan
Nannochloropsis sp.: implications for non destructive
thophyll cycle and of lutein in photoprotection of photo
assay of total fatty acids, Marine Biotechnol., 13, 527 535.
system II, Biochim. Biophys. Acta, 1817, 182 193.
28.
Zarter, C. R., Adams, W. W., Ebbert, V., Cuthbertson, D.
12.
Garc a Plazaola, J. I., Matsubara, S., and Osmond, C. B.
J., Adamska, I., et al. (2006) Winter down regulation of
(2007) The lutein epoxide cycle in higher plants: its rela
intrinsic photosynthetic capacity coupled with up regula
tionships to other xanthophyll cycles and possible func
tion of Elip like proteins and persistent energy dissipation
tions, Funct. Plant Biol., 34, 759 773.
in a subalpine forest, New Phytologist, 172, 272 282.
13.
Lohr, M., and Wilhelm, C. (1999) Algae displaying the
29.
Zarter, C., Adams, W. W., Ebbert, V., Adamska, I.,
diadinoxanthin cycle also possess the violaxanthin cycle,
Jansson, S., et al. (2006) Winter acclimation of PsbS and
Proc. Natl. Acad. Sci. USA, 96, 8784 8789.
related proteins in the evergreen Arctostaphylos uva ursi as
14.
Gilmore, A. M. (1997) Mechanistic aspects of xanthophyll
influenced by altitude and light environment, Plant Cell
cycle dependent photoprotection in higher plant chloro
Environ., 29, 869 878.
plasts and leaves, Physiol. Plant., 99, 197 209.
30.
Huang, W., Zhang, S. B., and Cao, K. F. (2010) The dif
15.
Kaňa, R., Kotabová, E., Kopečná, J., Trsková, E.,
ferent effects of chilling stress under moderate light inten
Belgio, E., et al. (2016) Violaxanthin inhibits nonphoto
sity on photosystem II compared with photosystem I and
chemical quenching in light harvesting antenna of
subsequent recovery in tropical tree species, Photosynth.
Chromera velia, FEBS Lett., 590, 1076 1085.
Res., 103, 175 182.
16.
Holt, N. E., Zigmantas, D., Valkunas, L., Li, X. P.,
31.
Theocharis, A., Clément, C., and Barka, E. A. (2012)
Niyogi, K. K., et al. (2005) Carotenoid cation formation
Physiological and molecular changes in plants grown at
and the regulation of photosynthetic light harvesting,
low temperatures, Planta, 235, 1091 1105.
Science, 307, 433 436.
32.
Los, D. A., Mironov, K. S., and Allakhverdiev, S. I. (2013)
17.
Johnson, M. P., and Ruban, A. V. (2011) Restoration of
Regulatory role of membrane fluidity in gene expression and
rapidly reversible photoprotective energy dissipation in the
physiological functions, Photosynth. Res., 116, 489 509.
absence of PsbS protein by enhanced ΔpH, J. Biol. Chem.,
33.
Watanabe, S., Hirabayashi, S., Boussiba, S., Cohen, Z.,
286, 19973 19981.
Vonshak, A., et al. (1996) Parietochloris incisa comb. nov.
18.
Pinnola, A., Staleva Musto, H., Capaldi, S.,
(Trebouxiophyceae, Chlorophyta), Phycol. Res., 44, 107 108.
Ballottari, M., Bassi, R., et al. (2016) Electron transfer
34.
Zorin, B., Pal Nath, D., Lukyanov, A., Smolskaya, S.,
between carotenoid and chlorophyll contributes to
Kolusheva, S., et al. (2017) Arachidonic acid is important
quenching in the LHCSR1 protein from Physcomitrella
for efficient use of light by the microalga Lobosphaera
patens, Biochim. Biophys. Acta, 1857, 1870 1878.
incisa under chilling stress, Biochim. Biophys. Acta, 1862,
19.
Bonente, G., Pippa, S., Castellano, S., Bassi, R., and
853 868, doi: 10.1016/j.bbalip.2017.04.008.
Ballottari, M. (2012) Acclimation of Chlamydomonas
35.
Strasser, R. J., Tsimilli Michael, M., and Srivastava, A.
reinhardtii to different growth irradiances, J. Biol. Chem.,
(2004) Analysis of the chlorophyll a fluorescence transient,
287, 5833 5847.
Chlorophyll Fluorescence, Springer, p. 321 362.
20.
Kouřil, R., Wientjes, E., Bultema, J. B., Croce, R., and
36.
Folch, J., Lees, M., and Stanley, G. H. S. (1957) A simple
Boekema, E. J. (2013) High light vs. low light: Effect of
method for the isolation and purification of total lipides
light acclimation on photosystem II composition and orga
from animal tissues, J. Biol. Chem., 226, 497 509.
nization in Arabidopsis thaliana, Biochim. Biophys. Acta,
37.
Kates, M. (1986) Techniques of Lipidology; Isolation, Analysis
1827, 411 419, doi: 10.1016/j.bbabio.2012.12.003.
and Identification of Lipids, 2nd Edn., Elsevier, Amsterdam.
21.
Jørgensen, K., and Skibsted, L. H. (1993) Carotenoid
38.
Wellburn, A. R. (1994) The spectral determination of
scavenging of radicals, Zeitschr. Lebensmittel Untersuchung
chlorophylls a and b, as well as total carotenoids, using var
Forschung, 196, 423 429.
ious solvents with spectrophotometers of different resolu
22.
Telfer, A., Dhami, S., Bishop, S. M., Phillips, D., and
tion, J. Plant Physiol., 144, 307 313.
Barber, J. (1994) Beta carotene quenches singlet oxygen
39.
Larsen, E., and Christensen, L. P. (2005) Simple saponifi
formed by isolated photosystem II reaction c enters,
cation method for the quantitative determination of
Biochemistry, 33, 14469 14474.
carotenoids in green vegetables, J. Agricul. Food Chem., 53,
23.
Lichtenthaler, H. K., Babani, F., Navrátil, M., and
6598 6602.
Buschmann, C. (2013) Chlorophyll fluorescence kinetics,
40.
Weaver, E. C. (1968) EPR studies of free radicals in photo
photosynthetic activity, and pigment composition of blue
synthetic systems, Annu. Rev. Plant Physiol., 19, 283 294.
shade and half shade leaves as compared to sun and shade
41.
Caffarri, S., Tibiletti, T., Jennings, R. C., and
leaves of different trees, Photosynth. Res., 117, 355 366.
Santabarbara, S. (2014) A comparison between plant pho
24.
Demmig Adams, B., and Adams, W. W. I. (1996) Chloro
tosystem I and photosystem II architecture and function
phyll and carotenoid composition in leaves of Euonymus
ing, Curr. Prot. Pept. Sci., 15, 296 331.
kiautschovicus acclimated to different degrees of light
42.
Givnish, T. J. (1988) Adaptation to sun and shade: a whole
stress in the field, Funct. Plant Biol., 23, 649 659.
plant perspective, Austr. J. Plant Physiol., 15, 63 92.
25.
Aburai, N., Sumida, D., and Abe, K. (2015) Effect of light
43.
Beneragama, C. K., and Goto, K. (2010) Chlorophyll a: b
level and salinity on the composition and accumulation of
ratio increases under low light in
“shade tolerant”
free and ester type carotenoids in the aerial microalga
Euglena gracilis, Tropic. Agricult. Res., 22, 12 25.
Scenedesmus sp. (Chlorophyceae), Algal Res., 8, 30 36.
44.
Virtanen, O., Khorobrykh, S., and Tyystjärvi, E. (2021)
26.
Solovchenko, A., Solovchenko, O., Khozin Goldberg, I.,
Acclimation of Chlamydomonas reinhardtii to extremely
Didi Cohen, S., Pal, D., et al. (2013) Probing the effects of
strong light, Photosynth. Res., 147, 91 106.
high light stress on pigment and lipid metabolism in nitro
45.
Eismann, A. I., Reis, R. P., da Silva, A. F., and Cavalcanti,
gen starving microalgae by measuring chlorophyll fluores
D. N. (2020) Ulva spp. carotenoids: Responses to environ
cence transients: studies with a Δ5 desaturase mutant of
mental conditions, Algal Res., 48, 101916.
БИОХИМИЯ том 86 вып. 12 2021
1864
ПТУШЕНКО и др.
46. Giovagnetti, V., and Ruban, A. V. (2018) The evolution
48. Sakamoto, T., and Murata, N. (2002) Regulation of the
of the photoprotective antenna proteins in oxygenic
desaturation of fatty acids and its role in tolerance to cold
photosynthetic eukaryotes, Biochem. Soc. Trans., 46, 1263
and salt stress, Curr. Opin. Microbiol., 5, 206 210.
1277.
49. Guschina, I. A., and Harwood, J. L. (2006) Lipids and lipid
47. Gerotto, C., and Morosinotto, T. (2013) Evolution of pho
metabolism in eukaryotic algae, Progr. Lipid Res., 45, 160 186.
toprotection mechanisms upon land colonization: evi
50. Richardson, K., Beardall, J., and Raven, J. A. (1983)
dence of PSBS dependent NPQ in late Streptophyte algae,
Adaptation of unicellular algae to irradiance: an analysis of
Physiol. Plant., 149, 583 598.
strategies, New Phytol., 93, 157 191.
THE EFFECT OF CHILLING ON THE PHOTOSYNTHETIC APPARATUS
OF MICROALGA Lobosphaera incisa IPPAS C 2047
V. V. Ptushenko1,2*, G. N. Bondarenko3, E. N. Vinogradova4,5, E. S. Glagoleva4,
O. V. Karpova4, O. S. Ptushenko4, A. E. Solovchenko4, B.V. Trubitsin6,
O. B. Chivkunova4, K. A. Shibzukhova4, and P. N. Shcherbakov4
1 Belozersky Institute of Physico Chemical Biology, Lomonosov Moscow State University,
119992 Moscow, Russia; e mail: ptush@belozersky.msu.ru
2 Emanuel Institute of Biochemical Physics, Russian Academy of Sciences, 119334 Moscow, Russia
3 Faculty of Chemistry, Lomonosov Moscow State University, 119991 Moscow, Russia
4 Faculty of Biology, Lomonosov Moscow State University, 119991 Moscow, Russia
5 National Research Center “Kurchatov Institute”, 123182 Moscow, Russia
6 Faculty of Physics, Lomonosov Moscow State University, 119991 Moscow, Russia
Photosynthetic organisms have developed a set of mechanisms aimed at preventing photo oxidative reactions in the
photosynthetic apparatus (PSA) initiated by excessively absorbed light energy. Along with high irradiance, other stres
sors, e.g., chilling temperatures can lead to the formation of the excess light energy and hence to photo oxidative
stress. The induction of photoprotective mechanisms in response to chilling (0 °C) at a low irradiance (50 μmol PAR
photons × m-2 × s-1) in the microalga Lobosphaera incisa IPPAS C 2047 cells was studied. After 4 days of incubation
at a low temperature, L. incisa IPPAS C 2047 revealed a notable decrease in the photochemical activity of photosys
tem II (PSII) and in the efficiency of photosynthetic electron transport as well as a significant increase in the thermal
dissipation of the absorbed light energy in the photosynthetic antenna. In contrast, most of the conventional markers
of the PSA acclimation to excess light energy, including the total chlorophyll and carotenoid content, violaxanthin
cycle pigments content and their deepoxidation, as well as the photosynthetic antennas, PSII and photosystem I (PSI)
complexes ratio remained practically unchanged. The content of the major unsaturated fatty acids also remained
almost unchanged, except for arachidonic acid (increased by 40%) recently assumed to activate the violaxanthin
deepoxidase by adjusting its lipid microenvironment. Significant changes were observed in the protective protein
LhcSR gene expression (4 7 fold increase was observed). Pre conditioning at 5 °C prior to subsequent acclimation to
0 °C had a positive effect on the PSA photochemical activity. The obtained data show that mid term (4 days last) accli
mation of L. incisa IPPAS C 2047 to a positive low temperature at low irradiance leads to PSA response partly typi
cal for high light response. At the same time, the main photoprotective PSA mechanism activated under these condi
tions is the protein (LhcSR) dependent quenching of excitation in the photosynthetic antenna.
Keywords: high light stress, low temperature acclimation, fatty acids desaturation, arachidonic acid, thermal dissipa
tion of light energy, LhcSR, microalgae
БИОХИМИЯ том 86 вып. 12 2021