БИОХИМИЯ, 2021, том 86, вып. 2, с. 158 - 174
УДК 551.464.796+616.12
БЕЛОК КЛОТО И СЕРДЕЧНО СОСУДИСТАЯ СИСТЕМА*
Обзор
© 2021
И.Н. Тюренков1, В.Н. Перфилова1**, А.А. Нестерова2, Е.Ю. Глинка3
1 Федеральное государственное бюджетное образовательное учреждение высшего образования «Волгоградский
государственный медицинский университет» Министерства здравоохранения Российской Федерации,
400066 Волгоград, Россия; электронная почта: vnperfilova@mail.ru; vnperfilova@gmail.com
2 Федеральное государственное бюджетное образовательное учреждение высшего образования
«Пятигорский медико3фармацевтический институт» - филиал «Волгоградского государственного
медицинского университета» Министерства здравоохранения Российской Федерации, 357500 Пятигорск, Россия
3 Keenan Research Centre, St. Michael’s Hospital, Toronto, Canada
Поступила в редакцию 11.04.2020
После доработки 20.08.2020
Принята к публикации 08.09.2020
Белок клото влияет на многие метаболические процессы, играющие важную роль в развитии сердечно
сосудистых заболеваний. Он способен подавлять процессы перекисного окисления липидов, воспаление,
предупреждать повреждение эндотелия, кальцификацию сосудов, повышение их ригидности, угнетать
фиброзирование сердца. Уровень его экспрессии при многих заболеваниях снижается. Молекулярные ме
ханизмы, посредством которых клото осуществляет кардиопротекторное действие, основаны на его взаимо
действии с рядом рецепторов и ионных каналов. Плейотропность этого белка делает его потенциальной ми
шенью в терапии сердечно сосудистых заболеваний. В настоящем обзоре также приведены данные о лекар
ственных препаратах, стимулирующих экспрессию белка клото, и рассмотрены перспективы дальнейших
исследований.
КЛЮЧЕВЫЕ СЛОВА: белок клото, сердечная недостаточность, ишемическая болезнь сердца, кардиомио
патии, артериальная гипертензия.
DOI: 10.31857/S0320972521020020
ВВЕДЕНИЕ
отдаленных последствий ведется поиск терапев
тически значимых мишеней, среди которых
Сердечно сосудистые заболевания (ССЗ)
особое внимание привлекают те, что задейство
остаются основной причиной ранней инвали
ваны в различных патогенетических механиз
дизации и преждевременной смертности насе
мах. С этой точки зрения заслуживает особого
ления. В основе ССЗ лежит множество патоге
внимания многофункциональный белок клото,
нетических механизмов, и их список продолжа
участвующий во многих метаболических про
ет расти. Поэтому для улучшения результатов
цессах. В обзоре представлены данные, свиде
профилактики и лечения ССЗ, минимизации их
тельствующие о значимой роли белка клото в
регуляции различных функций, сопряженных с
Принятые сокращения: АФК - активные формы физиологией и патологией сердечно сосудистой
кислорода; ИБС - ишемическая болезнь сердца; мРНК - системы, таких как предотвращение окисли
матричная рибонуклеиновая кислота; т.п.н. - тысяч пар
тельного стресса и повреждения эндотелия,
нуклеотидов; ХБП - хроническая болезнь почек; Akt -
протеинкиназа В; eNOS - эндотелиальная NO синтаза;
влияние на электрическую активность, ремоде
FGF - фактор роста фибробластов; FGFR - рецептор
лирование сердца и сосудов, развитие ишеми
фактора роста фибробластов; HUVECs - эндотелиальные ческой болезни сердца, артериальной гипер
клетки пупочной вены человека; IGF - инсулиноподоб
тонии, сердечной недостаточности и других.
ный фактор роста; MAPK - митоген активируемая протеин
киназа; NF κB - ядерный фактор каппа би; NO - оксид
азота; PI3K - фосфатидилинозитол 3 киназа; SОD - су
пероксиддисмутаза; TGF - трансформирующий фактор
СТРУКТУРА, ФУНКЦИИ
роста; TNF α - фактор некроза опухолей.
И ЛОКАЛИЗАЦИЯ БЕЛКА КЛОТО
* Первоначально английский вариант рукописи опубли
msu.ru/biokhimiya, в рубрике «Papers in Press», BM20 098,
Kl (известный как α клото или просто клото)
21.12.2020.
первоначально был идентифицирован Kuro O
** Адресат для корреспонденции.
et al. (1997) [1] как ген мыши, продукт которого
158
БЕЛОК КЛОТО, СЕРДЦЕ И СОСУДЫ
159
препятствует старению. У человека ген клото на
дился. Однако внеклеточные домены клото взаи
ходится на хромосомном бэнде 13q13.1, состоит
модействуют с другими рецепторными белками
из 50 т.п.н. и включает пять экзонов. Он экспрес
и образуют комплексы с лигандами, модифици
сируется в разных органах и тканях: основное
руя функцию этих рецепторов. Влияние этого
количество KL и его продукта обнаруживается в
взаимодействия на физиологию клетки опреде
почках и, существенно меньшее - в простате,
ляется типом рецептора и уровнем его экспрес
легких, печени, скелетных мышцах, аорте, ост
сии в данной ткани.
ровках поджелудочной железы и мозге. Его па
Экспериментально установлено, что α клото
ралог KLB (β клото) находится на 4 й хромосоме
связывается непосредственно с рецепторами
и имеет очень близкую структуру и размер. Ос
фактора роста фибробластов FGFR1c и FGFR4,
новным источником KLB в организме человека
инсулиноподобного фактора роста IGF1, рецеп
является жировая ткань. Некоторое его количе
тором второго типа трансформирующего факто
ство синтезируется в легких и поджелудочной
ра роста TGF β1, а также с Wnt. В случае с
железе, однако соответствующая мРНК найдена
FGFR1c и FGFR4 клото выполняет функцию
во многих тканях, в том числе в скелетных мыш
корецептора и вызывает переключение специ
цах, аорте, сердце. Оба гена благодаря альтерна
фичности рецептора и многократное увеличе
тивному сплайсингу кодируют и мембранные, и
ние его сродства к эндокринному фактору роста
секретируемые белки [2]. Третий член семейства
фибробластов FGF23 в противовес каноничес
клото кодируется геном LCTL - этот трансмемб
ким FGF1-FGF20, связывание которых с ре
ранный лактазоподобный белок (lactase like pro
цепторами зависит от гепарина. Структурный
tein) имеет альтернативные названия γ клото
анализ показывает, что α клото взаимодейству
или клото/лактазо флоризингидролазоподоб
ет одновременно с карбоксильным концом
ный белок (англ. абб. KLPH от klotho/
FGF23 и с доменом D3 FGFR1c, стабилизируя
lactase phlorizin hydrolase related protein). Ген
тройной комплекс и выполняя роль каркасного
LCTL находится на 15 й хромосоме и экспресси
белка. Карбоксильный конец FGF23 содержит
руется в большинстве органов примерно на од
мотив RXXR, который отвечает за связывание
ном уровне. Самое значительное его количество
FGF23 с димером FGFR1c-клото. Активность
обнаружено в ткани яичек. При сравнении уров
комплекса зависит от связи с гепарансульфатом,
ня экспрессии паралогов клото на первом месте
обязательным кофактором паракринной пере
оказался KL, а самый низкий уровень зафикси
дачи сигналов FGF. Три остатка аспарагиновой
рован у LCTL [1, 2, 3, 4, 5]. Таким образом, в ге
кислоты и один остаток цистеина в молекуле
номе млекопитающих закодировано 3 члена се
α клото координируют ион цинка. Связывание
мейства клото, они представляют собой транс
белка в комплексе меняет его конформацию и
мембранные белки различной длины [6].
исключает возможность его ферментативной
α и β клото состоят из двух внеклеточных
активности [7]. При взаимодействии с α клото
субдоменов (KL1 и KL2), каждый длиной около
кардинально изменяются физиологические
450 аминокислот, а также трансмембранного и
последствия стимуляции FGFR1. Сигнальный
внутриклеточного доменов с карбоксильным
путь, активируемый связыванием канонических
концом. γ Клото, в отличие от своих паралогов,
FGF в отсутствие α клото, включает димериза
состоит из 567 аминокислот и содержит только
цию и аутофосфорилирование рецептора, акти
один внеклеточный домен KL1. Внеклеточные
вацию его субстрата, ERK1/2 и Akt, а также
домены высоко гомологичны β глюкозидазам,
Ras/MAPK [8]. Он участвует в органогенезе,
гидролизующим связи в сахаридах, гликопротеи
дифференцировке клеток, способствует их про
нах и гликолипидах. Клото принадлежит к се
лиферации и миграции, кооперируется с
мейству гликозид гидролаз 1, хотя необходимые
TGF β1, Notch и неканоническими сигнальны
для гидролазной активности остатки глутамата в
ми путями Wnt [9]. В отличие от описанного вы
его активном центре отсутствуют. Очень корот
ше канонического пути тройной комплекс эндо
кий внутриклеточный домен клото (21 амино
кринного FGF23 с FGFR1c и α клото контро
кислота в α клото и 24 в β клото) исключает
лирует гомеостаз кальция и неорганического
возможность осуществления самостоятельной
фосфата, регулирует метаболизм витамина Д.
передачи сигнала и не содержит PDZ доменов
Сигнальный механизм, активированный обра
или мотивов, связывающих известные адаптер
зованием тройного комплекса, включает каскад
ные белки. В силу описанной структуры незави
Ras/MAPK, характерный для клеток, экспрес
симая рецепторная активность мембраносвя
сирующих α клото. Связывание FGF23 с кардио
занного клото маловероятна. Насколько нам из
миоцитами, не синтезирующими α клото, нап
вестно, поиск клото связывающих белков с
ротив, приводит к активации фосфолипазы
применением двугибридной системы не прово
PLCγ, кальциневрина и NFAT [10].
БИОХИМИЯ том 86 вып. 2 2021
160
ТЮРЕНКОВ и др.
Кроме этого, описаны FGFR независимые
как гуморальные факторы с плейотропной ак
сигнальные пути α клото. Взаимодействие раст
тивностью или действующие локально по ауто
воримого клото с Wnt и рецептором TGF β RII
кринно паракринному механизму. Они осущест
ингибирует соответствующие канонические
вляют передачу сигналов факторов роста, регу
сигнальные пути Wnt/β катенина и TGF β1/
лируют ионный гомеостаз и подавляют окисли
SMAD2, предотвращая развитие фиброза
тельный стресс, то есть выполняют протектор
[11-13]. Связывание α клото с рецептором
ную функцию [26]. Клетки, которые способны
инсулина/IGF1 предотвращает активацию его
связывать растворимый клото, должны экспрес
субстратов (insulin receptor substrate IRS1, IRS2)
сировать один или несколько из упомянутых
и пути PI3K/Akt [14, 15].
выше рецепторов или иметь на своей поверх
Помимо этого, многие эффекты α клото
ности сиаловые кислоты. Форма клеточного от
обусловливаются глюкозидазной или сиалидаз
вета зависит от типов рецепторов, преимущест
ной активностью его внеклеточных субдоменов
венно экспрессируемых данной клеткой. По
[16-18]. Структурные исследования показыва
видимому, все ткани млекопитающих содержат
ют, что растворимый клото связывается с α2 3
эти рецепторы в том или ином наборе и, соответ
сиалил лактозной частью ганглиозидов липид
ственно, могут реагировать на гормональные
ных рафтов за счет смещения петли β6α6. Это
сигналы, переносимые растворимым α клото.
происходит независимо от FGF23 и FGFR [18].
Существует две противоположные точки
Удаление сиаловых кислот с гликопротеинового
зрения на функциональные различия между
компонента ионных каналов влияет на присут
растворимой и мембраносвязанной формами
ствие и локализацию последних на мембране,
α клото. Так, считается, что корецепторную
интенсивность ионного транспорта [16-19]. Ре
функцию по отношению к FGF23 выполняет
гуляция активности ионных каналов играет
только мембраносвязанная форма [27, 28]. В
важную роль в функционировании сердечно
этом случае его действие ограничено клото
сосудистой системы.
экспрессирующими клетками. Однако в других
Подобно своему паралогу, β клото меняет
работах признается способность растворимого
физиологическую функцию FGFR: эндокрин
клото связываться с рецепторами FGF [29]. Не
ные FGF15/19 или FGF21 в комплексе с FGFR
давнее структурное исследование показало, что
и β клото регулируют уровень глюкозы, тригли
в формировании тройного комплекса участвует
церидов, холестерина. FGF19 и β клото, связы
растворимый клото [7] и, следовательно, его
ваясь с FGFR4, участвуют в гомеостазе желчных
гормональное действие может проявляться в
кислот. Так, у мышей, дефицитных по FGF15,
любых тканях, экспрессирующих рецепторы
β клото или FGFR4, наблюдается повышенная
FGF. С нашей точки зрения, вопрос о различиях
экспрессия Cyp7α1 и увеличение синтеза желч
между растворимой и мембраносвязанной фор
ных кислот в печени [20]. В кардиомиоцитах,
мами клото остается открытым, поскольку пока
экспрессирующих β клото и FGFR1, связыва
неясны причины указанных разногласий.
ние FGF21 с этим рецептором приводит к акти
Субдомены KL1 и KL2 функционально раз
вации путей PI3K/Akt, AMPK, ERK1/2 и ROR α
личаются, несмотря на значительное структур
и обеспечивает защиту от ишемии [21]. Струк
ное сходство. Так, растворимый клото, включа
турные исследования показывают, что FGF21
ющий в себя полный внеклеточный домен, т. е.
связывается с обоими внеклеточными субдоме
и KL1, и KL2, способен ингибировать сигналь
нами β клото, затем этот комплекс присоединя
ные пути IGF1 и bFGF и связывать FGF23. В от
ется к FGFR1c, и образовавшиеся тройные
личие от него, фрагмент, содержащий только
комплексы димеризуются [22]. Карбоксильные
KL1, не влияет на FGF23 [30]. KL2 не взаимо
концы FGF21 и FGF19 связываются с одним и
действует с путями IGF1 и bFGF, но необходим
тем же участком β клото [23].
для функционирования FGF23 [14]. Эти разли
Внеклеточный домен отщепляется мембран
чия подтверждаются структурными исследова
ными металлопротеиназами ADAM10 и
ниями [22]. Отметим, что представленные дан
ADAM17, активность которых регулируется их
ные относятся к растворимым формам клото, и,
фосфорилированием [18, 24, 25]. Участок между
следовательно, сигнальные пути IGF1 подвер
KL1 и KL2 содержит четыре аминокислоты
жены его гормональному действию. Он также
(Lys Lys Arg Lys), которые образуют потенци
взаимодействует с Wnt, рецепторами TGF β1,
альный сайт для протеолиза [26]. Растворимая
липидными рафтами и ионными каналами.
форма включает отщепленные при участии
Данные об индивидуальной роли KL1 и KL2 ог
ADAM10 и ADAM17 три продукта - полный
раничены, а о возможности отщепления раство
внеклеточный домен, содержащий KL1 и KL2,
римой формы γ клото можно судить только по
только KL1 или только KL2, функционирующие
аналогии с двумя другими формами.
БИОХИМИЯ том 86 вып. 2 2021
БЕЛОК КЛОТО, СЕРДЦЕ И СОСУДЫ
161
Секретируемый α клото образуется путем
рост сетчатки, а также дифференцировку и рост
альтернативного сплайсинга. Этот белок имеет
хрусталика у рыбок данио [36] и кур [37]. Спо
молекулярный вес 65 кДа, близкий к весу KL1
собность FGF15/19 передавать сигналы через
(70 кДа), и содержит дополнительный мотив из
комплекс γ клото - FGFR свидетельствует о его
десяти аминокислот. Аналогично KL1 и KL2 он
участии в регуляции этих процессов, а экспрес
подавляет воспаление, препятствует клеточному
сия FGFR тканями сердечно сосудистой систе
старению и контролирует минеральный обмен
мы создает возможности для этого взаимодей
[26, 31]. Однако некоторые авторы считают сом
ствия.
нительной независимую роль секретируемой
формы и наличие ее в крови [32]. В недавней ра
боте Xu и Sun [33] было показано, что корот
АНТИОКСИДАНТНОЕ И
кий фрагмент α клото, идентичный секретируе
ЭНДОТЕЛИОПРОТЕКТОРНОЕ
мому, введенный в клетки HEK293 и IMCD
ДЕЙСТВИЕ КЛОТО
(англ. абб. от inner medullary collecting duct) с по
мощью трансфекции, экспрессировался в них,
Окислительный стресс лежит в основе мно
связывался с S формилглутатионгидролазой
гих патологических состояний, при которых
(FGH) и регулировал ее активность. Этот белко
клеточная антиоксидантная защита работает не
вый комплекс находился в цитоплазме и окру
эффективно. Это справедливо в отношении за
жал ядро. Отметим, что при всей значимости
болеваний воспалительной природы, дисфунк
данного открытия физиологическая роль секре
ции эндотелия, гипертонии [38], атеросклероза
тируемой формы α клото остается под вопро
[39]. Антиоксидантные свойства белка α клото
сом, поскольку естественный уровень экспрес
продемонстрированы в многочисленных иссле
сии этой формы существенно ниже, чем в
дованиях. Выявлено, что он повышает жизне
представленном исследовании. Показано, что
способность эндотелиальных клеток пуповин
растворимый α клото внутри клетки связывает
ной вены человека (англ. абб. HUVECs от human
ся с шаперонами 60 и 70 или рибосомными бел
umbilical vein endothelial cells) в условиях окис
ками. Учитывая, что они облегчают свертыва
лительного повреждения, вызванного H2O2,
ние и посттрансляционную модификацию мно
способствует увеличению в них активности ан
гих белков, мы уже сейчас можем говорить о его
тиоксидантных ферментов (супероксиддисму
участии в регуляции трансформации и гомео
тазы (SOD), каталазы и гемоксигеназы 1 (HO 1))
стаза последних, хотя это требует дальнейшего
и, соответственно, инактивации реактивных
изучения [33].
кислородных радикалов. Кроме того, α клото
Очевидно, что для осуществления таких
снижает скорость апоптоза в эндотелиальных
функций требуется присутствие α клото в ци
клетках, в результате чего повышается секреция
топлазме, возможно за счет его эндоцитоза, что
оксида азота (NO) и улучшается вазодилатирую
также нуждается в дополнительных исследова
щая и антитромботическая функции эндотелия.
ниях. Аналогичные наблюдения растворимого
Антиоксидантная защита осуществляется за
α клото нам неизвестны и сравнить свойства
счет активации под влиянием α клото пути
всех укороченных форм этого белка в одинако
PI3K/Akt (фосфатидилинозитол 3 киназа/про
вых условиях мы пока не можем.
теинкиназа B) и увеличения экспрессии Nrf2
γ Клото образует комплексы с FGFR1b,
(транскрипционного фактора - ключевого ре
FGFR1c, FGFR2c, FGFR4 и может функциони
гулятора систем клеточной защиты, запускаю
ровать в качестве корецептора для FGF19 в
щего в условиях окислительного стресса
культивируемых клетках [34]. Структурные ис
экспрессию генов, кодирующих белки анти
следования этих комплексов пока не проводи
оксидантной защиты) [28].
лись. Данные о роли γ клото в сердечно сосу
Вопрос о взаимоотношении α клото и сиг
дистой системе также пока отсутствуют, но этот
нального пути PI3K/Akt не до конца ясен. Так,
белок отвечает за ряд важных функций в других
связываясь c рецепторами к инсулину и IGF 1
органах. Так, выявлено, что FGF15/19 вызывает
(insulin like growth factor 1), клото повышает ус
потерю веса у мышей с ожирением, активируя
тойчивость к окислительному стрессу через ин
термогенез в бурой жировой ткани [35]; регули
гибирование сигнального каскада инсулин (или
рует уровень экспрессии эфрина A3 и эфрина
IGF 1)/PI3K/Akt. В результате этого предотвра
A4b в развивающейся сетчатке, что определяет
щается фосфорилирование фактора транскрип
ее назально темпоральную дифференцировку,
ции FOXO1 (forkhead box protein O1), он стано
необходимую для корректной передачи инфор
вится активным и переносится в ядро, где на
мации в высшие зрительные центры растущими
прямую связывается с промотором и усиливает
аксонами ганглиозных клеток; контролирует
экспрессию гена SOD2, кодирующего митохон
2 БИОХИМИЯ том 86 вып. 2 2021
162
ТЮРЕНКОВ и др.
дриальную Mn зависимую супероксиддисмута
окислительный стресс, индуцированный
зу [40]. Вероятно, клото способен активировать
Ox LDL в HUVECs, активируя SOD1 и синтез
FOXO1 не только посредством ингибирования
NO, которые нейтрализуют реактивные кисло
Akt, но и подавляя активность сыворотка и
родные радикалы. Это происходит за счет акти
глюкокортикоид индуцируемой киназы (англ.
вации сигнального пути PI3K/Akt/eNOS и по
абб. SGK от serum and glucocorticoid inducible
давления экспрессии рецепторов Ox LDL [48].
kinase), а также стимулируя c Jun N терминаль
Обращает на себя внимание очевидное проти
ные киназы (JNKs). SGK, как и Akt, является
воречие: в одном случае клото активирует, а в
компонентом пути инсулин/PI3K. Вызванное
другом - ингибирует PI3K/Akt. В данном контек
ею фосфорилирование FOXO1 и FOXO3 увели
сте можно указать на то, что α клото подавляет
чивает их ассоциацию с регуляторными белками
активность сигнального пути IGF1/PI3K/Akt, в
14 3 3, приводит к перемещению FOXO из ядра
результате чего повышается экспрессия SOD2.
в цитоплазму, результатом чего является его
С другой стороны, клото не ингибирует
транскрипционная инактивация [41]. Таким об
PI3K/Akt при стимуляции других рецепторов,
разом, и в этом случае блокада рецепторов инсу
например FGFR. При этом активируются аль
лина белком α клото должна способствовать ог
тернативные защитные механизмы с участием
раничению окислительного стресса. JNK, в
Cu/Zn SOD, eNOS, гемоксигеназы. Таким об
свою очередь, напрямую взаимодействует с
разом, можно заключить, что клото гибко регу
FOXO. Индукция JNK способствует ядерной ло
лирует несколько альтернативных антиоксидант
кализации указанных факторов транскрипции,
ных механизмов.
и ее ингибирование приводит к снижению
Выше мы уже упоминали, что секретируе
экспрессии генов мишеней FOXO1 [42, 43]. По
мый α клото, содержащий KL1 и дополнитель
казано также, что стимуляция сигналов
ный пептидный мотив, непосредственно связы
PI3K/Akt может ингибировать индуцированную
вается с S формилглутатионгидролазой (FGH),
стрессом и цитокинами активацию JNK [44].
ключевым ферментом синтеза антиоксиданта
Таким образом, α клото, взаимодействуя с ре
глутатиона (GSH), активирует сам фермент и
цептором инсулина, ингибирует PI3K/Akt и
экспрессию его гена, влияя на транскрипцион
способствует активации JNK и FOXO1. JNK так
ный фактор Kid3 в культивируемых клетках
же может фосфорилировать белки 14 3 3, что
HEK293 и IMCD, а также в почках мыши.
вызывает высвобождение и активацию связан
Функциональное взаимодействие молекулы
ных с ними FOXO [45]. Кроме того, JNK фосфо
α клото и FGH становится возможным благода
рилирует FOXO4 в положениях Thr447 и Thr451,
ря процессу посттрансляционной модификации
вызывая их перемещение в ядро и экспрессию
первого - N гликозилированию аминокислот
SOD [46]. Интересно, что компонент сигналь
ного остатка аспарагина Asn285. Ингибирова
ного пути Wnt β катенин способен образовы
ние гликозилирования или замена аспарагина
вать комплексы с FOXO1 и усиливать его тран
(Asn) на аланин (Ala) в 285 м положении приво
скрипционную активность [47].
дила к потере антиоксидантной активности
Об антиоксидантном действии α клото сви
α клото. Можно предположить, что N гликози
детельствует работа Yao et al. (2017) [48], в кото
лирование в 285 м сайте является ключевым ме
рой было показано, что предварительная инку
ханизмом, определяющим активность белка, и
бация с рекомбинантным белком повышала
N гликановые фрагменты нужны для взаимо
жизнеспособность HUVECs, подвергнутых
действия с FGH [33]. Как мы уже упоминали,
действию окисленных липопротеинов низкой
α клото был обнаружен вместе с FGH в цито
плотности (англ. абб. Ox LDL от oxidized low
плазме, где функции его практически не иссле
density lipoprotein) и окислительному стрессу.
дованы. Эти вопросы ожидают своего изучения.
Под влиянием α клото повышалась активность
Дальнейшие исследования сигнальных пу
цитоплазматической Cu/Zn зависимой супер
тей с участием клото помогут лучше понять ме
оксиддисмутазы (SOD1), экспрессия PI3K, Akt,
ханизмы, с помощью которых белок повышает
эндотелиальной NO синтазы (eNOS) и продук
устойчивость к окислительному стрессу и, в ко
ция NO. При этом снижались содержание мало
нечном итоге, подавляет старение и патологи
нового диальдегида (МДА), синтез активных
ческие процессы, в которых АФК играют веду
форм кислорода (АФК), экспрессия индуци
щую роль [40].
бельной NO синтазы (iNOS), активность
Установлено, что клото связан с поддержа
Gp91(phox) (гем связывающей субъединицы
нием целостности эндотелия, увеличением вы
NADPH оксидазы, генерирующей супероксид
работки эндотелиального оксида азота и улуч
анион) и лектин подобных рецепторов Ox LDL.
шением эндотелий зависимой вазодилатации. В
Результаты показывают, что α клото ослабляет
экспериментах на HUVECs обнаружено, что ин
БИОХИМИЯ том 86 вып. 2 2021
БЕЛОК КЛОТО, СЕРДЦЕ И СОСУДЫ
163
кубация их с уремическим токсином индоксил
ти ERK1/2 [55]. Антагонистические взаимоот
сульфатом (IS) вызывает высвобождение боль
ношения между α клото и фактором тран
шого количества АФК, повышение экспрессии
скрипции NF κB, активирующим воспалитель
моноцитарного хемоаттрактантного белка
1
ные реакции, детально рассмотрены в работе
(англ. абб. MCP 1 от monocyte chemoattractant
Нестеровой и соавт. [13]. По видимому, систем
protein 1), снижение жизнеспособности клеток
ная терапия α клото способна оказывать проти
и подавление выработки оксида азота, что сви
вовоспалительное действие [56], которое может
детельствует о развитии дисфункции эндотелия.
проявляться во взаимодействии эндотелия и
При этом в клетках отмечено повышение актив
клеток иммунной системы. Эта тема представ
ности p38 митоген активируемой протеинкина
ляет значительный научный и клинический ин
зы (англ. абб. p38MAPK от p38 mitogen activated
терес. Обобщая сказанное выше, можно утверж
protein kinase), обусловленное ее фосфорилиро
дать, что в основе защитного действия α клото
ванием, и ядерная транслокация провоспали
на эндотелий лежат его антиоксидантные и про
тельного фактора транскрипции NF κB. Пред
тивовоспалительные свойства, а также способ
варительная обработка белком α клото способ
ность регулировать гомеостаз кальция.
ствует выживанию клеток и усилению синтеза
NO, уменьшению накопления АФК и сниже
нию экспрессии MCP 1, а также предотвращает
БЕЛОК КЛОТО И ИШЕМИЧЕСКАЯ
активацию p38MAPK и NF κB в HUVECs. Та
БОЛЕЗНЬ СЕРДЦА
ким образом, α клото предупреждает дисфунк
цию эндотелия, вероятно, частично за счет ин
Сегодня ученые продолжают работать над
гибирования накопления АФК и активности
расшифровкой молекулярных основ патогенеза
p38MAPK, а также нижестоящего участника
ССЗ, в частности ишемической болезни сердца
сигнального каскада NF κB [49, 50]. Антаго
(ИБС). Белок клото в этом смысле представляет
низм между α клото и NF κB проявляется на
несомненный интерес. Ряд авторов отметили
разных уровнях клеточных процессов, в част
зависимость между концентрацией его в плазме
ности, на уровне активации NF κB и
крови и риском развития ИБС [53, 57]. При об
FOXO1 [51].
следовании 3555 пациентов со стабильной ИБС
Циркулирующий α клото способствует нор
с фракцией выброса левого желудочка > 40%,
мализации эндотелий зависимой вазодилата
включенных в исследование PEACE (трандо
ции, предотвращению апоптоза и улучшению
лаприл против плацебо), выявлено, что низкая
регенерации эндотелия. Он поддерживает целост
концентрация α клото связана с повышенной
ность слоя эндотелиальных клеток и снижает
частотой смерти от сердечно сосудистых забо
проницаемость сосудов путем связывания с
леваний или госпитализации по поводу сердеч
Ca2+ каналами TRPC1 (transient receptor potential
ной недостаточности. После многопараметри
channels) и рецепторами фактора роста эндоте
ческой корректировки клинических перемен
лия сосудов 2 (англ. абб. VEGFR 2 от receptors
ных и биомаркеров (скорость клубочковой
for vascular endothelial growth factor 2). Комплекс
фильтрации, концентрация цистатина C, соот
интернализуется в ответ на стимуляцию VEGF,
ношение альбумина и креатинина в моче, кон
регулируя таким образом приток Ca2+ в клетку
центрации FGF23, тропонина T, про натрий
[52, 53], в то время как α клото ингибирует фос
уретического N концевого пептида B типа, C ре
форилирование рецептора VEGF [54] и пред
активного белка) корреляция сохранялась. Ком
отвращает его эндоцитоз. У мышей с дефицитом
бинация низкой концентрации α клото и высо
клото эндотелий сосудов обладает повышенной
кой концентрации FGF23 повышала риск смер
проницаемостью из за усиленного апоптоза,
ти или госпитализации при ИБС [58]. Это соот
пониженной экспрессии кадгерина эндотелия
ношение концентраций обоих белков, по види
сосудов и гиперактивности Ca2+ зависимого
мому, благоприятно для проявления клото не
кальпаина/каспазы 3 [52, 53], а также, по види
зависимой активности FGF23. Представление о
мому, высокой сигнальной активности VEGF.
его самостоятельных эффектах неоднозначно.
Растворимый α клото обладает противовос
Показано, что FGF23 способствует развитию
палительным действием, подавляя активацию
гипертрофии левого желудочка (ГЛЖ) в равной
NF κB и снижая экспрессию индуцированных
степени как у гомозиготных нокаутных Kl/ мы
фактором некроза опухолей TNF α молекул ад
шей, так и у животных дикого типа [59]. Однако
гезии ICAM 1 и VCAM 1 в эндотелии [53]. Тран
у гетерозиготных нокаутных мышей Kl+/ FGF23
скрипция α клото при воспалительных процес
повышается в меньшей степени, и ГЛЖ менее
сах подавляется цитокином интерлейкином
выражена, чем у гомозиготных. Хотя авторы
IL 1β при одновременном снижении активнос
объясняют это дозозависимым эффектом, мож
БИОХИМИЯ том 86 вып. 2 2021
2*
164
ТЮРЕНКОВ и др.
но говорить и о защитном действии α клото
активности сердца, играющие существенную
[59]. Кроме того, Xie et al. (2015), наоборот, счи
роль в координации сердцебиения [67], реполя
тают, что дефицит последнего, а не повышен
ризации сердца и участвующие в возбуждении
ный уровень FGF23, вызывает гипертрофию
миокарда ненормальным путем на фоне гипер
сердца. У гетерозиготных мышей с хронической
трофии. Это указывает на возможную положи
болезнью почек (ХБП) уровень сывороточного
тельную роль α клото в регуляции активности
фосфата и FGF23 не влиял на развитие ГЛЖ,
сердца и на перспективы терапевтического ис
ситуация изменялась только при введении экзо
пользования этого белка.
генного α клото [60]. У человека в настоящее
время невозможно четко определить, что явля
ется причиной ГЛЖ - дефицит α клото или по
ВОЗМОЖНАЯ РОЛЬ КЛОТО В РАЗВИТИИ
вышение FGF23, в том числе и в связи с тем, что
АРТЕРИАЛЬНОЙ ГИПЕРТЕНЗИИ
до сих пор нет надежных методов определения
растворимого клото.
Одним из факторов риска развития артери
Выявлено также, что дефицит α клото мо
альной гипертензии является повышение жест
жет приводить к нарушению неоваскуляриза
кости (ригидности) артерий, отражением кото
ции, вызванной ишемией, сверхэкспрессии ин
рого служит показатель скорости пульсовой
гибитора активатора плазминогена 1, который
волны [68]. У пациентов с гипертонией и повы
стимулирует фиброзные процессы, ведет к дис
шенной жесткостью сосудов наблюдается пони
функции синоатриального узла и внезапной
жение уровня циркулирующего α клото на 45%
сердечной смерти [53].
[69]. Недостаток α клото, вероятно, является
Ишемия/реперфузия активирует генерацию
важным фактором, который способствует воз
митохондриальных АФК, окислительное пов
никновению артериальной ригидности, что иг
реждение и гибель кардиомиоцитов [61]. Разви
рает существенную роль в патогенезе гипер
вающийся окислительный стресс вызывает дис
тонии, т.к. экспериментальный гаплодефицит
функцию эндотелия. В этой связи можно пред
белка у мышей (Kl+/ ) вызывает значительное
положить, что антиоксидантные и эндотелио
увеличение скорости пульсовой волны и повы
протекторные эффекты α клото играют ключе
шение артериального давления (АД), а также
вую роль в его противоишемическом действии.
сопровождается повышением уровня альдосте
Есть основания полагать, что в этом случае сис
рона. Артериальная жесткость является одним
темная терапия α клото может дать положи
из самых ранних обнаруживаемых проявлений
тельный клинический эффект.
неблагоприятных структурных и функциональ
ных изменений в стенке сосуда, что в значитель
ной мере повышает риск ИБС и инсульта
ВЛИЯНИЕ КЛОТО НА ЭЛЕКТРИЧЕСКУЮ
[69-71]. В культивируемых клетках гладких
АКТИВНОСТЬ СЕРДЦА
мышц аорты мышей дефицит гена Kl вызывал
повышение активности аутофагии, что приво
Клото обнаружен в пейсмекерных клетках
дило к увеличению экспрессии склераксиса,
синоатриального узла, и дефицит его у мышей
ключевого транскрипционного фактора синтеза
сопровождается дисфункцией этого узла. Пока
коллагена, играющего существенную роль в раз
зано, что в условиях 20 ти часового стрессорно
витии артериальной жесткости, и снижению
го воздействия частота внезапной смерти высо
уровня эластина [72]. Помимо этого, гаплоде
ка и связана с блокадой или проводимости, или
фицит α клото сопровождался активацией ме
синусового узла. Точные молекулярные и кле
таллопротеиназы MMP9, профиброзных факто
точные механизмы, лежащие в основе этого фе
ров TGF β1 и TGF β3, RUNX2 (фактора тран
номена, остаются неизвестными. Можно пред
скрипции, регулирующего клеточный цикл в
положить, что экспрессия α клото в синоатри
эндотелиальных клетках и остеобластах). Эти
альном узле важна для функционирования оп
эффекты нейтрализовались хлорокином или эп
ределенных ионных каналов, влияющих на воз
лереноном, антагонистом рецептора альдосте
будимость клеток водителей ритма [62]. К нас
рона. Изменениям на клеточном уровне соответ
тоящему времени известно, что α клото моду
ствуют физиологические эффекты in vivo: уве
лирует ионные каналы в плазматической мемб
личение скорости пульсовой волны и повыше
ране, в том числе Na+/фосфат котранспортеры
ние артериального давления. Важно отметить,
[63, 64], Na+/K+ ATPазы [65], Ca2+ каналы [66],
что α клото подавляет экспрессию CYP11B2,
специфические калиевые каналы сердца (коди
ключевого фермента синтеза альдостерона в
руемые геном hERG - от англ. human ether a go
надпочечниках, на уровне факторов транскрип
go related gene), способствующие электрической
ции [73]. Таким образом, α клото вовлечен в
БИОХИМИЯ том 86 вып. 2 2021
БЕЛОК КЛОТО, СЕРДЦЕ И СОСУДЫ
165
различные аспекты поддержания нормальной
включая активацию кальмодулин зависимой
функции артерий и предотвращение развития
серин/треонин фосфатазы (фермента кальци
артериальной гипертонии: регуляцию уровня
неврина). Эта фосфатаза дефосфорилирует и
альдостерона и жесткости сосудистой стенки.
стимулирует ядерный фактор активированных
Выявление связи между дефицитом белка и по
T клеток (англ. абб. NFAT от nuclear factor of
вышенной жесткостью сосудов является важ
activated T cells) и NFAT зависимую экспрессию
ным открытием, поскольку оно определяет но
определенных генов (например, тяжелой цепи
вое направление для понимания патогенеза ги
бета миозина), что, в свою очередь, способству
пертонии. Доступные в настоящее время анти
ет развитию патологической гипертрофии и ре
гипертензивные препараты в основном снижа
моделированию сердца [76, 77]. Считается, что
ют периферическое сопротивление и не влияют
растворимый α клото, циркулирующий в сис
на патологические процессы ремоделирования
темном кровотоке, взаимодействует с рецепто
и жесткость сосудов. В этой связи α клото мо
ром IGF1 и предотвращает IGF1 зависимую ак
жет быть важным этиологическим фактором и
тивацию PI3K и последующий PI3K зависимый
потенциальной мишенью для ограничения ре
экзоцитоз каналов TRPC6 в клетках сердца, что
моделирования и ригидности артерий.
обусловливает его кардиопротекторный эффект
[75]. При этом структурное моделирование и
молекулярный докинг позволили выявить, что
РОЛЬ КЛОТО В ПАТОГЕНЕЗЕ
растворимый α клото также может ингибиро
КАРДИОМИОПАТИЙ
вать каналы TRPC6 путем связывания с 2 3 си
алиллактозой ганглиозидов липидных рафтов.
α Клото продуцируется преимущественно в
Показано, что белок взаимодействует с глико
почках и секретируется в кровоток. Выявлено,
липидами благодаря репозиционной петле β6α6
что дефицит его при хронической болезни почек
в домене KL1 и образует стабильный комплекс.
вызывает уремическую кардиомиопатию. В экс
Связывание растворимого клото с липидными
периментах на крысах с ХБП длительное введе
рафтами модулирует их организацию в мембра
ние рекомбинантного клото ослабляло ремоде
не, подавляет передачу сигналов по пути
лирование сердца. Полученные данные позволя
PI3K/Akt, а также процесс экзоцитоза TRPC6.
ют считать рекомбинантный белок α клото без
Авторы исследования считают, что липидные
опасным, эффективным и многообещающим
рафты могут быть рецепторами для растворимо
профилактическим/терапевтическим агентом
го α клото [16, 18, 19], а белок таким путем обес
для предотвращения или замедления прогресси
печивает защиту от вызванной стрессом гипер
рования уремической кардиомиопатии [74].
трофии сердца у мышей [18].
Поскольку в соответствии с преобладающим
Было также обнаружено, что при ХБП раст
мнением в патогенезе уремической кардиомио
воримый α клото ограничивает кальцифика
патии существенную роль играет чрезмерное
цию сосудов, воздействуя непосредственно на
повышение уровня FGF23 и/или фосфатов в
их гладкомышечные клетки и косвенно регули
сыворотке, механизм протекторного действия
руя метаболизм фосфатов. In vitro белок подав
α клото предположительно может реализовы
ляет Na+ зависимое всасывание фосфатов и ми
ваться через его взаимодействие с FGFR и
нерализацию, вызванную их высоким содержа
FGF23. Однако недавно было выявлено, что
нием в клетках гладких мышц сосудов [78]. При
растворимая форма белка клото ограничивает
этом существуют противоречивые результаты
развитие гипертрофии миокарда независимым
относительно присутствия α клото в сосудистой
от FGF23 и фосфатов путем - он подавляет ано
сети [79]. Lindberg et al. (2013) не наблюдали
мальную активность кальций зависимых сиг
влияния белка на кальцификацию аортального
нальных механизмов в сердце [60, 75]. Показа
кольца мыши [80]. Lim et al. (2012) показали, что
но, что различные внеклеточные стрессорные
FGF23 снижает кальцификацию клеток гладких
стимулы вызывают увеличение концентрации
мышц аорты человека - и этот эффект зависит
внутриклеточного кальция, способствуя его
от индукции α клото [81]. Jimbo et al. (2014) об
высвобождению из клеточных органелл или
наружили, что FGF23 усиливал Pi стимулиро
проникновению через плазматическую мембра
ванную кальцификацию (Pi - неорганический
ну по Ca2+ проницаемым катионным TRPC ка
фосфат сыворотки крови) в культивируемых
налам. Семейство TRPC включает 7 членов
клетках гладких мышц сосудов человека, сверх
(TRPC1-7, TRPC2 не экспрессируется у челове
экспрессирующих α клото [82]. У мышей с де
ка). Имеющиеся данные указывают на то, что
фицитом белка наблюдались высокие уровни
приток Ca2+ по каналам TRPC1, 3, 4, 5 и 6 в
циркулирующего фосфора и кальцитриола, и
клетках сердца важен для передачи сигналов,
развивалась медиальная кальцификация арте
БИОХИМИЯ том 86 вып. 2 2021
166
ТЮРЕНКОВ и др.
рий, практически идентичная наблюдаемой у
ным введением изопротеренола, показано, что
нокаутированных по Fgf23 мышей [83]. Однако в
трансфекция гена Kl способствует повышению
подавляющем большинстве работ на сегодняш
фракции выброса, скоростей сокращения и рас
ний день преобладает мнение, что α клото за
слабления (± dP/dt max), а также существенно
щищает сосуды от кальцификации. Hu et al.
му уменьшению фиброза и ремоделирования
(2011) сообщили, что его дефицит у мышей с
миокарда у трансфицированных животных
ХБП вызывает Pi индуцированную кальцифи
опытной группы по сравнению с контрольной
кацию, а растворимый α клото может подавлять
[88]. Возможно, кардиопротекторные эффекты
натрий зависимое всасывание Pi и кальцифика
α клото обусловлены его участием в регуляции
цию у крыс [78]. В работе Zhang et al. (2015) по
внутриклеточного уровня Ca2+, повышение ко
казано, что растворимая форма белка подавляла
торого является одной из причин указанных вы
Pi индуцированную кальцификацию мезенхи
ше изменений в миокарде. В работе Tang et al.
мальных стволовых клеток, полученных из
(2018) показано, что α клото влияет на актив
костного мозга человека, путем инактивации
ность Na+/Ca2+ обменника и Na+/K+ ATPазы в
сигнального пути FGFR1/ERK [29]. Zhao et al.
клетках H9C2, обработанных изопротерено
(2015) и Chang et al. (2016) сообщили, что α клото
лом [89].
ослабляет кальцификацию сосудов, причем за
Эксперименты in vitro позволили обнару
щитная роль принадлежит как мембраносвязан
жить, что α клото способен ингибировать ангио
ной, так и растворимой формам белка. Учиты
тензин II индуцированную гипертрофию и
вая разноречия, необходимы дальнейшие иссле
пролиферацию кардиомиоцитов, а также фиб
дования в этой области [84, 85].
роз в соединительнотканных клетках сердца.
Следует заметить, что результаты исследова
Названные эффекты ангиотензина II реализу
ний роли клото в развитии гипертрофии сердца
ются через активацию TGF β1 сигнального пу
также разнятся. В некоторых исследованиях па
ти. TGF β1 секретируется моноцитами и макро
тология у мышей при дефиците α клото не была
фагами при их активации, а также фибробласта
обнаружена [86]. Она развивалась только после
ми, эндотелиоцитами, тучными клетками и др.
стрессорных воздействий, что позволяет думать
Существует 5 изоформ TGF, из них TGF β1 об
об участии белка в формировании толерантнос
ладает наиболее выраженной экспрессией и су
ти сердца к стрессу [60].
щественной ролью в ремоделировании и фибро
Тем не менее Hu et al. (2015) обнаружили ги
зировании сосудов и миокарда. На ранней ста
пертрофию миокарда с последующим фиброзом
дии инфаркта миокарда он участвует в воспали
у клото дефицитных мышей в возрасте до 12 не
тельной реакции, в более поздние сроки - в ре
дель [87]. Снижение уровня α клото было вызва
моделировании левого желудочка путем актива
но генетическим дефектом, потреблением боль
ции фибробластов и гипертрофии не поражен
шого количества фосфатов, старением и ХБП.
ного инфарктом участка миокарда [90]. Показа
Независимо от причины его дефицита степень
на связь уровня TGF β1 в сыворотке крови со
гипертрофии и фиброза сердца положительно
степенью выраженности фиброза миокарда ле
коррелировала с концентрацией фосфатов и бы
вого предсердия у пациентов с пароксизмаль
ла обратно пропорциональна уровню α клото в
ной формой фибрилляции предсердий [91]. Ре
плазме. In vitro белок ингибировал TGF β1 и ан
цидив ишемии миокарда в послеоперационном
гиотензин II индуцированную гипертрофию и
периоде ассоциирован с повышением уровня
фиброз кардиомиоцитов или фиброз, вызван
TGF β1 [92]. При взаимодействии TGF β1 с ре
ный высоким содержанием фосфатов [87].
цептором трансформирующего фактора рос
Причины противоречий в исследованиях не
та βII (TGFR βII) фосфорилируется ряд
обходимо выяснять. Возможно, это связано с ге
SMAD белков (smad and mad related proteins),
нетическими различиями между линиями мы
классический сигнальный каскад включает ге
шей, их стрессоустойчивости или иными разли
теромеризацию SMAD2/3 с участием SMAD4 и
чиями.
перемещение внутрь ядра, где они играют роль
факторов транскрипции генов профибротичес
ких белков (COL1A1 - коллаген I и ACTA2 -
УЧАСТИЕ КЛОТО В ПРОЦЕССАХ
гладкомышечный α актин (α SMA)) и генов
РЕМОДЕЛИРОВАНИЯ СЕРДЦА
прогипертрофических белков (NPPA/ANP -
И СОСУДОВ, РАЗВИТИИ
предсердный натрийуретический пептид и
СЕРДЕЧНОЙ НЕДОСТАТОЧНОСТИ
MYH7 - β форма тяжелой цепи миозина
(MHC β)).
В эксперименте на крысах с сердечной не
Растворимый клото может напрямую связы
достаточностью, вызванной интраперитонеаль
ваться с TGFR βII и блокировать взаимодей
БИОХИМИЯ том 86 вып. 2 2021
БЕЛОК КЛОТО, СЕРДЦЕ И СОСУДЫ
167
ствие с ним TGF β1, тем самым ингибируя пе
многочисленных исследований свидетельству
редачу сигналов, а также ослаблять экспрессию
ют о том, что высокий уровень FGF23 является
рецептора ангиотензина II типа 1 (англ. абб.
клинически значимым фактором риска разви
AT1R от angiotensin II receptor type 1) [11]. Клото
тия тяжелых осложнений, в том числе при сер
способен подавлять как экспрессию TGF β1,
дечно сосудистых заболеваниях, и смертности.
так и TGF β1 зависимое фосфорилирование
Показана связь высокой концентрации FGF23 с
SMAD2 и SMAD3 (канонический сигнальный
массой и гипертрофией левого желудочка, а так
путь TGF β1) в ангиотензин II инфузирован
же летальностью среди больных с терминальной
ных тканях сердца, а также ангиотензин II сти
стадией почечной недостаточности и ишеми
мулированных культивируемых кардиомиоци
ческой болезнью сердца [93]. Участие клото в
тах и фибробластах.
подавлении этих патологических процессов мо
Кроме того, клото ингибирует экспрессию
жет быть представлено следующим образом.
FGF23 при ангиотензин II индуцированной ги
Опосредованно, через снижение количества
пертрофии сердца и фиброзе in vivo и in vitro.
TGF β1, α клото ингибирует микроРНК
FGF23 является гормоном костного происхож
miR 132 (рисунок адаптирован из работы
дения. Он играет важную роль в регуляции мета
Ding et al. [94]), которая подавляет фактор тран
болизма фосфора в сыворотке крови, снижает
скрипции FOXO3, необходимый для экспрессии
его реабсорбцию в проксимальных почечных
атрогина 1. Этот F box белок вызывает убикви
канальцах, увеличивая клиренс. Результаты
тинирование и, следовательно, деградацию
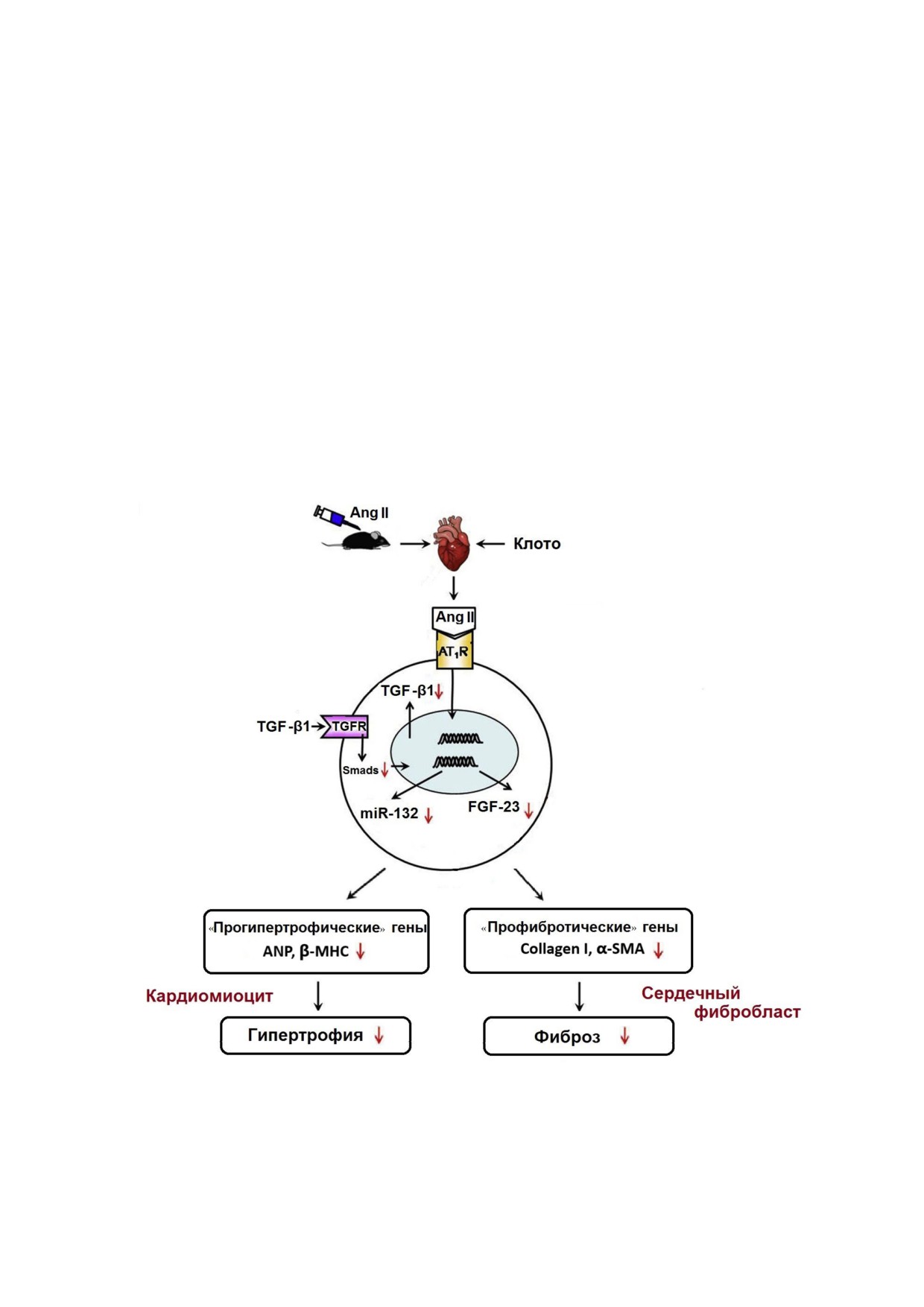
Роль клото в развитии ангиотензин II индуцированных гипертрофии и фиброза сердца мыши. Было обнаружено, что об
работка экзогенным клото положительно влияла на ангиотензин II индуцированное ремоделирование сердца и его дис
функцию, что частично можно объяснить его ингибирующим действием на TGF β1/miR 132 путь. Направленными вниз
стрелками обозначена отрицательная регуляция или ингибирование под действием клото. (С цветным вариантом рисун
БИОХИМИЯ том 86 вып. 2 2021
168
ТЮРЕНКОВ и др.
кальциневрина A в кардиомиоцитах. Избыток
медиа и атеросклерозом сонной артерии у паци
кальциневрина A стимулирует NFAT и, как
ентов с гипертонической болезнью [99].
следствие, увеличение экспрессии генов про
Выявлено, что полиморфизм G395A в про
фибротических и прогипертрофических факто
моторном участке гена KL человека может быть
ров. Ингибируя miR 132, клото ограничивает
генетическим фактором риска развития ИБС и
развитие фиброза и гипертрофии миокарда [95].
никак не связан с вазоспастической стенокар
Существенную роль в процессе ремоделиро
дией [100].
вания сердца и сосудов играет также сигналь
Полиморфизм C1818T в 4 м экзоне KL ас
ный путь Wnt. Показано, что эндотелиальные
социирован с более высоким систолическим
клетки эндокарда могут быть предшественника
АД, чем референсный вариант C1818C. Возмож
ми перицитов и миоцитов, которые способны
но, это связано с влиянием C1818T на продук
мигрировать в миокард, дифференцироваться и
цию оксида азота (NO), снижение концентра
формировать стенку вновь образуемых сосудов
ции которого обнаружено у лиц старше 40 лет,
миокарда. Ключевую роль в этом процессе игра
носителей названного полиморфизма. Сниже
ют Wnt/Frizzled 4, β катенин и лиганды Wnt,
ние биодоступности NO способствует эндотели
синтезируемые эндотелиальными клетками
альной дисфункции, вазоконстрикции, тромбо
[96]. Белок α клото ингибирует этот сигналь
зу и сердечно сосудистым заболеваниям [101,
ный путь, что теоретически может снижать ско
102]. Можно предполагать, что заместительная
рость ремоделирования. С другой стороны, про
терапия белком клото будет оказывать благо
фиброзная активность Wnt нейтрализуется
приятное воздействие при указанных патологиях.
α клото - и суммарный результат применения
белка, по видимому, должен быть положитель
ным, хотя это нуждается в экспериментальной
МОДУЛЯЦИЯ АКТИВНОСТИ КЛОТО -
проверке.
НОВЫЙ ТЕРАПЕВТИЧЕСКИЙ ПОДХОД
К ЛЕЧЕНИЮ СЕРДЕЧНО СОСУДИСТЫХ
ЗАБОЛЕВАНИЙ
ГЕНЕТИЧЕСКАЯ
ПРЕДРАСПОЛОЖЕННОСТЬ
В настоящее время не существует лекар
К СЕРДЕЧНО СОСУДИСТЫМ
ственных средств, разработанных специально
ЗАБОЛЕВАНИЯМ, СВЯЗАННАЯ
для модуляции активности клото, но показано,
С ПОЛИМОРФИЗМОМ KL
что некоторые из уже известных усиливают его
экспрессию или ограничивают снижение синте
Сердечно сосудистые заболевания имеют
за при патологических состояниях. Выявлено,
многофакторную этиологию, и генетическая
что у крыс в условиях изопротереноловой ин
предрасположенность к ним не является исклю
токсикации снижается частота сердечных сокра
чением. Перекрестные исследования показали
щений (ЧСС), экспрессия клото и каналов
связь между аллелем KL3VS гена клото и ранней
HCN4 (hyperpolarization activated
cyclic
ишемической болезнью сердца. Методом логис
nucleotide gated channels - управляемых цикли
тической регрессии выявлено, что KL3VS явля
ческими нуклеотидами гиперполяризационно
ется независимым фактором риска коронарных
активируемых каналов). Эти интегральные бел
заболеваний сердца, при этом модифицируемые
ки являются неселективными лиганд зависи
факторы влияют на этот риск: гипертония мас
мыми катионными каналами в мембранах кле
кирует, повышение уровня липопротеинов вы
ток сердца и головного мозга. HCN каналы на
сокой плотности снижает, курение увеличивает
зывают еще «каналами водителями ритма»,
[97]. Выявлена связь варианта KL3VS с ишеми
поскольку они участвуют в генерации ритми
ческим инсультом, причем у гомозигот по этому
ческой активности клетками сердца и головного
варианту в возрасте до 40 лет отмечен более вы
мозга [103]. Показано, что флавоноид астрага
сокий риск развития болезни по сравнению с ге
лозид IV повышает экспрессию α клото, кото
терозиготами, тогда как в старшей группе (в воз
рый, в свою очередь, увеличивает экспрессию
расте более 40 лет) значимой ассоциации не
HCN4 и If каналов (funny current channels). ЧСС
наблюдалось [98].
при этом нормализуется, что может служить ос
Обнаружены и другие типы полиморфизма
нованием для поиска веществ, влияющих на
клото, которые также ассоциированы с различ
экспрессию клото, с целью применения их при
ными отклонениями от физиологической нор
нарушениях ритма сердца [103].
мы. Продемонстрировано, что однонуклеотид
Возможно, в механизме ангиопротекторного
ный полиморфизм KL rs650439 в значительной
действия статинов (аторвастатин и питаваста
степени связан со средней толщиной интима
тин) α клото играет существенную роль, реали
БИОХИМИЯ том 86 вып. 2 2021
БЕЛОК КЛОТО, СЕРДЦЕ И СОСУДЫ
169
зуя защитные эффекты через инактивацию
ты. Их можно прогнозировать на основании
RhoA пути (от англ. Ras homolog family member
описанных выше сигнальных механизмов, регу
A) [104]. На культуре клеток IMCD3 продемон
лируемых им. Так, потенциальная передозиров
стрировано, что статины дозозависимо повыша
ка может предположительно способствовать ги
ют экспрессию мРНК α клото посредством ин
потонии, гипофосфатемии, гипокальциемии,
гибирования RhoA. Клото, в свою очередь, регу
т.к. тандем клото-FGF23 способствует экскре
лирует обмен кальция и защищает сосуды от
ции фосфата и кальция. И несмотря на то что в
кальцификации, которая способствует повыше
экспериментах на животных системная админи
нию их ригидности [104].
страция белка не приводила ни к одному из та
Установлено, что ингибиторы ангиотензин
ких эффектов, недостаточная экспрессия клото
превращающего фермента и блокаторы рецеп
и повышенная экспрессия FGF23 действитель
торов ангиотензина II увеличивают экспрессию
но сопровождается гипофосфатемией и гипо
α клото, очевидно, вследствие снижения актив
кальциемией. Как уже отмечено выше, гипотен
ности ренин ангиотензин альдостероновой
зивное действие клото обусловливается повы
системы, которая угнетает выработку этого бел
шением эластичности сосудов и антагонизмом
ка [105].
между ним и ренин ангиотензин альдостероно
Модулирующее действие гипогликемичес
вой системой. Помимо этого, взаимодействие
ких средств, росиглитазона и тиазолидиндиона,
клото с субстратами рецептора инсулина вызы
на экспрессию α клото в гладкомышечных
вает опасение в контексте возможной индукции
клетках сосудов (англ. абб. VSMCs от vascular
инсулинорезистентности, что было исследовано
smooth muscle cells) связано с тем, что они явля
на экспериментальной модели [108]. Установле
ются агонистами PPARγ, фактора его тран
но, что белок не принимает непосредственного
скрипции. Эти препараты препятствуют каль
участия в формировании толерантности к инсу
цификации тканей, по видимому, за счет повы
лину. В силу видовых различий доклинические
шения уровня α клото [106].
эксперименты не могут дать исчерпывающего
Сосудистая кальцификация усугубляет ише
ответа на вопрос о возможных побочных эффек
мические процессы в миокарде, является основ
тах у человека. Тем не менее индукторы клото,
ным фактором риска сердечно сосудистой
прошедшие клиническую проверку, могут дать
смертности у пациентов. Поскольку α клото иг
предварительную оценку. Так, статины и вита
рает критическую роль в ограничении кальци
мин Д используются в клинической практике, и
фикации сосудов иммунодепрессантом рапами
их длительный прием не сопровождается ука
цином in vitro и in vivo через торможение mTOR
занными побочными эффектами, что косвенно
[84], он может служить потенциальной ми
свидетельствует в пользу безопасности повыше
шенью для поиска лекарственных препаратов,
ния экспрессии клото или его системного введе
предупреждающих патологические изменения
ния. К сожалению, росиглитазон обладает ря
сосудов. Наиболее известный индуктор
дом нежелательных эффектов, которые, очевид
экспрессии α клото - витамин Д, избыточное
но, не имеют отношения к увеличению синтеза
потребление которого также сопряжено с каль
клото [109, 110]. Таким образом, индукция
цификацией сосудов и внутренних органов.
экспрессии клото может иметь свои ограниче
Многие положительные эффекты этого витами
ния, которые не распространяются на терапев
на, вероятно, связаны с экспрессией α клото,
тическое использование рекомбинантного бел
который, в свою очередь, регулирует уровень
ка. Окончательный ответ могут дать клиничес
витамина Д и препятствует развитию его побоч
кие испытания, которые, насколько нам извест
ных эффектов [107].
но, пока не проводились.
Таким образом, представленные в обзоре
данные позволяют считать, что вещества, повы
Проблема изучения молекулярных основ пато
шающие экспрессию клото, могут иметь высо
генеза сердечно сосудистых заболеваний на
кий терапевтический потенциал, т.к. этот белок
протяжении долгого времени остается чрезвы
влияет на многие процессы, играющие важную
чайно важной. Изучение роли взаимодействия
роль в развитии ССЗ: подавляет перекисное
белков в развитии патологических процессов
окисление липидов и развитие воспаления, пред
дает большие возможности для более точного
упреждает повреждение эндотелия, формирова
понимания как возникновения патологий серд
ние атеросклероза, кальцификацию сосудов, уг
ца и сосудов, так и поиска способов и лекар
нетает фиброзирование сердца и сосудов и по
ственных препаратов для их лечения. Белок
вышение их жесткости. Рассматривая возмож
клото играет существенную роль в механизмах
ность терапевтического применения клото, сле
защиты от нарушения функций сердечно сосу
дует учесть и предполагаемые побочные эффек
дистой системы и развития кардиомиопатии,
БИОХИМИЯ том 86 вып. 2 2021
170
ТЮРЕНКОВ и др.
сердечной недостаточности, артериальной ги
FGF и Wnt играет важную роль в органогенезе.
пертензии. Плейотропные свойства клото нахо
В зрелом организме поддержание гомеостаза яв
дят свое отражение в разнообразии и взаимо
ляется важной задачей, которая осуществляется
действии кардиопротекторных механизмов. Ре
разными способами, например, с помощью ре
гуляция уровня белка в сыворотке крови и его
гуляции экспрессии генов и протеолитической
экспрессии в кардиомиоцитах с помощью лекар
деградации белков. Модуляция активности су
ственных препаратов может иметь важное зна
ществующих сигнальных механизмов при учас
чение для клеточного метаболизма и представ
тии клото является еще одним таким способом.
лять собой перспективную мишень для лечения
Потеря этой настройки сопровождается патоло
ССЗ.
гиями, подобно тому, как избыток FGF23 в ус
Некоторые вопросы, требующие своего раз
ловиях дефицита α клото наблюдается при
решения, мы уже указали выше - различия
ИБС. Недостаточный контроль со стороны кло
между мембраносвязанной и растворимой фор
то и высокая активность сигнальных путей Wnt,
мами клото, механизмы ферментативной актив
IGF1, TGF β1 способствует развитию фиброза и
ности, различные функции KL1 и KL2. К этому
онкологических заболеваний. Можно постули
списку следует добавить малоисследованную
ровать, что физиологическое значение клото
роль клото в цитоплазме, где он может связы
состоит в этой настройке. Роль его как потенци
ваться с какими то другими партнерами, поми
ального регулятора синхронизатора гомеостаза
мо шаперонов. Не исключено, что именно внут
до сих пор не исследовалась. Наконец, большин
риклеточный клото влияет на экспрессию ге
ство работ на эту тему посвящены α клото, а не
нов, самостоятельно или при участии других
его паралогам β и γ, где, очевидно, существует
белков. В связи с этим возникает вопрос о воз
большое количество неисследованных вопросов.
можности его интернализации, например, пу
тем эндоцитоза рецепторных белков, взаимо
действующих с ним. Из всего сказанного выше
Конфликт интересов. Авторы заявляют об от
можно предположить, что клото, связываясь с
сутствии конфликта интересов.
каноническими рецепторами и модулируя их
Соблюдение этических норм. Настоящая
функцию, участвует в тонкой настройке орга
статья не содержит описания каких либо иссле
низма в разные периоды его жизни. Например,
дований с участием людей или животных в каче
высокая активность канонических механизмов стве объектов.
СПИСОК ЛИТЕРАТУРЫ
1.
Kuro o, M., Matsumura, Y., Aizawa, H., Kawaguchi, H.,
7. Chen, G., Liu, Y., Goetz, R., Fu, L., Jayaraman, S., Hu,
Suga, T., et al. (1997) Mutation of the mouse klotho gene
M. C., Moe, O. W., Liang, G., Li, X. and Mohammadi, M.
leads to a syndrome resembling ageing, Nature, 390, 45 51,
(2018) α Klotho is a non enzymatic molecular scaffold for
doi: 10.1038/36285.
FGF23 hormone signaling, Nature,
553,
461466,
2.
Shiraki Iida, T., Aizawa, H., Matsumura, Y., Sekine, S.,
doi: 10.1038/nature25451.
Iida, A., Anazawa, H., Nagai, R., Kuro o, M., and
8. Xie, T., and Leung, P. S. (2017) Fibroblast growth factor
Nabeshima, Y. (1998) Structure of the mouse klotho gene
21: a regulator of metabolic disease and health span, Am. J.
and its two transcripts encoding membrane and secreted
Physiol.
Endocrinol. Metab.,
313, E292 E302,
protein 1, FEBS Lett., 424, 6 10, doi: 10.1016/S0014
doi: 10.1152/ajpendo.00101.2017.
5793(98)00127 6.
9. Katoh, M., and Nakagama, H. (2014) FGF receptors: can
3.
Li, S. A., Watanabe, M., Yamada, H., Nagai, A., Kinuta, M.,
cer biology and therapeutics, Med. Res. Rev., 34, 280 300,
and Takei, K. (2004) Immunohistochemical localization of
doi: 10.1002/med.21288.
Klotho protein in brain, kidney, and reproductive organs
10. Grabner, A., Amaral, A. P., Schramm, K., Singh, S.,
of mice, Cell Struct. Funct., 29, 91 99, doi: 10.1247/
Sloan, A., et al. (2015) Activation of cardiac Fibroblast
csf.29.91.
Growth Factor Receptor 4 causes left ventricular hypertro
4.
Lim, K., Groen, A., Molostvov, G., Lu, T., Lilley, K. S.,
phy, Cell Metab., 22, 1020 1032, doi: 10.1016/j.cmet.
Snead, D., James, S., Wilkinson, I. B., Ting, S., Hsiao, L. L.,
2015.09.002.
Hiemstra, T. F., and Zehnder, D. (2015) α klotho expres
11. Doi, S., Zou, Y., Toga, O., Pastor, J. V., John, G. B., Wang, L.,
sion in human tissues, J. Clin. Endocrinol. Metab., 100,
Shiizaki, K., Gotschall, R., Schiavi, S., Yorioka, N.,
1308 1318, doi: 10.1210/jc.2015 1800.
Takahashi, M., Boothman, D. A., and Kuro o, M. (2011)
5.
Мельник А. А. (2017) Белок Klotho и фактор роста
Klotho inhibits Transforming Growth Factor β1
фибробластов FGF23 как маркеры хронической бо
(TGF β1) signaling and suppresses renal fibrosis and can
лезни почек, Почки, 6, 132 138.
cer metastasis in mice, J. Biol. Chem., 286, 8655 8665,
6.
Ito, S., Fujimori, T., Hayashizaki, Y., and Nabeshima Y.
doi: 10.1074/jbc.M110.174037.
(2002) Identification of a novel mouse membrane bound
12. Lee, J., Jeong, D. J., Kim, J., Lee, S., Park, J. H., et al.
family 1 glycosidase like protein, which carries an atypical
(2010) The anti aging gene KLOTHO is a novel target for
active site structure, Biochim. Biophys. Acta, 1576, 341
epigenetic silencing in human cervical carcinoma, Mol.
345, doi: 10.1016/s0167 4781(02)00281 6.
Cancer, 9, 109, doi: 10.1186/1476 4598 9 109.
БИОХИМИЯ том 86 вып. 2 2021
БЕЛОК КЛОТО, СЕРДЦЕ И СОСУДЫ
171
13.
Нестерова А. А., Глинка Е. Ю., Тюренков И. Н., Пер
27.
Kuro o, M. (2009) Klotho and aging, Biochim. Biophys.
филова В. Н. (2020) Белок клото - универсальный ре
Acta, 1790, 1049 1058, doi: 10.1016/j.bbagen.2009.02.005.
гулятор физиологических процессов в организме, Ус3
28.
Cui, W., Leng, B., and Wang, G. (2019) Klotho protein
пехи физиол. наук, 51, 88 104.
inhibits H2O2 induced oxidative injury in endothelial cells
14.
Ligumsky, H., Rubinek, T., Merenbakh Lamin, K.,
via regulation of PI3K/AKT/Nrf2/HO 1 pathways, Can. J.
Yeheskel, A., Sertchook, R., Shahmoon, S., Aviel Ronen,
Physiol. Pharmacol., 97, 370 376, doi: 10.1139/cjpp 2018
S., and Wolf, I. (2015) Tumor suppressor activity of Klotho
0277.
in breast cancer is revealed by structure-function analysis,
29.
Zhang, W., Xue, D., Hu, D., Xie, T., Tao, Y., Zhu, T.,
Mol. Cancer Res., 13, 1398 1407, doi: 10.1158/1541
Chen, E., and Pan, Z. (2015) Secreted klotho protein
7786.MCR 15 0141.
attenuates osteogenic differentiation of human bone mar
15.
Sopjani, M., Rinnerthaler, M., Kruja, J., and Dërmaku
row mesenchymal stem cells in vitro via inactivation of the
Sopjani, M. (2015) Intracellular signaling of the aging sup
FGFR1/ERK signaling pathway, Growth Factors, 33, 356
pressor protein Klotho, Curr. Mol. Med., 15, 2737,
365, doi: 10.3109/08977194.2015.1108313.
doi: 10.2174/1566524015666150114111258.
30.
Abramovitz, L., Rubinek, T., Ligumsky, H., Bose, S.,
16.
Dalton, G., An, S. W., Al Juboori, S. I., Nischan, N.,
Barshack, I., Avivi, C., Kaufman, B., and Wolf, I. (2011)
Yoon, J., et al. (2017) Soluble klotho binds monosialogan
KL1 internal repeat mediates Klotho tumor suppressor
glioside to regulate membrane microdomains and growth
activities and inhibits bFGF and IGF I signaling in pan
factor signaling, Proc. Natl. Acad. Sci. USA, 114, 752 757,
creatic cancer, Clin. Cancer Res.,
17,
42544266,
doi: 10.1073/pnas.1620301114.
doi: 10.1158/1078 0432.CCR 10 2749.
17.
Wolf, M. T., An, S. W., Nie, M., Bal, M. S., and Huang, C. L.
31.
Neyra, J. A., and Hu, M. C. (2017) Potential application of
(2014) Klotho up regulates renal calcium channel tran
klotho in human chronic kidney disease, Bone, 100, 41 49,
sient receptor potential vanilloid 5 (TRPV5) by intra and
doi: 10.1016/j.bone.2017.01.017.
extracellular N glycosylation dependent mechanisms, J.
32.
Mencke, R., Harms, G., Moser, J., van Meurs, M.,
Biol. Chem.,
289,
3584935857, doi:
10.1074/jbc.
Diepstra, A., Leuvenink, H. G., and Hillebrands, J. L.
M114.616649.
(2017) Human alternative Klotho mRNA is a nonsense
18.
Wright, J. D., An, S. W., Xie, J., Lim, C., and Huang, C. L.
mediated mRNA decay target inefficiently spliced in renal
(2019) Soluble klotho regulates TRPC6 calcium signaling
disease, JCI Insight, 2, e94375, doi: 10.1172/jci.insight.
via lipid rafts, independent of the FGFR FGF23 pathway,
94375.
FASEB J., 33, 9182 9193, doi: 10.1096/fj.201900321R.
33.
Xu, Y., and Sun, Z. (2017) Regulation of S formylglu
19.
Wright, J. D., An, S. W., Xie, J., Yoon, J., Nischan, N.,
tathione hydrolase by the anti aging gene klotho,
Kohler, J. J., Oliver, N., Lim, C., and Huang, C. L. (2017)
Oncotarget,
8,
8825988275, doi:
10.18632/oncotar
Modeled structural basis for the recognition of α2 3 sialyl
get.19111.
lactose by soluble Klotho, FASEB J., 31, 3574 3586,
34.
Tacer, K. F., Bookout, A. L., Ding, X. S., Kurosu, H.,
doi: 10.1096/fj.201700043R.
John, G. B., Wang, L., Goetz, R., Mohammadi, M.,
20.
Zhang, J., Gupte, J., Gong, Y., Weiszmann, J., Zhang, Y.,
Kuro o, M., Mangelsdorf, D. J., and Kliewer, S. A. (2010)
Lee, K. J., Richards, W. G., and Lia, Y. (2017) Over
Research resource: comprehensive expression atlas of the
expression of fibroblast growth factor 21 increases bile acid
fibroblast growth factor system in adult mouse, Mol.
biosynthesis by opposing FGF15/19 action, EBioMedicine,
Endocrinol., 24, 2050 2064, doi: 10.1210/me.2010 0142.
15, 173 183, doi: 10.1016/j.ebiom.2016.12.016.
35.
Tomlinson, E., Fu, L., John, L., Hultgren, B., Huang, X.,
21.
Patel, V., Adya, R., Chen, J., Ramanjaneya, M., Bari, M. F.,
Renz, M., Stephan, J. P., Tsai, S. P., Powell Braxton, L.,
Bhudia, S. K., Hillhouse, E. W., Tan, B. K., and Randeva,
French, D., and Stewart, T. A. (2002) Transgenic mice
H. S. (2014) Novel insights into the cardio protective
expressing human fibroblast growth factor 19 display
effects of FGF21 in lean and obese rat hearts, PLoS One, 9,
increased metabolic rate and decreased adiposity,
e87102, doi: 10.1371/journal.pone.0087102.
Endocrinology, 143, 1741 1747, doi: 10.1210/endo.143.
22.
Lee, S., Choi, J., Mohanty, J., Sousa, L. P., Tome, F.,
5.8850.
Pardon, E., Steyaert, J., Lemmon, M. A., Lax, I., and
36.
Nakayama, Y., Miyake, A., Nakagawa, Y., Mido, T.,
Schlessinger, J. (2018) Structures of β Klotho reveal a ‘zip
Yoshikawa, M., Konishi, M., and Itoh, N. (2008) Fgf19 is
code’ like mechanism for endocrine FGF signaling,
required for zebrafish lens and retina development, Dev.
Nature, 553, 501 505, doi: 10.1038/nature25010.
Biol., 313, 752 766, doi: 10.1016/j.ydbio.2007.11.013.
23.
Kuzina, E. S., Ung, P. M., Mohanty, J., Tome, F., Choi, J.,
37.
Kurose, H., Okamoto, M., Shimizu, M., Bito, T.,
Pardon, E., Steyaert, J., Lax, I., Schlessinger, A.,
Marcelle, C., Noji, S., and Ohuchi, H. (2005) FGF19
Schlessinger, J., and Lee, S. (2019) Structures of ligand
FGFR4 signaling elaborates lens induction with the
occupied β Klotho complexes reveal a molecular mecha
FGF8 L Maf cascade in the chick embryo, Dev. Growth
nism underlying endocrine FGF specificity and activity,
Differ., 47, 213223, doi: 10.1111/j.1440 169X.2005.
PNAS, 116, 7819 7824, doi: /10.1073/pnas.1822055116.
00795.x.
24.
Rubinek, T., Shahmoon, S., Shabtay Orbach, A., Ben
38.
Dinh, Q. N., Drummond, G. R., Sobey, C. G., and
Ami, M., Levy Shraga, Y., et al. (2016) Klotho response to
Chrissobolis, S. (2014) Roles of inflammation, oxidative
treatment with growth hormone and the role of IGF I as a
stress, and vascular dysfunction in hypertension, Biomed.
mediator, Metabolism, 65, 15971604, doi: 10.1016/
Res. Int., 2014, 406960, doi: 10.1155/2014/406960.
j.metabol.2016.08.004.
39.
Förstermann, U., Xia, N., and Li, H. (2017) Roles of vas
25.
Chen, C. D., Podvin, S., Gillespie, E., Leeman, S. E., and
cular oxidative stress and nitric oxide in the pathogenesis of
Abraham C. R. (2007) Insulin stimulates the cleavage and
atherosclerosis, Circ. Res., 120, 713 735, doi: 10.1161/
release of the extracellular domain of Klotho by ADAM10
CIRCRESAHA.116.309326.
and ADAM17, Proc. Natl. Acad. Ssi. USA, 104, 19796
40.
Yamamoto, M., Clark, J. D., Pastor, J. V., Gurnani, P.,
19801, doi: 10.1073/pnas.0709805104.
Nandi, A., Kurosu, H., Miyoshi, M., Ogawa, Y.,
26.
Kim, J. H., Hwang, K. H., Park, K. S., Kong, I. D., and
Castrillon, D. H., Rosenblatt, K. P., and Kuro o, M.
Cha, S. K. (2015) Biological role of anti aging protein
(2005) Regulation of oxidative stress by the anti aging hor
klotho, J. Lifestyle Med., 5, 1 6, doi: 10.15280/jlm.
mone klotho, J. Biol. Chem.,
280,
3802938034,
2015.5.1.1.
doi: 10.1074/jbc.M509039200.
БИОХИМИЯ том 86 вып. 2 2021
172
ТЮРЕНКОВ и др.
41.
Wang, Y., Zhou, Y., and Graves, D. T. (2014) FOXO tran
55.
Zhao, Y., Meng, C., Wang, Y., Huang, H., Liu, W., Zhang,
scription factors: their clinical significance and regulation,
J. F., Zhao, H., Feng, B., Leung, P. S., and Xi, Y. (2016)
Biomed. Res. Int., 2014, 925350, doi: 10.1155/2014/
IL 1 inhibits Klotho expression and FGF19 signaling in
925350.
hepatocytes, Physiol. Endocrinol. Metab., 310, E289 300,
42.
Kawamori, D., Kaneto, H., Nakatani, Y., Matsuoka, T. A.,
doi: 10.1152/ajpendo.00356.2015.
Matsuhisa, M., Hori, M., and Yamasaki, Y. (2006) The
56.
Prud’homme, G. J., Glinka, Y., Kurt, M., Liu, W., and
forkhead transcription factor Foxo1 bridges the JNK path
Wang, Q. (2020) Systemic Klotho therapy protects against
way and the transcription factor PDX 1 through its intra
insulitis and enhances beta cell mass in NOD mice,
cellular translocation, J. Biol. Chem., 281, 1091 1098,
Biochem. Biophys. Res. Commun.,
525,
693698,
doi: 10.1074/jbc.M508510200.
doi: 10.1016/j.bbrc.2020.02.123.
43.
Ju, Y., Xu, T., Zhang, H., and Yu, A. (2014) FOXO1
57.
Navarro González, J. F., Donate Correa, J., Muros de
dependent DNA damage repair is regulated by JNK in lung
Fuentes, M., Pérez Hernández, H., Mart nez Sanz, R.,
cancer cells, Int. J. Oncol., 44, 1284 1292, doi: 10.3892/
and Mora Fernández, C. (2014) Reduced Klotho is asso
ijo.2014.2269.
ciated with the presence and severity of coronary artery dis
44.
Zhao, H. F., Wang, J., and Tony To, S. S. (2015) The
ease, Heart, 100, 3440, doi: 10.1136/heartjnl 2013
phosphatidylinositol 3 kinase/Akt and c Jun N terminal
304746.
kinase signaling in cancer: Alliance or contradiction? Int. J.
58.
Bergmark, B. A., Udell, J. A., Morrow, D. A., Jarolim, P.,
Oncol., 47, 429 436, doi: 10.3892/ijo.2015.3052.
Kuder, J. F., Solomon, S. D., Pfeffer, M. A., Braunwald,
45.
Sunayama, J., Tsuruta, F., Masuyama, N., and Gotoh, Y.
E., and Sabatine, M. S. (2019) Klotho, fibroblast growth
(2005) JNK antagonizes Akt mediated survival signals by
factor 23, and the renin angiotensin system - an analysis
phosphorylating 1433, J. Cell. Biol., 170, 295304,
from the PEACE trial, Eur. J. Heart Fail., 21, 462 470,
doi: 10.1083/jcb.200409117.
doi: 10.1002/ejhf.1424.
46.
Essers, M. A., Weijzen, S., de Vries Smits, A. M., Saarloos,
59.
Faul, C., Amaral, A. P., Oskouei, B., Hu, M. C., Sloan, A.,
I., de Ruiter, N. D., Bos, J. L., and Burgering, B. M.
and Isakova, T. (2011) FGF23 induces left ventricular
(2004) FOXO transcription factor activation by oxidative
hypertrophy, J. Clin. Invest., 121, 4393 4408, doi: 10.1172/
stress mediated by the small GTPase Ral and JNK,
JCI46122.
EMBO J., 23, 4802 4812, doi: 10.1038/sj.emboj.7600476.
60.
Xie, J., Yoon, J., An, S. W., Kuro o, M., and Huang, C.
47.
Essers, M. A., de Vries Smits, L. M., Barker, N.,
L. (2015) Soluble klotho protects against uremic cardiomy
Polderman, P. E., Burgering, B. M., and Korswagen, H. C.
opathy independently of fibroblast growth factor 23 and
(2005) Functional interaction between beta catenin and
phosphate, J. Am. Soc. Nephrol.,
26,
11501160,
FOXO in oxidative stress signaling, Science, 308, 1181
doi: 10.1681/ASN.2014040325.
1184, doi: 10.1126/science.1109083.
61.
Zhou, X., Li, S., Wang, Z., Yu, L., and Jiang, H. (2015)
48.
Yao, Y., Wang, Y., Zhang, Y., and Liu, C. (2017) Klotho
Klotho protein: a potential therapeutic agent during
ameliorates oxidized low density lipoprotein (Ox LDL)
myocardial ischemia and reperfusion, Int. J. Cardiol., 191,
induced oxidative stress via regulating LOX 1 and
227 228, doi: 10.1016/j.ijcard.2015.05.029.
PI3K/Akt/eNOS pathways, Lipids Health Dis., 16, 77,
62.
Takeshita, K., Fujimori, T., Kurotaki, Y., Honjo, H.,
doi: 10.1186/s12944 017 0447 0.
Tsujikawa, H., et al. (2004) Sinoatrial node dysfunction
49.
Yang, K., Nie, L., Huang, Y., Zhang, J., Xiao, T., Guan, X.,
and early unexpected death of mice with a defect of klotho
and Zhao, J. (2012) Amelioration of uremic toxin indoxyl
gene expression, Circulation,
109,
17761782,
sulfate induced endothelial cell dysfunction by Klotho
doi: 10.1161/01.CIR.0000124224.48962.32.
protein, Toxicol. Lett., 215, 77 83, doi: 10.1016/j.toxlet.
63.
Dermaku Sopjani, M., Sopjani, M., Saxena, A.,
2012.10.004.
Shojaiefard, M., Bogatikov, E., Alesutan, I., Eichenmüller,
50.
Chung, C. P., Chang, Y. C., Ding, Y., Lim, K., Liu, Q.,
M., and Lang, F. (2011) Downregulation of NaPi IIa and
Zhu, L., Zhang, W., Lu, T. S., Molostvov, G., Zehnder, D.,
NaPi IIb Na coupled phosphate transporters by coexpres
and Hsiao, L. L. (2017) α Klotho expression determines
sion of Klotho, Cell Physiol. Biochem., 28, 251258,
nitric oxide synthesis in response to FGF23 in human aor
doi: 10.1159/000331737.
tic endothelial cells, PLoS One,
12, e0176817,
64.
Hu, M. C., Shi, M., Zhang, J., Pastor, J., Nakatani, T., and
doi: 10.1371/journal.pone.0176817.
Lanske, B. (2010) Klotho: a novel phosphaturic substance
51.
Prud’homme, G. J., Glinka, Y., Kurt, M., Liu, W., and
acting as an autocrine enzyme in the renal proximal tubule,
Wang, Q. (2017) The anti aging protein Klotho is induced
FASEB J., 24, 3438 3450, doi: 10.1096/fj.10 154765.
by GABA therapy and exerts protective and stimulatory
65.
Sopjani, M., Alesutan, I., Dermaku Sopjani, M., Gu, S.,
effects on pancreatic beta cells, Biochem. Biophys. Res.
Zelenak, C., Munoz, C., Velic, A., Föller, M., Rosenblatt,
Commun., 493, 1542 1547, doi: 10.1016/j.bbrc.2017.10.029.
K. P., Kuro o, M., and Lang, F. (2011) Regulation of the
52.
Kusaba, T., Okigaki, M., Matui, A., Murakami, M.,
Na+/K+ ATPase by Klotho, FEBS Lett., 585, 1759 1764,
Ishikawa, K., et al. (2010) Klotho is associated with VEGF
doi: 10.1016/j.febslet.2011.05.021.
receptor 2 and the transient receptor potential canonical 1
66.
Boros, S., Bindels, R. J., and Hoenderop, J. G. (2009)
Ca2+ channel to maintain endothelial integrity, Proc. Natl.
Active Ca(2+) reabsorption in the connecting tubule,
Acad. Sci. USA, 107, 19308 19313, doi: 10.1073/pnas.
Pflugers Arch., 458, 99 109, doi: 10.1007/s00424 008
1008544107.
0602 6.
53.
Semba, R. D., Cappola, A. R., Sun, K., Bandinelli, S.,
67.
Munoz, C., Pakladok, T., Almilaji, A., Elvira, B.,
Dalal, M., Crasto, C., Guralnik, J. M., and Ferrucci, L.
Seebohm, G., Voelkl, J., Föller, M., Shumilina, E., and
(2011) Plasma klotho and cardiovascular disease in adults,
Lang, F. (2013) Klotho sensitivity of the hERG channel,
J. Am. Geriatr. Soc., 59, 1596 1601, doi: 10.1111/j.1532
FEBS Lett.,
587,
16631668, doi:
10.1016/j.feb
5415.2011.03558.x.
slet.2013.04.011.
54.
Kokkinaki, M., Abu Asab, M., Gunawardena, N., Ahern, G.,
68.
Kaess, B. M., Rong, J., Larson, M. G., Hamburg, N. M.,
Javidnia, M., Young, J., and Golestaneh, N. (2013) Klotho
Vita, J. A., Levy, D., Benjamin, E. J., Vasan, R. S., and
regulates retinal pigment epithelial functions and protects
Mitchell, G. F. (2012) Aortic stiffness, blood pressure pro
against oxidative stress, J. Neurosci., 33, 16346 16359,
gression, and incident hypertension, JAMA, 308, 875 881,
doi: 10.1523/JNEUROSCI.0402 13.2013.
doi: 10.1001/2012.jama.10503.
БИОХИМИЯ том 86 вып. 2 2021
БЕЛОК КЛОТО, СЕРДЦЕ И СОСУДЫ
173
69.
Cavalcante, J. L., Lima, J. A., Redheuil, A., and Al
strates an essential physiological role of FGF23 in phos
Mallah, M. H. (2011) Aortic stiffness: current understand
phate and vitamin D metabolism, J. Clin. Invest. 113, 561
ing and future directions, J. Am. Coll. Cardiol., 57, 1511
568, doi: 10.1172/JCI19081.
1522, doi: 10.1016/j.jacc.2010.12.017.
84.
Zhao, Y., Zhao, M. M., Cai, Y., Zheng, M. F., Sun, W. L.,
70.
Gao, D., Zuo, Z., Tian, J., Ali, Q., Lin, Y., Lei, H., and
Zhang, S. Y., Kong, W., Gu, J., Wang, X., and Xu, M. J.
Sun, Z. (2016) Activation of SIRT1 attenuates klotho defi
(2015) Mammalian target of rapamycin signaling inhibi
ciency induced arterial stiffness and hypertension by
tion ameliorates vascular calcification via Klotho upregula
enhancing AMP activated protein kinase activity,
tion, Kidney Int., 88, 711 721, doi: 10.1038/ki.2015.160.
Hypertension, 68, 1191 1199, doi: 10.1161/HYPERTEN
85.
Chang, J. R., Guo, J., Wang, Y., Hou, Y. L., Lu, W. W., et al.
SIONAHA.116.07709.
(2016) Intermedin1 53 attenuates vascular calcification in
71.
Mencke, R., and Hillebrands, J. L. (2016) The Role of the
rats with chronic kidney disease by upregulation of α Klotho,
anti ageing protein klotho in vascular physiology and
Kidney Int., 89, 586 600, doi: 10.1016/j.kint.2015.12.029.
pathophysiology, Nature, 553, 461 466, doi: 10.1016/j.arr.
86.
Agarwal, I., Ide, N., Ix, J. H., Kestenbaum, B., Lanske, B.,
2016.09.001.
Schiller, N. B., Whooley, M. A., and Mukamal, K. J.
72.
Chen, K., and Sun, Z. (2019) Autophagy plays a critical
(2014) Fibroblast growth factor 23 and cardiac structure
role in Klotho gene deficiency induced arterial stiffening
and function, J. Am. Heart Assoc.,
3, e000584,
and hypertension, J. Mol. Med. (Berl), 97, 1615 1625,
doi: 10.1161/JAHA.113.000584.
doi: 10.1007/s00109 019 01841 6.
87.
Hu, M. C., Shi, M., Cho, H. J., Adams Huet, B., Paek, J.,
73.
Zhou, X., Chen, K., Wang, Y., Schuman, M., Lei, H., and
et al. (2015) Klotho and phosphate are modulators of
Sun, Z. (2016) Antiaging gene Klotho regulates adrenal
pathologic uremic cardiac remodeling, J. Am. Soc.
CYP11B2 expression and aldosterone synthesis, JASN, 27,
Nephrol., 26, 1290 1302, doi: 10.1681/ASN.2014050465.
1765 1776, doi: 10.1681/ASN.2015010093.
88.
Jia, Z., Wei, L., Liu, Q., Zhu, Z., Yang, J., Yang, X., Gan,
74.
Hu, M. C., Shi, M., Gillings, N., Flores, B., Takahashi,
S., Chen, W., and Zhang, L. (2015) Impact of transfection
M., Kuro O, M., and Moe, O. W. (2017) Recombinant
with recombinant adenovirus vector mediated Klotho gene
α Klotho may be prophylactic and therapeutic for acute to
on myocardial remodeling in a rat model of heart failure,
chronic kidney disease progression and uremic cardiomy
Zhonghua Xin Xue Guan Bing Za Zhi, 43, 219 226.
opathy, Kidney Int.,
91,
11041114, doi:
10.1016/
89.
Tang, G., Shen, Y., Gao, P., Song, S. S., and Si, L. Y.
j.kint.2016.10.034.
(2018) Klotho attenuates isoproterenol induced hyper
75.
Xie, J., Cha, S. K., An, S. W., Kuro O, M., Birnbaumer,
trophic response in H9C2 cells by activating Na+/K+
L., and Huang, C. L. (2012) Cardioprotection by Klotho
ATPase and inhibiting the reverse mode of Na+/Ca2+
through downregulation of TRPC6 channels in the mouse
exchanger, In Vitro Cell Dev. Biol. Anim., 54, 250 256,
heart, Nat. Commun., 3, 123, doi: 10.1038/ncomms2240.
doi: 10.1007/s11626 017 0215 5.
76.
Wu, X., Eder, P., Chang, B., and Molkentin, J. D. (2010)
90.
Москалёв А. В., Рудой А. С., Апчел А. В., Зуева В. О.,
TRPC channels are necessary mediators of pathologic car
Казымова О. Э. (2016) Особенности биологии транс
diac hypertrophy, Proc. Natl. Acad. Sci. USA, 107, 7000
формирующего ростового фактора β и иммунопатоло
7005, doi: 10.1073/pnas.1001825107.
гия, Вестн. РВМА, 54, 206 216.
77.
Eder, P., and Molkentin, J. D. (2011) TRPC channels as
91.
Заславская Е. Л., Морозов А. Н., Ионин В. А., Ма И.,
effectors of cardiac hypertrophy, Circ. Res., 108, 265 272,
Нифонтов С. Е., Баранова Е. И., Яшин С. М., Шлях
doi: 10.1161/CIRCRESAHA.110.225888.
то Е. В. (2018) Роль трансформирующего фактора рос
78.
Hu, M. C., Shi, M., Zhang, J., Quiñones, H., Griffith, C.,
та бета1 и галектина 3 в формировании фиброза лево
Kuro O, M., and Moe, O. W. (2011) Klotho deficiency
го предсердия у пациентов с пароксизмальной фор
causes vascular calcification in chronic kidney disease, J.
мой фибрилляции предсердий и метаболическим
Am. Soc. Nephrol., 22, 124136, doi: 10.1681/ASN.
синдромом, Рос. кардиол. ж., 154, 60 66.
2009121311.
92.
Корженевская К. В., Гавришева Н. А., Панов А. В.,
79.
Yamada, S., and Giachelli, C. M. (2017) Vascular calcifi
Сесь Т. П., Алугишвили М. З., Козлов В. В. (2010)
cation in CKD MBD: Roles for phosphate, FGF23, and
Трансформирующий фактор роста β1 при различном
Klotho, Bone, 100, 8793, doi: 10.1016/j.bone.2016.
клиническом течении ишемической болезни сердца
11.012.
после операции коронарного шунтирования, Мед. им3
80.
Lindberg, K., Olauson, H., Amin, R., Ponnusamy, A.,
мунология, 12, 521 528.
Goetz, R., Taylor, R. F., Mohammadi, M., Canfield, A.,
93.
Inoue, N., Maeda, R., Kavakami, H., Shokawa, T.,
Kublickiene, K., and Larsson, T. E. (2013) Arterial klotho
Yamamoto, H., Ito, C., and Sasaki, H. (2009) Aortic pulse
expression and FGF23 effects on vascular calcification and
wave velocity predicts cardiovascular mortality in middle
function, PLoS One, 8, e60658, doi: 10.1371/journal.
aged and elderly Japanese men, Circ. J., 73, 549 553,
pone.0060658.
doi: 10.1253/circj.cj 08 0492.
81.
Lim, K., Lu, T. S., Molostvov, G., Lee, C., Lam, F. T.,
94.
Ding, J., Tang, Q., Luo, B., Zhang, L., Lin, L., Han, L.,
Zehnder, D., and Hsiao, L. L. (2012) Vascular Klotho defi
Hao, M., Li, M., Yu, L., and Li, M. (2019) Klotho inhibits
ciency potentiates the development of human artery calci
angiotensin II induced cardiac hypertrophy, fibrosis, and
fication and mediates resistance to fibroblast growth factor
dysfunction in mice through suppression of transforming
23, Circulation, 125, 2243 2255, doi: 10.1161/CIRCULA
growth factor β1 signaling pathway, Eur. J. Pharmacol.,
TIONAHA.111.053405.
859, 172549, doi: 10.1016/j.ejphar.2019.172549.
82.
Jimbo, R., Kawakami Mori, F., Mu, S., Hirohama, D.,
95.
Ucar, A., Gupta, S. K., Fiedler, J., Erikci, E., Kardasinski,
Majtan, B., Shimizu, Y., Yatomi, Y., Fukumoto, S., Fujita,
M., et al. (2012) The miRNA 212/132 family regulates
T., and Shimosawa, T. (2014) Fibroblast growth factor 23
both cardiac hypertrophy and cardiomyocyte autophagy,
accelerates phosphate induced vascular calcification in the
Nat. Commun., 3, 1078, doi: 10.1038/ncomms2090.
absence of Klotho deficiency, Kidney Int., 85, 1103 1111,
96.
Chen, Q., Zhang, H., Liu, Y., Adams, S., Eilken, H.,
doi: 10.1038/ki.2013.332.
Stehling, M., Corada, M., Dejana, E., Zhou, B., and
83.
Shimada, T., Kakitani, M., Yamazaki, Y., Hasegawa, H.,
Adams, R. H. (2016) Endothelial cells are progenitors of
Takeuchi, Y., Fujita, T., Fukumoto, S., Tomizuka, K., and
cardiac pericytes and vascular smooth muscle cells, Nat.
Yamashita, T. (2004) Targeted ablation of Fgf23 demon
Commun., 7, 12422, doi: 10.1038/ncomms12422.
БИОХИМИЯ том 86 вып. 2 2021
174
ТЮРЕНКОВ и др.
97. Arking, D. E., Becker, D. M., Yanek, L. R., Fallin, D.,
and Matsubara, H. (2004) HMG CoA reductase inhibitors
Judge, D. P., Moy, T. F., Becker, L. C., and Dietz, H. C.
up regulate anti aging klotho mRNA via RhoA inactiva
(2003) KLOTHO allele status and the risk of early onset
tion in IMCD3 cells, Cardiovasc. Res., 64, 331 336,
occult coronary artery disease, Am. J. Hum. Genet., 72,
doi: 10.1016/j.cardiores.2004.07.011.
1154 1161, doi: 10.1086/375035.
105. Yoon, H. E., Ghee, J. Y., Piao, S., Song, J. H., Han, D. H.,
98. Majumdar, V., Nagaraja, D., and Christopher, R. (2010)
Kim, S., Ohashi, N., Kobori, H., Kuro O, M., and Yang, C.
Association of the functional KL VS variant of Klotho
W. (2011) Angiotensin II blockade upregulates the expres
gene with early onset ischemic stroke, Biochem. Biophys.
sion of Klotho, the anti ageing gene, in an experimental
Res. Commun.,
403,
412416, doi:
10.1016/j.bbrc.
model of chronic cyclosporine nephropathy, Nephrol. Dial.
2010.11.045.
Transplant., 26, 800 813, doi: 10.1093/ndt/gfq537.
99. Oguro, R., Kamide, K., Kokubo, Y., Shimaoka, I.,
106. Cheng, L., Zhang, L., Yang, J., and Hao, L. (2017)
Congrains, A., et al. (2010) Association of carotid athero
Activation of peroxisome proliferator activated receptor γ
sclerosis with genetic polymorphisms of the klotho gene in
inhibits vascular calcification by upregulating Klotho, Exp.
patients with hypertension, Geriatr. Gerontol. Int., 10, 311
Ther. Med., 13, 467 474, doi: 10.3892/etm.2016.3996.
318, doi: 10.1111/j.1447 0594.2010.00612.x.
107. Haussler, M. R., Whitfield, G. K., Haussler, C. A., Sabir,
100. Imamura, A., Okumura, K., Ogawa, Y., Murakami, R.,
M. S., Khan, Z., Sandoval, R., and Jurutka, P. W. (2016)
Torigoe, M., Numaguchi, Y., and Murohara, T. (2006)
1,25 Dihydroxyvitamin D and Klotho: A tale of two renal
Klotho gene polymorphism may be a genetic risk factor for
hormones coming of age, Vitam. Horm., 100, 165 230,
atherosclerotic coronary artery disease but not for
doi: 10.1016/bs.vh.2015.11.005.
vasospastic angina in Japanese, Clin. Chim. Acta., 371, 66
108. Lorenzi, O., Veyrat Durebex, C., Wollheim, C. B.,
70, doi: 10.1016/j.cca.2006.02.021.
Villemin, P., Rohner Jeanrenaud, F., Zanchi, A., and
101. Majumdar, V., Jose, D., and Christopher, R.
(2011)
Vischer, U. M. (2010) Evidence against a direct role of
Influence of Klotho genotypes on plasma NO(x) levels in
klotho in insulin resistance, Pflugers Arch., 459, 465 473,
South Indian population, Thromb Res., 128, 251 255,
doi: 10.1007/s00424 009 0735 2.
doi: 10.1016/j.thromres.2011.04.002.
109. Bilan, V. P., Salah, E. M., Bastacky, S., Jones, H. B.,
102. Pavlatou, M. G., Remaley, A. T., and Gold, P. W. (2016)
Mayers, R. M., Zinker, B., Poucher, S. M., and Tofovic,
Klotho: a humeral mediator in CSF and plasma that influ
S.P. (2011) Diabetic nephropathy and long term treatment
ences longevity and susceptibility to multiple complex dis
effects of rosiglitazone and enalapril in obese ZSF1 rats, J.
orders, including depression, Transl. Psychiatry, 6, e876,
Endocrinol., 210, 293 308, doi: 10.1530/JOE 11 0122.
doi: 10.1038/tp.2016.135.
110. Dagenais, G. R., Gerstein, H. C., Holman, R., Budaj, A.,
103. Qiu, X., Guo, Q., Xiong, W., Yang, X., and Tang, Y. Q.
Escalante, A., et al. (2008) Effects of ramipril and rosiglita
(2016) Therapeutic effect of astragaloside IV on bradycar
zone on cardiovascular and renal outcomes in people with
dia is involved in up regulating klotho expression, Life Sci.,
impaired glucose tolerance or impaired fasting glucose:
144, 94 102, doi: 10.1016/j.lfs.2015.11.021.
results of the diabetes reduction assessment with ramipril
104. Narumiya, H., Sasaki, S., Kuwahara, N., Irie, H., Kusaba,
and rosiglitazone medication (DREAM) Trial, Diabetes
T., Kameyama, H., Tamagaki, K., Hatta, T., Takeda, K.,
Care, 31, 1007 1014, doi: 10.2337/dc07 1868.
KLOTHO PROTEIN AND THE CARDIOVASCULAR SYSTEM
Review
I. N. Tyurenkov1, V. N. Perfilova1*, A. A. Nesterova2, and E. Yu. Glinka3
1 Volgograd State Medical University, 400066 Volgograd, Russia;
E3mail: vnperfilova@mail.ru; vnperfilova@gmail.com
2 Pyatigorsk State Pharmaceutical Academy, 357500 Pyatigorsk, Russia
3 Keenan Research Centre, St. Michael's Hospital, Toronto, Canada
Klotho protein affects a number of metabolic pathways essential for pathogenesis of cardiovascular diseases. It inhibits
lipid peroxidation and inflammation, it prevents endothelial injury and calcification of blood vessels. Klotho decreas
es rigidity of blood vessels and suppresses the development of heart fibrosis. Low level of its expression coincides with
a number of diseases. Cardioprotective effect of klotho is based on its ability to interact with multiple receptors and
ion channels. Being a pleiotropic protein, klotho may become a useful target for therapeutic intervention in the treat
ment of cardiovascular diseases. We list hereby pharmaceuticals that stimulate klotho expression and suggest some
possible perspectives for future studies.
Keywords: klotho protein, heart failure, coronary heart disease, cardiomyopathy, arterial hypertension
БИОХИМИЯ том 86 вып. 2 2021