БИОХИМИЯ, 2021, том 86, вып. 2, с. 228 - 235
УДК 577.152.342
УСИЛЕНИЕ РАСТВОРИМОСТИ И ОДНОСТАДИЙНАЯ ОЧИСТКА
ФУНКЦИОНАЛЬНОГО ДИМЕРА КАРБОКСИПЕПТИДАЗЫ G2*
© 2021
А. Ходакарами1, Б. Дабирманеш1**, С. Асад2, М. Каледи1
1 Department of Biochemistry, Faculty of Biological Sciences, Tarbiat Modares University,
14115 Tehran, Iran; E mail: dabirmanesh@modares.ac.ir
2 Department of Biotechnology, College of Science, University of Tehran, 14155 Tehran, Iran
Поступила в редакцию 02.04.2020
После доработки 22.09.2020
Принята к публикации 13.10.2020
Карбоксипептидаза G2 (CPG2) является бактериальным ферментом, который катализирует переход метот
рексата в его неактивные формы. Далее эти продукты в присутствии высоких доз метотрексата у пациентов
с почечными нарушениями выводятся, минуя почки. В связи с возрастающим спросом на этот фермент
важно было упростить процесс его продукции. С этой целью в настоящем исследовании проведена попыт
ка выделить и очистить этот ценный фермент, используя интеин опосредованную очистку с помощью хи
тин связывающей аффинной метки. Таким образом, ген CPG2 из Pseudomonas sp. (штамм RS16) был опти
мизирован, синтезирован и клонирован в экспрессионный вектор pTXB1. Впоследствии конструкцию
трансформировали в штамм BL21 (DE3) Escherichia сoli. Оптимальные условия для его растворимой
экспрессии достигались в 2×YT среде, содержащей 1% глюкозу, 0,5 мМ IPTG через 30 ч инкубации при
25 °C. Фермент без интеина экспрессировался в форме инклюзивных телец, что указывает на необходи
мость интеина для солюбилизации белка. Затем экспрессированный гомодимерный белок очищали до го
могенности с помощью хитиновой аффинной колонки. Для очищенного белка были получены значения Km
и kcat 6,5 мкМ и 4,57 с-1 соответственно. Анализ гель фильтрации показал, что полученный рекомбинант
ный белок представляет собой димер с молекуляроной массой 83 kDa. Флуоресцентная спектроскопия и
метод спектроскопии кругового дихроизма подтвердили наличие у CPG2 третичной и вторичной структур
соответственно. Применение интеин опосредованной системы обеспечило возможность одностадийной
очистки CPG2, открыв путь к использованию карбоксипептидазы G2 в фармацевтике.
КЛЮЧЕВЫЕ СЛОВА: карбоксипептидаза G2; интеин, метотрексат.
DOI: 10.31857/S032097252102007X
ВВЕДЕНИЕ
также как глюкарпидаза и продается под назва
нием Voraxaze [3, 4].
Карбоксипептидаза G2 (CPG2) является ди
В связи с его значимостью необходимо полу
мерным цинк зависимым металлоферментом,
чить этот фермент в высокоочищенной форме,
экзопептидазой с молекуляроной массой (ММ)
сохраняя при этом его активность и структуру.
83 kDa, которая превращает метотрексат (MTX)
Очистка часто является основным этапом и
в его неактивную форму, 4 дезокси 4 амино
сложным процессом в получении рекомбинант
N10 метилпропионовую кислоту и глутамат,
ных фармацевтических белков в биомедицинс
удаляя С концевой глутамат из фолиевой кисло
ких и биотехнологических исследованиях [5].
ты и её аналогов [1, 2]. CPG2 обеспечивает не
Стандартные методы требуют ряд дорогостоя
почечное удаление MTX у пациентов с почеч
щих и трудоемких этапов выделения, включая
ной недостаточностью. Эта активность сделала
разнообразные хроматографические стадии.
CPG2 ферментом, представляющим медицинс
Поэтому необходимость простой и экономичес
кий интерес. Карбоксипептидаза G2 известна
ки эффективной схемы очистки очевидна. К
настоящему времени в коммерческих целях ис
пользуются различные технологии для извлече
Принятые сокращения: КД - круговой дихроизм;
ММ - молекулярная масса; МТХ - метотрексат; CBD - ния нужных белков из грубых биологических
хитин связывающий домен; CPG2 - карбоксипептидаза
экстрактов с использованием простых, недоро
G2; IPTG - изопропил β D 1 тиогалактопиранозид.
гих и одностадийных методов [6, 7].
* Первоначально английский вариант рукописи опубли
Обратимое аффинное взаимодействие меж
msu.ru/biokhimiya, в рубрике «Papers in Press», BM20 099,
ду лигандом и связывающей его мишенью ши
18.01.2021.
роко используется при очистке биомолекул.
** Адресат для корреспонденции.
Присутствие аффинной метки может влиять на
228
ЭКСПРЕССИЯ И ОДНОЭТАПНАЯ ОЧИСТКА КАРБОКСИПЕПТИДАЗЫ G2
229
характеристики или функции белка мишени,
Иран); метотрексат и карбоксипептидаза
поэтому может возникнуть необходимость уда
G2 («Sigma Aldrich», USA); рестрикционные эн
лить метку, особенно в случае терапевтических
донуклеазы, pfu DNA полимераза и T4 DNA ли
белков. На стадии очистки для удаления метки
газа («Thermo Scientific», США); молекулярно
требуется добавлять ферменты или химические
биологические киты («GeneAll», Южная Ко
соединения [8, 9]. Эти ферментативные методы
рея); Q Сефароза («GE Healthcare», Великобри
могут также увеличивать затраты на процесс
тания). В работе использовали праймеры произ
производства и в некоторых случаях могут при
водства «Macrogen», Корея. Интеин опосредо
вести к добавлению аминокислотных остатков к
ванная очищающая аффинная хитин связыва
слитному белку в месте расщепления [10, 11].
ющая система tag была разработана компани
Поэтому для удобного удаления меток с по
ей «New England Biolab», Великобритания. Если
мощью различных способов, таких как добавле
не указано иное, остальные реактивы производ
ние восстановителей и изменение pH или тем
ства «Merck», Германия. Все реактивы были ана
пературы в зависимости от используемой
литической степени чистоты.
конструкции, были созданы самоотщепляющи
Клонирование и конструирование рекомбинант;
еся интеиновые аффинные метки. Однако ин
ной плазмиды pTXB1-CPG2. Ген, кодирую
дукция расщепления при изменении температу
щий карбоксипептидазу G2, был синтезирован
ры или рН in vivo не поддается жесткому контро
«GeneCust», Франция, предпочтительно на ос
лю и может привести к потере продукта, в то
нове кодона E. coli. Праймеры (прямой праймер:
время как восстановление тиола может нару
5′ GGTGGTCATATGGCACTGGCACAAAA
шить структуру белков, содержащих дисульфид
GCGTGAC 3′; обратный праймер: 5′ GGTG
ные связи [12-14].
GTTGCTCTTCCGCATTTGCCAGCACCCA
Целью настоящего исследования было упро
GATCCATAATCAGG 3′) были созданы для
щение производства CPG2. Для этого последо
ампплификации и клонирования гена карбок
вательность гена карбоксипептидазы G2
сипептидазы G2 в pTXB1 (внутрь сайтов рест
Pseudomonas sp. (штамм RS 16) была оптимизи
рикции NdeI and SapI). ПЦР выполняли на при
рована, синтезирована и клонирована в
боре Bio Rad thermocycler («Bio Rad», США).
экспрессионный вектор pTXB1. Рекомбинант
Условия проведения ПЦР включали следующие
ную конструкцию трансформировали в клетки
этапы: преденатурация при 95 °C в течение
Escherichia coli BL21 (DE3), и подобрали опти
5 мин; далее 30 циклов (95 °C в течение 1 мин,
мальные условия для ее экспрессии. Белок, ко
59 °C в течение 1 мин и 72 °C в течение 1 мин) и
дируемый конструкцией pTXB1-CPG2, содер
достройку цепи при 72 °C в течение 10 мин. За
жал аффинную метку интеина и хитин связыва
тем продукт ПЦР наносили на 1% ный (w/v)
ющего домена (CBD) на своем С конце. Полу
агарозный гель и очищали. Очищенный фраг
ченный меченый фермент был значительно бо
мент расщепляли эндонуклеазами рестрикции
лее растворим, чем нативный фермент без мет
NdeI и SapI и клонировали в дважды расщеп
ки. Поскольку полученный рекомбинантный
лённую плазмиду pTXB1 («New England Biolab»,
белок не имел дисульфидных связей, тиол ин
Великобритания). Секвенирование ДНК
дуцированная расщепляющая активность инте
(«Macrogen», Южная Корея) подтвердило встав
ина использовалась для высвобождения CPG2 с
ленную последовательность. Полученная кон
хитиновой колонки, в то время как интеин и
струкция (pTXB1-CPG2) была трансформиро
CBD оставались прикрепленными к сорбен
вана в E. coli BL21 (DE3).
ту (одностадийная очистка). Были определены
Экспрессия карбоксипептидазы G2 в E. coli.
кинетические параметры высвобождаемого
Для подбора оптимальных условий экспрессии
фермента. Вторичная и третичная структуры
были тестированы варианты концентраций
очищенного CPG2 были проанализированы с
IPTG (0,1; 0,5 и 1 мМ), различные культураль
помощью кругового дихроизма (КД) и флуорес
ные среды [Luria Bertani (LB), минимальная сре
центной спектроскопии.
да (M9) и триптон дрожжевой экстракт (2xYT)],
время (10, 20 и 30 ч) и температуры (25, 30 и
37 °C). Среду 2xYT (1 литр), содержащую ампи
МАТЕРИАЛЫ И МЕТОДЫ
циллин (100 мкг/мл), инокулировали трансфор
мированными бактериальными клетками и ин
Химические соединения, бактериальные
кубировали при 37 °C, 180 rpm, до значения
штаммы и плазмиды. В исследованиях использо
ОП 0,5-0,6. Затем экспрессию белка индуциро
вали следующие реактивы: дрожжевой экстракт
вали 0,5 мМ IPTG при 25 °C в течение 30 ч в при
и триптон («Liofilchem», Италия); изопропил β
сутствии 1% глюкозы. Клетки собирали центри
D 1 тиогалактопиранозид (IPTG, «Cinnagen»,
фугированием (8000 g, 15 мин, 4 °C). Бактери
БИОХИМИЯ том 86 вып. 2 2021
230
ХОДАКАРАМИ и др.
альные осадки ресуспендировали в 20 мМ Tris
Perkin Elmer («Perkin Elmer Inc.», США), и ис
HCl (pH 8,0), содержавшем 300 мМ NaCl, и об
ходную скорость реакции определяли при помо
рабатывали ультразвуком на льду в условиях
щи линейной регрессии. Данные вставлялись в
8 импульсов по 10 с. Растворимую и нераствори
уравнение Михаэлиса-Ментена, и кинетичес
мую фракции белка разделяли центрифугирова
кие параметры рассчитывались с использова
нием (8000 g, 30 мин, 4 °C).
нием программного обеспечения GraphPad
Стадии очистки фермента. Колоночная хрома
Prism 7. Одну единицу фермента определяли как
тография с хитином. Для очистки фермента и
количество CPG2, необходимое для превраще
удаления его хитин связывающей метки и инте
ния 1 мкмоль субстрата в продукт за 1 мин
ина аффинную хроматографию проводили на
[17, 18].
смоле, покрытой хитином, в соответствии с ре
Необходимо отметить, что до определения
комендациями производителя. Вкратце, хити
активности лиофилизованный коммерческий
новую колонку уравновешивали 20 мМ Tris
фермент (0,4 мг/мл) был растворён в 50 мМ Tris
HCl (pH 8,0), содержащим 500 мМ NaCl. Белок
HCl (pH
7,5) и диализован (для отсече
загружали в колонку и промывали 20 объемами
ния 30 kDa) против этого же буфера (50 мМ Tris
того же буфера. Связанный белок инкубировали
HCl) для удаления возможных неизвестных
в
20
мМ Tris HCl (pH
8,0), содержащем
примесей.
500 мМ NaCl и 50 мМ дитиотреитола (DTT), при
Гель;фильтрация. Лизозим (14 kDa), овальбу
4 °C в течение 16-40 ч. Элюированные образцы
мин (43 kDa), бычий сывороточный альбу
собирали в виде фракций по 0,5 мл. SDS
мин (66 kDa) и альдолаза (150 kDa) использова
PAGE (12% полиакриламид) использовали для
ли для построения стандартной кривой (log ММ
подтверждения чистоты CPG2 и полного удале
к объёму) с использованием Sephadex G
ния интеина и CBD.
100 («GE Healthcare», США). Затем очищенный
Колоночная хроматография на Q Сефарозе.
CPG2 загружали в колонку, уравновешенную
Для сохранения метки фермент, содержавший
50 мМ Tris HCl, содержащим 150 мМ NaCl, и
связанную с хитином метку и интеин, очищали
элюировали тем же буфером для определения
на Q Сефарозе. С этой целью исходный
его молекулярной массы (ММ).
экстракт был нанесён на колонку с Q Сефаро
Структурные исследования. Флуоресцентная
зой, предварительно уравновешенную 20 мМ
спектроскопия. Флуоресцентное излучение аро
Tris HCl буфером (pH 8,0).
матических остатков CPG2 в
50
мМ Tris
После промывания колонки тем же буфером
HCl (pH 7,5) измерялось на люминесцентном
был применён линейный градиент 0-2 M NaCl в
спектрофотометре Perkin Elmer LS 55 («Perkin
20 мМ Tris HCl (pH 8,0). Связанный фермент
Elmer Inc.», США). Использовали длину волны
элюировали
20
мМ Tris HCl, содержащим
возбуждения 280 нм, а эмиссионный спектр ре
0,8 M NaCl. Затем для удаления DTT буфер за
гистрировался в диапазоне 300-400 нм. Щели
меняли на 50 мМ Tris HCl (pH 7,5), используя
для возбуждения и излучения были установлены
центробежный фильтр Amicon Ultra 15
на 10 нм. Концентрация фермента составля
(«Millipore», США; отсечение - 10 kDa). Все
ла 30 мг/мл.
стадии проводили при 4 °C. После SDS PAGE
КД спектроскопия. Спектры КД в дальнем
белки окрашивали красителем Coomassie bril
УФ диапазоне (200-250 нм) записывали на
liant blue R 250 [15]. Концентрацию белка опре
спектрополяриметре JASCO J 715 («JASCO»,
деляли по методу Брэдфорда [16].
Япония). Концентрация CPG2 составляла
Активность фермента и биохимическая харак;
0,2 мг/мл в 50 мМ Tris HCl (pH 7,5). Результаты
теристика. Активность карбоксипептидазы G2
выражались как молярная эллиптичность [θ]
измеряли с использованием MTX в качестве
(град.·см2·дмоль-1) и рассчитывались по форму
субстрата. Разные концентрации субстра
ле [θ]λ = (θ × 100 MRW)/(cl), где c - концентра
та (1-200 мкМ) получали разведением сток
ция белка в мг/мл, l - длина оптического пути
раствора
(50
мМ) буфером
50
мМ Tris
света (см) и θ - измеренная эллиптичность (гра
HCl (pH 7,5), содержащим 50 мМ NaCl и
дусы) при длине волны λ.
0,2 мМ ZnSO4. Реакцию начинали добавлением
фермента к реакционной смеси (конечный объ
ем 300 мкл): 50 мкл очищенного рекомбинант
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
ного фермента слияния (1 мг/мл) или 10 мкл ре
комбинантного или коммерческого фермента
Для очистки целевого белка на хитин содер
без интеина (0,4 мг/мл).
жащей колонке использовали вектор pTXB1,
Поглощение при 320 нм (для MTX) непре
который содержит интеин из Mycobacterium
рывно регистрировали на спектрофотометре
xenopi и хитин связывающий домен (CBD) на
БИОХИМИЯ том 86 вып. 2 2021
ЭКСПРЕССИЯ И ОДНОЭТАПНАЯ ОЧИСТКА КАРБОКСИПЕПТИДАЗЫ G2
231
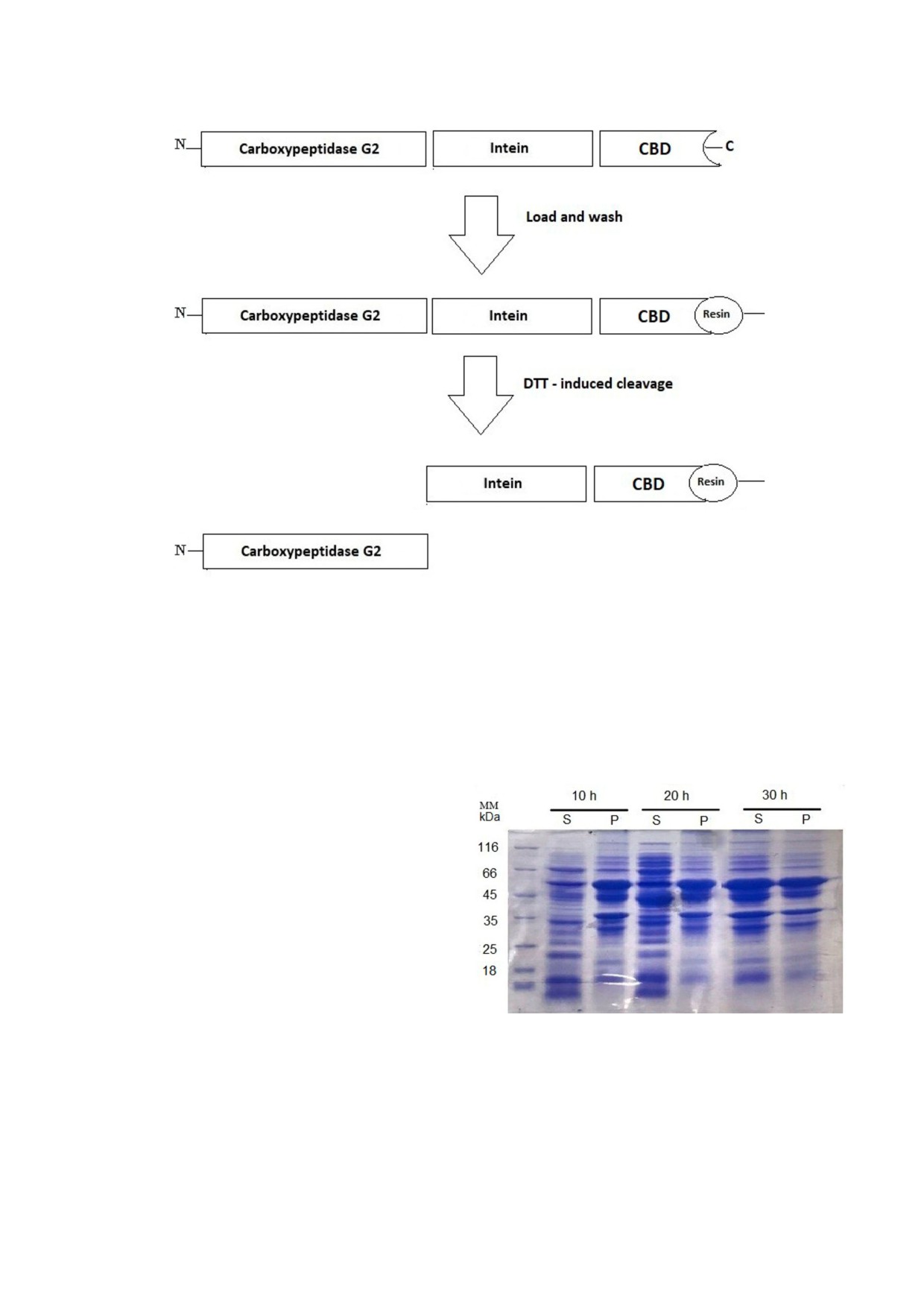
Рис. 1. Схематическое изображение конструкции гибридной карбоксипептидазы G2. Кодирующая последовательность
CPG2 была встроена в вектор pTXB1. Объединённая конструкция белка состояла из трёх частей: самого фермента, инте
ина и C концевого CBD для связывания со смолой, покрытой хитином, и для облегчения одностадийной очистки
С конце. CBD - одна из лучших альтернатив
воримого белка или к образованию телец вклю
гистидиновым меткам, поскольку он дешевле и
чения. Относительное содержание растворимого
его можно регенерировать большее количество
CPG2 в условиях оптимальной экспрессии было
раз [19, 20]. Генно инженерный интеин из
количественно определено с использованием
M. xenopi может подвергаться самоотщеплению
под действием тиоловых реагентов, в результате
чего высвобождается целевой белок (рис. 1).
В данном случае ген карбоксипептидазы G2 был
оптимизирован по кодонам, синтезирован и за
тем вставлен в NdeI и SapI (сайты рестрикции
вектора pTXB1) для предупреждения добавле
ния любой дополнительной аминокислоты к
очищенному ферменту после самоотщепле
ния (рис. 1). Правильное клонирование полного
гена подтверждали секвенированием ДНК по
лученной конструкции (pTXB-CPG2).
Впоследствии были тестированы различные
условия экспрессии, включая разные питатель
ные среды (LB, 2xYT и M9), концентрации
IPTG (0,1; 0,5 и 1 мМ), температуры (16, 25 и
Рис. 2. SDS PAGE анализ экспрессии карбоксипептидазы
37 °C) и время инкубации (10, 20 и 30 ч). Наи
G2 в оптимальных условиях. Экспрессия в среде 2xYT, со
большая растворимость белка (~ 50%) была дос
держащей 1% глюкозы, индукция 0,5 мМ IPTG при 25 °C в
течение 10, 20 и 30 ч. Оптимальные условия достигались
тигнута в среде 2xYT, содержавшей 1% глюкозы,
через 30 ч при 25 °C. S - супернатант, P - осадок. (С цвет
после индукции 0,5 мМ IPTG в течение 30 ч при
ными вариантами рис. 2 и 3 можно ознакомиться в элект
25 °C (рис. 2). В других условиях экспрессия бел
ка приводила к очень низкому количеству раст
journal/biokhsm/.)
БИОХИМИЯ том 86 вып. 2 2021
232
ХОДАКАРАМИ и др.
MM,
kDa
Рис. 3. а - SDS PAGE для анализа реакции расщепления на колонке слитого белка CPG2 в присутствии DTT в различ
ные моменты времени в течение 40 ч. Оптимальное время расщепления составляло 20 ч. После расщепления фермент
очищали до гомогенности. b - Определение молекулярной массы гель фильтрацией с использованием Sephadex G 100
программного обеспечения ImageJ (рис. 2), ко
кулярной массы от объема элюирования. Ре
торое продемонстрировало равные количества
зультаты показали наличие активной фрак
CPG2 в супернатанте и в осадке. Растворимая
ции (в объеме
110
мл), соответствующей
карбоксипептидаза G2 составляла около 35% от
ММ 83 kDa, что указывает на присутствие ди
общего количества белков в супернатанте.
мерного белка (рис. 3, b).
Растворённый экспрессированный белок
Кинетические параметры очищенного фер
был нанесён на колонку со связанным хитином.
мента с меткой CBD и без нее рассчитывали с
Отщепление интеина индуцировали 50 мМ DTT
использованием уравнения Михаэлиса-Мен
в течение 10, 20, и 40 ч при 4 °C. Инкубация в те
тен. Значения Km и kcat для очищенного фермен
чение 20 ч приводила к лучшему отщеплению, а
та были определены как 6,5 ± 0,3 мкМ и
через 40 ч степень отщепления существенно не
4,57 ± 0,23 с-1 соответственно, что существенно
изменялась, однако активность фермента значи
не отличалось от значений kcat и Km коммерчески
тельно снижалась. Выход активного CPG2 со
доступного CPG2 из Pseudomonas sp. («Sigma»),
ставил 305 мг CPG2 на литр культуры (табл. 1).
использованного в качестве контроля (табл. 2).
Очищенный белок дал полосу с ММ 42 kDa
Хотя для получения очищенного фермента за
на SDS PAGE (соответствует одной субъединице
одну стадию применялись очень большая метка
CPG2), что подтверждает полное удаление инте
и DTT, проверка активности и гель фильтрация
ина и CBD из карбоксипептидазы G2 (рис. 3, а).
показали, что фермент сохранил свою димерную
Молекулярную массу фермента определяли
структуру и восстановил свою активность после
гель фильтрацией на Sephadex G 100. Стандар
расщепления на колонке. Значение Km для очи
ты белков использовали для построения калиб
щенного фермента с интеином и хитин связыва
ровочной кривой зависимости логарифма моле
ющим доменом составляло ~47 мМ, а kcat состав
Таблица 1. Очистка растворимого CPG2 из 1 литра культуры
Этапы
Общий
Общая
Удельная
Целевой гибридный
Целевой
белок (мг)
активность (ед.)
активность (ед./мг)
белок (мг)
белок (мг)
Частицы (CPG2 с меткой)
~ 800
ND
ND
585
-
Супернатант (растворимый CPG2
1000
90
0,09
360
-
с меткой)
Колонка с хитин связанным доменом
305
1020
3,34
–
305
(растворимый CPG2 без метки)
БИОХИМИЯ том 86 вып. 2 2021
ЭКСПРЕССИЯ И ОДНОЭТАПНАЯ ОЧИСТКА КАРБОКСИПЕПТИДАЗЫ G2
233
Таблица 2. Кинетические параметры, полученные для
микробный) также экспрессировались с исполь
CPG2
зованием этой интеиновой системы [23-25].
Ранее CPG2 из Pseudomonas sp. (штамм
Фермент
Km (мкМ)
kcat (с-1)
kcat/K
m
RS16) был очищен с использованием трех ста
дий очистки, включающих хроматографии на
CPG2 (контроль)
6,3 ± 0,3
4,34 ± 0,22
0,68
SP Sephadex, DEAE Sepharose и затем с иммо
CPG2 (без интеина)
6,5 ± 0,3
4,57 ± 0,23
0,70
билизованной на Sepharose Procion red H
CPG2 (с интеином)
47,8 ± 2,4
0,47 ± 0,01
0,01
8BN [26]. В другом исследовании Minton et al.
[27] этот фермент экспрессировался в E. coli с
очень низким выходом. Чтобы улучшить его
экспрессию, Goda et al. [2] экспрессировали
ляло 0,47 с-1. По видимому, присутствие метки
синтетический ген с оптимизированными кодо
из за ее большого размера значительно снижает
нами в виде телец включения, которые требова
каталитическую эффективность.
ли рефолдинга, что могло снизить выход актив
Чтобы убедиться в отсутствии структурных
ного белка. В том же исследовании His метка
изменений в растворимой карбоксипептидазе
использовалась для одностадийной очистки с
G2, изучались также её вторичная и третичная
использованием колонки Ni NTA, но метка ос
структуры с использованием КД в дальнем УФ
тавалась неотщепленной [2]. Недавно Jeyharan
диапазоне и флуоресцентной спектроскопии.
et al. [28] сообщили о производстве растворимо
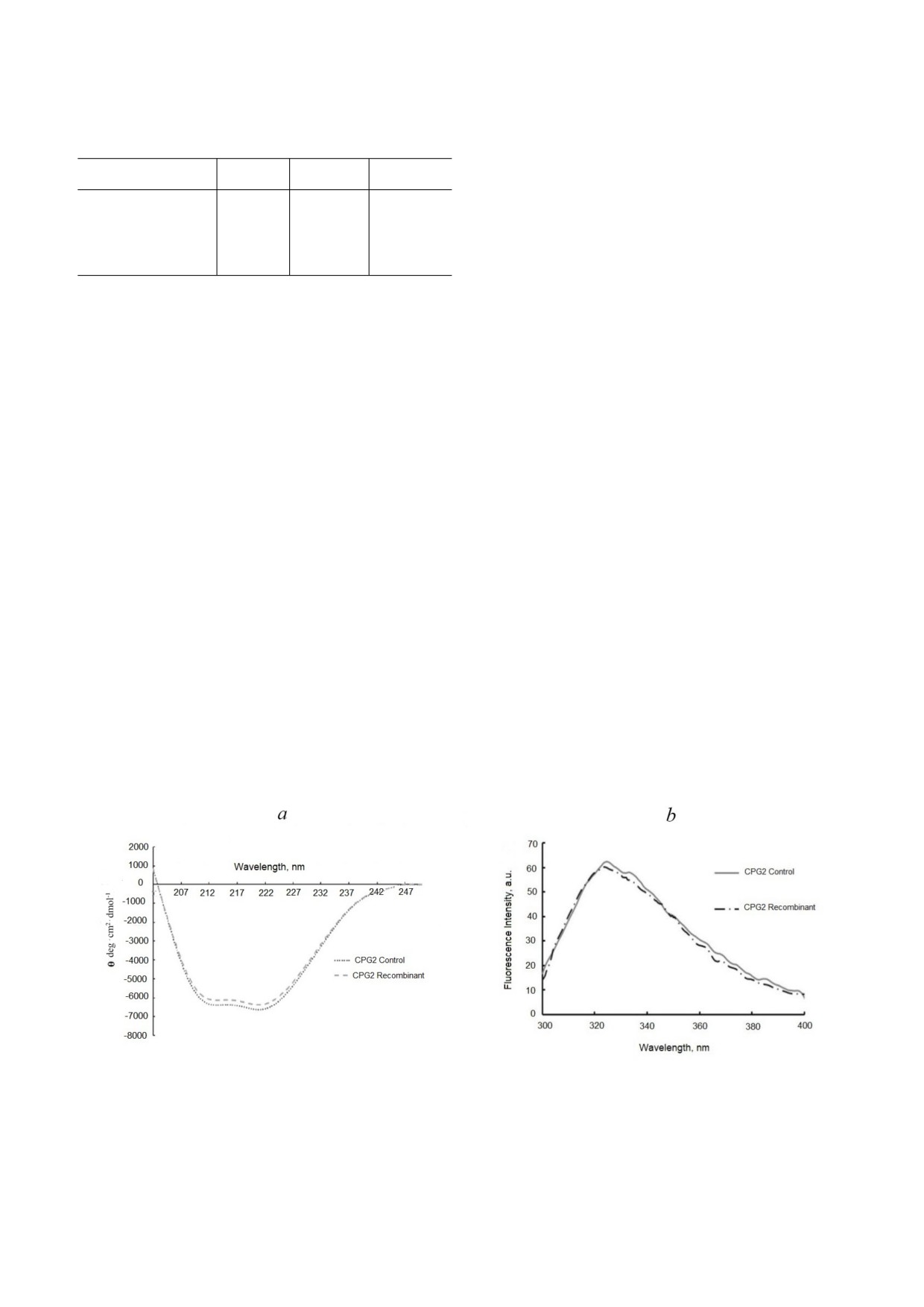
Спектр КД в дальнем УФ диапазоне полученно
го белка (250 мг/литр) с использованием His
го рекомбинантного фермента был подобен
метки для простой очистки. В их исследовании
спектру контрольного CPG2, показывая отри
метка была удалена протеазой TEV, что потребо
цательные пики, соответствующие структурам
вало дополнительной стадии очистки на колон
α спирали и β листа (рис. 4, а), о которых ранее
ке Ni NTA с последующей хроматографией на
сообщалось для карбоксипептидазы G2 [21].
Superdex 75 GL. Протеаза TEV - дорогой фер
Спектр флуоресценции рекомбинантной кар
мент; кроме того, расщепление TEV оставляет
боксипептидазы G2 также не отличался от конт
лишний остаток, который может не подходить
рольного (рис. 4, b).
для терапевтических белков [28].
Наши предыдущие исследования показали,
В текущем исследовании очистка CPG2 бы
что интеин можно использовать для очистки тет
ла упрощена до одной стадии с использованием
рамерного фермента (уриказы) [22]. Как и в те
самоотщепляющегося интеина без добавления
кущих исследованиях, функциональных и
аминокислот. К настоящему времени в ряде ис
структурных различий по сравнению с контро
следований сообщалось об очистке белков с по
лем не наблюдалось [22]. Кислые и основные
мощью интеинов, но уникальность характерис
факторы роста фибробластов человека, челове
тик каждого белка может привести к разным ре
ческий α 1 антитрипсин и цекропин (противо
зультатам. Таким образом, каждый белок требует
Рис. 4. Структурный анализ карбоксипептидазы G2. а - Спектры КД рекомбинантного и контрольного ферментов CPG2
карбоксипептидазы G2 (0,2 мг/мл) в 50 мМ Tris HCl (pH 7,5). b - Флуоресценция очищенного и контрольного фермен
тов CPG2. Длина волны возбуждения составляла 280 нм, и регистрировали излучение в диапазоне 300-400 нм. Концен
трация фермента составляла 60 мкг/мл в 50 мМ Tris HCl (pH 7,5)
БИОХИМИЯ том 86 вып. 2 2021
234
ХОДАКАРАМИ и др.
независимой оценки. В данной работе соответ
использовалась для очистки ряда белков, в дан
ствующий выход растворимого фермента
ном исследовании впервые оценивается ее вли
(305 мг/литр) был достигнут при оптимальных
яние на растворимость белка. В целом нам уда
условиях культивирования, и никаких структур
лось повысить растворимость экспрессирован
ных и функциональных изменений не произош
ного CPG2 и очистить его с помощью односта
ло. Другой ключевой аспект - способность этой
дийной процедуры, опосредованной интеином.
метки увеличивать растворимую экспрессию
Примечательно, что фермент сохранил свою ак
карбоксипептидазы G2. Прогноз ccSOL omics
тивность и гомодимерную структуру после про
был использован для расчёта показателя способ
цесса экспрессии и очистки. Наш результат все
ности к растворению и для идентификации раст
ляет надежду на то, что использование интеинов
воримых фрагментов в белке. Эта программа
для очистки мультимерных белков может стать
предсказывает результаты эндогенной и гетеро
перспективным вариантом. Тем не менее пред
логичной экспрессии белков E. coli на основе их
ставляется необходимым проведение дополни
гидрофобности и гидрофильности, а также
тельных исследований для улучшения самосто
склонности к образованию β листовых и α спи
ятельной системы интеина или в сочетании её с
ральных структур [29, 30]. Вероятность того, что
другими системами для крупномасштабной
CPG2, слитый с интеином и CBD, будет
очистки таких терапевтических ферментов, осо
экспрессироваться в растворимой форме была
бенно мультимерных белков.
рассчитана как ~60%, что было больше, чем об
щая оценка, полученная для одного фермен
та (35%). CcSOL omics также идентифицировал
Финансирование. Работа выполнена при фи
больше нерастворимых областей в первичной
нансовой поддержке Иранского национального
последовательности карбоксипептидазы G2 по
института развития медицинских исследований
сравнению с фрагментом интеина. Ранее мы
(NIMAD, проект № 940711).
клонировали ген, кодирующий карбоксипепти
Благодарности. Мы благодарны исследова
дазу G2 (без метки), в вектор pET28, и исследо
тельскому совету Университета Tarbiat Modares,
вали его экспрессию в различных условиях, од
проф. Khosro Khajeh за поддержку в этом иссле
нако только небольшое количество белка было
довании.
найдено в растворимой фракции (неопублико
Конфликт интересов. Авторы заявляют об от
ванные данные). Этот результат, согласующийся
сутствии конфликта интересов в какой либо
с другими нашими экспериментальными данны
сфере деятельности.
ми, также подтвердил способность интеина уве
Соблюдение этических норм. Настоящая
личивать растворимость CPG2.
статья не содержит каких либо исследований с
Насколько нам известно, хотя эта коммер
участием людей или использованием животных
ческая система саморасщепляющегося интеина
в качестве объектов.
СПИСОК ЛИТЕРАТУРЫ
1.
Rowsell, S., Pauptit, R. A., Tucker, A. D., Melton, R. G.,
6. Rosano, G. L., and Ceccarelli, E. A. (2014) Recombinant
Blow, D. M., and Brick, P. (1997) Crystal structure of car
protein expression in Escherichia coli: advances and chal
boxypeptidase G2, a bacterial enzyme with applications in
lenges, Front. Microbiol., 5, 172, doi: 10.3389/fmicb.2014.
cancer therapy, Structure, 5, 337 347, doi: 10.1016/S0969
00172.
2126(97)00191 3.
7. Goh, H. C., Sobota, R. M., Ghadessy, F. J., and
2.
Goda, S. K., Rashidi, F. A. B., Fakharo, A. A., and Al
Nirantar, S. (2017) Going native: Complete removal of
Obaidli, A. (2009) Functional overexpression and purifica
protein purification affinity tags by simple modification of
tion of a codon optimized synthetic glucarpidase
existing tags and proteases, Protein Expr. Purif., 129, 18 24,
(Carboxypeptidase G2) in Escherichia coli, Protein J., 28,
doi: 10.1016/J.PEP.2016.09.001.
435 442, doi: 10.1016/J.ENZMICTEC.2016.08.001.
8. Li, Y. (2011) Self cleaving fusion tags for recombinant pro
3
Ramsey, L. B., Balis, F. M., O’Brien, M. M., Schmiegelow,
tein production, Biotechnol. Lett.,
33,
869881,
K., Pauley, J. L., et al. (2018) Consensus guideline for use
doi: 10.1007/s10529 011 0533 8.
of glucarpidase in patients with high dose methotrexate
9. Fan, Y., Miozzi, J. M., Stimple, S. D., Han, T. C., and
induced acute kidney injury and delayed methotrexate
Wood, D. W. (2018) Column free purification methods for
clearance, Oncologist, 23, 52 61.
recombinant proteins using self cleaving aggregating tags,
4.
Rattu, M. A., Shah, N., Lee, J. M., Pham, A. Q., and
Polymers (Basel), 10, 468, doi: 10.3390/polym10050468.
Marzella, N. (2013) Glucarpidase (voraxaze), a car
10. Wu, W. Y., Mee, C., Califano, F., Banki, R., and Wood,
boxypeptidase enzyme for methotrexate toxicity, P T, 38,
D. W. (2006) Recombinant protein purification by self
732 744.
cleaving aggregation tag, Nat. Protoc., 1, 22572262,
5.
Wingfield, P. T. (2015) Overview of the purification of
doi: 10.1038/nprot.2006.314.
recombinant proteins, Curr. Protoc. Protein Sci., 80, 6.1.1
11. Arnau, J., Lauritzen, C., Petersen, G. E., and Pedersen, J.
6.1.35, doi: 10.1002/0471140864.ps0601s80.
(2006) Current strategies for the use of affinity tags and tag
БИОХИМИЯ том 86 вып. 2 2021
ЭКСПРЕССИЯ И ОДНОЭТАПНАЯ ОЧИСТКА КАРБОКСИПЕПТИДАЗЫ G2
235
removal for the purification of recombinant proteins,
an autoinhibited enzyme, Protein Eng. Des., 30, 321 331,
Protein Expr. Purif., 48, 1 13, doi: 10.1016/J.PEP.2005.
doi: 10.1093/protein/gzx005.
12.002.
22. Alishah, K., Asad, S., Khajeh, K., and Akbari, N. (2016)
12.
Belfort, M., Stoddard, B. L., Wood, D. W., and
Utilizing intein mediated protein cleaving for purification
Derbyshire, V. (2006). Homing endonucleases and inteins,
of uricase, a multimeric enzyme, Enzyme Microb. Technol.,
Springer Science & Business Media.
93;94, 92 98, doi: 10.1016/J.Enzmictec.2016.08.001.
13.
Banki, R., and Wood, D. W. (2005) Inteins and affinity
23. Wood, D. W., Derbyshire, V., Wu, W., Chartrain, M.,
resin substitutes for protein purification and scale up,
Belfort, M., and Belfort, G. (2000) Optimized single step
Microb. Cell Fact., 4, 1 6, doi: 10.1186/1475 2859 4 32.
affinity purification with a self cleaving intein applied to
14.
Lahiry, A., Fan, Y., Stimple, S. D., Raith, M., and Wood,
human acidic fibroblast growth factor, Biotechnol. Prog.,
D. W. (2018) Inteins as tools for tagless and traceless pro
16, 1055 1063, doi: 10.1021/bp0000858.
tein purification, J. Chem. Technol. Biotechnol., 93, 1827
24. Sharma, S. S., Chong, S., and Harcum, S. W. (2006) Intein
1835, doi: 10.1002/jctb.5415.
mediated protein purification of fusion proteins expressed
15.
Laemmli, U. K. (1970) Cleavage of structural proteins dur
under high cell density conditions in E. coli, J. Biotechnol.,
ing the assembly of the head of bacteriophage T4, Nature,
125, 48 56, doi: 10.1016/j.jbiotec.2006.01.018.
227, 680.
25. D az, M., Venturini, E., Marchetti, S., Arenas, G., and
16.
Bradford, M. M. (1976) A rapid and sensitive method for
Marshall, S. H. (2012) Intein mediated expression of
the quantitation of microgram quantities of protein utiliz
cecropin in Escherichia coli, Electron. J. Biotechnol., 15,
ing the principle of protein dye binding, Anal. Biochem.,
doi: 10.2225/vol15 issue2 fulltext 2.
72, 248 254.
26. Sherwood, R. F, Melton, R. G., Alwan, S. M., and Hughes, P.
17.
Rashidi, F. B., AlQhatani, A. D., Bashraheel, S. S.,
(1985) Purification and properties of carboxypeptidase G2
Shaabani S., Groves, M. R. et al. (2018) Isolation and mol
from Pseudomonas sp. strain RS 16, Eur. J. Biochem., 148,
ecular characterization of novel glucarpidases: enzymes to
447 453, doi: 10.1111/j.1432 1033.1985.tb08860.x.
improve the antibody directed enzyme pro drug therapy
27. Minton, N. P., Atkinson, T., and Sherwood, R. F. (1983)
for cancer treatment, PLoS One,
13, e0196254,
Molecular cloning of the Pseudomonas carboxypeptidase
doi: 10.1371/journal.pone.0196254.
G2 gene and its expression in Escherichia coli and
18.
AlQahtani, A. D, Al Mansoori, L., Bashraheel, S. S.,
Pseudomonas putida, J. Bacteriol., 156, 1222 1227.
Rashidi, F. B., Al Yafei, A., et al. (2019) Production of
28. Jeyaharan, D., Aston, P., Garcia Perez, A., Schouten, J.,
“biobetter” glucarpidase variants to improve drug detoxifi
Davis, P., and Dixon, A. M. (2016) Soluble expression,
cation and antibody directed enzyme prodrug therapy for
purification and functional characterisation of car
cancer treatment, Eur. J. Pharm. Sci., 127, 7991,
boxypeptidase G2 and its individual domains, Protein Expr.
doi: 10.1016/J.EJPS.2018.10.014.
Purif., 127, 44 52, doi: 10.1016/J.PEP.2016.06.015.
19.
Wang, L, Kang, J. H., Kim, K. H., and Leeb, E. K. (2009)
29. Agostini, F., Cirillo, D., Livi, C. M., DelliPonti, R., and
Expression of intein tagged fusion protein and its applica
Tartaglia, G. G. (2014) ccSOL omics: a webserver for solu
tions in downstream processing, J. Chem. Technol.
bility prediction of endogenous and heterologous expres
Biotechnol., 85, 11 18, doi: 10.1002/jctb.2277.
sion in Escherichia coli, Bioinformatics, 30, 2975 2977,
20.
Fong, B. A., Wu, W. Y., and Wood, D. W. (2010) The
doi: 10.1093/bioinformatics/btu420.
potential role of self cleaving purification tags in commer
30. Hebditch, M., Carballo Amador, M. A., Charonis, S.,
cial scale processes, Trends Biotechnol., 28, 272279,
Curtis, R., and Warwicker, J. (2017) Protein Sol: a web
doi: 10.1016/j.tibtech.2010.02.003.
tool for predicting protein solubility from sequence,
21.
Yachnin, B. J., and Khare, S. D. (2017) Engineering car
Bioinformatics, 33, 3098 3100, doi: 10.1093/bioinformatics/
boxypeptidase G2 circular permutations for the design of
btx345.
ENHANCED SOLUBILITY AND ONE;STEP PURIFICATION
OF FUNCTIONAL DIMERIC CARBOXYPEPTIDASE G2*
A. Khodakarami1, B. Dabirmanesh1**, S. Asad2, and M. Khaledi1
1 Department of Biochemistry, Faculty of Biological Sciences, Tarbiat Modares University,
14115 Tehran, Iran; E mail: dabirmanesh@modares.ac.ir
2 Department of Biotechnology, College of Science, University of Tehran, 14155 Tehran, Iran
Carboxypeptidase G2 is a bacterial enzyme that catalyzes methotrexate conversion to its inactive forms which are then
eliminated via a non renal pathway in patients with renal disorders during a high dose methotrexate administration.
Due to the increasing demand of this enzyme, it was of interest to simplify its production process. For this reason, we
developed a method for production and one step purification of this enzyme using an intein mediated system with a
chitin binding affinity tag. The carboxypeptidase G2 gene from Pseudomonas RS16 was optimized, synthesized,
cloned into the pTXB1 expression vector and finally transformed into Escherichia coli BL21 (DE3) cells. The optimal
condition for the enzyme soluble expression was achieved in 2×YT medium containing 1% glucose at 25°C for 30 h
with 0.5 mM IPTG. The enzyme without intein was expressed as inclusion bodies indicating the importance of intein
for the protein solubility. The expressed homodimer protein was purified to homogeneity on a chitin affinity column.
The Km and kcat values of 6.5 μM and 4.57 s-1, respectively, were obtained for the purified enzyme. Gel filtration analy
sis indicated that the resulting recombinant protein was a dimer of 83 kDa. Fluorescence and circular dichroism spec
troscopy confirmed the enzyme tertiary and secondary structures, respectively. The use of intein mediated system
provided the possibility of the one step carboxypeptidase G2 purification, paving the way to the application of this
enzyme in pharmaceutics.
Keywords: carboxypeptidase G2, intein, methotrexate
БИОХИМИЯ том 86 вып. 2 2021