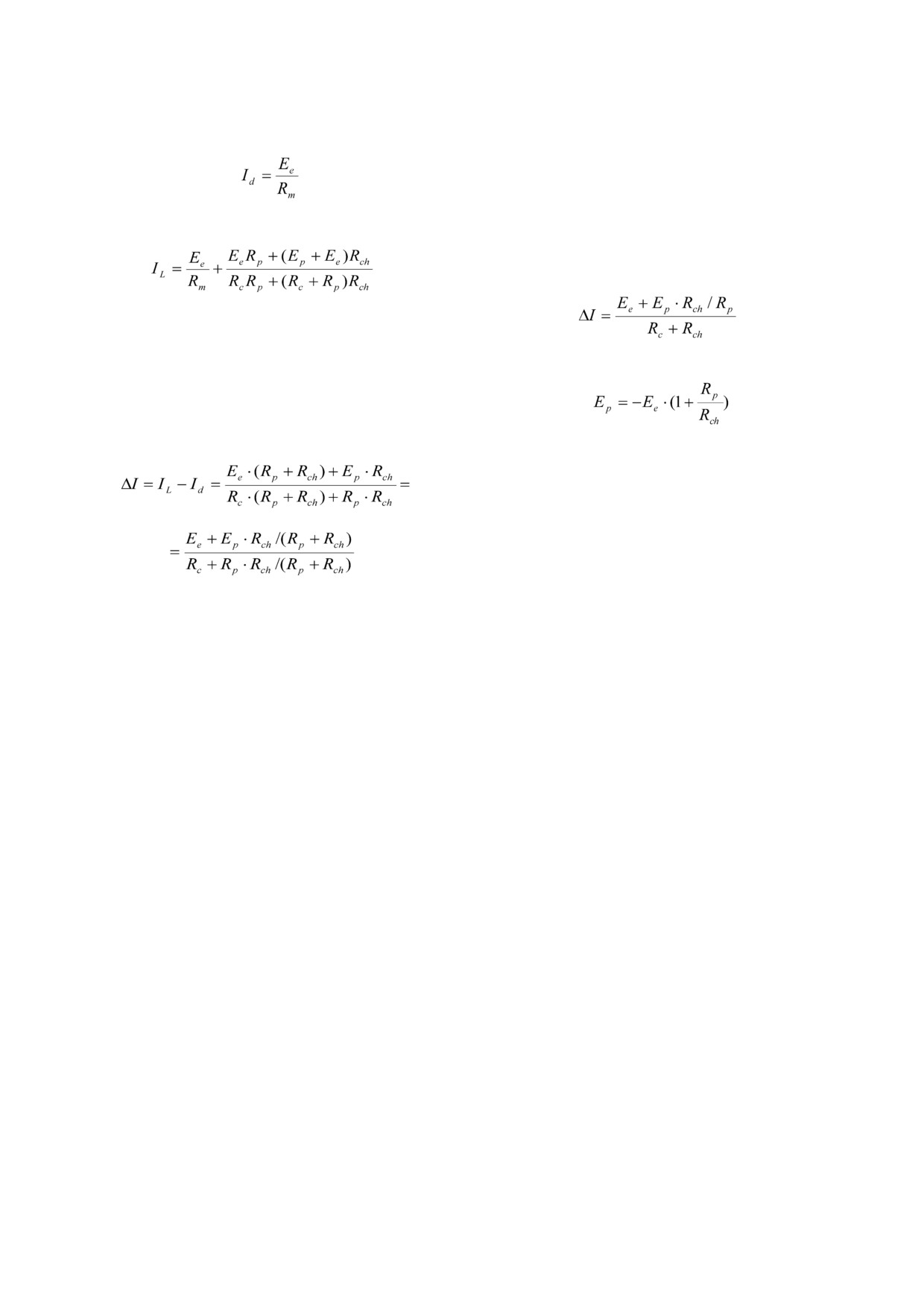БИОХИМИЯ, 2021, том 86, вып. 4, с. 483 - 495
УДК 577.12
КАНАЛЬНАЯ АКТИВНОСТЬ РОДОПСИНОВ МОЖЕТ БЫТЬ
ВЫЯВЛЕНА ПРИ ИЗМЕРЕНИИ ПОТЕНЦИАЛ ЗАВИСИМОСТИ
ФОТОТОКОВ НА ПЛОСКИХ БИСЛОЙНЫХ
ЛИПИДНЫХ МЕМБРАНАХ
© 2021
Т.И. Рокицкая1*, Н. Маляр2, К.В. Ковалев2,3, А.А. Волков4,5,
В.И. Горделий2,3,4,5, Ю.Н. Антоненко1
1 НИИ физико химической биологии имени А.Н. Белозерского, Московский государственный университет
имени М.В. Ломоносова, 119991 Москва, Россия; электронная почта: rokitskaya@genebee.msu.ru
2 Московский физико технический институт (национальный исследовательский университет),
141701 Долгопрудный, Московская обл., Россия
3 Университет Гренобль-Альпы, CEA, CNRS, Институт структурной биологии (IBS), 38044 Гренобль, Франция
4 Юлихский исследовательский центр, Институт биологической обработки информации.
Структурная биохимия (IBI 7), 52425 Юлих, Германия
5 Юлихский исследовательский центр, Центр структурной биологии Юлиха (JuStruct), 52425 Юлих, Германия
Поступила в редакцию 04.12.2020
После доработки 22.01.2021
Принята к публикации 22.01.2021
Определение функциональных свойств ретиналь содержащих белков зачастую включает исследования на
модельных системах, например, измерения электрического тока через плоские бислойные липидные мемб
раны (БЛМ) с адсорбированными на одной поверхности мембраны протеолипосомами. Однако возмож
ности этого метода до конца не изучены. На примере двух светочувствительных белков - бактериородопси
на (bR) и канального родопсина 2 (ChR2) - мы показали, что потенциал зависимости стационарных фото
токов в присутствии протонофора имеют сильно отличающиеся характеристики. В случае протонной пом
пы bR регистрируемый через БЛМ фототок не меняет направление при изменении знака прикладываемых
напряжений, а для светочувствительного белка канального типа ChR2 характерны увеличение фототока с
ростом напряжения и смена знака тока при переходе через нулевые значения напряжения. В работе также
показано, что для регистрации максимальных стационарных фототоков лучше всего подходит протоно
фор 4,5,6,7 тетрахлоро 2 трифлуорометил бензимидазол (ТТФБ). При использовании карбонилцианид m
хлорофенилгидразона (ХКФ) измеряемые фототоки для bR значительно меньше по амплитуде, а для
ChR2 - практически равны нулю. Это различие между ТТФБ и ХКФ, по видимому, связано с тем, что ХКФ,
в отличие от ТТФБ, обладает большей скоростью переноса протонов через липосомальные мембраны, чем
через декан содержащие БЛМ, которые используются в качестве поверхности адсорбции протеолипосом.
КЛЮЧЕВЫЕ СЛОВА: ретиналь содержащие белки, канальный родопсин, протонная помпа, протеолипо
сомы, бислойная липидная мембрана, протонофор.
DOI: 10.31857/S0320972521040035
ВВЕДЕНИЕ
Бактериородопсин, как в природных пурпурных
мембранах, так и солюбилизированный в ми
Бурный рост числа исследований микроб
целлах детергента и встроенный в протеолипо
ных родопсинов, начавшийся с определения ос
сомы (ПЛ) [2, 3], оказался чрезвычайно важным
новных функциональных свойств бактериоро
и удобным объектом исследования, что привело
допсина (bR) [1], привел к значительному раз
к его всестороннему изучению в модельных
витию и возникновению новых методов изуче
мембранных системах, в том числе при адсорб
ния светочувствительных мембранных белков.
ции протеолипосом на плоских бислойных ли
Принятые сокращения: БЛМ - бислойная липидная мембрана; ТТФБ - 4,5,6,7 тетрахлоро 2 трифлуорометил
бензимидазол; ФКФ - карбонилцианид n трифторометокси фенилгидразон; ХКФ - карбонилцианид m хлорофенил
гидразон; bR - бактериородопсин; ChR2 - канальный родопсин 2; ПЛ - протеолипосомы; ФХ - фосфатидилхолин; Ep -
эквивалентное напряжение помпы, Rm - эквивалентное сопротивление БЛМ, Rc - эквивалентное сопротивление облас
ти контактов с липосомами, Rch - эквивалентное сопротивление канала, Rv - эквивалентное сопротивление липосомаль
ной мембраны; Rp - эквивалентное сопротивление помпы.
* Адресат для корреспонденции.
483
484
РОКИЦКАЯ и др.
пидных мембранах (БЛМ) [4, 5]. В настоящее
ментов на основе перечисленных родопсинов
время метод адсорбции протеолипосом на
для получения белков с новыми свойствами,
мембранных фильтрах, пропитанных липидом,
например, с необычными параметрами откры
применяется для измерения электрических по
вания/закрывания канала, селективности и
тенциалов, генерируемых белком при обычном
проводимости. Кроме того, продолжается поиск
или лазерном освещении [6]. Также при адсорб
генов родопсинов в геномах неизученных бакте
ции ПЛ или мембранных дисков со светочув
рий, грибов, вирусов и дальнейшая гетерологи
ствительными белками на БЛМ проводятся из
ческая экспрессия наиболее интересных из ко
мерения переходных токов [7, 8] в ответ на
дируемых ими родопсинов с целью определения
включение и выключение освещения или ста
их функциональности, эффективности и воз
ционарных фототоков через БЛМ в присутствии
можностей дальнейшего применения [27-29].
протонофоров или других переносчиков [9-11].
В большинстве работ новые или мутантные
Способ измерения светочувствительного тока с
белки экспрессируются в плазматической мемб
помощью адсорбции ПЛ или фрагментов пур
ране эукариотических клеток, и их фотоэлект
пурных мембран на поверхности БЛМ получил
рическая активность изучается методом фикса
широкое применение благодаря тому, что он
ции потенциала всей клетки [17, 26]. Однако
оказался наиболее чувствительным. В этом слу
многие белки, особенно прокариотического
чае амплитуда стационарного тока в присут
происхождения, слабо экспрессируются в плаз
ствии протонофоров и/или ионообменников
матической мембране эукариот. Кроме этого, в
была гораздо выше, чем при встраивании bR не
опытах на клетках затруднительно значительно
посредственно в БЛМ путём добавления в мемб
изменять ионный состав внеклеточной сре
ран формирующий раствор или путём форми
ды (такие параметры, как pH и ионная сила) из
рования БЛМ из двух монослоев липида с фото
за необходимости поддерживать осмотическое
чувствительным белком [8, 10].
давление и концентрации ионов в физиологи
Открытие родопсинов канального типа [12,
ческих диапазонах значений, что может ограни
13], осуществляющих пассивный транспорт
чивать изучение свойств белков. В этой связи
ионов при воздействии светом, привело к рево
измерения в модельных системах с ПЛ, в том
люции в нейробилогии и развитию оптогенети
числе сорбированными на поверхности БЛМ,
ки
[14]. Катионный канальный родоп
могут более полно раскрыть функциональные
син 2 (ChR2) из одноклеточной водоросли
свойства родопсинов. Впервые стационарные
Chlamydomonas reinhardtii был первым микроб
фототоки через БЛМ в присутствии протонофо
ным родопсином, использованным для деполя
ра для ChR2 были продемонстрированы в рабо
ризации нейрональной мембраны [15]. Впослед
те Feldbauer et al. [30]. В представленной работе
ствии набор оптогенетических инструментов
мы сравнили зависимости светочувствительно
расширился за счёт разнообразных модифика
го тока через БЛМ с адсорбированными ПЛ от
ций ChR2 [16] и открытия других природных ка
прикладываемого к БЛМ напряжения и его зна
тионных и анионных канальных родопси
ка в присутствии протонофора для протонной
нов [17, 18], в том числе катионного канального
помпы bR и канального родопсина 2. В случае
родопсина из гигантских вирусов [19]. Помимо
канальной функции белка (на примере ChR2)
канальных родопсинов, некоторые светочув
величины фототоков меняют свой знак при
ствительные ионные помпы также эффективны
напряжениях близких к нулю, в то же время фо
в качестве оптогенетических инструментов: для
тотоки протонной помпы bR всегда положи
светоиндуцированного торможения нейрональ
тельны. Такие различия очень похожи на ре
ной активности путём гиперполяризации плаз
зультаты, получаемые при электрофизиологи
матической мембраны нейрона используются
ческих измерениях на клетках [18, 31]. Также
хлорная помпа NpHR из Natronomonas
нам удалось выяснить, что не любой протоно
pharaonic [20], протонная помпа археродоп
фор применим для изучения светочувствитель
син 3 (Arch) из Halorubrum sodomense [21], натри
ных белков с канальными свойствами. В опуб
евая помпа KR2 и её модификации [22-25], а
ликованных ранее работах наибольшее приме
для деполяризации мембраны можно приме
нение нашёл протонофор 1799, однако он ком
нять обратную протонную помпу [26]. К сожа
мерчески недоступен. Мы показали, что из за
лению, по причине низкой экспрессии в плаз
более эффективного увеличения проводимости
матической мембране эукариотических клеток
липосомальной мембраны, чем плоской БЛМ,
бактериородопсин не нашел широкого приме
такой широко распространенный протонофор,
нения в оптогенетике [20]. В последнее время
как карбонилцианид m хлорофенилгидразон
активно проводятся эксперименты по рацио
(ХКФ), не может применяться в данной модель
нальному дизайну оптогенетических инстру
ной системе. Из нескольких протестированных
БИОХИМИЯ том 86 вып. 4 2021
ФОТОТОКИ РЕТИНАЛЬ СОДЕРЖАЩИХ БЕЛКОВ НА БЛМ
485
известных протонофоров 4,5,6,7 тетрахлоро 2
куумного насоса. Полученную тонкую липид
трифлуорометил бензимидазол (ТТФБ) оказал
ную пленку, образовавшуюся на стенках колбы
ся самым подходящим кандидатом.
ресуспендировали в растворе, содержащем
0,1 M NaCl («Applichem», Германия), 2% (w/v)
холата натрия с конечной концентрацией азо
МАТЕРИАЛЫ И МЕТОДЫ
лектина - 1% (w/v). Суспензию липидов обраба
тывали ультразвуком в течение 5 мин при 4 °C,
В работе использовали реагенты фир
после чего быстро добавляли солюбилизирован
мы «Sigma Aldrich», США (если не указано дру
ный родопсин до конечной концентра
гое). 4,5,6,7 тетрахлоро 2 трифлуорометил бенз
ции 0,7 мг/мл и детергент абсорбирующие час
имидазол был предоставлен Ягужинским
тицы. Получившуюся смесь перемешивали на
Л.С. (НИИ физико химической биологии им.
орбитальной мешалке 2 ч при минимальном ос
А.Н. Белозерского, МГУ).
вещении, а затем сменяли частицы (так прово
Плоская бислойная липидная мембрана фор
дили минимум 4 смены частиц). ChR2 был
мировалась из раствора в декане, который со
экспрессирован в Leishmania tarentolae, выделен
держал 2% (w/v) дифитаноилфосфатидилхоли
и очищен, как описано в работе Volkov et al. [33].
на (дифитаноил ФХ) и 0,04% (w/v) димиристоил
bR был солюбилизирован из пурпурных мемб
этил ФХ («Avanti Polar Lipids», США), на отвер
ран по ранее опубликованному протоколу [34].
стии в перегородке, разделяющей на два отсека
Измерение транспорта протонов через мембра
тефлоновую ячейку, содержащую буферный
ну липосом. Проницаемость бислойных фосфо
раствор
[32]. Диаметр отверстия состав
липидных мембран для ионов водорода оцени
лял 0,8 мм. Состав буферного раствора варьиро
вали с помощью ранее предложенной и не
вался и указан в подписях к рисункам. Все экс
сколько модифицированной методике [35]. Для
перименты проводили при комнатной темпера
приготовления нагруженных пиранином липо
туре (23-25 °С). При измерении проводимос
сом смесь липидов (5,3 мг пальмитоил олео
ти БЛМ, индуцированной протонофора
ил ФХ, 1,3 мг пальмитоил олеоил фосфатидил
ми ТТФБ и ХКФ, мембрана формировалась из
глицерола и 3,3 мг холестерина) растворили в
2% ного раствора смеси фосфолипидов из сое
хлороформе, а затем высушили в струе азота в
вых бобов (азолектин) в сквалене.
пробирке с круглым дном. После этого липиды
Электрический ток регистрировался в усло
были ресуспендированы в 1 мл буферного раст
виях фиксации потенциала. Разность потенциа
вора (20 мМ Мес, 20 мМ Tris HCl, 20 мМ Три
лов подавалась на хлорсеребряные электроды,
цин,
100 мМ KCl, рН
6,0), содержащего
помещенные через агаровые мосты в тефлоно
0,5 мМ рН чувствительного флуоресцентного
вую ячейку с двух сторон мембраны. Ток изме
красителя пиранин. Суспензию тщательно
рялся с помощью пэтч клэмп усилителя ОЕС
встряхивали, затем трижды замораживали/отта
2
(«ОПУС», Россия), оцифровывался с по
ивали. Моноламелярные липосомы получали
мощью NI DAQmx («National Instruments»,
путем экструзии через поликарбонатный
США) и анализировался с использованием
фильтр с порами диаметром 0,1 мкм с помощью
компьютерной программы WinWCP Strathclyde
экструдера («Avanti Polar Lipids»). Наружный
Electrophysiology
Software,
написанной
пиранин убирали хроматографией на колонке с
Дж. Демпстером (University of Strathclyde, Вели
гелем Sephadex G 50 («Sigma Aldrich»), уравно
кобритания).
вешенной буферным раствором 20 мМ Мес,
Для освещения БЛМ использовали галоге
20 мМ Tris HCl, 20 мМ Трицин, 100 мМ KCl,
новую лампу Novaflex
(«World Precision
рН 6,0. В ходе эксперимента липосомы разбав
Instruments», США), плотность мощности кото
ляли в этом буфере с рН 6,0, в начале экспери
рой составляет 0,77 Вт/см2. Лампа освещала
мента рН внутри и снаружи липосом был одина
ячейку с передней (цис) стороны, ПЛ добавляли
ков. Далее к липосомам добавляли требуемую
к БЛМ с противоположной (транс) стороны.
концентрацию протонофора и инкубировали в
В некоторых экспериментах использовали си
течение 1 мин. Протонный транспорт иници
ний светофильтр СЗС 9 с шириной пропуска
ировался одномоментным увеличением рН вод
ния 400-540 нм и коэффициентом поглоще
ного раствора до значения 8,0 при добавлении
ния 0,36 на длине волны 480 нм.
определенного количества раствора щело
Протеолипосомы с родопсином (ChR2 или bR).
чи, КОН. Измерение скорости увеличения рН
В стеклянной колбе готовили 1% ный (w/v)
внутри липосом проводили в присутствии
раствор азолектина из соевых бобов в хлорофор
1 мМ ксилен пиридиниум бромида для тушения
ме («Химмед», Россия). От хлороформа избав
флуоресценции вытекающего пиранина. Внут
лялись с помощью роторного испарителя и ва
рилипосомальный рН оценивали по измерению
БИОХИМИЯ том 86 вып. 4 2021
486
РОКИЦКАЯ и др.
флуоресценции при длине волны 505 нм, длина
эксперимента добавляли ласалоцид А в концен
волны возбуждения - 455 нм. Измерения про
трации 1 мкМ для полного выравнивания рН
водили на спектрофлуориметре Панорама Флю
внутри и снаружи липосом. Для предотвраще
орат 02 («Люмэкс», Россия). В конце каждого
ния образования разности потенциалов на ли
посомальной мембране эксперименты проводи
ли в присутствии 10 нМ валиномицина. Для
уменьшения спонтанного выравнивания рН
температуру поддерживали на уровне 15 °С.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
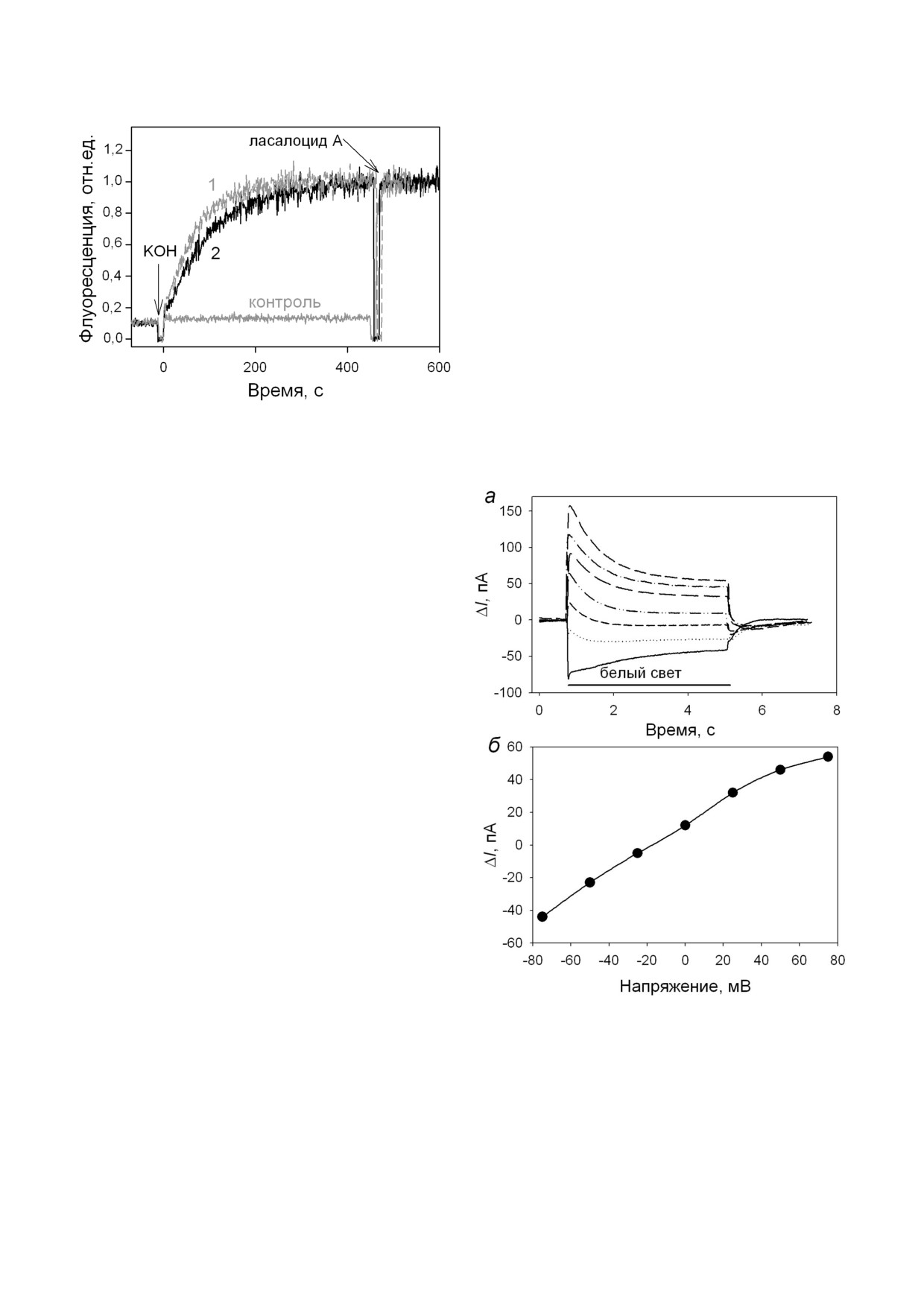
Измерения светоиндуцированного тока через
БЛМ с адсорбированными протеолипосомами со
встроенным ChR2. Добавление 10-15 мкл ПЛ со
встроенным ChR2 с одной стороны БЛМ
(транс сторона с высокоомным входом усили
теля) приводило к постепенному увеличению
переходного тока в ответ на включение освеще
ния белым светом (рис. 1, а) или синим све
том (с использованием фильтра СЗС 9, данные
не приведены). Процесс инкубации липосом
длился приблизительно 1 ч или более, пока ам
плитуда переходного тока не прекращала увели
чиваться. Амплитуда переходного тока никогда
не превышала 10-15 пА, время спада тока отли
чалось от эксперимента к эксперименту в диа
пазоне 40-130 мс. Регистрация тока при разных
напряжениях обычно показывала небольшое
увеличение стационарной темновой проводи
мости БЛМ после прилипания ПЛ, после вклю
чения освещения стационарная проводи
мость БЛМ не менялась (рис. 1, а).
Ранее было показано, что ПЛ со встроенным
бактериородопсином при адсорбции налипают
на поверхность бислойной липидной мембра
ны, но не сливаются с ней и остаются интактны
ми на поверхности БЛМ [7, 8]. В наших экспе
риментах при адсорбции ПЛ, содержащих ChR2
или bR, практически отсутствует светоиндуци
рованный стационарный ток через БЛМ, а реги
стрируется только переходный ток в ответ на
включение и выключение света. Это связано с
тем, что БЛМ не проводит ионы, которые
транспортирует bR, или которые проникают че
рез ChR2 под действием приложенного напря
жения. В начале освещения происходит увели
чение поверхностного заряда на мембране бла
годаря переносу ионов через липидную мембра
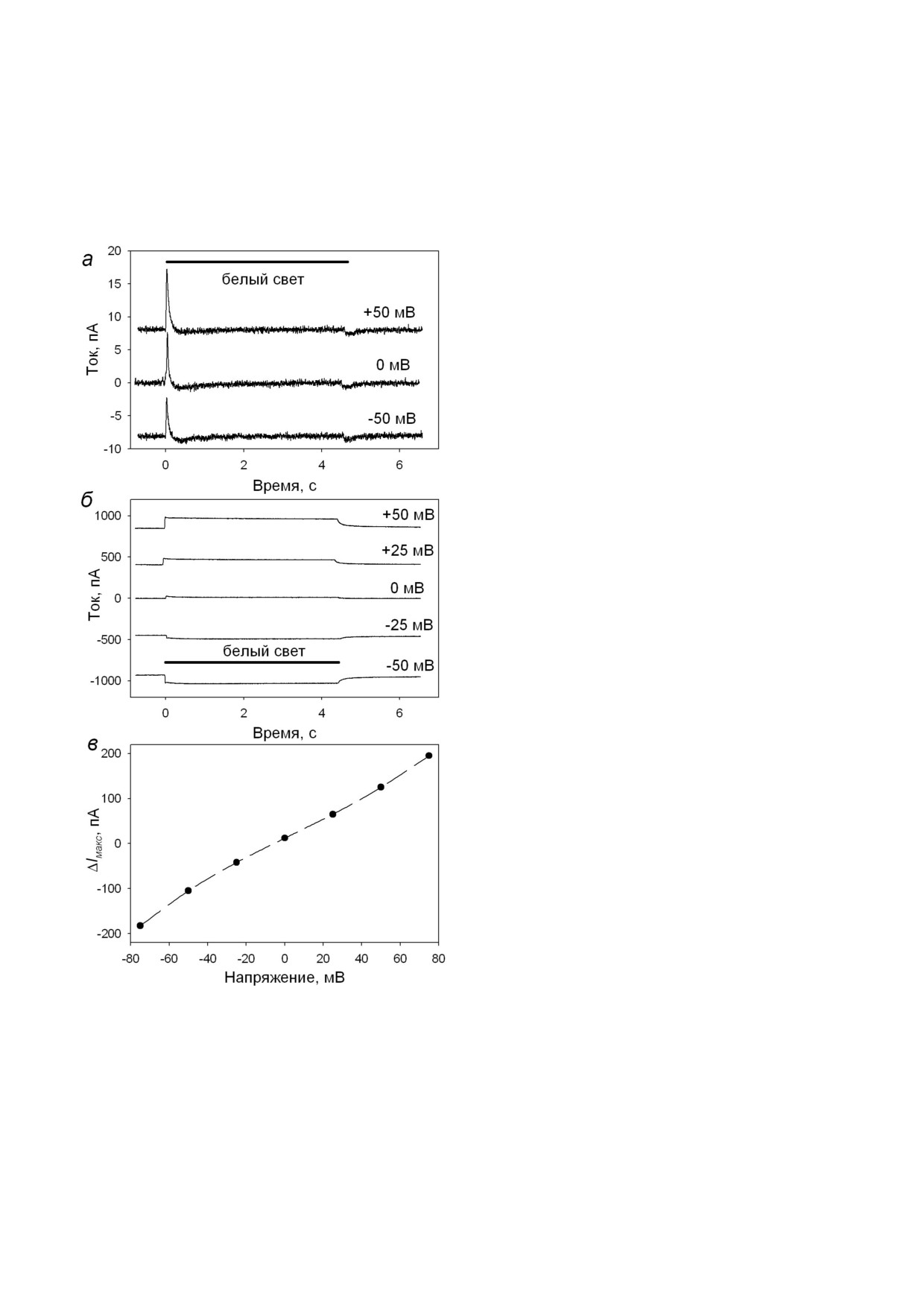
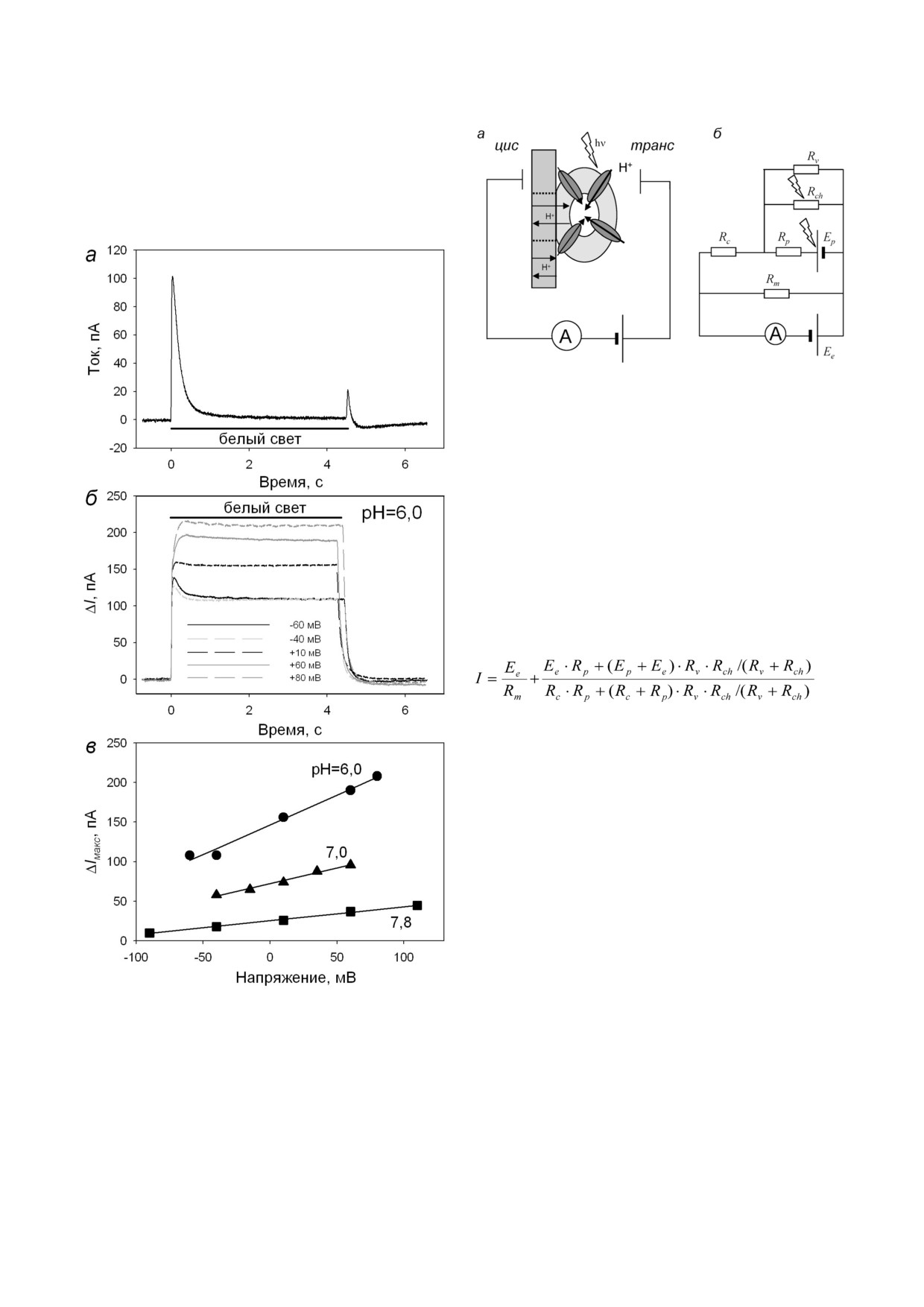
Рис. 1. Измерение электрического тока через БЛМ с адсор
ну липосом, в результате этого процесса наблю
бированными ПЛ с ChR2. а - Записи тока через БЛМ при
дается переходный ток через БЛМ, подобный
напряжениях 0, +/-50 мВ через 1 ч после начала инкуба
ции с протеолипосомами. Период освещения показан
ёмкостному ответу на прикладывание напряже
сплошной черной линией. б - Записи тока через БЛМ с ад
ния. В наших экспериментах, также как и у дру
сорбированными протеолипосомами в присутствии
гих авторов, не происходит слияния ПЛ с плос
0,1 мкМ ТТФБ при различных напряжениях. в - Зависи
кой мембраной, так как в течение длительного
мость максимального фототока (ΔIмакс) от напряжения. Бу
ферный раствор содержал 10 мМ Мес, 10 мМ Tris HCl,
времени налипания липосом не наблюдается
100 мМ NaCl, pH 6,0
увеличение стационарной проводимости БЛМ в
БИОХИМИЯ том 86 вып. 4 2021
ФОТОТОКИ РЕТИНАЛЬ СОДЕРЖАЩИХ БЕЛКОВ НА БЛМ
487
процессе освещения при различных напряже
присутствии протонофора 1799 при V = 0 мВ
ниях, а регистрируется только переходный ток
[30] в условиях, когда единственным проникаю
на включение освещения (рис.
1, а, кри
щим через белок катионом является протон.
вые +/-50 мВ). Если бы происходило слия
В то же время внутримолекулярный перенос
ние ПЛ с БЛМ, мы бы наблюдали светоиндуци
протона с шиффова основания на акцептор не
рованное увеличение проводимости мембраны в
был подтвержден у ChR2 из C. reinhardtii при ос
случае ПЛ с ChR2.
вещении вспышкой лазера, хотя был обнаружен
Далее в эксперименте, представленном на
у нескольких родопсинов с канальными свой
рис. 1, а, с цис стороны мембраны добавляли
ствами из других водорослей [37].
0,1 мкМ протонофора ТТФБ, который значитель
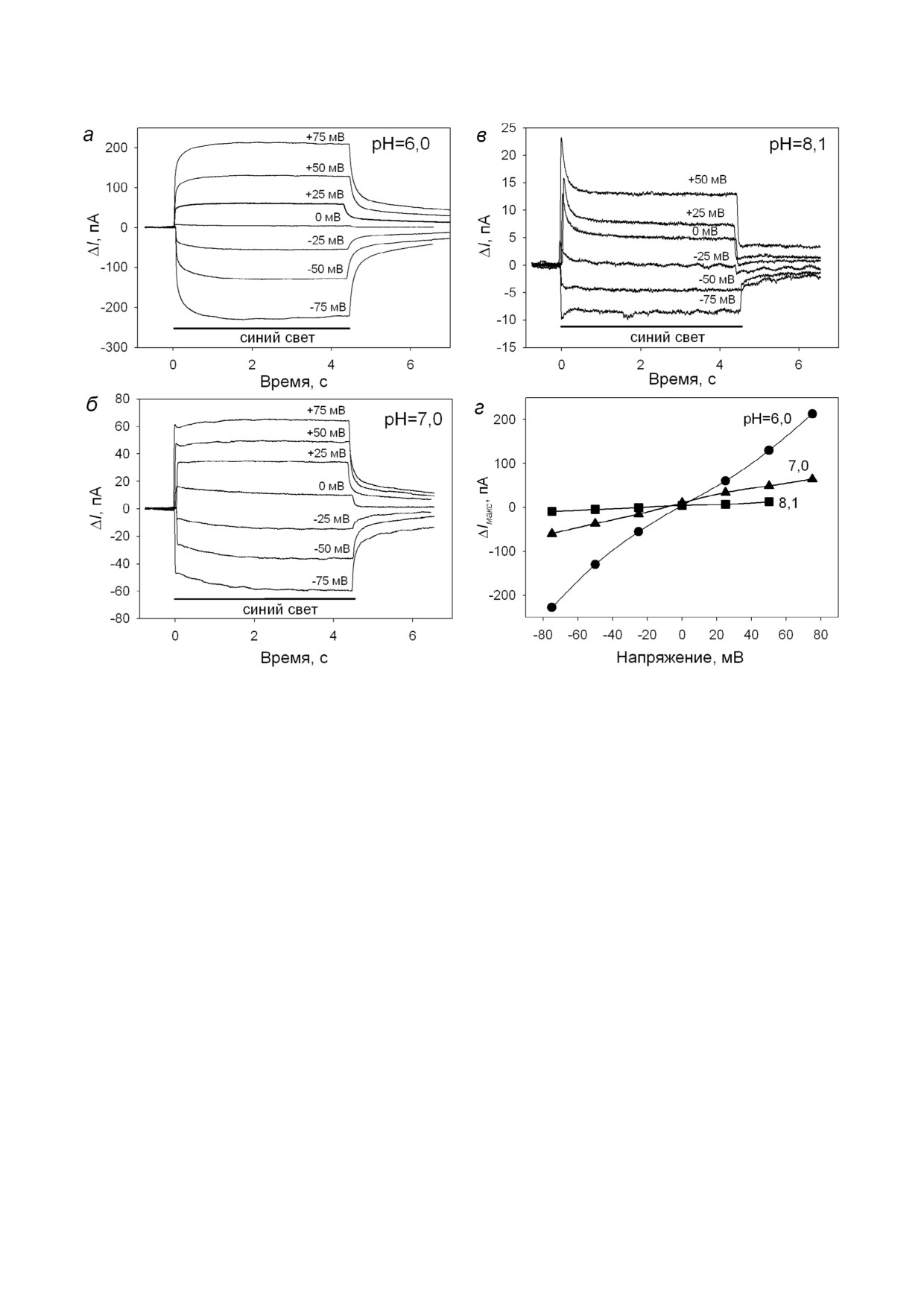
При освещении БЛМ синим светом качест
но увеличивал проводимость БЛМ (до 10 нСм
венно вид потенциал зависимости светоинду
и более). Величина стационарного тока че
цированного тока от приложенного напряже
рез БЛМ при разных напряжениях показана
ния не изменился (рис. 2). В присутствии ТТФБ
на рис. 1, б до начала освещения (t = 0 с). При
величины ΔIмакс были примерно на 40% меньше
освещении БЛМ в присутствии ТТФБ ток через
по сравнению с тем же экспериментом, но при
мембрану увеличивался (рис. 1, б) на величину
освещении белым светом без синего фильтра.
фототока ΔI(t). При прикладывании к липидной
Также увеличилось время нарастания фототока
мембране напряжения разной величины и по
до максимального стационарного значения при
лярности включение света приводило к увели
включении освещения (рис. 2, а). Увеличе
чению абсолютной величины стационарного
ние рН водного раствора с двух сторон мембра
тока (рис. 1, б). Зависимость максимального из
ны (с помощью небольшого оттитрованного ко
менения тока (ΔIмакс), вызванного освещением,
личества КОН) привело к уменьшению прово
от приложенной разности потенциалов к элект
димости мембраны и значительному уменьше
родам (V) является почти линейной и пересека
нию ΔI (рис. 2, б-г). Однако относительное из
ет ось ординат при V ≈ -6 мВ (рис. 1, в). Мы свя
менение тока в ответ на освещение α измени
зываем отличие от линейной зависимости ΔIмакс
лось незначительно: (8,5 ± 0,5)% при pH 6,0,
от V с тем, что проводимость БЛМ, опосредо
(7,1 ± 0,1)% при pH 7,0 и (6,7 ± 0,1)% при pH 8,1
ванная ТТФБ, нелинейно зависит от приложен
(среднее ± среднеквадратичное отклонение при
ного потенциала. В то же время вольт амперная
разных приложенных потенциалах). Также с
характеристика ChR2 в клеточной мембране то
ростом рН наблюдалось существенное ускоре
же нелинейна и определяется свойствами само
ние кинетики спада фототока при выключении
го белка [36], что может также сказываться на
освещения. Этот результат коррелирует с пока
измерениях на БЛМ. Мы оценили относитель
занной ранее зависимостью времени спада фо
ное изменение тока α при освещении для про
тотока ионных каналов ChR2 от внутриклеточ
тивоположных значений напряжений:
ного рН после вспышки лазера, полученной ме
тодом пэтч кламп регистрации тока на ооцитах,
экспрессирующих ChR2 [13].
,
Измерения светоиндуцированного тока через
БЛМ с адсорбированными протеолипосомами со
и величина α оказалась равна
12,5%
встроенным bR. Для сравнения потенциал зави
для +/-25 мВ, 12,9% - для +/-50 мВ и 13,1% -
симости индуцированного тока канального ро
для +/-75 мВ. Относительное изменение тока
допсина с родопсином, который функциониру
при освещении варьирует от эксперимента к
ет исключительно как протонная помпа, мы
эксперименту, но в каждом отдельном опыте α
провели эксперименты с ПЛ со встроенной про
почти не зависит от прикладываемого напряже
тонной помпой bR. Величина переходного тока
ния.
после включения белого света (рис. 3, а) была на
Следует отметить, что в присутствии ТТФБ
порядок больше, чем в случае с ChR2, направле
во всех опытах с ПЛ с ChR2 при V = 0 мВ при ос
ние тока совпадало с результатами, полученны
вещении регистрировался небольшой положи
ми другими авторами [7, 8]. После добавления
тельный стационарный ток (рис. 1, б). Направ
протонофора ТТФБ с цис стороны стационар
ление тока совпадает с таковым для бактериоро
ная проводимость БЛМ значительно увеличи
допсина (результаты представлены ниже), что
лась, и появился стационарный светоиндуциро
находится в согласии с представлением о слабой
ванный ток протонной помпы (рис. 3, б). На
помповой активности ChR2 [30]. Появление
правление тока указывает на движение прото
стационарного тока через БЛМ с адсорбирован
нов через БЛМ под действием света со стороны
ными протеолипосомами с ChR2 в ответ на ос
адсорбции ПЛ (транс сторона) на противопо
вещение синим светом было показано ранее в
ложную сторону. Это говорит о закачивании
БИОХИМИЯ том 86 вып. 4 2021
488
РОКИЦКАЯ и др.
Рис. 2. Кинетики фототока через БЛМ с адсорбированными ПЛ с ChR2 в присутствии 0,1 мкМ ТТФБ при разных напря
жения при освещении светом в присутствии синего фильтра при рН 6,0 (а), 7,0 (б) и 8,1 (в). Период освещения показан
сплошной черной линией. г - Зависимость величины максимального стационарного фототока (ΔIмакс) от приложенного
напряжения. Буферный раствор содержал 10 мМ Мес, 10 мМ Tris HCl, 100 мМ NaCl, рН 6,0
протонов внутрь ПЛ и проникновении их через
зом регистрируется ток в условиях фиксации
область контакта липосом с БЛМ на цис сторо
напряжения на БЛМ, необходимо рассмотреть
ну благодаря работе протонофора ТТФБ. Заще
схему адсорбции везикул на поверхности мемб
лачивание водных растворов симметрично с
раны (рис. 4, а) и соответствующую ей эквива
двух сторон мембраны до pH 7,0, а pH 7,8 приво
лентную электрическую схему (рис. 4, б). По
дило к уменьшению проводимости мембраны,
добные модели для быстрых переходных про
опосредованной протонофором, и уменьше
цессов были тщательно изучены ранее [38-40],
нию ΔI. Светоиндуцированный ток был при
и было показано, что время уменьшения пере
всех значениях pH и приложенных к БЛМ нап
ходного тока в ответ на включение света соответ
ряжениях положительного знака (рис. 3, в).
ствует RC времени мембраны и изменяется в ди
Эквивалентная электрическая схема БЛМ с
апазоне 100 мс. Для изучения светоиндуциро
адсорбированными протеолипосомами со светочув
ванных стационарных токов в зависимости от
ствительным белком. Итак, добавление протоно
внешнего напряжения мы использовали мо
фора ТТФБ приводило к значительному увели
дель, предложенную в работе Vodyanoy et al. [41],
чению протонной проводимости БЛМ и появ
в которой авторы пренебрегли ёмкостными пе
лению стационарного фотоиндуцированного
реходными процессами. Мы незначительно мо
тока, который был постоянного знака при лю
дифицировали эквивалентную электрическую
бых напряжениях для bR или менял направле
схему, чтобы модель описывала также возмож
ние согласно полярности напряжения
-
ные канальные свойства родопсинов, и ввели
для ChR2 (рис. 1-3). Чтобы понять, каким обра
эквивалентное сопротивление канала (Rch)
БИОХИМИЯ том 86 вып. 4 2021
ФОТОТОКИ РЕТИНАЛЬ СОДЕРЖАЩИХ БЕЛКОВ НА БЛМ
489
(рис. 4, б). Очевидно, что в случае проявления
канальных свойств родопсина ток ионной утеч
ки через мембрану ПЛ при освещении будет
усиливаться. Поэтому сопротивление Rch в
электрической схеме расположено параллельно
Рис. 4. а - Схематическое изображение плоской БЛМ с ад
сорбированными ПЛ в условиях фиксации напряжения и в
присутствии протонофора. Область контакта ПЛ и БЛМ
обозначена пунктиром. б - Эквивалентная электрическая
схема, где Ep - эквивалентное напряжение помпы, Rm - эк
вивалентное сопротивление БЛМ (за исключением облас
ти контактов с липосомами), Rc - эквивалентное сопро
тивление области контактов с липосомами, Rch - эквивалент
ное сопротивление канала, Rv - эквивалентное сопротив
ление липосомальной мембраны и Rp - эквивалентное
сопротивление помпы. Ёмкости мембран в данном при
ближении не рассматриваются
с Ep, то есть с генератором тока. Анализ этой
схемы дает соотношение между током и прило
женным напряжением Ee в виде:
, (1)
где Ep - эквивалентное напряжение помпы,
Rm - эквивалентное сопротивление БЛМ (за
исключением области контактов с липосома
ми), Rc - эквивалентное сопротивление области
контактов с липосомами (рис. 4, а), Rv - эквива
лентное сопротивление липосомальной мем
браны и Rp - эквивалентное сопротивление
помпы.
Нами были сделаны следующие предполо
жения: сопротивление помпы и/или канала
светочувствительных белков очень большое в
отсутствие освещения (Rp, Rch >> Rm, Rc, Rv) и
существенно уменьшается при освещении
(Rp, Rch ≈ Rm, Rc). Также очевидно, что в случае
высокой ионной проводимости липидной
мембраны липосом (Rv → 0), опосредованное
Рис. 3. Измерение электрического тока через БЛМ с адсор
каналом родопсина светоиндуцированное из
бированными ПЛ с bR. а - Записи тока через БЛМ при
менение тока будет ничтожно мало, так как ток
напряжении 0 мВ через 1 ч после начала инкубации с про
теолипосомами. Период освещения показан сплошной
пойдёт по наименьшему из сопротивле
черной линией. б - Кинетики фототока через БЛМ с ад
ний (рис. 4, б). Поэтому важной задачей являет
сорбированными ПЛ в присутствии 0,1 мкМ ТТФБ при
ся недопущение уменьшения сопротивления
разных напряжениях. Буферный раствор содер
липидной части липосом. При условии Rv → ∞
жал 10 мМ Мес, 10 мМ Tris HCl, 100 мМ NaCl, рН 6,0. в -
Зависимость величины максимального фототока от прило
уравнение (1) сводится к двум следующим урав
женного напряжения при разных рН
нениям:
3 БИОХИМИЯ том 86 вып. 4 2021
490
РОКИЦКАЯ и др.
мембранный ток в темноте -
В другом частном случае, когда белок обла
дает только канальными способностями (Ep = 0
и Rp
= ∞), уравнение
(2) преобразуется
,
(1а)
в ΔI=Ee/(Rc + Rch). Линейная аппроксимация за
висимости ΔI от напряжения позволяет опреде
и мембранный ток при освещении -
лить (Rc + Rch) по формуле (Rc + Rch) = Ee/ΔI.
Если белок обладает способностями и пом
пы, и канала, то Rp >> Rch, и уравнение (2) при
(1б)
мет вид:
Появление стационарного фототока при до
,
бавлении протонофора связано с тем, что ТТФБ
значительно снижает сопротивление Rc для
ионов водорода, что позволяет зарядам (ионам
а при ΔI = 0,
водорода), закачиваемым в липосомы протон
ной помпой, переходить на цис сторону БЛМ.
(3)
Изменение стационарного тока после включе
ния освещения описывается формулой:
Так как мы не знаем соотношение Rp/Rch, то
сложно с достаточной точностью оценить вели
чину Ep. Анализ вольт амперных характерис
тик ChR2 показывает, что -Ee при ΔI = 0 состав
ляет ~4 мВ при рН 6,0 (усреднение по четырём
экспериментам) и увеличивается до
27
мВ
при рН 8,1. (Rc + Rch) для эксперимента, приве
(2)
дённого на рис. 2, увеличивалось с 0,43 109 Ω
при pH 6,0 до 6,8 109 Ω - при pH 8,1, а сопротив
Из уравнения (2) следует, что в частном слу
ление мембраны увеличилось с
34
MΩ до
чае, когда белок обладает только помповой ак
370 MΩ. В среднем по нескольким эксперимен
тивностью и Rch = ∞, то ΔI = (Ee+Ep)/(Rc+Rp).
там при освещении белым светом для ChR2 -
Линейная аппроксимация зависимости ΔI от
(Rc + Rch) = 0,36 ± 0,1 GΩ при рН 6,0. И хотя не
напряжения позволяет определить Ep - (Ep =
совсем корректно сравнивать липосомы с бакте
= -Ee при ΔI = 0) и (Rc + Rp) - (Rc + Rp = Ep/ΔI
риородопсином и канальным родопсином ChR2
при Ee = 0).
из за некоторой разницы в концентрациях бел
Таким образом, в случае бактериородопсина
ка в ПЛ, оценка суммы сопротивления контакта
из рис. 3, в можно определить, что Ep состави
и белка в случае ChR2 дает величину в 3,5 раза
ло 195, 182 и 143 мВ для рН 6,0, 7,0 и 7,8 соответ
меньше, чем в случае bR (при одинаковом осве
ственно. Ранее было показано, что при измере
щении белым светом и рН 6,0), что может быть
нии напряжения на БЛМ с адсорбированными
связано со значительным светоиндуцирован
bR содержащими ПЛ в условиях постоянного
ным падением сопротивления белка в случае
освещения напряжение на мембране, при кото
ChR2.
ром фотоответ становился равен нулю, состави
Известно, что канал ChR2 пропускает про
ло ~300 мВ [5]. В другой работе при встраива
тоны, а также одно и двухвалентные катионы.
нии пурпурных мембран в БЛМ и измерении
Поэтому при уменьшении концентрации ионов
фототока при разных напряжениях путём
Na+ и протонов в водном растворе проводи
экстраполяции вольт амперной характеристи
мость канала ChR2 должна значительно умень
ки фотоиндуцированного тока было обнаруже
шиться. Тогда в этих условиях Rch увеличится и,
но, что нулевой ток помпы наблюдается
согласно уравнению (3), Ep приблизится к зна
при 200 мВ (эксперимент проводился при
чению -Ee при ΔI = 0. Мы измерили потенциал
рН 6,3) [8]. Из экспериментальных данных мы
зависимость фототока липосом с ChR2 в усло
оценили сумму сопротивлений контакта с ли
виях 20 мМ Tris HCl, 20 мМ Hepes и рН 6,8,
посомами и помпой. (Rc + Rp) увеличивается с
и -Ee при ΔI = 0 составило ~60 мВ (данные не
1,3 109 Ω при pH 6,0 до 5,6 109 Ω при pH 7,8, что
приведены). Таким образом, варьируя ионный
коррелирует с почти
4× увеличением Rm
состав буферного раствора, можно усиливать
(с 24 MΩ при pH 6,0 до 85 MΩ - при pH 7,8) и с
либо помповую, либо канальную активность
хорошо известной рН зависимостью рабо
светочувствительного белка. Измерения в кле
ты ТТФБ на БЛМ с максимумом проводимости
точных системах не всегда позволяют варьиро
при значении рН ~5 [42, 43].
вать условия эксперимента в широком диапазо
БИОХИМИЯ том 86 вып. 4 2021
ФОТОТОКИ РЕТИНАЛЬ СОДЕРЖАЩИХ БЕЛКОВ НА БЛМ
491
не. Следует сказать, что нам не удалось обнару
жить зависимость относительной амплитуды
фототока ChR2 или напряжения нулевого тока
от концентрации ионов Na+ в омывающем раст
воре (в диапазоне 30-500 мМ) в присутствии
протонофора ТТФБ и монензина. Это может
быть объяснено тем, что селективность ChR2 по
протону в ∼106 раз выше селективности по нат
рию [13].
Изучение влияния различных протонофоров на
проводимость БЛМ и возможности их использо
вания при измерении фототоков. Мы также обна
ружили, что амплитуда фототока сильно меня
ется при использовании различных протонофо
ров. Так в случае измерений в присутствии
5
мкМ ХКФ с цис стороны мембраны
при рН 6,0 проводимость мембраны возрастает
до 7 нСм, однако стационарный фототок для
липосом с ChR2 не превышает 1-2 рА и практи
чески не зависит от приложенного напряжения.
При добавлении 4 мкМ ХКФ после экспери
ментов с ТТФБ и липосомами с канальным ро
допсином относительная величина тока α
уменьшается в 2 и более раз, хотя Rm меняется
при этом незначительно. При использовании
протонофора ХКФ в случае липосом с бактерио
родопсином значения ΔI были примерно в
10 раз меньше, чем в случае ТТФБ. Ранее похо
жие результаты с бактериородопсином были по
лучены с протонофором ФКФ (карбонилциа
нид n трифторометокси фенилгидразон) в ра
Рис. 5. Значения проводимости БЛМ (нСм) в присутствии
боте Bamberg et al. [39]. В экспериментах с бак
протонофоров ТТФБ и ХКФ на БЛМ, сформированных из
териородопсин содержащими ПЛ фототок воз
раствора дифитаноил ФХ и димиристоилэтил ФХ в дека
не (а) или азолектина в сквалене (б). Измерения проводили
растал в 5 раз при добавлении 0,1 мкМ ФКФ.
в условиях 5 мМ МЕС, 5 мМ Tris HCl, 50 мМ KCl, рН 7,0.
Однако при добавлении 5 мкМ протонофо
Приведены средние значения ± стандартная ошибка
ра ФКФ ΔI становилось равным нулю. Особен
но сильное влияние было в случае низкой кон
центрации бактериородопсина в ПЛ. В то же
вора азолектина в сквалене, при двух концент
время ТТФБ значительно увеличивал стацио
рациях ХКФ и ТТФБ (рис. 5). Считается, что
нарный фототок в экспериментах с галородоп
при формировании БЛМ из липидного раствора
сином. В дальнейших работах Bamberg et al. ис
в сквалене, также как в случае липосом, образу
пользовали протонофор 1799.
ется мембрана, лишенная растворителя, так как
Поскольку при адсорбции ПЛ на поверхнос
сквален, в отличие от декана, не может распола
ти БЛМ в модельной системе участвует два типа
гаться между липидными монослоями и уходит
липидных мембран, мы предположили, что про
на периферию БЛМ при её формировании [44].
тонофоры могут по разному встраиваться в по
Поэтому БЛМ из раствора в сквалене по толщи
ложительно заряженную липидную мембрану
не более близка к липосомальной липидной
(сформированную по методу Mueller et al. [32] с
мембране, тогда как декановые мембраны име
использованием декана в качестве растворите
ют примерно вдвое большую толщину [45]. Ока
ля) и мембрану липосом, образованную из ли
залось, что в используемых концентрациях
пида азолектина и не содержащую растворите
ХКФ значительно сильнее увеличивает прово
ля. Для подтверждения этого предположения
димость сухой мембраны из раствора азолекти
нами была измерена проводимость мембраны,
на в сквалене, чем проводимость БЛМ из раст
сформированной из раствора 2% ного дифита
вора дифитаноил ФХ в декане. В то же время
ноил ФХ и 0,04% ного димиристоилэтил ФХ в
ТТФБ в концентрации 50 нМ сильнее увеличи
декане, используемой для адсорбции ПЛ, и
вает проводимость сухой мембраны, а при уве
мембраны, сформированной из 2% ного раст
личении концентрации лучше работает в мемб
БИОХИМИЯ том 86 вып. 4 2021
3*
492
РОКИЦКАЯ и др.
ров ХКФ и ТТФБ значительно ускоряло процесс
выравнивания рН, приблизительно одинаковая
скорость изменения рН внутри липосом наблю
далась при 5 мкм ХКФ и 12 мкМ ТТФБ (рис. 6).
Однако для индуцирования приблизительно
одинакового протонного тока на БЛМ, сформи
рованной из раствора липида в декане, требова
лись концентрации ХКФ на порядок больше,
чем ТТФБ (рис. 5). Значит, ХКФ в большей сте
пени делает мембрану ПЛ проницаемой по про
тону, чем увеличивает проводимость БЛМ, на
которой сорбируются липосомы. ТТФБ, напро
тив, сильнее увеличивает протонную проводи
мость плоской БЛМ, чем мембраны ПЛ.
Ранее при рассмотрении эквивалентной
электрической схемы мы показали, что в случае
Рис. 6. Измерение способности протонофоров переносить
высокой ионной проводимости липидной
протоны через липосомальную мембрану в модельной сис
мембраны липосом (Rv → 0) светоиндуцирован
теме липосом, нагруженных флуоресцентным зондом пи
ранином. Кинетики изменения рН внутри липосом при
отсутствии разобщителей (серая кривая, контроль), в при
сутствии
5
мкМ ХКФ (серая кривая,
1) или
12 мкМ ТТФБ (черная кривая, 2)
ране, сформированной из раствора в декане.
По видимому, это связано с тем, что ТТФБ
функционирует в димерной форме на мембра
нах с деканом [42, 43]. Похожие результаты бы
ли получены ранее в работе Bakker et al. [46]. Ав
торы показали, что концентрационные зависи
мости проводимости БЛМ с деканом в качестве
растворителя в присутствии различных прото
нофоров не коррелируют с их протонофорным
действием на липосомах, измерение которого
проводилось по валиномицин индуцированно
му набуханию мультиламеллярных липосом или
по восстановлению феррицианида, нагружен
ного в липосомы: ТТФБ сильнее увеличивал
проводимость БЛМ, а ФКФ оказывал более
сильное разобщающее действие на мембране
липосом [46].
Такие же выводы можно сделать из наших
опытов по сравнению протонофорного
действия ТТФБ и ХКФ на липосомах, нагру
женных рН чувствительным флуоресцентным
красителем пиранином (рис. 6). Соединения до
бавляли к липосомам в начале эксперимента
при рН 6,0, затем в момент времени t = 0 с, до
бавляя определенное количество оттитрованно
го раствора КОН, создавали градиент рН в две
Рис. 7. Потенциал зависимые измерения фототоков ка
единицы на мембране липосом (рН снаружи
нального родопсина в присутствии усниновой кислоты.
увеличивался с 6,0 до 8,0). В контрольном экс
а - Кинетики фототока через БЛМ с адсорбированными
перименте (серая кривая на рис. 5) рН внутри
ПЛ с ChR2 в присутствии 4,5 мкМ усниновой кислоты
с цис стороны при напряжении от -75 до +75 мВ (с ша
липосом практически не менялся, и только до
гом 25 мВ) при освещении белым светом. Буферный раст
бавление ласалоцида А приводило к выравнива
вор содержал 10 мМ Мес, 10 мМ Tris HCl, 0,2 мМ MgCl2,
нию внешнего и внутреннего рН на липосо
500 мМ NaCl, рН 5,7. б - Зависимость величины стацио
мальной мембране. Добавление протонофо
нарного фототока от приложенного напряжения
БИОХИМИЯ том 86 вып. 4 2021
ФОТОТОКИ РЕТИНАЛЬ СОДЕРЖАЩИХ БЕЛКОВ НА БЛМ
493
ное изменение сопротивления канала будет не
разовывался концентрационный градиент ионов
возможно зарегистрировать, а стационарный
Cl-, а вслед за этим градиент тетрафенилбората
ток при работе помпы будет очень мал, так как
на липосомальной мембране. При использова
он в основном будет шунтироваться на липосо
нии нами динитрофенола в качестве протонофо
мах. По видимому, из за быстрого проникнове
ра стационарные фототоки оказались неболь
ния через липидную мембрану добавление про
шими. Потенциал зависимость фототока реги
тонофора со стороны, противоположной добав
стрировалась при очень кислых значени
лению ПЛ с бактериородопсином, не предот
ях рН (∼2,8), относительное изменение тока α
вращает увеличение протонной проводимости
было ~1%. При рН 5,0 и выше динитрофенол
липосомальной мембраны. Дополнительные
очень слабо увеличивал проводимость БЛМ.
эксперименты с добавлением протонофора
Мы показали, что метод измерения фотото
ТТФБ с цис и транс стороны показали, что ве
ков при адсорбции липосом на поверхности
личины фототока в случае ПЛ с бактериородоп
БЛМ в присутствии протонофора и других пере
сином приблизительно одинаковы. Таким обра
носчиков применим не только для изучения
зом, из наших и литературных данных следует,
функционирования родопсинов помпового ти
что в экспериментах по изучению функций све
па, но и родопсинов канального типа при реги
точувствительных белков необходимо использо
страции потенциал зависимости фототоков.
вать протонофоры, которые сильнее увеличива
Особое внимание должно быть уделено выбору
ют проводимость плоской БЛМ, на которой
используемого протонофора.
сорбируются липосомы, чем проводимость ли
посом: ТТФБ и, возможно, протонофор 1799
[47], который используется в лаборатории
Финансирование. Работа выполнена при фи
Ernst Bamberg.
нансовой поддержке Российского Фонда Фун
Мы провели потенциал зависимые измере
даментальных Исследований (грант № 19 04
ния фототоков канального родопсина в присут
00238), Российского Фонда Фундаментальных
ствии усниновой кислоты [48], и также обнару
Исследований и Национального центра науч
жили почти симметричную по знаку напряже
ных исследований в рамках научного проекта
ния потенциал зависимость стационарного фо
№ 19 52 15017, а также при поддержке Государ
тотока (рис. 7). Однако в случае усниновой кис
ственного задания РФ (соглашение № 075
лоты, кроме стационарного, наблюдался значи
00337 20 03, проект FSMG 2020 0003).
тельный спад фототока, который, по видимому,
Благодарности. Выражаем благодарность
связан с большим количеством заряженной фор
Christian Baeken за предоставление пурпурных
мы протонофора и перераспределением ее в
мембран.
мембране липосом и БЛМ после включения све
Конфликт интересов. Авторы заявляют об от
та (рис. 7, а). Подобные кинетики спада тока бы
сутствии конфликта интересов.
ли показаны в работе Bamberg et al. [39] на БЛМ
Соблюдение этических норм. Настоящая
с адсорбированными ПЛ с галородопсином в
статья не содержит каких либо исследований с
присутствии липофильного аниона тетрафенил
участием людей или использованием животных
бората, где благодаря работе хлорной помпы об
в качестве объектов.
СПИСОК ЛИТЕРАТУРЫ
1.
Oesterhelt, D., and Stoeckenius, W. (1973) Functions of a
tric current. Bacteriorhodopsin, J. Biol. Chem., 251, 7059
new photoreceptor membrane, Proc. Natl. Acad. Sci. USA,
7065.
70, 2853 2857.
6.
Siletsky, S. A., Mamedov, M. D., Lukashev, E. P.,
2.
Kayushin, L. P., and Skulachev, V. P.
(1974)
Balashov, S. P., Dolgikh, D. A., et al. (2019) Elimination of
Bacteriorhodopsin as an electrogenic proton pump: recon
proton donor strongly affects directionality and efficiency
stitution of bacteriorhodopsin proteoliposomes generating
of proton transport in ESR, a light driven proton pump
delta psi and delta pH, FEBS Lett., 39, 39 42.
from Exiguobacterium sibiricum, Biochim. Biophys. Acta
3.
Oesterhelt, D., and Schuhmann, L. (1974) Reconstitution
Bioenerg., 1860, 1 11.
of bacteriorhodopsin, FEBS Lett., 44, 262 265.
7.
Herrmann, T. R., and Rayfield, G. W. (1978) The electrical
4.
Drachev, L. A., Jasaitis, A. A., Kaulen, A. D.,
response to light of bacteriorhodopsin in planar mem
Kondrashin, A. A., Liberman, E. A., et al. (1974) Direct
branes, Biophys. J., 21, 111 125.
measurement of electric current generation by cytochrome
8.
Bamberg, E., Dencher, N. A., Fahr, A., and Heyn, M. P.
oxidase, H+ ATPase and bacteriorhodopsin, Nature, 249,
(1981) Transmembranous incorporation of photoelectri
321 324.
cally active bacteriorhodopsin in planar lipid bilayers, Proc.
5.
Drachev, L. A., Frolov, V. N., Kaulen, A. D.,
Natl. Acad. Sci. USA, 78, 7502 7506.
Liberman, E. A., Ostroumov, S. A., et al.
(1976)
9.
Bamberg, E., Apell, H. J., Dencher, N. A., Sperling, W.,
Reconstitution of biological molecular generators of elec
Stieve, H., and Lauger, P. (1979) Photocurrents generated
БИОХИМИЯ том 86 вып. 4 2021
494
РОКИЦКАЯ и др.
by bacteriorhodopsin on planar bilayer membranes,
30.
Feldbauer, K., Zimmermann, D., Pintschovius, V.,
Biophys. Struct. Mechanism, 5, 277 292.
Spitz, J., Bamann, C., and Bamberg, E.
(2009)
10.
Bamberg, E., Butt, H. J., Eisenrauch, A., and Fendler, K.
Channelrhodopsin 2 is a leaky proton pump, Proc. Natl.
(1993) Charge transport of ion pumps on lipid bilayer
Acad. Sci. USA, 106, 12317 12322.
membranes, Q Rev Biophys., 26, 1 25.
31.
Geibel, S., Friedrich, T., Ormos, P., Wood, P. G.,
11.
Friedrich, T., Geibel, S., Kalmbach, R., Chizhov, I.,
Nagel, G., and Bamberg, E. (2001) The voltage dependent
Ataka, K., et al. (2002) Proteorhodopsin is a light driven pro
proton pumping in bacteriorhodopsin is characterized by
ton pump with variable vectoriality, J. Mol. Biol., 321, 821 838.
optoelectric behavior, Biophys. J., 81, 2059 2068.
12.
Nagel, G., Ollig, D., Fuhrmann, M., Kateriya, S., Musti, A.
32.
Mueller, P., Rudin, D. O., Tien, H. T., and Wescott, W. C.
M., et al. (2002) Channelrhodopsin 1: a light gated proton
(1963) Methods for the formation of single bimolecular lipid
channel in green algae, Science, 296, 2395 2398.
membranes in aqueous solution, J. Phys. Chem., 67, 534 535.
13.
Nagel, G., Szellas, T., Huhn, W., Kateriya, S.,
33.
Volkov, O., Kovalev, K., Polovinkin, V., Borshchevskiy, V.,
Adeishvili, N., et al. (2003) Channelrhodopsin 2, a direct
Bamann, C., et al. (2017) Structural insights into ion con
ly light gated cation selective membrane channel, Proc.
duction by channelrhodopsin 2, Science, 358, eaan8862.
Natl. Acad. Sci. USA, 100, 13940 13945.
34.
Dencher, N. A., and Heyn, M. P. (1982) Preparation and
14.
Deisseroth, K. (2015) Optogenetics: 10 years of microbial
properties of monomeric bacteriorhodopsin, Methods
opsins in neuroscience, Nat. Neurosci., 18, 1213 1225.
Enzymol., 88, 5 10.
15.
Boyden, E. S., Zhang, F., Bamberg, E., Nagel, G., and
35.
Chen, Y., Schindler, M., and Simon, S. M. (1999) A mech
Deisseroth, K. (2005) Millisecond timescale, genetically
anism for tamoxifen mediated inhibition of acidification,
targeted optical control of neural activity, Nat. Neurosci., 8,
J. Biol. Chem., 274, 18364 18373.
1263 1268.
36.
Gradmann, D., Berndt, A., Schneider, F., and
16.
McIsaac, R. S., Bedbrook, C. N., and Arnold, F. H. (2015)
Hegemann, P. (2011) Rectification of the channel
Recent advances in engineering microbial rhodopsins for
rhodopsin early conductance, Biophys. J., 101, 1057 1068.
optogenetics, Curr. Opin. Struct. Biol., 33, 8 15.
37.
Sineshchekov, O. A., Govorunova, E. G., Wang, J., Li, H.,
17.
Sineshchekov, O. A., Govorunova, E. G., Li, H., and
and Spudich, J. L. (2013) Intramolecular proton transfer in
Spudich, J. L. (2017) Bacteriorhodopsin like channel
channelrhodopsins, Biophys. J., 104, 807 817.
rhodopsins: alternative mechanism for control of cation con
38.
Rayfield, G. W. (1982) Kinetics of the light driven proton
ductance, Proc. Natl. Acad. Sci. USA, 114, E9512 E9519.
movement in model membranes containing bacterio
18.
Govorunova, E. G., Sineshchekov, O. A., Janz, R., Liu, X.,
rhodopsin, Biophys. J., 38, 79 84.
and Spudich, J. L. (2015) Natural light gated anion chan
39.
Bamberg, E., Hegemann, P., and Oesterhelt, D. (1984)
nels: a family of microbial rhodopsins for advanced opto
The chromoprotein of halorhodopsin is the light driven
genetics, Science, 349, 647 650.
electrogenic chloride pump in Halobacterium halobium,
19.
Zabelskii, D., Alekseev, A., Kovalev, K., Rankovic, V.,
Biochemistry, 23, 6216 6221.
Balandin, T., et al. (2020) Viral rhodopsins 1: a unique fam
40.
Bamberg, E., Hegemann, P., and Oesterhelt, D. (1984)
ily of light gated ion channels, Nat. Commun., 11, 5707.
Reconstitution of the light driven electrogenic ion pump
20.
Gradinaru, V., Zhang, F., Ramakrishnan, C., Mattis, J.,
halorhodopsin in black lipid membranes, Biochim. Biophys.
Prakash, R., et al. (2010) Molecular and cellular approaches
Acta, 773, 53 60.
for diversifying and extending optogenetics, Cell, 141, 154 165.
41.
Vodyanoy, I., Vodyanoy, V., and Lanyi, J. K.
(1986)
21.
Chow, B. Y., Han, X., Dobry, A. S., Qian, X.,
Current voltage characteristics of planar lipid membranes
Chuong, A. S., et al. (2020) High performance genetically
with attached Halobacterium cell envelope vesicles,
targetable optical neural silencing by light driven proton
Biochim. Biophys. Acta, 858, 92 98.
pumps, Nature, 463, 98 102.
42.
Liberman, E. A., and Topaly, V. P. (1968) Selective trans
22.
Kovalev, K., Astashkin, R., Gushchin, I., Orekhov, P.,
port of ions through bimolecular phospholipid membranes,
Volkov, D., et al. (2020) Molecular mechanism of light dri
Biochim. Biophys. Acta, 163, 125 136.
ven sodium pumping, Nat. Commun., 11, 2137.
43.
Borisova, M. P., Ermishkin, L. N., Liberman, E. A.,
23.
Vogt, A., Silapetere, A., Grimm, C., Heiser, F.,
Silberstein, A. Y., and Trofimov, E. M. (1974) Mechanism
Moller, M. A., and Hegemann, P. (2019) Engineered pas
of conductivity of bimolecular lipid membranes in the
sive potassium conductance in the KR2 sodium pump,
presence of tetrachlorotrifluoromethylbenzimidazole,
Biophys. J., 116, 1941 1951.
J. Membr. Biol., 18, 243 261.
24.
Kovalev, K., Polovinkin, V., Gushchin, I., Alekseev, A.,
44.
White, S. H. (1978) Formation of “solvent free” black
Shevchenko, V., et al. (2019) Structure and mechanisms of
lipid bilayer membranes from glyceryl monooleate dis
sodium pumping KR2 rhodopsin, Sci. Adv., 5, eaav2671.
persed in squalene, Biophys. J., 23, 337 347.
25.
Maliar, N., Kovalev, K., Baeken, C., Balandin, T.,
45.
Benz, R., Frohlich, O., Lauger, P., and Montal, M. (1975)
Astashkin, R., et al. (2020) Crystal structure of the N112A
Electrical capacity of black lipid films and of lipid bilayers
mutant of the light driven sodium pump KR2, Crystals, 10, 496.
made from monolayers, Biochim. Biophys. Acta, 394, 323 334.
26.
Shevchenko, V., Mager, T., Kovalev, K., Polovinkin, V.,
46.
Bakker, E. P., van den Heuvel, E. J., Wiechmann, A. H.,
Alekseev, A., Juettner, J., Chizhov, I., Bamann, C.,
and van Dam, K. (1973) A comparison between the effec
Vavourakis, C., Ghai, R., Gushchin, I., et al.
(2017)
tiveness of uncouplers of oxidative phosphorylation in
Inward H(+) pump xenorhodopsin: mechanism and alter
mitochondria and in different artificial membrane systems,
native optogenetic approach, Sci. Adv., 3, e1603187.
Biochim. Biophys. Acta, 292, 78 87.
27.
Gushchin, I., and Gordeliy, V.
(2018) Microbial
47.
Tittor, J., Schweiger, U., Oesterhelt, D., and Bamberg, E.
Rhodopsins, Subcell Biochem., 87, 19 56.
(1994) Inversion of proton translocation in bacterio
28.
Bratanov, D., Kovalev, K., Machtens, J. P., Astashkin, R.,
rhodopsin mutants D85N, D85T, and D85,96N,
Chizhov, I., et al. (2019) Unique structure and function of
Biophys. J., 67, 1682 1690.
viral rhodopsins, Nat. Commun., 10, 4939.
48.
Antonenko, Y. N., Khailova, L. S., Rokitskaya, T. I.,
29.
Maliar, N., Okhrimenko, I. S., Petrovskaya, L. E.,
Nosikova, E. S., Nazarov, P. A., et al. (2019) Mechanism of
Alekseev, A. A., Kovalev, K. V., et al. (2020) Novel pH sen
action of an old antibiotic revisited: role of calcium ions in
sitive microbial rhodopsin from Sphingomonas paucimo
protonophoric activity of usnic acid, Biochim. Biophys.
bilis, Dokl. Biochem. Biophys., 495, 342 346.
Acta, 1860, 310 316.
БИОХИМИЯ том 86 вып. 4 2021
ФОТОТОКИ РЕТИНАЛЬ СОДЕРЖАЩИХ БЕЛКОВ НА БЛМ
495
RHODOPSIN CHANNEL ACTIVITY CAN BE EVALUATED
BY MEASURING THE PHOTOCURRENT VOLTAGE DEPENDENCE
IN PLANAR BILAYER LIPID MEMBRANES
T. I. Rokitskaya1*, N. Maliar2, K. V. Kovalev2,3,
O. Volkov4,5, V. I. Gordeliy2,3,4,5, and Y. N. Antonenko1
1 Belozersky Institute of Physico Chemical Biology, Lomonosov Moscow State University,
119991 Moscow, Russia; E mail: rokitskaya@genebee.msu.ru
2 Moscow Institute of Physics and Technology, 141701 Dolgoprudny, Moscow Region, Russia
3 Institut de Biologie Structurale (IBS), Université Grenoble Alpes, CEA, CNRS, 38044 Grenoble, France
4 Institute of Biological Information Processing (IBI 7: Structural Biochemistry),
Forschungszentrum Jülich GmbH, 52425 Juelich, Germany
5 JuStruct: Jülich Center for Structural Biology, Forschungszentrum Jülich GmbH, 52425 Juelich, Germany
The studies of the functional properties of retinal containing proteins often include experiments in model membrane
systems, e.g., measurements of electric current through planar bilayer lipid membranes (BLMs) with proteoliposomes
adsorbed on one of the membrane surfaces. However, the possibilities of this method have not been fully explored yet.
We demonstrated that the voltage dependence of stationary photocurrents for two light sensitive proteins, bacteri
orhodopsin (bR) and channelrhodopsin 2 (ChR2), in the presence of protonophore had very different characteristics.
In the case of the bR (proton pump), the photocurrent through the BLM did not change direction when the polarity
of the applied voltage was switched. In the case of the photosensitive channel protein ChR2, the photocurrent
increased with the increase in voltage and the current polarity changed with the change in the voltage polarity. The
protonophore 4,5,6,7 tetrachloro 2 trifluoromethyl benzimidazole (TTFB) was more efficient in the maximizing
stationary photocurrents. In the presence of carbonyl cyanide m chlorophenylhydrazone (CCCP), the amplitude of
the measured photocurrents for bR significantly decreased, while in the case of ChR2, the photocurrents virtually dis
appeared. The difference between the effects of TTFB and CCCP was apparently due to the fact that, in contrast to
TTFB, CCCP transfers protons across the liposome membranes with a higher rate than through the decane contain
ing BLM used as a surface for the proteoliposome adsorption.
Keywords: retinal containing proteins, channel rhodopsin, proton pump, proteoliposomes, bilayer lipid membrane,
protonophore
БИОХИМИЯ том 86 вып. 4 2021