БИОХИМИЯ, 2021, том 86, вып. 4, с. 511 - 528
УДК 577.24::57.052.6
РЕГУЛЯЦИЯ БЕЛКОВ ЦИРКАДНЫХ РИТМОВ
И Nrf2 ОПОСРЕДОВАННОЙ АНТИОКСИДАНТНОЙ ЗАЩИТЫ:
ДВОЙНАЯ РОЛЬ КИНАЗЫ ГЛИКОГЕНСИНТАЗЫ 3
Обзор
© 2021
Г.А. Шиловский1,2,3*, Т.С. Путятина2, Г.В. Моргунова2, А.В. Селиверстов3,
В.В. Ашапкин1, Е.В. Сорокина2, А.В. Марков2, В.П. Скулачев1
1 НИИ физико химической биологии имени А.Н. Белозерского, Московский государственный университет
имени М.В. Ломоносова, 119991 Москва, Россия; электронная почта: gregory_sh@list.ru, grgerontol@gmail.com
2 Московский государственный университет имени М.В. Ломоносова,
биологический факультет, 119234 Москва, Россия
3 Институт проблем передачи информации РАН, 127051 Москва, Россия
Поступила в редакцию 14.07.2020
После доработки 11.01.2021
Принята к публикации 11.01.2021
В обзоре рассматриваются некоторые генетические и молекулярные пути, связывающие циркадный хроно
метраж с метаболизмом и образующие системы положительной и отрицательной обратной связи - регуля
торные петли. Путь Nrf2 (транскрипционного фактора 2 семейства NFE) считается компонентом антивоз
растной программы - хранителем периода здоровой жизни и долголетия. Nrf2 обеспечивает адаптацию к
стрессу путем положительной регуляции клеточной антиоксидантной защиты и других метаболических
процессов, контролируя экспрессию более 200 генов мишеней при различных видах стресса. Система ки
назы гликогенсинтазы 3 (GSK3) представляет собой «регулирующий клапан», контролирующий небольшие
колебания уровней Nrf2, в отличие от Keap1, предотвращающего большие колебания уровня Nrf2 в отсут
ствии окислительного стресса и инактивирующегося при окислительном стрессе. Кроме того, GSK3 моди
фицирует коровые белки циркадных ритмов (Bmal1, Clock, Per, Cry, Rev erbα). При этом модификация
GSK3 приводит к инактивации и деградации белков, положительно регулирующих биоритмы (Bmal1,
Clock), и наоборот, ведет к активации и ядерной транслокации негативно регулирующих биоритмы бел
ков (Per, Rev erbα). Исключением является Cry, опосредующий, видимо, тонкую настройку биологических
часов. Функция GSK3 представляется одним из узловых пунктов перекрестной регуляции циркадных рит
мов и антиоксидантной защиты. Обсуждается перекрестное взаимодействие между мощнейшей антиокси
дантной защитой клетки (системой Nrf2) и системой биоритмов у млекопитающих (включая влияние сверх
экспрессии/нокаута GSK3 на биоритмы и влияние нокаута/сверхэкспрессии генов циркадных биоритмов
на работу системы Nrf2). Понимание механизмов взаимодействия регуляторных каскадов, связывающих
программы поддержания гомеостаза и ответа клетки на окислительный стресс, способствует выяснению
молекулярных механизмов, лежащих в основе старения и долголетия.
КЛЮЧЕВЫЕ СЛОВА: GSK3, Nrf2, окислительный стресс, старение, биологические ритмы, программы
старения и антистарения, антиоксиданты.
DOI: 10.31857/S0320972521040059
ВВЕДЕНИЕ
организмов. С эволюционной точки зрения
первоочередными являются проблемы адапта
Долголетие как таковое не является перво
ции к окружающей среде, связанные с нуждами
очередной эволюционной «задачей» для живых выживания, обеспечения пищей и размноже
Принятые сокращения: АФК - активные формы кислорода; БА - болезнь Альцгеймера; ТФ - транскрипционный
фактор; ARE - антиоксидант респонс(ив)ный элемент (antioxidant response element); CK - казеинкиназа (casein kinase);
Cry - белок криптохром; Cul3 - куллин 3 (cullin); D3T - H3 1,2 дитиол 3 тион; GSK3 - киназа гликогенсинтазы 3;
Keap1 - Kelch подобный ECH ассоциированный белок 1 (Kelch like ECH associated protein 1); LPS - липополисахарид;
MEF - эмбриональные фибробласты мыши; Nrf1 - транскрипционный фактор 1 семейства NFE (NFE2 related factor 1);
Nrf2 - транскрипционный фактор 2 семейства NFE (Nuclear factor erythroid 2 related factor 2, NFE2 related factor 2);
NQO1 - NAD(P)H:хиноноксидоредуктаза; Per - белок Period; Rev erbα - белок Reverse erythroblastosis virus α; RORE -
RAR related orphan receptor response element; SCN - супрахиазматическое ядро гипоталамуса; β TrCP - белок, содержа
щий β трансдуциновые повторы (β transducin repeat containing protein), WT - дикий тип.
* Адресат для корреспонденции.
511
512
ШИЛОВСКИЙ и др.
ния. Регуляция поддержания гомеостаза и репа
будут относиться к программе старения [1].
рации представляет собой сложную сеть взаи
Транскрипционный фактор (ТФ) Nrf2 (Nuclear
мозависимых реакций, а эффективность этих
factor erythroid 2 related factor 2, транскрипци
процессов ухудшается с возрастом [1-9]. В ряде
онный фактор 2 семейства NFE) является, со
случаев старение может иметь адаптивное зна
гласно одному из авторов данной статьи (В.П.С.)
чение [4, 5].
[1], представителем одной из наиболее явных
Важной задачей биогеронтологии является
клеточных программ антистарения (рис. 1). Nrf2
изучение путей пересечения программ старе
регулирует транскрипцию антиоксидантных и
ния/антистарения с программами адаптации и
детоксифицирующих ферментов, которые в со
поддержания гомеостаза, в том числе через сис
вокупности представляют собой мощную за
тему регуляции биоритмов. Взаимодействие
щитную систему клетки [1-6]. Однако функции
программ антистарения с противоположными
Nrf2 этим не ограничиваются, он также являет
им по действию программами старения опреде
ся основным регулятором клеточного гомеоста
ляет форму кривых выживания и их изменение в
за, который контролирует экспрессию более 1%
ходе биологической, а у человека - еще и куль
генов человека, связанных с реакциями биотранс
турной - эволюции. Радикальные изменения
формации, редокс гомеостазом, энергетичес
динамики смертности человека произошли в
ким метаболизмом, репарацией ДНК и протео
последние 150 лет в связи с научно технической
стазом [2]. Активность Nrf2 оказывает огромное
революцией. Они привели к резкому увеличе
влияние на самые разные физиологические и
нию продолжительности жизни и приближению
патологические процессы, поэтому он подвер
кривой выживания к прямоугольной форме,
гается строгой регуляции в основном на уровне
резко отличающей ее от кривых выживания
стабильности белка. Также особо отмечалось,
шимпанзе, охотников собирателей и даже жи
что такие защитные системы могут находиться
телей развитых стран Европы в XVIII-XIX вв.
под контролем регуляторов (ингибиторов, игра
[1]. В то же время существуют и внутренние
ющих роль представителей программы старе
факторы, определяющие продолжительность
ния) не только напрямую, но и через регуляцию
жизни и ход кривых выживания. К ним относят
белков биоритмов (циркадных, ультрадианных
ся программы старения и антистарения, являю
и других), т.е. через «Большие биологические ча
щиеся, по современным представлениям, сово
сы» (рис. 1) [1].
купностью сигнальных генных каскадов [1-6].
В этом обзоре мы проанализировали данные
Если долгожительство поддерживается отбором
о молекулярных механизмах взаимодействия за
(например, вследствие того, что «гены долголе
щитной системы Nrf2, ингибитора Nrf2 - кина
тия», будучи связаны с каким либо адаптивным
зы гликогенсинтазы 3 (GSK3), а также коровых
признаком, могут благодаря этому закрепляться
белков циркадных биоритмов в контексте прог
в популяции), организмы могут вырабатывать
рамм старения и антистарения.
специальные защитные и репарационные сис
темы, замедляющие хронический феноптоз.
Поскольку продолжительность жизни является
ТРАНСКРИПЦИОННЫЙ ФАКТОР Nrf2
такой же устойчивой видовой характеристикой,
как размеры тела или плодовитость, ее длитель
Транскрипционный фактор 2 как представи
ность (т.е. момент наступления гибели), а также
тель программ антистарения. Nrf2 активируется
регулирующие ее механизмы должны быть хотя
окислительными стрессорами и электрофиль
бы частично запрограммированы в геноме [4, 7,
ными агентами, он обеспечивает адаптацию к
8]. Долгоживущие виды обычно обладают более
стрессу путем положительной регуляции клеточ
мощной системой восстановления поврежде
ной антиоксидантной защиты и других метабо
ний, в том числе антиоксидантной защиты. Та
лических процессов, контролируя экспрессию
кие системы, ответственные за репарацию и
более 200 генов мишеней при различных видах
другие восстановительные процессы, будут спо
стресса. Продукты этих генов регулируют мно
собствовать замедлению старения и долголе
жество защитных функций, в том числе - деток
тию. При старении активность работы таких
сикацию лекарств, пентозофосфатный шунт и
систем в базальных условиях (а также их способ
аутофагию [3]. Кроме того, Nrf2 непосредствен
ность реагировать на повреждения) обычно
но ингибирует индуцированную экспрессию
снижается. Соответственно, системы, снижаю
различных генов, участвующих в воспалении,
щие/подавляющие работу систем антистарения,
посредством связывания с их проксимальными
и/или системы, работа которых связана с разви
регуляторными областями [10]. В клетках мы
тием заболеваний (в том числе возрастных),
шей с нокаутом гена, кодирующего Nrf2 (Nfe2l2),
клеточным старением или клеточной гибелью,
повышен уровень активных форм кислорода
БИОХИМИЯ том 86 вып. 4 2021
GSK3, Nrf2, БИОРИТМЫ, ПРОГРАММЫ СТАРЕНИЯ И АНТИСТАРЕНИЯ
513
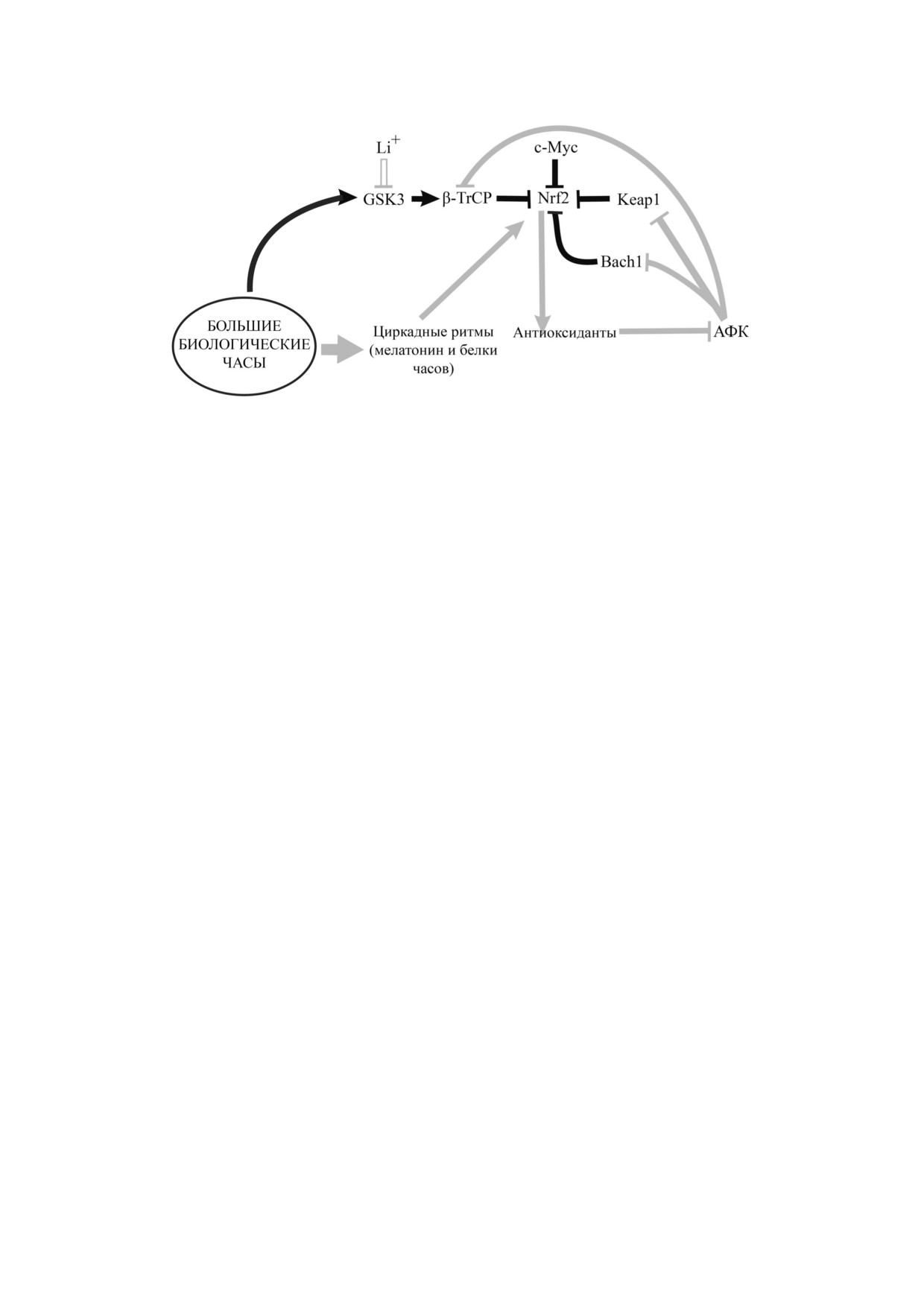
Рис. 1. Большие биологические часы регулируют антиоксидантный статус клетки, воздействуя на транскрипционный
фактор Nrf2, управляющий экспрессией более чем 200 цитопротекторных ферментов, ответственных за детоксикацию и
антиоксидантную защиту. Большие биологические часы способствуют адаптации организма, регулируя циркадные рит
мы с помощью мелатонина и белков циркадных ритмов. Активация Nrf2 вызывается действием активных форм кисло
рода. В то же время активируемая многими сигнальными путями киназа гликогенсинтазы 3 (GSK3) оказывает подавля
ющее действие, ингибируя транскрипционный фактор Nrf2. Препараты, содержащие соли лития, оказывают положи
тельное действие, подавляя активность GSK3, ингибитора Nrf2. Светлыми линиями обозначены эффекты, стимулиру
ющие активность Nrf2 (и последующую экспрессию антиоксидантных ферментов), в том числе и воздействие веществ,
подавляющих действие ингибиторов Nrf2; темными линиями - ингибиторов Nrf2. Стрелкой обозначено прямое стиму
лирующее воздействие, включая катализ, линией с тупым концом обозначено ингибирующее действие. АФК активные
формы кислорода; Bach1 - белок BTB domain and CNC homolog 1; GSK3 - киназа гликогенсинтазы 3; Keap1 - Kelch
подобный ECH ассоциированный белок 1 (Kelch like ECH associated protein 1); Nrf2 - NFE2 related factor 2 (транскрип
ционный фактор 2 семейства NFE); β TrCP - белок, содержащий β трансдуциновые повторы (β transducin repeat con
taining protein)
(АФК) [11], и они более чувствительны к окис
Активность Nrf2 в клетке не поддерживается
лительному стрессу [12]. С возрастом уровень
на постоянном уровне. Его содержание подвер
Nrf2 уменьшается, а также ухудшается его спо
жено осцилляции, а также циркадным (суточ
собность к активации в ответ на стресс [1, 2, 6,
ным) и ультрадианным колебаниям. Активато
13]. Активность Nrf2 положительно коррелирует
ры, которые стабилизируют Nrf2 от протеолиза,
с продолжительностью жизни [2]. Все это позво
увеличивают его количество в цитоплазме, а
ляет считать его компонентом особой антивоз
последующее выравнивание концентраций (т.е.
растной программы - хранителем периода здо
повышение уровня Nrf2 в ядре) активирует
ровой жизни и долголетия [2]. Системы, подав
транскрипционный ответ ARE. После увеличе
ляющие активность Nrf2, представляют собой
ния уровня белка Nrf2 и индукции ARE содер
компоненты программы старения [1]. Основны
жащих генов происходит активация GSK3, ко
ми из них являются системы регуляции, вызыва
торая, в свою очередь, фосфорилирует Nrf2 и та
ющие протеасомную деградацию белка Nrf2:
ким образом способствует его протеасомной
система Kelch подобного ECH ассоциирован
деградации с участием белка β TrCP [18].
ного белка 1 (Keap1) и система киназы глико
Биоритмы имеют важное адаптивное значе
генсинтазы 3 (GSK3) и белка, содержащего
ние и зависят от многих факторов, в том числе от
β трансдуциновые повторы (β TrCP) (рис. 1 и 2).
редокс статуса. Нарушение регуляции циркад
Еще одним белком, подавляющим действие
ных ритмов является одним из характерных воз
Nrf2, является c Myc [14]. Кроме того, белок
растных расстройств, поэтому поддержание пра
Bach1, не являясь ингибитором Nrf2, конкури
вильного функционирования системы суточных
рует с ним за связывание с последовательностью
часов представляется перспективным способом
ARE (антиоксидант респонсивный элемент,
продления жизни [19]. Основой механизма цир
antioxidant response element) [15] (рис. 1). Кроме
кадных часов являются ТФ Clock и Bmal1. Они
упомянутой выше GSK3, воздействие других
гетеродимеризуются через свои PAS домены и
киназ (например, Fyn киназы) также может
индуцируют экспрессию контролируемых часа
приводить к инактивации Nrf2 и его экспорту из
ми генов, связываясь с последовательностью
ядра [16, 17] (рис. 2).
E box в их промоторах [20, 21]. Периодичность
БИОХИМИЯ том 86 вып. 4 2021
514
ШИЛОВСКИЙ и др.
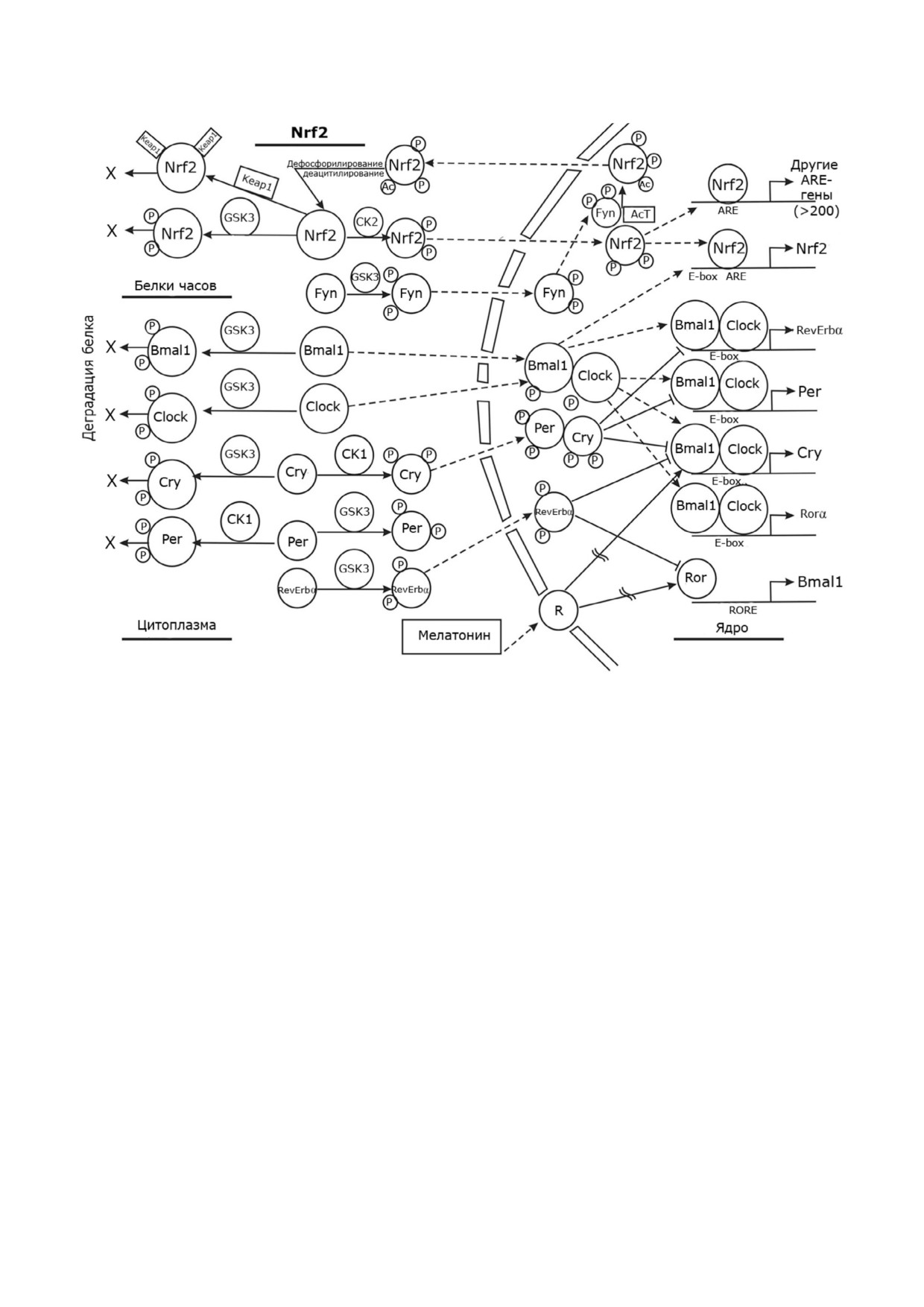
Рис. 2. Молекулярные механизмы циркадных биоритмов и осцилляций «цитоплазма ядро» транскрипционного фактора
Nrf2, управляющего экспрессией цитопротекторных ферментов. Характерной чертой регулируемых Nrf2 генов является
наличие последовательности ARE в их промоторе, тогда как для большинства генов белков циркадных биоритмов - пос
ледовательности E box (также есть и в промоторе гена Nfe2l2, кодирующего Nrf2). Ген Bmal1 содержит в промоторе пос
ледовательность RORE. Пунктирными линиями со стрелкой обозначено перемещение того или иного белка (в ядро и из
ядра), а сплошными линиями - прямое воздействие, включая катализ. Сплошной линией с тупым концом обозначено
ингибирующее действие. Сплошной линией с разрывом отмечено опосредованное влияние (например, стимулирующее
влияние мелатонина на экспрессию белков биоритмов и Nrf2). Кружочки с буквой p означают присоединение к белку
фосфатной группы. Наличие двух таких кружочков после взаимодействия модифицируемого белка с той или иной кина
зой означает, что реакция идет по механизму двойного фосфорилирования (подробнее см. в тексте). AcT - ацетилтранс
фераза; ARE - антиоксидант респонс(ив)ный элемент (antioxidant response element); Bmal1 - белок brain and muscle
ARNT like 1; Clock - белок Сircadian locomoter output cycles kaput; Cry - белок криптохром; GSK3 - киназа гликогенсин
тазы 3; Keap1 - Kelch подобный ECH ассоциированный белок 1 (Kelch like ECH associated protein 1); Nrf2 - транскрип
ционный фактор 2 семейства NFE (NFE2 related factor 2); Per - белок Period; Rev erbα - белок Reverse erythroblastosis
virus α; RORE - RAR related orphan receptor response element; β TrCP - белок, содержащий β трансдуциновые повторы
(β transducin repeat containing protein)
экспрессии генов суточных ритмов обеспечива
тем самым петлю отрицательной обратной связи
ют белки Per1 и Per2. Они транслоцируются в яд
[24, 25]. С белками регуляторами суточных рит
ро, образуя стабильные комплексы (включаю
мов связаны многие метаболические пути - на
щие в себя также белки криптохромы Cry1 и
пример, важный системный регулятор обмена
Cry2), подавляющие транскрипцию посред
веществ AMPK (AMP активируемая протеинки
ством связывания с позитивными факторами
наза) [26], которая фосфорилирует белок Cry1, и
Clock/Bmal1. В результате формируется чередо
этим способствует его деградации [27].
вание подъемов и спадов содержания мРНК, а
Транскрипционный фактор Nrf2 как осцилля
затем и самих белков Per1 и Per2 с фазой, равной
тор. Регуляция активации Nrf2 в ядре и цитоплаз
приблизительно 24 часа [22, 23], замыкающее
ме. Сложность в понимании процессов регуля
БИОХИМИЯ том 86 вып. 4 2021
GSK3, Nrf2, БИОРИТМЫ, ПРОГРАММЫ СТАРЕНИЯ И АНТИСТАРЕНИЯ
515
ции биоритмов отчасти связана с существовани
из комплекса с Keap1, поскольку скорость этого
ем у Nrf2, как и у АФК, своих собственных рит
процесса влияет на частоту колебаний и цито
мов. Показано, что при действии активаторов
протекторный транскрипционный ответ. При
Nrf2 стимуляция экспрессии ARE зависимых
действии индукторов Nrf2 (оксидантов и элект
генов происходит не за счет стабилизации и об
рофильных агентов) комплексы Nrf2/Keap1
щего повышения уровня Nrf2, а в результате по
фиксируются в закрытой конформации, из ко
вышения частоты и уменьшения амплитуды
торых Nrf2 не высвобождается. В результате
транслокационных циклов Nrf2 между цито
прекращается регенерация свободного Keap1, и
плазмой и ядром клетки [28]. В предложенной
вновь синтезируемые молекулы Nrf2 не разру
Xue et al. [28] «колебательной модели» GSK3 иг
шаются. Также модель предполагает наличие и
рает регуляторную роль, обеспечивая инактива
других способов активации Nrf2, например, де
цию и расщепление Nrf2. Согласно этой моде
ацетилирование Nrf2 ядерными деацетилазами
ли, Keap1 и Nrf2 удерживаются вместе за счет
[28].
протеин треонинфосфатазы PGAM5 (протеин
Перекрестное взаимодействие систем тран
треонинфосфатаза 5 из семейства фосфоглице
скрипционного фактора Nrf2 и биоритмов. Экс
ратмутаз), которая связывает Keap1 и Nrf2 с
прессия Nrf2 имеет циркадный ритм с периодом
внешней митохондриальной мембраной [29]. В
23,7 часа [34]. Циркадные вариации и гендерные
условиях окислительного (а точнее, электро
различия в уровнях транскриптов антиоксидант
фильного) стресса Nrf2 высвобождается из
ных генов могут влиять на реакцию организма в
комплекса с Keap1, фосфорилируется [3] и
ответ на окислительный стресс в разное время
транслоцируется в ядро с помощью импортинов
суток [35]. Early et al. [36] установили, что удале
α5 и β1 [30]. В ядре Nrf2 активирует гены мише
ние Bmal1 в макрофагах нарушает активность
ни, связываясь с промоторной последователь
Nrf2, способствуя накоплению АФК и провос
ностью ARE [3, 14]. После этого Nrf2 фосфори
палительного цитокина IL 1β. Также они пока
лируется Fyn киназой [16] и ацетилируется, а
зали, что нокдаун Nrf2 уменьшает индукцион
затем удаляется из ядра через экспортный канал
ный ответ на добавление липополисахарида
ядерной мембраны exportin 1/crm1 [28]. GSK3β
(LPS) трех основных генов мишеней Nrf2 - ге
при этом является регулирующим звеном, не
моксигеназы (Hmox1), глутатионредуктазы (Gsr)
посредственно фосфорилирующим Nrf2, вызы
и NAD(P)Н:хинон оксидоредуктазы 1 (Nqo1).
вая деградацию белка Nrf2 с помощью β TrCP
При индукции LPS уровень экспрессии этих ге
[3, 31, 32]. Xue et al. [28] также показали, что
нов в макрофагах Bmal1-/- ниже, чем в макро
удержание Nrf2 в ядре клетки с помощью блока
фагах Bmal1+/+. Подобно большинству генов,
тора экспортных каналов crm1, лептомицина B,
кодирующих коровые белки циркадных биорит
приводит к снижению ARE зависимой тран
мов, ген Nfe2l2, кодирующий Nrf2, также содер
скрипционной активности с цикличностью ко
жит последовательность E box. Гетеродимер
лебаний примерно 2 часа. В модели это объяс
Bmal1/Clock связывается с этой последователь
няется ацетилированием и инактивацией Nrf2 в
ностью, активируя транскрипцию Nrf2, и, как
ядре (рис. 2). Согласно оценкам Xue et al. [28],
следствие, его мишеней - Hmox1, Gsr и Nqo1.
Nrf2 совершает 2-3 колебания до деградации в
Также Early et al. [36] обнаружили, что базаль
нестимулированных клетках и большее количе
ный уровень АФК в перитонеальных миелоид
ство - в клетках, подвергнутых окислительному
ных клетках значительно увеличивается во вто
стрессу.
рой половине дня, что обратно коррелирует с
В колебательной модели Nrf2 есть альтерна
суточным ритмом экспрессии Bmal1 и Nrf2.
тивный регуляторный механизм. Функциональ
По сравнению с Bmal1+/+ в макрофагах
ная активность ядерного Nrf2 может регулиро
Bmal1-/- увеличен как базовый, так и индуциро
ваться активностью деацетилаз, циркадным
ванный LPS уровень АФК (таблица). Молеку
контролем экспрессии гена Nfe2l2, кодирующе
лярные часы контролируют экспрессию Nrf2 и
го Nrf2, и различными конформациями комп
его способность регулировать IL 1β в миелоид
лекса Nrf2 с Keap1 [28]. Показано, что в отсут
ных клетках.
ствии окислительного стресса взаимодействие
Pekovic Vaughan et al. [34] выявили, что уро
Keap1 и Nrf2 происходит циклически с образо
вень белка Nrf2 меняется ритмично. Ритмичес
ванием сначала «открытой» конформации, в ко
кая экспрессия белка Nrf2 обнаружена также в
торой Nrf2 связывается с одной из двух субъеди
клеточных лизатах и в ядрах фибробластов Rat1
ниц Keap1, и затем - «закрытой» конформации,
(таблица). Это доказывает клеточно автоном
в которой Nrf2 связывается с обеими субъеди
ную устойчивую ритмическую экспрессию Nrf2.
ницами Keap1 [33]. Колебательная модель осно
Мутация в кор последовательности E box в
вана на активации Nrf2 путем высвобождения
промоторе гена Nrf2 (Nfe2l2) полностью устра
БИОХИМИЯ том 86 вып. 4 2021
516
ШИЛОВСКИЙ и др.
няет его индукцию комплексами Clock/Bmal1. В
in vitro и in vivo через консервативный элемент
легких у мышей дикого типа мРНК Nrf2 прояв
E box в его промоторе. Данные, приведенные в
ляет четкую ритмическую экспрессию, которой
таблице, полученные на эмбриональных фиб
не наблюдается у мышей ClockΔ19. Обнаружено
робластах, нокаутированных по Nfe2l2 мышей,
также зависимое от времени связывание
подтверждают непосредственный Nrf2 зависи
Clock/Bmal1 в области E box промотора гена
мый ритмический контроль нижестоящих ми
Nrf2 (Nfe2l2). Эти результаты показывают, что
шеней (таблица).
ген Nfe2l2, кодирующий Nrf2, непосредственно
У мышей дикого типа (WT) индукция Nrf2 с
регулируется компонентами ядерных часов помощью D3T (H3 1,2 дитиол 3 тион) приво
Взаимовлияние генетической и химической активации систем биоритмов и Nrf2
Цель
Воздействие
Объект
Эффект
Ссылка
A. РИТМЫ Nrf2 И ДРУГИХ МАРКЕРОВ РЕАКЦИИ НА СТРЕСС
БР
БР
печень мыши
экспрессия индуцируемых Nrf2 генов выше днем, чем
[35]
ночью; пик Nrf2, Nqo1 и Dbp - ранним вечером; пик
Keap1, Gclc и Rev erbα - ближе к середине дня
Ритм АФК
БР
макрофаги
базальный уровень АФК увеличен на ~25% (p ≤ 0,05,
[36]
t тест) во второй половине дня (по сравнению со време
нем перед утром) и отрицательно коррелирует с суточ
ным ритмом экспрессии Bmal1 и Nrf2
Ритм Nrf2
БР
мыши
пик белка Nrf2 - в циркадное время 3-7 (CT3-CT7),
[34]
провал происходит в CT15-CT19
Ритм Nrf2
БР
фибробласты
ритм экспрессии белка Nrf2 обнаружен в клеточных ли
[34]
Rat1
затах (p < 0,01, односторонний ANOVA для оценки эф
фекта времени) и в ядрах (p < 0,001, t test)
БР
H2O2, D3T
MEF
H2O2 (100 мкМ) и D3T(100 мкМ) увеличивают амплитуду
[37]
(соответственно в ~2,5 и в ~5 раз, t тест, р < 0,05), но не
продолжительность периода
Б. ГЕНЕТИЧЕСКАЯ АКТИВАЦИЯ СИСТЕМЫ БИОРИТМОВ И Nrf2
Ритм Nrf2
нокдаун БР
мыши
экспрессия мРНК Nrf2 в легких мышей WT (но не в
[34]
ClockΔ19) имеет четкий ритм (p < 0,05, односторонний
ANOVA); нокдаун Bmal1 снижает уровень мРНК Nrf2
(p < 0,05)
Уровень
нокаут гена БР
макрофаги
в макрофагах Bmal1-/- выше по сравнению с Bmal1+/+
[36]
АФК
уровень АФК - как базовый (в 4 раза, p ≤ 0,01), так и
индуцированный LPS (в ~2,3 раза, p ≤ 0,05)
Уровень
нокаут гена БР
MEF
у синхронизированных MEF мышей Cry1-/-/Cry2-/-
[34]
Nrf2
повышены уровни экспрессии Nrf2 и его генов мишеней
БР
нокаут Nrf2
MEF
нокаут Nrf2 в MEF снижает амплитуду ритма и продол
[37]
жительность периода (соответственно в ~5 раз и на
~15%, t тест, р < 0,05)
БР
сверхэкспрессия
гепатоциты
сверхэкспрессия Nrf2 уменьшает амплитуду ритма (в
[37]
Nrf2
мыши
~2 раза) и продолжительность периода (на ~2%, t тест,
MMH D3
р < 0,05) по сравнению с WT
Экспрессия
нокаут Nrf2
MEF
в Nrf2-/- MEF пик накопления белка Rev erbα был
[37]
гена БР
отсрочен (но не исчез) на 4 ч относительно WT; нокдаун
Nrf2 в MEF снижает уровень экспрессии Rev erbα на
~45-50%
Примечание: БР - биоритмы; Dbp - Albumin site D binding protein; D3T - H3 1,2 дитиол 3 тион; Gclc - каталитическая
субъединица глутамат цистеинлигазы; LPS - липополисахарид; MEF - эмбриональные фибробласты мыши; Nqo1 -
NAD(P)H:хиноноксидоредуктаза; WT - дикий тип.
БИОХИМИЯ том 86 вып. 4 2021
GSK3, Nrf2, БИОРИТМЫ, ПРОГРАММЫ СТАРЕНИЯ И АНТИСТАРЕНИЯ
517
дит к активации E box и D box содержащих
ми (хотя с точки зрения биохимии более точным
часовых генов (Rev ErbA, Rev ErbB, Dbp,
было бы обозначение «изоферменты»). Кроме
Per3) [37]. Полная активация этих генов требует
обычной, GSK3β1, у GSK3β известна удлинен
наличия сигнального пути Keap1/Nrf2, так как у
ная GSK3β2 форма с высоким уровнем экс
мышей Nrf2-/- она значительно ослаблена. По
прессии при развитии мозга [42].
теря Nrf2 приводит к нарушению циркадного
Уникальное положение GSK3β в регуляции
ритма в эмбриональных фибробластах мы
клеточных функций связано с тем, что данный
шей Nrf2-/-, это является прямым эффектом и
фермент влияет на активность более чем
указывает на роль Nrf2 в регуляции амплитуды
100 белков и сам, в свою очередь, зависит от
ритма и продолжительности периода (табли
большого количества стимулов. Например, ак
ца)
[37]. Таким образом, Nrf2 регулирует
тивация Akt1 фосфорилирует и ингибирует
экспрессию коровых белков и стабилизирует
GSK3β [43].
циркадные циклы часов, связывает редокс по
GSK3 влияет на большинство клеточных
тенциал и определение времени [37]. Нокаут ге
процессов, включая рост, дифференцировку и
на, кодирующего Nrf2 (Nfe2l2), в печени мышей
смерть, и модулирует ответ на гормональные,
приводит к изменению длины циркадного пери
пищевые и стрессовые стимулы. Вызванная
ода. Эти эффекты Nrf2 реализуются, вероятно,
стрессом транслокация GSK3β может приво
через регуляцию экспрессии Cry2 и Rev erbα.
дить к взаимодействию с митохондриальными
По видимому, Nrf2 и белки биоритмов образуют
белками, включая PI3K Akt, PGC 1α, HK II,
блокирующую петлю, которая интегрирует кле
PKCε, компоненты дыхательной цепи и субъ
точные редокс сигналы в циркадный ритм [37].
единицы mPTP. Митохондриальный пул GSK3β
Nrf2 входит в группу CncC (семейство
оказывает регуляторное влияние на биогенез,
ТФ Cap’n’collar). В исследовании Spiers et al. [38]
энергетику, проницаемость и подвижность ми
было показано, что конститутивная сверхэкс
тохондрий, а также на апоптоз [44]. Важной
прессия CncC у Drosophila положительно влияет
функцией GSK3β является ингибирование бел
на функцию нейронов через модификацию си
ка β катенина и участие в сигнальном пути Wnt,
наптических механизмов, а подавление
играющем важную роль в процессах эмбриоге
экспрессии Keap1, являющегося ингибитором
неза, роста и дифференцировки клеток [41], а
CncC, улучшает синаптическую функцию и уве
также процессов нейрогенеза и синаптической
личивает продолжительность жизни. Результаты
пластичности [45]. GSK3β регулирует клеточ
исследования Hansen et al. [39] свидетельствуют,
ный цикл, ингибируя циклин D1, необходимый
что соотношение восстановленной и окислен
для вступления клетки в S фазу [46]. Она также
ной форм глутатиона (GSH/GSSG) контроли
принимает участие в регуляции обмена глюко
рует Nrf2 исключительно в цитоплазматическом
зы, ингибируя белки IRS и кинезины [47].
компартменте, но не регулирует связывание
Фосфорилирование GSK3 по серину 9 (S9),
Nrf2 с ARE в ядре. И наоборот, так как избыточ
вероятно, наиболее подвержено колебаниям.
ная экспрессия тиоредоксина 1 (Trx 1) не влия
Эти колебания могут быть быстрыми, как при
ет на диссоциацию Nrf2 и его перемещение в яд
деполяризации/реполяризации нейронов, или
ро, предполагается, что ядерный Trx 1 ответ
медленными, как при изменении уровней цир
ственен за регуляцию Nrf2 не в цитоплазмати
кулирующих гормонов, регулирующих GSK3, и
ческих событиях (диссоциация/ядерная транс
циркадных ритмов в супрахиазматическом яд
локация), а именно на уровне взаимодей
ре (SCN) и печени [48].
ствия Nrf2 с ДНК [39].
GSK3β конститутивно активируется путем
аутофосфорилирования по Y216 и инактивиру
ется путем фосфорилирования по S9. Актив
КИНАЗА ГЛИКОГЕНСИНТАЗЫ 3
ная GSK3β с фосфорилированием по Y216 сос
тавляет не менее половины общей GSK3β в
Далее мы перейдем к рассмотрению проте
культивируемых клетках [49]. В мозге мышей
инкиназы GSK3β, ее роли как ингибитора Nrf2
GSK3β присутствует в основном в активной
и других белков, механизмам ее действия и учас
форме, тогда как доля неактивной (с фосфори
тия в регуляции клеточных функций.
лированием по S9) невелика [50]. Фосфорили
GSK3 (ATP:protein phosphotransferase, EC
рование в положении Y216, необходимое для ак
2.7.1.37) - внутриклеточная серин/треониновая
тивации фермента, может обеспечиваться кина
протеинкиназа с молекулярной массой 47 кДа,
зами Pyk2 и Fyn либо в результате аутокаталити
синтезируемая во всех тканях организма [40,
ческого процесса [51]. Фосфорилирование по S9
41], представлена двумя паралогами (α и β),
ингибирует активность GSK3β, это является ос
обычно называемыми в литературе изоформа
новным механизмом ее регуляции. Большое ко
БИОХИМИЯ том 86 вып. 4 2021
518
ШИЛОВСКИЙ и др.
личество киназ фосфорилирует GSK3β в этом
Ингибитор GSK3, литий, снижает ее активность
положении: протеинкиназы A, В и С, кина
и возрастное накопление р53, связанное с се
зы PrkG1, ILK, p70S6K и p90SRK; а дефосфори
несцентным состоянием, а также заставляет
лирует - протеинфосфатаза 2А (РР2А) [52]. Од
клетки переходить в обратимое состояние по
нако в мозге основным путем регуляции GSK3β,
коя. Эти результаты показывают, что часть кле
видимо, является ингибирование при фосфори
точного пула p53, которая активируется в старе
лировании митоген активируемой протеинки
ющих клетках, модулируется ассоциацией
назой p38 по S389 [53].
с GSK3β в ядре, способствующей активнос
GSK3 как представитель программы старения.
ти p53 и клеточному старению [54]. Аналогично,
Косвенное подтверждение роли GSK3β в прог
базальный уровень фосфорилированного (т.е.
рамме старения можно найти в работе
неактивного) белка GSK3 у старых (18 мес.) си
Krishnankutty et al. [49], в которой изучались три
рийских хомячков (Mesocricetus auratus) намного
фракции GSK3β в нейронах и мозге мыши: фос
ниже, чем у молодых (1-3 мес.) [55]. У старых
форилированная по Y216 (активная форма фер
хомячков литий не влияет на период ритма дви
мента), фосфорилированная по S9 и Y216 и не
гательной активности и уровень фосфорилиро
фосфорилированная (две последние формы не
ванной GSK3, в отличие от его эффекта у более
активны). И хотя в гиппокампе общий уровень
молодых животных [55]. Все вышеперечислен
GSK3β с возрастом не изменялся, доля неактив
ное косвенно подтверждает предложенную
ного фосфорилированного по S9 фермента при
роль GSK3β как bona fide представителя прог
старении снижалась и была вдвое ниже у самок
раммы старения.
в возрасте 1,5 года, чем у трехнедельных осо
GSK3β и возрастные патологии. Еще одним
бей [49].
подтверждением участия GSK3β в программе
GSK3β и клеточное старение. Показано, что
старения можно считать изменение ее актив
в стационарной культуре первичных нейронов
ности при возрастных заболеваниях (рис. 3).
коры головного мозга мыши при практически
В нейронах она избирательно фосфорилирует
неизменном общем уровне GSK3β заметно из
ассоциированный с микротрубочками тау бе
меняется соотношение ее изоформ. Доля фос
лок в участках, которые являются гиперфосфо
форилированной по S9 (т.е. неактивной) формы
рилированными в мозге при болезни Альцгей
GSK3β была максимальной (более 30%) через
мера (БА) [56]. Такой гиперфосфорилирован
3 дня культивирования без пересева, а затем
ный тау белок имеет сниженную аффинность к
постепенно снижалась, достигая 15% через
микротрубочкам и накапливается в виде спи
12 дней культивирования. Активность GSK3β,
ральных филаментов, являющихся главным
фосфорилированной по Y216, наоборот, посте
компонентом нейрофибриллярных клубков и
пенно увеличивалась «с возрастом» [49]. «Ста
нитей в мозге при БА. Нейрофибриллярные
рые» фибробласты человека WI 38 (число удво
клубки обнаруживаются при таких заболевани
ений клеточной популяции (УКП) в диапазо
ях, как боковой амиотрофический склероз, пар
не 58-64), в отличие от клеток «среднего возрас
кинсонизм, деменция, корково базальная деге
та» (диапазон УКП - 38-41) и «молодых» (диа
нерация, травматическое повреждение мозга,
пазон УКП - 26-30), проявляют типичные для
синдром Дауна, постэнцефалитический пар
старения признаки, включая увеличенный раз
кинсонизм и болезнь Ниманна-Пика. В ткани
мер, уплощенную форму и повышенный уро
мозга пациентов с БА уровень белка GSK3β по
вень активности, ассоциированной со старени
вышен на 50% [56]. Ингибирование GSK3β
ем β галактозидазы. Также в ядрах «старых» кле
уменьшает когнитивные дефициты, ассоцииро
ток повышен уровень белков GSK3α и GSK3β.
ванные с БА и другими вышеупомянутыми за
болеваниями. Активность GSK3β увеличена в
клеточной (при депривации ростовых факто
ров) и животной (церебральная ишемия) моде
лях нейродегенерации [57]. Провоспалительный
эффект GSK3β обусловлен стимуляцией про
дукции IL 1β, IFN γ, IL 6, IL 12 и подавлением
синтеза IL 10 [48] через Toll like рецепторы мо
ноцитов [58].
Механизмы действия GSK3. Предварительное
фосфорилирование и GSK3. Фосфорилирование,
осуществляемое GSK3, требует предваритель
ного фосфорилирования субстрата другой кина
зой в положении +4 по отношению к сайту фос
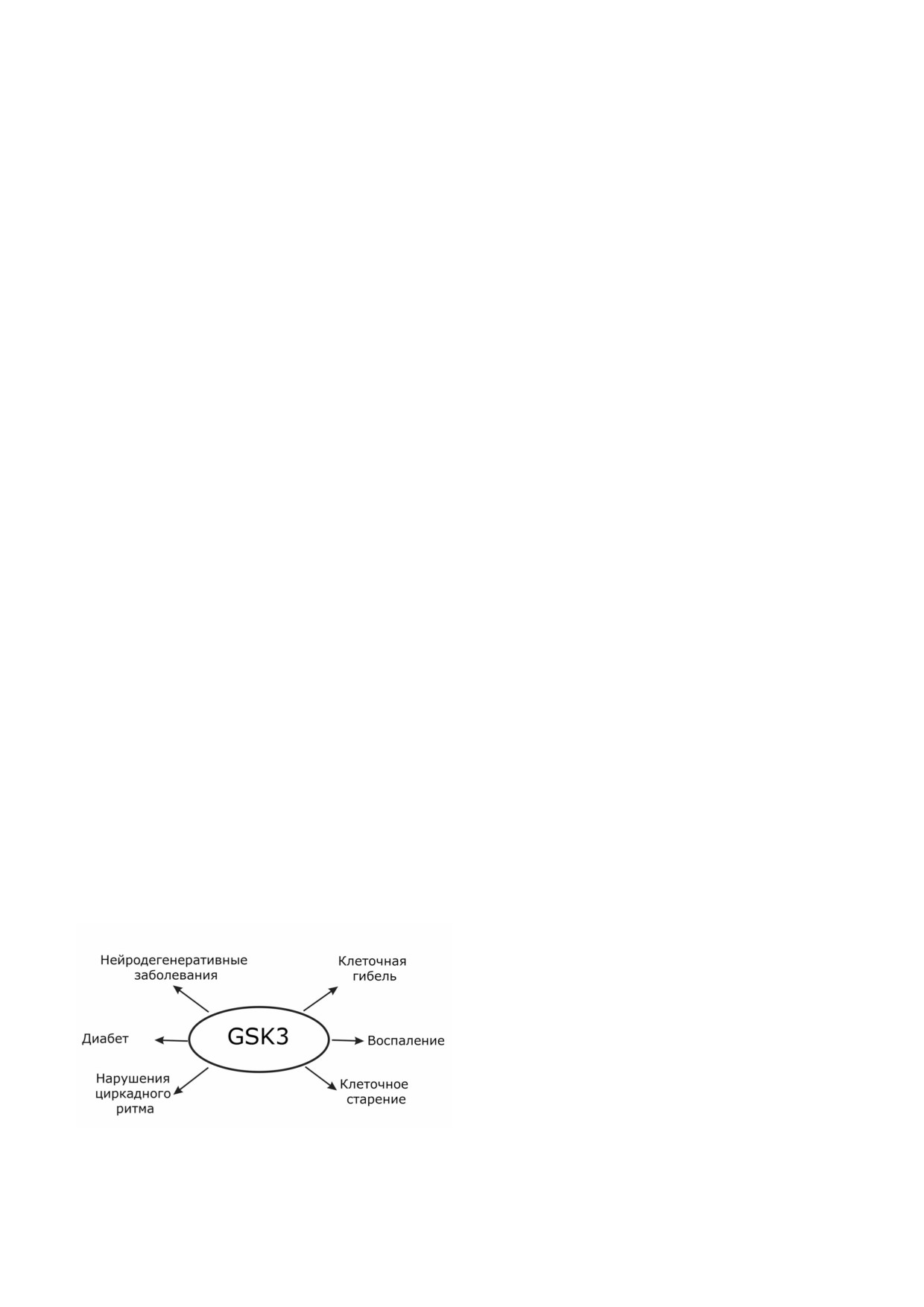
Рис. 3. Негативные эффекты активации GSK3
БИОХИМИЯ том 86 вып. 4 2021
GSK3, Nrf2, БИОРИТМЫ, ПРОГРАММЫ СТАРЕНИЯ И АНТИСТАРЕНИЯ
519
форилирования GSK3, что соответствует часто
мент антиоксидантного ответа (ARE) генов.
встречающемуся (но не универсальному) кон
В отсутствии стресса убиквитинирование Nrf2
сенсусу (S/TXXXS/T) для GSK3 [50, 59, 60]. За
преимущественно осуществляется с помощью
частую такая двойная модификация приводит к
куллина 3 (Cul3) с использованием Keap1 в ка
последующему убиквитинированию и опосре
честве субстратного адапторного белка для
дуемой соответствующими адаптерами (напри
комплекса лигазы E3 и белка Rbx1 (Rbx1/
мер, белками F box ) протеасомной деградации.
E3/Cul3) [3] (рис. 2). Обнаружено, что домен
Деградация белков: фосфорилирование и убик
Neh6 Nrf2 содержит две связывающие β TrCP
витинирование. Белки F box ответственны за
последовательности [31]. Фосфорилирование
распознавание субстрата, причем каждый такой
GSK3 по S338 (и S342) в домене Neh6 усиливает
белок распознает отдельную группу субстра
связывание с β TrCP [31, 32]. Предварительное
тов [61]. В зависимости от структуры субстрат
фосфорилирование Nrf2, по видимому, опосре
ассоциированной области белки F box подраз
дуется киназами семейства CMGC (CDK/
деляются на
3
категории: с повторами
MAPK/GSK3/CLK), в которых гибкая часть по
WD40 (Fbxw); с богатыми лейцином повтора
липептида, называемая Т петлей, блокирует ка
ми (Fbxl) и с другими доменами (Fbxo). Счита
талитический сайт, когда он не фосфорилиро
ется, что Fbxl3 отвечает за убиквитин зависи
ван сигнальной киназой. Однако, в отличие от
мую деградацию белка биоритмов Cry; мута
большинства CMGC киназ, GSK3 в основном
ция Fbxl3 у мышей приводит к удлинению цир
фосфорилируется по своей Т петле в положени
кадного периода примерно до 26 часов [62, 63].
ях Y279 (GSK3α) или Y216 (GSK3β). В результа
β TrCP (также известный как Fbxw1) узнает бе
те GSK3 способна к катализу в базальных усло
лок биоритмов Per после фосфорилирования
виях, т.е. при отсутствии сигнального стиму
казеинкиназой 1 (CK1) (но не GSK3) [64]. Ми
ла [50, 66, 67]. Это обеспечивает дополнитель
шени β TrCP часто содержат мотив разрушения
ную регуляторную точку для контроля стабиль
DSGXXS; фосфорилирование обоих серинов в
ности Nrf2 [15, 31]. Согласно другим данным,
этой последовательности значительно увеличи
предварительно фосфорилировать Nrf2 может
вает узнавание β TrCP [65]. Поскольку эта пос
киназа DYRK [68]. Ингибирование как GSK3,
ледовательность напоминает консенсус ми
так и осуществляющей предварительное фосфо
шень GSK3 (SXXXX(X)S), то много субстратов
рилирование киназы, стабилизирует Nrf2 [68].
GSK3 являются β TrCP связывающими белка
Интересно, что родственный Nrf2 ТФ, Nrf1,
ми. Такую последовательность содержат, напри
также деградируется протеасомой β TrCP зави
мер β катенин и Nrf2 [60].
симым образом через мотив DSGLS, но в этом
Далее мы рассмотрим более подробно роль и
случае мотив распознавания фосфорилируется
последствия модификации протеинкиназой
CK2, а не GSK3 [68]. β Катенин имеет ту же
GSK3 белков циркадных биоритмов и Nrf2.
самую предварительно фосфорилирующую
Регуляция активности Nrf2 c помощью GSK3.
киназу, что и гликогенсинтаза [68]. Таким обра
GSK3 фосфорилирует специфические остатки
зом, скорость убиквитинирования и деградации
серина в Neh6 домене Nrf2 для создания домена
каждого из этих субстратов частично определя
деградации, который затем распознается адап
ется регуляцией их специфических предвари
тером убиквитинлигазы β TrCP и убиквитини
тельно фосфорилирующих киназ и GSK3/CK2
руется с последующей деградацией протеасом
(рис. 2).
ным комплексом с участием куллина 1 (Cul1) и
В опухолевых клетках, в которых Keap1 (и,
белка RING box 1 (Rbx1). В альтернативном
следовательно, убиквитинлигазный комплекс
сценарии GSK3β репрессирует Nrf2 посред
Rbx1/E3/Cul3) не способен взаимодействовать с
ством активации тирозинкиназ (независимо от
Nrf2, GSK3 сохраняет способность подавлять
β TrCP). GSK3β фосфорилирует киназу Fyn
активность Nrf2. В этом случае и в эмбриональ
по Y213. Активированная Fyn накапливается в
ных фибробластах мыши Keap1-/- ингибирова
ядре, где фосфорилирует Nrf2 (у мышей и крыс
ние GSK3 с помощью CT99021 увеличивает ак
по Y568, а у человека - по Y576), что приводит к
тивность Nrf2 [31].
экспорту и деградации Nrf2 [16] (рис. 2).
GSK3 и биоритмы. Циркадный ритм пред
Cuadrado [3] предложил модель, называемую
ставляет собой консервативную систему био
«двойной регулятор потока», чтобы объяснить,
хронометрирования, которая адаптирует пове
как Keap1 и β TrCP координируют стабиль
денческие и физиологические процессы к 24
ность Nrf2. В условиях окислительного стресса
часовым циклам окружающей среды [25, 69].
или под воздействием соединений, реагирую
Регуляторное воздействие со стороны циркад
щих с тиолом, уровень Nrf2 в ядре увеличивает
ного осциллятора супрахиазматического ядра
ся, стимулируя экспрессию содержащих эле
осуществляется посредством нейрональных
БИОХИМИЯ том 86 вып. 4 2021
520
ШИЛОВСКИЙ и др.
связей с гонадолиберинэргическими нейрона
не происходит (т.е. содержание активной формы
ми, а также гуморальным путем - посредством
GSK3 не увеличивается). Таким образом, свето
гормона эпифиза, мелатонина [69, 70]. Секре
вой импульс подавляет активность GSK3, в ре
цию мелатонина эпифизом стимулирует
зультате чего происходит сглаживание ее коле
свет [71]. Известно, что система восприятия све
баний [80]. Даже у мышей, содержащихся в пос
та, ведущая к SCN, различается у различных
тоянной темноте в течение, по меньшей мере,
представителей семейства землекоповых
двух недель, в экстрактах гиппокампа наблюда
(Bathyergidae) (характеризующихся замедлен
ется выраженный эндогенный циркадный ритм
ным старением и высоким коэффициентом дол
в фосфорилировании GSK3β, но не GSK3α [81].
голетия) в зависимости от продолжительности
У дрозофилы активность Sgg (гомолог GSK3) в
жизни и степени социальности [72].
малых вентральных боковых нейронах (домини
Действие мелатонина опосредуется через его
рующих в регуляции общей ритмической двига
мембранные рецепторы (MT1 и MT2) или через
тельной активности взрослых особей) играет
независимые от рецепторов механизмы, вклю
критическую роль в поддержании нормальной
чая Nrf2 [73, 74]. Мелатонин связывается не толь
ритмичности [82].
ко с мембранными рецепторами, но и с белками
Субстраты GSK3, связанные с циркадными
рецепторами на поверхности ядра, а также
ритмами. GSK3 взаимодействует с Per2 in vitro и
действует на уровне хроматина, непосредственно
in vivo, фосфорилирует Per2 in vitro и способству
влияя на синтез белков. Показано, что гены ядер
ет его перемещению в ядро (рис. 2), но вызыва
ных рецепторов Rorα, Rorβ, Rorγ (так называе
ет протеасомную деградацию его партнера,
мых орфанных ядерных ретиноидных рецепто
Cry2 [48, 83, 84], фосфорилируя вместе с другой
ров Ror/Rzr) экспрессируются в разных органах
сериновой киназой, DYRK1A, белок Cry2 соот
и тканях, включая SCN гипоталамуса, сетчатку
ветственно по S557 и S553 [24, 85]. Также GSK3
глаза и эпифиз [75]. Их лигандами являются хо
фосфорилирует Bmal1 (S17/T21), что приводит
лестерин и его производные, но не мелато
к его последующему убиквитинированию и де
нин [75]. Мелатонин стимулирует экспрессию ге
градации [86] и Clock (S427/S431) [87] (рис. 2).
нов биоритмов через RORE элементы гена Bmal1
С помощью тестов на активацию/ингибирова
[25] и экспрессию Nrf2 - через цепочку проме
ние киназной активности GSK3 показано, что
жуточных звеньев [74, 75] (отмечено на рис. 2 ли
эта киназа регулирует фосфорилирование/де
нией, содержащей разрыв). Не подвергается сом
градацию Clock через особый кластер остатков
нению и существование ядерных рецепторов ме
серина (фосфодегрон) [87].
латонина [75]. Например, показано, что мелато
При оценке фосфорилирования GSK3β
нин является лигандом ядерного рецептора вита
по S9 (такое фосфорилирование, как уже упо
мина D (VDR) c Kd = 21,2 ± 1,9 мкM [76].
миналось, подавляет активность киназы), ак
GSK3α и GSK3β экспрессируются в SCN ги
тивность GSK3β максимальна с поздней ночи
поталамуса
[48], при этом уровень мРНК
до раннего утра, при этом она повышает уровень
GSK3α в SCN мыши выше, чем уровень мРНК
фосфорилирования Cry2 по S557, тем самым
GSK3β [77]. GSK3 обеспечивает обратную
способствуя ритмической деградации бел
связь, влияющую на функцию молекулярных
ка Cry2 [87]. Кроме того, GSK3 фосфорилирует
часов в нейронах SCN [78]. При этом экспрес
Rev erbα (белок, подавляющий экспрес
сия в SCN белка GSK3α и фосфорилированной
сию Bmal1, и, соответственно, индуцируемую
формы GSK3β имеет суточный ритм [77].
им экспрессию генов биоритмов), однако эта
С наступлением ночи активность GSK в
модификация приводит не к деградации, а к ак
нейронах SCN крысы падает (увеличивается ко
тивации белка Rev erbα и его транслокации в
личество клеток, окрашиваемых иммуногисто
ядро [88].
химически как фосфорилированная, неактив
Среди подавляющих экспрессию циркадных
ная форма GSK3β, достигая максимума в тече
белков выделяются Cry2 и Per2. Iitaka et al. [48]
ние 4 часов). Ближе к рассвету активность
обнаружили, что GSK3β взаимодействует с Per2
GSKβ, наоборот, возрастает. Иммунофлуорес
in vitro и in vivo и может фосфорилировать Per2
центное окрашивание SCN мышей показало,
in vitro, что не приводит к деградации Per2, но
что свет значительно увеличивает активность
способствует ядерной транслокации (в отличие
GSK3 (т.е. снижает уровень фосфорилирован
от фосфорилирования казеинкиназой) (рис. 2).
ной GSK3β) уже через 30-60 мин после светово
Сверхэкспрессия GSK3β вызывает сдвиг
го импульса [79]. В контроле поздней ночью со
фаз Per2, которые изменяют период примерно
держание фосфорилированной формы GSK3
на 15% (3-4 часа) или приводят к полной поте
снижается (а ее активность, соответственно,
ре циркадных ритмов, способствуя появлению
возрастает). В опытной группе такого снижения
экстремальных фенотипов. Существует также
БИОХИМИЯ том 86 вып. 4 2021
GSK3, Nrf2, БИОРИТМЫ, ПРОГРАММЫ СТАРЕНИЯ И АНТИСТАРЕНИЯ
521
несколько дополнительных молекулярных ме
evgoodei (черепаха Гуда). Ортологичный для
ханизмов,
регулирующих
циклическую
NPAS1 ген не обнаружен у всех птиц и некото
экспрессию генов Per1 и Per2 [23]. Уровень бел
рых рептилий: змей Laticauda laticaudata (коль
ков Per регулируется несколькими факторами,
чатый плоскохвост), Notechis scutatus (тигровая
обеспечивающими его стабильность и, по всей
змея) и Pseudonaja textilis (восточная коричневая
видимости, способность проникать в ядро.
змея); крокодила Crocodylus porosus (гребнистый
С другой стороны, фосфорилирование Per CKIε
крокодил); ящериц Anolis carolinensis (северо
обеспечивает цитоплазматическую деграда
американский красногорлый анолис), Podarcis
цию Per, не связанного с Cry (в отличие от фос
muralis (обыкновенная стенная ящерица),
форилирования с помощью GSK3), предотвра
Pogona vitticeps (бородатая агама), Salvator meri
щая преждевременное накопление Per в цито
anae (аргентинский чёрно белый тегу) и Varanus
плазме. Белок Per менее стабилен при отсут
komodoensis (комодский варан); черепах Chelydra
ствии Cry и может легко подвергаться убиквити
serpentina (каймановая черепаха), Gopherus
нированию и протеасомной деградации [22].
evgoodei (черепаха Гуда), Pelodiscus sinensis (даль
Ортолог GSK3 у Drosophila, Shaggy (Sgg), иг
невосточная черепаха) и Terrapene carolina triun
рает центральную роль в определении длины
guis (каролинская коробчатая черепаха). Также
циркадного периода у мух. Его мутация у дрозо
ортолог NPAS1 не найден у шпорцевой лягушки
филы вызывает удлинение периода циркадных
Xenopus tropicalis.
часов, тогда как сверхэкспрессия - сокращает
Гены GSK3B, CLOCK, CRY1, CRY2 и DEC2
его [89]. Sgg фосфорилирует Tim (Timeless, ана
имеют ортологи у большинства позвоночных.
лог белка Cry у дрозофилы) и регулирует ядер
Даже у дрожжей Saccharomyces cerevisiae найде
ную транслокацию гетеродимера Per/Tim [89].
ны два гена, ортологичные гену GSK3B, но не
Однако следует отметить, что и Tim, и mCry2 яв
были найдены ортологи для остальных рассмот
ляются партнерами димеризации белков Per в
ренных генов. У нематоды C. elegans не обнару
часовых структурах мухи и мыши соответствен
жены ортологи для генов CRY1, CRY2 и DEC2, а
но, и, вполне возможно, GSK3 вносит свой
у плодовой мушки D. melanogaster - для генов
вклад в часовой механизм путем регулирования
CRY1 и CRY2. Белок Clock сравнительно плохо
компонентов, которые действуют вместе с бел
выравнивается против белков нематоды C. ele
ками Per [24]. GSK3 фосфорилирует и регулиру
gans и плодовой мушки D. melanogaster (идентич
ет стабильность основных (коровых) белков
ны 10-20% позиций). Таким образом, можно
циркадного ритма (Bmal1, Clock, Per, Cry, Rev
предположить, что основную функцию в регу
erbα) у млекопитающих [25] (рис. 2).
ляции суточных (циркадных) ритмов играет не
Консервативность белков биоритмов и GSK3
GSK3α, которая отсутствует у большого числа
на эволюционном древе. Используя базу данных
видов (например, у птиц и многих рептилий), и
Ensembl 100, мы проверили наличие ортологов у
нокаут которой не приводит к тяжелым наруше
позвоночных, а также у дрозофилы Drosophila
ниям фенотипа, а GSK3β, которая с небольши
melanogaster и нематоды Caenorhabditis elegans
ми различиями присутствует у животных на всех
для генов GSK3A (ENSG00000105723), GSK3B
ступенях эволюционной лестницы, и нокаут ко
(ENSG00000082701), CLOCK (ENSG00000134852),
торой приводит к эмбриональной летальности.
CRY1 (ENSG00000008405), CRY2 (ENSG00000121671),
Поскольку регуляция биоритмов имеется у всех
а также BHLHE41 (DEC2) (ENSG00000123095) и
животных (в том числе рептилий и птиц), даль
NPAS1
(Neuronal PAS domain containing)
ше речь пойдет в основном о функции GSK3β.
(ENSG00000130751) (в круглых скобках указан
Препараты - ингибиторы GSK3. Литий. По
идентификатор гена у человека, согласно базе
казано, что ионы лития удлиняют период цир
данных Ensembl). Эти гены кодируют белки,
кадных ритмов у многих видов, включая одно
связанные с регуляцией биоритмов. Ген GSK3B
клеточные организмы, насекомых, мышей и
весьма консервативен даже у беспозвоноч
людей [77, 90, 91]. Литий (в концентрации
ных (при сравнении человека и нематоды иден
1-10 мМ) ингибирует GSK3β in vitro и in vivo у
тичны 71,27% позиций), и он практически пол
всех изученных видов [92-95]. Он снижает ак
ностью идентичен у человека и макаки.
тивность GSK3β/Sgg и удлиняет период двига
Ген GSK3A не имеет ортологов у птиц, а также у
тельной активности мух даже в постоянной тем
некоторых рептилий и у химеры Callorhinchus
ноте (без внешних световых активаторов) [96].
milii. В частности, ортологичный для GSK3A ген
Литий в низких концентрациях
(~1
мМ)
не обнаружен у черепах Chelydra serpentina (кай
действует в основном на амплитуду (предполо
мановая черепаха), Terrapene carolina triunguis
жительно, через GSK3β), тогда как в более вы
(каролинская коробчатая черепаха), Gopherus
соких концентрациях (~10 мМ) он способствует
agassizii (пустынный западный гофер) и Gopherus
удлинению периода [97].
5 БИОХИМИЯ том 86 вып. 4 2021
522
ШИЛОВСКИЙ и др.
SB415286. Аналогичное дневное подавление
карциномы мочевого пузыря человека линии Т
наблюдали с другим ингибитором GSK3
24 снижает уровень белка GSK3β, увеличивает
(SB415286; 1 мМ), который уменьшает частоту
фосфорилирование GSK3β и удлиняет период
спонтанных спайковых разрядов нейронов на
активности промотора Bmal1 [104].
66% по сравнению с контролем [98].
Активность GSK3β является основной для
Бензофуран 3 ил (индол 3 ил)малеимиды.
поддержания циркадного двигательного пове
В настоящее время разработаны ингибиторы
дения, необходимого для правильной организа
GSK3β нового поколения (бензофуран 3 ил
ции сна и бодрствования. У трансгенных мышей
(индол 3 ил)малеимиды), которые имеют зна
со сверхэкспрессией GSK3β при неизменной
чения IC50 в диапазоне 4-680 нМ в отношении
общей продолжительности суточных периодов
GSK3β человека. Один из них (с IC50, равной
бодрствования, медленного (non rapid eye move
67 ± 6 нМ) обладает приемлемой селектив
ment, NREM) и быстрого (rapid eye movement,
ностью и растворимостью в дозе 10-29 мкг/кг.
REM) сна увеличивалось число эпизодов каж
В экспериментах на мышах такие ингибиторы
дого из этих периодов, т.е. циклы бодрствования
обладают антипсихотической активностью,
и сна становились более фрагментарными [105].
аналогично литию и вальпроату, при лечении
Известно, что структура сна важна для адапта
биполярного расстройства и других маниакаль
ции и имеет большое эволюционное значение.
но депрессивных состояний [99].
Так, например, сон человека более эффективен
Генетическая активация/инактивация GSK3.
по длине, глубине сна и числу быстрых фаз
Ингибирующее фосфорилирование GSK3α и
сна (REM) по сравнению со сном других прима
GSK3β в SCN меняется с 24 часовой периодич
тов [106]. В целом обнаруженные изменения
ностью. У трансгенных мышей с мутациями по
структурной организации циклов сна и бодр
обеим формам GSK3α/β (GSK3α21A/21A/β9A/9A),
ствования при суперэкспрессии GSK3β сходны
приводящим к их перманентной активации, на
с нарушениями, наблюдаемыми при маниакаль
рушена ритмичность поведения, в том числе
но депрессивных и некоторых нейродегенера
значительно снижена амплитуда ритма, удлинен
тивных заболеваниях. По видимому, успешное
активный период и увеличены периоды актив
использование лития у маниакально депрессив
ности днем [100]. Сверхэкспрессия GSK3 уско
ных больных основано именно на его ингибиру
ряет наступление пика экспрессии гена mPER2
ющем действии в отношении GSK3β. Не ис
примерно на 2 часа [48]. Генетическая инактива
ключено также, что эпизоды гиперактивности у
ция обоих аллелей GSK3β в сочетании с делеци
таких больных объясняются влиянием GSK3β
ей одного аллеля GSK3α в синхронно осцилли
на дофамин и серотонинергические системы
рующих эмбриональных фибробластах мы
мозга.
ши (3/4 GSK3α/β KO MEF), наоборот, приводит
к значительной задержке в периодичности эн
догенного часового механизма, особенно в от
ЗАКЛЮЧЕНИЕ
ношении циклической экспрессии Per2 [83].
Lavoie et al. [101] показали, что период циркад
Долгоживущие виды обычно обладают более
ной двигательной активности у GSK3β+/- мы
совершенной/большой/мощной системой вос
шей удлинен (23,83 ± 0,05 ч) по сравнению с
становления повреждений, в том числе антиок
мышами WT (23,54 ± 0,10 ч). SB216763 (ингиби
сидантной защиты. Еще Frolkis [107] предлагал
тор GSK3α/GSK3β) сокращает период на 1,8 ч в
системы, ответственные за репарацию и другие
концентрации 10 мкМ и на 7,3 ч - в концентра
восстановительные процессы, называть систе
ции 40 мкМ [102]. Подавление экспрессии
мами антистарения (витаукта), так как они спо
GSK3β с помощью малой интерферирующей
собствуют долголетию. При старении актив
РНК (siRNA) или ингибиторами GSK3 (CHIR
ность работы таких систем в базальных услови
99021 и 1 азакенпауллон) укорачивают период
ях (а также их способность реагировать на пов
циркадного ритма [103]. Другой ингибитор
реждения) обычно снижается. Соответственно,
GSK3 (кенпауллон, 25 мкM) вызывает фазовую
системы, снижающие/подавляющие работу
задержку транскрипции Per2 [83].
систем антистарения, и/или системы, работа
У трансгенных мышей synRas с конститутив
которых связана с развитием заболеваний (в том
но активированным V12 Ha Ras в нейронах по
числе возрастных), клеточным старением или
вышен уровень экспрессии GSK3β и снижено
клеточной гибелью, будут относиться к прог
ингибирующее фосфорилирование GSK3β (по
рамме старения [1, 108]. На основе антагонисти
S9) в SCN. Наоборот, подавление активнос
ческой плейотропии постулируется наличие ге
ти Ras путем блокирования его функции антите
нов, усиливающих репродуктивный успех в мо
лами в осциллирующих клеточных культурах
лодом возрасте, несмотря на их отсроченные не
БИОХИМИЯ том 86 вып. 4 2021
GSK3, Nrf2, БИОРИТМЫ, ПРОГРАММЫ СТАРЕНИЯ И АНТИСТАРЕНИЯ
523
гативные эффекты в старости [108]. С возрастом
Интерес к этой киназе в рамках нашей
активность таких систем может не только не
статьи продиктован ее регуляторным влиянием
снижаться, но даже увеличиваться. В частности,
на Nrf2, осуществляемым, по меньшей мере,
для упоминаемых в данной работе обеспечива
тремя способами: i) GSK3 напрямую связана с
ющих убиквитин зависимую протеасомную
деградацией Nrf2, способствуя его убиквитини
деградацию Nrf2 белков GSK3 и Keap1 показано
рованию и протеасомной деградации (а не прос
увеличение их активности с возрастом [2], в то
то инактивации, как другие киназы); ii) GSK3
время как активность Nrf2 снижается. В сово
фосфорилирует Fyn киназу, которая перемеща
купности, экспериментальные данные, рас
ется в ядро, модифицирует там Nrf2, после чего
смотренные в обзоре, показывают, что Nrf2 и
Nrf2 удаляется из ядра; и iii) GSK3 фосфорили
GSK3 являются компонентами антагонистичес
рует белки положительной ветви регуляции
ких и тесно взаимодействующих программ ан
циркадных биоритмов Bmal1 и Clock, также вы
тистарения и старения соответственно [1].
зывая их протеасомную деградацию, что снижа
Определенным устойчивым, но пластичным
ет экспрессию Nrf2 (следует отметить, что в
ритмом циркадной активности характеризуются
промоторах как генов негативных регуляторов
не только белки, ответственные за биоритмы (в
биоритмов CRY1, CRY2 и Rev erbα, так и в самом
большинстве своем ТФ), но и регулирующая их
гене Nfe2l2, кодирующем Nrf2, содержится E
GSK3, а также антиоксидантная система, инду
box, вследствие чего их транскрипция позитив
цируемая Nrf2, «дирижирующего» транскрипци
но регулируется комплексом Clock/Bmal1 [23,
ей огромного количества белков, ответственных
36]). Таким образом, система, работа которой
за антиоксидантную защиту клетки. Молекуляр
подробно рассматривается в этой статье, опос
ные часы обеспечивают регуляторный механизм,
редуемая GSK3 и β TrCP, представляет собой
позволяющий организму готовиться и реагиро
«регулирующий клапан», который контролиру
вать на ежедневные изменения внешней среды.
ет небольшие колебания уровня Nrf2, обеспечи
Система Nrf2 индуцируется окислителями
вая тонкую настройку ультрадианной и циркад
(электрофилами). При этом запускается синтез
ной (Bmal1 опосредованной) регуляции Nrf2 [3,
антиоксидантных/детоксифицирующих фер
36]. Вместе с данными о циркадной и Bmal1
ментов, защищающих клетку от повреждения.
опосредованной регуляции Nrf2 это показывает,
Однако гормон биоритмов, мелатонин, несмотря
что Nrf2 и часовые гены образуют регуляторную
на то что сам обладает антиоксидантными свой
петлю, которая интегрирует клеточные редокс
ствами, также индуцирует активацию Nrf2 [74],
сигналы в циркадный ритм [37].
но не напрямую, а опосредованно. Это косвенно
Эффекты фосфорилирования протеинкина
поддерживает представление о системе циркад
зой GSK3 различных субстратов весьма разно
ных биоритмов как способствующей адаптации.
образны: изменение активности ферментов, ло
В случае Nrf2 ситуация осложняется сущест
кализации белков, взаимодействий между бел
вованием не только циркадных ритмов актив
ками, а также стабильность белков [60]. Фосфо
ности (т.е. колебаний во времени), но и простран
рилирование белков GSK3 часто приводит к их
ственных, а именно осциллирующих ядерных и
последующему убиквитинированию и протеа
цитоплазматических пулов Nrf2. Более того, в
сомной деградации. Распознавание убиквити
качестве «дирижера» системы антиоксидантной
нированного белка протеасомой в случае с Nrf2,
защиты Nrf2 опосредует противодействие эф
Cry2, Clock и Bmal1 происходит с помощью бел
фекту токсичных веществ и окислителей, влияя
ка адаптера, например β TrCP [60]. Этому пред
тем самым на упомянутую пластичность
шествует фосфорилирование того же самого
экспрессии циркадных белков (таблица).
белка другой киназой. Фосфорилирование бел
GSK3, видимо, может считаться характер
ков с помощью GSK3 не всегда приводит к пос
ным представителем программ старения, так
ледующему расщеплению. Например, для нега
как, в отличие от Nrf2, активность GSK3 растет
тивных белков регуляторов биоритмов Rev
с возрастом как in vivo, так и in vitro, а также при
erbα и Per2 фосфорилирование GSK3, наоборот,
патологиях. GSK3 участвует в самых разных ме
приводит к повышению стабильности. Cry яв
таболических путях, в том числе ассоциирован
ляется единственным из негативных регулято
ных с возрастными болезнями (сахарный диабет
ров циркадных биоритмов, фосфорилирование
второго типа, рак), а также нейродегенератив
которого GSK3 приводит не к перемещению в
ными патологиями. Кроме того, GSK3 участву
ядро (как для Rev erbα и Per), а к деграда
ет в клеточной гибели и воспалении. Ингибито
ции (как для белков позитивной регуляции цир
ры GSK3 в настоящее время представляются
кадных биоритмов Bmal1 и Clock). Существует
перспективными терапевтическими целями для
предположение, что белок Cry опосредует
борьбы с этими заболеваниями.
подстройку биологических часов под внешний
БИОХИМИЯ том 86 вып. 4 2021
5*
524
ШИЛОВСКИЙ и др.
ритм освещенности, кроме всего прочего, явля
циально возможное подавление «цитокинового
ясь ингибитором транскрипции Per и регулируя
шторма» при COVID 19 [116, 117].
уровень белка Per [22]. Таким образом, GSK3
Длительность периода клеточных часов точ
взаимодействует с разными эффектами практи
но настраивается с помощью сети передачи сиг
чески со всеми коровыми белками биорит
налов фосфорилирования, опосредованной
мов (Bmal1, Clock, Per, Cry, Rev erbα), влияя на
множественными протеинкиназами, из кото
длительность той или иной фазы, а также с Nrf2,
рых наиболее универсальной, по крайней мере
регулируя антиоксидантный статус клетки [3,
по количеству субстратов, является GSK3.
15, 18, 25, 29-32, 36, 37, 89].
Именно поэтому функция GSK3 представляет
ся узловым пунктом перекрестной регуляции
Генетические и молекулярные исследования
циркадных ритмов и антиоксидантной защиты,
показывают важность цепей обратной связи,
что и является основной темой этой статьи. По
регулируя тем самым уровень экспрессии генов.
пытки воздействия на два пути (идущие от
Через метаболизм NAD+ биоритмы связаны и с
«Больших биологических часов» к системе Nrf2
биоэнергетикой клетки. Показано, что NAD+
на рис. 1) одновременно представлены, напри
зависимая деацетилаза SIRT1 с циркадной пе
мер, получением препарата, являющегося гиб
риодичностью связывается с комплексом
ридом сульфорафана (известного активатора
Clock/Bmal1 и регулирует циркадные тран
Nrf2) и мелатонина (регулятора суточных био
скрипционные программы посредством деаце
ритмов) [118, 119], а также веществ, являющих
тилирования основных белков часов (Bmal1,
ся одновременно ингибиторами GSK3 и актива
Per2) и хроматин ассоциированных белков
торами Nrf2 (2,4 дигидропирано[2,3 c]пиразо
[109, 110]. Окислительный стресс может вызы
лов) [120]. Можно предположить, что подобные
вать перезапуск молекулярных часов [111]. Так
препараты в перспективе могут быть использо
же изменяют ритмическое поведение и ткане
ваны не только для лечения нейродегенератив
вые часы модуляции пентозофосфатного пу
ных патологий, но и для увеличения продолжи
ти [112].
тельности здоровой жизни и долголетия.
Изучение белков, находящихся на пересече
нии сигнальных и регуляторных путей, и срав
нение их биохимическими и биоинформатичес
Финансирование. Исследование выполнено
кими методами у коротко и долгоживущих ви
при финансовой поддержке Российского фонда
дов позволяет выявлять молекулярные механиз
фундаментальных исследований (грант № 18
мы, лежащие в основе процессов и явлений, ре
29 13037).
гулирующих тайминг онтогенеза (включая бел
Конфликт интересов. Авторы заявляют об от
ки часов [20-25, 37, 113] и гормон эпифиза ме
сутствии конфликта интересов.
латонин, его предшественники и производ
Соблюдение этических норм. В данной работе
ные [69-75, 114]) и определяющих долголе
не было никаких исследований, в которых были
тие (включая острый и хронический феноптоз,
использованы в качестве объектов люди или
неотению и т.д.) [7-9, 115], в том числе и потен
животные.
СПИСОК ЛИТЕРАТУРЫ
1.
Skulachev, V. P., Shilovsky, G. A., Putyatina, T. S., Popov,
5.
Galimov, E. R., Lohr, J. N., and Gems, D. (2019) When and
N. A., Markov, A. V, et al. (2020) Perspectives of Homo
how can death be an adaptation? Biochemistry (Moscow), 84,
sapiens lifespan extension: focus on external or internal
1433 1437, doi: 10.1134/S0006297919120010.
resources? Aging (Albany NY),
12,
55665584,
6.
Duan, W. S., Zhang, R. Y., Guo, Y. S., Jiang, Y. F., Huang,
doi: 10.18632/aging.102981.
Y. L., et al. (2009) Nrf2 activity is lost in the spinal cord and
2.
Lewis, K. N., Wason, E., Edrey, Y. H., Kristan, D. M.,
its astrocytes of aged mice, In vitro Cell. Dev. Biol. Anim.,
Nevo, E., and Buffenstein, R. (2015) Regulation of Nrf2
45, 388 397, doi: 10.1007/s11626 009 9194 5.
signaling and longevity in naturally long lived rodents,
7.
Skulachev, V. P., Holtze, S., Vyssokikh, M. Y., Bakeeva,
Proc. Natl. Acad. Sci. USA, 112, 3722 3727, doi: 10.1073/
L. E., Skulachev, M. V., et al. (2017) Neoteny, prolongation
pnas.1417566112.
of youth: from naked mole rats to “naked apes” (humans),
3.
Cuadrado, A. (2015) Structural and functional characteri
Physiol. Rev., 97, 699 720, doi: 10.1152/physrev.00040.2015.
zation of Nrf2 degradation by glycogen synthase kinase
8.
Skulachev, V. P. (2019) Phenoptosis as a phenomenon
3/β TrCP, Free Radic. Biol. Med.,
88,
147157,
widespread among many groups of living organisms
doi: 10.1016/j.freeradbiomed.2015.04.029.
including mammals [Commentary to the paper by E. R.
4.
Skulachev, M. V., Severin, F. F., and Skulachev, V. P. (2015)
Galimov, J. N. Lohr, and D. Gems (2019), Biochemistry
Aging as an evolvability increasing program which can be
(Moscow), 84, 1433 1437], Biochemistry (Moscow), 84,
switched off by organism to mobilize additional resources
1438 1441, doi: 10.1134/S0006297919120022.
for survival, Curr. Aging Sci., 8, 95 109, doi: 10.2174/
9.
Vyssokikh, M. Y., Holtze, S., Averina, O. A, Lyamzaev,
1874609808666150422122401.
K. G., Panteleeva, A. A., et al. (2020) Mild depolarization
БИОХИМИЯ том 86 вып. 4 2021
GSK3, Nrf2, БИОРИТМЫ, ПРОГРАММЫ СТАРЕНИЯ И АНТИСТАРЕНИЯ
525
of the inner mitochondrial membrane is a crucial compo
25.
Alessandro, M. S., Golombek, D. A., and Chiesa, J. J.
nent of an anti aging program, Proc. Natl. Acad. Sci. USA,
(2019) Protein kinases in the photic signaling of the mam
117, 6491 6501, doi: 10.1073/pnas.1916414117.
malian circadian clock, Yale J. Biol. Med., 92, 241 250.
10.
Kobayashi, E. H., Suzuki, T., Funayama, R.,
26.
Morgunova, G. V., and Klebanov, A. A. (2019) Age related
Nagashima, T., Hayashi, M., et al. (2016) Nrf2 suppresses
AMP activated protein kinase alterations: from cellular
macrophage inflammatory response by blocking proin
energetics to longevity, Cell Biochem. Funct., 37, 169 176,
flammatory cytokine transcription, Nat. Commun., 7,
doi: 10.1002/cbf.3384.
11624, doi: 10.1038/ncomms11624.
27.
Suter, D. M., and Schibler, U. (2009) Physiology. Feeding
11.
Aw Yeang, H. X., Hamdam, J. M., Al Huseini, L. M.,
the clock, Science, 326, 378 379, doi: 10.1126/science.
Sethu, S., Djouhri, L., et al. (2012) Loss of transcription
1181278.
factornuclear factor erythroid 2 (NF E2) p45 related fac
28.
Xue, M., Momiji, H., Rabbani, N., Bretschneider, T.,
tor 2 (Nrf2) leads to dysregulation of immune functions,
Rand, D. A., and Thornalley, P. J. (2015) Frequency mod
redox homeostasis, and intracellular signaling in dendritic
ulated translocational oscillations of Nrf2, a transcription
cells, J. Biol. Chem., 287, 10556 10564, doi: 10.1074/jbc.
factor functioning like a wireless sensor, Biochem. Soc.
M111.322420.
Trans., 43, 669 673, doi: 10.1042/BST20150060.
12.
He, X., Kan, H., Cai, L., and Ma, Q. (2009) Nrf2 is criti
29.
Lo, S. C., and Hannink, M. (2008) PGAM5 tethers a
cal in defense against high glucose induced oxidative dam
ternary complex containing Keap1 and Nrf2 to mitochon
age in cardiomyocytes, J. Mol. Cell. Cardiol., 46, 47 58,
dria, Exp. Cell Res., 314, 1789 1803, doi: 10.1016/j.yexcr.
doi: 10.1016/j.yjmcc.2008.10.007.
2008.02.014.
13.
Xu, S. F., Ji, L. L., Wu, Q., Li, J., and Liu, J. (2018) Onto
30.
Theodore, M., Kawai, Y., Yang, J., Kleshchenko, Y.,
geny and aging of Nrf2 pathway genes in livers of rats, Life
Reddy, S. P., Villalta, F., and Arinze, I. J. (2008) Multiple
Sci., 203, 99 104, doi: 10.1016/j.lfs.2018.04.018.
nuclear localization signals function in the nuclear import
14.
Levy, S., and Forman, H. J. (2010) C Myc is a Nrf2 inter
of the transcription factor Nrf2, J. Biol. Chem., 283, 8984
acting protein that negatively regulates phase II genes
8994, doi: 10.1074/jbc.M709040200.
through their electrophile responsive elements, IUBMB
31.
Chowdhry, S., Zhang, Y., McMahon, M., Sutherland, C.,
Life, 62, 237 246, doi: 10.1002/iub.314.
Cuadrado, A., and Hayes, J. D. (2013) Nrf2 is controlled
15.
Tebay, L. E., Robertson, H., Durant, S. T., Vitale, S. R.,
by two distinct beta TrCP recognition motifs in its Neh6
Penning, T. M., and Dinkova Kostova, A. T. (2015)
domain, one of which can be modulated by GSK 3 activi
Mechanisms of activation of the transcription factor Nrf2
ty, Oncogene, 32, 3765 3781, doi: 10.1038/onc.2012.388.
by redox stressors, nutrient cues, and energy status and the
32.
Rada, P., Rojo, A. I., Chowdhry, S., McMahon, M.,
pathways through which it attenuates degenerative disease,
Hayes, J. D., and Cuadrado, A. (2011) SCF/{beta} TrCP
Free Radic. Biol. Med., 88, 108 146, doi: 10.1016/j.freerad
promotes glycogen synthase kinase 3 dependent degrada
biomed.2015.06.021.
tion of the Nrf2 transcription factor in a Keap1 indepen
16.
Jain, A. K., and Jaiswal, A. K. (2007) GSK3β acts
dent manner, Mol. Cell. Biol., 31, 1121 1133, doi: 10.1128/
upstream of Fyn kinase in regulation of nuclear export and
MCB. 01204 10.
degradation of NF E2 related factor 2, J. Biol. Chem., 282,
33.
Baird, L., Llères, D., Swift, S., and Dinkova Kostova, A. T.
16502 16510, doi: 10.1074/jbc.M611336200.
(2013). Regulatory flexibility in the Nrf2 mediated stress
17.
Huang, H. C., Nguyen, T., and Pickett, C. B. (2000)
response is conferred by conformational cycling of the
Regulation of the antioxidant response element by protein
Keap1 Nrf2 protein complex, Proc. Natl. Acad. Sci. USA,
kinase C mediated phosphorylation of NF E2 related fac
110, 15259 15264, doi: 10.1073/pnas.1305687110.
tor 2, Proc. Natl. Acad. Sci. USA, 97, 1247512480,
34.
Pekovic Vaughan, V., Gibbs, J., Yoshitane, H., Yang, N.,
doi: 10.1073/pnas.220418997.
Pathiranage, D., et al. (2014) The circadian clock regu
18.
Tong, K. I., Kobayashi, A., Katsuoka, F., and
lates rhythmic activation of the NRF2/glutathione medi
Yamamoto, M. (2006) Two site substrate recognition model
ated antioxidant defense pathway to modulate pulmonary
for the Keap1 Nrf2 system: a hinge and latch mechanism,
fibrosis, Genes Dev., 28, 548560, doi: 10.1101/gad.
Biol. Chem., 387, 1311 1320, doi: 10.1515/BC.2006.164.
237081.113.
19.
Bonaconsa, M., Malpeli, G., Montaruli, A.,
35.
Xu, Y.Q., Zhang, D., Jin, T., Cai, D. J., Wu, Q., et al.
Carandente, F., Grassi Zucconi, G., and Bentivoglio, M.
(2012) Diurnal variation of hepatic antioxidant gene
(2014) Differential modulation of clock gene expression in
expression in mice, PLoS One, 7, e44237, doi: 10.1371/
the suprachiasmatic nucleus, liver and heart of aged mice,
journal.pone. 0044237.
Exp. Gerontol., 5, 70 79, doi: 10.1016/j.exger.2014.03.011.
36.
Early, J. O., Menon, D., Wyse, C. A., Cervantes Silva,
20.
Bunger, M. K., Wilsbacher, L. D., Moran, S. M.,
M. P., Zaslona, Z., et al. (2018) Circadian clock protein
Clendenin, C., Radcliffe, L. A., et al. (2000) Mop3 is an
BMAL1 regulates IL 1β in macrophages via NRF2, Proc.
essential component of the master circadian pacemaker in
Natl. Acad. Sci. USA, 115, 8460 8468, doi: 10.1073/pnas.
mammals, Cell, 103, 1009 1017, doi: 10.1016/s0092
1800431115.
8674(00)00205 1.
37.
Wible, R. S, Ramanathan, C., Sutter, C. H., Olesen,
21.
Wijnen, H., and Young, M. W. (2006) Interplay of circadi
K. M., Kensler, T. W., et al. (2018) NRF2 regulates core
an clocks and metabolic rhythms, Annu. Rev. Genet., 40,
and stabilizing circadian clock loops, coupling redox and
409 448, doi: 10.1146/annurev.genet.40.110405.090603.
timekeeping in Mus musculus, Elife,
7, e31656,
22.
Okamura, H. (2003) Integration of mammalian circadian
doi: 10.7554/eLife.31656.
clock signals: from molecule to behavior, J. Endocrinol.,
38.
Spiers, J. G., Breda, C., Robinson, S., Giorgini, F., and
177, 3 6, doi: 10.1677/joe.0.1770003.
Steinert, J. R. (2019) Drosophila Nrf2/Keap1 mediated
23.
Kennaway, D. J. (2005) The role of circadian rhythmicity
redox signaling supports synaptic function and longevity
in reproduction, Hum. Reprod. Update, 11, 91101,
and impacts on circadian activity, Front. Mol. Neurosci., 12,
doi: 10.1093/humupd/dmh054.
86, doi: 10.3389/fnmol.2019.00086.
24.
Harada, Y., Sakai, M., Kurabayashi, N., Hirota, T., and
39.
Hansen, J. M., Watson, W. H., and Jones, D. P. (2004)
Fukada, Y. (2005) Ser 557 phosphorylated mCRY2 is
Compartmentation of Nrf2 redox control: regulation of
degraded upon synergistic phosphorylation by glycogen
cytoplasmic activation by glutathione and DNA binding by
synthase kinase 3 beta, J. Biol. Chem., 280,
31714
thioredoxin 1, Toxicol. Sci., 82, 308 317, doi: 10.1093/
3172110, doi: 1074/jbc.M506225200.
toxsci/kfh231.
БИОХИМИЯ том 86 вып. 4 2021
526
ШИЛОВСКИЙ и др.
40.
Embi, N., Rylatt, D. B., and Cohen, P. (1980) Glycogen
vate dehydrogenase activity by tau protein kinase I/glyco
synthase kinase 3 from rabbit skeletal muscle. Separation
gen synthase kinase 3beta in brain, Proc. Natl. Acad. Sci.
from cyclic AMP dependent protein kinase and phospho
USA, 93, 2719 2723, doi: 10.1073/pnas.93.7.2719.
rylase kinase, Eur. J. Biochem.,
107,
519527,
57.
Salcedo Tello, P., Ortiz Matamoros, A., and Arias, C.
doi: 10.1111/j.1432 1033.1980.tb06059.x.
(2011) GSK3 function in the brain during development,
41.
Doble, B. W., and Woodgett, J. R. (2003) GSK 3: tricks of
neuronal plasticity, and neurodegeneration, Int. J.
the trade for a multi tasking kinase, J. Cell. Sci., 116, 1175
Alzheimers Dis., 11, 1 12, doi: 10.4061/2011/189728.
1186, doi: 10.1242/jcs.00384.
58.
Martin, M., Rehani, K., Jope, R. S., and Michalek, S. M.
42.
Mukai, F., Ishiguro, K., Sano, Y., and Fujita, S. C. (2002)
(2005) Toll like receptor mediated cytokine production is
Alternative splicing isoform of tau protein kinase I/glyco
differentially regulated by glycogen synthase kinase 3, Nat.
gen synthase kinase 3beta, J. Neurochem., 81, 1073 1083,
Imunnol., 6, 777 784, doi: 10.1038/ni1221.
doi: 10.1046/j.1471 4159.2002.00918.x.
59.
Sutherland, C. (2011) What are the bona fide GSK3 sub
43.
Souder, D. C., and Anderson, R. M. (2019) An expanding
strates? Int. J. Alzheimers Dis.,
2011,
505607,
GSK3 network: Implications for aging research,
doi: 10.4061/2011/505607.
GeroScience, 41, 369382, doi: 10.1007/s11357 019
60.
Robertson, H., Hayes, J. D., and Sutherland, C. A. (2018)
00085 z.
A partnership with the proteasome; the destructive nature
44.
Yang, K., Chen, Z., Gao, J., Shi, W., Li, L., et al. (2017)
of GSK3, Biochem. Pharmacol., 147, 77 92, doi: 10.1016/
The key roles of GSK 3beta in regulating mitochondrial
j.bcp.2017.10.016.
activity, Cell. Physiol. Biochem.,
44,
14451459,
61.
Jin, J., Cardozo, T., Lovering, R. C., Elledge, S. J.,
doi: 10.1159/000485580.
Pagano, M., and Harper, J. W. (2004) Systematic analysis
45.
Jaworski, T., Banach Kasper, E., and Gralec, K. (2019)
and nomenclature of mammalian F box proteins, Genes
GSK 3β at the intersection of neuronal plasticity and neu
Dev., 18, 2573 2580, doi: 10.1101/gad.1255304.
rodegeneration, Neural Plast.,
2019,
4209475,
62.
Siepka, S. M., Yoo, S. H., Park, J., Song, W., Kumar, V.,
doi: 10.1155/2019/4209475.
et al. (2007) Circadian mutant overtime reveals F box pro
46.
Alt, J. R. (2000) Phosphorylation dependent regulation of
tein FBXL3 regulation of cryptochrome and period gene
cyclin D1 nuclear export and cyclin D1 dependent cellular
expression, Cell, 129, 1011 1023, doi: 10.1016/j.cell.2007.
transformation, Genes Dev., 14, 3102 3114, doi: 10.1101/
04.030.
gad.854900.
63.
Godinho, S. I., Maywood, E. S., Shaw, L., Tucci, V.,
47.
Morfini, G., Szebenyi, G., Elluru, R., Ratner, N., and
Barnard, A. R., et al. (2007) The after hours mutant reveals
Brady, S. T. (2002) Glycogen synthase kinase 3 phosphory
a role for Fbxl3 in determining mammalian circadian peri
lates kinesin light chains and negatively regulates kinesin
od, Science, 316, 897 900, doi: 10.1126/science.1141138.
based motility, EMBO J., 21, 281 293, doi: 10.1093/
64.
Shirogane, T., Jin, J., Ang, X. L., and Harper, J. W. (2005)
emboj/21.3.281.
SCFβ TRCP controls clock dependent transcription via
48.
Iitaka, C., Miyazaki, K., Akaike, T., and Ishida, N. (2005)
casein kinase 1 dependent degradation of the mammalian
A role for glycogen synthase kinase 3β in the mammalian
period 1 (Per1) protein, J. Biol. Chem., 280, 26863 26872,
circadian clock, J. Biol. Chem., 280, 2939729402,
doi: 10.1074/jbc.M502862200.
doi: 10.1074/jbc.M503526200.
65.
Najumuddin, Fakhar, M., Gul, M., and Rashid, S. (2018)
49.
Krishnankutty, A., Kimura, T., Saito, T., Aoyagi, K.,
Interactive structural analysis of βTrCP1 and PER2 phos
Asada, A., et al. (2017) In vivo regulation of glycogen syn
phoswitch binding through dynamics simulation assay,
thase kinase 3β activity in neurons and brains, Sci. Rep., 7,
Arch. Biochem. Biophys., 651, 34 42, doi: 10.1016/j.abb.
8602, doi: 10.1038/s41598 017 09239 5.
2018.05.020.
50.
Kaidanovich Beilin, O., and Woodgett, J. R.
(2011)
66.
Cole, A., Frame, S., and Cohen, P. (2004) Further evi
GSK3: functional insights from cell biology and animal
dence that the tyrosine phosphorylation of glycogen syn
models, Front. Mol. Neurosci., 4, 40, doi: 10.3389/
thase kinase 3 (GSK3) in mammalian cells is an autophos
fnmol.2011.00040.
phorylation event, Biochem. J., 377, 249 255, doi: 10.1042/
51.
Lesort, M., Jope, R. S., and Johnson, G. V. (1999) Insulin
BJ20031259.
transiently increases tau phosphorylation: involvement of
67.
Beurel, E., Grieco, S. F., and Jope, R. S. (2015) Glycogen
glycogen synthase kinase 3beta and Fyn tyrosine kinase,
synthase kinase 3 (GSK3): regulation, actions, and dis
J. Neurochem., 72, 576 584, doi: 10.1046/j.1471 4159.
eases, Pharmacol. Ther., 148, 114 131, doi: 10.1016/
1999.0720576.x.
j.pharmthera.2014.11.016.
52.
Beaulieu, J. M., Sotnikova, T. D., Marion, S., Lefkowitz,
68.
Tsuchiya, Y., Taniguchi, H., Ito, Y., Morita, T., Karim,
R. J., et al. (2011) An Akt/β arrestin 2/PP2A signaling
M. R., and Ohtake, N. (2013) The casein kinase 2 NRF1
complex mediates dopaminergic neurotransmission and
axis controls the clearance of ubiquitinated proteins by reg
behavior, Cell, 122, 261 273, doi: 10.1016/j.cell.2005.
ulating proteasome gene expression, Mol. Cell. Biol., 33,
05.012.
3461 3472, doi: 10.1128/MCB.01271 12.
53.
Thornton, T. M., Pedraza Alva, G., Deng, B., and Wood,
69.
Zee, P. C., Attarian, H., and Videnovic, A. (2013) Circa
C. D., Aronshtam, A., et al. (2008) Phosphorylation by
dian rhythm abnormalities, Continuum (Minneap. Minn),
p38 MAPK as an alternative pathway for GSK3beta inac
19, 132 147, doi: 10.1212/01.CON.0000427209.21177.aa.
tivation, Science, 320, 667 670, doi: 10.1126/science.
70.
Patel, S. A., Velingkaar, N. S., and Kondratov, R. V. (2014)
1156037.
Transcriptional control of antioxidant defense by the circa
54.
Zmijewski, J. W., and Jope, R. S. (2004) Nuclear accumu
dian clock, Antioxid. Redox Signal., 20, 29973006,
lation of glycogen synthase kinase 3 during replicative
doi: 10.1089/ars.2013.5671.
senescence of human fibroblasts, Aging Cell, 3, 309 317,
71.
Golombek, D. A., and Rosenstein, R. E. (2010) Physiology
doi: 10.1111/j.1474 9728.2004.00117.x.
of circadian entrainment, Physiol. Rev., 90, 1063 1102,
55.
Iwahana, E., Hamada, T., Uchida, A., and Shibata, S.
doi: 10.1152/physrev.00009.2009.
(2007) Differential effect of lithium on the circadian oscil
72.
Oosthuizen, M. K., Bennett, N. C., and Cooper, H. M.
lator in young and old hamsters, Biochem. Biophys. Res.
(2005) Fos expression in the suprachiasmatic nucleus in
Commun., 354, 752 756, doi: 10.1016/j.bbrc.2007.01.042.
response to light stimulation in a solitary and social species
56.
Hoshi, M., Takashima, A., Noguchi, K., Murayama, M.,
of African mole rat (family Bathyergidae), Neuroscience,
Sato, M., et al. (1996) Regulation of mitochondrial pyru
133, 555 560, doi: 10.1016/j.neuroscience.2005.01.017.
БИОХИМИЯ том 86 вып. 4 2021
GSK3, Nrf2, БИОРИТМЫ, ПРОГРАММЫ СТАРЕНИЯ И АНТИСТАРЕНИЯ
527
73.
Slominski, R. M., Reiter, R. J., Schlabritz
88. Yin, L., Wang, J., Klein, P. S., and Lazar, M. A. (2006)
Loutsevitch, N., Ostrom, R. S., and Slominski, A. T.
Nuclear receptor Rev erbalpha is a critical lithium sensi
(2012) Melatonin membrane receptors in peripheral tis
tive component of the circadian clock, Science, 311, 1002
sues: distribution and functions, Mol. Cell. Endocrinol.,
1005, doi: 10.1126/science.1121613.
351, 152 166, doi: 10.1016/j.mce.2012.01.004.
89. Martinek, S., Inonog, S., Manoukian, A. S., and Young,
74.
Fang, J., Yan, Y., Teng, X., Wen, X., Li, N., et al. (2018)
M. W. (2001) A role for the segment polarity gene shag
Melatonin prevents senescence of canine adipose derived
gy/GSK 3 in the Drosophila circadian clock, Cell, 105,
mesenchymal stem cells through activating Nrf2 and
769 779, doi: 10.1016/s0092 8674(01)00383 x.
inhibiting ER stress, Aging (Albany NY), 10, 2954 2972,
90. Li, J., Lu, W. Q., Beesley, S., Loudon, A. S., and Meng,
doi: 10.18632/aging.101602.
Q. J. (2012) Lithium impacts on the amplitude and period
75.
Slominski, A. T., Zmijewski, M. A., and Jetten, A. M.
of the molecular circadian clockwork, PLoS One, 7,
(2016) RORα is not a receptor for melatonin (response to
e33292, doi: 10.1371/journal.pone.0033292.
DOI: 10.1002/bies.201600018), Bioessays, 38, 1193 1194,
91. Sawai, Y., Okamoto, T., Muranaka, Y., Nakamura, R.,
doi: 10.1002/bies.201600204.
Matsumura, R., et al. (2019) In vivo evaluation of the
76.
Fang, N., Hu, C., Sun, W., Xu, Y., Gu, Y., et al. (2020)
effect of lithium on peripheral circadian clocks by real
Identification of a novel melatonin binding nuclear recep
time monitoring of clock gene expression in near freely
tor: vitamin D receptor, J. Pineal. Res., 68, e12618,
moving mice, Sci. Rep., 9, 10909, doi: 10.1038/s41598
doi: 10.1111/jpi.12618.
019 47053 3.
77.
Iwahana, E., Akiyama, M., Miyakawa, K., Uchida, A.,
92. Jope, R. S. (2003) Lithium and GSK 3: one inhibitor, two
Kasahara, J., et al. (2004) Effect of lithium on the circadi
inhibitory actions, multiple outcomes. Trends Pharmacol.
an rhythms of locomotor activity and glycogen synthase
Sci., 24, 441 443, doi: 10.1016/S0165 6147(03)00206 2.
kinase 3 protein expression in the mouse suprachiasmatic
93. Freland, L., and Beaulieu J. M. (2012) Inhibition of GSK3
nuclei, Eur. Neurosci., 19, 2281 2287, doi: 10.1111/j.0953
by lithium, from single molecules to signaling networks,
816X.2004.03322.x.
Front. Mol. Neurosci., 5, 14, doi: 10.3389/fnmol.2012.
78.
Besing, R. C., Paul, J. R., Hablitz, L. M., Rogers, C. O.,
00014.
Johnson, R. L., et al. (2015) Circadian rhythmicity of
94. Siebel, A. M., Vianna, M. R., and Bonan, C. D. (2014)
active GSK3 isoforms modulates molecular clock gene
Pharmacological and toxicological effects oflithium in
rhythms in the suprachiasmatic nucleus, Biol. Rhythms, 30,
zebrafish, ACS Chem. Neurosci., 5, 468 476, doi: 10.1021/
155 160, doi: 10.1177/0748730415573167.
cn500046h.79.
79.
Paul, J. R., McKeown, A. S., Davis, J. A., Totsch, S. K.,
95. Plotnikov, E. Y., Silachev, D. N., Zorova, L. D., Pevzner,
Mintz, E. M., et al. (2017) Glycogen synthase kinase 3 reg
I. B., Jankauskas, S. S., et al. (2014) Lithium salts - simple
ulates photic signaling in the suprachiasmatic nucleus,
but magic, Biochemistry (Moscow),
79,
740749,
Eur. J. Neurosci., 45, 1102 1110, doi: 10.1111/ejn.13549.
doi: 10.1134/S0006297914080021.
80.
Červená, K., Pačesová, D., Spišská, V., and Bendová, Z.
96. Padiath, Q. S, Paranjpe, D., Jain, S., and Sharma, V. K.
(2015) Delayed effect of the light pulse on phosphorylated
(2004) Glycogen synthase kinase 3beta as a likely target for
ERK1/2 and GSK3β Kinases in the ventrolateral suprachi
the action of lithium on circadian clocks, Chronobiol. Int.,
asmatic nucleus of rat, Mol. Neurosci., 56, 371376,
21, 43 55, doi: 10.1081/cbi 120027981.
doi: 10.1007/s12031 015 0563 0.
97. Wei, H., Landgraf, D., Wang, G., and McCarthy, M. J.
81.
Besing, R. C., Rogers, C. O., Paul, J. R., Hablitz, L. M.,
(2018) Inositol polyphosphates contribute to cellular circa
Johnson, R. L., et al. (2017) GSK3 activity regulates
dian rhythms: Implications for understanding lithium’s
rhythms in hippocampal clock gene expression and synap
molecular mechanism, Cell. Signal.,
44,
8291,
tic plasticity, Hippocampus, 27, 890 898, doi: 10.1002/
doi: 10.1016/j.cellsig.2018.01.001.
hipo.22739.
98. Paul, J. R., DeWoskin, D., McMeekin, L. J., Cowell,
82.
Top, D., Harms, E., Syed, S., Adams, E. L., and Saez, L.
R. M., Forger, D. B., and Gamble, K. L. (2016) Regulation
(2016) GSK 3 and CK2 kinases converge on timeless to
of persistent sodium currents by glycogen synthase kinase 3
regulate the master clock, Cell Rep., 16, 357367,
encodes daily rhythms of neuronal excitability, Nat.
doi: 10.1016/j.celrep.2016.06.005.
Commun., 7, 13470, doi: 10.1038/ncomms13470.
83.
Kaladchibachi, S. A., Doble, B., Anthopoulos, N.,
99. Kozikowski, A. P., Gunosewoyo, H., Guo, S., Gaisina,
Woodgett, J. R., and Manoukian, A. S. (2007) Glycogen
I. N., Walter, R. L., et al. (2011) Identification of a glyco
synthase kinase 3, circadian rhythms, and bipolar disorder:
gen synthase kinase 3β inhibitor that attenuates hyperac
a molecular link in the therapeutic action of lithium,
tivity in CLOCK mutant mice, ChemMedChem, 6, 1593
J. Circadian Rhythms, 5, 3, doi: 10.1186/1740 3391 5 3.
1602, doi: 10.1002/cmdc.201100188.
84.
Leloup, J. C., and Goldbeter, A. (2011) Modelling the dual
100. Paul, J. R., Johnson, R. L., Jope, R. S., and Gamble, K. L.
role of Per phosphorylation and its effect on the period and
(2012) Disruption of circadian rhythmicity and suprachi
phase of the mammalian circadian clock, IET Syst. Biol., 5,
asmatic action potential frequency in a mouse model with
44, doi: 10.1049/iet syb.2009.0068.
constitutive activation of glycogen synthase kinase 3,
85.
Kurabayashi, N., Hirota, T., Sakai, M., Sanada, K., and
Neuroscience, 226, 1 9, doi: 10.1016/j.neuroscience.
Fukada, Y. (2010) DYRK1A and glycogen synthase kinase
2012.08.047.
3beta, a dual kinase mechanism directing proteasomal
101. Lavoie, J., Hébert, M., and Beaulieu, J. M.
(2013)
degradation of CRY2 for circadian timekeeping, Mol. Cell.
Glycogen synthase kinase 3β haploinsufficiency length
Biol., 30, 1757 1768, doi: 10.1128/MCB.01047 09.
ens the circadian locomotor activity period in mice,
86.
Sahar, S., Zocchi, L., Kinoshita, C., Borrelli, E., and
Behav. Brain Res., 253, 262 265, doi: 10.1016/j.bbr.2013.
Sassone Corsi, P. (2010) Regulation of BMAL1 protein
08.001.
stability and circadian function by GSK3beta mediated
102. Kon, N., Sugiyama, Y., Yoshitane, H., Kameshita, I., and
phosphorylation, PLoS One, 5, e8561, doi: 10.1371/journal.
Fukada, Y. (2015) Cell based inhibitor screening identifies
pone.0008561.
multiple protein kinases important for circadian clock
87.
Spengler, M. L., Kuropatwinski, K. K., Schumer, M., and
oscillations, Commun. Integr. Biol.,
8, e982405,
Antoch, M. P. (2009) A serine cluster mediates BMAL1
doi: 10.4161/19420889.2014.982405.
dependent CLOCK phosphorylation and degradation, Cell
103. Hirota, T., Lewis, W. G., Liu, A. C., Lee, J. W., Schultz,
Cycle, 8, 4138 4146, doi: 10.4161/cc.8.24.10273.
P. G., and Kay, S. A. (2008) A chemical biology approach
БИОХИМИЯ том 86 вып. 4 2021
528
ШИЛОВСКИЙ и др.
reveals period shortening of the mammalian circadian
regulates the circadian clock, Cell Metab., 24, 462 473,
clock by specific inhibition of GSK 3beta, Proc. Natl.
doi: 10.1016/j.cmet.2016.07.024.
Acad. Sci. USA, 105, 20746 2075, doi: 10.1073/pnas.
113. Young, M. W., and Kay, S. A. (2001) Time zones: a com
0811410106.
parative genetics of circadian clocks, Nat. Rev. Genet., 2,
104. Serchov, T., Jilg, T., Radtke, I., Stehle, J. H., and
702 715, doi: 10.1038/35088576.
Heumann, R. (2016) Ras activity oscillates in the mouse
114. Chaban, A. K., and Voronezhskaya, E. E.
(2008)
suprachiasmatic nucleus and modulates circadian clock
Involvement of transient larval neurons in osmoregulation
dynamics, Mol. Neurobiol., 53, 1843 1855, doi: 10.1007/
and neurogenesis in the freshwater snails, Lymnaea stag
s12035 015 9135 0.
nalis and Helisoma trivolvis, Acta Biol. Hung., 59 (Suppl.),
105. Ahnaou, A., and Drinkenburg, W. H. (2011) Disruption of
123 126, doi: 10.1556/ABiol.59.2008.Suppl.20.
glycogen synthase kinase 3 beta activity leads to abnor
115. Dilman, V. M. (1986) Ontogenetic model of ageing and dis
malities in physiological measures in mice, Behav. Brain
ease formation and mechanisms of natural selection, J. Theor.
Res., 221, 246 252, doi: 10.1016/j.bbr.2011.03.004.
Biol., 118, 73 81, doi: 10.1016/S0022 5193(86)80009 1.
106. Samson, D. R., and Nunn, C. L. (2015) Sleep intensity
116. Zinovkin, R. A., and Grebenchikov, O. A.
(2020)
and the evolution of human cognition, Evol. Anthropol., 24,
Transcription factor Nrf2 as a potential therapeutic target
225 237, doi: 10.1002/evan.21464.
for prevention of cytokine storm in COVID 19 patients,
107. Frolkis, V. V. (1982) Aging and Life Prolonging Processes,
Biochemistry (Moscow),
85,
833837, doi:
10.1134/
Springer Verlag, Wien, New York.
s00062920070111.
108. Williams, G. C. (1957) Pleiotropy, natural selection and
117. Cuadrado, A., Pajares, M., Benito, C., Jiménez
the evolution of senescence, Evolution, 11, 398411,
Villegas, J., Escoll, M., et al. (2020) Can activation of
doi: 10.1111/j.1558 5646.1957.tb02911.x.
NRF2 be a strategy against COVID 19? Trends Pharmacol.
109. Asher, G., Gatfield, D., Stratmann, M., Reinke, H.,
Sci., 41, 598 610, doi: 10.1016/j.tips.2020.07.003.
Dibner, C., et al. (2008) SIRT1 regulates circadian clock
118. Egea, J., Buendia, I., Parada, E., Navarro, E.,
gene expression through PER2 deacetylation, Cell, 134,
Cuadrado, P., et al. (2015) Melatonin sulforaphane hybrid
317 328, doi: 10.1016/j.cell.2008.06.050.
ITH12674 induces neuroprotection in oxidative stress con
110. Nakahata, Y., Kaluzova, M., Grimaldi, B., Sahar, S.,
ditions by a “drug prodrug” mechanism of action, Br. J.
Hirayama, J., et al. (2008) The NAD+ dependent deacety
Pharmacol., 172, 1807 1821, doi: 10.1111/bph.13025.
lase SIRT1 modulates CLOCK mediated chromatin
119. Cecon, E., Oishi, A., and Jockers, R. (2018) Melatonin
remodeling and circadian control, Cell, 134, 329 340,
receptors: molecular pharmacology and signalling in the
doi: 10.1016/j.cell.2008.07.002.
context of system bias, Br. J. Pharmacol., 175, 3263 3280,
111.
Tamaru, T., Hattori, M., Ninomiya, Y., Kawamura, G.,
doi: 10.1111/bph.13950.
Varès, G., et al. (2013) ROS stress resets circadian clocks to
120. Gameiro, I., Michalska, P., Tenti, G., Cores, Á.,
coordinate pro survival signals, PLoS One, 8, e82006,
Buendia, I., et al. (2017) Discovery of the first dual GSK3β
doi: 10.1371/journal.pone.0082006.
inhibitor/Nrf2 inducer. A new multitarget therapeutic
112. Rey, G., Valekunja, U. K., Feeney, K. A., Wulund, L.,
strategy for Alzheimer’s disease, Sci. Rep., 7, 45701,
Milev, N. B., et al. (2016) The pentose phosphate pathway
doi: 10.1038/srep45701.
A CROSSTALK BETWEEN THE BIORHYTHMS AND GATEKEEPERS
OF LONGEVITY: TWO AFFILIATIONS OF GLYCOGEN SYNTHASE KINASE 3
Review
G. A. Shilovsky1,2,3*, T. S. Putyatina2, G. V. Morgunova2, A. V. Seliverstov3,
V. V. Ashapkin1, E. V. Sorokina2, A. V. Markov2, and V. P. Skulachev1
1 Belozersky Institute of Physico Chemical Biology, Lomonosov Moscow State University,
119991 Moscow, Russia; E mail: gregory_sh@list.ru, grgerontol@gmail.com
2 Faculty of Biology, Lomonosov Moscow State University, 119234 Moscow, Russia
3 Institute for Information Transmission Problems, Russian Academy of Sciences, 127051 Moscow, Russia
This review discusses genetic and molecular pathways that link circadian timing with metabolism, resulting in the emer
gence of positive and negative regulatory feedback loops. The Nrf2 pathway is believed to be a component of the anti
aging program responsible for the healthspan and longevity. Nrf2 enables stress adaptation by activating cell antioxidant
defense and other metabolic processes via control of expression of over 200 target genes in response to various types of
stress. The GSK3 system represents a “regulating valve” that controls fine oscillations in the Nrf2 level, unlike Keap1,
which prevents significant changes in the Nrf2 content in the absence of oxidative stress and which is inactivated by the
oxidative stress. Furthermore, GSK3 modifies core circadian clock proteins (Bmal1, Clock, Per, Cry, and Rev erbα).
Phosphorylation by GSK3 leads to the inactivation and degradation of circadian rhythm activating proteins (Bmal1
and Clock) and vice versa to the activation and nuclear translocation of proteins suppressing circadian rhythms (Per
and Rev erbα) with the exception of Cry protein, which is likely to be implicated in the fine tuning of biological clock.
Functionally, GSK3 appears to be one of the hubs in the cross regulation of circadian rhythms and antioxidant defense.
Here, we present the data on the crosstalk between the most powerful cell antioxidant mechanism, the Nrf2 system,
and the biorhythm regulating system in mammals, including the impact of GSK3 overexpression and knockout on the
Nrf2 signaling. Understanding the interactions between the regulatory cascades linking homeostasis maintenance and
cell response to oxidative stress will help in elucidating molecular mechanisms that underlie aging and longevity.
Keywords: GSK3, Nrf2, oxidative stress, aging, biological rhythms, aging and antiaging programs, antioxidants
БИОХИМИЯ том 86 вып. 4 2021