БИОХИМИЯ, 2021, том 86, вып. 4, с. 575 - 583
УДК 577.151
ГЕТЕРОЛОГИЧНАЯ ЭКСПРЕССИЯ ЭНДО КСАНТАНАЗЫ
Thermogutta terrifontis в Penicillium verruculosum:
ВЫДЕЛЕНИЕ И ПЕРВИЧНАЯ ХАРАКТЕРИСТИКА ФЕРМЕНТА
© 2021
Ю.А. Денисенко1*, О.Г. Короткова1, И.Н. Зоров1,2, А.М. Рожкова1,2,
М.В. Семенова1, А.Г. Ельченинов1, И.В. Кубланов1, А.П. Синицын1,2
1 Федеральный исследовательский центр «Основы фундаментальной биотехнологии»
Российской академии наук, 119071 Москва, Россия; электронная почта: denisenkoyura@mail.ru
2 Московский государственный университет им. М.В. Ломоносова,
химический факультет, 119991 Москва, Россия
Поступила в редакцию 10.11.2020
После доработки 29.12.2020
Принята к публикации 29.12.2020
С помощью экспрессионной системы на основе реципиентного штамма Penicillium verruculosum 537 (ΔniaD)
и промотора гена целлобиогидролазы 1 был создан штамм продуцент гетерологичной эндо ксантаназы из
термофильного планктомицета Thermogutta terrifontis. Методами жидкостной хроматографии была выделена
гомогенная эндо ксантаназа с молекулярной массой 23,7 кДа (pI 6,5). Фермент обладал способностью к
деструкции ксантана, а также проявлял активность по отношению к КМ целлюлозе, β глюкану, курдлану,
лихенану, ламинарину, галактоманнану, ксилоглюкану и не гидролизовал п нитрофенильные производные
β D глюкозы, маннозы и целлобиозы. Температурный оптимум эндо ксантаназы составил 55 °C, оптимум
pH - 4,0; фермент проявлял 90% от максимальной активности в диапазоне температуры 50-60 °C и pH 3-5.
КЛЮЧЕВЫЕ СЛОВА: эндо ксантаназа, Thermogutta terrifontis, Penicillium verruculosum, гетерологичная
экспрессия, деструкция ксантана.
DOI: 10.31857/S0320972521040096
ВВЕДЕНИЕ
Водные растворы ксантана образуют гелеоб
разную структуру. При растворении ксантан мо
Ксантан (ксантановая камедь) является
жет быть неупорядочен, но чаще склонен к об
внеклеточным гетерополисахаридом, который
разованию упорядоченных структур, наиболее
продуцируют бактерии Xanthomonas campestris.
простая из которых - спираль главной цепи,
Основная цепь ксантана состоит из связанных
вокруг которой выстраиваются боковые группы.
β 1,4 глюкозидной связью остатков глюкозы,
Раствор ксантана обладает свойством псев
боковые группы состоят из трех остатков:
допластичности (вязкость раствора уменьшает
α D манноза (2 → 1) β D глюкуроновая кис
ся при увеличении напряжения сдвига). Благо
лота (4 → 1) β D манноза у каждого второго
даря этим качествам ксантановая камедь нашла
остатка глюкозы в положении C3 [1] (рис. 1),
применение в таких отраслях, как нефтедобыча,
при этом проксимальный и дистальный манно
пищевая и косметическая промышленность
зильные остатки боковой цепи часто являются
[2, 3]. Основной объем ксантана используется
ацетилированными или содержат пируватные
при бурении вертикальных и наклонных сква
группы.
жин большого диаметра, а также в процессах
Молекулярная масса (ММ) ксантана состав
интенсификации добычи нефти и природного
ляет 1-7×106 Да. Степень полимеризации и аце
газа с использованием технологии гидроразрыва
тилирования ксантана может варьировать в за
пласта, где 0,5-2% ные растворы ксантана (в
висимости от условий культивирования
том числе в смеси с другими полисахаридами)
X. campestris.
используются для доставки расклинивающих
агентов (проппантов) в тело пласта. Закачивае
мые в скважины растворы ксантана характери
Принятые сокращения: КЖ - культуральная жид
зуются низким фильтрационным сопротивле
кость; ММ - молекулярная масса; пНФ - пара нитрофе
нильные производные; п.н. - пар нуклеотидов; ФП - фер
нием при движении в среде, после завершения
ментный препарат; ЭК - эндо ксантаназа.
прокачки происходит гелеобразование, и вяз
* Адресат для корреспонденции.
кость раствора возрастает в сотни раз.
575
576
ДЕНИСЕНКО и др.
ти на ксантановой среде в аэробных и анаэроб
ных условиях [7]. Кроме того, транскриптом
этой бактерии, помимо ЭК, имеет в своём сос
таве мРНК нескольких ферментов, которые в
соответствии с их субстратной специфичностью
способны в комплексе с ЭК приводить к дест
рукции ксантана, в частности, α и β маннози
дазы, и другие.
В работе Yang et al. [8] описана ЭК MiXen
Microbacterium sp. XT11, которая имеет мульти
доменную структуру и способна гидролизовать
ксантан, находящийся в упорядоченной кон
формации. Также охарактеризована ЭК PspXan9
из Paenibacillus nanensis, которая демонстрирует
невысокую активность по отношению к немо
дифицированному ксантану и способна эффек
Рис. 1. Структура мономерного звена ксантана
тивно гидролизовать только модифицирован
ный ксантан - обработанный ксантан лиазой
[9].
Важно, что вязкость ксантана в стволе сква
Создание эффективных и экологичных фер
жины должна быть уменьшена после заверше
ментных препаратов (ФП) на основе ЭК, спо
ния операции гидроразрыва пласта, т.е. ксантан
собных снижать вязкость растворов ксантана,
должен быть разрушен до низкомолекулярных
представляет интерес для нефтедобывающей и
сахаров. В настоящее время для этих целей при
других отраслей промышленности. В связи с
меняются сильные окислители и другие агрес
этим целью данной работы было использование
сивные компоненты, которые оказывают нега
экспрессионной системы гриба P. verruculosum
тивное влияние на окружающую среду при по
для клонирования гена гетерологичной эндо
падании в открытые водоемы, грунтовые воды и
ксантаназы термофила T. terrifontis, выделение и
отвалы в районе скважин.
первичная характеристика новой ЭК.
Вместо сильнодействующих и вредных для
окружающей среды химических веществ для де
полимеризации ксантановой камеди целесооб
МАТЕРИАЛЫ И МЕТОДЫ
разно использовать гидролитические ферменты.
Ввиду образования молекулами ксантана упоря
Штаммы. Гриб P. verruculosum 537 (ΔniaD)
доченных структур в водных растворах, необхо
был использован в качестве ауксотрофного
димо использовать комплекс ферментов, состо
штамма реципиента, дефектного по гену niaD,
ящий из ксантан специфичных эндо глюканаз
кодирующему нитратредуктазу. Клетки термо
(эндо ксантаназ, ЭК), разрушающих основную
фильного планктомицета T. terrifontis R1(T) слу
полисахаридную цепь ксантана, а также ксан
жили источником геномной ДНК [10].
тан лиаз, β маннозидаз, α маннозидаз и α глю
Субстраты. Для измерения активности ис
куронидаз, которые расщепляют боковые цепи.
пользовали следующие субстраты: ксантан
Считается, что для эффективного снижения
(ксантановая камедь из X. campestris), Na соль
вязкости раствора ксантана необходим комп
карбоксиметилцеллюлозы (КМ целлюлоза),
лекс двух совместно функционирующих фер
глюкуроноксилан бука (ксилан), п нитрофе
ментов, в состав которого входят ЭК и ксан
нил β D глюкопиранозид, п нитрофенил β D
тан лиаза. Ксантан лиаза катализирует расщеп
маннопиранозид, целлобиоза («Sigma Aldrich»,
ление β D маннозил β D 1,4 глюкуронильной
США); ксантан нефтяной («TNJ», КНР); кси
связи на боковом радикале ксантана и высво
логлюкан, галактоманнан, β глюкан ячменя,
бождает дистальную D маннозильную группу
ламинарин, лихенан, курдлан («Megazyme», Ир
(EC 4.2.2.12) [4].
ландия).
На сегодняшний день известны бактерии,
Прочие реактивы. Для приготовления реа
которые способны к деструкции ксантана за
гентов Шомоди-Нельсона, Лоури и буферных
счет экспрессии ксантан литических фермен
растворов использовали реактивы классифика
тов, например, Cellulomonas sp. LX
[5] и
ции х.ч., ч.д.а. и о.с.ч. производства «АО Реа
Bacillus sp. [6]. Термофильный планктомицет
хим» и «Хеликон» (Россия), «MP Biomedicals»
T. terrifontis, который был выделен из горячих
(Франция), «Applichem» (Испания) и «Sigma
источников на Дальнем Востоке, способен рас
Aldrich» (США).
БИОХИМИЯ том 86 вып. 4 2021
ГЕТЕРОЛОГИЧНАЯ ЭКСПРЕССИЯ ЭНДО КСАНТАНАЗЫ
577
Для культивирования рекомбинантного
США). Концентрацию белка определяли моди
штамма P. verruculosum использовали глюкозу
фицированным методом Лоури [14].
(«Хеликон», Россия), пшеничные отруби («Эн
Наработка ферментных препаратов. Культи
зим», Украина), микрокристаллическую целлю
вирование рекомбинантных штаммов для нара
лозу (МКЦ) («МК Центр», Россия), дрожжевой
ботки ФП проводили в однолитровых фермен
экстракт («Lesaffre», Франция). В качестве ми
терах КФ 104/3 («Проинтех», Россия) с исполь
неральных компонентов питательных сред при
зованием следующего состава среды (в г/л):
меняли реактивы производства
«Лабтех»,
глюкоза - 57,1, МКЦ - 40, пшеничные отру
«АО Реахим», «Химмед» (Россия), «MP Bio
би - 10, кукурузный экстракт - 30, мочевина -
medicals» и «Sigma Aldrich» (США).
2,5, KH2PO4 - 14, (NH4)2SO4 - 10, CaCl2 - 0,6,
Ферменты. Для измерения вязкости раство
MgSO4*7H2O - 0,6 при 32 °C, pH 5,0 в течение
ров ксантана использовали ксантан лиазу
144 ч. По окончании грибную биомассу отделя
Bacillus sp. GL1, EC 4.2.2.12 («Megazyme», Ир
ли от культуральной жидкости центрифугирова
ландия).
нием (30 мин, 4200 g, 4 °C) на приборе Avanti J6
ПЦР и получение генетических конструкций.
(«Beckman Coulter», США), после чего среда бы
Для ПЦР был использован амплификатор
ла обезвожена в распылительной сушилке Mini
C1000 Touch («Bio Rad», США). Для амплифи
Spray Dryer B 290 («Buchi», Швейцария).
кации гена thte_1561, кодирующего ЭК
Выделение и очистка целевого белка. Выделе
DUF1080, использовали в качестве матрицы ге
ние проводили с использованием системы для
номную ДНК, выделенную из термофильного
белковой хроматографии AKTA Purifier UPC 100
планктомицета T. terrifontis R1(T). Для ПЦР
(«GE Healthcare», Швеция). Процесс выделения
применяли Phusion ДНК полимеразу («Thermo
состоял из следующих стадий: осаждение
Scientific», США). Полученный ПЦР продукт
70% ным раствором сульфата аммония, пере
был клонирован методом независимого лигиро
растворение и обессоливание ФП на колонке с
вания [11]. Далее ПЦР продукт и линеаризо
носителем Bio Gel Р2 («Bio Rad», США), урав
ванный вектор pUC CBHI обрабатывали
новешенной c 0,01 М буфером Bis Tris/HCl,
Т4 ДНК полимеразой в присутствии дезоксиа
pH 7,3. Анионообменную хроматографию ФП
денозинтрифосфата (dATP) и дезокситимиди
проводили на колонке, заполненной носителем
нтрифосфата (dTTP) соответственно («Thermo
Source 15Q («GE Healthcare», США), уравнове
Scientific», США). Лигирование вставки (150 нг)
шенной c таким же
0,01
М буфером
и вектора pUC CBHI (50 нг) проводили путем
Bis Tris/HCl, pH 7,3. Гидрофобную хроматогра
их смешивания и инкубирования; затем смесью
фию проводили на колонке с носителем
трансформировали клетки E. coli Mach1
Source 15ISO («GE Healthcare», США), уравно
(«Invitrogen», США) по стандартному протоколу
вешенной c 0,05 М Na ацетатным буфером,
[12]. Котрансформация штамма реципиента
pH 5,0, в присутствии 1,7 М (NH4)2SO4. Фрак
P. verruculosum 537 (ΔniaD) была проведена по
ции с целевым ферментом обессоливали на ко
адаптированной методике, описанной Алексен
лонке с носителем Bio Gel Р2, уравновешенной
ко и соавт. [13].
c 0,05 М Nа ацетатным буфером, pH 5,0.
Скрининг клонов. Первичный скрининг с
Идентификация целевого белка. Масс спект
грибных колоний на наличие целевого гена осу
рометрический анализ проводили в ЦКП
ществляли с использованием ДНК полимеразы
«Прикладные биотехнологии» ФИЦ Биотехно
Phire Hot Start («Thermo Scientific», США) по
логии РАН на приборе UltrafleXtreme II
исходным праймерам. Клоны P. verruculosum с
(«Bruker Daltonics», Германия). Пептидные
подтвержденной вставкой целевого гена культи
фрагменты анализировали с помощью програм
вировали в колбах Эрленмейера при 30 °C в те
мы Mascot («Matrix Science», Великобритания,
чение 6 сут. В состав среды входили следующие
компоненты (в г/л): МКЦ - 40, пшеничные от
com), а также онлайн сервисов PeptideMass и
руби - 10, дрожжевой экстракт - 10, КН2PO4 -
15, (NH4)2SO4
-
5, MgSO4*7H2O
-
0,3,
Определение активности ферментов. Актив
СaCl2*2H2O - 0,3. Отбор клонов осуществляли
ность по отношению к полисахаридным
по результатам проведения Ds Na ПААГ элект
субстратам определяли по начальным скорос
рофореза полученной при их культивировании
тям образования восстанавливающих сахаров
культуральной жидкости (КЖ). Электрофорез
(ВС) при 50 °C и pH 5,0. Концентрацию ВС оп
проводили на приборе Mini PROTEAN Tetra
ределяли методом Шомоди-Нельсона [15], пог
Cell («Bio Rad Laboratories», США). В качестве
решность которого составляет 5-10%.
маркеров для электрофореза использовали
Активность по отношению к п нитрофе
смесь белков
№26612
(«Thermo Scientific»,
нильным производным (пНФ ) сахаров опреде
БИОХИМИЯ том 86 вып. 4 2021
578
ДЕНИСЕНКО и др.
ляли по скорости образования п нитрофенола
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
при 40 °C и pH 5,0 [16]. За единицу активности
принимали количество фермента, которое ката
Получение генно инженерных конструкций,
лизирует образование 1 мкмоль продукта за
трансформация штамма реципиента. С помощью
1 мин [16].
методов генной инженерии был амплифициро
Определение температурного и pH оптимума
ван ген thte_1561 (GenBank ASV74163.1) длиной
активности ФП и очищенных ферментов. При из
642 пары нуклеотидов (п.н.) при использовании
мерении pH зависимости активности использо
LPM ДНК полимеразы и пары праймеров на
вали лихенан и 0,1 М цитрат фосфатный буфер
целевой ген, кодирующий ЭК DUF1080
(pH 3,0-8,5). Температурный профиль актив
(UniProt A0A286RDZ9). Амплификацию прово
ности определяли в диапазоне 30-85 °C с шагом
дили методом ПЦР с геномной ДНК T. terri*
5 °C при pH 5,0. Оптимальным считали интервал
fontis R1(T). После выделения ПЦР продукта из
значений pH или температуры, в котором на
агарозного геля его лигировали с линеаризован
блюдалось не менее 85% максимальной актив
ным вектором pUC CBHI.
ности.
Полученная плазмида была клонирована в
Влияние индивидуальных ферментов на изме
компетентные клетки E. coli Mach1 для нара
нение вязкости растворов ксантана. Сначала го
ботки генетического материала. После выделе
товили 1% ный раствор ксантана путем суспен
ния и очистки плазмидной ДНК была проведе
дирования порошка ксантана в течение ночи
на котрансформация штамма реципиента
при комнатной температуре на магнитной ме
P. verruculosum 537 (ΔniaD). Для первичного
шалке в 0,02 М Tris HCl буфере, pH 7,3. Далее
скрининга было отобрано 80 клонов, которые
разбавляли тем же буфером в присутствии 2 мМ
были пересеяны на твердую селективную среду,
CaCl2 до необходимой концентрации (0,1%
содержащую 10 мМ нитрата натрия в качестве
ксантана) и перемешивали. К 15 мл рабочего
источника азота. Скрининг грибных колоний
раствора ксантана добавляли 0,5 мл буфера или
был проведен с помощью ДНК полимеразы
фермента, перемешивали и инкубировали в тер
Phire Hot Start и соответствующих праймеров.
мостате при 60 °C в течение 65 ч. Измерение вяз
Было установлено, что 93% клонов содержали
кости проводили на ротационном вискозиметре
необходимый ген длиной 642 п.н. В качестве
DV2TLV («Brookfield», США) с термостатируе
контроля использовали геномную ДНК T. terri*
мой ячейкой, управление прибором и обработку
fontis R1(T).
результатов проводили при помощи программы
Культивирование рекомбинантных штаммов.
Rheocalc T («Brookfield», США). Относительная
Отобранные на селективной среде и содержа
погрешность измерения в ходе трехкратного
щие целевой ген thte_1561 клоны были культи
повторения составила 4%.
вированы в колбах Эрленмейера со стандартной
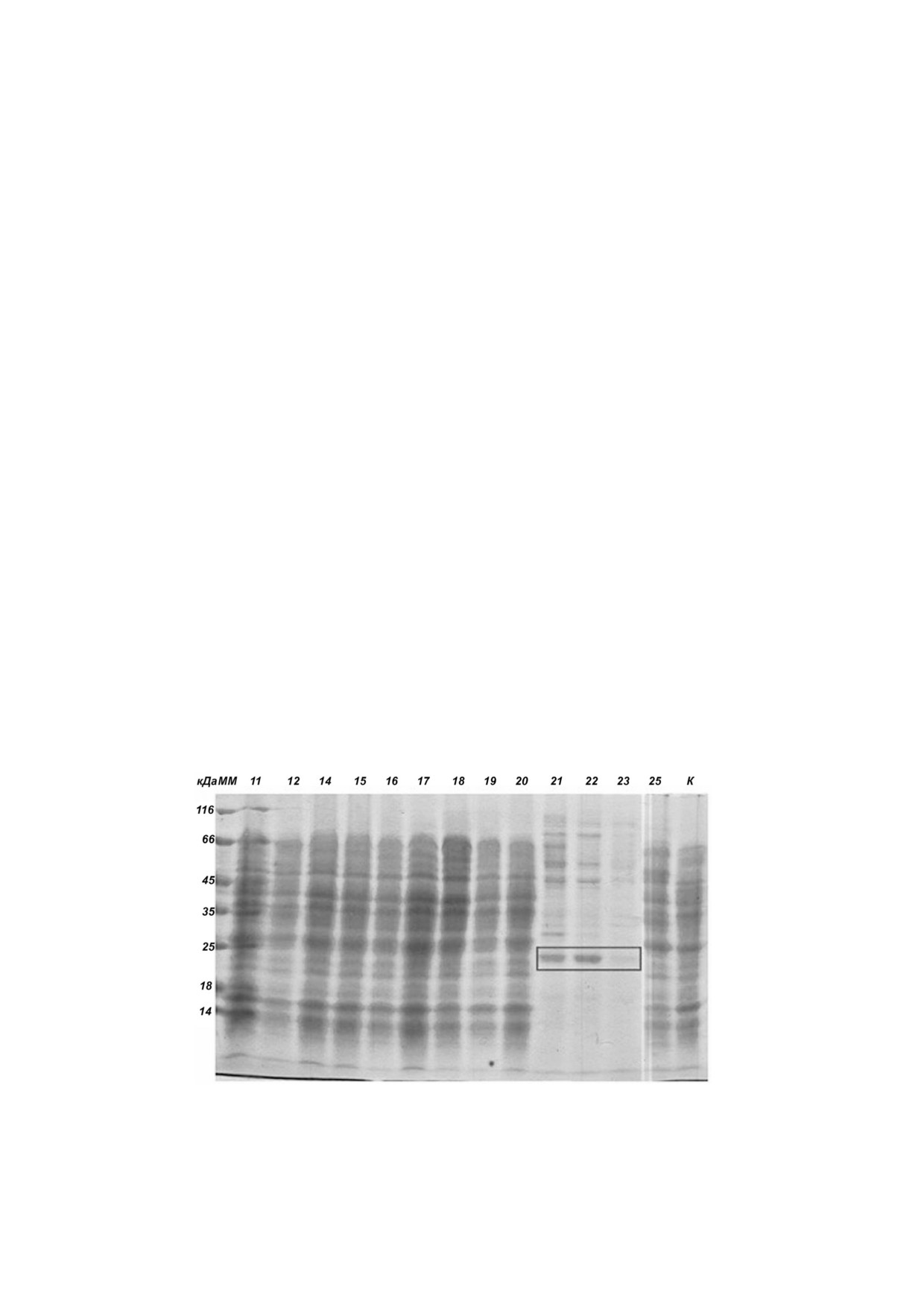
Рис. 2. Электрофореграмма КЖ после 6 сут. культивирования в колбах Эрленмейера. М - маркеры, слева по вертикали
указаны ММ стандартных белков (кДа); К - реципиентный штамм P. verruculosum 537 (контроль). Сверху по горизонтали
указаны номера КЖ (номер КЖ соответствует номеру культивируемого клона)
БИОХИМИЯ том 86 вып. 4 2021
ГЕТЕРОЛОГИЧНАЯ ЭКСПРЕССИЯ ЭНДО КСАНТАНАЗЫ
579
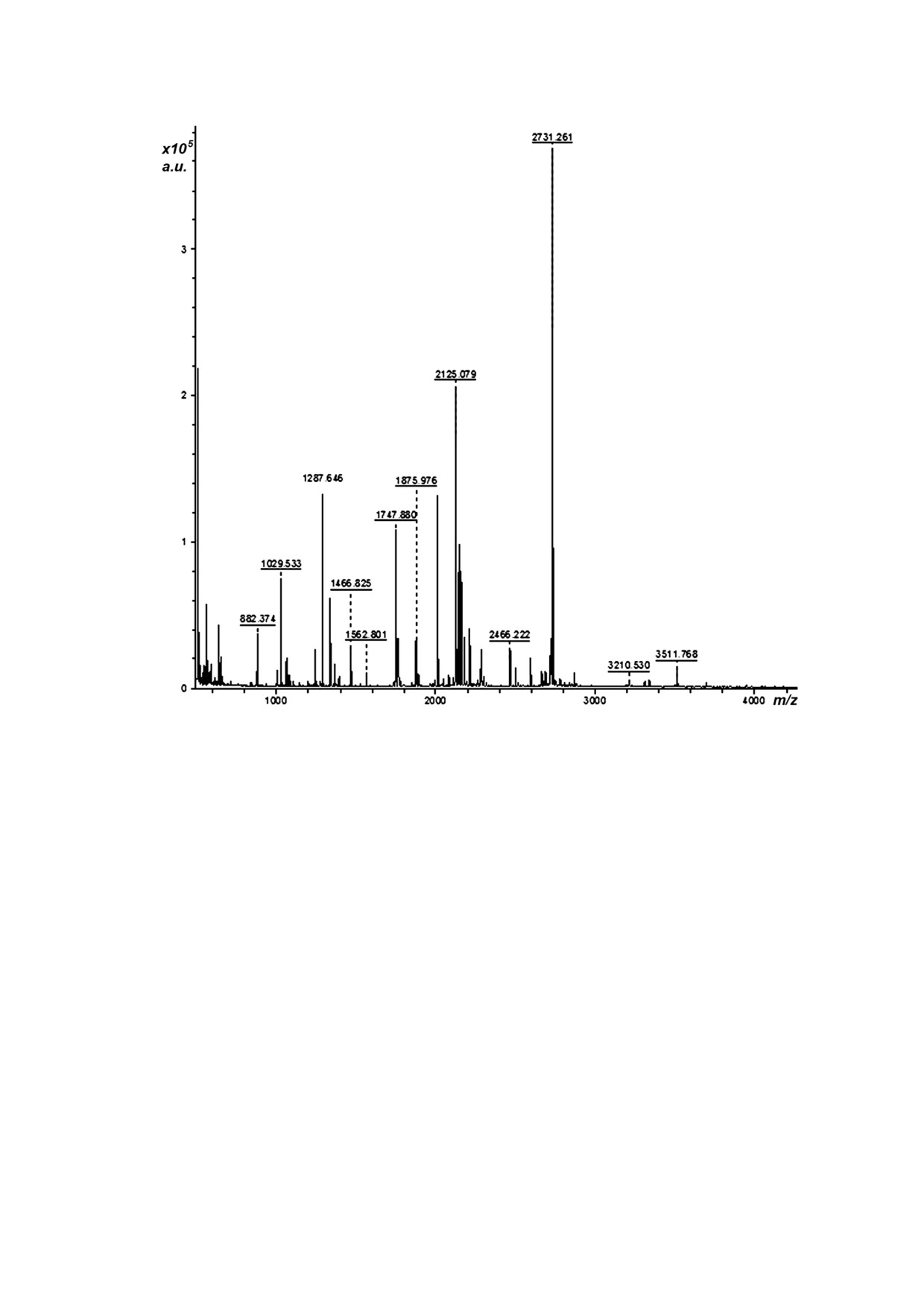
Рис. 3. Масс спектр образца ЭК, зарегистрированный на приборе UltrafleXtreme II (a.u. - относительные единицы, m/z -
приведенная масса)
жидкой питательной средой для P. verruculosum.
Белковые полосы, соответствующие ЭК, бы
На шестые сутки был проведен Ds Na ПА
ли вырезаны из геля и обработаны трипсином,
АГ электрофорез белковых фракций, а также
гидролизаты подвергали MALDI TOF масс
измерены pH и концентрация белка в КЖ. При
спектрометрическому анализу (matrix assisted
разделении белковых фракций по массе удалось
laser desorption ionization time of flight mass spec
выявить ряд клонов, экспрессирующих фермент
trometry). Результат представлен на рис. 3.
с видимой ММ 24 кДа, которая соответствует
Анализ данных масс спектрометрии прово
теоретической ММ целевой ЭК - 23,7 кДа. На
дили с помощью онлайн сервиса FindPept и
рис. 2 приведен пример электрофореграммы
программы flexAnalysis. Массы 22 х полученных
КЖ ряда клонов.
пептидов (1029,5; 1244,5; 1287,6; 1338,7; 1392,7;
Полосы, соответствующие ЭК в КЖ № 21,
1466,8; 1562,8; 1747,9; 1876,0; 2009,0; 2048,1;
22 и 23, выделены рамкой на рис. 2. Контроль
2125,1; 2144,0; 2176,0; 2466,2; 2500,2; 2594,3;
ная электрофореграмма лабораторного штамма
2731,2; 3195,5; 3210,5; 3511,8; 3696,9 Да) соответ
P. verruculosum 537 представлена в крайнем пра
ствовали ММ теоретических пептидов после
вом треке. С помощью программного обеспече
специфического трипсинолиза ЭК c погреш
ния Gel Analyzer 2010a была проведена количе
ностью 100 ppm (point per million). Выравнива
ственная оценка экспрессии ЭК. Она составила
ние последовательностей пептидов и аминокис
от 33 до 45% от общего содержания ферментов,
лотной последовательности зрелого белка ЭК
т.е. 1,6 и 2,7 мг/мл в случае КЖ №21 и 22 соответ
показало 69,5% сходства; на последовательности
ственно.
ЭК ниже идентичные участки отмечены серым:
БИОХИМИЯ том 86 вып. 4 2021
580
ДЕНИСЕНКО и др.
а
б
Акт, %
Акт, %
pH
T, C
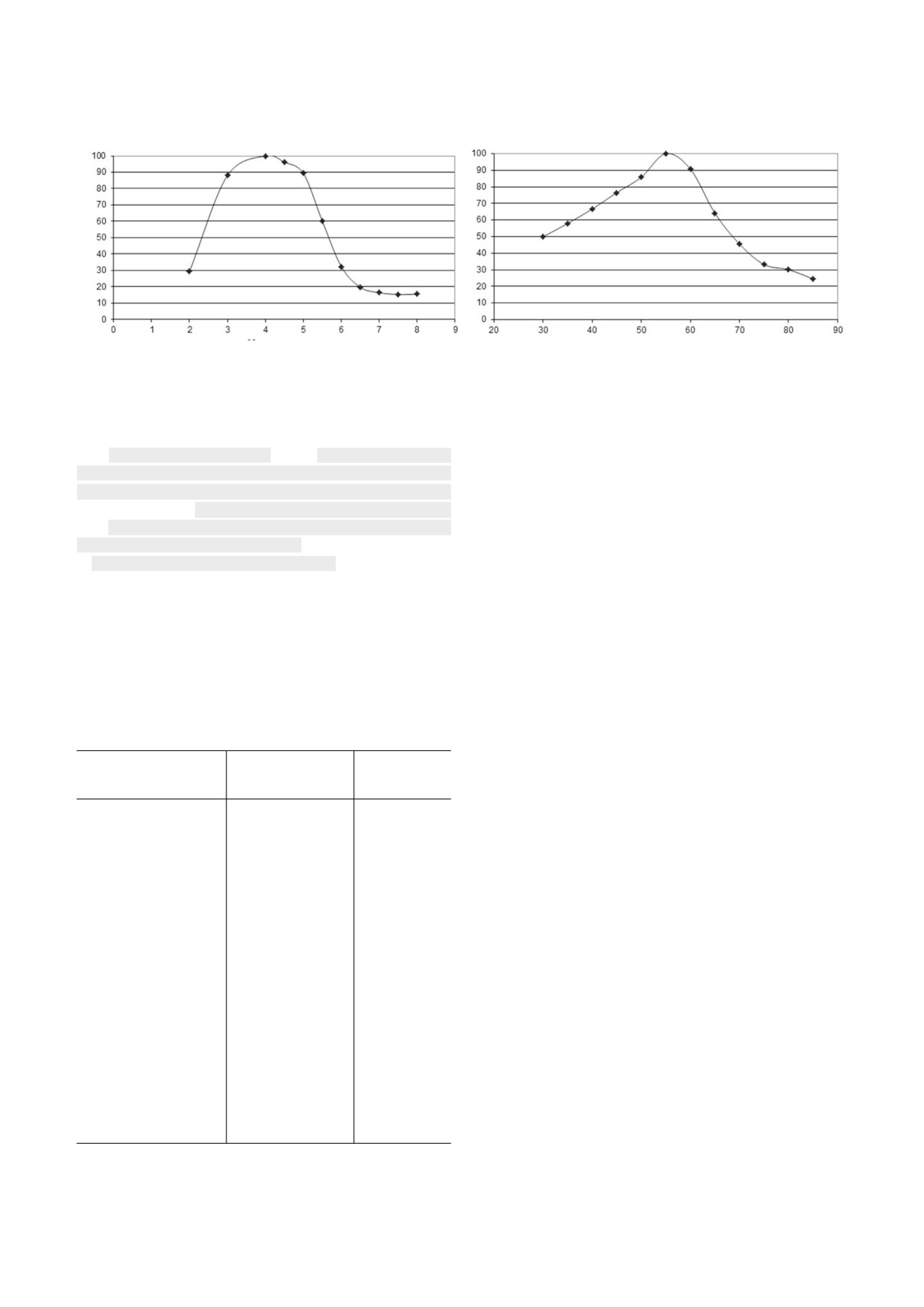
Рис. 4. а - Зависимость активности ЭК от pH (при 50 °C); б - зависимость активности ЭК от температуры (при pH 5,0)
MKKLLVAVTEMFVLAVSLNLLYGTCVGAEE
По результатам культивирования в колбах
FRGKWKPLWDGKTFKGWHTIGVG
был выбран клон №21, который далее культи
TWTIEDGAIVGRKKAEEKEFGHLVSD
вировали в однолитровых ферментерах
DVFKDFVVRLKFKVLQGNSGFYFRVEEK
КФ 104/3. КЖ после ферментации была обез
GYSGVSGFQAEIAPDANTGGLYETN
вожена на распылительной сушилке Mini Spray
GRAWVVQPSPEVVKKAFKPNEWNEMI
Dryer B 290 («Buchi», Швейцария) с получени
VAAKGGDITVWVNGVKTAEVKNDPGR
ем сухого ферментного препарата ЭК. Для вы
REGHFALQLHGGNDMLVMFKDIKILEPEE
деления ЭК в гомогенном виде полученный ФП
растворяли в стартовом буфере Tris HCl,
Таким образом, масс спектрометрические
pH 7,3, центрифугировали и обессоливали.
данные подтвердили экспрессию бактериаль
Обессоленный ФП фракционировали путем
ной ЭК DUF1080 T. terrifontis в грибном штам
анионобменной хроматографии - ЭК не связы
ме реципиенте P. verruculosum 537.
валась с носителем и элюировалась в несвязав
шейся фракции. В ходе гидрофобной хромато
графии ЭК также элюировалась в несвязавшей
ся фракции. Анализом MALDI TOF было под
Активность выделенной гомогенной ЭК по отношению к
тверждено выделение именно бактериальной
разным субстратам (50 °C, pH 5,0)
ЭК T. terrifontis.
Субстрат
Тип связи
Активность,
В итоге благодаря двум последовательным
в основной цепи
ед./мг
стадиям хроматографического разделения из
ФП была выделена целевая бактериальная ЭК в
Ксантан
β(1,4)
0,12
гомогенном виде с чистотой > 98% (по данным
Ds Na ПААГ электрофореза).
КМ целлюлоза
β(1,4)
0,58
Свойства гомогенной ЭК. Активность ЭК бы
Ксилоглюкан
β(1,4)
0,18
ла измерена по отношению к ряду субстратов
Галактоманнан
β(1,4)
0,12
(таблица). Определение субстратной специфич
β глюкан ячменя
β(1,3)/β(1,4)
0,56
ности продемонстрировало, что помимо ксанта
Ламинарин
β(1,3)/β(1,6)
0,17
на, исследуемая ЭК проявляла активность по
отношению к ряду полисахаридов, имеющих
Лихенан
β(1,3)/β(1,4)
1,48
β 1,4 и β 1,3/β 1,4 связи (КМ целлюлоза, кси
Курдлан
β(1,3)
0,12
логлюкан, галактоманнан, β глюкан, ламина
Целлобиоза
β(1,4)
<0,01
рин, лихенан, курдлан). Максимальная актив
nНФ β целлобиозид
β(1,4)
<0,002
ность наблюдалась по отношению к лихенану.
nНФ α D глюкозид
α(1,4)
<0,002
Активности по отношению к пНФ α и β глю
козидов детектировано не было. Следует отме
nНФ β D глюкозид
β(1,4)
<0,002
тить, что активность выделенной ЭК по отно
nНФ α D маннозид
α(1,4)
<0,002
шению к ксантану оказалась сопоставима с ак
nНФ β D маннозид
β(1,4)
<0,002
тивностью ЭК PspXan9 P. nanensis, составляю
nНФ β D глюкуронид
β(1,4)
<0,002
щей 0,285 ед./мг (по отношению к нативному
ксантану) [9].
БИОХИМИЯ том 86 вып. 4 2021
ГЕТЕРОЛОГИЧНАЯ ЭКСПРЕССИЯ ЭНДО КСАНТАНАЗЫ
581
Для определения температурного и pH оп
буфера или раствора фермента. Концентрация
тимума активности ЭК в качестве субстрата ис
каждого из ферментов в реакционной смеси
пользовали лихенан, поскольку по отношению
составляла 3,25 мкг/мл. Далее раствор переме
к нему наблюдалась максимальная активность
шивали и инкубировали в термостате при 60 °C
(рис. 4).
в течение 65 ч. Вязкость растворов ксантана с
Температурный оптимум ЭК составил 55 °C,
буфером и с ферментами определяли на ротаци
pH оптимум - 4,0. Фермент проявлял 90% от
онном вискозиметре. Остаточная вязкость раст
максимальной активности в диапазоне темпера
воров ксантана под действием ферментов
тур 50-60 °C и pH 3-5; 30% активности - при
представлена на рисунке 5.
значениях pH 2 и 6 и температуре 80 °C.
Для обеих выбранных концентраций ксанта
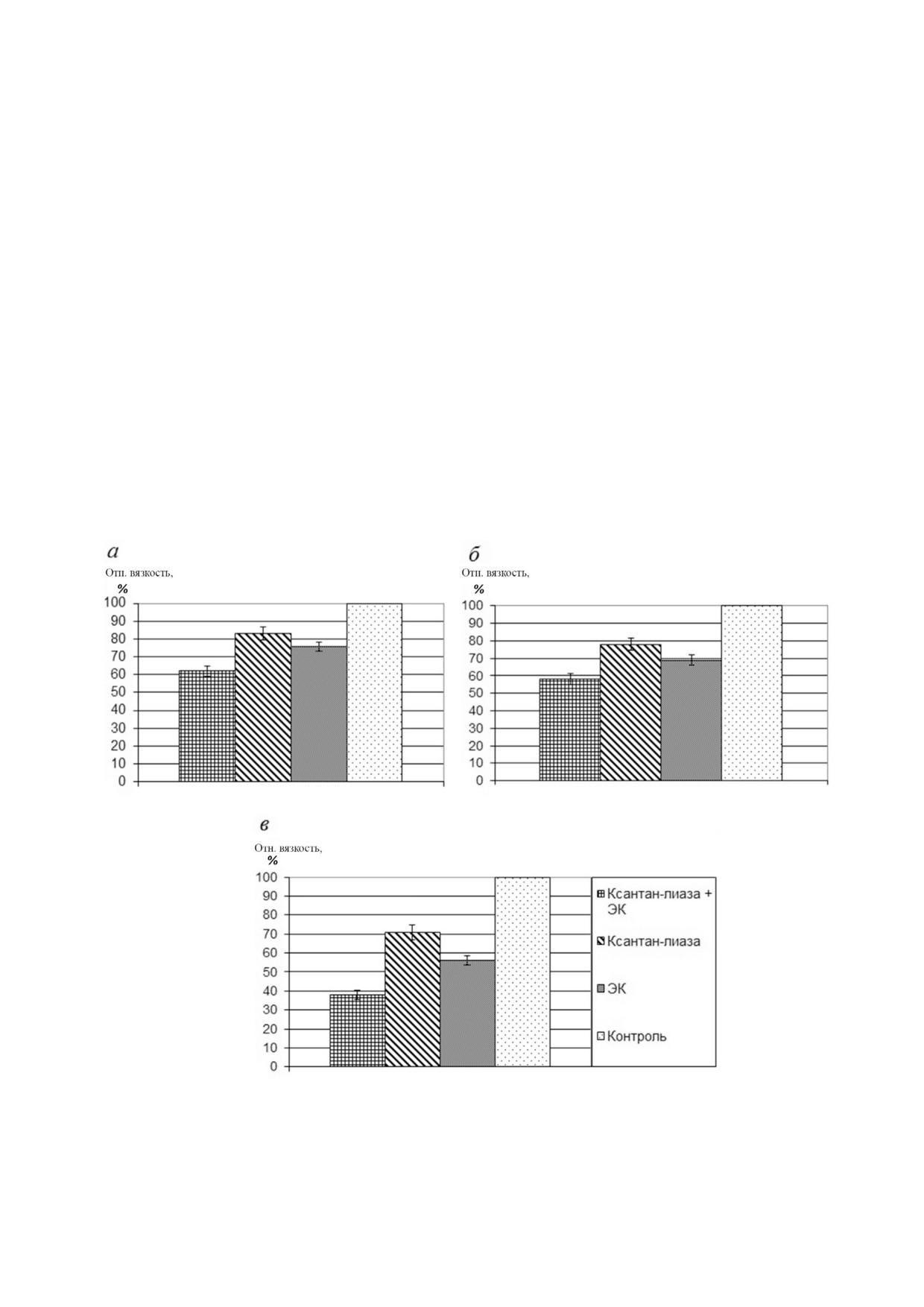
Влияние ЭК на вязкость растворов ксантана.
на максимальное уменьшение вязкости наблю
Как известно, ксантан лиаза является одним из
далось в случае совместного использования
ферментов, способных модифицировать ксан
ксантан лиазы и ЭК - до 60% от исходной. В
тан. В данной работе использовали фермент
одиночку ксантан лиаза снижала вязкость до
Bacillus sp., штамм GL1, которая является ксан
80% от исходной. Гомогенная ЭК также оказа
тан лиазой I типа, т.е. специфичной к наличию
лась эффективнее в менее концентрированном
пируватной группы на дистальном остатке
растворе ксантана - остаточная вязкость соста
D маннозы. Было измерено влияние ЭК и ксан
вила 77 и 69% в случае 0,5 и 0,1% ного раствора
тан лиазы на изменение вязкости раствора
соответственно.
ксантана поодиночке и совместно. К 15 мл 0,1 и
При увеличении загрузки фермента в 4 раза
0,5% ного раствора ксантана добавляли 0,5 мл остаточная вязкость 0,1% ного раствора ксанта
Рис. 5. Относительная остаточная вязкость растворов ксантана после обработки ферментами: ЭК, ксантан лиазой и сов
местно двумя ферментами при 60 °C в течение 65 ч. а - 0,5% ный раствор ксантана при загрузке ферментов в концентра
ции 3,25 мкг/мл; б - 0,1% ный раствор при загрузке ферментов в концентрации 3,25 мкг/мл; в - 0,1% ный раствор при
концентрации ферментов 13 мкг/мл
БИОХИМИЯ том 86 вып. 4 2021
582
ДЕНИСЕНКО и др.
на при добавлении гомогенной ЭК составила
логлюкану, но не гидролизовала п нитрофе
56%, ксантан лиазы - 71%. Максимальное сни
нильные производные β D глюкозы, маннозы и
жение вязкости 0,1% ного раствора ксантана
целлобиозы. Температурный и pH оптимум ЭК
наблюдалось в случае совместного действия
составил 55 °C и 4,0, фермент проявлял 90% ак
ферментов. Увеличение концентрации фермен
тивности от максимальной в диапазоне темпе
тов привело к снижению остаточной вязкости
ратуры 50-60 °C и pH 3-5. Таким образом, была
0,1% ного раствора с 60 до 38%.
показана возможность получения ферментного
Полученные данные свидетельствуют, что
препарата с эндо ксантаназой на основе штам
ЭК способна самостоятельно снижать вязкость
ма P. verruculosum 537 (ΔniaD), способного к
раствора ксантана в ходе длительного термоста
деструкции и снижению вязкости растворов
тирования при 60 °C, а добавление ксантан лиа
ксантана.
зы Bacillus sp. увеличивает эффективность этого
процесса.
Финансирование. Работа выполнена при под
держке Министерства науки и высшего образо
С помощью экспрессионной системы на ос
вания Российской Федерации (Государственное
нове реципиентного штамма P. verruculosum 537
задание 0104 2019 0009).
(ΔniaD) и промотора гена целлобиогидролазы 1
Благодарности. Работа выполнена с исполь
был создан штамм продуцент эндо ксантаназы
зованием научного оборудования ЦКП «Про
(ЭК, DUF1080) из термофильного планктоми
мышленные биотехнологии» и АЦКП «Биоин
цета T. terrifontis. Методами хроматографии бы
женерия» ФИЦ Биотехнологии РАН.
ла получена гомогенная ЭК с ММ 23,7 кДа
Конфликт интересов. Авторы заявляют об от
(pI 6,5). ЭК обладала способностью к деструк
сутствии конфликта интересов.
ции ксантана без добавления вспомогательных
Соблюдение этических норм. Настоящая
ферментов, а также проявляла активность по от
статья не содержит описания каких либо иссле
ношению к КМ целлюлозе, β глюкану, курдла
дований с участием людей или животных в каче
ну, лихенану, ламинарину, галактоманнану, кси стве объектов.
СПИСОК ЛИТЕРАТУРЫ
1.
Janson, P., Kenne, L., and Lindberg, B. (1975) Structure
8. Yang, F., Li, H., Sun, J., Guo, X., Zhang, X., et al. (2019)
of extracellular polysaccharide from Xanthamonas
Novel endotype xanthanase from xanthan degrading
campestris, Carbohydr. Res., 45, 275 282, doi: 10.1016/
Microbacterium sp. strain XT11, Appl. Environ. Microbiol.,
s0008 6215(00)85885 1.
85, doi: 10.1128/AEM.01800 18.
2.
Santos, V. E., Casas, J. A., and Go, E. (2000) Xanthan
9. Moroz, O. V., Jensen, P. F., McDonald, S. P., McGregor,
gum: production, recovery, and properties, Biotechnol.
N., Blagova, E., Comamala, G., et al. (2018) Structural
Adv., 18, 549 579, doi: 10.1016/s0734 9750(00)00050 1.
dynamics and catalytic properties of a multi modular xan
3.
Benny, I. S., Gunasekar, V., and Ponnusami, V. (2014)
thanase, ACS Catal., 8, 6021 6034.
Review on application of xanthan gum in drug delivery, Int.
10. Slobodkina, G. B., Kovaleva, O. L., Miroshnichenko,
J. Pharmtech Res., 6, 1322 1326.
M. L., Slobodkin, A. I., Kolganova, T. V., et al. (2014)
4.
Nankai, H., Hashimoto, W., Miki, H., Kawai, S., and
Thermogutta terrifontis gen. nov., sp. nov. and Thermogutta
Murata, K. (1999) Microbial system for polysaccharide
hypogea sp. nov., thermophilic anaerobic representatives of
depolymerization: enzymatic route for xanthan depoly
the phylum Planctomycetes, Int. J. System. Evol. Microbiol.,
merization by Bacillus sp. strain GL1, Appl. Environ.
65, 760 765, doi: 10.1099/ijs.0.000009.
Microbiol., 65, 2520 2526.
11. Aslanidis, C., and de Jong, P. J. (1990) Ligation indepen
5.
Liu, H., Huang, Ch., Dong, W., Du, Y., Bai, X., and Li, X.
dent cloning of PCR products (LIC PCR), Nucleic Acids
(2005) Biodegradation of xanthan by newly isolated
Res., 18, 6069 6074.
Cellulomonas sp. LX, releasing elicitor active xantho
12. Sambrook, J., and Russell, D. (2001) Molecular Cloning, a
oligosaccharides induced phytoalexin synthesis in soybean
Laboratory Manual, Cold Spring Harbor Laboratory.
cotyledons, Process Biochemistry, 40, 3701 3706.
13. Aleksenko, A., Makarova, N., Nikolaev, I., and
6.
Cadmus, M., Jackson, L., Kermita, A., Burton, E.,
Clutterbuc, K. A. (1995) Integrative and replicative trans
Plattner, R., and Slodki, M. (1981) Biodegradation of
formation of Penicillium canescens with a heterologous
xanthan gum by Bacillus sp., Appl. Environ. Microbiol., 44,
nitrate reductase gene, Curr. Genet., 28, 474 478.
5 11.
14. Досон Р., Эллиот Д., Эллиот У., Джонс К. (1991) Спра
7.
Elcheninov, A. G., Menzel, P., Soley Gudbergsdottir, R.,
вочник биохимика, Мир, Москва, c. 544.
Slesarev, A. I., Kadnikov, V. V., et al. (2017) Sugar metabo
15. Somogyi, M. (1952) A new reagent for the determination
lism of the first thermophilic planctomycete Thermogutta
of sugars, J. Biol. Chem., 195, 19 23.
terrifontis: comparative genomic and transcriptomic
16. Синицын А. П., Гусаков А. В., Черноглазов В. М.
approaches, Front. Microbiol., 8, 2140, doi: 10.3389/fmicb.
(1995) Биоконверсия лигноцеллюлозных материалов.
2017.02140.
Учебн. пособие, Изд во МГУ, Москва, с. 224.
БИОХИМИЯ том 86 вып. 4 2021
ГЕТЕРОЛОГИЧНАЯ ЭКСПРЕССИЯ ЭНДО КСАНТАНАЗЫ
583
HETEROLOGOUS EXPRESSION OF ENDO XANTHANASE
Thermogutta terrifontis IN Penicillium verruculosum,
ISOLATION AND PRIMARY CHARACTERIZATION OF THE ENZYME
Y. A. Denisenko1*, O. G. Korotkova1, I. N. Zorov1,2, A. M. Rozhkova1,2, M. V. Semenova1,
A. G. Elcheninov1, I. V. Kublanov1, and A. P. Sinitsyn1,2
1 Federal Research Centre «Fundamentals of Biotechnology» of the Russian Academy of Sciences,
119071 Moscow, Russia; E*mail: denisenkoyura@mail.ru
2 Department of Chemistry, Lomonosov Moscow State University, 119991 Moscow, Russia
Heterologous endo xanthanase (EX) from the thermophilic planktomycete Thermogutta terrifontis strain was obtained
using Penicillium verruculosum 537 (ΔniaD) expression system with the cellobiohydrolase 1 gene promoter.
Homogeneous EX with a molecular weight of 23.7 kDa (pI 6.5) was isolated using liquid chromatography methods.
This xanthan degrading enzyme also possesses the enzymatic activity towards CM cellulose, β glucan, curdlan,
lichenan, laminarin, galactomannan, xyloglucan but not towards p nitrophenyl derivatives of β D glucose, mannose
and cellobiose. The temperature and pH optima of EX were 55°C and 4.0, respectively; the enzyme exhibited 90% of
its maximum activity in the temperature range 50 60°C and pH 3 5.
Keywords: endo xanthanase, Thermogutta terrifontis, Penicillium verruculosum, heterologous expression, destruction of
xanthan
БИОХИМИЯ том 86 вып. 4 2021