БИОХИМИЯ, 2021, том 86, вып. 4, с. 584 - 594
УДК 615+616 05
АНТИОКСИДАНТНЫЕ СВОЙСТВА ГАЛАНИНА
И ЕГО N КОНЦЕВЫХ ФРАГМЕНТОВ ПРИ МОДЕЛИРОВАНИИ
ОКИСЛИТЕЛЬНОГО СТРЕССА in vitro И in vivо*
© 2021
О.И. Писаренко**, И.М. Студнева, Л.И. Серебрякова, А.А. Тимошин,
Г.Г. Коновалова, В.З. Ланкин, А.К. Тихазе, О.М. Веселова, И.В. Доброхотов,
Р.О. Любимов, М.В. Сидорова, М.Е. Палькеева, А.С. Молокоедов
ФГБУ «НМИЦ кардиологии» Минздрава РФ, 121552 Москва, Россия; электронная почта: olpi@live.ru
Поступила в редакцию 21.12.2020
После доработки 04.02.2021
Принята к публикации 08.02.2021
Антиоксидантные свойства галанина крысы GWTLNSAGYLLGPHAIDNHRSFSDKHGLT NH2 (Gal), N
концевого фрагмента галанина (2-15 а. о.) WTLNSAGYLLGPHA (G1) и его модифицированного аналога
WTLNSAGYLLGPβAH (G2) изучены на моделях региональной ишемии и реперфузии сердца крысы in vivo
и Сu2+ индуцированного свободнорадикального окисления липопротеидов низкой плотности в плазме че
ловека in vitro. Пептиды получены автоматическим твердофазным синтезом с использованием Fmoc мето
дологии. Их структура охарактеризована с помощью 1Н ЯМР спектроскопии и MALDI TOF масс спект
рометрии. Полученные данные о влиянии пептидов показали, что внутривенное введение G1, G2 и Gal
крысам после индуцированной ишемии уменьшало размеры инфаркта миокарда и активность маркеров
некроза, креатинкиназы МВ и лактатдегидрогеназы, в плазме крови к концу реперфузии. G1, G2 и Gal сни
жали образование спинового аддукта гидроксильных радикалов в интерстиции зоны риска сердца при ре
перфузии; более того, G2 и Gal также снижали образование вторичных продуктов перекисного окисления
липидов в реперфузированном миокарде. В экспериментах in vivo и in vitro показано, что способность пеп
тидов галанина снижать продукцию АФК и ингибировать перекисное окисление липидов при реперфузи
онном повреждении миокарда не связана напрямую с их влиянием на активность ферментов антиоксидант
ной защиты - Сu,Zn супероксиддисмутазы, каталазы и глутатионпероксидазы. Пептиды G1, G2 и Gal в
концентрации 0,01 и 0,1 мМ ингибировали Сu2+ индуцированное свободнорадикальное окисление липо
протеидов низкой плотности человека in vitro. Полученные при моделировании окислительного стресса ре
зультаты показывают, что природные и синтетические агонисты рецепторов галанина снижают продукцию
короткоживущих АФК в сердце, а также липидных радикалов в плазме крови. Таким образом, рецепторы
галанина могут быть перспективной терапевтической мишенью при сердечно сосудистых заболеваниях.
КЛЮЧЕВЫЕ СЛОВА: галанин, сердце, ишемия и реперфузия, некроз, перекисное окисление липидов, ан
тиоксидантные ферменты, мембраны кардиомиоцитов.
DOI: 10.31857/S0320972521040102
ВВЕДЕНИЕ
развитии алкогольной зависимости и невропа
тической боли. В периферических органах,
Нейропептид галанин, состоящий у крысы
включая сердце, действие галанина опосредова
из 29 аминокислотных остатков (а. о.) (из 30 - у
но не только нейрональными механизмами, но
человека), участвует в жизненно важных про
и активацией трансмембранных рецепторов
цессах - запоминания, потребления пищи, за
GalR1, GalR2 и GalR3 [1]. За связывание с ре
сыпания, продукции ряда гормонов; на клеточ
цепторами отвечает N концевой фрагмент пеп
ном уровне - в поддержании ионного гомеоста
тида, первые 15 а. о. которого консервативны и
за и осмоса. Этот пептид также играет роль в
сохраняются у большинства видов. Роль рецеп
Принятые сокращения: АФК - активные формы кислорода; ДМПО - 5,5 диметил 1 пирролин N оксид; ДМСО -
диметилсульфоксид; ЗР - зона риска; И/Р - ишемия/реперфузия; ИМ - инфаркт миокарда; КК МВ - креатинкиназа
МВ; ЛДГ - лактатдегидрогеназа; ЛЖ - левый желудочек; ЛНП - липопротеиды низкой плотности; ПНА - передняя
нисходящая коронарная артерия; ПОЛ - перекисное окисление липидов; BHT - бутилированный гидрокситолуол;
CAT - каталаза; Cu,Zn SOD - Cu,Zn супероксиддисмутаза; GSH Px - глутатионпероксидаза.
biokhimiya, в рубрике «Papers in Press», BM20 393, 25.03.2021.
** Адресат для корреспонденции.
584
ВЛИЯНИЕ ПЕПТИДОВ ГАЛАНИНА НА ОКИСЛИТЕЛЬНЫЙ СТРЕСС
585
торов галанина в регуляции сердечно сосудис
татионпероксидазы (GSH Px) в поврежденном
той системы в норме и при патологии малоизу
миокарде, а также улучшением энергетического
чена. Исследования последних лет показали,
обеспечения кардиомиоцитов. Настоящая рабо
что запуск сигнального пути через рецептор
та является продолжением исследования анти
GalR2 N концевыми фрагментами галанина
оксидантных свойств лигандов рецепторов гала
H Trp Thr Leu Asn Ser Ala Gly Tyr Leu Leu OH
нина. Цели данной работы: (1) изучение дей
(2-11) и H Trp Thr Leu Asn Ser Ala Gly Tyr
ствия синтетического пептида G2, природного
Leu Leu Gly Pro His Ala OH (2-15) (G1) инги
фрагмента галанина (2-15) G1, и полноразмер
бирует апоптоз при гипоксии/реоксигенации
ного галанина крысы (1-29) (Gal) на активность
изолированных кардиомиоцитов крысы и кар
Cu,Zn SOD, GSH Px и каталазы (СAT), образо
диомиобластов клеточной линии H9c2 благода
вание активных форм кислорода (АФК) и про
ря снижению продукции супероксидного анион
дуктов ПОЛ в ишемизированном сердце крысы
радикала и пероксида водорода в митохондриях
in vivo; (2) изучение действия указанных пепти
[2, 3]. Оба пептида способствуют метаболичес
дов на активность ферментов Cu,Zn SOD,
кому и функциональному восстановлению
GSH Px и СAT в модельных системах in vitro;
сердца крысы после повреждения, индуциро
(3) оценка влияния пептидов на уровень свобод
ванного ишемией/реперфузией (И/Р) ex vivo и
норадикального окисления липопротеидов низ
in vivo. Благодаря указанным выше свойствам
кой плотности (ЛНП) при его индукции in vitro с
пептидов, становится перспективной возмож
помощью Сu2+.
ность использования фармакологических аго
нистов рецепторов галанина для уменьшения
повреждения ишемизированного сердца. Для
МАТЕРИАЛЫ И МЕТОДЫ
оптимизации физико химических свойств
фрагментов галанина мы синтезировали ряд мо
Пептиды галанина. В работе использованы
дифицированных аналогов пептида G1 с сохра
Gal и его N концевые фрагменты G1 и G2, по
нением фармакофорных а. о., ответственных за
лученные путём ступенчатого твердофазного
связывание с рецептором GalR2. Общая форму
синтеза с использованием Fmoc методологии в
ла этих пептидов - Trp Thr Leu Asn Ser Ala
лаборатории синтеза пептидов ФГБУ «НМИЦ
Gly Tyr Leu X Gly Pro Y, где X = Leu, Y = His
кардиологии» МЗ РФ [5, 7]. Их очистка прове
Ala NH2; или X = Nle, Y = His Arg OH; или
дена методом высокоэффективной жидкостной
X = Leu, Y = βAla His OH (G2). Изучение этих
хроматографии на обращённой фазе, структура
пептидов на моделях И/Р повреждения сердца
охарактеризована с помощью 1Н ЯМР спект
продемонстрировало их кардиотропные свой
роскопии и MALDI TOF (Matrix assisted laser
ства [4]. Наиболее эффективной оказалась хи
desorption/ionization time of flight) масс спект
мерная молекула G2, представляющая собой
рометрии. Характеристики пептидов представ
последовательность галанина (2-13), дополнен
лены в таблице 1.
ную природным дипептидом карнозином, H
Модельные животные. Для изучения влияния
Trp Thr Leu Asn Ser Ala Gly Tyr Leu Leu Gly
пептидов на сердце при ишемии и реперфузии
Pro βAla His OH [5]. В недавнем исследовании,
использовали самцов крыс Wistar (массой
выполненном на крысах с кардиомиопатией,
300-350 г). Животных содержали в виварии в
вызванной введением доксорубицина, приме
условиях естественного освещения и свободно
нение пептида G2 уменьшало дисфункцию
го доступа к воде и корму. Все применимые меж
сердца [6]. Защитный эффект сопровождался
дународные, национальные и/или институцио
снижением перекисного окисления липидов
нальные принципы ухода за лабораторными
(ПОЛ) вследствие увеличения активности
животными и их использования в эксперимен
Cu,Zn супероксиддисмутазы (Cu,Zn SOD) и глу
тах были соблюдены.
Таблица 1. Характеристики пептидов галанина
Пептид
Последовательность
Мол. вес, г/моль
MALDI TOF, m/z
Gal
GWTLNSAGYLLGPHAIDNHRSFSDKHGLT NH2
3164,4
3163,47
G1
WTLNSAGYLLGPHA
1499,7
1499,72
G2
WTLNSAGYLLGPβAH
1499,7
1499,76
Примечание. Замены аминокислот показаны жирным шрифтом.
9 БИОХИМИЯ том 86 вып. 4 2021
586
ПИСАРЕНКО и др.
Модель региональной ишемии и реперфузии у
В каждой группе рассчитывали отношение «зо
крыс in vivo. Крыс Wistar наркотизировали 20%
на риска/вес левого желудочка» (ЗР/ЛЖ) и «ин
ным уретаном (1200 мг/кг веса внутрибрюшин
фаркт миокарда/зона риска» (ИМ/ЗР), выра
но) и в условиях торакотомии осуществляли ис
женное в процентах [8].
кусственную вентиляцию лёгких комнатным
Оценка повреждения клеточных мембран.
воздухом с помощью аппарата KTR 5 («Hugo
Повреждение мембран кардиомиоцитов оцени
Sacks Electronik», Германия). Яремную вену ка
вали по увеличению активности лактатдегидро
тетеризировали для окрашивания сердца 1%
геназы (ЛДГ) и креатинкиназы МВ (КК МВ) в
ным раствором Эванса в конце процедуры, сон
плазме крови. Около 0,5 мл крови собирали в ге
ную артерию - для регистрации артериального
паринизированные пробирки из венозного ка
давления. Регистрацию систолического артери
тетера крысы в исходном состоянии (перед ок
ального давления (САД) и частоты сердечных
клюзией ПНА) и после часа реперфузии. Актив
сокращений (ЧСС) проводили на полиграфе
ность ферментов в плазме определяли на спект
Biograph 4 (Санкт Петербургский госуниверси
рофотометре UV 1800 («Shimadzu», Япония)
тет аэрокосмического приборостроения, Рос
при λ = 340 нм с использованием наборов
сия) при присоединении артериального катете
«BioSystems SA» (Испания).
ра к тензометрическому датчику. Запись на
Определение активности антиоксидантных
компьютер выполнена с помощью аналого
ферментов и содержания продуктов свободнора
цифрового преобразователя USB 6210 и прог
дикального окисления липидов в ЗР. Ткань зоны
раммы LabView 7 («National Instruments», США)
риска сердца крысы, замороженную в жидком
[5]. По окончании подготовки животного следо
азоте, гомогенизировали в 50 мМ натрий фос
вал 30 минутный период стабилизации гемоди
фатном буфере (рН 7,4; вес/объем 1 : 10) при
намических показателей (далее - «исходное
помощи гомогенизатора Ultra Turrax T18 («IKA
состояние»), затем проводилась окклюзия пе
Werke», Германия) и центрифугировали на
редней нисходящей коронарной артерии (ПНА)
Sigma 3 16KL (Германия) при 1000 g и 4 °С в те
в течение 40 мин, после чего следовал период
чение 10 мин. В супернатанте определяли со
реперфузии в течение 60 мин. В эксперимен
держание вторичных продуктов ПОЛ (реагиру
тальной серии после периода региональной
ющих с 2 тиобарбитуровой кислотой - TBARS)
ишемии внутривенно болюсом вводили пепти
и активность антиоксидантных ферментов
ды Gal, G1 и G2 в дозах 0,25; 0,5; 1,0; 2,0 или
(Cu,Zn SOD, GSH Px и CAT). Активность
3,0 мг/кг веса одновременно с началом репер
Cu,Zn SOD определяли по ингибированию
фузии; в контрольной серии опытов - такой же
восстановления п нитротетразолия синего су
объём физиологического раствора (0,5 мл). В
пероксидным радикалом, генерируемым в сис
отдельной серии экспериментов было исследо
теме ксантин-ксантиноксидаза. Кинетику об
вано влияние растворителя пептидов 0,2% ного
разования формазана регистрировали на спект
раствора диметилсульфоксида (ДМСО) на раз
рофотометре UV 2600 («Shimadzu», Япония)
меры инфаркта миокарда (ИМ). В конце проце
при 560 нм. За единицу активности Cu,Zn SOD
дуры для идентификации зоны риска (ЗР) и ин
принимали количество фермента, необходимое
тактной области миокарда реокклюдировали
для
50% ного подавления восстановления
ПНА и в яремную вену вводили болюсно 2%
п нитротетразолия синего; результаты выража
ный раствор Эванса (2 мл). Затем сердце выре
ли в ед. акт./мг белка [9]. Активность CAT опре
зали и выделяли левый желудочек (ЛЖ) для пос
деляли по скорости расходования H2O2 при
ледующего определения размеров ИМ.
20 °C в течение 1 мин. Измерения проводили
Оценка некротической гибели кардиомиоци
при 240 нм на спектрофотометре UV 2600. При
тов в зоне риска. Степень некроза кардиомиоци
расчете активности использовали коэффициент
тов в ЗР определяли по площади ИМ методом
молярной экстинкции пероксида водорода
компьютерной планиметрии с помощью прог
ε = 43,6 М-1⋅см-1. За единицу активности при
раммы ImageJ (NIH, США). Замороженный ЛЖ
нимали количество фермента, необходимое для
разрезали перпендикулярно длинной оси сердца
утилизации 1 мкмоль H2O2 в минуту; результаты
на 4-5 срезов толщиной ≈ 1,5-2,0 мм, которые
также выражали в ед. акт./мг белка [10]. Актив
затем инкубировали 10 мин в 1% ном растворе
ность GSH Px определяли в сопряженной сис
2,3,5 трифенилтетразолий хлорида в 0,1 М ка
теме глутатион-глутатионредуктаза по окисле
лий фосфатном буфере (рН 7,4 при 37 °С) и
нию NADPH, используя гидропероксид трет
фиксировали в 10% ном формалине. Получен
бутила в качестве субстрата. Скорость окисле
ные образцы сканировали для определения пло
ния NADPH (λ = 340 нм) определяли в термо
щади ИМ и ЗР на сохраненных изображениях.
статируемой 9 канальной кювете при 30 °С на
Срезы взвешивали для определения массы ЛЖ.
химическом анализаторе FP 900 («Labsystems
БИОХИМИЯ том 86 вып. 4 2021
ВЛИЯНИЕ ПЕПТИДОВ ГАЛАНИНА НА ОКИСЛИТЕЛЬНЫЙ СТРЕСС
587
Oy», Финляндия). За единицу активности при
спектрофотометре UV 2600. Степень ингибиро
нимали количество фермента, необходимое для
вания свободнорадикального окисления ЛНП
окисления 1 мкмоль восстановленного глутати
характеризовали продолжительностью периода
она в условиях определения; результаты выра
индукции (лаг фазы) окисления (τ), за который
жали в ед. акт./мг белка [11]. В супернатанте го
принимали время достижения оптической плот
могената сердечной мышцы белки осаждали
ности при λ = 233 нм на кинетических кривых
10% ной трихлоруксусной кислотой (1 : 1) и оп
окисления ЛНП, равное 0,15 (ΔD233 = 0,15)
ределяли содержание вторичных продуктов
[13]. В референсную пробу вносили 0,01 мМ
ПОЛ по реакции с 2 тиобарбитуровой кисло
синтетического фенольного антиоксиданта, бу
той, анализируя количество образовавшегося
тилированного гидрокситолуола (BHT) в раст
триметинового комплекса при λ = 532 нм на
воре этанола (конечное содержание этанола
спектрофотометре UV 2600 [12].
0,25%). Предварительно было показано, что
Оценка влияния пептидов на активность анти
внесение 0,25% ного этанола в пробу не влияет
оксидантных ферментов. Коммерческие препа
на продолжительность лаг фазы при окислении
раты Cu,Zn SOD и GSH Px из бычьих эритро
ЛНП без других добавок.
цитов и CAT из бычьей печени («Sigma», CША)
Мониторирование продукции АФК в ЗР серд
растворяли в 50 мМ фосфатном буфере рН 7,4 в
ца крысы с помощью спиновой ловушки. Для ре
концентрации 250 мкг/мл. Активность фермен
гистрации уровня короткоживущих кислород
тов составила
145,3
±
3,19;
462,8
± 43,07;
ных радикалов в зоне риска ЛЖ использовали
12,73 ± 0,45 ед./мл соответственно. Затем в раст
метод микродиализа и спиновую ловушку 5,5
вор, содержащий ферменты, вводили растворы
диметил 1 пирролин N оксид (ДМПО). Это
пептидов G1, G2 и Gal в 50 мМ фосфатном бу
соединение способно эффективно взаимодей
фере рН 7,4 до конечных концентраций 0,01 и
ствовать как с супероксидными, так и с гидрок
0,1 мМ и инкубировали полученные смеси при
сильными радикалами с образованием относи
4 °С в течение 24 ч. После окончания инкубации
тельно стабильных спиновых аддуктов, регист
активность Cu,Zn SOD, CAT и GSH Px опреде
рируемых методом электронного парамагнит
ляли согласно описанным методикам [9-11].
ного резонанса (ЭПР) [14]. В область регио
Исследование влияния пептидов на свободно
нальной ишемии имплантировали микродиа
радикальное окисление ЛНП человека. Для пре
лизное волокно (внешний диаметр 0,25 мм,
паративного выделения липопротеидов низкой
проницаемое для веществ с молекулярной мас
плотности (ЛНП) плазму крови доноров, содер
сой < 5 кДа), которое с помощью микронасоса
жащую 1 мг/мл ЭДТА, подвергали двукратному
перфузировали со скоростью 3 мкл/мин раство
центрифугированию в градиенте плотности
ром Рингера (рН 7,4 при 37 °С) с содержанием
1,019-1,063 г/см3 NaBr в течение 2 ч при скорос
100 мМ ДМПО. Вытекающий диализат собира
ти 42 000 об./мин в угловом роторе 50Ti при 4 °С
ли последовательными фракциями по 20 мин в
в рефрижераторной ультрацентрифуге Optima
пластиковые пробирки, охлаждённые до 0 °С.
XPN 80 («Beckman Coulter», США) согласно
Образцы диализатов замораживали и хранили в
описанной методике [13]. Полученные ЛНП ди
жидком азоте. Спектры ЭПР образцов диализа
ализовали в изотоничном (0,154 М NaCl) 50 мМ
та, содержащего спиновую ловушку ДМПО, ре
K,Na фосфатном буфере pH 7,4 при 4 °С в тече
гистрировали на спектрометре Х диапазона
ние 16 ч. Короткое время центрифугирования
Е 109Е («Varian», США) при комнатной темпе
позволяет избежать окисления нативных ЛНП в
ратуре. Амплитуда высокочастотной модуляции
процессе выделения. При электрофорезе в об
магнитного поля составляла 0,1 мТл при часто
разцах ЛНП, полученных описанным методом,
те 100 кГц. Частота СВЧ поля спектрометра со
не было выявлено существенных загрязнений
ставляла 9,14 ГГц, а его мощность устанавлива
другими фракциями липопротеидов или белка
лась на уровне 10 мВт. Сканирование магнитно
ми плазмы.
го поля при записи сигналов осуществлялось с
После диализа содержание белка в образцах
центром при g = 2,00.
ЛНП определяли по методу Лоури. Затем пробы
Статистическая обработка данных. Для обра
белка разбавляли до 50 мкг/мл раствором, со
ботки полученных данных использовали пакет
держащим 0,154 М NaCl в 50 мМ K,Na фосфат
программ SigmaPlot 11.2 («SysStat», США). Ре
ном буфере рН 7,4, добавляли пептиды галани
зультаты представлены как среднее значе
на в концентрациях 0,01 и 0,1 мМ. Окисление
ние ± стандартная ошибка среднего значения
ЛНП индуцировали при
37
°С введением
(M ± SEM). При сравнении нескольких групп с
30 мкМ CuSO4*5H2O, после чего через фиксиро
контролем использовали t критерий Стьюдента
ванные интервалы времени измеряли накопле
с поправкой Бонферрони. Статистически зна
ние липогидропероксидов при λ = 233 нм на
чимыми считали отличия при p < 0,05.
БИОХИМИЯ том 86 вып. 4 2021
9*
588
ПИСАРЕНКО и др.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Влияние пептидов на И/Р повреждение сердца
у крыс in vivo. Гистохимический анализ срезов
ЛЖ после реперфузии не выявил достоверных
различий в размерах ЗР между контролем, пеп
тидами галанина и 0,2% ным ДМСО. Для ис
следованных групп величина ЗР/ЛЖ в среднем
составляла 40,5 ± 1,3%, что свидетельствует о
единообразии моделирования И/Р поврежде
ния у всех животных. В контроле величина ИМ,
выраженная отношением ИМ/ЗР в процентах,
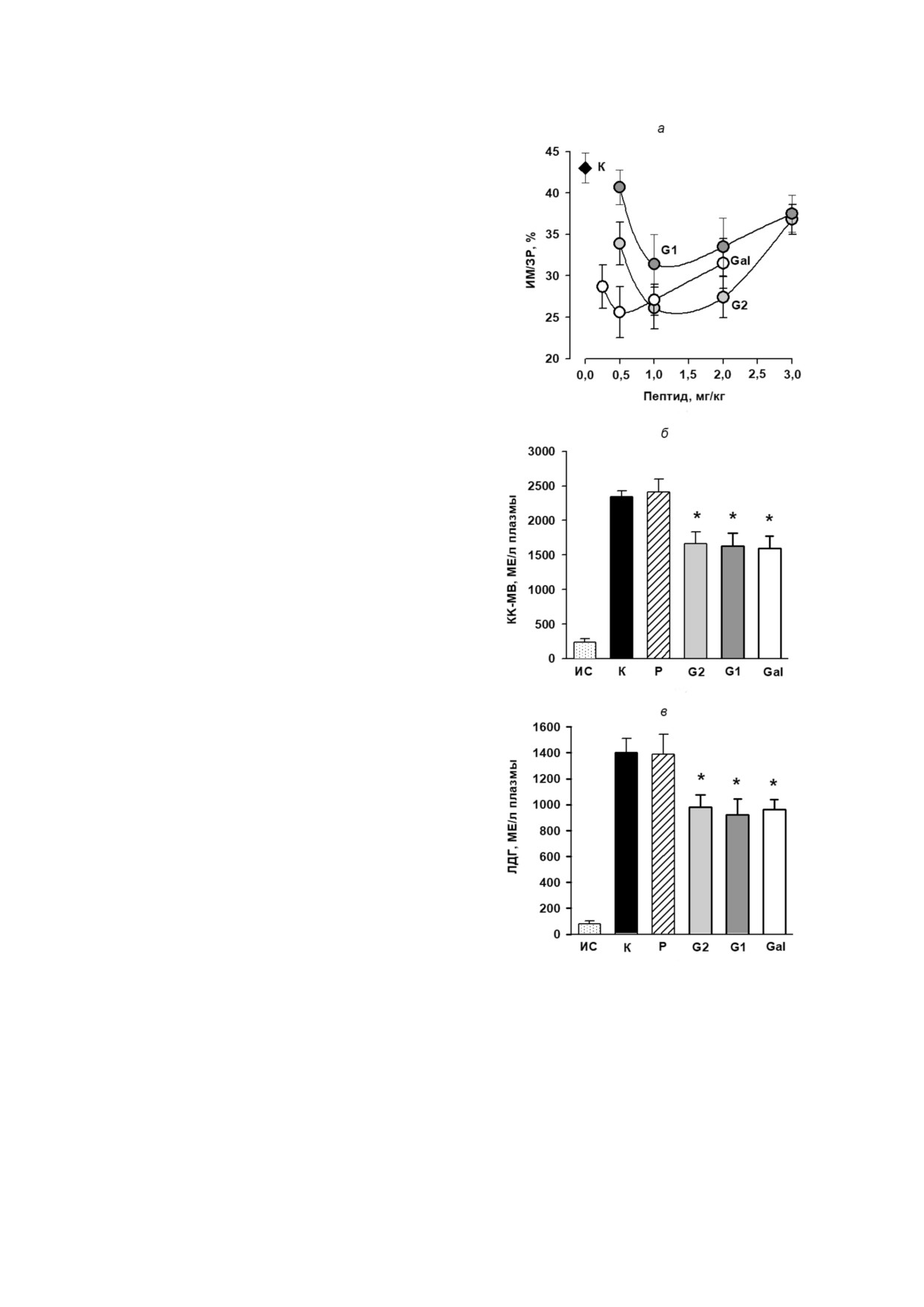
составляла 43,0 ± 2,0% (рис. 1, а). Введение
0,2% ного ДМСО не влияло на размеры ИМ - в
этом случае отношение ИМ/ЗР составляло
41,6 ± 3,1%. В то же время внутривенное введе
ние каждой из исследованных доз пептидов
приводило к уменьшению размеров ИМ. Опти
мальная доза для Gal составила 0,5 мг/кг, для G1
и G2 - 1,0 мг/кг. Использование этих доз Gal и
G2 снижало размеры ИМ в среднем на 40%,
G1 - на 27% по сравнению с контролем
(p < 0,001). Развитие ИМ в контроле к концу ре
перфузии сопровождалось значительным увели
чением активности КК МВ и ЛДГ в плазме по
сравнению с исходным состоянием (рис. 1, б, в).
Введение 0,2% ного ДМСО не влияло на актив
ность обоих ферментов по сравнению с контро
лем. Введение оптимальных доз пептидов Gal,
G1 и G2 уменьшало активность ЛДГ и КК МВ к
окончанию реперфузии в среднем на 30% по
сравнению с контролем (p < 0,01). Эти данные
отражают снижение уровня некроза кардиомио
цитов в ЗР под действием галанина и его N кон
цевых фрагментов. В дальнейшем на этой моде
ли были использованы указанные выше опти
мальные концентрации пептидов.
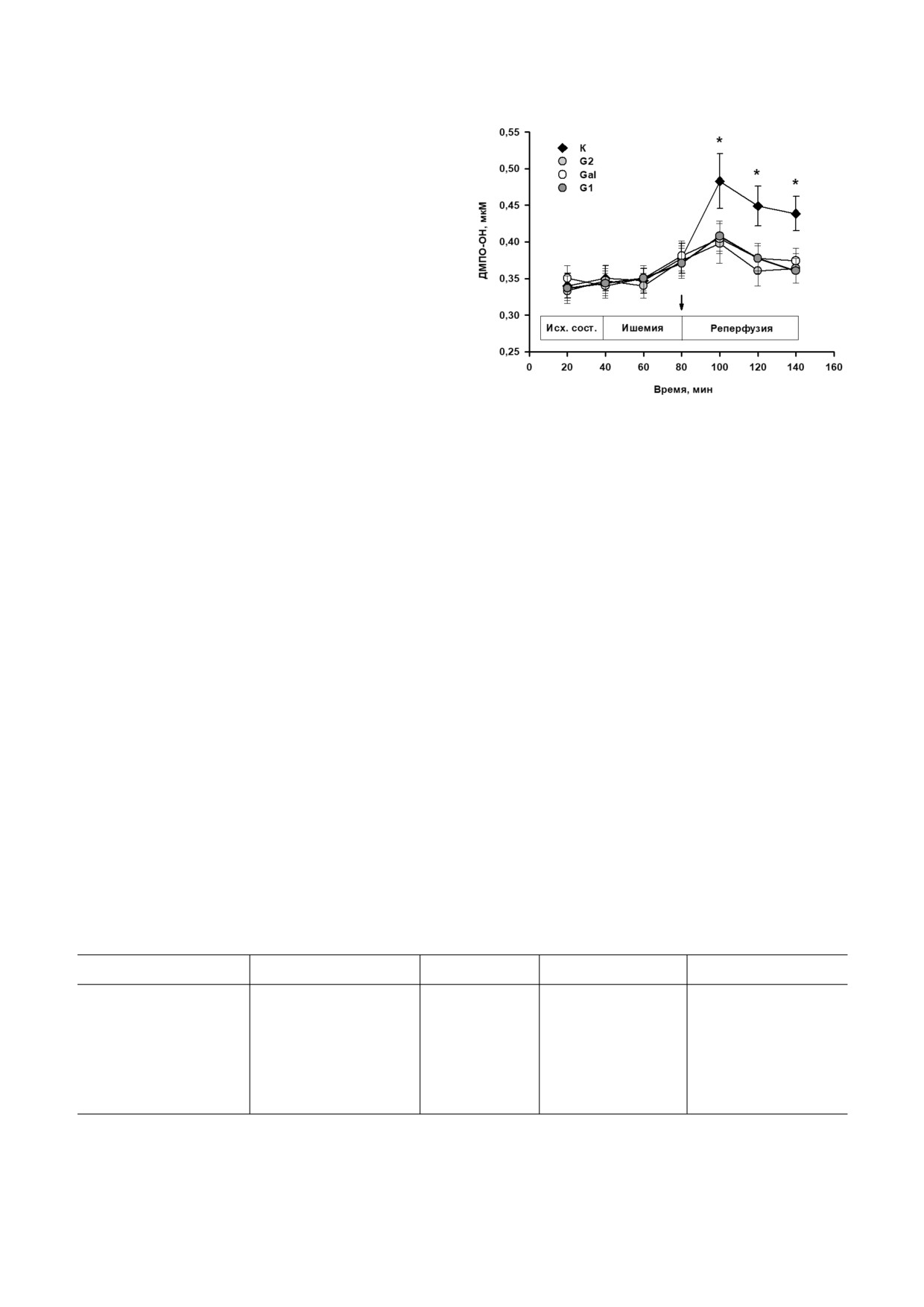
Влияние пептидов на продукцию АФК в ЗР
сердца крысы. Регистрируемые спектры ЭПР об
разцов диализата состояли из четырёх узких эк
видистантных линий, соотношение амплитуд
которых составило 1 : 2 : 2 : 1, характерных для
парамагнитного аддукта ДМПО OH, образую
щегося в результате взаимодействия ДМПО и
гидроксида [14]. На рисунке 2 представлены из
менения в содержании аддукта ДМПО OH в об
разцах диализата в ходе эксперимента. Видно,
что в контроле после 40 минутной окклюзии
Рис. 1. Влияние внутривенного введения пептидов галани
на на показатели И/Р повреждения сердца у крыс in vivo.
коронарной артерии содержание ДМПО OH в
а - Дозозависимое действие пептидов Gal, G1 и G2 на раз
диализате увеличивалось, отражая увеличение
меры инфаркта миокарда (ИМ/ЗР, %): К - контроль,
уровня АФК в интерстиции ЗР. Это может быть
ИМ - инфаркт миокарда, ЗР - зона риска. Влияние опти
связано с существенным возрастанием скорости
мальных доз пептидов на активность КК МВ (б) и ЛДГ (в)
генерации АФК в дыхательной цепи митохон
в плазме крови крыс в конце реперфузии: ИС - исходное
состояние, К - контроль (введение физиологического
дрий при восстановлении кровотока в ЗР. Введе
раствора), P - растворитель 0,2% ДМСО, пептиды G1
ние пептидов G1, G2 или Gal перед реперфузи
(1 мг/кг), G2 (1 мг/кг), Gal (0,5 мг/кг). Данные представле
ей достоверно снижало содержание ДМПО OH
ны как M ± SEM для каждой группы из 8 животных.
по сравнению с контролем (p < 0,01). Эти дан
* - Достоверное отличие от К и Р (p < 0,01)
БИОХИМИЯ том 86 вып. 4 2021
ВЛИЯНИЕ ПЕПТИДОВ ГАЛАНИНА НА ОКИСЛИТЕЛЬНЫЙ СТРЕСС
589
ные указывают на снижение продукции АФК в
реперфузированной области сердца под
действием пептидов галанина.
Влияние пептидов на активность антиоксидант
ных ферментов и содержание продуктов ПОЛ в
ЗР сердца крысы. В контроле (после региональ
ной ишемии и реперфузии сердца без введения
пептидов) активности Cu,Zn SOD, CAT и
GSH Px в ЗР не отличались от значений в ис
ходном состоянии (табл.
2). Активность
Cu,Zn SOD под действием G2 и Gal в ЗР к
окончанию реперфузии не изменялась, введе
ние G1 приводило к ее снижению. Активность
CAT достоверно не изменялась под действием
пептидов галанина. Активность GSH Px в ЗР по
сравнению с контролем достоверно увеличива
Рис. 2. Влияние пептидов галанина на концентрацию ад
лась при введении пептидов G2 и Gal, тогда как
дукта ДМПО ОН в интерстиции ЗР сердца крысы: К -
введение G1 воздействия не оказывало. Под
контроль (введение физиологического раствора), пептиды
влиянием региональной ишемии и реперфузии
G1 (1 мг/кг), G2 (1 мг/кг), Gal (0,5 мг/кг). Данные пред
сердца в контроле содержание TBARS в ЗР воз
ставлены как M ± SEM для каждой группы из 5 животных.
* - Достоверное отличие от G1, G2 и Gal (p < 0,01); стрел
растало вдвое по сравнению с исходным значе
кой указан момент введения пептидов
нием. Введение G2 и Gal заметно снижало на
копление TBARS в ЗР к концу реперфузии, G1
не оказывал влияния на этот показатель. Таким
миоцитов [15], может способствовать переносу
образом, под действием пептидов G2 и Gal про
экзогенных пептидов галанина из кровотока во
исходило снижение образования продуктов
внутриклеточное пространство. Это не исклю
ПОЛ в реперфузированном миокарде, несмотря
чает непосредственного взаимодействия пепти
на отсутствие влияния на активность
дов с антиоксидантными ферментами миокар
Cu,Zn SOD и CAT, и незначительное увеличе
да. Такая ситуация была смоделирована нами
ние активности GSH Px. Почти двукратное
инкубацией пептидов G1, G2 и Gal с коммер
снижение активности Cu,Zn SOD, вызванное
ческими ферментами Cu,Zn SOD, GSH Px и
введением G1, не влияло на интенсивность
CAT в модельных системах in vitro. При выборе
ПОЛ в ЗР по сравнению с контролем. Эти дан
концентраций пептидов в инкубационной среде
ные показывают, что наблюдаемые изменения
мы руководствовались следующими соображе
ПОЛ в реперфузированной области сердца под
ниями. Оптимальная доза G1 и G2 для внутри
действием пептидов не связаны непосредствен
венного введения крысе составляет 1 мг/кг,
но с активностью ключевых антиоксидантных
Gal - 0,5 мг/кг. Учитывая молекулярный вес
ферментов.
пептидов (табл. 1) и объем циркулирующей кро
Влияние пептидов галанина на активность
ви (20 мл) в крысе средней массы (350 г), полу
Cu,Zn SOD, GSH Px и CAT in vitro. Реперфузи
чаем, что концентрация пептидов в кровотоке
онное повреждение миокарда, сопровождающе
должна составить 0,012 мМ для G1 и G2 и
еся нарушениями структуры мембран кардио
0,003 мM для Gal. В соответствии с этим для
Таблица 2. Активность антиоксидантных ферментов и содержание TBARS (продуктов ПОЛ) в серд
це крысы
Состояние
Cu,Zn SOD, ед./мг белка
CAT, ед./мг белка
GSH Px, ед./мг белка
TBARS, нмоль/мг белка
Исходное состояние
105,48 ± 6,85
27,26 ± 3,22
0,37 ± 0,03
0,19 ± 0,06
Контроль
123,99 ± 6,25
33,66 ± 1,00
0,27 ± 0,02
0,40 ± 0,03*
G1
67,00 ± 2,86*#
35,10 ± 2,39
0,30 ± 0,02
0,36 ± 0,04*
G2
131,70 ± 14,40
32,11 ± 2,85
0,36 ± 0,01#
0,13 ± 0,01#
Gal
123,84 ± 5,76
27,80 ± 2,65
0,36 ± 0,02#
0,12 ± 0,03#
# Примечание. Приведены данные для серий из 8 экспериментов. * - Достоверное отличие от исходного состояния;
# - достоверное отличие от контроля; (p < 0,05).
БИОХИМИЯ том 86 вып. 4 2021
590
ПИСАРЕНКО и др.
Таблица 3. Влияние пептидов галанина на ак
в условиях in vivo, из приведенных результатов
тивность антиоксидантных ферментов in vitro
следует, что G1, G2 и Gal практически не влия
ют на активность антиоксидантных ферментов.
Условия
Cu,Zn SOD,
GSH Px,
CAT, ед./мл
Влияние пептидов на свободнорадикальное
ед./мл
ед./мл
окисление ЛНП плазмы крови человека. Для изу
чения влияния G1, G2 и Gal на параметры сво
Контроль
145,30 ± 3,19
12,73 ± 0,45
462,84 ± 3,07
боднорадикального окисления липидов был ис
G1, 0,01 мM
135,09 ± 3,41
13,08 ± 0,36
463,12 ± 1,73
пользован разработанный нами ранее кинети
G1, 0,1 мM
148,88 ± 2,83
13,29 ± 0,52
454,33 ± 3,44
ческий метод исследования ингибиторной ак
тивности соединений на модели Cu2+ иници
G2, 0,01 мM
193,73 ± 3,72*
13,82 ± 0,34
443,12 ± 1,77*
ированного окисления природных изолирован
G2, 0,1 мM
180,23 ± 3,36*
13,12 ± 0,10
438,36 ± 2,68*
ных ЛНП плазмы крови здоровых доноров [13].
Gal, 0,01 мM
136,73 ± 1,39
13,58 ± 0,34
470,44 ± 4,90
Известно, что продолжительность периода ин
Gal, 0,1 мM
140,04 ± 3,15
13,17 ± 0,22
465,03 ± 2,85
дукции τ (лаг фаза окисления) определяется
следующим уравнением: τ
= [InH]/w, где
Примечание. Приведены данные для серий из 3 экспери
[InH] - концентрация ингибиторов свободно
ментов. * - Достоверное отличие от контроля (p < 0,05).
радикальных процессов в системе, w - скорость
инициирования окисления [16, 17]. Мы прово
оценки влияния пептидов на активность анти
дили эксперименты с использованием одних и
оксидантных ферментов в инкубационной среде
тех же образцов свежевыделенных ЛНП в стан
мы использовали две концентрации пептидов:
дартных условиях. Очевидно, что концентрация
близкую к физиологической (0,01 мМ) и на по
природных эндогенных ингибиторов свободно
рядок более высокую (0,1 мM) (табл. 3). Из таб
радикальных процессов [InH] в исходных образ
лицы 3 видно, что пептиды G1 и Gal не оказыва
цах ЛНП была идентичной. Стандартной долж
ли влияния на активность антиоксидантных
на быть и скорость инициирования окисления
ферментов при длительной инкубации (разли
изолированных из плазмы крови ЛНП (w), по
чия между опытными и контрольной группами
скольку она зависит от содержания образован
были статистически не достоверны). В то же
ных in vivo липогидропероксидов [LООН]. В
время действие G2 в указанных выше концент
присутствии ионов меди липогидропероксиды
рациях вызывало заметную активацию
подвергаются деструкции с образованием ак
Cu,Zn SOD (на 24 и 34% соответственно), не
тивных липидных радикалов, инициирующих
значительно снижало активность CAT (в сред
дальнейшее окисление ненасыщенного суб
нем на 4,5% независимо от концентрации) и не
страта - полиеновых липидов [18, 19]:
влияло на активность GSH Px. Однако с учетом
того, что использованные в этих модельных
LООН + Cu2+ → LО• + Н+ + Cu+
опытах концентрации пептидов и длительность
их взаимодействия с ферментами маловероятны
LООН + Cu+ → LО• + ОН- + Cu2+
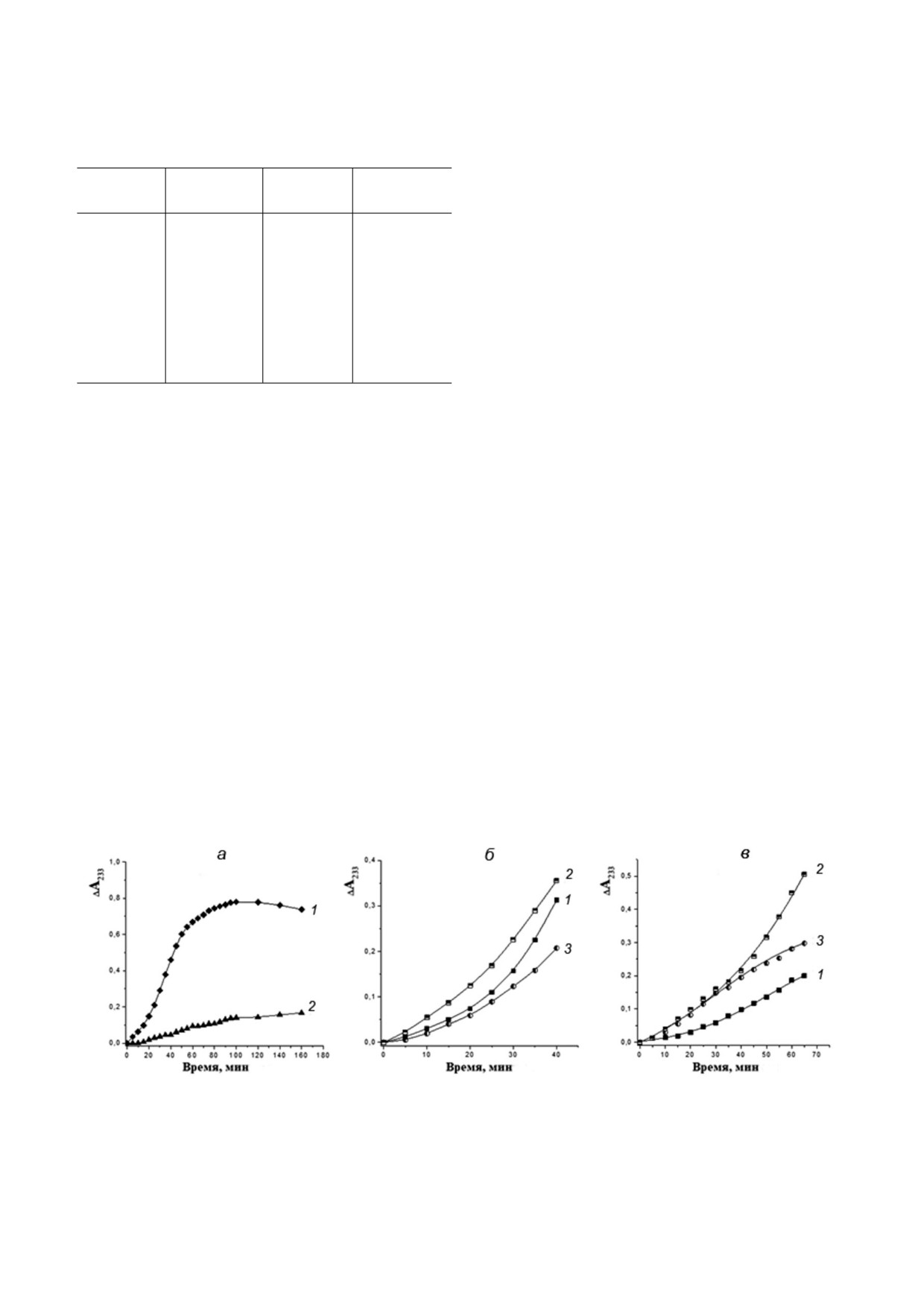
Рис 3. Характерные кинетические кривые Cu2+ инициированного свободнорадикального окисления ЛНП в присутствии
синтетического фенольного антиоксиданта ВНТ и пептидов G1, G2 и Gal. а - Влияние BHT: кривая 1 - контроль (без до
бавок); 2 - в присутствии 0,01 мМ ВНТ. Влияние пептидов: б - в присутствии G1 (кривая 1), G2 (2) и Gal (3) в концент
рации 0,01 мМ; в - в присутствии G1(1), G2 (2) и Gal (3) в концентрации 0,1 мМ
БИОХИМИЯ том 86 вып. 4 2021
ВЛИЯНИЕ ПЕПТИДОВ ГАЛАНИНА НА ОКИСЛИТЕЛЬНЫЙ СТРЕСС
591
Таким образом, продолжительность периода
Таблица 4. Продолжительность периодов индук
индукции окисления ЛНП в наших опытах (τ)
ции свободнорадикального окисления ЛНП
зависела исключительно от антиоксидантной
(τ, мин)
способности внесённых в среду окисления экзо
Концентрация исследуемых веществ
генных пептидов. Результаты проведённых ки
Группы
нетических экспериментов представлены на ри
0,01 мМ
0,1 мМ
сунке 3. Они демонстрируют выраженное инги
бирующее действие синтетического фенольного
Контроль
20 ± 0,2
20 ± 0,2
антиоксиданта, бутилированного гидроксито
G1
29 ± 0,4*
55 ± 0,3*#
луола (BHT) в концентрации 0,01 мМ (рис. 3, а).
G2
23 ± 0,2*
30 ± 0,05*#
Пептиды G1, G2 и Gal в концентрациях 0,01 мМ
и 0,1 мМ также подавляли свободнорадикальное
Ga1
35 ± 0,1*
30 ± 0,1*#
окисление ЛНП (рис. 3, б и в).
BHT
140 ± 0,1*
Вычисленные при анализе кинетических
кривых окисления значения периодов индук
Примечание. *, p < 0,05 по сравнению с контролем;
#, p < 0,05 по сравнению с пептидом в концентрации
ции (τ) представлены в таблице 4. Из приведен
0,01 мМ; n = 3.
ных значений τ следует, что все исследованные
пептиды галанина обладают ингибирующей ак
тивностью по отношению к свободнорадикаль
вание вторичных продуктов ПОЛ в реперфузи
ному окислению липидов. При концентрации
рованном миокарде. Кроме того, все пептиды
0,01 мМ продолжительность периодов индук
галанина ингибировали Сu2+ индуцированное
ции окисления для G1, G2 и Gal была достовер
свободнорадикальное окисление ЛНП человека
но выше контроля на 45, 15 и 75% соответствен
in vitro.
но. Увеличение концентрации пептидов в среде
Как было отмечено выше, введение пепти
инкубации до 0,1 мM приводило к возрастанию
дов G1, G2 и Gal крысам после периода регио
антиоксидантной активности G1 в 2,75, а G2 и
нальной ишемии миокарда существенно снижа
Gal в 1,5 раза по сравнению с контролем, а так
ло образование ДМПО ОН в интерстиции ЗР
же снижению периода индукции для Gal на 25%
ЛЖ при возобновлении кровотока. Образование
по сравнению с этим показателем при концент
этого спинового аддукта в диализном волокне,
рации 0,01 мМ. Результаты экспериментов с ис
вероятно, являлось следствием проникновения
пользованием различных концентраций пепти
в него гидроксильных радикалов, образующихся
дов показывают, что способность ингибировать
при реакции Фентона. Возможно также, что об
свободнорадикальное окисление липидов у этих
разование ДМПО ОН проходило вне диализно
соединений снижалась в ряду G1 > Gal > G2.
го волокна: в этом случае молекулы ДМПО мог
ли проникать в ткань миокарда по градиенту
концентрации через поры в диализаторе, и пос
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
ле взаимодействия с АФК в ткани сердечной
мышцы образовавшийся спиновый аддукт мог
В настоящей работе антиоксидантная актив
возвращаться обратно в диализатор. Нельзя так
ность полноразмерного галанина Gal и его при
же исключать факт взаимодействия молекул ло
родного и химически модифицированного
вушки ДМПО с супероксидными анион ради
N концевого фрагмента (G1 и G2 соответствен
калами с образованием аддукта ДМПО OOH с
но) продемонстрирована на двух моделях окис
последующим его спонтанным переходом в ад
лительного стресса - ишемическом/реперфузи
дукт гидроксида ДМПО OH [20]. Тем не менее
онном повреждении сердца крысы in vivo и сво
полученные методом микродиализа результаты
боднорадикальном окислении ЛНП плазмы
свидетельствуют об уменьшении генерации
крови человека in vitro. Внутривенное введение
АФК в ткани реперфузированного миокарда
пептидов галанина крысам после региональной
под действием пептидов. Они согласуются со
ишемии уменьшало необратимые повреждения
способностью пептида G1 снижать продукцию
зоны риска. Это проявлялось в ограничении
супероксид аниона и пероксида водорода в ми
размера инфаркта миокарда и защите мембран
тохондриях изолированных кардиомиоцитов
кардиомиоцитов - уменьшении активности
при их инкубации в условиях реоксигенации
КК МВ и ЛДГ в плазме крови к концу реперфу
после периода гипоксии [3]. Как известно, гипер
зии. Пептиды G1, G2 и Gal снижали образова
продукция АФК является одним из основных
ние спинового аддукта гидроксильных радика
механизмов повреждения миокарда во время ре
лов ДМПО ОН в интерстиции ЗР при реперфу
перфузии, вызывающим нарушение проницае
зии, при этом G2 и Gal также снижали образо
мости мембран кардиомиоцитов, изменение
БИОХИМИЯ том 86 вып. 4 2021
592
ПИСАРЕНКО и др.
ионного гомеостаза и гибель клеток путем нек
Однако, насколько нам известно, данные о пря
роза и апоптоза [21]. В соответствии с этим сни
мом антиоксидантном действии галанина или
жение образования ДМПО ОН в эксперимен
его биоактивных N концевых фрагментах в ли
тальных группах с введением пептидов G1, G2 и
тературе отсутствуют. Поэтому изучение меха
Gal сопровождалось заметным уменьшением
низмов снижения окислительного стресса в
размеров инфаркта миокарда и снижением ак
сердце с помощью пептидов галанина представ
тивности маркеров некроза в плазме крови в
ляется важной задачей будущих исследований.
конце реперфузии (рис. 1). Дополнительно в ЗР
В этой связи интерес представляют результаты,
ЛЖ животных, защищенных введением G2 или
полученные при изучении влияния G1, G2 и Gal
Gal, обнаружено снижение содержания продук
на Сu2+ индуцированное свободнорадикальное
тов ПОЛ до предишемических значений
окисление ЛНП плазмы крови человека in vitro.
(табл. 2). Эти данные однозначно указывают на
Полученные нами данные продемонстрировали
способность пептидов галанина снижать окис
ингибирующий эффект этих соединений, выз
лительный стресс при реперфузии.
ванный уменьшением образования липидных
Ранее мы показали, что у крыс с кардиомио
радикалов, хотя и более слабый, чем у синтети
патией, вызванной доксорубицином, подкожное
ческого антиоксиданта BHT (табл. 4, рис. 3).
введение пептида G2 в течение 8 недель снижало
Тем не менее нельзя исключить, что при исполь
ПОЛ и увеличивало активность Cu,Zn SOD и
зовании указанной модели подавление свобод
GSH Px в поврежденном сердце [6]. В настоя
норадикального окисления липидов могло быть
щей работе существенного влияния пептидов
вызвано хелатированием ионов меди изучаемы
G1, G2 и Gal на активность ключевых фермен
ми пептидами.
тов антиоксидантной защиты Cu,Zn SOD, CAT
Помимо регуляции свободнорадикальных
и GSH Px в зоне риска ЛЖ миокарда крыс выяв
процессов, активация пептидами галанина раз
лено не было. В данной работе отмечено лишь
личных путей трансдукции при связывании с
незначительное увеличение активности GSH Px
рецепторами GalR1-3 также может способство
под действием G2 и Gal и снижение активности
вать уменьшению повреждения клеток. Все три
Cu,Zn SOD под действием G1 (табл. 2). Вполне
подтипа рецепторов галанина через белки
вероятно, что короткого времени реперфузии
Gi/Go ингибируют активность аденилатцикла
(1 ч) недостаточно для экспрессии генов этих
зы, что приводит к ингибированию транскрип
ферментов в миокарде. В пользу этого предпо
ционного фактора СREB - белка, связывающе
ложения свидетельствуют не только результаты
го цикло АМP зависимый элемент. Это повы
нашей работы [6], но и исследование Timotin
шает экспрессию транспортера глюкозы
et al. [22], в котором показано, что снижение
GLUT4 и способствует его перемещению в сар
размеров инфаркта миокарда у мышей в резуль
колемму, стимулируя захват и окисление глюко
тате длительного введения Gal сопровождается
зы кардиомиоцитами. Запуск этого механизма
ростом количества мРНК Cu,Zn SOD в кардио
имеет решающее значение в условиях снижения
миоцитах. Для понимания причин изменения
продукции АТP [25]. Сопряжение рецептора
активности Cu,Zn SOD и GSH Px в зоне риска
GalR2 с белком Gq/11 активирует фосфолипа
сердца крыс под действием пептидов при репер
зу C и через гидролиз фосфатидилинозитол ди
фузии мы оценили влияние G1, G2 и Gal на ак
фосфата регулирует гомеостаз кальция, что
тивность коммерческих антиоксидантных фер
улучшает инотропные свойства сердца. Нижние
ментов in vitro. Несмотря на длительную инкуба
звенья этого сигнального пути вызывают фос
цию (24 ч) и использование высоких концентра
форилирование протеинкиназы В (Akt), инги
ций пептидов (0,1 мМ), заметное влияние было
бирование проапоптозных белков BAD/BAX,
отмечено только при действии G2, проявлявше
каспазы 3 и каспазы 9 [1, 26]. Как правило, на
еся в активации Cu,Zn SOD и ингибировании
моделях in vivo снижение апоптоза кардиомио
CAT (табл. 3). Различное влияние пептидов га
цитов сопровождается ограничением области
ланина на активность Cu,Zn SOD, CAT и
инфаркта миокарда и улучшением сократитель
GSH Px в экспериментах in vitro и in vivo свиде
ной функции сердца [27]. Активация GalR1 и
тельствует в пользу того, что их способность к
GalR2 стимулирует сигнальные пути, иници
снижению генерации АФК и продуктов ПОЛ в
ируемые митоген активируемыми протеинки
сердце крыс при реперфузии не связана с воз
назами (MEK1/2 и ERK1/2), приводящие к ин
действием на ферментативную систему антиок
гибированию открытия митохондриальной по
сидантной защиты.
ры временной проницаемости (mPTP) и, таким
Известно, что многие пептиды обладают
образом, способствует выживанию и подвиж
способностью перехватывать АФК и ингибиро
ности клеток [28]. Кроме того, активация фос
вать перекисное окисление липидов [23, 24].
форилирования киназ ERK способствует увели
БИОХИМИЯ том 86 вып. 4 2021
ВЛИЯНИЕ ПЕПТИДОВ ГАЛАНИНА НА ОКИСЛИТЕЛЬНЫЙ СТРЕСС
593
чению экспрессии рецепторов, активируемых
мическому/реперфузионному повреждению и
пролифераторами пероксисом (PPARs), контро
окислительному стрессу. Эти данные указывают
лирующих энергетический метаболизм, вклю
на перспективность молекулярного конструиро
чая и экспрессию PPARγ, стимулирующего по
вания фармакологических агонистов рецептора
глощение и окисление глюкозы кардиомиоци
галанина GalR2 c улучшенными физико хими
тами [29]. Из этого следует, что пептидные аго
ческими характеристиками (растворимость,
нисты рецепторов галанина способны усиливать
протеолитическая стабильность) и детального
адаптационные механизмы метаболической за
изучения механизмов их действия. Подобные со
щиты при повреждении сердца.
единения могут служить основой для разработки
нового класса кардиопротекторов для терапии
Одним из важных аспектов реализации эф
различных сердечно сосудистых заболеваний.
фектов биоактивных пептидов является их влия
ние на интенсивность свободнорадикального
Финансирование. Работа выполнена при фи
окисления в органах и тканях, которое сопро
нансовой поддержке Российского фонда фунда
вождается коррекцией нарушений, вызванных
ментальных исследований (гранты № 18 015
различными патологическими факторами. В
0008 а и 18 015 0009 а).
связи с этим природные и синтетические пеп
Конфликт интересов. Авторы заявляют об от
тидные биорегуляторы можно рассматривать как
сутствии конфликта интересов.
перспективные фармакологические средства,
Соблюдение этических норм. Все примени
способствующие уменьшению стресс индуциро
мые международные, национальные и/или инс
ванных изменений в организме. Полученные ре
титуциональные принципы ухода за лаборатор
зультаты свидетельствуют об участии галанинер
ными животными и их использования в экспе
гической системы в адаптации сердца к ише
риментах были соблюдены.
СПИСОК ЛИТЕРАТУРЫ
1.
Branchek, T. A., Smith, K. E., Gerald, C., and Walker,
8. Kitakaze, M., Takashima, S., Funaya, H., Minamino, T.,
M. W.
(2000) Galanin receptor subtypes, Trends
Node, K., et al. (1997) Temporary acidosis during reperfu
Pharmacol. Sci.,
21,
109117, doi:
10.1016/S0165
sion limits myocardial infarct size in dogs, Am. J. Physiol.,
6147(00)01446 2.
272, H2071 H2078, doi: 10.1152/ajpheart.1997.272.5.
2.
Timotin, A., Pisarenko, O., Sidorova, M., Studneva, I.,
H2071.
Shulzhenko, V., et al. (2017) Myocardial protection from
9. Beauchamp, C., and Fridovich, I. (1971) Superoxide dis
ischemia/reperfusion injury by exogenous galanin frag
mutase: improved assays and assay applicable to acrylamide
ment, Oncotarget, 8, 21241 21252, doi: 10.18632/oncotarget.
gels, Anal. Biochem., 44, 276 287, doi: 10.1016/0003
15071.
2697(71)90370 8.
3.
Pisarenko, O., Timotin, A., Sidorova, M., Studneva, I.,
10. Aebi, H. (1984) Catalase in vitro, Methods Enzymol., 105,
Shulzhenko, V., et al. (2017) Cardioprotective properties of
121 126, doi: 10.1016/s0076 6879(84)05016 3.
N terminal galanin fragment (215) in experimental
11. Ланкин В. З., Гуревич С. М. (1976) Ингибирование пе
ischemia/reperfusion injury, Oncotarget, 8, 60,
101659
реокисления липидов и детоксикация липоперекисей
101671, doi: 10.18632/oncotarget.21503.
защитными ферментативными системами (суперок
4.
Азьмуко А. А., Веселова О. М., Молокоедов А. С., Ов
сиддисмутаза, глутатионпероксидаза, глутатионре
чинников М. В., Палькеева М. Е., Писаренко О. И.,
дуктаза) при экпериментальном злокачественном
Серебрякова Л. И., Сидорова М. В., Студнева И. М.
росте, ДАН СССР, 226, 705 708.
(2018) Тетрадекапептиды, улучшающие восстанови
12. Draper, H. H., and Hadley, M. (1990) Malondialdehyde
тельную функцию сердечно сосудистой системы при
determination as index of lipid peroxidation, Methods
ишемии. Патент № 2648846. РФ. A61K 38/10 (2006.01).
Enzymol., 186, 421 431, doi: 10.1016/0076 6879(90)86135 i.
5.
Palkeeva, M., Studneva, I., Molokoedov, A.,
13. Ланкин В. З., Кандалинцева Н. В., Коновалова Г. Г., Ти
Serebryakova, L., Veselova, O., et al.
(2019)
хазе А. К., Хольшин С. В., Ягунов С. Е., Одинокова О.
Galanin/GalR1 3 system: a promising therapeutic target
А. (2017) Способ экспресс скрининга потенциальных
for myocardial ischemia/reperfusion injury, Biomed.
антиоксидантов с использованием кинетической моде
Pharmacother.,
109,
15561562, doi:
10.1016/j.bio
ли медь инициированного свободнорадикального
pha.2018.09.182.
окисления липопротеидов низкой плотности плазмы
6.
Студнева И. М., Веселова О. М., Бахтин A. A., Коно
крови человека. Патент на изобретение RU 2629398.
валова Г. Г., Ланкин В. З., Писаренко О. И. (2020) Ме
14. Britigan, B. E., Cohen, M. S., and Rosen, G. M. (1987)
ханизмы защиты сердца синтетическим агонистом ре
Detection of the production of oxygen centered free radi
цепторов галанина при повреждении хроническим
cals by human neutrophils using spin trapping techniques:
введением доксорубицина, Acta Naturae, 12, 28 37,
a critical perspective, J. Leukoc. Biol., 41, 349362,
doi: 10.32607/actanaturae.10945.
doi: 10.1002/jlb.41.4.349.
7.
Sidorova, M. V., Palkeeva, M. E., Avdeev, D. V.,
15. Vanden Hoek, T. L., Shao, Z., Li, C., Zak, R.,
Molokoedov, A. S., Ovchinnikov, M. V., et al. (2020)
Schumacker, P. T., and Becker, L. B. (1996) Reperfusion
Convergent synthesis of the rat galanin and study of its bio
injury on cardiac myocytes after simulated ischemia, Am. J.
logical activity, Russ. J. Bioorg. Chem.,
46,
3242,
Physiol.,
270, H1334 H1341, doi:
10.1152/ajpheart.
doi: 10.1134/S1068162020010100.
1996.270.4.H1334.
БИОХИМИЯ том 86 вып. 4 2021
594
ПИСАРЕНКО и др.
16.
Эмануэль Н. М., Лясковская Ю. Н. (1961) Торможе
22. Timotin, A., Cinato, M., Kramar, S., Loy, H.,
ние процессов окисления жиров, Пищепромиздат,
Merabishvili, G., and (2019) Galanin is a checkpoint regu
Москва, стр. 10 19.
lator of mitochondrial biogenesis coordinating a pro survival
17.
Lankin, V., Konovalova, G., Tikhaze, A., Shumaev, K.,
phenotype in post infarct myocardial remodeling, Lancet,
Kumskova, E., and Viigimaa, M. (2014) The initiation of
preprint, doi: 10.2139/ssrn.3424189.
free radical peroxidation of low density lipoproteins by
23. Power, O., Jakeman, P., and FitzGerald, R. J. (2013)
glucose and its metabolite methylglyoxal: a common mol
Antioxidative peptides: enzymatic production, in vitro and
ecular mechanism of vascular wall injure in atherosclerosis
in vivo antioxidant activity and potential applications of
and diabetes, Mol. Cell. Biochem.,
395,
241252,
milk derived antioxidative peptides, Amino Acids, 44, 797
doi: 10.1007/s11010 014 2131 2.
820, doi: 10.1007/s00726 012 1393 9.
18.
Lankin V. Z. (2003) The enzymatic systems in the regula
24. Jakubczyk, A., Karas, M., Rybczynska Tkaczyk, K.,
tion of free radical lipid peroxidation, in Free Radicals,
Zielinska, E., and Zielinski, D. (2020) Current trends of
Nitric Oxide, and Inflammation: Molecular, Biochemical,
bioactive peptides - new sources and therapeutic effect,
and Clinical Aspects, NATO Science Series
Foods, 9, 846, doi: 10.3390/foods9070846.
(Tomasi, A., et al., eds) vol. 344, IOS Press, Amsterdam,
25. Tian, R., and Abel, E. D. (2001) Responses of GLUT4
pp. 8 23.
deficient hearts to ischemia underscore the importance of
19.
Lankin, V. Z., Antonovsky, V. L., and Tikhaze, A. K. (2004)
glycolysis,
Circulation,
103,
29612966,
Regulation of Free radical lipoperoxidation and organic
doi: 10.1161/01.CIR.103.24.2961.
peroxides metabolism during normal station and patholo
26. Lang, R., Gundlach, A. L., Holmes, F. E., Hobson, S. A.,
gies, in Peroxides at the Beginning of the Third Millennium
Wynick, D., et al. (2015) Physiology, signaling, and phar
(Antonovsky, V.L., et al., eds) Nova Science Publishers
macology of galanin peptides and receptors: three decades
Inc., New York, pp. 85 111.
of emerging diversity, Pharmacol. Rev., 67, 118 175.
20.
Тимошин А. А., Дроботова Д. Ю., Цкитишвили О. В.,
27. Krijnen, P. A., Nijmeijer, R., Meijer, C. J., Visser, C. A.,
Серебрякова Л. И., Писаренко О. И., Рууге Э. К., Ва
Hack, C. E., and Niessen, H. W. (2002) Apoptosis in
нин А. Ф. (2010) Защитное действие динитрозильных
myocardial ischaemia and infarction, J. Clin. Pathol., 55,
комплексов железа с глутатионом в условиях регио
801 811, doi: 10.1136/jcp.55.11.801.
нальной ишемии миокарда крыс: исследование мето
28. Hausenloy, D. J., and Yellon, D. M. (2013) Myocardial
дом микродиализа, Доклады Академии Наук (Раздел
ischemia reperfusion injury: a neglected therapeutic target,
«Биофизика»), 432, 416 419.
J. Clin Invest., 123, 92 100, doi: 10.1172/JCI62874.
21.
Murphy, E., and Steenbergen, C. (2008) Mechanisms
29. Jay, M. A., and Ren, J. (2007) Peroxisome proliferator
underlying acute protection from cardiac ischemia reper
activated receptor (PPAR) in metabolic syndrome and type
fusion injury, Physiol. Rev., 88, 581 609, doi: 10.1152/
2 diabetes mellitus, Curr. Diab. Rev.,
3,
3339,
physrev.00024.2007.
doi: 10.2174/157339907779802067.
ANTIOXIDANT PROPERTIES OF GALANIN AND ITS N TERMINAL
FRAGMENTS IN MODELING OXIDATIVE STRESS in vitro AND in vivo*
O. I. Pisarenko**, I. M. Studneva, L. I. Serebryakova, A. A. Timoshin, G. G. Konovalova,
V. Z. Lankin, A. K. Tihaze, O. M. Veselova, I. V. Dobrokhotov, R. O. Lyubimov,
M. V. Sidorova, M. E. Palkeeva, and A. S. Molokoedov
National Medical Research Center for Cardiology, 121552 Moscow, Russia; E mail: olpi@live.ru
Antioxidant properties of rat galanin GWTLNSAGYLLGPHAIDNHRSFSDKHGLT NH2 (Gal), N terminal frag
ment of galanin (2 15 aa) WTLNSAGYLLGPHA (G1), and its modified analogue WTLNSAGYLLGPβAH (G2)
were studied in vivo in the rat model of regional myocardial ischemia and reperfusion and in vitro in the process of
Cu2+ induced free radical oxidation of human blood plasma low density lipoproteins. Intravenous administration of
G1, G2, and Gal to rats after ischemia induction reduced the infarction size and activities of the necrosis markers,
creatine kinase MB and lactate dehydrogenase, in blood plasma at the end of reperfusion. G1, G2, and Gal reduced
formation of the spin adducts of hydroxyl radicals in the interstitium of the area at risk during reperfusion, moreover,
G2 and Gal also reduced formation of the secondary products of lipid peroxidation in the reperfused myocardium. It
was shown in the in vivo experiments and in the in vitro model system that the ability of galanin peptides to reduce for
mation of ROS and attenuate lipid peroxidation during myocardial reperfusion injury was not associated directly with
their effects on activities of the antioxidant enzymes of the heart: Cu,Zn superoxide dismutase, catalase, and glu
tathione peroxidase. The peptides G1, G2, and Gal at concentrations of 0.01 and 0.1 mM inhibited Cu2+ induced free
radical oxidation of human low density lipoproteins in vitro. The results of oxidative stress modeling demonstrated
that the natural and synthetic agonists of galanin receptors reduced formation of the short lived ROS in the reperfused
myocardium, as well as of lipid radicals in blood plasma. Thus, galanin receptors could be a promising therapeutic tar
get for cardiovascular diseases.
Keywords: galanin, heart, ischemia and reperfusion, necrosis, lipid peroxidation, antioxidant enzymes, cardiomyocyte
membrane damage
БИОХИМИЯ том 86 вып. 4 2021