БИОХИМИЯ, 2021, том 86, вып. 4, с. 595 - 606
УДК 577.124
D РАМНАН И ПИРУВАТСОДЕРЖАЩАЯ ТЕЙХУРОНОВАЯ КИСЛОТА
КЛЕТОЧНОЙ СТЕНКИ Rathayibacter sp. ВКМ Ac 2759
© 2021
А.С. Шашков1, Е.М. Тульская2*, Н.В. Потехина2, А.С. Дмитренок1,
С.Н. Сенченкова1, В.А. Зайчиков2, Л.В. Дорофеева3, Л.И. Евтушенко3
1 Институт органической химии им. Н.Д. Зелинского РАН, 119991 Москва, Россия
2 Московский государственный университет имени М.В. Ломоносова, биологический факультет,
119234 Москва, Россия; электронная почта: em_tulskaya@mail.ru
3 Всероссийская коллекция микроорганизмов (ВКМ), Институт биохимии и физиологии микроорганизмов
им. Г.К. Скрябина, ФИЦ Пущинский научный центр биологических исследований РАН,
142290 Пущино, Московская обл., Россия
Поступила в редакцию 18.01.2021
После доработки 16.02.2021
Принята к публикации 16.02.2021
Rathayibacter sp. ВКМ Ac 2759 (семейство Microbacteriaceae, класс Actinobacteria) содержит в клеточной
стенке два гликополимера. Основная цепь рамнана, гликополимера 1, построена из повторяющихся тетраса
харидных звеньев, несущих на нередуцирующем конце терминальные остатки арабинофуранозы: →3) α
[α D Araf (1→2)] D Rhap (1→2) α D Rhap (1→3) α D Rhap (1→2) α D Rhap (1→. Подобно другим изу
ченным видам рода Rathayibacter, в нейтральном гликополимере штамма ВКМ Ac 2759 рамноза присутству
ет в D конфигурации. Ацеталированная пировиноградной кислотой тейхуроновая кислота, гликополимер 2,
состоит из линейных тетрасахаридных звеньев: →4) β D GlcpA (1→4) β D Galp (1→4) β D Glcp (1→3)
β [4,6 S Pyr] D Manp (1→. Структуры гликополимеров установлены химическими и ЯМР спектроскопи
ческими методами и описаны впервые для прокариотных микроорганизмов. Полученные данные могут
быть востребованы в таксономических исследованиях и работах по выяснению механизмов колонизации и
инфекции растений бактериями рода Rathayibacter.
КЛЮЧЕВЫЕ СЛОВА: Rathayibacter, клеточная стенка, гликополимеры, D рамнан, тейхуроновая кислота,
пируват.
DOI: 10.31857/S0320972521040114
ВВЕДЕНИЕ
го состава клеточных стенок у представителей
пяти видов рода (Rathayibacter tritici, RathayibacD
Род Rathayibacter (семейство Microbacteria
ter iranicus, Rathayibacter toxicus, Rathayibacter
ceae, класс Actinobacteria) [1] включает 8 валид
caricis и «Rathayibacter tanaceti») были обнаруже
но описанных видов (LPSN - List of Prokaryotic
ны бесфосфатные полимеры различных типов и
структур - рамноманнаны, тейхуроновые кис
dsmz.de/genus/rathayibacter), более половины из
лоты, рамнан (у R. caricis) и рамнозосодержа
которых известны как фитопатогены [2-4]. Ви
щий нейтральный гликополимер с остатками
ды Rathayibacter имеют высокий уровень сход
D Manp, D Glcp и L Rhap в повторяющемся
ства между собой по генам 16S рРНК (до
звене (у R. toxicus) [6-9]. Штамм каждого вида
99,52%) и традиционным фенотипическим ха
имел индивидуальный профиль полисахаридов
рактеристикам [2-5]. При изучении химическо
и содержал один или два гликополимера, при
этом практически каждый из них имел структу
ру, впервые описанную у прокариотов [8, 9].
Принятые сокращения: HMBC - гетероядерная
корреляция 1H,13C через несколько связей; HSQC - про
В настоящей работе представлены результа
тон детектированная HOHO квантовая корреляция; J -
ты изучения структур гликополимеров клеточ
константа спин спинового взаимодействия; ROESY - дву
ной стенки Rathayibacter sp. ВКМ Ac 2759,
мерная спектроскопия ядерного эффекта Оверхаузера во представителя пока не описанного нового вида,
вращающейся системе координат; COSY - корелляцион
ная спектроскопия; TOCSY - тотальная корреляционная
выделенного из некротического участка листа
спектроскопия; δC, δH - значения химических сдвигов ато
пижмы обыкновенной (Tanacetum vulgare), ин
мов 13C, 1H соответственно.
фицированной фитопатогенной нематодой
* Адресат для корреспонденции.
Aphelenchoides fragariae [10].
595
596
ШАШКОВ и др.
МАТЕРИАЛЫ И МЕТОДЫ
ратурном режиме 160-290 °С со скоростью
7 °С/мин.
Бактериальный штамм Rathayibacter sp. ВКМ
Абсолютную конфигурацию нейтральных гек
Ac 2759 был получен из Всероссийской коллек
соз, входящих в структуры гликополимеров 1 и 2,
устанавливали модифицированным методом
Условия культивирования и получение биомас
Gerwig et al. [13]. К препарату гликополимеD
сы для исследований, а также выделение и
ра (0,5 мг) добавляли (+) 2 октанол и безводную
очистка клеточных стенок описаны ранее [11].
трифторуксусную кислоту (15 мкл), нагревали в
Выделение гликополимеров проводили мето
герметически закрытом контейнере 1 ч при
дом холодной и горячей ТХУ экстракций (10%
120 °С, избыток реагентов удаляли током возду
ная ТХУ, 4 °С, 24 ч и затем - 5% ная ТХУ, 90 °С,
ха. Полученные гликозиды ацетилировали и
20 мин), как описано ранее [7]. Выход препара
анализировали методом ГЖХ. Стандартные об
тов гликополимеров составил 4,8% и 14,2% со
разцы готовили аналогичным способом из L и
ответственно. Полученные препараты (иден
D моносахаридов.
тичные по химическим и ЯМР спектроскопи
Абсолютную конфигурацию арабинозы под
ческим данным) были объединены и обозначе
тверждали на основании правил, опубликован
ны как суммарный препарат.
ных ранее [14], в соответствии с эффектами гли
Методы кислотного гидролиза клеточной
козилирования в спектре ЯМР13C гликополимеD
стенки и препаратов гликополимеров (2 M HCl,
ра 1.
3 ч, 100 °С), нисходящей хроматографии и
Абсолютную конфигурацию остатков глюкуро
электрофореза, а также реактивы для проявле
новой кислоты в гликополимере 2 определяли по
ния сахаров и фосфатсодержащих соединений и
эффектам гликозилирования в остатках моноса
продуктов их кислотной деградации описаны в
харидов в спектрах ЯМР13С на основании при
работе Potekhina et al. [11].
надлежности глюкозы к D ряду, согласно зако
Гликополимеры суммарного препарата разде
номерностям, изложенным в работе Shashkov
ляли методом анионообменной хроматографии
et al. [14].
на колонке (80 × 1,5 см) с DEAE целлюло
Спектры ЯМР снимали на приборе Bruker
зой («Toyopearl», Япония). Фракции гликополи
AV600
(«Bruker», Германия) для растворов
меров элюировали фосфатным буфером
в 99,96% D2O при температурах, обеспечиваю
(pH 6,3) в разных концентрациях: нейтраль
щих минимальное перекрывание остаточного
ную (гликополимер 1) - 0,005 M, а кислую (гликоD
сигнала дейтерированной воды с сигналами по
полимер 2) - 0,5 M. Полученные фракции обес
лимеров. В качестве внутреннего эталона ис
соливали на колонке
(90
×
1,5
см) с ге
пользовали натриевую соль 3 (триметилсилил)
лем TSK HW 40S («Toyopearl»). Элюцию прово
3,3,2,2 тетрадейтеропропионовой
кисло
дили 1% ным раствором AcOH, используя диф
ты (TSP, δH 0,0 м.д., δС - 1,6 м.д.). Двумерные
ференциальный рефрактометр («Knauer», Гер
ЯМР эксперименты выполняли с использова
мания). Фракции гликополимеров 1 и 2 диализо
нием стандартного математического обеспече
вали против дистиллированной воды, высуши
ния («Bruker Optik GmbH», Германия). Время
вали лиофильно и исследовали методами ЯМР
спин лока в экспериментах TOCSY составляло
спектроскопии.
100
мс. Время смешивания в эксперимен
Депирувилирование гликополимера 2 прово
те ROESY составляло 150 мс. Эксперимен
дили следующим образом: ∼30 мг образца кис
ты HMBC были оптимизированы для констант
лой фракции обрабатывали 2% ным раство
спин спинового взаимодействия JH, C 8 Гц.
ром AcOH в течение 6 ч при 110 °С с последую
щей гель хроматографией на колонке
(90 × 1,5 см) с гелем TSK HW 40S в 1% ном
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
AcOH, осуществляя мониторинг элюции с по
мощью рефрактометра.
Кислотные гидролизаты (2 M HCl, 100 °С,
Состав моносахаридов в гликополимерах 1 и 2
3 ч) клеточной стенки Rathayibacter sp. ВКМ Ac
исследовали модифицированным методом
2759 и выделенных из нее препаратов гликопо
Leontein et al. [12] с помощью ГЖХ. Образцы
лимеров содержали набор сахаров (рамноза,
гидролизовали 2 М CF3COOH (120 °C, 2 ч), вос
глюкоза, галактоза, манноза и арабиноза) и не
станавливали NaBH4 (20 °C, 16 ч), ацетилирова
содержали характерных продуктов гидролиза
ли уксусным ангидридом, и полученные ацета
тейхоевых кислот и гликозил 1 фосфатных по
ты полиолов разделяли на хроматографе Маэст
лимеров (фосфорных эфиров полиолов и саха
ро ГХ 7820 («Интерлаб», Россия), оборудован
ров). Эти данные указывали на возможное при
ном HP 5 колонкой (0,32 мм × 30 м) при темпе
сутствие в клеточной стенке исследуемого штам
БИОХИМИЯ том 86 вып. 4 2021
РАМНАН И ТЕЙХУРОНОВАЯ КИСЛОТА Rathayibacter sp. ВКМ Ас 2759
597
ма бесфосфатных гликополимеров, характерных
держала гликополимер 2 (рис. 1, в) с небольшой
для других штаммов рода Rathayibacter [6-9].
примесью гликополимера 1.
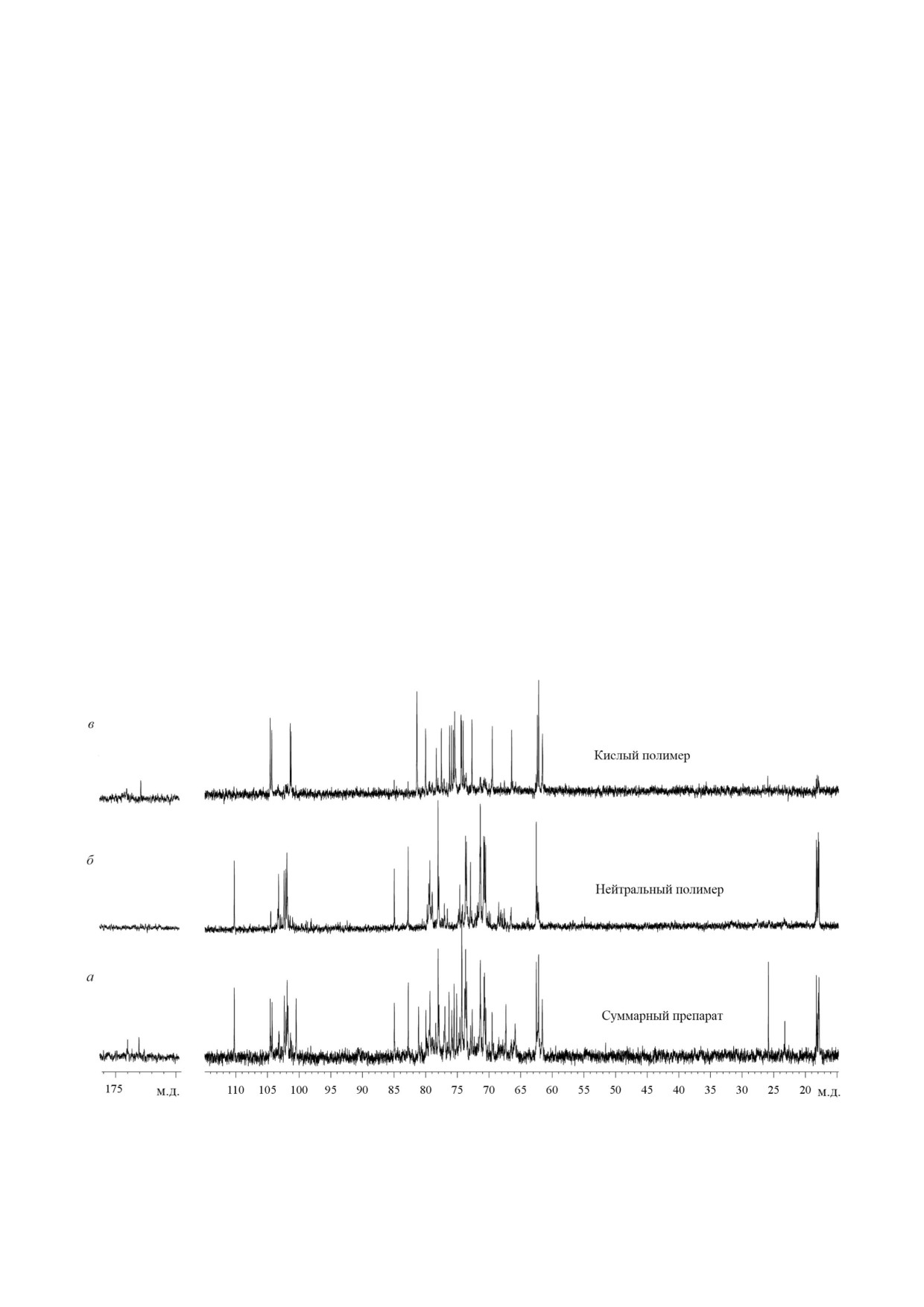
13C ЯМР спектр суммарного препара
Нейтральная фракция (гликополимер
1).
та (рис. 1, а) в аномерной области содержал во
Спектр ЯМР13C нейтрального гликополимеD
семь сигналов в диапазоне при δС
100,5-
ра 1 (рис. 1, б; таблица) содержал четыре интен
104,6 м.д. и сигнал при δС 110,0 м.д. В области
сивных сигнала при δС 101,9-103,3 м.д. и сигнал
высокого поля наблюдались четыре сигнала
при 110,0 м.д., характерный для фуранозида
6 дезоксипиранозы при δС 17,8-18,3 м.д. и ин
с транс ориентацией заместителей при C 1 и
тенсивный сигнал при δС 25,9 м.д., характерный
C 2. Никаких интенсивных сигналов не наблю
для пируватной группы с шестичленным цик
далось в слабом поле при 165-185 м.д. В области
лом и с экваториальной ориентацией метильной
сильного поля наблюдалось четыре сигнала
группы в этом цикле. В низкопольной части
6 дезоксипиранозы (δС 17,8-18,3 м.д.). В спект
спектра присутствовали сигналы при δС 173,1 и
ре ЯМР1H (рис. 2, вверху) в аномерной области
173,9 м.д. Остальные сигналы находились в об
наблюдалось пять интенсивных протонных сиг
ласти δС 61-85 м.д. Cпектры 2D ЯМР, необходи
налов (δH 4,96-5,22 м.д.). Четыре дуплетных сиг
мые для расшифровки структуры, были сняты
нала были видны в области сильного по
для суммарного препарата, но их анализ оказал
ля (δH 1,27-1,34 м.д.), что типично для 6 дезок
ся сложным из за многочисленных перекрытий
сипираноз (J5,6 6 Гц).
протонных сигналов в области δH 3,4-4,2 м.д.
Анализ моносахаридного состава гликополиD
Чтобы облегчить задачу, была сделана попытка
мера 1 выявил присутствие рамнозы и арабино
разделить препарат на кислый и нейтральный
зы в соотношении 4/1 как основных компонен
компоненты с использованием хроматографии
тов полисахарида.
на колонке с DEAE целлюлозой (см. «Материа
Сигналы в спектрах ЯМР13С и1Н были от
лы и методы»).
несены с помощью анализа двумерных гомо
В результате разделения были получены две
ядерных 1Н,1Н COSY, TOCSY, ROESY и гетеро
фракции. Первая, нейтральная фракция, содер
ядерных 1Н,13С HSQC, HSQC TOCSY и HMBC
жала преимущественно гликополимер 1 (рис. 1, б)
экспериментов.
и небольшую примесь кислого полисахарида
Анализ спектров 1Н,1Н COSY, TOCSY и
(гликополимер 2), а вторая, кислая фракция, со
ROESY показал наличие в гликополимере 1 четы
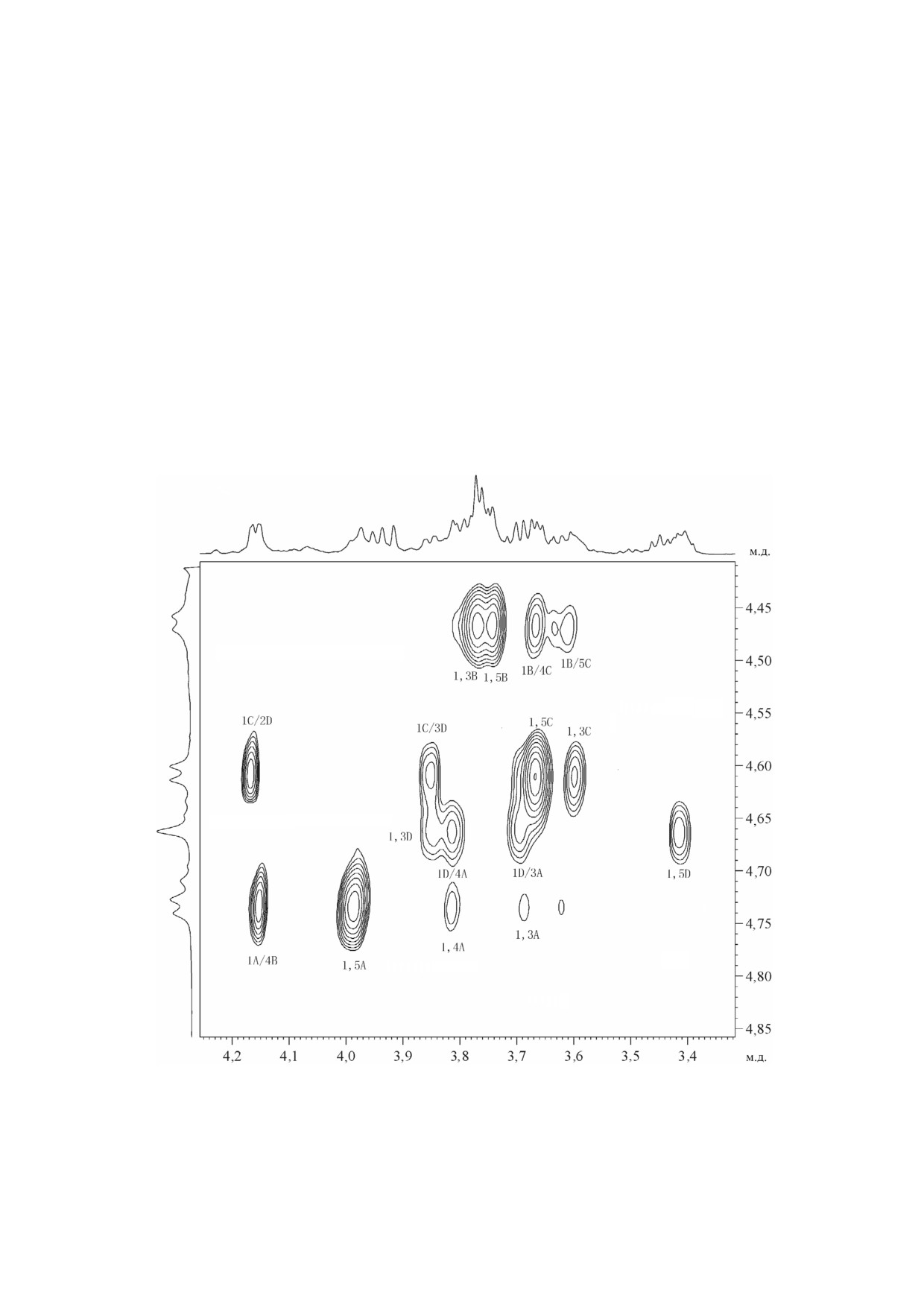
Рис. 1. Спектры ЯМР 13С гликополимеров из клеточной стенки Rathayibacter sp. ВКМ Ac 2759: суммарный препарат (а);
нейтральная фракция (б); кислая фракция (в)
БИОХИМИЯ том 86 вып. 4 2021
598
ШАШКОВ и др.
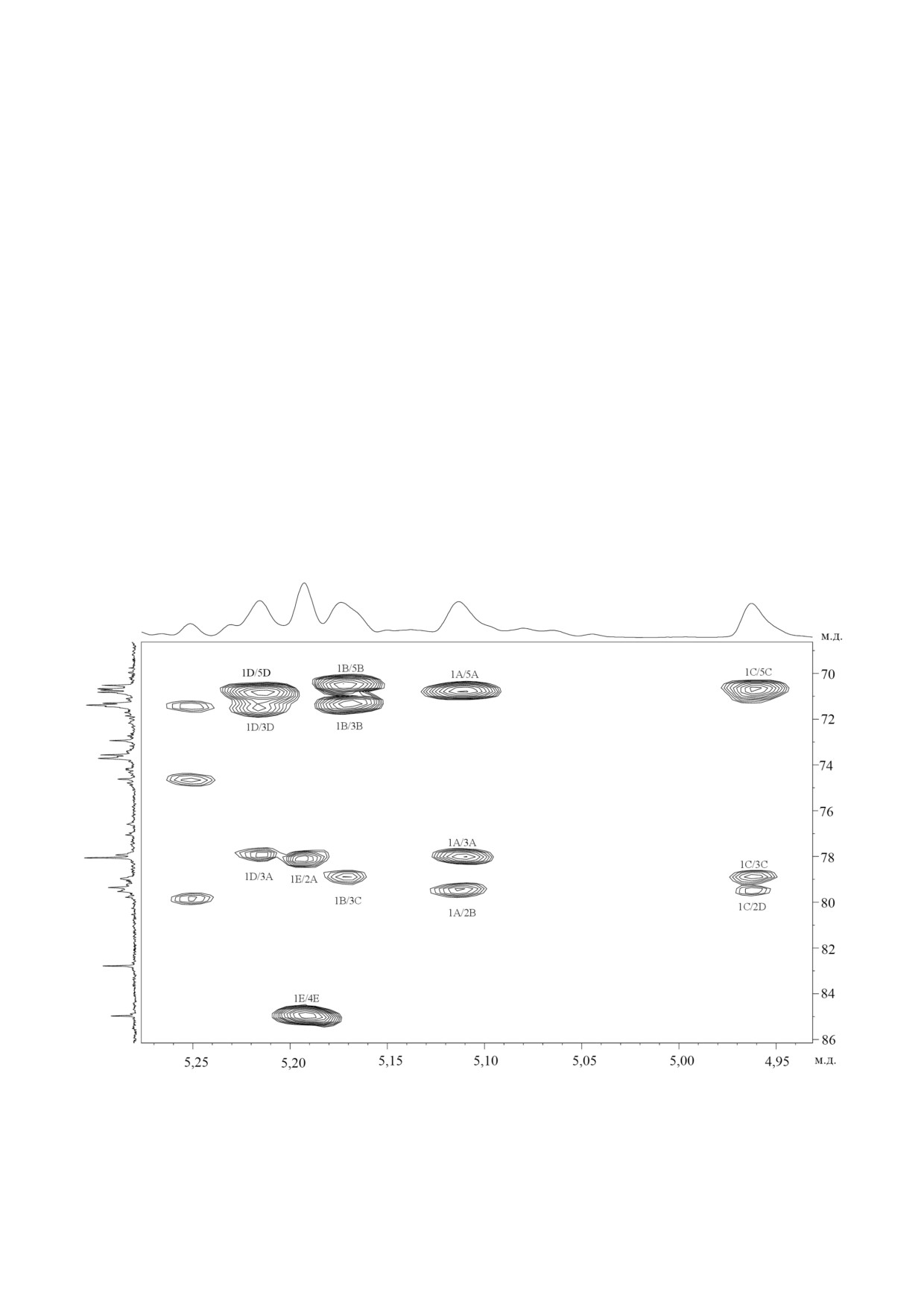
Рис. 2. Части двумерного 1H,13C HSQC спектра гликополимера 1 нейтральной фракции из клеточной стенки RathayibacD
ter sp. ВКМ Ac 2759. Соответствующие части1H и 13C ЯМР спектров приведены вверху и слева от двумерного спектра со
ответственно. Арабские цифры относятся к номерам атомов углерода в остатках, обозначенных заглавными латинскими
буквами в соответствии с таблицей
рех остатков α рамнопиранозы (α Rhap) и од
следующей последовательности остатков в пов
ного остатка α арабинофуранозы (α Araf).
торяющемся звене гликополимера 1:
Смещение в спектре 1H,13C HSQC (рис. 2;
таблица) сигналов атомов углерода в сравнении
с таковыми родоначальных пираноз свидетель
ствует о замещении двух остатков α Rhap в по
ложение 2 (δC2 79,5 м.д. - остаток B и δC2
79,3 м.д. - остаток D, таблица, гликополимер 1),
замещении остатка α Rhap в положение 3 (δC3
78,9 м.д. - остаток C) и замещении остатка
α Rhap в положения 2 и 3 (δC2 78,1 м.д. и δC3
Анализ спектра 1H,13C HMBC (рис. 4, таб
78,0 м.д. - остаток A). Сравнение химических
лица), содержавшего корреляционные пики:
сдвигов остатка α Araf (E) с таковыми, напри
H 1(A)/C 2(B)
(5,11/79,5); H 1(B)/C 3(C)
мер, в метил α арабинофуранозиде, указывает
(5,17/78,9); H 1(C)/C 2(D) (4,96/79,3); H 1(D)/
на отсутствие замещения у C 2, С 3 и С 5 в ос
C 3(A) (5,22/78,0) и H 1(E)/C 2(A) (5,20/78,1),
татке E.
подтверждал последовательность остатков,
Последовательность остатков в гликополимере 1
представленную выше.
следовала из анализов спектров 1Н,1Н ROESY
Газожидкостная хроматография обработан
и
1Н,13С HMBC. Гомоядерный
2D спектр
ного оптически активным октанолом гидроли
1Н,1Н ROESY (рис. 3, таблица) содержал следу
зата гликополимера 1 выявила D абсолютную
ющие корреляционные пики между протонами:
конфигурацию рамнозы и арабинозы. Такая же
1A/2B
(5,11/4,08);
1B/3C
(5,17/3,85);
D абсолютная конфигурация сахаров была
1C/2D
(4,96/4,06);
1D/3A
(5,22/3,95) и
подтверждена на основе правил, касающихся
1E/2A (5,20/4,16). Очевидно, что корреляцион
эффектов гликозилирования в спектрах
ные пики в спектре1Н,1Н ROESY соответствуют
ЯМР13C полисахаридов [14]. Изучение спектра
БИОХИМИЯ том 86 вып. 4 2021
РАМНАН И ТЕЙХУРОНОВАЯ КИСЛОТА Rathayibacter sp. ВКМ Ас 2759
599
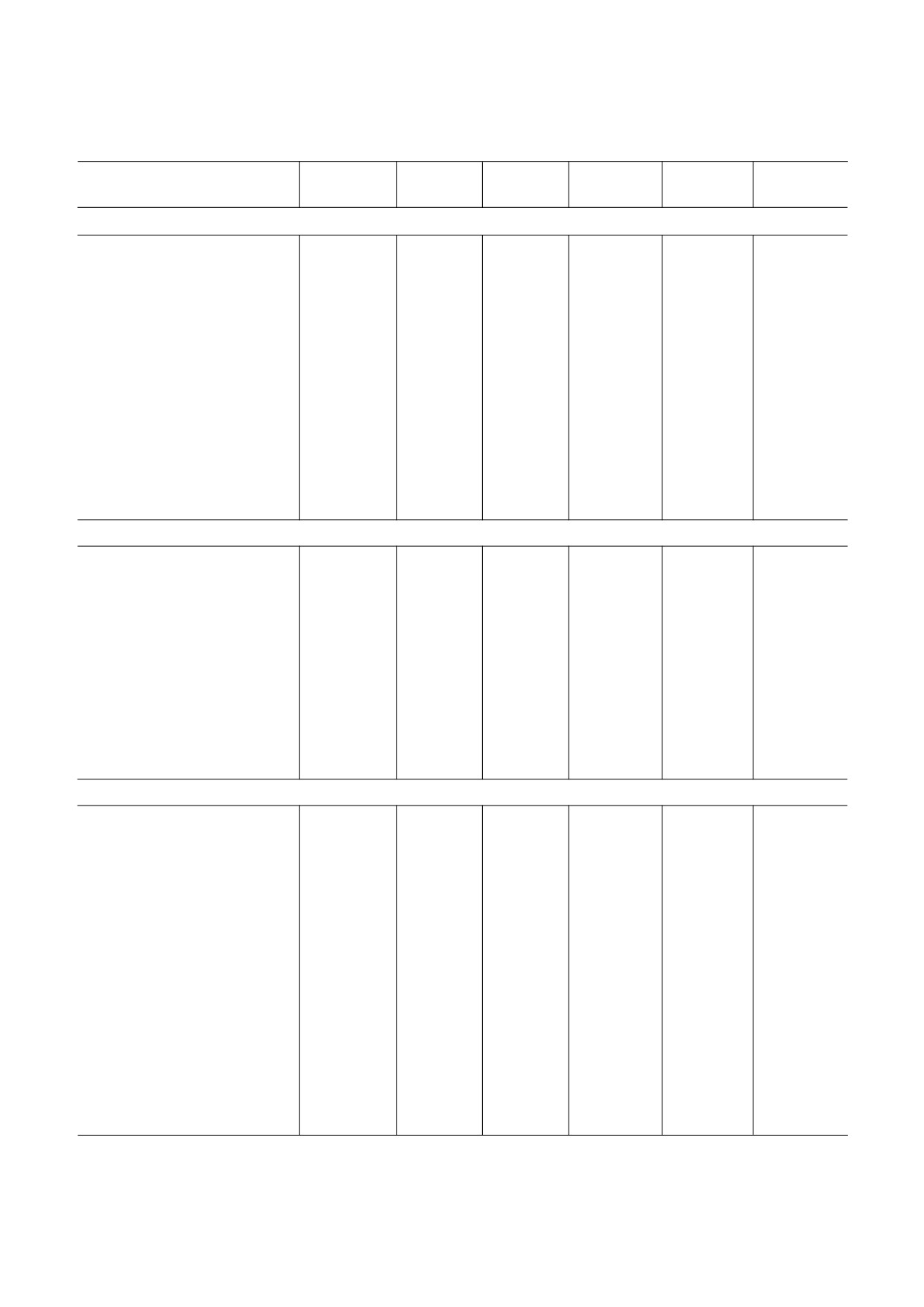
Химические сдвиги в спектрах ЯМР 13С и 1H гликополимеров клеточной стенки Rathayibacter sp. ВKM Ac 2759 (TSP
δC -1,6 м.д. и δH 0,00 м.д.)
Остаток
C 1
C 2
C 3
C 4
C 5
C 6
HD1
HD2
HD3
HD4
HD5
HD6, HD6′
Гликополимер 1
α D Araf (1
E
110,0
82,6
78,0
85,0
62,5
↓
5,20
4,16
3,95
4,06
3,80, 3,70
2)
→3) α D Rhap (1→
A
102,4
78,1
78,0
73,5
70,7
17,8
5,11
4,16
3,95
3,62
3,76
1,28
→2) α D Rhap (1→
B
102,1
79,5
71,3
72,7
70,6
18,3
5,17
4,08
3,88
3,51
3,75
1,34
→3) α D Rhap (1→
C
103,0
71,3
78,9
73,0
70,7
17,9
4,96
4,14
3,85
3,58
3,76
1,27
→2) α D Rhap (1→
D
101,9
79,3
71,4
73,7
70,5
18,1
5,22
4,06
3,94
3,50
3,81
1,31
Депирувилированный гликополимер 2 (dePyr гликополимер 2)
→4) β D GlcpA (1→
A
104,6
74,5
75,5
81,5
75,7
173,1
4,73
3,45
3,69
3,82
3,96
→4) β D Galp (1→
B
104,4
72,7
74,4
78,4
76,0
62,2
4,47
3,62
3,76
4,15
3,74
3,77, 3,77
→4) β D Glcp (1→
C
101,4
74,2
76,3
80,1
75,7
61,6
4,61
3,41
3,59
3,67
3,66
3,96, 3,80
→3) β D Manp (1→
D
101,3
69,6
81,5
66,5
77,6
62,5
4,66
4,17
3,85
3,70
3,41
3,93, 3,75
Гликополимер 2
→4) β D GlcpA (1→
A
104,5
74,2
75,3
81,1
74,4
173,1
4,75
3,43
3,67
3,83
4,09
→4) β D Galp (1→
B
104,2
72,8
74,3
78,5
75,9
62,2
4,47
3,62
3,77
4,16
3,75
3,77, 3,77
→4) β D Glcp (1→
C
100,5
73,8
76,2
80,0
75,6
61,6
4,63
3,45
3,59
3,67
3,67
3,97, 3,81
→3) β D Manp (1→
D′
101,8
69,5
77,0
73,7
67,3
65,8
4) 6)
4,73
4,23
4,10
3,83
3,48
4,14, 3,76
\ /
C
101,4
/ \
HOOC CH3
173,9
25,9
1,56
БИОХИМИЯ том 86 вып. 4 2021
600
ШАШКОВ и др.
Рис.
3. Часть двумерного 1Н,1Н ROESY спектра гликополимера 1 нейтральной фракции из клеточной стенки
Rathayibacter sp. ВКМ Ac 2759. Соответствующие части 1H ЯМР спектра показаны вдоль осей. Арабские цифры относят
ся к номерам атомов протона в остатках, обозначенных заглавными латинскими буквами в соответствии с таблицей. Ко
сая черта обозначает пики корреляции между остатками
ЯМР13C гликополимера 1 показало большой поло
резонанса аномерных атомов углерода содер
жительный эффект гликозилирования (+8,1 м.д.)
жал четыре интенсивных сигнала при δC 101,3;
для C 1 α Araf в дисахаридном фрагменте α
101,4; 104,4 и 104,6 м.д. В высокопольной об
ArafD(1→2) α Rhap (1→, что характерно для
ласти спектра наблюдались только минорные
одинаковой (то есть D ) абсолютной конфигу
сигналы метильных групп от 6 дезоксисахари
рации обоих сахаров. Намного мень
дов, а также слабый сигнал при 25,9 м.д. по
ший (+3,5 м.д.) эффект в том же фрагменте
сравнению с таковым в спектре исходного сум
можно было ожидать, если бы в качестве глико
марного препарата (рис. 1, а). В низкопольной
зилирующего сахара присутствовала α L Araf.
области спектра был виден слабый сигнал
Таким образом, структуру повторяющегося
при 173,9 м.д., характерный для карбоксильной
звена гликополимера 1 можно представить следу
группы пирувата, и более интенсивный -
ющим образом: →3) α [α D ArafD(1→2)] D
при 173,1 м.д., характерный для карбоксильной
Rhap (1→2) α D Rhap (1→3) α D Rhap (1→2)
группы уроновой кислоты. В спектре ЯМР
α D Rhap (1→.
1H (рис. 5, вверху) в аномерной области наблю
Кислая фракция (гликополимер 2). Спектр
дались интенсивные сигналы четырёх прото
ЯМР13C гликополимера 2 (рис. 1, в) в области нов (δH 4,47, дублет J1,2 8 Hz; δH 4,61, дублет J1,2
БИОХИМИЯ том 86 вып. 4 2021
РАМНАН И ТЕЙХУРОНОВАЯ КИСЛОТА Rathayibacter sp. ВКМ Ас 2759
601
8 Hz; δH 4,66, уширенный синглет J1,2 < 2 Hz и
нозы (β Glcp, остаток C) и β маннопирано
δH 4,73, дублет J1,2 8 Hz). Только минорные сиг
зы (β Manp, остаток D).
налы метильных групп от четырёх остатков
Отнесение сигналов атомов углерода в
рамнопиранозы из гликополимера 1 и слабый
спектрах 1H,13C HSQC (рис. 5) и 1H,13C HSQC
синглет при 1,53 м.д. наблюдались в высоко
TOCSY dePyrDгликополимера 2, а также сравне
польной области спектра. Почти полное исчез
ние спектров ЯМР13C остатков со спектрами
новение сигналов пируватных групп в гликопоD
для соответствующих незамещённых пираноз
лимере 2 при сравнении его спектров со спект
выявило замещение остатков A (δC4 81,5), B (δC4
рами для исходного суммарного препара
78,4) и C (δC4 80,1) в положение 4 и замещение
та (рис. 1, а) выявило нестабильность пирувата
остатка D (δC3 81,5) в положение 3.
в кислом растворе (вследствие автогидролиза).
Последовательность остатков в dePyrDгликоD
Локализация пирувата в исходном кислом пре
полимере
2
следовала из анализов спектров
парате была установлена после изучения струк
1Н,1Н ROESY и 1H,13C HMBC. Гомоядерный
туры депирувилированного гликополимера 2
2D спектр1Н,1Н ROESY (рис. 6, таблица) со
(dePyrDгликополимер 2).
держал следующие корреляционные пики меж
Анализ нейтральных моносахаридов в dePyrD
ду протонами:
1A/4B
(4,73/4,15);
1B/4C
гликополимере 2 показал присутствие в качестве
(4,47/3,67); 1C/2,3D (4,61/4,17; 3,85) и 1D/4A
основных компонентов полисахарида галакто
(4,66/3,82), демонстрируя линейное повто
зы, глюкозы и маннозы в соотношении 1/1/0,6.
ряющееся звено dePyrDгликополимера
2:
Анализ спектров
1H,1H COSY, TOCSY
→4A1→ 4B1→4C1→3D1→.
и ROESY dePyrDгликополимера 2 из кислой фрак
Анализ спектра 1H,13C HMBC (рис. 7, табли
ции показал наличие остатков β глюкуроновой
ца), содержащего корреляционные пики: H 1(A)/
кислоты (β GlcpA, остаток A, таблица), β галак
C 4(B) (4,73/78,4); H 1(B)/C 4(C) (4,47/80,1);
топиранозы (β Galp, остаток B), β глюкопира
H 1(C)/C 3(D)
(4,61/81,5); H 1(D)/C 4(A)
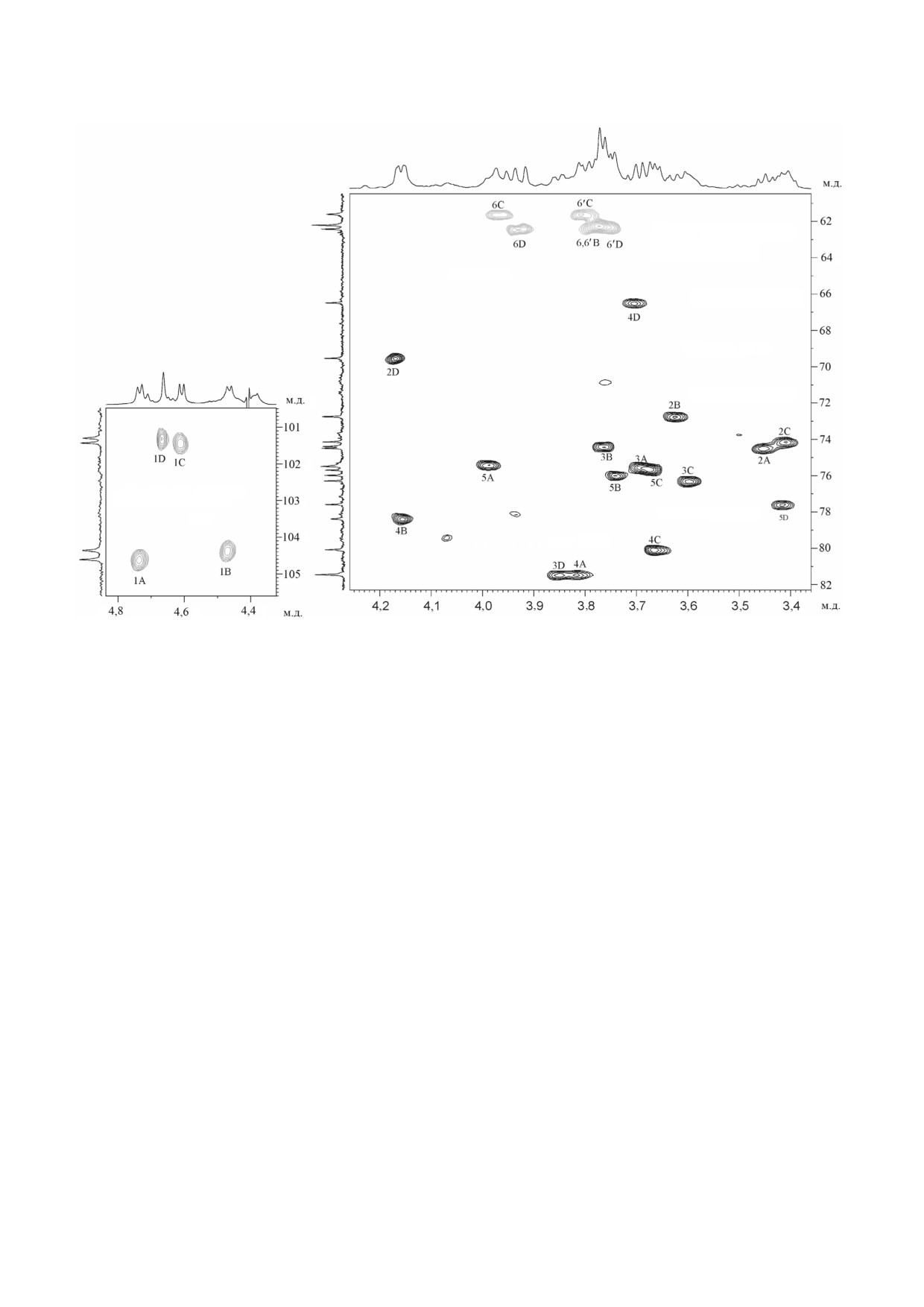
Рис.
4. Часть двумерного 1H,13C HMBC спектра гликополимера 1 нейтральной фракции из клеточной стенки
Rathayibacter sp. ВКМ Ac 2759. Соответствующие части1H и 13C ЯМР спектров приведены вверху и слева от двумерного
спектра соответственно. Арабские цифры до косой черты относятся к атомам протона, а после - к атомам углерода в ос
татках, обозначенных заглавными латинскими буквами в соответствии с таблицей
10 БИОХИМИЯ том 86 вып. 4 2021
602
ШАШКОВ и др.
Рис. 5. Части двумерного 1H,13C HSQC спектра dePyrDгликополимера 2 кислой фракции из клеточной стенки
Rathayibacter sp. ВКМ Ac 2759. Соответствующие части1H и 13C ЯМР спектров приведены вверху и слева от двумерного
спектра соответственно. Арабские цифры относятся к номерам атомов углерода в остатках, обозначенных заглавными ла
тинскими буквами в соответствии с таблицей
(4,66/81,5), так же как H 4(B)/C 1(A) (4,15/104,6);
ция пирувата с шестичленным циклом в интакт
H 4(C)/C 1(B)
(3,67/104,4); H 3(D)/C 1(C)
ном гликополимере 2 у С 4,6 маннопирано
(3,85/101,4) и H 4(A)/C 1(D) (3,82/101,3), пока
зы (остаток D′), поскольку остатки В и С оказа
зал согласование с последовательностью, пред
лись гликозилированными в положение 4. Это
ставленной выше.
утверждение можно было экспериментально
Газожидкостная хроматография обработан
подтвердить с помощью анализа двумерных
ного оптически активным октанолом гидроли
спектров ЯМР исходного суммарного препара
зата гликополимера 2 выявила D абсолютную
та, представляющего собой смесь гликополимеD
конфигурацию глюкозы, галактозы и маннозы.
ра 1 и интактного гликополимера 2, содержащего
Как положительный эффект β гликозилирова
4,6 пируват. Анализ спектров облегчался тем,
ния по C 3 (+1,4 м.д.) остатка A (GlcpA) в диса
что сигналы нейтрального гликополимера и
харидном фрагменте
→3) β Manp (1→4) β
сигналы остатков A, B и C кислого гликополи
GlcpA (1→, так и отсутствие γ эффекта по C 6
мера в спектрах исходного препарата совпадали
остатка B (Galp) в фрагменте →4) β GlcpA
с таковыми в спектрах разделённых полиме
(1→4) β Galp (1→ указывают на одну и ту же
ров (рис. 2 и 5, таблица). Только в подспектре
D конфигурацию остатков D, A и A, B в соответ
кислого гликополимера в спектре суммарного
ствующих фрагментах [14].
препарата существенно изменился сигнал ос
Таким образом, dePyrDгликополимер 2 имеет
татка D′ (с δC4 73,7 - для остатка D′ на δC4 66,5 -
следующую структуру повторяющегося звена:
для остатка D).
→4) β D GlcpA (1→4) β D Galp (1→4) β D
Низкопольный химический сдвиг сигна
Glcp (1→3) β D Manp (1→.
лов C 4 и C 6 (эффекты α замещения) и высо
Принимая во внимание структуру dePyrDглиD
копольный химический сдвиг сигнала C 5 (два
кополимера 2, становится очевидной локализа эффекта β замещения) были типичными для
БИОХИМИЯ том 86 вып. 4 2021
РАМНАН И ТЕЙХУРОНОВАЯ КИСЛОТА Rathayibacter sp. ВКМ Ас 2759
603
пирувата, расположенного в положениях
4
клеточной стенки штамма ВКМ Ac 2759, явля
и 6 (таблица). Локализация пировиноградной
ющегося претендентом на новый вид рода
кислоты на остатке D маннопиранозы по поло
Rathayibacter [10]. Структуры полимеров описа
жению О 4 и О 6, а также наличие интенсивно
ны впервые у прокариотов. У штамма ВКМ Ac
го сигнала при δС 25,9 м.д., характерного для пи
2759 обнаружены D рамнан и ацеталированная
руватной группы с шестичленным циклом и с
пировиноградной кислотой тейхуроновая кис
экваториальной ориентацией метильной груп
лота, отличные от гликополимеров представи
пы в этом цикле, свидетельствовали об S кон
телей других видов рода [8, 9]. Эти результаты
фигурации пирувата [15].
согласуются с полученными ранее данными,
Таким образом, гликополимер 2 является тей
свидетельствующими о видоспецифичности
хуроновой кислотой и имеет следующую струк
гликополимеров клеточных стенок для актино
туру повторяющегося звена: →4) β D GlcpA
бактерий рода Rathayibacter [8].
(1→4) β D Galp (1→4) β D Glcp (1→3) β
Основная цепь выявленного рамнана пост
[4,6 S Pyr] D Manp (1→.
роена из тетрасахаридных повторяющихся
звеньев, в которых остатки α D рамнопирано
В настоящей работе представлены результа
зы связаны чередующимися (1→2) и (1→3) гли
ты изучения состава и структур гликополимеров козидными связями. Каждый остаток на нере
Рис. 6. Часть двумерного 1H,1H ROESY спектра dePyrDгликополимера 2 кислой фракции из клеточной стенки
Rathayibacter sp. ВКМ Ac 2759. Соответствующие части 1H ЯМР спектра показаны вдоль осей. Арабские цифры относят
ся к номерам атомов протона в остатках, обозначенных заглавными латинскими буквами в соответствии с таблицей. Ко
сая черта обозначает пики корреляции между остатками
БИОХИМИЯ том 86 вып. 4 2021
10*
604
ШАШКОВ и др.
Рис. 7. Часть двумерного 1H,13C HMBC спектра dePyrDгликополимера 2 кислой фракции из клеточной стенки
Rathayibacter sp. ВКМ Ac 2759. Соответствующие части1H и 13C ЯМР спектров приведены вверху и слева от двумерного
спектра соответственно. Арабские цифры до косой черты относятся к атомам протона, а после - к атомам углерода в ос
татках, обозначенных заглавными латинскими буквами в соответствии с таблицей
дуцирующем конце тетрасахарида гликозилиро
(Bacterial Carbohydrate Structure Database:
ван по гидроксилу при С 2 боковыми остатка
ми α D арабинофуранозы: →3) α [α D ArafD
да Rathayibacter L изомер рамнозы присутствует в
(1→2)] D Rhap (1→2) α D Rhap (1→3) α D
нейтральном полисахариде R. toxicus и тейхуро
Rhap (1→2) α D Rhap (1→. Ранее у грамполо
новых кислотах R. iranicus [7] и R. caricis [9].
жительных бактерий арабинофуранозу находи
Близкий по структуре к полисахариду штам
ли только в составе арабиногалактанов клеточ
ма ВКМ Ac 2759 D рамнан был описан в гли
ной стенки представителей семейства Myco
копротеине S слоя Aneurinibacillus therD
bacteriaceae (Bacterial Carbohydrate Structure
moaerophilus GS4 97, выделенном из сока сахар
ной свёклы [18]. Основная цепь полимера также
Среди актинобактерий рода Rathayibacter
состояла из тетрасахаридных повторяющихся
D рамнан (отличающийся по структуре) был об
звеньев с чередованием гликозидных свя
наружен нами у R. caricis ВКМ Ac 1799T [9]. Изу
зей (1→2) и (1→3), но в качестве боковых замес
ченные к настоящему времени штаммы четырех
тителей присутствовали остатки аминопроиз
других видов Rathayibacter содержали в клеточ
водного фукопиранозы: →3) α [α D Fucp3NAc
ной стенке рамноманнаны [8]. Следует отметить,
(1→2)] D Rhap (1→3) α [α D Fucp3NAc
что все идентифицированные у Rathayibacter рам
(1→2)] D Rhap (1→2) α D Rhap (1→2) α D
номаннаны и рамнаны имеют общую особен
Rhap (1→.
ность: наличие в их составе рамнозы в D конфи
D Рамнаны довольно часто встречаются в
гурации [8, 9], которая значительно реже встре
биополимерах грамотрицательных бактерий
чается в гликополимерах бактерий по сравнению
(Bacterial Carbohydrate Structure Database: http://
с широко распространенной L рамнозой [16, 17]
csdb.glycoscience.ru). Среди них описаны поли
БИОХИМИЯ том 86 вып. 4 2021
РАМНАН И ТЕЙХУРОНОВАЯ КИСЛОТА Rathayibacter sp. ВКМ Ас 2759
605
сахариды, в том числе с тетрасахаридными пов
структурах гликополимеров, представителей ро
торяющимися звеньями, но с другим положени
да Rathayibacter, а также сведения о моносаха
ем и чередованием гликозидных связей в струк
ридном составе их клеточных стенок (рамноза,
туре основной цепи. Например, у фитопатоге
манноза, глюкоза, галактоза, арабиноза) позво
нов Burkholderia gladioli pv. agaricicola такой D
ляют более полно охарактеризовать род и его
рамнан присутствует в качестве экзополисаха
виды и могут быть использованы в таксономи
рида: →4) α D Rhap (1→3) α D Rhap (1→3)
ческой практике для дифференциации таксонов
α D Rhap (1→3) β D Rhap (1→; у Pantoea
видового и родового рангов на фенотипическом
agglomerans - O специфического полисахарида:
уровне. Кроме того, полученные результаты
→2) α D Rhap (1→2) β D Rhap (1→3) α D
расширяют представления о разнообразии гли
Rhap (1→2) α D Rhap (1→ [19, 20]. Интересно
кополимеров микробного происхождения и мо
отметить, что у представителей различных пато
гут быть востребованы в работах по выяснению
варов Pseudomonas syringae в составе О полиса
механизмов колонизации и инфекции растений
харидов были найдены линейные энантиомер
бактериями рода Rathayibacter.
ные рамнаны [17].
Тейхуроновая кислота Rathayibacter sp.
ВКМ Ac 2759, гликополимер 2, содержит в повто
Финансирование. Работа выполнялась в рам
ряющемся звене четыре моносахаридных остат
ках программы исследований № ЦИТИС: АА
ка, один из которых, маннопираноза, несет аце
АА А16 116021660068 1, запланированных в
таль пировиноградной кислоты в S конфигура
МГУ имени М.В. Ломоносова, кафедра микро
ции: →4) β D GlcpA (1→4) β D Galp (1→4)
биологии 2016-2022 гг.
β D Glcp (1→3) β [4,6 S Pyr] D Manp (1→.
Благодарности. Авторы благодарны Галине
Это второй случай обнаружения пирувата в
Матвеевне Стрешинской за помощь в исследо
структуре тейхуроновых кислот у представителей
ваниях и обсуждении статьи.
рода Rathayibacter. Ранее тейхуроновая кислота,
Конфликт интересов. Авторы заявляют об от
содержащая ацеталь пировиноградной кислоты с
сутствии конфликта интересов.
гептасахаридным повторяющимся звеном, была
Соблюдение этических норм. Настоящая
обнаружена у R. caricis ВКМ Ac 1799T [9].
статья не содержит описания выполненных ав
Таким образом, результаты настоящей рабо
торами исследований с участием людей или ис
ты и опубликованные ранее данные о наборе и пользованием животных в качестве объектов.
СПИСОК ЛИТЕРАТУРЫ
1.
Zgurskaya, H. I., Evtushenko, L. I., Akimov, V. N., and
Rhamnose containing cell wall glycopolymers from
Kalakoutskii, L. V. (1993) Rathayibacter gen, nov., includ
Rathayibacter toxicus VKM Ac 1600 and “Rathayibacter
ing the species Rathayibacter rathayi comb. nov.,
tanaceti” VKM Ac 2596, Biochemistry (Moscow), 83, 717
Rathayibacter tritici comb. nov., Rathayibacter iranicus
726, doi: 10.1134/S0006297918060093.
comb., nov., and six strains from annual grasses, Int. J. Sys.
7. Dmitrenok, A. S., Shashkov, A. S., Streshinskaya, G. M.,
Bacteriol., 43, 143 149, doi: 10.1099/00207713 43 1 143.
Tul’skaya, E. M., Potekhina, N. V., et al. (2019) New
2.
Evtushenko, L. I., and Dorofeeva, L. V. (2012) Genus
rhamnose contaning glycopolymers from Rathayibacter
XXII. Rathayibacter Zgurskaya, Evtushenko, Akimov and
iranicus VKM Ac 1602T cell wall, Carbohydr. Res., 482,
Kalakoutskii 1993, 147VP in Bergey’s manual of systematic
107728, doi: 10.1016/j.carres.2019.06.007.
bacteriology (Goodfellow, M., Kämpfer, P., Busse, H. J.,
8. Shashkov, A. S., Tul’skaya, E. M., Streshinskaya, G. M.,
Trujillo, M. E., Suzuki, K. I., Ludwig, W., Whitman,
Dmitrenok, A. S., Potekhina, N. V., et al.
(2020)
W. B., eds.) 2nd Edn., Vol. 5, Springer, New York,
Rhamnomannans and teichuronic acid from the cell wall
Dordrecht, Heidelberg, London, pp. 953 964.
of Rathayibacter tritici VKM Ac 1603T, Biochemistry
3.
Murray, T. D., Schroeder, B. K., Schneider, W. L., Luster,
(Moscow), 85, 369 377, doi: 10.1134/S0006297920030128.
D. G., Sechler, A., et al. (2017) Rathayibacter toxicus, other
9. Shashkov, A. S., Potekhina, N. V., Dmitrenok, A. S.,
Rathayibacter species inducing bacterial head blight of
Tul’skaya, E. M., Senchenkova, S. N., et al. (2021) D
grasses, and the potential for livestock poisonings,
Rhamnan and teichuronic acid from the cell wall of
Phytopathology, 107, 804 815, doi: 10.1094/PHYTO 02
Rathayibacter caricis VKM Ac 1799T, Carbohydr. Res.,
17 0047 RVW.
499, 108233.
4.
Murray, T. D., Barrantes Infante, B., and Schroeder, B. K.
10. Tarlachkov, S. V., Starodumova, I. P., Dorofeeva, L. V.,
(2020) First report of bacterial head blight of
Prisyazhnaya, N. V., Leyn, S. A., et al. (2020) Complete
Pseudoroegneria spicata subsp. spicata caused by
and draft genome sequences of 12 plant associated
Rathayibacter agropyri in Idaho, Plant Disease, 104, 1534,
Rathayibacter strains of known and putative new species,
doi: 10.1094/PDIS 06 19 1233 PDN.
Microbiol. Resour. Announc., 9, e00316 20, doi: 10.1128/
5.
Starodumova, I. P. (2018) Development of the classifica
MRA.00316 20.
tion system for actinobacteria of the genus Rathayibacter,
11. Potekhina, N. V., Streshinskaya, G. M., Tul’skaya, E. M.,
candidate dissertation (in Russian), Moscow.
and Shashkov, A. S. (2011) Cell wall teichoic acids in the
6.
Shashkov, A. S., Tul’skaya, E. M., Dmitrenok, A. S.,
taxonomy and characterization of Gram positive bacte
Streshinskaya, G. M., Potekhina, N. V., et al.
(2018)
ria, in Methods in Microbiology (Rainey, F. A., and
БИОХИМИЯ том 86 вып. 4 2021
606
ШАШКОВ и др.
Oren, A., eds.) Vol. 38, Chap.
6, Academic Press,
16. Mistou, M. Y., Sutcliffe, I. C., and van Sorge, N. M.
Elsevier, pp. 132 164, doi: 10.1016/B978 0 12 387730
(2016) Bacterial glycobiology: rhamnose containing cell
7.00020 6.
wall polysaccharides in Gram positive bacteria, FEMS
12.
Leontein, K., Lindberg, B., and Lönngren, J.
(1978)
Microbiol. Rev., 40, 464 479, doi: 10.1093/femsre/fuw006.
Assignment of absolute configuration of sugars by glc of
17. Knirel, Y. A. (2010) O Specific polysaccharides of Gram
their acetylated glycosides formed from chiral alcohols,
negative bacteria, in Microbial Glycobiology (Holst, O.,
Carbohyd. Res.,
62,
359362, doi:
10.1016/S0008
Brennan, P. J., von Itzstein, M., eds.) Vol. 4, Academic
6215(00)80882 4.
Press, pp. 57 73, doi: 10.1016/B978 0 12 374546 0.X0001 6.
13.
Gerwig, G. J., Kamerling, I. P., and Vliegenthart, J. F. G.
18. Schaffer, C., Muller, N., Christian, R., Graninger, M.,
(1979) Determination of the absolute configuration of
Wugeditsch, T., et al. (1999) Complete glycan structure of
monosaccharides in complex carbohydrates by capillary
the S layer glycoprotein of Aneurinibacillus therD
GLC, Carbohydr. Res., 77, 1 7, doi: 10.1016/s0008
moaerophilus GS4 97, Glycobiology,
9,
407414,
6215(00)83788 x.
doi: 10.1093/glycob/9.4.407.
14.
Shashkov, A. S., Lipkind, G. M., Knirel, Y. A., and
19. Kaczynski, Z., Karapetyan, G., Evidente, A., Iacobellis,
Kochetkov, N. K. (1988) Stereometrical factors determin
N. S., and Holst, O. (2006) The structure of a putative
ing the effects of glycosylation on the 13C chemical shifts in
exopolysaccharide of Burkholderia gladioli pv. agaricicola,
carbohydrates, Magn. Reson. Chem.,
26,
735747,
Carbohydr. Res., 341, 285288, doi: 10.1016/j.carres.
doi: 10.1002/mrc.1260260904.
2005.10.020.
15.
Garegg, P. J., Jansson, P. E., Lindberg, B., Lindh, F.,
20. Cimmino, A., Marchi, G., Hanuszkiewicz, A., Surico, G.,
Lönngren, J. (1980) Configuration of the acetal carbon
Evidente, A., and Holst, O. (2008) The structure of the O
atom of pyruvic acid acetals in some bacterial polysaccha
specific polysaccharide of the lipopolysaccharide from
rides, Carbohydr. Res., 79, 127 132, doi: 10.1016/S0008
Pantoea agglomerans strain FL1, Carbohydr. Res., 343, 392
6215(00)83666 6.
396, doi: 10.1016/j.carres.2007.10.023.
D RHAMNAN AND PYRUVAT CONTAINING TEICHURONIC ACID
FROM THE CELL WALL OF Rathayibacter sp. VKM Ac 2759
A. S. Shashkov1, E. M. Tul’skaya2*, N. V. Potekhina2, A. S. Dmitrenok1,
S. N. Senchenkova1, V. A. Zaychikov2, L. V. Dorofeeva3, and L. I. Evtushenko3
1 Zelinsky Institute of Organic Chemistry, Russian Academy of Sciences, 199334 Moscow, Russia
2 Faculty of Biology, Lomonosov Moscow State University, 119234 Moscow, Russia; EDmail: em_tulskaya@mail.ru
3 AllDRussian Collection of Microorganisms (VKM), Skryabin Institute of Biochemistry
and Physiology of Microorganisms, Pushchino Scientific Center for Biological Research,
Russian Academy of Sciences, 142290 Pushchino, Moscow Region, Russia
Rathayibacter sp. VKM Ac 2759 (family of Microbacteriaceae, class Actinobacteria) contains two glycopolymers in
the cell wall. The main chain of rhamnan, glycopolymer 1, is built from the repeating tetrasaccharide units carrying
terminal arabinofuranose residues at the non reducing end, →3) α [α D Araf (1→2)] D Rhap (1→2) α D Rhap
(1→3) α D Rhap (1→2) α D Rhap (1→. Similar to other described Rathayibacter species, rhamnose in the neu
tral glycopolymer of the VKM Ac 2759 strain is present in D configuration. Teichuronic acid with pyruvilated units,
glycopolymer 2, is composed of tetrasaccharide repeating units, →4) β D GlcpA (1→4) β D Galp (1→4) β D
Glcp (1→3) β [4,6 S Pyr] D Manp (1→. The polymer structures were established using chemical analysis and
NMR spectroscopy, and described for the first time in prokaryotic microorganisms. The data obtained can be used in
taxonomic studies and in studies elucidating mechanisms of colonization and infection of plants by bacteria of the
Rathayibacter genus.
Keywords: Rathayibacter, cell wall, glycopolymers, D rhamnan, teichuronic acid, pyruvate
БИОХИМИЯ том 86 вып. 4 2021