БИОХИМИЯ, 2021, том 86, вып. 5, с. 619 - 628
УДК 577.152.311
ВЛИЯНИЕ ДИЕТЫ С ВЫСОКИМ СОДЕРЖАНИЕМ САХАРОЗЫ
НА УРОВНИ мРНК ЭЛОНГАЗ И ДЕСАТУРАЗ И АКТИВНОСТЬ
ЭТИХ БЕЛКОВ В ЖИРОВОЙ ТКАНИ КРЫСЫ
© 2021
Я. Драг1*, М. Кнапик%Чайка1, А. Гаведзка1, И. Гдула%Аргасинска2, Е. Яцкевич1
1 Department of Biochemical Analytics, Faculty of Pharmacy, Jagiellonian University Medical College,
30 688 Krakow, Poland; E mail: jagoda.drag@uj.edu.pl
2 Department of Radioligands, Faculty of Pharmacy, Jagiellonian University Medical College, 30 688 Krakow, Poland
Поступила в редакцию 07.10.2020
После доработки 09.02.2021
Принята к публикации 09.02.2021
В жировой ткани (AT) структура жирных кислот (FA) может подвергаться изменениям в результате
действия элонгаз и десатураз. Регуляция активности этих ферментов обеспечивается различными фактора#
ми, в том числе питательными веществами. Целью исследования была оценка влияния диеты с высоким со#
держанием сахарозы (HSD; 68% сахароза) на уровни мРНК элонгаз (Elovl2, Elovl5, Elovl6) и десатураз (Fads1,
Fads2, Scd) и определение активности соответствующих белков в AT крыс. Самцы крыс линии Wistar были
случайным образом разбиты на две группы. В первой группе (HSD) их кормили пищей с высоким содержа#
нием сахарозы, а в другой они получали стандартный пищевой рацион (ST). Уровни мРНК определяли с по#
мощью метода полуколичественной ПЦР с обратной транскриптазой. Состав FA анализировали с помощью
газовой хроматографии, и соотношения FA использовали для оценки активности ферментов. У крыс из
группы HSD уровни мРНК для Elovl5, Elovl6, Fads1 и Scd были выше, а уровень мРНК Fads2 ниже, чем в
группе ST. Повышенные уровни мРНК для Elovl5 и Elovl6 соответствовали относительно более высокой ак#
тивности этих ферментов, в то время как снижение уровня мРНК Fads2 ассоциировалось с пониженной ак#
тивностью этой десатуразы. Напротив, повышение уровня мРНК Scd сопровождалось снижением актив#
ности соответствующего фермента. В АТ крыс группы HSD было обнаружено меньше мононенасыщен#
ных FA, чем в группе ST. Выявлены различия в составе индивидуальных FA между группами. Это исследо#
вание поддерживает идею о том, что регуляция уровней мРНК и активности как элонгаз, так и десатураз иг#
рает важную роль в формировании липидного состава AT в ответ на изменения в пищевом рационе.
КЛЮЧЕВЫЕ СЛОВА: элонгазы, десатуразы, жирные кислоты, диета с высоким содержанием сахарозы,
жировая ткань.
DOI: 10.31857/S0320972521050018
ВВЕДЕНИЕ
на (TG), которые составляют до 85% массы WAT.
Преобладающими компонентами TG, хранящи#
Белая жировая ткань (WAT) хранит большое
мися в WAT, являются FA, такие как C14 : 0,
количество жирных кислот (FA) в форме внут#
C16 : 0, C16 : 1 n#7, C18 : 0, C18 : 1 n#9 и 18 : 2 n#
риклеточных отложений триацилглицери#
6, которые в сумме составляют до 90% от обще#
го количества FA, входящих в состав TG [1].
Принятые сокращения: AT - жировая ткань; BAT -
Жирные кислоты присутствуют в адипоци#
бурая жировая ткань (brown adipose tissue); ChREBP - бе#
тах в основном после приёма пищи и последую#
лок, связывающий элементы, реагирующие на углеводы
(carbohydrate#responsive element#binding protein); ELOVL -
щего гидролиза TG сывороточных липопротеи#
элонгаза; FA - жирная кислота; FADS1 и FADS2 - десату#
нов (хиломикроны, липопротеины очень низ#
разы жирных кислот 1 и 2; HSD - диета с высоким содер# кой плотности), катализируемого липопротеин#
жанием сахарозы; LXR - печёночный рецептор Х (liver X
липазой (LPL). Также они образуются в резуль#
receptor); MUFA - мононенасыщенная жирная кислота;
PUFA - полиненасыщенная жирная кислота; SAT - насы#
тате синтеза de novo из ацетил#КоА (липогенез
щенная жирная кислота; SCD - стеароил#КоА#десатураза;
de novo или DNL). Основным субстратом липо#
SREBP#1c - белок, связывающий регуляторный элемент генеза de novo является глюкоза, которая посту#
стерола 1c (sterol regulatory element#binding protein 1c); ST -
пает через инсулинзависимый глюкозный
стандартный пищевой рацион; TG - триацилглицерин;
транспортёр 4#го типа (GLUT 4) [2].
UNSAT - ненасыщенная жирная кислота; WAT - белая
жировая ткань; eWAT - белая жировая ткань придатка
В жировой ткани (АТ) структура FA может
яичка.
подвергаться изменениям под воздействием эн#
* Адресат для корреспонденции.
догенных ферментов, таких как элонгазы и де#
619
620
ДРАГ и др.
сатуразы, с образованием нескольких видов ли#
кулуме. Этот процесс требует наличия молеку#
пидов. Элонгация и десатурация FA являются
лярного кислорода, NADPH, флавопротеи#
двумя ключевыми метаболическими путями био#
на (цитохром#b5 редуктаза) и акцептора элект#
синтеза насыщенных (SAT), мононенасыщен#
ронов (цитохром#b5). Десатурация жирных кис#
ных (MUFA) и полиненасыщенных жирных
лот катализируется мембраносвязанными ацил#
кислот (PUFA) [2-4].
КоА#десатуразами, в состав которых в основном
В клетках млекопитающих удлинение це#
входят десатураза жирных кислот 1 (FADS1), де#
пи FA на два атома углерода (элонгация) проис#
сатураза жирных кислот 2 (FADS2) и стеароил#
ходит в основном в эндоплазматическом рети#
КоА#десатураза (SCD). FADS1 и FADS2 прини#
кулуме. Для этого процесса необходим мало#
мают участие в биосинтезе длинноцепочечных
нил#КоА в качестве донора двух атомов углеро#
полиненасыщенных FA. Их основными суб#
да и NADPH в качестве восстанавливающего
стратами являются полиненасыщенные жирные
агента. Начальная реакция конденсации, конт#
кислоты C16-С24 PUFA, преимущественно
ролирующая скорость, катализируется элонга#
18 : 2 n#6 и 18 : 3 n#3 [9]. Начальный этап Δ6#де#
зами, называемыми ELOVL (для удлинения
сатурации рассматривается как реакция, огра#
очень длинных FA). Связанные с мембраной
ничивающая скорость биосинтеза PUFA, кото#
элонгазы взаимодействуют с 3#кетоацил#КоА#
рая включает чередующееся действие десату#
редуктазой, дегидратазой и транс#2,3#еноил#
раз (FADS1 и FADS2) и элонгаз (ELOVL2 и
КоА#редуктазой для удлинения FA [5].
ELOVL5). SCD является ключевым ферментом
В семейство элонгаз входит семь чле#
биосинтеза MUFA, в основном олеата (18 : 1 n#9)
нов (ELOVL1-ELOVL7). Гены Elovl1, Elovl5 и
и пальмитолеата (16 : 1 n#7) [10, 11].
Elovl6 экспрессируется в различных тканях, в то
Было установлено, что экспрессия генов
время как Elovl2, Elovl3, Elovl4 и Elovl7 показы#
элонгаз и десатураз регулируется преимущест#
вают чёткую тканеспецифичную картину
венно на уровне транскрипции различными
экспрессии. ELOVL1 катализирует образование
факторами, включая питательные вещества и
насыщенных жирных кислот (SAT), содержа#
гормоны. Экспрессия генов элонгаз и десатураз
щих до 26 атомов углерода, и этот фермент пре#
регулируется непосредственно связыванием
имущественно экспрессируется в мозге.
факторов транскрипции, таких как белок, свя#
ELOVL2 удлиняет молекулы PUFA, таких как
зывающий элементы, реагирующие на углево#
C20 : 4 n#6, C20 : 5 n#3, C22 : 5 n#3 и демонстри#
ды (ChREBP) [12-14], печёночный рецеп#
рует ограниченный паттерн экспрессии генов с
тор Х (LXR) [15, 16], белок, связывающийся с
наивысшими уровнями мРНК в семенниках и
элементом регуляции стеролов (SREBP) и ре#
печени и в меньшей степени в WAT, головном
цептор, активируемый пролифератором перок#
мозге и почках. ELOVL3 катализирует образова#
сисом (PPAR) со специфическими чувствитель#
ние SATи MUFA длиной до 24 атомов углерода и
ными элементами промоторов генов [4, 5 17].
в основном экспрессируется в бурой жировой
Строгий контроль экспрессии генов элонгаз и
ткани (BAT). ELOVL4 участвует в биосинтезе
десатураз достигается за счёт комбинированно#
насыщенных жирных кислот с очень длинной
го действия различных факторов транскрипции.
цепью (VLCFA), C28 и C30, а также в синтезе
Большинство исследований по изучению
очень длинных полиненасыщенных жирных
влияния различных пищевых рационов на ак#
кислот (VLCPUFA) C28-С38. Этот фермент
тивность элонгаз и десатураз проводилось на
специфически экспрессируется в сетчатке и в
культурах клеток печени или гепатоцитов.
меньшей степени в мозге, семенниках, тимусе и
На настоящий момент было показано, что в
коже. ELOVL5 участвует в элонгации C18-
первичных гепатоцитах глюкоза способствует
С20 PUFA, и наивысшие уровни соответствую#
повышению уровня мРНК для Elovl6 и Scd, а ин#
щей мРНК были выявлены в печени, семенни#
сулин повышает уровни мРНК для Elovl6, Fads1,
ках, надпочечниках и WAT. ELOVL6, который
Fads2 и Scd [4]. Экспрессию гена Scd1 в печени
удлиняет C12-С16 SAT, экспрессируется в WAT,
мышей индуцировали кормлением голодных
BAT, печени и мозге. ELOVL7 представляет со#
мышей обезжиренной высокоуглеводной пи#
бой элонгазу VLCFA, которая была идентифи#
щей [18]. Также было показано, что экспрессия
цирована совсем недавно. Этот фермент участ#
и активность печёночных элонгаз (ELOVL1,
вует в удлинении SAT, содержащих до 24 атомов
ELOVL2, ELOVL5, ELOVL6) и десатураз
углерода, и экспрессируется на высоком уровне
(FADS1, FADS2, SCD) изменялась у взрослых
в почках, поджелудочной железе, надпочечни#
крыс#самцов после потребления ими пищи с
ках и простате [6-8].
высоким содержанием углеводов с добавкой
Введение двойных связей в цепь FA (десату#
оливкового масла (10%, w/w) и рыбьего жи#
рация) происходит в эндоплазматическом рети#
ра (10%, w/w) [14]. Однако данные о влиянии
БИОХИМИЯ том 86 вып. 5 2021
ВЛИЯНИЕ HSD НА ЭЛОНГАЗЫ И ДЕСАТУРАЗЫ
621
обогащённой сахарозой диеты (HSD) на элонга#
алюминиевых щипцов, предварительно охлаж#
зы и десатуразы в AT ограничены.
денных в жидком азоте. До проведения анали#
Целью настоящего исследования было оце#
зов все образцы хранили при -80 °C.
нить влияния HSD (68% сахарозы) на относи#
Определение уровня мРНК для элонгаз и деса%
тельные уровни мРНК Elovl2, Elovl5, Elovl6,
тураз. Относительные уровни мРНК для Elovl2,
Fads1, Fads2 и Scd в белой жировой ткани при#
Elovl5, Elovl6, Fads1, Fads2 и Scd в eWAT оцени#
датка яичка крысы (eWAT). Нами были отобра#
вали с помощью полуколичественной полиме#
ны гены Elovl2, Elovl5 и Elovl6, так как ранее
разной цепной реакции с использованием об#
экспрессия этих генов была продемонстрирова#
ратной транскриптазы. Препарат общей РНК из
на в WAT и является предметом регуляции пита#
жировой ткани получали с помощью реаген#
ния. Кроме того, были определены относитель#
та TRI («Sigma#Aldrich», Германия), а затем син#
ные активности (выраженные в виде индексов -
тезировали кДНК с использованием 1 мкг об#
соотношения отдельных FA) ELOVL5, ELOVL6,
щей РНК, обратной транскриптазы и олигоdT#
FADS2 и SCD. Также был определен состав FA
праймеров, входящих в RevertAid™ H Minus
жировой ткани.
First Strand cDNA Synthesis Kit («Fermentas»,
Литва). кДНК амплифицировали с помощью
ДНК#полимеразы OptiTaq («Eurx», Польша)
МАТЕРИАЛЫ И МЕТОДЫ
согласно инструкциям производителя. Для про#
ведения ПЦР в реакционную смесь добавляли
Животные. Крысы#самцы (6 недель) линии
1,2 мкл кДНК и 1,6 мкл специфических для
Wistar весом 151 ± 3 г были приобретены в пи#
каждого гена праймеров (табл. 1), которые были
томнике фармацевтического факультета Ягел#
предсказаны с помощью программы Primer3
лонского университета. Животных содержали в
(v. 0.4.0; NCBI, США). В работе использовали
отдельных клетках в стандартных условиях ис#
Mastercycler gradient EP 5331 («Eppendorf», Гер#
кусственного светового режима: 12 ч свет/тем#
мания). Продукты ПЦР подвергали электрофо#
нота при постоянной комнатной температуре
резу в 1,5%#ном агарозном геле, окрашивали
(21-23 °C). Крысам был предоставлен неогра#
этидиумбромидом и проводили денситометрию
ниченный доступ к пище и воде. Животные
с помощью программы Quantity One 4.2.1. («Bio#
(12 крыс) были случайным образом разбиты на
Rad», США). Полученные данные нормализова#
две группы:
(1) экспериментальная груп#
ли относительно β#актина как внутреннего
па (n = 6), получавшая HSD (68% сахароза, MP
контроля (в таком же образце). После выделе#
Biomedicals, 960236, США) и (2) контроль#
ния общей РНК были проведены две независи#
ная (ST) группа (n = 6), питавшаяся стандартной
мых ПЦР с обратной транскриптазой. Количе#
пищей (55% углеводов, Murigran, Concentrate
ство циклов ПЦР для всех протестированных
and Mix Feed Factory AGROPOL, Мотыч, Поль#
ферментов было равно 35.
ша). Животных кормили до достижения ими ве#
Экстракция липидов и определение содержа%
са в 250 г (21 день в группе HSD и 25 дней в груп#
ния жирных кислот (FA) в жировой ткани. Общий
пе ST). Не было выявлено изменений в их внеш#
экстракт липидов из eWAT получали по методу
нем виде или поведении. Затем крыс умерщвля#
Folch [19]. Синтез метиловых эфиров жирных
ли и вырезали белую жировую ткань придатков
кислот (FAME) проводили с использованием
яичка (eWAT). Ткань замораживали с помощью
14%#ного BF3 в метаноле согласно методу
Таблица 1. Праймеры, использованные для проведения ПЦР
Название
Последовательность
Последовательность
Концентрация;
Длина
гена
прямого праймера
обратного праймера
прямой/обратный
продукта
(символ)
праймер (мкМ)
(п.н)
Elovl2
TCAACAATGGCAGCTCAAAG
GGGGGATTTACTTGGGAAAA
4/4
249
Elovl5
GAGGCATCCTGGTGGTGTAT
ACGTGCAGGACTGTGATCTG
4/4
247
Elovl6
GCTACAACGGAGCAGAGGAC
CCATTTTCAAGCCAACCAGT
4/4
247
Fads1
GAAGGAACAGCAGTCCAAGC
GTCTGGACTCGTGGAAGAGC
4/4
185
Fads2
ATCTGCCCTACAACCACCAG
TGTGACCCACACAAACCAGT
4/4
248
Scd
CTGTTAGCCCAGCCTCACTC
GTCTGCAGGAAAACCTCTGC
2/2
668
β actin
AGCCATGTACGTAGCCATCC
CTCTCAGCTGTGGTGGTGAA
4/4
228
БИОХИМИЯ том 86 вып. 5 2021
622
ДРАГ и др.
Таблица 2. Проанализированные жирные кислоты
Группа
FA
SAT
12 : 0, 14 : 0, 15 : 0, 16 : 0, 17 : 0, 18 : 0, 21 : 0
UNSAT
14 : 1, 16 : 1 n#7, 17 : 1, 18 : 1 n#9, 18 : 2 n#6, 18 : 3 n#6, 18 : 3 n#3, 20 : 3 n#6, 20 : 4 n#6, 20 : 5 n#3, 22 : 6 n#3
MUFA
14 : 1, 16 : 1 n#7, 17 : 1, 18 : 1 n#9
PUFA
18 : 2 n#6, 18 : 3 n#6, 18 : 3 n#3, 20 : 3 n#6, 20 : 4 n#6, 20 : 5 n#3, 22 : 6 n#3
Metcalfe и Schmitz [20]. Полученные FAME ана#
SCD (C16) и SCD (C18) (данные представлены в
лизировали с помощью метода газовой хрома#
виде среднего значения и разброса). Приемле#
тографии Agilent 6890N («Agilent», США) с ис#
мый уровень достоверности был установлен как
пользованием пламенно#ионизационного де#
p < 0,05.
тектора (FID - flame ionization detector) и ко#
лонки DB#23 (60 м × 0,25 мм), как было описано
ранее [21, 22], и идентифицировали с использо#
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
ванием Supelco®
37
Component FAME
Mixstandards
(«Sigma#Aldrich»). Полученные
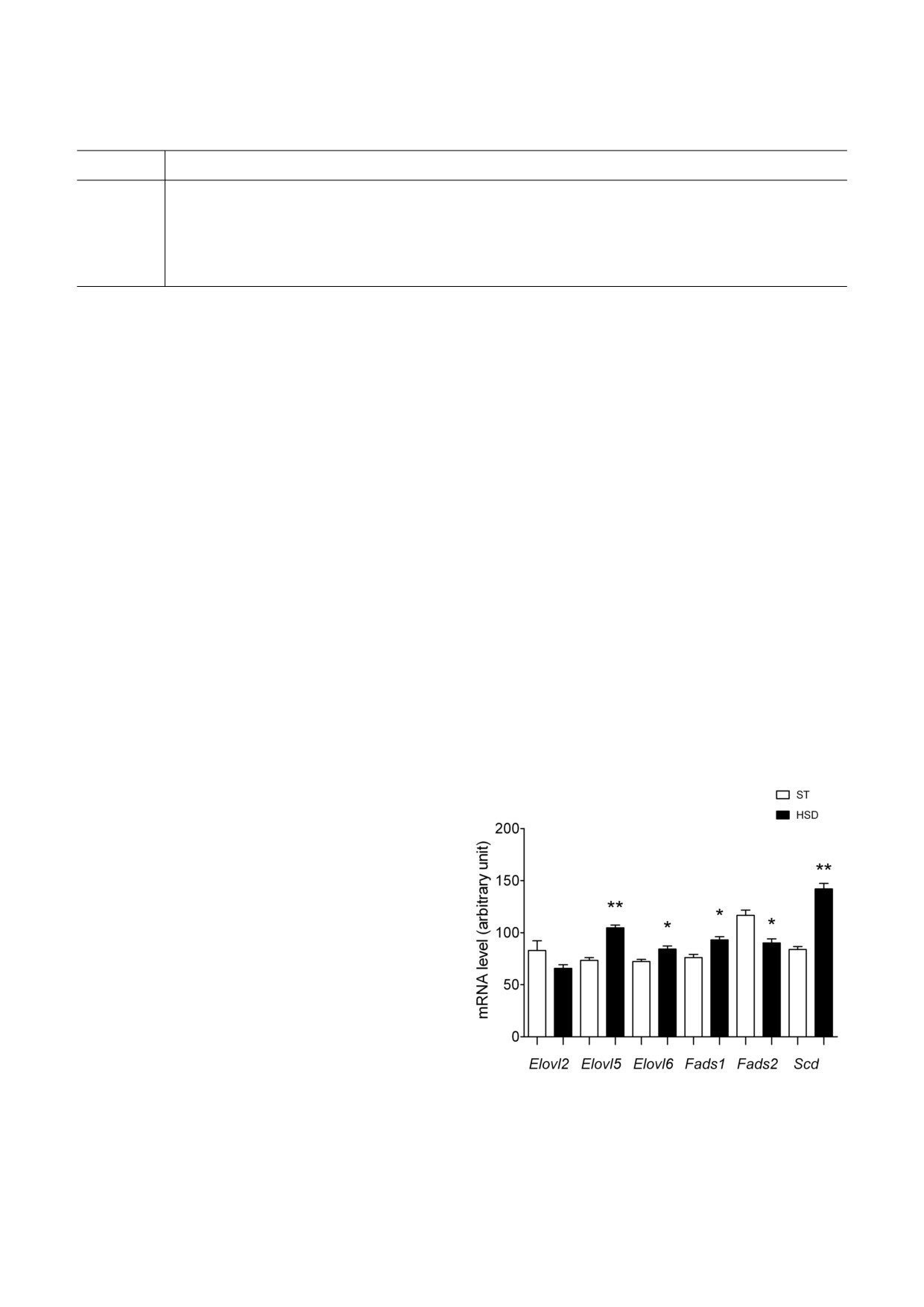
Оценка уровня мРНК для элонгаз и десатураз.
данные были проанализированы с использова#
В группе HSD уровень мРНК Elovl2 был пони#
нием программного обеспечения ChemStation
жен на 21% по сравнению с группой ST. Уровни
(«Agilent Technologies», Германия). Для каждого
мРНК Elovl5 и Elovl6 были на 43% и 16% выше
образца содержание отдельных жирных кислот
по сравнению с контролем. Выявленные разли#
выражали в виде процента от общего количест#
чия в случае Elovl5 и Elovl6 были статистически
ва жирных кислот. Жирные кислоты были раз#
достоверны (рис. 1).
биты на группы, обозначаемые как SAT, UNSAT
Уровень мРНК Fads2 в группе HSD снизился
(ненасыщенные жирные кислоты), MUFA и
на 23% по сравнению с группой ST. Напротив,
PUFA (табл. 2).
уровни мРНК для Fads1 и Scd были на 22% и
Индексы элонгации, десатурации и липогенеза
69% выше соответственно, чем в контрольной
de novo. Для оценки относительной активности
группе. Выявленные различия в уровне мРНК
отдельных элонгаз и десатураз были использо#
для Fads1, Fads2 и Scd были статистически дос#
ваны индексы, выраженные в виде соотноше#
товерны (рис. 1).
ния концентраций конкретных жирных кис#
FA%состав белой жировой ткани придатков
лот
[23,
24]. Индексы для SCD (C16) и
яичка. В жировой ткани крыс группы HSD со#
SCD (C18) описывают активность SCD в про#
цессе десатурации жирных кислот C16 и C18 со#
ответственно. Оценка индекса FADS1, как соот#
ношения 20 : 4 n#6 и 20 : 3 n#6, оказалась невоз#
можной из#за отсутствия в хроматограммах пи#
ка, соответствующего 20 : 4 n#6.
Статистическая обработка данных. Статисти#
ческая обработка данных была проведена с по#
мощью программ STATISTICA 13 и GraphPad
Prism v. 5.02. Для оценки нормализации исполь#
зовали критерий Шапиро-Вилк. Односторон#
ний дисперсионный анализ ANOVA и крите#
рий Тьюки использовались для оценки уровня
мРНК для всех элонгаз и десатураз, индек#
сов (такие как SAT, UNSAT, PUFA и MUFA),
состава жирных кислот 16 : 0, 16 : 1, 18 : 0, 18 : 2
n#6, 18 : 3 n#6, 18 : 3n#3 и индексов для ELOVL5
и ELOVL6 и FADS2 (данные представлены в ви#
де среднего значения ± SD). U#критерий Ман#
Рис. 1. Относительные уровни мРНК для генов Elovl2,
на-Уитни был использован для анализа состава
Elovl5, Elovl6, Fads1, Fads2 и Scd в eWAT у крыс из груп#
жирных кислот 12 : 0, 14 : 0, 14 : 1, 15 : 0, 17 : 0,
пы HSD (n = 6) и контрольной (ST) группы (n = 6);
17 : 1, 18 : 1 n#9, 21 : 0, 20 : 3 n#6 и индексов для
* p < 0,01, ** p < 0,001
БИОХИМИЯ том 86 вып. 5 2021
ВЛИЯНИЕ HSD НА ЭЛОНГАЗЫ И ДЕСАТУРАЗЫ
623
HSD по сравнению с группой ST. Процентное
содержание других FA в группе HSD было ниже,
чем у контрольных крыс. Выявленные различия
были статистически достоверными для всех FA,
за исключением 21 : 0 (табл. 3).
В отличие от крыс группы ST, в жировой тка#
ни крыс группы HSD арахидоновая (20 : 4 n#6),
эйкозапентаеновая (20 : 5 n#3) и докозагексае#
новая (22 : 6 n#3) кислоты обнаружены не бы#
ли (табл. 3). Типичные хроматограммы пред#
ставлены на рис. 3.
Активность элонгаз и десатураз. Мы также об#
наружили различия в активности (выраженные
в виде индексов) элонгаз и десатураз в белой
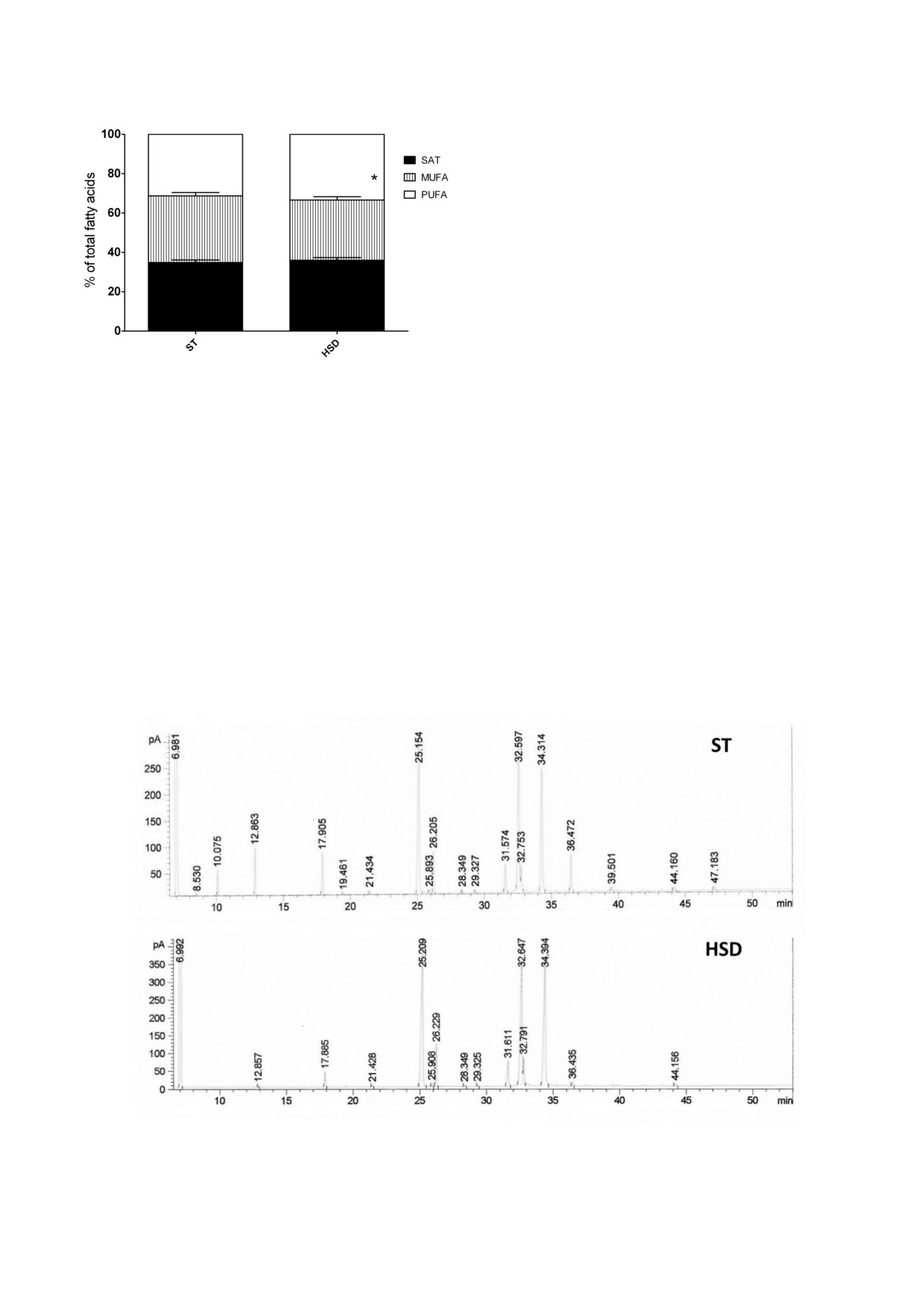
Рис.
2. Средние значения индексов SAT, PUFA
eWAT крыс. В группе HSD индексы FADS2,
и MUFA в eWAT крыс группы HSD (n = 6) и контроль#
ной группы (ST) (n = 6); * p < 0,01
SCD (C16) и SCD (C18) были понижены на 93,
51 и 16% соответственно по сравнению с груп#
пой ST. Индексы ELOVL5 и ELOVL6 были на 828
держание SAT увеличилось на 3%, а содержание
и 12% выше по сравнению с контролем. Все
ненасыщенных жирных кислот (UNSATs)
наблюдаемые различия были статистически
уменьшилось на 2% по сравнению с группой ST.
достоверными (табл. 4). В группе HSD актив#
Средний уровень PUFA был на 7% выше в груп#
ность FADS1 не определялась из#за отсутствия
пе HSD, чем в контрольной группе. Средний
FA, необходимой для определения индекса.
уровень MUFA был на 10% ниже, чем в груп#
пе ST, и выявленные различия были статисти#
чески достоверны (рис. 2).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Процентное содержание отдельных жирных
кислот у крыс групп HSD и ST различается. Со#
Результаты этого исследования показывают,
держание 16 : 0, 18 : 0 и 18 : 2 n#6 выше в группе что HSD снижает общее содержание MUFA
Рис. 3. Типичные хроматограммы для групп ST и HSD
БИОХИМИЯ том 86 вып. 5 2021
624
ДРАГ и др.
Таблица 3. Содержание FA в процентах и изменения их со#
В нашем исследовании относительные уровни
держания в группе HSD в сравнении с группой ST
мРНК для Elovl6 и Scd в группе HSD были выше,
чем в контрольной группе. Известно, что угле#
% FA в
% FA
% FA в группе HSD
FA
группе ST
в группе HSD
относительно группы
воды пищи индуцируют секрецию инсулина β#
ST
клетками поджелудочной железы и повышают
поглощение глюкозы адипоцитами [25, 26]. Бы#
12 : 0
1,1
0,3
↓ 74*
ло показано, что в адипоцитах глюкоза и инсу#
14 : 0
2,9
1,8
↓ 40**
лин стимулируют факторы транскрипции
LXRα, ChREBP и SREBP#1c (белки, связываю#
14 : 1
0,2
0,1
↓ 58**
щие регуляторный элемент стерола 1c). Глюкоза
15 : 0
0,5
0,2
↓ 51**
активирует преимущественно ChREBP, в то вре#
16 : 0
26,6
29,4
↑ 11**
мя как инсулин активирует LXRα либо прямо,
16 : 1 n#7
5,9
4,1
↓ 31*
либо через SREBP#1c [27-31]. Эти факторы
транскрипции, в особенности ChREBP, регули#
17 : 0
0,3
0,2
↓ 43**
руют экспрессию элонгаз и десатураз, включая
17 : 1
0,4
0,2
↓ 59**
гены Elovl6 и Scd [4]. Мы не измеряли уровни
18 : 0
3,3
4,0
↑ 21***
мРНК и белка для LXRα, ChREBP и SREBP#1c,
18 : 1 n#9
27,4
26,3
↓ 4*
но предполагаем, что HSD стимулирует экс#
18 : 2 n#6
21,7
32,2
↑ 51***
прессию генов Elovl6 и Scd, активируя эти тран#
скрипционные факторы.
18 : 3 n#6
5,5
0,6
↓ 88***
В настоящем исследовании было показано,
18 : 3 n#3
0,6
0,2
↓ 68***
что повышенный уровень мРНК Elovl6 соответ#
21 : 0
0,2
0,2
↓ 26
ствует более высокой активности ELOVL6. На#
20 : 3 n#6
0,5
0,4
↓ 28*
против, повышение содержания мРНК Scd со#
20 : 4 n#6
0,7
0,0
-
провождалось снижением активности соответ#
ствующего фермента. Нельзя исключить, что
20 : 5 n#3
0,9
0,0
-
активность SCD регулируется на пост#тран#
22 : 6 n#3
1,5
0,0
-
скрипционном уровне. Tan et al. [32] показали,
что miR#199a#3p подавляет активность SCD и
Примечание. * p < 0,05; ** p < 0,01; *** p < 0,001.
изменяет состав FA в адипоцитах 3T3#L1, целе#
направленно воздействуя на 3′#UTR гена Scd.
Было показано, что глюкоза регулирует экс#
Таблица 4. Средние значения индексов элонгаз и десатураз
прессию микроРНК из семейства 199a в β#клет#
Фермент
Индекс
ST
HSD
ках поджелудочной железы [33]. В исследовании
Li et al. [34] было показано, что в плазме боль#
FADS2
18 : 3 n#6/18 : 2 n#6
0,25 ± 0,01
0,01 ± 0,007**
ных диабетом экспрессия miR#199a#3p повыше#
SCD (C16)
16 : 1 n#7/16 : 0
0,23 (0,14#0,27)
0,11 (0,11#0,14)*
на по сравнению со здоровыми волонтёрами.
SCD (C18)
18 : 1 n#9/18 : 0
8,07 (7,96#9,32)
6,76 (6,04#7,03)*
Мы предполагаем, что HSD может быть ответ#
ственным за ингибирование трансляции мРНК
ELOVL5
20 : 3 n#6/18 : 3 n#6
0,09 ± 0,008
0,91 ± 0,41**
Scd и снижение активности SCD за счёт повы#
ELOVL6
18 : 0/16 : 0
0,12 ± 0,009
0,14 ± 0,006*
шения уровня miR#199a#3p.
Примечание. Данные представлены в виде среднего значе#
Нами было показано, что в eWAT крыс из
ния ± стандартное отклонение или в виде медианы (диапа#
группы HSD уровни 16 : 0 и 18 : 0 были значи#
зон). * p < 0,01, ** p < 0,001.
тельно выше, а уровни 16 : 1 n#7 и 18 : 1 n#9 бы#
ли понижены по сравнению с контролем. Эти
(сумма мононасыщенных жирных кислот 14 : 1,
результаты соответствуют результатам, полу#
16 : 1 n#7, 17 : 1 и 18 : 1 n#9) в eWAT крысы.
ченным на моделях нокаутированных живот#
Уменьшение содержания MUFA можно объяс#
ных. Так, мыши со специфическим удалением
нить более низкой активностью SCD у крыс, по#
из жировой ткани SCD1 (AKO), мыши с одно#
лучавших рацион, обогащённый сахарозой.
временным удалением SCD1 из печени и
Путь биосинтеза MUFA включает стадии, кото#
АТ (LAKO) и Scd1#дефицитные мыши характе#
рые катализируются ELOVL6 и SCD. ELOVL6 в
ризуются выраженным снижением содержания
основном ответственен за элонгацию 16 : 0
16 : 1 n#7 и 18 : 1 n#9 и повышением уровня 16 : 0
(пальмитиновая кислота) до 18 : 0 (стеариновая
и 18 : 0 в составе жирных кислот TG жировой
кислота), в то время как SCD, фермент, ограни#
ткани [35, 36]. Кроме того, недавно было пока#
чивающий скорость в синтезе MUFA, катализи#
зано, что пальмитолеиновая кислота контроли#
рует десатурацию насыщенных FA C16-C18.
рует важные метаболические процессы в АТ, та#
БИОХИМИЯ том 86 вып. 5 2021
ВЛИЯНИЕ HSD НА ЭЛОНГАЗЫ И ДЕСАТУРАЗЫ
625
кие как повышенный липолиз и поглощение
вой кислоты; однако мы полагаем, что более вы#
глюкозы, и увеличивает расход энергии за счёт
сокая активность ELOVL5 приводит к увеличе#
стимуляции цикла TG/FA [37, 38]. Мы предпо#
нию содержания этого соединения.
лагаем, что низкое содержание MUFA, особен#
Более высокий уровень мРНК Elovl5 соответ#
но пальмитолеиновой кислоты, оказывает от#
ствовал повышенной активности ELOVL5. От#
рицательное влияние на метаболизм АТ, вклю#
носительный уровень мРНК Fads1 в груп#
чая повышенное накопления TG у крыс из
пе HSD был выше по сравнению с контрольной
группы HSD.
группой, однако в группе HSD не удалось опре#
Мыши с мутациями гена Scd1 и Scd1#дефи#
делить активность FADS1 из#за отсутствия
цитные мыши демонстрируют замечательный
конкретной FA, необходимой для расчёта ин#
гиперметаболический фенотип, который защи#
декса, отражающего активность FADS1.
щает их от ожирения, инсулиновой резистент#
В печени экспрессия генов Elovl5, Fads1 и
ности и стеатоза печени. Ntambi et al. [39] пока#
Fads2 регулируется на уровне транскрипции, а
зали, что мыши с целевым разрушением изо#
именно белками SREBP#1c и LXR [4]. Было по#
формы SCD1 в меньшей степени страдали от
казано, что как глюкоза, так и инсулин индуци#
ожирения, они обладали повышенной чувстви#
руют экспрессию LXRα, который является клю#
тельностью к инсулину и были устойчивы к уве#
чевым фактором транскрипции, стимулирую#
личению веса, вызванному диетой. Снижение
щим экспрессию ферментов липогенеза. LXR
ожирения, вызванного высокоуглеводной дие#
высоко экспрессируется в AT [41]. Hua et al. [29]
той, у мышей с печёночно#специфической деле#
предположили, что LXRα может играть цент#
цией Scd1 (LKO) и у Scd1#дефицитных мышей
ральную роль в контроле транскрипции с по#
было связано с ингибированием экспрессии ге#
мощью глюкозы и инсулина в адипоцитах. Кро#
нов, участвующих в биосинтезе FA. В то же вре#
ме того, в промоторе гена, кодирующего
мя было обнаружено, что делеция или ингиби#
SREBP#1, имеется сайт связывания LXRα, и,
рование Scd1 в WAT и BAT оказывают мини#
следовательно, SREBP#1c может являться ми#
мальное воздействие на энергетический метабо#
шенью для LXRα. В целом вполне возможно,
лизм всего организма [35]. Таким образом, мы
что более высокие уровни мРНК Elovl5 и Fads1
предполагаем, что снижение активности SCD
в AT крыс группы HSD могут быть ассоциирова#
в eWAT оказывает лишь некоторый локальный
ны с индукцией LXRα и SREBP#1c глюкозой и
эффект, как было описано выше, но не оказыва#
инсулином. Более низкий уровень мРНК Fads2
ет значительного влияния на метаболизм липи#
коррелировал с пониженной активностью бел#
дов в организме.
ка FADS2 в группе крыс HSD, и эти изменения
В этом исследовании не было обнаружено
нуждаются в дальнейших исследованиях.
различий между группами в содержании PUFA
Уровень мРНК Elovl2 в AT крыс группы HSD
в eWAT. Однако содержание отдельных FA зна#
не отличался от её уровня в контрольной группе.
чительно изменялось. Так, у крыс группы HSD
Wang et al. [4] показали, что обработка гепатоци#
было обнаружено повышенной содержание 18 : 2
тов глюкозой или инсулином не оказывает вли#
n#6 и пониженное содержание 18 : 3 n#3 и 18 : 3
яния на уровень экспрессии Elovl2. Кроме того,
n#6 по сравнению с группой ST.
на экспрессию Elovl2 в печени не влияют голо#
Изменения содержания PUFA можно объяс#
дание и повторное кормление, а также диети#
нить снижением уровня мРНК и активнос#
ческие добавки с рыбным или оливковым мас#
ти FADS2, который является первым и ско#
лом. Можно предположить, что уровень
рость#лимитирующим ферментом биосинте#
мРНК Elovl2 в AT, как и в печени, не изменяется
за PUFA [9]. Напротив, уровень мРНК и актив#
в ответ на различные диеты.
ность ELOVL5, второго фермента, принимаю#
Как описано в нашем предыдущем исследо#
щего участие в синтезе PUFA, были повышены в
вании, в группе HSD уровень TG в сыворотке
группе HSD. Недавно было обнаружено, что
повышается по сравнению с контрольной груп#
ELOVL5 катализирует не только элонгацию
пой [42], что могло быть результатом как стиму#
C18 PUFA (18 : 3 n#6 и 18 : 4 n#3), но также и
лирования синтеза TG в печени, так и снижения
элонгацию MUFA от 16 : 1 n#7 до 18 : 1 n#7 (вак#
деградации TG липазой липопротеинов [43-46].
ценовая кислота) [40]. В исследовании наблюда#
Результаты этого исследования поддержива#
лось значительное снижение количества 18 : 3 n#
ют идею о том, что регуляция уровня мРНК и
6 и отсутствие 18 : 4 n#3. Мы предположили, что
активности элонгаз и десатураз играет важную
у крыс, получавших HSD, синтез вакценовой
роль в контроле липидного состава AT в ответ на
кислоты (18 : 1 n#7), катализируемый ELOVL5,
изменения в пищевом рационе. Нами было по#
доминирует над реакцией, приводящей к синте#
казано, что повышенное потребление углеводов
зу PUFA. Мы не измеряли содержание вакцено#
вызывает изменения состава FA в AT путём сни#
БИОХИМИЯ том 86 вып. 5 2021
626
ДРАГ и др.
жения содержания MUFA. Кроме того, было
ли эксперименты. Я. Драг провела эксперимен#
показано, что HSD может регулировать гены
ты на животных. Я. Драг, М. Кнапик#Чайка и
элонгаз (Elovl5 и Elovl6) и десатураз (Fads1, Fads2
А. Гаведзка проанализировали полученные дан#
и Scd) FA. Чтобы изучить молекулярную основу
ные. Я. Драг и М. Кнапик#Чайка написали
регуляции экспрессии элонгаз и десатураз в AT в
статью. Все авторы прочли и одобрили оконча#
ответ на изменения в питании, необходимы
тельный вариант статьи.
дальнейшие исследования.
Конфликт интересов. Авторы заявляют об от#
сутствии конфликта интересов.
Соблюдение этических норм. Все процедуры с
Благодарности. Авторы выражают благодар#
лабораторными животными были выполнены в
ность Катаржине Вадовской и Анне Цихон за
соответствии с этическими стандартами инсти#
прекрасную техническую поддержку.
тута, где было выполнено настоящее исследова#
Вклад авторов. Я. Драг и Е. Яцкевич задума#
ние (комитет по работе с животными, комитет
ли и спланировали эксперименты. Я. Драг,
по этике Ягеллонского университета, 19.11.2009,
И. Гдула#Аргасинска и М. Кнапик#Чайка прове#
№ 116/2009).
СПИСОК ЛИТЕРАТУРЫ
1.
Jurešić, G. Č., Percan, K., and Broznić, D. (2016) Effect
temic metabolism, Trends Endocrinol. Metab., 28, 831#
of dietary fatty acid variation on mice adipose tissue lipid
842, doi: 10.1016/j.tem.2017.10.003.
content and phospholipid composition, Croat. J. Food
11.
Paton, C. M., and Ntambi, J. M. (2009) Biochemical and
Technol. Biotechnol. Nutr., 11, 128#137.
physiological function of stearoyl#CoA desaturase, Am. J.
2.
Beylot, M. (2007) Metabolism of white adipose tissue, in
Physiol. Endocrinol. Metab., 297, 28#37, doi: 10.1152/
Adipose Tissue And Adipokines In Health And Disease
ajpendo.90897.2008.
(Fantuzzi, G., and Mazzone, T., ed.) Totowa, pp. 21#35,
12.
Dentin, R., Denechaud, P. D., Benhamed, F., Girard, J.,
doi: 10.1007/978#1#59745#370#7_2.
and Postic, C. (2006) Hepatic gene regulation by glucose
3.
Kunešová, M., Hlavatý, P., Tvrzická, E., Staňková, B.,
and polyunsaturated fatty acids: a role for ChREBP,
Kalousková, P., et al. (2012) Fatty acid composition of adi#
J. Nutr., 136, 1145#1149, doi: 10.1093/jn/136.5.1145.
pose tissue triglycerides after weight loss and weight main#
13.
Ma, L., Robinson, L. N., and Towle, H. C. (2006)
tenance: the DIOGENES study, Physiol. Res., 61, 597#
ChREBP·Mlx is the principal mediator of glucose#induced
607, doi: 10.33549/physiolres.932414.
gene expression in the liver, J. Biol. Chem., 281, 28721#
4.
Wang, Y., Botolin, D., Xu, J., Christian, B., Mitchell, E.,
28730, doi: 10.1074/jbc.M601576200.
et al. (2006) Regulation of hepatic fatty acid elongase and
14.
Wang, Y., Botolin, D., Christian, B., Busik, J., Xu, J., and
desaturase expression in diabetes and obesity, J. Lipid Res.,
Jump, D. B. (2005) Tissue#specific, nutritional, and devel#
47, 2028#2041, doi: 10.1194/jlr.M600177#JLR200.
opmental regulation of rat fatty acid elongases, J. Lipid
5.
Guillou, H., Zadravec, D., Martin, P. G. P., and
Res., 46, 706#715, doi: 10.1194/jlr.M400335#JLR200.
Jacobsson, A. (2010) The key roles of elongases and desat#
15.
Mitro, N., Mak, P. A., Vargas, L., Godio, C.,
urases in mammalian fatty acid metabolism: Insights from
Hampton, E., et al. (2007) The nuclear receptor LXR is a
transgenic mice, Prog. Lipid Res.,
49,
186#199,
glucose sensor, Nature, 445, 219#223, doi: 10.1038/
doi: 10.1016/j.plipres.2009.12.002.
nature05449.
6.
Kihara, A. (2012) Very long#chain fatty acids: elongation,
16.
Qin, Y., Dalen, K. T., Gustafsson, J. Å., and Nebb, H. I.
physiology and related disorders, J. Biochem., 152, 387#
(2009) Regulation of hepatic fatty acid elongase 5 by
395, doi: 10.1093/jb/mvs105.
LXRα#SREBP#1c, Biochim. Biophys. Acta Mol. Cell Biol.
7.
Moon, Y.#A., Hammer, R. E., and Horton, J. D. (2009)
Lipids, 1791, 140#147, doi: 10.1016/j.bbalip.2008.12.003.
Deletion of ELOVL5 leads to fatty liver through activation
17.
Jazurek, M., Dobrzyń, P., and Dobrzyń, A.
(2008)
of SREBP#1c in mice, J. Lipid Res., 50, 412#423,
Regulation of gene expression by long#chain fatty acids,
doi: 10.1194/jlr.M800383#JLR200.
Postepy Biochem., 54, 242#250.
8.
Tripathy, S., Lytle, K. A., Stevens, R. D., Bain, J. R.,
18.
Ntambi, J. M. (1992) Dietary regulation of stearoyl#CoA
Newgard, C. B., et al. (2014) Fatty acid elongase#5
desaturase 1 gene expression in mouse liver, J. Biol. Chem.,
(Elovl5) regulates hepatic triglyceride catabolism in obese
267, 10925#10930, doi: 10.1016/S0021#9258(19)50107#7.
C57BL/6J mice, J. Lipid Res.,
55,
1448#1464,
19.
Folch, J., Lees, M., and Sloane Stanley, G. H. (1957) A
doi: 10.1194/jlr.M050062.
simple method for the isolation and purification of total
9.
Zhang, J. Y., Kothapalli, K. S. D., and Brenna, J. T. (2016)
lipides from animal tissues, J. Biol. Chem., 226, 497#509.
Desaturase and elongase#limiting endogenous long#chain
20.
Metcalfe, L. D., and Schmitz, A. A. (1961) The rapid
polyunsaturated fatty acid biosynthesis, Curr. Opin. Clin.
preparation of fatty acid esters for gas chromatographic
Nutr. Metab. Care, 19, 103#110, doi: 10.1097/MCO.
analysis, Anal. Chem.,
33,
363#364, doi:
10.1021/
0000000000000254.
ac60171a016.
10.
ALJohani, A. M., Syed, D. M., and Ntambi, J. M. (2017)
21.
Chaves Das Neves, H. J., and Vasconcelos, A. M. (1987)
Insights into stearoyl#CoA desaturase#1 regulation of sys#
Capillary gas chromatography of amino acids, including
БИОХИМИЯ том 86 вып. 5 2021
ВЛИЯНИЕ HSD НА ЭЛОНГАЗЫ И ДЕСАТУРАЗЫ
627
asparagine and glutamine: sensitive gas chromatographic#
34.
Li, Y. B., Wu, Q., Liu, J., Fan, Y. Z., Yu, K. F., and Cai, Y.
mass spectrometric and selected ion monitoring gas chro#
(2017) miR#199a#3p is involved in the pathogenesis and
matographic#mass spectrometric detection of the N,O(S)#
progression of diabetic neuropathy through downregula#
tert.#butyldimethylsilyl derivativ, J. Chromatogr., 392, 249#
tion of SerpinE2, Mol. Med. Rep., 16, 2417#2424,
258.
doi: 10.3892/mmr.2017.6874.
22.
Li, Y., and Watkins, B. A. (1998) Conjugated linoleic acids
35.
Flowers, M. T., Ade, L., Strable, M. S., and Ntambi, J. M.
alter bone fatty acid composition and reduce ex vivo
(2012) Combined deletion of SCD1 from adipose tissue
prostaglandin E 2 biosynthesis in rats fed n#6 or n#3
and liver does not protect mice from obesity, J. Lipid Res.,
fatty acids, Lipids, 33, 417#425, doi: 10.1007/s11745#998#
53, 1646#1653, doi: 10.1194/jlr.M027508.
0223#9.
36.
Dragos, S. M., Bergeron, K. F., Desmarais, F., Suitor, K.,
23.
Cedernaes, J., Alsiö, J., Västermark, Å., Risérus, U., and
Wright, D. C., et al. (2017) Reduced SCD1 activity alters
Schiöth, H. B. (2013) Adipose tissue stearoyl#CoA desat#
markers of fatty acid reesterification, glyceroneogenesis,
urase 1 index is increased and linoleic acid is decreased in
and lipolysis in murine white adipose tissue and 3T3#L1
obesity#prone rats fed a high#fat diet, Lipids Health Dis.,
adipocytes, Am. J. Physiol. Cell Physiol., 313, 295#304,
12, 2, doi: 10.1186/1476#511X#12#2.
doi: 10.1152/ajpcell.00097.2017.
24.
Harding, S. V., Bateman, K. P., Kennedy, B. P., Rideout,
37.
Soriguer, F., Moreno, F., Rojo#Mart nez, G., Garc a
T. C., and Jones, P. J. H. (2015) Desaturation index versus
Fuentes, E., Tinahones, F., et al. (2003) Monounsaturated
isotopically measured de novo lipogenesis as an indicator of
n#9 fatty acids and adipocyte lipolysis in rats, Br. J. Nutr.,
acute systemic lipogenesis, BMC Res. Notes, 8, 49,
90, 1015#1022, doi: 10.1079/BJN2003993.
doi: 10.1186/s13104#015#1016#0.
38.
Cruz, M. M., Lopes, A. B., Crisma, A. R., De Sá, R. C. C.,
25.
Gastaldelli, A., Gaggini, M., and DeFronzo, R. A. (2017)
Kuwabara, W. M. T., et al. (2018) Palmitoleic acid (16 : 1
Role of adipose tissue insulin resistance in the natural his#
n7) increases oxygen consumption, fatty acid oxidation
tory of type 2 diabetes: results from the San Antonio
and ATP content in white adipocytes, Lipids Heal. Dis., 17,
metabolism study, Diabetes, 66, 815#822, doi: 10.2337/
55, doi: 10.1186/s12944#018#0710#z.
db16#1167.
39.
Ntambi, J. M., Miyazaki, M., Stoehr, J. P., Lan, H.,
26.
Govers, R. (2014) Molecular mechanisms of GLUT4 reg#
Kendziorski, C. M., et al. (2002) Loss of stearoyl#CoA
ulation in adipocytes, Diabetes Metab., 40, 400#410,
desaturase#1 function protects mice against adiposity, Proc.
doi: 10.1016/J.DIABET.2014.01.005.
Natl. Acad. Sci. USA, 99, 11482#11486, doi: 10.1073/pnas.
27.
Beaven, S. W. W., Matveyenko, A., Wroblewski, K.,
132384699.
Chao, L., Wilpitz, D., et al. (2013) Reciprocal regulation of
40.
Tripathy, S., Torres#Gonzalez, M., and Jump, D. B. (2010)
hepatic and adipose lipogenesis by liver X receptors in obe#
Elevated hepatic fatty acid elongase#5 activity corrects
sity and insulin resistance, Cell Metab., 18, 106#117,
dietary fat#induced hyperglycemia in obese BL/6J mice,
doi: 10.1016/j.cmet.2013.04.021.
J. Lipid Res., 51, 2642#2654, doi: 10.1194/jlr.M006080.
28.
Herman, M. A., Peroni, O. D., Villoria, J., Schön, M. R.,
41.
Steffensen, K. R., and Gustafsson, J. A. (2004) Putative
Abumrad, N. A., et al. (2012) A novel ChREBP isoform in
metabolic effects of the liver X receptor (LXR), Diabetes,
adipose tissue regulates systemic glucose metabolism,
53, Suppl. 1, 36#42, doi: 10.2337/diabetes.53.2007.s36.
Nature, 484, 333#338, doi: 10.1038/nature10986.
42.
Dr g, J., Goździalska, A., Knapik Czajka, M., Gaw dzka,
29.
Hua, Z. G., Xiong, L. J., Yan, C., Wei, D. H., Ying Pai, Z.,
A., Gawlik, K., and Jaśkiewicz, J. (2017) Effect of high
et al. (2016) Glucose and insulin stimulate lipogenesis in
carbohydrate diet on elongase and desaturase activity and
porcine adipocytes: dissimilar and identical regulation
accompanying gene expression in rat’s liver, Genes Nutr.,
pathway for key transcription factors, Mol. Cells, 39, 797#
12, 2, doi: 10.1186/s12263#017#0551#9.
806, doi: 10.14348/molcells.2016.0144.
43.
Kanazawa, M., Xue, C. Y., Kageyama, H., Suzuki, E., Ito,
30.
Nuotio#Antar, A. M., Poungvarin, N., Li, M., Schupp, M.,
R., et al. (2003) Effects of a high#sucrose diet on body
Mohammad, M., et al. (2015) FABP4#Cre mediated
weight, plasma triglycerides, and stress tolerance, Nutr.
expression of constitutively active ChREBP protects
Rev., 61, 27#33, doi: 10.1301/nr.2003.may.s27#s33.
against obesity, fatty liver, and insulin resistance,
44.
Xue, C. Y., Kageyama, H., Kashiba, M., Kobayashi, A.,
Endocrinology, 156, 4020#4032, doi: 10.1210/en.2015#
Osaka, T., et al. (2001) Different origin of hypertriglyc#
1210.
eridemia induced by a high#fat and a high#sucrose diet in
31.
Song, Z., Xiaoli, A. M., and Yang, F. (2018) Regulation
ventromedial hypothalamic#lesioned obese and normal
and metabolic significance of de novo lipogenesis in adi#
rats, Int. J. Obes., 25, 434#438, doi: 10.1038/sj.ijo.0801548.
pose tissues, Nutrients, 10, 1383, doi: 10.3390/nu10101383.
45.
Huang, W., Dedousis, N., and O’Doherty, R. M. (2007)
32.
Tan, Z., Du, J., Shen, L., Liu, C., Ma, J., et al. (2017)
Hepatic steatosis and plasma dyslipidemia induced by a
MiR#199a#3p affects adipocytes differentiation and fatty
high#sucrose diet are corrected by an acute leptin infusion,
acid composition through targeting SCD, Biochem.
J. Appl. Physiol., 102, 2260#2265, doi: 10.1152/japplphysi#
Biophys. Res. Commun., 492, 82#88, doi: 10.1016/j.bbrc.
ol.01449.2006.
2017.08.030.
46.
Feng, R., Du, S., Chen, Y., Zheng, S., Zhang, W., et al.
33.
De Castro, J.P.W., Blandino#Rosano, M., and Bernal#
(2015) High carbohydrate intake from starchy foods is pos#
Mizrachi, E. (2018) The microRNA 199a family is regulat#
itively associated with metabolic disorders: a Cohort Study
ed by glucose levels in pancreatic beta cells, Diabetes, 67,
from a Chinese population, Sci. Rep.,
5,
16919,
2170, doi: 10.2337/db18#2170#P.
doi: 10.1038/srep16919.
БИОХИМИЯ том 86 вып. 5 2021
628
ДРАГ и др.
IMPACT OF HIGH%SUCROSE DIET ON THE mRNA LEVELS
FOR ELONGASES AND DESATURASES AND ESTIMATED
PROTEIN ACTIVITY IN RAT ADIPOSE TISSUE
Jagoda Drag1*, Malgorzata Knapik%Czajka1, Anna Gawedzka1,
Joanna Gdula%Argasinska2, and Jerzy Jaskiewicz1
1 Department of Biochemical Analytics, Faculty of Pharmacy, Jagiellonian University Medical College,
30 688 Krakow, Poland; E mail: jagoda.drag@uj.edu.pl
2 Department of Radioligands, Faculty of Pharmacy, Jagiellonian University Medical College, 30 688 Krakow, Poland
Fatty acids (FAs) present in the adipose tissue (AT) can be modified by elongases and desaturases. These enzymes are
regulated by different factors including nutrients. The aim of the study was to evaluate the impact of high#sucrose diet
(HSD; 68% sucrose) on the levels of mRNAs for elongases (Elovl2, Elovl5, Elovl6) and desaturases (Fads1, Fads2,
Scd) and on the activity of the corresponding proteins in the rat AT. Male Wistar rats were randomized into two study
groups: fed with an HSD and with a standard diet (ST). The mRNA levels were determined by a semi#quantitative
reverse transcription#PCR. FA composition was analyzed by gas chromatography, and FA ratios were used to estimate
the activity of the enzymes. In the HSD rats, the levels of Elovl5, Elovl6, Fads1, and Scd mRNAs were higher, while
the level of Fads2 mRNA was lower than in the ST group. Higher levels of Elovl5 and Elovl6 mRNAs corresponded to
higher relative activities of these enzymes, while downregulation of the Fads2 mRNA was associated with the lower
activity of this desaturase. In contrast, an increase in the level of Scd mRNA was accompanied by a decrease in the
enzyme activity. Less monounsaturated FAs was detected in the AT of HSD rats than in the ST group. The composi#
tion of individual FAs differed between the groups. This study supports the notion that the regulation of mRNA lev#
els and activity of both elongases and desaturases play an important role in managing the AT lipid composition in
response to changes in the dietary status.
Keywords: elongases, desaturases, fatty acids, high#sucrose diet, adipose tissue
БИОХИМИЯ том 86 вып. 5 2021