БИОХИМИЯ, 2021, том 86, вып. 5, с. 672 - 688
УДК 577.218
МикроРНК В ОНКОЛОГИИ: ОТ МЕХАНИЗМОВ РЕГУЛЯЦИИ
ЭКСПРЕССИИ ГЕНОВ ДО ПЕРЕПРОГРАММИРОВАНИЯ
МЕТАСТАТИЧЕСКОЙ НИШИ
Обзор
© 2021
Е.В. Семина1,2*, К.Д. Рысенкова1,2, К.Э. Трояновский2,
А.А. Шмакова1, К.А. Рубина2
1 Федеральное государственное бюджетное учреждение «Национальный медицинский исследовательский
центр кардиологии» Министерства здравоохранения Российской Федерации,
121552 Москва, Россия; электронная почта: e+semina@yandex.ru
2 Московский государственный университет имени М.В. Ломоносова,
факультет фундаментальной медицины, 119192 Москва, Россия
Поступила в редакцию 11.03.2021
После доработки 11.03.2021
Принята к публикации 31.03.2021
Проект «Геном человека» к 2003 году позволил выявить полную структуру генома, но оказалось, что 97%
ДНК приходится на последовательности, которые не кодируют белки. Объяснение этому пришло позднее,
когда в нетранслируемых областях ДНК были обнаружены последовательности, кодирующие короткие
микроРНК, длинные некодирующие РНК и другие типы нуклеотидных последовательностей, которые
участвуют в регуляции экспрессии генов. Впервые идентифицированные в цитоплазме, с изначальной
функцией деградации целевой мРНК, на сегодняшний день микроРНК обнаружены во всех компартмен-
тах клетки. В составе экзосом или в комплексе с белками микроРНК секретируются во внеклеточное прост-
ранство и участвуют в процессах морфогенеза и регенерации, а также онкогенезе, метастазировании и хи-
миорезистентности клеток опухоли. В онкогенезе микроРНК играют двоякую роль: с одной стороны, они
могут выступать в качестве онкосупрессоров, подавляя экспрессию онкогенов, с другой стороны, функцио-
нируя как онкогены, они нивелируют инактивирующее действие онкосупрессоров, стимулируют опухоле-
вый ангиогенез и опосредуют иммуносупрессивные свойства в опухоли. Обзор описывает современное
представление о биогенезе микроРНК, их функциях в цитоплазме и ядре. Особое внимание уделено нека-
ноническим механизмам регуляции экспрессии генов, контролируемым микроРНК, и их участию в онко-
генезе. В обзоре также приведено представление авторов о роли микроРНК в процессах метастазирования
и формировании преметастатической ниши.
КЛЮЧЕВЫЕ СЛОВА: микроРНК, биогенез микроРНК, функции микроРНК в ядре, экзосомы, внеклеточ-
ные микроРНК, онкогенез, метастазирование, метастатическая ниша.
DOI: 10.31857/S0320972521050055
ВВЕДЕНИЕ
ко второй личиночной стадии [1]. Гораздо позд-
нее, уже в 2000 г., двумя независимыми коман-
Первая микроРНК была обнаружена в 1993 г.
дами ученых было обнаружено, что небольшая
у нематоды C. elegans в локусе гена lin-4 [1].
(21 нуклеотид) РНК, let-7, играет важную роль в
Группа Lee et al. продемонстрировала считыва-
процессе развития личинок нематоды во взрос-
ние с этого гена 22-нуклеотидной РНК, компле-
лую особь C. elegans [2]. Впоследствии мик-
ментарной мРНК другого гена, lin-14, в резуль-
роРНК были описаны у многих живых организ-
тате чего происходило торможение его трансля-
мов, эволюционно друг от друга далёких, вклю-
ции, определяющее переход C. elegans от первой
чая человека [3]. На сегодняшний день эти мо-
лекулы определены как малые некодирующие
Принятые сокращения: МЭП - мезенхимально- эволюционно консервативные РНК длиной
эпителиальный переход; НТО - нетранслируемая область;
18-25 нуклеотидов, участвующие в регуляции
ПТИГ - посттранскрипционная инактивация генов;
экспрессии генов. Обнаружены и описаны ты-
ЭМП - эпителиально-мезенхимальный переход; Ago - бе-
лок аргонавт, каталитический компонент комплекса RISC;
сячи микроРНК, информация о которых хра-
RISC - РНК-индуцируемый комплекс выключения гена.
нится в различных базах данных, основные из
* Адресат для корреспонденции.
672
МикроРНК В ОНКОГЕНЕЗЕ И МЕТАСТАЗИРОВАНИИ
673
После этого 2′-5′-фосфодиэфирная связь под-
mirtarbase.cuhk.edu.cn/php/index.php).
вергается гидролизу с помощью линеаризующе-
Хорошо описанной функцией микроРНК
го фермента лассо 1, DBR1 (Lariat debranching
является регуляция экспрессии генов путём свя-
enzyme) [8]. Процессированный миртрон при-
зывания с 3′-нетранслируемой областью (НТО)
обретает структуру пре-микроРНК и экспорти-
мРНК-мишени и ингибирования её трансля-
руется в цитоплазму, где претерпевает дальней-
ции. Однако за последние несколько лет появи-
ший процессинг при помощи рибонуклеазы
лись данные о взаимодействии микроРНК с
Dicer в двухцепочечную РНК длиной ≈ 22 п.о.,
другими мишенями, включая промоторы генов,
что в конечном итоге приводит к образованию
кодирующих последовательность, и 5′-НТО [4].
зрелой микроРНК, способной участвовать в ре-
В литературе накапливаются данные о свобод-
гуляции экспрессии РНК-мишеней. В 2018 г.
ном перемещении микроРНК между разными
была разработана программа, которая отличает
компартментами клетки, где они регулируют
миртроны от предшественников канонических
различные процессы, включая транскрипцию,
микроРНК по длине шпильки и содержанию
трансляцию, альтернативный сплайсинг и репа-
GC-нуклеотидов. В будущем этот инструмент
рацию ДНК. Кроме того, микроРНК секретиру-
может способствовать изучению механизмов
ются во внеклеточное пространство и являются
процессинга миртронов [9].
молекулярными маркерами онкологических за-
На сегодняшний день известна только одна
болеваний, в развитии которых могут играть
микроРНК, которая подвергается Dicer-незави-
ключевую роль. По всей вероятности, мик-
симому пути биогенеза - это микроРНК-451. Ее
роРНК способны выступать как в роли онко-
процессинг осуществляет фермент Ago2, так как
супрессоров, подавляя прогрессию опухоли, так
Dicer не может расцепить шпильку из-за её ко-
и в роли онкогенов, стимулируя канцерогенез
роткой длины (19 п.о.) [10]. Значимую роль в
[5]. Данный обзор посвящен описанию различ-
процессинге пре-микроРНК-451 играет еще
ных путей биогенеза микроРНК, их функциям в
один компонент RISC, а именно эукариотичес-
клетках, секреции во внеклеточное простран-
кий фактор инициации трансляции 1A (EIF1A),
ство и определению их потенциальной роли в
который взаимодействует с Ago2, способствуя
формировании преметастатической ниши.
его активации. Далее происходит загрузка мик-
роРНК-451 в состав RISC в цитоплазме, где она
осуществляет свою стандартную деятельность -
БИОГЕНЕЗ микроРНК
посттранскрипционную регуляцию экспрессии
генов.
Биогенез микроРНК является многостадий-
ным процессом и начинается с транскрипции их
генов. В ядре микроРНК транскрибируются в
ФУНКЦИИ микроРНК В ЦИТОПЛАЗМЕ
виде длинной последовательности, называемой
при-микроРНК (primary - pri-miRNA), с учас-
На сегодняшний день большинство публи-
тием РНК-полимеразы II либо с собственных
каций в этой области посвящено основной
промоторов, либо с промотора гена-хозяина [6].
функции микроРНК, а именно связыванию с
Биогенез микроРНК может происходить как по
3′-НТО мРНК-мишени с целью индукции
каноническому (рис. 1), так и по неканоничес-
трансляционной репрессии [11]. Однако в пос-
кому пути, например, миртронному, при кото-
леднее время появляется все больше работ о взаи-
ром микроРНК образуются Drosha-независи-
модействии микроРНК с 5′-НТО мРНК, приво-
мым способом (см. ниже).
дящем к противоположному эффекту, а именно
Предшественники микроРНК могут быть за-
активации трансляции [12], что делает актуаль-
кодированы в коротких интронах [7] - именно
ным исследования функциональной значимос-
они получили название миртроны. Такие пред-
ти микроРНК в цитоплазме.
шественники имеют шпилечную структуру, на-
Основными компонентами микроРНК-ин-
поминающую пре-микроРНК. Однако после
дуцированного комплекса выключения гена
транскрипции миртроны не претерпевают про-
(микроRISC) являются направляющая цепь
цессинг комплексом Drosha-DGCR8 в отличие
микроРНК и белки Ago [13]. Для инициации
от классических при-микроРНК (рис. 1, справа).
Ago2, который проявляет эндонуклеазную ак-
Вместо этого миртроны подвергаются сплайсин-
тивность в отношении мРНК, необходимым и
гу, при котором образованный продукт, как и все
достаточным условием является комплементар-
сплайсированные интроны, формируется в виде
ное взаимодействие начала последовательности
лассо, в котором 5′-конец интрона присоединен
микроРНК (2-8 нуклеотиды), получившей наз-
к 2′-ОН (гидроксильной) группе аденозина.
вание «seed sequence», со своей мишенью [14].
БИОХИМИЯ том 86 вып. 5 2021
674
СЕМИНА и др.
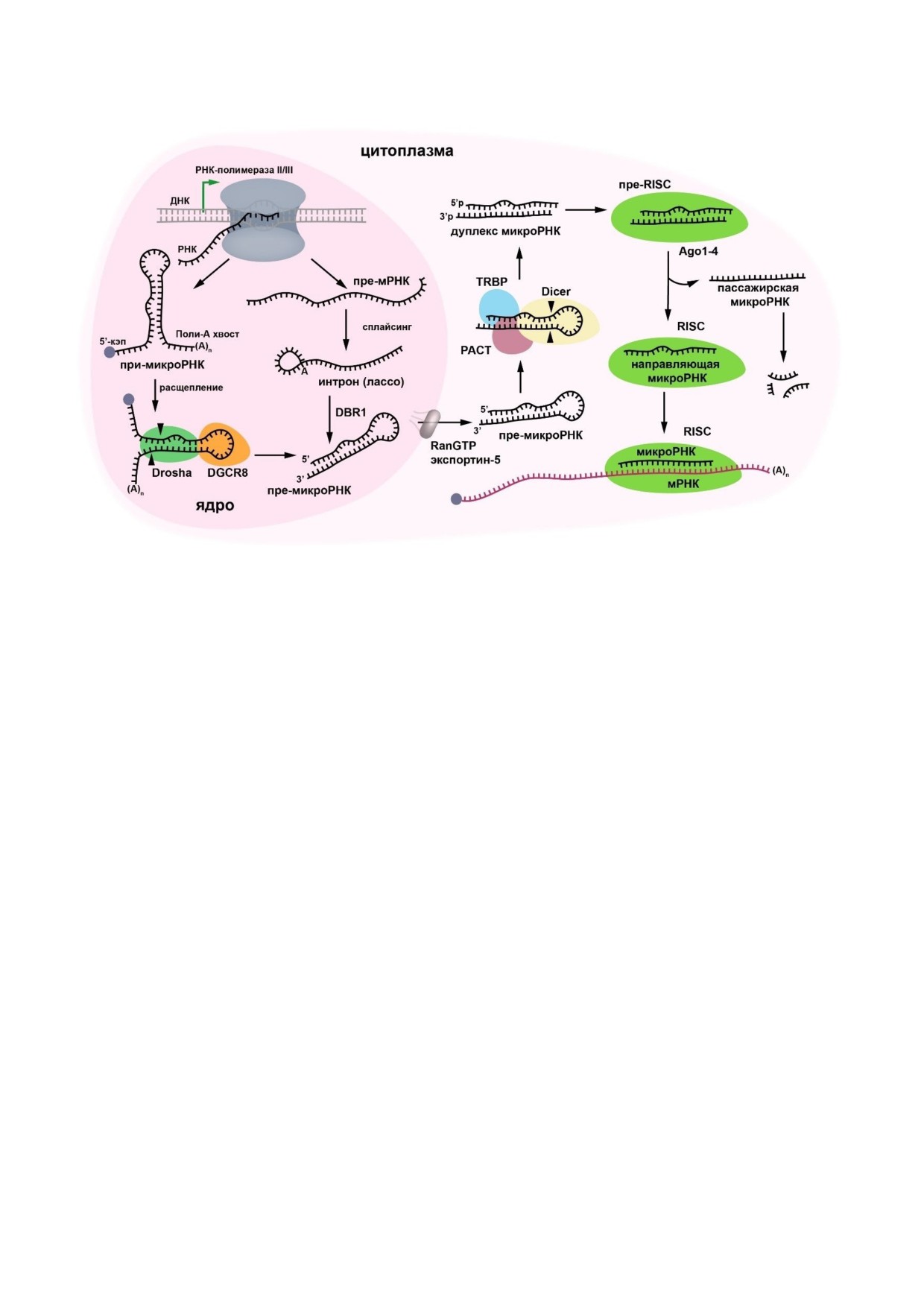
Рис. 1. Биогенез микроРНК. Классический биогенез микроРНК начинается с синтеза транскрипта при-микроРНК. Комп-
лекс, состоящий из рибонуклеазы III Drosha и белка критической области синдрома ДиДжорджи 8 (DGCR8), расщепляет
(первичную) при-микроРНК с образованием предшественника микроРНК (пре-микроРНК). При-микроРНК подвергает-
ся кэппированию на 5′-конце и полиаденилированию на 3′-конце. Пре-микроРНК может также формироваться с по-
мощью линеаризующего фермента лассо 1 (DBR1). После сплайсинга пре-микроРНК экспортируется в цитоплазму с по-
мощью комплекса RanGTP - экспортин-5 и разрезается рибонуклеазой Dicer в присутствии кофакторов TRBP (белок,
связывающий трансактивирующую РНК) и PACT (белковый активатор интерферон-индуцируемой протеинкиназы) с об-
разованием дуплекса микроРНК. Последний связывается с белками Ago1-4, формируя предшественник РНК-индуциру-
емого комплекса выключения гена (пре-RISC), после чего пассажирская микроРНК покидает комплекс и разрушается, а
в зрелом RISC остается направляющая микроРНК, готовая к связыванию своей мРНК-мишени. (С цветными вариантами
Как правило «seed sequence» используется для
данных о микроРНК-опосредованной регуля-
предсказания мишеней микроРНК, однако в
ции трансляции, где они могут выступать как в
ряде исследований было продемонстрировано,
роли ингибиторов, так и коактиваторов транс-
что условие комплементарности «seed sequence»
ляции. В частности, недавно появились данные
не является достаточным для работы мик-
о взаимодействии микроРНК-15а c 3′-НТО фак-
роРНК - комплементарность 3′-концевой пос-
тора инициации трансляции eIF4E с последую-
ледовательности также важна для работы комп-
щим снижением его экспрессии. Для инициа-
лекса RISC [4]. Более того, взаимодействия
ции трансляции eIF4E узнает 5′-концевой кэп
микроРНК с таргетной мРНК могут контроли-
мРНК и рекрутирует другие факторы, включая
роваться РНК-связывающими белками, опреде-
eIF4G, eIF2, eIF3, РНК-хеликазу eIF4A, а также
ляя особенности их функционирования в раз-
малую рибосомную субъединицу 40S, опосредуя
ных типах клеток [15]. Важность участия белков
поддержание трансляции [17]. Таким образом,
Ago при формировании комплекса мик-
микроРНК-15а выступает как репрессор транс-
роРНК-RISC также подтверждается их функ-
ляции, нацеливаясь не на мРНК-мишень, а
цией по рекрутированию семейства белков
действуя опосредованно, путем подавления
TNRC6A-C [16] (рис. 2).
экспрессии белков, формирующих трансляци-
Долгое время считалось, что микроРНК
онный комплекс. В других исследованиях была
участвуют только в подавлении экспрессии ге-
показана роль микроРНК как активатора транс-
нов путём деградации их мРНК. Однако за пос-
ляции. Так, микроРНК let-7 в комплексе с бел-
ледние несколько лет появилось множество
ками Ago2 и FXR1 (белок 1, ассоциированный с
БИОХИМИЯ том 86 вып. 5 2021
МикроРНК В ОНКОГЕНЕЗЕ И МЕТАСТАЗИРОВАНИИ
675
синдромом интеллектуальной недостаточности
ны и выходят за рамки канонических представ-
ломкой Х-хромосомы) активируют трансляцию
лений об их роли в организме как негативных
во время остановки клеточного цикла в клетках
регуляторов трансляции.
HeLa [18].
В рассмотренных примерах микроРНК регу-
лируют экспрессию генов в цитоплазме как нап-
ФУНКЦИИ микроРНК В ЯДРЕ
рямую за счёт деградации мРНК-мишеней, так
и опосредованно путём регуляции активности
Долгое время в литературе, посвящённой
трансляционного комплекса - можно сказать,
изучению биогенеза и функциям микроРНК, су-
что эти два механизма дополняют друг друга.
ществовало утверждение о том, что после завер-
Для выявления приоритетного механизма необ-
шения биогенеза микроРНК остаются в цито-
ходимо проведение дальнейших исследований в
плазме клетки, однако в 2004 г. Meister et al. об-
этой области.
наружили высокое содержание микроРНК-21 в
Совсем недавно была обнаружена новая
ядрах клеток линии аденокарциномы HeLa [22].
функция микроРНК-1254. Было продемонстри-
Чуть позже несколько исследований подтверди-
ровано, что она взаимодействует с 5′-НТО
ли существование зрелых микроРНК не только
мРНК белка CCAR1 (белок-регулятор клеточ-
в цитоплазматической, но и в ядерной фракции.
ного цикла и апоптоза 1) и ассоциированного с
Позднее с помощью РНК-секвенирования бы-
Ago2 микроRISC, стабилизируя этот комплекс,
ли идентифицированы сотни микроРНК в яд-
что приводит к увеличению экспрессии CCAR1.
рах различных типов клеток. Часть результатов
Также в этом исследовании было показано, что
были подтверждены с применением методов
5′-НТО CCAR1 может выполнять функцию есте-
Northern blot, RT-qPCR, RT-PCR и in situ гибри-
ственного стабилизатора микроРНК-1254 (на-
дизации (ISH), которые исключают сигналы
подобие искусственно синтезированных моле-
предшественников микроРНК [23]. Рассматри-
кул «miRancer», призванных стабилизировать
ваются три возможных механизма ядерной ло-
ассоциированные с ними микроРНК). Показа-
кализации: 1) присутствие сигнала ядерной ло-
но, что такое взаимодействие повторно сенси-
кализации в последовательности микроРНК,
билизирует клетки рака молочной железы
что предопределяет ее транспортировку в ядро;
(РМЖ) к тамоксифену [19].
2) существование независимого ядерного биоге-
Другим необычным явлением оказалось су-
неза микроРНК; 3) челночный перенос мик-
ществование микроРНК, обладающей способ-
роРНК из цитоплазмы в ядро с помощью ком-
ностью подавлять или активировать трансля-
плекса RISC [24] (рис. 2).
цию в зависимости от степени её комплементар-
Механизмы транспорта микроРНК в ядро. На-
ности мишени; для обоих процессов необходи-
личие мотивов ядерной локализации было пока-
мо наличие белка Ago. Такого рода микроРНК
зано для микроРНК-29b и микроРНК семейства
была обнаружена в лямблиях и получила назва-
let-7 [24]. МикроРНК-29b, относящаяся к се-
ние микроРНК-3. В лямблиях микроРНК-3 по-
мейству микроРНК-29, является одной из наи-
давляет трансляцию мРНК гистона H2A за счёт
более изученных «ядерных» микроРНК. Она от-
не полностью комплементарного спаривания,
личается от других членов семейства наличием
но увеличивает трансляцию, когда мРНК-ми-
уридина в 10-м положении и AGUGUU-мотива
шень полностью комплементарна
[20]. На
на 3′-конце (позиции 18-23), который отвечает
T. thermophilus было показано, что наличие не-
за перемещение микроРНК-29b в ядро. В ядрах
комплементарного спаривания в позициях нук-
клеток эмбриональной клеточной линии C166
леотида 10 или 11 в дуплексе миРНК / мРНК-
были обнаружены две другие микроРНК того же
мишень делает мРНК-мишень устойчивой к
семейства [25]. Результаты исследований показа-
расщеплению Ago [21]. Существуют и другие
ли, что в отличие от микроРНК-29b, мик-
примеры двоякой роли микроРНК в различных
роРНК-29a/c не имеют AGUGGU-мотива на
организмах. МикроРНК могут влиять на уров-
3′-конце, однако в большей степени локализу-
ень мРНК, микро- и рибонуклеопротеинов как
ются в ядре [25], что позволяет предполагать су-
напрямую, так и опосредованно, регулируя ак-
ществование и других механизмов, отвечающих
тивность промоторов своих мишеней. Было об-
за транспорт микроРНК в ядро клетки.
наружено, что микроРНК-369-3 у человека ак-
Кроме того, микроРНК, имеющие мотивы
тивирует трансляцию мРНК TNF-α во время
5′-UUGCAUAGU-3′ и 5′-AGGUUGKSUG-3′,
остановки клеточного цикла, но подавляет её же
где K - уридин или гуанин, обнаружены в ядрах
в пролиферирующих клетках [18]. Все эти дан-
клеток эндотелия желточного мешка мыши. Эти
ные свидетельствуют о том, что описанные
последовательности присутствуют в основном в
функции микроРНК в цитоплазме многообраз-
микроРНК семейства let-7 [25]. Более того, при-
БИОХИМИЯ том 86 вып. 5 2021
676
СЕМИНА и др.
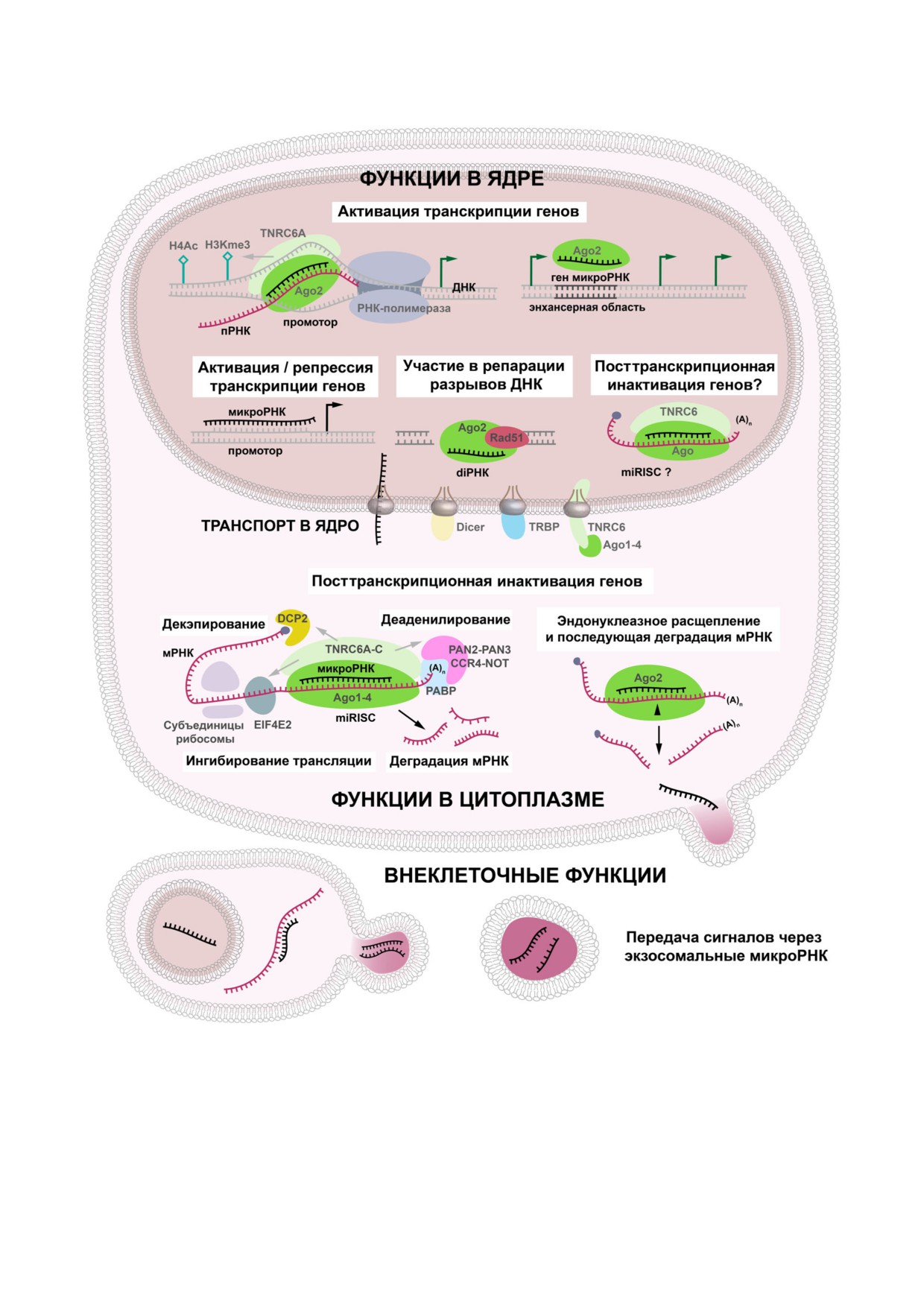
Рис. 2. Функции микроРНК в цитоплазме и ядре клетки, а также внеклеточные функции микроРНК в составе экзосом.
Классическая функция микроРНК в цитоплазме клеток, состоящая в инициации деградации мРНК, расширена возмож-
ностью микроРНК проникать из цитоплазмы в ядро и участвовать в таких процессах, как активация или репрессия тран-
скрипции генов, участие в репарации двухцепочечных разрывов ДНК, а также, возможно, в посттранскрипционной
инактивации генов (ПТИГ). Секретируемые в составе экзосом микроРНК могут осуществлять все эти функции в клет-
ках-реципиентах как непосредственно в зоне высвобождения экзосом, так и транспортируясь с током крови в различные
органы и ткани
БИОХИМИЯ том 86 вып. 5 2021
МикроРНК В ОНКОГЕНЕЗЕ И МЕТАСТАЗИРОВАНИИ
677
мерно треть ядерных микроРНК имеет консен-
специфичность наблюдаемых эффектов, зави-
сусную последовательность ASUS, где S - гуа-
симых от выбранной линии клеток. Можно так-
нин или цитозин. В целом, можно с уверен-
же предположить, что эпигенетическое состоя-
ностью говорить о существовании последова-
ние генома влияет на активацию генов при по-
тельностей в структуре микроРНК, облегчаю-
мощи малых РНК. Так, нацеленная на промотор
щих их транспорт в ядро с участием РНК-связы-
гена Е-кадгерина малая двухцепочечная РНК
вающих белков, однако конкретный механизм и
вызывает его индукцию в клетках рака простаты
белки, принимающие в нем участие, до сих пор
PC-3 и DU-145, но не в клетках HeLa, в которых
не известны.
промотор гена Е-кадгерина гиперметилирован,
Компоненты комплекса RISC, впервые
что препятствует работе малой двухцепочечной
идентифицированные в цитоплазме, такие как
РНК; использование двухцепочечной РНК сов-
Ago1-4, TRBP и TNRC6A, также обнаружены в
местно с деметилирующим агентом вызывает
ядрах клеток млекопитающих [26]. Наличие этих
индукцию экспрессии Е-кадгерина в клетках
факторов само по себе не является гарантией то-
HeLa [30]. Кроме того, микроРНК-373 взаимо-
го, что ядерные микроРНК будут «загружаться» с
действует с последовательностями, располо-
RISC, так как для формирования функциональ-
женными в генах CDH1, CSCD2 и PDE4D в клет-
ного комплекса также необходимы белки
ках карциномы молочной железы MCF-7, но не
HSP90, TRAX и TSN, находящиеся исключи-
в клетках HeLa [31]. Другая микроРНК-552 ин-
тельно в цитоплазме [27]. Можно предположить,
гибирует экспрессию цитохрома человека
что часть ядерных микроРНК не имеют опреде-
P450 2E1 (CYP2E1), связываясь с промоторной
ленных функций и деградируют в ядре уже после
областью гена CYP2E1 [32]. В целом, все эти
процессинга ферментами Drosha и Dicer [24].
данные говорят о том, что одним из механизмов
Появляются также данные, свидетельствую-
регуляции экспрессии генов-мишеней является
щие об участии неканонических белков-погруз-
прямое взаимодействие микроРНК с целевыми
чиков в формировании комплекса RISC. Одним
последовательностями в самих генах, а не толь-
из кандидатов на эту роль является белок AUF1,
ко канонический путь через связывание с мРНК
который способен связывать микроРНК семей-
и индукцию РНК-интерференции в цитоплазме
ства let-7 и циркулировать между ядром и ци-
клеток.
топлазмой [27]. Несмотря на отсутствие ясности
К настоящему моменту сложилось понима-
относительно того, может ли погрузка мик-
ние того, что компоненты комплекса RISC мо-
роРНК в ядро происходить в составе RISC, уже
гут находиться не только в цитоплазме, но и в
появляются данные о том, что компоненты
ядре, что допускает возможность их участия в
комплекса RISC могут перемещаться между яд-
посттранскрипционной инактивации генов с
ром и цитоплазмой, выступая в роли шаттл-бел-
участием микроРНК в ядре. Возможно также,
ков. Например, такие белки, как экспор-
что предшественники микроРНК или другие
тин-1 и -5, импортин-8 и кариоферины, опосре-
эндонуклеарные некодирующие РНК могут дег-
дуют перемещение белков, несущих классичес-
радировать в ядре. В 2013 г. Matsui et al. обнару-
кие сигналы ядерной локализации и экспорта
жили, что микроРНК-589 в комплексе с Ago2 и
через ядерный поровый комплекс [28].
TNRC6A взаимодействует с промотор-ассоции-
Регуляция экспрессии генов микроРНК в ядре.
рованной РНК циклооксигеназы-2 (COX-2), в
В настоящее время известны два механизма ре-
результате чего экспрессия фермента увеличи-
гуляции экспрессии генов с помощью мик-
вается, однако механизм этого феномена не из-
роРНК в ядре: активация и репрессия тран-
вестен. В то же время при этом взаимодействии
скрипции. Одним из способов регуляции тран-
индуцируются хроматиновые метки, связанные
скрипции генов считается связывание мик-
с активацией генов, такие как H3K4me3 и аце-
роРНК с промотором этого гена. В 2008 г. Place
тилирование гистона H4 (H4Ac) [33]. Контролю
et al. продемонстрировали способность мик-
со стороны ПТИГ также подвергается и длин-
роРНК-373 активировать экспрессию белка
ная некодирующая РНК (lncRNA) размером бо-
CSDC2 (белок C2, содержащий домен холодо-
лее 200 нуклеотидов, MALAT1 (транскрипт 1,
вого шока) и CDH1 (E-кадгерин) путем спари-
ассоциированный с метастазированием адено-
вания микроРНК с промоторами этих генов в
карциномы легкого). MALAT1 связывается с
линии клеток рака простаты PC-3, однако дан-
микроРНК-9, что приводит к Ago2-зависимой
ные об индукции не подтвердились на другой
деградации lncRNA. Еще одним примером
линии клеток рака простаты (LNCaP); в линии
служит работа MACC1-AS1, являющейся анти-
клеток колоректального рака HCT-116 при
смысловой lncRNA из шестого интрона гена
действии микроРНК-373 наблюдалась индук-
MACC. Основные функции этой lncРНК связы-
ция только CSDC2 [29], что может указывать на
вают с модулированием клеточной пролифера-
БИОХИМИЯ том 86 вып. 5 2021
678
СЕМИНА и др.
ции и опухолевой прогрессией при РМЖ. Одна-
действия микроРНК изменяется паттерн аль-
ко связывание MACC1-AS1 с опухолевыми суп-
тернативного сплайсинга соответствующих ни-
рессорами микроРНК-384 и микроРНК-145
жестоящих мишеней этих факторов сплайсинга
приводит к увеличению пролиферации клеток
(unc-60, unc-52, lin-10 и ret-1, основные регуля-
за счёт повышения экспрессии мРНК плейотро-
торы развития C. elegans) [37].
фина (PTN) и онкогена c-Myc [34].
За последние десять лет появилось большое
Последовательности, кодирующие мик-
количество данных, свидетельствующих об
роРНК, могут быть расположены в энхансерных
участии микроРНК в процессе репарации ДНК.
областях белок-кодирующих генов. В недавнем
Двухцепочечный разрыв (DSB) ДНК иницииру-
исследовании было обнаружено, что мик-
ет формирование микроРНК [38]. Известно, что
роРНК-26a-1, -339, -3179, -24-1 и -24-2 способ-
эти микроРНК образуются из фланкирующих
ны индуцировать экспрессию соседних генов.
областей DSB-сайтов и подвергаются обработке
Так, ген микроРНК-26а-1 находится в окруже-
Dicer. Такие микроРНК получили название
нии группы белок-кодирующих генов ITGA9,
DSB-индуцированные малые РНК (diRNA). В
CTDSPL, VILL и PLCD1, и гиперэкспрессия этой
комплексе с Ago2 они транспортируются к
микроРНК в линии клеток почечного эпителия
DSB-сайтам, где Ago2 функционирует в роли
HEK293T вызывает транскрипционную актива-
адаптера и рекрутирует RAD51 - ключевой эу-
цию двух из них - ITGA9 и VILL, в то время как
кариотический фактор репарации ДНК [38].
микроРНК-24-1 увеличивает экспрессию сосед-
Различные модификации ДНК, такие как окис-
них генов, FBP1 и FANC [35]. Более того, в неко-
ление, метилирование, алкилирование и замена
торых случаях экспрессия микроРНК необходи-
тимина на урацил, приводят к спонтанным пов-
ма для работы энхансеров - при их отсутствии
реждениям ДНК. Для ее защиты клетки исполь-
эффект индукции транскрипции генов не наб-
зуют механизм эксцизионной репарации осно-
людается. Интересно, что для транскрипцион-
ваний (base excision repair, BER). В процессе ра-
ной активации соседних генов требуется нали-
боты ферментов BER происходит специфичес-
чие Ago2 в локусе энхансера, в связи с чем был
кое узнавание этих повреждений и репарация
сделан вывод о том, что сама по себе микроРНК
ДНК. Некоторые микроРНК участвуют в регу-
не может индуцировать активацию энхансера,
ляции компонентов BER. МикроРНК-16, -34c и
что обусловливает особенности регуляции
-199a могут связываться с 3′-НТО урацил-ДНК-
экспрессии этих генов [35].
гликозилазы (UNG2), которая обеспечивает
МикроРНК могут влиять не только на про-
удаление урацила из ДНК в клетках опухоли
цессы транскрипции генов, но также участво-
[39]. Другим наглядным примером служит регу-
вать в регуляции факторов альтернативного
лирование принимающей участие в репарации
сплайсинга, которые воздействуют на профили
ДНК-полимеразы β (Polβ) с помощью мик-
экспрессии различных мРНК [36]. Ярким при-
роРНК-499, которая также связывается с
мером служит управление микроРНК события-
3′-НТО мРНК Polβ и активирует ее деграда-
ми альтернативного сплайсинга в постнаталь-
цию [40].
ном развитии сердца путем связывания с ELAV-
В 2011 г. группа ученых из Китая обнаружила
подобными белками CELF, важными регулято-
еще одну функцию, которую микроРНК выпол-
рами стабильности мРНК. CELF связываются с
няет в ядре - связывание с при-микроРНК. Так,
интронами предшественников пре-мРНК в ка-
было показано, что микроРНК-709 может свя-
честве посредников альтернативного сплайсин-
зываться с при-микроРНК-15a и -16-1, ингиби-
га: микроРНК-23a и -23b нацелены на мРНК
руя их дальнейший биогенез, что говорит о со-
белков CUGBP (CUG-связывающий белок) и
вершенно уникальной роли микроРНК в регу-
CELF (ETR-3-подобный фактор). Эти белки
ляции экспрессии генов [41]. Таким образом,
контролируют образование почти половины
диапазон действий микроРНК на сегодняшний
сплайс-изоформ в эмбриогенезе сердца, что
день активно дополняется рядом их «ядерных»
указывает на иерархию, в которой быстрое пост-
функций, в число которых входит актива-
натальное повышение уровня специфических
ция/репрессия транскрипции, альтернативный
микроРНК контролирует экспрессию альтерна-
сплайсинг и репарация ДНК.
тивных регуляторов сплайсинга и их нисходя-
щие мишени [36]. Другим примером может быть
влияние микроРНК на правильный процессинг
ВНЕКЛЕТОЧНЫЕ микроРНК
экзонов мРНК известными факторами сплай-
И ИХ ФУНКЦИИ В СОСТАВЕ ЭКЗОСОМ
синга asd-2, hrp-2 и smu-2, которые в своей 3′-
НТО содержат сайты связывания микроРНК.
В многочисленных исследованиях было по-
Причем было обнаружено, что при подавлении
казано, что микроРНК способны высвобож-
БИОХИМИЯ том 86 вып. 5 2021
МикроРНК В ОНКОГЕНЕЗЕ И МЕТАСТАЗИРОВАНИИ
679
даться во внеклеточную среду и быть использо-
синтезе церамида, снижает секрецию экзосом и
ваны в качестве биомаркеров при различных па-
высвобождение экзосомальных микроРНК во
тологиях [42]. Внеклеточные микроРНК имеют
внеклеточную среду [48]. Вышеописанные ме-
высокую стабильность: они не подвергаются
ханизмы сортировки экзосомальных микроРНК
деградации при комнатной температуре в тече-
позволяют считать, что их экзоцитоз в целом яв-
ние нескольких дней, в том числе при неблаго-
ляется регулируемым процессом. Однако в оп-
приятных условиях (таких как сильное измене-
ределенных случаях (повреждение или гибель
ние температуры и пребывание в среде с высо-
клеток) высокие концентрации микроРНК в
ким или низким рН) [43]. На данный момент из-
составе экзосом считаются побочными клеточ-
вестно о существовании двух типов микроРНК
ными продуктами.
во внеклеточном пространстве: одни присут-
В настоящее время механизмы поглощения
ствуют в везикулах, таких как экзосомы, микро-
экзосомальных микроРНК клетками изучены
везикулы и апоптотические тельца, а другие - в
недостаточно. Существуют различные гипотезы
растворимом виде в комплексе с белками, в
о путях проникновения микроРНК в клетки.
частности с Ago2 [44]. Липопротеиды высокой
Считается, что микроРНК в составе экзосом ока-
плотности (ЛПВП) [45] и нуклеофосмин 1
зываются внутри клеток путем эндоцитоза, фаго-
(NPM1) [46] также являются молекулами, свя-
цитоза, микропиноцитоза или прямого слияния
зывающими внеклеточные микроРНК. Нахож-
с плазматической мембраной [49]. В свою очередь,
дение микроРНК в комплексах необходимо для
микроРНК вне экзосом могут проникать в клет-
поддержания их стабильности и защиты во
ку с помощью специфических рецепторов [49].
внеклеточной среде и в крови.
За последние несколько лет накоплены дан-
Экзосомы представляют собой внеклеточ-
ные о внеклеточных микроРНК, выступающих
ные везикулы диаметром 30-150 нм, секретиру-
в роли сигнальных молекул и выполняющих оп-
емые различными типами клеток и содержащие
ределенные функции в клетках-реципиентах
огромное количество различных соединений, в
как в норме (табл. 1), так и при различных пато-
частности белков и нуклеиновых кислот [47].
логиях. Особо следует отметить роль микроРНК
Наиболее подробно состав экзосом описан в ба-
в составе внеклеточных везикул в развитии и
прогрессии различных типов злокачественных
Попадание микроРНК в экзосомы происходит
новообразований. После высвобождения опухо-
под контролем белков hnRNPA2B1 и hnRNPA1,
левыми клетками содержащих микроРНК экзо-
которые узнают специфические мотивы мик-
сом происходит их поглощение клетками-реци-
роРНК. Описано также присутствие Ago2 сов-
пиентами. В результате микроРНК оказываются
местно с микроРНК. Одним из механизмов экс-
внутри клеток и могут влиять на рост опухоли,
порта экзосомальных микроРНК во внеклеточ-
стимулировать/ингибировать инвазию, метас-
ную среду является церамид-зависимый меха-
тазирование и опухолевый неоангиогенез. По-
низм: ингибирование nSMase 2 (нейтральной
мимо влияния на клетки-реципиенты, мик-
сфингомиелиназы 2), которая участвует в био-
роРНК в составе экзосом могут изменять мик-
Таблица 1. Функции некоторых микроРНК при физиологических состояниях
Тип микроРНК
Процесс
Биообъекты,
Дата
источники микроРНК
публикации
МикроРНК-21-3p
стимуляция пролиферации и миграции фибробластов,
пуповинная кровь
2018 [50]
индукция процессов ангиогенеза в эндотелиальных клетках
МикроРНК-214
стимуляция миграции, ангиогенеза в линии клеток HMEC-1
клеточная линия
2013 [51]
HMEC-1
МикроРНК-335
подавление трансляции мРНК SOX-4 в антигенпрезенти-
T-лимфоциты
2011 [52]
рующих клетках (APC), стимуляция иммунной системы
МикроРНК-143/145
стимуляция атеропротективных свойств в гладкомышечных
HUVECs
2012 [53]
клетках (SMS)
МикроРНК-21
стимуляция регенерации аксонов периферических нервов
репаративные Шван-
2020 [54]
новские клетки (rSC)
Примечание. В квадратных скобках приведены ссылки на соответствующие публикации.
БИОХИМИЯ том 86 вып. 5 2021
680
СЕМИНА и др.
роокружение опухоли путем воздействия на
и метастазирование, эпителиально-мезенхи-
внеклеточный матрикс, активацию и привлече-
мальный переход, а также пролиферацию и
ние клеток иммунной системы [50-54].
дифференцировку клеток опухоли.
В последнее время появляются данные о
При исследовании роли микроРНК-532-3p в
том, что мезенхимальные стромальные клетки
развитии рака простаты было установлено, что её
(МСК) являются активными продуцентами
гиперэкспрессия in vitro подавляет инвазию и
микроРНК, в том числе в составе их секретома.
миграцию клеток рака простаты PC-3 за счёт
В значительной степени эти микроРНК выпол-
прямого ингибирования экспрессии факторов
няют функцию антивоспалительных и антифиб-
транскрипции TRAF1/2/4 и снижения активнос-
ротических посредников, а также способны сти-
ти транскрипционного фактора NF-κΒ. Гипер-
мулировать рост сосудов и нервов при регенера-
экспрессия микроРНК-532-3p in vivo ингибирует
ции ткани [55]. Тем не менее обнаруженная в
способность клеток PC-3 к метастазированию в
составе секретома МСК «антиангиогенная»
костную ткань по сравнению с клетками кон-
микроРНК-92а [56, 57] указывает на гетероген-
трольной группы [61]. Подобный механизм опи-
ность популяции МСК, а также двоякую функ-
сан также для микроРНК-3664-5P и -145-5p, ко-
цию конкретной микроРНК [58]. В доказатель-
торые подавляют прогрессию опухоли, связыва-
ство этого есть данные о том, что эффекты мик-
ясь с посредниками NF-κΒ сигнального пути и
роРНК-92а могут зависеть от выбранной линии
инактивируя его, что в конечном счёте тормозит
клеток, условий эксперимента, клеточного мик-
инвазию, миграцию и метастазирование опухоле-
роокружения и пр. [58], а феномен гетероген-
вых клеток различного происхождения [62, 63].
ности популяции МСК был показан нашими
Другим хорошо описанным способом, с по-
коллегами на примере микроРНК-29с и мик-
мощью которого микроРНК могут контролиро-
роРНК-21 в составе внеклеточных везикул, ас-
вать рост и метастазирование опухоли, является
социированных с фиброзом [59], хотя одним из
подавление эпителиально-мезенхимального пе-
хорошо описанных свойств секретома МСК яв-
рехода (ЭМП), играющего одну из ведущих ро-
ляется как раз подавление фиброза [60].
лей в канцерогенезе, запуская метастазирование
Обобщая данные, можно сказать, что прио-
и поддерживая химиорезистентность клеток
ритет исследователей, изучающих микроРНК,
опухоли. На примере подавления экспрессии
лежит в области идентификации и выявления их
микроРНК-2392 была показана её функция по
функций в клетках. В то же время работ по изу-
сдерживанию инвазии, миграции и метастазиро-
чению механизмов доставки и поглощения
вания клеток рака желудка in vitro и in vivo. Ми-
клетками-реципиентами достаточно мало. До-
шенями этой микроРНК служат гены MAML3 и
полнительные исследования в этом направле-
WHSC1 и их нисходящие мишени Slug и Twist1
нии раскроют новый потенциал экзосомальных
соответственно, которые являются транскрип-
микроРНК в прикладном значении.
ционными репрессорами гена CDH1, экспрессия
которого поддерживает эпителиальный фенотип
опухолевых клеток и препятствует появлению в
МикроРНК КАК ОНКОСУПРЕССОРЫ
них мезенхимальных маркеров, свойственных
В ПРОГРЕССИИ
мигрирующим клеткам [64]. Такая особенность
И МЕТАСТАЗИРОВАНИИ РАКА
микроРНК-2392 ингибировать процесс ЭМП
позволяет рассматривать её как перспективную
На сегодняшний день почти все исследова-
мишень в лечении высокометастатической аде-
ния, связанные с микроРНК, основаны на срав-
нокарциномы желудка. Ещё одним онкосупрес-
нении профилей экспрессии микроРНК в абер-
сором, подавляющим ЭМП, вероятно, является
рантных и нормальных клетках. Такой подход
микроРНК-143-5p. Используя подход подавле-
используется и при изучении функции мик-
ния экспрессии микроРНК, была показана её
роРНК в патогенезе рака, что в результате дает
способность снижать экспрессию факторов
информацию о ранее неизвестных микроРНК,
HIF-1α и Twist1, а также ингибировать ЭМП в
которые могут выступать в качестве онкосуп-
клетках рака желчного пузыря [65].
рессоров или онкогенов [5]. МикроРНК-суп-
Нарушение сигнального пути Wnt/β-катени-
рессоры опухолей обычно предотвращают раз-
на/TCF в клетках опухоли может быть причи-
витие опухоли, ингибируя онкогены и/или ге-
ной её гиперпролиферации, дедифференциров-
ны, контролирующие клеточную дифференци-
ки и химиорезистентности [66]. В одной из не-
ровку и апоптоз. Ниже на примере нескольких
давних работ была показана способность мик-
хорошо изученных микроРНК будут рассмотре-
роРНК-148a в клетках рака поджелудочной же-
ны молекулярные механизмы онкосупрессив-
лезы PANC-1 in vitro и in vivo подавлять
ных свойств микроРНК, влияющих на инвазию
Wnt/β-катенин-опосредованную пролифера-
БИОХИМИЯ том 86 вып. 5 2021
МикроРНК В ОНКОГЕНЕЗЕ И МЕТАСТАЗИРОВАНИИ
681
цию и инвазию, а также инициировать апоптоз
могут «обмениваться» информацией с окружаю-
путём индукции онкосупрессора MEG+3 (mater-
щей опухоль стромой [98]. Процессу инвазии
nally expressed gene-3) [67]. Ещё одной мик-
предшествует ремоделирование опухолевой ни-
роРНК, способной влиять на сигнальный путь
ши, разрушение структурных белков и межкле-
Wnt/β-катенина, а также ЭМП, функционируя
точных контактов, что облегчает проникнове-
как опухолевый супрессор, является мик-
ние опухолевых клеток в сосудистое русло. Бы-
роРНК-506. Подавляя экспрессию гомеобокс-
ло показано, что высокометастатические клетки
ного белка LHX2 и фактора транскрипции
РМЖ в составе экзосом высвобождают мик-
TCF4, а также снижая активность Wnt/β-кате-
роРНК-105, которая снижает экспрессию белка
нина и фактора транскрипции Twist на ксено-
плотных контактов ZO-1 в эндотелиальных
графтной модели, была показана способность
клетках, нарушая барьерную функцию и облег-
гиперэкспрессии микроРНК-506 in vivo запус-
чая инвазию клеток опухоли сквозь стенку сосу-
кать апоптоз и подавлять метастазирование кле-
да [71]. Стимуляция опухолевого неоангиогене-
ток рака носоглотки в лимфатических узлы; ла-
за также напрямую связана с ростом опухолево-
бораторные результаты, полученные экспери-
го узла и его метастазированием. Было показа-
ментальным путём, проходят дальнейшую про-
но, что нейтральная сфингомиелиназа nSMase2
верку в клинических образцах [68].
в составе экзосом эндотелиальных клеток
Несмотря на то что онкосупрессивные свой-
HUVECs регулирует экспрессию микроРНК-
ства микроРНК привлекают онкологов в каче-
210 в клетках РМЖ; в свою очередь, экзосомаль-
стве потенциального терапевтического подхода,
ная микроРНК-210 стимулирует ангиогенез и
требуется более тщательное их изучение. Насто-
метастазирование за счёт влияния на экспрес-
раживает, в частности, пример мик-
сию Ephrin-A3 [72].
роРНК-532-3p, которая может быть онкосуп-
Другим характерным признаком опухолевой
рессором при раке простаты [61], но высокая
прогрессии является изменение метаболизма
экспрессия которой способствует прогрессии
глюкозы не только в опухолевых клетках, но и
аденокарциномы лёгких, т.е. она работает в ка-
метастатических нишах. В исследовании
честве онкогена [69]. Подробно функции мик-
Fong et al. было продемонстрировано действие
роРНК как онкогенов рассмотрены ниже.
микроРНК-122, выделенной в составе экзосом
опухолевых клеток РМЖ, на нормальные лёгоч-
ные фибробласты и астроциты - клетки, типич-
МикроРНК КАК ОНКОГЕНЫ
ные для мест метастазирования при РМЖ. В
В ПРОГРЕССИИ
частности, под влиянием «опухолевых» экзосом
И МЕТАСТАЗИРОВАНИИ РАКА
авторами было обнаружено снижение экспрес-
сии гликолитического фермента пируваткиназы
МикроРНК, экспрессия которых повышена
в нормальных клетках как in vitro, так и in vivo
в опухолях, могут рассматриваться как онкоге-
[73]. Данное перепрограммирование системно-
ны, способствующие прогрессированию и ме-
го метаболизма может приводить к большей
тастазированию опухоли, ингибируя гены-суп-
доступности глюкозы для опухолевых клеток,
рессоры опухоли и/или гены, контролирующие
способствовать опухолевой прогрессии и фор-
клеточную дифференцировку или апоптоз. В
мированию благоприятной среды в метастати-
2009 г. для обозначения микроРНК, ассоцииро-
ческой нише.
ванных с метастазами, был предложен термин
При раке предстательной железы наиболее
metastamiR [70], с тех пор микроРНК в метаста-
часто наблюдаются метастазы в костную ткань и
зировании активно исследуются. Метастазиро-
разрушение остеобластов, однако механизм та-
вание является этапом опухолевой прогрессии,
кого «направленного» метастазирования в кост-
характеризующим негативное течение онколо-
ную ткань и избирательного поражения остео-
гических заболеваний. Это сложный многосту-
бластов не известен. Было показано, что мик-
пенчатый процесс, который включает в себя
роРНК-940 в составе экзосом опухолевых клеток
распространение клеток опухоли из первичного
стимулирует остеогенную дифференцировку
узла в окружающую строму (инвазия), кровь или
МСК человека in vitro, и индуцирует образование
лимфу и отдаленные органы и ткани. В табли-
обширных остеобластических и остеолитических
це 2 суммированы функции наиболее известных
метастазов in vivo у мышей [78]. Тот факт, что
микроРНК, имеющих отношение к прогрессии
МСК являются резидентами костной ткани и
опухоли.
могут дифференцироваться в остеогенном нап-
Опухолевые клетки являются активными
равлении, свидетельствует в пользу того, что
продуцентами внеклеточных везикул с мик-
микроРНК клеток опухоли перепрограммируют
роРНК в их составе, с помощью которых они
метастатическую нишу, формируя в ней благо-
5 БИОХИМИЯ том 86 вып. 5 2021
682
СЕМИНА и др.
Таблица 2. МикроРНК, вовлеченные в процессы онкогенеза и метастазирования различных типов рака
МикроРНК
Клеточная
Процесс, регулируемый микроРНК
Тип рака
Дата
мишень
публикации
МикроРНК-105
ZO 1
нарушение барьерной функции эндотелия
рак молочной железы
2014 [71]
МикроРНК-210
Ephrin-A3
ангиогенез
2013 [72]
МикроРНК-122
PKM
изменение метаболизма глюкозы
2015 [73]
Семейство
Zeb1
активация МЭП
2014 [74]
микроРНК-200
Zeb2
МикроРНК-615-3p
PICK1
активация ЭМП
2020 [75]
МикроРНК-222
LBR
стимуляция инвазии и миграции
2019 [76]
МикроРНК-665
NR4A3
активация ЭМП
2019 [77]
инвазия
МикроРНК-940
ARHGAP1
индукция остеобластических поражений
рак предстательной железы
2018 [78]
FAM134A
МикроРНК-21
TLR7
индукция секреции провоспалительных
рак лёгкого
2012 [79]
цитокинов
МикроРНК-29a
TLR8
индукция секреции провоспалительных
2012 [79]
цитокинов
МикроРНК-26a-5p
ITGβ8
миграция
2018 [80]
инвазия
МикроРНК-214
SUFU
активация ЭМП
2018 [81]
МикроРНК-490-3p
PCBP1
активация ЭМП
2016 [82]
миграция
инвазия
МикроРНК-1247-3p
B4GALT3
индукция секреции провоспалительных
рак печени
2018 [83]
цитокинов
МикроРНК-190
PHLPP1
активация ЭМП
2018 [84]
МикроРНК-92a-3p
PTEN
активация ЭМП
2020 [85]
МикроРНК-135a
GSK3β
активация ЭМП
рак мочевого пузыря
2018 [86]
МикроРНК-221
STMN1
активация ЭМП
2015 [87]
МикроРНК-301b
EGR1
активация ЭМП
2017 [88]
МикроРНК-301a
SOCS5
ангиогенез
рак поджелудочной
2020 [89]
усиление миграции опухолевых клеток
железы
МикроРНК-196a-5p
IκBα
активация ЭМП
рак кишечника
2019 [90]
миграция
инвазия
МикроРНК-188-5p
PTEN
миграция
рак желудка
2019 [91]
инвазия
МикроРНК-187
FOXA2
миграция
2017 [92]
инвазия
МикроРНК-155-5p
TP53INP1
миграции
рак шейки матки
2019 [93]
инвазия
БИОХИМИЯ том 86 вып. 5 2021
МикроРНК В ОНКОГЕНЕЗЕ И МЕТАСТАЗИРОВАНИИ
683
Окончание таблицы 2
МикроРНК
Клеточная
Процесс, регулируемый микроРНК
Тип рака
Дата
мишень
публикации
МикроРНК-652
RORA
миграция
рак эндометрия
2018 [94]
инвазия
МикроРНК-590-3p
FOXA2
миграция
рак яичников
2018 [95]
инвазия
МикроРНК-504
TP53INP1
миграция
рак костей
2017 [96]
инвазия
МикроРНК-144-3p
ARID1A
миграция
рак почек
2017 [97]
инвазия
Примечание. В квадратных скобках приведены ссылки на соответствующие публикации.
приятную среду для формирования вторичного
Известно, что в сыворотке крови онкологи-
опухолевого узла.
ческих пациентов с подтвержденными метаста-
Секреция провоспалительных цитокинов
зами повышается уровень микроРНК-200, регу-
клетками опухоли также может изменять опухо-
лирующей ЭМП [99]. Семейство микроРНК-
левое микроокружение, стимулируя рост и ин-
200 включает, в частности, микроРНК-200a,
вазию клеток опухоли. Показано, что связыва-
-200b, -200c, -429, -141. Основной их функцией
ние микроРНК-21 и микроРНК-29a, получен-
является подавление ЭМП и запуск обратного,
ных из экзосом линий клеток опухоли лёгкого
мезенхимально-эпителиального
перехода,
A-549 и SK-MES, с Toll-подобными рецептора-
МЭП. Механизмом этого процесса является
ми 8 и 7 (TLR8, TLR7) приводит к активации
прямое связывание микроРНК-200 с тран-
этих рецепторов в иммунных клетках. В резуль-
скрипционными факторами Zeb1/2 и их инги-
тате чего инициируется фактор транскрипции
бирование, а также дальнейшая репрессия мно-
NF-κB и запускается секреция цитокинов, ко-
гих мезенхимальных генов [99]. Исследования
торые далее могут активировать микроокруже-
Lee et al. in vitro показали, что экзосомальная
ние опухоли, способствовать инвазии опухоле-
микроРНК-200, выделенная из клеточной ли-
вых клеток и появлению вторичных очагов опу-
нии высокометастатического РМЖ, поглощает-
холевого роста [79]. В другом исследовании бы-
ся клетками неметастатической линии опухоле-
ло показано, что клетки высокометастатической
вых клеток молочной железы, что приводит к
гепатоклеточной карциномы в составе экзосом
изменению экспрессии генов в них и активации
секретируют микроРНК-1247-3p, которая не-
МЭП [74]. В наших исследованиях было обна-
посредственно нацелена на ген B4GALT3, приво-
ружено, что при выключении гена uPAR в клет-
дящий к активации β1-интегрин/NF-κB сиг-
ках нейробластомы Neuro2a происходит повы-
нального пути в фибробластах, которые пере-
шение экспрессии микроРНК-34c-5p и сниже-
программируются в реактивные, т.н. опухоль-
ние экспрессии микроРНК-141-3р, -28a-5p,
ассоциированные фибробласты. Такие клетки
-291-3p и -295-5p. Используя методы биоинфор-
дополнительно способствуют прогрессирова-
матического анализа, мы выявили кластеры ге-
нию заболевания, секретируя провоспалитель-
нов-мишеней указанных микроРНК и опреде-
ные цитокины IL-6 и IL-8 и формируя реактив-
лили среди них группы генов, ответственных за
ное опухолевое микроокружение [83].
ЭМП (Snai1, Zeb2), индукцию апоптоза (Bcl6,
Способность опухолевых клеток к метастази-
р21), пролиферацию (Atf1), адгезию и миграцию
рованию служит предиктором, определяющим
клеток (CD93, ITGAV), а также участвующих в
неблагоприятный онкологический прогноз, т.к.
биогенезе экзосом (TSPAN2, TSPAN11, Rab11b,
одним из параметров диагностики является
Rab21) [100].
оценка инвазивного статуса первичного опухо-
Совместно приведенные данные свидетель-
левого узла. На примере микроРНК-188-5p была
ствуют в пользу того, что способность опухоли к
показана способность микроРНК провоциро-
метастазированию и формированию вторичных
вать метастазирование линий клеток рака же-
очагов опухолевого роста может быть приобре-
лудка AGS и MGC803, усиливая их инвазивные
тена посредством секреции везикул, содержа-
способности и увеличивая число метастазов в
щих микроРНК, способных выступать в роли
легкие [91].
гуморальных посредников, регулирующих меж-
БИОХИМИЯ том 86 вып. 5 2021
5*
684
СЕМИНА и др.
клеточные коммуникации, ремоделирование
ной микроРНК let-7i уже показаны не только её
внеклеточного матрикса и перепрограммирова-
«классические» функции регуляции экспрессии
ние преметастатической ниши при метастази-
генов, сдерживания инвазии клеток опухоли, но
ровании.
и уникальная способность работать как лиганд
Toll-подобных рецепторов [101], активируя спе-
цифическую TLR-зависимую сигнализацию.
ЗАКЛЮЧЕНИЕ
Учитывая важную роль этих рецепторов в фор-
мировании противоопухолевого иммунитета,
Известно, что в процессах онкогенеза и ме-
можно предположить, что использование let-7i
тастазирования опухолевые клетки могут пара-
в составе экзосом может стать эффективным
кринно оказывать эффекты далеко за пределами
противоопухолевым методом лечения.
их непосредственного микроокружения за счёт
Обобщая имеющиеся данные об экспрессии
продукции внеклеточных везикул и входящих в
и функционировании микроРНК в составе эк-
их состав белков, микроРНК, рецепторов и их
зосом, можно сказать, что они обладают свой-
сигнальных посредников. Входящие в состав
ствами гуморальных посредников при онкоге-
внеклеточных везикул микроРНК могут быть
незе. Возможно, они не только отражают харак-
маркерами химиорезистентности опухоли и ак-
тер онкогенеза в первичном очаге, но также
тивного фиброза окружающей опухоль ткани. В
способны к активному перепрограммированию
этой связи использование микроРНК с целью
клеток в составе метастатической ниши. В этой
диагностики и в качестве мишеней для терапев-
связи использование подходов, сдерживающих
тического воздействия существенно расширяет
синтез онкогенных микроРНК, или использо-
арсенал имеющихся подходов в онкологии, т.к.
вание антисмысловых последовательностей бу-
использование экзосом с микроРНК лишено
дет актуальным как для подавления роста пер-
побочных эффектов и ограничений клеточных
вичной опухоли и блокирования её инва-
технологий.
зии/метастазирования, так и для препятствова-
Хочется отдельно подчеркнуть, что биоин-
ния формированию вторичных опухолевых уз-
форматические методы поиска мишеней мик-
лов.
роРНК основываются на выявлении компле-
ментарных им последовательностям в составе
3′-НТО мРНК-мишени, значительно ускоряя и
Финансирование. Работа выполнена при фи-
упрощая задачу. Подходы, основанные на ана-
нансовой поддержке Российского фонда фунда-
лизе прямого взаимодействия микроРНК с це-
ментальных исследований (грант РФФИ № 20-
левыми последовательностями в самих генах
015-00186).
или даже с белками, используются редко. Боль-
Конфликт интересов. Авторы заявляют об от-
шие надежды возлагают на идентификацию ре-
сутствии конфликта интересов.
цепторов микроРНК, которые, как предполага-
Соблюдение этических норм. Настоящая
ется, и будут определять эндоцитоз микроРНК и
статья не содержит описания каких-либо прове-
специфичность вызываемых ими эффектов в
денных авторами исследований с участием лю-
клетках-мишенях. На примере хорошо изучен-
дей или животных в качестве объектов.
СПИСОК ЛИТЕРАТУРЫ
1.
Lee, R. C., Feinbaum, R. L., and Ambros, V. (1993) The
ports microRNA targeting specificity, Mol Cell, 64, 320-
C. elegans heterochronic gene lin-4 encodes small RNAs
333, doi: 10.1016/j.molcel.2016.09.004.
with antisense complementarity to lin-14, Cell, 75, 843-
5.
Zacharias, F., George, D., Michail, D., Ioannis, P.,
854, doi: 10.1016/0092-8674(93)90529-Y.
Marianna, T., et al. (2020) MicroRNAs determining car-
2.
Slack, F. J., Basson, M., Liu, Z. C., Ambros, V., Horvitz,
cinogenesis by regulating oncogenes and tumor suppressor
H. R., and Ruvkun, G. (2000) The lin-41 RBCC gene acts
genes during cell cycle, MicroRNA,
9,
82-92,
in the C-elegans heterochronic pathway between the let-7
doi: 10.2174/2211536608666190919161849.
regulatory RNA and the LIN-29 transcription factor, Mol.
6.
Lee, Y., Kim, M., Han, J., Yeom, K.-H., Lee, S., et al. (2004)
Cell, 5, 659-669, doi: 10.1016/s1097-2765(00)80245-2.
MicroRNA genes are transcribed by RNA polymerase II,
3.
Pasquinelli, A. E., Reinhart, B. J., Slack, F., Martindale,
EMBO J., 23, 4051-4060, doi: 10.1038/sj.emboj.7600385.
M. Q., Kuroda, M. I., et al. (2000) Conservation of the
7.
Berezikov, E., Chung, W.-J., Willis, J., Cuppen, E., and
sequence and temporal expression of let-7 heterochronic
Lai, E. C. (2007) Mammalian mirtron genes, Mol. Cell, 28,
regulatory RNA, Nature, 408, 86-89, doi: 10.1038/
328-336, doi: 10.1016/j.molcel.2007.09.028.
35040556.
8.
Ruby, J. G., Jan, C. H., and Bartel, D. P. (2007) Intronic
4.
Broughton, J. P., Lovci, M. T., Huang, J. L., Yeo, G. W.,
microRNA precursors that bypass Drosha processing,
and Pasquinelli, A. E. (2016) Pairing beyond the seed sup-
Nature, 448, 83-86, doi: 10.1038/nature05983.
БИОХИМИЯ том 86 вып. 5 2021
МикроРНК В ОНКОГЕНЕЗЕ И МЕТАСТАЗИРОВАНИИ
685
9.
Rorbach, G., Unold, O., and Konopka, B. M. (2018)
cytoplasmic microRNA distribution in response to hypox-
Distinguishing mirtrons from canonical miRNAs with data
ic stress, Sci. Rep., 9, doi: 10.1038/s41598-019-46841-1.
exploration and machine learning methods, Sci. Rep., 8,
26.
Sarshad, A. A., Juan, A. H., Muler, A. I. C., Anastasakis,
doi: 10.1038/s41598-018-25578-3.
D. G., Wang, X., et al. (2018) Argonaute-miRNA com-
10.
Cifuentes, D., Xue, H., Taylor, D. W., Patnode, H.,
plexes silence target mRNAs in the nucleus of mammalian
Mishima, Y., et al. (2010) A Novel miRNA processing
stem cells, Mol. Cell, 71, 1040-1050.e8, doi: 10.1016/
pathway independent of dicer requires argonaute2 cata-
j.molcel.2018.07.020.
lytic activity, Science, 328, 1694-1698, doi: 10.1126/
27.
Yoon, J.-H., Jo, M. H., White, E. J. F., De, S., Hafner, M.,
science.1190809.
et al. (2015) AUF1 promotes let-7b loading on Argonaute 2,
11.
Huntzinger, E., and Izaurralde, E. (2011) Gene silencing
Genes Dev., 29, 1599-1604, doi: 10.1101/gad.263749. 115.
by microRNAs: contributions of translational repression
28.
Schraivogel, D., Schindler, S. G., Danner, J., Kremmer,
and mRNA decay, Nat. Rev. Genet.,
12,
99-110,
E., Pfaff, J., et al. (2015) Importin-β facilitates nuclear
doi: 10.1038/nrg2936.
import of human GW proteins and balances cytoplasmic
12.
Kehl, T., Backes, C., Kern, F., Fehlmann, T., Ludwig, N.,
gene silencing protein levels, Nucleic Acids Res., 43, 7447-
et al. (2017) About miRNAs, miRNA seeds, target genes
7461, doi: 10.1093/nar/gkv705.
and target pathways, Oncotarget, 8, 107167-107175,
29.
Place, R. F., Li, L.-C., Pookot, D., Noonan, E. J., and
doi: 10.18632/oncotarget.22363.
Dahiya, R. (2008) MicroRNA-373 induces expression of
13.
Kawamata, T., and Tomari, Y. (2010) Making RISC,
genes with complementary promoter sequences, Proc.
Trends Biochem. Sci., 35, 368-376, doi: 10.1016/j.tibs.
Natl. Acad. Sci. USA, 105, 1608-1613, doi: 10.1073/
2010.03.009.
pnas.0707594105.
14.
Lewis, B. P., Burge, C. B., and Bartel, D. P. (2005)
30.
Li, L.-C., Okino, S. T., Zhao, H., Pookot, D., Place, R. F.,
Conserved Seed Pairing, often flanked by adenosines, indi-
et al. (2006) Small dsRNAs induce transcriptional activa-
cates that thousands of human genes are microRNA tar-
tion in human cells, Proc. Natl. Acad. Sci. USA, 103,
gets, Cell, 120, 15-20, doi: 10.1016/j.cell.2004.12.035.
17337-17342, doi: 10.1073/pnas.0607015103.
15.
Nussbacher, J. K., and Yeo, G. W. (2018) Systematic dis-
31.
Xun, Y., Tang, Y., Hu, L., Xiao, H., Long, S., et al. (2019)
covery of RNA binding proteins that regulate microRNA
Purification and identification of miRNA target sites in
levels, Mol. Cell, 69, 1005-1016.e7, doi: 10.1016/j.mol-
genome using DNA affinity precipitation, Front. Genet.,
cel.2018.02.012.
10, doi: 10.3389/fgene.2019.00778.
16.
Behm-Ansmant, I., Rehwinkel, J., Doerks, T., Stark, A.,
32.
Miao, L., Yao, H., Li, C., Pu, M., Yao, X., et al. (2016) A
Bork, P., and Izaurralde, E. (2006) mRNA degradation by
dual inhibition: microRNA-552 suppresses both transcrip-
miRNAs and GW182 requires both CCR4: NOT deadeny-
tion and translation of cytochrome P450 2E1, Biochim.
lase and DCP1:DCP2 decapping complexes, Genes Dev.,
Biophys. Acta Gene Regul. Mechanisms, 1859, 650-662,
20, 1885-1898, doi: 10.1101/gad.1424106.
doi: 10.1016/j.bbagrm.2016.02.016.
17.
Gingras, A.-C., Raught, B., and Sonenberg, N. (1999)
33.
Matsui, M., Chu, Y., Zhang, H., Gagnon, K. T.,
eIF4 initiation factors: effectors of mRNA recruitment to
Shaikh, S., et al. (2013) Promoter RNA links transcrip-
ribosomes and regulators of translation, Ann. Rev.
tional regulation of inflammatory pathway genes, Nucleic
Biochem., 68, 913-963, doi: 10.1146/annurev.biochem.68.
Acids Res., 41, 10086-10109, doi: 10.1093/nar/gkt777.
1.913.
34.
Zhang, X., Zhou, Y., Chen, S., Li, W., Chen, W., and
18.
Vasudevan, S., Tong, Y., and Steitz, J. A. (2007) Switching
Gu, W. (2019) LncRNA MACC1-AS1 sponges multiple
from repression to activation: microRNAs can up-regulate
miRNAs and RNA-binding protein PTBP1, Oncogenesis,
translation, Science,
318,
1931-1934, doi:
10.1126/
8, doi: 10.1038/s41389-019-0182-7.
science.1149460.
35.
Xiao, M., Li, J., Li, W., Wang, Y., Wu, F., et al. (2016)
19.
Li, G., Wu, X., Qian, W., Cai, H., Sun, X., et al. (2016)
MicroRNAs activate gene transcription epigenetically as
CCAR1 5′ UTR as a natural miRancer of miR-1254 over-
an enhancer trigger, RNA Biol.,
14,
1326-1334,
rides tamoxifen resistance, Cell Res.,
26,
655-673,
doi: 10.1080/15476286.2015.1112487.
doi: 10.1038/cr.2016.32.
36.
Kalsotra, A., Wang, K., Li, P. F., and Cooper, T. A. (2010)
20.
Saraiya, A. A., Li, W., and Wang, C. C. (2013) Transition of
MicroRNAs coordinate an alternative splicing network
a microRNA from repressing to activating translation
during mouse postnatal heart development, Genes Dev., 24,
depending on the extent of base pairing with the target,
653-658, doi: 10.1101/gad.1894310.
PLoS One, 8, e55672, doi: 10.1371/journal.pone.0055672.
37.
Kotagama, K, Schorr, A. L., Steber, H. S., and Mangone,
21.
Wang, Y., Juranek, S., Li, H., Sheng, G., Tuschl, T., and
M. (2018) MiRNA activity contributes to accurate RNA
Patel, D. J. (2008) Structure of an argonaute silencing
splicing in C. elegans intestine and body muscle tissues,
complex with a seed-containing guide DNA and target
bioRxiv, doi: 10.1101/479832.
RNA duplex, Nature,
456,
921-926, doi:
10.1038/
38.
Gao, M., Wei, W., Li, M.-M., Wu, Y.-S., Ba, Z., et al.
nature07666.
(2014) Ago2 facilitates Rad51 recruitment and DNA dou-
22.
Meister, G., Landthaler, M., Patkaniowska, A., Dorsett,
ble-strand break repair by homologous recombination, Cell
Y., Teng, G., and Tuschl, T. (2004) Human Argonaute2
Res., 24, 532-541, doi: 10.1038/cr.2014.36.
mediates RNA cleavage targeted by miRNAs and siRNAs,
39.
Hegre, S. A., Sætrom, P., Aas, P. A., Pettersen, H. S.,
Mol. Cell, 15, 185-197, doi: 10.1016/j.molcel.2004.07.
Otterlei, M., and Krokan, H. E.
(2013) Multiple
007.
microRNAs may regulate the DNA repair enzyme uracil-
23.
Wong, J. J., Ritchie, W., Gao, D., Lau, K. A.,
DNA glycosylase, DNA Rep., 12, 80-86, doi: 10.1016/
Gonzalez, M., et al. (2014) Identification of nuclear-
j.dnarep.2012.10.007.
enriched miRNAs during mouse granulopoiesis,
40.
Wang, Y., Feng, J., Zang, W., Du, Y., Chen, X., et al.
J. Hematol. Oncol., 7, 42, doi: 10.1186/1756-8722-7-42.
(2015) MiR-499 enhances the cisplatin sensitivity of
24.
Stavast, C. J., and Erkeland, S. J. (2019) The non-canoni-
esophageal carcinoma cell lines by targeting DNA poly-
cal aspects of microRNAs: many roads to gene regulation,
merase β, Cell. Physiol. Biochem.,
36,
1587-1596,
Cells, 8, 1465, doi: 10.3390/cells8111465.
doi: 10.1159/000430321.
25.
Turunen, T. A., Roberts, T. C., Laitinen, P., Väänänen, M.-
41.
Tang, R., Li, L., Zhu, D., Hou, D., Cao, T., et al. (2011)
A., Korhonen, P., et al. (2019) Changes in nuclear and
Mouse miRNA-709 directly regulates miRNA-15a/16-1
БИОХИМИЯ том 86 вып. 5 2021
686
СЕМИНА и др.
biogenesis at the posttranscriptional level in the nucleus:
for peripheral nerve injury: a novel therapeutic strategy,
evidence for a microRNA hierarchy system, Cell Res., 22,
Biomed. Res. Int.,
2019, 6458237, doi: 10.1155/2019/
504-515, doi: 10.1038/cr.2011.137.
6458237.
42.
Pereira-da-Silva, T., Coutinho Cruz, M., Carrusca, C.,
56.
Bonauer, A., Carmona, G., Iwasaki, M., Mione, M.,
Cruz Ferreira, R., Napoleão, P., and Mota Carmo, M.
Koyanagi, M., and Dimmeler, S. (2009) MicroRNA-92a
(2018) Circulating microRNA profiles in different arterial
controls angiogenesis and functional recovery of ischemic
territories of stable atherosclerotic disease: a systematic
tissues in mice, Science, 324, 1710-1713, doi: 10.1126/sci-
review, Am. J. Cardiovasc. Disease, 8, 1-13.
ence.1174381.
43.
Turchinovich, A., Weiz, L., Langheinz, A., and
57.
Efimenko, A., Sagaradze, G., Akopyan, Z., Lopatina, T.,
Burwinkel, B. (2011) Characterization of extracellular cir-
and Kalinina, N. (2016) Data supporting that miR-92a
culating microRNA, Nucleic Acids Res., 39, 7223-7233,
suppresses angiogenic activity of adipose-derived mes-
doi: 10.1093/nar/gkr254.
enchymal stromal cells by down-regulating hepatocyte
44.
Turchinovich, A., and Burwinkel, B. (2012) Distinct Ago1
growth factor, Data Brief, 6, 295-310, doi: 10.1016/
and Ago2 associated miRNA profiles in human cells and
j.dib.2015.12.021.
blood plasma, RNA Biol., 9, 1066-1075, doi: 10.4161/rna.
58.
Zhang, L., Zhou, M., Qin, G., Weintraub, N. L., and
21083.
Tang, Y. (2014) MiR-92a regulates viability and angiogen-
45.
Canfrán Duque, A., Lin, C. S., Goedeke, L., Suárez, Y.,
esis of endothelial cells under oxidative stress, Biochem.
and Fernández-Hernando, C. (2016) Micro-RNAs and
Biophys. Res. Commun., 446, 952-958, doi: 10.1016/j.bbrc.
high-density lipoprotein metabolism, Arterioscler. Thromb.
2014.03.035.
Vasc. Biol., 36, 1076-1084, doi: 10.1161/atvbaha.116.
59.
Basalova, N., Sagaradze, G., Arbatskiy, M., Evtushenko,
307028.
E., Kulebyakin, K., et al. (2020) Secretome of mesenchy-
46.
Hasan, S., Gadewal, N., Aher, S., Kumar, R., Varma, A.,
mal stromal cells prevents myofibroblasts differentiation
and Khattry, N. (2018) Identification of miRNA-mRNA
by transferring fibrosis-associated microRNAs within
network in NPM1 mutated acute myeloid leukemia, Clin.
extracellular vesicles, Cells, 9, 1272, doi: 10.3390/
Lymphoma Myeloma Leukemia, 18, S193, doi: 10.1016/
cells9051272.
j.clml.2018.07.035.
60.
Chuang, H. M., Shih, T. E., Lu, K. Y., Tsai, S. F., Harn,
47.
Li, M., Zeringer, E., Barta, T., Schageman, J., Cheng, A.,
H. J., and Ho, L. I. (2018) Mesenchymal stem cell therapy
and Vlassov, A. V. (2014) Analysis of the RNA content of
of pulmonary fibrosis: improvement with target combina-
the exosomes derived from blood serum and urine and its
tion, Cell Transplant., 27, 1581-1587, doi: 10.1177/
potential as biomarkers, Philos. Trans. R. Soc. B. Biol. Sci.,
0963689718787501.
369, 20130502-20130502, doi: 10.1098/rstb.2013.0502.
61.
Wa, Q., Zou, C., Lin, Z., Huang, S., Peng, X., et al. (2020)
48.
Kubota, S., Chiba, M., Watanabe, M., Sakamoto, M., and
Ectopic expression of miR-532-3p suppresses bone metas-
Watanabe, N. (2014) Secretion of small/microRNAs
tasis of prostate cancer cells via inactivating NF-κB signal-
including miR-638 into extracellular spaces by sphin-
ing, Mol. Ther. Oncol., 17, 267-277, doi: 10.1016/j.omto.
gomyelin phosphodiesterase 3, Oncol. Rep., 33, 67-73,
2020.03.024.
doi: 10.3892/or.2014.3605.
62.
Jiao, Y., Yang, H., Qian, J., Gong, Y., Liu, H., et al. (2019)
49.
Tian, T., Zhu, Y.-L., Zhou, Y.-Y., Liang, G.-F., Wang, Y.-
miR-3664-5P suppresses the proliferation and metastasis
Y., et al. (2014) Exosome uptake through clathrin-mediat-
of gastric cancer by attenuating the NF-κB signaling path-
ed endocytosis and macropinocytosis and mediating miR-
way through targeting MTDH, Int. J. Oncology., 54, 845-
21 delivery, J. Biol. Chem., 289, 22258-22267, doi: 10.1074/
858, doi: 10.3892/ijo.2019.4680.
jbc.m114.588046.
63.
Jin, C., Wang, A., Liu, L., Wang, G., Li, G., and Han, Z.
50.
Hu, Y., Rao, S.-S., Wang, Z.-X., Cao, J., Tan, Y.-J., Luo, J.,
(2019) miR-145-5p inhibits tumor occurrence and metas-
et al. (2018) Exosomes from human umbilical cord blood
tasis through the NF-κB signaling pathway by targeting
accelerate cutaneous wound healing through miR-21-3p-
TLR4 in malignant melanoma, J. Cell. Biochem., 120,
mediated promotion of angiogenesis and fibroblast function,
11115-11126, doi: 10.1002/jcb.28388.
Theranostics, 8, 169-184, doi: 10.7150/thno.21234.
64.
Li, J., Li, T., Lu, Y., Shen, G., Guo, H., et al. (2017) MiR-
51.
Van Balkom, B. W. M., de Jong, O. G., Smits, M.,
2392 suppresses metastasis and epithelial-mesenchymal
Brummelman, J., den Ouden, K., et al. (2013) Endothelial
transition by targeting MAML3 and WHSC1 in gastric
cells require miR-214 to secrete exosomes that suppress
cancer, FASEB J.,
31,
3774-3786, doi:
10.1096/
senescence and induce angiogenesis in human and mouse
fj.201601140RR.
endothelial cells, Blood, 121, 3997-4006, doi: 10.1182/
65.
He, M., Zhan, M., Chen, W., Xu, S., Long, M., et al.
blood-2013-02-478925.
(2017) MiR-143-5p deficiency triggers EMT and metasta-
52.
Mittelbrunn, M., Gutiérrez Vázquez, C., Villarroya
sis by targeting HIF-1α in gallbladder cancer, Cell. Physiol.
Beltri, C., González, S., Sánchez Cabo, F., et al. (2011)
Biochem., 42, 2078-2092, doi: 10.1159/000479903.
Unidirectional transfer of microRNA-loaded exosomes
66.
Zhang, Y., and Wang, X. (2020) Targeting the Wnt/β-
from T cells to antigen-presenting cells, Nat. Commun., 2,
catenin signaling pathway in cancer, J. Hematol. Oncol., 13,
doi: 10.1038/ncomms1285.
165, doi: 10.1186/s13045-020-00990-3.
53.
Hergenreider, E., Heydt, S., Tréguer, K., Boettger, T.,
67.
Sun, Y., Zhu, Q., Zhou, M., Yang, W., Shi, H., et al. (2019)
Horrevoets, A. J. G., et al. (2012) Atheroprotective com-
Restoration of miRNA-148a in pancreatic cancer reduces
munication between endothelial cells and smooth muscle
invasion and metastasis by inhibiting the Wnt/β-catenin
cells through miRNAs, Nat. Cell Biol., 14, 249-256,
signaling pathway via downregulating maternally expressed
doi: 10.1038/ncb2441.
gene-3, Exp. Ther. Med., 17, 639-648, doi: 10.3892/
54.
López Leal, R., D az Viraqué, F., Catalan, R. J.,
etm.2018.7026.
Saquel, C., et al. (2020) Schwann cell reprogramming into
68.
Liang, T. S., Zheng, Y. J., Wang, J., Zhao, J. Y., Yang,
repair cells increases exosome-loaded miRNA-21 promot-
D. K., and Liu, Z. S. (2019) MicroRNA-506 inhibits
ing axonal growth, J. Cell Sci.,
133, jcs.239004,
tumor growth and metastasis in nasopharyngeal carcinoma
doi: 10.1242/jcs.239004.
through the inactivation of the Wnt/β-catenin signaling
55.
Dong, R., Liu, Y., Yang, Y., Wang, H., Xu, Y., and
pathway by down-regulating LHX2, J. Exp. Clin. Cancer
Zhang, Z. (2019) MSC-derived exosomes-based therapy
Res., 38, 97, doi: 10.1186/s13046-019-1023-4.
БИОХИМИЯ том 86 вып. 5 2021
МикроРНК В ОНКОГЕНЕЗЕ И МЕТАСТАЗИРОВАНИИ
687
69.
Subat, S., Inamura, K., Ninomiya, H., Nagano, H.,
liver cancer, Nat. Commun., 9, 191, doi: 10.1038/s41467-
Okumura, S., and Ishikawa, Y. (2018) Unique microRNA
017-02583-0.
and mRNA interactions in EGFR-mutated lung adeno-
84.
Xiong, Y., Wu, S., Yu, H., Wu, J., Wang, Y., et al. (2018)
carcinoma, J. Clin. Med.,
7,
419, doi:
10.3390/
miR-190 promotes HCC proliferation and metastasis by
jcm7110419.
targeting PHLPP1, Exp. Cell Res.,
371,
185-195,
70.
Edmonds, M. D., Hurst, D. R., Welch, D. R. (2009)
doi: 10.1016/j.yexcr.2018.08.008.
Linking metastasis suppression with metastamiR regula-
85.
Yang, B., Feng, X., Liu, H., Tong, R., Wu, J., et al. (2020)
tion, Cell Cycle, 8, 2673-2675, doi: 10.4161/cc.8.17.9303.
High-metastatic cancer cells derived exosomal miR92a-3p
71.
Zhou, W., Fong, M. Y., Min, Y., Somlo, G., Liu, L., et al.
promotes epithelial-mesenchymal transition and metasta-
(2014) Cancer-secreted miR-105 destroys vascular
sis of low-metastatic cancer cells by regulating PTEN/Akt
endothelial barriers to promote metastasis, Cancer Cell, 25,
pathway in hepatocellular carcinoma, Oncogene, 39, 6529-
501-515, doi: 10.1016/j.ccr.2014.03.007.
6543, doi: 10.1038/s41388-020-01450-5.
72.
Kosaka, N., Iguchi, H., Hagiwara, K., Yoshioka, Y.,
86.
Mao, X. W., Xiao, J. Q., Li, Z. Y., Zheng, Y. C., and
Takeshita, F., and Ochiya, T. (2013) Neutral sphingomyeli-
Zhang, N. (2018) Effects of microRNA-135a on the
nase 2 (nSMase2)-dependent exosomal transfer of angio-
epithelial-mesenchymal transition, migration and invasion
genic microRNAs regulate cancer cell metastasis, J. Biol.
of bladder cancer cells by targeting GSK3β through the
Chem., 288, 10849-10859, doi: 10.1074/jbc.m112.446831.
Wnt/β-catenin signaling pathway, Exp. Mol. Med., 50,
73.
Fong, M. Y., Zhou, W., Liu, L., Alontaga, A. Y.,
e429, doi: 10.1038/emm.2017.239.
Chandra, M., et al. (2015) Breast-cancer-secreted miR-
87.
Liu, J., Cao, J., and Zhao, X. (2015) miR-221 facilitates
122 reprograms glucose metabolism in premetastatic niche
the TGFbeta1-induced epithelial-mesenchymal transition
to promote metastasis, Nat. Cell Biol., 17, 183-194,
in human bladder cancer cells by targeting STMN1, BMC
doi: 10.1038/ncb3094.
Urol., 15, 36, doi: 10.1186/s12894-015-0028-3.
74.
Le, M. T. N., Hamar, P., Guo, C., Basar, E., Perdigão
88.
Yan, L., Wang, Y., Liang, J., Liu, Z., Sun, X., and Cai, K.
Henriques, R., et al. (2014) MiR-200-containing extracel-
(2017) MiR-301b promotes the proliferation, mobility, and
lular vesicles promote breast cancer cell metastasis, J. Clin.
epithelial-to-mesenchymal transition of bladder cancer
Invest., 124, 5109-5128, doi: 10.1172/jci75695.
cells by targeting EGR1, Biochem. Cell Biol., 95, 571-577,
75.
Lei, B., Wang, D., Zhang, M., Deng, Y., Jiang, H., and
doi: 10.1139/bcb-2016-0232.
Li, Y. (2020) miR-615-3p promotes the epithelial-mes-
89.
Hu, H., Zhang, Q., Chen, W., Wu, T., Liu, S., et al. (2020)
enchymal transition and metastasis of breast cancer by tar-
MicroRNA-301a promotes pancreatic cancer invasion and
geting PICK1/TGFBRI axis, J. Exp. Clin. Cancer Res., 39,
metastasis through the JAK/STAT3 signaling pathway by
71, doi: 10.1186/s13046-020-01571-5.
targeting SOCS5, Carcinogenesis,
41,
502-514,
76.
Chatterjee, A., Jana, S., Chatterjee, S., Wastall, L. M.,
doi: 10.1093/carcin/bgz121.
Mandal, G., et al. (2019) MicroRNA-222 reprogrammed
90.
Xin, H., Wang, C., and Liu, Z. (2019) miR-196a-5p pro-
cancer-associated fibroblasts enhance growth and metasta-
motes metastasis of colorectal cancer via targeting IκBα,
sis of breast cancer, Br. J. Cancer,
121,
679-689,
BMC cancer, 19, 30, doi: 10.1186/s12885-018-5245-1.
doi: 10.1038/s41416-019-0566-7.
91.
Li, Y., Yan, X., Shi, J., He, Y., Xu, J., et al.
(2019)
77.
Zhao, X. G., Hu, J. Y., Tang, J., Yi, W., Zhang, M. Y.,
Aberrantly expressed miR-188-5p promotes gastric cancer
Deng, R., et al. (2019) miR-665 expression predicts poor
metastasis by activating Wnt/β-catenin signaling, BMC
survival and promotes tumor metastasis by targeting
Cancer, 19, 505, doi: 10.1186/s12885-019-5731-0.
NR4A3 in breast cancer, Cell Death Dis., 10, 479,
92.
Li, C., Lu, S., and Shi, Y. (2017) MicroRNA-187 promotes
doi: 10.1038/s41419-019-1705-z.
growth and metastasis of gastric cancer by inhibiting
78.
Hashimoto, K., Ochi, H., Sunamura, S., Kosaka, N.,
FOXA2, Oncol. Rep., 37, 1747-1755, doi: 10.3892/or.
Mabuchi, Y., et al. (2018) Cancer-secreted hsa-miR-940
2017.5370.
induces an osteoblastic phenotype in the bone metastatic
93.
Li, N., Cui, T., Guo, W., Wang, D., and Mao, L. (2019)
microenvironment via targeting ARHGAP1 and
MiR-155-5p accelerates the metastasis of cervical cancer
FAM134A, Proc. Natl. Acad. Sci. USA, 115, 2204-2209,
cell via targeting TP53INP1, OncoTargets Ther., 12, 3181-
doi: 10.1073/pnas.1717363115.
3196, doi: 10.2147/OTT.S193097.
79.
Fabbri, M., Paone, A., Calore, F., Galli, R., Gaudio, E.,
94.
Sun, X., Dongol, S., Qiu, C., Xu, Y., Sun, C., et al. (2018)
et al. (2012) MicroRNAs bind to Toll-like receptors to
miR-652 Promotes tumor proliferation and metastasis
induce prometastatic inflammatory response, Proc. Natl.
by targeting RORA in endometrial cancer, Mol. Cancer
Acad. Sci. USA, 109, E2110-E2116, doi: 10.1073/pnas.
Res., 16, 1927-1939, doi: 10.1158/1541-7786.MCR-18-
1209414109.
0267.
80.
Song, Q., Liu, B., Li, X., Zhang, Q., Cao, L., et al. (2018)
95.
Salem, M., O’Brien, J. A., Bernaudo, S., Shawer, H.,
MiR-26a-5p potentiates metastasis of human lung cancer
Ye, G., et al. (2018) miR-590-3p promotes ovarian cancer
cells by regulating ITGβ8- JAK2/STAT3 axis, Biochem.
growth and metastasis via a novel FOXA2-versican path-
Biophys. Res. Commun., 501, 494-500, doi: 10.1016/
way, Cancer Res., 78, 4175-4190, doi: 10.1158/0008-
j.bbrc.2018.05.020.
5472.CAN-17-3014.
81.
Liu, C., Luo, J., Zhao, Y. T., Wang, Z. Y., Zhou, J., et al.
96.
Cai, Q., Zeng, S., Dai, X., Wu, J., and Ma, W. (2017) miR-
(2018) TWIST1 upregulates miR-214 to promote epithe-
504 promotes tumour growth and metastasis in human
lial-to-mesenchymal transition and metastasis in lung ade-
osteosarcoma by targeting TP53INP1, Oncol. Rep., 38,
nocarcinoma, Int. J. Mol. Med., 42, 461-470, doi: 10.3892/
2993-3000, doi: 10.3892/or.2017.5983.
ijmm.2018.3630.
97.
Xiao, W., Lou, N., Ruan, H., Bao, L., Xiong, Z., et al.
82.
Li, J., Feng, Q., Wei, X., and Yu, Y. (2016) MicroRNA-490
(2017) Mir-144-3p promotes cell proliferation, metastasis,
regulates lung cancer metastasis by targeting poly r(C)-
sunitinib resistance in clear cell renal cell carcinoma by
binding protein 1, Tumour Biol., 37, 15221-15228,
downregulating ARID1A, Cell. Physiol. Biochem., 43,
doi: 10.1007/s13277-016-5347-9.
2420-2433, doi: 10.1159/000484395.
83.
Fang, T., Lv, H., Lv, G., Li, T., Wang, C., et al. (2018)
98.
Vu, L. T., Gong, J., Pham, T. T., Kim, Y., and Le, M.
Tumor-derived exosomal miR-1247-3p induces cancer-
(2020) microRNA exchange via extracellular vesicles in
associated fibroblast activation to foster lung metastasis of
cancer, Cell Prolif., 53, e12877, doi: 10.1111/cpr.12877.
БИОХИМИЯ том 86 вып. 5 2021
688
СЕМИНА и др.
99. Madhavan, D., Zucknick, M., Wallwiener, M., Cuk, K.,
темы в канцерогенезе и метастазировании опухолевых
Modugno, C., et al. (2012) Circulating miRNAs as surro-
клеток с участием микроРНК, Гены и клетки, 14, 200-
gate markers for circulating tumor cells and prognostic
200.
markers in metastatic breast cancer, Clin. Cancer Res., 18,
101. Bayraktar, R., Bertilaccio, M., and Calin, G. A. (2019) The
5972-5982, doi: 10.1158/1078-0432.ccr-12-1407.
interaction between two worlds: microRNAs and toll-like
100. Рысенкова К. Д., Рубина К. А., Иванова К. А., Карагя-
receptors, Front. Immunol., 10, 1053, doi: 10.3389/
ур М. Н., Семина Е. В. (2019) Роль урокиназной сис-
fimmu.2019.01053.
MicroRNA IN ONCOLOGY: FROM MECHANISMS OF GENE EXPRESSION
REGULATION TO REPROGRAMMING OF THE METASTATIC NICHE
Review
E. V. Semina1,2*, K. D. Rysenkova1,2, K. E. Troyanovskiy2, A. A. Shmakova1, and K. A. Rubina2
1 Federal State Budgetary Organization National Cardiology Research Center of the Ministry of Health
of the Russian Federation, 121552 Moscow, Russia; E+mail: e+semina@yandex.ru
2 Lomonosov Moscow State University, Faculty of Basic Medicine, 119192 Moscow, Russia
By 2003, the Human Genome project allowed revealing the complete structure of the human genome, but it appeared
that 97% of the DNA did not encode any known proteins. The explanation for this emerged later, when the untrans-
lated regions of DNA sequences were shown to encode short microRNAs and long noncoding RNAs and other
nucleotide sequences involved in regulation of gene expression. First identified in the cytoplasm, miRNAs have now
been discovered in all cell compartments, where their functions are not limited to degradation of the target mRNAs.
Being a part of exosomes or of a protein complex, microRNAs are secreted into the extracellular milieu and are
involved in morphogenesis and regeneration, oncogenesis, metastasis, and chemoresistance of cancer cells.
MicroRNAs play a dual role in cancer: on one hand, they can act as oncosuppressors; on the other hand, they can
stimulate cancer progression via inhibition of oncosuppressors or by stimulation of tumor neoangiogenesis and
immunosuppression. The review focuses on the current landscape in the field of microRNAs biogenesis, their func-
tions in cytoplasm and nucleus, non-canonical mechanisms of regulation of gene expression and microRNAs role in
oncogenesis. The authors present their opinion on the potential role of microRNAs in the premetastatic niche orga-
nization and metastasizing per se.
Keywords: microRNA, RISC, Ago, biogenesis, exosomes, metastasis
БИОХИМИЯ том 86 вып. 5 2021