БИОХИМИЯ, 2021, том 86, вып. 6, с. 755 - 770
УДК 577.25, 577.171.6
РОЛЬ ИЗМЕНЕНИЙ ЭКСПРЕССИИ HOMER1
В ЧУВСТВИТЕЛЬНОСТИ К СТРЕССУ
Обзор
© 2021
В.В. Решетников1,2*, Н.П. Бондарь1,3
1 Институт цитологии и генетики СО РАН, 630090 Новосибирск, Россия;
электронная почта: vasiliyreshetnikov@bionet.nsc.ru
2 Научно%технологический университет «Сириус», 354340 Сочи, Россия
3 Новосибирский государственный университет, 630090 Новосибирск, Россия
Поступила в редакцию 05.10.2020
После доработки 25.02.2021
Принята к публикации 05.03.2021
Стресс нарушает процессы синаптической пластичности и является значимым фактором риска различных
психических расстройств, таких как депрессия и тревожное расстройство. Homer1 является важным компо
нентом постсинаптической плотности - конститутивно экспрессирующиеся длинные изоформы Homer1b
и Homer1с связывают метаботропные рецепторы глутамата первой группы mGluR1 и mGluR5 и другие эф
фекторные белки, формируя постсинаптический белковый скаффолд. Активация mGluR1/5 - Homer1b/c
регулирует активность NMDA и AMPA рецепторов, а также гомеостаз Ca2+, модулируя таким образом раз
личные формы синаптической пластичности. Как результат индуцируемой альтернативной терминации
трансляции образуется белок Homer1a с доминантно негативными свойствами. Экспрессия усеченной изо
формы в ответ на активацию нейрона приводит к нарушению взаимодействия Homer1b/с c адаптерными
белками, активирует лиганд независимую сигнальную трансдукцию через mGluR1/5, приводит к подавле
нию AMPA и NMDA опосредованной передачи сигнала и, таким образом, запускает ремоделинг постси
наптического белкового скаффолда, подавляя долговременную потенциацию. Исследования на животных
моделях подтверждают, что Homer1a зависимый ремоделинг, по всей видимости, играет важную роль в
чувствительности к стрессу, а сам Homer1a может рассматриваться как нейропротектор. В данном обзоре мы
исследуем влияние различных животных моделей стресса на экспрессию Homer1, а также вклад генетичес
ких вариантов HOMER1 у людей в поведение, структурные и функциональные особенности мозга.
КЛЮЧЕВЫЕ СЛОВА: стресс, депрессия, синаптическая пластичность, Homer1, метаботропные рецепторы
глутамата.
DOI: 10.31857/S0320972521060014
ВВЕДЕНИЕ
ных и функциональных нарушениях синапти
ческой пластичности, связанных с различными
Стресс нарушает баланс между возбуждаю
психическими расстройствами [2]. Нарушения
щими и тормозными сигналами в головном моз
активности глутаматергической системы обна
ге, который поддерживается главным образом
ружены при различных заболеваниях, таких как
путем изменения активности глутаматергичес
депрессия [1-5], шизофрения [6-8] и расстрой
кой (возбуждающей) и ГАМКергической (инги
ства аутистического спектра [9].
биторной) систем. Нарушение этого баланса
Ключевую роль в изменении синаптической
приводит к морфологическим изменениям и ре
пластичности в ответ на стресс играют белки
организации дендритной сети в различных
постсинаптической плотности (postsynaptic den
структурах головного мозга [1]. Устойчивые отк
sity), включающие комплексы рецепторов, бел
лонения уровня глутамата от нормы могут иг
ки скаффолда, адаптерные белки, которые рас
рать ключевую роль в долгосрочных структур
полагаются преимущественно в глутаматерги
ческих синапсах. Белки постсинаптической
Принятые сокращения: AMPA - α амино 3 гид
плотности модулируют передачу сигнала, объ
рокси 5 метил 4 изоксазолпропионовая кислота; mGluR - единяя синаптические сигналы от пресинапти
метаботропный рецептор глутамата; mGluR1/5 - метабо
ческих нейронов и различных нейротрансмит
тропные рецепторы глутамата первой группы, 1 и 5;
NMDA - N метил D аспартат; LTD - долговременная
терных систем, преимущественно посредством
депрессия; LTP - долговременная потенциация.
глутаматных рецепторов N метил D аспартата
* Адресат для корреспонденции.
(NMDAR) и метаботропных рецепторов глута
755
756
РЕШЕТНИКОВ, БОНДАРЬ
мата первой группы (mGluR1 и mGluR5). Скаф
на молекулярном уровне. Механизм переключе
фолд белок Homer1 связывается с mGluR1,
ния экспрессии с длинных транскриптов на ко
mGluR5 [10] и адаптерными белками, в частнос
роткие не полностью ясен; считается, что он мо
ти с семейством скаффолд белков Shank [10],
жет быть связан с преждевременной остановкой
фосфолипазой С бета
[11,
12], рецептором
РНК полимеразы II, расщеплением мРНК и
145 инозитолтрифосфата
(IP3)
[13,
14],
полиаденилированием образовавшегося 3′ кон
TRPC каналами (transient receptor potential
ца [24]. Показано, что важную роль в этом игра
canonical) [13, 14], рианодиновыми рецепторами
ет транскрипционный фактор MEF2 и регуля
RyRs [15] и селективно с Ca2+ каналами L типа
торная последовательность TTGTTGGG, рас
[16], регулируя передачу сигнала, гомеостаз
положенная рядом с участком терминации
Ca2+, долговременную потенциацию (long term
транскрипции коротких изоформ Homer1 [24].
potentiation, LTP) и долговременную депрессию
Homer1 имеет консервативный регион,
(long term depression, LTD) [17, 18]. Поскольку
включающий в себя N концевой EVH1 (WH1,
нарушения передачи глутамата наблюдаются
RanBP1 WASP) домен, который связывает кон
при множестве стресс индуцированных патоло
сенсную пролин богатую последовательность
гий, мы предположили, что Homer1 может рас
(Pro Pro X X Phe), а также так называемый
сматриваться как важный компонент чувстви
пролиновый мотив (P мотив) - последователь
тельности/устойчивости к стрессу. Работы пос
ность из 5 аминокислот (Ser Pro Leu Thr Pro)
ледних двух десятилетий демонстрируют, что из
[23]. Домен EVH1 связывается со множеством
менение экспрессии Homer1 или его доминант
адаптерных белков, рецепторов и лигандов (см.
но негативной изоформы Homer1a наблюдается
подробные обзоры [18, 23]). P Мотив также мо
у животных после стресса ограничения подвиж
жет связываться и с EVH1 доменом, однако
ности (restrain stress) [19], стресса социальных
сродство с пролин богатой последователь
поражений (social defeat stress) [20], а также у
ностью значительно сильнее [25]. В связи с этим
взрослых животных, подвергнутых пренаталь
P мотив связывается с соседними EVH1 доме
ному стрессу (prenatal stress) [21]. Кроме того,
нами только в отсутствие доступных Pro Pro X
показано, что экспрессия Homer1 изменяется
X Phe мотивов, препятствуя мультимеризации
после терапии анксиолитиками и антидепрес
комплексов Homer1-рецептор/эффекторный
сантам [22]. Тем не менее, несмотря на интен
белок. Таким образом, P мотив играет важную
сивное изучение Homer1 в синаптической плас
роль в регуляции кластеризации Homer1 [25].
тичности, все еще мало известно, какую роль иг
У длинных изоформ (Homer1b, Homer1c)
рает изменение соотношения его изоформ в
также есть С концевой (coiled coil, CC) домен,
чувствительности к стрессу, а также при стресс
обеспечивающий мультимеризацию этих изо
индуцированных психических расстройствах.
форм за счет связывания между собой специфи
ческих мотивов типа лейциновая застежка
(leucine zipper) [26]. Изоформы Homer1b и
СТРУКТУРА HOMER1
Homer1c имеют схожую структуру и функции,
отличаясь только последовательностью из
Homer1 имеет 9 белковых изоформ, 3 из ко
12 аминокислотных остатков, функциональная
торых (Homer1b, Homer1c и Homer1d) являются
роль которых до конца не выяснена (рис. 1).
«длинными» изоформами, содержащими все
Мультимерные комплексы Homer1b/c позволя
функциональные домены; у двух других
ют связывать множество различных эффектор
(Homer1a и Ania3 (Homer1m)) отсутствует
ных белков, обеспечивая высокую скорость си
С концевой домен; у 4 изоформ (Homer1e, f, g и
наптической передачи на постсинаптической
h) отсутствуют частично или полностью оба
мембране. У транскриптов Homer1а и Ania3 от
функциональных домена [23]. В нашем обзоре
сутствует последовательность, кодирующая
мы остановимся на 4 х наиболее изученных изо
CC домен, однако в 3′ нетранслируемой облас
формах (Homer1a, Homer1b, Homer1c и Ania3),
ти (3′ UTR) содержится множество AUUUA
поскольку только для них показана функцио
повторов, характерных для генов раннего ответа
нальная активность.
[26, 27]. Наличие таких повторов снижает ста
В состоянии покоя в нейронах ген Homer1
бильность мРНК, что приводит к ее селектив
транскрибируется с образованием конститутив
ной деградации [28]. Усеченные транскрипты
ных транскриптов Homer1b/c. Активация нейро
содержат 5-6 экзонов вместо 10 у полноразмер
нов стимулирует транскрипцию генов раннего
ных Homer1b и Homer1с. Homer1а и Ania3 отли
ответа (immediate early genes), в частности ко
чаются друг от друга С концевой последователь
ротких транскриптов Homer1a и Ania3, экспрес
ностью (рис. 1), чья функциональная роль также
сия которых обеспечивает адаптацию к стрессу
не ясна. Однако следует отметить, что паттерн
БИОХИМИЯ том 86 вып. 6 2021
HOMER1 В ЧУВСТВИТЕЛЬНОСТИ К СТРЕССУ
757
Homer1a
Ania3
Homer1b
Homer1c
Рис. 1. Структура транскриптов Homer1 и его белковых изоформ. Homer1 содержит 11 экзонов. Первые 4 экзона кодиру
ют EVH1 домен; 5 й экзон - P мотив; 8-11 экзоны кодируют СС домен
экспрессии мРНК Homer1а и Ania3 в ответ на
мы не разделяют на Homer1a и Ania3, как и
нейрональную активацию различен: экспрессия
длинные - на b и с, поэтому функциональная
мРНК Homer1а достигает пика уже через час, в
роль отдельных изоформ остается малоисследо
то время как Ania3 - только через 4 ч [29].
ванной.
Отсутствие CC домена у изоформ Homer1a и
Ania3 не позволяет им образовывать олигомер
ные комплексы друг с другом, однако наличие
РОЛЬ HOMER1 В СИНАПТИЧЕСКОЙ
EVH1 домена обеспечивает их взаимодействие
ПЛАСТИЧНОСТИ
с пролин богатыми мотивами различных рецеп
торов, в том числе mGluR1/5 и адаптерными
Скорость и длительность синаптической пе
белками. Таким образом, обе короткие изофор
редачи, а также способность адекватной реак
мы выполняют доминантно негативную роль,
ции клетки в ответ на внешние стимулы являют
«захватывая» целевые для Homer1b и Homer1с
ся неотъемлемыми компонентами синаптичес
молекулы и приводя к диссоциации белковых
кой пластичности. Несмотря на множество бел
комплексов с Homer1b/с на постсинаптической
ковых взаимодействий Homer1, вероятнее всего
мембране. Нарушение связей Homer1b/с, инду
его основная роль в синаптической пластичнос
цированное Homer1a, приводит к снижению
ти связана с взаимодействием с mGuR1/5 [10,
внутриклеточной концентрации Ca2+ [30] и ин
17, 18, 26, 31]. Комплексы mGluR1/5 - Homer1b/c
гибированию путей сигнальной трансдукции,
являются необходимыми компонентами осущест
что в совокупности способствует ремоделирова
вления LTP [32], LTD [33-35] и депотенциа
нию постсинаптической плотности. Следует от
ции [36]. Следует отметить, что молекулярные
метить, что во многих работах короткие изофор
механизмы mGluR1/5 опосредованного запуска
БИОХИМИЯ том 86 вып. 6 2021
758
РЕШЕТНИКОВ, БОНДАРЬ
LTP и LTD схожи и, по всей вероятности, запуск
DAG, в свою очередь, активирует протеинкина
LTP или LTD определяется активностью других
зу C [38]. Оба этих механизма лежат в основе
компонентов системы [32]. Каноническая пере
mGluR1/5 опосредованной активации сигналь
дача сигнала mGluR1/5 происходит через акти
ный путей через митоген активируемую киназу
вацию фосфолипазы С субъединицей Gqα, про
(MAPК), механистическую мишень рапамици
дукта диссоциации гетеродимерного комплекса
на (mTOR) и белок, связывающий cAMP чув
G белка mGluR1/5 в результате связывания ли
ствительный элемент (cAMP CREB) [38-40].
ганда с рецептором (рис. 2, а) [37]. Фосфолипа
Помимо этого, протеинкиназа С наряду с
за С стимулирует гидролиз фосфоинозитидов с
Ca2+ индуцируемой киназой Camk2b напрямую
образованием инозитол 1,4,5 трифосфата (IP3)
фосфорилируют С конец субъединиц AMPA
и диацилглицерола (DAG). IP3, связываясь со
рецептора, обеспечивая их стабильность на
своими рецепторами на поверхности эндоплаз
постсинаптической мембране.
матического ретикулума, приводит к высвобож
Агломераты mGluR1/5-Homer1b/c распола
дению Ca2+ во внутриклеточное пространство; гаются в пресинаптической области или встрое
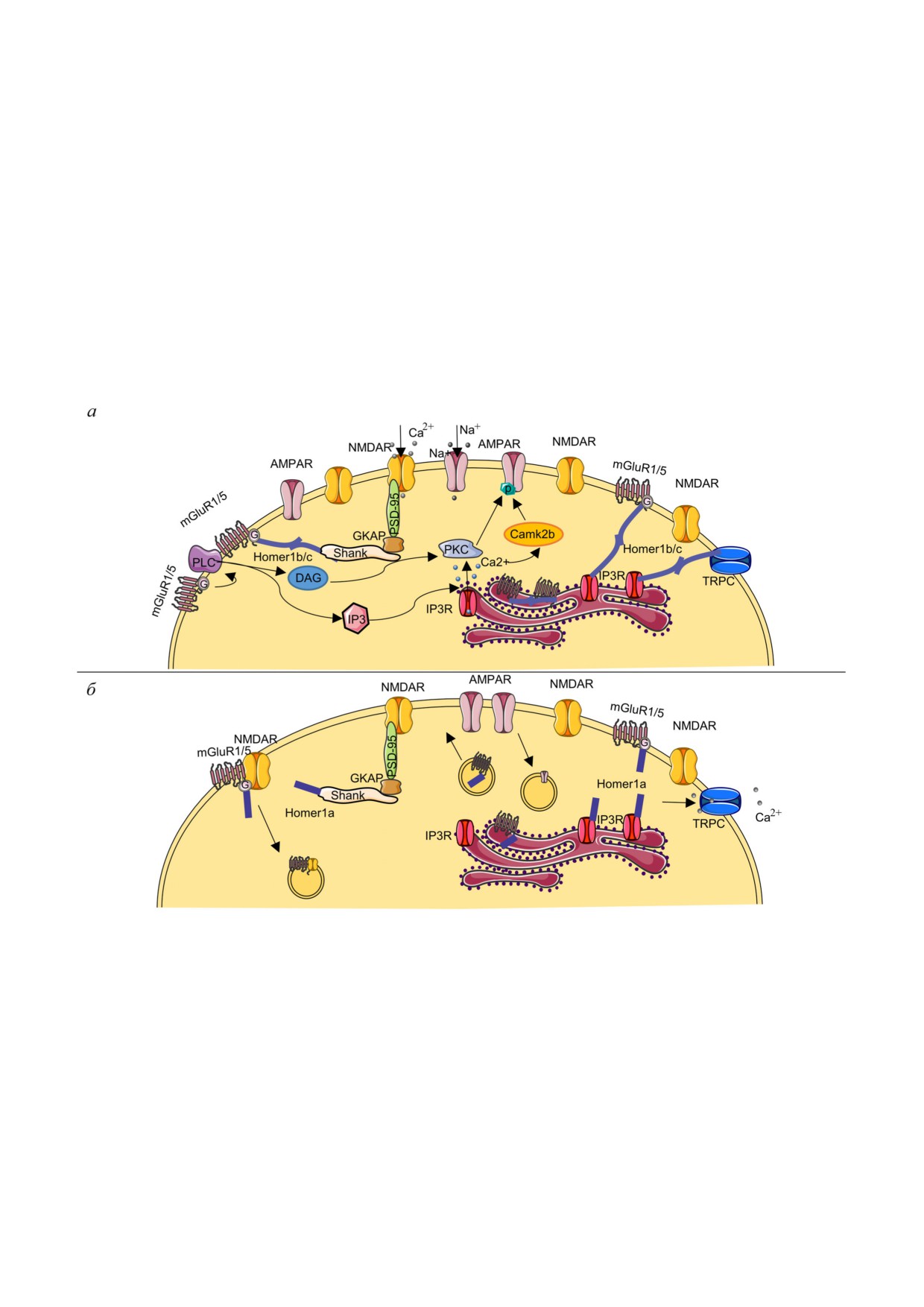
Рис. 2. Схематическое изображение постсинаптической мембраны и роли Homer1. а - Конститутивно экспрессирующа
яся изоформа Homer1b/c обеспечивает взаимосвязь mGluR1/5 c NMDAR через белок белковые комплексы
Shank - GKAP - PSD 95, а также связь mGluR/5 и кальциевых каналов TRPC с IP3R на постсинаптической мембране.
Формирование скаффолда Homer1b/c с другими белками способствует долговременной потенциации и эффективной
сигнальной трансдукции. Высвобождение депонированного Ca2+ из эндоплазматического ретикулума во внутриклеточ
ное пространство приводит к активации протеинкиназы Camk2b, которая совместно с протеинкиназой С участвует в фос
форилировании C конца субъединиц AMPAR. Такое взаимодействие препятствует эндоцитозу AMPAR, способствуя их
стабилизации на поверхности постсинаптической мембраны. б - Молекулярные механизмы Homer1a зависимого сниже
ния синаптической передачи (downscaling). Короткая изоформа Homer1a конкурирует с Homer1b/c за сайты связывания,
приводя к нарушению мультимерных комплексов mGluR1/5-Homer1b/c-Shank и mGluR1/5-Homer1b/c-IP3R, приводя
к переключению активации mGluR1/5 на лиганд независимую форму. Комплексы mGluR1/5-Homer1a способны инги
бировать активность NMDAR с помощью β субъединицы G белка mGluR1/5, приводя к их эндоцитозу. Снижение уров
ня протеинкиназ приводит к уменьшению фосфорилирования субъединиц AMPAR, что приводит к их последующему эн
доцитозу, поскольку нефосфорилированные формы менее стабильны. (С цветными вариантами рис. 2 и 3 можно ознако
БИОХИМИЯ том 86 вып. 6 2021
HOMER1 В ЧУВСТВИТЕЛЬНОСТИ К СТРЕССУ
759
ны в мембрану эндоплазматического ретикулума
передачу за счёт независимой от глутамата
[40, 41]. Мультимерные комплексы Homer1b/c
mGluR5 опосредованного усиления экспрессии
посредством белок белковых взаимодействий
и количества AMPAR на постсинаптической
способны образовывать регуляторные сети, та
мембране [55, 56]. Механизм подобной актива
кие как mGluR1/5 - Homer1b/c - Shank -
ции глутаматергической передачи не ясен, пос
GKAP - PSD 95. Последние повышают эффек
кольку в работе Holz et al. [56], как и других со
тивность сигнальной трансдукции через NMDAR
ответствующих исследованиях, показано, что
и являются структурными компонентами пост
усиление экспрессии Homer1a приводит к де
синаптической плотности [18, 42, 43]. Кроме то
фосфорилированию субъединиц AMPAR. При
го, связывание комплекса mGluR1/5-Homer1b/c
этом считается, что дефосфорилирование при
с эндоплазматическими рецепторами IP3 обес
водит к снижению количества AMPAR на пост
печивает регуляцию гомеостаза Ca2+ [44]. Таким
синаптической мембране [57]. В связи с указан
образом, взаимодействие с различными адап
ными данными мы считаем, что утверждение об
терными белками в постсинаптической плот
усилении экспрессии Homer1a, приводящей к
ности, а также необходимость участия Homer1b/c
усилению AMPA опосредуемой передаче сигна
для созревания дендритных шипиков [44-46]
ла, требуют дальнейшей проверки. Возможно,
свидетельствуют в пользу того, что Homer1b/c
наблюдаемые в этих работах эффекты были выз
необходим в создании «арматуры» постсинапти
ваны методическими особенностями увеличе
ческой плотности.
ния количества Homer1a. В частности, в работе
Короткая изоформа Homer1a конкурирует с
Holz et al. [56] Homer1a был синтезирован в бак
Homer1b/c за связывание с адаптерными белка
териальных клетках и доставлен в нейроны в
ми, приводя к диссоциации агломератов
составе белковой конструкции TAT-Homer1a.
Homer1b/c - Shank - GKAP - PSD 95 в дозоза
Согласно нашему предположению, такой способ
висимой форме (рис. 2, б) [42]. Помимо этого,
может влиять на синаптическую пластичность
связывание Homer1a с эндоплазматическими
ввиду избирательного проникновения Homer1a
mGluR1/5 приводит к их перемещению в пост
только в некоторые из множества различаю
синаптическое пространство [47], где они могут
щихся синапсов [58].
осуществлять прямое ингибирование передачи
сигнала через NMDAR путем связывания
β субъединицы G белка рецептора mGluR1/5 с
ОСТРЫЙ СТРЕСС ПРИВОДИТ
С концом NR1 субъединицы NMDAR [48, 49].
К ИНДУКЦИИ ЭКСПРЕССИИ Homer1a
Повышение экспрессии Homer1a и нарушение
взаимодействия Homer1b/c-mGluR1/5 приво
Острый стресс приводит к активации нейро
дит к запуску лиганд независимой активации
нов и значительно увеличивает скорость иници
mGluR1/5 [17, 47, 50]. Активация этих глутамат
ации транскрипции Homer1 с образованием ко
ных рецепторов приводит к снижению количе
ротких транскриптов Homer1a и Ania3 [27]. По
ства AMPAR на постсинаптической мембране за
казано, что тест условно рефлекторного зами
счет уменьшения фосфорилирования GluA2
рания (contextual fear conditioning) приводит к
субъединицы AMPAR и усилению их эндоцито
устойчивому усилению экспрессии Homer1a в
за (см. детальный обзор механизма в работах
различных регионах гиппокампа и миндалине,
[17, 18, 50, 51]). Индуцированное Homer1a сни
которое наблюдается уже через 30 мин после
жение эффективности синаптической передачи
стрессового воздействия и сохраняется до 24 ч
за счёт действия mGluR1/5 лежит в основе так
[59, 60] (таблица). Стресс, вызванный страхом
называемой гомеостатической синаптической
хищника, также приводит к индукции экспрес
пластичности, которая направлена на поддер
сии транскрипта Homer1a в различных регионах
жание долгосрочной стабильности молекуляр
мозга, таких как гиппокамп, гипоталамус и
ных сетей [52]. Таким образом, повышенная
миндалины [61]. Причем уровень экспрессии
экспрессия Homer1a приводит к ремоделирова
Homer1a в этих структурах коррелирует с дли
нию постсинаптической плотности. Функцио
тельностью реакции замирания (freezing) [61].
нально эти изменения сопровождаются подав
Интересно, что схожие результаты были получе
лением долговременной потенциации и способ
ны после однократного воздействия стресса со
ствуют снижению эффективности синаптичес
циального поражения (social defeat stress) у
кой передачи [53, 54], а также редукции размера
взрослых самцов мышиной линии C57BL: в дан
синапса и количества зрелых шипиков в денд
ном случае увеличения экспрессии Homer1a не
рите [46]. В противоположность этим данным,
наблюдалось, однако уровень транскрипта
некоторые работы свидетельствуют о том, что
Homer1b/c был снижен. Вероятно, это привело
экспрессия Homer1a усиливает синаптическую
к изменению соотношения Homer1a / Homer1b/c
БИОХИМИЯ том 86 вып. 6 2021
760
РЕШЕТНИКОВ, БОНДАРЬ
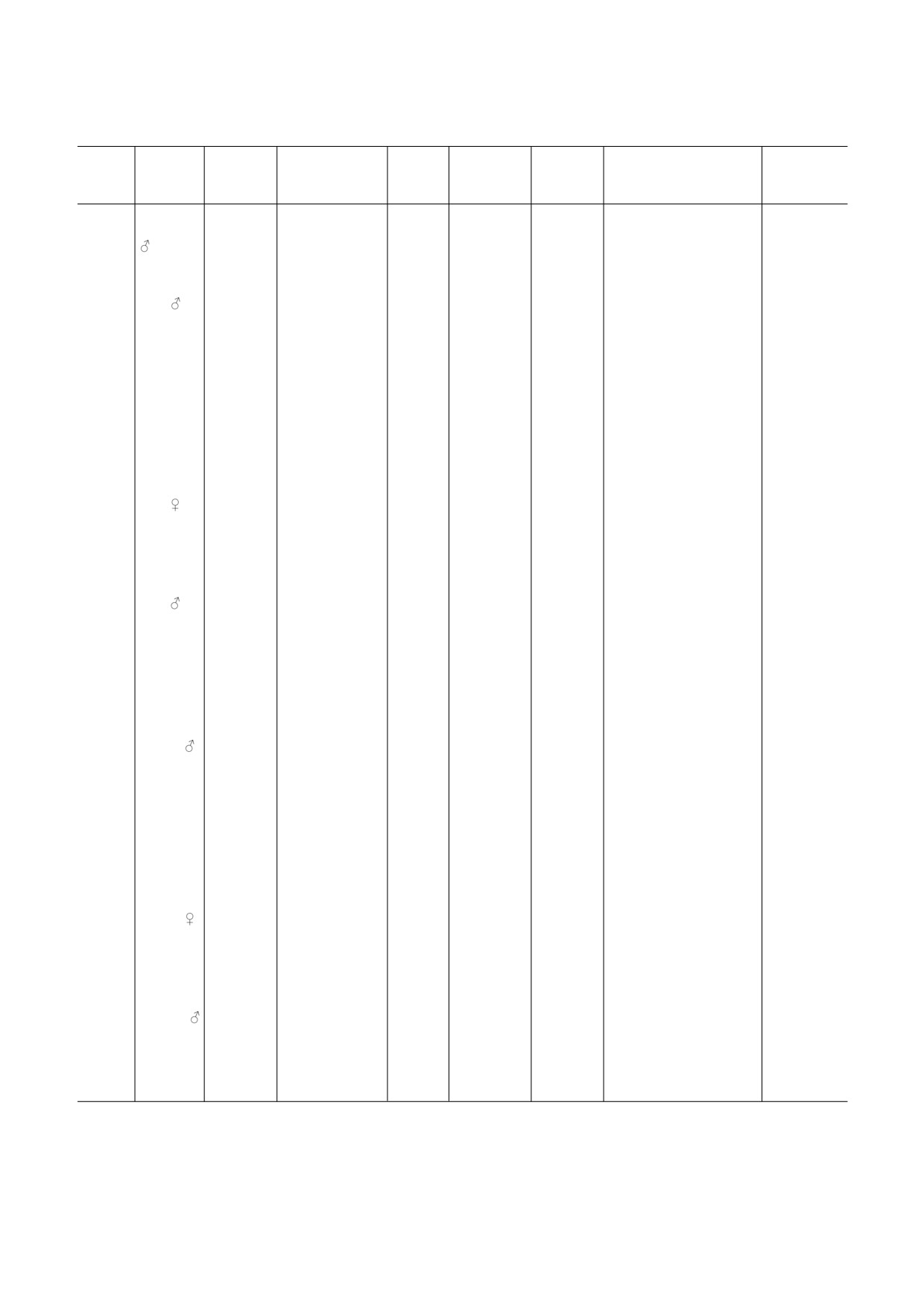
Стресс индуцированные изменения в экспрессии Homer1
Вид
Возраст
Тип
Время стрессиро
Забор
Структура
Методика
Экспресcия Homer1
Ссылки
(линия)
стрессора
вания
материала
мозга
Крысы
взрослые
модель ус
однократное
через
области
in situ
Homer1b/c - без
[59]
Lister
ловно реф
30 мин
CA1, CA3
изменений во всех
Hooded
лекторного
1 ч
и DG dHIP
исследованных регионах;
замирания
4 ч
(Bregma
Homer1a ↑ в CA1 через
(Contextual
24 ч
-3,5 мм)
30 мин, 2 и 4 ч DG ↑ через
fear condi
30 мин; Ania3 ↑ в CA1,
tioning)
CA3 и DG через 30 мин
Мыши
взрослые
модель ус
однократное
через 2 ч
HIP; AMY
qPCR
Homer1a ↑ как в HIP, так
[60]
C57BL/6J
(6-10 нед.)
ловно реф
и в AMY
лекторного
Homer1c без изменений
замирания
(Contextual
fear condi
tioning)
Крысы
взрослые
воздействие
однократное в те
через 1 ч
PVN (Bregma
in situ
Homer1a ↑ во всех
[61]
Sprague
хищника
чение 15 мин
-1,80 мм);
структурах
Dawley
AMY, DG,
CA1, CA3
(Bregma
-3,14 мм)
Мыши
взрослые
стресс со
однократное в те
через 1 ч
CA1 зона
in situ
Homer1a без изменений
[20]
C57BL/6N
(12 нед.)
циального
чение 5 мин
4 ч
гиппокампа
ни в одной временной
поражения
8 ч
точке; Homer1b/c ↓ через
24 ч
4 и 8 ч
Крысы
взрослые
воздействие
40 мин
через 1 сут
HIP
qPCR;
Homer1 ↑ через 7 сут;
[105]
Sprague
током (Foot
7 сут
Western
Homer1b/c без изменений
Dawley
shock)
14 сут
blotting
Крысы
взрослые
воздействие
40 мин
через 24 ч
mPFC
qPCR
Homer1b/c ↓ через 24 ч
[62]
Sprague
током (Foot
7 сут
Dawley
shock)
14 сут
Крысы
взрослые
cтресс ог
повторяющееся
через
HIP
Western
Homer1b/c ↑
[63]
Wistar
раничения
6 ч/сут в течение
18 ч
blotting
подвиж
21 сут
ности
Крысы
взрослые
cтресс ог
повторяющееся
через
HIP
qPCR
Homer1b/c ↑
[19]
Wistar
раничения
6 ч/сут в течение
18 ч
подвиж
21 сут
ности
Мыши
взрослые
cтресс со
повторяющееся
через
DG, CA1,
in situ
Homer1b/c ↑ в CA1, CA3;
[64]
C57BL/6N
(12 нед.)
циального
1 раз в сут в тече
24 ч
CA3 зоны
Homer1a без изменений
поражения
ние 21 сут
dHIP
Мыши
взрослые
cтресс со
повторяющееся
через
mPFC, HIP,
qPCR;
Homer1b/c ↑ в HIP у жи
[65]
C57BL/6N
(7 8 нед.)
циального
1 раз в сут в тече
120 ч
AMY
Western
вотных, чувствительных
поражения
ние 10 сут + пов
через
HIP
blotting
к стрессу социального
+ cтресс
торяющееся 2 ч/сут
72 ч
поражения
ограниче
в течение 21 сут
Homer1a без изменений
ния под
Homer1b/c ↑ HIP
вижности
Крысы
взрослые
хрониче
повторяющееся
N/A
FC
qPCR
Homer1b/c ↓
[68]
Wistar
(170 г)
ский мяг
в течение 42 сут
кий стресс
Крысы
подростки
хроничес
повторяющееся
N/A
mPFC
протеом
Homer1b/c ↑
[69]
Wistar
(5-6 нед.)
кий мягкий
в течение 56 сут
ный анализ
стресс
БИОХИМИЯ том 86 вып. 6 2021
HOMER1 В ЧУВСТВИТЕЛЬНОСТИ К СТРЕССУ
761
Окончание таблицы
Вид
Возраст
Тип
Время стрессиро
Забор
Структура
Методика
Экспресcия Homer1
Ссылки
(линия)
стрессора
вания
материала
мозга
Мыши
взрослые
хроничес
повторяющееся в
через
HIP; PFC
Western
Homer1a ↓ в HIP и PFC
[66]
C57BL/6J
(8-10 нед.)
кий мягкий
течение 57 сут
120 ч
blotting
стресс
Мыши
взрослые
стресс со
стресс социаль
через 48 ч
PFC
RNA seq;
Homer1a ↓ у группы с
[67]
C57BL/6J
(15-16
циального
ных поражений
после
qPCR
комбинацией стрессов
нед.)
поражения
1 раз в день в те
последней
+ комби
чение 15 сут; ран
социаль
нация ран
ний постнаталь
ной кон
него пост
ный: отделение
фронта
натального
детенышей от ма
ции
и стресса
терей на 3 ч 1 раз
социально
в день со 2 по 14
го пораже
постнатальный
ния во
день
взрослом
возрасте
Мыши
взрослые
ранний
отделение детены
во взрос
dHIP
qPCR
Homer1a без изменений в
[74]
C57BL/6J
(12-15
постна
шей от матерей
лом воз
(Bregma
обеих группах; Homer1b/c
нед.)
тальный
на 15 мин или 180
расте
-1,86 -
без изменений в обеих
стресс
мин 1 раз в день
-2,16 мм);
группах
со 2 по 14 постна
PFC
тальный день
Мыши
взрослые
ранний
отделение дете
во взрос
PFC
RNA seq
у группы с хроническим
неопублико
C57BL/6J
(12-15
постна
нышей от мате
лом воз
постнатальным стрессом
ванные ре
нед.)
тальный
рей на 180 мин
расте
общая экспрессия
зультаты,
стресс
1 раз в день со 2
Homer1↓, но Homer1a и
NCBI
по 14 постнаталь
Homer1b/c по отдельности
BioProject
ный день + од
не были изменены; у
PRJNA649640
нократное отде
группы с однократным
ление от матерей
отделением Homer1,
на 24 ч на 9 пост
Homer1a, Homer1b/c без
натальный день
изменений
Мыши
детеныши
ранний
отделение дете
на 15 й
PFC
RNA seq
Homer1, Homer1a,
неопублико
C57BL/6
(15 сут)
постна
нышей от мате
постна
Homer1b/c без изменений
ванные ре
тальный
рей на 180 мин
тальный
в обеих группах (с однок
зультаты,
стресс
1 раз в день со 2
день
ратным и хроническим
NCBI
по 14 постнаталь
отделением)
BioProject
ный день + од
PRJNA649640
нократное отде
ление от матерей
на 24 ч на 9 пост
натальный день
Крысы
ювениль
пренаталь
повторяющееся
на 21 й
AMY; HIP;
Western
Homer1a ↑ в AMY, HIP и
[73]
Sprague
ные
ный стресс,
(3 раза в сут по
постна
PFC
blotting
PFC; Homer1b/c ↑ в PFC
Dawley
(21 сут)
связанный
30 мин на протя
тальный
с ограниче
жении 7 послед
день
нием под
них дней геста
вижности
ции)
матери
Крысы
взрослые
пренаталь
повторяющееся
во взрос
AMY; dHIP;
in situ
Homer1a ↑ AMY и ↓
[21]
Sprague
(17 нед.)
ный стресс,
(3 раза в сут по
лом воз
PFC
в HIP и PFC;
Dawley
связанный
45 мин, начиная с
расте
Homer1b/c ↓ в AMY
с ограниче
11 го дня геста
нием под
ции)
вижности
матери
Примечание. PVN - паравентрикулярные ядра гипоталамуса, AMY - миндалина, HIP - гиппокамп, dHIP - дорсальный
гиппокамп, PFC - префронтальная кора, mPFC - медиальная префронтальная кора, ↑ - усиление экспрессии,
↓ - снижение экспрессии, N/A - нет данных.
БИОХИМИЯ том 86 вып. 6 2021
762
РЕШЕТНИКОВ, БОНДАРЬ
в дорсальном гиппокампе и сопровождалось на
параметрами социального поведения (social
рушениями пространственной памяти [20]. Од
interaction ratio) и позитивную корреляцию с па
нако эти негативные эффекты стресса на прост
раметрами депрессивно подобного поведения
ранственную память были нивелированы как с
(sucrose preference), которые были оценены у
помощью направленной оверэкспрессии тран
этих животных после хронического стресса.
скрипта Homer1b/c в дорсальном гиппокампе,
Кроме того, авторы этого исследования показа
так и после введения антагониста mGluR5 (3 2
ли, что у животных, чувствительных к хроничес
метил 4 тиазолил этинил пиридин, MTEP) за
кому стрессу социальных поражений, наблюда
5 мин до процедуры стресса социального пора
ется усиление mGluR опосредованной долго
жения [20]. У крыс, на которых воздействовали
временной депрессии и снижение уровня
электрическим током (foot shock), в префрон
экспрессии субъединиц AMPA рецепторов
тальной коре была снижена экспрессия
(GluA1, GluA2). Авторы предполагают, что по
Homer1b/c через 24 ч после воздействия [62]. В
вышение сигналинга, опосредованного комп
целом, индукция экспрессии изоформы
лексом mGluR-Homer1b/c, приводит к высво
Homer1a вне зависимости от типа стресса наб
бождению Ca2+ из эндоплазматического ретику
людается в ответ на различные типы стимулов,
лума, который, в свою очередь, активирует
такие как химически индуцированная нейро
PERK eIF2α и CREB сигнальный путь в гиппо
нальная деполяризация, эпилептическая актив
кампе: уровень фосфорилированных форм
ность, травматическое повреждение, использо
PERK, eIF2α и CREB оказался повышен у груп
вание психостимуляторов, физическая актив
пы чувствительных к стрессу животных. Анало
ность и, наконец, стресс, вызванный негатив
гичные эффекты были получены на модели хро
ными факторами окружающей среды или новой
нического мягкого стресса (chronic mild stress),
обстановкой (см. обзоры [18, 22]). Таким обра
который приводил к снижению уровня Homer1a
зом, предположительно, индукция экспрессии
в гиппокампе и префронтальной коре, что соп
Homer1a при остром стрессе неспецифична и
ровождалось выраженным депрессивно подоб
играет роль в подавлении LTP и ремоделинге си
ным поведением [66]. Длительное воздействие
наптической плотности.
высокочастотной транскраниальной магнитной
стимуляции (15 или 25 Гц с 30 го по 57 й день
стрессирования), которая используется в тера
РОЛЬ Homer1 В АДАПТАЦИИ
пии различных неврологических и психических
К ХРОНИЧЕСКОМУ СТРЕССУ
заболеваний, сглаживает эффекты стресса как
на поведенческом уровне, так и на уровне
Хронический, как и острый, стресс также
экспрессии Homer1a в различных структурах
влияет на уровень экспрессии различных изо
мозга [66]. Поскольку известно, что Homer1a яв
форм Homer1. Так, у крыс, подвергнутых хрони
ляется доминантно негативной изоформой,
ческому стрессу ограничения подвижности
можно предположить, что снижение ее количе
(6 ч/день в течение 21 дня), в гиппокампе было
ства приводит к усилению Homer1b/c опосре
повышено содержание изоформы Homer1b/с
дованной передачи сигнала. Аналогичное сни
[63] и уровень мРНК этих транскриптов [19] че
жение экспрессии Homer1 в префронтальной
рез 18 ч после последней процедуры стресса.
коре взрослых самцов мышей, главным обра
Аналогичные изменения в экспрессии
зом за счет снижения уровня Homer1a, было
Homer1b/c в дорсальном гиппокампе наблюда
показано также в нашей работе после воздей
лись и после хронического стресса социальных
ствия хронического стресса социальных пора
поражений [64]. Помимо этого, в работе Wagner
жений [67].
et al. [64] было показано, что хронический
Однако не во всех структурах мозга наблюда
стресс социальных поражений приводит к сни
ются аналогичные эффекты хронического
жению числа комплексов Homer1b/c-mGluR5
стресса на соотношение Homer1a / Homer1b/c.
по сравнению с контролем, при том что содер
В вышеописанной работе Li et al. [65] на живот
жание самих белков Homer1b/c и mGluR5 меж
ных с хроническим стрессом социальных пора
ду группами было схожим. Элегантное исследо
жений авторы продемонстрировали изменение
вание на мышах [65] показало, что у животных,
экспрессии Homer1b/c только в гиппокампе, в
чувствительных к хроническому стрессу соци
то время как уровень Homer1b/c и Homer1a в
альных поражений, и у животных с хроничес
префронтальной коре и миндалине оставался
ким стрессом ограничения подвижности наб
неизменным. Хронический мягкий стресс в те
людается схожее повышение экспрессии
чение 6 недель приводит к снижению уровня
Homer1b/c в гиппокампе. Уровень экспрессии
Homer1b/c во фронтальной коре [68]. Протеом
этой изоформы имел негативную корреляцию с
ный анализ также показал, что у крыс, устойчи
БИОХИМИЯ том 86 вып. 6 2021
HOMER1 В ЧУВСТВИТЕЛЬНОСТИ К СТРЕССУ
763
вых к хроническому мягкому стрессу, уровень
ной коре самцов мышей на 15 й постнатальный
Homer1b/c в префронтальной коре выше, чем у
день. Однако важно отметить, что во взрослом
чувствительных животных [69]. Можно предпо
возрасте у этих мышей наблюдается снижение
ложить, что подобные различия в эффектах хро
общей экспрессии Homer1 без изменения соот
нического стресса на экспрессию Homer1 могут
ношения коротких и длинных транскриптов
быть связаны с регион специфичностью, мето
(неопубликованные данные, NCBI BioProject
дологическими различиями, типом стресса, а
PRJNA649640). Интересно, что совокупность
также методом детекции уровня белка. Прини
наших результатов демонстрирует, что отсро
мая во внимание все эти данные, можно заклю
ченные эффекты раннего постнатального стрес
чить, что наиболее воспроизводимые эффекты
са наблюдаются только у самцов, но не у самок
различных типов хронического стресса связаны
мышей [74]. Снижение совокупной экспрессии
с увеличением уровня Homer1b/c и снижением
гена может являться свидетельством эпигенети
соотношения Homer1a / Homer1b/c в гиппокам
ческих изменений, произошедших в его регуля
пе, причем эти молекулярные изменения нап
торных регионах или в генах, белковые продук
рямую связаны с чувствительностью/устойчи
ты которых являются регуляторами экспрессии
востью животных к хроническому стрессу.
Homer1. C помощью in vitro и in vivo подходов
было показано, что эпигенетическая регуляция
Homer1 зависит от BDNF индуцируемого сиг
ОТСРОЧЕННЫЕ ВО ВРЕМЕНИ
налинга (brain derived neurotrophic factor,
ЭФФЕКТЫ СТРЕССА
BDNF) [75], который в значительной степени
подвержен влиянию раннего постнатального
Стресс в ранний период жизни (пренаталь
стресса [76, 77]. Таким образом, стресс в ранний
ный и ранний постнатальный период) может
период жизни, по всей вероятности, не оказыва
оказывать влияние на чувствительность к нему в
ет прямого влияния на переключение тран
подростковом и взрослом возрасте. Молекуляр
скрипции Homer1b/c и Homer1a, однако может
ные механизмы таких отсроченных во времени
оказывать влияние на активность экспрессии
эффектов, по всей видимости, связаны с эпиге
Homer1, которая, в свою очередь, определяет
нетическими изменениями, приводящими к из
амплитуду этого переключения.
менению паттерна экспрессии генов [70, 71].
Экспрессия Homer1a в кортикальных структу
рах и гиппокампе последовательно увеличива
HOMER1 И ПСИХИЧЕСКИЕ
ется после рождения и достигает пика на 3 ю
РАССТРОЙСТВА
постнатальную неделю жизни у грызунов
[31, 72]. Этот процесс совпадает с периодом ин
Данные, полученные с помощью полноге
тенсивной реорганизации синапсов и установ
номного поиска ассоциаций (GWAS), свиде
ления устойчивых синаптических сетей. В рабо
тельствуют в пользу наличия связи некоторых
те на крысах было показано, что хронический
полиморфизмов, расположенных в регулятор
стресс в пренатальном периоде приводит к уси
ных районах гена HOMER1 человека, c депрес
лению экспрессии Homer1a в миндалине у юве
сией [78, 79] и суицидальным поведением
нильных и взрослых животных [21, 73]. Однако
[80, 81]. Функциональная роль таких полимор
если уровень Homer1a в гиппокампе и префрон
физмов остается не до конца изученной, однако
тальной коре ювенильных животных также был
с помощью различных биоинформатических
повышен [73], то у взрослых он был наоборот
подходов удалось предсказать возможные сайты
снижен [21]. Экспрессия Homer1a в гиппокампе
связывания транскрипционных факторов, та
и префронтальной коре прямо пропорциональ
ких как CEBPA, REL, NFKB1, которые могут
но коррелировала со временем, проведенным в
быть нарушены в случае полиморфных замен
светлой зоне в процессе теста светлой темной
[79, 81]. Данные функциональной магнитной
коробки (light dark box), в то время как экспрес
томографии (fMRI) показали, что наличие по
сия в миндалинах имела обратную корреляцию
лиморфизма rs7713917 у человека приводит к
с этим параметром [21]. Наши исследования на
сниженной активации префронтальной коры в
моделях раннего постнатального стресса пока
процессе ожидания вознаграждения [78] и к по
зали, что как хроническое отделение детенышей
вышенной активации - в ответ на эмоциональ
от матерей в течение первых двух недель жизни
ный стимул [82], что может свидетельствовать о
(по 3 ч в день), так и однократное отделение на
снижении уровня мотивации и усилении им
9 й постнатальный день (на 24 ч) не приводит к
пульсивности. Кроме того, носители такого ал
изменению уровня экспрессии Homer1 и тран
леля медленнее переключали внимание в ответ
скриптов Homer1a и Homer1b/c в префронталь
на негативные стимулы, что может свидетель
БИОХИМИЯ том 86 вып. 6 2021
764
РЕШЕТНИКОВ, БОНДАРЬ
ствовать о нарушении в процессах исполнитель
рят том, что поведенческие нарушения и повы
ного контроля [83]. Помимо функциональных
шение чувствительности к стрессу могут быть
изменений, у носителей аллеля риска (А)
связаны с изменением общей экспрессии
rs7713917 был снижен объем медиальной пре
Homer1, а не с изменением соотношения
фронтальной коры и показатели фракционной
Homer1a к Homer1b/c. Однако можно предпо
анизотропии (fractional anisotropy) в лобном
ложить, что именно низкая скорость индукции
тракте [82]. Подобные структурные особенности
Homer1a может быть причиной негативных по
могут свидетельствовать о снижении уровня мие
веденческих эффектов, поскольку именно
линизации, что часто ассоциировано со стресс
действие короткой изоформы связывают с ус
индуцированными психическими расстройства
тойчивостью к стрессу. Подтверждение нашему
ми [84]. Следует отметить, что результаты пост
предположению можно найти в работах на жи
мортальных исследований демонстрируют схо
вотных с нокаутом гена Homer1, демонстрирую
жий уровень экспрессии HOMER1 у тех, кто был
щие снижение исследовательской активности,
подвержен депрессии при жизни и условно здо
повышение тревожности, ухудшение адаптив
ровых людей. Лишь недавнее исследование по
ного поведения в тесте вынужденного плавания,
казало, что уровень HOMER1A в интернейронах
а также нарушение сенсомоторных реакций и
стриатума был повышен у пациентов, склонных
когнитивных функций [92, 93]. Однако восста
к депрессии, по сравнению с условно здоровыми
новление экспрессии одной лишь изоформы
индивидуумами [85]. Более того, у депрессивных
Homer1a в префронтальной коре путем введе
пациентов часто обнаруживаются регион спе
ния векторной конструкции нивелирует боль
цифичные изменения экспрессии mGLUR1 и
шинство негативных поведенческих эффектов у
mGLUR5 [5, 86], что также может свидетель
этих животных [93]. В то же время восстановле
ствовать о нарушении HOMER1 опосредован
ние экспрессии Homer1b/c в префронтальной
ного сигналинга. Роль HOMER1 в устойчивости
коре не приводит к каким либо поведенческим
к психическим заболеваниям также подтвержда
улучшениям.
ется тем, что носители аллелей риска гена
Каковы же молекулярные механизмы подоб
HOMER1 получают меньший эффект от терапии
ных эффектов Homer1a? На этот вопрос пока
антидепрессантами [82, 87].
нет точного ответа. Поскольку Homer1b/c спо
собен к модуляции различных форм синапти
ческой пластичности в отличие от Homer1a, ве
АКТИВАЦИЯ Homer1a
роятнее всего, такие эффекты не могут объяс
И НЕЙРОПРОТЕКТОРНЫЙ ЭФФЕКТ
няться только лишь изменением скорости си
наптической передачи. Недавно показано, что
Представленные нами данные свидетель
антидепрессивные эффекты, вызванные индук
ствуют о том, что острый стресс приводит в ос
цией Homer1a, связаны с активацией сигналь
новном к усилению экспрессии Homer1a в раз
ного каскада ERK, причем как через
личных регионах мозга, в то время как хрони
BDNF-Ras-ERK, так и через A1R ERK1/2 пу
ческий стресс наиболее часто приводит к усиле
ти [22]. В вышеописанной работе Li et al. [65] ав
нию экспрессии изоформ Homer1b/c в гиппо
торы демонстрируют, что усиление чувствитель
кампе. Примечательно, что изменения в соот
ности к стрессу связано с активностью PERK-
ношении Homer1a и Homer1b/c в гиппокампе
eIF2α пути в гиппокаме. Следует отметить, что
или префронтальной коре могут определять ус
активация Homer1a в разных структурах мозга,
тойчивость/чувствительность к стрессу [65, 67].
таких как префронтальная кора и гиппокамп,
Эти данные хорошо согласуются с предыдущи
может иметь противоположный эффект в
ми работами, в которых показано, что индукция
стресс индуцированном депрессивном поведе
Homer1a в кортикальных структурах позволяет
нии [94]. Более того, эффекты Homer1a на
лучше приспособиться к стрессовым условиям
чувствительность к стрессу могут также зависеть
[88] и оказывает выраженный антидепрессив
от степени специфичности индукции экспрес
ный эффект [22, 89-91]. При этом усиление
сии Homer1a - активируется ли она только в од
экспрессии Homer1a наблюдается как при тера
ной области мозга или сразу в нескольких [95].
пии фармацевтическими препаратами [22], так
Интересно, что вызванное индукцией Homer1a
и с помощью других воздействий, таких как
подавление LTP и синаптической передачи пло
транскраниальная магнитная стимуляция [89],
хо согласуется с общепринятой концепцией
электроконвульсивная терапия [91], деприва
двухфазного изменения активности глутамат
ция сна [91] и фототерапия [90].
ергической передачи, вызванной стрессом
В то же время данные экспериментов на жи
[96-98]. Эта концепция предполагает, что ост
вотных по отсроченным эффектам стресса гово
рый стресс усиливает высвобождение глутамата,
БИОХИМИЯ том 86 вып. 6 2021
HOMER1 В ЧУВСТВИТЕЛЬНОСТИ К СТРЕССУ
765
встраивание AMPA и NMDA рецепторов в
ня до начала воздействия. В этом контексте
постсинаптическую мембрану, в то время как
можно рассматривать Homer1a зависимый ре
хронический стресс ассоциирован со снижени
моделинг как важный компонент «переключе
ем количества глутаматных рецепторов на пост
ния» синаптической передачи, а индукцию
синаптической мембране и подавлением пере
экспрессии Homer1a - как адаптацию клетки в
дачи сигнала с помощью глутамата. Одно из воз
ответ на аберрантную активацию глутаматерги
можных объяснений непоследовательности эф
ческой передачи. Таким образом, Homer1a мо
фектов активации экспрессии Homer1a на
жет выполнять нейропротекторную роль. В
AMPA сигналинг может быть связано с различ
подтверждение этой гипотезы на культурах ней
ными временными профилями стрессорного от
ронов in vitro было показано, что Homer1a защи
вета [99] и с так называемым двухфазным ремо
щает нейроны от NMDA опосредованного пов
делингом архитектуры постсинаптической
реждения [101]. Кроме того, как оверэкспрессия
мембраны [100], который предполагает, что дли
Homer1a, так и снижение экспрессии Homer1b/c
тельная стимуляция глутаматом изначально (че
подавляет апоптоз в нейронах, подверженных
рез
30-60
мин) приводит к нарушению
травматическому воздействию, усиливает жиз
Homer1b/c содержащих постсинаптических
неспособность клеток и стимулирует процессы
кластеров, но спустя 4-8 ч наблюдается увели
аутофагии [102, 103]. Важность Homer1a как
чение плотности кластеров относительно уров
нейропротектора подтверждается также его
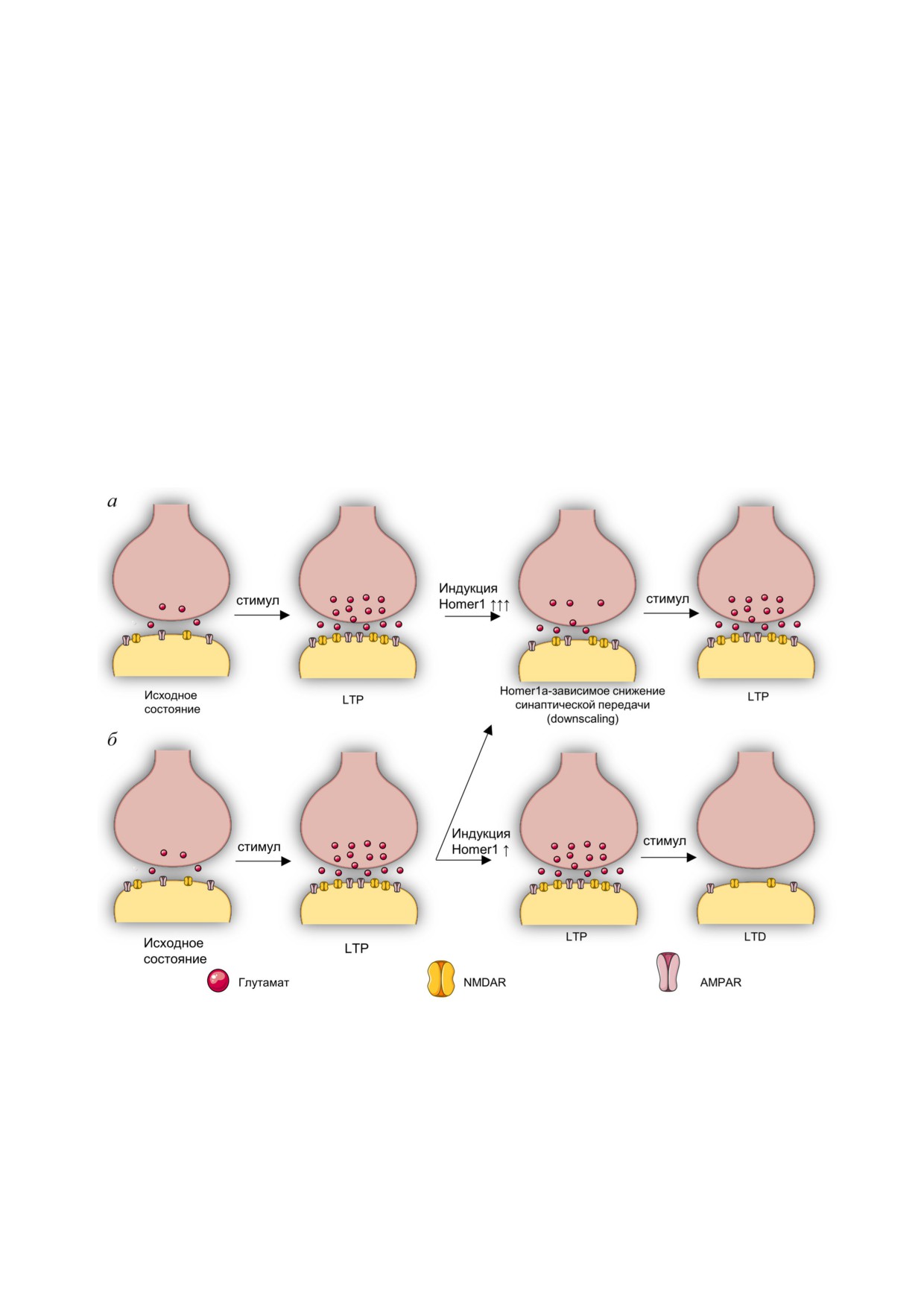
Рис. 3. Предполагаемая роль Homer1a зависимого ремоделинга в устойчивости к стрессу в синаптической передаче.
а - При высоком уровне индукции Homer1a (↑↑↑) в ответ на LTP происходит обратимое подавление синаптической пе
редачи (downscaling), необходимое для защиты клетки от чрезмерной активации глутаматергической передачи и адапта
ции клетки для последующей LTP. Эта модель предположительно характерна для устойчивых к стрессовым воздействиям
индивидуумов или непродолжительного стрессового воздействия. б - При низком уровне индукции Homer1a (↑) в ответ
на LTP, вероятно, лишь в части синапсов наблюдается Homer1a зависимое подавление активности, другие же синапсы,
по всей видимости, продолжают находиться в состоянии LTP, после чего неизбежно наступает фаза LTD, сопровождаю
щаяся более глубоким ингибированием синаптической передачи. Эта модель предположительно характерна для более
чувствительных к стрессовым воздействиям индивидуумов или ситуации хронического стресса
БИОХИМИЯ том 86 вып. 6 2021
766
РЕШЕТНИКОВ, БОНДАРЬ
ролью в гомеостатической синаптической плас
ответственных за психоэмоциональное состоя
тичности во время сна, которая включает в себя
ние. В этом контексте усиление экспрессии
удаление AMPAR с постсинаптической мембра
Homer1b/c, вызванное хроническим стрессом,
ны и ингибирование LTP, обеспечивая снижение
может быть следствием, а не причиной сниже
числа возбуждающих синапсов [104]. Тем не ме
ния глутаматергического сигналинга и уровня
нее, несмотря на то что Homer1a приводит к по
активность индуцируемой экспрессии Homer1a.
давлению LTP, опосредованные им изменения в
подавлении синаптической передачи (downscal
ing) являются обратимыми и менее выраженны
Финансирование. Работа выполнена при фи
ми, чем LTD или депотенциация [36].
нансовой поддержке Российского научного
Таким образом, по всей видимости, именно
фонда (грант № 16 15 10131).
возможность быстрой адаптации синапсов бла
Конфликт интересов. Авторы заявляют об от
годаря Homer1a зависимому ремоделингу пост
сутствии конфликта интересов.
синаптической плотности в ответ на стрессовые
Соблюдение этических норм. Настоящая
стимулы обеспечивает устойчивость и предотв
статья не содержит описания каких либо иссле
ращение более сильного ингибирования синап
дований с участием людей или животных в каче
тической передачи в нейронных сетях (рис. 3), стве объектов.
СПИСОК ЛИТЕРАТУРЫ
1.
Qiao, H., Li, M. X., Xu, C., Chen, H. B., An, S. C., and
phatase, and homer 1, in autism: a postmortem study in
Ma, X. M. (2016) Dendritic spines in depression: what we
cerebellar vermis and superior frontal cortex, Mol. Autism,
learned from animal models, Neural Plast., 2016, 8056370,
4, 21, doi: 10.1186/2040 2392 4 21.
doi: 10.1155/2016/8056370.
10.
Tu, J. C., Xiao, B., Yuan, J. P., Lanahan, A. A.,
2.
Musazzi, L., Treccani, G., and Popolil, M.
(2015)
Leoffert, K., et al. (1998) Homer binds a novel proline rich
Functional and structural remodeling of glutamate synaps
motif and links group 1 metabotropic glutamate receptors
es in prefrontal and frontal cortex induced by behavioral
with IP3 receptors, Neuron, 21, 717 726, doi: 10.1016/
stress, Front. Psychiatry, 6, 60, doi: 10.3389/Fpsyt.2015.
S0896 6273(00)80589 9.
00060.
11.
Nakamura, M., Sato, K., Fukaya, M., Araishi, K.,
3.
Sanacora, G., Treccani, G., and Popoli, M. (2012) Towards
Aiba, A., et al. (2004) Signaling complex formation of
a glutamate hypothesis of depression: an emerging frontier
phospholipase C beta 4 with metabotropic glutamate
of neuropsychopharmacology for mood disorders,
receptor type 1 alpha and 1,4,5 trisphosphate receptor at
Neuropharmacology, 62, 63 77, doi: 10.1016/j.neuropharm.
the perisynapse and endoplasmic reticulum in the mouse
2011.07.036.
brain, Eur. J. Neurosci., 20, 2929 2944, doi: 10.1111/
4.
Gulyaeva, N. V. (2017) Interplay between brain BDNF and
j.1460 9568.2004.03768.x.
glutamatergic systems: a brief state of the evidence and
12.
Hwang, J. I., Kim, H. S., Lee, J. R., Kim, E., et al. (2005)
association with the pathogenesis of depression,
The interaction of phospholipase C beta 3 with Shank2
Biochemistry (Moscow),
82,
301307, doi:
10.1134/
regulates mGluR mediated calcium signal, J. Biol. Chem.,
S0006297917030087.
280, 12467 12473, doi: 10.1074/jbc.M410740200.
5.
Deschwanden, A., Karolewicz, B., Feyissa, A. M.,
13.
Yuan, J. P., Kiselyov, K., Shin, D. M., Chen, J.,
Treyer, V., Ametamey, S. M., et al. (2011) Reduced
Shcheynikov, N., et al. (2003) Homer binds TRPC family
metabotropic Glutamate receptor 5 density in major
channels and is required for gating of TRPC1 by IP3 recep
depression determined by [C 11]ABP688 positron emis
tors, Cell,
114,
777789, doi:
10.1016/S0092
sion tomography and postmortem study, Curr.
8674(03)00716 5.
Neuropharmacol., 9, 15 15.
14.
Kim, J. Y., Zeng, W. Z., Kiselyov, K., Yuan, J. P., Dehoff,
6.
Tsai, G. C., and Coyle, J. T. (2002) Glutamatergic mecha
M. H., et al. (2006) Homer 1 mediates store and inositol
nisms in schizophrenia, Annu. Rev. Pharmacol., 42, 165
1,4,5 trisphosphate receptor dependent translocation and
179, doi: 10.1146/annurev.pharmtox.42.082701.160735.
retrieval of TRPC3 to the plasma membrane, J. Biol.
7.
Engmann, O., Hortobágyi, T., Pidsley, R., Troakes, C.,
Chem., 281, 32540 32549, doi: 10.1074/jbc.M602496200.
Bernstein, H. G., et al. (2011) Schizophrenia is associated
15.
Hwang, S. Y., Wei, J., Westhoff, J. H., Duncan, R. S.,
with dysregulation of a Cdk5 activator that regulates synap
Ozawa, F., et al. (2003) Differential functional interaction
tic protein expression and cognition, Brain J. Neurol., 134,
of two Vesl/Homer protein isoforms with ryanodine recep
2408 2421, doi: 10.1093/brain/awr155.
tor type 1: a novel mechanism for control of intracellular
8.
Matosin, N., Fernandez Enright, F., Lum, J. S.,
calcium signaling, Cell Calcium,
34,
177184,
Engel, M., Andrews, J. L., et al. (2016) Molecular evi
doi: 10.1016/S0143 4160(03)00082 4.
dence of synaptic pathology in the CA1 region in schizo
16.
Yamamoto, K., Sakagami, Y., Sugiura, S., Inokuchi, K.,
phrenia, Npj Schizophr.,
2,
16022, doi:
10.1038/
Shimohama, S., and Kato, N. (2005) Homer 1a enhances
Npjschz.2016.22.
spike induced calcium influx via L type calcium channels
9.
Fatemi, S. H., Folsom, T. D., Kneeland, R. E., Yousefi,
in neocortex pyramidal cells, Eur. J. Neurosci., 22, 1338
M. K., Liesch, S. B., and Thuras, P. D. (2013) Impairment
1348, doi: 10.1111/j.1460 9568.2005.04278.x.
of fragile X mental retardation protein metabotropic gluta
17.
Hu, J. H., Park, J. M., Park, S., Xiao, B., Dehoff, M. H.,
mate receptor 5 signaling and its downstream cognates ras
et al. (2010) Homeostatic scaling requires group I mGluR
related C3 botulinum toxin substrate 1, amyloid beta A4
activation mediated by Homer1a, Neuron, 68, 1128 1142,
precursor protein, striatal enriched protein tyrosine phos
doi: 10.1016/j.neuron.2010.11.008.
БИОХИМИЯ том 86 вып. 6 2021
HOMER1 В ЧУВСТВИТЕЛЬНОСТИ К СТРЕССУ
767
18.
Clifton, N. E., Trent, S., Thomas, K. L., and Hall, J.
33.
Ronesi, J. A., and Huber, K. M. (2008) Homer interactions
(2019) Regulation and function of activity dependent
are necessary for metabotropic glutamate receptor induced
homer in synaptic plasticity, Mol. Neuropsychiatry, 5, 147
long term depression and translational activation,
161, doi: 10.1159/000500267.
J. Neuroscience, 28, 543 547, doi: 10.1523/Jneurosci.
19.
Orlowski, D., Elfving, B., Müller, H. K., Wegener, G., and
5019 07.2008.
Bjarkam, C. R. (2012) Wistar rats subjected to chronic
34.
Bellone, C., Lüscher, C., and Mameli, M.
(2008)
restraint stress display increased hippocampal spine densi
Mechanisms of synaptic depression triggered by
ty paralleled by increased expression levels of synaptic scaf
metabotropic glutamate receptors, Cell. Mol. Life Sci., 65,
folding proteins, Stress, 15, 514523, doi: 10.3109/
2913 2923, doi: 10.1007/s00018 008 8263 3.
10253890.2011.643516.
35.
Lüscher, C., and Huber, K. M. (2010) Group 1 mGluR
20.
Wagner, K. V., Hartmann, J., Mangold, K., Wang, X. D.,
dependent synaptic long term depression: mechanisms
Labermaier, C., et al. (2013) Homer1 mediates acute
and implications for circuitry and disease, Neuron, 65, 445
stress induced cognitive deficits in the dorsal hippocam
459, doi: 10.1016/j.neuron.2010.01.016.
pus, J. Neuroscience, 33, 38573864, doi: 10.1523/
36.
Jones, O. D. (2017) Do group I metabotropic glutamate
Jneurosci.4333 12.2013.
receptors mediate LTD? Neurobiol. Learn Mem., 138, 85
21.
Buonaguro, E. F., Morley Fletcher, S., Avagliano, C.,
97, doi: 10.1016/j.nlm.2016.08.010.
Vellucci, L., Iasevoli, F., et al. (2020) Glutamatergic post
37.
Saugstad, J. A., and Ingram, S. L. (2008) Group I
synaptic density in early life stress programming:
Metabotropic glutamate receptors (mGlu1 and mGlu5), in
Topographic gene expression of mGlu5 receptors and
The Glutamate Receptors, Humana Press, pp. 387 463.
Homer proteins, Prog. Neuro Psychoph., 96, 109725,
38.
Niswender, C. M., and Conn, P. J. (2010) Metabotropic
doi: 10.1016/J.Pnpbp.2019.109725.
glutamate receptors: physiology, pharmacology, and dis
22.
Serchov, T., Heumann, R., van Calker, D., and Biber, K.
ease,
Annu. Rev. Pharmacol.,
50,
295322,
(2016) Signaling pathways regulating Homer1a expression:
doi: 10.1146/annurev.pharmtox.011008.145533.
implications for antidepressant therapy, Biol. Chem., 397,
39.
Mao, L. M., Yang, L., Tang, Q. S., Samdani, S., Zhang,
207 214, doi: 10.1515/hsz 2015 0267.
G. C., and Wang, J. Q. (2005) The scaffold protein
23.
Shiraishi Yamaguchi, Y., and Furuichi, T. (2007) The
homer1b/c links metabotropic glutamate receptor 5 to
Homer family proteins, Genome Biol.,
8,
206,
extracellular signal regulated protein kinase cascades in
doi: 10.1186/Gb 2007 8 2 206.
neurons, J. Neuroscience, 25, 2741 2752, doi: 10.1523/
24.
Flavell, S. W., Kim, T. K., Gray, J. M., Harmin, D. A.,
Jneurosci.4360 04.2005.
Hemberg, M., et al. (2008) Genome wide analysis of
40.
Baudry, M., Greget, R., Pernot, F., Bouteiller, J. M., and
MEF2 transcriptional program reveals synaptic target
Bi, Xi. (2012) Roles of group I metabotropic glutamate
genes and neuronal activity dependent polyadenylation
receptors under physiological conditions and in neuro
site selection, Neuron, 60, 1022 1038, doi: 10.1016/j.neu
degeneration, WIREs Membr. Transp. Signal., 1,
523
ron.2008.11.029.
532.
25.
Irie, K., Nakatsu, T., Mitsuoka, K., Miyazawa, A.,
41.
Holbro, N., Grunditz, Å., and Oertner, T. G. (2009)
Sobue, K., et al. (2002) Crystal structure of the homer 1
Differential distribution of endoplasmic reticulum controls
family conserved region reveals the interaction between the
metabotropic signaling and plasticity at hippocampal
EVH1 domain and own proline rich motif, J. Mol. Biol.,
synapses, Proc. Natl. Acad. Sci. USA, 106, 15055 15060,
318, 1117 1126, doi: 10.1016/S0022 2836(02)00170 5.
doi: 10.1073/pnas.0905110106.
26.
Xiao, B., Tu, J. C., Petralia, R. S., Yuan, J. P., Doan, A.,
42.
Hayashi, M. K., Tang, C. Y., Verpelli, C., Narayanan, R.,
et al. (1998) Homer regulates the association of group 1
Stearns, M. H., et al. (2009) The postsynaptic density pro
metabotropic glutamate receptors with multivalent com
teins homer and shank form a polymeric network structure,
plexes of Homer related, synaptic proteins, Neuron, 21,
Cell, 137, 159 171, doi: 10.1016/j.cell.2009.01.050.
707 716, doi: 10.1016/S0896 6273(00)80588 7.
43.
Tu, J. C., Xiao, B., Naisbitt, S., Yuan, J. P., Petralia, R. S.,
27.
Bottai, D., Guzowski, J. F., Schwarz, M. K., Kang, S. H.,
et al. (1999) Coupling of mGluR/Homer and PSD 95
Xiao, B., et al. (2002) Synaptic activity induced conver
complexes by the shank family of postsynaptic density pro
sion of intronic to exonic sequence in Homer 1 immediate
teins, Neuron,
23,
583592, doi:
10.1016/S0896
early gene expression, J. Neuroscience, 22, 167175,
6273(00)80810 7.
doi: 10.1523/Jneurosci.22 01 00167.2002.
44.
Sala, C., Roussignol, G., Meldolesi, J., and Fagni, L.
28.
Shaw, G., and Kamen, R. (2012) A conserved AU
(2005) Key role of the postsynaptic density scaffold pro
sequence from the 3′ untranslated region of GM CSF
teins shank and homer in the functional architecture of
mRNA mediates selective mRNA degradation, J.
Ca2+ homeostasis at dendritic spines in hippocampal neu
Immunol., 189, 5 13.
rons, J. Neuroscience, 25, 45874592, doi: 10.1523/
29.
Hermey, G., Mahlke, C., Gutzmann, J. J., Schreiber, J.,
Jneurosci.4822 04.2005.
Bluthgen, N., and Kuhl, D. (2013) Genome wide profiling
45.
Sala, C., Piëch, V., Wilson, N. R., Passafaro, M., Liu,
of the activity dependent hippocampal transcriptome,
G. S., and Sheng, M. (2001) Regulation of dendritic spine
PLoS One, 8, e76903, doi: 10.1371/journal.pone.0076903.
morphology and synaptic function by Shank and Homer,
30.
Worley, P. F., Zeng, W. Z., Huang, G. J., Kim, J. Y., Shin,
Neuron, 31, 115 130, doi: 10.1016/S0896 6273(01)00339 7.
D. M., et al. (2007) Homer proteins in Ca2+ signaling by
46.
Sala, C., Futai, K., Yamamoto, K., Worley, P. F.,
excitable and non excitable cells, Cell Calcium, 42, 363
Hayashi, Y., and Sheng, M. (2003) Inhibition of dendritic
371, doi: 10.1016/j.ceca.2007.05.007.
spine morphogenesis and synaptic transmission by activity
31.
Brakeman, P. R., Lanahan, A. A., O’Brien, R., Roche, K.,
inducible protein homer1a, J. Neuroscience, 23,
6327
Barnes, C. A., et al. (1997) Homer: a protein that selective
6337.
ly binds metabotropic glutamate receptors, Nature, 386,
47.
Ango, F., Prézeau, L., Muller, T., Tu, J. C., Xiao, B., et al.
284 288, doi: 10.1038/386284a0.
(2001) Agonist independent activation of metabotropic
32.
Le Duigou, C., and Kullmann, D. M. (2011) Group I
glutamate receptors by the intracellular protein Homer,
mGluR agonist evoked long term potentiation in hip
Nature, 411, 962 965, doi: 10.1038/35082096.
pocampal oriens interneurons, J. Neuroscience, 31, 5777
48.
Bertaso, F., Roussignol, G., Worley, P., Bockaert, J.,
5781, doi: 10.1523/Jneurosci.6265 10.2011.
Fagni, L., and Ango, F.
(2010) Homer1a dependent
БИОХИМИЯ том 86 вып. 6 2021
768
РЕШЕТНИКОВ, БОНДАРЬ
crosstalk between NMDA and metabotropic glutamate
Neuropsychopharm, 27, 19 28, doi: 10.1016/j.euroneuro.
receptors in mouse neurons, PLoS One, 5, e9755,
2016.11.010.
doi: 10.1371/journal.pone.0009755.
63.
Müller, H. K., Orlowski, D., Bjarkam, C. R., Wegener, G.,
49.
Moutin, E., Raynaud, F., Roger, J., Pellegrino, E.,
and Elfving, B. (2015) Potential roles for Homer1 and
Homburger, V., et al. (2012) Dynamic remodeling of scaf
Spinophilin in the preventive effect of electroconvulsive
fold interactions in dendritic spines controls synaptic
seizures on stress induced CA3c dendritic retraction in the
excitability, J. Cell Biol., 198, 251 263, doi: 10.1083/jcb.
hippocampus, Eur. Neuropsychopharm., 25, 1324 1331,
201110101.
doi: 10.1016/j.euroneuro.2015.04.011.
50.
Cingolani, L. A., Vitale, C., and Dityatev, A. (2019) Intra
64.
Wagner, K. V., Hartmann, J., Labermaier, C., Hausl, A. S.,
and extracellular pillars of a unifying framework for home
Zhao, G. J., Harbich, D., et al. (2015) Homer1/mGluR5
ostatic plasticity: a crosstalk between metabotropic recep
activity moderates vulnerability to chronic social stress,
tors and extracellular matrix, Front. Cell. Neurosci., 13,
Neuropsychopharmacology, 40, 1222 1233, doi: 10.1038/
513, doi: 10.3389/Fncel.2019.00513.
npp.2014.308.
51.
Thomazeau, A., Bosch, M., Essayan Perez, S., Barnes,
65.
Li, M. X., Li, Q., Sun, X. J., Luo, C., Li, Y., et al. (2019)
S. A., De Jesus Cortes, H., and Bear, M. F.
(2020)
Increased Homer1 mGluR5 mediates chronic stress
Dissociation of functional and structural plasticity of den
induced depressive like behaviors and glutamatergic dys
dritic spines during NMDAR and mGluR dependent
regulation via activation of PERK eIF2alpha, Prog.
long term synaptic depression in wild type and fragile X
Neuropsychopharmacol. Biol. Psychiatry, 95, 109682,
model mice, Mol. Psychiatry, doi: 10.1038/s41380 020
doi: 10.1016/j.pnpbp.2019.109682.
0821 6.
66.
Zuo, C. C., Cao, H., Ding, F. F., Zhao, J. L., Huang, Y. Q.,
52.
Turrigiano, G. G., and Nelson, S. B. (2004) Homeostatic
et al. (2020) Neuroprotective efficacy of different levels of
plasticity in the developing nervous system, Nat. Rev.
high frequency repetitive transcranial magnetic stimulation
Neurosci., 5, 97 107, doi: 10.1038/nrn1327.
in mice with CUMS induced depression: involvement of
53.
Celikel, T., Marx, V., Freudenberg, F., Zivkovic, A.,
the p11/BDNF/Homer1a signaling pathway, J. Psychiatr.
Resnik, E., et al. (2007) Select overexpression of Homer1a
Res., 125, 152 163, doi: 10.1016/j.jpsychires.2020.03.018.
in dorsal hippocampus impairs spatial working memory,
67.
Reshetnikov, V. V., Kisaretova, P. E., Ershov, N. I.,
Front. Neurosci., 1, 97 110, doi: 10.3389/neuro.01.1.1.
Merkulova, T. I., and Bondar, N. P. (2020) Social defeat
007.2007.
stress in adult mice causes alterations in gene expression,
54.
Rozov, A., Zivkovic, A. R., and Schwarz, M. K. (2012)
alternative splicing, and the epigenetic landscape of
Homer1 gene products orchestrate Ca(2+) permeable
H3K4me3 in the prefrontal cortex: an impact of early life
AMPA receptor distribution and LTP expression, Front.
stress, Prog. Neuropsychopharmacol. Biol. Psychiatry, 106,
Synap. Neurosci., 4, 4, doi: 10.3389/fnsyn.2012.00004.
110068, doi: 10.1016/j.pnpbp.2020.110068.
55.
Hennou, S., Kato, A., Schneider, E. M., Lundstrom, K.,
68.
Orsetti, M., Di Brisco, F., Canonico, P. L., Genazzani,
Gähwiler, B. H., et al. (2003) Homer 1a/Vesl 1S enhances
A. A., and Ghi, P. (2008) Gene regulation in the frontal
hippocampal synaptic transmission, Eur. J. Neurosci., 18,
cortex of rats exposed to the chronic mild stress paradigm,
811 819, doi: 10.1046/j.1460 9568.2003.02812.x.
an animal model of human depression, Eur. J. Neurosci.,
56.
Holz, A., Mülsch, F., Schwarz, M. K., Hollmann, M.,
27, 2156 2164, doi: 10.1111/j.1460 9568.2008.06155.x.
Dobrossy, M. D., et al. (2019) Enhanced mGlu5 signaling
69.
Palmfeldt, J., Henningsen, K., Eriksen, S. A., Müller,
in excitatory neurons promotes rapid antidepressant effects
H. K., and Wiborg, O. (2016) Protein biomarkers of sus
via AMPA receptor activation, Neuron, 104, 338 352, doi:
ceptibility and resilience to stress in a rat model of depres
10.1016/j.neuron.2019.07.011.
sion, Mol. Cell. Neurosci., 74, 8795, doi: 10.1016/
57.
Diering, G. H., and Huganir, R. L. (2018) The AMPA
j.mcn.2016.04.001.
receptor code of synaptic plasticity, Neuron, 100, 314 329,
70.
Burns, S. B., Almeida, D., and Turecki, G. (2018) The epi
doi: 10.1016/j.neuron.2018.10.018.
genetics of early life adversity: current limitations and pos
58.
Okada, D., Ozawa, F., and Inokuchi, K. (2009) Input spe
sible solutions, Prog. Mol. Biol. Transl., 157, 343 425,
cific spine entry of soma derived Vesl 1S protein conforms
doi: 10.1016/bs.pmbts.2018.01.008.
to synaptic tagging, Science,
324,
904909,
71.
Turecki, G., Ota, V. K., Belangero, S. I., Jackowski, A.,
doi: 10.1126/science.1171498.
and Kaufman, J. (2014) Early life adversity, genomic plas
59.
Clifton, N. E., Cameron, D., Trent, S., Sykes, L. H.,
ticity, and psychopathology, Lancet Psychiat., 1, 461 466,
Thomas, K. L., and Hall, J. (2017) Hippocampal regula
doi: 10.1016/S2215 0366(14)00022 4.
tion of postsynaptic density Homer1 by associative learn
72.
Montes Rodriguez, C. J., Lapointe, V., Trivedi, V., Lu, Q.,
ing, Neural Plast., 2017, 5959182, doi: 10.1155/2017/
Demchuk, A. M., and McNaughton, B. L.
(2013)
5959182.
Postnatal development of Homer1a in the rat hippocam
60.
Mahan, A. L., Mou, L. P., Shah, N., Hu, J. H., Worley,
pus, Hippocampus, 23, 890 902, doi: 10.1002/hipo.22146.
P. F., and Ressler, K. J. (2012) Epigenetic modulation of
73.
Ary, A. W., Aguilar, V. R., Szumlinski, K. K., and Kippin,
Homerla transcription regulation in amygdala and hip
T. E. (2007) Prenatal stress alters limbo corticostriatal
pocampus with pavlovian fear conditioning, J. Neurosci.,
Homer protein expression, Synapse,
61,
938941,
32, 4651 4659, doi: 10.1523/Jneurosci.3308 11.2012.
doi: 10.1002/syn.20439.
61.
Qi, C., Roseboom, P. H., Nanda, S. A., Lane, J. C.,
74.
Ryabushkina, Y. A., Reshetnikov, V. V., and Bondar, N. P.
Speers, J. M., and Kalin, N. H. (2010) Anxiety related
(2020) Maternal Separation early in life alters the expres
behavioral inhibition in rats: a model to examine mecha
sion of genes Npas4 and Nr1d1 in adult female mice: cor
nisms underlying the risk to develop stress related psy
relation with social behavior, Behav. Neurol., 2020,
chopathology, Genes Brain Behav.,
9,
974984,
7830469, doi: 10.1155/2020/7830469.
doi: 10.1111/j.1601 183X.2010.00636.x.
75.
Ji, Y., Lu, Y., Yang, F., Shen, W., Tang, T. T., et al. (2010)
62.
Nava, N., Treccani, G., Müller, H. K., Popoli, M.,
Acute and gradual increases in BDNF concentration elicit
Wegener, G., and Elfving, B. (2017) The expression of
distinct signaling and functions in neurons, Nat. Neurosci.,
plasticity related genes in an acute model of stress is
13, 302 309, doi: 10.1038/nn.2505.
modulated by chronic desipramine in a time dependent
76.
Bondar, N. P., and Merkulova, T. I. (2016) Brain derived
manner within medial prefrontal cortex, Eur.
neurotrophic factor and early life stress: multifaceted
БИОХИМИЯ том 86 вып. 6 2021
HOMER1 В ЧУВСТВИТЕЛЬНОСТИ К СТРЕССУ
769
interplay, J. Biosciences, 41, 751 758, doi: 10.1007/s12038
91. Conti, B., Maier, R., Barr, A. M., Morale, M. C.,
016 9648 3.
Lu, X., et al. (2007) Region specific transcriptional
77.
Roth, T. L., and Sweatt, J. D. (2011) Epigenetic marking of
changes following the three antidepressant treatments
the BDNF gene by early life adverse experiences, Horm.
electro convulsive therapy, sleep deprivation and fluoxe
Behav., 59, 315 320, doi: 10.1016/j.yhbeh.2010.05.005.
tine, Mol. Psychiatry, 12, 167 189, doi: 10.1038/sj.mp.
78.
Rietschel, M., Mattheisen, M., Frank, J., Treutlein, J.,
4001897.
Degenhardt, F., et al. (2010) Genome wide association ,
92. Szumlinski, K. K., Lominac, K. D., Kleschen, M. J.,
replication , and neuroimaging study implicates HOMER1
Oleson, E. B., Dehoff, M. H., et al. (2005) Behavioral and
in the etiology of major depression, Biol. Psychiat., 68, 578
neurochemical phenotyping of Homer1 mutant mice: pos
585, doi: 10.1016/j.biopsych.2010.05.038.
sible relevance to schizophrenia, Genes Brain Behav., 4,
79.
Rao, S. T., Leung, C. S. T., Lam, M. H., Wing, Y. K., Waye,
273 288, doi: 10.1111/j.1601 183X.2005.00120.x.
M. M. Y., and Tsui, S. K. W. (2017) Resequencing three
93. Lominac, K. D., Oleson, E. B., Pava, M., Klugmann, M.,
candidate genes discovers seven potentially deleterious
Schwarz, M. K., et al. (2005) Distinct roles for different
variants susceptibility to major depressive disorder and sui
Homer1 isoforms in behaviors and associated prefrontal
cide attempts in Chinese, Gene, 603, 34 41, doi: 10.1016/
cortex function, J. Neurosci.,
25,
1158611594,
j.gene.2016.12.006.
doi: 10.1523/Jneurosci.3764 05.2005.
80.
Strauss, J., McGregor, S., Freeman, N., Tiwari, A.,
94. Serchov, T., Schwarz, I., Theiss, A., Sun, L., Holz, A.,et al.
George, C. J., et al. (2012) Association study of early
(2020) Enhanced adenosine A1 receptor and Homer1a
immediate genes in childhood onset mood disorders and
expression in hippocampus modulates the resilience to stress
suicide attempt, Psychiatry Res.,
197,
4954, doi:
induced depression like behavior, Neuropharmacology, 162,
10.1016/j.psychres.2011.11.022.
107834, doi: 10.1016/j.neuropharm.2019.107834.
81.
Rao, S. T., Lam, M. H. B., Yeung, V. S. Y., Wing, Y. K., and
95. Albert, P. R. (2019) Targeting Homer1a for rapid antide
Waye, M. M. Y. (2016) Association of HOMER1 rs2290639
pressant effects, Neuron, 104, 182 183, doi: 10.1016/j.neu
with suicide attempts in Hong Kong Chinese and the
ron.2019.10.003.
potentially functional role of this polymorphism,
96. Treccani, G., Musazzi, L., Perego, C., Milanese, M.,
Springerplus, 5, 767, doi: 10.1186/S40064 016 2404 1.
Nava, N., et al. (2014) Stress and corticosterone increase
82.
Benedetti, F., Poletti, S., Locatelli, C., Mazza, E.,
the readily releasable pool of glutamate vesicles in synaptic
Lorenzi, C., et al. (2018) A Homer 1 gene variant influ
terminals of prefrontal and frontal cortex, Mol. Psychiatry,
ences brain structure and function, lithium effects on white
19, 433 443, doi: 10.1038/mp.2014.5.
matter, and antidepressant response in bipolar disorder: a
97. Musazzi, L., Tornese, P., Sala, N., and Popoli, M. (2017)
multimodal genetic imaging study, Prog. Neuro Psychoph.,
Acute stress is not acute: sustained enhancement of gluta
81, 88 95, doi: 10.1016/j.pnpbp.2017.10.011.
mate release after acute stress involves readily releasable
83.
Wells, T. T., Judah, M. R., Ellis, A. J., McGeary, J. E., and
pool size and synapsin I activation, Mol. Psychiatry, 22,
Beevers, C. G. (2015) Inhibition of attention for affective
1226 1227, doi: 10.1038/mp.2016.175.
material: contributions by HOMER1 gene variation,
98. Popoli, M., Yan, Z., McEwen, B. S., and Sanacora, G.
Psychol. Neurosci., 8, 495 508, doi: 10.1037/pne0000027.
(2012) The stressed synapse: the impact of stress and glu
84.
Antontseva, E., Bondar, N., Reshetnikov, V., and
cocorticoids on glutamate transmission, Nat. Rev.
Merkulova, T. (2020) The effects of chronic stress on brain
Neurosci., 13, 22 37, doi: 10.1038/nrn3138.
myelination in humans and in various rodent models,
99. Joëls, M., and Baram, T. Z. (2009) The neuro symphony
Neuroscience, 441, 226 238, doi: 10.1016/j.neuroscience.
of stress, Nat. Rev. Neurosci., 10, 459 466, doi: 10.1038/
2020.06.013.
nrn2632.
85.
Leber, S. L., Llenos, I. C., Miller, C. L., Dulay, J. R.,
100. Inoue, Y., Udo, H., Inokuchi, K., and Sugiyama, H.
Haybaeck, J., and Weis, S. (2017) Homer1a protein expres
(2007) Homer1a regulates the activity induced remodeling
sion in schizophrenia, bipolar disorder, and major depres
of synaptic structures in cultured hippocampal neurons,
sion, J. Neural Transm., 124, 1261 1273, doi: 10.1007/
Neuroscience, 150, 841 852, doi: 10.1016/j.neuroscience.
s00702 017 1776 x.
2007.09.081.
86.
Bernard, R., Kerman, I. A., Thompson, R. C., Jones,
101. Wang, Y., Rao, W., Zhang, C., Zhang, C., Liu, M. D., et al.
E. G., Bunney, W. E., et al. (2011) Altered expression of
(2015) Scaffolding protein Homer1a protects against
glutamate signaling, growth factor, and glia genes in the
NMDA induced neuronal injury, Cell Death Dis., 6, e1843,
locus coeruleus of patients with major depression, Mol.
doi: 10.1038/cddis.2015.216.
Psychiatry, 16, 634 646, doi: 10.1038/mp.2010.44.
102. Wang, Y., Zhao, M. M., Shang, L., Zhang, Y. G., Huang,
87.
Ising, M., Lucae, S., Binder, E. B., Bettecken, T., Uhr, M.,
C. G., et al. (2020) Homer1a protects against neuronal
et al. (2009) A genomewide association study points to
injury via PI3K/AKT/mTOR signaling pathway, Int. J.
multiple loci that predict antidepressant drug treatment
Neurosci., 130, 621 630, doi: 10.1080/00207454.2019.
outcome in depression, Arch. Gen. Psychiatry, 66, 966 975,
1702535.
doi: 10.1001/archgenpsychiatry.2009.95.
103. Fei, F., Rao, W., Zhang, L., Chen, B. G., Li, J., et al.
88.
Szumlinski, K. K., Kalivas, P. W., and Worley, P. F. (2006)
(2014) Downregulation of Homer1b/C improves neuronal
Homer proteins: implications for neuropsychiatric disor
survival after traumatic neuronal injury, Neuroscience, 267,
ders, Curr. Opin. Neurobiol., 16, 251 257, doi: 10.1016/
187 194, doi: 10.1016/j.neuroscience.2014.02.037.
j.conb.2006.05.002.
104. Diering, G. H., Nirujogi, R. S., Roth, R. H., Worley, P. F.,
89.
Sun, P., Wang, F. R., Wang, L., Zhang, Y., Yamamoto, R.,
Pandey, A., and Huganir, R. L. (2017) Homer1a drives
et al. (2011) Increase in cortical pyramidal cell excitability
homeostatic scaling down of excitatory synapses during
accompanies depression like behavior in mice: a transcra
sleep, Science,
355,
511515, doi:
10.1126/science.
nial magnetic stimulation study, J. Neurosci., 31, 16464
aai8355.
16472, doi: 10.1523/Jneurosci.1542 11.2011.
105. Chen, F. H., Polsinelli, B., Nava, N., Treccani, G.,
90.
Sun, P., Zhang, Q., Zhang, Y., Wang, F. R., Chen, R., et al.
Elfving, B., et al. (2020) Structural plasticity and molecu
(2015) Homer1a dependent recovery from depression like
lar markers in hippocampus of male rats after acute stress,
behavior by photic stimulation in mice, Physiol. Behav.,
Neuroscience,
438,
100115, doi:
10.1016/j.neuro
147, 334 341, doi: 10.1016/j.physbeh.2015.05.007.
science.2020.05.001.
2 БИОХИМИЯ том 86 вып. 6 2021
770
РЕШЕТНИКОВ, БОНДАРЬ
THE ROLE OF STRESSBINDUCED CHANGES IN THE EXPRESSION
OF HOMER1 IN STRESS SUSCEPTIBILITY
Review
V. V. Reshetnikov1,2* and N. P. Bondar1,3
1 Institute of Cytology and Genetics, SB RAS, 630090 Novosibirsk, Russia; e%mail: vasiliyreshetnikov@bionet.nsc.ru
2 Sirius University of Science and Technology, 354340 Sochi, Russia
3 Novosibirsk State University, 630090 Novosibirsk, Russia
Stress negatively affects processes of synaptic plasticity and is a major risk factor of various psychopathologies such as
depression and anxiety. HOMER1 is an important component of the postsynaptic density: constitutively expressed
long isoforms HOMER1b and HOMER1c bind to group I metabotropic glutamate receptors MGLUR1 (GRM1) and
MGLUR5 and to other effector proteins, thereby forming a postsynaptic protein scaffold. Activation of the
GLUR1-HOMER1b,c and/or GLUR5-HOMER1b,c complex regulates activity of the NMDA and AMPA recep
tors and Ca2+ homeostasis, thus modulating various types of synaptic plasticity. Dominant negative transcript
Homer1a is formed as a result of activity induced alternative termination of transcription. Expression of this truncat
ed isoform in response to neuronal activation impairs interactions of HOMER1b,c with adaptor proteins, triggers lig
and independent signal transduction through MGLUR1 and/or MGLUR5, leads to suppression of the AMPA and
NMDA mediated signal transmission, and thereby launches remodeling of the postsynaptic protein scaffold and
inhibits long term potentiation. The studies on animal models confirm that the HOMER1a dependent remodeling
most likely plays an important part in the stress susceptibility, whereas HOMER1a itself can be regarded as a neuro
protector. In this review article, we consider the effects of different stressors in various animal models on HOMER1
expression as well as impact of different HOMER1 variants on human behavior as well as structural and functional
characteristics of the brain.
Keywords: stress, depression, synaptic plasticity, Homer1, metabotropic glutamate receptors
БИОХИМИЯ том 86 вып. 6 2021