БИОХИМИЯ, 2021, том 86, вып. 6, с. 831 - 844
УДК 577.25
ВЛИЯНИЕ ГЛОБАЛЬНОЙ ИШЕМИИ ГОЛОВНОГО МОЗГА
НА МЕТАБОЛИЗМ БЕЛКА ПРЕДШЕСТВЕННИКА β АМИЛОИДА
И ЭКСПРЕССИЮ АМИЛОИД ДЕГРАДИРУЮЩИХ
ФЕРМЕНТОВ В КОРЕ ГОЛОВНОГО МОЗГА КРЫС:
РОЛЬ В ПАТОГЕНЕЗЕ БОЛЕЗНИ АЛЬЦГЕЙМЕРА
© 2021
E. Бабусикова1, Д. Доброта1, Э.Дж. Тернер2, Н.Н. Наливаева2,3*
1 Университет Коменского в Братиславе, медицинский факультет Ессениуса в Мартине,
отдел медицинской биохимии, 036 01 Мартин, Словакия
2 Школа биомедицинских наук факультета биологических наук Университета Лидс,
LS2 9JT Лидс, Великобритания
3 Институт эволюционной физиологии и биохимии им. И.М. Сеченова РАН,
194223 Санкт<Петербург, Россия; электронная почта: n.n.nalivaeva@leeds.ac.uk
Поступила в редакцию 08.02.2021
После доработки 20.04.2021
Принята к публикации 20.04.2021
Заболеваемость болезнью Альцгеймера (БА) значительно увеличивается из за хронического стресса и ише
мии мозга, которые с годами вызывают накопление токсичных видов амилоидного пептида и повреждение
головного мозга. Изучено влияние глобальной 15 минутной ишемии и 120 минутной реперфузии на уров
ни экспрессии белка предшественника β амилоида (APP) и его процессинга в коре головного мозга (Cx)
самцов крыс линии Wistar. Также проведена оценка уровней экспрессии амилоид деградирующих фермен
тов: неприлизина (NEP), эндотелин превращающего фермента 1 (ECE 1) и инсулин деградирующего фер
мента (IDE), а также некоторых маркёров окислительного повреждения. Полученные нами результаты сви
детельствуют, что уровнь мРНК и белка APP в Cx значительно повышается после ишемического инсульта.
Уровни растворимых фрагментов APP (особенно sAPPβ, продуцируемого β секретазой (BACE1)), мРНК и
белка BACE1 также были увеличены после ишемии. Через 120 мин реперфузии уровни белков APP и BACE1
в Сх возвращались к контрольным значениям. Уровни мРНК NEP и ECE 1 также были снижены после
ишемии, что коррелировало со снижением содержания этих ферментов. Однако мы не наблюдали никаких
изменений в содержании инсулин деградирующего фермента. Маркёры окислительного повреждения (ди
тирозина и конъюгатов лизина с продуктами перекисного окисления липидов) также были повышены пос
ле ишемии. Полученные данные позволяют предположить, что ишемия смещает процессинг APP в сторо
ну амилоидогенного β секретазного пути и накопления нейротоксичного пептида Aβ, а также запускает
окислительный стресс в клетках. Данные результаты обсуждаются в контексте роли стресса и ишемии в
инициации и прогрессировании БА.
КЛЮЧЕВЫЕ СЛОВА: болезнь Альцгеймера, белок предшественник β амилоида, β секретаза, эндотелин
превращающий фермент 1, глобальная ишемия головного мозга, инсулин деградирующий фермент, неп
рилизин, стресс.
DOI: 10.31857/S0320972521060063
ВВЕДЕНИЕ
многофакторный характер, и её основные при
чины все ещё плохо изучены. Однако накоплен
Спорадическая или старческая форма болез
ные клинические и экспериментальные данные
ни Альцгеймера (БА) - одно из самых тяжёлых
позволяют полагать, что стресс на протяжении
неврологических расстройств людей пожилого
всей жизни играет важную роль в разви
возраста. Патофизиология БА имеет сложный
тии БА [1, 2], увеличивая риск ишемии мозга и
инсульта [3], что, в свою очередь, увеличивает
Принятые сокращения: АФК - активные формы частоту заболеваемости БА [4, 5]. Одной из ос
кислорода; ПОЛ - перекисное окисление липидов; Aβ - новных причин возникновения нейродегенера
β амилоидный пептид; APP - белок предшественник
амилоида; BACE1 - β секретаза, Cx - кора головного моз
ции, вызванной ишемией, является повышен
га; ECE 1 - эндотелин превращающий фермент 1; IDE -
ная экспрессия генов, связанных с патогене
инсулин деградирующий фермент; NEP - неприлизин.
зом БА [6, 7]. Хронический стресс также может
* Адресат для корреспонденции.
способствовать патогенезу БА, влияя на функ
831
832
БАБУСИКОВА и др.
циональный статус глиальных клеток головного
лобной коре [13]. Хотя гипотеза «амилоидного
мозга и приводя к дефициту клиренса амилои
каскада» БА [14] подвергалась критике из за
да [8]. С другой стороны, раннее нарушение ре
неудач в разработке успешного лечения, осно
гуляции гипоталамо гипофизарно надпочечни
ванного на её главных постулатах, она по преж
ковой оси также часто встречается у пациентов
нему остаётся основным направлением иссле
с БА, что приводит к нарушению метаболизма
дований патологии БА [15]. Гипотеза «амилоид
глюкокортикоидов. Эти стероидные гормоны
ного каскада» предполагает, что образование Aβ
могут легко проникать в мозг и вызывать эксай
из белка предшественника β амилоида (APP)
тотоксичность в лимбических структурах (пре
является начальной стадией событий, ведущих
фронтальная кора и гиппокамп), которые пора
при определённых патологических условиях к
жаются на ранних стадиях БА [9-12].
накоплению токсичных агрегатов Aβ, которые
Патология головного мозга при БА характе
вызывают гибель нейрональных клеток и дру
ризуется образованием двух основных белко
гие нейропатологические процессы в головном
вых кластеров: внеклеточных отложений β
мозге [16-17]. Формирование сенильных бля
амилоидного пептида (Aβ) и внутриклеточных
шек, в которых Aβ часто находится в комплексе
агрегатов гиперфосфорилированного тау, кото
с другими белками, некоторые авторы рассмат
рые накапливаются в головном мозге пациен
ривают, как попытку удалить токсичные амило
тов с БА, особенно в гиппокампе, амигдале и
идные формы из нейрональных клеток, хотя ги
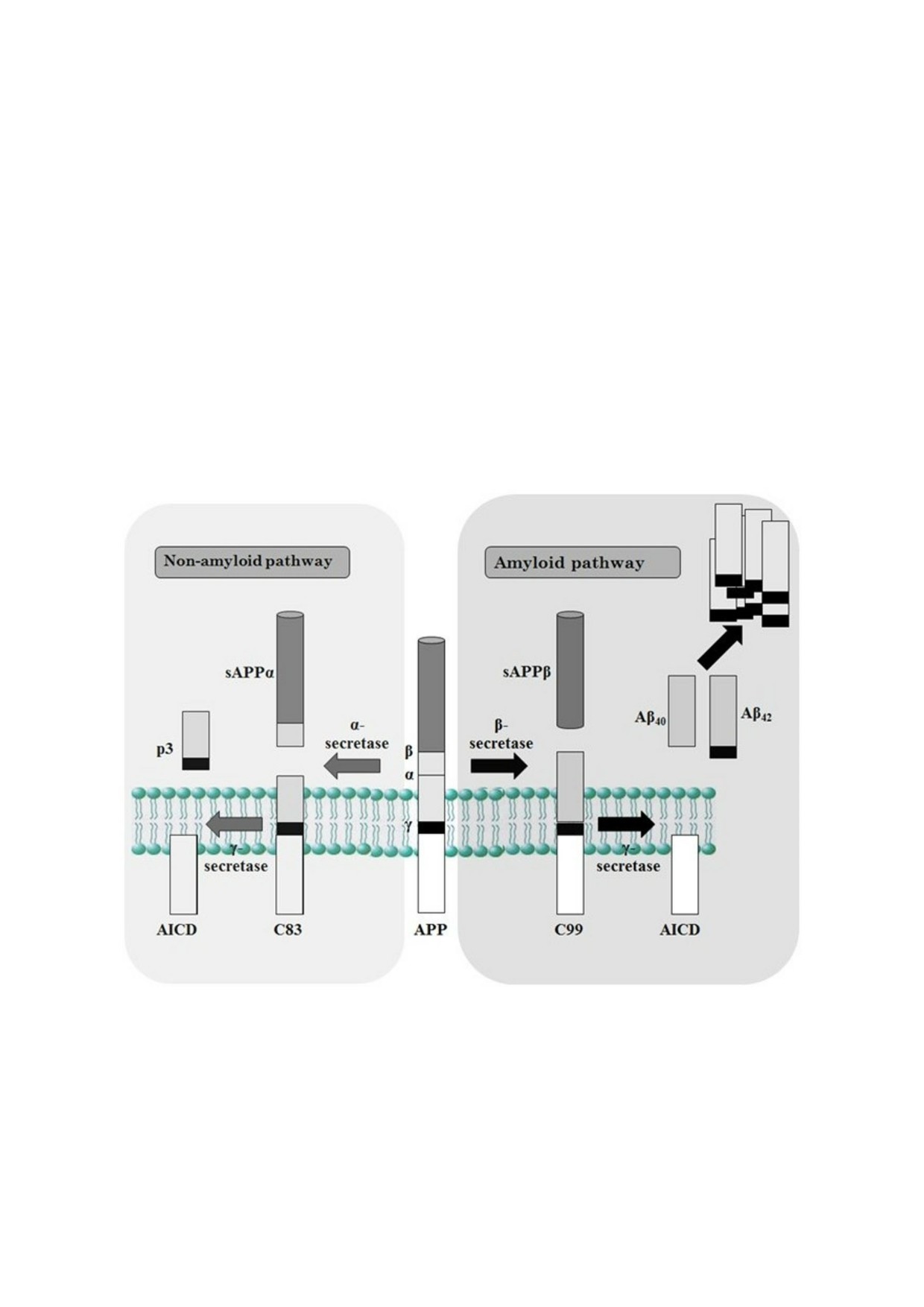
Рис. 1. Процессинг белка предшественника β амилоида (АРР). Неамилоидогенный путь процессинга АРР начинается с
его расщепления α секретазой с образованием нейропротекторного растворимого N концевого фрагмента sAPPα и
мембраносвязанного фрагмента C83, который далее расщепляется комплексом γ секретазы, продуцирующим неболь
шой пептид (p3) и внутриклеточный домен APP (AICD). Амилоидогенный путь начинается с расщепления АРР β сек
ретазой с образованием нейропротекторного растворимого N концевого фрагмента sAPPβ и мембраносвязанного фраг
мента C99, который также расщепляется γ секретазой, образуя Aβ пептиды различной длины (в основном Aβ40, но так
же более токсичный Aβ42) и AICD. Aβ Пептиды образуют токсичные олигомеры, а затем сенильные бляшки, связыва
емые с патогенезом БА. (С цветными вариантами рисунков можно ознакомиться в электронной версии статьи на сайте:
БИОХИМИЯ том 86 вып. 6 2021
ИШЕМИЯ ГОЛОВНОГО МОЗГА И АМИЛОИДНЫЙ МЕТАБОЛИЗМ
833
бель клеток наблюдается также и вблизи самих
стресс [34-36]. Также показано, что дефицит ак
бляшек [18, 19].
тивности NEP увеличивает содержание амилои
Образование Aβ из APP происходит через
да в головном мозге [37], в то время как повы
амилоидогенный путь процессинга APP, иниции
шение его экспрессии приводит к уменьшению
руемый действием аспартатной протеазы β сек
количества амилоидных бляшек в мозге транс
ретазы (ВАСЕ1), с расщеплением АРР и высво
генных мышей, моделирующих БА [38], и улуч
бождением растворимого N концевого фраг
шению когнитивных функций животных [39].
мента sAPPβ (рис. 1). Дальнейшее протеолити
Активные формы кислорода (АФК) играют
ческое расщепление оставшегося мембраносвя
важную роль в нейродегенерации, вызванной
занного C концевого фрагмента APP (C99) с по
недостатком кислорода в нервной ткани [40], а
мощью γ секретазы, представляющей собой
также токсичностью Aβ [41, 42]. В процессе ста
большой мембранный белковый комплекс [20,
рения в мозге наблюдается несколько различ
21], приводит к образованию Aβ пептидов раз
ных видов окислительного повреждения белков
личной длины (в основном Aβ40, но также и бо
и липидов, а также повышенное образование
лее токсичного Aβ42), а также C концевого
АФК [43]. В ткани головного мозга пациентов
фрагмента APP (AICD), обладающего свойства
с БА наблюдается повышенный уровень маркё
ми регуляции экспрессии генов [22, 23].
ров окислительного стресса, включая окислен
В неамилоидогенном пути, на который при
ные белки, мембранные липиды и ДНК [44],
ходится ~90% процессинга АРР [24], он сначала
окислительное повреждение которых непосред
расщепляется α секретазой, продуцирующей
ственно вовлечено в патогенез нейродегенера
растворимый N концевой фрагмент sAPPα и
тивных и нейроваскулярных заболеваний
мембраносвязанный концевой фрагмент С83
[45, 46].
(рис. 1). В настоящее время общепринято, что
АФК эффективны в очень малых концентра
металлопротеиназы семейства ADAM, в част
циях, а их период полураспада очень короткий.
ности ADAM10, расщепляют АРР по данному
Наиболее важными мишенями окислительного
пути [25, 26]. Далее C83 также расщепляется
повреждения являются липиды и аминокислот
комплексом γ секретазы, высвобождая неболь
ные остатки белков, и их реакции с АФК часто
шой пептид p3 с неизвестными свойствами и
приводят к потере ферментативной, регулятор
AICD. Однако транскрипционно активным яв
ной, транспортной или структурной функций
ляется только AICD, продуцируемый амилоидо
[47, 48]. Вызванное АФК повреждение ДНК, в
генным β секретазным путем [22]. Оба этих пу
том числе митохондриальной ДНК, приводит к
ти протекают в нормальных физиологических
развитию различных нейродегенеративных про
условиях, и все фрагменты APP, включая Aβ,
цессов [49], а также к раку [50]. Перекисное
выполняют важные физиологические функ
окисление липидов (ПОЛ) также способствует
ции [27, 28].
развитию дисфункции ферментов и сигнальных
Метаболизм Aβ сложен, и сейчас хорошо из
молекул путём изменения состава мембран, а
вестно, что он включает в себя различные про
также путём образования реактивных альдеги
теолитические ферменты, среди которых основ
дов, способных связываться с белками [51].
ное место занимает металлопептидаза неприли
В данном исследовании мы изучали влияние
зин (NEP), играющая основную роль в регуля
ишемии на экспрессию и метаболизм АРР с по
ции содержания Aβ в головном мозге [29]. Дру
мощью анализа уровней мРНК АРР и общих
гими важными ферментами, раcщепляющи
уровней белков sAPP и sAPPβ, а также экспрес
ми Aβ, являются эндотелин превращающий
сию ВАСЕ1 на уровнях мРНК и белка. Также
фермент 1 (ECE 1) и инсулин деградирующий
был проведён анализ экспрессии амилоид дег
фермент (IDE). И NEP, и ECE 1 способствуют
радирующих ферментов NEP, ECE 1 и IDE на
поддержанию стабильного уровня Aβ, предот
уровнях мРНК и белка, а также маркёров окис
вращая его накопление [30]. Различное клеточ
лительного повреждения белков (дитирозина и
ное и тканевое распределение в головном мозге
конъюгатов лизина) в коре головного мозга (Cx)
ферментов, разрушающих амилоид, а также
крыс после индуцированной in vivo ишемии и
других транспортных белков, таких как трансти
реперфузии.
ретин и ApoE, обеспечивает эффективную сис
тему удаления Аβ из ткани мозга [31]. Однако
эта система может ухудшаться либо с возрастом,
МАТЕРИАЛЫ И МЕТОДЫ
либо из за воздействия различных патологичес
ких состояний, приводящих к снижению эф
Животные. Крысы самцы линии Wistar (мас
фективности её работы [32, 33], среди которых
са 250-350 г, 6 мес.) были предоставлены Инс
важную роль играют ишемия и хронический
титутом экспериментальной фармакологии и
6 БИОХИМИЯ том 86 вып. 6 2021
834
БАБУСИКОВА и др.
токсикологии Центра экспериментальной ме
ческих анализов животных декапитировали под
дицины Словацкой Академии Наук (IEPT SAS,
галотановым наркозом. Объединённую ткань
Добра Вода, Словацкая Республика). Живот
коры обоих полушарий использовали для даль
ным был предоставлен свободный доступ к пи
нейшего анализа, разделив после измельчения
ще и воде, и их содержали в кондиционируемой
скальпелем на две части для последующего ана
комнате с контролируемой температу
лиза мРНК с помощью ПЦР РВ (ПЦР в реаль
рой (18-22 °C) и 12 часовым циклом свет/тем
ном времени) и белков с помощью вестерн
нота. Для обеспечения статистической значи
блоттинга и флуоресцентной спектрометрии,
мости экспериментов использовали по 8 живот
как описано ниже. Всем животным и образцам
ных в каждой группе (ишемия, реперфузия,
головного мозга были присвоены номера, и экс
контроль). Все эксперименты были одобрены
периментаторы не знали об их групповом рас
Этическим комитетом медицинского факульте
пределении, которое было раскрыто только в
та им. Ессениуса в Мартине Университета
ходе статистического анализа данных.
им. Коменского в Братиславе. Все исследования
Подготовка образцов головного мозга. Для по
проводили в соответствии с «Руководством по
лучения фракции, содержащей растворимые
уходу и использованию лабораторных живот
белки, ткань Сх обоих полушарий гомогенизи
ных», опубликованным Национальным инсти
ровали в гомогенизаторе стекло/стекло в 1 мл
тутом здравоохранения США (публикация NIH
низкосолевого буфера (20 мМ Tris HCl (pH 7,5),
№ 85 23, пересмотренная в 1996 г.), рекоменда
содержащего 10 мМ MgCl2 и 50 мМ NaCl), а за
циями ARRIVE [52], а также с правилами, уста
тем гомогенизатор снова промывали 1 мл того
новленными Государственной ветеринарной и
же буфера с коктейлем ингибиторов протеаз
пищевой администрацией Словацкой Респуб
(«Roche Diagnostics», Германия), и объединён
лики. Были предприняты все усилия, чтобы
ный гомогенат центрифугировали при 100 000 g
свести к минимуму страдания животных и
в течение 10 мин. Супернатант собирали и рас
уменьшить количество используемых живот
сматривали как низкосолевую растворимую ци
ных.
тозольную фракцию. Осадок ресуспендировали
Моделирование ишемии. Животные были раз
в 1 + 1 мл 10 мМ фосфатного буфера (pH 7,4),
делены на три экспериментальные группы по
содержащего 1% (w/v) Triton X 100, инкубирова
8 животных в каждой: контроль (ложно опери
ли на льду в течение 1 ч и центрифугировали в
рованные), ишемия (15 мин ишемия) и репер
течение 10 мин, как указано выше, для получе
фузия (15 мин ишемия с последующей 120 мин
ния растворимой в детергенте (мембранной)
реперфузией). Ишемию переднего мозга вызы
фракции.
вали методом окклюзии четырёх сосудов [53].
Электрофорез белков в полиакриламидном ге
Вкратце, в первый день крыс подвергали хирур
ле в присутствии додецилсульфата натрия (SDS
гической подготовке под наркозом галотаном, и
PAGE), вестерн блоттинг, иммунодетекция. Об
позвоночные артерии были полностью закупо
разцы, содержащие равные количества белка (45
рены электрокоагуляцией. Затем были найдены
или 90 мкг в зависимости от содержания предва
сонные артерии, и вокруг них свободно разме
рительно оцененных белков), разделяли на
щены петли пластиковых трубок, чтобы обеспе
8% ном SDS PAGE и переносили на поливинили
чить быстрое последующее обнаружение этих
ден флуоридную (PVDF) мембрану (Amersham
сосудов. На второй день сонные артерии были
Hybond P, «GE Healthcare», Великобритания).
снова локализованы и перекрыты артериальны
Мембраны обрабатывали в течение ночи соот
ми зажимами. Нормальный температурный ре
ветствующими первичными антителами: для
жим тела во время ишемии поддерживался с
обнаружения APP и общего sAPP - мышиными
помощью термического одеяла. Через 15 мин
моноклональными антителами 22C11 («Roche
крыс декапитировали (группа животных с ише
Molecular Biochemicals», Германия), 1/4000; для
мией). Реперфузию инициировали удалением
sAPPβ - мышиными моноклональными антите
зажимов с сонных артерий после 15 мин ише
лами G26 («GlaxoSmithKline», Великобрита
мии. После периода рециркуляции (120 мин)
ния), 1/200; для BACE1 - мышиными монокло
крыс умерщвляли декапитацией (группа живот
нальными антителами 9B21 («GlaxoSmithKline»,
ных с реперфузией). В период реперфузии жи
Великобритания), 1/2000; для NEP - кроличьи
вотных содержали в боксе со стабильной темпе
ми поликлональными антителами против НЕП
ратурой. Животные контрольной группы были
крысы («US Biological», США),
1/100; для
ложно оперированы. Только одно животное в
ECE 1 - мышиными моноклональными анти
группе ишемии погибло после операции. Ни од
телами Mab 32 (AEC32 236) (получены в дар от
но из выживших животных не было исключено
доктора К. Танзавы, Токио, Япония), 1/200;
из дальнейших экспериментов. Для биохими
для IDE - мышиными моноклональными анти
БИОХИМИЯ том 86 вып. 6 2021
ИШЕМИЯ ГОЛОВНОГО МОЗГА И АМИЛОИДНЫЙ МЕТАБОЛИЗМ
835
телами MMS 282R («Covance», Великобрита
Cycler («MJ Research», США) с многоцветной
ния), 1/200; для β актина - кроличьи антите
системой детектирования ПЦР с использовани
ла Actin (20 33) («Sigma Aldrich», США). После
ем
«SensiMixTM SYBR & Fluorescein Kit»
инкубации с первичными антителами мембра
(«Bioline», Великобритания), и выражали
ны промывали
4
раза по
15
мин в
экспрессию генов интереса относительно
TBS (20 мМ Tris HCl, pH 7,6, содержащий
мРНК актина. Все образцы анализировали трое
0,1% Tween 20 (v/v)) с последующей инкубацией
кратно. Список праймеров приведён в табл. 1.
в течение 1 ч со вторичными антителами, конъ
Анализ дитирозина и конъюгатов лизина. Ана
югированными с пероксидазой хрена - HRP
лизы дитирозина и конъюгатов лизина с про
кроличьими анти крысиными или анти мыши
дуктами ПОЛ проводили при 25 °C с использо
ными антителами («Amersham Biosciences»),
ванием спектрофлуориметра «Shimadzu RF 540»
1/2000. Затем мембраны промывали 4 раза по
(«Shimadzu Corporation», Япония), как описано
15 мин в TBS pH 7,6, содержащем 0,1% Tween 20
ранее [54]. Для измерений флуоресценции алик
(v/v); детекцию проводили с помощью системы
воты мембранной фракции, содержащие 50 мкг
обнаружения хемилюминесценции ECL - «Pierce
общего белка, разбавляли в 1 мл буфера (10 мМ
ECL western blotting substrate» («ThermoFisher
HEPES, 100 мМ KCl, pH 7,0). Спектры излуче
Scientific», Великобритания) в соответствии с
ния дитирозина, продукта окисления тирозина,
инструкциями производителея, визуализацию
регистрировали в диапазоне длин волн
проводили на фотоплёнке Kodak. За загрузкой
380-440 нм (ширина щели 5 нм) при λex (длина
образца следили либо по актину (анти ак
волны возбуждения) 325 нм. Спектры излуче
тин 1/2000), либо по окрашиванию PVDF мем
ния конъюгатов лизина с продуктами ПОЛ реги
бран 0,1% ным «Ponceau S» («Sigma Aldrich») в
стрировали в диапазоне длин волн 425-480 нм
5% ной уксусной кислоте (v/v). Количественное
при λex 365 нм (ширина щели 5 нм). Результаты
определение полос проводили с помощью хеми
представлены в виде средних значений ± стандарт
люминесцентной сканирующей денситометрии
ная ошибка среднего для интенсивности флуо
с использованием системы ChemiDoc SRS+ и
ресценции, выраженной в условных единицах.
программного обеспечения «Bio Rad Multi
Концентрацию белка в образцах измеряли с
AnalystTM/PC», версия 1.1.1 («Bio Rad», Вели
помощью бицинхонинового метода (BCA) [55],
кобритания).
модифицированного для 96 луночных микро
ПЦР в реальном времени. Ткани Сх выдержи
титровальных планшетов. Рабочий реагент го
вали в соответствующем объёме реагента для
товили путём смешивания раствора бицинхони
стабилизации РНК («RNAlater», «Qiagen», Ве
новой кислоты (B9643,
«Sigma Aldrich») с
ликобритания) в соответствии с инструкциями
4% ным (w/v) CuSO4 в соотношении 50/1. Об
производителя при 4 °C до выделения РНК.
разцы (10 мкл) вносили в лунки планшетов, в
РНК выделяли с помощью набора «RNeasy Lipid
каждую лунку добавляли
200
мкл реаген
Tissue» («Qiagen») в соответствии с протоколом
та BCA/CuSO4 и инкубировали при 37 °C в тече
производителя. кДНК получали с использова
ние 30 мин, после чего определяли поглощение
нием набора «iScript cDNA kit» («Bio Rad») и об
при длине волны 570 нм на мультидетекторном
щепринятой полимеразной цепной реак
микропланшете ридере «FLUOstar Omega multi
ции (ПЦР). ПЦР в реальном времени выполня
detection microplate reader» («BMG Labtech», Ве
ли в термоциклере PTC 200 Peltier Thermal
ликобритания). В лунках для проб сравнения
Таблица 1. Праймеры, используемые для ПЦР РВ
Последовательность праймеров (5′-3′)
МРНК
Прямой
Обратный
APP
GGCCCTCGAGAATTACATCA
GTTCATGCGCTCGTAGATCA
BACE 1
GCATGATCATTGGTGGTATC
CCATCTTGAGATCTTCACCA
NEP
GGAAGCCATTCAGCTGGT
TGGAGCATAAACAACCACTTCT
ECE 1
GGACTTCTTCAGCTACGCCTGT
CTAGTTTCGTTCATACACGCACG
β актин
GCTACAGCTTCACCACCACA
GCCATCTCTTGCTCGAAGTC
БИОХИМИЯ том 86 вып. 6 2021
6*
836
БАБУСИКОВА и др.
содержалось 10 мкл воды или 10 мкл различных
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
разведений бычьего сывороточного альбуми
на (P0914, «Sigma Aldrich»), который использо
Влияние ишемии и реперфузии на уровни
вали в качестве стандарта.
мРНК и белка APP. Вызванная in vivo 15 мин
Статистический анализ. Статистический ана
глобальная ишемия приводила к увеличению
лиз данных выполняли с использованием прог
экспрессии мРНК АРР в Сх крыс на
раммного обеспечения «GraphPad Prism 9.1.0.».
22,26 ± 8,52% (F2,21 = 6,22; p = 0,0076) по сравне
Оценку минимального размера группы прово
нию с экспрессией у ложно оперированных жи
дили по методу Салливана на основе предвари
вотных, принятой за 100% (табл. 2). После
тельных экспериментов. Нормальность распре
120 мин реперфузии содержание мРНК АРР
деления анализировали с использованием кри
возвращалось к контрольным значениям
терия Колмогорова-Смирнова, при этом все
(97,80 ± 3,96%), зарегистрированным для лож
данные проходили тест на нормальность. Срав
но оперированных животных.
нение экспериментальной и контрольной групп
Уровни белка АРР анализировали как в раст
проводили с помощью однофакторного диспер
воримой (цитозольной), так и в мембранной
сионного анализа ANOVA с тестом множествен
фракциях Сх (рис. 2). В мембранной фракции
ных сравнений Тьюки. Все данные представле
уровень мембраносвязанного АРР после гло
ны как среднее значение ± SEM (стандартная
бальной ишемии увеличился до 182,83 ± 5,66%
ошибка среднего). Статистически значимым
(F2,21 = 66,97; p < 0,0001), тогда как после
считалось значение при p < 0,05.
120
мин реперфузии он составил только
a
b
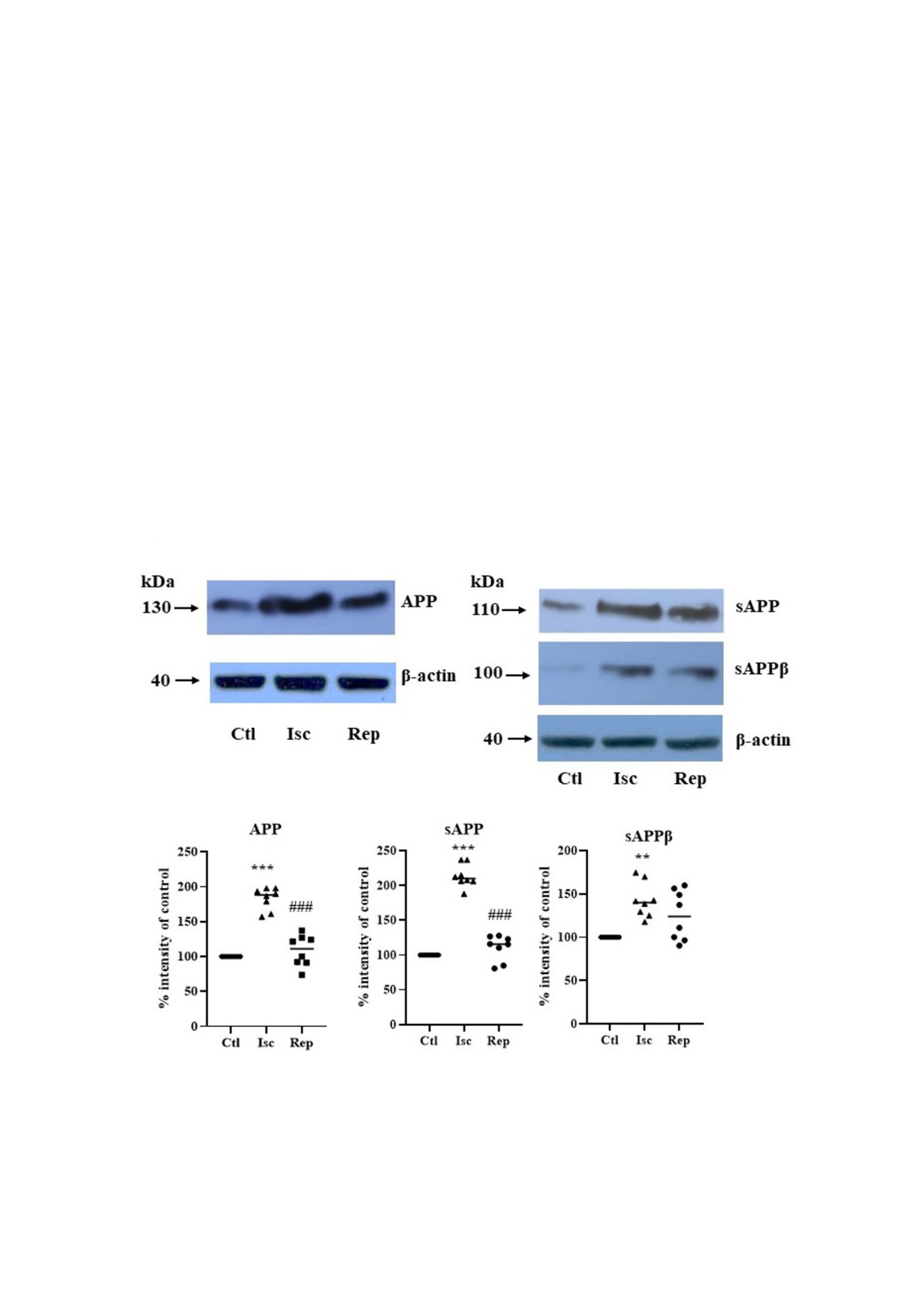
Рис. 2. Влияние ишемии на уровни APP и sAPP в коре головного мозга крысы. a - Репрезентативный вестерн блот.
b - Количественный анализ уровней белка APP, sAPP и sAPPβ в % от контроля (принят за 100%). Условные обозначения:
Ctl - контроль; Isc - 15 мин ишемия; Rep - 15 мин ишемия с последующей 120 мин реперфузией. Результаты выраже
ны как среднее значение ± стандартная ошибка среднего (n = 8). ** p < 0,01; *** p < 0,001 по сравнению с контролем.
### p < 0,001 по сравнению с ишемией
БИОХИМИЯ том 86 вып. 6 2021
ИШЕМИЯ ГОЛОВНОГО МОЗГА И АМИЛОИДНЫЙ МЕТАБОЛИЗМ
837
a
b
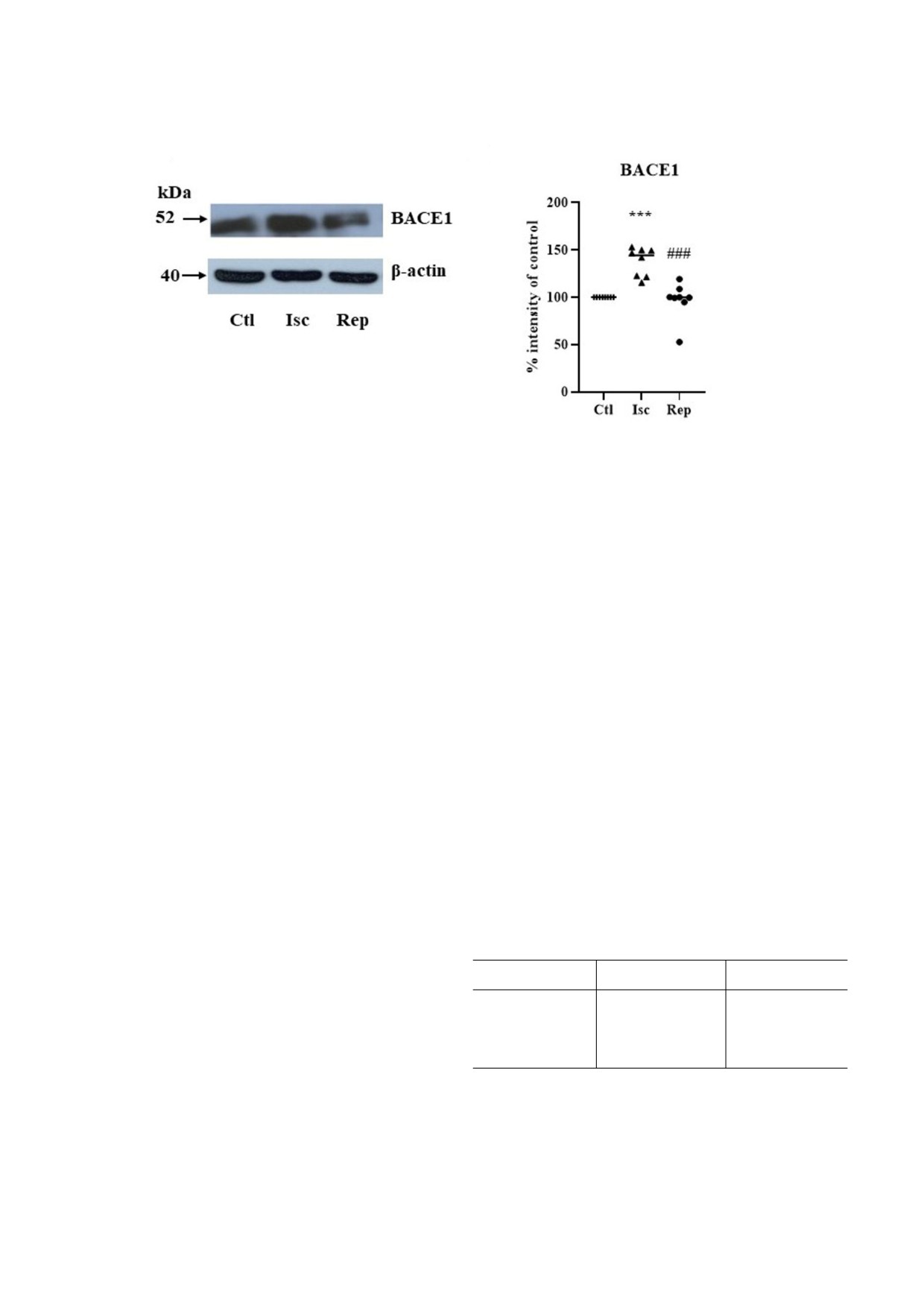
Рис. 3. Уровни белка BACE1 в коре головного мозга крысы после ишемии. а - Репрезентативный вестерн блот. b - Ко
личественный анализ уровня белка ВАСЕ1 в % от контроля (принят за 100%). Условные обозначения: Ctl - контроль;
Isc - 15 мин ишемия; Rep - 15 мин ишемия с последующей 120 мин реперфузией. Результаты выражены как среднее
значение ± стандартная ошибка среднего (n = 8). *** p < 0,001 по сравнению с контролем; ### p < 0,001 по сравнению с
ишемией
108,49 ± 7,81% (p < 0,001) от уровня ложно опе
уровней мРНК NEP и ECE 1 в Сх показал, что
рированных животных (рис. 2, a и b). Уровень
экспрессия обоих ферментов снижалась после
общего sAPP в растворимой фракции после гло
ишемии (табл. 3). В Cx экспрессия NEP была
бальной ишемии увеличился до 213,69 ± 5,79%
ниже на 22,14 ± 7,54% (F2,21 = 3,86; p < 0,05) по
(F2,21 = 158,0; p < 0,0001). После реперфузии уро
сравнению с контролем. После реперфузии
вень sAPP был все ещё выше, чем у ложно опе
уровни мРНК NEP возвращались к контроль
рированных животных (приблизительно на
ным значениям. Мы также наблюдали значи
10%), но это не было статистически значимым.
тельное снижение на 24,98 ± 5,71% (F2,21 = 5,22;
Количество sAPPβ (продукта расщепления APP
p = 0,014) уровней мРНК ECE 1 в Сх, которые
по β секретазному пути) также было значитель
возвращались к контрольным значениям после
но выше после глобальной ишемии и достигало
реперфузии.
142,37 ± 7,21% (F2,21 = 8,82; p = 0,0017). Хотя
Данные вестерн блоттинга показали, что
после реперфузии уровни sAPPβ оставались до
ишемия также приводит к снижению уровней
вольно высокими по сравнению с ложно опери
белков NEP и ECE 1 (рис. 4). Уровни NEP сни
рованными животными, это не было статисти
жались на 38,11 ± 5,29% (F2,21 = 21,33; p < 0,001)
чески достоверным.
после 15 мин глобальной ишемии по сравне
Влияние ишемии и реперфузии на уровни
нию с ложно оперированными контрольными
мРНК и белка BACE1. Поскольку в Cх ишемизи
животными, в то время как после 120 мин ре
рованного мозга мы наблюдали повышенные
перфузии они существенно не отличались от
уровни sAPPβ, мы также предприняли анализ
экспрессии β секретазы (BACE1), которая отве
чает за амилоидогенный процессинг APP. Уров
Таблица 2. Уровни мРНК APP и BACE1 в коре головного
ни мРНК и белка BACE1 были увеличены после
мозга крыс после ишемии и реперфузии
глобальной ишемии, но снижались до контроль
ных уровней после реперфузии. Так, уровень
Статус
APP
BACE1
мРНК ВАСЕ1 в Сх после ишемии был выше на
Контроль
100
100
34,02 ± 10,86% (F2,21 = 5,86; p = 0,0095) (табл. 2),
Ишемия
122,26 ± 8,52*
134,02 ± 10,86*
а на уровне белка - на 37,61 ± 3,34% (F2,21 =
= 20,45; p < 0,001) (рис. 3), в то время как статис
Реперфузия
97,80 ± 3,96##
100,85 ± 8,63##
тически значимых различий после реперфузии
Примечание. Результаты рассчитывали в % от значений
по сравнению с ложно оперированными живот
контроля (ложно оперированные животные), взятых
ными зарегистрировано не было.
за 100%, и выражали в виде среднего значения ± стандарт
Ишемия снижает уровни мРНК и белка ами
ная ошибка среднего (n = 8). * p < 0,01 по сравнению с
лоид деградирующих ферментов. ПЦР анализ
контролем; ## p < 0,01 по сравнению с ишемией.
БИОХИМИЯ том 86 вып. 6 2021
838
БАБУСИКОВА и др.
контроля. Уровни ECE 1 снижались на
ишемии и реперфузии, которая увеличилась
47,32 ± 4,85% (F2,21 = 51,96; p < 0,001) после ише
на 36,33 ± 6,23% (F2,21 = 21,8; p < 0,0001) соответ
мии, но были выше на 24,65 ± 7,33% после ре
ственно по сравнению с ложно оперированны
перфузии по сравнению с контрольной группой
ми животными, но вернулась к контрольному
(p < 0,01). Вестерн блоттинг также показал отсут
уровню после реперфузии.
ствие изменений в уровнях белка IDE как после
ишемии (F2,21 = 1,53; p = 0,24), так и после ре
перфузии.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Маркёры окислительного повреждения. На
копление продуктов перекисного окисления ли
Хотя влияние различных типов ишемии на
пидов и белков, которые мы проанализировали в
метаболизм амилоидного пептида было изучено
мембранной фракции Сх, позволили предполо
на различных моделях [56-58], наше исследова
жить, что ишемия приводит к значительному
ние впервые продемонстрировало, что острая
окислительному повреждению ткани. Так, уро
глобальная ишемия влияет одновременно на
вень интенсивности флуоресценции дитирозина
различные пути метаболизма амилоидного пеп
увеличивался после ишемии на 32,15 ± 10,92%
тида в ткани коры мозга крыс, включая экспрес
(F2,21 = 18,85; p < 0,0001) по сравнению с контро
сию APP на уровне мРНК и белка, его процес
лем (табл. 4), но снижался до контрольных вели
синг с помощью амилоидогенной β секрета
чин после реперфузии. Чтобы оценить модифи
зы (BACE1) и экспрессию белкового продук
кации белков конечными продуктами перекис
та BACE1, а также на уровни экспрессии фер
ного окисления липидов, мы измерили спектры
ментов, участвующих в деградации Aβ. Данные,
флуоресценции, соответствующие конъюгатам
накопленные в этом исследовании, ясно проде
конечных продуктов ПОЛ со свободными ами
монстрировали, что даже после 15 мин глобаль
ногруппами белков. В табл. 4 приведены резуль
ной ишемии происходит значительный сдвиг в
таты изменения интенсивности флуоресценции
сторону процессов, ведущих к продукции и на
в спектре излучения конъюгатов лизина после
коплению Aβ из за повышенной экспрес
сии APP и BACE1 (как на уровне мРНК, так и на
уровне белка), образования sAPPβ, а также из за
снижения экспрессии амилоид деградирующих
Таблица 3. Уровни мРНК амилоид деградирующих фер
ментов в коре головного мозга крыс после ишемии и ре
ферментов NEP и ECE 1. Полученные результа
перфузии
ты объясняют, почему различные авторы сооб
щают о повышенных уровнях Aβ и накоплении
Статус
NEP
ECE 1
сенильных бляшек в ишемизированном мозге у
трансгенных мышей, моделирующих БА [59, 60],
Контроль
100
100
или в мозге человека [61, 62]. Поскольку крысы
Ишемия
77,86 ± 7,54*
75,02 ± 5,71**
дикого типа не накапливают амилоидные отло
Реперфузия
95,19 ± 8,22
101,26 ± 9,65#
жения из за различий в аминокислотной после
довательности АРР в домене Aβ по сравнению с
Примечание. Результаты рассчитывали в % от значений
контроля (ложно оперированные животные), взятых
АРР человека [63], большая часть исследований
за 100%, и выражали как среднее значение ± стандартная
метаболизма амилоида проводится на трансген
ошибка среднего (n = 8). * p < 0,05; ** p < 0,01 по сравне
ных животных. Тем не менее весь механизм про
нию с контролем; # p < 0,05 по сравнению с ишемией.
цессинга АРР и деградации амилоида у крыс
имеет те же основные компоненты, что и в чело
веческом мозге, поэтому данные исследований
Таблица 4. Влияние ишемии и реперфузии на интенсив
на крысах можно экстраполировать на основ
ность флуоресценции (условные единицы) маркёров окис
ную биохимию человеческого мозга.
лительного повреждения во фракции мембран коры мозга
крыс
В нашем исследовании повышение уровней
мРНК АРР после 15 мин глобальной ишемии
Статус
Дитирозин
Конъюгаты лизина
коррелировало с увеличением уровней бел
ка АРР как в мембранной, так и в растворимой
Контроль
67,89 ± 2,58
61,57 ± 3,32
фракции Сх крысы, что согласуется с ранее по
Ишемия
87,88 ± 2,61***
83,56 ± 1,46***
лученными нами данными для всего полушария
Реперфузия
69,09 ± 2,69###
61,68 ± 2,99###
мозга [64]. Также имеются данные об ускорен
ной продукции C и N концевых фрагмен
Примечание. Результаты выражены как среднее значе
тов sAPP в периинфарктной зоне головного
ние ± стандартная ошибка среднего (n = 8). *** p < 0,001 по
сравнению с контролем; ### p < 0,001 по сравнению с
мозга крыс после очаговой церебральной ише
ишемией.
мии [65]. В то время как количество общих сек
БИОХИМИЯ том 86 вып. 6 2021
ИШЕМИЯ ГОЛОВНОГО МОЗГА И АМИЛОИДНЫЙ МЕТАБОЛИЗМ
839
a
b
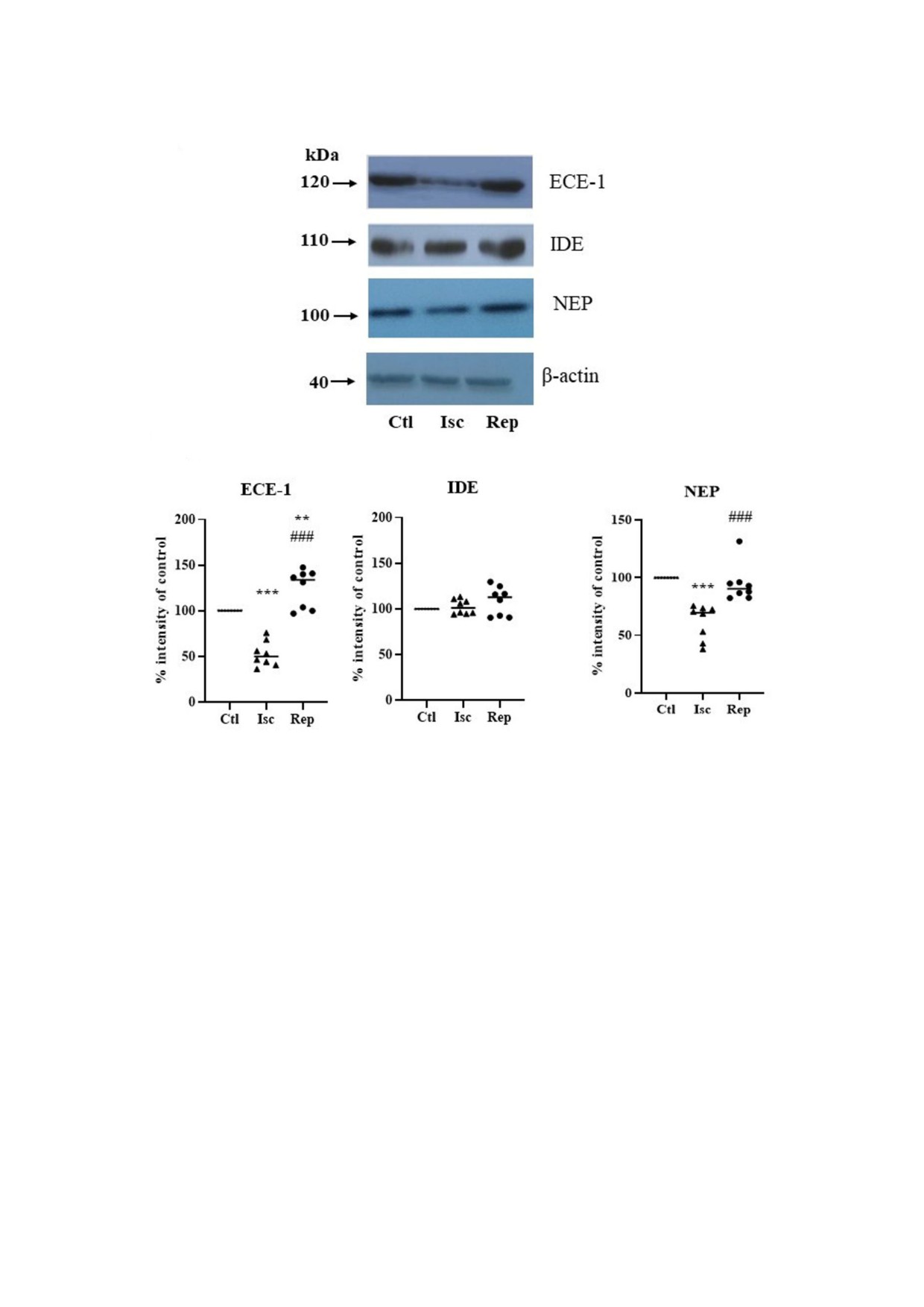
Рис. 4. Уровни белка амилоид деградирующих ферментов в мембранной фракции коры головного мозга крысы после
ишемии. а - Репрезентативный вестерн блот. b - Количественный анализ уровней белков ECE 1, IDE и NEP в % от конт
роля (принят за 100%). Условные обозначения: Сtl - контроль; Isc - 15 мин ишемия; Rep - 15 мин ишемия с последую
щей 120 мин реперфузией. Результаты выражены как среднее значение ± стандартная ошибка среднего (n = 8). ** p < 0,01;
*** p < 0,001 по сравнению с контролем; ### p < 0,001 по сравнению с ишемией
ретируемых продуктов APP, наблюдаемых нами
статистически значимым, уровни sAPPβ были
в Cx после глобальной ишемии, было увеличено
все же выше после 120 мин реперфузии, в то
на 113% по сравнению с контролем, количест
время как общий sAPP практически снижался
во sAPPβ увеличилось на 42%, это позволяет
до уровней ложно оперированных животных.
сделать предположение о том, что другая часть
Также ранее нами была показана повышенная
секретируемых продуктов была образована при
иммунореактивность sAPPβ и BACE1 в гиппо
действии на АРР α секретазы. Действительно,
кампе крыс после глобальной ишемии, что поз
имеются данные, что хроническая ишемия го
воляет сделать предположение о том, что амилои
ловного мозга вызывает активацию металлопеп
догенный процессинг АРР увеличивается в раз
тидаз семейства ADAM, особенно ADAM10 и
личных структурах мозга. Стоит отметить, что
ADAM17 [66].
увеличение уровней sAPPβ в гиппокампе было
Увеличение продукции sAPPβ после 15 мин
намного выше, чем мы наблюдали в данном ис
глобальной ишемии также коррелировало с по
следовании в Cx, несмотря на то что в гиппо
вышенной экспрессией и уровнями бел
кампе не было обнаружено значительного уве
ка BACE1, который инициирует амилоидоген
личения уровней белка BACE1 [67]. После ише
ный процессинг APP. Хотя это и не является
мии в коре средней височной доли крыс были
БИОХИМИЯ том 86 вып. 6 2021
840
БАБУСИКОВА и др.
зарегистрированы повышенные уровни мРНК
мозге различных видов животных, включая при
BACE1 даже через 2 дня после глобальной ише
матов [37, 74, 75].
мии [68]. Увеличение выработки sAPPβ предпо
Поскольку экспрессия NEP в нейрональных
лагает, что после ишемии клетки в Сх имеют
клетках повышается при участии AICD через β
больше субстрата для расщепления γ секретазой
секретазный путь расщепления APP [22, 76],
и продукции Aβ. Более того, есть сообщения о
было возможным ожидать, что после ишемии
том, что ишемия увеличивает экспрессию ос
экспрессия NEP будет увеличиваться при акти
новных белков комплекса γ секретазы, PS1
вации процессинга APP с помощью BACE1, ко
и PS2, в гиппокампе крыс даже через 2 дня пос
торую мы обнаружили в данном исследовании.
ле временной 10 мин глобальной ишемии, выз
Однако после глобальной ишемии мы не наб
ванной остановкой сердца у крыс [69]. В сово
людали увеличения уровня мРНК NEP, а напро
купности эти данные позволяют сделать вывод,
тив, значительное его снижение в Cx крыс. Ос
что ишемия неизбежно приводит к условиям,
новной причиной этого может быть повышен
благоприятствующим образованию избыточно
ная экспрессия каспаз в условиях ишемии, ко
го количества пептида Aβ в Cx мозга. Хотя в на
торые разрушают AICD, а также высокие уров
шем исследовании мы наблюдали, что после
ни IDE, который также расщепляет AICD [77].
120 мин реперфузии экспрессия APP и BACE1
Активация каспаз в условиях ишемии довольно
практически возвращалась к контрольным зна
хорошо изучена [78]. В наших исследованиях
чениям, есть данные, что после ишемии их
мы также наблюдали повышенную экспрессию
экспрессия может увеличиваться на более позд
каспаз, сопровождаемую снижением уров
них стадиях восстановления, что предраспола
ней AICD и NEP в Cx головного мозга крыс
гает к продолжительной выработке Aβ [68, 69] с
после пренатальной гипоксии, которая восста
более выраженным эффектом у старых живот
навливалась после инъекции ингибитора каспаз
ных [70].
Ac DEVD CHO [79]. Поскольку настоящее ис
Помимо потенциации образования Aβ, ише
следование не выявило каких либо изменений
мия определенно влияет на ферменты, участву
уровней мРНК и белка IDE после глобальной
ющие в его деградации. Как мы показали в дан
ишемии, можно предположить, что IDE может
ном исследовании, экспрессия мРНК и уровни
легко расщеплять AICD в Cx крыс, предотвра
белка двух основных ферментов, расщепляю
щая повышение экспрессии NEP.
щих амилоид, NEP и ECE 1, значительно сни
Уменьшение экспрессии ECE 1, помимо
жаются после 15 мин глобальной ишемии. По
сниженного расщепления амилоида β, также
мимо того, что NEP является ферментом, разла
может оказывать повреждающее действие на
гающим Aβ, он также является важной нейро
мозг, поскольку, как было показано, его
пептидазой, участвующей в прекращении пеп
субстрат, эндотелин 1, усугубляет ишемически
тидергической нейротрансмиссии таких важ
реперфузионное повреждение в неокортексе
ных нейропептидов, как соматостатин, энкефа
крыс [80]. Более того, имеются данные, что по
лины, вещество P и т.д., и снижение уровня NEP
лиморфизм в гене ECE<1b увеличивает риск
приведет к нарушению всех процессов в голов
ишемического инсульта [81]. Поскольку число
ном мозге, которые требуют его активности [71].
исследований экспрессии ECE 1 после ишемии
С другой стороны, есть сообщения о том, что
весьма ограничено, наши данные добавляют но
предварительное введение мышам комбиниро
вую информацию к общим знаниям об этой
ванного препарата LCZ696 (блокатор рецепто
важной металлопептидазе.
ров ангиотензина/ингибитор NEP) предотвра
Окислительный стресс, который всегда соп
щает повреждение мозга, вызванное окклюзией
ровождает ишемию и реперфузию, заметно уси
средней мозговой артерии, за счёт снижения
ливает их патогенное действие на мозг [82]. Как
уровней супероксидного аниона на ишемичес
мы показали в данном исследовании, 15 мин
кой стороне коры [72]. Хотя NEP также играет
глобальная ишемия приводит к значительному
очень важную роль в регулировании артериаль
увеличению модификаций белков на уровне ди
ного давления, и его ингибиторы в сочетании с
тирозина и конъюгатов лизина в Сх крыс, что
блокаторами рецепторов ангиотензина предотв
коррелирует с данными, полученными ранее, о
ращают сердечную недостаточность [73], нельзя
повышенных уровнях модификаций липидов и
недооценивать возможность негативного влия
белков в переднем мозге крыс [83]. Есть также
ния пониженной экспрессии NEP в головном
данные о том, что окислительный стресс влияет
мозге на содержание Aβ. Действительно, есть
на экспрессию и активность NEP [34]. Окисли
существенные доказательства того, что дефицит
тельное повреждение липидов и белков также
экспрессии NEP или ингибирование его актив
является потенциальной основной причиной
ности увеличивает накопление Aβ в головном
гиперпродукции Aβ при ишемии и гибели ней
БИОХИМИЯ том 86 вып. 6 2021
ИШЕМИЯ ГОЛОВНОГО МОЗГА И АМИЛОИДНЫЙ МЕТАБОЛИЗМ
841
рональных клеток [5], что представляет собой
выступать фактором, предрасполагающим к
порочный круг в патогенных процессах, вызы
нейродегенеративным процессам, а в более тя
ваемых ишемией. Повышенные уровни окис
жёлых случаях - к БА [3, 6, 12].
ленных белков и липидов могут быть результа
Поскольку патологические изменения в го
том не только увеличения производства АФК и
ловном мозге, приводящие к БА, на протяже
их реактивности во время ишемического ин
нии многих лет имеют кумулятивный эффект,
сульта, но также и следствием снижения спо
не следует недооценивать роль хронического
собности организма защищаться от окислитель
стресса, депрессии, гипоперфузии мозга и ише
ных повреждений, вызванных ослаблением
мии. Нельзя ожидать создание одного магичес
системы антиоксидантной защиты, что также
кого лекарства, которое бы предотвращало или
является одним из основных механизмов пато
полностью излечивало нейродегенеративные
логии БА и мишенью для нейропротекции [84].
процессы в головном мозге. Только комплекс
Лечение антиоксидантами может ослабить не
ный терапевтический подход, направленный на
гативные эффекты ишемии у пациентов и мо
различные аспекты метаболизма амилоида, мо
жет быть полезным для предотвращения свя
жет привести к разработке стратегии, позволяю
занного с ишемией накопления Aβ за счёт уве
щей отсрочить начало заболевания и миними
личения уровней и активности белка NEP, как
зировать его тяжесть.
показано на животных после пренатальной ги
поксии [85].
Данные, полученные в этом исследовании,
Финансирование. Работа поддержана гранта
предполагают, что даже 15 мин глобальная ише
ми FP7 PEOPLE 2010 IEF, MRC, ARUK,
мия значительно влияет на белки, которые яв
VEGA 1/0266/18, а также частично Российским
ляются основными участниками метаболизма
фондом фундаментальных исследований (грант
Aβ. Тот факт, что после относительно короткой
№ 19 015 00232) и Госзаданием АААА А18
(120 мин) реперфузии их экспрессия практичес
118012290373 7.
ки возвращается к контрольным уровням, пред
Благодарности. Благодарим Я. Бенкатова,
полагает, что мозг имеет способность восстанав
З. Цетлова и А. Кемпна за лабораторную по
ливать свой нормальный гомеостаз даже после
мощь.
глобального эпизода ишемии. Однако в долгос
Конфликт интересов. Авторы заявляют об от
рочной перспективе эпизоды ишемии и реокси
сутствии конфликта интересов.
генации могут приводить к более серьезным на
Соблюдение этических норм. Эта статья не
рушениям, наблюдаемым на различных уровнях
содержит исследований с участием людей. Все
метаболизма амилоида [57, 58, 68, 74]. Поэтому
эксперименты на животных проводились в со
хронический стресс, который часто приводит к
ответствии с руководящими принципами
нарушению мозгового кровообращения и ише
ARRIVE по проведению исследований на жи
мическим состояниям в головном мозге, может
вотных и отчетности по ним.
СПИСОК ЛИТЕРАТУРЫ
1.
Escher, C. M., Sannemann, L., and Jessen, F. (2019) Stress
brain degeneration, Pharmacol. Rep., 68, 13451349,
and Alzheimer’s disease, J. Neural. Transm (Vienna), 126,
doi: 10.1016/j.pharep.2016.09.006.
1155 1161, doi: 10.1007/s00702 019 01988 z.
7. Pluta, R., Ułamek Kozioł, M., Januszewski, S., and
2.
Sotiropoulos, I., Silva, J. M., Gomes, P., Sousa, N., and
Czuczwar, S. J. (2020) shared genomic and proteomic con
Almeida, O. F. X. (2019) Stress and the etiopathogenesis of
tribution of amyloid and tau protein characteristic of
Alzheimer’s disease and depression, Adv. Exp. Med. Biol.,
Alzheimer’s disease to brain ischemia, Int. J. Mol. Sci., 21,
1184, 241 257, doi: 10.1007/978 981 32 9358 8_20.
3186, doi: 10.3390/ijms21093186.
3.
Kotl ga, D., Goł b Janowska, M., Masztalewicz, M.,
8. Bisht, K., Sharma, K., and Tremblay, M. È.
(2018)
Ciećwież, S., and Nowacki, P. (2016) The emotional stress
Chronic stress as a risk factor for Alzheimer’s disease: roles
and risk of ischemic stroke, Neurol. Neurochir. Pol., 50,
of microglia mediated synaptic remodeling, inflammation,
265 270.
and oxidative stress, Neurobiol. Stress,
9,
9 21,
4.
Daulatzai, M. A. (2017) Cerebral hypoperfusion and glu
doi: 10.1016/j.ynstr.2018.05.003.
cose hypometabolism: key pathophysiological modulators
9. Canet, G., Hernandez, C., Zussy, C., Chevallier, N.,
promote neurodegeneration, cognitive impairment, and
Desrumaux, C., and Givalois, L. (2019) Is AD a stress
Alzheimer’s disease, J. Neurosci. Res., 95, 943972,
related disorder? Focus on the HPA axis and its promising
doi: 10.1002/jnr.23777.
therapeutic targets, Front. Aging Neurosci., 11, 269,
5.
Dong, S., Maniar, S., Manole, M. D., and Sun, D. (2018)
doi: 10.3389/fnagi.2019.00269.
Cerebral hypoperfusion and other shared brain pathologies
10. Gulyaeva, N. V. (2019) Functional neurochemistry of the
in ischemic stroke and Alzheimer’s disease, Transl. Stroke
ventral and dorsal hippocampus: stress, depression,
Res., 9, 238 250, doi: 10.1007/s12975 017 0570 2.
dementia and remote hippocampal damage, Neurochem.
6.
Ułamek Kozioł, M., Pluta, R., Januszewski, S., Kocki, J.,
Res., 44, 1306 1322, doi: 10.1007/s11064 018 2662 0.
Bogucka Kocka, A., and Czuczwar, S. J.
(2016)
11. Podgorny, O. V., and Gulyaeva, N. V.
(2020)
Expression of Alzheimer’s disease risk genes in ischemic
Glucocorticoid mediated mechanisms of hippocampal
БИОХИМИЯ том 86 вып. 6 2021
842
БАБУСИКОВА и др.
damage: contribution of subgranular neurogenesis,
APP alpha secretase, Biochem. Biophys. Res. Commun.,
J. Neurochem., doi: 10.1111/jnc.15265.
301, 231 235, doi: 10.1016/s0006 291x(02)02999 6.
12.
Gulyaeva, N. V. (2019) Biochemical mechanisms and
27.
Octave, J. N., Pierrot, N., Santos, S. F., Nalivaeva, N. N.,
translational relevance of hippocampal vulnerability to dis
and Turner, A. J. (2013) From synaptic spines to nuclear sig
tant focal brain injury: the price of stress response,
naling: nuclear and synaptic actions of the amyloid precursor
Biochemistry (Moscow), 84, 13061328, doi: 10.1134/
protein, J. Neurochem., 126, 183 190, doi: 10.1111/jnc.12239.
S0006297919110087.
28.
Chasseigneaux, S., and Allinquant, B. (2012) Functions of
13.
Ballard, C., Gauthier, S., Corbett, A., Brayne, C.,
Aβ, sAPPα and sAPPβ: similarities and differences,
Aarsland, D., and Jones, E. (2011) Alzheimer’s disease,
J. Neurochem., 120 Suppl. 1, 99 108, doi: 10.1111/j.1471
Lancet,
377,
10191031, doi:
10.1016/S0140
4159.2011.07584.x.
6736(10)61349 9.
29.
Nalivaeva, N. N., and Turner, A. J. (2019) Targeting amy
14.
Hardy, J., and Selkoe, D. J. (2002) The amyloid hypothe
loid clearance in Alzheimer’s disease as a therapeutic strat
sis of Alzheimer’s disease: progress and problems on the
egy, Br. J. Pharmacol., 176, 3447 3463, doi: 10.1111/bph.
road to therapeutics, Science, 297, 353 356, doi: 10.1126/
14593.
science.1072994.
30.
Eckman, E. A., Adams, S. K., Troendle, F. J., Stodola,
15.
Walton, C. C., Begelman, D., Nguyen, W., and Andersen,
B. A., Kahn, M. A., et al. (2006) Regulation of steady state
J. K. (2020) Senescence as an amyloid cascade: the amy
beta amyloid levels in the brain by neprilysin and endothe
loid senescence hypothesis, Front. Cell. Neurosci., 14, 129,
lin converting enzyme but not angiotensin converting
doi: 10.3389/fncel.2020.00129.
enzyme, J. Biol. Chem., 281, 30471 30478, doi: 10.1074/
16.
Walsh, D. M., Hartley, D. M., Condron, M. M., Selkoe,
jbc.M605827200.
D. J., and Teplow, D. B. (2001) In vitro studies of amyloid
31.
Nalivaeva, N. N., Beckett, C., Belyaev, N. D., and Turner,
beta protein fibril assembly and toxicity provide clues to
A. J. (2012) Are amyloid degrading enzymes viable thera
the aetiology of Flemish variant (Ala692→Gly)
peutic targets in Alzheimer’s disease? J. Neurochem., 120,
Alzheimer’s disease, Biochem. J.,
355,
869877,
Suppl. 1, 167 185, doi: 10.1111/j.1471 4159.2011.07510.x.
doi: 10.1042/bj3550869.
32.
Miners, J. S., Palmer, J. C., Tayler, H., Palmer, L. E.,
17.
Ferreira, S. T., Lourenco, M. V., Oliveira, M. M., and De
Ashby, E., et al. (2014) Aβ degradation or cerebral perfu
Felice, F. G. (2015) Soluble amyloid beta oligomers as
sion? Divergent effects of multifunctional enzymes, Front.
synaptotoxins leading to cognitive impairment in
Aging Neurosci., 6, 238, doi: 10.3389/fnagi.2014.00238.
Alzheimer’s disease, Front. Cell. Neurosci.,
9,
191,
33.
Di Marco, L. Y., Farkas, E., Martin, C., Venneri, A., and
doi: 10.3389/fncel.2015.00191.
Frangi, A. F. (2015) Is vasomotion in cerebral arteries
18.
Kobayashi, K., Hayashi, M., Nakano, H., Shimazaki, M.,
impaired in Alzheimer’s disease? J. Alzheimer’s Dis., 46,
Sugimori, K., and Koshino, Y. (2004) Correlation between
35 53, doi: 10.3233/JAD 142976.
astrocyte apoptosis and Alzheimer changes in gray matter
34.
Nalivaeva, N. N., and Turner, A. J. (2017) Role of ageing and
lesions in Alzheimer’s disease, J. Alzheimers Dis., 6, 623
oxidative stress in regulation of amyloid degrading enzymes
632, doi: 10.3233/jad 2004 6606.
and development of neurodegeneration, Curr. Aging Sci., 10,
19.
Kuhla, A., Ludwig, S. C., Kuhla, B., Münch, G., and
32 40, doi: 10.2174/1874609809666161111101111.
Vollmar, B. (2015) Advanced glycation end products are
35.
Shi, X., Ohta, Y., Liu, X., Shang, J., Morihara, R., et al.
mitogenic signals and trigger cell cycle reentry of neurons
(2019) Chronic cerebral hypoperfusion activates the coagula
in Alzheimer’s disease brain, Neurobiol. Aging, 36, 753
tion and complement cascades in Alzheimer’s disease mice,
761, doi: 10.1016/j.neurobiolaging.2014.09.025.
Neuroscience, 416, 126 136, doi: 10.1016/j.neuroscience.
20.
Vassar, R., Bennett, B. D., Babu Khan, S., Kahn, S.,
2019.07.050.
Mendiaz, E. A., et al. (1999) Beta secretase cleavage of
36.
Morgese, M. G., Schiavone, S., and Trabace, L. (2017)
Alzheimer’s amyloid precursor protein by the transmem
Emerging role of amyloid beta in stress response: implica
brane aspartic protease BACE, Science, 286, 735 741,
tion for depression and diabetes, Eur. J. Pharmacol., 817,
doi: 10.1126/science.286.5440.735.
22 29, doi: 10.1016/j.ejphar.2017.08.031.
21.
Wolfe, M. S., Xia, W., Moore, C. L., Leatherwood, D. D.,
37.
Mouri, A., Zou, L. B., Iwata, N., Saido, T. C., Wang, D.,
Ostaszewski, B., et al. (1999) Peptidomimetic probes and
et al. (2006) Inhibition of neprilysin by thiorphan (i.c.v.)
molecular modeling suggest that Alzheimer’s gamma sec
causes an accumulation of amyloid beta and impairment of
retase is an intramembrane cleaving aspartyl protease,
learning and memory, Behav. Brain Res., 168, 83 91,
Biochemistry, 38, 4720 4727, doi: 10.1021/bi982562p.
doi: 10.1016/j.bbr.2005.10.014.
22.
Belyaev, N. D., Kellett, K. A., Beckett, C., Makova, N. Z.,
38.
Devi, L., and Ohno, M. (2015) A combination Alzheimer’s
Revett, T. J., et al. (2010) The transcriptionally active amy
therapy targeting BACE1 and neprilysin in 5XFAD trans
loid precursor protein (APP) intracellular domain is pref
genic mice, Mol. Brain, 8, 19, doi: 10.1186/s13041 015
erentially produced from the 695 isoform of APP in a β
0110 5.
secretase dependent pathway, J. Biol. Chem., 285, 41443
39.
Poirier, R., Wolfer, D. P., Welzl, H., Tracy, J., Galsworthy,
41454, doi: 10.1074/jbc.M110.141390.
M. J., et al. (2006) Neuronal neprilysin overexpression is
23.
Beckett, C., Nalivaeva, N. N., Belyaev, N. D., and Turner,
associated with attenuation of Abeta related spatial mem
A. J. (2012) Nuclear signalling by membrane protein intra
ory deficit, Neurobiol. Dis., 24, 475 483, doi: 10.1016/
cellular domains: the AICD enigma, Cell. Signal., 24, 402
j.nbd.2006.08.003.
409, doi: 10.1016/j.cellsig.2011.10.007.
40.
Bakthavachalam, P., and Shanmugam, P. S. T. (2017)
24.
Parvathy, S., Hussain, I., Karran, E. H., Turner, A. J., and
Mitochondrial dysfunction - Silent killer in cerebral
Hooper, N. M. (1999) Cleavage of Alzheimer’s amyloid
ischemia, J. Neurol. Sci., 375, 417 423, doi: 10.1016/j.jns.
precursor protein by alpha secretase occurs at the surface
2017.02.043.
of neuronal cells, Biochemistry,
38,
97289734,
41.
Butterfield, D. A. (2002) Amyloid β peptide (1 42)
doi: 10.1021/bi9906827.
induced oxidative stress and neurotoxicity: implications for
25.
Allinson, T. M., Parkin, E. T., Turner, A. J., and Hooper,
neurodegeneration in Alzheimer’s disease brain. A review,
N. M. (2003) ADAMs family members as amyloid precur
Free Radic. Res.,
36,
13071313, doi:
10.1080/
sor protein alpha secretases, J. Neurosci. Res., 74, 342 352,
1071576021000049890.
doi: 10.1002/jnr.10737.
42.
Angelova, P. R., and Abramov, A. Y. (2014) Interaction of
26.
Asai, M., Hattori, C., Szabó, B., Sasagawa, N.,
neurons and astrocytes underlies the mechanism of Abeta
Maruyama, K., Tanuma, S., and Ishiura, S.
(2003)
induced neurotoxicity, Biochem. Soc. Trans., 42, 1286
Putative function of ADAM9, ADAM10, and ADAM17 as
1290, doi: 10.1042/BST20140153.
БИОХИМИЯ том 86 вып. 6 2021
ИШЕМИЯ ГОЛОВНОГО МОЗГА И АМИЛОИДНЫЙ МЕТАБОЛИЗМ
843
43.
Babusikova, E., Hatok, J., Dobrota, D., and Kaplan, P.
59.
Garcia Alloza, M., Gregory, J., Kuchibhotla, K. V.,
(2007) Age related oxidative modifications of proteins and
Fine, S., Wei, Y., et al. (2011) Cerebrovascular lesions
lipids in rat brain, Neurochem. Res., 32, 13511356,
induce transient beta amyloid deposition, Brain, 134,
doi: 10.1007/s11064 007 9314 0.
3697 3707, doi: 10.1093/brain/awr300.
44.
Umeno, A., Biju, V., and Yoshida, Y. (2017) In vivo ROS
60.
Pimentel Coelho, P. M., Michaud, J. P., and Rivest, S.
production and use of oxidative stress derived biomarkers
(2013) Effects of mild chronic cerebral hypoperfusion and
to detect the onset of diseases such as Alzheimer’s disease,
early amyloid pathology on spatial learning and the cellular
Parkinson’s disease, and diabetes, Free Radic Res., 51, 413
innate immune response in mice, Neurobiol. Aging, 34,
427, doi: 10.1080/10715762.2017.1315114.
679 693, doi: 10.1016/j.neurobiolaging.2012.06.025.
45.
Butterfield, D. A., Reed, T., Newman, S. F., and
61.
Jendroska, K., Poewe, W., Daniel, S. E., Pluess, J.,
Sultana, R. (2007) Roles of amyloid β peptide associated
Iwerssen Schmidt, H., Paulsen, J., et al. (1995) Ischemic
oxidative stress and brain protein modifications in the
stress induces deposition of amyloid beta immunoreactivi
pathogenesis of Alzheimer’s disease and mild cognitive
ty in human brain, Acta Neuropathol., 90, 461466,
impairment, Free Radic. Biol. Med.,
43,
658677,
doi: 10.1007/BF00294806.
doi: 10.1016/j.freeradbiomed.2007.05.037.
62.
Kövari, E., Herrmann, F. R., Hof, P. R., and Bouras, C.
46.
Nanetti, L., Raffaelli, F., Vignini, A., Perozzi, C.,
(2013) The relationship between cerebral amyloid angiopa
Silvestrini, M., et al. (2011) Oxidative stress in ischaemic
thy and cortical microinfarcts in brain ageing and
stroke, Eur. J. Clin. Invest., 41, 1318 1322, doi: 10.1111/
Alzheimer’s disease, Neuropathol. Appl. Neurobiol., 39,
j.1365 2362.2011.02546.x.
498 509, doi: 10.1111/nan.12003.
47.
Hawkins, C. L., and Davies, M. J. (2019) Detection, iden
63.
Fraser, P. E., Nguyen, J. T., Inouye, H., Surewicz, W. K.,
tification, and quantification of oxidative protein modifi
Selkoe, D. J., et al. (1992) Fibril formation by primate,
cations, J. Biol. Chem., 294, 19683 19708, doi: 10.1074/
rodent, and Dutch hemorrhagic analogues of Alzheimer
jbc.REV119.006217.
amyloid β protein, Biochemistry,
31,
1071610723,
48.
Sies, H., and Jones, D. P. (2020) Reactive oxygen species
doi: 10.1021/bi00159a011.
(ROS) as pleiotropic physiological signalling agents, Nat.
64.
Nalivaeva, N. N., Fisk, L., Kochkina, E. G., Plesneva,
Rev. Mol. Cell. Biol., 21, 363 383, doi: 10.1038/s41580
S. A., Zhuravin, I. A., et al.
(2004) Effect of
020 0230 3.
hypoxia/ischemia and hypoxic preconditioning/reperfu
49.
Nissanka, N., and Moraes, C. T. (2018) Mitochondrial
sion on expression of some amyloid degrading enzymes,
DNA damage and reactive oxygen species in neurodegen
Ann. N. Y. Acad. Sci., 1035, 21 33, doi: 10.1196/annals.
erative disease, FEBS Lett., 592, 728 742, doi: 10.1002/
1332.002.
1873 3468.12956.
65.
Badan, I., Dinca, I., Buchhold, B., Suofu, Y., Walker, L.,
50.
Assi, M. (2017) The differential role of reactive oxygen
et al. (2004) Accelerated accumulation of N and C termi
species in early and late stages of cancer, Am. J. Physiol.
nal β APP fragments and delayed recovery of microtubule
Regul. Integr. Comp. Physiol.,
313, R646 R653,
associated protein 1B expression following stroke in aged
doi: 10.1152/ajpregu.00247.2017.
rats, Eur. J. Neurosci., 19, 2270 2280, doi: 10.1111/j.0953
51.
Petersen, D. R., and Doorn, J. A. (2004) Reactions of 4
816X.2004.03323.x.
hydroxynonenal with proteins and cellular targets, Free
66.
Cai, Z., Liu, Z., Xiao, M., Wang, C., and Tian, F. (2017)
Radic. Biol. Med., 37, 937 945, doi: 10.1016/j.freeradbiomed.
Chronic cerebral Hypoperfusion promotes amyloid beta
2004.06.012.
pathogenesis via activating β/γ secretases, Neurochem.
52.
Kilkenny, C., Browne, W., Cuthill, I., Emerson, M., and
Res., 42, 3446 3455, doi: 10.1007/s11064 017 2391 9.
Altman, D. (2010) Improving bioscience research report
67.
Nalivaeva, N. N., Babusikova, E. B., Dobrota, D., and
ing: the ARRIVE guidelines for reporting animal research,
Turner, A. J. (2005) Effect of ischaemia and reperfusion on
PLoS Biol., 8, e1000412, doi: 10.1371/journal.pbio.
the content and degradaiton of amyloid precursor Protein
1000412.
in the hippoampus of rats, Neirokhimia, 22, 207 212.
53.
Pulsinelli, W. A., and Buchan, A. M. (1988) The four ves
68.
Pluta, R., Kocki, J., Ułamek Kozioł, M., Petniak, A.,
sel occlusion rat model: method for complete occlusion of
Gil Kulik, P., et al. (2016) Discrepancy in expression of
vertebral arteries and control of collateral circulation,
beta secretase and amyloid beta protein precursor in
Stroke, 19, 913 914, doi: 10.1161/01.str.19.7.913.
Alzheimer related genes in the rat medial temporal lobe
54.
Babus ková, E., Kaplán, P., Lehotský, J., Jesenák, M., and
cortex following transient global brain ischemia,
Dobrota, D. (2004) Oxidative modification of rat cardiac
J. Alzheimer’s Dis., 51, 1023 1031, doi: 10.3233/JAD
mitochondrial membranes and myofibrils by hydroxyl rad
151102.
icals, Gen. Physiol. Biophys., 23, 327 335.
69.
Kocki, J., Ułamek Kozioł, M., Bogucka Kocka, A.,
55.
Smith, P. K., Krohn, R. I., Hermanson, G. T., Mallia,
Januszewski, S., Jabłoński, M., et al. (2015) Dysregulation
A. K., Gartner, F. H., et al. (1985) Measurement of protein
of amyloid β protein precursor, β Secretase, presenilin 1
using bicinchoninic acid, Anal. Biochem., 150, 76 85,
and 2 genes in the rat selectively vulnerable CA1 subfield of
doi: 10.1016/0003 2697(85)90442 7.
hippocampus following transient global brain ischemia,
56.
Pluta, R., Kida, E., Lossinsky, A. S., Golabek, A. A.,
J. Alzheimer’s Dis., 47, 1047 1056, doi: 10.3233/JAD
Mossakowski, M. J., and Wisniewski, H. M. (1994) Complete
150299.
cerebral ischemia with short term survival in rats induced by
70.
Petcu, E. B., Sfredel, V., Platt, D., Herndon, J. G.,
cardiac arrest. I. Extracellular accumulation of Alzheimer’s
Kessler, C., and Popa Wagner, A. (2008) Cellular and mol
beta amyloid protein precursor in the brain, Brain Res., 649,
ecular events underlying the dysregulated response of the
323 328, doi: 10.1016/0006 8993(94)91081 2.
aged brain to stroke: a mini review, Gerontology, 54, 6 17,
57.
Hiltunen, M., Mäkinen, P., Peräniemi, S., Sivenius, J., van
doi: 10.1159/000112845.
Groen, T., et al. (2009) Focal cerebral ischemia in rats
71.
Nalivaeva, N. N., Vasilev, D. S., Dubrovskaya, N. M.,
alters APP processing and expression of Abeta peptide
Turner, A. J., and Zhuravin, I. A. (2020) Role of neprilysin
degrading enzymes in the thalamus, Neurobiol. Dis., 35,
in synaptic plasticity and memory, Russ. J. Physiol., 106,
103 113, doi: 10.1016/j.nbd.2009.04.009.
1191 1208, doi: 10.31857/S0869813920100076.
58.
Koike, M. A., Garcia, F. G., Kitazawa, M., Green, K. N.,
72.
Bai, H. Y., Mogi, M., Nakaoka, H., Kan No, H.,
and Laferla, F. M. (2011) Long term changes in phospho
Tsukuda, K., et al. (2015) Pre treatment with LCZ696, an
APP and tau aggregation in the 3xTg AD mice following
orally active angiotensin receptor neprilysin inhibitor, pre
cerebral ischemia, Neurosci. Lett.,
495,
5559,
vents ischemic brain damage, Eur. J. Pharmacol., 762, 293
doi: 10.1016/j.neulet.2011.03.034.
298, doi: 10.1016/j.ejphar.2015.05.059.
БИОХИМИЯ том 86 вып. 6 2021
844
БАБУСИКОВА и др.
73.
Haynes, R., Zhu, D., Judge, P. K., Herrington, W. G.,
after hypoxia, J. Evol. Biochem. Physiol., 51, 480 484,
Kalra, P. A., and Baigent, C. (2020) Chronic kidney dis
doi: 10.1134/S0022093015060046.
ease, heart failure and neprilysin inhibition, Nephrol. Dial.
80. Chang, C. Z., Yen, C. P., Winadi, D., Wu, S. C., Howng,
Transplant., 35, 558 564, doi: 10.1093/ndt/gfz058.
S. L., et al. (2004) Neuroprotective effect of CGS 26303,
74.
Newell, A. J., Sue, L. I., Scott, S., Rauschkolb, P. K.,
an endothelin converting enzyme inhibitor, on transient
Walker, D. G., et al. (2003) Thiorphan induced neprilysin
middle cerebral artery occlusion in rats, J. Cardiovasc.
inhibition raises amyloid beta levels in rabbit cortex and
Pharmacol., 44, Suppl. 1, 487 489, doi: 10.1097/01.fjc.
cerebrospinal fluid, Neurosci. Lett.,
350,
178180,
0000166307.86678.d1.
doi: 10.1016/s0304 3940(03)00902 9.
81. Li, R., Cui, M., Zhao, J., Yu, M., Ying, Z., Zhou, S., and
75.
Li, W., Wu, Y., Min, F., Li, Z., Huang, J., and Huang, R.
Zhou, H. (2013) Association of endothelin converting
(2010) A nonhuman primate model of Alzheimer’s disease
enzyme 1b C 338A polymorphism with increased risk of
generated by intracranial injection of amyloid beta42 and
ischemic stroke in Chinese Han population, J. Mol.
thiorphan, Metab. Brain Dis., 25, 277 284, doi: 10.1007/
Neurosci., 51, 485 492, doi: 10.1007/s12031 013 0100 y.
s11011 010 9207 9.
82. Rodrigo, R., Fernández Gajardo, R., Gutiérrez, R.,
76.
Belyaev, N. D., Nalivaeva, N. N., Makova, N. Z., and
Matamala, J. M., Carrasco, R., et al. (2013) Oxidative
Turner, A. J. (2009) Neprilysin gene expression requires
stress and pathophysiology of ischemic stroke: novel thera
binding of the amyloid precursor protein intracellular
peutic opportunities, CNS Neurol. Disord. Drug Targets, 12,
domain to its promoter: implications for Alzheimer’s dis
698 714, doi: 10.2174/1871527311312050015.
ease, EMBO Rep., 10, 94 100, doi: 10.1038/embor.2008.
83. Urikova, A., Babusikova, E., Dobrota, D., Drgova, A.,
222.
Kaplan, P., et al. (2006) Impact of Ginkgo Biloba Extract
77.
Venugopal, C., Pappolla, M. A., and Sambamurti, K.
EGb 761 on ischemia/reperfusion - induced oxidative
(2007) Insulysin cleaves the APP cytoplasmic fragment at
stress products formation in rat forebrain, Cell. Mol.
multiple sites, Neurochem. Res.,
32,
22252234,
Neurobiol., 26, 1343 1353, doi: 10.1007/s10571 006 9030 3.
doi: 10.1007/s11064 007 9449 z.
84. Quan, H., Koltai, E., Suzuki, K., Aguiar, A. S. Jr.,
78.
Garc a de la Cadena, S., and Massieu, L. (2016) Caspases
Pinho, R., et al. (2020) Exercise, redox system and neu
and their role in inflammation and ischemic neuronal
rodegenerative diseases, Biochim. Biophys. Acta Mol. Basis
death. Focus on caspase 12, Apoptosis, 21, 763777,
Dis., 1866, 165778, doi: 10.1016/j.bbadis.2020.165778.
doi: 10.1007/s10495 016 1247 0.
85. Zhuravin, I. A., Dubrovskaya, N. M., Vasilev, D. S.,
79.
Kozlova, D. I., Vasylev, D. S., Dubrovskaya, N. M.,
Kozlova, D. I., Kochkina, E. G., et al. (2019) Regulation
Nalivaeva, N. N., Tumanova, N. L., and Zhuravin, I. A.
of neprilysin activity and cognitive functions in rats after
(2015) Role of caspase 3 in regulation of the amyloid
prenatal hypoxia, Neurochem. Res.,
44,
13871398,
degrading neuropeptidase neprilysin level in the rat cortex
doi: 10.1007/s11064 019 02796 3.
EFFECT OF GLOBAL BRAIN ISCHEMIA ON AMYLOID PRECURSOR
PROTEIN METABOLISM AND EXPRESSION
OF AMYLOID DEGRADING ENZYMES IN RAT CORTEX:
ROLE IN PATHOGENESIS OF ALZHEIMER’S DISEASE
E. Babusikova1, D. Dobrota1, A. J. Turner2, and N. N. Nalivaeva2,3*
1 Comenius University in Bratislava, Jessenius Faculty of Medicine in Martin,
Department of Medical Biochemistry, 036 01 Martin, Slovakia
2 School of Biomedical Sciences, Faculty of Biological Sciences, University of Leeds, Leeds, LS2 9JT United Kingdom
3 Sechenov Institute of Evolutionary Physiology and Biochemistry, Russian Academy of Sciences,
194223 St. Petersburg, Russia; E<mail: n.n.nalivaeva@leeds.ac.uk
The incidence of Alzheimer’s disease (AD) increases significantly following chronic stress and brain ischemia which,
over the years, cause accumulation of toxic amyloid species and brain damage. The effects of global 15 min ischemia
and 120 min reperfusion on the levels of expression of the amyloid precursor protein (APP) and its processing were
investigated in the brain cortex (Cx) of male Wistar rats. Additionally, the levels of expression of the amyloid degrad
ing enzymes neprilysin (NEP), endothelin converting enzyme 1 (ECE 1), and insulin degrading enzyme (IDE), as
well as of some markers of oxidative damage were assessed. It was shown that the APP mRNA and protein levels in
the rat Cx were significantly increased after the ischemic insult. Protein levels of the soluble APP fragments, especially
of sAPPβ produced by β secretase, (BACE 1) and the levels of BACE 1 mRNA and protein expression itself were also
increased after ischemia. The protein levels of APP and BACE 1 in the Cx returned to the control values after 120
min reperfusion. The levels of NEP and ECE 1 mRNA also decreased after ischemia, which correlated with the
decreased protein levels of these enzymes. However, we have not observed any changes in the protein levels of insulin
degrading enzyme. Contents of the markers of oxidative damage (di tyrosine and lysine conjugates with lipid peroxi
dation products) were also increased after ischemia. The obtained data suggest that ischemia shifts APP processing
towards the amyloidogenic β secretase pathway and accumulation of the neurotoxic Aβ peptide as well as triggers
oxidative stress in the cells. These results are discussed in the context of the role of stress and ischemia in initiation
and progression of AD.
Keywords: Alzheimer’s disease, amyloid precursor protein, β secretase, endothelin converting enzyme 1, global brain
ischemia, insulin degrading enzyme, neprilysin, stress
БИОХИМИЯ том 86 вып. 6 2021