БИОХИМИЯ, 2021, том 86, вып. 6, с. 857 - 870
УДК 577.25;616 092.9
ДЛИТЕЛЬНАЯ СОЦИАЛЬНАЯ ИЗОЛЯЦИЯ ПРИВОДИТ
К СНИЖЕНИЮ ЭКСПРЕССИИ ПРЕДШЕСТВЕННИКА BDNF
И ПРОЛИЛЭНДОПЕПТИДАЗЫ В СТРУКТУРАХ МОЗГА КРЫС
© 2021
С.Д. Ширенова*, Н.Н. Хлебникова, Н.А. Крупина
Федеральное государственное бюджетное научное учреждение
«Научно исследовательский институт общей патологии и патофизиологии»,
125315 Москва, Россия; электронная почта: Shirenova.jr@gmail.com
Поступила в редакцию 29.12.2020
После доработки 25.03.2021
Принята к публикации 15.04.2021
Стресс в раннем периоде развития человека и животных является фактором риска развития нарушений в
поведении и когнитивных расстройств. К числу таких стрессирующих воздействий относится социальная
изоляция в раннем постнатальном онтогенезе. Развитие нарушений поведения и когнитивных функций
связывают с нейропластическими изменениями в структурах мозга. В наших исследованиях показано, что
у крыс&самцов Wistar после 10 недель социальной изоляции развиваются нарушения в поведении и когни&
тивный дефицит, что сопровождается повышением относительного уровня экспрессии гена, кодирующего
сериновую протеазу пролилэндопептидазу (PREP, EC 3.4.21.26), во фронтальной коре мозга. Цель настоя&
щей работы заключалась в определении методом иммуноблоттинга уровня белков синаптофизина (SYP),
предшественника нейротрофического фактора мозга (proBDNF) и PREP в структурах мозга (гиппокампе,
фронтальной коре и стриатуме) крыс, находившихся в длительной социальной изоляции, в сравнении с жи&
вотными, находившимися на групповом содержании. Работа проведена на 20 крысах (10 самцов, 10 самок)
популяции Wistar. Крыс опытной группы (5 самцов и 5 самок) содержали поодиночке в течение 9 мес., на&
чиная с возраста 1 мес. В возрасте 10 мес. у социально изолированных крыс выявлены нарушения памяти в
тестах «Условный рефлекс пассивного избегания» и «Водный лабиринт Морриса» и снижение реакции на
новизну. Экспрессию белков SYP, proBDNF и PREP в структурах мозга крыс оценивали методом Вестерн&
блот с использованием моноклональных антител. Социальная изоляция привела к снижению уровня
proBDNF во фронтальной коре мозга у самок и снижению экспрессии PREP в стриатуме у самцов. Полу&
ченные данные предполагают участие системы нейротрофических факторов и PREP в механизмах развития
поведенческих и когнитивных нарушений, наблюдаемых у крыс в условиях длительной социальной изоля&
ции, начинающейся в раннем возрасте.
КЛЮЧЕВЫЕ СЛОВА: социальная изоляция, синаптофизин, предшественник BDNF, пролилэндопептида&
за, структуры мозга, Вестерн&блот.
DOI: 10.31857/S0320972521060087
ВВЕДЕНИЕ
циальных, когнитивных и речевых навыков в
критические периоды развития.
Стресс в раннем онтогенезе является факто&
Социальная изоляция (СИ) является сущест&
ром риска развития нарушений в поведении и
венным стрессором как для человека, так и для
когнитивных расстройств, ряда соматических
социальных животных, к которым относятся и
заболеваний [1-4]. К числу таких стрессирую&
грызуны [5, 6]. Сообщается о развитии у соци&
щих воздействий относится социальная изоля&
ально изолированных крыс признаков повы&
ция (депривация) в детском возрасте, сопро&
шенной агрессивности, нарушений мотивации,
вождающаяся ограничением сенсорной стиму&
гиперактивного фенотипа, когнитивного дефи&
ляции и недостаточностью формирования со&
цита [7]. Считается, что нейробиологической
основой этих сдвигов в поведении являются
нейропластические изменения в структурах
Принятые сокращения:ВЛМ - тест «Водный лаби&
ринт Морриса»; ГП - гиппокамп; ОП - тест «Открытое мозга [8] и нарушения эпигенетического прог&
поле»; СИ - социальная изоляция; СТР - стриатум; раммирования активности генома в раннем воз&
УРПИ - тест «Условный рефлекс пассивного избегания»;
расте [9-11].
ФК - фронтальная кора; BDNF - brain&derived neurotroph&
ic factor (нейротрофический фактор мозга); PREP - про&
К фундаментальным компонентам нейро&
лилэндопептидаза; SYP - синаптофизин.
пластичности относится пластичность синапти&
* Адресат для корреспонденции.
ческих связей, изменение которых зависит в
857
858
ШИРЕНОВА и др.
первую очередь от активности нейронов; эти
ние конверсии предшественника до зрелого
процессы, в свою очередь, определяются регу&
BDNF, обнаружено в ГП крыс на модели стрес&
ляцией синаптических белков [12]. Основным
са «двойного удара» (хроническое неонатальное
интегральным белком мембран малых (не со&
отлучение от матери и питьё раствора кортико&
держащих пептидов) синаптических везикул
стерона взрослыми животными) [30] и на моде&
нейронов является трансмембранный глико&
ли пренатального стресса [31]. Ранняя СИ, на&
протеин синаптофизин (SYP), к функциям ко&
чинавшаяся сразу после отлучения от матери и
торого относят формирование синаптических
продолжавшаяся
2
недели (постнатальные
пузырьков, выделение из них нейромедиаторов
дни 21-34), приводила к снижению предсти&
и синаптогенез [13, 14]. Данные о влиянии раз&
мульного торможения в тесте на сенсомоторную
ных видов хронического стресса (иммобилиза&
реактивность и эпигенетическим модификаци&
ционный, непредсказуемый, стресс отлучения
ям BDNF: увеличению экспрессии BDNF в ме&
новорождённых крысят от матери) на экспрес&
диальной префронтальной коре и снижению его
сию SYP противоречивы [15-21], что может
экспрессии в ГП у самцов крыс Sprague&
быть обусловлено как особенностями самого
Dawley [32]. Данных о том, изменяется ли уро&
стрессогенного воздействия, так и особенностя&
вень изоформ BDNF при стрессе длитель&
ми реагирования на стресс животных разных
ной СИ, и, если да, то как, в настоящее время
линий, пола и возраста. Данных по эффектам
нет.
стресса СИ немного, и они также неоднознач&
В наших исследованиях на модели СИ, на&
ны. Хронический
8&недельный стресс СИ
чинавшейся сразу после отлучения крысят от
взрослых самок Sprague&Dawley не изменял
матери и длившейся 2 мес., крысы&самцы
экспрессии SYP в гиппокампе (ГП) и гипотала&
Wistar демонстрировали повышенную агрес&
мусе [22], а 8&недельный стресс СИ самцов крыс
сивность, снижение предстимульного тормо&
Lister hooded, начинавшийся сразу после отлу&
жения и когнитивный дефицит, проявлявший&
чения крысят от матери, приводил к снижению
ся нарушением привыкания, о котором судили
экспрессии SYP в зубчатой извилине ГП [23].
по снижению амплитуды акустического
Двухнедельная СИ взрослых самцов крыс
стартл&ответа; это сопровождалось повышени&
Sprague&Dawley приводила к снижению экс&
ем во фронтальной коре (ФК) мозга относи&
прессии SYP и синаптической пластичности
тельного уровня экспрессии гена prep, кодиру&
в ГП [24]. Нам не удалось найти в научной лите&
ющего сериновую протеазу пролилэндопепти&
ратуре данных об экспрессии SYP в структурах
дазу (PREP, EC 3.4.21.26) [33]. PREP, протеаза с
мозга крыс при пролонгированной СИ.
плейотропным действием [34], вовлечена во
Ещё одним хорошо известным маркёром и
многие процессы, в том числе в процессы обу&
регулятором синаптической и нейрональной
чения и памяти, нейропластичности, по&види&
пластичности является BDNF - самый распро&
мому, вследствие взаимодействия с другими
странённый нейротрофин в мозге млекопитаю&
белками [35]. На модели смешанного тревожно&
щих, который относят к наиболее важным ме&
депрессивного состояния, индуцированного
диаторам стресс&ответа [25, 26]. BDNF регули&
действием одного из ингибиторов дипептидил&
рует выживаемость нейронов и их дифференци&
пептидазы IV (EC 3.4.14.5) в раннем постнаталь&
ровку, модулирует синаптическую функцию
ном периоде, у крыс&самцов Wistar с возрастом
(способствует долговременной потенциации,
показано повышение активности PREP в ФК,
структурному увеличению шипиков дендри&
гипоталамусе, прилежащем ядре и стриатуме
тов) [27]. BDNF первоначально синтезируется в
(СТР), у крыс&самок - в ГП и СТР [36]. У этих
форме pre&proBDNF&предшественника в эндо&
крыс обучение в тесте условного рефлекса ак&
плазматическом ретикулуме, транспортируется
тивного избегания проходило хуже, чем у жи&
в аппарат Гольджи, где образуется изоформа
вотных контрольной группы [37]. Тревожно&
proBDNF, из которой после отщепления после&
депрессивное состояние, индуцированное нео&
довательности про&домена образуется зрелый
натальным действием другого ингибитора ди&
BDNF (mBDNF) [28, 29]. Регулирующее дей&
пептидилпептидазы IV, сопровождалось повы&
ствие proBDNF и самого BDNF на синаптичес&
шением экспрессии гена prep в СТР [38]. На мо&
кую пластичность отличается, часто противопо&
делях экспериментальной ретроградной амне&
ложно. Предполагается, что proBDNF может
зии, вызванной действием м&холиноблокатора
быть ключевым регулятором синаптической
скополамина или максимальным электрошо&
пластичности и формирования нервных цепей в
ком, активность PREP в ФК и ГП самцов Wistar
подростковом возрасте, а эффекты сохраняются
возрастала [39]. Недавно мы показали, что дли&
у взрослых животных [27]. Нарушение баланса
тельная СИ крыс Wistar, начинавшаяся после
proBDNF и mBDNF, предполагающее торможе&
отлучения от матери и длившаяся 9 мес., ухуд&
БИОХИМИЯ том 86 вып. 6 2021
СОЦИАЛЬНАЯ ИЗОЛЯЦИЯ СНИЖАЕТ ЭКСПРЕССИЮ proBDNF И PREP
859
шала когнитивные способности самцов и самок
классического ОП, УРПИ и ВЛМ. Подробное
крыс в тестах условного рефлекса пассивного
описание процедур тестирования приведено в
избегания и пространственной памяти, причём
работе Krupina et al. [40].
эффект был более выражен у самок [40].
Тест автоматизированного «Открытого по
Цель настоящей работы заключалась в опре&
ля» (оценка двигательной активности). В автома&
делении методом иммуноблоттинга уровня бел&
тизированном ОП (аОП) с прозрачными стен&
ков SYP, proBDNF и PREP в структурах моз&
ками (арена размером 48 × 48 × 21 см) (Opto&
га (гиппокампе, фронтальной коре и стриатуме)
Varimex, «Columbus Instruments», США) двига&
крыс, находившихся в длительной социальной
тельную активность крыс оценивали в течение
изоляции, в сравнении с животными, которых
10
мин при мягком комнатном освещении
содержали в группах.
(17 люкс) в условных см (по числу прерываний
инфракрасных лучей).
Тест классического «Открытого поля» (оцен
МАТЕРИАЛЫ И МЕТОДЫ
ка двигательной активности и реакции на новиз
ну). В классическом ОП (кОП) (круглая белая
Моделирование социальной изоляции и оценка
арена диаметром 120 см разделена на 20 квадра&
поведения крыс. Оценка экспрессии белков SYP,
тов, высота непрозрачных стенок 28 см) двига&
proBDNF и PREP проведена на
20
кры&
тельную активность крыс оценивали в течение
сах (10 самцов, 10 самок) популяции Wistar,
трёх минут по числу пересечённых квадратов
рождённых и выращенных в питомнике
при ярком освещении (500-510 люкс в центре,
ФГБНУ «НИИОПП» (система «Меркурий», но&
400-410 люкс на периферии ОП). На четвертой
мер в реестре: RU 1487336). Эти животные были
минуте белый свет переключали на мягкий
отобраны из больших по объёму групп самцов и
красный (лампочка 40 Вт над центром ОП). Ре&
самок крыс Wistar, содержавшихся в социальной
акцию на новизну определяли по увеличению
изоляции или в группах в течение 9 мес. и про&
двигательной активности животных в ответ на
шедших поведенческое тестирование. У ото&
изменение окружающей среды [41]; фактором
бранных крыс масса каждого из образцов ткани
новизны в данном случае служила резкая смена
выделенных структур мозга была не ме&
освещённости. Рассчитывали отношение: (путь,
нее 100 мг, что необходимо для проведения ана&
пройденный за четвертую минуту при красном
лиза методом иммуноблоттинга без потери его
свете)/(путь, пройденный за первую минуту при
чувствительности. Результаты оценки поведе&
белом свете).
ния в исходных больших группах крыс в тестах
Тест «Условный рефлекс пассивного избега
«Открытое поле» (ОП), «Условный рефлекс пас&
ния». Выработку УРПИ проводили в установке,
сивного избегания» (УРПИ) и «Водный лаби&
разделённой опускающейся дверцей на «безо&
ринт Морриса» (ВЛМ) опубликованы
[40].
пасный» освещённый и «опасный» (с электри&
В настоящей работе мы также провели оценку
фицированным полом) неосвещённый отсеки.
поведения в данных тестах у крыс, отобранных в
Установку помещали в звукоизолированную ка&
эксперимент по определению уровня экспрес&
меру (Multi Conditioning System, «TSE Systems»,
сии белков в мозге, для того чтобы определить,
Германия). В первый день крысы привыкали к
насколько поведение животных в этой выборке
установке, исследуя светлый (156 люкс) отсек в
отражает выявленные ранее изменения в пове&
течение 60 с, и затем в течение 120 с получали
дении животных в больших группах. Начиная с
возможность посетить тёмный отсек. Через 24 ч
возраста 1 мес. и до выведения животных из экс&
проводили выработку УРПИ (этап обучения):
перимента в возрасте 10 мес., часть крыс содер&
крысу помещали в освещённый отсек установки,
жали в группах по 4-5 животных в клетках раз&
через 5 с разделительную дверцу автоматически
мером 57,0 × 37,0 × 19,0 см (группы «Контроль,
открывали, а через 1 с после перехода животного
самки», n = 5 и «Контроль, самцы», n = 5),
в неосвещённый отсек - закрывали; через 5 с
часть - поодиночке в клетках размером 36,5 ×
крыса получала удар током (0,5 мA, 1 Hz, в тече&
× 20,5 × 14,0 см (группы «Изоляция, самки»,
ние 5 с); через 30 с после этого крысу возвраща&
n = 5 и «Изоляция, самцы», n = 5). Животных
ли в клетку. Сохранение УРПИ проверяли через
содержали в стандартных условиях вивария с ес&
24 ч после выработки (Тестирование 1) и через
тественной сменой освещённости и свободным
неделю (Тестирование 2). На всех этапах фикси&
доступом к пище (ООО «Лабораторкорм», Рос&
ровали латентный период перехода из освещён&
сия) и воде.
ного отсека установки в неосвещённый отсек (с).
Перед выведением крыс из эксперимента
Процедура проверки была аналогичной проце&
оценивали двигательную активность и память
дуре выработки УРПИ за исключением того, что
животных в тестах автоматизированного ОП,
электрический ток при переходе в тёмный отсек
БИОХИМИЯ том 86 вып. 6 2021
860
ШИРЕНОВА и др.
не подавали. Максимально возможное время для
гибиторный микс 10 мкл/мл («Sigma&Aldrich»)]
перехода в тёмный отсек составляло 300 с.
и лизис&буфер&II [60 мМ HEPES, 150 мМ NaCl,
Тест «Водный лабиринт Морриса» (оценка
2 мМ EGTA, 1% (w/v) Triton X&100, 10% (v/v)
пространственной памяти). Установка ВЛМ
глицерин, 1 мМ DTT, протеазный ингибитор&
представляла собой бассейн круглой формы ди&
ный микс 10 мкл/мл; («Sigma&Aldrich»)]. Пробы
аметром 160 см, заполненный водой до высо&
лизировали в гипотоническом буфере&I
ты 30 см; температура воды составляла 25 ± 1 °С;
в течение 5 мин при 4 °С, затем супернатант от&
поведение крыс фиксировали с помощью прог&
деляли при помощи центрифугирования
раммного обеспечения (Video tracking system
[1000 об./мин, 5 мин, 4 °C («Eppendorf», Герма&
VideoMot2, «TSE Systems»). Пространство бас&
ния)]. Лизис буфером&II проводили в течение
сейна было виртуально разделено на 4 квадран&
25 мин при 4 °C, затем пробы повторно центри&
та. Во время обучения прозрачную платформу
фугировали [13 000 об./мин, 25 мин, 4 °C;
диаметром 14 см располагали в одном и том же
(«Eppendorf»)]. В цитоплазматический экстракт,
квадранте (целевой квадрант) так, чтобы она на&
содержащий исследуемые белки, добавляли за&
ходилась на 1,5 см ниже уровня воды. Визуаль&
грузочный буфер [0,5 М Tris&HСl, pH 6,8,
ные ключи располагали вне бассейна. Крыс на&
0,08 г/мл SDS, 5 мг/мл DTT, 0,2 мг/мл бромфе&
чинали обучать в возрасте 5,5 мес. В течение че&
ноловый синий, 40% (v/v) глицерин] в соотно&
тырёх последовательных дней крысе предостав&
шении 3/1 и инкубировали в течение 5 мин при
ляли 4 попытки найти скрытую платформу,
95 °C, далее образцы хранили при -80 °C.
стартовые квадранты чередовали в псевдослу&
Определение экспрессии белков SYP,
чайном порядке. Максимальная длительность
proBDNF и PREP методом иммуноблоттинга.
попытки составляла 2 мин. Выработку навыка
Концентрацию общего белка в образцах опреде&
проверяли в двухминутной пробе через 24 ч пос&
ляли спектрофотометрически по методу Бред&
ле последнего дня обучения; платформу из ла&
форда [42]. В каждую лунку 8%&ного (w/v) поли&
биринта убирали. Проверку сохранения навыка
акриламидного разрешающего геля загружали
проводили в тех же условиях через 4 мес. после
подготовленные образцы всех исследованных
обучения - у крыс в возрасте 9,5 мес. На следу&
белков (140 мкг общего белка/проба) и проводи&
ющий день после проверки крысе предоставля&
ли электрофорез 120 V, 90 мин), после чего раз&
ли 2 попытки (максимальная длительность -
делённые образцы переносили на целлюлозную
2 мин) с напоминанием места расположения
мембрану («Bio&Rad») при помощи электроэлю&
платформы, которую вновь помещали в целевой
ции (100 V, 60 мин). Блокирование неспецифи&
квадрант. Через сутки проводили третью про&
ческого связывания антител проводили путём
верку сохранения навыка при отсутствии плат&
погружения мембраны в 5%&ный раствор обез&
формы в бассейне. В пробах анализировали ла&
жиренного молока в PBS («Bio&Rad»), содержав&
тентность достижения зоны платформы и зоны,
ший 0,1% (v/v) Tween 20 и 0,02% азид Na, на 1 ч
прилежащей к платформе (10 см от края плат&
при 4 °C. Одновременно с этим первичные мо&
формы), относительное время, проведённое в
ноклональные антитела мыши к SYP
(2):
краевой зоне (дистальные 20% от радиуса бас&
sc&136271,
38-48 кДа, антитела мыши к
сейна). В настоящей работе даны результаты
proBDNF (5H8): sc&65514, 32 кДа, антитела мы&
сравнения всех групп крыс в последней провер&
ши к PREP (C&12): sc&365416, 80 кДа и антитела
ке, перед выведением животных из экспери&
мыши к β&Actin (C4): sc&47778, 43 кДа («Santa
мента.
Cruz Biotechnology Inc.», США) были преинку&
В возрасте 10 мес. всех крыс декапитировали
бированы при 4 °С в растворе молока (5% обез&
с использованием гильотины.
жиренного молока, 0,1% (v/v) Tween 20 и 0,02%
Подготовка проб. После декапитации крыс
азид Na в PBS). Затем мембрану инкубировали в
мозг быстро извлекали и помещали в охлаждён&
растворе первичных антител ещё 15 ч при 4 °C.
ный физиологический раствор. На ледяной под&
После промывания блоты в течение 60 мин ин&
ложке выделяли гиппокамп, фронтальную кору
кубировали в растворе вторичных антител (goat
и стриатум; до окончания сбора всех проб об&
anti&mouse IgG&HRP: ab6789 («Abcam», США)
разцы помещали в жидкий азот, в дальнейшем
при 4 °C. Белки выявляли при помощи ECL&ре&
пробы хранили в морозильнике Sanio MDF&
агента («Pierce Biotechnology», США). Затем
193 («Sanio», Япония) при -80 °C. Пробы расти&
мембрану помещали под фотоплёнку («Kodak»,
рали в жидком азоте. Для получения цитозоль&
США) на 10 мин. Для денситометрии получен&
ного экстракта использовали 2 лизис&буфера:
ных результатов использовали программу Adobe
гипотонический буфер&I [pH 7,5, 20 мМ Tris,
Photoshop 7.0 («Adobe Systems», США). Резуль&
«Bio&Rad», США), 1 мМ EDTA («Sigma&Aldrich»,
таты приведены в относительных денситомет&
США), 1 мМ DTT («Bio&Rad»), протеазный ин&
рических единицах (ОДЕ). Помимо оценки
БИОХИМИЯ том 86 вып. 6 2021
СОЦИАЛЬНАЯ ИЗОЛЯЦИЯ СНИЖАЕТ ЭКСПРЕССИЮ proBDNF И PREP
861
концентрации белка в образцах по методу Брэд&
dCohen = 2,928] (рис. 1, б). У крыс, находившихся
форда, в качестве дополнительного контроля
на изолированном содержании (самцы + сам&
равномерности загрузки проб производили ок&
ки), двигательная активность не отличалась от
рашивание нитроцеллюлозной мембраны на об&
двигательной активности крыс, содержавшихся
щий белок (Ponceau S) и измеряли экспрессию
в группах (самцы + самки) (U = 29,0; p = 0,123).
β&актина (белок внутреннего контроля).
Однако выявлено статистически значимое уве&
Статистическая обработка результатов. Ис&
личение двигательной активности у самцов, со&
пользовали алгоритмы программы Statistica 12.0.
державшихся в изоляции, по сравнению с сам&
Проверка по тесту Шапиро-Уилка не подтвер&
цами, содержавшимися в группах [U = 1,0;
дила соответствия распределения эмпирических
p = 0,016 (pкр = 0,025); η2 = 0,577; dCohen = 2,336].
данных нормальному закону по ряду показате&
У крыс, содержавшихся в изоляции (сам&
лей в небольших по объёму группах. На этом ос&
цы + самки), реакция на новизну была снижена
новании статистический анализ по всем показа&
по сравнению с крысами, которых содержали в
телям был проведён с помощью непараметри&
группах (U = 18,0; p = 0,015; η2 = 0,293;
ческого двустороннего U&критерия Манна-Уит&
dCohen = 1,286) (рис. 1, в). Не выявлено различий
ни для независимых переменных. Принятый
в реакции на новизну в зависимости от пола
уровень значимости составлял 5%. Для поправ&
крыс.
ки на множественность сравнений рассчитыва&
Тест УРПИ. На этапе обучения латентный
ли критическое значение p (pкр) по методу FDR&
период перехода в тёмный отсек установки в
контроля [43]. Соотношение pкр < p < 0,05 рас&
группах не различался (рис. 1, г). Через сутки
сматривали как выраженную тенденцию, соот&
после обучения снижение длительности латент&
ношение 0,05 < p < 0,06 - как тенденцию. До&
ного периода перехода в тёмный отсек у крыс&
полнительно рассчитывали размер эффекта
изолянтов (самцы + самки) по сравнению с жи&
(Effect size, ES). Использовали индексы оценоч&
вотными, находившимися на групповом содер&
ной статистики η2 (объяснённая дисперсия для
жании (самцы + самки), было статистически
выборки) и dCohen (Cohen’s d, стандартизирован&
значимым: U = 23,0; p = 0,043; η2 = 0,208;
ная мера эффекта) [44]. Применяли следующую
dCohen = 1,026) (рис. 1, д). На этапе проверки па&
интерпретацию размера эффекта dCohen: 0,20-
мяти через неделю после первого тестирования
0,40 - ES маленький, 0,50-0,70 - средний, от
латентный период перехода в тёмный отсек ус&
0,80 и выше - большой; η2: 0,010-0,039 - ма&
тановки у крыс&изолянтов (самцы + самки) так&
ленький, 0,060-0,110 - средний, 0,140-0,200 -
же был ниже, чем у крыс, содержавшихся в
большой [45].
группах (самцы + самки): U = 2,5; p < 0,001;
η2 = 0,645; dCohen = 2,694) (рис. 1, е). Выявлена
выраженная тенденция к уменьшению длитель&
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
ности латентного периода перехода в тёмный
отсек как у самцов, находившихся на изолиро&
Оценка поведения крыс. Тест автоматизиро
ванном содержании, по сравнению с самцами,
ванного «Открытого поля». Двигательная актив&
содержавшимися в группах [U = 0,0; p = 0,016
ность всех самок (содержавшихся в группах и
(pкр = 0,013); η2 = 0,682; dCohen = 2,928], так и у са&
изолированно) превышала двигательную актив&
мок, находившихся на изолированном содержа&
ность всех самцов (содержавшихся в группах и
нии, по сравнению с самками контрольной
изолированно) (U = 18,0; p = 0,015; η2 = 0,293;
группы [U = 2,0; p = 0,032 (pкр = 0,025);
dCohen = 1,286) (рис. 1, а), однако двигательная
η2 = 0,481; dCohen = 1,926]. На всех этапах провер&
активность всех крыс&изолянтов (самцы + сам&
ки памяти не выявлено различий по длитель&
ки) не отличалась от величины показателя у всех
ности латентного периода перехода в тёмный
крыс, содержавшихся в группах (U = 34,0;
отсек установки у крыс разного пола, находив&
p = 0,247). Статистически значимых различий
шихся в одних и тех же условиях содержания.
по данному показателю между крысами одного
Тест «Водный лабиринт Морриса». Все кры&
пола, содержавшимися в изоляции и в группах,
сы, которых содержали поодиночке (сам&
не выявлено.
цы + самки), не отличались от всех крыс, содер&
Тест классического «Открытого поля». В этом
жавшихся в группах, по относительному време&
тесте также двигательная активность у всех са&
ни, проведённому в краевой зоне лабирин&
мок была выше, чем у всех самцов (U = 23,5;
та: U = 31,0; p = 0,165. Не выявлено статистичес&
p = 0,043; η2 = 0,201; dCohen = 1,002), причём это
ки значимых различий по данному показателю
различие было обусловлено вкладом крыс, со&
при сравнении всех самок (содержавшихся в
державшихся в группах, а не в изоляции
группах и изолированно) со всеми самца&
[U = 0,0; p = 0,008 (pкр = 0,013); η2 = 0,682;
ми: U = 27,0; p = 0,089. Однако у самок, находив&
БИОХИМИЯ том 86 вып. 6 2021
862
ШИРЕНОВА и др.
Рис. 1. Показатели двигательной активности, обучения и памяти у крыс, находившихся в условиях длительной социаль&
ной изоляции (СИ), и контрольных животных (К) в возрасте 9-10 мес. В каждой группе n = 5. Тест автоматизированного
«Открытого поля» (аОП) (а) - двигательная активность, суммарно за 10 мин; тест классического «Открытого по&
ля» (кОП) (б) - двигательная активность, суммарно за 3 мин; в - реакция на новизну; тест «Условный рефлекс пассивно&
го избегания» (г) - латентный период перехода в тёмный отсек камеры на стадии обучения; д - тот же показатель на ста&
дии проверки сохранности памяти через 24 ч после обучения (Тестирование 1); е - через неделю после первой провер&
ки (Тестирование 2); тест «Водный лабиринт Морриса» (ж) - относительное время, проведённое в краевой зоне лабирин&
та; з - латентный период достижения зоны платформы; и - латентный период достижения зоны, прилежащей к платфор&
ме (обозначение по вертикальной оси - зона около платформы). * p < 0,05 - Статистически значимые различия между все&
ми самцами и всеми самками; # p < 0,05 - статистически значимые различия между всеми крысами, находившимися на
изолированном содержании, и всеми крысами, которых содержали в группах; ^ p < 0,05 - по сравнению с самцами, со&
державшимися в группах; + pкр < p < 0,05 - по сравнению с животными того же пола, находившимися на групповом со&
держании; & 0,05 < p < 0,06 - по сравнению с самками, находившимися на групповом содержании (U&критерий Манна-
Уитни с поправкой на множественность сравнений по методу FDR&контроля)
шихся в длительной изоляции, по сравнению с
платформе, позже крыс, содержавшихся в груп&
самками, содержавшимися в группах, обнару&
пах (самцы + самки): U = 22,0; p = 0,035;
жена тенденция к увеличению этого показате&
η2 = 0,224; dCohen = 1,075. По данным, приведён&
ля (рис. 1, ж): U = 3,0; p = 0,056; η2 = 0,394;
ным на рис. 1, и, видно, что у некоторых самок&
dCohen = 1,612.
изолянток был значительно увеличен латент&
Различий по длительности латентного пери&
ный период достижения зоны, прилежащей к
ода достижения зоны платформы между всеми
платформе. Однако статистический анализ вы&
крысами, содержавшимися в изоляции и в груп&
явил только тенденцию к увеличению этого по&
пах, а также между всеми самцами и самками не
казателя у самок, находившихся в изоляции, по
было обнаружено (рис. 1, з).
сравнению с контрольным значением у самок,
Крысы, содержавшиеся изолированно (сам&
содержавшихся в группах: U = 3,0; p = 0,056;
цы + самки), достигали зоны, прилежащей к η2 = 0,394; dCohen = 1,612.
БИОХИМИЯ том 86 вып. 6 2021
СОЦИАЛЬНАЯ ИЗОЛЯЦИЯ СНИЖАЕТ ЭКСПРЕССИЮ proBDNF И PREP
863
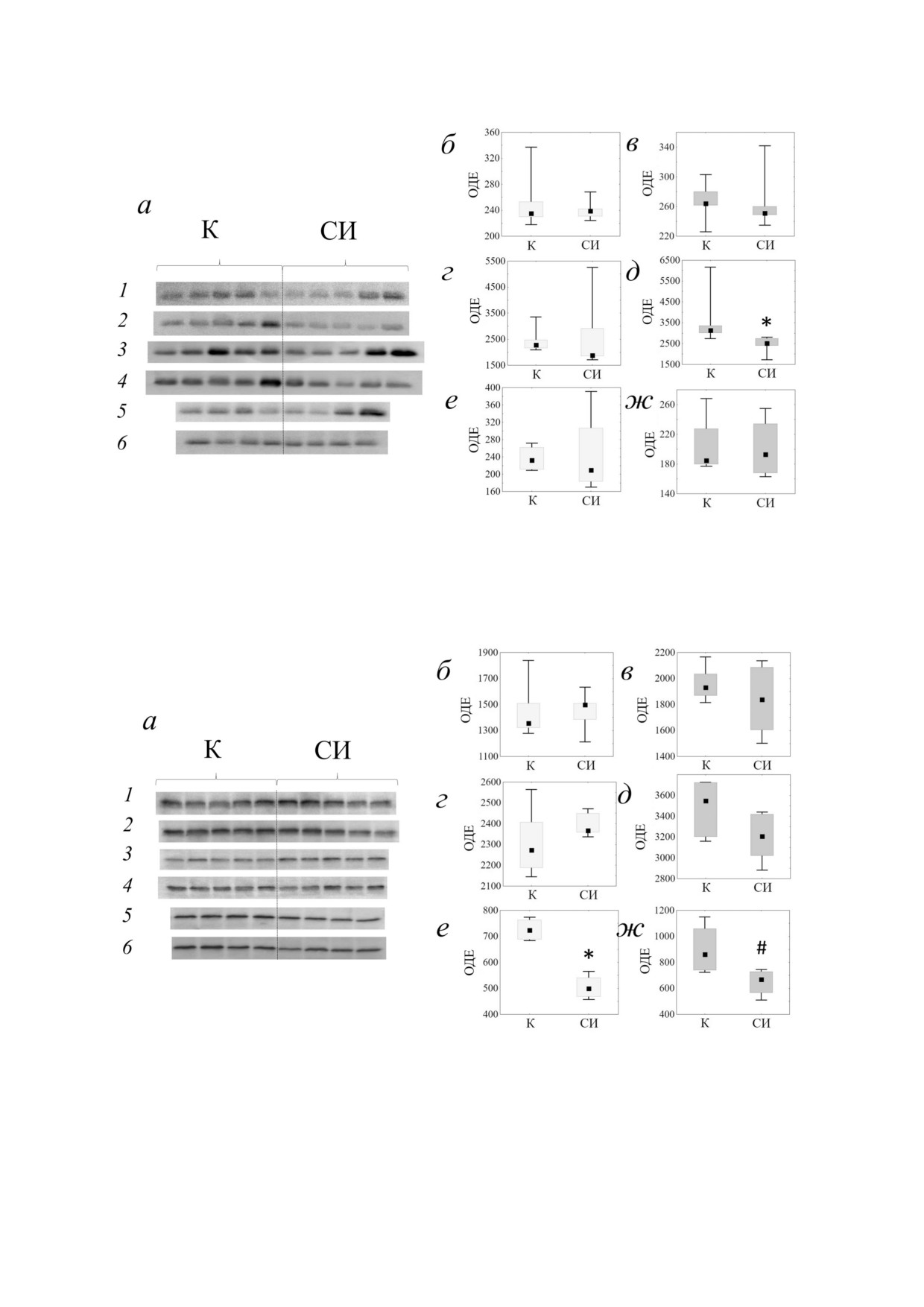
Экспрессия белков SYP, proBDNF и PREP в
чимо меньшей, чем у самцов, которых содержа&
структурах мозга. В ГП экспрессия SYP,
ли в группах (рис. 4, а (5), е): U = 0,0; p = 0,029;
proBDNF и PREP у крыс&изолянтов не отлича&
η2 = 0,667; dCohen = 2,828. У самок, находивших&
лась от экспрессии этих белков у животных того
ся на изолированном содержании, наблюдалась
же пола, которых содержали в группах
тенденция к снижению экспрессии PREP
(рис. 2, а (1 и 2), б и в; рис. 3, а (1 и 2), б и в;
(рис. 4, а (6), ж): U = 1,0; p = 0,057; η2 = 0,51;
рис. 4, а (1 и 2), б и в). Просматриваемое разли&
dCohen = 2,042. Отличий в содержании SYP и
чие в содержании SYP у самцов, которых содер&
proBDNF у крыс одного и того же пола, содер&
жали поодиночке и в группах (рис. 2, б), не дос&
жавшихся в социальной изоляции и в группах, в
тигло уровня статистической значимости:
СТР не выявлено.
U = 5,0; p = 0,151; η2 = 0,245; dCohen = 1,141.
Статистически значимых различий в
В ФК была обнаружена тенденция к сниже&
экспрессии β&актина в структурах мозга крыс,
нию экспрессии SYP у самцов, находившихся в
которых содержали в группах или в социальной
изоляции, по сравнению с самцами, содержав&
изоляции, не обнаружено. Результаты анализа
шимися в группах (рис. 2, а (3), г): U = 3,0;
уровня β&актина в структурах мозга методом им&
p = 0,056; η2 = 0,394; dCohen = 1,612. Экспрессия
муноблоттинга и примеры проявленных плёнок
proBDNF у самок, находившихся на изолиро&
и окрашенных на общий белок мембран с мар&
ванном содержании, была статистически значи&
кёрами молекулярных масс представлены
мо снижена по сравнению с экспрессией белка у
на рис. S1 и S2 в Приложении.
самок, которых содержали в группах (рис. 3, а
(4), д): U = 2,0; p = 0,032; η2 = 0,481; dCohen = 1,926.
Как у самцов, так и у самок крыс, находившихся
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
в изоляции, экспрессия PREP не отличалась от
экспрессии белка у животных, которых содержа&
В настоящей работе анализ поведения на ис&
ли в группах (рис. 4, а (3 и 4), г и д).
пользованной выборке крыс (n = 20) выявил бо&
В СТР экспрессия PREP у самцов, которых
лее высокую двигательную активность у самок
содержали в изоляции, была статистически зна& по сравнению с самцами в двух тестах ОП. Реак&
Рис. 2. Результаты анализа уровня SYP методом иммуноблоттинга (а) ГП самцов (1), ГП самок (2), ФК самцов (3), ФК са&
мок (4), СТР самцов (5) и СТР самок (6). б-ж - Уровень экспрессии SYP в структурах мозга крыс, содержавшихся в те&
чение 9 мес. в социальной изоляции (СИ) или в контрольных группах (К): ГП самцы (б), ГП самки (в), ФК самцы (г),
ФК самки (д), СТР самцы (е), СТР самки (ж). На блочной диаграмме нижняя сторона блока - Q1 (первый квартиль),
верхняя сторона блока - Q3 (третий квартиль), квадратиком в блоке отмечена медиана - Q2 (второй квартиль), высота
блока - интерквартильный размах. ОДЕ - относительные денситометрические единицы. 0,05 < # р < 0,06 сравнение с
крысами того же пола, находившимися на групповом содержании (двусторонний U&критерий Манна-Уитни)
БИОХИМИЯ том 86 вып. 6 2021
864
ШИРЕНОВА и др.
Рис. 3. Результаты анализа уровня proBDNF методом иммуноблоттинга (а) ГП самцов (1), ГП самок (2), ФК самцов (3),
ФК самок (4), СТР самцов (5), СТР самок (6). б-ж - Уровень экспрессии proBDNF в структурах мозга крыс, содержав&
шихся в течение 9 мес. в социальной изоляции (СИ) или в контрольных группах (К): ГП самцы (б), ГП самки (в), ФК сам&
цы (г), ФК самки (д), СТР самцы (е), СТР самки (ж). ОДЕ - относительные денситометрические единицы. * р < 0,05 -
сравнение с крысами того же пола, находившимися на групповом содержании (двусторонний U&критерий Манна-Уитни)
3800
Рис. 4. Результаты анализа уровня PREP методом иммуноблоттинга (а) ГП самцов (1), ГП самок (2), ФК самцов (3),
ФК самок (4), СТР самцов (5), СТР самок (6). б-ж - Уровень экспрессии PREP в структурах мозга крыс, содержавших&
ся в течение 9 мес. в социальной изоляции (СИ) или в контрольных группах (К): ГП самцы (б), ГП самки (в), ФК сам&
цы (г), ФК самки (д), СТР самцы (е), СТР самки (ж). ОДЕ - относительные денситометрические единицы. * р < 0,05;
# p < 0,06 - сравнение с крысами того же пола, находившимися на групповом содержании (двусторонний U&критерий
Манна-Уитни)
БИОХИМИЯ том 86 вып. 6 2021
СОЦИАЛЬНАЯ ИЗОЛЯЦИЯ СНИЖАЕТ ЭКСПРЕССИЮ proBDNF И PREP
865
ция на новизну в классическом ОП у крыс, со&
ной системе
[47]. Возможно, снижение
державшихся ~8 мес. в изоляции, была снижена
proBDNF в ФК у 10&месячных самок крыс отра&
независимо от пола. Эти данные принципиаль&
жает нейропластические изменения, возникшие
но схожи с данными, полученными в указанных
в раннем периоде развития, когда животные уже
тестах на больших группах крыс Wistar (размер
находились в условиях социальной изоляции.
всей выборки n = 69), подвергнутых социальной
Если такие изменения сопровождались дисба&
изоляции той же длительности [40]. Результаты
лансом proBDNF/mBDNF, то это могло быть
оценок когнитивных функций в тестах УРПИ
одним из механизмов, лежащих в основе боль&
и ВЛМ также свидетельствуют о сходной на&
шей уязвимости самок к стрессу длительной
правленности нарушений у крыс из малой и
СИ, начинавшейся в раннем возрасте. Есть сви&
большой выборок: независимо от пола СИ при&
детельства того, что функционирование сиг&
водила к ухудшению пассивного избегания и
нального каскада proBDNF-p75NTR в нейро&
пространственной памяти (по показателю дли&
нах взрослых мышей тормозило активность пи&
тельности латентного периода достижения зо&
рамидных клеток V&слоя энторинальной ко&
ны, прилежащей к платформе) (рис. S3 в При&
ры ГП, возбуждение которых является ключе&
ложении). Полученные данные позволяют гово&
вым компонентом рабочей и пространственной
рить о том, что малая выборка крыс, на которой
памяти [48]. Блокировка proBDNF антителами
оценивали уровень белков - маркёров нейро&
усиливала возбудимость пирамидных нейро&
пластичности и PREP в структурах мозга, по ха&
нов ГП.
рактеру нарушений поведения животных доста&
В ряде работ обнаружено, что когнитивные
точно хорошо представляет исходную большую
нарушения у крыс, индуцированные социаль&
группу крыс, подвергнутых длительной соци&
ной изоляцией, продолжавшейся от 4 до 8 не&
альной изоляции.
дель в разные периоды постнатального онтоге&
В настоящем исследовании снижение уров&
неза, сопровождались усилением экспрессии
ня proBDNF было выявлено только у самок, ко&
белков&маркёров апоптоза [49-51]. В экспери&
торых содержали поодиночке, и только в ФК.
ментах на культуре клеток симпатических ней&
Результаты, полученные в тесте на простран&
ронов выявлено, что proBDNF может оказывать
ственную память в ВЛМ на малой выборке, да&
проапоптотическое действие в случае образова&
ют основание предполагать, что в условиях хро&
ния комплекса рецепторов p75NTR (рецептор
нического стресса СИ память у самок может
нейротрофинов) и NTSR3/сортилина (не со&
быть хуже, чем у групповых крыс и у изолиро&
пряженный с G&белками рецептор нейротензи&
ванных самцов (рис. 1, ж и и). Это предположе&
на&3) [47]. Возможно, выявленное в настоящем
ние согласуется с заключением, сделанным в
исследовании снижение уровня proBDNF в ФК
нашем недавнем исследовании на большой вы&
у самок крыс с развившимся на фоне социаль&
борке крыс: в условиях длительной социальной
ной изоляции нарушением памяти является
изоляции, начинавшейся в раннем возрасте, у
адаптивным ответом на проапоптотическое
самок крыс по сравнению с самцами когнитив&
действие этого белка.
ные нарушения в парадигме ВЛМ более выра&
В нашем исследовании на малой выборке мы
жены, что может указывать на бóльшую уязви&
обнаружили лишь тенденцию к снижению уров&
мость самок к стрессу длительной СИ [40]. В ра&
ня SYP у самцов&изолянтов только в ФК. В ра&
боте Marco et al. [46] показано, что ухудшение
боте Carvalho&Netto et al. [52] показано, что им&
распознавания нового объекта, выявленное у
мунореактивность SYP в префронтальной коре
самок, но не у самцов крыс, подвергнутых
не подвергавшихся стрессу крыс Sprague&Dawley
стрессу суточной депривации от матери в ран&
была ниже у самцов по сравнению с самками.
нем постнатальном периоде, не сопровождалось
Авторы рассматривали этот факт, как свидетель&
различиями в снижении уровня экспрессии
ство половых различий в физиологической ор&
BDNF в ФК и ГП у крысят разного пола в под&
ганизации пресинаптической иннервации у
ростковом возрасте. Однако надо принять во
крыс, однако 14&дневный хронический непред&
внимание тот факт, что мы оценивали экспрес&
сказуемый стресс не изменял иммунореактив&
сию не зрелого BDNF, а только его предшест&
ность белка ни у самцов, ни у самок. В нашем
венника, регулирующего синаптическую плас&
исследовании хронический стресс был принци&
тичность и формирование нервных связей в
пиально другого характера и значительно боль&
подростковом возрасте [27]. Результаты настоя&
шей продолжительности, однако и в этом случае
щего исследования поддерживают гипотезу о
статистически значимых различий в экспрессии
том, что разнообразие функций нейротрофинов
SYP выявить не удалось. Надо отметить, что из&
может частично модулироваться регулируемым
менения уровня одного из маркёров нейроплас&
высвобождением зрелых и про&изоформ в нерв&
тичности BDNF (в настоящем исследовании -
8 БИОХИМИЯ том 86 вып. 6 2021
866
ШИРЕНОВА и др.
его незрелой формы proBDNF) или SYP в одной
изоляции? На первый взгляд, ответ должен
и той же структуре мозга может происходить без
быть, скорее, отрицательным, и выявленные из&
изменения уровня другого [53].
менения отражают включение независимых ме&
Неожиданным результатом настоящей рабо&
ханизмов - изменений в нейротрофической
ты является то, что при длительном 9&месячном
системе мозга и активности одной из пролин&
стрессе СИ нам не удалось выявить изменений
специфических пептидаз. Однако полностью
маркёров нейропластичности в ГП, тогда как
исключить такую взаимосвязь нельзя. Выше мы
при действии других видов стресса и менее про&
привели свидетельства того, что хроническая
должительной СИ (длительностью 2 и 8 недель)
СИ усиливает апоптоз в структурах моз&
такие изменения были многократно описа&
га [49-51], и этот процесс в определенных об&
ны [16, 20, 21, 23, 24]. Однако после острого
стоятельствах может быть запущен предшест&
стресса депривации от матери у крысят подрост&
венником BDNF [47]. Нам не удалось найти в
кового возраста обоего пола и при 8&недельной
научной литературе прямых доказательств связи
СИ взрослых самок крыс не было выявлено из&
PREP с процессами апоптоза. В экспериментах
менений уровня SYP в ГП [22, 46]. Можно пола&
с ингибиторами фермента были получены про&
гать, что одним из ключевых моментов в объяс&
тиворечивые данные: в работе Fiedorowicz
нении отсутствия изменения уровня маркёров
et al. [56] ингибирование PREP не предотвраща&
нейропластичности в ГП в нашем исследовании
ло индуцированную нейротоксином гибель гра&
является большой срок изоляции, за время ко&
нулярных нейронов зубчатой извилины ГП; в
торого могла произойти адаптация к нейроплас&
исследованиях других авторов, напротив, инги&
тическим изменениям, развившимся в раннем
биторы PREP эффективно предотвращали воз&
возрасте.
растной апоптоз культивируемых нейронов кор&
В настоящей работе, насколько нам извест&
ковых клеток головного мозга крысы и грану&
но, впервые получены данные о том, что дли&
лярных клеток мозжечка, а также отсроченную
тельная СИ приводит к снижению уровня
гибель нейронов ГП, индуцированную транзи&
PREP в СТР у самцов. У самок крыс статисти&
торной ишемией [цит. по 57]. Авторы работ, в
чески значимых изменений экспрессии PREP в
которых было показано нейропротективное
этой структуре выявить не удалось, хотя у жи&
действие ингибиторов PREP, считают, что это
вотных обоих полов была снижена реакция на
действие может быть опосредовано нейропеп&
новизну и ухудшалось обучение в тесте УРПИ.
тидами - субстратами фермента, которые участ&
Когнитивный дефицит, предположительно,
вуют в реализации антиапоптотических меха&
связывают с повышением активности PREP в
низмов. В контексте сказанного привлекает
структурах мозга, а некоторые ингибиторы
внимание нейропептид с промнестическим
PREP проявляют антиамнестические свой&
действием, нейротензин, который экспрессиру&
ства [39, 54]. В настоящее время нет ответа на
ется в стриатуме [58, 59] и расщепляется PREP
вопрос, сопровождается ли снижение уровня
[60, 61]. Нейротензин оказывает антиапоптоти&
PREP в СТР у самцов крыс, подвергнутых дли&
ческое действие в ЦНС через взаимодействие со
тельному стрессу СИ, изменением экспрессии
своими рецепторами, в частности, с NTSR3/
гена prep и активности фермента. О роли сни&
сортилином [62]. NTSR3/сортилин способен
жения уровня PREP можно судить, только со&
формировать гетеродимеры (белковые комп&
поставляя эти данные. Однако обращает на се&
лексы) с рецепторами нейротрофинов, в том
бя внимание тот факт, что изменение экспрес&
числе с p75NTR, что, как сказано выше, являет&
сии гена prep после 10&недельной СИ самцов
ся триггером proBDNF&индуцированной гибели
крыс, начинавшейся в раннем постнатальном
нейронов, а нейротензин способен противодей&
периоде, происходило в ФК [33], тогда как пос&
ствовать пронейротрофин&индуцированному
ле 9&месячной СИ изменение уровня белка
апоптозу путём конкуренции за сайт связыва&
PREP у самцов выявлены в другой структуре
ния NTSR3/сортилина, действуя как конкурент&
мозга - в СТР. В процессы обучения вовлечены
ный ингибитор [47, 63]. Если исходить из того,
обе структуры мозга [55]. Каким образом PREP
что пролонгированная СИ сопровождалась раз&
участвует в этих процессах у крыс разного пола,
витием процессов апоптоза у крыс (а это ещё
и происходит ли изменение её роли при увели&
нужно показать на данной модели), то можно
чении длительности социальной изоляции -
предположить, что у животных разного пола
ещё предстоит выяснить.
включились различные защитные механизмы: у
Возможна ли взаимосвязь выявленных изме&
самцов - снижение экспрессии PREP в СТР, ве&
нений экспрессии предшественника нейротро&
дущее к увеличению уровня антиапоптотичес&
фического фактора BDNF и белка PREP в мозге
кого субстрата нейротензина, у самок - сниже&
под влиянием стресса длительной социальной
ние экспрессии proBDNF в ФК, ведущее к
БИОХИМИЯ том 86 вып. 6 2021
СОЦИАЛЬНАЯ ИЗОЛЯЦИЯ СНИЖАЕТ ЭКСПРЕССИЮ proBDNF И PREP
867
уменьшению проапоптотических эффектов. Это
логии и патофизиологии (рег. № НИОКТР АА&
предположение требует серьёзной эксперимен&
АА&А19&119100790089&5).
тальной проверки.
Благодарности. Авторы выражают благодар&
Наше исследование имеет ограничения, что
ность доктору биологических наук Юлии Иго&
важно учитывать при интерпретации получен&
ревне Кировой за консультации и помощь в
ных данных. В первую очередь отметим, что вы&
проведении исследований методом иммуно&
борка крыс была невелика. Кроме того, помимо
блоттинга.
экспрессии белков, мы не оценивали экспрес&
Конфликт интересов. Авторы заявляют об от&
сию генов, кодирующих эти белки, и не оцени&
сутствии конфликта интересов.
вали, как сказано выше, активность пролинспе&
Соблюдение этических норм. Все процедуры и
цифической протеазы PREP. Мы не исследова&
эксперименты на животных проводили в соответ&
ли динамику нейропластичности и изменений
ствии с «Правилами надлежащей лабораторной
активности фермента в условиях пролонгиро&
практики», утверждёнными приказом Министер&
ванного стресса социальной изоляции. Прини&
ства здравоохранения РФ № 199н от 01.04.2016,
мая во внимание сказанное, мы рассматриваем
и ГОСТ 33215&2014, 33216&2014 «Руководство по
настоящую работу как пилотное исследование,
содержанию и уходу за лабораторными живот&
продолжение которого позволит получить но&
ными» под контролем Этического комитета
вые данные о влиянии продолжительного стрес&
ФГБНУ «НИИОПП» (протокол утверждения
са социальной изоляции на состояние нейро&
проекта исследования № 6 от 23.11.2018, прото&
трофической системы мозга и роли PREP в ин&
кол окончательного утверждения проведённого
дуцированных стрессом нарушениях поведения
исследования № 3 от 16.06.2020). Все примени&
и когнитивных функций у крыс в зависимости
мые международные, национальные и/или инс&
от пола животных.
титуциональные принципы ухода и использова&
ния животных были соблюдены.
Дополнительные материалы. Приложение к
Финансирование. Работа выполнена при фи&
статье на английском языке опубликовано на
нансовой поддержке Российского фонда фунда&
сайте журнала «Biochemistry» (Moscow) (http://
ментальных исследований (грант № 20&315&
protein.bio.msu.ru/biokhimiya/) и на сайте из&
90110) и государственного задания ФГБНУ «На&
учно&исследовательский институт общей пато&
journal/10541), том 86, вып. 6, 2021.
СПИСОК ЛИТЕРАТУРЫ
1.
Walker, A. J., Kim, Y., Price, J. B., Kale, R. P.,
6. Schweinfurth, M. K. (2020) The social life of Norway rats
McGillivray, J. A., et al. (2014) Stress, inflammation, and
(Rattus norvegicus), Elife, 9, e54020, doi: 10.7554/
cellular vulnerability during early stages of affective disor&
eLife.54020.
ders: biomarker strategies and opportunities for prevention
7. Fone, K. C., and Porkess, M. V. (2008) Behavioural and
and intervention, Front. Psychiatry, 5, 34, doi: 10.3389/
neurochemical effects of post&weaning social isolation in
fpsyt.2014.00034.
rodents - relevance to developmental neuropsychiatric
2.
Vargas, J., Junco, M., Gomez, C., and Lajud, N. (2016)
disorders, Neurosci. Biobehav. Rev.,
32,
1087&1102,
Early life stress increases metabolic risk, HPA axis reactiv&
doi: 10.1016/j.neubiorev.2008.03.003.17.
ity, and depressive&like behavior when combined with post&
8. Liu, N., Wang, Y., An, A. Y., Banker, C., Qian, Y.&H., and
weaning social isolation in rats, PLoS One, 11, e0162665,
O’Donnell, J. M. (2020) Single housing&induced effects
doi: 10.1371/journal.pone.0162665.
on cognitive impairment and depression&like behavior in
3.
Friedler, B., Crapser, J., and McCullough, L. (2015) One is
male and female mice involve neuroplasticity&related sig&
the deadliest number: the detrimental effects of social iso&
naling, Eur. J. Neurosci., 52, 2694&2704, doi: 10.1111/
lation on cerebrovascular diseases and cognition, Acta
ejn.14565.
Neuropathol., 129, 493&509, doi: 10.1007/s00401&014&
9. Siuda, D., Wu, Z., Chen, Y., Guo, L., Linke, M., et al.
1377&9.
(2014) Social isolation&induced epigenetic changes in mid&
4.
Duffy, K. A., McLaughlin, K. A., and Green, P. A. (2018)
brain of adult mice, J. Physiol. Pharmacol., 65, 247&255.
Early life adversity and health&risk behaviors: proposed
10. Murgatroyd, C., Patchev, A., Wu, Y., Micale, V.,
psychological and neural mechanisms, Ann. N. Y. Acad.
Bockmühl, Y., et al. (2009) Dynamic DNA methylation
Sci., 1428, 151&169, doi: 10.1111/nyas.13928.
programs persistent adverse effects of early&life stress, Nat.
5.
Mumtaz, F., Khan, M. I., Zubair, M., and Dehpour, A. R.
Neurosci., 12, 1559&1566, doi: 10.1038/nn.2436.
(2018) Neurobiology and consequences of social isolation
11. Gapp, K., von Ziegler, L., Tweedie&Cullen, R Y., and
stress in animal model - a comprehensive review, Biomed.
Mansuy, I. M. (2014) Early life epigenetic programming
Pharmacother., 105, 1205&1222, doi: 10.1016/j.biopha.
and transmission of stress&induced traits in mammals,
2018.05.086.
BioEssays, 36, 491&502, doi: 10.1002/bies.201300116.
БИОХИМИЯ том 86 вып. 6 2021
8*
868
ШИРЕНОВА и др.
12.
Gulyaeva, N. V. (2017) Molecular mechanisms of neuro&
25.
Bondar, N. P., and Merkulova, T. I. (2016) Brain&derived
plasticity: an expanding universe, Biochemistry (Moscow),
neurotrophic factor and early&life stress: Multifaceted
82, 237&242, doi: 10.1134/S0006297917030014.
interplay, J. Biosci., 41, 751&758, doi: 10.1007/s12038&016&
13.
Korzhevskii, D. E., Petrova, E. S., Kirik, O. V., Beznin,
9648&3.
G. V., and Sukhrukova, E. G. (2010) Neural markers used
26.
Paltsyn, A. A. (2019) Neurotrophic brain factor - BDNF,
for investigation of differentiation of stem cells, Geny
Patogenez, 17, 83&88, doi: 10.25557/2310&0435.2019.03.83&88.
Kletki, 5, 57&63.
27.
Hempstead, B. L. (2015) Brain&derived neurotrophic fac&
14.
Kolos, E. A., Grigoriev, I. P., and Korzhevskii, D. E.
tor: three ligands, many actions, Trans. Am. Clin. Climatol.
(2015) Marker of synaptic contacts - synaptophisin,
Assoc., 126, 9&19.
Morfologiya, 147, 79&83.
28.
Giacobbo, L. B., Doorduin, J., Klein, H. C., Dierckx,
15.
Hao, Y., Shabanpoor, A., and Metz, G. A. (2017) Stress
R. A. J. O., Bromberg, E., and de Vries, E. F. J. (2019)
and corticosterone alter synaptic plasticity in a rat model of
Brain&derived neurotrophic factor in brain disorders: focus
Parkinson’s disease, Neurosci. Lett.,
651,
79&87,
on neuroinflammation, Mol. Neurobiol., 56, 3295&3312,
doi: 10.1016/j.neulet.2017.04.063.
doi: 10.1007/s12035&018&1283&6.
16.
Xu, H., He, J., Richardson, J. S., and Li, X. M. (2004) The
29.
Wang, M., Xie, Y., and Qin, D. (2021) Proteolytic cleavage
response of synaptophysin and microtubule&associated
of proBDNF to mBDNF in neuropsychiatric and neu&
protein 1 to restraint stress in rat hippocampus and its
rodegenerative diseases, Brain Res. Bull., 166, 172&184,
modulation by venlafaxine, J. Neurochem., 91, 1380&1388,
doi: 10.1016/j.brainresbull.2020.11.005.
doi: 10.1111/j.1471&4159.2004.02827.x.
30.
Hill, R. A., Klug, M., Kiss Von Soly, S., Binder, M. D.,
17.
Gemmel, M., Kokras, N., Dalla, C., and Pawluski, J. L.
Hannan, A. J., and van den Buuse, M. (2014) Sex&specific
(2018) Perinatal fluoxetine prevents the effect of pre&gesta&
disruptions in spatial memory and anhedonia in a “two hit”
tional maternal stress on 5&HT in the PFC, but maternal
rat model correspond with alterations in hippocampal
stress has enduring effects on mPFC synaptic structure in
brain&derived neurotrophic factor expression and signaling.
offspring, Neuropharmacology, 128, 68&180, doi: 10.1016/
Hippocampus, 24, 1197&1211, doi: 10.1002/hipo.22302.
j.neuropharm.2017.10.009.
31.
Yeh, C. M., Huang, C. C., and Hsu, K. S. (2012) Prenatal
18.
Zhang, L., Luo, J., Zhang, M., Yao, W., Ma, X., and Yu,
stress alters hippocampal synaptic plasticity in young rat
S. Y. (2014) Effects of curcumin on chronic, unpredictable,
offspring through preventing the proteolytic conversion of
mild, stress&induced depressive&like behaviour and struc&
pro&brain&derived neurotrophic factor (BDNF) to mature
tural plasticity in the lateral amygdala of rats, Int. J.
BDNF, J. Physiol., 590, 991&1010, doi: 10.1113/jphysiol.
Neuropsychopharmacology, 17, 793&806, doi: 10.1017/
2011.222042.
S1461145713001661.
32.
Li, M., Du, W., Shao, F., and Wang, W. (2016) Cognitive
19.
Hescham, S., Grace, L., Kellaway, L. A., Bugarith, K., and
dysfunction and epigenetic alterations of the BDNF gene
Russell, V. A. (2009) Effect of exercise on synaptophysin
are induced by social isolation during early adolescence,
and calcium/calmodulin&dependent protein kinase levels
Behav. Brain Res., 313, 177&183, doi: 10.1016/j.bbr.2016.
in prefrontal cortex and hippocampus of a rat model of
07.025.
developmental stress, Metab. Brain Dis., 24, 701&709,
33.
Zubkov, E. A., Zorkina, Ya. A., Orshanskaya, E. V.,
doi: 10.1007/s11011&009&9165&2.
Khlebnikova, N. N., Krupina, N. A., and Chekhnin, V. P.
20.
Andersen, S. L., and Teicher, M. H. (2004) Delayed effects
(2019) Post&weaning social isolation disturbs gene expres&
of early stress on hippocampal development,
sion in rat brain structures, Bull. Exper. Biol. Med., 166,
Neuropsychopharmacology, 29, 1988&1993, doi: 10.1038/
364&368, doi: 10.1007/s10517&019&04351&0.
sj.npp.1300528.
34.
Garc a&Horsman, J. A. (2020) The role of prolyl oligopep&
21.
Dandi, Е., Kalamari, A., Touloumi, O., Lagoudaki, R.,
tidase, understanding the puzzle, Ann. Transl. Med., 8,
Nousiopoulou, E., et al. (2018) Beneficial effects of envi&
983, doi: 10.21037/atm&20&3412.
ronmental enrichment on behavior, stress reactivity and
35.
Männistö, P. T., and Garc a&Horsman, J. A. (2017) Mecha&
synaptophysin/BDNF expression in hippocampus follow&
nism of action of prolyl oligopeptidase (PREP) in degener&
ing early life stress, Int. J. Dev. Neurosci., 67, 19&32,
ative brain diseases: has peptidase activity only a modulato&
doi: 10.1016/j.ijdevneu.2018.03.003
ry role on the interactions of PREP with proteins? Front.
22.
Ramos&Ortolaza, D. L., Doreste&Mendez, R. J., Alvarado&
Aging Neurosci., 9, 27, doi: 10.3389/fnagi.2017.00027.
Torres, J. K., and Torres&Reveron, A. (2017) Ovarian hor&
36.
Kushnareva, E. Yu., Krupina, N. A., Khlebnikova, N. N.,
mones modify anxiety behavior and glucocorticoid recep&
Zolotov, N. N., and Kryzhanovskii, G. N. (2011) Activities
tors after chronic social isolation stress, Behav. Brain Res.,
of proline&specific peptidases in brain structures of rats
328, 115&122, doi: 10.1016/j.bbr.2017.04.016.
with experimental anxiety&depressive state caused by
23.
Varty, G. B., Marsden, C. A., and Higgins, G. A. (1999)
administration dipeptidyl peptidase IV inhibitor in the
Reduced synaptophysin immunoreactivity in the dentate gyrus
early postnatal period, Bull. Exp. Biol. Med., 151, 675&679,
of prepulse inhibition&impaired isolation&reared rats, Brain
doi: 10.1007/s10517&011&1413&x.
Res., 824, 197&203, doi: 10.1016/s0006&8993(99)01173&7.
37.
Khlebnikova, N. N., Krupina, N. A., Kushnareva, E. Yu.,
24.
Das, S. K., Baitharu, I., Barhwal, K., Hota, S. K., and
and Orlova, I. N. (2015) Differences in active avoidance
Singh, S. B. (2016) Early mood behavioral changes follow&
conditioning in male and female rats with experimental anx&
ing exposure to monotonous environment during isolation
iety&depressive disorder, Bull. Exp. Biol. Med., 159, 337&340,
stress is associated with altered hippocampal synaptic plas&
doi: 10.1007/s10517&015&2956&z.
ticity in male rats, Neurosci. Lett.,
612,
231&237,
38.
Zubkov, E. A., Zorkina, Y. A., Orshanskaya, E. V.,
doi: 10.1016/j.neulet.2015.12.038.
Khlebnikova, N. N., Krupina, N. A., and Chekhonin, V. P.
БИОХИМИЯ том 86 вып. 6 2021
СОЦИАЛЬНАЯ ИЗОЛЯЦИЯ СНИЖАЕТ ЭКСПРЕССИЮ proBDNF И PREP
869
(2017) Changes in gene expression profiles in adult rat
isolation&induced memory impairment by enhancing silent
brain after neonatal action of dipeptidyl peptidase&IV
information regulator&1 expression in rats, J. Exerc.
inhibitors, Neuropsychobiology, 76, 89&99, doi: 10.1159/
Rehabil., 16, 227&233, doi: 10.12965/jer.2040400.200.
000488367.
52.
Carvalho&Netto, E. F., Myers, B., Jones, K., Solomon,
39.
Nazarova, G. A., Zolotov, N. N., Krupina, N. A.,
M. B., and Herman, J. P. (2011) Sex differences in synap&
Kraineva, V. A., Garibova, T. L., and Voronina, T. A. (2007)
tic plasticity in stress&responsive brain regions following
Changes in proline&specific peptidase activity in experi&
chronic variable stress, Physiol. Behav., 104, 242&247,
mental model of retrograde amnesia, Eksperim. klinich.
doi: 10.1016/j.physbeh.2011.01.024.
farmakol., 70, 6&8, doi: 10.30906/0869&2092&2007&70&6&
53.
Yau, S. Y., Li, A., Zhang, E. D., Christie, B. R., Xu, A.,
6&8.
et al. (2014) Sustained running in rats administered corti&
40.
Krupina, N. A., Shirenova, S. D., and Khlebnikova, N. N.
costerone prevents the development of depressive behaviors
(2020) Prolonged social isolation, started early in life,
and enhances hippocampal neurogenesis and synaptic plas&
impairs cognitive abilities in rats depending on sex,
ticity without increasing neurotrophic factor levels, Cell
Brain Sci., 10, 799, doi: 10.3390/brainsci10110799.
Transplant., 23, 481&492, doi: 10.3727/096368914X678490.
41.
Hall, F. S., Humby, T., Wilkinson, L., and Robbins, T.
54.
Babkova, K., Korabecny, J., Soukup, O., Nepovimova, E.,
(1997) The effects of isolation&rearing of rats on behav&
Jun, D., and Kuca, K. (2017) Prolyl oligopeptidase and its
ioural responses to food and environmental novelty,
role in the organism: attention to the most promising and
Physiol. Behav.,
62,
281&290, doi:
10.1016/S0031&
clinically relevant inhibitors, Future Med. Chem., 9, 1015&
9384(97)00115&7.
1038, doi: 10.4155/fmc&2017&0030.
42.
Bradford, M. M. (1976) A rapid and sensitive method for
55.
Yavas, E., Gonzalez, S., and Fanselow, M. S. (2019)
the quantitation of microgram quantities of protein utiliz&
Interactions between the hippocampus, prefrontal cortex,
ing the principle of protein&dye binding, Anal. Biochem.,
and amygdala support complex learning and memory,
72, 248&254, doi: 10.1006/abio.1976.9999.
F1000Res., 31, 8, doi: 10.12688/f1000research.19317.1.
43.
Benjamini, Y., and Hochberg, Y. (1995) Controlling the
56.
Fiedorowicz, A., Figiel, I., Kamińska, B., Zaremba, M.,
false discovery rate: a practical and powerful approach to
Wilk, S., and Oderfeld&Nowak, B. (2001) Dentate granule
multiple testing, J. R. Stat. Soc. Ser. B, 57, 289&300,
neuron apoptosis and glia activation in murine hippocam&
doi: 10.1111/j.2517&6161.1995.tb02031.x.
pus induced by trimethyltin exposure, Brain Res., 912,
44.
Psychometrica: Computation of effect sizes. 11. Effect size
116&127, doi: 10.1016/s0006&8993(01)02675&0.
calculator for non¶metric tests: Mann&Whitney&U,
57.
Bär, J. W., Rahfeld, J.&U., Schulz, I., Gans, K., Ruiz&
Carrillo, D., et al. (2006) Prolyl endopeptidase cleaves the
psychometrica.de/effect_size.html.
apoptosis rescue peptide humanin and exhibits an
45.
Cohen, J.
(1988) Statistical Power Analysis for the
unknown post&cysteine cleavage specificity, Adv. Exp. Med.
Behavioral Sciences, Edn. 2, Hillsdale, Erlbaum.
Biol., 575, 103&108, doi: 10.1007/0&387&32824&6_11.
46.
Marco, E. M., Valero, M., de la Serna, O., Aisa, B.,
58.
Zahm, D. S. (1987) Neurotensin&immunoreactive neurons
Borcel, E., et al. (2013) Maternal deprivation effects on
in the ventral striatum of the adult rat: ventromedial cau&
brain plasticity and recognition memory in adolescent
date&putamen, nucleus accumbens and olfactory tubercle,
male and female rats, Neuropharmacology, 68, 223&231,
Neurosci. Lett.,
81,
41&47, doi:
10.1016/0304&
doi: 10.1016/j.neuropharm.2012.08.014.
3940(87)90337&5.
47.
Teng, H. K., Teng, K. K., Lee, R., Wright, S., Tevar, S.,
59.
Liu, Q., Hazan, A., Grinman, E., and Angulo, J. A. (2017)
et al. (2005) ProBDNF induces neuronal apoptosis via
Pharmacological activation of the neurotensin receptor 1
activation of a receptor complex of p75NTR and sortilin,
abrogates the methamphetamine&induced striatal apopto&
J. Neurosci., 25, 5455&5463, doi: 10.1523/JNEUROSCI.
sis in the mouse brain, Brain Res., 1659, 148&155,
5123&04.2005.
doi: 10.1016/j.brainres.2017.01.029.
48.
Gibon, J., Buckley, S. M., Unsain, N., Kaartinen, V.,
60.
Jalkanen, A. J., Puttonen, K. A., Venäläinen, J. I.,
Seguela, P., and Barker, P. A. (2015) proBDNF and
Sinervä, V., Mannila, A., et al. (2006) Beneficial effect of
p75NTR control excitability and persistent firing of corti&
prolyl oligopeptidase inhibition on spatial memory in
cal pyramidal neurons, J. Neurosci., 35, 9741&9753,
young but not in old scopolamine&treated rats, Basic Clin.
doi: 10.1523/jneurosci.4655&14.2015.
Pharmacol. Toxicol., 100, 132&138, doi: 10.1111/j.1742&
49.
Park, S.&S, Park, H. S., Kim, T. W., and Lee, S. J. (2020)
7843.2006.00021.x.
Effects of swimming exercise on social isolation&induced
61.
Peltonen, I., Myöhänen, T. T., and Männistö, P. T. (2012)
memory impairment and apoptosis in old rats, J. Exerc.
Different interactions of prolyl oligopeptidase and neu&
Rehabil., 16, 234&241, doi: 10.12965/jer.2040366.183.
rotensin in dopaminergic function of the rat nigrostriatal
50.
Park, H.&S., Kim, T.&W., Park, S.&S., Lee, S.&J. (2020)
and mesolimbic pathways, Neurochem. Res., 37, 2033&
Swimming exercise ameliorates mood disorder and memo&
2041, doi: 10.1007/s11064&012&0825&y.
ry impairment by enhancing neurogenesis, serotonin
62.
Devader, C., Béraud&Dufour, S., Coppola, T., and
expression, and inhibiting apoptosis in social isolation rats
Mazella, J. (2013) The anti&apoptotic role of neurotensin,
during adolescence, J. Exerc. Rehabil., 16, 132&140,
Cells, 2, 124&135, doi: 10.3390/cells2010124.
doi: 10.12965/jer.2040216.108.
63.
Nykjaer, A., and Willnow, T. E. (2012) Sortilin: a receptor
51.
Kim, T.&W., Park, S.&S., Shin, M.&S., Park, H.&S., and
to regulate neuronal viability and function, Trends
Baek, S.&S. (2020) Treadmill exercise ameliorates social
Neurosci., 35, 261270, doi: 10.1016/j.tins.2012.01.003.
БИОХИМИЯ том 86 вып. 6 2021
870
ШИРЕНОВА и др.
LONGXTERM SOCIAL ISOLATION REDUCES BDNF PRECURSOR
AND PROLYL ENDOPEPTIDASE EXPRESSION
IN RAT BRAIN STRUCTURES
S. D. Shirenova*, N. N. Khlebnikova, and N. A. Krupina
Institute of General Pathology and Pathophysiology, 125315 Moscow, Russia; E mail: Shirenova.jr@gmail.com
Early&life stress is a risk factor for the development of behavioral and cognitive disorders in humans and animals. Such
stressful situations include social isolation in early postnatal ontogenesis. Behavioral and cognitive impairments asso&
ciated with neuroplastic changes in brain structures. We have found that after ten weeks of social isolation, male Wistar
rats show behavioral abnormalities and cognitive deficit, accompanied by an increase in the relative expression of gene
encoding serine protease prolyl endopeptidase (PREP, EC 3.4.21.26) in the brain frontal cortex. The present study
aimed to assess synaptophysin (SYP), brain&derived neurotrophic factor precursor (proBDNF), and PREP expres&
sion using Western blot in the brain structures - the hippocampus, frontal cortex, and striatum of the rats subjected
to prolonged social isolation compared with group&housed animals. Twenty Wistar rats were used for this study
(10 males and 10 females). Experimental animals (5 males and 5 females) were kept one per cage for nine months,
starting from the age of one month. Ten&month&old socially isolated rats showed memory deficit in passive avoidance
paradigm and Morris Water Maze and reactivity to novelty reduction. We used monoclonal antibodies for the Western
blot analysis of the expression of SYP, proBDNF, and PREP in the rat brain structures. Social isolation caused a
proBDNF expression reduction in the frontal cortex in females and a reduction in PREP expression in the striatum
in males. These data suppose that neurotrophic factors and PREP are involved in the mechanisms of behavioral and
cognitive impairments observed in the rats subjected to prolonged social isolation with an early life onset.
Keywords: social isolation, neuroplasticity, synaptophysin, BDNF precursor, prolyl endopeptidase, brain structures,
Western blot
БИОХИМИЯ том 86 вып. 6 2021