БИОХИМИЯ, 2021, том 86, вып. 6, с. 894 - 903
УДК 612.014; 57.052; 57.053; 57.054
СОВРЕМЕННЫЕ ПРЕДСТАВЛЕНИЯ О РОЛИ
СТРЕССА В ПАТОГЕНЕЗЕ ХРОНИЧЕСКИХ
НЕЙРОДЕГЕНЕРАТИВНЫХ ЗАБОЛЕВАНИЙ
Обзор
© 2021
Л.Г. Хаспеков
ФГБНУ «Научный центр неврологии», 125367 Москва, Россия; электронная почта: khaspekleon@mail.ru
Поступила в редакцию 05.03.2021
После доработки 26.04.2021
Принята в печать 26.04.2021
В обзоре обобщены данные литературы о клеточных и молекулярных механизмах, опосредующих влияние
стресса на патогенез нейродегенеративных форм церебральной патологии (болезнь Альцгеймера, болезнь
Паркинсона и др.). Представлены современные сведения о роли стресса в гиперфосфорилировании тау"
белка, агрегации бета"амилоида, гиперактивации гипоталамо"гипофизарно"надпочечниковой оси,
участвующей в гиперпродукции факторов, способствующих усилению патогенетической роли стресса в
нейродегенерации. Приведены данные об участии микроглии в медиации стрессового воздействия на
патогенез нейродегенеративных заболеваний.
КЛЮЧЕВЫЕ СЛОВА: стресс, нейродегенерация, деменция, болезнь Альцгеймера, болезнь Паркинсона.
DOI: 10.31857/S0320972521060117
ВВЕДЕНИЕ
ниям, патогенез которых значительно отягоща"
ется под влиянием стресса, признаваемым так"
Гибель нервных клеток в ходе нейродегене"
же одним из факторов риска, в первую очередь
рации приводит к тяжелым хроническим когни"
относят болезнь Альцгеймера (БА) и болезнь
тивным и/или моторным расстройствам. Тече"
Паркинсона (БП). Другие распространенные
ние нейродегенеративных заболеваний усугуб"
дегенеративные заболевания нервной системы,
ляется под влиянием перенесенных ранее орга"
в частности болезнь Гентингтона (БГ) и боковой
низмом экстремальных стрессовых воздей"
амиотрофический склероз (БАС), судя по мно"
ствий, среди которых могут быть неблагоприят"
гочисленным данным литературы, изучены в
ные факторы окружающей среды, тяжелые со"
этом отношении гораздо меньше.
матические заболевания, травмы, отравления,
Показано, что стресс, перенесенный в ран"
сильные отрицательные эмоции и т.д. Исследо"
нем возрасте (early"life stress), увеличивает риск
вание нейрональных цепей, опосредующих по"
развития деменции у взрослого. Кроме того, на"
веденческие и гормональные реакции на стресс,
рушения, ассоциируемые с посттравматическим
позволило выявить множество областей мозга,
стрессом, способствуют нейродегенерации, а
где связанная с заболеванием дисфункция вы"
хронический стресс приводит к повышению в
зывает нейродегенерацию, приводящую к раз"
цереброспинальной жидкости уровней биомар"
витию психоневрологических симптомов [1, 2].
керов неспецифического нейродегенеративного
К хроническим нейродегенеративным заболева"
процесса - тау"белка и бета"амилоида 40 (Aβ
длиной 40 аминокислот) [3, 4].
Вероятно, в механизмы патогенетического
Принятые сокращения: АКТГ - адренокортико"
тропный гормон; БА - болезнь Альцгеймера; БАС - влияния стресса на нейродегенерацию вовлече"
боковой амиотрофический склероз; БГ
- болезнь на иммунная система. Иммунные клетки мозга
Гентингтона; БП - болезнь Паркинсона; ГГН"ось -
(в первую очередь микроглиальные) в ответ на
гипоталамо"гипофизарно"надпочечниковая ось; ГК -
глюкокортикоиды; КС
- кортикостероиды; Aβ
-
стресс секретируют провоспалительные медиа"
бета"амилоид; BDNF
- нейротрофический фактор
торы, которые отрицательно влияют на морфо"
головного мозга; CaMKII
- кальций/кальмодулин" функциональные свойства нейронов, усиливая
зависимая киназа II; CDK5 - циклин"зависимая киназа 5;
экспрессию провоспалительных генов, продук"
CRH - кортикотропин"рилизинг"гормон; CRHR
-
рецептор CRH; FOXO3 - транскрипционный фактор fork"
цию активных форм кислорода и перекисное
head box O3; GSK3β - киназа гликогенсинтазы 3β.
окисление липидов [5]. Зависимость нейродеге"
894
РОЛЬ СТРЕССА В НЕЙРОДЕГЕНЕРАЦИИ
895
нерации от стресса также может опосредоваться
kinase and NR2B"containing N"methyl"D"aspar"
гиперфосфорилированием тау"белка, что под"
tate receptors) приводит к когнитивным наруше"
тверждается экспериментами с нокаутировани"
ниям вследствие дисфункции ГАМКергических
ем кодирующего его гена [6, 7].
нейронов и снижения экспрессии белка релина.
Тесная взаимосвязь между стрессом и ней"
Под влиянием стресса активируется патоге"
родегенерацией обусловливается и рядом дру"
нез различных форм нейродегенеративной па"
гих факторов [4]. Так, усиленная продукция ак"
тологии головного мозга, как показано ниже.
тивных форм кислорода митохондриями при
стрессе снижает их энергетический потенциал,
отягощая нейродегенеративную патологию. В
БОЛЕЗНЬ АЛЬЦГЕЙМЕРА
состоянии стресса индуцируется экспрессия
транскрипционного фактора NR4A1 (Nuclear
Общепринятыми нейропатологическими
Receptor Subfamily 4 Group A Member 1), кото"
маркерами болезни Альцгеймера являются
рый модулирует энергетическую функцию ми"
внеклеточные скопления бета"амилоидного
тохондрий и регулирует нейрональную плас"
белка в ткани мозга и включения в нейронах ги"
тичность. В антенатальный и ранний постна"
перфосфорилированного тау"белка (далее -
тальный периоды стрессовые ситуации (внут"
р"тау) в виде нейрофибриллярных клубков (ри"
риматочные инфекции, стресс матери, дефицит
сунок). Хорошо известно, что в норме тау, при"
питания матери и/или ребенка) приводят к ак"
надлежащий к семейству белков, ассоциирован"
тивации эпигенетических механизмов, нега"
ных с микротрубочками, играет важную роль в
тивно влияющих на структуру и функцию нерв"
сохранении структуры и целостности нервной
ной ткани. Например, индуцированное перене"
ткани, стабилизируя нейритные микротрубочки
сенным в раннем возрасте стрессом поврежде"
и способствуя аксональному транспорту, синап"
ние сигнального пути Fyn/NMDAR2B (Fyn
тогенезу и росту нейритов [8].
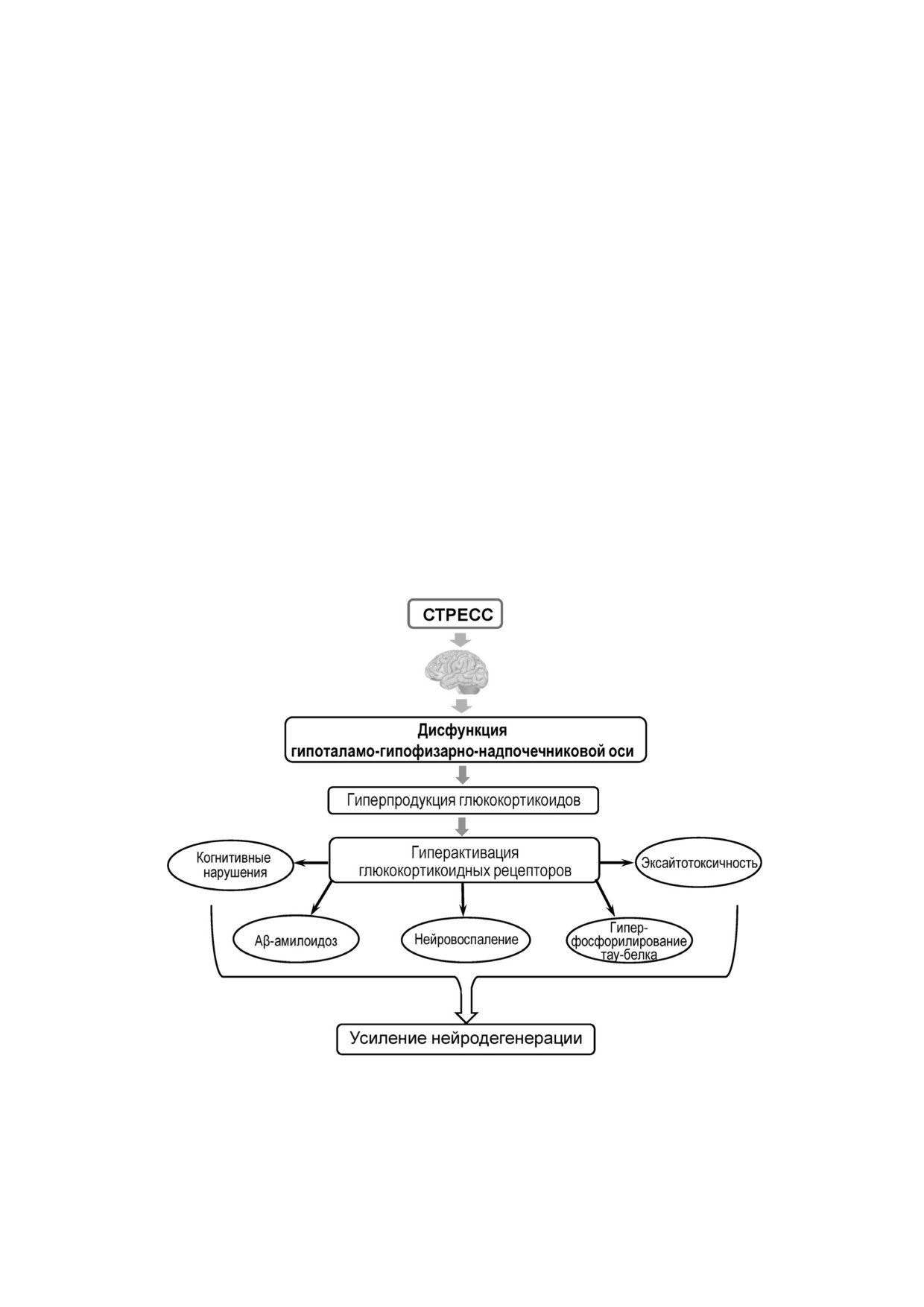
Вовлечение стресса в патогенез болезни Альцгеймера (БА). Состояние стресса способствует дисрегуляции гипоталамо"
гипофизарно"надпочечниковой оси, что приводит к усилению продукции глюкокортикоидов с последующей гиперак"
тивацией глюкокортикоидных рецепторов. Этот процесс сопровождается аккумуляцией Aβ, гиперфосфорилированием
тау"белка, эксайтотоксичностью и нейровоспалением, что впоследствии приводит к когнитивными нарушениям и отя"
гощению симптоматики БА. Пояснения в тексте
БИОХИМИЯ том 86 вып. 6 2021
896
ХАСПЕКОВ
Однако в патофизиологических условиях
котропного гормона (АКТГ) передней долей ги"
может происходить гиперфосфорилирование и
пофиза и последующую активацию выработки
неправильный фолдинг тау с его агрегацией в
ГК корой надпочечников [9]. Действие CRH
нерастворимые структуры; термин «таупатия»
опосредуется рецепторами CRHR1 и CRHR2,
используется для обозначения таких заболева"
сопряженными с G"белком, причем у нокаут"
ний (БА, болезнь Пика, кортикобазальная деге"
ных по CRHR1 мышей уровень p"тау снижен, а
нерация и др.), для которых характерно патоло"
по CRHR2 - повышен, что свидетельствует о
гическое накопление тау"белка в нейронах. Свя"
преимущественном участии CRHR1 в патологи"
зываясь с микротрубочками, p"тау снижает
ческом формировании p"тау под влиянием
растворимость и вызывает агрегацию последних
стресса. Кроме того, у мышей с гиперэкспресси"
в фибриллярные структуры, известные как пар"
ей CRH, обеспечивающей стабильную сигнали"
ные спиральные филаменты, которые затем
зацию, опосредуемую ГК, также усиливается
формируют внутри нейронов высокотоксичные
образование патологических форм p"тау [9].
филаментозные клубки, выявляемые при БА [8].
Использование в экспериментах как острых,
Показано, что различные виды стресса (хо"
так и хронических стрессорных воздействий
лодовой, иммобилизационный, непредсказуе"
различной интенсивности показало усиление
мый, стресс голодания) сопровождаются значи"
продукции Aβ и его аккумуляцию в виде амило"
тельным повышением в мозге эксперименталь"
идных бляшек у трансгенных мышей с моделью
ных животных уровня p"тау, что обычно обнару"
БА [14, 15]. У модельных мышей с двойным
живается при различных вариантах моделирова"
трансгеном (по предшественнику Aβ и пресени"
ния БА у крыс и мышей [9]. Важным фактором
лину"1, APP/PS1) хронический умеренный
повышения уровня и накопления р"тау в мозге
стресс усиливал повреждение нейронов и фор"
является активация стрессом каскада нейроэн"
мирование сенильных бляшек [16, 17]. Даже
докринных сигнальных путей, формирующего
кратковременный стресс в раннем возрасте у
гипоталамо"гипофизарно"надпочечниковую
мышей с моделью БА влиял на аккумуляцию
ось (ГГН"ось, или HPA"axis). Основным приз"
амилоида, вероятно, при участии нейровоспале"
наком активации ГГН"оси под воздействием
ния [18]. Повышение уровня интерстициально"
стресса является гиперсекреция глюкокортикои"
го Aβ можно было обнаружить уже в течение
дов (ГК), которая оказывает нейротоксический
первого часа после индукции иммобилизацион"
эффект и усиливает аккумуляцию Aβ у мышей с
ного стресса, а кратковременный стресс различ"
моделью БА [10, 11]. В то же время при хрони"
ной природы стимулировал формирование
ческом стрессе у мышей с нокаутом гена, коди"
скоплений амилоида [14, 15, 19]. У мышей с мо"
рующего тау"белок, нейроны гиппокампа и но"
делью БА стрессовое состояние приводило к ус"
вой коры не атрофируются и, соответственно,
коренной утрате когнитивных функций [17, 20],
не возникают когнитивные нарушения [7], что
при этом у молодых животных (возрастом до
указывает на роль тау как патогенетического эф"
1 года) стресс приводил к повышению содержа"
фектора стрессовых воздействий. У контроль"
ния Aβ в цереброспинальной жидкости и усиле"
ных крыс введение ГК на фоне хронического
нию его аккумуляции [14, 18].
непредсказуемого стресса повышало экспрес"
Таким образом, индуцированная стрессом
сию эпитопов p"тау, характерных для БА, а по"
гиперактивация ГГН"оси сопровождается пато"
тенцирование эффекта ГК усиливало формиро"
логическим процессингом p"тау. При этом гипер"
вание p"тау"подобных клубков в нейро"
фосфорилирование тау, наблюдаемое при БА,
нах [12, 13].
сопровождается нарушением регуляции протео"
Существование многочисленных регулятор"
стаза в нейронах, в норме поддерживаемого
ных механизмов ГГН"оси позволяет предполо"
многочисленными механизмами и компонента"
жить, что гиперфосфорилирование и аккумуля"
ми клеточного аппарата, которые отвечают за
ция p"тау, индуцируемые стрессом, опосредова"
транскрипцию, синтез, модификацию, сорти"
ны не только действием ГК. Действительно, у
ровку, транспортировку и локализацию белков.
мышей с адреналэктомией состояние стресса
Нарушения протеостаза приводят, в конечном
также сопровождается повышением в мозге
счете, к формированию токсических вариантов
уровня p"тау. Следовательно, из факторов гор"
p"тау. Подобный дисбаланс происходит и при
мональной регуляции избыточного фосфорили"
нейродегенеративных заболеваниях, для кото"
рования тау при стрессе нельзя исключить еще
рых характерна патологическая агрегация бел"
одно звено ГГН"оси - паравентрикулярное яд"
ков с последующим необратимым повреждени"
ро гипоталамуса, секреция которым кортикот"
ем нейронов.
ропин"рилизинг"гормона (CRH) и вазопресси"
В формировании p"тау задействовано более
на стимулирует высвобождение адренокорти"
80 сайтов фосфорилирования, осуществляемого
БИОХИМИЯ том 86 вып. 6 2021
РОЛЬ СТРЕССА В НЕЙРОДЕГЕНЕРАЦИИ
897
при участии многочисленных киназ, в том чис"
лучены в результате исследований различных
ле киназы гликогенсинтазы 3β (GSK3β), цик"
форм хронического стресса [33-35]. У трансген"
лин"зависимой киназы 5 (CDK5), c"Jun N"тер"
ных мышей линии Tg2576 с моделью БА под
минальной киназы (JNK), кальций/кальмоду"
влиянием хронического стресса ускорялось воз"
лин"зависимой киназы II (CaMKII), AMP"акти"
растное накопление Aβ в мозге, сопровождае"
вируемой протеинкиназы (AMPK), cAMP"зави"
мое торможением нейрогенеза в гиппокампе и
симой протеинкиназы (PKA) и ряда других. Так,
нарушением контекстуальной памяти [36]. По"
было обнаружено, что при холодовом стрессе в
казано, что стрессорные воздействия различной
повышении уровня p"тау участвуют GSK3β,
природы ингибировали экспрессию нейротро"
CDK5 и JNK. Обратный процесс, дефосфори"
финов, в частности нейротрофического фактора
лирование p"тау, опосредуется рядом фосфатаз,
головного мозга (BDNF), в нейронах гиппокам"
в частности протеинфосфатазой 2А, 2В, 1 и 5
па экспериментальных животных [37, 38]. Сни"
(PP2A, PP2B, PP1 и PP5) [21].
жение уровня BDNF, коррелирующее с тя"
В норме нейрональный тау"белок локализо"
жестью симптоматики БА, обнаруживалось в
ван в основном в аксонах, где он взаимодейству"
гиппокампе и височной коре пациентов на док"
ет с микротрубочками и нейрофиламентами,
линической и клинической стадиях заболевания
участвуя в регуляции аксонального транспорта и
[39, 40]. Следовательно, нарушения сигнализа"
нейротрофической сигнализации, а также под"
ции BDNF и, вероятно, ряда других нейротро"
держании цитоскелета. При БА p"тау выявляет"
финов могут быть медиатором патогенетичес"
ся в виде клубков в соме и дендритах нейронов,
ких эффектов хронического стресса и влиять на
а также накапливается в синапсах, приводя к
течение БА.
повреждению цитоскелета. Аналогичные изме"
Существуют доказательства того, что хрони"
нения локализации тау, происходящие при хро"
ческий стресс может ускорять старение, которое
ническом стрессе, могут служить отягчающим
является одним из основных факторов риска
фактором патогенеза БА [6, 8].
развития БА и характеризуется снижением спо"
Реактивность микроглиальных клеток игра"
собности адекватно реагировать на стресс, при"
ет важную роль в патогенезе БА. Известно, что
чем в процессе старения экспрессия глюкокор"
микроглия быстро реагирует на изменения го"
тикоидных рецепторов ослабевает, а появление
меостаза мозга при стрессе, травме и других па"
при этом свободного кортизола оказывает ней"
тологических состояниях организма [22, 23].
ротоксический эффект [41]. Кроме того, старе"
Клетки микроглии являются основными им"
ние может способствовать воспалительному
мунными клетками мозга и наряду с регуляцией
процессу, включающему активацию микроглии
нейровоспалительных и нейродегенеративных
с участием рецепторного механизма, который
процессов [24] участвуют в поддержании гомео"
опосредует передачу сигналов кортизола [41] и
стаза ЦНС, процессах обучения и запомина"
при старении страдает, что приводит к измене"
ния, пластическом ремоделировании нейро"
ниям циркадного ритма с нарушениями сна,
нальных цепей [25-28]. Для БА характерен так
сопровождающимися усилением секреции кор"
называемый реактивный микроглиоз, характе"
тизола [42].
ризующийся усиленной пролиферацией мик"
Как уже говорилось выше, у мышей с БА
роглиальных клеток в области скоплений
хронический стресс приводит к ускоренному
Aβ [29].
развитию заболевания, в частности усиливает
При хроническом стрессе реактивность мик"
отложение внеклеточных бета"амилоидных бля"
роглии возрастает, опосредуя реакцию мозга на
шек и внутриклеточное гиперфосфорилирова"
постоянное стрессорное воздействие [30]. Ре"
ние тау"белка [43], что, по крайней мере, час"
зультаты экспериментальных исследований по"
тично обусловлено гиперсекрецией кортикосте"
казывают, что микроглия играет важную роль в
роидов. Еще одним механизмом стресс"индуци"
медиации влияния хронического стресса на ма"
рованного отягощения симптомов БА, способ"
нифестацию и прогрессирование БА [31]. У
ствующим накоплению Aβ и гиперфосфорили"
трансгенных мышей в отсутствие взаимодей"
рованию тау, может быть усиленная секреция
ствия нейронов с микроглией, опосредуемого в
гипоталамического кортикотропин"рилизинг"
норме хемокином Cx3cl1 (фракталкином) и на"
гормона [19].
рушенного нокаутом гена, кодирующего его ре"
Принимая во внимание результаты много"
цептор Cx3cr1, хронический стресс не влияет на
численных исследований в различных лаборато"
морфологию микроглиальных клеток и не вы"
риях и на разных экспериментальных моделях
зывает признаков депрессивных расстройств
БА, можно с большой долей уверенности утвер"
[32]. Сходные данные о повышенной устойчи"
ждать, что практически любой тип стресса уско"
вости к стрессу у мышей с нокаутом Cx3cr1 по"
ряет патогенез заболевания, способствуя внекле"
10 БИОХИМИЯ том 86 вып. 6 2021
898
ХАСПЕКОВ
точной аккумуляции Aβ и формированию клуб"
Сказанное выше позволяет предположить
ков p"тау [19]. Эти данные свидетельствуют в
наличие прямой корреляции между стресс"ин"
пользу того, что стресс является важным факто"
дуцированным повышением уровня глюкокор"
ром ускорения развития БА и у человека.
тикоидов в кровяном русле и прогрессирующи"
Существуют указания на то, что тяжелые
ми когнитивными нарушениями. Высокое со"
возраст"зависимые заболевания, такие как диа"
держание кортизола в слюне пожилых пациен"
бет и метаболический синдром, сами по себе
тов, отражающее уровень биологически актив"
могут индуцировать стрессовое состояние у че"
ного свободного кортизола в сыворотке крови,
ловека, приводя к повышению риска развития
может служить маркером возрастных когнитив"
БА [44, 45]. Кроме того, связь между депрессив"
ных нарушений. В недавней работе Ho et al. [57]
ными симптомами и деменцией у пожилых лю"
такое повышение уровня кортизола в крови у па"
дей может быть в первую очередь обусловлена
циентов с умеренными когнитивными наруше"
как общими причинами, так и симптомами, от"
ниями было экспериментально подтверждено.
ражающими особенности доклинической фазы
Ранее было показано, что ассоциированная с
деменции [46].
БА деменция на ранней стадии ассоциируется с
Одной из структур головного мозга, наибо"
повышением уровня кортикостероидов (КС) в
лее повреждаемой при БА, особенно под влия"
крови и нервно"психическими расстройствами,
нием стресса, является гиппокамп [11]. В нем
которые обусловлены тревожным состоянием.
активно экспрессируются глюкокортикоидные
Впервые увеличение уровня КС в сосудистом
и минералокортикоидные рецепторы, баланс
русле было обнаружено у пациентов с умерен"
которых обеспечивает правильное функциони"
ными когнитивными нарушениями [58, 59].
рование гиппокампа. Стресс способен нару"
Позднее оказалось, что дальнейшее повышение
шить баланс между рецепторами этих типов и
уровня КС прямо коррелирует с ускорением
привести к уменьшению объема гиппокампа
прогрессирования деменции [60, 61]. С исполь"
[47, 48]. Динамическое МРТ"исследование ха"
зованием базы данных ADNI (Alzheimer’s
рактера атрофии полей гиппокампа крыс под
Disease Neuroimaging Initiative) при анализе
воздействием физических и психологических
МРТ головного мозга пациентов на самых ран"
стрессоров показало, что в обоих случаях атро"
них стадиях деменции и через 2 года было пока"
фия сначала идентифицируется в CA1, тогда как
зано, что депрессивная симптоматика ассоции"
CA3 и зубчатая извилина затрагиваются позд"
рована с ускорением снижения плотности ткани
нее, хотя именно поле СА3 повреждается наибо"
мозга и повышением вероятности трансформа"
лее интенсивно. С устранением стресса состоя"
ции умеренных когнитивных нарушений в де"
ние аммонова рога постепенно возвращается к
менцию [62, 63].
норме, однако атрофия зубчатой извилины про"
должает развиваться [49, 50].
Известно, что длительное воздействие повы"
БОЛЕЗНЬ ПАРКИНСОНА
шенных уровней кортикостероидов приводит к
изменению морфологии дендритов и уменьше"
Локомоторные нарушения у пациентов с бо"
нию объема гиппокампа [51-53]. У старых крыс
лезнью Паркинсона (БП) сочетаются с эмоцио"
психологический стресс, индуцированный дли"
нальным дистрессом и снижением способности
тельной социальной изоляцией, одновременно
к ежедневной нормальной жизнедеятельности
с нарушением пространственной памяти приво"
[64]. Кроме того, для наиболее подверженных
дил к повышению уровня плазматического кор"
стрессу пациентов характерно наличие немо"
тикостерона, а также сокращению объема крае"
торных симптомов и снижение качества жиз"
вого слоя и плотности шипиков в поле CA1 [54].
ни [65].
Сходные с указанными изменения были обна"
В целом диагнозу БП de novo часто предше"
ружены и в гиппокампе пожилых людей, у кото"
ствует психологический стресс, а также измене"
рых при многолетнем и стабильно высоком
ния в ГГН"оси, оцениваемые по уровням корти"
уровне кортизола на фоне хронического стресса
зола и АКТГ в крови [66]. По результатам об"
наблюдалось уменьшение объема полей СА2,
ширного популяционного исследования, пост"
СА3, CA4 и зубчатой извилины [55]. Полагают,
травматический стресс представляется серьез"
что индуцированная стрессом атрофия зубчатой
ным фактором риска БП [67]. Кроме того, эмо"
извилины, в которой на протяжении всей жизни
циональные стимулы, вызывающие стресс, мо"
у многих видов позвоночных, включая челове"
гут способствовать усугублению двигательных
ка, сохраняется устойчивый нейрогенез, являет"
симптомов при БП [68].
ся важным фактором развития возрастных ког"
Полагают, что белок RTP801 играет важную
нитивных нарушений и деменции [56].
роль в процессах, опосредующих влияние стрес"
БИОХИМИЯ том 86 вып. 6 2021
РОЛЬ СТРЕССА В НЕЙРОДЕГЕНЕРАЦИИ
899
са на патогенез БП. Показано, что после стрес"
ного дыхания и гликолиза до 50%, снижение
сорного воздействия содержание RTP801 в до"
уровня антиоксидантных белков, а также содер"
фаминергических нейронах черной субстанции
жания митохондрий и BDNF в префронтальной
возрастает, при этом ингибируется аутофагия и
коре крыс как дикого типа, так и нокаутных.
усиливается аккумуляция α"синуклеина [69].
Кроме того, психологический дистресс заметно
Стресс при БП может действовать как «аксе"
индуцировал тревогу и появление паркинсони"
лератор» заболевания. Действительно, у самцов
ческих симптомов у крыс дикого типа и ускорял
мышей с моделью БП в условиях хронического
манифестацию симптомов БП у нокаутных жи"
стресса происходило усиленное накопление
вотных.
α"синуклеина, сопровождавшееся двигательны"
Получены новые данные, раскрывающие
ми нарушениями [70]. Однако молекулярные
роль микроглии и индуцируемого стрессом вос"
механизмы, опосредующие гендерные различия
паления в патогенезе БП [73] и описывающие
этого эффекта, до сих пор не выяснены.
роль инфламмасомы NLRP3, полипротеиново"
В одной из последних работ, основанной на
го олигомерного комплекса, отвечающего за
мета"анализе ряда публикаций, обнаружена ас"
распознавание стрессовых сигналов и реализа"
социация между подверженностью стрессу в
цию воспалительного ответа [74]. Так, в пове"
раннем возрасте и развитием депрессии и БП
денческих экспериментах и морфохимических
[71]. Показано, что стресс этого типа может спо"
исследованиях головного мозга крыс было опи"
собствовать развитию депрессии, а пациенты с
сано нарастание нарушений в поведении, а так"
депрессией подвергаются риску развития БП в
же активация микроглии и инфламмасомы
более позднем возрасте. Подчеркивается, что
NLRP3 у крыс с индуцированным липополиса"
депрессия является распространенным немо"
харидом синдромом БП через 2 недели после
торным симптомом, предшествующим двига"
хронического непредсказуемого умеренного
тельным нарушениям при БП. Стимуляция об"
стресса. В эти же сроки после стрессового воз"
ластей, прилегающих к черной субстанции, а
действия в сыворотке крови этих животных по"
также применение дофаминовых агонистов мо"
вышался уровень интерлейкина"1β, интерлей"
жет облегчить течение депрессии. Авторы за"
кина"6 и фактора некроза опухоли α, а в черной
ключают, что, поскольку БП вызывает истоще"
субстанции усиливалась экспрессия NLRP3, Asc
ние дофаминергических нейронов черной суб"
(адаптерного белка с доменом активации кас"
станции, депрессия может быть частью патофи"
паз) и каспазы"1, сопровождавшаяся поврежде"
зиологического процесса, приводящего к БП.
нием дофаминергических нейронов. Таким об"
Вполне вероятно, что мезокортикальные и ме"
разом, показано, что предварительное воздей"
золимбические дофаминергические пути, лежа"
ствие стресса усиливает активацию микроглии и
щие в основе эмоций и когнитивных функций,
повреждение дофаминергических нейронов,
также могут играть ключевую роль в депрессии,
что, вероятно, опосредуется ускорением воспа"
ассоциированной с БП. Отмечается положи"
лительного ответа и активацией инфламмасомы
тельный терапевтический эффект антидепрес"
NLRP3. Эти данные значительно расширили
санта флувоксамина (из группы селективных
сформулированные в более ранних работах
ингибиторов обратного захвата серотонина) в
представления о патогенетической роли стресса
экспериментах на животных с моделью БП в со"
в активации микроглии и индуцируемого ею
четании с депрессивно"подобным поведени"
нейровоспаления при БП [70, 75, 76].
ем [71].
В совсем недавнем детальном исследовании,
выполненном на крысах с моделью БП, нокаут"
ДРУГИЕ ФОРМЫ НЕЙРОДЕГЕНЕРАТИВНОЙ
ных по гену Pink1, обнаружено, что хроничес"
ЦЕРЕБРАЛЬНОЙ ПАТОЛОГИИ
кий психологический дистресс индуцирует у
них моторные симптомы, подобные наблюдае"
Болезнь Гентингтона. У мышей R6/1 HD с
мым при БП у человека, и способствует разви"
моделью болезнью Гентингтона (БГ), так же как
тию нейродегенеративной патологии [72]. У мо"
при БА и БП, изменяется активность ГГН"оси,
лодых крыс, подвергнутых психологическому
что указывает на вовлечение кортизола в патоге"
дистрессу (реакция на хищника), проводили
нез БГ [77]. Интересно отметить, что степень
анализ биоэнергетического профиля головного
отягощения хроническим стрессом симптома"
мозга (окислительное фосфорилирование и гли"
тики БГ, такой как локомоторная активность и
колиз), поведения и двигательной функции,
координация, обонятельная чувствительность,
оценку экспрессии антиоксидантных фермен"
была связана с полом животного [78]. При
тов и BDNF, а также состояния митохондрий.
стрессе двигательная активность и координация
Результаты показали снижение митохондриаль"
усиливались у самцов, но не у самок, независи"
БИОХИМИЯ том 86 вып. 6 2021
10*
900
ХАСПЕКОВ
мо от генотипа, тогда как обонятельная чувстви"
мощных критических факторов, влияющих на
тельность нарушалась у самок мышей R6/1 HD,
патогенез нейродегенеративных заболеваний.
но не у дикого типа. Обонятельная чувствитель"
Многочисленные экспериментальные данные
ность у самцов снижалась - как у мышей линии
свидетельствуют о том, что патогенетические
R6/1 HD, так и у дикого типа.
эффекты стресса во многом опосредуются акти"
Кроме того, выявлен общий сигнальный
вацией ГГН"оси с последующей цитотоксичес"
путь, характерный как для стресса, так и для БГ,
кой гиперпродукцией ГК, которые способны
в котором задействован трансформирующий
воздействовать на множество субклеточных ме"
фактор роста β (TGF"β) в сочетании с транс"
ханизмов и, таким образом, приводить к нару"
крипционным фактором forkhead box O3
шению протеостаза, а также структуры и функ"
(FOXO3) [79].
ции нейронов. Этот процесс может усугубляться
Боковой амиотрофический склероз. О влия"
мутациями в ключевых генах и старением, кото"
нии стресса на патогенез бокового амиотрофи"
рое само по себе также является важным факто"
ческого склероза (БАС) сведений в литературе
ром риска нейродегенеративных заболеваний.
очень мало. Так, в одной из работ было показа"
Следует, однако, отметить, что специфичес"
но, что индивиды с высокой устойчивостью к
кие клеточные и молекулярные механизмы, ле"
стрессу были менее подвержены риску развития
жащие в основе стресс"индуцированной агрега"
БАС в возрасте до 55 лет [80]. Однако результаты
ции белков, остаются недостаточно изученны"
другого исследования свидетельствуют о том,
ми. Поэтому дальнейшие исследования должны
что стресс (в данном случае, профессиональ"
быть сосредоточены на детальном изучении
ный) не является фактором риска развития это"
этих механизмов при особом внимании к стрес"
го заболевания, поскольку у пациентов с БАС и
совым ситуациям в ранний период жизни, па"
в контрольной группе наблюдался сходный
губные последствия которых могут проявляться
стрессовый фон [81]. Не выявлено никакой свя"
и во взрослом возрасте вплоть до самой старос"
зи между когнитивными нарушениями и стрес"
ти. Кроме того, при разработке эффективной
сом среди пациентов с БАС [82]. Противоречи"
терапии нейродегенеративной патологии следу"
вые результаты этих исследований могут отчас"
ет учитывать стресс как важный фактор риска
ти объясняться применением различных ней"
развития заболевания.
ропсихологических и нейропсихиатрических
подходов.
Финансирование. Работа не была финанси"
рована какими"либо фондами или проектами.
ЗАКЛЮЧЕНИЕ
Конфликт интересов. Автор заявляет об отсут"
ствии конфликта интересов.
Стресс вызывает глубокие изменения в рабо"
Соблюдение этических норм. Настоящая
те мозга от морфофункциональной реорганиза"
статья не содержит описания каких"либо прове"
ции нервной ткани до нарушения экспрессии
денных автором исследований с участием людей
синаптических белков и является одним из
или животных в качестве объектов.
СПИСОК ЛИТЕРАТУРЫ
1.
Kolanowski, A., Boltz, M., Galik, E., Gitlin, L. N., Kales,
5.
Liu, Y. Z., Wang, Y. X., and Jiang, C. L.
(2017)
H. C., et al. (2017) Determinants of behavioral and psy"
Inflammation: the common pathway of stress"related dis"
chological symptoms of dementia: a scoping review of the
eases, Front. Hum. Neurosci., 11, 316, doi: 10.3389/fnhum.
evidence, Nurs. Outlook, 65, 515"529, doi: 10.1016/j.out"
2017.00316.
look.2017.06.006.
6.
Lopes, S., Vaz"Silva, J., Pinto, V., Dalla, C., Kokras, N.,
2.
Ross, J. A., Gliebus, G., and Van Bockstaele, E. J. (2017)
et al. (2016) Tau protein is essential for stress"induced brain
Stress induced neural reorganization: a conceptual frame"
pathology, Proc. Natl. Acad. Sci. USA, 113, E3755"E3763,
work linking depression and Alzheimer’s disease, Prog.
doi: 10.1073/pnas.1600953113.
Neuropsychopharmacol. Biol. Psychiatry, 85, 136"151,
7.
Lopes, S., Teplytska, L., Vaz"Silva, J., Dioli, C.,
doi: 10.1016/j.pnpbp.2017.08.004.
Trindade, R., et al. (2017). Tau deletion prevents stress"
3.
Donley, G. A. R., Lönnroos, E., Tuomainen, T. P., and
induced dendritic atrophy in prefrontal cortex: role of
Kauhanen, J. (2018) Association of childhood stress with
synaptic mitochondria, Cerebr. Cortex, 27, 2580"2591.
late"life dementia and Alzheimer’s disease: the KIHD
8.
Arendt, T., Stieler, J. T., and Holzer, M. (2016) Tau and
study, Eur. J. Public Health, 28, 1069"1073, doi: 10.1093/
tauopathies, Brain Res. Bull., 126, 238"292, doi: 10.1016/
eurpub/cky134.
j.brainresbull.2016.08.018.
4.
Peña Bautista, C., Casas Fernández, E., Vento, M.,
9.
Sierra"Fonseca, J. A., and Gosselink, K. L.
(2018)
Baquero, M., and Cháfer Pericás, C. (2020) Stress and
Tauopathy and neurodegeneration: a role for stress,
neurodegeneration. Clin. Chim. Acta, 503, 163"168,
Neurobiol. Stress, 9,
105"112, doi: 10.1016/j.ynstr.2018.
doi: 10.1016/j.cca.2020.01.019.
08.009.
БИОХИМИЯ том 86 вып. 6 2021
РОЛЬ СТРЕССА В НЕЙРОДЕГЕНЕРАЦИИ
901
10.
Stephens, M. A., and Wand, G. (2012) Stress and the HPA
24.
Cartier, N., Lewis, C."A., Zhang, R., and Rossi, F. M. V.
axis: role of glucocorticoids in alcohol dependence,
(2014) The role of microglia in human disease: therapeutic
Alcohol. Res., 34, 468"483.
tool or target? Acta Neuropathol.,
128,
363"380,
11.
Gulyaeva, N. V. (2019) Biochemical mechanisms and
doi: 10.1007/s00401"014"1330"y.
translational relevance of hippocampal vulnerability to dis"
25.
Derecki, N. C., Katzmarski, N., Kipnis, J., and Meyer"
tant focal brain injury: the price of stress response,
Luehmann, M. (2014) Microglia as a critical player in both
Biochemistry (Moscow), 84, 1306"1328, doi: 10.1134/
developmental and late"life CNS pathologies, Acta
S0006297919110087.
Neuropathol., 128, 333"345, doi: 10.1007/s00401"014"
12.
Sotiropoulos, I., and Sousa, N. (2016) Tau as the converg"
1321"z.
ing protein between chronic stress and Alzheimer’s disease
26.
Sipe, G. O., Lowery, R. L., Tremblay, M."È., Kelly, E. A.,
synaptic pathology, Neurodegener. Dis.,
16,
22"25,
Lamantia, C. E., and Majewska, A. K. (2016) Microglial
doi: 10.1159/000440844.
P2Y12 is necessary for synaptic plasticity in mouse visual cor"
13.
Yi, J. H., Brown, C., Whitehead, G., Piers, T., Lee, Y. S.,
tex, Nat. Commun., 7, 10905, doi: 10.1038/ncomms10905.
et al. (2017) Glucocorticoids activate a synapse weakening
27.
Ransohoff, R. M., and El Khoury, J. (2015) Microglia in
pathway culminating in tau phosphorylation in the hip"
health and disease, Cold Spring Harb. Perspect. Biol., 8,
pocampus, Pharmacol. Res., 121, 42"51, doi: 10.1016/
a020560, doi: 10.1101/cshperspect.a020560.
j.phrs.2017.04.015.
28.
Tay, T. L., Savage, J. C., Hui, C. W., Bisht, K., and
14.
Lesuis, S. L., Maurin, H., Borghgraef, P., Lucassen, P. J.,
Tremblay, M."È. (2017) Microglia across the lifespan: from
Van Leuven, F., and Krugers, H. J. (2016) Positive and neg"
origin to function in brain development, plasticity and cog"
ative early life experiences differentially modulate long
nition, J. Physiol.,
595,
1929"1945, doi:
10.1113/
term survival and amyloid protein levels in a mouse model
JP272134.
of Alzheimer’s disease, Oncotarget, 7, 39118"39135,
29.
Chun, H., Marriott, I., Lee, C. J., Cho, H.
(2018)
doi: 10.18632/oncotarget.9776.
Elucidating the interactive roles of glia in Alzheimer’s dis"
15.
Justice, N. J., Huang, L., Tian, J. B., Cole, A., Pruski, M.,
ease using established and newly developed experimental
et al. (2015) Posttraumatic stress disorder"like induction
models. Front. Neurol., 26, 797, doi: 10.3389/fneur.2018.
elevates beta"amyloid levels, which directly activates corti"
00797.
cotropin"releasing factor neurons to exacerbate stress
30.
Santos, L. E., Beckman, D., and Ferreira, S. T. (2016)
responses, J. Neurosci., 35, 2612"2623, doi: 10.1523/
Microglial dysfunction connects depression and
JNEUROSCI.3333"14.2015.
Alzheimer’s disease, Brain Behav. Immun., 55, 151"165,
16.
Cuadrado"Tejedor, M., and Garc a"Osta, A.
(2016)
doi: 10.1016/j.bbi.2015.11.011.
Chronic mild stress assay leading to early onset and propa"
31.
Piirainen, S., Youssef, A., Song, C., Kalueff, A. V.,
gation of Alzheimer’s disease phenotype in mouse models,
Landreth, G. E., et al. (2017) Psychosocial stress on neu"
Methods Mol. Biol., 1303, 241"246, doi: 10.1007/978"1"
roinflammation and cognitive dysfunctions in Alzheimer’s
4939"2627"5_14.
disease: the emerging role for microglia? Neurosci.
17.
Han, B., Yu, L., Geng, Y., Shen, L., Wang, H., et al. (2016)
Biobehav. Rev., 77, 148"164, doi: 10.1016/j.neubiorev.
Chronic stress aggravates cognitive impairment and sup"
2017.01.046.
presses insulin associated signaling pathway in APP/PS1
32.
Milior, G., Lecours, C., Samson, L., Bisht, K., Poggini, S.,
mice, J. Alzheimer’s Dis., 53, 1539"1552, doi: 10.3233/
et al. (2016) Fractalkine receptor deficiency impairs
JAD"160189.
microglial and neuronal responsiveness to chronic stress,
18.
Hoeijmakers, L., Ruigrok, S. R., Amelianchik, A.,
Brain Behav. Immun., 55, 114"125, doi: 10.1016/j.bbi.
Ivan, D., van Dam, A. M., et al. (2017) Early"life stress
2015.07.024.
lastingly alters the neuroinflammatory response to amyloid
33.
Hellwig, S., Brioschi, S., Dieni, S., Frings, L., Masuch, A.,
pathology in an Alzheimer’s disease mouse model, Brain
et al. (2016) Altered microglia morphology and higher
Behav. Immun., 63, 160"175, doi: 10.1016/j.bbi.2016.
resilience to stress"induced depression"like behavior in
12.023.
CX3CR1"deficient mice, Brain Behav. Immun., 55, 126"
19.
Justice, N. J. (2018) The relationship between stress and
137, doi: 10.1016/j.bbi.2015.11.008.
Alzheimer’s disease, Neurobiol. Stress,
8,
127"133,
34.
Rimmerman, N., Schottlender, N., Reshef, R., Dan"
doi: 10.1016/j.ynstr.2018.04.002.
Goor, N., and Yirmiya, R. (2017) The hippocampal tran"
20.
Han, B., Wang, J. H., Geng, Y., Shen, L., Wang, H. L.,
scriptomic signature of stress resilience in mice with
et al. (2017) Chronic stress contributes to cognitive dys"
microglial fractalkine receptor (CX3CR1) deficiency,
function and hippocampal metabolic abnormalities in
Brain Behav. Immun., 61, 184"196, doi: 10.1016/j.bbi.
APP/PS1 mice, Cell. Physiol. Biochem., 41, 1766"1776,
2016.11.023.
doi: 10.1159/000471869.
35.
Winkler, Z., Kuti, D., Ferenczi, S., Gulyás, K., Polyák,Á.,
21.
Mietelska"Porowska, A., Wasik, U., Goras, M.,
and Kovács, K. J. (2017) Impaired microglia fractalkine
Filipek, A., and Niewiadomska, G. (2014) Tau protein
signaling affects stress reaction and coping style in mice,
modifications and interactions: their role in function and
Behav. Brain Res., 334, 119"128, doi: 10.1016/j.bbr.2017.
dysfunction, Int. J. Mol. Sci., 15, 4671"4713, doi: 10.3390/
07.023.
ijms15034671.
36.
Dong, H., Goico, B., Martin, M., Csernansky, C. A.,
22.
Matcovitch"Natan, O., Winter, D. R., Giladi, A., Vargas
Bertchume, A., and Csernansky, J. G. (2004) Modulation
Aguilar, S., Spinrad, A., et al. (2016) Microglia develop"
of hippocampal cell proliferation, memory, and amyloid
ment follows a stepwise program to regulate brain home"
plaque deposition in APPsw (Tg2576) mutant mice by iso"
ostasis, Science, 353, aad8670, doi: 10.1126/science.
lation stress, Neuroscience, 127, 601"609, doi: 10.1016/
aad8670.
j.neuroscience.2004.05.040.
23.
Tian, L., Hui, C. W., Bisht, K., Tan, Y., Sharma, K., et al.
37.
Chiba, S., Numakawa, T., Ninomiya, M., Richards,
(2017) Microglia under psychosocial stressors along the
M. C., Wakabayashi, C., and Kunugi, H. (2012) Chronic
aging trajectory: consequences on neuronal circuits,
restraint stress causes anxiety" and depression"like behav"
behavior, and brain diseases, Prog. Neuropsychopharmacol.,
iors, downregulates glucocorticoid receptor expression,
Biol. Psychiatry, 79 (Pt. A), 27"39, doi: 10.1016/j.pnpbp.
and attenuates glutamate release induced by brain"derived
2017.01.007.
neurotrophic factor in the prefrontal cortex, Prog.
БИОХИМИЯ том 86 вып. 6 2021
902
ХАСПЕКОВ
Neuropsychopharmacol. Biol. Psychiatry, 39,
112"119,
52.
Sousa, N., Lukoyanov, N. V., Madeira, M. D., Almeida,
doi: 10.1016/j.pnpbp.2012.05.018.
O. F. X., and Paula"Barbosa, M. M. (2000) Reorganization
38.
Roth, T. L., Zoladz, P. R., Sweatt, J. D., and Diamond,
of the morphology of hippocampal neurites and synapses
D. M. (2011) Epigenetic modification of hippocampal
after stress"induced damage correlates with behavioral
BDNF DNA in adult rats in an animal model of post"trau"
improvement, Neuroscience, 97, 253"266, doi: 10.1016/
matic stress disorder, J. Psychiatr. Res., 45, 919"926,
S0306"4522(00)00050"6.
doi: 10.1016/j.jpsychires.2011.01.013.
53.
Woolley, C. S., Gould, E., and McEwen, B. S. (1990)
39.
Michalski, B., and Fahnestock, M. (2003) Pro"brain"
Exposure to excess glucocorticoids alters dendritic mor"
derived neurotrophic factor is decreased in parietal cortex
phology of adult hippocampal pyramidal neurons, Brain
in Alzheimer’s disease, Mol. Brain Res., 111, 148"154,
Res., 531, 225"231, doi: 10.1016/0006"8993(90)90778"A.
doi: 10.1016/s0169"328x(03)00003"2.
54.
Pereda"Pérez, I., Valencia, A., Baliyan, S., Núñez, Á.,
40.
Peng, S., Wuu, J., Mufson, E. J., and Fahnestock, M.
Sanz Garc a, A., et al. (2019) Systemic administration of a
(2005) Precursor form of brain"derived neurotrophic factor
fibroblast growth factor receptor 1 agonist rescues the cog"
and mature brain"derived neurotrophic factor are
nitive deficit in aged socially isolated rats, Neurobiol. Aging,
decreased in the pre"clinical stages of Alzheimer’s disease,
78, 155"165, doi: 10.1016/j.neurobiolaging.2019.02.011.
J. Neurochem., 93, 1412"1421, doi: 10.1111/j.1471"
55.
Zimmerman, M. E., Ezzati, A., Katz, M. J., Lipton,
4159.2005.03135.x.
M. L., Brickman, A. M., et al. (2016) Perceived stress is
41.
Fonken, L. K., Frank, M. G., Gaudet, A. D., and Maier,
differentially related to hippocampal subfield volumes
S. F. (2018) Stress and aging act through common mecha"
among older adults, PLoS One, 11, 154530, doi: 10.1371/
nisms to elicit neuroinflammatory priming, Brain. Behav.
journal.pone.0154530.
Immun., 73, 133"148, doi: 10.1016/j.bbi.2018.07.012.
56.
Moreno"Jiménez, E. P., Flor Garc a, M., Terreros
42.
Schouten, M., Bielefeld, P., Garcia"Corzo, L., Passchier,
Roncal, J., Rábano, A., Cafini, F., et al. (2019) Adult hip"
E. M. J., Gradari, S., et al. (2019) Circadian glucocorticoid
pocampal neurogenesis is abundant in neurologically
oscillations preserve a population of adult hippocampal
healthy subjects and drops sharply in patients with
neural stem cells in the aging brain, Mol. Psychiatry, 25,
Alzheimer’s disease, Nat. Med.,
25,
554"560,
1382"1405, doi: 10.1038/s41380"019"0440"2.
doi: 10.1038/s41591"019"0375"9.
43.
Kvetnansky, R., Novak, P., Vargovic, P., Lejavova, K.,
57.
Ho, R. T. H., Fong, T. C. T., Yau, J. C. Y., Chan, W. C.,
Horvathova, L., Ondicova, K., et al. (2016). Exaggerated
Kwan, J. S. K., et al. (2020) Diurnal cortisol slope mediates
phosphorylation of brain tau protein in CRH KO mice
the association between affect and memory retrieval in
exposed to repeated immobilization stress, Stress, 19, 395"
older adults with mild cognitive impairment: a pathanalyt"
405, doi: 10.1080/10253890.2016.1183119
ical study, Front. Aging Neurosci., 12 35. doi: 10.3389/
44.
Huang, C."C., Chung, C."M., Leu, H."B., Lin, L."Y.,
fnagi.2020.00035.
Chiu, C."C., et al. (2014) Diabetes mellitus and the risk of
58.
Davis, K. L., Davis, B. M., Greenwald, B. S., Mohs, R. C.,
Alzheimer’s disease: a nationwide population"based study,
Mathe, et al. (1986) Cortisol and Alzheimer’s disease, I:
PLoS One, 9, e87095, doi: 10.1371/journal.pone.0087095.
basal studies, Am. J. Psychiatr., 143, 300"305, doi: 10.1176/
45.
Rojas"Gutierrez, E., Muñoz Arenas, G., Treviño, S.,
ajp.143.3.300.
Espinosa, B., Chavez, R., et al. (2017) Alzheimer’s disease
59.
Hartmann, A., Veldhuis, J. D., Deuschle, M.,
and metabolic syndrome: a link from oxidative stress and
Standhardt, H., and Heuser, I. (1997) Twenty"four hour
inflammation to neurodegeneration, Synapse, 71, e21990,
cortisol release profiles in patients with Alzheimer’s and
doi: 10.1002/syn.21990.
Parkinson’s disease compared to normal controls: ultradi"
46.
Singh"Manoux, A., Dugravot, A., Fournier, A., Abell, J.,
an secretory pulsatility and diurnal variation, Neurobiol.
Ebmeier, K., et al. (2017) Trajectories of depressive symp"
Aging, 18, 285"289, doi: 10.1016/s0197"4580(97)80309"0.
toms before diagnosis of dementia: a 28"year follow"up
60.
Lupien, S. J., de Leon, M., de Santi, S., Convit, A.,
study, JAMA Psychiatry, 74, 712"718, doi: 10.1001/
Tarshish, C., et al. (1998) Cortisol levels during human
jamapsychiatry.2017.0660.
aging predict hippocampal atrophy and memory deficits.
47.
Rogalska, J. (2010) Mineralocorticoid and glucocorticoid
Nat. Neurosci., 1, 69-73, doi: 10.1038/271.
receptors in hippocampus: their impact on neurons survival
61.
Csernansky, J. G., Dong, H., Fagan, A. M., Wang, L.,
and behavioral impairment after neonatal brain injury,
Xiong, C., et al. (2006) Plasma cortisol and progression of
Vitam Horm.,
82,
391"419, doi:
10.1016/S0083"
dementia in subjects with Alzheimer type dementia, Am. J.
6729(10)82020"5.
Psychiatry, 163, 2164"2169, doi: 10.1176/ajp.2006.163.
48.
Yau, J. L. W., Noble, J., and Seckl, J. R. (2011) 11b"
12.2164.
hydroxysteroid dehydrogenase type 1 deficiency prevents
62.
Lebedeva, A. K., Westman, E., Borza, T., Beyer, M. K.,
memory deficits with aging by switching from glucocorti"
Engedal, K., et al. (2017) MRI"Based classification mod"
coid receptor to mineralocorticoid receptor"mediated cog"
els in prediction of mild cognitive impairment and demen"
nitive control, J. Neurosci., 31, 4188"4193, doi: 10.1523/
tia in late"life depression, Front. Aging Neurosci., 9, 13,
JNEUROSCI.6145"10.2011.
doi: 10.3389/fnagi.2017.00013.
49.
Li, Y., Qin, J., Yan, J., Zhang, N., Xu, Y., et al. (2019) Dif"
63.
Mah, L., Binns, M. A., and Steffens, D. C. (2015) Anxiety
ferences of physical vs. psychological stress: evidences from
symptoms in amnestic mild cognitive impairment are asso"
glucocorticoid receptor expression, hippocampal subfields
ciated with medial temporal atrophy and predict conver"
injury, and behavioral abnormalities, Brain Imaging Behav.,
sion to Alzheimer’s disease, Am. J. Geriatr. Psychiatry, 23,
13, 1780"1788, doi: 10.1007/s11682"018"9956"3.
466"476, doi: 10.1016/j.jagp.2014.10.005.
50.
McEwen, B. S. (1997) Possible mechanisms for atrophy of
64.
Starkstein, S., Dragovic, M., Brockman, S., Wilson, M.,
the human hippocampus, Mol. Psychiatry, 2, 255"262.
Bruno, V., and Merello, M. (2015) The impact of emo"
doi: 10.1038/sj.mp.4000254.
tional distress on motor blocks and festination in
51.
Sousa, N., Madeira, M. D., and Paula"Barbosa, M. M.
Parkinson’s disease, J. Neuropsychiatry Clin. Neurosci., 27,
(1998) Effects of corticosterone treatment and rehabilita"
121"126, doi: 10.1176/appi.neuropsych.13030053.
tion on the hippocampal formation of neonatal and adult
65.
Kim, S. R., Kim, J. Y., Kim, H. K., Lim, K. E., Kim,
rats. An unbiased stereological study, Brain Res., 794, 199"
M. S., and Chung, S. J. (2017) Association among type D
210, doi: 10.1016/S0006"8993(98) 00218"2.
personality, non"motor symptoms, and quality of life in
БИОХИМИЯ том 86 вып. 6 2021
РОЛЬ СТРЕССА В НЕЙРОДЕГЕНЕРАЦИИ
903
Parkinson’s disease: a cross"sectional study, Geriatr Nurs.,
75.
De Pablos, R. M., Herrera, A. J., Espinosa"Oliva, A. M.,
38, 431"436, doi: 10.1016/j.gerinurse.2017.02.006.
Sarmiento, M., Muñoz, M. F., et al. (2014) Chronic stress
66.
Ibrahimagic, O. C., Jakubovic, A. C., Smajlovic, D.,
enhances microglia activation and exacerbates death of
Dostovic, Z., Kunic, S., Iljazovic, A. (2016) Psychological
nigral dopaminergic neurons under conditions of inflam"
stress and changes of hypothalamic"pituitary"adrenal axis
mation, J. Neuroinflammation, 24, 34, doi: 10.1186/1742"
in patients with “De Novo” Parkinson’s disease, Med.
2094"11"34.
Arch., 70, 445"448, doi: 10.5455/medarh.016.70.445"448.
76.
Sugama, S., Sekiyama, K., Kodama, T., Takamatsu, Y.,
67.
Chan, Y. E., Bai, Y. M., Hsu, J. W., Huang, K. L., Su, T. P., et al.
Takenouchi, T., et al. (2016) Chronic restraint stress trig"
(2017) Post"traumatic stress disorder and risk of Parkinson’s
gers dopaminergic and noradrenergic neurodegeneration:
disease: a nationwide longitudinal study, Am. J. Geriatr.
Possible role of chronic stress in the onset of Parkinson’s
Psychiatry, 25, 917"923, doi: 10.1016/j.jagp.2017.03.012.
disease, Brain Behav. Immun., 51, 39"46, doi: 10.1016/
68.
Blakemore, R. L., MacAskill’, M. R., Shoorangiz, R., and
j.bbi.2015.08.015.
Anderson, T. J. (2018) Stress"evoking emotional stimuli
77.
Dufour, B. D., and McBride, J. L. (2016) Corticosterone
exaggerate deficits in motor function in Parkinson’s dis"
dysregulation exacerbates disease progression in the R6/2
ease, Neuropsychologia, 112, 66"76, doi: 10.1016/j.neu"
transgenic mouse model of Huntington’s disease, Exp.
ropsychologia.2018.03.006.
Neurol., 283, Pt. A, 308"317, doi: 10.1016/j.expneurol.
69.
Zhang, Z., Chu, S. F., Wang, S. S., Jiang, Y. N., Gao, Y.,
2016.06.028.
et al. (2018) RTP801 is a critical factor in the neurodegen"
78.
Mo, C., Renoir, T., and Hannan, A. J. (2014) Effects of
eration process of A53T α"synuclein in a mouse model of
chronic stress on the onset and progression of
Parkinson’s disease under chronic restraint stress, Br. J.
Huntington’s disease in transgenic mice, Neurobiol. Dis.,
Pharmacol., 175, 590"605, doi: 10.1111/bph.14091.
71, 81"94, doi: 10.1016/j.nbd.2014.07.008.
70.
Wu, Q., Yang, X., Zhang, Y., Zhang, L., and Feng, L.
79.
Scarpa, J. R., Jiang, P., Losic, B., Readhead, B., Gao,
(2016) Chronic mild stress accelerates the progression of
V. D., et al. (2016) Systems genetic analyses highlight a
Parkinson’s disease in A53T α"synuclein transgenic mice,
TGFβ"FOXO3 dependent striatal astrocyte network con"
Exp. Neurol., 285, Pt A, 61"71, doi: 10.1016/j.expneu"
served across species and associated with stress, sleep, and
rol.2016.09.004.
Huntington’s disease, PLoS Genet.,
12, e1006137,
71.
Dallé, E., and Mabandla, M. V. (2018) Early life stress,
doi: 10.1371/journal.pgen.1006137.
depression and Parkinson’s disease: a new approach, Mol.
80.
Longinetti, E., Mariosa, D., Larsson, H., Almqvist, C.,
Brain, 11, 18, doi: 10.1186/s13041"018"0356"9.
Lichtenstein, P., et al. (2017) Physical and cognitive fitness
72.
Grigoruţă, M., Mart nez Mart nez, A., Dagda, R. Y., and
in young adulthood and risk of amyotrophic lateral sclero"
Dagda, R. K. (2020) Psychological stress phenocopies
sis at an early age, Eur. J. Neurol.,
24,
137"142,
brain mitochondrial dysfunction and motor deficits as
doi: 10.1111/ene.13165.
observed in a parkinsonian rat model, Mol. Neurobiol., 57,
81.
Parkin Kullmann, J. A., Hayes, S., and Pamphlett, R.
1781"1798, doi: 10.1007/s12035"019"01838"9.
(2018) Is psychological stress a predisposing factor for
73.
Kong, H., Yang, L., He, C., Zhou, J. W., Li, W. Z., et al.
amyotrophic lateral sclerosis (ALS)? An online interna"
(2019) Chronic unpredictable mild stress accelerates
tional case"control study of premorbid life events, occupa"
lipopolysaccharide"induced microglia activation and dam"
tional stress, resilience and anxiety, PLoS One, 13,
age of dopaminergic neurons in rats, Pharmacol. Biochem.
e0204424, doi: 10.1371/journal.pone.0204424.
Behav., 179, 142"149, doi: 10.1016/j.pbb.2019.01.004.
82.
Rabkin, J., Goetz, R., Murphy, J. M., Factor"Litvak, P.,
74.
Mariathasan, S., Newton, K., Monack, D. M., Vucic, D.,
Mitsumoto, H., and ALS COSMOS Study Group (2016)
French, D. M., et al. (2004) Differential activation of the
Cognitive impairment, behavioral impairment, depression,
inflammasome by caspase"1 adaptors ASC and Ipaf,
and wish to die in an ALS cohort, Neurology, 87, 1320"
Nature, 430, 213"218, doi: 10.1038/nature02664.
1328, doi: 10.1212/WNL.0000000000003035.
CURRENT VIEWS ON THE ROLE OF STRESS IN THE PATHOGENESIS
OF CHRONIC NEURODEGENERATIVE DISEASES
Review
L. G. Khaspekov
Research Center of Neurology, 125367 Moscow, Russia; e%mail: khaspekleon@mail.ru
The review summarizes the results of studies on the cellular and molecular mechanisms mediating the impact of stress
on the pathogenesis of neurodegenerative brain pathologies (Alzheimer’s disease, Parkinson’s disease, etc.) and pre"
sents current information on the role of stress in the hyperphosphorylation of tau protein, aggregation of beta"amy"
loid, and hyperactivation of the hypothalamic"pituitary"adrenal axis involved in the hyperproduction of factors that
contribute to the pathogenetic role of stress in neurodegeneration. The data on the participation of microglia in the
effects of stress on the pathogenesis of neurodegenerative diseases are presented.
Keywords: stress, neurodegeneration, dementia, Alzheimer’s disease, Parkinson’s disease
БИОХИМИЯ том 86 вып. 6 2021