БИОХИМИЯ, 2021, том 86, вып. 7, с. 1018 - 1026
УДК 577.24
ЭФФЕКТЫ ИНГИБИТОРОВ СУПЕРОКСИДДИСМУТАЗЫ
И ГЛЮКОЗЫ НА ГИБЕЛЬ КЛЕТОК И ОБРАЗОВАНИЕ
АКТИВНЫХ ФОРМ КИСЛОРОДА В ЛИСТЬЯХ ГОРОХА
© 2021
В.Д. Самуилов1*, Д.Б. Киселевский1*, Е.В. Дзюбинская1, О.Ю. Фролова2
1 Московский государственный университет имени М.В. Ломоносова, биологический факультет,
119234 Москва, Россия; электронная почта: vdsamuilov@mail.ru; dkiselevs@mail.ru
2 Московский государственный университет имени М.В. Ломоносова,
ООО «НИИ Митоинженерии МГУ», 119234 Москва, Россия
Поступила в редакцию 09.02.2021
После доработки 15.06.2021
Принята к публикации 15.06.2021
Исследовали действие ингибиторов супероксиддисмутазы (СОД) диэтилдитиокарбамата (ДДК), триэти!
лентетрамина (триена) и их комбинации с глюкозой на клетки эпидермиса из листьев гороха разного воз!
раста: быстро растущих молодых листьев и старых листьев с замедленным ростом. ДДК и триен вызывали
гибель устьичных клеток, которую регистрировали по разрушению их ядер. Глюкоза не влияла на разруше!
ние ядер, вызванное ингибиторами СОД в клетках из старых листьев, но усиливала его в клетках из моло!
дых листьев. Ингибитор гликолиза 2!дезоксиглюкоза и имитирующий СОД антиоксидант пропилгаллат по!
давляли зависимое от ингибиторов СОД и глюкозы разрушение ядер в клетках эпидермиса из молодых, но
не из старых листьев. Глюкоза и триен стимулировали, а пропилгаллат уменьшал образование активных
форм кислорода (АФК) в эпидермисе гороха, определяемое по флуоресценции 2′,7′!дихлорфлуоресцеи!
на (DCF). Протонофорный разобщитель окислительного и фотосинтетического фосфорилирования
м!хлоркарбонилцианидфенилгидразон (ХКФ) подавлял флуоресценцию DCF в устьичных клетках. Обра!
ботка клеток ХКФ с последующей отмывкой от него усиливала разрушение ядер, вызванное ингибиторами
СОД и глюкозой. В молодых листьях ХКФ был менее эффективен, чем в старых. Полученные результаты
демонстрируют эффекты ингибиторов СОД и глюкозы на гибель клеток и генерацию АФК и могут свиде!
тельствовать о зависимом от гликолиза образовании АФК.
КЛЮЧЕВЫЕ СЛОВА: глюкоза, супероксиддисмутаза, активные формы кислорода, программируемая кле!
точная смерть, устьичные клетки листьев, горох.
DOI: 10.31857/S032097252107006X
ВВЕДЕНИЕ
Роль хлоропластов в гибели клеток растений
была продемонстрирована на клетках из эпи!
В регуляцию гибели клеток у растений вов!
дермиса листьев гороха [3]. В эпидермисе два
лечены активные формы кислорода (АФК) [1].
типа клеток: основные эпидермальные клетки,
Их образование ассоциировано с переносом
которые не имеют хлоропластов, и фотосинте!
электронов в электронтранспортных цепях ми!
зирующие замыкающие клетки устьиц (устьич!
тохондрий и хлоропластов. 1-2% потребляемо!
ные клетки). Освещение усиливало гибель усть!
го растениями О2 превращается в АФК [2].
ичных клеток, но не влияло на гибель эпидер!
Представляет интерес вопрос о том, как систе!
мальных клеток, лишённых хлоропластов. Ги!
мы энергообеспечения и образующиеся с их по!
бель устьичных клеток зависела как от АФК, так
мощью АФК участвуют в гибели клеток расте!
и от редокс!состояния пластохинона в хлоро!
ний. В связи с этим изучали, какой вклад вносят
пластах [3].
хлоропласты и митохондрии в процесс клеточ!
Митохондриально!направленные антиокси!
ной смерти [3, 4].
данты SkQ подавляли образование АФК и ги!
бель клеток в эпидермисе листьев гороха, что
свидетельствует об участии митохондрий и ми!
Принятые сокращения: АФК - активные формы тохондриальных АФК в гибели клеток расте!
кислорода; ДДК - N,N′!диэтилдитиокарбамат; СОД - су! ний [4, 5].
пероксиддисмутаза; триен - триэтилентетрамин; ХКФ -
Ещё одним клеточным компартментом, ге!
м!хлоркарбонилцианидфенилгидразон; DCF - 2′,7′!ди!
хлорфлуоресцеин; DCFH!DA - диацетат 2′,7′!дихлорфлуо!
нерирующим АФК, являются пероксисомы.
ресцина.
Внутри них различные оксидазы катализируют
* Адресат для корреспонденции.
образование Н2O2 или супероксидного анион!
1018
ЭФФЕКТЫ ИНГИБИТОРОВ СОД И ГЛЮКОЗЫ НА КЛЕТКИ РАСТЕНИЙ
1019
радикала (O2 ), который затем превращается
СОД [9]. У растений имеются СОД первых трёх
в Н2O2. Ферменты в мембране перокси!
групп, расположенные в различных клеточных
сом (PMP, peroxisome membrane polypeptides) с
компартментах: Fe!СОД - в хлоропластах, Mn!
молекулярной массой 18 (цитохром b), 29 и
СОД - в митохондриях и пероксисомах, Cu,Zn!
32 кДа используют NADH или NADPH для вос!
СОД - в хлоропластах, пероксисомах и цито!
становления кислорода до O2 в цитоплазме кле!
плазме, а также в ядре и апопласте [9, 10]. Нару!
ток [2].
шение действия этих ферментов ведёт к гибели
Существует возможность образования АФК
клеток [11]. Активность Cu,Zn!СОД, как пока!
и в результате гликолиза, при котором происхо!
зано у бактерий, дрожжей и животных, подавля!
дит восстановление NAD+. Тот NAD+, который
ется агентами, хелирующими Cu2+: N,N′!ди!
восстанавливается в цикле трикарбоновых кис!
этилдитиокарбаматом (ДДК) [12-15] и триэти!
лот (ЦТК) и регенерируется при окисле!
лентетрамином (триеном) [16-18]. Цианид,
нии NADH дыхательной цепью, локализован в
азид и Н2O2 в миллимолярных концентрациях
митохондриях и не доступен для ферментов,
ингибируют СОД разных групп [9].
действующих в цитоплазме и других клеточных
Энергетический метаболизм регулируется в
компартментах. NADH может функциониро!
зависимости от состояния и потребностей кле!
вать в качестве донора электронов для перокси!
ток. O2 снижает потребление глюкозы и подав!
дазы и превращаться в радикал NAD•, который
ляет образование лактата из пирувата (эффект
окисляется кислородом с образованием АФК:
Пастера [19, 20]). В расчёте на 1 молекулу пот!
NAD• + O2 → NAD+ + O2 [6]. В связанном с
реблённой глюкозы выход ATP при гликолизе
гликолизом пентозофосфатном пути восстанав!
составляет 2 молекулы, а при окислительном
ливается NADP+. Образующийся NADPH мо!
фосфорилировании - до 36 молекул [21]. Не!
жет окисляться NADPH!оксидазой плазмати!
смотря на это, быстро растущие клетки предпо!
ческой мембраны, генерирующей O2 . Взаимо!
читают использовать гликолиз как источ!
действие растений с патогеном инициирует ги!
ник ATP при аэробной пролиферации - аэроб!
перчувствительный ответ, который проявляется
ный гликолиз [22], свойственный опухолевым
в локальной гибели клеток и образовании АФК
клеткам, лимфоцитам, эндотелиальным клет!
NADPH!оксидазой плазматической мембраны
кам, дрожжам. Благодаря высокой скорости аэ!
для того, чтобы обезвредить инфекцию и не до!
робный гликолиз может дать ATP даже больше,
пустить её распространения. При этом происхо!
чем окислительное фосфорилирование [23]. Аэ!
дит быстрое увеличение пула NADPH
-
робный гликолиз обеспечивает превращение
субстрата NADPH!оксидазы. Эта реакция регу!
глюкозы в пируват и лактат при достатке O2 для
лируется Ca2+ и связывающим его белком каль!
поддержания ЦТК и окислительного фосфори!
модулином и катализируется NAD!киназой.
лирования в функционально активных митохон!
Из NAD+ образуется NADP+, который может за!
дриях (эффект Варбурга [24, 25]). Главная роль
тем превращаться в NADPH с помощью пенто!
аэробного гликолиза, по!видимому, заключает!
зофосфатного пути [7].
ся в поддержании постоянного уровня его про!
В реакциях образования АФК O2 возникает
межуточных продуктов для синтеза макромоле!
в результате одноэлектронного восстановления
кулярных соединений при делении клеток [22]:
молекулярного кислорода. O2 - эффективный
из рибозо!5!фосфата, синтезированного из
ингибитор [4Fe, 4S]!групп различных белков.
глюкозо!6!фосфата или фруктозо!6!фосфата,
После протонирования O2 становится сильным
образуется фосфорибозилпирофосфат, исполь!
одновалентным окислителем этих групп, кото!
зуемый в синтезе нуклеотидов; промежуточный
рые, теряя стабильность, подвергаются затем
продукт гликолиза, 3!фосфоглицериновый аль!
разрушению [8]. Одноэлектронное восстановле!
дегид, является предшественником дигидрокси!
ние O2 ведет к образованию Н2O2, а двухэлект!
ацетонфосфата, из которого синтезируются ли!
ронное - гидроксильного радикала (OH⋅), спо!
пиды (фосфолипиды и триацилглицеролы) -
собного окислить практически любое соедине!
компоненты клеточных мембран; из продуктов
ние в клетке и обладающее временем жиз!
гликолиза 3!фосфоглицерата образуется амино!
ни 10-9 с.
кислота серин (а из серина - глицин и цистеин),
Растения защищает от АФК супероксиддис!
из пирувата - аланин. Окислительное фосфори!
мутаза (СОД), катализирующая реакцию: 2O2 +
лирование эффективнее в синтезе ATP, тогда
+ 2H+ → O2 + H2O2. Образующийся Н2O2 может
как гликолиз предпочтителен в синтезе биомас!
быть утилизирован каталазой или пероксидаза!
сы, видимо, поэтому покоящиеся клетки глав!
ми. СОД подразделяют на четыре основные груп!
ным образом используют митохондриальное
пы: Cu,Zn!СОД, Mn!СОД, Fe!СОД и Ni!СОД.
окислительное фосфорилирование, а быстро
Кроме того, имеются данные о Fe,Zn! и Co,Zn!
пролиферирующие - гликолиз [26]. Следует от!
БИОХИМИЯ том 86 вып. 7 2021
1020
САМУИЛОВ и др.
метить, что в быстро растущих опухолевых клет!
20 мин. Окрашенные плёнки эпидермиса про!
ках, для которых характерен аэробный глико!
мывали водой и исследовали на световом мик!
лиз, содержание АФК выше, чем в нормальных
роскопе («Carl Zeiss», Германия). Для каждого
клетках той же ткани [27].
варианта опыта подсчитывали долю клеток с
Глюкоза ускоряет гликолиз и подавляет
разрушенными ядрами и лишённых ядер из
окислительное фосфорилирование - это эф!
300-500 клеток в 2-3 плёнках эпидермиса.
фект Кребтри [28], характерный для дрожжей и
Поглощение или светозависимое выделе!
некоторых опухолевых клеток и имеющий об!
ние O2 высечками из листьев гороха (20 мг) из!
щие черты с эффектом Варбурга [29]. Цитозоль!
меряли с помощью закрытого платинового
ный NADH, продуцируемый при гликолизе,
электрода в полярографической ячейке, содер!
снижает проницаемость наружной мембраны
жащей 1,5 мл среды инкубации: 50 мМ Tricine!
митохондрий из клубней картофеля для ADP и
KOH, рН 7,8, 35 мМ NaCl и 1 мМ MgCl2. Высеч!
тем самым тормозит их дыхание, имитируя эф!
ки листьев гороха освещали сфокусированным
фект Кребтри [30]. Данные об аэробном глико!
светом галогеновой лампы, 250 Вт, с интенсив!
лизе у растений в литературе отсутствуют.
ностью света ∼2000 мкE⋅м-2⋅с-1. Интенсивность
В настоящей работе ДДК и триен, ингибиру!
света измеряли сенсором Quantitherm PAR/
ющие СОД, испытаны на клетках эпидермиса
Temp («Hansatech», Великобритания).
листьев растений. В опытах использованы
Для определения содержания глюкозы и
листья из проростков гороха разного возраста:
лактата в листьях гороха гомогенизировали
«молодые», 6-11!суточные, быстро растущие с
200 мг нарезок листьев, к гомогенату добавляли
интенсивными обменными реакциями и «ста!
300 мкл бидистиллированной воды, центрифу!
рые», 14-26!суточные, с замедленным ростом.
гировали 15 мин при 12 000 g, отбирали 300 мкл
Исследован эффект глюкозы в комбинации с
надосадочной жидкости и измеряли в ней глю!
ингибиторами СОД на гибель клеток и генера!
козу или лактат с помощью биохимического
цию АФК в эпидермисе из молодых и старых
анализатора Random Access А!25 («BioSystems
листьев гороха.
S.A.», Испания). Определение осуществлялось
по глюкозооксидазной и лактатоксидазной ре!
акциям с образованием Н2O2, который затем в
МАТЕРИАЛЫ И МЕТОДЫ
реакциях с 4!аминоантипирином и фенолом
или N!этил!N!(2!гидрокси!3!сульфопропил)!
Проростки гороха (Pisum sativum L. сорта
3!метиланилином, катализируемых пероксида!
Альфа) выращивали при периодическом осве!
зой, образовывал окрашенные хинонимины с
щении (свет - 16 ч, темнота - 8 ч) металлогало!
максимумами поглощения при 505 или 555 нм
геновой лампой ДРиЗ, 250 Вт, с интенсивностью
соответственно.
света ∼100 мкE⋅м-2⋅с-1. Использовали быстро
АФК определяли по образованию 2′,7′!ди!
растущие нераскрывшиеся листья с верхушки
хлорфлуоресцеина (DCF) из диацетата 2′,7′!
побегов молодых проростков, выращиваемых
дихлорфлуоресцина (DCFH!DA). Проникая в
6-11 суток, или медленно растущие листья, от!
клетки, DCFH!DA дезацетилируется внутрик!
делённые от середины побегов зрелых растений
леточными эстеразами и окисляется АФК, пре!
(14-26 суток), которые обозначены в работе как
имущественно Н2O2 с участием пероксидаз,
«молодые» или «старые» листья соответственно.
превращаясь в интенсивно флуоресцирую!
Гибель устьичных клеток гороха регистриро!
щий DCF. Образованию DCF могут способство!
вали по разрушению клеточных ядер [3]. Плён!
вать ионы металлов переменной валентности,
ки эпидермиса отделяли от листьев пинцетом,
например, Fe2+ и цитохром с, обладающий ак!
помещали в бидистиллированную воду и добав!
тивностью, сходной с пероксидазной [31, 32].
ляли реагенты (см. подписи к рисункам). Ин!
Образование АФК детектировали двумя спосо!
фильтрацию реагентов проводили под вакуу!
бами. 1. Плёнку эпидермиса, закреплённую на
мом, создаваемым с помощью вакуумного насо!
пластиковой пластинке с помощью силиконо!
са в течение 1 мин. Плёнки эпидермиса инкуби!
вого геля, помещали в кювету с 2 мл среды инку!
ровали с реагентами в полистирольных планше!
бации, содержащей 50 мМ Tricine!KOH, рН 7,8,
тах. После инкубации их обрабатывали фикса!
35
мМ NaCl и 1 мМ MgCl2, добавляли
тором Батталья (смесь хлороформа, 96%!ного
20 мкМ DCFH!DA. Флуоресценцию DCF изме!
этанола, ледяной уксусной кислоты и 40%!ного
ряли с помощью флуориметра VersaFluor («Bio!
формалина в соотношении 5/5/1/1) 5 мин, про!
Rad», США), возбуждая светом 485-495 нм и
мывали этанолом 10 мин для удаления фиксато!
регистрируя при 515-525 нм. 2. Плёнки эпидер!
ра, инкубировали 5 мин в воде и окрашивали
миса окрашивали 20 мкМ DCFH!DA в течение
ядерным красителем гематоксилином Карацци
30
мин и исследовали под микроскопом
БИОХИМИЯ том 86 вып. 7 2021
ЭФФЕКТЫ ИНГИБИТОРОВ СОД И ГЛЮКОЗЫ НА КЛЕТКИ РАСТЕНИЙ
1021
Axiovert 200M с конфокальной приставкой LSM
510Meta («Carl Zeiss», Германия). Флуоресцен!
цию DCF возбуждали светом лазера 488 нм и ре!
гистрировали при 500-530 нм.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
ДДК и триен, соединения, хелирующие Cu2+
и используемые в качестве ингибиторов СОД,
вызывали разрушение ядер устьичных клеток в
эпидермисе из листьев гороха (рис. 1). Действие
глюкозы зависело от возраста листьев. Глюкоза
сама по себе не влияла на состояние ядер усть!
ичных клеток, но усиливала разрушение ядер,
вызванное ингибиторами СОД в эпидермисе из
молодых листьев, и не оказывала влияния на
ДДК! и триен!зависимое разрушение ядер в
эпидермисе из старых листьев. 2!Дезоксиглю!
коза, ингибитор гликолиза, снимала эффект
глюкозы на клетки из молодых листьев, не ока!
зывая влияния на разрушение ядер в клетках из
старых листьев под действием ингибиторов
СОД и глюкозы (рис. 1).
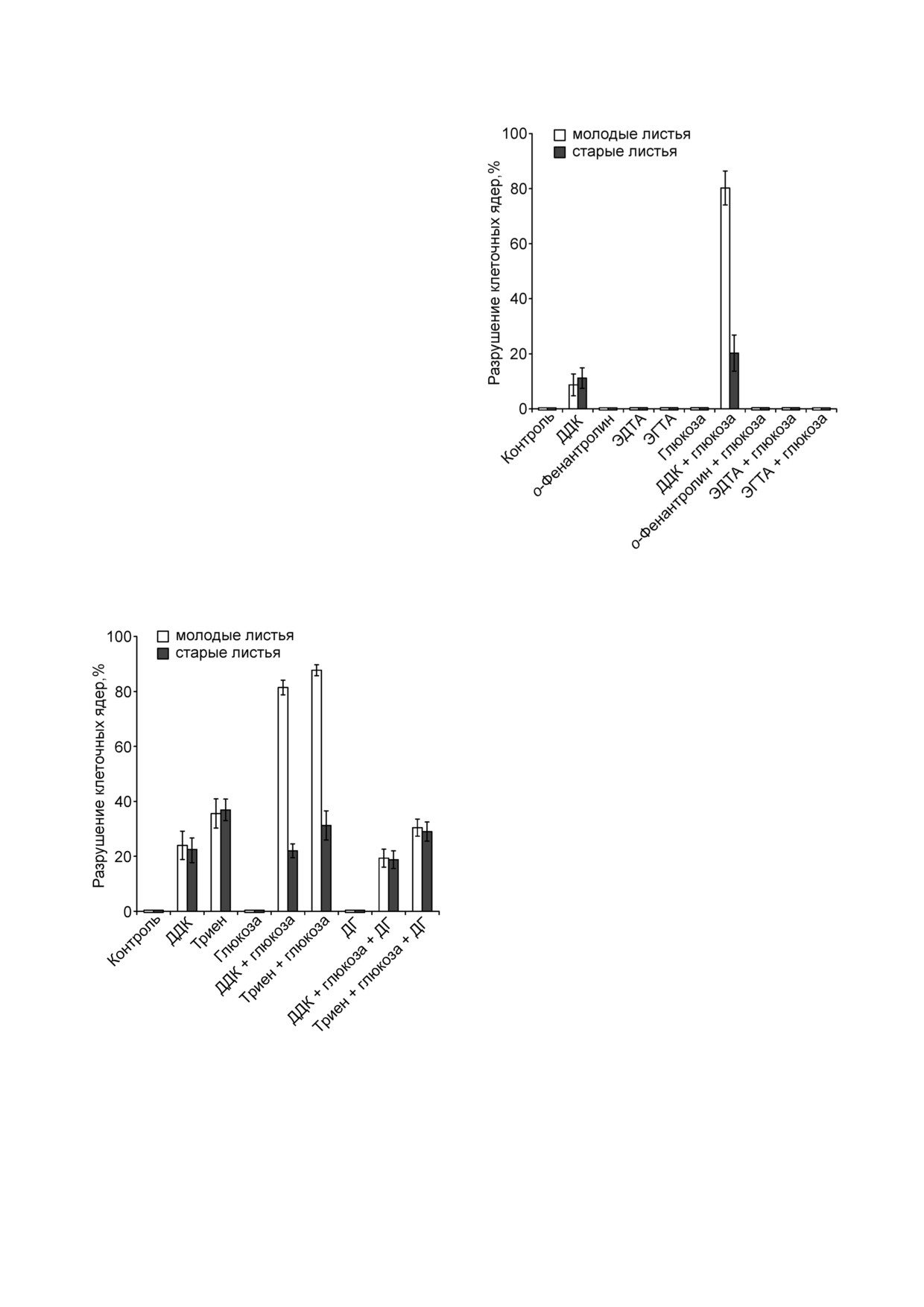
Было испытано действие других соедине!
Рис. 2. Действие ДДК, о!фенантролина, ЭДТА, ЭГТА и
ний, хелирующих ионы металлов, на разруше!
глюкозы на состояние ядер устьичных клеток в плёнках
эпидермиса из молодых и старых листьев гороха. Молодые
и старые листья из 8! или из 22!суточных проростков соот!
ветственно. К плёнкам эпидермиса добавляли 10 мМ ДДК,
10 мМ о!фенантролина, 10 мМ ЭДТА, 10 мМ ЭГТА и
5 мМ глюкозы, вакуумировали 1 мин и инкубировали 22 ч
в темноте
ние ядер устьичных клеток в эпидермисе из мо!
лодых или старых листьев гороха. о!Фенантро!
лин, ЭДТА и ЭГТА, в отличие от ДДК, не вызы!
вали разрушения ядер клеток сами по себе или в
комбинации с глюкозой (рис. 2).
Оксиметрически и по содержанию лактата
сравнивали реакции энергетического обмена
(дыхание, фотосинтетическое выделение O2 и
гликолиз) в молодых и старых листьях. Скорос!
ти выделения O2 на свету и темнового дыхания в
высечках из молодых листьев гороха были в
среднем в 2-3 раза выше, чем в высечках из ста!
рых листьев (рис. 3). Это согласуется с данными
о возрастных изменениях фотосинтеза и дыха!
ния в листьях растений [33, 34]. Добавка глюко!
зы не влияла на скорость дыхания. ДДК при!
мерно в 1,5 раза снижал скорость поглоще!
ния O2 в темноте молодыми листьями, но не
Рис. 1. Действие ДДК, триена, глюкозы и 2!дезоксиглюко!
влиял на дыхание старых листьев, а триен не
зы (ДГ) на состояние ядер устьичных клеток в плёнках
действовал на молодые листья, но на 80% уско!
эпидермиса из молодых и старых листьев гороха. Молодые
рял поглощение O2 старыми листьями (рис. 3).
и старые листья из 8! или из 14!суточных проростков соот!
Поскольку реакция, катализируемая СОД, про!
ветственно. К плёнкам эпидермиса добавляли 10 мМ ДДК,
10 мМ триена, 10 мМ глюкозы и 10 мМ ДГ, вакуумировали
исходит с выделением O2, ингибиторы СОД бу!
1 мин и инкубировали 23 ч в темноте
дут усиливать поглощение O2. Этот их эффект
БИОХИМИЯ том 86 вып. 7 2021
1022
САМУИЛОВ и др.
проявляется в большей степени на старых
листьях, что может свидетельствовать об увели!
чении в них скорости реакции, осуществляемой
СОД, т.е. о повышенном содержании O2 и/или
СОД в старых листьях. Так, в старых листьях
рапса активность СОД была выше, чем в моло!
дых, а концентрация O2 , напротив, уменьша!
лась с возрастом [35].
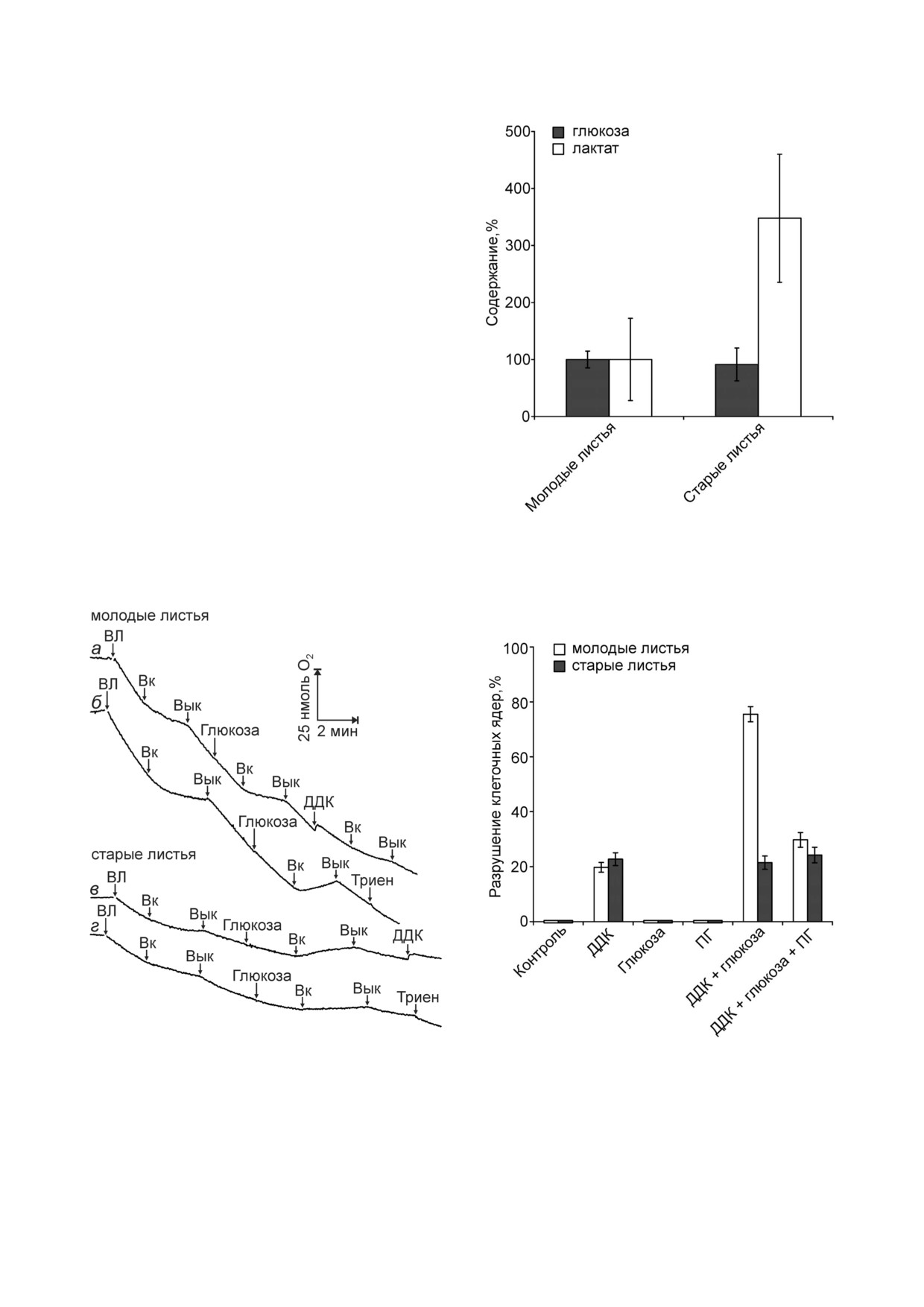
Концентрация глюкозы в молодых и старых
листьях гороха поддерживалась на одном уров!
не, но содержание лактата в старых листьях бы!
ло в 3-4 раза выше, чем в молодых (рис. 4). Это
может быть обусловлено потреблением проме!
жуточных продуктов гликолиза в молодых
листьях для синтеза органических соединений,
а также использованием пирувата в митохонд!
риальном дыхании.
Пропилгаллат, антиоксидант, имитирующий
действие СОД [36], подавлял разрушение ядер
клеток в эпидермисе из молодых листьев гороха,
вызванное ДДК и глюкозой, но не оказывал
влияния на разрушение ядер устьичных клеток
из старых листьев (рис. 5).
Рис. 4. Содержание глюкозы и лактата в молодых или ста!
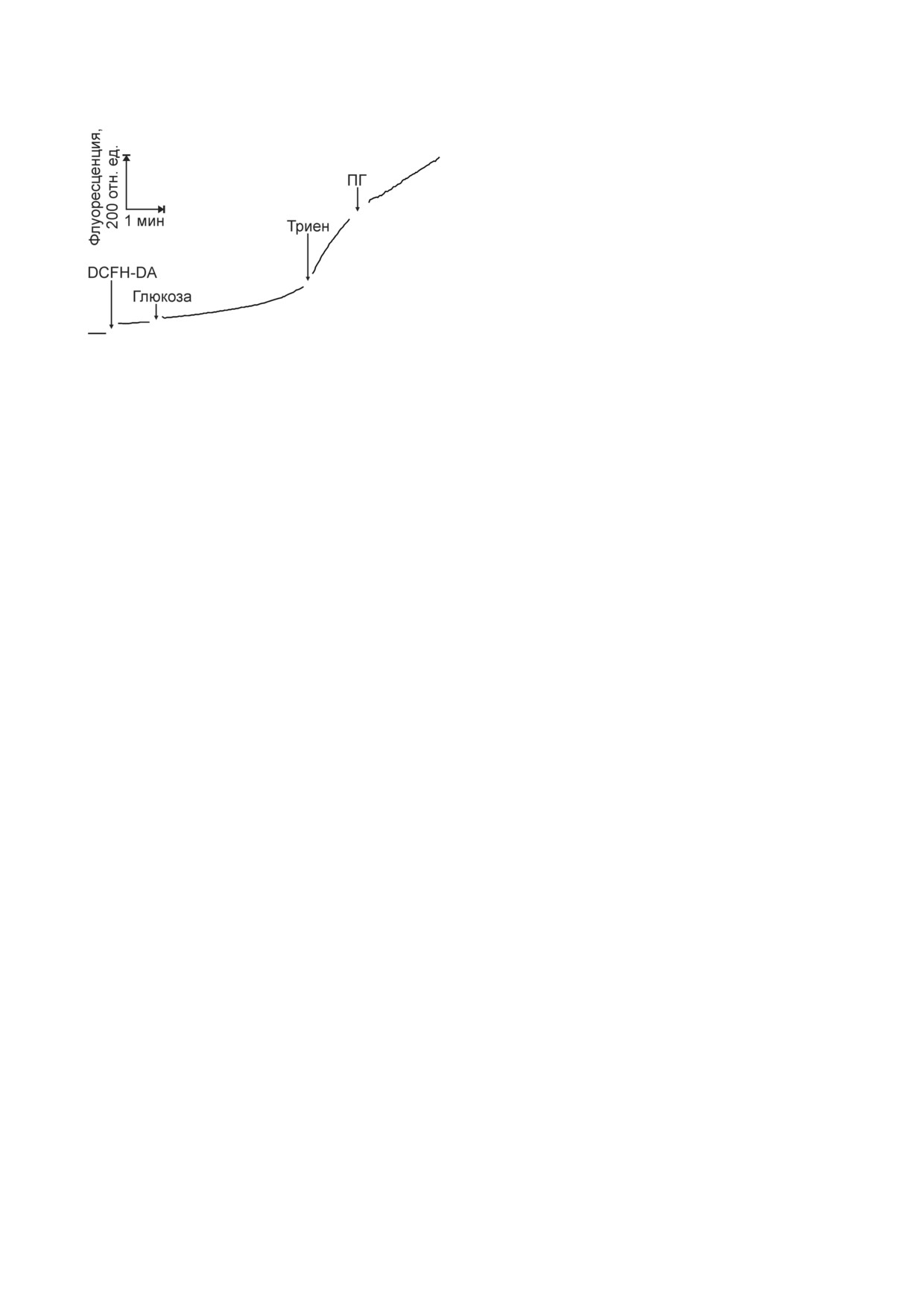
Глюкоза стимулировала образование АФК в
рых листьях гороха. Молодые и старые листья из 10! или
17!суточных проростков соответственно. За 100% принято
плёнке эпидермиса из листьев гороха, которое
усреднённое содержание глюкозы или лактата в молодых
листьях, которое соответствует 1,37 мг глюкозы или
10,2 мкг лактата на 1 г сырой массы листьев
Рис. 3. Дыхание и фотосинтетическое выделение O2 в вы!
Рис. 5. Действие ДДК, глюкозы и пропилгаллата (ПГ) на
сечках из молодых (а, б) или старых (в, г) листьев гороха:
состояние ядер устьичных клеток в плёнках эпидермиса из
действие глюкозы, ДДК и триена. Молодые и старые
молодых и старых листьев гороха. Молодые и старые
листья из 10! или 21!суточных проростков соответственно.
листья из 11! или из 26!суточных проростков соответ!
ВЛ - высечки листьев. Вк и Вык - включение и выключе!
ственно. К плёнкам эпидермиса добавляли 10 мМ ДДК,
ние света соответственно. Добавки: 20 мг ВЛ, 10 мМ глю!
10 мМ глюкозы и 0,1 мМ ПГ, вакуумировали 1 мин и инку!
козы, 10 мМ ДДК и 10 мМ триена
бировали 23 ч в темноте
БИОХИМИЯ том 86 вып. 7 2021
ЭФФЕКТЫ ИНГИБИТОРОВ СОД И ГЛЮКОЗЫ НА КЛЕТКИ РАСТЕНИЙ
1023
колизе у дрожжей Saccharomyces cerevisiae [38].
В этой работе высокое содержание глюкозы в
питательной среде дрожжей подавляло митохон!
дриальное дыхание (эффект Кребтри [28]), но
усиливало образование O2 , что свидетельствует
о зависимом от глюкозы образовании АФК. Ис!
точником O2 мог быть подобный NADPH!ок!
сидазе белок YNO1. С использованием мутантов
дрожжей с делецией в генах, кодирующих СОД,
установлено, что O2 , генерируемый при аэроб!
ном росте дрожжей на глюкозе, при участии
Cu,Zn!СОД превращается в Н2O2. Действуя ло!
кально Н2O2 стабилизирует казеинкиназу YCK1
Рис. 6. Действие глюкозы, триена и пропилгаллата (ПГ) на
плазматической мембраны, регулирующую по!
образование АФК в плёнке эпидермиса из листьев гороха,
регистрируемое по флуоресценции DCF. Использовали
давление дыхания и рецепцию глюкозы и ами!
молодые листья из 9!суточных проростков. Флуоресцен!
нокислот [38].
цию измеряли с помощью флуориметра. Добавки:
Ингибирование СОД приводит к накопле!
20 мкМ DCFH!DA, 10 мМ глюкозы, 10 мМ триена и
нию в клетках АФК (рис. 6) и разрушению кле!
0,5 мМ ПГ
точных ядер, а глюкоза усиливает разрушение
ядер в устьичных клетках в эпидермисе из моло!
регистрировали по флуоресценции DCF (рис. 6).
дых листьев гороха (рис. 1). Представляет инте!
Триен, ингибирующий СОД, увеличивал выход
рес, как добавка глюкозы может стимулировать
флуоресценции DCF. Антиоксидант, пропил!
образование АФК. Глюкоза эффективно дей!
галлат, снижал рост флуоресценции DCF, выз!
ствует на клетки из молодых листьев (рис. 1),
ванный глюкозой и триеном.
которые активнее пролиферируют, следователь!
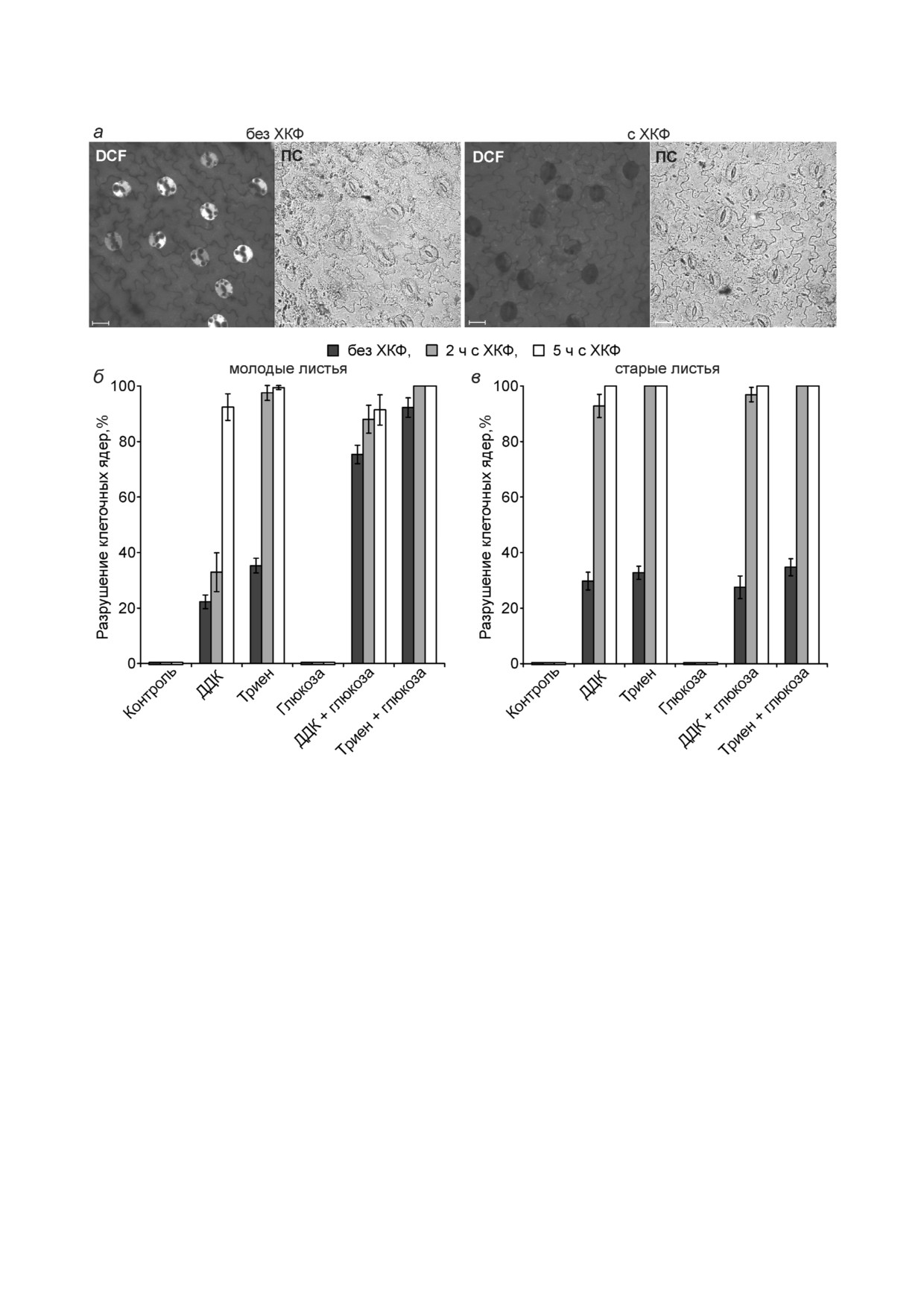
Обработка клеток протонофорными разоб!
но, гликолиз играет более значительную роль в
щителями значительно усиливает гликолиз [37].
их энергетическом и строительном обмене.
Протонофорный разобщитель м!хлоркарбонил!
Зависимая от глюкозы генерация АФК, ско!
цианидфенилгидразон (ХКФ) снижал выход
рее всего, не связана с митохондриями. Об этом
флуоресценции DCF в устьичных клетках эпи!
свидетельствуют результаты действия протоно!
дермиса из листьев гороха (рис. 7, а). Обработка
форного разобщителя. В митохондриях прото!
плёнок эпидермиса из молодых или старых
нофорные разобщители подавляют окислитель!
листьев гороха ХКФ с последующей отмывкой
ное фосфорилирование и образование АФК
от него усиливала разрушение ядер устьичных
[39]. Действительно, ХКФ снижал выход флуо!
клеток, вызванное ингибиторами СОД ДДК и
ресценции DCF в устьичных клетках горо!
триеном (рис. 7, б и в). При обработке плёнок
ха (рис. 7, а), но разрушение ядер, напротив,
эпидермиса ХКФ в течение 2 ч стимуляция раз!
усиливалось ХКФ (рис. 7, б и в). По!видимому, в
рушения ядер клеток, вызванного ДДК (без
клетках из старых листьев после обработки ра!
глюкозы), проявлялась лишь в старых листьях.
зобщителем происходит активация гликоли!
Данные о разрушении ядер клеток при
за [37] и возрастает разрушение ядер клеток -
действии ингибиторов СОД (рис. 1), отсутствии
как в клетках из молодых листьев при добавке
эффекта других комплексонов на ядра кле!
глюкозы. В молодых листьях ХКФ был менее
ток (рис. 2) и подавлении разрушения ядер про!
эффективен, чем в старых (рис. 7, б и в).
пилгаллатом, имитирующим СОД (рис. 5), под!
Не исключено, что стимуляция разрушения
тверждают, что ДДК! и триен!зависимая гибель
ядер протонофорным разобщителем связана не
клеток обусловлена подавлением активнос!
с АФК, а с деэнергизацией клеток: ХКФ усили!
ти СОД. Глюкоза усиливает зависимое от инги!
вал разрушение ядер устьичных клеток гороха,
биторов СОД разрушение ядер клеток. Действие
вызванное цианидом; ХКФ и 2!дезоксиглюкоза
глюкозы проявляется только на клетках из моло!
сами по себе вызывали гибель устьичных клеток
дых листьев и предотвращается ингибитором
при инкубации, длящейся двое суток и бо!
гликолиза 2!дезоксиглюкозой (рис. 1) - это сви!
лее [40].
детельствует о том, что эффект глюкозы опосре!
Предположительно, эффект глюкозы может
дован гликолизом. В этом процессе задействова!
быть опосредован гликолизом или пентозофос!
ны АФК, образование которых стимулируется
фатным путём, в которых происходит восстанов!
глюкозой и триеном (рис. 6).
ление NAD+ или NADP+ соответственно. С од!
Полученные данные соответствуют резуль!
ной стороны, NADH может играть роль антиок!
татам исследования роли СОД в аэробном гли!
сиданта: в митохондриях клеток он является ос!
БИОХИМИЯ том 86 вып. 7 2021
1024
САМУИЛОВ и др.
Рис. 7. Действие м!хлоркарбонилцианидфенилгидразона (ХКФ) на образование АФК в устьичных клетках, регистрируе!
мое по флуоресценции DCF (а) и действие ДДК, триена и глюкозы на состояние ядер устьичных клеток после обработки
ХКФ в плёнках эпидермиса из молодых (б) и старых (в) листьев гороха. Молодые листья из 9!суточных проростков (б),
старые листья из 16!суточных проростков (а) или из 21!суточных проростков (в). а - Плёнки эпидермиса 30 мин инкуби!
ровали с 20 мкМ DCFН!DA без ХКФ или с 1 мкМ ХКФ. Изображения получали методом конфокальной микроскопии.
Обозначения: DCF - флуоресценция DCF, ПС - изображение в проходящем свете. Масштабный отрезок - 20 мкм.
б, в - К плёнкам эпидермиса, необработанным ХКФ или преинкубированным 2 или 5 ч в темноте с 1 мкМ ХКФ, а затем
отмытым от ХКФ полосканием в 100 мл дистиллированной воды, добавляли 10 мМ ДДК, 10 мМ триена и 10 мМ глюко!
зы, вакуумировали 1 мин и инкубировали 22 (б) или 21 (в) ч в темноте
новной мишенью для синглетного кислорода
использован в качестве субстрата NADPH!окси!
(1O2) [41]. С другой стороны, NADH как донор
дазы плазматической мембраны, генерирующей
электронов для пероксидазы способствует обра!
внеклеточный O2 . Судя по всему, NADPH!окси!
зованию O2 [6]. Фенольные соединения ускоря!
даза плазматической мембраны задействована в
ют окисление NADH пероксидазой [42]. Так,
гибели клеток растений: её ингибиторы хинак!
NADH вызывал образование O2 в суспензии ми!
рин и дифенилениодоний подавляли разруше!
тохондрий из корней гороха, которое стимули!
ние ядер устьичных клеток гороха, вызванное
ровалось фенольными соединениями и было
CN- [44]. АФК в форме O2 , тем более образован!
обусловлено пероксидазой. NADH, добавлен!
ного снаружи клеток, не будут детектировать!
ный в среду инкубации, вызывал разрушение
ся DCF, что не противоречит данным рис. 7, а.
ядер устьичных клеток гороха, а фенольные сое!
Полученные результаты описывают дей!
динения усиливали его [43]. NADPH может быть ствие ингибиторов СОД и глюкозы на гибель
БИОХИМИЯ том 86 вып. 7 2021
ЭФФЕКТЫ ИНГИБИТОРОВ СОД И ГЛЮКОЗЫ НА КЛЕТКИ РАСТЕНИЙ
1025
клеток и генерацию АФК в эпидермисе из моло!
имени М.В. Ломоносова за предоставленную
дых и старых листьев гороха. В совокупности
возможность использовать оборудование, при!
данные могут свидетельствовать об образовании
обретенное за счет средств Программы развития
АФК, зависящем от гликолиза.
МГУ при финансовой поддержке Министерства
образования и науки РФ.
Конфликт интересов. Авторы заявляют об от!
Финансирование. Исследование выполнено в
сутствии конфликта интересов.
рамках научного проекта государственного за!
Соблюдение этических норм. Настоящее ис!
дания МГУ № 121042600047!9.
следование проводили без использования жи!
Благодарности. Авторы благодарны сотруд!
вотных и без привлечения людей в качестве ис!
никам Центра коллективного пользования МГУ пытуемых.
СПИСОК ЛИТЕРАТУРЫ
1.
Samuilov, V. D., Kiselevsky, D. B., Shestak, A. A., Nesov, A.
diethyldithiocarbamate with the copper of superoxide dis!
V., and Vasil’ev, L. A. (2008) Reactive oxygen species in pro!
mutase, J. Biol. Chem., 256, 8983!8986.
grammed death of pea guard cells, Biochemistry (Moscow),
14.
Benov, L., and Fridovich, I. (1996) Functional significance
73, 1076!1084, doi: 10.1134/s0006297908100039.
of the Cu,ZnSOD in Escherichia coli, Arch. Biochem.
2.
Sachdev, S., Ansari, S. A., Ansari, M. I., Fujita, M., and
Biophys., 327, 249!253, doi: 10.1006/abbi.1996.0117.
Hasanuzzaman, M. (2021) Abiotic stress and reactive oxy!
15.
Lushchak, V., Semchyshyn, H., Lushchak, O., and
gen species: generation, signaling, and defense mecha!
Mandryk, S. (2005) Diethyldithiocarbamate inhibits
nisms, Antioxidants, 10, 277, doi: 10.3390/antiox10020277.
in vivo Cu,Zn!superoxide dismutase and perturbs free rad!
3.
Samuilov, V. D., Lagunova, E. M., Kiselevsky, D. B.,
ical processes in the yeast Saccharomyces cerevisiae cells,
Dzyubinskaya, E. V., Makarova, Y. V., and Gusev, M. V.
Biochem. Biophys. Res. Commun.,
338,
1739!1744,
(2003) Participation of chloroplasts in plant apoptosis,
doi: 10.1016/j.bbrc.2005.10.147.
Biosci. Rep., 23, 103!117, doi: 10.1023/a:1025576307912.
16.
Kelner, M. J., Bagnell, R., Hale, B., and Alexander, N. M.
4.
Vasil’ev, L. A., Dzyubinskaya, E. V., Kiselevsky, D. B.,
(1989) Inactivation of intracellular copper!zinc superoxide
Shestak, A. A., and Samuilov, V. D. (2011) Programmed
dismutase by copper chelating agents without glutathione
cell death in plants: protective effect of mitochondrial!tar!
depletion and methemoglobin formation, Free Radic. Biol.
geted quinones, Biochemistry (Moscow), 76, 1120!1130,
Med., 6, 355!360, doi: 10.1016/0891!5849(89)90079!8.
doi: 10.1134/S0006297911100051.
17.
An, J., and Hsie, A. W. (1992) Effects of an inhibitor and a
5.
Samuilov, V. D., Kiselevsky, D. B., and Oleskin, A. V.
mimic of superoxide dismutase on bleomycin mutagenesis
(2019) Mitochondria!targeted quinones suppress the gen!
in Chinese hamster ovary cells, Mutat. Res., 270, 167!175,
eration of reactive oxygen species, programmed cell death
doi: 10.1016/0027!5107(92)90127!n.
and senescence in plants, Mitochondrion, 46, 164!171,
18.
An, J., and Hsie, A. W. (1993) Polymerase chain reaction!
doi: 10.1016/j.mito.2018.04.008.
based deletion screening of bleomycin induced 6!thiogua!
6.
Yamazaki, I., and Yokota, K. (1973) Oxidation states of
nine!resistant mutants in Chinese hamster ovary cells: the
peroxidase, Mol. Cell. Biochem., 2, 39!52, doi: 10.1007/
effects of an inhibitor and a mimic of superoxide dismu!
BF01738677.
tase, Mutat. Res., 289, 215!222, doi: 10.1016/0027!
7.
Dell’Aglio, E., Giustini, C., Kraut, A., Couté, Y.,
5107(93)90072!n.
Costa, A., et al. (2019) Identification of the Arabidopsis
19.
Pasteur, L. (1861) Expériences et vues nouvelles sur la
calmodulin!dependent NAD+ kinase that sustains the elic!
nature de fermentations, C. R. Acad. Sci., 52, 1260!1264.
itor!induced oxidative burst, Plant Physiol., 181, 1449!
20.
Racker, E. (1974) History of the Pasteur effect and its
1458, doi: 10.1104/pp.19.00912.
pathobiology, Mol. Cell. Biochem.,
5,
17!23,
8.
Imlay, J. A. (2013) The molecular mechanisms and physi!
doi: 10.1007/BF01874168.
ological consequences of oxidative stress: lessons from a
21.
Ленинджер А. (1985) Основы биохимии, Мир, Москва.
model bacterium, Nat. Rev. Microbiol., 11, 443!454,
22.
Lunt, S. Y., and Vander Heiden, M. G. (2011) Aerobic gly!
doi: 10.1038/nrmicro3032.
colysis: meeting the metabolic requirements of cell prolif!
9.
Wang, W., Xia, M. X., Chen, J., Yuan, R., Deng, F. N., and
eration, Annu. Rev. Cell Dev. Biol.,
27,
441!464,
Shen, F. F. (2016) Gene expression characteristics and reg!
doi: 10.1146/annurev!cellbio!092910!154237.
ulation mechanisms of superoxide dismutase and its physi!
23.
Pfeiffer, T., Schuster, S., and Bonhoeffer, S.
(2001)
ological roles in plants under stress, Biochemistry
Cooperation and competition in the evolution of ATP!pro!
(Moscow), 81, 465!480, doi: 10.1134/S0006297916050047.
ducing pathways, Science, 292, 504!507, doi: 10.1126/science.
10.
Alscher, R. G., Erturk, N., and Heath, L. S. (2002) Role of
1058079.
superoxide dismutases (SODs) in controlling oxidative
24.
Warburg, O., Posener, K., and Negelein, E. (1924) Über den
stress in plants, J. Exp. Bot., 53, 1331!1341.
stoffwechsel der carcinomzelle, Biochem. Z., 152, 309!344.
11.
Tsunoda, S., Kibe, N., Kurahashi, T., and Fujii, J. (2013)
25.
Warburg, O. (1956) On the origin of cancer cells, Science,
Differential responses of SOD1!deficient mouse embryon!
123, 309!314, doi: 10.1126/science.123.3191.309.
ic fibroblasts to oxygen concentrations, Arch. Biochem.
26.
Sokolov, S. S., Balakireva, A. V., Markova, O. V., and
Biophys., 537, 5!11, doi: 10.1016/j.abb.2013.06.008.
Severin, F. F. (2015) Negative feedback of glycolysis and
12.
Heikkila, R. E., Cabbat, F. S., and Cohen, G. (1976)
oxidative phosphorylation: mechanisms of and reasons for
In vivo inhibition of superoxide dismutase in mice by
it, Biochemistry (Moscow), 80, 559!564, doi: 10.1134/
diethyldithiocarbamate, J. Biol. Chem., 251, 2182!2185.
S0006297915050065.
13.
Cocco, D., Calabrese, L., Rigo, A., Argese, E., and
27.
Aykin!Burns, N., Ahmad, I. M., Zhu, Y., Oberley, L. W.,
Rotilio, G. (1981) Re!examination of the reaction of
and Spitz, D. R. (2009) Increased levels of superoxide and
6 БИОХИМИЯ том 86 вып. 7 2021
1026
САМУИЛОВ и др.
H2O2 mediate the differential susceptibility of cancer cells
dismutase mimic and protects cultured lens epithelial cells
versus normal cells to glucose deprivation, Biochem. J.,
from H2O2 insult, Exp. Eye Res., 76, 49!59, doi: 10.1016/
418, 29!37, doi: 10.1042/BJ20081258.
s0014!4835(02)00256!7.
28.
Crabtree, H. G. (1929) Observations on the carbohydrate
37. Sugiyama, Y., Shudo, T., Hosokawa, S., Watanabe, A.,
metabolism of tumours, Biochem. J.,
23,
536!545,
Nakano, M., and Kakizuka, A. (2019) Emodin, as a mito!
doi: 10.1042/bj0230536.
chondrial uncoupler, induces strong decreases in adenosine
29.
Diaz!Ruiz, R., Rigoulet, M., and Devin, A. (2011) The
triphosphate (ATP) levels and proliferation of B16F10
Warburg and Crabtree effects: on the origin of cancer cell
cells, owing to their poor glycolytic reserve, Genes Cells, 24,
energy metabolism and of yeast glucose repression,
569!584, doi: 10.1111/gtc.12712.
Biochim. Biophys. Acta, 1807, 568!576, doi: 10.1016/
38. Reddi, A. R., and Culotta, V. C. (2013) SOD1 integrates
j.bbabio.2010.08.010.
signals from oxygen and glucose to repress respiration, Cell,
30.
Lee, A. C., Zizi, M., and Colombini, M. (1994) Beta!
152, 224!235, doi: 10.1016/j.cell.2012.11.046.
NADH decreases the permeability of the mitochondrial
39. Korshunov, S. S., Skulachev, V. P., and Starkov, A. A.
outer membrane to ADP by a factor of 6, J. Biol. Chem.,
(1997) High protonic potential actuates a mechanism of
269, 30974!30980.
production of reactive oxygen species in mitochondria,
31.
LeBel, C. P., Ischiropoulos, H., and Bondy, S. C. (1992)
FEBS Lett.,
416,
15!18, doi:
10.1016/s0014!
Evaluation of the probe 2′,7′!dichiorofluorescin as an indi!
5793(97)01159!9.
cator of reactive oxygen species formation and oxidative
40. Dzyubinskaya, E. V., Kiselevsky, D. B., Lobysheva, N. V.,
stress, Chem. Res. Toxicol., 5, 227!231, doi: 10.1021/
Shestak, A. A., and Samuilov, V. D. (2006) Death of stoma
tx00026a012.
guard cells in leaf epidermis under disturbance of energy
32.
Karlsson, M., Kurz, T., Brunk, U. T., Nilsson, S. E., and
provision, Biochemistry (Moscow),
71,
1120!1127,
Frennesson, C. I. (2010) What does the commonly used
doi: 10.1134/s0006297906100105.
DCF test for oxidative stress really show? Biochem. J., 428,
41. Petrat, F., Pindiur, S., Kirsch, M., and de Groot, H. (2003)
183!190, doi: 10.1042/BJ20100208.
NAD(P)H, a primary target of 1O2 in mitochondria of
33.
Sesay, A., Stewart, C. R., and Shibles, R. M. (1986) Effects
intact cells, J. Biol. Chem., 278, 3298!3307, doi: 10.1074/
of KCN and salicylhydroxamic acid on respiration of soy!
jbc.M204230200.
bean leaves at different ages, Plant Physiol., 82, 443!447,
42. Brooks, J. L. (1983) Stimulation of peroxidase reactions by
doi: 10.1104/pp.82.2.443.
hydroxamates, Biochem. Biophys. Res. Comm., 116, 916!
34.
Moore, B. D., and Edwards, G. E. (1988) The influence of
921.
leaf age on C4 photosynthesis and the accumulation of
43. Самуилов В. Д., Киселевский Д. Б. (2016) Салицилгид!
inorganic carbon in Flaveria trinervia, a C4 Dicot, Plant
роксамат усиливает НАДН!оксидазную активность пе!
Physiol., 88, 125!130, doi: 10.1104/pp.88.1.125.
роксидазы в суспензиях митохондрий и хлоропластов
35.
Hajiboland, R., Rahmat, S., Zeinalzadeh, N., Farsad!
гороха, Вестник Московского университета. Серия 16,
Akhtar, N., and Hosseinpour!Feizi, M.!A.
(2019)
Биология, 1, 23!28, doi: 10.3103/S0096392516010089.
Senescence is delayed by selenium in oilseed rape plants,
44. Samuilov, V. D., Kiselevsky, D. B., Sinitsyn, S. V., Shestak,
J. Trace Elem. Med. Biol., 55, 96!106, doi: 10.1016/j.jtemb.
A. A., Lagunova, E. M., and Nesov, A. V. (2006) H2O2
2019.06.005.
intensifies CN-!induced apoptosis in pea leaves,
36.
Reddan, J. R., Giblin, F. J., Sevilla, M., Padgaonkar, V.,
Biochemistry (Moscow),
71,
384!394, doi:
10.1134/
Dziedzic, D. C., et al. (2003) Propyl gallate is a superoxide
s0006297906040067.
EFFECTS OF SUPEROXIDE DISMUTASE INHIBITORS
AND GLUCOSE ON CELL DEATH AND GENERATION
OF REACTIVE OXYGEN SPECIES IN PEA LEAVES
V. D. Samuilov1*, D. B. Kiselevsky1*, E. V. Dzyubinskaya1, and O. Yu. Frolova2
1 Lomonosov Moscow State University, Faculty of Biology, 119234 Moscow, Russia;
E<mail: vdsamuilov@mail.ru; dkiselevs@mail.ru
2 Lomonosov Moscow State University, Institute of Mitoengineering, 119234 Moscow, Russia
The effect of diethyldithiocarbamate (DDC) and triethylenetetramine (triene), superoxide dismutase (SOD)
inhibitors, and their combination with glucose on cells of the epidermis from pea leaves of different ages (fast grow!
ing young leaves and old leaves with slow growth) was investigated. DDC and triene caused the death of guard cells,
which was determined from the destruction of their nuclei. Glucose did not affect the destruction of nuclei that was
induced by SOD inhibitors in cells from old leaves, but increased it in cells from young leaves. 2!Deoxyglucose, a gly!
colysis inhibitor, and propyl gallate, an antioxidant that mimics SOD, suppressed the destruction of nuclei in cells of
the epidermis from young, but not from old leaves, which was caused by SOD inhibitors with glucose. Glucose and
triene stimulated, and propyl gallate reduced the generation of reactive oxygen species (ROS) in the pea epidermis,
that was determined from the fluorescence of 2′,7′!dichlorofluorescein (DCF). Carbonyl cyanide m!chlorophenyl
hydrazone (CCCP), a protonophoric uncoupler of oxidative and photosynthetic phosphorylation, suppressed DCF
fluorescence in guard cells. Treatment of cells with CCCP followed by removing it by washing increased the destruc!
tion of the nuclei that was caused by SOD inhibitors and glucose. In young leaves, CCCP was less effective than in old
ones. The results obtained demonstrate the effects of SOD inhibitors and glucose on cell death and generation of ROS
and apparently testify to glycolysis!dependent ROS production.
Keywords: glucose, superoxide dismutase, reactive oxygen species, programmed cell death, guard cells, pea
БИОХИМИЯ том 86 вып. 7 2021