БИОХИМИЯ, 2021, том 86, вып. 7, с. 1066 - 1077
УДК 543.94
НЕСПЕЦИФИЧЕСКИЙ СИНТЕЗ НУКЛЕИНОВЫХ КИСЛОТ
В РЕАКЦИЯХ ИЗОТЕРМИЧЕСКОЙ АМПЛИФИКАЦИИ
Обзор
© 2021
Н.В. Зырина1,2, В.Н. Антипова2*
1 Институт белка РАН, 142290 Пущино, Московская обл., Россия
2 Институт теоретической и экспериментальной биофизики РАН, 142290 Пущино,
Московская обл., Россия; электронная почта: valery_a@rambler.ru
Поступила в редакцию 10.02.2021
После доработки 16.04.2021
Принята к публикации 16.04.2021
В обзоре рассматривается проблема образования неспецифических продуктов при использовании различ
ных методов изотермической амплификации как результат действия целого ряда факторов: неспецифичес
ких взаимодействий праймеров, синтеза ДНК ab initio и проявления дополнительных активностей ДНК по
лимераз. Обсуждаются разрабатываемые подходы для устранения неспецифического синтеза в методах
LAMP, RPA, NASBA, RCA, SDA, LSDA, NDA и EXPAR.
КЛЮЧЕВЫЕ СЛОВА: изотермическая амплификация, фоновый синтез, ДНК полимеразы, LAMP, SDA,
EXPAR.
DOI: 10.31857/S0320972521070101
ВВЕДЕНИЕ
вирусов в клинических образцах [4]. Все чаще
она применяется при разработке новых страте
Изотермические методы амплификации
гий оценки безопасности пищевых продуктов и
нуклеиновых кислот разрабатываются как аль
мониторинга окружающей среды, при геноти
тернатива ПЦР, их применение особенно акту
пировании и обнаружении некодирующих
ально при проведении диагностики непосред
РНК, целевых белков, небольших молекул и ио
ственно в местах оказания медицинской помо
нов металлов, а также для конструирования
щи [1-3]. С 2000 х годов некоторые методы по
нуклеиновых кислот с заданными нанострукту
ставлены на коммерческую основу, например,
рами, гидрогелей, наноматериалов и прибо
созданы наборы NUCLISENS («bioMerieux»,
ров [5, 6]. Все разнообразие методов изотерми
Франция), Illustra TempliPhi™ («Cytiva», США),
ческой амплификации исчерпывающе описано
WarmStart® LAMP Kit
(«NEB», США) и
в работах, процитированных выше.
LavaLAMP™ DNA Master Mix
(«Lucigen»,
Тем не менее существует проблема, возника
США). В первую очередь изотермическая амп
ющая с «завидной» регулярностью и накладыва
лификация нашла практическое применение в
ющая ограничения на использование изотерми
обнаружении патогенных микроорганизмов и
ческой амплификации в качестве альтернативы
ПЦР. Она заключается в появлении неспецифи
ческих продуктов реакции, критически препят
Принятые сокращения: EXPAR - экспоненциаль
ная реакция амплификации нуклеиновых кислот (expo
ствующих идентификации или синтезу специ
nential amplification reaction); LAMP - петлевая изотерми
фических последовательностей в препаратив
ческая амплификация (loop mediated isothermal amplifica
ных количествах. Наличие таких продуктов
tion); NASBA - амплификация на основе последователь
приводит к ложноположительным результатам,
ности нуклеиновой кислоты (nucleic acid sequence based
amplification); PNA - пептидная нуклеиновая кислота
отрицательно влияет и на чувствительность ме
(peptide nucleic acid); RCA - амплификация по типу катя
тода, и на его специфичность, а также наклады
щегося кольца (rolling circle amplification); SDA - ампли
вает ограничение на максимальную длину син
фикация с замещением цепи (strand displacement amplifica
тезируемого фрагмента. Несмотря на актуаль
tion); RPA - рекомбиназная полимеразная амплификация
ность обозначенной проблемы, ей не уделяется
(recombinase polymerase amplification); SSB - белок, связы
вающий одноцепочечную ДНК (single strand binding pro
должного внимания. Работ, направленных
tein).
именно на изучение явления неспецифического
* Адресат для корреспонденции.
синтеза при использовании методов изотерми
1066
НЕСПЕЦИФИЧЕСКИЙ СИНТЕЗ ПРИ АМПЛИФИКАЦИИ
1067
ческой амплификации, не так много. Как пра
кации за счет стратегии праймирования и до
вило, в статьях, касающихся появления нового
вольно высокой температуры реакции (60 °С),
метода, о наличии фонового синтеза упомина
эта амплификация не исключается полностью;
ется лишь поверхностно. В данном обзоре мы
ее основной причиной считают образование ди
постарались обобщить данные исследований,
меров праймеров [8]. Первоначально обратный
посвященных проблеме появления неспецифи
внутренний праймер формирует гомодимер.
ческих продуктов при использовании различ
Достраивание полимеразой его 3′ конца приво
ных методов изотермической амплификации
дит к образованию двухцепочечного продукта,
или акцентирующих внимание на разрабатывае
содержащего фрагмент этого же праймера в об
мых подходах для устранения этих продуктов.
ратной ориентации. 5′ Конец такого продукта в
Существует несколько основных причин
процессе спонтанной обратимой денатурации
возникновения неспецифических продуктов:
может гибридизоваться с 3′ концом прямого
образование комплементарными участками
внутреннего праймера, образуя прерванную
праймеров димеров и шпилек, способных к уд
матрицу. На этой матрице ДНК полимераза Bst
линению ДНК полимеразой; взаимодействие
ведет дальнейший синтез комплементарной це
праймеров с матрицей в неспецифических
пи ДНК, используя, в свою очередь, денатури
участках; дополнительные активности ДНК по
ровавший
3′ конец обратного внутреннего
лимераз, а также синтез ДНК ab initio.
праймера, синтезируя при этом последователь
ность, комплементарную прямому внутреннему
праймеру. Дойдя до конца матрицы, ДНК поли
НЕСПЕЦИФИЧЕСКИЕ
мераза может далее наращивать длину цепи пу
ВЗАИМОДЕЙСТВИЯ ПРАЙМЕРОВ
тем вытеснения последовательностей, исполь
зовавшихся в качестве матрицы на предыдущем
При использовании методов изотермичес
этапе. Эти процессы приводят к образованию
кой амплификации, перечисленных ниже, ос
внутримолекулярных шпилек, служащих прай
новной причиной образования неспецифичес
мерами для дальнейшей амплификации. Неза
ких продуктов считают нежелательные взаимо
висимо от последовательности матрицы поли
действия комплементарных участков праймеров
мераза может добавлять от одного до несколь
с образованием димеров и шпилек, способных к
ких нуклеотидов, что приводит к появлению пу
удлинению с участием ДНК полимеразы, а так
ла шпилек, 3′ концы которых содержат некото
же неспецифические взаимодействия прайме
рое количество случайных нуклеотидов. После
ров с матрицей.
довательности с комплементарными 3′ конца
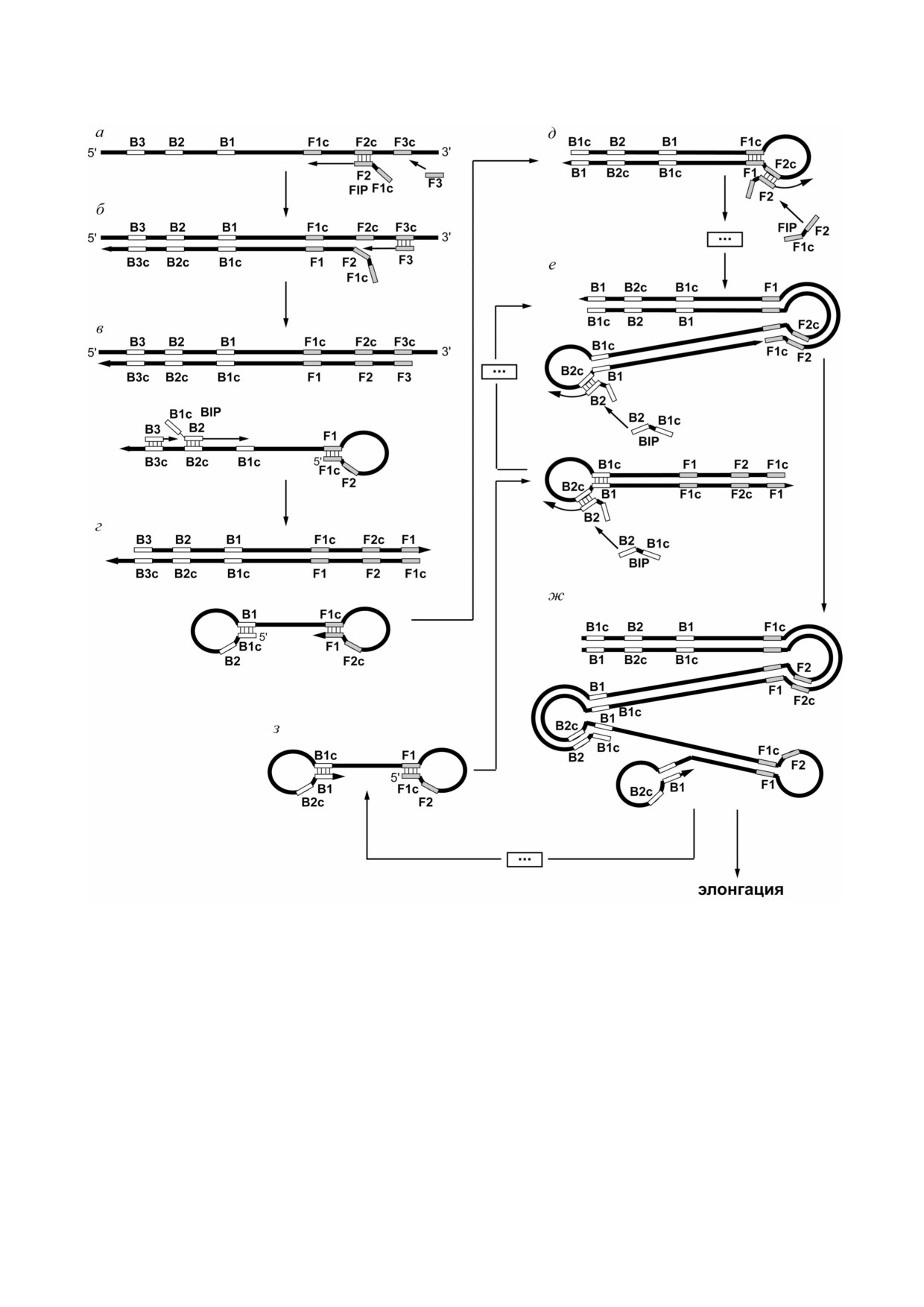
Метод петлевой изотермической амплифика5
ми селективно амплифицируются in vitro. Двух
ции (loop5mediated isothermal amplification, LAMP)
цепочечный продукт этой амплификации пос
позволяет нарабатывать целевую последова
редством внутримолекулярной водородной свя
тельность двухцепочечной ДНК за счёт само
зи может образовывать структуру, подобную
праймирования шпилечными структурами, ко
гантели, и амплифицироваться по стандартному
торые образуются в ходе реакции [7]. Для этого
механизму LAMP. Для улучшения аналитичес
конструируется набор праймеров: пара внешних
кой специфичности анализа в реакции LAMP
(буферных) и пара внутренних. Внешние прай
предложили исключить обнаружение продуктов
меры являются вспомогательными и служат для
неспецифической амплификации, детектируя
вытеснения цепей, синтезированных с внутрен
только амплификацию мишени с помощью зон
них праймеров, комплементарных целевым
дов, маяков, флуоресцентного (Фёрстеровско
последовательностям. Внутренние праймеры
го) резонансного переноса энергии (FRET) или
конструируются так, чтобы при дальнейшем
схем «репортер гаситель» [8]. Другой подход
синтезе ДНК образовывались инвертированные
заключается в использовании оригинальной ма
повторы, замыкающиеся в шпилечные структу
тематической модели, позволяющей предсказы
ры (рис. 1). На каждом последующем этапе ре
вать размер, количество и специфичность иско
акции собираются все более сложные тандем
мых продуктов в зависимости от целевой ДНК,
ные шпилечные структуры, каждая из которых
набора праймеров, а также условий реакции.
содержит копию целевой последовательности. В
Эта модель была разработана авторами на осно
реакции используют ДНК полимеразу Bst, ко
ве экспериментальных данных с использовани
торая обладает активностью замещения цепи и
ем электрофореза на чипе, позволяющем оце
способна проходить шпилечные структуры без
нить структуры, которые образуются в ходе ре
диссоциации от матрицы.
акции LAMP [9]. Еще один способ снижения
Несмотря на заверения авторов метода о
количества неспецифических продуктов - вне
незначительности неспецифической амплифи
сение в реакцию пуллулана и других химических
БИОХИМИЯ том 86 вып. 7 2021
1068
ЗЫРИНА, АНТИПОВА
Рис. 1. Основные этапы петлевой изотермической амплификации: а-г - образование стартового продукта; д-з - цикли
ческий синтез и элонгация ДНК со шпилечными структурами. F2c и B2 - фланги, F1c и B1 - внутренние участки целе
вой (амплифицируемой) последовательности, F3c и B3 - «внешние» последовательности; FIP (forward inner primer) -
прямой внутренний праймер с участками F1c и F2, BIP (backward inner primer) - обратный внутренний праймер с участ
ками B1c и B2, F3 - внешний (буферный) прямой праймер, B3 - внешний (буферный) обратный праймер. Прямоуголь
никами обозначены комплементарные последовательности: серые - F1c и F1, F2c и F2, F3c и F3, белые - B1c и B1, B2c
и B2, B3c и B3, где c - обозначение комплементарной цепи. Стрелки - направление синтеза, | | | | - гибридизация, · · · -
промежуточные продукты. Начало процесса показано с праймера FIP; следует помнить, что синтез начинается и с прай
мера BIP. Предложено согласно работе Notomi et al. [7]
соединений, предположительно, стабилизиру
Рекомбиназная полимеразная амплификация
ющих структуру праймеров и предотвращающих
(recombinase polymerase amplification, RPA) осно
формирование их димеров в отсутствие целевой
вана на использовании рекомбиназы, которая
ДНК [10].
катализирует гибридизацию пары праймеров с
БИОХИМИЯ том 86 вып. 7 2021
НЕСПЕЦИФИЧЕСКИЙ СИНТЕЗ ПРИ АМПЛИФИКАЦИИ
1069
гомологичными последовательностями ампли
Амплификация на основе последовательности
фицируемого участка матрицы с последующей
нуклеиновой кислоты (nucleic acid sequence5based
элонгацией с помощью ДНК полимеразы Bsu,
amplification, NASBA) разработана для амплифи
обладающей свойством замещения цепи. Ста
кации РНК. ДНК можно амплифицировать
билизацию получаемых в процессе реакции
этим способом в том случае, если она вступает в
промежуточных продуктов обеспечивает белок,
реакцию в одноцепочечной форме [18]. Экспо
связывающий одноцепочечную ДНК (single
ненциальная амплификация целевых последо
stranded DNA binding protein, SSB) [11]. Появле
вательностей РНК происходит за счет сопря
ние неспецифических продуктов в данной реак
женных реакций обратной транскрипции, тран
ции объясняют нежелательными взаимодей
скрипции интермедиатов кДНК и удалении
ствиями между праймерами при невысокой
РНКазой H цепи РНК с кДНК. Несмотря на вы
температуре процесса (37 °C). Для уменьшения
сокую специфичность реакции NASBA, пробле
этих взаимодействий предлагается использовать
ма появления продуктов, приводящих к ложно
олигонуклеотид, содержащий тетрагидрофура
положительным результатам, все же существует
новый миметик апурин апиримидинового сай
[19]. В качестве основной причины традицион
та (AP сайта), фланкированный флуорофором и
но рассматривается неспецифическая гибриди
гасителем, а также 3′ конец, заблокированный
зация и димеризация праймеров [20]. Для ее уст
дидеоксицитозином (ddC). Флуоресценция ин
ранения рекомендуется проводить оптимиза
тактной конструкции находится на низком
цию условий реакции и тщательный расчет из
уровне, а блок на 3′ конце не позволяет олиго
менения свободной энергии Гиббса (ΔG) и тем
нуклеотиду выступать в качестве праймера в ре
пературы плавления (Tm) при конструировании
акции амплификации. После гибридизации
праймеров, например, с помощью сетевого ре
олигонуклеотида с матричной ДНК эндонук
сурса DINAMelt [21]. NASBA позволяет с высо
леаза IV E. coli узнает и расщепляет миметик
кой точностью выявлять целевую РНК в присут
AP сайта, флуоресценция усиливается, образу
ствии фоновой двухцепочечной ДНК [22]. На
ется свободный 3′ конец на разрезанной цепи
личие большого количества фоновой РНК мо
праймера, который удлиняется полимеразой.
жет мешать амплификации целевых последова
Значительно снизить образование димеров
тельностей, но эта проблема устранима разведе
праймеров позволяет принцип самоисключаю
нием исследуемого образца [23]. Проблема не
щего молекулярного распознавания (self avoid
специфического синтеза в NASBA стоит наиме
ing molecular recognition systems, SAMRS) [12].
нее остро, что позволяет использовать эту реак
Праймеры не взаимодействуют друг с другом, а
цию для развития диагностических мето
связываются исключительно с флангами целе
дов [24].
вой последовательности за счет замены естест
Амплификация по типу катящегося кольца
венных нуклеотидов в некоторых положениях
(rolling circle amplification, RCA) осуществляется
на нуклеотидные аналоги. Для увеличения спе
на ковалентно замкнутом олигонуклеотиде
цифичности взаимодействия олигонуклеотидов
(зонде), гибридизованном с целевой последова
и ДНК, было предложено использовать пептид
тельностью ДНК [25]. С участком зонда также
ные нуклеиновые кислоты (PNAs) [13], однако
гибридизуется другой олигонуклеотид, после
гибридизация PNA с целевой последователь
чего ДНК полимераза удлиняет его, проходя
ностью требует отдельного этапа реакции. Для
множество раз «по кольцу» зонда, синтезируя
снижения вероятности неспецифической гиб
его тандемные копии, включающие в себя пос
ридизации праймеров особое внимание реко
ледовательность целевой ДНК.
мендуется уделять их дизайну [14, 15]. Пакет
В мультипраймерной RCA, или амплификации
PrimedRPA позволяет автоматизировать созда
с множественным замещением цепи (multiple dis5
ние праймеров и наборов зондов [16]. Причи
placement amplification, MDA), с кольцевым оли
ной неспецифической амплификации также
гонуклеотидом или с продуктами реакции гиб
может быть гибридизация праймеров с «фоно
ридизуется несколько праймеров [25-27]. В ре
вой» (тотальной) ДНК, присутствующей в реак
акциях используют ДНК полимеразы phi29 или
ции вместе с целевыми последовательностями,
Bst, а также белок SSB gp32 фага T4 (T4 gp32). В
например, в образцах крови или окружающей
одной из первых работ по данному методу было
среде [17]. С проблемой позволяет справиться
показано, что стандартная денатурация двухце
метод «обогащения» реакции, основанный на
почечной матрицы ДНК приводила к ее дегра
связывании целевой ДНК с иммобилизованным
дации, после чего специфичность реакции сни
олигонуклеотидом с последующим ее элюиро
жалась, а большая часть продуктов представляла
ванием в реакционную смесь после удаления
собой артефакт амплификации, не содержащий
примесей.
целевой последовательности [27]. Неспецифи
БИОХИМИЯ том 86 вып. 7 2021
1070
ЗЫРИНА, АНТИПОВА
ческие высокомолекулярные (более 10 тыс. п.н.)
Wang et al. [31]. Предложенный механизм вклю
продукты амплификации геномной ДНК были
чает следующие основные этапы: гибридизацию
обнаружены в контрольных образцах, куда до
и удлинение праймера на олигонуклеотидной
бавляли олигонуклеотиды и дезоксинуклеотиды
матрице, гибридизацию выступающего 3′ конца
(dNTPs), но не добавляли матрицу [28]. Их об
матрицы с участком продукта удлинения прай
разование объяснили самопраймированием с
мера «своего» же дуплекса за счет ошибочного
последующей амплификацией. Устранить неже
спаривания, последующее связывание полиме
лательную реакцию удалось с помощью введе
разой этого комплекса и удлинение 3′ конца
ния в последовательности праймеров спейсе
матрицы (рис. 2). Многократная инициация
ра С3 (фосфорамидитного) или спейсера С18
синтеза как праймерами, так и одноцепочечны
(гексаэтиленгликоля) на некотором расстоянии
ми продуктами реакции вызывает экспоненци
от 5′ концов. Олигонуклеотиды с такими моди
альное накопление длинных мультимерных
фикациями имели возможность гибридизовать
продуктов. Такая амплификация инициируется
ся с целевыми последовательностями, но не
только способными к замещению цепи и обрат
могли служить матрицами в том случае, если
ной транскрипции ДНК полимеразами Bst, Bsm
произошло самопраймирование. С проблемой
и BcaBEST.
появления неспецифических высокомолеку
Для предотвращения мультимеризации ДНК
лярных продуктов в контрольных образцах, не
было предложено использовать праймеры с мо
содержащих матрицу, столкнулись и при прове
дифицированными межнуклеотидными фос
дении RCA с добавлением никующей эндонук
фатными группами [32]. Введение трех и более
леазы (PG-RCA), но связали это с неспецифи
фосфорилгуанидиновых групп в центр прайме
ческой полимеризацией субстратов ДНК поли
ров предотвращало мультимеризацию и при
меразой [29]. Снижения уровня неспецифичес
этом не ингибировало специфическую ампли
кой амплификации удалось достичь оптимиза
фикацию. Для общего подавления синтеза по
цией условий реакции: уменьшением концент
бочных продуктов использовали белок SSB
раций dNTPs и ДНК полимеразы, подбором
Thermus thermophilus [33, 34].
оптимальной концентрации хлорида магния.
Амплификации с замещением цепи (strand dis5
Изменение температуры реакции, добавление
placement amplification, SDA) основана на внесе
веществ, увеличивающих эффективность реак
нии эндонуклеазой рестрикции одноцепочеч
ции, или наоборот, ингибиторов ДНК полиме
ного разрыва (ника) в немодифицированную
раз, на уровень неспецифического синтеза не
цепь целевой последовательности двухцепочеч
влияли.
ной ДНК и удлинении ДНК полимеразой
Продукты неспецифической амплификации
3′ конца этого ника с вытеснением цепи исход
в виде набора мультимеров (тандемно располо
ного дуплекса в ходе синтеза новой цепи. Вы
женных повторов последовательности исходной
тесненная цепь, в свою очередь, служит матри
ДНК матрицы), синтезируемые полимера
цей для синтеза комплементарной цепи [35].
зой Bst, оказалось невозможным отличить от
Дальнейшее развитие метод SDA получил с
продуктов реакции RCA, результатом которой
открытием никующих эндонуклеаз (никаз). Эти
также является набор ДНК кратной длины (кон
ферменты узнают определенную последователь
катемеров), поскольку на электрофореграмме и
ность, подобно эндонуклеазам рестрикции, но
те и другие проявляются в виде лестницы фраг
гидролизуют только одну из цепей. На основе
ментов [30]. Существенным условием для муль
никаз предложен целый ряд методов изотерми
тимеризации является наличие коротких
ческой амплификации ДНК [36-40] (подробно
(50-60 п.н.) ДНК дуплексов, образующихся за
в обзорной статье [41]). Наиболее распростра
счет удлинения праймера в гомо и гетеродиме
нен метод экспоненциальной реакции амплифи5
рах или после отжига на матрице. Эффектив
кации нуклеиновых кислот (exponential amplifica5
ность мультимеризации зависит от условий ре
tion reaction, EXPAR), в котором амплифициру
акции: наибольшая наблюдается в буферах с вы
ют олигонуклеотидные последовательности
сокой концентрацией соли в присутствии вос
ДНК, используя термофильные ферменты - ни
становителей (β меркаптоэтанол) и при субоп
казу Nt.BstNBI и ДНК полимеразу Bst
тимальной для ДНК полимеразы температуре
(рис. 3, а-г) [37].
реакции. Формирования нежелательных муль
Проблема синтеза побочных продуктов, ин
тимеров в реакциях с ДНК полимеразой Bst
терферирующих с целевыми, стала ключевой
можно избежать, используя краситель SYBR
уже с появления первых работ по данному мето
Green I. Образование мультимеров на линейной
ду [35, 42]. Их наличие объясняли неспецифи
одноцепочечной матрице ДНК с одним прайме
ческим связыванием праймеров с тотальной
ром в изотермических условиях описали
ДНК, присутствующей в образцах, или образо
БИОХИМИЯ том 86 вып. 7 2021
НЕСПЕЦИФИЧЕСКИЙ СИНТЕЗ ПРИ АМПЛИФИКАЦИИ
1071
ванием димеров праймеров с последующей амп
смесь перед внесением dNTPs и ДНК полиме
лификацией в случае проведения реакции при
разы. Проблеме устранения фоновой амплифи
невысокой температуре [42, 43]. Однако повы
кации на начальных этапах EXPAR посвящена
шение температуры реакции и замена мезо
также работа Raid et al. [47]. В качестве причины
фильных ферментов exo фрагмента Кленова и
неспецифического синтеза в ней рассматривали
эндонуклеазы HincII термофильными эндонук
возможность достраивания полимеразой
леазами рестрикции и ДНК полимеразами с
3′ концов матрицы, формирующихся в резуль
лучшей активностью вытеснения цепи и про
тате временных взаимодействий: внутримолеку
цессивностью не позволило полностью решить
лярной гибридизации одной матрицы (форми
проблему [43, 44]. Изучены возможности устра
рование шпильки), межмолекулярной гибриди
нения неспецифических взаимодействий путем
зации 3′ конца одной матрицы с каким либо
оптимизации праймеров для реакций SDA [45].
участком другой матрицы EXPAR, взаимодей
Продукты, образующиеся в результате таких
ствия нескольких участков одной матрицы с
взаимодействий, выявляли на электрофоре
участками другой. Для решения этих проблем
грамме в виде лестницы фрагментов. Секвени
было предложено две стратегии: блокирование
рование этих продуктов показало, что они обра
3′ конца матрицы, например, с помощью пеп
зованы путем конкатемеризации праймера. Для
тидной нуклеиновой кислоты, и независимое от
решения этой проблемы с целью повышения
последовательности ослабление взаимодей
точности гибридизации праймеров с целевой
ствий матрица-матрица. Добавление белка SSB
последовательностью был разработан компью
E. сoli для снижения взаимодействий матриц
терный алгоритм.
EXPAR приводило к снижению неспецифичес
В EXPAR неспецифический фоновый синтез
кой амплификации на три порядка.
отмечали на начальных этапах реакции (ранняя
Еще одной причиной синтеза неспецифи
фаза) [46]. Было выдвинуто предположение, что
ческих продуктов в реакциях изотермической
полимераза связывается с одноцепочечной мат
амплификации ДНК может быть неконтролируе
рицей и полимеризует на ней dNTPs, не требуя
мая активность используемых никаз [41]. Для
праймера. Неспецифический синтез удавалось
регулирования активности предложили добав
значительно снизить, прогревая реакционную
лять в реакционную смесь модуляторы актив
Рис. 2. Основные этапы образования мультимеров на линейной одноцепочечной матрице: а, б - гибридизация и удлине
ние праймера; в - ошибочное спаривание выступающего 3′ конца матрицы с удлиненным праймером в дуплексе и нача
ло копирования цепи удлиненного праймера; г, д, е - образование мультимерных продуктов. a, a1, b, с - последователь
ности на матрице; одинаковые цвета обозначают комплементарные участки матрицы и праймера или продукта синтеза,
стрелки - направление синтеза. Предложено согласно работе Wang et al. [31]
БИОХИМИЯ том 86 вып. 7 2021
1072
ЗЫРИНА, АНТИПОВА
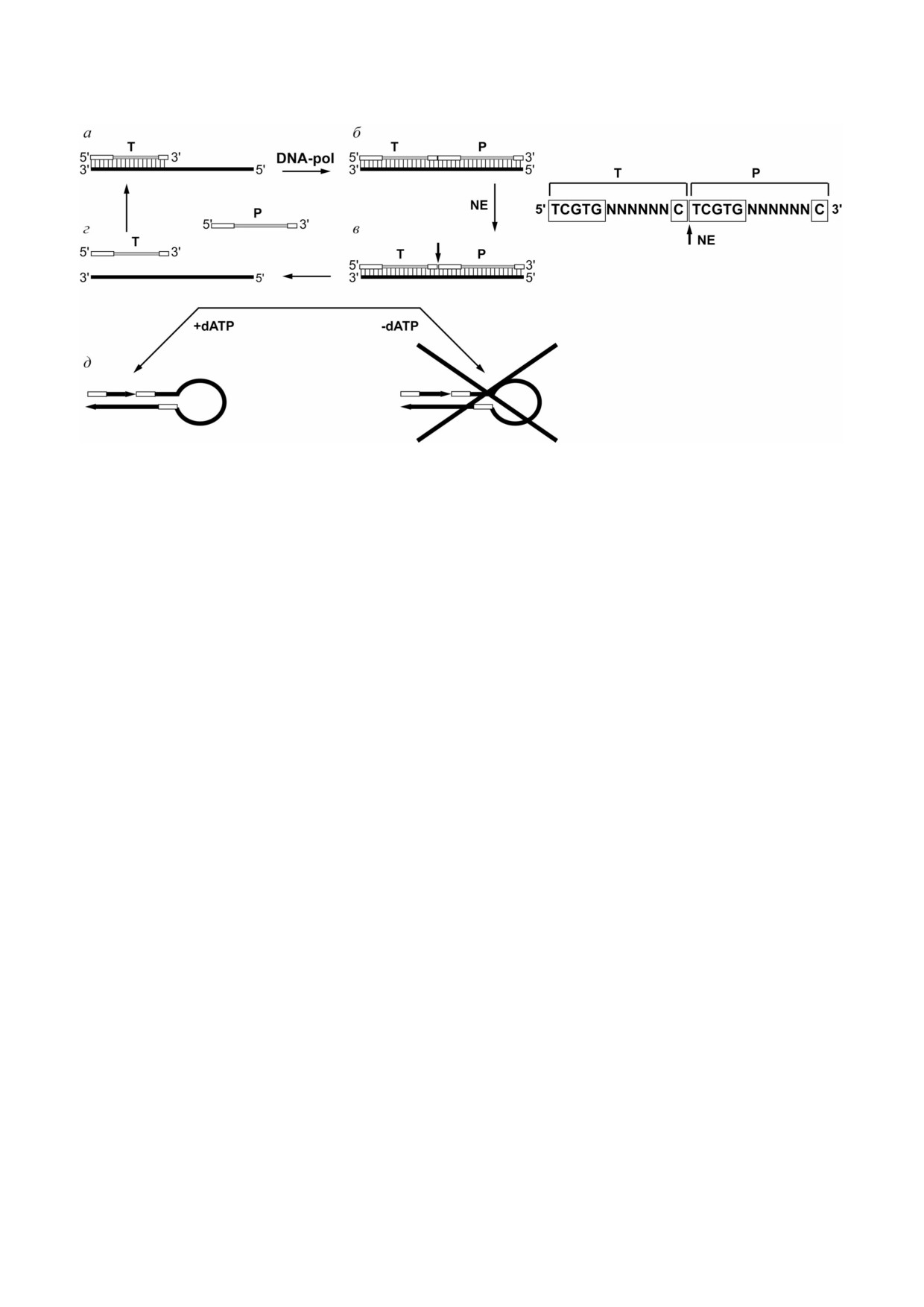
Рис. 3. Метод EXPAR, синтез целевого и неспецифических продуктов: а - гибридизация олигонуклеотида триггера, со
держащего часть последовательности сайта узнавания никазы на матрице; б - удлинение триггера ДНК полимеразой и
образование полного сайта узнавания никазы (в рамке) и олигонуклеотидного продукта; в - гидролиз сайта никазы;
г - диссоциация комплекса между триггером, продуктом и матрицей; д - побочная реакция образования неспецифичес
ких продуктов. Последовательность, синтезируемая на матрице, вынесена отдельно: T - олигонуклеотид триггер,
Р - олигонуклеотид продукт, в рамке - сайт узнавания никазы, DNA pol - ДНК полимераза, NE - никаза, N - любой
нуклеотид. Предложено согласно работам Van Ness et al., Urtel et al. [37, 52]
ности никаз - короткие (до 30 п.н.) синтетичес
жет выступать синтез ДНК ab initio, или безмат
кие дуплексы ДНК. При температуре 20 °С эти
ричный синтез [29, 38, 46, 49-52]. Этот феномен
дуплексы образуют непродуктивный комплекс с
представляет собой способность ДНК полиме
ферментом и блокируют его активность. Повы
раз синтезировать ДНК без добавления какой
шение температуры до 40-50 °С вызывает дис
либо ДНК или РНК в реакционную смесь [53].
социацию комплекса никазы и дуплекса инги
Результатом синтеза является спектр продуктов
битора, приводя к инициации гидролиза целе
от нескольких десятков до десятков тысяч п.н.
вой ДНК. Однако авторы подхода не показали
Скорость синтеза ДНК ab initio значительно уве
результат его практического применения в SDA,
личивается при добавлении в реакционную
а именно устранение неспецифических продук
смесь эндонуклеаз рестрикции и никаз [54-56],
тов реакции.
а также праймазы или хеликазы [57, 58]. Синтез
И, наконец, в качестве общей стратегии
ДНК в отсутствие матрицы и праймера впервые
улучшения аналитической специфичности ме
был обнаружен Корнбергом и его коллегами
тода SDA было предложено использовать схе
[59]. Однако научная общественность скепти
мы, определяющие только специфическую амп
чески отнеслась к этим данным, считая, что
лификацию целевой последовательности [44,
синтез мог проходить за счет примесей ДНК или
48]. Среди множества методов, использующих
присутствующих в препаратах ДНК полимераз
эту стратегию, интересной представляется изо
других ферментов, способных инициировать
термическая амплификация, основанная на за
непраймируемый синтез. Спустя 30 лет японс
висимой от матрицы элонгации (template
кие исследователи, работая с термофильными
dependent extension based isothermal amplifica
ДНК полимеразами Tli и Tth, вновь открыли
tion, TEIA), поскольку при ее разработке макси
это явление [60, 61]. Для освобождения от воз
мально учитывали причины появления неспе
можных примесей они использовали высоко
цифических продуктов [39].
очищенные реактивы и полимеразы, обрабаты
вали ДНКазой I и РНКазой А белки, участвую
щие в реакции, денатурировали с последующей
СИНТЕЗ ДНК ab initio
ренатурацией ДНК полимеразы, дополнитель
но очищали dNTPs и др. Все эти обработки не
Причиной появления побочных продуктов в
снижали способности ДНК полимеразы вести
реакциях изотермической амплификации мо синтез ab initio. Интересно, что механизм ини
БИОХИМИЯ том 86 вып. 7 2021
НЕСПЕЦИФИЧЕСКИЙ СИНТЕЗ ПРИ АМПЛИФИКАЦИИ
1073
циации синтеза ab initio до сих пор не известен.
матрицу, содержащую лишь dC, dG и dA в своей
Предполагают, что первые олигонуклеотиды
последовательности. В отсутствие dATP изотер
синтезируются самой ДНК полимеразой непос
мическая амплификация с матрицы протекала
редственно из dNTPs [53]. Из олигонуклеотидов
эффективно, тогда как синтез ab initio был инги
с различными последовательностями дальней
бирован. Ингибирование происходило за счет
шей амплификации подвергаются палиндром
затруднения синтеза неспецифических продук
ные последовательности, т.к. они могут образо
тов со шпилечными структурами, а также за счет
вывать шпильки на 3′ концах молекулы при
невозможности расщепления неспецифических
частичном «плавлении» концов и выступать в
продуктов никазой (отсутствие сайта никазы в
качестве праймеров в синтезе ДНК. Этот про
их последовательности).
цесс может происходить непрерывно, причем
шпилечная структура может возникнуть и ини
циировать элонгацию цепи даже за счет оши
ОСОБЕННОСТИ ДНК5ПОЛИМЕРАЗ,
бочного спаривания нуклеотидов на 3′ конце
ВЛИЯЮЩИЕ НА ОБРАЗОВАНИЕ
олигонуклеотида.
НЕСПЕЦИФИЧЕСКИХ ПРОДУКТОВ
Изучена возможность ингибирования син
теза ab initio ДНК полимеразой Bst в присут
При обсуждении образования неспецифи
ствии никазы Nt.BspD6I при добавлении в реак
ческих продуктов амплификации отмечается
ционную смесь белков T4 gp32 и SSB E. coli [49].
важная роль используемых ДНК полимераз,
Оказалось, что эти два функционально сходных
поскольку каждая обладает своим собственным
белка имеют различное влияние на синтез ab initio:
набором каталитических и других функцио
T4 gp32 полностью его ингибирует, а SSB
нальных активностей. Синтез неспецифичес
E. coli - нет. Эффект объяснили различной
ких продуктов объясняют проявлением допол
пространственной организацией формируемых
нительных активностей определенной ДНК
комплексов этих белков с одноцепочечной
полимеразы, используемой в методе. ДНК по
ДНК. С другой стороны, T4 gp32 и SSB E. coli ус
лимеразы, помимо основных свойств (полиме
пешно применяли в реакциях NDA (никаза за
разной и экзонуклеазной активностей), могут
висимая изотермическая ДНК амплификация,
дополнительно обладать активностями обрат
nickase dependent isothermal DNA amplification)
ной транскриптазы (RT) и терминальной де
и LSDA (амплификация с замещением цепи в
зоксинуклеотидилтрансферазы (TdT) [62]. При
«линейном» режиме, linear strand displacement
мерами полимераз, обладающих этими двумя
amplification) для подавления неспецифическо
активностями, могут служить фрагмент Клено
го синтеза, в том числе и вызванного синтезом
ва полимеразы I E. coli и ДНК полимераза Bst
ab initio [38, 50]. Вероятнее всего, в реакции
[63]. Недавно было продемонстрировано, что и
LSDA белок SSB E. coli функционировал в ком
ДНК полимераза phi29 обладает ограниченной
бинации с очень точной и процессивной секве
активностью обратной транскриптазы
[64].
назой 2.0 (модифицированная Т7 ДНК полиме
Эта полимераза амплифицировала кольцевые
раза) и никазой Nt.BspQI, узнающей 7 звенную
ДНК матрицы с небольшим количеством «рас
последовательность в ДНК. Применение такой
сеянных» по последовательности рибонуклео
комбинации позволило решить проблему огра
зидтрифосфатов (rNTPs) в реакциях RCA с та
ничения длины и получить целевые дискретные
кой же эффективностью, как и обычные. Одна
продукты реакции размером до нескольких ты
ко в случае увеличения количества rNTPs в пос
сяч п.н. [38]. Появление неспецифических про
ледовательности ДНК матрицы выход продук
дуктов синтеза ДНК ab initio в поздней фазе
та реакции заметно снижался. Добавление по
амплификации EXPAR предложили попросту
лимеразой одного или более нуклеотидов (как
игнорировать, поскольку синтез целевых олиго
правило, dATP) на «тупые» 3′ концы ДНК дуп
нуклеотидных продуктов происходит в течение
лекса за счет активности TdT независимо от
10 мин, тогда как максимальное количество
матрицы вызывает нежелательное образование
продуктов безматричного синтеза образуется в
выступающих концов и может инициировать
течение 0,5-1 ч [46]. Urtel et al. увидели решение
появление неспецифических продуктов. Воз
проблемы в проведении реакции без dATP в
можность перехода с одной матрицы на другую
смеси при использовании никаз Nb.BssSI,
и образования нового более длинного продукта
Nt.BsmAI и Nt.BspQI, имеющих сайты узнава
за счет активности TdT показана в эксперимен
ния, содержащие последовательности из только
тах с фрагментом Кленова [65]. В недавнем ис
трех нуклеотидов (dC, dG, dT) в «верхней» цепи
следовании Que et al. использовали TdT для
(рис. 3) [52]. Для реакции конструировали оли
синтеза длинной последовательности поли A
гонуклеотид триггер только из dC, dG и dT и
на 3′ конце детектируемой ДНК. В свою оче
9 БИОХИМИЯ том 86 вып. 7 2021
1074
ЗЫРИНА, АНТИПОВА
редь, эта последовательность поли A выполня
бегать ситуаций, в которых функционирование
ла роль праймера в реакции RCA [66]. Актив
ДНК полимеразы может быть некорректным и
ностью RT, т.е. способностью использовать
выражаться в проявлении дополнительных ак
РНК в качестве матрицы для синтеза ДНК, и
тивностей в большей степени, в ущерб основ
условиями, в которых она проявляется, часто
ным.
пренебрегают. Эта активность может служить
причиной неспецифического синтеза ДНК с
примесной экзогенной РНК и снижения точ
ЗАКЛЮЧЕНИЕ
ности полимеразы. В итоге одновременное на
личие активности TdT, RT, способности выпол
Изотермические методы амплификации
нять синтез ab initio, а также отсутствие 5′→3′ и
имеют большой потенциал для проведения ана
3′→5′ экзонуклеазной активности позволяет
лизов в местах оказания медицинской помощи
некоторым ДНК полимеразам, в частности Bst,
или в «полевых» условиях, поскольку не требу
инициировать реакции образования неспеци
ют сложного оборудования и высокой квали
фических продуктов [31, 53].
фикации персонала. Для успешного внедрения
Необходимыми, в первую очередь для изо
изотермической амплификации в широкую
термической амплификации, функциональны
практику проблема синтеза неспецифических
ми свойствами ДНК полимераз являются про
продуктов требует особого осмысления и от
цессивность и способность к вытеснению цепи,
дельного изучения для каждого метода. Сумми
однако именно эти активности позволяют поли
руя рассмотренные данные, можно предполо
меразам успешно амплифицировать и нежела
жить, что сам механизм того или иного метода
тельные конструкции. Источником проблем
изотермической амплификации нуклеиновых
амплификации может выступать конфликт
кислот наряду с условиями реакции может дик
функциональных свойств ДНК полимеразы
товать основную причину неспецифической
[62]. Например, 3′→5′ экзонуклеазная актив
амплификации. Возникновение неспецифи
ность повышает точность амплификации, одна
ческих продуктов обусловливается совокуп
ко может приводить к сниженному выходу про
ностью целого ряда причин. В их числе можно
дукта и деградации праймеров. Полимеразы,
рассматривать все комбинации нежелательных
которые позволяют получать высокий выход
взаимодействий праймеров, способствующих
продукта, имеют меньшую точность, что приво
дальнейшей амплификации (образование ди
дит к появлению большего числа неканоничес
меров праймеров и шпилечных структур), а так
ких пар нуклеотидов в целевом продукте. Разра
же неспецифическую гибридизацию праймера
батывая или адаптируя метод изотермической
с матрицей или тотальной ДНК, присутствую
амплификации для конкретной задачи и выби
щей в образце. Появление сильного фона, ме
рая при этом ДНК полимеразу, необходимо
шающего различить целевую последователь
учитывать подобные факты.
ность, можно объяснить неканоническим син
Заслуживает внимания и давно известная
тезом ДНК ab initio, а также способностью
проблема образования неспецифических про
ДНК полимеразы за счет своих дополнитель
дуктов на ДНК матрицах, содержащих тракты
ных активностей инициировать «артефактный»
(А)n, прямые или инвертированные повторы, в
синтез на матрице.
т.ч. палиндромные или квазипалиндромные
На пути к улучшению изотермических сис
последовательности, формирующие альтерна
тем амплификации, в частности, устранению
тивные структуры ДНК [67]. Показано, как
неспецифических продуктов реакции, исследо
ДНК полимеразы с лучшей процессивностью
ватели двигаются в разных направлениях, но од
успешно преодолевают такие структуры, а дру
ним из самых перспективных является работа с
гие, менее процессивные, диссоциируют от
ДНК полимеразами. Корректировать работу
матрицы и образуют укороченные продукты ре
ДНК полимераз можно путем оптимизации ус
акции [68, 69]. Тем не менее проблема «слож
ловий их функционирования в ходе реакции
ных» матриц остается актуальной и для высо
(варьирование количества и набора dNTPs, ион
копроцессивных ДНК полимераз. Очевидно,
ной силы раствора, pH), а также изучения их
что помимо выбора ДНК полимераз с лучшей
функционирования в условиях макромолеку
процессивностью и более высокой способ
лярного краудинга (т.е. в условиях повышенной
ностью к замещению цепи, избавиться от неже
концентрации молекул и уменьшения степеней
лательных продуктов реакции в значительной
свободы диффузии молекул белков от ДНК)
степени позволяет оптимизация условий реак
[62, 70-72]. Поиск новых природных ДНК по
ции, в т.ч. повышение температуры и примене
лимераз и улучшение их активностей генно ин
ние белков SSB. Так или иначе, необходимо из
женерными методами даст возможность более
БИОХИМИЯ том 86 вып. 7 2021
НЕСПЕЦИФИЧЕСКИЙ СИНТЕЗ ПРИ АМПЛИФИКАЦИИ
1075
гибко подбирать условия проведения реакции
ДНК полимераз с функцией замещения це
[73]. Получение ДНК полимераз с повышенной
пи [31].
термостабильностью позволяет повышать тем
пературу реакции для более точной гибридиза
ции праймеров [74]. Использование полимераз
Финансирование. Работа выполнена в рамках
с повышенным сродством к ДНК, возможно,
государственного задания № 075 00845 20 01.
будет способствовать снижению количества
Конфликт интересов. Авторы заявляют об от
неспецифических продуктов [75]. Также в реше
сутствии конфликта интересов.
нии проблемы неспецифического синтеза в ре
Соблюдение этических норм. Настоящая
акциях изотермической амплификации может
статья не содержит описания каких либо иссле
помочь устранение способности ферментов к
дований с участием людей или животных в каче
обратной транскрипции и повышение точности стве объектов.
СПИСОК ЛИТЕРАТУРЫ
1.
Craw, P., and Balachandran, W. (2012) Isothermal nucleic
advances, Trends Anal. Chem., 98, 19 35, doi: 10.1016/
acid amplification technologies for point of care diagnos
j.trac.2017.10.015.
tics: a critical review, Lab Chip,
12,
24692486,
14.
Li, J., Macdonald, J., and von Stetten, F. (2019) Review: a
doi: 10.1039/c2lc40100b.
comprehensive summary of a decade development of the
2.
Gill, P., and Ghaemi, A. (2008) Nucleic acid isothermal
recombinase polymerase amplification, Analyst, 144, 31
amplification technologies: a review, Nucleosides
67, doi: 10.1039/c8an01621f.
Nucleotides Nucleic Acids, 27, 224 243, doi: 10.1080/
15.
James, A., and Macdonald, J. (2015) Recombinase poly
15257770701845204.
merase amplification: Emergence as a critical molecular
3.
Niemz, A., Ferguson, T. M., and Boyle, D. S. (2011)
technology for rapid, low resource diagnostics, Expert Rev.
Point of care nucleic acid testing for infectious diseases,
Mol. Diagn., 15, 1475 1489, doi: 10.1586/14737159.2015.
Trends Biotechnol., 29, 240 250, doi: 10.1016/j.tibtech.
1090877.
2011.01.007.
16.
Higgins, M., Ravenhall, M., Ward, D., Phelan, J.,
4.
Obande, G. A., and Banga Singh, K. K. (2020) Current
Ibrahim, A., et al. (2018) PrimedRPA: primer design
and future perspectives on isothermal nucleic acid amplifi
for recombinase polymerase amplification assays,
cation technologies for diagnosing infections, Infect. Drug
Bioinformatics, 35, 682 684, doi: 10.1093/bioinformatics/
Resist., 13, 455 483, doi: 10.2147/IDR.S217571.
bty701.
5.
Zhao, Y., Chen, F., Li, Q., Wang, L., and Fan, C. (2015)
17.
Rohrman, B., and Richards Kortum, R. (2015) Inhibition
Isothermal amplification of nucleic acids, Chem. Rev., 115,
of recombinase polymerase amplification by background
12491 12545, doi: 10.1021/acs.chemrev.5b00428.
DNA: a lateral flow based method for enriching target
6.
Bodulev, O. L., and Sakharov, I. Y. (2020) Isothermal
DNA, Anal. Chem., 87, 1963 1967, doi: 10.1021/ac504365v.
nucleic acid amplification techniques and their use in
18.
Compton, J. (1991) Nucleic acid sequence based amplifi
bioanalysis, Biochemistry (Moscow),
85,
147166,
cation, Nature, 350, 91 92, doi: 10.1038/350091a0.
doi: 10.1134/S0006297920020030.
19.
Kievits, T., van Gemen, B., van Strijp, D., Schukkink, R.,
7.
Notomi, T., Okayama, H., Masubuchi, H., Yonekawa, T.,
Dircks, M., et al. (1991) NASBA™ isothermal enzymatic
Watanabe, K., et al. (2000) Loop mediated isothermal
in vitro nucleic acid amplification optimized for the diag
amplification of DNA, Nucleic Acids Res., 28, E63,
nosis of HIV 1 infection, J. Virol. Methods, 35, 273 286,
doi: 10.1093/nar/28.12.e63.
doi: 10.1016/0166 0934(91)90069 C.
8.
Rolando, J. C., Jue, E., Barlow, J. T., and Ismagilov, R. F.
20.
Morabito, K., Wiske, C., and Tripathi, C. W. A. (2013)
(2020) Real time kinetics and high resolution melt curves
Engineering insights for multiplexed real time nucleic acid
in single molecule digital LAMP to differentiate and study
sequence based amplification (NASBA): implications for
specific and non specific amplification, Nucleic Acids Res.,
design of point of care diagnostics, Mol. Diagn. Ther., 17,
48, e42 e42, doi: 10.1093/nar/gkaa099.
185 192, doi: 10.1007/s40291 013 0029 4.
9.
Schneider, L., Blakely, H., and Tripathi, A. (2019) Mathe
21.
Markham, N. R., and Zuker, M. (2005) DINAMelt web
matical model to reduce loop mediated isothermal ampli
server for nucleic acid melting prediction, Nucleic Acids
fication (LAMP) false positive diagnosis, Electrophoresis,
Res., 33, W577 W581, doi: 10.1093/nar/gki591.
40, 2706 2717, doi: 10.1002/elps.201900167.
22.
Heim, A., Grumbach, I. M., Zeuke, S., and Top, B. (1998)
10.
Gao, X., Sun, B., and Guan, Y. (2019) Pullulan reduces
Highly sensitive detection of gene expression of an intronless
the non specific amplification of loop mediated isother
gene: amplification of mRNA, but not genomic DNA by
mal amplification (LAMP), Anal. Bioanal. Chem., 411,
nucleic acid sequence based amplification (NASBA), Nucleic
1211 1218, doi: 10.1007/s00216 018 1552 2.
Acids Res., 26, 2250 2251, doi: 10.1093/nar/26.9.2250.
11.
Piepenburg, O., Williams, C. H., Stemple, D. L., and
23.
Polstra, A. M., Goudsmit, J., and Cornelissen, M. (2002)
Armes, N. A. (2006) DNA detection using recombination
Development of real time NASBA assays with molecular
proteins, PLoS Biol., 4, e204, doi: 10.1371/journal.pbio.
beacon detection to quantify mRNA coding for HHV 8
0040204.
lytic and latent genes, BMC Infect. Dis., 2, 18, doi: 10.1186/
12.
Sharma, N., Hoshika, S., Hutter, D., Bradley, K. M., and
1471 2334 2 18.
Benner, S. A. (2014) Recombinase based isothermal
24.
Honsvall, B. K., and Robertson, L. J. (2017) From
amplification of nucleic acids with self avoiding molecular
research lab to standard environmental analysis tool: will
recognition systems (SAMRS), ChemBioChem, 15, 2268
NASBA make the leap? Water Res., 109, 389 397,
2274, doi: 10.1002/cbic.201402250.
doi: 10.1016/j.watres.2016.11.052.
13.
Lobato, I. M., and O′Sullivan, C. K. (2018) Recombinase
25.
Lizardi, P. M., Huang, X., Zhu, Z., Bray Ward, P.,
polymerase amplification: basics, applications and recent
Thomas, D. C., and Ward, D. C. (1998) Mutation detec
БИОХИМИЯ том 86 вып. 7 2021
9*
1076
ЗЫРИНА, АНТИПОВА
tion and single molecule counting using isothermal
nential amplification for double stranded DNA detection,
rolling circle amplification, Nat. Genet., 19, 225 232,
Sens. Actuat. B. Chem., 222, 221225, doi: 10.1016/
doi: 10.1038/898.
j.snb.2015.08.060.
26.
Dean, F. B., Nelson, J. R., Giesler, T. L., and Lasken, R. S.
41.
Абросимова Л. А., Кисиль О. В., Романова Е. А.,
(2001) Rapid amplification of plasmid and phage DNA
Орецкая Т. С., Кубарева Е. А. (2019) Никующие эндо
using Phi 29 DNA polymerase and multiply primed rolling
нуклеазы как уникальные инструменты в биотехноло
circle amplification, Genome Res.,
11,
10951099,
гии и генетической инженерии, Биоорганическая хи/
doi: 10.1101/gr.180501.
мия, 445, 451 471, doi: 10.1134/S0132342319050014.
27.
Dean, F. B., Hosono, S., Fang, L., Wu, X., Faruqi, A. F.,
42.
Walker, G. T., Fraiser, M. S., Schram, J. L., Little, M. C.,
et al. (2002) Comprehensive human genome amplification
Nadeau, J. G., and Malinowski, D. P. (1992) Strand dis
using multiple displacement amplification, Proc. Natl.
placement amplification - an isothermal, in vitro DNA
Acad. Sci. USA, 99, 5261, doi: 10.1073/pnas.082089499.
amplification technique, Nucleic Acids Res., 20,
1691
28.
Brukner, I., Paquin, B., Belouchi, M., Labuda, D., and
1696, doi: 10.1093/nar/20.7.1691.
Krajinovic, M. (2005) Self priming arrest by modified ran
43.
Spargo, C. A., Fraiser, M. S., Van Cleve, M., Wright, D. J.,
dom oligonucleotides facilitates the quality control of
Nycz, C. M., et al. (1996) Detection of M. tuberculosis
whole genome amplification, Anal. Biochem., 339, 345
DNA using thermophilic strand displacement amplifica
347, doi: 10.1016/j.ab.2005.01.005.
tion, Mol. Cell. Probes, 10, 247 256, doi: 10.1006/mcpr.
29.
Murakami, T., Sumaoka, J., and Komiyama, M. (2008)
1996.0034.
Sensitive isothermal detection of nucleic acid sequence by
44.
Nadeau, J. G., Pitner, J. B., Linn, C. P., Schram, J. L.,
primer generation - rolling circle amplification, Nucleic
Dean, C. H., and Nycz, C. M. (1999) Real time,
Acids Res., 37, e19 e19, doi: 10.1093/nar/gkn1014.
sequence specific detection of nucleic acids during strand
30.
Garafutdinov, R. R., Gilvanov, A. R., and Sakhabutdinova,
displacement amplification, Anal. Biochem., 276, 177 187,
A. R. (2020) The influence of reaction conditions on DNA
doi: 10.1006/abio.1999.4350.
multimerization during isothermal amplification with Bst
45.
Ehses, S., Ackermann, J., and McCaskill, J. S. (2005)
exo DNA polymerase, Appl. Biochem. Biotechnol., 190,
Optimization and design of oligonucleotide setup for
758 771, doi: 10.1007/s12010 019 03127 6.
strand displacement amplification, J. Biochem. Biophys.
31.
Wang, G., Ding, X., Hu, J., Wu, W., Sun, J., and Mu, Y.
Methods, 63, 170 186, doi: 10.1016/j.jbbm.2005.04.005.
(2017) Unusual isothermal multimerization and amplifica
46.
Tan, E., Erwin, B., Dames, S., Ferguson, T., Buechel, M.,
tion by the strand displacing DNA polymerases with
et al. (2008) Specific versus nonspecific isothermal DNA
reverse transcription activities, Sci. Rep., 7, 017 13324,
amplification through thermophilic polymerase and nick
doi: 10.1038/s41598 017 13324 0.
ing enzyme activities, Biochemistry,
47,
99879999,
32.
Garafutdinov, R. R., Sakhabutdinova, A. R., Kupryushkin,
doi: 10.1021/bi800746p.
M. S., and Pyshnyi, D. V. (2020) Prevention of DNA mul
47.
Reid, M. S., Paliwoda, R. E., Zhang, H., and Le, X. C.
timerization using phosphoryl guanidine primers during
(2018) Reduction of background generated from template
isothermal amplification with Bst exo DNA polymerase,
template hybridizations in the exponential amplification
Biochimie, 168, 259267, doi: 10.1016/j.biochi.2019.
reaction, Anal. Chem., 90, 11033 11039, doi: 10.1021/acs.
11.013.
analchem.8b02788.
33.
Inoue, J., Shigemori, Y., and Mikawa, T.
(2006)
48.
Little, M. C., Andrews, J., Moore, R., Bustos, S.,
Improvements of rolling circle amplification (RCA) effi
Jones, L., et al. (1999) Strand displacement amplification
ciency and accuracy using Thermus thermophilus SSB
and homogeneous real time detection incorporated in a
mutant protein, Nucleic Acids Res.,
34, e69 e69,
second generation DNA probe system, BDProbeTecET,
doi: 10.1093/nar/gkl350.
Clin. Chem., 45, 777 784, doi: 10.1093/clinchem/45.6.777.
34.
Mikawa, T., Inoue, J., and Shigemori, Y. (2009) Single
49.
Зырина Н. В., Артюх Р. И., Свадьбина И. В., Железная
stranded DNA binding protein facilitates specific enrich
Л. А., Матвиенко Н. И. (2012) Влияние белков, связы
ment of circular DNA molecules using rolling circle ampli
вающихся с одноцепочечной ДНК, на безматрич
fication, Anal. Biochem., 391, 81 84, doi: 10.1016/j.ab.
ный/беспраймерный синтез ДНК в присутствии ни
2009.05.013.
кующей эндонуклеазы Nt.BspD6I, Биоограническая
35.
Walker, G. T., Little, M. C., Nadeau, J. G., and Shank,
химия, 38, 199 205, doi: 10.1134/S1068162012020161.
D. D. (1992) Isothermal in vitro amplification of DNA by
50.
He, Y., and Jiang, T. (2013) Nickase dependent isothermal
a restriction enzyme/DNA polymerase system, Proc. Natl.
DNA amplification, Adv. Biosci. Biotechnol., 4, 539 542,
Acad. Sci. USA, 89, 392 396, doi: 10.1073/pnas.89.1.392.
doi: 10.4236/abb.2013.44070.
36.
Chan, S. H., Zhu, Z., Van Etten, J. L., and Xu, S. Y.
51.
Menova, P., Raindlova, V., and Hocek, M. (2013) Scope
(2004) Cloning of CviPII nicking and modification system
and limitations of the nicking enzyme amplification reac
from chlorella virus NYs 1 and application of Nt. CviPII in
tion for the synthesis of base modified oligonucleotides
random DNA amplification, Nucleic Acids Res., 32, 6187
and primers for PCR, Bioconj. Chem., 24, 1081 1093,
6199, doi: 10.1093/nar/gkh958.
doi: 10.1021/bc400149q.
37.
Van Ness, J., Van Ness, L. K., and Galas, D. J. (2003)
52.
Urtel, G., Van Der Hofstadt, M., Galas, J. C., and
Isothermal reactions for the amplification of oligonu
Estevez Torres, A. (2019) rEXPAR: an isothermal amplifi
cleotides, Proc. Natl. Acad. Sci. USA,
100,
4504,
cation scheme that is robust to autocatalytic parasites,
doi: 10.1073/pnas.0730811100.
Biochemistry, 58, 2675 2681, doi: 10.1021/acs.biochem.
38.
Joneja, A., and Huang, X. (2011) Linear nicking endonu
9b00063.
clease mediated strand displacement DNA amplification,
53.
Zyrina, N. V., Antipova, V. N., and Zheleznaya, L. A.
Anal. Biochem., 414, 58 69, doi: 10.1016/j.ab.2011.02.025.
(2014) Ab initio synthesis by DNA polymerases, FEMS
39.
Zhou, H., Xie, S. J., Zhang, S. B., Shen, G. L., Yu, R.
Microbiol. Lett., 351, 1 6, doi: 10.1111/1574 6968.12326.
Q., and Wu, Z. S. (2013) Isothermal amplification system
54.
Liang, X., Jensen, K., and Frank Kamenetskii, M. D.
based on template dependent extension, Chem. Commun.,
(2004) Very efficient template/primer independent DNA
49, 2448 2450, doi: 10.1039/c3cc38358j.
synthesis by thermophilic DNA polymerase in the presence
40.
Shi, C., Liu, Q., Zhou, M., Zhao, H., Yang, T., and Ma, C.
of a thermophilic restriction endonuclease, Biochemistry,
(2016) Nicking endonuclease mediated isothermal expo
43, 13459 13466, doi: 10.1021/bi0489614.
БИОХИМИЯ том 86 вып. 7 2021
НЕСПЕЦИФИЧЕСКИЙ СИНТЕЗ ПРИ АМПЛИФИКАЦИИ
1077
55.
Zyrina, N. V., Zheleznaya, L. A., Dvoretsky, E. V., Vasiliev,
66.
Que, H., Yan, X., Guo, B., Ma, H., Wang, T., et al. (2019)
V. D., Chernov, A., and Matvienko, N. I. (2007) N.BspD6I
Terminal deoxynucleotidyl transferase and rolling circle
DNA nickase strongly stimulates template independent
amplification induced G triplex formation: a label free
synthesis of non palindromic repetitive DNA by Bst DNA
fluorescent strategy for DNA methyltransferase activity
polymerase, Biol. Chem., 388, 367 372, doi: 10.1515/BC.
assay, Sens. Actuat. B Chem., 291, 394 400, doi: 10.1016/
2007.043.
j.snb.2019.04.091.
56.
Antipova, V. N., Zheleznaya, L. A., and Zyrina, N. V.
67.
Sinden, R. R., Potaman, V. N., Oussatcheva, E. A.,
(2014) Ab initio DNA synthesis by Bst polymerase in the
Pearson, C. E., Lyubchenko, Y. L., and Shlyakhtenko,
presence of nicking endonucleases Nt.AlwI, Nb.BbvCI,
L. S. (2002) Triplet repeat DNA structures and human
and Nb.BsmI, FEMS Microbiol. Lett., 357, 144 150,
genetic disease: dynamic mutations from dynamic DNA,
doi: 10.1111/1574 6968.12511.
J. Biosci., 27, 53 65, doi: 10.1007/BF02703683.
57.
Kaboev, O. K., and Luchkina, L. A. (2004) Template free
68.
Canceill, D., Viguera, E., and Ehrlich, S. D. (1999) Repli
primer independent DNA synthesis by bacterial DNA
cation slippage of different DNA polymerases is inversely
polymerases I using the DnaB protein from Escherichia
related to their strand displacement efficiency, J. Biol.
coli, Dokl. Biochem. Biophys., 398, 265 267, doi: 10.1023/
Chem., 274, 27481 27490, doi: 10.1074/jbc.274.39.27481.
b:dobi.0000046633.66624.58.
69.
Viguera, E., Canceill, D., and Ehrlich, S. D.
(2001)
58.
Beguin, P., Gill, S., Charpin, N., and Forterre, P. (2015)
Replication slippage involves DNA polymerase pausing
Synergistic template free synthesis of dsDNA by
and dissociation, EMBO J., 20, 2587 2595, doi: 10.1093/
Thermococcus nautili primase PolpTN2, DNA polymerase
emboj/20.10.2587.
PolB, and pTN2 helicase, Extremophiles, 19, 6976,
70.
Akabayov, B., Akabayov, S. R., Lee, S. J., Wagner, G., and
doi: 10.1007/s00792 014 0706 1.
Richardson, C. C. (2013) Impact of macromolecular
59.
Schachman, H. K., Adler, J., Radding, C. M., Lehman,
crowding on DNA replication, Nat. Commun., 4, 1615,
I. R., and Kornberg, A. (1960) Enzymatic synthesis of deoxy
doi: 10.1038/ncomms2620.
ribonucleic acid. VII. Synthesis of a polymer of deoxyaden
71.
Tong, Y., Lemieux, B., and Kong, H. (2011) Multiple
ylate and deoxythymidylate, J. Biol. Chem., 235, 3242 3249.
strategies to improve sensitivity, speed and robustness of
60.
Ogata, N., and Miura, T. (1997) Genetic information “cre
isothermal nucleic acid amplification for rapid pathogen
ated” by archaebacterial DNA polymerase, Biochem. J.,
detection, BMC Biotechnol., 11, 1472 6750, doi: 10.1186/
324 (Pt 2), 667 671, doi: 10.1042/bj3240667.
1472 6750 11 50.
61.
Ogata, N., and Miura, T. (1998) Creation of genetic infor
72.
Garafutdinov, R. R., Gilvanov, A. R., Kupova, O. Y., and
mation by DNA polymerase of the thermophilic bacterium
Sakhabutdinova, A. R. (2020) Effect of metal ions on
Thermus thermophilus, Nucleic Acids Res., 26, 4657 4661,
isothermal amplification with Bst exo DNA polymerase,
doi: 10.1093/nar/26.20.4657.
Int. J. Biol. Macromol., 161, 1447 1455, doi: 10.1016/
62.
Pavlov, A. R., Pavlova, N. V., Kozyavkin, S. A., and
j.ijbiomac.2020.08.028.
Slesarev, A. I. (2004) Recent developments in the optimiza
73.
Piotrowski, Y., Gurung, M. K., and Larsen, A. N. (2019)
tion of thermostable DNA polymerases for efficient appli
Characterization and engineering of a DNA polymerase
cations, Trends Biotechnol., 22, 253 260, doi: 10.1016/
reveals a single amino acid substitution in the fingers sub
j.tibtech.2004.02.011.
domain to increase strand displacement activity of A fam
63.
Shi, C., Shen, X., Niu, S., and Ma, C. (2015) Innate
ily prokaryotic DNA polymerases, BMC Mol. Cell. Biol.,
reverse transcriptase activity of DNA polymerase for
20, 31, doi: 10.1186/s12860 019 0216 1.
isothermal RNA direct detection, J. Am. Chem. Soc., 137,
74.
Milligan, J. N., Shroff, R., Garry, D. J., and Ellington,
13804 13806, doi: 10.1021/jacs.5b08144.
A. D. (2018) Evolution of a thermophilic strand displacing
64.
Krzywkowski, T., Kühnemund, M., Wu, D., and
polymerase using high temperature isothermal compart
Nilsson, M. (2018) Limited reverse transcriptase activity of
mentalized self replication, Biochemistry, 57, 4607 4619,
phi29 DNA polymerase, Nucleic Acids Res., 46, 3625
doi: 10.1021/acs.biochem.8b00200.
3632, doi: 10.1093/nar/gky190.
75.
Oscorbin, I. P., Belousova, E. A., Boyarskikh, U. A.,
65.
Garcia, P. B., Robledo, N. L., and Islas, A. L. (2004)
Zakabunin, A. I., Khrapov, E. A., and Filipenko, M. L.
Analysis of non template directed nucleotide addition and
(2017) Derivatives of Bst like Gss polymerase with
template switching by DNA polymerase, Biochemistry, 43,
improved processivity and inhibitor tolerance, Nucleic
16515 16524, doi: 10.1021/bi0491853.
Acids Res., 45, 9595 9610, doi: 10.1093/nar/gkx645.
NONSPECIFIC SYNTHESIS IN THE REACTIONS
OF ISOTHERMAL NUCLEIC ACID AMPLIFICATION
Review
N. V. Zyrina1,2 and V. N. Antipova2*
1 Institute of Protein Research, Russian Academy of Sciences, 142290 Pushchino, Moscow Region, Russia
2 Institute of Theoretical and Experimental Biophysics, Russian Academy of Sciences,
142290 Pushchino, Moscow Region, Russia; E/mail: valery_a@rambler.ru
The review focuses on the main causes of nonspecific products synthesis in the course of isothermal nucleic acid
amplification as a result of wide range of factors: mispriming with a subsequent amplification, ab initio DNA synthe
sis and additional activities of DNA polymerases. The approaches being developed to eliminate nonspecific products
are discussed in LAMP, RPA, NASBA, RCA, SDA, LSDA, NDA and EXPAR reactions.
Keywords: isothermal amplification, background synthesis, DNA polymerases, LAMP, SDA, EXPAR
БИОХИМИЯ том 86 вып. 7 2021