БИОХИМИЯ, 2021, том 86, вып. 9, с. 1273 - 1313
УДК 577.12
НЕКАНОНИЧЕСКИЕ МЕХАНИЗМЫ ИНИЦИАЦИИ
ТРАНСЛЯЦИИ мРНК ВИРУСОВ ЭУКАРИОТ
Обзор
© 2021
И.И. Сорокин1,2,3, К.С. Василенко2, И.М. Теренин1,
Н.О. Калинина1,4, В.И. Агол1,5, С.Е. Дмитриев1,6,7*
1 НИИ физико химической биологии имени А.Н. Белозерского, Московский государственный университет
имени М.В. Ломоносова, 119234 Москва, Россия; электронная почта: sergey.dmitriev@belozersky.msu.ru
2 Институт белка РАН, 142290 Пущино, Московская обл., Россия
3 Центр исследований молекулярных механизмов старения и возрастных заболеваний,
Московский физико технический институт, 141701 Долгопрудный, Московская обл., Россия
4 Институт биоорганической химии имени акад. М.М. Шемякина и Ю.А. Овчинникова РАН, 117997 Москва, Россия
5 ФГБНУ Федеральный научный центр исследований и разработки иммунобиологических препаратов
им. М.П. Чумакова РАН (Институт полиомиелита), 108819 Москва, Россия
6 Институт молекулярной биологии им. В.А. Энгельгардта РАН, 119991 Москва, Россия
7 Московский государственный университет имени М.В. Ломоносова,
факультет биоинженерии и биоинформатики, 119234 Москва, Россия
Поступила в редакцию 14.06.2021
После доработки 04.08.2021
Принята к публикации 04.08.2021
Для производства своих белков вирусы используют трансляционный аппарат заражённой клетки. При этом
их мРНК вынуждены вступать в конкуренцию за рибосомы и трансляционные факторы с многочисленны&
ми клеточными матрицами. Чтобы не проиграть в этой борьбе, вирусы применяют специальные стратегии.
мРНК многих эукариотических вирусов, размножающихся в цитоплазме, не имеют m7G&кэпа на 5′&конце.
Однако они могут содержать структуры, привлекающие факторы трансляции и рибосомы альтернативными
способами - например, участки внутреннего связывания рибосом (IRES&элементы), которые делают их
трансляцию не зависящей от 5′&конца и, как следствие, от m7G&кэпа. Другие вирусные мРНК содержат кэп&
независимые трансляционные энхансеры (CITE&элементы), которые могут быть расположены, в том числе
и в 3′&нетранслируемой области (3′&НТО). В тех случаях, когда посадка рибосомы на мРНК происходит по
кэп&зависимому пути, особые структуры в 5′&НТО могут менять формат рибосомного сканирования и узна&
вания стартового кодона. Необходимость компактизировать геном зачастую приводит к наличию в вирусных
мРНК внутренних рамок, для трансляции которых могут использоваться разнообразные механизмы - на&
пример, пропускающее сканирование, соскальзывание 43S&комплекса, шунтирование или сопряжённая
терминация&реинициация, требующие особых цис&действующих элементов в мРНК. Некоторые из перечис&
ленных особенностей делают вирусные мРНК менее требовательными к набору факторов инициации транс&
ляции, обеспечивая устойчивость к условиям клеточного стресса и антивирусным механизмам клетки. Более
того, вирусы могут создавать конкурентные преимущества для трансляции своих мРНК, инактивируя от&
дельные трансляционные факторы, подменяя их своими или провоцируя развитие стрессового ответа. Мно&
гие вирусы реорганизуют мембранные структуры клетки, в том числе с целью создания вирусных трансляци&
онных «фабрик», пространственно изолируя места синтеза своих белков от действия антивирусных систем и
обогащая их трансляционными компонентами. Тем не менее зачастую именно трансляция является ахилле&
совой пятой их жизненного цикла. Лучшее понимание неканонических механизмов инициации трансляции
вирусных мРНК даёт дополнительные ключи к разработке новых подходов в антивирусной терапии.
КЛЮЧЕВЫЕ СЛОВА: внутренняя инициация трансляции, кэп&независимая трансляция, VPg, TURBS&
опосредованная реинициация, кольцевые РНК, факторы инициации трансляции eIF2 и eIF4F, пикорнави&
русы PV и EMCV, флавивирусы HCV и DENV, лентивирусы HIV&1 и HIV&2, коронавирус SARS&CoV&2.
DOI: 10.31857/S0320972521090049
ПОСВЯЩЕНИЕ
ный вклад в изучение биосинтеза белка. Хотя
основной областью интересов Александра Сер&
Мы написали этот обзор, чтобы отдать дань
геевича были рибосомология и базовые процес&
уважения памяти Александра Сергеевича Спи&
сы трансляции, он уделил внимание также и
рина, замечательного учёного, внёсшего огром&
изучению трансляции РНК вирусов. В частнос&
1273
1274
СОРОКИН и др.
ти, можно упомянуть исследования структуры и
КЛАССИЧЕСКИЙ МЕХАНИЗМ
регуляции трансляции РНК вирусов растений,
ИНИЦИАЦИИ ТРАНСЛЯЦИИ
изучение особенностей инициации трансляции
ЭУКАРИОТИЧЕСКИХ мРНК
поксвирусов, использование вирусных механиз&
мов для оптимизации бесклеточных систем син&
Цитоплазматические мРНК эукариот имеют
теза белка. Этот труд написан учениками и
на 5′&конце особую химическую структуру, m7G&
друзьями Александра Сергеевича, его коллега&
кэп (7&метилгуанозин, присоединённый через
ми, соавторами и сотрудниками. Все мы восхи&
5′,5′&трифосфатный мостик к первому нуклео&
щаемся им как учёным и человеком и с глубо&
тиду мРНК), а на 3′&конце, за редкими исключе&
ким уважением и признательностью посвящаем
ниями, - поли(А)&хвост. Эти полифункцио&
его памяти наш обзор.
нальные «метки» узнаются в цитоплазме специ&
альными белками [2-5]. 5′&Кэп в условиях ак&
тивной трансляции связан с фактором eIF4F,
ВВЕДЕНИЕ
состоящим из трёх субъединиц: небольшого
кэп&связывающего белка eIF4E, крупной «плат&
Наша планета населена вирусами, многие из
формы» eIF4G и ATP&зависимой РНК&хелика&
которых являются патогенами эукариот. Не&
зы eIF4A. 3′&Конец мРНК обычно связан с нес&
смотря на то что вирусные геномы могут превы&
колькими молекулами поли(А)&связывающего
шать по своим размерам и сложности геномы не&
белка PABP, который, взаимодействуя с eIF4G,
которых примитивных бактерий, до сих пор не
замыкает мРНК в петлю (рис. 1).
известно ни одного случая, когда они содержали
Другой набор трансляционных факторов
бы полный комплект генов, необходимых для
связывается с малой субчастицей рибосомы,
биосинтеза белка [1]. Это делает вирусы пол&
формируя преинициаторный 43S&комплекс [6].
ностью зависимыми от клеточного трансляцион&
Гетеротример eIF2 в комплексе с GTP обеспечи&
ного аппарата. Однако зачастую они не ограни&
вает доставку инициаторной Met&тРНКi в P&
чиваются простым его использованием: многие
сайт. Ещё три фактора - eIF1, eIF1A и eIF5 -
вирусы способны узурпировать белоксинтезиру&
связываются в непосредственной близости от
ющую машинерию, направляя львиную долю
него и контролируют аккомодацию тРНК. Гигант&
клеточных ресурсов на производство собствен&
ский белок eIF3, состоящий у млекопитающих
ных белков. В ходе эволюции они выработали
из 13 субъединиц, «обволакивает» 40S&субчасти&
способность манипулировать разными этапами
цу с разных сторон, контактируя одновременно
трансляционного цикла, в первую очередь стади&
почти со всеми факторами инициации. Благода&
ей инициации трансляции. Атакуя отдельные
ря взаимодействию eIF3 и eIF4G происходит
компоненты этой системы и используя некано&
привлечение 43S&комплекса на 5′&конец мРНК.
нические механизмы привлечения рибосом, ви&
Важно подчеркнуть, что при канонической ини&
русы обеспечивают конкурентное преимущество
циации трансляции эукариотическая рибосома
своим мРНК и лишают клетку возможности раз&
связывается именно в районе 5′&конца мРНК, и
вернуть полноценный антивирусный ответ.
там же происходит укладка матрицы в канал 40S&
В этом обзоре мы рассмотрим многообразие
субчастицы. Вслед за этим 43S&комплекс начи&
способов, позволяющих вирусным мРНК выиг&
нает двигаться в направлении 3′&конца, прове&
рывать конкуренцию за трансляционный аппа&
ряя (сканируя) встречающиеся последователь&
рат заражённой клетки, и основные структур&
ности на наличие триплета AUG. Узнавание
ные особенности таких мРНК.
правильного стартового кодона (обычно AUG в
Принятые сокращения: гРНК - геномная РНК; кРНК - кольцевая РНК; НТО - нетранслируемая область;
пгРНК - пре&геномная РНК; сгРНК - субгеномная РНК; CaMV - вирус мозаики цветной капусты; CITE - кэп&незави&
симый трансляционный энхансер; CrPV - вирус паралича сверчка; DENV - вирус денге; EMCV - вирус энцефаломио&
кардита; FCV - кошачий калицивирус; FMDV - вирус ящура; HAV - вирус гепатита А; HalV - вирус Halastavi árva; HCV -
вирус гепатита C; HIV&1 - вирус иммунодефицита человека типа 1; HNV - вирус Норуолка человека; IBV - вирус гриппа B;
IGR - межцистронный участок; IRES - участок внутренней посадки рибосомы; ITAF - транс&действующий фактор, не&
обходимый для работы IRES; ORF - открытая рамка считывания; PEMV&2 - вирус деформирующей мозаики гороха 2;
PTE - трансляционный энхансер типа PMV (вируса мозаики проса); PV - полиовирус; RHDV - вирус геморрагической бо&
лезни кроликов; RhPV - вирус черёмуховой тли; RRL - лизат ретикулоцитов кролика; SARS&CoV&2 - коронавирус 2, вы&
зывающий тяжёлый острый респираторный синдром; TCV - вирус морщинистости турнепса; TED - трансляционно&эн&
хансерный домен; TLS - тРНК&подобная структура; TMEV - вирус мышиного энцефаломиелита Тейлера; TMV - вирус
табачной мозаики; TPL - трёхчастный лидер поздних аденовирусных мРНК; TURBS - участок связывания рибосомы,
расположенный до места терминации; TYMV - вирус жёлтой мозаики турнепса; VACV - вирус осповакцины; VPg - вирус&
ный белок, ковалентно связанный с 5′&концом гРНК; WGE - бесклеточная система трансляции из зародышей пшеницы.
* Адресат для корреспонденции.
БИОХИМИЯ том 86 вып. 9 2021
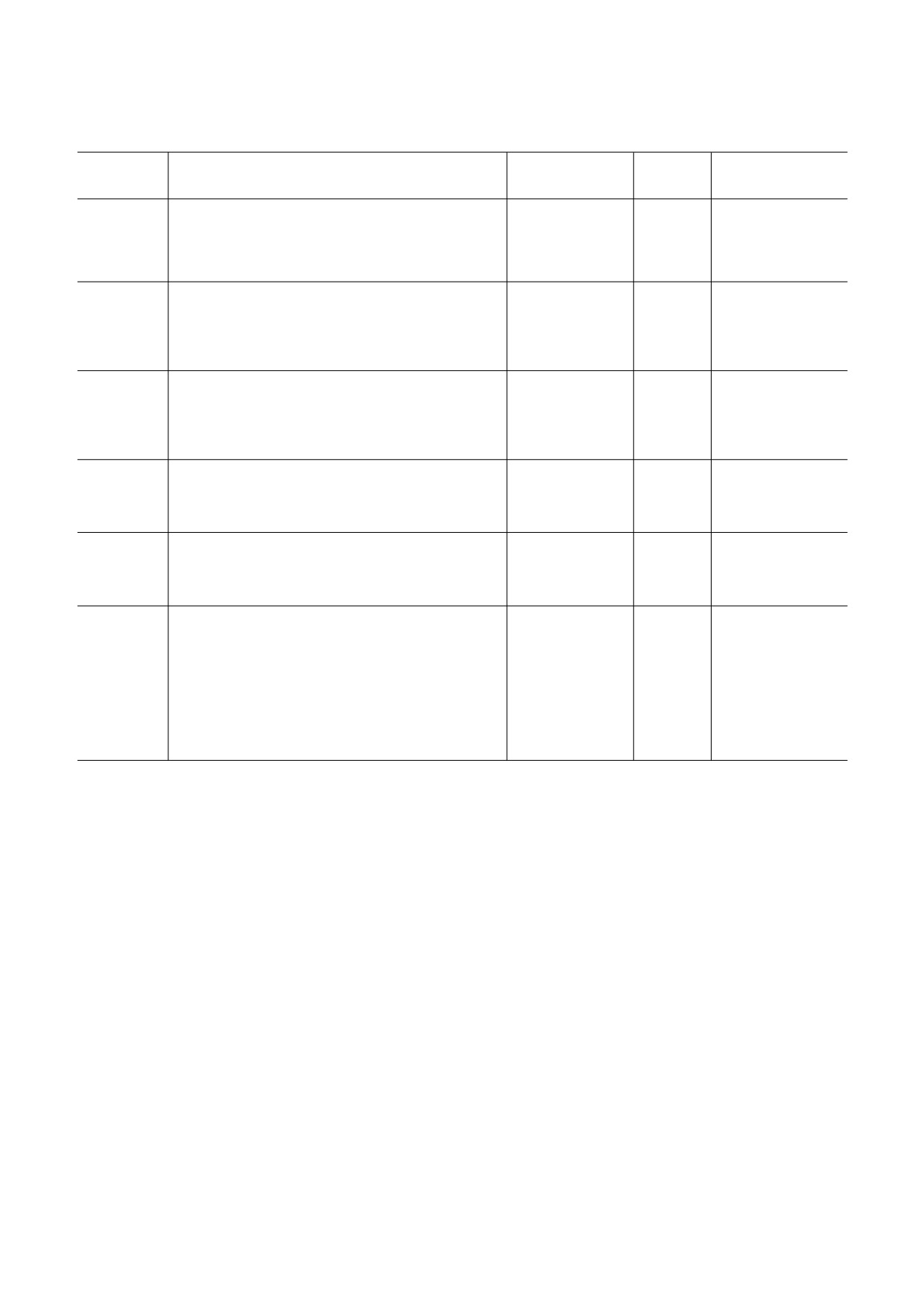
ИНИЦИАЦИЯ ТРАНСЛЯЦИИ ВИРУСНЫХ мРНК
1275
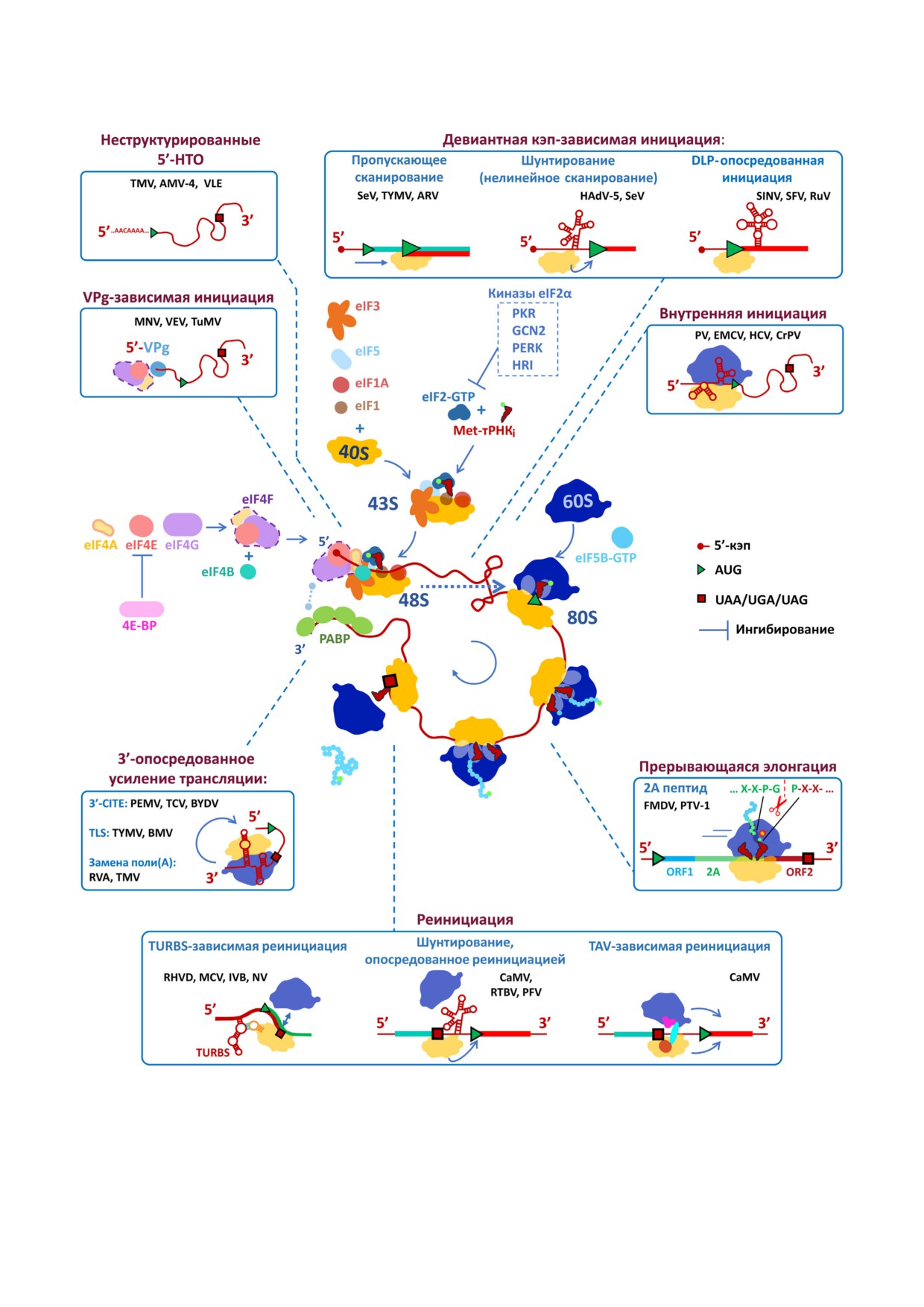
Рис. 1. Трансляционный цикл эукариотической мРНК и основные неканонические механизмы инициации трансляции,
используемые вирусными мРНК. Полные названия вирусов приведены в тексте статьи
БИОХИМИЯ том 86 вып. 9 2021
1276
СОРОКИН и др.
подходящем нуклеотидном контексте, но иног&
С одной мРНК может быть синтезировано более
да - похожего кодона: CUG, ACG, GUG и т.п.)
одного белка - при этом они могут быть закоди&
обеспечивается путём тщательного отслежива&
рованы как в разных рамках считывания, так и в
ния конформации Met&тРНКi в P&сайте при
одной и той же рамке, беря начало с разных
участии факторов eIF1, eIF2, eIF5 и некоторых
стартовых кодонов (в последнем случае речь мо&
субъединиц eIF3. Благодаря их слаженному взаи&
жет идти о ко&терминальных изоформах или об
модействию при распознавании стартового ко&
отдельных белках, получаемых протеолитичес&
дона из гидролизованной молекулы GTP, свя&
ким процессингом).
занной с eIF2, происходит высвобождение фос&
При классическом кэп&зависимом сканиро&
фата Pi, что вызывает последовательную диссо&
вании рибосома не всегда начинает трансляцию
циацию большинства факторов и необратимую
с 5′&проксимального AUG&кодона. Сканирую&
остановку сканирующей рибосомы. На этом
щий 43S&комплекс может не узнать AUG и
этапе с 40S&субчастицей связывается фактор
просто «проехать» мимо [7]. Вероятность такого
eIF5B, который способствует присоединению
события зависит от нуклеотидного контекста
60S&субчастицы. Образовавшийся инициатор&
AUG, в первую очередь от нуклеотидов в поло&
ный 80S&комплекс готов принять аминоацил&
жениях -3 и +4. Пиримидины в этих позициях
тРНК в A&сайт и перейти к элонгации.
уменьшают вероятность узнавания («слабый»
Описанный выше классический механизм
контекст), что приводит к явлению, называемо&
инициации трансляции называется кэп&зависи&
му «пропускающим сканированием» (leaky scan&
мым сканированием и является доминирующим
ning). Пурины в обоих положениях образуют
для клеточных мРНК [3, 7]. Разные его этапы
«сильный» контекст, иногда называемый «коза&
могут регулироваться в зависимости от условий,
ковским», в честь открывшей это явление
в которых оказывается клетка. В частности, при
М. Козак. Узнавание может быть усилено ста&
некоторых видах стресса фактор eIF2 подверга&
бильной вторичной структурой мРНК на опре&
ется фосфорилированию, в результате чего он
делённом расстоянии к 3′&концу от рассматри&
уходит в неактивный комплекс с фактором об&
ваемого триплета, т.к. это замедляет продвиже&
мена гуаниновых нуклеотидов eIF2B и переста&
ние сканирующего комплекса (см. ниже). Одна&
ёт доставлять Met&тРНКi в инициаторный
ко даже если комплекс узнал AUG и остановил&
комплекс, что приводит к быстрому подавле&
ся, для окончательного его закрепления на выб&
нию клеточной трансляции. Другой объект ре&
ранном кодоне должен произойти гидролиз свя&
гуляции - кэп&связывающий аппарат: связыва&
занной с eIF2 молекулы GTP и, главное, высво&
ние eIF4E с eIF4G разобщается белком 4E&BP1,
бождение Pi, делающее гидролиз необратимым.
активирующимся при дефосфорилировании.
Если этого не происходит длительное время
Оба пути зачастую включаются в клетке при ви&
(например, в условиях неактивного eIF5), комп&
русной инфекции.
лекс может возобновить сканирование и доехать
Многие вирусы в ходе эволюции выработали
до следующего подходящего кодона [8]. Этот
способность использовать альтернативные ме&
второй механизм получил название «соскальзы&
ханизмы инициации трансляции, а также мани&
вание 43S&комплекса» (43S sliding), и он не зави&
пулировать разными её этапами и изменять ре&
сит от контекста.
гуляцию. Это даёт им возможность обеспечить
На практике обычно нелегко различить про&
своим мРНК конкурентное преимущество пе&
пускающее сканирование и соскальзывание
ред клеточными матрицами.
43S&комплекса, т.к. оба имеют одни и те же пос&
ледствия, хотя механизм и кинетика этих про&
цессов различны. Однако поскольку 5′&прокси&
«ДЕВИАНТНЫЕ» ФОРМЫ
мальные AUG&кодоны, причём в разных кон&
КЭП/ЗАВИСИМОЙ ИНИЦИАЦИИ
текстах, игнорируются не так редко, оба явле&
ТРАНСЛЯЦИИ ВИРУСНЫХ мРНК
ния, по&видимому, довольно распространены.
Многие вирусы используют эти механизмы в
В этом разделе мы рассмотрим механизмы
своих целях. Например, мРНК P/C мышиного
инициации трансляции тех вирусных мРНК,
респировируса, более известного как вирус Сен&
которые содержат на 5′&конце стандартную кэп&
дай (murine respirovirus или Sendai virus, SeV),
структуру, однако используют неканонические
кодирует сразу восемь продуктов, для инициа&
пути связывания с рибосомой или выбора стар&
ции синтеза трёх из них (C′, P и C, в порядке
тового кодона.
расположения сайтов инициации) используется
Манипуляции с выбором стартового кодона.
пропускающее сканирование [9]. При этом бел&
Из&за компактности вирусные геномы часто со&
ки C′ и C имеют общий С&конец и закодированы
держат перекрывающиеся кодирующие рамки.
в одной рамке, а P - в другой, сильно перекры&
БИОХИМИЯ том 86 вып. 9 2021
ИНИЦИАЦИЯ ТРАНСЛЯЦИИ ВИРУСНЫХ мРНК
1277
вающейся с первой. Для попадания инициатор&
ных мРНК и гРНК самих вирусов [16, 18], одна&
ного комплекса на стартовый кодон С&белка
ко сгРНК продолжают эффективно транслиро&
ему необходимо пропустить два предыдущих.
ваться. Эта трансляция устойчива также к искус&
Это обеспечивается тем, что стартовым кодоном
ственному ингибированию eIF2, хелика&
C′&белка является ACG, а в случае P - контекст
зы eIF4A [19, 20] и к разрезанию eIF4G [19], од&
AUG&кодона содержит пиримидин в положе&
нако всё это справедливо только в контексте ви&
нии -3. Аналогичные принципы позволяют
русной инфекции. Причина этого до конца не
продуцировать несколько белков с одной мРНК
понятна, как и механизм доставки Met&тРНКi в
и другим вирусам, часто при этом в качестве
инициаторный комплекс при отсутствии eIF2 в
первого из стартовых кодонов выступает AUG&
этих условиях [21]. При реконструкции трансля&
подобный триплет (см. обзор Firth и Brierley
ции сгРНК SINV из очищенных компонентов
[10]). Один из самых ярких случаев, когда благо&
eIF2 может быть заменён на факторы рециклин&
даря пропускающему сканированию кодирую&
га и реинициации eIF2D или MCTS•DENR
щий потенциал мРНК используется особенно
[22], однако эта активность, скорее всего, явля&
эффективно, - это субгеномная РНК (сгРНК)
ется для них побочной и едва ли имеет значение
некоторых умбравирусов [11], где два довольно
in vivo [23].
крупных белка закодированы в разных, но поч&
Консервативная шпилька в соответствую&
ти полностью перекрывающихся рамках.
щем положении кодирующей части, помогаю&
Некоторые вирусные мРНК, возможно, на&
щая в выборе стартового кодона (cHP), есть и в
рушают классические принципы пропускающе&
мРНК некоторых флавивирусов (например, ви&
го сканирования. Например, в случае геномной
руса денге, dengue virus, DENV) [24], однако в
РНК (гРНК) вируса жёлтой мозаики турнепса
этом случае устойчивость трансляции к фосфо&
(turnip yellow mosaic virus, TYMV) частота ини&
рилированию eIF2 не задокументирована. Ин&
циации на первом из двух кодонов зависит от
тересно, что мРНК DENV и родственных ему
эффективности узнавания второго и от расстоя&
флавивирусов имеют пониженные требования к
ния между ними [12], что сложно объяснить с
активности
кэп&связывающего
аппара&
позиций классического однонаправленного
та (см. ниже), однако шпилька cHP к этому, по&
(5′-3′) сканирования даже с учётом всех нюан&
видимому, отношения не имеет [25].
сов [13]. «Облегчённое» пропускающее скани&
Нелинейное сканирование. Классическая мо&
рование на мРНК S1&реовируса птиц (avian
дель рибосомного сканирования предполагает
reovirus, ARV) позволяет преинициаторному
непрерывную инспекцию преинициаторным
комплексу оказаться на стартовом кодоне рамки
комплексом всех позиций в 5′&НТО без каких&
ςС. Возможно, в этих случаях первоочередную
либо пропусков. Однако в некоторых вирусных
роль играет соскальзывание 43S&комплекса или
мРНК определённые участки лидера как будто
выбор меняется в зависимости от концентрации
избегают такого просмотра. Наличие в этих
мРНК и факторов в клетке [14]. Пропуск AUG&
участках AUG&кодонов или стабильных шпи&
кодонов возможен не только в случае кэп&зави&
лек, которые обычно препятствуют прохожде&
симой инициации, но и при других случаях ска&
нию 43S&комплекса, не сказывается на уровне
нирования (см. ниже).
трансляции основной рамки. В таких случаях
Влияние на выбор стартового кодона могут
принято говорить о нелинейном сканировании
оказывать также специальные элементы вто&
или шунтировании (shunting).
ричной структуры вирусной мРНК. Стабильные
Шунтирование - понятие собирательное.
шпильки, расположенные на расстоянии 14 нт
Обычно рассказ о нём начинают со случая 35S&
или немного дальше от инициаторного кодона,
прегеномной РНК (пгРНК) параретровируса
не только способствуют его узнаванию, но и мо&
CaMV (cauliflower mosaic virus, вирус мозаики
гут каким&то образом снижать потребность та&
цветной капусты), при описании которого и был
кой мРНК в некоторых факторах инициации (в
введён этот термин [26]. Однако мы позволим
частности, eIF2 и eIF4F). Такие структуры, на&
себе нарушить эту традицию, поскольку сейчас
зываемые DLP (от англ. downstream loop), есть в
известно, что в основе «шунтирования» на 35S&
сгРНК некоторых альфавирусов (например,
пгРНК лежит не нелинейное сканирование ли&
вируса Синдбис (Sindbis virus, SINV) и вируса
дера преинициаторным 43S&комплексом, а осо&
леса Семлики (Semliki forest virus, SFV)), а также
бый механизм реинициации трансляции, вклю&
у родственных им рубивирусов (вируса краснухи
чающийся после прочтения и терминации на
(rubella virus, RuV)) [15-17]. В заражённых ими
стоп&кодоне первой короткой рамки, располо&
клетках фосфорилирование фактора eIF2 кина&
женной в 5′&НТО (upstream open reading frame,
зой PKR на поздних стадиях инфекции приво&
uORF). Поэтому мы опишем этот случай в раз&
дит к резкому подавлению трансляции клеточ&
деле про реинициацию.
БИОХИМИЯ том 86 вып. 9 2021
1278
СОРОКИН и др.
Шунтирование как нелинейное сканирова&
100K содержит RGG&мотив (аргинин&глицин&
ние в полном смысле слова было впервые задо&
глицин), который присутствует также в ряде
кументировано в 1988 г. при изучении трансля&
клеточных мРНК&связывающих белков и, как
ции уже упоминавшейся выше мРНК P/C виру&
выяснилось значительно позднее, действитель&
са Сендай [27]. В то время как инициация транс&
но может опосредовать связывание с eIF4G [32].
ляции первых трёх рамок в этой мРНК происхо&
В случае клеточных RGG&белков, правда, такое
дит по механизму обычного и пропускающего
взаимодействие приводит к образованию неак&
сканирования, на три дистальных стартовых ко&
тивных рибонуклеопротеидов (мРНП). Транс&
дона (находящихся в одной рамке и дающих на&
ляция, направляемая TPL, устойчива к частич&
чало ко&терминальным белкам Y1, Y2 и X) рибо&
ной инактивации eIF4F [33], хотя связано ли это
сомы попадают, минуя проксимальную об&
с шунтированием, неизвестно.
ласть [9, 28]. Для этого, однако, требуется кэпи&
Существуют и другие, менее охарактеризо&
рованный 5′&конец мРНК P/C. Механизм шун&
ванные случаи шунтирования: например, на
тирования при инициации на AUG&кодонах Y1
мРНК папилломавируса 18 человека (human
и Y2 (расположенных на расстоянии 15 нт друг
papillomavirus 18, HPV 18), кодирующей бе&
от друга) детально изучен. После связывания с
лок E1; на бицистронной пгРНК вируса гепати&
5′&кэпом и сканирования первых ~50 нт лидера
та B уток (duck hepatitis B virus, DHBV); на три&
преинициаторный комплекс «перескакивает»
цистронной мРНК S1 реовируса ARV; на
на стартовые кодоны Y1 или Y2. Выраженного
мРНК 3 коронавируса, вызывающего свиной
донорного сайта обнаружено не было, а акцеп&
трансмиссивный гастроэнтерит (transmissible
торным сайтом служит локальная окрестность
gastroenteritis coronavirus, TGEV), и некоторых
AUG&кодонов Y1 и Y2, включающая необходи&
других (см. обзоры [10, 34]). Инициация транс&
мую для шунтирования последовательность
ляции на всех этих мРНК требует наличия кэпи&
длиной 24 нт, расположенную сразу за вторым
рованного 5′&конца, но введение в «шунтируе&
из них. Интересно, что в искусственной
мую» рибосомой область стабильных шпилек и
конструкции, направляющей рибосому на те же
AUG&кодонов не приводит к ингибированию
кодоны путём классического кэп&зависимого
трансляции. Молекулярные механизмы во всех
сканирования, эта последовательность не влия&
этих случаях также до конца не охарактеризова&
ла на эффективность их узнавания (т.е. необхо&
ны, но они, по&видимому, отличаются от двух
димость в этой структуре не связана с останов&
вышеописанных, поскольку не имеют упомяну&
кой сканирования, как в случае вышеописан&
тых специфических черт.
ной DLP). Другой уникальной особенностью
Особенности инициации трансляции вирусных
является то, что стартовые AUG&кодоны Y1 и Y2
мРНК с неструктурированными 5′/НТО. мРНК
могут быть заменены на другие триплеты без по&
некоторых вирусов имеют лидеры, находящиеся
тери эффективности шунтирования. Вирусные
полностью в одноцепочечной конформации.
белки для шунтирования на мРНК P/C не тре&
Это понижает их требования к некоторым фак&
буются.
торам инициации. Классическим примером яв&
Второй случай, считающийся классичес&
ляется сгРНК 4 вируса мозаики люцерны (alfalfa
ким, - это нелинейное сканирование так назы&
mosaic virus, AMV), которая содержит U&бога&
ваемого трёхчастного лидера (tripartite
тую неструктурированную 5′&НТО длиной 36 нт.
leader, TPL) поздних мРНК аденовируса 5 чело&
В системе in vitro, реконструированной из очи&
века (human adenovirus 5, HAdV&5), а также
щенных компонентов, эта мРНК может образо&
мРНК IVa2 этого же вируса. Группа Р. Шнайдера
вывать инициаторный 48S&комплекс при отсут&
показала, что 40S&субчастица, связавшись с кэ&
ствии ATP и факторов группы eIF4 [35]. И хотя
пированным 5′&концом и начав сканирование,
в полном клеточном лизате её трансляция, по&
пропускает затем внутреннюю сильно структу&
видимому, требует целостного фактора eIF4F
рированную часть TPL, причём важную роль в
(см. обсуждение в статье Hann и Gehrke [36]),
этом шунтировании, по мнению авторов, играет
упомянутые структурные особенности дают
спаривание определённого участка лидера с
этой мРНК конкурентные преимущества перед
18S рРНК [29]. Этот процесс может идти и в не&
клеточными матрицами и позволяют относи&
заражённых клетках, но требует каких&то допол&
тельно эффективно транслироваться даже при
нительных белков, помимо канонических ини&
отсутствии 5′&кэпа.
циаторных факторов [30]. При инфекции он до&
Преимущественно одноцепочечную кон&
полнительно стимулируется аденовирусным
формацию, по&видимому, имеет также A&бога&
белком 100K, который связывает одновременно
тый омега&лидер мРНК вируса табачной мозаи&
TPL и фактор eIF4G [31]. Механизм этого явле&
ки (tobacco mosaic virus, TMV), способный нап&
ния не до конца ясен, однако стоит заметить, что
равлять очень эффективную трансляцию во
БИОХИМИЯ том 86 вып. 9 2021
ИНИЦИАЦИЯ ТРАНСЛЯЦИИ ВИРУСНЫХ мРНК
1279
многих эукариотических бесклеточных систе&
ции eIF4F или некоторые из его субъединиц.
мах, в том числе и в некэпированном виде [37].
Поскольку сам способ инициации трансляции
В лаборатории А.С. Спирина было показано,
при этом остаётся стандартным, мы ограничим&
что в реконструированной трансляционной
ся лишь их перечислением, а заинтересованные
системе мРНК с этим лидером может образовы&
читатели могут обратиться к ранее опублико&
вать инициаторный 48S&комплекс при отсут&
ванным работам [47, 48]. Так, гигантские вирусы
ствии eIF4F и ATP [38]. Авторами была предло&
простейших кодируют собственный ортолог
жена модель «диффузионного блуждания» -
фактора eIF4E; кэп&связывающая субъедини&
двунаправленного ATP&независимого сканиро&
ца PB2 РНК&полимеразы вируса грип&
вания этого лидера, хотя вопрос о том, может ли
па (influenza A virus, IAV) связывает eIF4G и та&
происходить такой процесс в полном клеточном
ким образом заменяет клеточный eIF4E (кото&
лизате и тем более в живой клетке, остаётся от&
рый при инфекции инактивируется) для вирус&
крытым.
ных мРНК; сходную активность имеет, по&ви&
Ещё более выражены необычные свойства
димому, белок N некоторых аренавирусов (Junin
неспирализованных
5′&НТО в случае тран&
virus (JUNV), Tacaribe virus (TCRV) и Pichinde
скриптов с олиго(А)&лидерами, характерными
virus (PICV)); а белок N хантавируса (Sin Nombre
для промежуточных и поздних мРНК вируса ос&
orthohantavirus, SNV, семейство Bunyaviridae) за&
повакцины (vaccinia virus, VACV). По ранним
меняет фактор eIF4F целиком, поскольку обла&
оценкам, длина этих лидеров, образующихся
дает активностями всех трёх его субъединиц.
при транскрипции путём нематричного синтеза,
В следующем разделе мы рассмотрим случаи,
составляет около 30-40 нт, однако более позд&
когда функции 5′&кэпа (все или только некото&
ние данные говорят о меньшей длине: от 7-8 нт
рые) выполняют белки, ковалентно связанные с
для промежуточных до 11-20 нт - для позд&
5′&концом вирусной мРНК.
них [39, 40], и указывают на превалирование не&
кэпированных транскриптов среди мРНК, син&
тезируемых на этих стадиях инфекции [40].
VPg/ЗАВИСИМАЯ ИНИЦИАЦИЯ
В работе Shirokikh и Spirin [41] было показано,
ТРАНСЛЯЦИИ
что в системе сборки инициаторных 48S&комп&
лексов из очищенных компонентов мРНК с
Наличие кэп&структуры не является обяза&
олиго(А)&лидерами сходной длины могут обхо&
тельным для инициации трансляции, зависи&
диться не только без eIF4F, но и без eIF3. Воз&
мой от 5′&конца. Некоторые вирусные мРНК не
можно, это свойство лежит в основе преимущес&
имеют кэпа, но способны использовать тот же
твенной трансляции мРНК VACV во время ин&
набор факторов инициации, вовлекаемых в
фекции и её устойчивости к разрезанию eIF4G и
трансляцию, в той же последовательности, что и
добавлению аналога кэпа в in vitro систе&
при кэп&зависимой инициации. Для этого вмес&
му [42, 43]. Похожая ситуация имеет место и в
то кэпа используется белок VPg (viral protein
случае мРНК дрожжевых вирусоподобных эле&
genome&linked), ковалентно связанный с 5′&кон&
ментов (virus&like elements, VLE) pGKL1/2, ко&
цом РНК и в каком&то смысле подменяющий
торые также имеют олиго(А)&лидеры вариабель&
кэп&структуру. Наличие VPg характерно для
ной длины, не превышающей, как правило,
многих РНК&вирусов, однако основная функ&
12 нт [44]. Как и в случае VACV, многие тран&
ция этого белка связана с репликацией РНК.
скрипты VLE некэпированы, а их трансляция не
Использование же его вместо кэпа характерно
требует eIF4E. Чтобы эффективно иницииро&
только для представителей семейств Potyviridae,
вать трансляцию в инфицированных клетках,
Caliciviridae и, возможно, Astroviridae.
длина олиго(А)&лидеров не должна превышать
Яркими примерами являются калицивиру&
12 нт [45]. Это объясняется тем, что при боль&
сы, инфицирующие млекопитающих. Их VPg
шей длине с таким лидером сможет связаться
может выполнять функцию 5′&кэпа, обеспечи&
PABP [5], что приведёт к ингибированию посад&
вая вирусной мРНК связывание с eIF4E или да&
ки рибосом. В клетках человека, заражён&
же напрямую с eIF4G и PABP, что описано для
ных VACV, преимущественная трансляция
представителей родов Vesivirus и Norovirus
мРНК с олиго(А)&лидерами требует фосфори&
[49, 50]. Например, С&концевой участок VPg но&
лирования рибосомного белка RACK1 вирусной
ровируса мышей (murine norovirus, MNV) взаи&
киназой [46], однако причина этого неясна.
модействует с HEAT&1&доменом фактора eIF4G,
Альтернативный кэп/связывающий аппарат.
что приводит к эффективной сборке преиници&
Отдельного упоминания заслуживают примеры,
аторного комплекса на вирусной мРНК [50].
когда вирусы кодируют собственные кэп&связы&
Подобные случаи известны и для вирусов расте&
вающие белки, подменяющие фактор инициа&
ний: VPg потивирусов способен конкурировать
БИОХИМИЯ том 86 вып. 9 2021
1280
СОРОКИН и др.
за кэп&связывающий сайт фактора eIF4E. Таким
щиеся в 5′&НТО или в межгенных спейсерах по&
образом, с одной стороны, подавляется кэп&за&
лицистронных мРНК, отдельные домены кото&
висимая инициация мРНК заражённой клетки,
рых отвечают за связывание факторов инициа&
а с другой - обеспечивается трансляция вирус&
ции и рибосом, а иногда имитируют тРНК или
ных мРНК [51]. Помимо этого, для потивирусов
другие трансляционные компоненты (рис. 2).
показано синергичное действие VPg и PABP:
IRES должен выполнять две задачи: во&первых,
PABP в 3-4 раза усиливает связывание VPg с
привлекать инициаторный комплекс независи&
eIF4F, что стимулирует трансляцию мРНК виру&
мо от наличия в мРНК 5′&кэпа, а во&вторых,
са мозаичности турнепса (turnip mosaic virus,
обеспечивать ремоделирование малой рибосом&
TuMV) в бесклеточной системе из зародышей
ной субчастицы, позволяющее ей поместить
пшеницы (wheat germ extract, WGE). При добав&
внутреннюю область матрицы в РНК&связыва&
лении очищенного PABP в систему WGE, исто&
ющий канал. Именно второй аспект активности
щённую по факторам eIF4F, eIFiso4F и PABP,
IRES&элемента определяет его способность
наблюдалось усиление трансляции вирусной
обеспечивать внутреннюю инициацию трансля&
мРНК более чем в 30 раз [52], что практически
ции, а не только делать её кэп&независимой. Это
на порядок превышает стимулирующий эффект
отличает IRES&элементы, например, от рас&
PABP на трансляцию клеточных мРНК в этой
сматриваемых ниже кэп&независимых энхансе&
системе. Возможны и альтернативные механиз&
ров трансляции.
мы привлечения инициаторного комплекса:
Особый способ привлечения инициаторного
так, VPg кошачьего калицивируса (feline cali&
комплекса зачастую позволяет IRES&содержа&
civirus, FCV) и вируса Норуолка челове&
щим мРНК иметь пониженные требования к
ка (human Norwalk virus, HNV) действуют путём
набору факторов инициации (а в отдельных слу&
связывания с eIF3 [53].
чаях и вовсе обходиться без них), что даёт им
Помимо привлечения факторов инициации,
возможность эффективно функционировать в
VPg может выполнять и другие функции в
условиях, когда трансляция клеточных мРНК
трансляции: например, норовирусные VPg взаи&
подавлена. На этом свойстве IRES&элементов
модействуют с G3BP1, одним из ключевых ком&
многие содержащие их вирусы строят свои стра&
понентов в формировании стресс&гранул, и это
тегии трансляционного приоритета, принуди&
связывание также стимулирует синтез вирусных
тельно инактивируя отдельные компоненты бе&
белков [54]. Важность этих механизмов подчёр&
локсинтезирующего аппарата клетки.
кивает тот факт, что протеолитическое удаление
Многообразие и сложности с классификацией
VPg (например, у вируса везикулярной экзанте&
IRES/элементов. Известно большое разнообра&
мы (vesicular exanthema virus, VEV), представите&
зие вирусных IRES&элементов в плане их струк&
ля калицивирусов) приводит к полной потере
туры и функциональных свойств. Не все они
инфекционности вирусной мРНК [55].
изучены одинаково хорошо, что сильно затруд&
Всё вышеописанное свидетельствует в поль&
няет их классификацию. Недавно открытые или
зу того, что наличие VPg у потивирусов и кали&
малоизученные IRES&элементы часто выделяют
цивирусов является жизненной необходи&
в новые типы, что ещё больше запутывает дело.
мостью в борьбе за клеточный трансляционный
Кроме того, существенная доля работ по иден&
аппарат. Дизайн низкомолекулярных ингибито&
тификации IRES&элементов выполнена без учё&
ров, способных специфично разобщать взаимо&
та возможных артефактов (см. следующий раз&
действие VPg с его партнёрами, может быть
дел), из&за чего некоторые случаи, вероятно,
перспективным направлением в лечении забо&
могут оказаться ложными. Ситуация осложня&
леваний, вызываемых калицивирусами у млеко&
ется ещё и тем, что у вирусов часты случаи гори&
питающих и потивирусами у растений.
зонтального переноса между отдалёнными фи&
логенетическими группами, и это не позволяет с
уверенностью использовать для классификации
ВНУТРЕННЯЯ ИНИЦИАЦИЯ
таксономическую принадлежность вируса.
ТРАНСЛЯЦИИ
На наш взгляд, удобной является классифи&
кация, построенная на подобии вторичных
Альтернативным способом инициации
структур, механизмов привлечения рибосом и
трансляции является использование особых
минимального набора необходимых факторов
цис&действующих элементов в мРНК, именуе&
инициации, предопределяемых этой структу&
мых участками внутренней посадки рибосо&
рой. Для целей данного обзора мы выделим
мы (internal ribosome entry site, IRES). Как пра&
4 основных типа IRES&элементов, пронумеро&
вило, IRES&элементы представляют собой вы&
вав их в порядке истории их открытия, а группы,
сокоструктурированные участки мРНК, находя&
не вошедшие в эту классификацию, опишем от&
БИОХИМИЯ том 86 вып. 9 2021
ИНИЦИАЦИЯ ТРАНСЛЯЦИИ ВИРУСНЫХ мРНК
1281
дельно. При этом мы хотели бы подчеркнуть,
ные мРНК, синтезированные in vitro [63, 67], од&
что мы не претендуем на то, что этот способ
нако этот метод по&прежнему применяется лишь
классификации лучше тех, которые используют
в единичных работах. При этом стоит заметить,
наши коллеги [47, 56-60].
что метод РНК&трансфекции также имеет свои
Обстоятельства, затрудняющие изучение
ограничения. В частности, при использовании
IRES/элементов. Успехи в изучении классичес&
липокатионных реагентов большая часть достав&
ких IRES&элементов, описанных в следующем
ленных в клетку липосом не изливается в цитоп&
разделе, способствовали появлению мнения,
лазму, поэтому, например, анализировать коли&
что и многие другие вирусные мРНК использу&
чество или стабильность попавшей в клетки
ют для инициации трансляции механизм внут&
мРНК методом RT&qPCR бессмысленно [68].
реннего связывания рибосомы. Действительно,
Однако главный изъян метода бицистронных
у целого ряда вирусных мРНК 5′&НТО имеют
конструкций проявляется, когда исследователи
сложную вторичную структуру и содержат
проводят сравнение уровней экспрессии второго
uAUG&кодоны (от англ. upstream AUG), кото&
цистрона, направляемых гипотетическими
рые, казалось бы, должны сильно снижать эф&
IRES&элементами, между собой (а также с конт&
фективность рибосомного сканирования. При
рольной конструкцией с неспецифичным спей&
этом такие мРНК продолжают транслироваться
сером). Принципиальный недостаток кроется в
в условиях, когда кэп&связывающий аппарат
субъективности интерпретации результатов та&
частично инактивирован, а большинство кле&
кого сравнения [63]. Этот подход оправдан, если
точных мРНК неактивны.
в природной мРНК изучаемая область действи&
Для подтверждения присутствия IRES&эле&
тельно находится в межцистронном положении
мента в том или ином фрагменте мРНК обычно
(как, например, в случае межгенного IRES&эле&
используется метод бицистронных конструк&
мента Dicistroviridae), однако такие ситуации
ций, предложенный ещё в первых работах на эту
встречаются редко. В случае же 5′&НТО необхо&
тему [61, 62]. Он основан на оценке экспрессии
димо сравнивать между собой не разные бицист&
двух репортёрных генов, находящихся в одной
ронные конструкции, а бицистронную и моно&
мРНК. Репортёр, расположенный ближе к 5′&
цистронную конструкции, содержащие изучае&
концу мРНК, транслируется по кэп&зависимому
мую 5′&НТО в межгенном или 5′&концевом поло&
механизму и служит внутренним контролем.
жении соответственно. Именно такое сравнение
В то же время вторая рамка может эффективно
позволит выяснить, по какому механизму транс&
транслироваться, только если рибосомы будут
лируется природная мРНК: если эффективности
иметь возможность связаться с межцистронной
трансляции, направляемой 5′&НТО в этих двух
областью, т.е. если в ней будет содержаться
ситуациях, будут сопоставимы, можно говорить
функциональный IRES. Этот элегантный под&
о заметном вкладе внутренней инициации [63].
ход получил широкое распространение, однако
Впрочем, этот подход также не даёт полной га&
при его неправильном применении и пренебре&
рантии однозначного вывода, поскольку есть
жении рядом «подводных камней» есть высокий
риск, что встраивание изучаемого фрагмента
риск получить ложноположительные результа&
РНК в искусственный контекст может повлиять
ты [63-66].
на его функциональную активность.
Одна из основных проблем в применении
Ещё одним источником ложноположитель&
этого метода - использование плазмид для дос&
ных результатов при поиске IRES&элементов
тавки бицистронных репортёров. Плазмидная
может являться популярная бесклеточная сис&
ДНК, попадая в культивируемые клетки млеко&
тема трансляции, лизат ретикулоцитов кроли&
питающих, помимо ожидаемых бицистронных
ка (rabbit reticulocyte lysate, RRL) с гидролизо&
мРНК, продуцирует в небольших количествах
ванными эндогенными мРНК. Эта система не
хаотичный набор «нелегитимных» транскрип&
воспроизводит конкурентные условия клетки и
тов - продуктов фоновой промоторной актив&
имеет обеднённый репертуар РНК&связываю&
ности и неконтролируемого сплайсинга [64, 67].
щих белков, поэтому транслируемые в ней
Среди них оказываются моноцистронные
мРНК демонстрируют относительно слабую за&
мРНК, кодирующие тот репортёр, по активнос&
висимость от 5′&кэпа, повышенную чувстви&
ти которого оценивается внутренняя инициа&
тельность к вариациям вторичной структуры 5′&
ция. И как бы ни было мало их количество по
НТО и аберрантную внутреннюю инициацию
сравнению с аутентичным бицистронным тран&
на протяжённых неструктурированных облас&
скриптом, иногда именно они и обеспечивают
тях, содержащих AUG&кодоны (см. обсуждение
всю наблюдаемую продукцию этого репортёра.
в ранее опубликованных работах [63, 65, 69]).
В качестве альтернативы, лишённой этих недос&
Кроме того, часть молекул eIF4G, входящих в
татков, предлагается использовать бицистрон&
состав eIF4F, связана в RRL с кэпированными
3 БИОХИМИЯ том 86 вып. 9 2021
1282
СОРОКИН и др.
5′&концевыми фрагментами гидролизованных
ченных представителей каждого из четырёх ти&
мРНК и высвобождается при добавлении инги&
пов (рис. 2, табл. 1), а затем коснёмся тех случа&
биторов кэп&зависимой инициации (m7GTP,
ев, которые находятся в процессе изучения и не
4E&BP1 или специфичных протеаз, разрезаю&
отнесены пока к какой&либо из категорий либо
щих eIF4G), что приводит к стимуляции транс&
требуют дополнительного подтверждения.
ляции некэпированных или малоэффективных
Классические IRES/элементы типа I. Внут&
кэпированных мРНК. Аберрантная внутренняя
ренняя инициация трансляции эукариотической
инициация в случае бицистронных конструк&
мРНК впервые была показана в конце 1980&х гг.
ций и ложная кэп&независимость в случае мо&
на примере IRES&элемента полиовируса (polio&
ноцистронных могут быть ошибочно истолко&
virus, PV, семейство Picornaviridae) [62, 77], ко&
ваны как признак наличия IRES. В бесклеточ&
торый и стал прототипом IRES&элементов ти&
ных системах, приготовленных из культивируе&
па I. Представители этой группы обнаружены
мых клеток млекопитающих, эти явления
только в 5′&НТО гРНК некоторых пикорнавиру&
обычно не воспроизводятся [69, 70]. Впрочем,
сов, и IRES PV является наиболее изученным из
при работе даже с такими системами нужно
них (рис. 2, а).
помнить, что результаты могут сильно зависеть
Как и у других пикорнавирусов, гРНК PV
от условий приготовления и концентрации
некэпирована и содержит на 5′&конце бе&
компонентов, и с осторожностью соотносить
лок VPg (который в данном случае, скорее все&
данные, полученные в конкретной бесклеточ&
го, не участвует в инициации трансляции).
ной системе, с результатами в культивируемых
IRES имеет длину около 650 нт и занимает
клетках, а тем более in vivo.
большую часть ~740&нуклеотидной 5′&НТО.
Далее мы опишем способы IRES&опосредо&
В этой области расположено несколько струк&
ванной инициации на примере наиболее изу& турных доменов (II-VI), необходимых для ак&
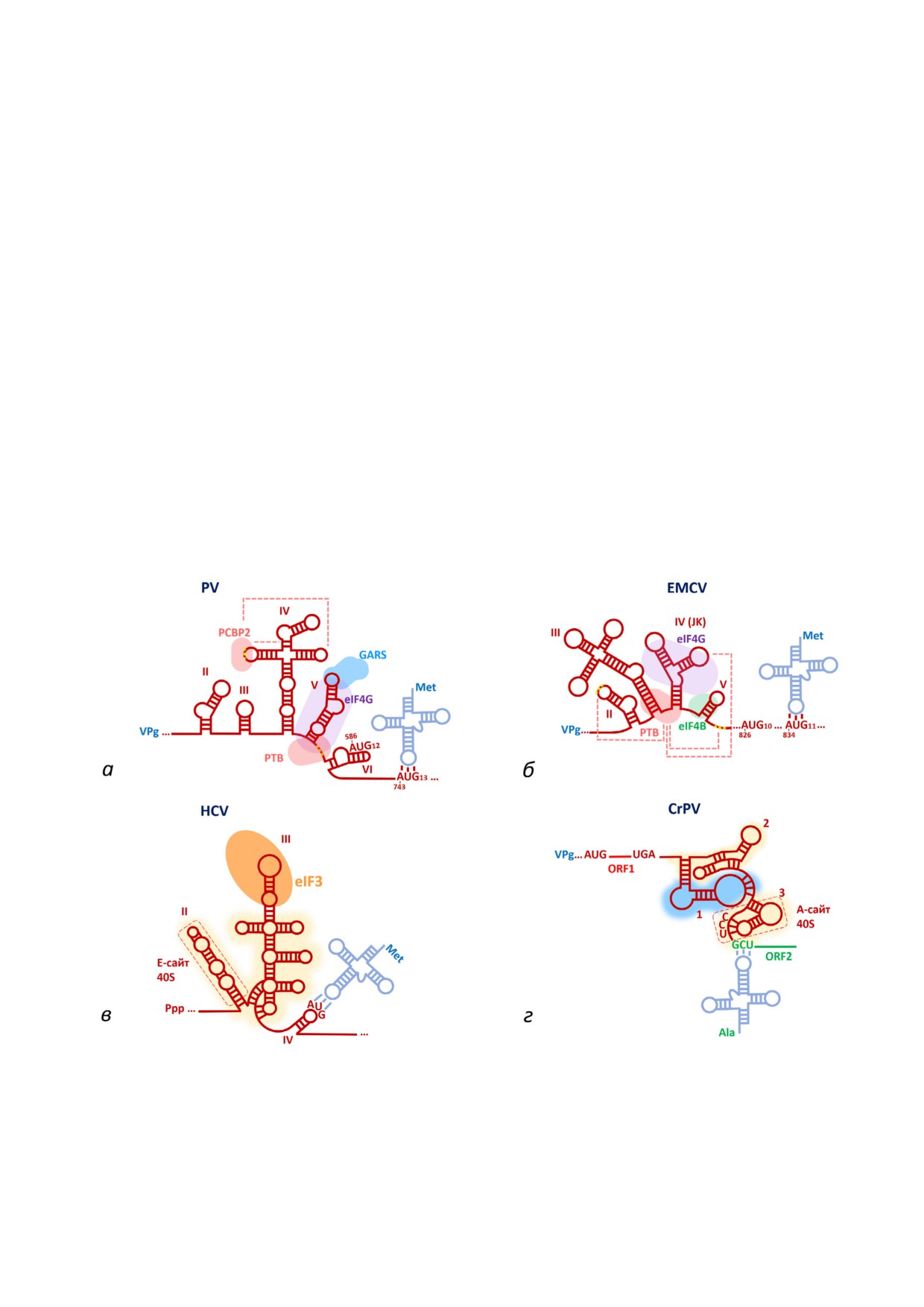
Рис. 2. Основные типы классических IRES&элементов на примере наиболее характерных представителей (полные назва&
ния вирусов приведены в тексте статьи). Схематически показана вторичная структура элементов типов I-IV (а-г соответ&
ственно), специфично связывающиеся с ними белки, а также области контакта с 40S& и 60S&субчастицами (жёлтое и го&
лубое затенение соответственно). Показаны также аминоацил&тРНК, обеспечивающие доставку N&концевой аминокис&
лоты будущего белка
БИОХИМИЯ том 86 вып. 9 2021
ИНИЦИАЦИЯ ТРАНСЛЯЦИИ ВИРУСНЫХ мРНК
1283
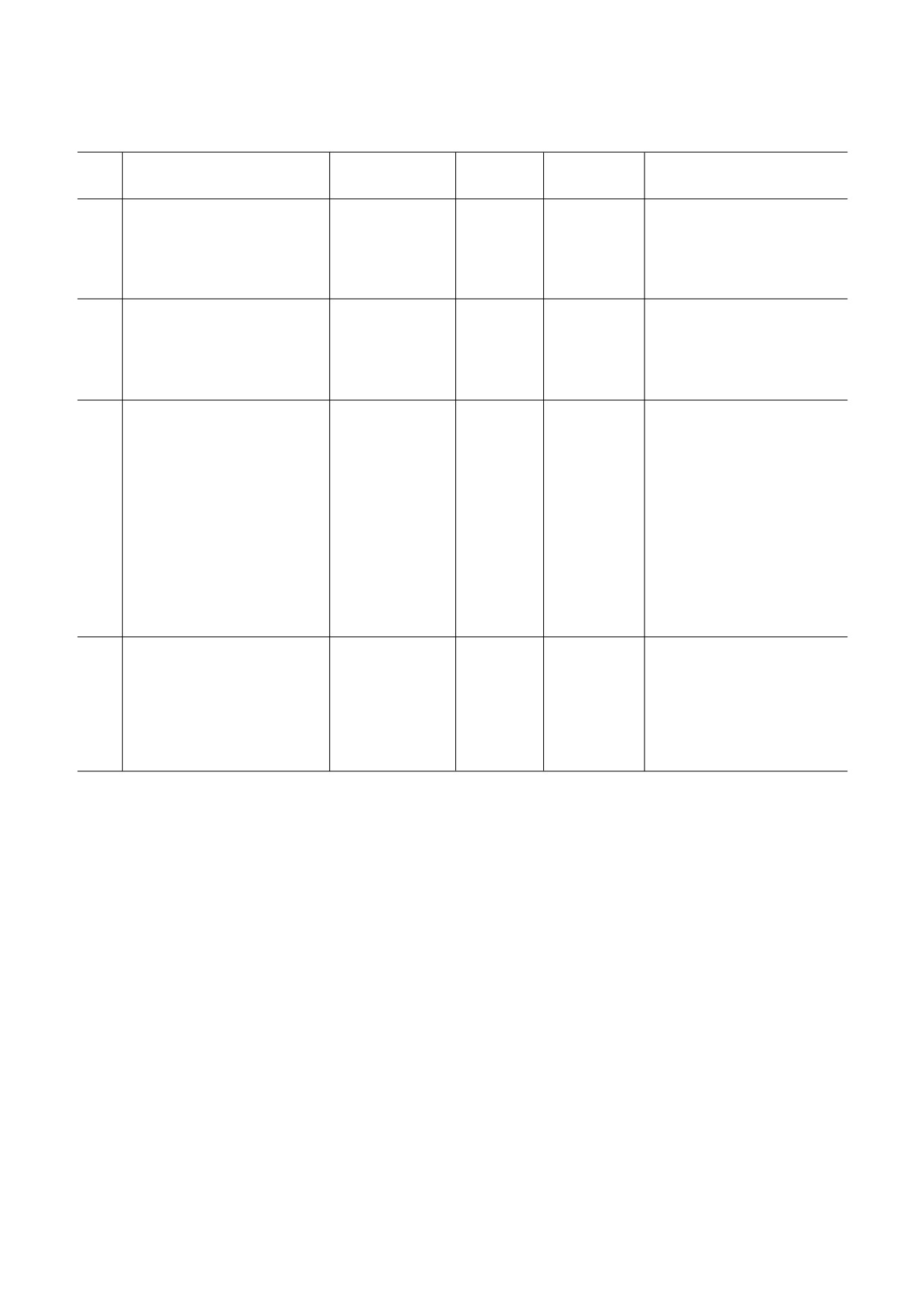
Таблица 1. Классические типы IRES&элементов и их краткая характеристика
Тип
Необходимые eIF и ITAF*
Kd, нМ
Положение
Семейство
Некоторые представители**
IRES
в мРНК
(Род) вирусов
I
(eIF1), (eIF1A), eIF2, eIF3,
78 (eIF4G) [71];
5′&НТО
Picornaviridae
Poliovirus (PV)
eIF4A, (eIF4B), eIF4G,
40 (eIF4F) [71];
(Enterovirus)
(PTB), PCBP2, (PCBP1,
41 (PTB) [71];
Human Coxsackievirus B3 CVB3)
GARS, UNR, La)
250 (PCBP1) [72]
Human rhinovirus A (HRV)
II
(eIF1), (eIF1A), eIF2, eIF3,
55 (40S) [73]
5′&НТО
Picornaviridae
Encephalomyocarditis virus
eIF4A, (eIF4B), eIF4G;
(Cardiovirus)
(EMCV)
PTB, (ITAF45)
Picornaviridae
Foot and mouth disease virus
(Aphthovirus)
(FMDV)
III
(eIF1A), eIF2/eIF5B, eIF3
1,9 (40S) [74];
5′&НТО
Flaviviridae
Hepatitis C virus (HCV)
35 (eIF3) [74]
(Hepacivirus)
Flaviviridae
Classical swine fever virus (CSFV)
(Pestivirus)
Picornaviridae
Seneca valley virus (SVV)
(Senecavirus)
Picornaviridae
Porcine teschovirus 1 (PTV&1)
(Teschovirus)
Picornaviridae
Porcine enterovirus 8 (PEV8)
(Enterovirus)
IV a
нет (eEF2)
22-26 (40S) [75]
IGR
Dicistroviridae
Cricket paralysis virus (CrPV)
8 (80S) [76]
(Cripavirus)
b
нет (eEF2)
25 (80S) [76]
Dicistroviridae
Taura syndrome virus (TSV)
(Aparavirus)
c
нет
-
не присвоено
Halastavi árva virus (HalV)
Примечание. Указаны характерные представители (названия вирусов, в мРНК которых они содержатся), расположение
в гРНК, необходимые для инициации трансляции факторы и ITAF, а также равновесные константы диссоциации (Kd) для
некоторых из них.
* Информация о требованиях к факторам инициации и ITAF основана преимущественно на данных, полученных в опы&
тах по реконструкции инициаторных комплексов из очищенных компонентов, и отражает потребности, характерные
именно для этих реконструированных систем; в скобках даны названия факторов, либо стимулирующих сборку (eIF1A,
eIF4B, PTB), либо не являющихся абсолютно необходимыми для всех представителей данного типа (ITAF45), либо нуж&
ных для дополнительных целей - например, выбора правильного стартового кодона (eIF1), перехода к элонгации (eEF2)
или трансляции в других бесклеточных системах (некоторые ITAF).
** Жирным шрифтом выделены названия вирусов с наиболее хорошо охарактеризованными IRES&элементами данного
типа.
тивности IRES&элемента [78, 79], за которыми
CVB3) и риновируса человека A (human rhi&
следует слабоструктурированная область дли&
novirus A2, HRV A2) - имеют сходное устрой&
ной 160 нт и стартовый кодон AUG743, 13&й по
ство (подробнее см. в недавно опубликованных
счёту с 5′&конца (рис. 2, а). У основания доме&
обзорах [56, 59, 80]).
на VI расположен олигопиримидиновый
Особенностью этого типа IRES&элементов
тракт (Yn), включающий консервативную пос&
является наличие «криптического» AUG&кодо&
ледовательность UUUCC. Другие представите&
на (в случае PV - это AUG586), расположенного
ли этого типа IRES&элементов - например,
внутри домена VI, на расстоянии 18-20 нт в 3′&
в гРНК энтеровируса A71 (enterovirus EV&A71),
сторону от Yn. Этот кодон важен для эффектив&
вируса Коксаки типа B (Coxsackievirus B3,
ной работы IRES&элемента [81]. Он может узна&
БИОХИМИЯ том 86 вып. 9 2021
3*
1284
СОРОКИН и др.
ваться инициаторным комплексом, однако из&за
лек и дополнительных AUG позволяют предпо&
неоптимального нуклеотидного контекста этот
ложить нелинейное сканирование этого регио&
AUG не является основным стартовым кодоном
на, напоминающее шунтирование
[84,
85].
для синтеза вирусного полипротеина. Настоя&
В случае HRV, где два AUG находятся друг нап&
щий стартовый кодон, AUG743, находится гораз&
ротив друга в стабильной шпильке, часть рибо&
до дальше - на расстоянии более 100 нт от кон&
сом также попадает с AUG589 на AUG626 путём её
ца домена VI. В случае HRV аналогичную пару
шунтирования [86].
составляют AUG589 и AUG626, расположенные
Для функционирования IRES&элементов ти&
друг напротив друга вблизи основания шпильки
па I необходим практически весь стандартный
домена VI. У разных вирусов эти два AUG&кодо&
для канонической схемы инициации трансля&
на могут находиться как в одной, так и в разных
ции набор факторов, за исключением
рамках считывания.
eIF4E (табл. 2; [85]). Вместо связывания eIF4E с
Результаты экспериментов по мутагенезу по&
кэпом начало процессу даёт взаимодействие
казывают, что мотив Yn, криптический AUG&ко&
eIF4G с доменом V IRES&элемента, а дальше
дон и разделяющий их спейсер фиксированной
последовательность событий очень похожа на
длины образуют единый функциональный мо&
стандартную для эукариот: eIF4G связыва&
дуль Yn-Xm-AUG, который важен для эффек&
ет eIF3 и привлекает преинициаторный 43S&
тивной работы IRES&элемента и, по всей види&
комплекс, который затем узнаёт AUG&кодон в
мости, является местом посадки рибосо&
нижерасположенной области. Есть, однако, и
мы (см. статью Pilipenko et al. [81] и упомянутые
существенные отличия. Прежде всего, посадка
в ней более ранние работы). Тандем Yn-AUG
40S&субчастицы на мРНК происходит не с 5′&
характерен также и для других типов пикорна&
конца, а на внутренний участок (по&видимому, в
вирусных IRES&элементов, однако там он может
районе криптического AUG); возможно, какую&
не быть строго необходимым (см. ниже). Осо&
то роль в этом играет непосредственное срод&
бый интерес к этому элементу структуры связан
ство IRES&элемента к рибосоме [73]. Кроме то&
с тем, что он обусловливает нейровирулентность
го, для работы этих IRES&элементов требуются
вируса. Сконструированные мутанты высоко&
вспомогательные белки (IRES trans&acting fac&
нейровирулентного для мышей штамма полио&
tors, ITAF), не принимающие участия в канони&
вируса, у которых в состав тандема на место
ческой трансляции.
криптического AUG был перемещён основной
Как правило, в роли ITAF выступают кле&
инициаторный AUG743 в благоприятном контек&
точные РНК&связывающие белки, которые ли&
сте, проявляли высокую степень аттенуации
бо помогают связаться факторам инициации,
(уменьшения патогенности) в опытах на мышах.
либо просто участвуют в поддержании правиль&
При этом они в значительной степени сохраня&
ной пространственной структуры IRES&эле&
ли способность размножаться в культивируемых
мента, выполняя функцию РНК&шаперо&
клетках (в том числе нейрональной природы), а
нов [56, 60]. Несмотря на то что связывание с
их РНК проявляла высокую трансляционную
IRES&элементами типа I задокументировано
активность в бесклеточной системе из клеток
для десятков разных белков, лишь для очень не&
асцитной карциномы Кребс&2, тем самым ука&
большого числа этих взаимодействий чётко по&
зывая на наличие/отсутствие именно в клетках
казана функциональная значимость. В частнос&
центральной нервной системы особого фактора
ти, в реконструированной из очищенных ком&
или факторов, определяющих значимость моду&
понентов бесклеточной системе для сборки
ля Yn-Xm-AUG для биологии полиовируса [82].
48S&комплекса на IRES PV из восьми проана&
Интересно, что в вышедшей недавно работе
лизированных ITAF строго необходим оказался
Lulla et al. [83] было обнаружено, что AUG589 у
всего один, поли(rС)&связывающий бе&
ряда энтеровирусов не является «молчащим», а
лок PCBP2, взаимодействующий с нескольки&
может направлять синтез 65&членного пептида,
ми участками в домене IV (см. статью Sweeney
влияющего на ход инфекции в клетках кишеч&
et al. [85] и ссылки в ней), либо его пара&
ного эпителия. Возможно, некоторые из ранее
лог PCBP1. Эффективность образования комп&
описанных эффектов мутаций AUG586 на пато&
лекса несколько усиливалась ещё одним ITAF,
генность вируса связаны с нарушением синтеза
полипиримидин&связывающим белком PTB/
этого пептида.
PTBP1, классическим РНК&шапероном, спосо&
Ещё одна интрига заключается в малопонят&
бствующим привлечению фактора eIF4G [87].
ном механизме попадания рибосомы с участ&
Другие ITAF, такие как GARS [88], La/SSB [89]
ка Yn-Xm-AUG на основной стартовый ко&
или UNR/CSDE1 [90], несмотря на специфич&
дон AUG743. Данные по мутагенезу области меж&
ное связывание с участками IRES&элемента и на
ду этими кодонами, введению стабильных шпи&
стимуляцию его работы в других in vitro систе&
БИОХИМИЯ том 86 вып. 9 2021
ИНИЦИАЦИЯ ТРАНСЛЯЦИИ ВИРУСНЫХ мРНК
1285
мах, в этом эксперименте на сборку 48S&комп&
кой работе, выполненной группой Э. Виммера в
лекса не повлияли [85].
1988 г. [61]. В качестве классических представи&
Тем не менее, по&видимому, именно набор
телей этого типа принято рассматривать струк&
ITAF и их взаимодействие с отдельными струк&
туры в 5′&НТО двух пикорнавирусов: вируса эн&
турными участками РНК определяет тканеспе&
цефаломиокардита (encephalomyocarditis virus,
цифичность, присущую активности IRES&эле&
EMCV, из рода кардиовирусов, Cardiovirus) и
ментов типа I in vivo. Эта черта важна для вирус&
ящура (foot&and&mouth disease virus, FMDV, из
ного патогенеза. Так, эффекты аттенуирующих
рода афтовирусов, Aphthovirus). IRES&элементы
мутаций во внутреннем районе 5′&НТО штам&
EMCV и FMDV имеют практически одинаковую
мов живой противополиомиелитной вакцины
длину (около 450 нт) и очень схожую доменную
Сэбина, снижающих аффинность к факторам
организацию (домены II-V/VI или, по другой
инициации трансляции [71, 91], значительно
номенклатуре, домены H-K/L [98]; рис. 2, б),
сильнее выражены в нервных клетках, чем в
однако отличаются расположением стартовых
клетках другой природы [92-94]. Это различие,
кодонов. Кроме того, некоторые аспекты био&
имеющее прямое отношение к патогенезу полио&
логии IRES&элементов этого типа были подроб&
миелита, очевидно, объясняется межклеточны&
но изучены на примере ещё одного кардиовиру&
ми вариациями в концентрации или наборе
са - вируса мышиного энцефаломиелита Тейле&
ITAF, или трансляционных факторов.
ра (Theiler′s murine encephalomyelitis virus,
Ещё один немаловажный аспект патогенеза
TMEV).
связан с механизмами, с помощью которых ви&
Как и представители предыдущей группы,
русы этой группы обеспечивают трансляцион&
IRES&элементы типа II содержат высокоаффин&
ный приоритет своим мРНК. На ранних стадиях
ный сайт связывания eIF4G, расположенный в
инфекции энтеровирусная протеаза 2A расщеп&
домене IV (J&K) [99]. Такой способ привлечения
ляет фактор eIF4G, отрезая от него сайт связы&
eIF4G делает трансляцию независимой от 5′&кэ&
вания eIF4E, что влечёт за собой подавление
па и eIF4E. Однако важно понимать, что само
трансляции клеточных мРНК (см. обзоры [56,
по себе привлечение инициаторных факторов
80]). Кроме того, деградации подвергает&
не является достаточным условием для внутрен&
ся PABP, однако в этом случае полноразмерный
ней инициации. Так, при введении одного толь&
белок окончательно исчезает лишь к моменту,
ко домена J&K в 5′&НТО или 3′&НТО репортёр&
когда необходимо переключить трансляцию ви&
ной мРНК её трансляция практически пол&
русной РНК на репликацию (мРНК пикорнави&
ностью перестаёт зависеть от кэпа, но посадка
русов полиаденилированы и используют PABP
рибосомы на неё по&прежнему может происхо&
для стимуляции трансляции [95]). Также на
дить исключительно с 5′&конца [100]. На этом
поздних стадиях инфекции протеаза 3С разру&
примере наглядно видно, что пикорнавирусный
шает PTB и PCBP2, что подавляет активность
IRES имеет модульную структуру, в которой до&
IRES&элемента, и разрезает фактор eIF5B (хотя
мен J&K может рассматриваться как своеобраз&
получающийся в результате протеолиза фраг&
ный CITE (см. ниже), а для укладки мРНК в ка&
мент длиннее тех, что успешно работают in vitro
нал необходимы другие домены.
в реакциях сборки 80S&комплексов, поэтому
Посадка рибосомы происходит, как и в слу&
физиологическая роль протеолиза eIF5B неяс&
чае PV, с 3′&стороны от IRES&элемента. При
на) [80].
этом AUG консервативного модуля Yn-Xm-
В процессе репликации РНК&содержащих
AUG, расположенного на его границе, в данном
вирусов, к которым принадлежит и полиовирус,
случае обычно выступает в качестве инициатор&
синтезируется двуцепочечная РНК, что активи&
ного кодона, а целостность тандема Yn-AUG не
рует протеинкиназу R (PKR/EIF2AK2). След&
критична для общей активности IRES&элемен&
ствием является фосфорилирование eIF2α, но
та, хотя и важна для нейровирулентности виру&
при этом трансляция вирусной мРНК продол&
са (см. ниже). Анализ влияния вставок и деле&
жается [96]. Одно из возможных объяснений
ций, вносимых в эту область у IRES TMEV, поз&
заключается в том, что специфичная к eIF2α
волил сформулировать концепцию «стартового
субъединица фосфатазы PP1, CReP/PPP1R15B,
окна» (starting window; [101]). Согласно ей, IRES
способна удерживать активный eIF2α на мемб&
помещает инициаторный 43S&комплекс на оп&
ране эндоплазматического ретикулума, где и
ределённый участок мРНК, после чего он может
происходит трансляция вирусных мРНК. Это
либо узнать AUG&кодон внутри этого участка,
физически ограждает трансляционные комп&
либо, при отсутствии там AUG, начать сканиро&
лексы от инактивирующих киназ [97].
вание и выбрать точку старта дальше. Правила
Классические IRES/элементы типа II. IRES&
выбора инициаторного кодона внутри стартово&
элементы этого типа были открыты в пионерс&
го окна не совсем соответствуют таковым при
БИОХИМИЯ том 86 вып. 9 2021
1286
СОРОКИН и др.
стандартном сканировании: с одной стороны,
здесь заслуживают ITAF, которые в ряде случаев
нуклеотидный контекст играет здесь ту же роль,
определяют биологию вирусов - в частности, их
с другой - вероятность узнавания AUG от 5′&
способность синтезировать белки и размно&
концевой границы к 3′&концевой сильно увели&
жаться в тех или иных типах клеток, а также
чивается, а затем выходит на плато [101]. Эта
нейровирулентность in vivo. Так, все три упоми&
разница наглядно видна при сравнении распре&
навшихся выше IRES&элемента (из EMCV,
деления 48S&комплексов между AUG&кодонами
TMEV и FMDV) требуют для сборки инициа&
в инициаторной области EMCV в двух случаях:
торного 48S&комплекса PTB, но FMDV нужен
когда трансляция направляется IRES&элемен&
ещё и дополнительный ITAF, белок Mpp1/
том и когда большая часть IRES&элемента удале&
ITAF45/PA2G4 [105, 106]. PA2G4 связан с кле&
на, а рибосомы садятся с 5′&конца [8, 102]. В пер&
точным циклом и есть только в пролиферирую&
вом из них комплексы в основном формируются
щих клетках, а в нейронах отсутствует - вероят&
на AUG834 (11&м по счёту), который и является
но, поэтому замена IRES&элемента нейровиру&
основным стартовым кодоном полипротеи&
лентного штамма GDVII вируса TMEV на IRES
на EMCV, а расположенный перед ним AUG826,
FMDV приводит к полной потере им способнос&
несмотря на хороший контекст, почти не узнаёт&
ти размножаться в нервных клетках [105].
ся рибосомой, т.к. находится, по&видимому, на
Интересны случаи взаимосвязи мутаций в
самой границе стартового окна. Если же рибосо&
участках узнавания ITAF с потерей нейровиру&
мы попадают на эту же область путём кэп&зави&
лентности без утраты вирусом способности
симой инициации, то наблюдается обратное
размножаться и синтезировать белки в клетках
распределение в полном соответствии с пред&
других типов. Например, у TMEV разрушение
сказанием сканирующей модели. Уместно отме&
тандема Yn-AUG путём изменения критическо&
тить, что сходные правила характерны и для
го расстояния между его полипиримидиновым
классической 5′&конец&зависимой инициации
блоком (который, вероятно, служит одним из
трансляции в случае AUG&кодонов, находящих&
сайтов связывания PTB [107]) и AUG не оказы&
ся вблизи самого 5′&конца - это сходство, веро&
вает существенного влияния на его репродук&
ятно, обусловлено общими для этих двух случа&
цию в культуре клеток ВНК&21 и бесклеточную
ев особенностями, возникающими при укладке
трансляцию [101], но резко снижает нейровиру&
мРНК в канал 40S&субчастицы. Аналогия усили&
лентность для мышей [108]. Известны и другие
вается тем, что 48S&комплексы на AUG826 EMCV
подобные примеры (см. обсуждение в ранее
можно увидеть в реконструированной трансля&
опубликованных работах [105, 109]). Механизм
ционной системе при отсутствии фактора eIF1 -
такой взаимосвязи удалось установить при изу&
в тех же условиях, в которых удаётся увидеть
чении зависимости нейровирулентности TMEV
комплексы на AUG, расположенных вблизи 5′&
от взаимодействия IRES&элемента с разными
конца, на кэп&зависимых мРНК [103].
формами PTB. Клетки центральной нервной
В инициаторной области мРНК EMCV есть
системы (в частности, нейроны) содержат мало
ещё один AUG, 12&й по счёту (AUG846), который
белка PTBP1, но зато продуцируют его нейрон&
находится в одной рамке с AUG834. В некоторых
специфичный паралог - nPTB/PTBP2. Обе фор&
условиях на него может происходить описанное
мы PTB связываются с одними и теми же участ&
выше соскальзывание 43S&комплекса [8], но в
ками IRES TMEV и проявляют сравнимую спо&
норме он не является инициаторным. А вот
собность стимулировать трансляцию. Однако
FMDV имеет два функциональных стартовых
некоторые мутации в PTB&связывающих моти&
кодона (также находящихся в одной рамке), раз&
вах снижают сродство IRES к nPTB существен&
делённых протяжённым спейсером длиной
но сильнее, чем к «обычному» PTB. Эти мута&
84 нт и дающих начало двум изоформам лидер&
ции значительно понижают нейровирулент&
ной (L) протеазы, при этом второй AUG ис&
ность вируса, не оказывая существенного влия&
пользуется чаще [80]. По всей видимости, пре&
ния на трансляционную активность и его раз&
инициаторный комплекс собирается на
множение в других клетках [109].
IRES FMDV в окрестностях первого AUG, пос&
Функциональные свойства цис&элементов
ле чего либо происходит его узнавание, либо
5′&НТО IRES&зависимых вирусов влияют также
eIF1&зависимое сканирование и узнавание вто&
и на характер клинических симптомов вызывае&
рого (см. статью Andreev et al. [104] и ссыл&
мых ими болезней. Сконструированные мутан&
ки в ней).
ты TMEV могут вызывать или летальную тет&
Требования к каноническим факторам ини&
раплегию, или лишь лёгкие неврологические
циации у IRES&элементов типа II в бесклеточ&
нарушения в зависимости от контекста AUG&
ной системе в основном такие же, как и у PV&
кодона, входящего в состав стартового ок&
подобных [105, 106]. Однако особого внимания
на [110]. Эти примеры иллюстрируют, как осо&
БИОХИМИЯ том 86 вып. 9 2021
ИНИЦИАЦИЯ ТРАНСЛЯЦИИ ВИРУСНЫХ мРНК
1287
бенности неканонических механизмов инициа&
роны, обращённой в раствор, взаимодействуя
ции трансляции вирусных РНК, обусловленные
как с рибосомными белками, так и с рРНК, а до&
структурой соответствующих цис&элементов и
мен II располагается в районе E&сайта (см. ранее
разнообразием взаимодействующих с ними кле&
опубликованные статьи [117-120] и ссылки в
точных факторов, углубляют понимание патоге&
них). Помимо 40S&субчастицы, IRES HCV спо&
неза вирусных заболеваний.
собен связывать и фактор eIF3 [121], хотя ста&
Патогенез пикорнавирусов с IRES&элемента&
бильность комплекса РНК•40S (Kd = 1,9 нM)
ми типа II связан, конечно же, и с применяемы&
гораздо выше, чем комплекса РНК•eIF3
ми ими механизмами подавления клеточной
(Kd = 35 нM) [74]. Ранние эксперименты in vitro
трансляции. Так, вирус ящура кодирует две про&
показали, что для инициации на мРНК HCV
теазы, способные расщеплять eIF4G: 3C и L [80].
принципиально необходимы лишь факторы
EMCV не кодирует протеаз, способных разрезать
eIF2 и eIF3 [116]. eIF1A помогает стабилизиро&
этот фактор, однако при заражении в клетке ак&
вать Met&тРНКi в P&сайте [122]. Дополнитель&
тивируется белок&репрессор 4E&BP1 [111], что
ные белки (ITAF) не являются обязательными,
приводит к ингибированию кэп&зависимой
хотя некоторые из них, возможно, способны
трансляции и даёт приоритет вирусной мРНК.
усиливать трансляцию, направляемую IRES&
В связи с описанными стратегиями репрес&
элементом HCV [123]. В недавней работе пока&
сии eIF4F уместно упомянуть ещё одну разно&
зана важная роль модифицированных нуклео&
видность пикорнавирусных IRES&элементов,
тидов (m6A), а также m6A&связывающего белка
обнаруженную в
5′&НТО вируса гепати&
YTHDC2 в активности IRES&элемента HCV [124].
та А (hepatitis A virus, HAV). Несмотря на явное
Позднее классический eIF2&зависимый путь
сходство с пикорнавирусными IRES&элемента&
оказался не единственным вариантом доставки
ми типа II, IRES HAV долгое время относили к
Met&тРНКi. Выяснилось, что трансляция, нап&
отдельной группе, поскольку он требует для сво&
равляемая IRES HCV, может идти и при недос&
ей работы полнокомпонентный фактор eIF4F,
тупности функционального eIF2 (при его фос&
включающий и eIF4E, и интактный eIF4G [112].
форилировании в условиях клеточного стресса
Кроме того, его домен V, связывающий eIF4G,
или при добавлении специфичных ингибито&
отличается по первичной структуре от J&K&до&
ров) [125, 126]. In vitro было показано, что дос&
мена EMCV и FMDV. Однако последующие ис&
тавка Met&тРНКi в 48S&комплекс на HCV&по&
следования показали, что пространственные
добных IRES&элементах возможна c помощью
структуры этих доменов похожи [113]. Что же
eIF5B, ортолога бактериального IF2 [126, 127],
касается зависимости от eIF4E - оказалось, что
что затем подтвердили структурные исследова&
и в случае других пикорнавирусных IRES&эле&
ния [128]. В системе сборки из очищенных ком&
ментов eIF4E положительно влияет на аффин&
понентов функциональный инициаторный
ность eIF4G и хеликазную активность eIF4A
комплекс на IRES HCV может быть сформиро&
[114], так что специфика HAV IRES оказалась,
ван также с помощью факторов 40S&рециклин&
скорее, в степени этой зависимости. В любом
га и реинициации: eIF2D или димера
случае протеолиз eIF4G не является необходи&
MCTS1•DENR [22, 129, 130]. Однако нокаут ге&
мым для функционирования IRES&элементов
на EIF2D не приводит к потере eIF2&независи&
типов I и II: в начале инфекции вирусные проте&
мости IRES HCV [122, 131], что может говорить
азы ещё не синтезированы, поэтому для привле&
о том, что этот фактор, скорее всего, не участву&
чения рибосом используется интактный eIF4F.
ет в инициации трансляции мРНК HCV в жи&
Классические IRES/элементы типа III. Данная
вых клетках (хотя для более корректного экспе&
группа представлена в мРНК нескольких се&
римента следовало бы одновременно удалить
мейств вирусов: Flaviridae, Picornaviridae и, воз&
eIF2D и один из компонентов димера
можно, отдельных представителей Dicistroviri&
MCTS1•DENR, т.к. эти факторы взаимозаме&
dae. Механизм работы этого типа элементов луч&
няемы [22, 132]). В работе Kim et al. [133] актив&
ше всего изучен для IRES из 5′&НТО вируса гепа&
ность по доставке Met&тРНКi при инициации
тита C (hepatitis C virus, HCV) из семейства
трансляции HCV была также приписана факто&
флавивирусов (рис. 2, в) [115]. Инициация на 5′&
ру eIF2A, хотя в прямом эксперименте по сбор&
НТО HCV длиной ~330 нт в отличие от вышеопи&
ке инициаторного комплекса он не был акти&
санных механизмов не включает стадию скани&
вен [129], а нокаут его гена не приводил к поте&
рования. IRES связывает 40S&субчастицу рибосо&
ре устойчивости к инактивации eIF2 [122, 131].
мы напрямую [116], при этом AUG&кодон оказы&
Более того, преинициаторный комплекс с Met&
вается в непосредственной близости от Р&сайта
тРНКi на некоторых IRES&элементах этого типа
малой субчастицы рибосомы. Более крупный
можно получить и без участия трансляционных
домен III связывается с 40S&субчастицей со сто&
факторов, что описано для IRES обезьяньего
БИОХИМИЯ том 86 вып. 9 2021
1288
СОРОКИН и др.
пикорнавируса 9 (simian picornavirus type 9,
ствуют IRES&элементы, не требующие для рабо&
SPV9) [134]. На IRES HCV такой комплекс уда&
ты ни факторов инициации, ни вспомогатель&
лось получить только при нефизиологически
ных белков, таких как ITAF, ни даже инициатор&
высокой концентрации Mg2+ [135], но этот путь,
ной Met&тРНКi [138]. Направляемая ими транс&
по&видимому, крайне неэффективен [126].
ляция начинается не с метионина [138, 139]. По&
Изначально предполагалось, что положение
добные IRES&элементы отличаются малой дли&
eIF3 в инициаторном комплексе на IRES ти&
ной (~200 нт) и найдены пока только у предста&
па III совпадает с положением eIF3 в аналогич&
вителей семейства Dicistroviridae, где они распо&
ных комплексах, образуемых в процессе кэп&за&
лагаются в межцистронном участке (intergenic
висимой трансляции. Однако структурные ис&
region, IGR) гРНК [56]. Независимость от фак&
следования показали, что сайты связывания
торов инициации и взаимодействие с высоко&
IRES и eIF3 на поверхности 40S&субчастицы пе&
консервативной межсубъединичной областью
рекрываются. Это предполагает иную ориента&
рибосом позволяет этим IRES&элементам ини&
цию eIF3 в инициаторных комплексах, образо&
циировать трансляцию в гетерологичных систе&
ванных на HCV&подобных IRES&элементах.
мах - например, клетках (и их экстрактах) мле&
Так, в комплексе 40S, eIF2, eIF3 и DHX29 c
копитающих, насекомых, растений, простей&
IRES CSFV, лишённым домена II, белок eIF3
ших, дрожжей и даже бактерий [58] - что совер&
вообще не образует контактов с 40S&субчасти&
шенно не характерно, например, для IRES&эле&
цей [120]. На этом основании было высказано
ментов типов I, II и III.
предположение, что основным предназначени&
На данный момент известны три подгруппы
ем связывания eIF3 IRES&элементами этого ти&
IRES&элементов типа IV. Классическим пред&
па является конкурентное ингибирование кле&
ставителем подтипа IVa, как и всего типа в це&
точной трансляции. Так ли это на самом деле,
лом, является IRES из IGR вируса паралича
должны показать дополнительные эксперимен&
сверчка (cricket paralysis virus, CrPV), отвечаю&
ты. Отметим, однако, что лишённые домена II
щий за трансляцию второго цистрона его гРНК
IRES&элементы HCV и CSFV не способны обра&
(рис. 2, г). Три домена этого IRES&элемента, со&
зовывать 80S&комплекс [127, 136], а eIF5B&зави&
держащие псевдоузлы (см. статью Pfingsten et al.
симый механизм доставки инициаторной тРНК
[140] и ссылки в ней), напрямую связывают ри&
требует участия eIF3 [126, 127].
босому и функционально подменяют тРНК и
Интересен процесс захвата
(«угона»,
трансляционные факторы [138, 141, 142], что
англ. hijack) транслирующей рибосомы IRES&
позволяет собирать готовую к элонгации 80S&
элементами этого типа. Методами спектроско&
рибосому, минуя классические стадии инициа&
пии одиночных молекул и криоэлектронной
ции. Детали этого механизма были выяснены с
микроскопии показано, что IRES HCV спосо&
помощью криоэлектронной микроскопии: до&
бен связывать рибосому, транслирующую дру&
мен 3 IRES CrPV и подобных ему вирусов связы&
гую мРНК или ту же мРНК, в которой он нахо&
вается с А&сайтом рибосомы, при этом входя&
дится. IRES прочно связывается с платформой
щий в его состав псевдоузел I (PKI) мимикриру&
40S&субчастицы и, предположительно, остаётся
ет под тРНК, находящуюся в кодон&антикодо&
в таком состоянии до момента терминации.
новом взаимодействии с мРНК [141, 143].
После высвобождения синтезированного пеп&
В процессе псевдотранслокации под действием
тида и разборки рибосомы домен II IRES&эле&
фактора элонгации eEF2 домен 3 перемещается
мента укладывается в Е&сайт, направляя РНК
в P&cайт, освобождая А&сайт для eEF1A&зависи&
HCV в мРНК&связывающий канал [137]. Такой
мой посадки Ala&тРНКAla (GCU - первый коди&
способ «резервирования» рибосомы, вероятно,
рующий кодон второго цистрона CrPV) [75, 141,
помогает вирусной РНК получить трансляцион&
144, 145]. Синтез полипептидной цепи начина&
ный приоритет в заражённой клетке.
ется после следующего (второго) акта трансло&
HCV&подобные IRES&элементы, помимо
кации, т.е. сразу со стадии элонгации - благода&
Flaviviridae, встречаются ещё и в некоторых
ря чему первым аминокислотным остатком в
группах Picornaviridae (подробнее см. в обзоре
белке становится аланин [138]. Методом FRET
Arhab et al. [59]), что подтверждает существова&
показано, что IRES CrPV способен связываться
ние горизонтального переноса не только генов,
как со свободной 40S&субчастицей, так и с пол&
но и отдельных регуляторных элементов вирус&
ностью собранной 80S&рибосомой [75].
ных мРНК.
Подтип IVb представлен IGR IRES&элемен&
Классические IRES/элементы типа IV. Выше&
тами вирусов синдрома Тауры (Taura syndrome
перечисленные типы IRES требуют участия хотя
virus, TSV), красного огненного муравья
бы некоторых факторов инициации для обеспе&
(Solenopsis invicta virus 1, SINV&1) и паралича ме&
чения внутренней посадки рибосомы. Но суще&
довой пчелы (honey bee paralysis virus, HBPV).
БИОХИМИЯ том 86 вып. 9 2021
ИНИЦИАЦИЯ ТРАНСЛЯЦИИ ВИРУСНЫХ мРНК
1289
От IRES&элементов подтипа IVa их отличает на&
ные неструктурированные последовательности
личие дополнительной шпилечной структу&
обычно обогащены остатками уридина или аде&
ры (SLIII) в домене 3, роль которой до конца не
нина, как в случае 5′&концевых IRES&элементов
ясна. Удаление этой шпильки хотя и не препят&
вируса черёмуховой тли (Rhopalosyphum padi
ствует связыванию с 80S&рибосомой или транс&
virus, RhPV) и HalV соответственно. Для образо&
локационной активности eEF2, но делает про&
вания инициаторного комплекса строго необхо&
дуктивную трансляцию невозможной [76, 146].
димы лишь eIF2, eIF3 и сама 40S&субчастица,
Структурные исследования показывают, что
однако для нахождения стартового кодона пу&
SLIII принимает участие в имитации тРНК и
тём ограниченного сканирования нужен также
взаимодействует с 28S рРНК [143]. По всей ви&
eIF1, а eIF1A и факторы группы eIF4 сильно
димости, SLIII необходима для корректного по&
стимулируют сборку [150, 151]. Из&за того, что в
зиционирования IRES&элемента на рибосоме,
этом механизме не используется специфичное
но, возможно, как&то влияет и на транслока&
связывание мРНК с компонентами трансляци&
цию [76, 143].
онного аппарата, 5′&концевой IRES RhPV обес&
Особенности недавно охарактеризованного
печивает инициацию трансляции в любых эука&
механизма инициации на IGR IRES вируса
риотических системах, от дрожжей до млекопи&
Halastavi árva (HalV), выделенного из содержи&
тающих.
мого кишечника пресноводного карпа, позво&
В то же время 5′&концевой IRES другого
лили отнести его к отдельному подтипу IVc.
представителя Dicisroviridae, уже упоминавше&
Главным его отличием от CrPV является неспо&
гося вируса CrPV, имеет, по&видимому, отдалён&
собность связываться со свободной 40S&субчас&
ное функциональное сходство с IRES HCV, не&
тицей из&за отсутствия функционального доме&
смотря на различие их структур. Он специфично
на 2. IRES HalV связывает 80S&рибосому при
связывает фактор eIF3, причём в данном случае
помощи домена 1, взаимодействующего с 60S&
это взаимодействие строго необходимо для по&
субчастицей, в то время как домен 3 связывает&
садки
40S&субчастицы
[152,
153]. Как и
ся с 40S&субчастицей сразу в P&, а не в А&сайте.
IRES HCV, 5′&концевой IRES CrPV взаимодей&
Как следствие, инициация на IRES HalV не тре&
ствует с «факультативным» рибосомным бел&
бует eEF2&зависимой псевдотранслокации, что
ком RACK1, что объясняет обнаруженную ранее
делает его простейшим из всех известных на
зависимость трансляции первого, но не второго
данный момент механизмов инициации транс&
цистрона CrPV от этого белка [154]. Тем не ме&
ляции [147].
нее детальный структурно&функциональный
Помимо трансляции рамки, кодирующей
анализ реконструированного комплекса этого
белки оболочки, некоторые IGR IRES способны
IRES&элемента с очищенными 40S и eIF3 вы&
также направлять трансляцию альтернатив&
явил ряд уникальных черт [152]. Три его домена
ных (+1 и +2) рамок считывания. Механизм и
охватывают «голову» 40S&субчастицы, взаимо&
физиологическое значение этого процесса пока
действуя с белками и рРНК, а одноцепочечная
поняты не до конца (см. обсуждение в рабо&
область, следующая за доменом III, оказывается
тах [148, 149]). Вторая интересная черта, свой&
уложенной в мРНК&канал. Добавление Met&
ственная лишь некоторым из упомянутых групп
тРНКi и либо eIF2, либо eIF5B приводит к обра&
вирусов, - очень стабильная шпилька (SLVI)
зованию преинициаторного комплекса, в кото&
длиной 14-18 п.н. на конце первого цистрона,
ром в P&сайте находится не стартовый кодон
непосредственно перед началом IRES&элемен&
AUG709, а предшествующий ему uAUG701. Чтобы
та. Вероятно, эта шпилька помогает регулиро&
комплекс собрался именно на стартовом
вать поток рибосом «на подходе» к IRES&эле&
AUG709, необходимы дополнительные факто&
менту, препятствуя его разворачиванию [149].
ры - eIF1 и eIF1A, причём в этом случае eIF2
Химерные и неклассифицированные IRES/
уже не может быть заменён на eIF5B [152]. Это
элементы. Говоря о Dicisroviridae, необходимо
подразумевает локальное сканирование иници&
отметить, что мРНК этих вирусов модифициро&
аторной области, напоминающее таковое у вы&
ваны VPg, поэтому трансляция их первого цис&
шеописанного IRES EMCV. Интересно, что
трона также не может быть кэп&зависимой. Она
uAUG701 открывает микрорамку AUGUGA, по&
направляется IRES&элементами, при этом раз&
этому при реальной трансляции нельзя исклю&
ные вирусы этого семейства используют различ&
чить попадания рибосомы на стартовый кодон
ные стратегии для привлечения рибосом. Пер&
AUG709 также и в результате реинициации.
вая заключается в том, что 5′&НТО содержит
Ещё одной группой IRES&элементов, не по&
протяжённые одноцепочечные участки, способ&
падающих в приведённую нами классифика&
ные «неспецифично» связывать 40S&субчастицу
цию, являются обнаруженные у некоторых пи&
в присутствии фактора eIF3 [150, 151]. Подоб&
корнавирусов
«химерные» IRES&элементы.
БИОХИМИЯ том 86 вып. 9 2021
1290
СОРОКИН и др.
По доменной организации они сходны с типа&
гивая синтез gag и трансляцию репортёрных
ми I и II, однако одни домены в их составе боль&
мРНК с пикорнавирусными IRES, в других -
ше похожи на соответствующие участки IRES&
отрицательно действовало на любые мРНК
элементов типа I, а другие - на домены элемен&
(включая репортёры с лидером HIV&1 и пикор&
тов типа II
[59]. Среди представителей
навирусными IRES), кроме тех, которые содер&
Flaviviridae также есть вирусы, несущие IRES&
жали IRES HCV [157-159]. Пикорнавирусные
элементы пикорнавирусного типа с плохо оха&
же протеазы подавляют трансляцию мРНК
рактеризованной структурой [59].
HIV&1, что контрастирует с их эффектом на
В силу слабой изученности не подлежит по&
классическую IRES&зависимую инициацию.
ка однозначной классификации IRES, обнару&
Тем не менее в ряде работ были сделаны по&
женный в вирусе мозаики пшеницы (triticum
пытки показать наличие в несплайсированной
mosaic virus, TriMV). Некэпированная мРНК
мРНК HIV&1 IRES&элемента [161-163]. К сожа&
этого вируса имеет необычно большую для рас&
лению, в большинстве из них авторы использо&
тительных вирусов 5′&НТО (739 нт), содержа&
вали бицистронные плазмиды и RRL, а основ&
щую 12 uAUG, что исключает эффективную
ным подходом было сравнение разных бицист&
инициацию трансляции с использованием ска&
ронных конструкций между собой. В един&
нирующего механизма. И действительно, поме&
ственной на сегодняшний день работе, где при&
щение стабильной шпильки на 5′&конец вирус&
меняли мРНК&трансфекцию клеток, никакого
ной мРНК не приводит к подавлению трансля&
значимого вклада внутренней инициации в
ции. Механизм работы этого IRES&элемента
трансляцию, направляемую 5′&НТО HIV&1, об&
изучен недостаточно, но известно, что он связы&
наружено не было [164]. Такой же результат был
вает eIF4G [155]. Это, как и наличие важной для
получен и в бесклеточных системах на основе
трансляции полипиримидиновой последова&
лизатов культивируемых клеток. Выяснилось,
тельности перед инициаторным кодоном, воз&
что шпилечная структура TAR, очень сильно по&
можно, роднит его с пикорнавирусными IRES&
давляющая трансляцию в RRL [165], слабо вли&
элементами типов I и II [156], однако утверж&
яет на неё в живых клетках [164]. Введение же
дать это наверняка пока нельзя.
uAUG в 5′&НТО HIV&1 значительно подавляло
Случаи, требующие дополнительного изуче/
трансляцию вирусной мРНК, что лучше сочета&
ния. В силу большой социальной значимости
ется с кэп&зависимым сканированием, чем с
вируса иммунодефицита человека 1 (human
внутренней инициацией [164, 166]. В то же вре&
immunodeficiency virus type 1, HIV&1) исследова&
мя нельзя исключать, что в трансляции мРНК
нию трансляции его мРНК посвящено множе&
HIV&1, помимо канонических факторов иници&
ство работ. мРНК HIV&1, синтезируемые кле&
ации, задействованы какие&то вспомогательные
точной РНК&полимеразой II с провирусной
белки, облегчающие сканирование структури&
ДНК, кэпированы и полиаденилированы. Аль&
рованного лидера - например, РНК&хеликазы
тернативный сплайсинг приводит к образова&
RHA/DDX9 и DDX3, компонент ядерного кэп&
нию нескольких транскриптов, кодирующих
связывающего комплекса CBP80/NCBP1 или
различные вирусные белки, а несплайсирован&
вирусный белок Tat (см. обсуждение в статье
ная (она же геномная) РНК кодирует gag&pol. Её
Smirnova et al. [164]).
5′&НТО имеет длину 335 нт и содержит ряд эле&
Ещё более экстравагантная гипотеза предпо&
ментов вторичной структуры, необходимых для
лагает наличие IRES&элемента внутри кодирую&
репликации вируса, и стабильную шпильку, на&
щих последовательностей gag HIV&1 и HIV&
зываемую TAR, расположенную на самом 5′&
2 [167-169]. Сама возможность существования
конце гРНК. Считается, что такие шпильки эф&
IRES&элемента целиком в кодирующей части,
фективно ингибируют
5′&конец&зависимую
где его структура будет постоянно нарушаться
инициацию трансляции. С другой стороны, на&
транслирующими рибосомами, представляется
личие 5′&кэпа и отсутствие uAUG&кодонов в 5′&
несколько сомнительной, и аргументы в пользу
НТО говорят, скорее, в пользу стандартного ме&
его присутствия там также нельзя назвать убеди&
ханизма инициации трансляции этой мРНК.
тельными. Для его изучения авторы использова&
Подобно пикорнавирусам, HIV&1 кодирует про&
ли безлидерную мРНК - то есть мРНК, вообще
теазу, которая способна разрезать eIF4G (а так&
не имеющую 5′&НТО [167-169]. Это исключало
же PABP) [157-160]. Однако она действует лишь
какое&либо влияние природной
5′&НТО на
на один из паралогов eIF4G - eIF4GI/eIF4G1,
трансляцию. При этом авторы исходили из
не затрагивая второй, eIF4GII/eIF4G3 [158,
предпосылки, что безлидерная мРНК не может
159]. Данные об эффектах этого разрезания про&
эффективно инициировать трансляцию по 5′&
тиворечивы: в одних работах оно подавляло
конец&зависимому механизму. Однако это
трансляцию только клеточных мРНК, не затра&
предположение расходится с фактами: такие
БИОХИМИЯ том 86 вып. 9 2021
ИНИЦИАЦИЯ ТРАНСЛЯЦИИ ВИРУСНЫХ мРНК
1291
мРНК в эукариотических системах могут ис&
и клетках млекопитающих [176]. С другой сто&
пользовать до четырёх разных способов иници&
роны, как и все тобамовирусы, crTMV кодирует
ации трансляции, включая классичес&
отдельную моноцистронную сгРНК СР, из&за
кий [170, 171]. Ещё один аргумент авторов сос&
чего вклад трансляции бицистронной мРНК в
тоит в том, что инициация на 5′&концевом
общий синтез СР составляет около 3% [177].
AUG&кодоне безлидерной мРНК с гипотети&
Схожая оценка вклада внутренней инициации
ческим IRES&элементом в кодирующей части
была сделана и для неструктурированного
имеет иные требования к концентрациям фак&
IRES&элемента из вируса морщинистости тур&
торов инициации, чем трансляция с внутрен&
непса (turnip crinkle virus, TCV) [178]. Физиоло&
них AUG&кодонов [167]. Однако подобные раз&
гическую роль такого «запасного» механизма
личия описаны и для обычных кэп&зависимых
синтеза CP ещё предстоит выяснить.
мРНК, содержащих несколько стартовых кодо&
нов [14, 172]. Таким образом, несмотря на оби&
лие работ, изучавших инициацию трансляции
СТРУКТУРНЫЕ ЭЛЕМЕНТЫ В 3′/НТО
мРНК ретро& и лентивирусов [173], пока нельзя
ВИРУСНЫХ мРНК, ВОВЛЕЧЕННЫЕ
утверждать, что она происходит по какому&то
В ИНИЦИАЦИЮ ТРАНСЛЯЦИИ
необычному механизму.
Неканонический механизм инициации транс&
На первый взгляд, размещение энхансеров
ляции несомненно характерен для мРНК пред&
трансляции на 3′&конце мРНК, т.е. на макси&
ставителей семейства Flaviviridae: вирусов Зи&
мальном удалении от места, где происходит
ка (Zika virus, ZIKV), лихорадки Западного Ни&
инициация, кажется несколько странным. Од&
ла (West Nile virus, WNV), жёлтой лихорад&
нако необходимо помнить, что трансляция ви&
ки (yellow fever virus, YFV) и уже упоминавшего&
русной гРНК конкурирует с её репликацией.
ся DENV. Хотя эти мРНК кэпированы, их эф&
Размещение трансляционных энхансеров близ&
фективная трансляция продолжается и после
ко к 3′&концу гРНК является изящным решени&
инактивации eIF4E и eIF4G, а наличие функ&
ем этой проблемы: начиная синтез отрицатель&
ционального кэпа не является необходи&
ной цепи, РНК&зависимая РНК&полимера&
мым [25, 174, 175]. По одним данным, это свой&
за (RdRp) практически сразу «плавит» структуру
ство полностью определяется 5′&НТО вирусной
3′&концевых элементов, ингибируя трансляцию
мРНК [174, 175], по другим - требует взаимо&
и тем самым обеспечивая беспрепятственную
действия 5′& и 3′&НТО [25], однако описанная
репликацию генома. К примеру, было показано,
ранее шпилька cHP в кодирующей части для
что связывание RdRp с 3′&НТО гРНК TCV вы&
этого точно не требуется. Несмотря на то что в
зывает необратимую структурную перестройку
2006 г. у 5′&НТО мРНК DENV было показано
3′&концевого элемента, тем самым обеспечивая
отсутствие IRES&активности [25], две недавние
начало репликации и ингибируя встречную
работы [174, 175] оспаривают это утверждение.
трансляцию РНК [179].
С учётом вышеописанных сложностей в интер&
Кроме того, (+)РНК&вирусы в качестве мат&
претации результатов, полученных методом
риц для синтеза белков часто используют
бицистронных конструкций, разобраться в
сгРНК, которые преимущественно являются 3′&
этом вопросе помогли бы дополнительные ис&
концевыми фрагментами гРНК. В ряде случаев
следования. Тем не менее не вызывает сомне&
трансляция сгРНК регулируется теми же 3′&кон&
ний тот факт, что механизм инициации транс&
цевыми элементами, что и трансляция полно&
ляции этих вирусных мРНК является нестан&
размерной гРНК. Такая унификация позволяет
дартным.
вирусам реализовывать свойственную им стра&
Ещё одним недостаточно изученным случа&
тегию компактизации генома.
ем является полипуриновый IRES в сгРНК рас&
В отличие от вирусов животных, большин&
тительного вируса crTMV. Он направляет синтез
ство вирусов растений заинтересованы в выжи&
вирусного белка оболочки (CP), закодирован&
вании клетки&хозяина, т.к. это способствует их
ного во втором цистроне этой бицистронной
распространению в соседние клетки через плаз&
мРНК. Отсутствием стабильной вторичной
модесмы. Поэтому полное подавление синтеза
структуры он напоминает вышеописанные
клеточных белков путём высокоэффективной
IRES&элементы из 5′&НТО вирусов RhPV и HalV:
прямой конкуренции или путём разрушения
богатая остатками аденинов последователь&
части элементов клеточного аппарата трансля&
ность, по&видимому, формирует протяжённые
ции для них нехарактерно. Как правило, гРНК
одноцепочечные участки, которые способны
вирусов растений не являются более эффектив&
обеспечивать внутреннюю инициацию трансля&
ными матрицами по сравнению с клеточными
ции не только в растениях, но также и в дрожжах
РНК, но постоянно связанные с их 3′&концевы&
БИОХИМИЯ том 86 вып. 9 2021
1292
СОРОКИН и др.
ми структурными элементами ключевые факто&
модействия с eIF4F является субъединица
ры инициации и/или рибосомные субчастицы
eIF4E. Генетические, биохимические и струк&
могут обеспечить их оптимальную трансляци&
турные данные, полученные при изучении PTE,
онную активность, достаточную для размноже&
TED и ISS, показывают, что эти 3′&CITE взаи&
ния вируса и не зависящую от уровня трансля&
модействуют с кэп&связывающим карманом
ции клеточных мРНК.
eIF4E, при этом высокоподвижные остатки гуа&
3′/Концевые энхансеры трансляции (3′/CITE).
нина имитируют кэп. Отметим, что PTE связы&
Большинство (+)РНК&вирусов растений, 5′&кон&
вает eIF4E с высокой аффинностью, близкой к
цы гРНК которых не несут ни кэпа, ни VPg, со&
аффинности связывания полного eIF4F, в то
держат в своих 3′&НТО так называемые энхансе&
время как TED взаимодействует с eIF4E гораздо
ры кэп&независимой трансляции (cap&indepen&
слабее, чем с полным eIF4F (Kd для последнего
dent translation enhancers, 3′&CITE) - структур&
более чем на порядок ниже). Вероятно, во вто&
ные элементы, которые функционально заменя&
ром случае структурные перестройки eIF4E при
ют кэп&структуру, связывая факторы инициа&
взаимодействии с eIF4G увеличивают проч&
ции трансляции и/или субчастицы рибосом.
ность его связывания с 3′&CITE аналогично то&
Как правило, 3′&CITE формируют киссинг&взаи&
му, как это происходит при связывании с кэпи&
модействие со шпилькой на 5′&конце гРНК,
рованными мРНК.
своеобразно воспроизводя циркуляризацию
BTE - единственный из 3′&CITE, непосред&
клеточных мРНК, обычно обеспечиваемую взаи&
ственно связывающий eIF4G. eIF4F он связы&
модействием eIF4F с PABP.
вает примерно в 5 раз сильнее, что также может
Основываясь на сходстве вторичной струк&
говорить о конформационных перестройках
туры, различают 6 основных типов 3′&CITE, а
eIF4G, вызываемых взаимодействием с eIF4E.
именно: BTE (BYDV&like translation enhancer),
Анализ минимального фрагмента eIF4G, необ&
TED (translation enhancer domain), PTE (PMV&
ходимого для связывания 3′&CITE и для усиле&
like translational enhancer), ISS (I&shaped struc&
ния трансляции, показал, что он включает в се&
ture), YSS (Y&shaped structure) и TSS (T&shaped
бя сайты связывания eIF4A, eIF3 и РНК&связы&
structure) (рис. 3, а; табл. 2).
вающий домен, а участки, взаимодействующие
Все 3′&CITE, кроме TSS, связывают фактор
с eIF4E и PABP, не являются необходимыми
инициации eIF4F, используя при этом немного
[189].
разные механизмы. В случае PTE и TED, а так&
Возможно, способность 3′&CITE прочно свя&
же, вероятно, ISS и YSS основной точкой взаи& зывать (секвестировать) факторы инициации
Рис. 3. Основные способы усиления трансляции вирусных мРНК с помощью элементов, размещённых в 3′&НТО. а - 5 ос&
новных типов 3′&CITE и связывающиеся с ними трансляционные компоненты. б - Аминоацилированный 3′&TLS в комп&
лексе с eEF1A. в - 3′&CS ротавируса и компоненты, замыкающие мРНК в кольцо. Полные названия вирусов приведены
в тексте статьи, названия элементов - в табл. 2. аа - аминоацильный остаток
БИОХИМИЯ том 86 вып. 9 2021
ИНИЦИАЦИЯ ТРАНСЛЯЦИИ ВИРУСНЫХ мРНК
1293
Таблица 2. Типы 3′&концевых энхансеров кэп&независимой трансляции (3′&CITE) и их краткая характеристика
Тип 3′&CITE
Семейство (Род) вирусов
Взаимодействие с
Связывает
Kd, нМ
5′&концом гРНК
BTE
Luteoviridae (Luteovirus); Tombusviridae (Necrovirus,
Да
eIF4G
177 [180]
BYDV like
Dianthovirus, Umbravirus*)
(RCNMV?)**
eIF4F
37 [180]
Translation
Enhancer
TED
Не присвоено (Albetovirus); Tombusviridae
Да
eIF4F
17-30 [181]
Translation
(Carmovirus)
(STNV?)**
eIFiso4F
33-50 [181]
Enhancer
eIF4E
780 [181]; 313 [182]
Domain
eIF4isoE
660 [181]
PTE
Tombusviridae (Panicovirus, Carmovirus, Aureusvirus,
Да
eIF4E
58 [182]
PMV like
Umbravirus*)
(PEMV&2 нет)
eIF4F
48 [182]
Translation
Enhancer
ISS
Tombusviridae (Tombusvirus, Carmovirus, Aureusvirus)
Да
eIF4F
190 [183]
I&Shaped
Structure
YSS
Tombusviridae (Tombusvirus)
Да
eIF4F
[184]***
Y&Shaped
eIFiso4F
[184]***
Structure
TSS
Tombusviridae (Carmovirus, Umbravirus*)
Нет
60S
340 [185]; 233 [186]
T&Shaped
80S
450 [185]; 300 [187];
Structure
1720 [186]
kl/TSS
Tombusviridae (Umbravirus*)
Да
40S
360 [186]
kissing loop
60S
300 [186]
T&Shaped
80S
520 [186]; 610 [188]
Structure
* Принадлежность умбравирусов к семейству Tombusviridae условна: сходство с представителями этого семейства имеет
лишь одна из двух гРНК этих вирусов, но именно она содержит 3′&CITE.
** Для этих вирусов мутационный анализ не подтвердил предсказанного киссинг&взаимодействия 3′&CITE со шпилькой
на 5′&конце гРНК.
*** Связывание белков показано неравновесным методом.
четвертой группы используется вирусами не
ную субчастицу и 80S&рибосому, а в случае
только для стимуляции синтеза собственных
kl&TSS из гРНК&2 вируса деформирующей мо&
белков, но и для подавления кэп&зависимой
заики гороха 2 (pea enation mosaic virus 2,
трансляции клеточных мРНК. Было показано,
PEMV&2) - также и малую рибосомную субчас&
что фрагменты РНК, содержащие 3′&CITE раз&
тицу. Структурный анализ показал, что TSS
личных типов, являются эффективными инги&
формирует тРНК&подобную структуру, которая,
биторами трансляции как вирусных, так и кэпи&
однако, не может быть аминоацилирована, пос&
рованных репортёрных мРНК in vitro [190]. Кро&
кольку находится не на самом 3′&конце РНК.
ме того, при конкурентной трансляции в бес&
Тем не менее TSS может конкурировать с ами&
клеточной системе вирусной РНК, содержащей
ноацил&тРНК за посадку на рибосому, и пред&
3′&CITE PTE, и кэпированной матрицы только
варительные крио&ЭМ&данные подтвердили,
трансляция последней была существенно по&
что TSS TCV связывается в P&сайте 80S&рибосо&
давлена [191].
мы [192].
В отличие от 3′&CITE других типов, TSS не&
В одном из изолятов вируса некротической
посредственно связывает большую рибосом& пятнистости дыни (melon necrotic spot virus,
БИОХИМИЯ том 86 вып. 9 2021
1294
СОРОКИН и др.
MNSV) идентифицирован короткий (65 нт) эн&
той карликовости ячменя (barley yellow dwarf
хансер трансляции, который, вероятно, был по&
virus, BYDV) усиливается при добавлении eIF4F,
лучен в результате рекомбинации с 3′&НТО
eIF4A, eIF4B и ATP [200], что может означать
гРНК азиатского варианта вируса желтухи тык&
формирование преинициаторного комплекса на
венных (cucurbit aphid&borne yellows virus,
этом 3′&CITE. Однако превалирует всё же аль&
CABYV, изолят Xinjiang) из рода Polerovirus се&
тернативная точка зрения, что хеликазная ак&
мейства Luteoviridae [193]. Поскольку вторичная
тивность факторов инициации усиливает пря&
структура этого элемента - две соединённые ко&
мое связывание 40S с участком BTE, компле&
роткие шпильки - не похожа на структуру ни
ментарным 18S рРНК [189]. Недавно показано,
одного из известных 3′&CITE, его иногда выде&
что гРНК PEMV&2 с точечной мутацией, разру&
ляют в отдельный тип
- CXTE (CABYV&
шившей дальнее киссинг&взаимодействие и заб&
Xinjiang&like Translation Element). Механизм
локировавшей перенос компонентов инициа&
действия CXTE пока не изучен. Почти ничего не
ции с 3′& на 5′&конец, количественно связывала
известно ни о требованиях этого 3′&CITE к
40S&субчастицу в WGE [191]. гРНК с аналогич&
трансляционным факторам (кроме того, что он
ной мутацией и удалённым 3′&CITE PTE 40S&
остаётся активным в растениях с подавленной
субчастицу не связывала. Это прямое свидетель&
активностью eIF4E), ни о его взаимодействии с
ство того, что PTE, помимо факторов инициа&
5′&концом мРНК.
ции, связывает и малую субчастицу рибосомы
Механизмы инициации трансляции с ис&
(возможно, через цепочку взаимодействий).
пользованием иммобилизованных на 3′&конце
Особняком стоят 3′&CITE группы TSS, свя&
матрицы факторов до конца не ясны, однако су&
зывающие большую рибосомную субчастицу и
ществуют указания на то, что посадка рибосомы
целую 80S&рибосому. В отличие от факторов
в этом случае происходит на 5′&конец мРНК,
инициации четвёртой группы, которые связы&
после чего следует классическое сканирование в
вают остальные 3′&CITE, 60S&субчастицы не яв&
поисках нужного инициаторного кодона. До&
ляются дефицитными компонентами аппарата
бавление стабильной шпильки на самый конец
трансляции. Иммобилизация 60S&субчастиц на
5′&НТО приводит к блокированию или сильно&
вирусной гРНК для обеспечения эффективной
му ингибированию синтеза вирусного или ре&
трансляции в условиях конкуренции не выгля&
портёрного белка как in vivo, так и in vitro
дит целесообразной. Секвестрирование 60S&
[194, 195], подтверждая необходимость свобод&
субчастиц для подавления трансляции клеточ&
ного 5′&конца мРНК. Сканирование 5′&НТО бы&
ных мРНК также вряд ли может быть эффектив&
ло проверено с помощью стандартных тестов -
ным, поскольку количество вирусной РНК в
введением дополнительных AUG&кодо&
клетке относительно невелико. Кроме того,
нов [183, 195-197] или шпилек между 5′&концом
большинство вирусных гРНК, содержащих TSS,
мРНК и инициаторным кодоном [195, 198].
не имеют структур, обеспечивающих взаимо&
В большинстве случаев приоритет в инициации
действие 5′& и 3′&конца, т.е. отсутствует меха&
трансляции имели ближайшие к 5′&концу AUG&
низм доставки связанных субчастиц или рибо&
кодоны, а промежуточные шпильки ингибиро&
сом для участия в инициации трансляции. На
вали синтез белка.
основании косвенных данных было высказано
Тем не менее следует упомянуть необычный
предположение, что 80S&рибосома способна од&
3′&CITE, идентифицированный в обеих гРНК
новременно связывать 5′&НТО и 3′&TSS гРНК
вируса махровости чёрной смородины (blackcur&
TCV, приводя к образованию петли [201]. Одна&
rant reversion nepovirus, BRV), который обеспе&
ко остаётся непонятным, как связанная рибосо&
чивает эффективную кэп&независимую транс&
ма может быть включена в процесс инициации.
ляцию, взаимодействуя с 5′&НТО [199]: он спо&
То, что и в этом случае используется более или
собен стимулировать внутреннюю инициацию в
менее традиционный механизм, можно заклю&
протопластах клеток, когда последовательность
чить из того, что в клетках, дефицитных по фак&
5′&НТО вставлена между репортёрными рамка&
тору инициации eIF4G, трансляция репортёр&
ми считывания. Таким образом, этот 3′&CITE,
ной РНК с 5′& и 3′&НТО гРНК TCV была замет&
вероятно, функционирует как часть составного
но подавлена [202].
IRES&элемента.
Точное взаимное позиционирование эле&
Неясным остаётся вопрос, связывают ли 3′&
ментов 5′&НТО и сближенного с ней 3′&CITE,
CITE только факторы инициации или на них
по&видимому, не является важным для эффек&
может формироваться 40S&содержащий пре&
тивной инициации трансляции или выбора
инициаторный комплекс для последующего
стартового кодона. Удлинение 5′&конца гРНК
трансфера на 5′&конец. Известно, что слабое
[195, 196] или изменение положения шпильки,
связывание 40S&субчастицы c BTE вируса жел&
обеспечивающей киссинг&взаимодействие [196,
БИОХИМИЯ том 86 вып. 9 2021
ИНИЦИАЦИЯ ТРАНСЛЯЦИИ ВИРУСНЫХ мРНК
1295
197], критически не сказываются на уровне
руемым сдвигом рамки считывания, вызывае&
синтеза белков. В единственном известном слу&
мым тремя последовательными структурными
чае (гРНК PEMV&2), когда 3′&концевой сайт
элементами в районе точки сдвига [203]. Оче&
дальнего киссинг&взаимодействия не является
видно, что трансляция гРНК должна приводить
частью основного 3′&CITE PTE (связывающего
к периодическому плавлению этих элементов,
eIF4E или eIF4F), а входит в отдельный вспо&
для восстановления структуры которых могут
могательный 3′&CITE kl&TSS, перенос точки
требоваться значительные пространственные и
взаимодействия также не оказывал существен&
временные промежутки между транслирующи&
ного влияния на трансляцию гРНК in vitro [191].
ми рибосомами.
Всё это говорит о том, что ни узнавание 5′&кон&
тРНК/подобные структуры (TLS). На 3′&кон&
ца, ни позиционирование инициаторного
це гРНК некоторых вирусов растений, принад&
комплекса на конкретном AUG&кодоне не оп&
лежащих к восьми родам трёх различных се&
ределяются геометрией взаимодействия конк&
мейств, обнаружены элементы, структурно и
ретных элементов. Иными словами, 3′&CITE
функционально напоминающие тРНК - TLS
лишь обеспечивает пространственное сближе&
(тРНК&подобные структуры, tRNA&like struc&
ние факторов инициации (или преинициатор&
ture; рис. 3, б). Все TLS содержат псевдоузел, ко&
ных комплексов), связанных с концами РНК,
торый позволяет сформировать аминоацилиру&
для уменьшения общей энтропии процесса.
емый аналог акцепторного стебля, не содержа&
Вместе с тем при инициации на сгРНК того же
щий 5′&конец РНК. TLS обладают тремя важны&
PEMV&2, где 3′&CITE&зависимый синтез двух
ми свойствами тРНК: они являются субстратом
вспомогательных белков стартует с близкорас&
для клеточной CCA&нуклеотидилтрансферазы,
положенных AUG&кодонов, находящихся на
аминоацилируются конкретными аминоацил&
небольшом расстоянии от обеспечивающей
тРНК&синтетазами и формируют тройственный
дальнее взаимодействие шпильки, преимуще&
комплекс с eEF1A•GTP.
ство имеет второй инициаторный кодон. Отно&
Различают 3 основных типа TLS: аминоаци&
сительная эффективность синтеза этих двух
лируемые валином (характерные для представи&
белков in vivo зависит от расстояния между
телей семейства Tymoviridae), гистидином
AUG&кодонами и их положения относительно
(Viraviridae) и тирозином (Bromoviridae). Каж&
сайта взаимодействия концов сгРНК [195]. Воз&
дый из этих типов имеет характерную первич&
можно, при определенных условиях взаимодей&
ную и вторичную структуры, обеспечивающие
ствие инициирующей 40S&субчастицы с цепью
специфичность аминоацилирования. Несмотря
РНК через 3′&CITE может определять её преи&
на то что способность TLS к аминоацилирова&
мущественное положение при сканировании и
нию и связыванию фактора элонгации подразу&
тем самым обеспечивать узнавание определен&
мевает участие этих структурных элементов в
ного AUG&кодона.
трансляции, пока достоверно была показана
Очевидно, что сканирование 5′&НТО или
только их роль в регуляции посадки вирусной
начало трансляции рамки считывания, разру&
репликазы для синтеза (-)&цепи РНК и в вы&
шающие вторичную структуру РНК, должны
полнении функции теломер при участии нуклео&
приводить к потере дальнего взаимодействия
тидилтрансферазы.
между 3′&CITE и 5′&концом гРНК и, таким об&
TLS вируса TYMV является наиболее изучен&
разом, к периодическому выключению инициа&
ным примером тРНК&подобного трансляцион&
ции трансляции. Считается, что такой динами&
ного энхансера. гРНК TYMV кэпирована, и для
ческий, или «осциллирующий», характер ини&
максимального усиления трансляции требуется
циации является своего рода регуляцией, обес&
одновременно кэпирование 5′&конца и амино&
печивающей уровень трансляции оптимальный
ацилирование 3′&конца гРНК [204]. Поскольку
для размножения вируса [196, 197]. Действи&
способность связывать eEF1A•GTP необходима
тельно, было показано, что загруженность
для эффективной трансляции, а специфичность
транслируемой in vitro гРНК PEMV&2 рибосо&
аминоацилирования не оказывает на неё влия&
мами невысока по сравнению с кэпированной
ния, был сделан вывод, что эффект усиления
мРНК и составляет 1-3 рибосомы [191, 195].
опосредуется фактором элонгации eEF1A.
Это означает относительно низкую частоту по&
Кристаллическая структура TLS TYMV подтвер&
садки рибосом на РНК, что может быть след&
дила сходство его поверхности с тРНК со сторо&
ствием периодического блокирования инициа&
ны, взаимодействующей с аминоацил&тРНК&
ции трансляции. Было высказано предположе&
синтетазой и фактором eEF1A [205]. Недавно
ние [191], что «разреженное» распределение ри&
показано, что TLS TYMV может связывать рибо&
босом на гРНК важно для эффективного синте&
сому [205] (правда, только на примере прокарио&
за RdRp, который обеспечивается программи&
тических 70S&рибосом). В связи с вышесказан&
БИОХИМИЯ том 86 вып. 9 2021
1296
СОРОКИН и др.
ным возникает вопрос: выполняют ли амино&
На данный момент до конца не ясно, являет&
ацилированные 3′&TLS главную функцию ами&
ся ли усиление трансляции общим и необходи&
ноацил&тРНК - включение аминокислоты в
мым свойством всех аминоацилируемых TLS.
синтезируемый белок? После открытия амино&
Ряд наблюдений заставляет в этом усомниться.
ацилирования TLS такая их функция казалась
Например, тРНК&подобная структура гРНК
очевидной, и были сделаны попытки это прове&
TMV, схожая с TLS TYMV, не важна для её
рить. Хотя в ряде работ был показан перенос ра&
трансляции [211], а TLS вируса розетчатости
диоактивно&меченой аминокислоты с TLS
арахиса (peanut clump virus, PCV) не связывает
TYMV в синтезируемый белок, другие исследо&
eEF1A•GTP [212].
вания этого не подтвердили, и позднее сами ав&
Аминоацилируемые TLS изредка встречают&
торы признали эти результаты артефактами,
ся и на 3′&концах РНК вирусов животных -
вызванными переносом аминокислоты на соот&
например, у представителей тетравирусов
ветствующую тРНК (см. обсуждение в статье
(Tetraviridae), поражающих насекомых [213, 214].
Haenni et al. [206]). История получила продолже&
Однако эти структуры пока почти не изучены.
ние через четверть века, когда, чтобы объяснить
Функциональные элементы, заменяющие по/
эффективную инициацию трансляции на вто&
ли(А)/хвост. (+)РНК всех ротавирусов группы A
ром инициаторном кодоне гРНК TYMV, на ос&
(group A rotavirus, RVA) содержат на 3′&конце
новании полученных in vitro данных был предло&
консенсусную последовательность GACC (3′&
жен механизм «троянского коня», предполагаю&
consensus sequence (3′&CS); рис. 3, в), которая
щий прямое узнавание этого кодона рибосомой,
специфично связывает N&концевой домен ви&
связанной с Val&TLS, и начало синтеза белка с N&
русного неструктурного белка 3 (NSP3) [215].
концевым валином [207]. Однако независимая
C&Концевой домен этого белка взаимодействует
проверка этих результатов, выполненная на тех
с eIF4G [216], конкурируя с поли(A)&связываю&
же объектах и в той же системе трансляции, их
щим белком. NSP3 является очень эффектив&
не подтвердила [208]. Были получены свидетель&
ным энхансером вирусной трансляции [217], ве&
ства в пользу того, что в данном случае, скорее
роятно, выполняя функцию PABP при форми&
всего, имеет место необычный вариант пропус&
ровании циклической структуры вирусной
кающего сканирования (см. выше) [12], и пока&
РНК. Кроме того, NSP3 - мощный ингибитор
зано, что инициация трансляции на втором ини&
трансляции клеточных мРНК, поскольку вытес&
циаторном кодоне зависит от наличия 5′&кэпа, а
нение PABP из комплекса с eIF4G препятствует
не TLS [208]. В целом непосредственное участие
циркуляризации полиаденилированных мат&
TLS в трансляции в качестве функционального
риц [217].
аналога аминоацил&тРНК остаётся интересной
Схожий механизм реализуется при трансля&
гипотезой, не получившей пока убедительного
ции гРНК уже упоминавшегося вируса AMV. 3′&
подтверждения.
НТО этой РНК формирует содержащую псевдо&
TLS вируса мозаики костра (brome mosaic
узел структуру, напоминающую TLS и узнавае&
virus, BMV) также является энхансером трансля&
мую вирусной репликазой и тРНК&специфич&
ции [209]. Мутации, нарушающие структу&
ными ферментами. Однако эта тРНК&подобная
ру TLS, приводили к снижению эффективности
структура разрушается при связывании вирус&
трансляции гРНК BMV in vitro [210]. Поскольку
ного белка оболочки (CP), который блокирует
были получены свидетельства того, что и в этом
синтез (-)&цепи РНК и приводит к усилению
случае аминоацилирование TLS (тирозином)
трансляции [218, 219]. CP также связывает
является важным для его энхансерной актив&
eIF4G или eIFiso4G [220] и, вероятно, имитиру&
ности, можно предположить схожий механизм
ет взаимодействие eIF4G•PABP•poly(A), обес&
действия TLS вирусов TYMV и BMV, однако его
печивая циклизацию вирусной гРНК и стиму&
детали до сих пор неясны. Синергизм действия
лируя её трансляцию.
5′&кэпа и 3′&TLS позволил предположить, что
Шпилька на 3′&конце гРНК DENV [221] и
связанный с TLS фактор eEF1A каким&то обра&
содержащий несколько псевдоузлов структур&
зом взаимодействует с фактором инициации
ный элемент внутри 3′&НТО гРНК TMV [211]
eIF4F, подменяя тем самым каноническую це&
способны заменять 3′&поли(A) при трансляции
почку взаимодействий eIF4F•PABP•poly(A).
кэпированных репортёрных мРНК. На этом ос&
С другой стороны, данные о связывании амино&
новании был сделан вывод об их функциональ&
ацил&TLS с рибосомой [205] говорят о возмож&
ной эквивалентности полиаденилированному
ности того же механизма усиления трансляции,
3′&концу мРНК. 3′&НТО вируса HCV также спо&
что и в случае 3′&CITE TSS, для которых тоже
собна неспецифично увеличивать уровень
постулировано связывание рибосом благодаря
экспрессии мРНК вне зависимости от механиз&
мимикрии под тРНК в P&сайте.
ма инициации трансляции [222].
БИОХИМИЯ том 86 вып. 9 2021
ИНИЦИАЦИЯ ТРАНСЛЯЦИИ ВИРУСНЫХ мРНК
1297
РЕИНИЦИАЦИЯ ПРИ ТРАНСЛЯЦИИ
TURBS/опосредованная реинициация трансля/
ВИРУСНЫХ мРНК
ции. Некоторые вирусы используют для синтеза
нескольких белков с одной РНК особый меха&
Вирусные мРНК, содержащие несколько
низм терминации&реинициации на частично пе&
разнесённых или частично перекрывающихся
рекрывающихся рамках [224], трансляция кото&
рамок считывания, могут использовать для дос&
рых является сопряжённой. В местах перекрыва&
тавки рибосомы на дистальные рамки механизм
ния таких рамок возможны варианты взаимного
реинициации трансляции. Обычно эукариоти&
расположения старт& и стоп&кодонов, некоторые
ческая рибосома не склонна к реинициации
из которых показаны на рис. 4, а. Подобная реи&
после прочтения полноразмерных белок&коди&
нициация хорошо изучена на примере предста&
рующих рамок, поскольку ввиду моноцистрон&
вителей семейства Caliciviridae (вирусе геморра&
ности большинства мРНК эволюция здесь рабо&
гической болезни кроликов (rabbit hemorrhagic
тала на противодействие аберрантной реинициа&
disease virus, RHDV), а также ранее упоминав&
ции на 3′&НТО [223]. Тем не менее из этого пра&
шихся FCV, MNV и WNV) и несколько хуже -
вила есть как минимум два исключения. Пер&
для вируса гриппа B (influenza B virus, IBV) из се&
вое - это реинициация после трансляции uORF,
мейства Orthomyxoviridae. Так, одна из сгРНК
расположенных в 5′&НТО многих мРНК. Её эф&
RHDV кодирует основной белок капсида VP1 в
фективность может сильно варьировать в зави&
первой рамке и малый белок капсида VP2 - во
симости от длины uORF, расстояния от стоп&ко&
второй. Механизм сопряжённой терминации&
дона до основной рамки и присутствия цис&
реинициации позволяет, по всей видимости,
действующих элементов в 5′&НТО. Второе иск&
поддерживать оптимальную стехиометрию двух
лючение - это случаи, когда благодаря специ&
белков, способствуя правильной сборке капсида.
альным механизмам становится возможной эф&
Данный механизм основан на «принужде&
фективная реинициация после прочтения пол&
нии» рибосомы, терминировавшей на стоп&ко&
норазмерной рамки, и этот путь характерен в
доне первой рамки, вместо диссоциации с
первую очередь для вирусных мРНК.
мРНК (рециклинга) заново инициировать
Рис. 4. Механизмы трансляции вирусных мРНК, основанные на эффективной реинициации. а - Примеры участков пе&
рекрывания трансляционно сопряжённых рамок в вирусных мРНК, содержащих TURBS. б - Механизм работы TURBS.
в - Два механизма, используемых пгРНК CaMV: слева - шунтирование, опосредованное реинициацией, справа - TAV&
опосредованная реинициация. Обозначения стартовых и стоп&кодонов - как на рис. 2 и 3
4 БИОХИМИЯ том 86 вып. 9 2021
1298
СОРОКИН и др.
трансляцию (рис. 4, б). Он требует наличия в
ванной in vitro системе, могут отличаться от зна&
конце первой рамки, незадолго до стоп&кодона,
чений в полном лизате. Тем не менее на основа&
специального структурного элемента, связыва&
нии вышеизложенных данных можно предполо&
ющего рибосому - TURBS (от англ. termination
жить, что ключевую роль в TURBS&опосредо&
upstream ribosomal binding site) [225-227]. В сос&
ванной реинициации играет именно связывание
таве TURBS есть консервативный мотив 1 (m1),
m1 с 40S&субчастицей, хотя eIF3 может усили&
комплементарный петле в шпильке h26
вать, стабилизировать или даже заменять это
18S рРНК, и мотив 2 (m2/2*), формирующий
взаимодействие, а также, возможно, участвовать
шпилечную структуру с выпетливанием, содер&
в регуляции реинициации в зависимости от сос&
жащим m1 [228, 229]. В результате взаимодей&
тояния клетки или в ходе жизненного цикла.
ствия h26 с участком UGGGA, общим для m1
Помимо калицивирусов и IBV, описаны и
калицивирусов и IBV, некоторые из 40S&субчас&
другие случаи эффективной реинициации на пе&
тиц после терминации и разборки пост&терми&
рекрывающихся рамках: например, у мРНК ви&
национного комплекса остаются связанными
руса HvV190S паразитического грибка Helmintho
с мРНК. Это позволяет им реинициировать, ес&
sporium victoriae, респираторно&синцитиального
ли поблизости окажется стартовый кодон. Та&
вируса человека (human respiratory syncytial virus,
ким образом, в каком&то смысле TURBS обес&
HRSV) и прототипического гиповируса (Crypho&
печивает внутреннюю инициацию трансляции,
nectria hypovirus 1, CHV1&EP713) [223]. Мотив
однако в отличие от IRES&элементов он спосо&
TURBS в РНК этих вирусов не обнаружен, одна&
бен оперировать лишь с уже привлечённой ра&
ко выявлены другие слабо охарактеризованные
нее рибосомой, т.е. когда нет необходимости за&
участки неконсервативной вторичной структу&
ново укладывать мРНК в канал 40S&субчастицы.
ры, имеющие комплементарность с 18S рРНК.
Представления о том, какие трансляционные
Шунтирование, опосредованное реинициаци/
факторы необходимы для TURBS&опосредован&
ей. 35S пгРНК параретровируса CaMV исполь&
ной реинициации, неоднозначны. В ранних ра&
зует ещё один необычный способ реинициации.
ботах было показано, что eIF3, как и 40S, спосо&
Эта мРНК имеет очень длинную 5′&НТО, во
бен прямо связываться с TURBS FCV в in vitro
внутренней части которой находится протяжён&
системе на основе RRL. На этом основании бы&
ная область, формирующая сложную вторичную
ло высказано предположение, что eIF3 играет
структуру со стабильным стеблем в основании и
ключевую роль в этом процессе и строго необхо&
разветвлёнными шпильками в дистальной час&
дим для эффективной реинициации по этому
ти. Эта область содержит несколько нефункци&
механизму [225]. Это соответствовало важной роли
ональных AUG&кодонов, а непосредственно пе&
данного фактора в реинициации на некоторых
ред стеблем расположена короткая uORF, коди&
клеточных мРНК, содержащих uORF [223]. Од&
рующая 6&членный пептид [26]. В серии работ,
нако впоследствии в реконструированной in vitro
выполненных в лаборатории Т. Хона и его пос&
системе было показано, что реинициация на мРНК
ледователей, было показано, что данный вари&
RHDV и норовируса человека (human norovirus,
ант шунтирования требует трансляции этой
HNV) возможна и без участия eIF3, хотя его до&
uORF, терминации на её стоп&кодоне и высво&
бавление усиливает эффект [230]. Авторы также
бождения пептида, после чего рибосома «прос&
показали, что реинициация возможна по несколь&
какивает» всю область со стабильной вторичной
ким сценариям. В одном случае требуются Met&
структурой и реинициирует на рамке ORF VII,
тРНКi, eIF1, eIF1A и eIF2; при другом варианте
кодирующей белок P7 [34]. Таким образом, в
нужны Met&тРНКi и eIF2D; третий механизм
данном случае шунтирование не является, по
требует лишь Met&тРНКi и вовлекает в инициа&
сути, нелинейным сканированием (уже описан&
цию не диссоциировавшую на субчастицы 80S&
ным ранее), а выступает как особый случай ре&
рибосому [230]. Тем не менее в других работах по
инициации (рис. 4, в, слева). В область, пропус&
изучению TURBS RHDV, HNV и IBV реинициа&
каемую рибосомой, авторы вводили разные
ция в присутствии eIF3 происходила эффектив&
фрагменты РНК, в том числе очень длинные и
но даже на мРНК с нарушенным m1 TURBS
содержащие варьируемое количество AUG&ко&
[231, 232], из чего был сделан вывод, что связы&
донов, а в одном из опытов она даже содержала
вания eIF3 с TURBS достаточно для удержания
разрыв сахарофосфатного остова - и все эти мо&
пост&терминационной 40S&субчастицы на мРНК.
дификации не приводили к снижению эффек&
Различия в наблюдаемых механизмах реини&
тивности трансляции ORF VII. Участки, окайм&
циации могут объясняться тем, что у разных ви&
ляющие эту область, получили образные назва&
русов процесс происходит немного по&разному,
ния мест
«взлёта» (take&off) и
«приземле&
а концентрации инициаторных факторов, ионов
ния» (landing) рибосомы, подразумевающие её
магния и калия, используемые в реконструиро&
схождение с мРНК во время «прыжка». Тем не
БИОХИМИЯ том 86 вып. 9 2021
ИНИЦИАЦИЯ ТРАНСЛЯЦИИ ВИРУСНЫХ мРНК
1299
менее сейчас более приемлемой представляется
предложена интересная модель, согласно кото&
точка зрения, что при «прыжке» цепочка мРНК
рой протяжённая молекула RISP, взаимодей&
не выходит из канала малой субчастицы: вместо
ствуя одновременно с белками eS6/RSP6 и
этого стабильная шпилька «протягивается» че&
eL24/RPL24, выполняет роль скобы, удержива&
рез канал, не расплетаясь. Такое прохождение
ющей вместе большую и малую субчастицы ри&
нерасплетённой шпильки через канал можно
босом. При этом связывание регулируется фос&
наблюдать в реконструированной in vitro систе&
форилированием eS6 и самого RISP сигналь&
ме в присутствии неполного набора факторов
ным каскадом TOR&S6K1.
инициации - в частности, при отсутствии eIF1
По всей видимости, в условиях вирусной
[233]. Поскольку рециклинг пост&терминацион&
инфекции присутствие на рибосоме TAV и ак&
ного комплекса и последующая реинициация
тивированного RISP обеспечивает эффектив&
подразумевают малоизученное пока перекрыва&
ную реинициацию сразу двумя способами. Во&
ние функций между содержащими SUI1&домен
первых, удержание eIF3 на элонгирующих ри&
факторами eIF1, eIF2D и DENR [132], специ&
босомах позволяет 40S&субчастице, оставшейся
фика 35S пгРНК CaMV может заключаться в ис&
на мРНК после терминации и ухода 60S&суб&
пользовании необычного сочетания факторов в
частицы, быстро рекрутировать факторы ини&
этих пост&терминационных процессах.
циации и возобновить сканирование. Во&вто&
CaMV - не единственный вирус, применяю&
рых, нарушение рециклинга 60S&субчастицы
щий такую необычную стратегию. пгРНК ряда
предположительно способствует 80S&опосредо&
других параретровирусов растений (в том числе
ванной реинициации (существование которой
большинства представителей семейства Cauli&
ранее было показано в других эукариотических
moviridae), ДНК&параретровирусов (например,
системах [132, 230, 238, 239]). Являются ли эти
палочковидного тунгровируса риса, rice tungro
механизмы специфичными для упомянутых
bacilliform virus, RTBV), гРНК одного из пикор&
растительных вирусов или они могут работать и
на&подобных вирусов растений (сферического
в случае других полицистронных вирусных
тунгровируса риса, rice tungro spherical virus,
мРНК, пока неизвестно.
RTSV), а также пгРНК спумавирусов - ретрови&
русов с ДНК&геномом (в частности, прототип&
ного спумавируса человека, prototypic foamy
ПРЕРЫВАЮЩАЯСЯ ЭЛОНГАЦИЯ
virus, PFV), имеют похожие структуры, которые
(МЕХАНИЗМ «StopGo»)
обеспечивают такую же реинициацию с шунти&
рованием большого участка РНК [34].
У некоторых вирусов семейств Picornaviri&
Механизмы реинициации с участием вирусных
dae, Iflaviviridae, Tetraviridae, Dicistroviridae и
белков. Растительные параретровирусы исполь&
Reoviridae есть и ещё один принципиально иной
зуют и другой способ эффективной реинициа&
способ продукции отдельного полипептида, за&
ции, который был охарактеризован в серии ра&
кодированного во внутренней области мРНК, -
бот, выполненных под руководством Л. Рябовой,
так называемый механизм «StopGo» [240]. Он
также на примере мРНК CaMV. Этот механизм
требует специального участка аминокислотной
связан с активностью вирусного белка P6/TAV
последовательности - 2A&пептида. Рибосома,
(transactivator viroplasmin) и назван TAV&опосре&
синтезировавшая такой пептид, с высокой час&
дованной реинициацией (рис. 4, в, справа).
тотой (иногда близкой к 100%) не образует пеп&
TAV связывается с фактором eIF3 в составе
тидную связь в одной конкретной позиции, од&
инициаторного комплекса (вероятно, в момент,
нако после этого продолжает трансляцию. В ре&
когда из него уходит фактор eIF4B) и удержива&
зультате начинает синтезироваться отдельный
ет его после присоединения большой субчасти&
белок, хотя нового акта инициации трансляции
цы рибосомы благодаря своему сродству к нес&
в этом случае, по сути, не происходит. «Класси&
кольким белкам 60S [34]. Кроме того, TAV при&
ческим» примером считается 2А&пептид из
влекает в полисомы киназу TOR и способствует
FMDV, на практике же широко применяются
её активации [234]. TOR, в свою очередь, акти&
более активные пептиды E2A и T2A из вирусов
вирует киназу S6K1, которая затем фосфорили&
PTV&1 и TaV (Thosea asigna virus) [240, 241].
рует субъединицу h фактора eIF3, что помогает
удерживать eIF3 на рибосоме при элонгации и
способствует реинициации [235].
ТРАНСЛЯЦИЯ КОЛЬЦЕВЫХ
Другой важный игрок в этом процессе - кле&
ВИРУСНЫХ РНК
точный белок RISP, выступающий партнёром
TAV в связывании eIF3, 40S& и 60S&субчас&
Большой интерес представляют также коль&
тиц [236]. В недавней работе той же группы [237]
цевые (ковалентно замкнутые) белок&кодирую&
БИОХИМИЯ том 86 вып. 9 2021
4*
1300
СОРОКИН и др.
щие РНК (circRNA, кРНК). Такие кРНК не име&
диапазону условий стресса, неизбежно возника&
ют свободного 5′&конца и должны инициировать
ющего в клетках при вирусной инфекции.
трансляцию по механизму внутренней посадки
В данном разделе мы кратко опишем наиболее
рибосомы - т.е., вероятно, содержать IRES [242].
яркие примеры механизмов, позволяющих ви&
Однако имеющиеся на этот счёт данные проти&
русам обеспечивать преимущественную транс&
воречивы, получены преимущественно метода&
ляцию своих мРНК. Зачастую это достигается
ми биоинформатики и не всегда имеют экспери&
при помощи ингибирования компонентов кле&
ментальное подтверждение. В клетках эукариот
точного кэп&связывающего аппарата или других
кольцевые транскрипты получаются в результате
элементов канонического механизма инициа&
«обратного» сплайсинга, при котором последую&
ции трансляции, их модификации или уничто&
щий экзон соединяется с предыдущим. Подоб&
жения (рис. 5). Кроме того, существуют страте&
ные «закольцованные» в результате сплайсинга
гии, основанные на компартментализации ком&
РНК были обнаружены и у вирусов [243], но про
понентов жизненного цикла вирусов, что позво&
механизм их трансляции мало что известно.
ляет в буквальном смысле оградить их от защит&
Одна из транслируемых кРНК кодирует он&
ных механизмов заражённой клетки.
кобелок E7 вируса папилломы [244]. E7 вызыва&
Воздействие на компоненты трансляционного
ет опухолевую трансформацию клеток, контро&
аппарата. Многие вирусы для эффективной
лируя транскрипцию протоонкогенов и генов&
конкуренции за клеточные ресурсы активно ма&
супрессоров опухолевого роста, структуру и мо&
нипулируют трансляционными компонентами.
дификации хроматина. Показано, что кРНК
Яркий пример - белок NSP1 коронавируса
HPV, синтезируемая после трансфекции клеток
SARS&CoV&2 (коронавирус 2, вызывающий тя&
цервикальной карциномы плазмидой с мини&
жёлый острый респираторный синдром, severe
геном Е7, содержит модифицированные нуклео&
acute respiratory syndrome&related coronavirus 2).
тиды m6А и транслируется в полисомах [244].
Своим C&концевым доменом он связывается с
кРНК найдены в жизненном цикле и других ви&
входным мРНК&каналом 40S&субчастицы, «за&
русов - например, Эпштейна-Барр (Epstein-
купоривая» его подобно пробке [247-249]. N&
Barr virus, EBV), саркомы Капоши (Kaposhi
Концевой домен стабилизирует это связывание
sarсoma herpes virus, KSHV), HBV и др. [245]. Од&
и, вероятно, тоже взаимодействует с 40S&субчас&
нако достоверно неизвестно, выполняют ли они
тицей. Препятствуя загрузке клеточных мРНК в
роль мРНК.
рибосому, NSP1 в то же время позволяет транс&
В мире вирусов встречаются также РНК, ко&
лироваться мРНК SARS&CoV&2. Дело в том, что
торые изначально являются кольцевыми - в ос&
вирусные гРНК и сгРНК имеют общий лидер,
новном это вироиды и вирусоиды. Однако слу&
содержащий шпилечную структуру SL1, которая
чаев, когда вирусная кРНК кодирует белок, из&
специфично связывается с N&концевым доме&
вестно совсем немного. Один из них - вирусо&
ном белка [250-252]. Это взаимодействие при&
ид&сателлит вируса жёлтой пятнистости риса
водит к освобождению мРНК&канала рибосомы
(rice yellow mottle virus - RYMV), чей «РНК&на&
от C&концевого домена NSP1 и позволяет начать
ногеном» представляет собой ковалентно замк&
трансляцию [251, 252]. Интересно, что связыва&
нутую РНК длиной
220
нт. Согласно
нию NSP1 с 40S&субчастицей способствуют
AbouHaidar et al. [246], эта кРНК содержит сайт
факторы инициации, а с целой рибосомой бе&
связывания рибосомы (AAGGA) за 11 нт до
лок взаимодействует хуже [253]. Это позволяет
AUG&кодона, обеспечивающий внутреннюю
предположить, что в заражённой клетке инги&
инициацию. Продукт трансляции - белок мас&
бирующий комплекс образуется именно на ста&
сой 16 кДа, у которого отсутствует гомология с
дии инициации трансляции. Так или иначе,
известными белками. Этот белок способен свя&
NSP1 является мощным инструментом, помога&
зывать свою мРНК и, вероятно, необходим для
ющим вирусу распоряжаться ресурсами клетки,
защиты генома вирусоида [246].
но одновременно он может быть и удобной ми&
шенью для антивирусной терапии [250].
Белок NSP1 другого коронавируса, SARS&
МЕХАНИЗМЫ, ОБЕСПЕЧИВАЮЩИЕ
CoV, также способен связываться с рибосомой,
ВИРУСНЫМ мРНК ТРАНСЛЯЦИОННЫЙ
ингибируя трансляцию клеточных мРНК. Одна&
ПРИОРИТЕТ
ко в данном случае NSP1, вероятно, привлекает
ряд клеточных эндонуклеаз, избирательно рас&
Выше мы описывали механизмы трансляции
щепляющих мРНК в зависимости от используе&
вирусных мРНК, направленные на повышение
мого ими механизма инициации трансляции [254].
эффективности синтеза вирусных белков, а так&
Известны примеры, когда вирусы осущест&
же позволяющие адаптироваться к широкому
вляют ограниченный протеолиз факторов ини&
БИОХИМИЯ том 86 вып. 9 2021
ИНИЦИАЦИЯ ТРАНСЛЯЦИИ ВИРУСНЫХ мРНК
1301
Рис. 5. Механизмы создания вирусами конкурентных преимуществ для трансляции собственных мРНК. Полные назва&
ния вирусов приведены в тексте статьи
циации трансляции. Так, в разделах, посвящён&
торы инициации, необходимые для трансляции
ных IRES&элементам, мы упоминали вирусные
мРНК самого вируса (субъединицы eIF3, eIF5B,
протеазы, разрезающие eIF4G. Подобные меха&
PABP и другие), что может использоваться для
низмы позволяют вирусам повысить эффектив&
регуляции жизненного цикла.
ность кэп&независимой трансляции, направляя
Возможны и другие пути воздействия на
на неё высвобождающиеся ресурсы клетки
инициаторный аппарат [255]. Например, РНК&
[80, 255]. Иногда протеолизу подвергаются фак&
полимераза и белок NS1 вируса гриппа привле&
БИОХИМИЯ том 86 вып. 9 2021
1302
СОРОКИН и др.
кают фактор eIF4G на вирусные мРНК, обеспе&
мый для кэпирования мРНК, синтезированных
чивая им победу в конкуренции за этот дефицит&
in vitro. Подробнее о декэпировании, «похище&
ный фактор; белок ICP6 вируса простого герпе&
нии» кэпа и неканоническом кэпировании ви&
са 1&го типа (herpes simplex virus 1, HSV&1) уси&
русных РНК можно прочитать в обзоре Decroly
ливает взаимодействие eIF4E с eIF4G, не давая
et al. [257].
клетке инактивировать трансляцию с помощью
Компартментализованная трансляция вирус/
4E&BP1 в ответ на заражение; вирус EMCV, нап&
ных мРНК. Отдельного рассмотрения заслужи&
ротив, активирует 4E&BP1 (см. выше), посколь&
вают механизмы, связанные с локализованной
ку не нуждается в eIF4E; обезьяний полиома&
трансляцией, формированием РНП&гранул и
вирус SV40 также активирует 4E&BP1 на поздних
образованием особых вирусных компартментов
стадиях инфекции; ряд вирусов манипулируют
внутри клетки [258]. У многих РНК&содержащих
белком PABP, модулируя образование замкну&
вирусов жизненный цикл связан с «вирусными
той петли (белок капсида вируса краснухи, NS1
фабриками» (viral factory, VF) - специальными
вируса гриппа, белки SOX10 и K10 вируса KSHV,
внутриклеточными структурами, формирующи&
белок NSP3 ротавируса). Подробнее с этой те&
мися с использованием мембранных органелл
мой можно ознакомиться в обзоре Walsh и
клетки [259]. У (+)РНК&содержащих вирусов VF,
Mohr [255].
как правило, являются лишь платформами для
Манипуляции с 5′/кэпом. Некоторые вирусы
синтеза вирусных РНК, но у ряда вирусов с
используют другой способ «нечестной конку&
дцРНК& и (-)РНК&геномом они служат ещё и
ренции» - выводят из строя клеточные матри&
местом трансляции их мРНК, ограждая их от
цы. Так, белки D9 и D10 вируса VACV прямо
действия клеточных регуляторных механизмов.
связывают кэп клеточных мРНК и декэпируют
В такие специализированные компартменты ви&
их. Это высвобождает ресурсы для трансляции
русы могут активно привлекать трансляционные
некэпированных вирусных мРНК с 5′&поли(А)&
факторы [258]. Ассоциация трансляции вирус&
лидером, что необходимо на поздней стадии ин&
ных мРНК с мембранами может играть роль в ус&
фекции (см. выше). Интересно, что белок D9
тойчивости её к клеточному ответу на инфекцию
только ингибирует трансляцию, декэпируя
и безотносительно VF - как в описанном выше
мРНК и тем самым провоцируя их деградацию,
случае мРНК полиовируса, избегающей ингиби&
а D10 дополнительно стимулирует трансляцию
рующего эффекта фосфорилирования eIF2α
мРНК с поли(А)&лидерами [256].
благодаря мембранной локализации активной
Ещё более виртуозным является механизм
фракции eIF2 в инфицированной клетке [97].
«похищения» кэпа у клеточных мРНК, осущест&
Клеточный ответ на вирусную инфекцию
вляемый (-)РНК&вирусами семейств Arenaviri&
включает образование стресс&гранул. Это при&
dae, Bunyaviridae и Orthomyxoviridae. Эти вирусы
водит, в частности, к уменьшению концентра&
не имеют собственных кэпирующих ферментов,
ции доступных трансляционных компонентов в
однако кодируют белки, способные связывать
цитозоле, что должно мешать трансляции ви&
кэп и отщеплять его вместе с 5′&концевыми
русных мРНК. Однако многие вирусы умело ма&
15-20 нт клеточной мРНК. Отделяемый фраг&
нипулируют этим процессом, либо препятствуя
мент используется затем как затравка для синтеза
образованию гранул (например, путём протео&
(+)&цепи РНК вируса, содержащей кэпирован&
лиза их ключевых компонентов), как это делают
ный отрезок клеточной мРНК. Например, реп&
ZIKV, VSV, IAV и ряд пикорнавирусов, либо, на&
ликаза (RdRp) вируса гриппа IAV состоит из трёх
оборот, способствуя их сборке в нужный момент
субъединиц: PA, PB1 и PB2, при этом PB2 отвеча&
жизненного цикла, как RuV [260, 261]. Подроб&
ет за связывание кэпа, а PA обладает эндонукле&
нее о механизмах, связанных с локализованной
азной активностью. Представители аренавирусов
трансляцией вирусных мРНК, и манипуляциях
и буньявирусов совмещают функции связывания
мембранными и гранулярными компартмента&
кэпа и эндонуклеазы в одном белке L.
ми можно прочитать в соответствующих обзо&
Другие вирусы (как РНК&, так и ДНК&содер&
рах [258-261].
жащие, но также размножающиеся в цитоплаз&
Воздействие на компоненты сигнальных кас/
ме) приобрели в ходе эволюции собственный
кадов. Ещё одна распространённая стратегия,
кэпирующий аппарат. Кэпирующие ферменты
используемая вирусами для манипуляции стрес&
закодированы в геномах VACV, RuV, SARS&CoV,
совым ответом, заключается в непосредствен&
SARS&CoV&2, вируса Эбола (Ebola virus, EBOV),
ном воздействии на сигнальные пути клетки.
вируса везикулярного стоматита (vesicular stom&
Классический пример - ингибирование киназ
atitis virus, VSV), гигантских вирусов простей&
α&субъединицы eIF2, способствующих репрес&
ших и других. Наиболее изученным является ге&
сии инициации трансляции. Белки US1 вируса
теродимер D1&D12 VACV, широко применяе&
HSV&1, SM EBV, E3L и K3L VACV, NS5A HCV
БИОХИМИЯ том 86 вып. 9 2021
ИНИЦИАЦИЯ ТРАНСЛЯЦИИ ВИРУСНЫХ мРНК
1303
связываются с киназой PKR/EIF2AK2 и инги&
щество в условиях вирусной инфекции, зачас&
бируют её активность. Белки gB HSV&1,
тую усугубляемое активностью специальных ви&
K3L VACV и E2 HCV действуют на другую кина&
русных белков. С другой стороны, эти особен&
зу eIF2α, PERK/EIF2AK3. При этом E2 HCV
ности делают вирусы потенциально уязвимыми
выступает в роли псевдосубстрата как для PKR,
к лекарствам, направленным на специфические
так и для PERK. Известны случаи, когда с PKR
компоненты этих путей [265]. Низкомолекуляр&
связываются малые некодирующие РНК виру&
ные вещества и олигонуклеотиды, изменяющие
сов, препятствуя её активации: например, такой
сложную структуру IRES&элементов или CITE,
активностью обладают РНК EBER вируса EBV и
нарушающие важные РНК-РНК и РНК&белко&
РНК VA аденовируса [255, 262].
вые взаимодействия, атакующие ITAF и другие
Нельзя забывать и об опосредованном влия&
критические для неканонической трансляции
нии вирусной инфекции на инициацию транс&
компоненты, могут препятствовать экспрессии
ляции. Например, пикорнавирусы способны
вирусных мРНК и блокировать инфекцию. По&
влиять на проницаемость клеточной мембраны
тенциал антивирусной терапии, связанной с та&
и изменять внутриклеточные концентрации со&
ким подходом, ещё предстоит раскрыть.
лей, оптимизируя условия для инициации транс&
ляции IRES&элементами и негативно влияя на
кэп&зависимую трансляцию [263, 264].
Финансирование. Работа выполнена при фи&
Зачастую разные механизмы избирательного
нансовой поддержке Российского научного
подавления биосинтеза белка в клетке работают
фонда: гранты № 19&74&20186 (К.С.В., раздел
скоординированно, лишая клеточные мРНК
«Структурные элементы в 3′&НТО вирусных
одновременно 5′&кэпа, аппарата кэп&зависимой
мРНК, вовлечённые в инициацию трансля&
трансляции и канонической доставки Met&
ции») и № 20&14&00178 (Н.О.К., остальные раз&
tRNAi, а также доступа к компартментам с ак&
делы).
тивными трансляционными компонентами. До&
Благодарности. Авторы благодарны А.А. Бог&
полнительное воздействие осуществляется пу&
данову за приглашение в тематический сбор&
тём манипуляции механизмами стрессового от&
ник, посвящённый памяти А.С. Спирина, а так&
вета клетки. Всё это ставит клетку под контроль
же А.А. Аграновскому и М.В. Щепетильникову
размножающегося в ней вируса и зачастую ли&
за обсуждение отдельных разделов обзора.
шает её шансов не только на выживание, но и на
И.И.С. и С.Е.Д. входят в состав Междисципли&
контролируемую гибель.
нарной научно&образовательной школы Москов&
ского университета «Молекулярные технологии
живых систем и синтетическая биология».
ЗАКЛЮЧЕНИЕ
Конфликт интересов. Авторы заявляют об от&
сутствии конфликта интересов.
В данном обзоре мы рассмотрели неканони&
Соблюдение этических норм. Настоящая
ческие механизмы инициации трансляции, ха&
статья не содержит описания каких&либо иссле&
рактерные для вирусных мРНК. Использование
дований с участием людей или животных в каче&
этих механизмов даёт им конкурентное преиму&
стве объектов.
СПИСОК ЛИТЕРАТУРЫ
1.
Rodrigues, R. A. L., da Silva, L. C. F., and Abrahão, J. S.
5.
Eliseeva, I. A., Lyabin, D. N., and Ovchinnikov, L. P.
(2020) Translating the language of giants: translation&relat&
(2013) Poly(A)&binding proteins: structure, domain orga&
ed genes as a major contribution of giant viruses to the
nization, and activity regulation, Biochemistry (Moscow),
virosphere, Arch. Virol., 165, 1267&1278, doi: 10.1007/
78, 1377&1391, doi: 10.1134/S0006297913130014.
s00705&020&04626&2.
6.
Hinnebusch, A. G. (2017) Structural insights into the
2.
Pelletier, J., and Sonenberg, N. (2019) The organizing
mechanism of scanning and start codon recognition in
principles of eukaryotic ribosome recruitment, Annu. Rev.
eukaryotic translation initiation, Trends Biochem. Sci., 42,
Biochem., 88, 307&335, doi: 10.1146/annurev&biochem&
589&611, doi: 10.1016/j.tibs.2017.03.004.
013118&111042.
7.
Kozak, M. (2002) Pushing the limits of the scanning
3.
Hinnebusch, A. G. (2014) The scanning mechanism of
mechanism for initiation of translation, Gene, 299, 1&34,
eukaryotic translation initiation, Annu. Rev. Biochem., 83,
doi: 10.1016/s0378&1119(02)01056&9.
779&812, doi: 10.1146/annurev&biochem&060713&035802.
8.
Terenin, I. M., Akulich, K. A., Andreev, D. E., Polyanskaya,
4.
Alekhina, O. M., and Vassilenko, K. S. (2012) Translation
S. A., Shatsky, I. N., and Dmitriev, S. E. (2016) Sliding of a
initiation in eukaryotes: versatility of the scanning model,
43S ribosomal complex from the recognized AUG codon
Biochemistry (Moscow), 77, 1465&1477, doi: 10.1134/
triggered by a delay in eIF2&bound GTP hydrolysis, Nucleic
S0006297912130056.
Acids Res., 44, 1882&1893, doi: 10.1093/nar/gkv1514.
БИОХИМИЯ том 86 вып. 9 2021
1304
СОРОКИН и др.
9.
Latorre, P., Kolakofsky, D., and Curran, J. (1998) Sendai
tion, J. Virol., 80, 2170&2182, doi: 10.1128/JVI.80.5.2170&
virus Y proteins are initiated by a ribosomal shunt, Mol. Cell
2182.2006.
Biol., 18, 5021&5031, doi: 10.1128/MCB.18.9.5021.
25.
Edgil, D., Polacek, C., and Harris, E. (2006) Dengue virus
10.
Firth, A. E., and Brierley, I. (2012) Non&canonical transla&
utilizes a novel strategy for translation initiation when cap&
tion in RNA viruses, J. Gen. Virol., 93, 1385&1409,
dependent translation is inhibited, J. Virol., 80, 2976&2986,
doi: 10.1099/vir.0.042499&0.
doi: 10.1128/JVI.80.6.2976&2986.2006.
11.
Taliansky, M. E., and Robinson, D. J. (2003) Molecular
26.
Fütterer, J., Kiss László, Z., and Hohn, T.
(1993)
biology of umbraviruses: phantom warriors, J. Gen. Virol.,
Nonlinear ribosome migration on cauliflower mosaic virus
84, 1951&1960, doi: 10.1099/vir.0.19219&0.
35S RNA, Cell,
73,
789&802, doi:
10.1016/0092&
12.
Matsuda, D., and Dreher, T. W. (2006) Close spacing of
8674(93)90257&q.
AUG initiation codons confers dicistronic character on a
27.
Curran, J., and Kolakofsky, D. (1988) Scanning indepen&
eukaryotic mRNA, RNA, 12, 1338&1349, doi: 10.1261/rna.
dent ribosomal initiation of the Sendai virus X protein,
67906.
EMBO J., 7, 2869&2874, doi: 10.1002/j.1460&2075.1988.
13.
Kozak, M. (1995) Adherence to the first&AUG rule when a
tb03143.x.
second AUG codon follows closely upon the first, Proc.
28.
de Breyne, S., Simonet, V., Pelet, T., and Curran, J. (2003)
Natl. Acad. Sci. USA, 92, 2662&2666, doi: 10.1073/pnas.
Identification of a cis&acting element required for shunt&
92.7.2662.
mediated translational initiation of the Sendai virus Y pro&
14.
Dasso, M. C., Milburn, S. C., Hershey, J. W., and Jackson,
teins, Nucleic Acids Res., 31, 608&618, doi: 10.1093/nar/
R. J. (1990) Selection of the 5′&proximal translation initia&
gkg143.
tion site is influenced by mRNA and eIF&2 concentrations,
29.
Yueh, A., and Schneider, R. J. (2000) Translation by ribo&
Eur. J. Biochem., 187, 361&371, doi: 10.1111/j.1432&1033.
some shunting on adenovirus and hsp70 mRNAs facilitat&
1990.tb15313.x.
ed by complementarity to 18S rRNA, Genes Dev., 14, 414&
15.
Frolov, I., and Schlesinger, S. (1994) Translation of Sindbis
421.
virus mRNA: effects of sequences downstream of the initi&
30.
Dmitriev, S. E., Terenin, I. M., Dunaevsky, Y. E., Merrick,
ating codon, J. Virol., 68, 8111&8117, doi: 10.1128/JVI.68.
W. C., and Shatsky, I. N. (2003) Assembly of 48S transla&
12.8111&8117.1994.
tion initiation complexes from purified components with
16.
Ventoso, I., Sanz, M. A., Molina, S., Berlanga, J. J.,
mRNAs that have some base pairing within their 5′&
Carrasco, L., and Esteban, M. (2006) Translational resis&
untranslated regions, Mol. Cell. Biol., 23, 8925&8933,
tance of late alphavirus mRNA to eIF2alpha phosphoryla&
doi: 10.1128/MCB.23.24.8925&8933.2003.
tion: a strategy to overcome the antiviral effect of protein
31.
Xi, Q., Cuesta, R., and Schneider, R. J. (2004) Tethering of
kinase PKR, Genes Dev., 20, 87&100, doi: 10.1101/gad.
eIF4G to adenoviral mRNAs by viral 100k protein drives
357006.
ribosome shunting, Genes Dev.,
18,
1997&2009,
17.
Pappas, C. L., Tzeng, W. P., and Frey, T. K. (2006)
doi: 10.1101/gad.1212504.
Evaluation of cis&acting elements in the rubella virus
32.
Rajyaguru, P., and Parker, R. (2012) RGG motif proteins:
subgenomic RNA that play a role in its translation, Arch.
modulators of mRNA functional states, Cell Cycle, 11,
Virol., 151, 327&346, doi: 10.1007/s00705&005&0614&x.
2594&2599, doi: 10.4161/cc.20716.
18.
Gorchakov, R., Frolova, E., Williams, B. R., Rice, C. M.,
33.
Dolph, P. J., Racaniello, V., Villamarin, A., Palladino, F.,
and Frolov, I. (2004) PKR&dependent and &independent
and Schneider, R. J. (1988) The adenovirus tripartite leader
mechanisms are involved in translational shutoff during
may eliminate the requirement for cap&binding protein
Sindbis virus infection, J. Virol.,
78,
8455&8467,
complex during translation initiation, J. Virol., 62, 2059&
doi: 10.1128/JVI.78.16.8455&8467.2004.
2066, doi: 10.1128/JVI.62.6.2059&2066.1988.
19.
Sanz, M. A., Castelló, A., Ventoso, I., Berlanga, J. J., and
34.
Pooggin, M. M., and Ryabova, L. A. (2018) Ribosome
Carrasco, L. (2009) Dual mechanism for the translation of
shunting, polycistronic translation, and evasion of antiviral
subgenomic mRNA from Sindbis virus in infected and
defenses in plant pararetroviruses and beyond, Front.
uninfected cells, PLoS One, 4, e4772, doi: 10.1371/journal.
Microbiol., 9, 644, doi: 10.3389/fmicb.2018.00644.
pone.0004772.
35.
Pestova, T. V., and Kolupaeva, V. G. (2002) The roles of
20.
Garcia&Moreno, M., Sanz, M. A., Pelletier, J., and
individual eukaryotic translation initiation factors in ribo&
Carrasco, L. (2013) Requirements for eIF4A and eIF2 dur&
somal scanning and initiation codon selection, Genes Dev.,
ing translation of Sindbis virus subgenomic mRNA in ver&
16, 2906&2922, doi: 10.1101/gad.1020902.
tebrate and invertebrate host cells, Cell Microbiol., 15, 823&
36.
Hann, L. E., and Gehrke, L. (1995) mRNAs containing
840, doi: 10.1111/cmi.12079.
the unstructured 5′ leader sequence of alfalfa mosaic virus
21.
Carrasco, L., Sanz, M. A., and Gonzalez&Almela, E.
RNA 4 translate inefficiently in lysates from poliovirus&
(2018) The regulation of translation in alphavirus&infected
infected HeLa cells, J. Virol., 69, 4986&4993, doi: 10.1128/
cells, Viruses, 10, 70, doi: 10.3390/v10020070.
JVI.69.8.4986&4993.1995.
22.
Skabkin, M. A., Skabkina, O. V., Dhote, V., Komar, A. A.,
37.
Gallie, D. R., Sleat, D. E., Watts, J. W., Turner, P. C., and
Hellen, C. U., and Pestova, T. V. (2010) Activities of
Wilson, T. M. (1987) A comparison of eukaryotic viral 5′&
Ligatin and MCT&1/DENR in eukaryotic translation initi&
leader sequences as enhancers of mRNA expression in vivo,
ation and ribosomal recycling, Genes Dev., 24, 1787&1801,
Nucleic Acids Res., 15, 8693&8711, doi: 10.1093/nar/15.21.
doi: 10.1101/gad.1957510.
8693.
23.
Sanz, M. A., González Almela, E., and Carrasco, L.
38.
Agalarov, S., Sakharov, P. A., Fattakhova, D., Sogorin,
(2017) Translation of Sindbis Subgenomic mRNA is
E. A., and Spirin, A. S. (2014) Internal translation initia&
Independent of eIF2, eIF2A and eIF2D, Sci. Rep., 7,
tion and eIF4F/ATP&independent scanning of mRNA by
43876, doi: 10.1038/srep43876.
eukaryotic ribosomal particles, Sci. Rep.,
4,
4438,
24.
Clyde, K., and Harris, E. (2006) RNA secondary structure
doi: 10.1038/srep04438.
in the coding region of dengue virus type 2 directs transla&
39.
Yang, Z., Martens, C. A., Bruno, D. P., Porcella, S. F., and
tion start codon selection and is required for viral replica&
Moss, B. (2012) Pervasive initiation and 3′&end formation
БИОХИМИЯ том 86 вып. 9 2021
ИНИЦИАЦИЯ ТРАНСЛЯЦИИ ВИРУСНЫХ мРНК
1305
of poxvirus postreplicative RNAs, J. Biol. Chem., 287,
translation, Int. J. Biol. Macromol.,
121,
947&955,
31050&31060, doi: 10.1074/jbc.M112.390054.
doi: 10.1016/j.ijbiomac.2018.10.135.
40.
Vopálenský, V., Sýkora, M., Mělková, Z., Mašek, T., and
53.
Daughenbaugh, K. F., Fraser, C. S., Hershey, J. W., and
Posp šek, M.
(2020) Transcripts of vaccinia virus
Hardy, M. E. (2003) The genome&linked protein VPg of the
postreplicative genes do not contain a 5′ methylguanosine
Norwalk virus binds eIF3, suggesting its role in translation
cap, bioRxiv, doi: 10.1101/2020.07.15.204867.
initiation complex recruitment, EMBO J., 22, 2852&2859,
41.
Shirokikh, N. E., and Spirin, A. S. (2008) Poly(A) leader of
doi: 10.1093/emboj/cdg251.
eukaryotic mRNA bypasses the dependence of translation
54.
Hosmillo, M., Lu, J., McAllaster, M. R., Eaglesham, J. B.,
on initiation factors, Proc. Natl. Acad. Sci. USA, 105,
Wang, X., et al. (2019) Noroviruses subvert the core stress
10738&10743, doi: 10.1073/pnas.0804940105.
granule component G3BP1 to promote viral VPg&depen&
42.
Mulder, J., Robertson, M. E., Seamons, R. A., and
dent translation, Elife, 8, e46681, doi: 10.7554/eLife.46681.
Belsham, G. J. (1998) Vaccinia virus protein synthesis has
55.
Burroughs, J. N., and Brown, F. (1978) Presence of a cova&
a low requirement for the intact translation initiation factor
lently linked protein on calicivirus RNA, J. Gen. Virol., 41,
eIF4F, the cap&binding complex, within infected cells,
443&446, doi: 10.1099/0022&1317&41&2&443.
J. Virol., 72, 8813&8819, doi: 10.1128/JVI.72.11.8813&
56.
Mailliot, J., and Martin, F. (2018) Viral internal ribosomal
8819.1998.
entry sites: four classes for one goal, Wiley Interdiscip. Rev.
43.
Bablanian, R., Goswami, S. K., Esteban, M., Banerjee,
RNA, 9, e1458, doi: 10.1002/wrna.1458.
A. K., and Merrick, W. C. (1991) Mechanism of selective
57.
Yamamoto, H., Unbehaun, A., and Spahn, C. M. T. (2017)
translation of vaccinia virus mRNAs: differential role of
Ribosomal chamber music: toward an understanding of
poly(A) and initiation factors in the translation of viral and
IRES mechanisms, Trends Biochem. Sci., 42, 655&668,
cellular mRNAs, J. Virol., 65, 4449&4460, doi: 10.1128/
doi: 10.1016/j.tibs.2017.06.002.
JVI.65.8.4449&4460.1991.
58.
Jaafar, Z. A., and Kieft, J. S. (2019) Viral RNA structure&
44.
Vopálenský, V., Sýkora, M., Mašek, T., and Posp šek, M.
based strategies to manipulate translation, Nat. Rev.
(2019) Messenger RNAs of yeast virus&like elements con&
Microbiol., 17, 110&123, doi: 10.1038/s41579&018&0117&x.
tain non&templated 5′ Poly(A) leaders, and their expression
59.
Arhab, Y., Bulakhov, A. G., Pestova, T. V., and Hellen,
is independent of eIF4E and Pab1, Front. Microbiol., 10,
C. U. T. (2020) Dissemination of Internal Ribosomal Entry
2366, doi: 10.3389/fmicb.2019.02366.
Sites (IRES) between viruses by horizontal gene transfer,
45.
Dhungel, P., Cao, S., and Yang, Z. (2017) The 5′&poly(A)
Viruses, 12, 612, doi: 10.3390/v12060612.
leader of poxvirus mRNA confers a translational advantage
60.
Kwan, T., and Thompson, S. R. (2019) Noncanonical
that can be achieved in cells with impaired cap&dependent
translation initiation in eukaryotes, Cold Spring Harb.
translation, PLoS Pathog., 13, e1006602, doi: 10.1371/
Perspect. Biol., 11, a032672, doi: 10.1101/cshperspect.
journal.ppat.1006602.
a032672.
46.
Jha, S., Rollins, M. G., Fuchs, G., Procter, D. J., Hall,
61.
Jang, S. K., Krausslich, H. G., Nicklin, M. J., Duke,
E. A., et al. (2017) Trans&kingdom mimicry underlies ribo&
G. M., Palmenberg, A. C., and Wimmer, E. (1988) A seg&
some customization by a poxvirus kinase, Nature, 546,
ment of the 5′ nontranslated region of encephalomyocardi&
651&655, doi: 10.1038/nature22814.
tis virus RNA directs internal entry of ribosomes during
47.
Jan, E., Mohr, I., and Walsh, D. (2016) A cap&to&tail guide
in vitro translation, J. Virol., 62, 2636&2643, doi: 10.1128/
to mRNA translation strategies in virus&infected cells,
JVI.62.8.2636&2643.1988.
Annu. Rev. Virol., 3, 283&307, doi: 10.1146/annurev&virology&
62.
Pelletier, J., and Sonenberg, N. (1988) Internal initiation
100114&055014.
of translation of eukaryotic mRNA directed by a sequence
48.
Linero, F., Welnowska, E., Carrasco, L., and Scolaro, L.
derived from poliovirus RNA, Nature, 334, 320&325,
(2013) Participation of eIF4F complex in Junin virus infec&
doi: 10.1038/334320a0.
tion: blockage of eIF4E does not impair virus replication,
63.
Terenin, I. M., Smirnova, V. V., Andreev, D. E., Dmitriev,
Cell Microbiol.,
15,
1766&1782, doi:
10.1111/cmi.
S. E., and Shatsky, I. N. (2017) A researcher’s guide to the
12149.
galaxy of IRESs, Cell. Mol. Life Sci., 74, 1431&1455,
49.
Leen, E. N., Sorgeloos, F., Correia, S., Chaudhry, Y.,
doi: 10.1007/s00018&016&2409&5.
Cannac, F., et al. (2016) A conserved interaction between a
64.
Kozak, M. (2005) A second look at cellular mRNA
C&terminal motif in Norovirus VPg and the HEAT&1
sequences said to function as internal ribosome entry sites,
domain of eIF4G is essential for translation initiation,
Nucleic Acids Res., 33, 6593&6602, doi: 10.1093/nar/
PLoS Pathog., 12, e1005379, doi: 10.1371/journal.ppat.
gki958.
1005379.
65.
Jackson, R. J. (2013) The current status of vertebrate cellu&
50.
Chung, L., Bailey, D., Leen, E. N., Emmott, E. P.,
lar mRNA IRESs, Cold Spring Harb. Perspect. Biol., 5,
Chaudhry, Y., et al. (2014) Norovirus translation requires
a011569, doi: 10.1101/cshperspect.a011569.
an interaction between the C terminus of the genome&
66.
Thompson, S. R. (2012) So you want to know if your mes&
linked viral protein VPg and eukaryotic translation initia&
sage has an IRES? Wiley Interdiscip. Rev. RNA, 3, 697&705,
tion factor 4G, J. Biol. Chem., 289, 21738&21750,
doi: 10.1002/wrna.1129.
doi: 10.1074/jbc.M114.550657.
67.
Andreev, D. E., Terenin, I. M., Dmitriev, S. E., and
51.
Coutinho de Oliveira, L., Volpon, L., Rahardjo, A. K.,
Shatsky, I. N. (2016) Pros and cons of pDNA and mRNA
Osborne, M. J., Culjkovic&Kraljacic, B., et al.
(2019)
transfection to study mRNA translation in mammalian
Structural studies of the eIF4E&VPg complex reveal a direct
cells, Gene, 578, 1&6, doi: 10.1016/j.gene.2015.12.008.
competition for capped RNA: implications for translation,
68.
Barreau, C., Dutertre, S., Paillard, L., and Osborne, H. B.
Proc. Natl. Acad. Sci. USA,
116,
24056&24065,
(2006) Liposome&mediated RNA transfection should be
doi: 10.1073/pnas.1904752116.
used with caution, RNA, 12, 1790&1793, doi: 10.1261/rna.
52.
Khan, M. A., and Goss, D. J. (2019) Poly (A) binding pro&
191706.
tein enhances the binding affinity of potyvirus VPg to
69.
Dmitriev, S. E., Andreev, D. E., Adyanova, Z. V., Terenin,
eukaryotic initiation factor eIF4F and activates in vitro
I. M., and Shatsky, I. N. (2009) Efficient cap&dependent
БИОХИМИЯ том 86 вып. 9 2021
1306
СОРОКИН и др.
translation of mammalian mRNAs with long and highly
83.
Lulla, V., Dinan, A. M., Hosmillo, M., Chaudhry, Y.,
structured 5′&untranslated regions in vitro and in vivo,
Sherry, L., et al. (2019) An upstream protein&coding region
Mol. Biol. (Mosk.),
43,
108&113, doi:
10.1134/
in enteroviruses modulates virus infection in gut epithelial
S0026893309010154.
cells, Nat. Microbiol., 4, 280&292, doi: 10.1038/s41564&
70.
Dmitriev, S. E., Bykova, N. V., Andreev, D. E., and
018&0297&1.
Terenin, I. M. (2006) Adequate system for studying trans&
84.
Hellen, C. U., Pestova, T. V., and Wimmer, E. (1994)
lation initiation on the human retrotransposon L1 mRNA
Effect of mutations downstream of the internal ribosome
in vitro, Mol. Biol. (Mosk.), 40, 20&24, doi: 10.1134/
entry site on initiation of poliovirus protein synthesis,
S0026893306010043.
J. Virol., 68, 6312&6322, doi: 10.1128/JVI.68.10.6312&
71.
Avanzino, B. C., Jue, H., Miller, C. M., Cheung, E.,
6322.1994.
Fuchs, G., and Fraser, C. S. (2018) Molecular mechanism
85.
Sweeney, T. R., Abaeva, I. S., Pestova, T. V., and Hellen, C.
of poliovirus Sabin vaccine strain attenuation, J. Biol.
U. (2014) The mechanism of translation initiation on
Chem., 293, 15471&15482, doi: 10.1074/jbc.RA118.004913.
type
1 picornavirus IRESs, EMBO J.,
33,
76&92,
72.
Beckham, S. A., Matak, M. Y., Belousoff, M. J.,
doi: 10.1002/embj.201386124.
Venugopal, H., Shah, N., et al. (2020) Structure of the
86.
Kaminski, A., Pöyry, T. A., Skene, P. J., and Jackson, R. J.
PCBP2/stem&loop IV complex underlying translation ini&
(2010) Mechanism of initiation site selection promoted by
tiation mediated by the poliovirus type I IRES, Nucleic
the human rhinovirus 2 internal ribosome entry site,
Acids Res., 48, 8006&8021, doi: 10.1093/nar/gkaa519.
J. Virol., 84, 6578&6589, doi: 10.1128/JVI.00123&10.
73.
Chamond, N., Deforges, J., Ulryck, N., and Sargueil, B.
87.
Kafasla, P., Morgner, N., Robinson, C. V., and Jackson,
(2014) 40S recruitment in the absence of eIF4G/4A by
R. J. (2010) Polypyrimidine tract&binding protein stimu&
EMCV IRES refines the model for translation initiation on
lates the poliovirus IRES by modulating eIF4G binding,
the archetype of type II IRESs, Nucleic Acids Res., 42,
EMBO J., 29, 3710&3722, doi: 10.1038/emboj.2010.
10373&10384, doi: 10.1093/nar/gku720.
231.
74.
Kieft, J. S., Zhou, K., Jubin, R., and Doudna, J. A. (2001)
88.
Andreev, D. E., Hirnet, J., Terenin, I. M., Dmitriev, S. E.,
Mechanism of ribosome recruitment by hepatitis C IRES
Niepmann, M., and Shatsky, I. N. (2012) Glycyl&tRNA
RNA, RNA, 7, 194&206, doi: 10.1017/s1355838201001790.
synthetase specifically binds to the poliovirus IRES to acti&
75.
Petrov, A., Grosely, R., Chen, J., O’Leary, S. E., and
vate translation initiation, Nucleic Acids Res., 40, 5602&
Puglisi, J. D. (2016) Multiple parallel pathways of transla&
5614, doi: 10.1093/nar/gks182.
tion initiation on the CrPV IRES, Mol. Cell, 62, 92&103,
89.
Meerovitch, K., Svitkin, Y. V., Lee, H. S., Lejbkowicz, F.,
doi: 10.1016/j.molcel.2016.03.020.
Kenan, D. J., et al. (1993) La autoantigen enhances and
76.
Jang, C. J., and Jan, E. (2010) Modular domains of the
corrects aberrant translation of poliovirus RNA in reticulo&
Dicistroviridae intergenic internal ribosome entry site,
cyte lysate, J. Virol., 67, 3798&3807, doi: 10.1128/JVI.67.
RNA, 16, 1182&1195, doi: 10.1261/rna.2044610.
7.3798&3807.1993.
77.
Jang, S. K., Davies, M. V., Kaufman, R. J., and
90.
Hunt, S. L., Hsuan, J. J., Totty, N., and Jackson, R. J.
Wimmer, E. (1989) Initiation of protein synthesis by inter&
(1999) unr, a cellular cytoplasmic RNA&binding protein
nal entry of ribosomes into the 5′ nontranslated region of
with five cold&shock domains, is required for internal initi&
encephalomyocarditis virus RNA in vivo, J. Virol., 63,
ation of translation of human rhinovirus RNA, Genes Dev.,
1651&1660, doi: 10.1128/JVI.63.4.1651&1660.1989.
13, 437&448, doi: 10.1101/gad.13.4.437.
78.
Pilipenko, E. V., Blinov, V. M., Romanova, L. I., Sinyakov,
91.
Svitkin, Y. V., Pestova, T. V., Maslova, S. V., and Agol, V. I.
A. N., Maslova, S. V., and Agol, V. I. (1989) Conserved
(1988) Point mutations modify the response of poliovirus
structural domains in the 5′&untranslated region of picor&
RNA to a translation initiation factor: a comparison of
naviral genomes: an analysis of the segment controlling
neurovirulent and attenuated strains, Virology, 166, 394&
translation and neurovirulence, Virology, 168, 201&209,
404, doi: 10.1016/0042&6822(88)90510&7.
doi: 10.1016/0042&6822(89)90259&6.
92.
Agol, V. I., Drozdov, S. G., Ivannikova, T. A., Kolesnikova,
79.
Skinner, M. A., Racaniello, V. R., Dunn, G., Cooper, J.,
M. S., Korolev, M. B., and Tolskaya, E. A.
(1989)
Minor, P. D., and Almond, J. W. (1989) New model for the
Restricted growth of attenuated poliovirus strains in cul&
secondary structure of the
5′ non&coding RNA of
tured cells of a human neuroblastoma, J. Virol., 63, 4034&
poliovirus is supported by biochemical and genetic data
4038, doi: 10.1128/JVI.63.9.4034&4038.1989.
that also show that RNA secondary structure is important
93.
La Monica, N., and Racaniello, V. R. (1989) Differences
in neurovirulence, J. Mol. Biol.,
207,
379&392,
in replication of attenuated and neurovirulent polio&
doi: 10.1016/0022&2836(89)90261&1.
viruses in human neuroblastoma cell line SH&SY5Y,
80.
Mart nez&Salas, E., Francisco&Velilla, R., Fernandez&
J. Virol., 63, 2357&2360, doi: 10.1128/JVI.63.5.2357&
Chamorro, J., Lozano, G., and Diaz&Toledano, R. (2015)
2360.1989.
Picornavirus IRES elements: RNA structure and host pro&
94.
Guest, S., Pilipenko, E., Sharma, K., Chumakov, K., and
tein interactions, Virus Res., 206, 62&73, doi: 10.1016/
Roos, R. P. (2004) Molecular mechanisms of attenuation
j.virusres.2015.01.012.
of the Sabin strain of poliovirus type 3, J. Virol., 78, 11097&
81.
Pilipenko, E. V., Gmyl, A. P., Maslova, S. V., Svitkin, Y. V.,
11107, doi: 10.1128/JVI.78.20.11097&11107.2004.
Sinyakov, A. N., and Agol, V. I. (1992) Prokaryotic&like cis
95.
Svitkin, Y. V., Imataka, H., Khaleghpour, K.,
elements in the cap&independent internal initiation of
Kahvejian, A., Liebig, H. D., and Sonenberg, N. (2001)
translation on picornavirus RNA, Cell, 68, 119&131,
Poly(A)&binding protein interaction with elF4G stimulates
doi: 10.1016/0092&8674(92)90211&t.
picornavirus IRES&dependent translation, RNA, 7, 1743&
82.
Slobodskaya, O. R., Gmyl, A. P., Maslova, S. V., Tolskaya,
1752.
E. A., Viktorova, E. G., and Agol, V. I. (1996) Poliovirus
96.
White, J. P., Reineke, L. C., and Lloyd, R. E. (2011)
neurovirulence correlates with the presence of a cryptic
Poliovirus switches to an eIF2&independent mode of trans&
AUG upstream of the initiator codon, Virology, 221, 141&
lation during infection, J. Virol.,
85,
8884&8893,
150, doi: 10.1006/viro.1996.0360.
doi: 10.1128/JVI.00792&11.
БИОХИМИЯ том 86 вып. 9 2021
ИНИЦИАЦИЯ ТРАНСЛЯЦИИ ВИРУСНЫХ мРНК
1307
97. Kastan, J. P., Dobrikova, E. Y., Bryant, J. D., and
starting window of Theiler’s murine encephalomyelitis
Gromeier, M. (2020) CReP mediates selective translation
virus, J. Virol., 73, 3190&3196, doi: 10.1128/JVI.73.4.3190&
initiation at the endoplasmic reticulum, Sci. Adv., 6,
3196.1999.
eaba0745, doi: 10.1126/sciadv.aba0745.
111.
Gingras, A. C., Svitkin, Y., Belsham, G. J., Pause, A., and
98. Pilipenko, E. V., Blinov, V. M., Chernov, B. K., Dmitrieva,
Sonenberg, N. (1996) Activation of the translational sup&
T. M., and Agol, V. I. (1989) Conservation of the secondary
pressor 4E&BP1 following infection with encephalomy&
structure elements of the 5′&untranslated region of cardio&
ocarditis virus and poliovirus, Proc. Natl. Acad. Sci. USA,
and aphthovirus RNAs, Nucleic Acids Res., 17, 5701&5711,
93, 5578&5583, doi: 10.1073/pnas.93.11.5578.
doi: 10.1093/nar/17.14.5701.
112. Borman, A. M., and Kean, K. M. (1997) Intact eukaryotic
99. Kolupaeva, V. G., Pestova, T. V., Hellen, C. U., and
initiation factor 4G is required for hepatitis A virus internal
Shatsky, I. N. (1998) Translation eukaryotic initiation fac&
initiation of translation, Virology,
237,
129&136,
tor 4G recognizes a specific structural element within the
doi: 10.1006/viro.1997.8761.
internal ribosome entry site of encephalomyocarditis virus
113. Koirala, D., Shao, Y., Koldobskaya, Y., Fuller, J. R.,
RNA, J. Biol. Chem., 273, 18599&18604, doi: 10.1074/jbc.
Watkins, A. M., et al. (2019) A conserved RNA structural
273.29.18599.
motif for organizing topology within picornaviral internal
100. Terenin, I. M., Andreev, D. E., Dmitriev, S. E., and
ribosome entry sites, Nat. Commun.,
10,
3629,
Shatsky, I. N. (2013) A novel mechanism of eukaryotic
doi: 10.1038/s41467&019&11585&z.
translation initiation that is neither m7G&cap&, nor IRES&
114. Avanzino, B. C., Fuchs, G., and Fraser, C. S. (2017)
dependent, Nucleic Acids Res.,
41,
1807&1816,
Cellular cap&binding protein, eIF4E, promotes picor&
doi: 10.1093/nar/gks1282.
navirus genome restructuring and translation, Proc. Natl.
101. Pilipenko, E. V., Gmyl, A. P., Maslova, S. V., Belov, G. A.,
Acad. Sci. USA, 114, 9611&9616, doi: 10.1073/pnas.
Sinyakov, A. N., et al. (1994) Starting window, a distinct
1704390114.
element in the cap&independent internal initiation of
115. Tsukiyama&Kohara, K., Iizuka, N., Kohara, M., and
translation on picornaviral RNA, J. Mol. Biol., 241, 398&
Nomoto, A. (1992) Internal ribosome entry site within
414, doi: 10.1006/jmbi.1994.1516.
hepatitis C virus RNA, J. Virol.,
66,
1476&1483,
102. Kaminski, A., Howell, M. T., and Jackson, R. J. (1990)
doi: 10.1128/JVI.66.3.1476&1483.1992.
Initiation of encephalomyocarditis virus RNA translation:
116. Pestova, T. V., Shatsky, I. N., Fletcher, S. P., Jackson, R. J.,
the authentic initiation site is not selected by a scanning
and Hellen, C. U. (1998) A prokaryotic&like mode of cyto&
mechanism, EMBO J., 9, 3753&3759, doi: 10.1002/j.1460&
plasmic eukaryotic ribosome binding to the initiation
2075.1990.tb07588.x.
codon during internal translation initiation of hepatitis C
103. Pestova, T. V., Borukhov, S. I., and Hellen, C. U. (1998)
and classical swine fever virus RNAs, Genes Dev., 12, 67&
Eukaryotic ribosomes require initiation factors 1 and 1A to
83, doi: 10.1101/gad.12.1.67.
locate initiation codons, Nature,
394,
854&859,
117. Malygin, A. A., Kossinova, O. A., Shatsky, I. N., and
doi: 10.1038/29703.
Karpova, G. G. (2013) HCV IRES interacts with the 18S
104. Andreev, D. E., Fernandez&Miragall, O., Ramajo, J.,
rRNA to activate the 40S ribosome for subsequent steps of
Dmitriev, S. E., Terenin, I. M., et al. (2007) Differential
translation initiation, Nucleic Acids Res., 41, 8706&8714,
factor requirement to assemble translation initiation com&
doi: 10.1093/nar/gkt632.
plexes at the alternative start codons of foot&and&mouth
118. Quade, N., Boehringer, D., Leibundgut, M., van den
disease virus RNA, RNA, 13, 1366&1374, doi: 10.1261/
Heuvel, J., and Ban, N. (2015) Cryo&EM structure of
rna.469707.
Hepatitis C virus IRES bound to the human ribosome at
105. Pilipenko, E. V., Pestova, T. V., Kolupaeva, V. G., Khitrina,
3.9&Å resolution, Nat. Commun., 6, 7646, doi: 10.1038/
E. V., Poperechnaya, A. N., et al. (2000) A cell cycle&
ncomms8646.
dependent protein serves as a template&specific translation
119. Yamamoto, H., Collier, M., Loerke, J., Ismer, J.,
initiation factor, Genes Dev., 14, 2028&2045.
Schmidt, A., et al. (2015) Molecular architecture of the
106. Pestova, T. V., Hellen, C. U., and Shatsky, I. N. (1996)
ribosome&bound Hepatitis C Virus internal ribosomal entry
Canonical eukaryotic initiation factors determine initia&
site RNA, EMBO J., 34, 3042&3058, doi: 10.15252/embj.
tion of translation by internal ribosomal entry, Mol. Cell.
201592469.
Biol., 16, 6859&6869, doi: 10.1128/MCB.16.12.6859.
120. Hashem, Y., des Georges, A., Dhote, V., Langlois, R.,
107. Kolupaeva, V. G., Hellen, C. U., and Shatsky, I. N. (1996)
Liao, H. Y., et al. (2013) Hepatitis&C&virus&like internal
Structural analysis of the interaction of the pyrimidine
ribosome entry sites displace eIF3 to gain access to the
tract&binding protein with the internal ribosomal entry site
40S subunit, Nature,
503,
539&543, doi:
10.1038/
of encephalomyocarditis virus and foot&and&mouth disease
nature12658.
virus RNAs, RNA, 2, 1199&1212.
121. Sizova, D. V., Kolupaeva, V. G., Pestova, T. V., Shatsky,
108. Pilipenko, E. V., Gmyl, A. P., Maslova, S. V., Khitrina,
I. N., and Hellen, C. U. (1998) Specific interaction of
E. V., and Agol, V. I. (1995) Attenuation of Theiler’s
eukaryotic translation initiation factor 3 with the 5′ non&
murine encephalomyelitis virus by modifications of the
translated regions of hepatitis C virus and classical swine
oligopyrimidine/AUG tandem, a host&dependent transla&
fever virus RNAs, J. Virol., 72, 4775&4782, doi: 10.1128/
tional cis element, J. Virol., 69, 864&870, doi: 10.1128/
JVI.72.6.4775&4782.1998.
JVI.69.2.864&870.1995.
122. Jaafar, Z. A., Oguro, A., Nakamura, Y., and Kieft, J. S.
109. Pilipenko, E. V., Viktorova, E. G., Guest, S. T., Agol, V. I.,
(2016) Translation initiation by the hepatitis C virus IRES
and Roos, R. P. (2001) Cell&specific proteins regulate viral
requires eIF1A and ribosomal complex remodeling, Elife,
RNA translation and virus&induced disease, EMBO J., 20,
5, e21198, doi: 10.7554/eLife.21198.
6899&6908, doi: 10.1093/emboj/20.23.6899.
123. King, H. A., Cobbold, L. C., and Willis, A. E. (2010)
110. Pilipenko, E. V., Viktorova, E. G., Khitrina, E. V.,
The role of IRES trans&acting factors in regulating transla&
Maslova, S. V., Jarousse, N., et al. (1999) Distinct attenu&
tion initiation, Biochem. Soc. Trans., 38, 1581&1586,
ation phenotypes caused by mutations in the translational
doi: 10.1042/BST0381581.
БИОХИМИЯ том 86 вып. 9 2021
1308
СОРОКИН и др.
124. Kim, G. W., and Siddiqui, A. (2021) N6&methyladenosine
ribosome, Cell,
102,
511&520, doi:
10.1016/s0092&
modification of HCV RNA genome regulates cap&inde&
8674(00)00055&6.
pendent IRES&mediated translation via YTHDC2 recog&
139. Sasaki, J., and Nakashima, N. (2000) Methionine&inde&
nition, Proc. Natl. Acad. Sci. USA, 118, e2022024118,
pendent initiation of translation in the capsid protein of an
doi: 10.1073/pnas.2022024118.
insect RNA virus, Proc. Natl. Acad. Sci. USA, 97, 1512&
125. Robert, F., Kapp, L. D., Khan, S. N., Acker, M. G.,
1515, doi: 10.1073/pnas.010426997.
Kolitz, S., et al. (2006) Initiation of protein synthesis by
140. Pfingsten, J. S., Costantino, D. A., and Kieft, J. S. (2006)
hepatitis C virus is refractory to reduced eIF2, GTP, Met&
Structural basis for ribosome recruitment and manipula&
tRNA(i)(Met) ternary complex availability, Mol. Biol. Cell,
tion by a viral IRES RNA, Science, 314, 1450&1454,
17, 4632&4644, doi: 10.1091/mbc.e06&06&0478.
doi: 10.1126/science.1133281.
126. Terenin, I. M., Dmitriev, S. E., Andreev, D. E., and
141. Fernández, I. S., Bai, X. C., Murshudov, G., Scheres, S.
Shatsky, I. N. (2008) Eukaryotic translation initiation
H., and Ramakrishnan, V. (2014) Initiation of translation
machinery can operate in a bacterial&like mode without
by cricket paralysis virus IRES requires its translocation in
eIF2, Nat. Struct. Mol. Biol., 15, 836&841, doi: 10.1038/
the ribosome, Cell, 157, 823&831, doi: 10.1016/j.cell.2014.
nsmb.1445.
04.015.
127. Pestova, T. V., de Breyne, S., Pisarev, A. V., Abaeva, I. S.,
142. Spahn, C. M., Jan, E., Mulder, A., Grassucci, R. A.,
and Hellen, C. U. (2008) eIF2&dependent and eIF2&inde&
Sarnow, P., and Frank, J. (2004) Cryo&EM visualization of
pendent modes of initiation on the CSFV IRES: a com&
a viral internal ribosome entry site bound to human ribo&
mon role of domain II, EMBO J., 27, 1060&1072,
somes: the IRES functions as an RNA&based translation
doi: 10.1038/emboj.2008.49.
factor, Cell, 118, 465&475, doi: 10.1016/j.cell.2004.08.001.
128. Yamamoto, H., Unbehaun, A., Loerke, J., Behrmann, E.,
143. Koh, C. S., Brilot, A. F., Grigorieff, N., and Korostelev, A.
Collier, M., et al. (2014) Structure of the mammalian 80S
A. (2014) Taura syndrome virus IRES initiates translation
initiation complex with initiation factor 5B on HCV&IRES
by binding its tRNA&mRNA&like structural element in the
RNA, Nat. Struct. Mol. Biol., 21, 721&727, doi: 10.1038/
ribosomal decoding center, Proc. Natl. Acad. Sci. USA, 111,
nsmb.2859.
9139&9144, doi: 10.1073/pnas.1406335111.
129. Dmitriev, S. E., Terenin, I. M., Andreev, D. E., Ivanov,
144. Murray, J., Savva, C. G., Shin, B. S., Dever, T. E.,
P. A., Dunaevsky, J. E., et al. (2010) GTP&independent
Ramakrishnan, V., and Fernandez, I. S. (2016) Structural
tRNA delivery to the ribosomal P&site by a novel eukaryot&
characterization of ribosome recruitment and translocation
ic translation factor, J. Biol. Chem., 285, 26779&26787,
by type IV IRES, Elife, 5, e13567, doi: 10.7554/eLife.
doi: 10.1074/jbc.M110.119693.
13567.
130. Weisser, M., Schafer, T., Leibundgut, M., Bohringer, D.,
145. Muhs, M., Hilal, T., Mielke, T., Skabkin, M. A.,
Aylett, C. H. S., and Ban, N. (2017) Structural and func&
Sanbonmatsu, K. Y., et al. (2015) Cryo&EM of ribosomal
tional insights into human re&initiation complexes, Mol.
80S complexes with termination factors reveals the translo&
Cell, 67, 447&456.e447, doi: 10.1016/j.molcel.2017.06.032.
cated cricket paralysis virus IRES, Mol. Cell, 57, 422&432,
131. González&Almela, E., Williams, H., Sanz, M. A., and
doi: 10.1016/j.molcel.2014.12.016.
Carrasco, L. (2018) The initiation factors eIF2, eIF2A,
146. Pfingsten, J. S., Costantino, D. A., and Kieft, J. S. (2007)
eIF2D, eIF4A, and eIF4G are not involved in translation
Conservation and diversity among the three&dimensional
driven by hepatitis C virus IRES in human cells, Front.
folds of the Dicistroviridae intergenic region IRESes,
Microbiol., 9, 207, doi: 10.3389/fmicb.2018.00207.
J. Mol. Biol., 370, 856&869, doi: 10.1016/j.jmb.2007.04.
132. Young, D. J., Makeeva, D. S., Zhang, F., Anisimova, A. S.,
076.
Stolboushkina, E. A., et al.
(2018) Tma64/eIF2D,
147. Abaeva, I. S., Vicens, Q., Bochler, A., Soufari, H.,
Tma20/MCT&1, and Tma22/DENR recycle post&termina&
Simonetti, A., et al. (2020) The Halastavi arva virus inter&
tion 40S subunits in vivo, Mol. Cell, 71, 761&774.e765,
genic region IRES promotes translation by the simplest
doi: 10.1016/j.molcel.2018.07.028.
possible initiation mechanism, Cell Rep., 33, 108476,
133. Kim, J. H., Park, S. M., Park, J. H., Keum, S. J., and Jang,
doi: 10.1016/j.celrep.2020.108476.
S. K. (2011) eIF2A mediates translation of hepatitis C viral
148. Kerr, C. H., Wang, Q. S., Moon, K. M., Keatings, K.,
mRNA under stress conditions, EMBO J., 30, 2454&2464,
Allan, D. W., et al. (2018) IRES&dependent ribosome
doi: 10.1038/emboj.2011.146.
repositioning directs translation of a +1 overlapping ORF
134. de Breyne, S., Yu, Y., Pestova, T. V., and Hellen, C. U.
that enhances viral infection, Nucleic Acids Res., 46,
(2008) Factor requirements for translation initiation on the
11952&11967, doi: 10.1093/nar/gky1121.
Simian picornavirus internal ribosomal entry site, RNA,
149. Ren, Q., Wang, Q. S., Firth, A. E., Chan, M. M., Gouw,
14, 367&380, doi: 10.1261/rna.696508.
J. W., et al. (2012) Alternative reading frame selection
135. Lancaster, A. M., Jan, E., and Sarnow, P. (2006) Initiation
mediated by a tRNA&like domain of an internal ribosome
factor&independent translation mediated by the hepatitis C
entry site, Proc. Natl. Acad. Sci. USA, 109, E630&639,
virus internal ribosome entry site, RNA, 12, 894&902,
doi: 10.1073/pnas.1111303109.
doi: 10.1261/rna.2342306.
150. Terenin, I. M., Dmitriev, S. E., Andreev, D. E., Royall, E.,
136. Locker, N., Easton, L. E., and Lukavsky, P. J. (2007) HCV
Belsham, G. J., et al. (2005) A cross&kingdom internal
and CSFV IRES domain II mediate eIF2 release during
ribosome entry site reveals a simplified mode of internal
80S ribosome assembly, EMBO J.,
26,
795&805,
ribosome entry, Mol. Cell Biol.,
25,
7879&7888,
doi: 10.1038/sj.emboj.7601549.
doi: 10.1128/MCB.25.17.7879&7888.2005.
137. Yokoyama, T., Machida, K., Iwasaki, W., Shigeta, T.,
151. Abaeva, I. S., Pestova, T. V., and Hellen, C. U. (2016) Attach&
Nishimoto, M., et al. (2019) HCV IRES captures an
ment of ribosomal complexes and retrograde scanning dur&
actively translating 80S ribosome, Mol. Cell, 74, 1205&
ing initiation on the Halastavi arva virus IRES, Nucleic
1214.e1208, doi: 10.1016/j.molcel.2019.04.022.
Acids Res., 44, 2362&2377, doi: 10.1093/nar/ gkw016.
138. Wilson, J. E., Pestova, T. V., Hellen, C. U., and Sarnow, P.
152. Neupane, R., Pisareva, V. P., Rodriguez, C. F., Pisarev,
(2000) Initiation of protein synthesis from the A site of the
A. V., and Fernandez, I. S. (2020) A complex IRES at the
БИОХИМИЯ том 86 вып. 9 2021
ИНИЦИАЦИЯ ТРАНСЛЯЦИИ ВИРУСНЫХ мРНК
1309
5′&UTR of a viral mRNA assembles a functional 48S com&
166. Berkhout, B., Arts, K., and Abbink, T. E.
(2011)
plex via an uAUG intermediate, Elife,
9, e54575,
Ribosomal scanning on the 5′&untranslated region of the
doi: 10.7554/eLife.54575.
human immunodeficiency virus RNA genome, Nucleic
153. Gross, L., Vicens, Q., Einhorn, E., Noireterre, A.,
Acids Res., 39, 5232&5244, doi: 10.1093/nar/gkr113.
Schaeffer, L., et al. (2017) The IRES5′UTR of the dicistro&
167. de Breyne, S., Chamond, N., Décimo, D., Trabaud, M.
virus cricket paralysis virus is a type III IRES containing an
A., André, P., et al. (2012) In vitro studies reveal that differ&
essential pseudoknot structure, Nucleic Acids Res., 45,
ent modes of initiation on HIV&1 mRNA have different
8993&9004, doi: 10.1093/nar/gkx622.
levels of requirement for eukaryotic initiation factor 4F,
154. Majzoub, K., Hafirassou, M. L., Meignin, C., Goto, A.,
FEBS J., 279, 3098&3111, doi: 10.1111/j.1742&4658.2012.
Marzi, S., et al. (2014) RACK1 controls IRES&mediated
08689.x.
translation of viruses, Cell, 159, 1086&1095, doi: 10.1016/
168. Weill, L., James, L., Ulryck, N., Chamond, N.,
j.cell.2014.10.041.
Herbreteau, C. H., et al. (2010) A new type of IRES with&
155. Roberts, R., Mayberry, L. K., Browning, K. S., and
in gag coding region recruits three initiation complexes on
Rakotondrafara, A. M. (2017) The Triticum Mosaic virus 5′
HIV&2 genomic RNA, Nucleic Acids Res., 38, 1367&1381,
leader binds to both eIF4G and eIFiso4G for translation,
doi: 10.1093/nar/gkp1109.
PLoS One, 12, e0169602, doi: 10.1371/journal.pone.
169. Herbreteau, C. H., Weill, L., Décimo, D., Prévôt, D.,
0169602.
Darlix, J. L., et al. (2005) HIV&2 genomic RNA contains a
156. Jaramillo&Mesa, H., Gannon, M., Holshbach, E., Zhang,
novel type of IRES located downstream of its initiation
J., Roberts, R., et al. (2019) The Triticum Mosaic virus
codon, Nat. Struct. Mol. Biol.,
12,
1001&1007,
internal ribosome entry site relies on a picornavirus&like
doi: 10.1038/nsmb1011.
YX&AUG motif to designate the preferred translation initi&
170. Akulich, K. A., Andreev, D. E., Terenin, I. M., Smirnova,
ation site and to likely target the 18S rRNA, J. Virol., 93,
V. V., Anisimova, A. S., et al. (2016) Four translation ini&
e01705&18, doi: 10.1128/JVI.01705&18.
tiation pathways employed by the leaderless mRNA
157. Castelló, A., Franco, D., Moral López, P., Berlanga, J. J.,
in eukaryotes, Sci. Rep.,
6,
37905, doi:
10.1038/
Álvarez, E., et al. (2009) HIV&1 protease inhibits Cap& and
srep37905.
poly(A)&dependent translation upon eIF4GI and PABP cleav&
171. Andreev, D. E., Terenin, I. M., Dunaevsky, Y. E., Dmitriev,
age, PLoS One, 4, e7997, doi: 10.1371/journal.pone.0007997.
S. E., and Shatsky, I. N. (2006) A leaderless mRNA can
158. Perales, C., Carrasco, L., and Ventoso, I. (2003) Cleavage
bind to mammalian 80S ribosomes and direct polypeptide
of eIF4G by HIV&1 protease: effects on translation, FEBS
synthesis in the absence of translation initiation factors,
Lett., 533, 89&94, doi: 10.1016/s0014&5793(02)03764&x.
Mol. Cell. Biol., 26, 3164&3169, doi: 10.1128/MCB.26.8.
159. Ohlmann, T., Prévôt, D., Décimo, D., Roux, F., Garin, J.,
3164&3169.2006.
et al. (2002) In vitro cleavage of eIF4GI but not eIF4GII by
172. Tahara, S. M., Dietlin, T. A., Dever, T. E., Merrick, W. C.,
HIV&1 protease and its effects on translation in the rabbit
and Worrilow, L. M. (1991) Effect of eukaryotic initiation
reticulocyte lysate system, J. Mol. Biol., 318, 9&20,
factor 4F on AUG selection in a bicistronic mRNA, J. Biol.
doi: 10.1016/S0022&2836(02)00070&0.
Chem., 266, 3594&3601.
160. Ventoso, I., Blanco, R., Perales, C., and Carrasco, L.
173. Barrera, A., Olgu n, V., Vera Otarola, J., and López
(2001) HIV&1 protease cleaves eukaryotic initiation factor
Lastra, M. (2020) Cap&independent translation initiation
4G and inhibits cap&dependent translation, Proc. Natl.
of the unspliced RNA of retroviruses, Biochim. Biophys.
Acad. Sci. USA, 98, 12966&12971, doi: 10.1073/pnas.
Acta Gene Regul. Mech., 1863, 194583, doi: 10.1016/j.bba&
231343498.
grm.2020.194583.
161. Buck, C. B., Shen, X., Egan, M. A., Pierson, T. C., Walker,
174. Song, Y., Mugavero, J., Stauft, C. B., and Wimmer, E.
C. M., and Siliciano, R. F. (2001) The human immunode&
(2019) Dengue and Zika virus 5′ untranslated regions har&
ficiency virus type 1 gag gene encodes an internal ribosome
bor internal ribosomal entry site functions, mBio, 10,
entry site, J. Virol., 75, 181&191, doi: 10.1128/JVI.75.1.
e00459&19, doi: 10.1128/mBio.00459&19.
181&191.2001.
175. Fernández Garc a, L., Angulo, J., Ramos, H., Barrera, A.,
162. Vallejos, M., Carvajal, F., Pino, K., Navarrete, C.,
Pino, K., et al. (2020) The internal ribosome entry site of
Ferres, M., et al. (2012) Functional and structural analysis
the Dengue virus mRNA is active when cap&dependent
of the internal ribosome entry site present in the mRNA of
translation
initiation
is
inhibited,
J.
Virol.,
natural variants of the HIV&1, PLoS One, 7, e35031,
doi: 10.1128/JVI.01998&20.
doi: 10.1371/journal.pone.0035031.
176. Dorokhov, Y. L., Skulachev, M. V., Ivanov, P. A., Zvereva,
163. Brasey, A., Lopez&Lastra, M., Ohlmann, T., Beerens, N.,
S. D., Tjulkina, L. G., et al. (2002) Polypurine (A)&rich
Berkhout, B., et al. (2003) The leader of human immunod&
sequences promote cross&kingdom conservation of internal
eficiency virus type 1 genomic RNA harbors an internal
ribosome entry, Proc. Natl. Acad. Sci. USA, 99, 5301&5306,
ribosome entry segment that is active during the G2/M
doi: 10.1073/pnas.082107599.
phase of the cell cycle, J. Virol.,
77,
3939&3949,
177. Dorokhov, Y. L., Sheshukova, E. V., and Komarova, T. V.
doi: 10.1128/jvi.77.7.3939&3949.2003.
(2017) Tobamovirus 3′&terminal Gene overlap may be a
164. Smirnova, V. V., Terenin, I. M., Khutornenko, A. A.,
mechanism for within&host fitness improvement, Front.
Andreev, D. E., Dmitriev, S. E., and Shatsky, I. N. (2016)
Microbiol., 8, 851, doi: 10.3389/fmicb.2017.00851.
Does HIV&1 mRNA 5′&untranslated region bear an inter&
178. May, J., Johnson, P., Saleem, H., and Simon, A. E. (2017)
nal ribosome entry site? Biochimie,
121,
228&237,
A sequence&independent, unstructured internal ribosome
doi: 10.1016/j.biochi.2015.12.004.
entry site is responsible for internal expression of the coat
165. Svitkin, Y. V., Pause, A., and Sonenberg, N.
(1994)
protein of Turnip Crinkle virus, J. Virol., 91, e02421&16,
La autoantigen alleviates translational repression by the 5′
doi: 10.1128/JVI.02421&16.
leader sequence of the human immunodeficiency virus
179. Yuan, X., Shi, K., Meskauskas, A., and Simon, A. E.
type 1 mRNA, J. Virol., 68, 7001&7007, doi: 10.1128/
(2009) The 3′ end of Turnip crinkle virus contains a highly
JVI.68.11.7001&7007.1994.
interactive structure including a translational enhancer that
БИОХИМИЯ том 86 вып. 9 2021
1310
СОРОКИН и др.
is disrupted by binding to the RNA&dependent RNA poly&
translational enhancer of the Turnip crinkle virus (TCV)
merase, RNA, 15, 1849&1864, doi: 10.1261/rna.1708709.
bound to the eukaryotic ribosome, Biophys. J., 102, 393A,
180. Treder, K., Kneller, E. L., Allen, E. M., Wang, Z.,
doi: 10.1016/j.bpj.2011.11.2147.
Browning, K. S., and Miller, W. A. (2008) The 3′ cap&inde&
193. Miras, M., Sempere, R. N., Kraft, J. J., Miller, W. A.,
pendent translation element of Barley yellow dwarf virus
Aranda, M. A., and Truniger, V. (2014) Interfamilial
binds eIF4F via the eIF4G subunit to initiate translation,
recombination between viruses led to acquisition of a novel
RNA, 14, 134&147, doi: 10.1261/rna.777308.
translation&enhancing RNA element that allows resistance
181. Gazo, B. M., Murphy, P., Gatchel, J. R., and Browning,
breaking, New Phytol., 202, 233&246, doi: 10.1111/nph.
K. S. (2004) A novel interaction of Cap&binding protein
12650.
complexes eukaryotic initiation factor (eIF) 4F and
194. Guo, L., Allen, E. M., and Miller, W. A. (2001) Base&pair&
eIF(iso)4F with a region in the 3′&untranslated region of
ing between untranslated regions facilitates translation of
satellite tobacco necrosis virus, J. Biol. Chem., 279, 13584&
uncapped, nonpolyadenylated viral RNA, Mol. Cell, 7,
13592, doi: 10.1074/jbc.M311361200.
1103&1109, doi: 10.1016/s1097&2765(01)00252&0.
182. Wang, Z., Treder, K., and Miller, W. A. (2009) Structure of
195. Gao, F., Alekhina, O. M., Vassilenko, K. S., and Simon,
a viral cap&independent translation element that functions
A. E. (2018) Unusual dicistronic expression from closely
via high affinity binding to the eIF4E subunit of eIF4F,
spaced initiation codons in an umbravirus subgenomic
J. Biol. Chem., 284, 14189&14202, doi: 10.1074/jbc.
RNA, Nucleic Acids Res., 46, 11726&11742, doi: 10.1093/
M808841200.
nar/gky871.
183. Nicholson, B. L., Wu, B., Chevtchenko, I., and White,
196. Rakotondrafara, A. M., Polacek, C., Harris, E., and
K. A. (2010) Tombusvirus recruitment of host translational
Miller, W. A. (2006) Oscillating kissing stem&loop interac&
machinery via the
3′ UTR, RNA,
16,
1402&1419,
tions mediate 5′ scanning&dependent translation by a viral
doi: 10.1261/rna.2135210.
3′&cap&independent translation element, RNA, 12, 1893&
184. Nicholson, B. L., Zaslaver, O., Mayberry, L. K., Browning,
1906, doi: 10.1261/rna.115606.
K. S., and White, K. A. (2013) Tombusvirus Y&shaped trans&
197. Fabian, M. R., and White, K. A. (2006) Analysis of a 3′&
lational enhancer forms a complex with eIF4F and can be
translation enhancer in a tombusvirus: a dynamic model
functionally replaced by heterologous translational
for RNA&RNA interactions of mRNA termini, RNA, 12,
enhancers, J. Virol., 87, 1872&1883, doi: 10.1128/JVI.02711&12.
1304&1314, doi: 10.1261/rna.69506.
185. Stupina, V. A., Meskauskas, A., McCormack, J. C.,
198. Sarawaneeyaruk, S., Iwakawa, H. O., Mizumoto, H.,
Yingling, Y. G., Shapiro, B. A., et al. (2008) The 3′ proxi&
Murakami, H., Kaido, M., et al. (2009) Host&dependent
mal translational enhancer of Turnip crinkle virus binds to
roles of the viral 5′ untranslated region (UTR) in RNA sta&
60S ribosomal subunits, RNA,
14,
2379&2393,
bilization and cap&independent translational enhancement
doi: 10.1261/rna.1227808.
mediated by the 3′ UTR of Red clover necrotic mosaic
186. Gao, F., Kasprzak, W., Stupina, V. A., Shapiro, B. A., and
virus RNA1, Virology, 391, 107&118, doi: 10.1016/j.virol.
Simon, A. E. (2012) A ribosome&binding, 3′ translational
2009.05.037.
enhancer has a T&shaped structure and engages in a long&
199. Karetnikov, A., and Lehto, K. (2008) Translation mecha&
distance RNA-RNA interaction, J. Virol., 86, 9828&9842,
nisms involving long&distance base pairing interactions
doi: 10.1128/JVI.00677&12.
between the 5′ and 3′ non&translated regions and internal
187. Zuo, X., Wang, J., Yu, P., Eyler, D., Xu, H., et al. (2010)
ribosomal entry are conserved for both genomic RNAs of
Solution structure of the cap&independent translational
Blackcurrant reversion nepovirus, Virology, 371, 292&308,
enhancer and ribosome&binding element in the 3′ UTR of
doi: 10.1016/j.virol.2007.10.003.
Turnip crinkle virus, Proc. Natl. Acad. Sci. USA, 107, 1385&
200. Sharma, S. D., Kraft, J. J., Miller, W. A., and Goss, D. J.
1390, doi: 10.1073/pnas.0908140107.
(2015) Recruitment of the 40S ribosome subunit to the 3′&
188. Gao, F., Gulay, S. P., Kasprzak, W., Dinman, J. D., Shapiro,
untranslated region (UTR) of a viral mRNA, via the eIF4
B. A., and Simon, A. E. (2013) The kissing&loop T&shaped
complex, facilitates cap&independent translation, J. Biol.
structure translational enhancer of Pea enation mosaic virus
Chem., 290, 11268&11281, doi: 10.1074/jbc.M115.645002.
can bind simultaneously to ribosomes and a 5′ proximal hair&
201. Stupina, V. A., Yuan, X., Meskauskas, A., Dinman, J. D.,
pin, J. Virol., 87, 11987&12002, doi: 10.1128/JVI.02005&13.
and Simon, A. E. (2011) Ribosome binding to a 5′ transla&
189. Zhao, P., Liu, Q., Miller, W. A., and Goss, D. J. (2017)
tional enhancer is altered in the presence of the 3′ untrans&
Eukaryotic translation initiation factor 4G (eIF4G) coor&
lated region in cap&independent translation of turnip crin&
dinates interactions with eIF4A, eIF4B, and eIF4E in
kle virus, J. Virol., 85, 4638&4653, doi: 10.1128/JVI.00005&11.
binding and translation of the barley yellow dwarf virus 3′
202. Yoshii, M., Nishikiori, M., Tomita, K., Yoshioka, N.,
cap&independent translation element (BTE), J. Biol.
Kozuka, R., et al. (2004) The Arabidopsis cucumovirus
Chem., 292, 5921&5931, doi: 10.1074/jbc.M116.764902.
multiplication 1 and 2 loci encode translation initiation
190. Wang, Z., Parisien, M., Scheets, K., and Miller, W. A.
factors 4E and 4G, J. Virol., 78, 6102&6111, doi: 10.1128/
(2011) The cap&binding translation initiation factor,
JVI.78.12.6102&6111.2004.
eIF4E, binds a pseudoknot in a viral cap&independent
203. Gao, F., and Simon, A. E. (2016) Multiple Cis&acting ele&
translation element, Structure, 19, 868&880, doi: 10.1016/
ments modulate programmed &1 ribosomal frameshifting
j.str.2011.03.013.
in Pea enation mosaic virus, Nucleic Acids Res., 44, 878&
191. Du, Z., Alekhina, O. M., Vassilenko, K. S., and Simon, A.
895, doi: 10.1093/nar/gkv1241.
E. (2017) Concerted action of two 3′ cap&independent
204. Matsuda, D., and Dreher, T. W. (2004) The tRNA&like
translation enhancers increases the competitive strength of
structure of Turnip yellow mosaic virus RNA is a 3′&trans&
translated viral genomes, Nucleic Acids Res., 45, 9558&
lational enhancer, Virology, 321, 36&46, doi: 10.1016/
9572, doi: 10.1093/nar/gkx643.
j.virol.2003.10.023.
192. Sharma, G., Stupina, V., Pallesen, J., Shapiro, B., Simon,
205. Colussi, T. M., Costantino, D. A., Hammond, J. A.,
A., Dinman, J., and Frank, J. (2012) Cryo&electron
Ruehle, G. M., Nix, J. C., and Kieft, J. S.
(2014)
microscopy (Cryo&EM) structure of a cap&independent
The structural basis of transfer RNA mimicry and confor&
БИОХИМИЯ том 86 вып. 9 2021
ИНИЦИАЦИЯ ТРАНСЛЯЦИИ ВИРУСНЫХ мРНК
1311
mational plasticity by a viral RNA, Nature, 511, 366&369,
component of initiation factor eIF4F, J. Gen. Virol., 86,
doi: 10.1038/nature13378.
1841&1849, doi: 10.1099/vir.0.80796&0.
206. Haenni, A. L., Joshi, S., and Chapeville, F. (1982) tRNA&
221. Holden, K. L., and Harris, E. (2004) Enhancement of
like structures in the genomes of RNA viruses, Prog.
dengue virus translation: role of the 3′ untranslated region
Nucleic Acid Res. Mol. Biol., 27, 85&104, doi: 10.1016/
and the terminal 3′ stem&loop domain, Virology, 329, 119&
s0079&6603(08)60598&x.
133, doi: 10.1016/j.virol.2004.08.004.
207. Barends, S., Bink, H. H., van den Worm, S. H., Pleij,
222. Bung, C., Bochkaeva, Z., Terenin, I., Zinovkin, R.,
C. W., and Kraal, B. (2003) Entrapping ribosomes for viral
Shatsky, I. N., and Niepmann, M. (2010) Influence of the
translation: tRNA mimicry as a molecular Trojan horse,
hepatitis C virus 3′&untranslated region on IRES&depen&
Cell, 112, 123&129, doi: 10.1016/s0092&8674(02)01256&4.
dent and cap&dependent translation initiation, FEBS Lett.,
208. Matsuda, D., and Dreher, T. W. (2007) Cap& and initiator
584, 837&842, doi: 10.1016/j.febslet.2010.01.015.
tRNA&dependent initiation of TYMV polyprotein synthe&
223. Gunišová, S., Hronová, V., Mohammad, M. P., Hinnebusch,
sis by ribosomes: evaluation of the Trojan horse model for
A. G., and Valášek, L. S. (2018) Please do not recycle! Trans&
TYMV RNA translation, RNA, 13, 129&137, doi: 10.1261/
lation reinitiation in microbes and higher eukaryotes, FEMS
rna.244407.
Microbiol. Rev., 42, 165&192, doi: 10.1093/femsre/fux059.
209. Gallie, D. R., and Kobayashi, M. (1994) The role of the 3′&
224. Powell, M. L. (2010) Translational termination&reinitia&
untranslated region of non&polyadenylated plant viral
tion in RNA viruses, Biochem. Soc. Trans., 38, 1558&1564,
mRNAs in regulating translational efficiency, Gene, 142,
doi: 10.1042/BST0381558.
159&165, doi: 10.1016/0378&1119(94)90256&9.
225. Pöyry, T. A., Kaminski, A., Connell, E. J., Fraser, C. S.,
210. Barends, S., Rudinger&Thirion, J., Florentz, C., Giegé, R.,
and Jackson, R. J. (2007) The mechanism of an exception&
Pleij, C. W., and Kraal, B. (2004) tRNA&like structure reg&
al case of reinitiation after translation of a long ORF reveals
ulates translation of Brome mosaic virus RNA, J. Virol., 78,
why such events do not generally occur in mammalian
4003&4010, doi: 10.1128/jvi.78.8.4003&4010.2004.
mRNA translation, Genes Dev.,
21,
3149&3162,
211. Leathers, V., Tanguay, R., Kobayashi, M., and Gallie,
doi: 10.1101/gad.439507.
D. R. (1993) A phylogenetically conserved sequence with&
226. Meyers, G. (2007) Characterization of the sequence ele&
in viral 3′ untranslated RNA pseudoknots regulates transla&
ment directing translation reinitiation in RNA of the cali&
tion, Mol. Cell. Biol., 13, 5331&5347, doi: 10.1128/mcb.13.
civirus rabbit hemorrhagic disease virus, J. Virol., 81, 9623&
9.5331&5347.1993.
9632, doi: 10.1128/JVI.00771&07.
212. Matsuda, D., Dunoyer, P., Hemmer, O., Fritsch, C., and
227. Meyers, G. (2003) Translation of the minor capsid protein
Dreher, T. W. (2000) The valine anticodon and valylatabil&
of a calicivirus is initiated by a novel termination&depen&
ity of Peanut clump virus RNAs are not essential but provide
dent reinitiation mechanism, J. Biol. Chem., 278, 34051&
a modest competitive advantage in plants, J. Virol., 74,
34060, doi: 10.1074/jbc.M304874200.
8720&8725, doi: 10.1128/jvi.74.18.8720&8725.2000.
228. Wennesz, R., Luttermann, C., Kreher, F., and Meyers, G.
213. Gordon, K. H., Johnson, K. N., and Hanzlik, T. N. (1995)
(2019) Structure&function relationship in the “termination
The larger genomic RNA of Helicoverpa armigera stunt
upstream ribosomal binding site” of the calicivirus rabbit
tetravirus encodes the viral RNA polymerase and has a
hemorrhagic disease virus, Nucleic Acids Res., 47, 1920&
novel 3′&terminal tRNA&like structure, Virology, 208, 84&
1934, doi: 10.1093/nar/gkz021.
98, doi: 10.1006/viro.1995.1132.
229. Luttermann, C., and Meyers, G. (2009) The importance of
214. Sherlock, M. E., Hartwick, E. W., MacFadden, A., and
inter& and intramolecular base pairing for translation reini&
Kieft, J. S. (2021) Structural diversity and phylogenetic
tiation on a eukaryotic bicistronic mRNA, Genes Dev., 23,
distribution of valyl tRNA&like structures in viruses, RNA,
331&344, doi: 10.1101/gad.507609.
27, 27&39, doi: 10.1261/rna.076968.120.
230. Zinoviev, A., Hellen, C. U. T., and Pestova, T. V. (2015)
215. Poncet, D., Laurent, S., and Cohen, J. (1994) Four nucleo&
Multiple mechanisms of reinitiation on bicistronic cali&
tides are the minimal requirement for RNA recognition by
civirus mRNAs, Mol. Cell, 57, 1059&1073, doi: 10.1016/
rotavirus non&structural protein NSP3, EMBO J., 13,
j.molcel.2015.01.039.
4165&4173.
231. Powell, M. L., Leigh, K. E., Poyry, T. A., Jackson, R. J.,
216. Groft, C. M., and Burley, S. K. (2002) Recognition of
Brown, T. D., and Brierley, I. (2011) Further characterisa&
eIF4G by rotavirus NSP3 reveals a basis for mRNA circu&
tion of the translational termination&reinitiation signal of
larization, Mol. Cell, 9, 1273&1283, doi: 10.1016/s1097&
the influenza B virus segment 7 RNA, PLoS One, 6,
2765(02)00555&5.
e16822, doi: 10.1371/journal.pone.0016822.
217. Vende, P., Piron, M., Castagné, N., and Poncet, D. (2000)
232. Powell, M. L., Napthine, S., Jackson, R. J., Brierley, I.,
Efficient translation of rotavirus mRNA requires simulta&
and Brown, T. D. (2008) Characterization of the termina&
neous interaction of NSP3 with the eukaryotic translation
tion&reinitiation strategy employed in the expression of
initiation factor eIF4G and the mRNA 3′ end, J. Virol., 74,
influenza B virus BM2 protein, RNA, 14, 2394&2406,
7064&7071, doi: 10.1128/jvi.74.15.7064&7071.2000.
doi: 10.1261/rna.1231008.
218. Olsthoorn, R. C., Mertens, S., Brederode, F. T., and Bol,
233. Abaeva, I. S., Marintchev, A., Pisareva, V. P., Hellen,
J. F. (1999) A conformational switch at the 3′ end of a plant
C. U., and Pestova, T. V. (2011) Bypassing of stems versus
virus RNA regulates viral replication, EMBO J., 18, 4856&
linear base&by&base inspection of mammalian mRNAs
4864, doi: 10.1093/emboj/18.17.4856.
during ribosomal scanning, EMBO J., 30, 115&129,
219. Chen, S. C., and Olsthoorn, R. C. (2010) In vitro and in
doi: 10.1038/emboj.2010.302.
vivo studies of the RNA conformational switch in Alfalfa
234. Schepetilnikov, M., Kobayashi, K., Geldreich, A., Caranta, C.,
mosaic virus, J. Virol., 84, 1423&1429, doi: 10.1128/JVI.
Robaglia, C., et al. (2011) Viral factor TAV recruits TOR/S6K1
01443&09.
signalling to activate reinitiation after long ORF translation,
220. Krab, I. M., Caldwell, C., Gallie, D. R., and Bol, J. F.
EMBO J., 30, 1343&1356, doi: 10.1038/emboj.2011.39.
(2005) Coat protein enhances translational efficiency of
235. Schepetilnikov, M., and Ryabova, L. A. (2018) Recent dis&
Alfalfa mosaic virus RNAs and interacts with the eIF4G
coveries on the role of TOR (Target of rapamycin) signaling
БИОХИМИЯ том 86 вып. 9 2021
1312
СОРОКИН и др.
in translation in plants, Plant Physiol., 176, 1095&1105,
targets, a vaccine, and virulence, J. Phys. Chem. Lett., 11,
doi: 10.1104/pp.17.01243.
9659&9668, doi: 10.1021/acs.jpclett.0c02818.
236. Thiébeauld, O., Schepetilnikov, M., Park, H. S.,
251. Tidu, A., Janvier, A., Schaeffer, L., Sosnowski, P.,
Geldreich, A., Kobayashi, K., et al. (2009) A new plant
Kuhn, L., et al. (2020) The viral protein NSP1 acts as a
protein interacts with eIF3 and 60S to enhance virus&acti&
ribosome gatekeeper for shutting down host translation and
vated translation re&initiation, EMBO J., 28, 3171&3184,
fostering SARS&CoV&2 translation, RNA, doi: 10.1261/
doi: 10.1038/emboj.2009.256.
rna.078121.120.
237. Mancera&Mart nez, E., Dong, Y., Makarian, J., Srour, O.,
252. Shi, M., Wang, L., Fontana, P., Vora, S., Zhang, Y., et al.
Thiébeauld, O., et al. (2021) Phosphorylation of a reinitia&
(2020) SARS&CoV&2 Nsp1 suppresses host but not viral
tion supporting protein, RISP, determines its function in
translation through a bipartite mechanism, bioRxiv,
translation reinitiation, Nucleic Acids Res., 49, 6908&6924,
doi: 10.1101/2020.09.18.302901.
doi: 10.1093/nar/gkab501.
253. Lapointe, C. P., Grosely, R., Johnson, A. G., Wang, J.,
238. Skabkin, M. A., Skabkina, O. V., Hellen, C. U., and
Fernandez, I. S., and Puglisi, J. D. (2021) Dynamic competi&
Pestova, T. V. (2013) Reinitiation and other unconvention&
tion between SARS&CoV&2 NSP1 and mRNA on the human
al posttermination events during eukaryotic translation,
ribosome inhibits translation initiation, Proc. Natl. Acad. Sci.
Mol. Cell, 51, 249&264, doi: 10.1016/j.molcel.2013.05.026.
USA, 118, e2017715118, doi: 10.1073/pnas.2017715118.
239. Young, D. J., Guydosh, N. R., Zhang, F., Hinnebusch, A.
254. Huang, C., Lokugamage, K. G., Rozovics, J. M.,
G., and Green, R. (2015) Rli1/ABCE1 recycles terminating
Narayanan, K., Semler, B. L., and Makino, S. (2011)
ribosomes and controls translation reinitiation in 3′&UTRs
SARS coronavirus nsp1 protein induces template&depen&
in vivo, Cell, 162, 872&884, doi: 10.1016/j.cell.2015.07.041.
dent endonucleolytic cleavage of mRNAs: viral mRNAs
240. Brown, J. D., and Ryan, M. D. (2010) Ribosome
are resistant to nsp1&induced RNA cleavage, PLoS Pathog.,
“Skipping”: “Stop Carry On” or “StopGo” Translation. in
7, e1002433, doi: 10.1371/journal.ppat.1002433.
Recoding: Expansion of Decoding Rules Enriches Gene
255. Walsh, D., and Mohr, I. (2011) Viral subversion of the host
Expression (Atkins, J. F., and Gesteland, R. F., eds.)
protein synthesis machinery, Nat. Rev. Microbiol., 9, 860&
Springer New York, New York, NY, pp. 101&121.
875, doi: 10.1038/nrmicro2655.
241. Liu, Z., Chen, O., Wall, J. B. J., Zheng, M., Zhou, Y., et al.
256. Cantu, F., Cao, S., Hernandez, C., Dhungel, P., Spradlin,
(2017) Systematic comparison of 2A peptides for cloning
J., and Yang, Z. (2020) Poxvirus&encoded decapping
multi&genes in a polycistronic vector, Sci. Rep., 7, 2193,
enzymes promote selective translation of viral mRNAs,
doi: 10.1038/s41598&017&02460&2.
PLoS Pathog., 16, e1008926, doi: 10.1371/journal.ppat.
242. Pamudurti, N. R., Bartok, O., Jens, M., Ashwal&Fluss, R.,
1008926.
Stottmeister, C., et al. (2017) Translation of CircRNAs,
257. Decroly, E., Ferron, F., Lescar, J., and Canard, B. (2011)
Mol. Cell, 66, 9&21.e27, doi: 10.1016/j.molcel.2017.02.021.
Conventional and unconventional mechanisms for capping
243. Tagawa, T., Kopardé, V. N., and Ziegelbauer, J. M. (2021)
viral mRNA, Nat. Rev. Microbiol., 10, 51&65, doi: 10.1038/
Identifying and characterizing virus&encoded circular
nrmicro2675.
RNAs, Methods, doi: 10.1016/j.ymeth.2021.03.004.
258. Lashkevich, K. A., and Dmitriev, S. E. (2021) mRNA tar&
244. Zhao, J., Lee, E. E., Kim, J., Yang, R., Chamseddin, B.,
geting, transport and local translation in eukaryotic cells:
et al. (2019) Transforming activity of an oncoprotein&
from the classical view to a diversity of new concepts, Mol.
encoding circular RNA from human papillomavirus,
Biol., doi: 10.1134/S0026893321030080.
Nat. Commun., 10, 2300, doi: 10.1038/s41467&019&10246&5.
259. Romero&Brey, I., and Bartenschlager, R. (2014) Membra&
245. Tan, K. E., and Lim, Y. Y. (2020) Viruses join the circular
nous replication factories induced by plus&strand RNA
RNA world, FEBS J., doi: 10.1111/febs.15639.
viruses, Viruses, 6, 2826&2857, doi: 10.3390/v6072826.
246. AbouHaidar, M. G., Venkataraman, S., Golshani, A., Liu,
260. Reineke, L. C., and Lloyd, R. E. (2013) Diversion of stress
B., and Ahmad, T. (2014) Novel coding, translation, and
granules and P&bodies during viral infection, Virology, 436,
gene expression of a replicating covalently closed circular
255&267, doi: 10.1016/j.virol.2012.11.017.
RNA of 220 nt, Proc. Natl. Acad. Sci. USA, 111, 14542&
261. McCormick, C., and Khaperskyy, D. A. (2017) Translation
14547, doi: 10.1073/pnas.1402814111.
inhibition and stress granules in the antiviral immune
247. Thoms, M., Buschauer, R., Ameismeier, M., Koepke, L.,
response, Nat. Rev. Immunol., 17, 647&660, doi: 10.1038/
Denk, T., et al. (2020) Structural basis for translational
nri.2017.63.
shutdown and immune evasion by the Nsp1 protein of
262. Dzananovic, E., McKenna, S. A., and Patel, T. R. (2018)
SARS&CoV&2, Science, 369, 1249&1255, doi: 10.1126/
Viral proteins targeting host protein kinase R to evade an
science.abc8665.
innate immune response: a mini review, Biotechnol. Genet.
248. Yuan, S., Peng, L., Park, J. J., Hu, Y., Devarkar, S. C.,
Eng. Rev., 34, 33&59, doi: 10.1080/02648725.2018.1467151.
et al. (2020) Nonstructural protein 1 of SARS&CoV&2 is a
263. Alonso, M. A., and Carrasco, L. (1981) Reversion by hypo&
potent pathogenicity factor redirecting host protein syn&
tonic medium of the shutoff of protein synthesis induced by
thesis machinery toward viral RNA, Mol. Cell, 80, 1055&
encephalomyocarditis virus, J. Virol.,
37,
535&540,
1066.e1056, doi: 10.1016/j.molcel.2020.10.034.
doi: 10.1128/JVI.37.2.535&540.1981.
249. Schubert, K., Karousis, E. D., Jomaa, A., Scaiola, A.,
264. Nair, C. N. (1981) Monovalent cation metabolism and
Echeverria, B., et al. (2020) SARS&CoV&2 Nsp1 binds the
cytopathic effects of poliovirus&infected HeLa cells,
ribosomal mRNA channel to inhibit translation, Nat. Struct.
J. Virol., 37, 268&273, doi: 10.1128/JVI.37.1.268&273.1981.
Mol. Biol., 27, 959&966, doi: 10.1038/s41594&020&0511&8.
265. Dmitriev, S. E., Vladimirov, D. O., and Lashkevich, K. A.
250. Vankadari, N., Jeyasankar, N. N., and Lopes, W. J. (2020)
(2020) A quick guide to small&molecule inhibitors of
Structure of the SARS&CoV&2 Nsp1/5′&untranslated
eukaryotic protein synthesis, Biochemistry (Moscow), 85,
region complex and implications for potential therapeutic
1389&1421, doi: 10.1134/S0006297920110097.
БИОХИМИЯ том 86 вып. 9 2021
ИНИЦИАЦИЯ ТРАНСЛЯЦИИ ВИРУСНЫХ мРНК
1313
NON/CANONICAL TRANSLATION INITIATION MECHANISMS
EMPLOYED BY EUKARYOTIC VIRAL mRNAs
Review
I. I. Sorokin1,2,3, K. S. Vassilenko2, I. M. Terenin1,
N. O. Kalinina1,4, V. I. Agol1,5, and S. E. Dmitriev1,6,7*
1 Belozersky Institute of Physico Chemical Biology, Lomonosov Moscow State University,
119234 Moscow, Russia; E mail: sergey.dmitriev@belozersky.msu.ru
2 Institute of Protein Research, Russian Academy of Sciences, 142290 Pushchino, Moscow Region, Russia
3 Research Center for Molecular Mechanisms of Aging and Age Related Diseases,
Moscow Institute of Physics and Technology, 141701 Dolgoprudny, Moscow Region, Russia
4 Shemyakin-Ovchinnikov Institute of Bioorganic Chemistry, Russian Academy of Sciences, 117997 Moscow, Russia
5 Institute of Poliomyelitis, Chumakov Federal Scientific Center for Research and Development
of Immune and Biological Products of the Russian Academy of Sciences, 108819 Moscow, Russia
6 Engelhardt Institute of Molecular Biology, Russian Academy of Sciences, 119991 Moscow, Russia
7 Faculty of Bioengineering and Bioinformatics, Lomonosov Moscow State University, 119234 Moscow, Russia
Viruses exploit translation machinery of the infected cell for the synthesis of their proteins. Therefore, viral mRNAs
have to compete for ribosomes and translation factors with bulk cellular mRNAs. To win this fight, viruses adopt vari&
ous strategies, one of which is to circumvent the need for cap&binding factors. Instead, they recruit translation initia&
tion factors and ribosomes in alternative ways, either via internal ribosome binding sites (IRESs) that make translation
independent of the 5′&end altogether or via cap&independent translational enhancers (CITEs) that promote initiation
at the bare 5′&end, even if located in the 3′&untranslated regions (3′&UTRs). The viruses that use the canonical cap&
dependent ribosome recruitment can alter ribosomal scanning and start&codon recognition. The urge for genome com&
pression often gives rise to internal and overlapped open reading frames, which translation occurs by means of specific
initiation mechanisms, such as leaky scanning, 43S sliding, shunting, or coupled termination&reinitiation. The devia&
tions from the canonical initiation mechanism allow viral mRNAs to have a more relaxed dependence on the transla&
tion initiation factors, thereby providing resistance to antiviral mechanisms and cellular stress responses. Moreover,
viruses can relieve the competition for the translational machinery by inactivating individual translational factors
and/or replacing them with virus&encoded counterparts. Certain viruses even reorganize intracellular structure creat&
ing viral translational “factories”, thus spatially isolating the sites of their protein synthesis from cellular antiviral sys&
tems, and enriching them with translational components. On the other hand, such virus&specific mechanisms may
become the Achilles’ heel of a viral life cycle. A better understanding of the non&canonical mechanisms of viral mRNA
translation initiation provides additional clues to the development of new approaches in antiviral therapy.
Keywords: internal initiation of translation, cap&independent translation, VPg, 3′&CITE, TURBS&mediated reinitia&
tion, circular RNAs, translation initiation factors eIF2 and eIF4F, picornaviruses PV and EMCV, flaviviruses HCV
and DENV, lentiviruses HIV&1 and HIV&2, coronavirus SARS&CoV&2
5 БИОХИМИЯ том 86 вып. 9 2021