БИОХИМИЯ, 2021, том 86, вып. 9, с. 1380 - 1392
УДК 577.23
ТРАНСЛЯЦИОННЫЙ АКТИВАТОР Mss51p ДРОЖЖЕЙ
И БЕЛОК ZMYND17 ЧЕЛОВЕКА -
ОБЩНОСТЬ ПРОИСХОЖДЕНИЯ, РАЗЛИЧИЕ ФУНКЦИЙ
© 2021
М.В. Балева, У.Е. Пиунова, И.В. Чичерин,
Д.Г. Красавина, С.А. Левицкий*, П.А. Каменский
Московский государственный университет имени М.В.Ломоносова, биологический факультет,
кафедра молекулярной биологии, 119234 Москва, Россия; электронная почта: sergey.levitskii@yandex.ru
Поступила в редакцию 18.05.2021
После доработки 19.07.2021
Принята к публикации 19.07.2021
Трансляция в митохондриях современных эукариот, несмотря на сходство с биосинтезом белка у бактерий,
имеет ряд особенностей. Одной из таких уникальных черт является необходимость координации трансля
ции отдельных митохондриальных мРНК, кодирующих субъединицы комплексов цепи окислительного
фосфорилирования, с трансляцией других компонентов этих комплексов в цитозоле. В митохондриях пе
карских дрожжей Saccharomyces cerevisiae такая координация осуществляется посредством системы бел
ков - трансляционных активаторов, преимущественно взаимодействующих с 5′ нетранслируемыми облас
тями митохондриальных мРНК. В митохондриях человека подобной системы не обнаружено, хотя и выяв
лен один трансляционный активатор TACO1. В данной работе мы изучили влияние на митохондриальную
трансляцию в клетках человека делеции гена ZMYND17, кодирующего ортолог дрожжевого трансляционно
го активатора Mss51p. Нам удалось продемонстрировать, что делеция ZMYND17 не влияет на трансляцию в
митохондриях, однако снижает активность цитохром с'оксидазы и увеличивает количество свободной
F1 субъединицы АТФ синтазы. Помимо этого, мы изучили эволюционную историю Mss51p и ZMYND17 и
выявили путь расхождения функций этих ортологичных белков.
КЛЮЧЕВЫЕ СЛОВА: митохондрии, трансляция, активаторы трансляции, регуляция трансляции.
DOI: 10.31857/S0320972521090104
ВВЕДЕНИЕ
хондрии с использованием особого аппарата
транслокации. Тем не менее митохондрии сов
Митохондрии являются облигатными орга
ременных организмов, как правило, имеют свой
неллами большинства эукариотических клеток,
сравнительно небольшой геном, а также аппа
выполняющими множество важнейших функ
раты его поддержания, транскрипции и транс
ций. Помимо обеспечения клеток энергией пу
ляции.
тём синтеза АТФ в результате окислительного
Несмотря на общую схожесть процессов
фосфорилирования, митохондрии участвуют в
трансляции у бактерий и митохондрий, аппарат
образовании FeS кластеров, метаболизме липи
биосинтеза белка в этих органеллах имеет ряд
дов, аминокислот и нуклеотидов, регуляции
существенных отличий от аппарата митохонд
апоптоза, а также и во многих других процессах.
риальной трансляции [2]. В первую очередь сле
Согласно общепринятой эндосимбиотической
дует отметить существенно большее содержание
теории, митохондрии произошли путём погло
белка относительно рРНК в митохондриальных
щения их предка, родственного современным
рибосомах, предположительно, обусловленное
α протеобактериям, архееподобным предшест
замещением функций отдельных участков
венником эукариот [1]. В ходе эволюции подав
рРНК синтезируемыми в цитозоле белками.
ляющее большинство генов предка митохонд
Кроме этого, митохондриальные рибосомы
рий элиминировались или были перенесены в
строго ассоциированы с внутренней мембраной
ядро. Таким образом, большинство митохонд
митохондрий [3]. Важной особенностью мито
риальных белков кодируется в ядре, синтезиру
хондриальной трансляции является необходи
ется в цитозоле, а затем импортируется в мито
мость её точной взаиморегуляции с биосинте
зом митохондриально адресованных белков в
Принятые сокращения: 5′ НТО - 5′ нетранслируе
цитозоле для обеспечения правильных стехио
мая область; CIV - комплекс IV цитохром c оксидазы.
метрических соотношений новосинтезируемых
* Адресат для корреспонденции.
и импортируемых белков, обуславливающих
1380
РАЗЛИЧИЕ ФУНКЦИЙ ОРТОЛОГОВ Mss51p И ZMYND17
1381
корректную сборку комплексов и суперкомп
Ключевым компонентом системы регуляции
лексов электрон транспортной цепи на внут
трансляции мРНК COX1 у S. cerevisiae является
ренней мембране митохондрий. По всей види
четвёртый трансляционный активатор - бе
мости, в ходе эволюции механизмы такой тон
лок Mss51p. Его функционирование осущест
кой регуляции биосинтеза белка в митохондри
вляется по принципу обратной связи. Mss51p
ях возникали и развивались параллельно и неза
изначально взаимодействует с 5′ НТО и кодиру
висимо у разных групп эукариот [4]. В наиболь
ющей частью мРНК COX1, опосредуя биосинтез
шей степени особенности митохондриальной
соответствующего белка, а также непосред
трансляции и её регуляции изучены у двух объ
ственно с новосинтезируемым полипепти
ектов - пекарских дрожжей Saccharomyces cere'
дом Cox1p [12]. По завершении трансляции свя
visiae и млекопитающих.
занный с Cox1p Mss51p включается в состав ин
Геном современных митохондрий представ
термедиата сборки комплекса цитохром c окси
ляет собой кольцевую или линейную молекулу
дазы (комплекса IV CIV), содержащего ряд дру
ДНК, несущую несколько генов, кодирующих
гих факторов - регуляторов. В случае остановки
преимущественно субъединицы комплексов це
корректной сборки CIV на этой стадии
пи окислительного фосфорилирования, гены
Mss51p остаётся связанным с интермедиатом и
РНК митохондриальных рибосом, а также гены
не способен заново участвовать в активации
тРНК. У пекарских дрожжей S. cerevisiae геном
трансляции мРНК COX1 [13]. Если же на внут
митохондрий содержит гены семи белков (субъ
ренней мембране митохондрий присутствует
единиц комплексов электрон транспортной це
достаточное количество необходимых для сбор
пи), одного белка малой субъединицы митохон
ки субъединиц CIV, Mss51p диссоциирует из ин
дриальной рибосомы, гены 15S и 21S рРНК ми
термедиата и становится доступным для следу
тохондриальных рибосом, ген РНК компонента
ющего раунда активации трансляции мРНК
митохондриальной РНКазы P, а также 24 ге
COX1. Помимо этого, Mss51p является гем свя
на тРНК [5]. Регуляция экспрессии митохонд
зывающим белком, причём недостаток гема
риального генома дрожжей в основном осущес
приводит к значительным нарушениям биосин
твляется на пост транскрипционном уровне [6].
теза Cox1p [14]. По всей видимости, связывание
Матричные РНК митохондрий дрожжей имеют
гема белком Mss51p является необходимым ус
протяжённые
5′ нетранслируемые облас
ловием для ассоциации упоминавшегося интер
ти (НТО), с которыми взаимодействуют участ
медиата сборки CIV и не играет значительной
ники сложной системы регуляции трансляции -
роли в активации трансляции мРНК COX1 [7,
трансляционные активаторы. Подробно систе
15]. Таким образом, Mss51p играет ключевую
ма трансляционных активаторов S. cerevisiae
роль в регуляции трансляции Cox1p в митохонд
рассмотрена в недавнем обзоре [7]. Особенно
риях, определяя интенсивность биосинтеза это
изящно осуществляется регуляция трансляции
го белка в зависимости от эффективности сбор
мРНК COX1. Для этой мРНК обнаружено
ки цитохром c оксидазы.
4 трансляционных активатора: Pet309р, Mss51р,
В геноме митохондрий млекопитающих за
Mam33р и Mss116p. Содержащий 12 пентатри
кодировано 13 белков, являющихся субъедини
копептидных повторов белок внутренней мемб
цами комплексов цепи окислительного фосфо
раны Pet309p взаимодействует с
5′ НТО
рилирования I, III, IV и V [16]. Это гены
мРНК COX1, причём такое взаимодействие яв
COB (апоцитохром b), COX1,2,3 (субъединицы
ляется абсолютно необходимым для трансляции
цитохром c оксидазы), ATP6,8 (субъединицы
этой мРНК [8]. Помимо этого, Pet309p стабили
АТФ синтазы), а также ND1,2,3,4,4L,5,6 (субъ
зирует предшественника мРНК COX1 [9]. Также
единицы NADH дегидрогеназы), кодируемые
с 5′ НТО мРНК COX1 взаимодействует актива
одиннадцатью мРНК [17]. Трансляция соответ
тор Mam33p, помимо этого участвующий в регу
ствующих мРНК в митохондриях млекопитаю
ляции сборки митохондриальных рибосом [10].
щих, по всей видимости, регулируется отлич
Третий трансляционный фактор мРНК COX1,
ным от S. cerevisiae способом. В первую очередь
белок Mss166p, относится к семейству DEAD
это обусловлено практически полным отсут
box хеликаз. В условиях холодового шока он яв
ствием 5′ НТО у митохондриальных мРНК мле
ляется фактором элонгации транскрипции, а в
копитающих. Более того, добавление всего
нормальных условиях - фактором сплайсинга
лишь нескольких нуклеотидов к 5′ концу мРНК
митохондриальных пре мРНК. Помимо этого,
существенно снижает эффективность образова
он взаимодействует с Pet309p, причём делеция
ния инициаторных комплексов на них in vitro
кодирующего Mss116p гена приводит к отсут
[18]. Недавние структурные исследования, про
ствию Pet309p в митохондриях, что существенно
ведённые с помощью криоэлектронной микро
снижает эффективность трансляции COX1 [11].
скопии, показали, что важную роль в связыва
БИОХИМИЯ том 86 вып. 9 2021
1382
БАЛЕВА и др.
нии безлидерной мРНК малой субъединицей
ния [25]. В более позднем исследовании, прове
митохондриальной рибосомы играет рибосом
дённом на лабораторных животных, нокаутных
ный PPR белок mS39, располагающийся у мес
по гену ZMYND17, было показано, что, несмот
та входа мРНК. Важно, что контакт мРНК
ря на нормальное развитие таких мышей, у них
с mS39, по всей видимости, не является струк
наблюдались морфологические и функцио
турно специфичным, а также не может быть за
нальные нарушения митохондрий мышц. Кро
висимым от последовательности, поскольку
ме того, у нокаутных по ZMYND17 мышей сред
сколько либо значимого консенсуса в 11 мито
него возраста отмечены сниженная производи
хондриальных мРНК не обнаруживается, как и
тельность аэробных упражнений, плохая усвоя
значимых вторичных структур в 5′ фланговых
емость глюкозы и инсулинорезистентность. Ав
областях мРНК [19, 20]. Предполагается, что это
торы предположили, что ZMYND17 является
взаимодействие обусловлено частым появлени
стресс индуцируемым метаболическим регуля
ем нуклеотида U во втором положении кодонов
тором, поддерживающим целостность митохон
всех мРНК, начиная с седьмого кодона. Воз
дрий, отсутствие которого приводит к наруше
можно, наличие часто повторяющихся U явля
ниям метаболизма глюкозы во всем организ
ется своего рода мишенью для связывания PPR
ме [26]. Интересно, что в другой работе на сход
доменами и образования инициаторного комп
ных нокаутных по ZMYND17 мышах были полу
лекса [19]. Однако эти данные не объясняют, ка
чены другие результаты. Оказалось, что лишен
ким именно образом осуществляется регуляция
ные ZMYND17 мыши были устойчивы к набору
трансляции различных мРНК, а также то, как
веса на высокожировой диете, обладали повы
осуществляется взаимосвязь биосинтеза мито
шенной скоростью метаболизма глюкозы, уве
хондриально закодированных субъединиц ком
личенной чувствительностью к инсулину и ус
плексов цепи окислительного фосфорилирова
коренным β окислением жирных кислот [27].
ния с трансляцией других субъединиц в цито
В последующем исследовании той же группы
золе.
авторов на мышиной модели мышечной дист
Отсутствие 5′ НТО, казалось бы, отвергает
рофии Дюшенна было показано, что удаление
возможность существования у млекопитающих
гена ZMYND17 приводит к увеличению погло
системы трансляционных активаторов, сходных
щения кислорода миофибриллами, а также сни
с таковой у S. cerevisiae. Однако в 2009 году был
жению гистологической патологии. Делеция ге
идентифицирован первый трансляционный ак
на, кодирующего ортолог Mss51p, снижала
тиватор в митохондриях человека - TACOI [21].
обусловленные заболеванием дефекты митохон
Авторам указанной работы удалось продемон
дриального дыхания и увеличивала устойчи
стрировать, что мутации в гене этого белка в
вость к усталости, однако не увеличивала силу
клетках пациента с синдромом Лея приводят к
мышц [28].
существенному снижению эффективности
Таким образом, ортолог гена трансляцион
трансляции COX1 в митохондриях. При этом
ного активатора Mss51p S. cerevisiae у человека,
эффективность биосинтеза COX1 восстанавли
белок ZMYND17, несмотря на митохондриаль
валась при крайне слабом уровне экспрессии
ную локализацию, по всей видимости, имеет от
экзогенного TACOI, а также ингибировалась
личную от дрожжевого белка функцию. В дан
при сверхэкспрессии кодирующего TACOI ге
ной работе для сравнительной функциональной
на [21]. Тем не менее молекулярные механизмы
характеристики этих белков мы решили оценить
влияния TACOI на трансляцию COX1 остаются
влияние делеции гена ZMYND17 в линии клеток
неизученными, хотя и показана взаимосвязь му
HeLa человека на митохондриальную трансля
таций в гене этого белка с тяжёлыми митохонд
цию и функциональность митохондрий, а также
риальными заболеваниями [22, 23].
проследить эволюционную историю Mss51p и
Кроме этого, методами биоинформатики
ZMYND17.
было предсказано, что белок человека с неизве
стной функцией, ZMYND17, является ортоло
гом уже упоминавшегося трансляционного ре
МАТЕРИАЛЫ И МЕТОДЫ
гулятора S. cerevisiae Mss51p [24]. При дальней
шем изучении было продемонстрировано, что
Штаммы и линии клеток, среды для культиви>
этот белок локализован в митохондриях, коди
рования. В работе использовали штамм
рующий его ген, преимущественно экспресси
Escherichia coli TOP10 OneShot («Invitrogen»,
руется в скелетной мускулатуре, а подавление
США), культивируемый в среде LB, а также ад
его экспрессии приводит к увеличению уровня
гезионную линию клеток HeLa человека (ATCC
клеточной АТФ, увеличению эффективности
CCL 2, «ATCC», США), культивируемую в сре
гликолиза и окислительного фосфорилирова
де DMEM (Dulbecco’s Modified Eagle’s Medium)
БИОХИМИЯ том 86 вып. 9 2021
РАЗЛИЧИЕ ФУНКЦИЙ ОРТОЛОГОВ Mss51p И ZMYND17
1383
Использованные в работе нуклеотиды
Наименование
Последовательность 5′-3′
Назначение
MSS51 3Fwd
CACCgTCCACGGTCCCGGCGACGA
сборка sgRNA 3
MSS51 3Rev
AAACTCGTCGCCGGGACCGTGGAc
сборка sgRNA 3
MSS51 17Fwd
CACCgCCTTGGATGATAATGTTCC
сборка sgRNA 17
MSS51 17Rev
AAACGGAACATTATCATCCAAGGc
сборка sgRNA 17
ZMYND 1Fwd
CCTGGGTCTGAGAGACTGG
анализ клонов на прохождение редактирования
ZMYND 1Rev
CTGTACTCCCTCTCCACCTTC
анализ клонов на прохождение редактирования
Примечание. Серым выделены участки для создания липких концов, соответствующих образуемым эндонуклеазой BbsI.
с глюкозой (4,5 г/л) и аланил глутамином
сортирирующей цитофлуометрической системы
(«ПанЭко», Россия).
FACS Aria SORP («Beckton Dickinson», США).
Плазмидные векторы и олигонуклеотиды. Для
После подсчёта клеток в камере Горяева 100 кле
получения делеции гена ZMYND17 использова
ток помещали в 10 мл DMEM и высевали на 96
ли плазмиду pCas9 ires EGFP, содержащую ге
луночный планшет по 100 мкл в лунку. Далее
ны РНК направляемой эндонуклеазы Cas9 и зе
клетки пересевали на 12 луночный планшет,
лёного флуоресцирующего белка (EGFP), раз
культивировали до 50-70% конфлюентности,
делённые IRES под контролем CMV промото
выделяли ДНК и проверяли на наличие делеции
ра, полученную ранее [29]. Плазмида pU6 gRNA
с помощью заранее подобранной и протестиро
была любезно предоставлена доктором Скряби
ванной пары олигонуклеотидов (таблица).
ным, Университет Мюнстера, Германия [30].
Анализ митохондриальной трансляции in vivo.
Использованные в работе олигонуклеотиды
Для одного анализа использовали ~106 клеток.
приведены в таблице.
Клетки промывали раствором PBS (1,7 мМ
Делеция гена ZMYND17. Для получения ли
KH2PO4, 5,2 мМ Na2HPO4, 150 мМ NaCl, pH 7,4),
нии клеток HeLa c делецией в гене ZMYND17
добавляли среду DMEM без метионина, содер
были получены векторы, содержащие гены двух
жащую 10% диализованной сыворотки крупного
одиночных направляющих РНК (sgRNA) под
рогатого скота и 5 мМ циклогексимида, и инку
контролем промотора U6. Для этого олигонук
бировали при 37 °C в атмосфере 5% CO2 в тече
леотиды, соответствующие sgRNA 3 и 17 (таб
ние 15 мин. Далее к клеткам добавляли 0,1 мкКю
лица), отжигали попарно друг на друга, фосфо
метионина («Perkin Elmer», США) и инкубиро
рилировали полинуклеотидкиназой (PNK,
вали 45 мин при 37 °C в атмосфере 5% CO2. Реак
«ThermoFisher Scientific», США), следуя реко
цию мечения останавливали добавлением хо
мендациям производителя, а затем лигировали
лодного L метионина до 4 мМ и пуромицина до
в предварительно гидролизованные эндонукле
30 мкг/мл. Клетки промывали раствором PBS,
азой BbsI («ThermoFisher Scientific») плазмид
диссоциировали 0,25% ным раствором Трип
ные векторы pU6 gRNA. Лигазными смесями
син EDTA («ПанЭко», Россия) и центрифугиро
трансформировали компетентные клетки E. coli.
вали 4 мин при 400 g. Клетки промывали раство
После отбора трансформантов и выделения
ром PBS, а затем лизировали ультразву
плазмид корректность сборки векторов под
ком («Branson Scientific», США) в PBS. По 25 мкг
тверждали секвенированием по Сэнгеру («Ев
суммарного белка разделяли в 18% ном денату
роген», Россия).
рирующем ПААГ. Гель окрашивали Кумасси, вы
Клетки HeLa трансфицировали плазмидами,
сушивали на приборе Gel Dryer System («Hoefer»,
которые содержали компоненты системы
Германия) при 80 °C в течение часа. Продукты
CRISPR/Cas9 (2 плазмиды на основе pU6
митохондриальной трансляции визуализирова
gRNA, содержавших гены sgRNA 3 и 17, pCas9
ли радиоавтографически на приборе Storm865
ires EGFP) при помощи реагента Lipofectamine
(«GE Healthcare», США). Анализ распределения
3000 («Invitrogen», США), следуя рекомендаци
продуктов митохондриальной трансляции про
ям производителя. Через 48 ч трансфицирован
водили с помощью программного обеспечения
ные клетки анализировали с помощью системы
ImageJ («NIH», США).
мультифотонной и конфокальной микроскопии
Измерение скорости поглощения кислорода.
Nikon A1 MP+ («Nikon», Япония) и проводили
Поглощение клетками кислорода определяли
отбор флуоресцирующих клеток с помощью
полярографически при помощи электрода
БИОХИМИЯ том 86 вып. 9 2021
1384
БАЛЕВА и др.
Кларка на приборе Oxygraph Plus («Hansatech»,
тохром с оксидазы выражали в единицах актив
Великобритания) при 37 °C в среде DMEM. Для
ности (U) на мг митохондриального белка, где
каждого измерения использовали ~4 × 106 кле
одна единица активности окисляет 1 мкмоль
ток. Для установления базального уровня дыха
ферроцитохрома c в минуту.
ния измерения проводили в суспензии клеток
Blue>Native>электрофорез. Митохондрии ре
на протяжении 5 мин, затем в ячейку добавляли
суспендировали в буфере для солюбилиза
разобщитель СCCP до концентрации 10 мкМ
ции (50 мМ имидазол, 50 мМ NaCl, 2 мМ 6 ами
для измерения истинного дыхания; измерения
ногексановая кислота, 1 мМ EDTA; рН 7,0) до
проводили ещё 2 мин, после чего активность
конечной концентрации митохондриального
цитохром с оксидазы ингибировали добавлени
белка 10 мкг/мкл. Далее добавляли 20% ный ди
ем KCN до 1 мМ. Эксперименты проводили в
гитонин (в расчёте 6 мг дигитонина на 1 мг ми
трёх независимых повторах. Скорость поглоще
тохондриального белка) и инкубировали 15 мин
ния кислорода клетками высчитывалась как
на льду. Суспензию митохондрий центрифуги
производная функции, выражающей зависи
ровали в течение 1 ч при 25 000 g и 4 °С. К супер
мость концентрации кислорода от времени.
натанту добавляли 50% ный глицерин (в расчё
Выделение митохондрий. Митохондрии вы
те 1 мкл/2,4 мкл дигитонина) и 5% ный Кумас
деляли из ~2 × 107 клеток. Клетки ресуспендиро
си G 250 (в расчёте 1 мкл/2 мкл детергента),
вали в 2 мл охлажденного RSB буфера (10 мМ
центрифугировали 5 мин при 25 000 g и наноси
NaCl, 1,5 мМ MgCl2, 10 мМ Tris HCl pH, 7,5),
ли на 4-10% ный Blue Native полиакриламид
переносили в 7 мл гомогенизатор Даунса и ин
ный гель, согласно ранее опубликованному
кубировали 5 мин на льду. Клетки лизировали
протоколу [31]. Электрофоретическое разделе
семью ударами и немедленно добавляли
ние проводили в течение 30 мин при постоян
1,455 мл 2,5× MS буфера (525 мМ маннитола,
ном напряжении 75 В, используя катодный бу
175 мМ сахарозы, 2,5 мМ EDTA, 12,5 мМ Tris
фер, содержащий 7,5 мМ имидазол, 50 мМ
HCl, pH 7,5). Лизат клеток центрифугировали
Tricine, 0,02% Кумасси G 250, pH 7,0, а затем
5 мин при 1300 g и 4 °C. Митохондрии осаждали
1,5 ч при постоянном напряжении 125 В, ис
центрифугированием в течение 15 мин при
пользуя катодный буфер, содержащий 7,5 мМ
17 000 g и 4 °C. Концентрацию митохондриаль
имидазол, 50 мМ Tricine, 0,002% Кумасси G 250,
ного белка измеряли методом Бредфорда.
pH 7,0. В качестве анодного буфера использова
Измерение активности комплекса IV. В каче
ли 25 мМ имидазол HCl, рН 7,0.
стве субстрата для измерения активности комп
Измерение активностей комплекса I и АТФ>
лекса IV использовали раствор восстановленно
синтазы в геле. Активность НАДН дегидрогена
го цитохрома c. Для его приготовления 2,7 мг су
зы в геле анализировали, согласно ранее опуб
хого цитохрома с («Sigma Aldrich», США) раст
ликованному протоколу [32]. Кратко, Blue
воряли в 1 мл воды, после чего добавляли 5 мкл
Native гель после электрофореза инкубировали
0,1 М DTT и инкубировали 15-30 минут при
при комнатной температуре в растворе, содер
комнатной температуре. Исходный раствор раз
жащем 100 мM Tris HCl, pH 7,4, 1 мг/мл NBT
бавляли в 20 раз и измеряли разницу поглоще
(нитросиний тетразолий) и 0,14 мМ НАДН, до
ния A550/A565. Соотношение A550/A565 должно
появления специфической окраски. Обсчёт
быть 10-20. Для измерения активности 1 мкг
распределения активности по суперкомплексам
митохондрий, растворенных в 40 мкл буфера,
проводили с использованием программы
содержащего 10 мМ Tris HCl, pH 7,0 и 250 мМ
ImageJ. Активность комплекса V (АТФ синта
сахарозы, добавляли в 180 мкл буфера, содержа
зы) исследовали непосредственно в геле, сог
щего 10 мМ Tris HCl, 125 мМ KCl, pH 7,0; мито
ласно ранее опубликованному протоколу [32].
хондрии пермеабилизовали добавлением 1 мМ
Гель инкубировали в буфере, содержащем
додецилмальтозида. К полученной суспензии
35 мM Tris HCl, pH 7,8, 270 мM глицин, 14 мM
добавляли 20 мкл раствора субстрата и измеряли
MgSO4, 5 мM ATФ и 0,2% Pb(NO3)2 при 37 °С
поглощение цитохрома с при 550 нм каждые 10 с
при постоянном помешивании до проявления
в течение 3 мин в планшетном спектрофотомет
характерной окраски. Реакцию останавливали
ре («Tecan», Швейцария). Реакцию ингибирова
инкубацией геля в 1 M растворе глицина.
ли добавлением 1 мкл 1 M KCN, специфически
блокирующем комплекс IV, и продолжали изме
рение в тех же временных интервалах. При рас
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
чётах скорость изменения поглощения после
добавления KCN вычитали из скорости измене
Получение линии клеток HeLa c делецией в ге>
ния поглощения без KCN для исключения вли
не ZMYND17. Для получения линии клеток HeLa
яния активности комплекса III. Активность ци
c делецией в гене ZMYND17 (далее
-
БИОХИМИЯ том 86 вып. 9 2021
РАЗЛИЧИЕ ФУНКЦИЙ ОРТОЛОГОВ Mss51p И ZMYND17
1385
ΔZMYND17) была использована система
Количественный анализ эффективности транс
CRISPR/Cas9, которая позволила направленно
ляции проводили по результатам шести незави
внести в геном двуцепочечные разрывы с после
симых экспериментов (по 3 эксперимента для
дующей их репарацией с помощью негомоло
каждого из полученных клонов). Согласно ре
гичного соединения концов. Делетируемый
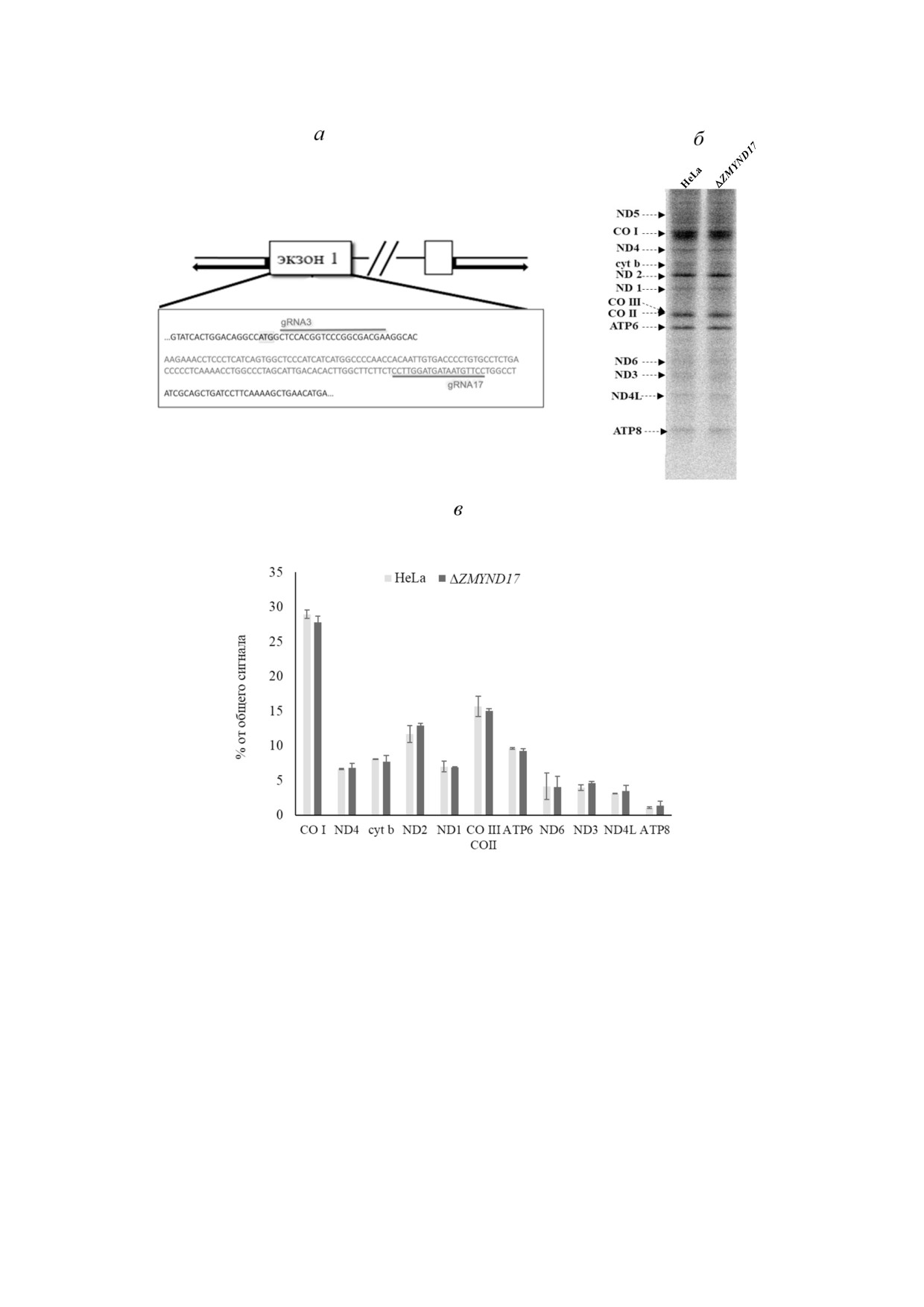
зультатам количественного анализа, делеция в
участок выбирали, учитывая следующие усло
гене ZMYND17 не приводила к значимым изме
вия: а) делеция должна возникать в одном из
нениям эффективности трансляции ни одного
первых экзонов; б) для предотвращения возник
из 13 митохондриально кодируемых белков.
новения в отредактированном гене альтернатив
Анализ скорости поглощения кислорода и ак>
ных стартовых кодонов исходный стартовый ко
тивности цитохром c>оксидазы в клетках с деле>
дон должен сохраняться; в) длина делетируемого
цией гена ZMYND17. Для того чтобы выяснить,
участка должна быть не кратна 3 для того, чтобы
влияет ли делеция гена ZMYND17 на митохонд
обеспечить сбой рамки считывания и невозмож
риальную функцию, мы измерили скорость пог
ность синтеза «укороченной» формы белка;
лощения кислорода в нокаутных линиях и клет
г) делеция должна возникать в участке, содержа
ках дикого типа. Измерение скорости поглоще
щемся во всех возможных изоформах мРНК,
ния кислорода проводили поляриграфически с
возникающих в результате альтернативного
использованием электрода Кларка. Измеряли
сплайсинга. Для получения клонов с нефункцио
как базальное клеточное дыхание, так и истин
нальным белком ZMYND17 в качестве мишени
ное, определяемое в присутствии разобщите
для sgRNA был выбран участок первого экзона
ля СССР (карбонилцианид м хлорфенилгидра
соответствующего гена (рис 1, а). Подбор нап
зона). Последнее значение отражает максималь
равляющих последовательностей одиночных
но возможное для исследуемого образца погло
гидовых РНК осуществляли с помощью он
щение кислорода, не зависящее от протонного
лайн сервиса genscript.com. Гены, кодирующие
градиента на внутренней мембране митохонд
комплементарные мишени участки sgRNA, кло
рий. Для нормирования результатов до измере
нировали в составе плазмидного вектора pU6
ния подсчитывали количество клеток, скорость
gRNA. После трансфекции клеток HeLa компо
поглощения выражали в нМ/106 клеток/мин.
нентами системы CRISPR/Cas9, отбора транс
На рис. 2, а представлены обобщённые резуль
фицированных клеток и их клонирования
таты по данным четырёх независимых экспери
из потомства трансфицированных моноклонов
ментов.
выделяли ДНК и оценивали эффективность ре
Согласно полученным нами данным, уро
дактирования с помощью ПЦР. Полученные в
вень базального дыхания у клеток с делецией в
ходе ПЦР фрагменты, соответствующие по дли
гене ZMYND17 не отличался от такового у кле
не ожидаемым в результате корректного редак
ток исходной линии HeLa. Тем не менее уровень
тирования обоих аллелей, выделяли, после чего
истинного дыхания, измеряемого при разобще
определяли их нуклеотидную последователь
нии работы электрон транспортной цепи и
ность. В результате секвенирования таких фраг
электрохимического градиента с помощью
ментов были отобраны 2 клона, содержавшие
СССР, у клеток исходной линии был больше
делеции в первом экзоне гена ZMYND17 протя
на ~27%. Последнее может быть обусловлено
жённостью в 137 нуклеотидов, которые приво
сниженной активностью цитохром c оксидазы у
дили к сдвигу рамки считывания и образованию
клеток с делецией.
стоп кодона через 40 нуклеотидов после места
Для проверки этого предположения мы
сдвига рамки (рис 1, а).
спектрофотометрически измерили активность
Делеция в гене ZMYND17 не влияет на эффек>
CIV в изолированных митохондриях из клеток
тивность трансляции в митохондриях. После по
исходной линии HeLa и ΔZMYND17 (рис. 2, б).
лучения линий клеток с делецией в ге
Действительно, согласно полученным нами
не ZMYND17, приводящей к отсутствию возмож
данным, активность цитохром c оксидазы в ми
ности синтеза полноценного белка, мы оценили
тохондриях клеток ΔZMYND17 была снижена в
влияние такой делеции на эффективность транс
среднем на 23% от таковой в митохондриях кле
ляции в митохондриях. Для этого цитозольная
ток исходной линии HeLa.
трансляция блокировалась добавлением цикло
Распределение активности НАДН>дегидроге>
гексимида, после чего к клеткам в среде без ме
назы в суперкомплексах цепи окислительного
тионина добавляли L [S35] метионин. Реакцию
фосфорилирования в митохондриях клеток
останавливали добавлением холодного метио
ΔZMYND17 и исходной линии HeLa. Ранее было
нина и пуромицина, анализ включения радиоак
показано, что организация отдельных комплек
тивной метки проводили после разделения про
сов дыхательной цепи в структуры более высо
дуктов трансляции в 18% ном ПААГ (рис. 1, б).
кого порядка - суперкомплексы - может влиять
БИОХИМИЯ том 86 вып. 9 2021
1386
БАЛЕВА и др.
Рис. 1. Делеция гена ZMYND17 не влияет на эффективность трансляции в митохондриях человека. а - Cхема редактиро
вания ZMYND17 для получения нефункциональных генов, gRNA3 и gRNA17 - отмечены комплементарные участки sgRNA,
серым цветом выделена последовательность, удаленная из генома в результате редактирования. б - Радиоавтограф разде
лённых продуктов митохондриальной трансляции в клетках исходной линии HeLa и клетках с делецией в ге
не ZMYND17 (ΔZMYND17). Стрелками указаны продукты трансляции. Эксперимент проводился в трёх независимых био
логических повторах для каждого из двух полученных клонов, представлен результат типичного эксперимента. в - Резуль
тат количественной оценки эффективности трансляции отдельных белков. Планки погрешностей отражают среднее зна
чение и стандартное отклонение (M ± SD) по результатам шести независимых экспериментов
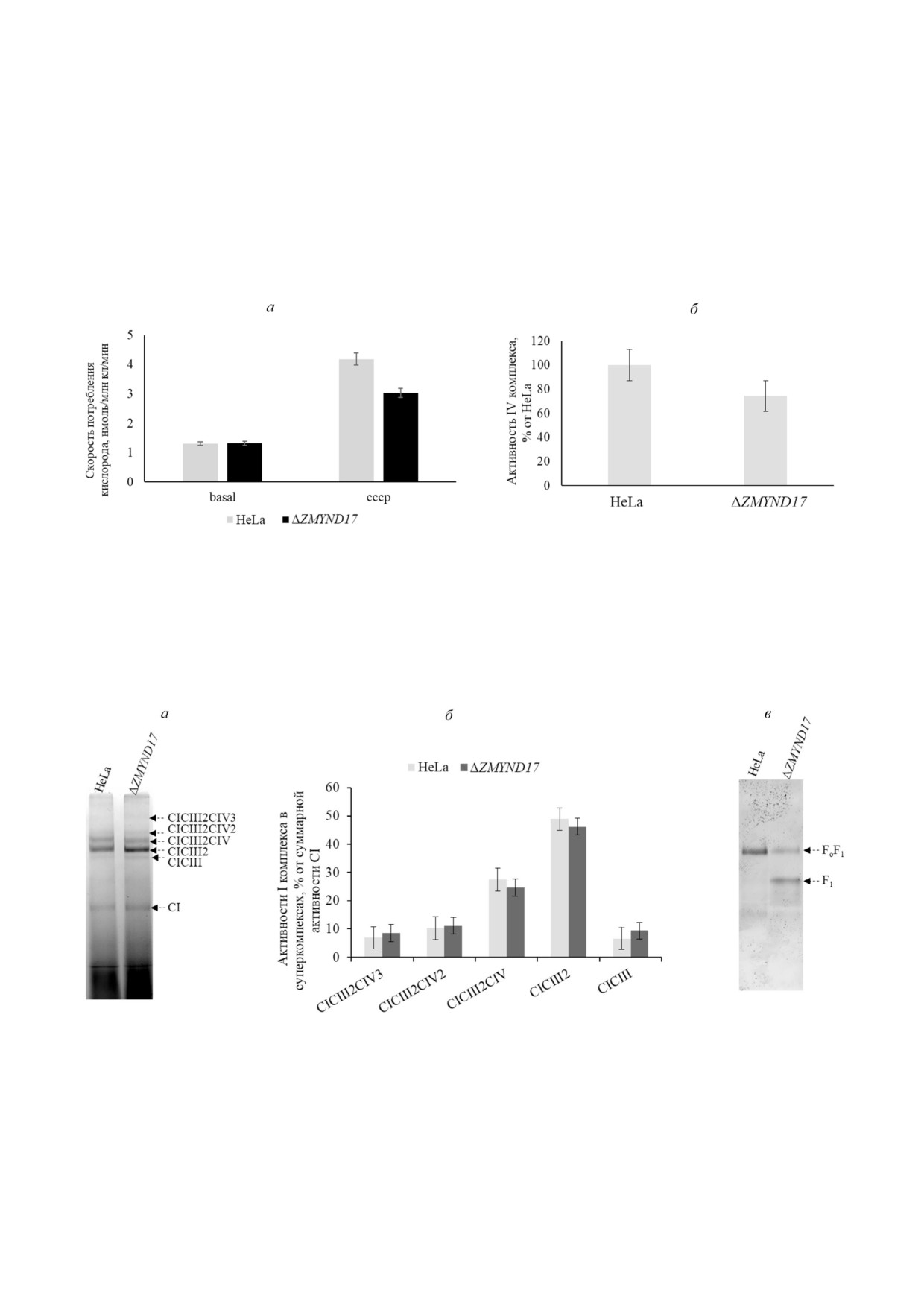
на их активность [33]. Таким образом, наблюда
ндрии из клеток исходной линии HeLa и линии
емые нами снижения активности комплекса IV
с делецией в гене ZMYND17, после чего супер
в митохондриях клеток ΔZMYND17 могут быть
комплексы были разделены с помощью Blue
обусловлены изменениями состава суперкомп
Native электрофореза с последующим анализом
лексов внутренней мембраны митохондрий дан
активности комплекса I, который является ко
ной клеточной линии. Для проверки данного
ровым для всех суперкомплексов (рис. 3, а).
предположения нами были выделены митохо
Согласно полученным нами данным, сущест
БИОХИМИЯ том 86 вып. 9 2021
РАЗЛИЧИЕ ФУНКЦИЙ ОРТОЛОГОВ Mss51p И ZMYND17
1387
венных различий в составе суперкомплексов и
ZMYND17 на функциональность митохондрий,
распределения активности НАДН дегидрогена
было показано, что митохондрии таких клеток
зы между суперкомплексами различного поряд
имеют морфологические дефекты, а именно,
ка не обнаружено (рис. 3, б).
снижение количества крист [26]. Помимо этого,
Анализ активности в геле АТФ>синтазы в ми>
имеется ряд противоречивых данных, свиде
тохондриях клеток ΔZMYND17 и клеток исходной
тельствующих об увеличении клеточной про
линии HeLa. В одной из работ, направленной на
дукции АТФ при делеции ZMYND17 [27] или же
изучение влияния подавления экспрессии гена
её снижении [26]. Мы решили проанализиро
Рис. 2. Делеция гена ZMYND17 приводит к снижению истинного дыхания клеток и уменьшению активности цитохром c
оксидазы. а - Скорость потребления кислорода клетками с делецией в гене ZMYND17 и клетками исходной линии HeLa.
Скорость потребления кислорода измеряли поляриграфически с использованием электрода Кларка. basal - Базальный
уровень поглощения кислорода при 37 °С; СССР - уровень поглощения кислорода при добавлении разобщителя СССР.
Планки погрешностей отражают среднее значение и стандартное отклонение (M ± SD) по результатам четырёх независи
мых экспериментов. б - Активность цитохром c оксидазы в митохондриях клеток с делецией в гене ZMYND17 и клеток
исходной линии HeLa. Активность измеряли спектрофотометрически по снижению поглощения при 550 нм. Планки пог
решностей отражают среднее значение и стандартное отклонение (M ± SD) по результатам пяти независимых экспери
ментов
Рис. 3. Активности НАДН дегидрогеназы и АТФ синтазы митохондрий клеток исходной линий HeLa и ΔZMYND17 в ге
ле после Blue Native электрофореза. Изолированные митохондрии из клеток исходной линии HeLa и ΔZMYND17 (по
100 мкг) солюбилизировали дигитонином, осветленные лизаты разделяли на 4-10% ном Blue Native ПААГ. а - Окраши
вание на активность НАДН дегидрогеназы (CI), стрелками обозначены суперкомплексы различной стехиометрии.
Представлен результат типичного эксперимента. б - Количественная оценка распределения активности CI по супер
комплексам различного стехиометрического состава. Планки погрешностей отражают среднее значение и стандартное
отклонение (M ± SD) по результатам трёх независимых экспериментов. в - Анализ активности АТФ синтазы в геле пос
ле Blue Native электрофореза. FоF1 - АТФ синтаза, F1 - матриксный домен фермента
БИОХИМИЯ том 86 вып. 9 2021
1388
БАЛЕВА и др.
вать субъединичный состав АТФ синтазы в ми
trahens) и таксона Ichthyosporea (Sphaeroforma
тохондриях из клеток исходной линии HeLa и
arctica) и представителю Choanoflagellata
линии с делецией в гене ZMYND17. Оказалось,
(Monosiga brevicollis). При помощи алгоритма
что в митохондриях клеток ΔZMYND17 количе
Mafft было получено множественное выравни
ство полного FoF1 фермента снижено относи
вание отобранных последовательностей. На
тельно такового в митохондриях дикого типа, в
рис. 4, а представлено дерево гомологичных
то время как существенно увеличено количество
белков, построенное методом Maximum likeli
свободной F1 субъединицы.
hood в программе MEGA 7.0.21, укоренённое в
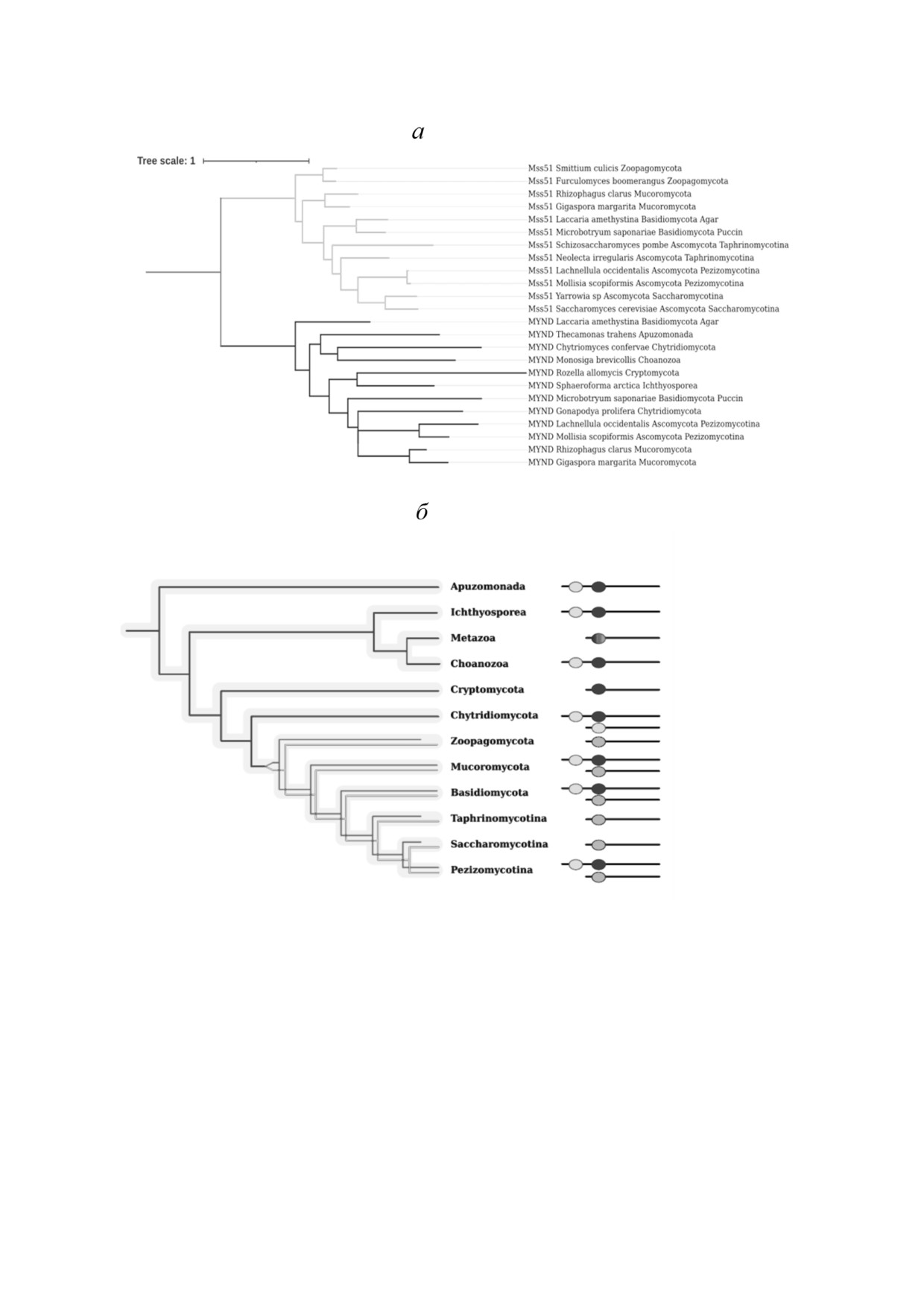
Биоинформатический анализ эволюции бел>
среднюю точку и визуализированное при помо
ков Mss51p и ZMYND17. Белок Mss51p S. cere'
щи сервиса ITOL.
visiae, предположительно, является ортологом
На рис. 4, б схематично изображена эволю
белка ZMYND17 человека [24], однако подроб
ционная история белков, гомологичных Mss51p
ное изучение эволюционного происхождения
и ZMYND17 (слева), а также доменная архитек
этих белков не проводилось. Мы решили про
тура белков, характерная для различных групп
следить эволюцию этих полипептидов с по
(справа). Вероятно, белок общего предка групп
мощью методов биоинформатики. Глобальное
Apusomonadida и Opisthokonta имел 2 домена
парное выравнивание с использованием алго
zf Mynd (на рис. 4, б обозначены чёрными ова
ритма Needleman Wunsch первичных структур
лами). Основываясь на анализе последователь
дрожжевого белка Mss51p (NCBI RefSeq:
ностей одного белка Sphaeroforma arctica, предс
NP_013304.1) и белка ZMYND17 челове
тавителя Ichthyosporea, и одного белка Monosiga
ка (NCBI RefSeq: NP_001019764.1) показало,
brevicollis, представителя Choanoflagellata (един
что они имеют всего 19% идентичных амино
ственные найденные белки из этих групп, гомо
кислот (94/504). Белок Mss51p содержит одно
логичные исследуемым), можно предположить,
именный домен, а ZMYND17 - домен zf MYND,
что в рано дивергировавших ветвях клады Holo
относящиеся к суперсемейству TRASH (Pfam
zoa гомологичные исследуемым белки сохраняют
ID: CL0175). Суперсемейство объединяет доме
также 2 домена zf Mynd. Далее в процессе эво
ны, содержащие консервативные остатки цис
люции один из доменов zf Mynd был потерян,
теина, включая домены типа «цинковый палец»,
причём точно установить, какой из zf Mynd до
в том числе zf Mss51 (Pfam ID: PF13824) и
менов утерян в ходе нашего анализа не удалось.
zf MYND (Pfam ID: PF01753). В ходе биоинфор
Таким образом, согласно результатам нашего
матического анализа, проведённого с использо
исследования, можно предположить, что белки
ванием алгоритмов BLAST на сайте NCBI и веб
ZMYND17 человека и Mss51p S. cerevisiae
действительно имеют общее эволюционное
мологичные дрожжевому Mss51p и ZMYND17
происхождение, однако нетривиальную эволю
человека, были найдены в транслированных ге
ционную историю, включающую дупликацию
номах представителей всех супергрупп эукари
гена предкового белка с последующей редукци
от (Archaeplastida, Excavata, «SAR», Unikonta),
ей одной из его копий и различные перестройки
что может указывать на то, что последний об
доменных архитектур. Таким образом, ортоло
щий предок эукариот также имел белок, гомо
гичные белки ZMYND17 и Mss51p имеют раз
логичный исследуемым.
личные функциональные домены и, по всей ви
Далее внимание было сосредоточено на су
димости, выполняют различные функции.
пергруппе Unikonta, а именно на группе Obazoa,
объединяющей таксоны Breviatea, Apusomona
dida и Opisthokonta, к последнему из которых
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
относятся и S. cerevisiae, и Homo sapiens. Белки,
гомологичные Mss51p и ZMYND17, были най
Биосинтез белка в митохондриях, несмотря
дены в транслированных геномах различных
на очевидное сходство с бактериальной транс
представителей группы Opisthokonta и трансли
ляцией, имеет ряд уникальных особенностей,
рованном геноме одного представителя Apuso
возникших в ходе эволюции эукариот. К таким
monadida - Thecamonas trahens. На основании
особенностям можно отнести отличия в белко
анализа этих белковых последовательностей
вом составе митохондриальных рибосом, изме
был восстановлен предположительный сцена
нения в структуре рРНК, неканонические
рий эволюции данных белков. Для этого были
функции факторов инициации трансляции и
выбраны 24 последовательности гомологичных
другие [2, 34]. По всей видимости, такие эволю
белков, принадлежащих представителям раз
ционные изменения обусловлены не только пе
личных групп царства Грибов, а также предста
реносом множества генов митохондриальных
вителям таксона Apusomonadida (Thecamonas
белков в ядро и заменой некоторых функций
БИОХИМИЯ том 86 вып. 9 2021
РАЗЛИЧИЕ ФУНКЦИЙ ОРТОЛОГОВ Mss51p И ZMYND17
1389
Рис. 4. Биоинформатический анализ белков гомологичных Mss51p и ZMYND17. а - Дерево гомологичных белков. Клада,
объединяющая белки, содержащие домен Mss51, выделена светло серым; белки, содержащие домен zf MYND - черным,
точка укоренения - серым. б - Схема эволюционной истории гомологичных Mss51p и ZMYND17 белков. Чёрные ветви -
ген архаичного белка, не претерпевший дупликации. Серая и светло серая ветви - две независимые копии гена, возник
шие в результате дупликации. Чёрные и светло серые овалы - домены zf Mynd, серые овалы - домены zf Mss51. На дере
ве выделяются две клады: клада белков, содержащих домен zf Mss51 (включает и дрожжевой белок Mss51p), и клада бел
ков, содержащих домен zf Mynd. Первая клада включает только белки представителей царства грибов, в то время как во
второй кладе присутствуют как белки грибов, так и видов других групп. Такая топология дерева гомологичных белков го
ворит о дупликации гена предкового белка, произошедшей внутри клады грибов после дивергенции с группой Holozoa
митохондриальных рРНК синтезируемыми в
рии кодируемых в ядре белков митохондрий.
цитозоле белками, но и необходимостью стро
Для осуществления такой координации у дрож
гой взаимокоординации митохондриальной
жей S. cerevisiae имеется система трансляцион
трансляции с синтезом и импортом в митохонд
ных активаторов, которые представляют собой
БИОХИМИЯ том 86 вып. 9 2021
1390
БАЛЕВА и др.
группу белков, регулирующих трансляцию от
гулятором трансляции, однако тем или иным
дельных митохондриальных мРНК [7, 35].
образом участвует в регуляции метаболической
Особенностью митохондриального биосин
активности митохондрий. Ещё одним интерес
теза белка у млекопитающих является отсут
ным результатом стало исследование активнос
ствие 5′ НТО у митохондриальных мРНК. Ис
ти АТФ синтазы в геле. Оказалось, что при де
ходя из этого факта, предполагалось, что систе
леции гена ZMYND17 в митохондриях снижает
мы, подобной трансляционным активаторам
ся количество FoF1 фермента и накапливается
дрожжей, у млекопитающих существовать не
свободная F1 субъединица. Подобный эффект
может, поскольку регуляция биосинтеза белка в
нередко наблюдается при нарушении баланса
митохондриях S. cerevisiae в значительной степе
синтеза митохондриально и ядерно закодиро
ни обусловлена взаимодействиями с
5′
ванных белков, например, при делеции третьего
НТО мРНК. Однако в митохондриях человека
фактора инициации трансляции [29]. Логично
был выявлен белок TACOI, являющийся акти
предположить, что увеличение количества сво
ватором трансляции мРНК COI. Механизм его
бодной F1 субъединицы приведёт к усилению
действия пока не изучен, однако достоверно по
гидролиза этим ферментом АТФ. Это может
казано его влияние именно на процесс трансля
привести к компенсационному увеличению
ции отдельной мРНК [21]. Помимо этого, у че
синтеза АТФ полноразмерной FoF1 АТФ синта
ловека найден ортолог дрожжевого Mss51p, бе
зой, что позволит снизить эффект ингибирова
лок ZMYND17 [24]. В ряде работ, посвящённых
ния электрон транспортной цепи высоким
его изучению, были получены противоречивые
трансмембранным потенциалом. Последнее, в
данные. Согласно одним авторам, подавление
свою очередь, должно приводить к увеличению
кодирующего его гена приводило к увеличению
скорости поглощения кислорода, что не подтве
клеточного АТФ и повышению скорости мета
рждается полученными нами данными
болизма глюкозы [25]. В то же время данные
(рис. 2, а). Вероятно, отсутствие увеличения
других исследователей показывают, что делеция
скорости потребления кислорода обусловлено
этого гена, напротив, приводит к снижению эф
тем, что, помимо накопления свободной F1
фективности метаболизма глюкозы, изменению
субъединицы, наблюдается и снижение количе
морфологии митохондрий и увеличению резис
ства полноразмерного FoF1 фермента. Это мо
тентности к инсулину [26].
жет приводить к недостаточности активности
Основываясь на перечисленных фактах, мы
АТФ синтазы для снижения трансмембранного
решили выяснить, участвует ли ортолог Mss51p
потенциала.
белок ZMYND17 в регуляции трансляции в ми
Наконец, мы решили изучить эволюцион
тохондриях клеток человека. Для этого мы про
ную историю Mss51p и ZMYND17, чтобы попы
вели функциональную делецию гена ZMYND17,
таться выяснить, почему продукты ортологич
внеся с помощью системы CRISPR/Cas9 деле
ных генов выполняют, очевидно, различные
цию в первый кодирующий экзон. Получив та
функции. Согласно полученным нами результа
кую линию клеток с делеций, мы проанализиро
там, исследуемые белки имеют общее эволюци
вали эффективность трансляции отдельных
онное происхождение, однако нетривиальную
мРНК в митохондриях. Как оказалось, отсут
эволюционную историю, включающую дупли
ствие белка ZMYND17 не повлияло на эффек
кацию гена предкового белка с последующей
тивность биосинтеза белка в митохондриях.
редукцией одной из его копий и различные пе
После этого мы проанализировали функцио
рестройки доменных архитектур. Таким обра
нальность митохондрий в линии клеток с деле
зом, полученные нами данные однозначно ука
цией, измерив скорость потребления кислоро
зывают на различие функций Mss51p и
да, а также активности цитохром c оксидазы,
ZMYND17 в митохондриях дрожжей и человека
НАДН дегидрогеназы и АТФ синтазы. Соглас
соответственно. По всей видимости, ZMYND17
но полученным нами данным, в митохондриях
является своего рода метаболическим регулято
клеток с делецией ZMYND17 отмечено сниже
ром митохондрий, однако механизм его
ние активности цитохром c оксидазы на ~25%
действия нуждается в дальнейшем изучении.
относительно клеток исходной линии HeLa.
Причём такое снижение не сказывается на ба
зальном уровне потребления клетками кислоро
Финансирование. Работа выполнена при под
да, однако проявляется при разобщении работы
держке Российского фонда фундаментальных
электрон транспортной цепи и электрохими
исследований (грант № 18 29 07002) (практи
ческого градиента. Наши данные хорошо согла
ческая часть), а также в рамках государственно
суются с результатами работы Fujita et al. [26] и
го задания МГУ, тема 24 2 21 (биоинформати
указывают на то, что ZMYND17 не является ре
ческая часть).
БИОХИМИЯ том 86 вып. 9 2021
РАЗЛИЧИЕ ФУНКЦИЙ ОРТОЛОГОВ Mss51p И ZMYND17
1391
Благодарности. Работа частично выполнена
Конфликт интересов. Авторы заявляют об от
на научном оборудовании, закупленном в рам
сутствии конфликта интересов в финансовой
ках реализации Программы развития МГУ име
или какой либо иной сфере.
ни М.В. Ломоносова. Авторы статьи - участни
Соблюдение этических норм. Настоящая
ки коллектива Научно образовательной школы
статья не содержит описания каких либо иссле
МГУ «Молекулярные технологии живых систем
дований с участием людей или животных в каче
и синтетическая биология».
стве объектов.
СПИСОК ЛИТЕРАТУРЫ
1.
Lazcano, A., and Peretó, J. (2021) Prokaryotic symbiotic
thesis of Cox1 to assembly of cytochrome c oxidase in
consortia and the origin of nucleated cells: a critical review
Saccharomyces cerevisiae mitochondria, Mol. Biol. Cell, 20,
of Lynn Margulis hypothesis, BioSystems,
204,
4371 4380, doi: 10.1091/mbc.E09 06 0522.
doi: 10.1016/j.biosystems.2021.104408.
14.
Soto, I. C., Fontanesi, F., Myers, R. S., Hamel, P., and
2.
Levitskii, S. A., Baleva, M. V., Chicherin, I. V.,
Barrientos, A. (2012) A heme sensing mechanism in the
Krasheninnikov, I. A., and Kamenski, P. A. (2020) Protein
translational regulation of mitochondrial cytochrome c
biosynthesis in mitochondria: past simple, present perfect,
oxidase biogenesis, Cell Metab.,
16,
801813,
future indefinite, Biochem., 85, 257 263, doi: 10.1134/
doi: 10.1016/j.cmet.2012.10.018.
S0006297920030013.
15.
Khalimonchuk, O., Bestwick, M., Meunier, B., Watts,
3.
Kuzmenko, A. V., Levitskii, S. A., Vinogradova, E. N.,
T. C., and Winge, D. R. (2010) Formation of the redox
Atkinson, G. C., Hauryliuk, V., et al. (2013) Protein
cofactor centers during cox1 maturation in yeast
biosynthesis in mitochondria, Biochemistry, 78, 855 866.
cytochrome oxidase, Mol. Cell. Biol., 30, 10041017,
4.
Al Faresi, R. A. Z., Lightowlers, R. N., Chrzanowska
doi: 10.1128/mcb.00640 09.
Lightowlers, Z. M. A. (2019) Mammalian mitochondrial
16.
Scheffler, I. E. (2007) Mitochondria: Second Edition, John
translation revealing consequences of divergent evolution,
Wiley and Sons, doi: 10.1002/9780470191774.
Biochem. Soc. Trans., 47, 14291436, doi: 10.1042/
17.
Gissi, C., Iannelli, F., and Pesole, G. (2008) Evolution of
BST20190265.
the mitochondrial genome of Metazoa as exemplified by
5.
Foury, F., Roganti, T., Lecrenier, N., and Purnelle, B.
comparison of congeneric species, Heredity (Edinb.), 101,
(1998) The complete sequence of the mitochondrial
301 320, doi: 10.1038/hdy.2008.62.
genome of Saccharomyces cerevisiae, FEBS Lett., 440, 325
18.
Christian, B. E., Spremulli, L. L. (2010) Preferential selec
331, doi: 10.1016/S0014 5793(98)01467 7.
tion of the 5′ terminal start codon on leaderless mRNAs by
6.
Lipinski, K. A., Kaniak Golik, A., and Golik, P. (2010)
mammalian mitochondrial ribosomes, J. Biol. Chem., 285,
Maintenance and expression of the S. cerevisiae mitochon
28379 28386, doi: 10.1074/jbc.M110.149054.
drial genome - from genetics to evolution and systems
19.
Kummer, E., Leibundgut, M., Rackham, O., Lee, R. G.,
biology, Biochim. Biophys. Acta,
1797,
10861098,
Boehringer, D., et al. (2018) Unique features of mam
doi: 10.1016/j.bbabio.2009.12.019.
malian mitochondrial translation initiation revealed by
7.
Derbikova, K. S., Levitsky, S. A., Chicherin, I. V.,
cryo EM, Nature, 560, 263 267, doi: 10.1038/s41586 018
Vinogradova, E. N., and Kamenski, P. A. (2018) Activation
0373 y.
of yeast mitochondrial translation: who is in charge?
20.
Jones, C. N., Wilkinson, K. A., Hung, K. T., Weeks, K. M.,
Biochemistry (Moscow),
83,
8797, doi:
10.1134/
and Spremulli, L. L. (2008) Lack of secondary structure
S0006297918020013.
characterizes the 5′ ends of mammalian mitochondrial
8.
Zamudio Ochoa, A., Camacho Villasana, Y., Garc a
mRNAs, RNA, 14, 862 871, doi: 10.1261/rna.909208.
Guerrero, A. E., Pérez Mart nez, X. (2014) The Pet309
21.
Weraarpachai, W., Antonicka, H., Sasarman, F., Seeger, J.,
pentatricopeptide repeat motifs mediate efficient binding
Schrank, B., et al. (2009) Mutation in TACO1, encoding a
to the mitochondrial COX1 transcript in yeast, RNA Biol.,
translational activator of COX I, results in cytochrome c
11, 953 967, doi: 10.4161/rna.29780.
oxidase deficiency and late onset Leigh syndrome, Nat.
9.
Manthey, G. M., and McEwen, J. E. (1995) The product of
Genet., 41, 833 837, doi: 10.1038/ng.390.
the nuclear gene PET309 is required for translation of
22.
Richman, T. R., Spahr, H., Ermer, J. A., Davies, S. M. K.,
mature mRNA and stability or production of intron con
Viola, H. M., et al. (2016) Loss of the RNA binding pro
taining RNAs derived from the mitochondrial COX1 locus
tein TACO1 causes late onset mitochondrial dysfunction
of Saccharomyces cerevisiae, EMBO J., 14, 4031 4043,
in mice, Nat. Commun., 7, doi: 10.1038/ncomms11884.
doi: 10.1002/j.1460 2075.1995.tb00074.x.
23.
Sferruzza, G., Del Bondio, A., Citterio, A., Vezzulli, P.,
10.
Hillman, G. A., and Henry, M. F. (2019) The yeast protein
Guerrieri, S., et al. (2021) U fiber leukoencephalopathy
Mam33 functions in the assembly of the mitochondrial
due to a novel mutation in the TACO1 gene, Neurol. Genet.,
ribosome, J. Biol. Chem., 294, 9813 9829, doi: 10.1074/
7, e573, doi: 10.1212/nxg.0000000000000573.
jbc.RA119.008476.
24.
Szklarczyk, R., Wanschers, B. F. J., Cuypers, T. D.,
11.
De Silva, D., Poliquin, S., Zeng, R., Zamudio Ochoa, A.,
Esseling, J. J., Riemersma, M., et al. (2012) Iterative
Marrero, N., et al. (2017) The DEAD box helicase Mss116
orthology prediction uncovers new mitochondrial proteins
plays distinct roles in mitochondrial ribogenesis and
and identifies C12orf62 as the human ortholog of COX14,
mRNA specific translation, Nucleic Acids Res., 45, 6628
a protein involved in the assembly of cytochrome c oxidase,
6643, doi: 10.1093/nar/gkx426.
Genome Biol., 13, R12, doi: 10.1186/gb 2012 13 2 r12.
12.
Perez Martinez, X., Broadley, S. A., and Fox, T. D. (2003)
25.
Moyer, A. L., and Wagner, K. R. (2015) Mammalian
Mss51p promotes mitochondrial Cox1p synthesis and
Mss51 is a skeletal muscle specific gene modulating cellu
interacts with newly synthesized Cox1p, EMBO J., 22,
lar metabolism, J. Neuromuscul. Dis.,
2,
371385,
5951 5961, doi: 10.1093/emboj/cdg566.
doi: 10.3233/JND 150119.
13.
Perez Martinez, X., Butler, C. A., Shingu Vazquez, M.,
26.
Fujita, R., Yoshioka, K., Seko, D., Suematsu, T.,
and Fox, T. D. (2009) Dual functions of Mss51 couple syn
Mitsuhashi, S., et al. (2018) Zmynd17 controls muscle
БИОХИМИЯ том 86 вып. 9 2021
1392
БАЛЕВА и др.
mitochondrial quality and whole body metabolism,
31. Wittig, I., Braun, H. P., and Schägger, H. (2006) Blue
FASEB J., 32, 5012 5025, doi: 10.1096/fj.201701264R.
native PAGE, Nat. Protoc., 1, 418 428, doi: 10.1038/nprot.
27.
Rovira Gonzalez, Y. I., Moyer, A. L., LeTexier, N. J.,
2006.62.
Bratti, A. D., Feng, S., et al. (2019) Mss51 deletion
32. Jha, P., Wang, X., Auwerx, J. (2016) Analysis of mitochon
enhances muscle metabolism and glucose homeostasis in
drial respiratory chain supercomplexes using blue native
mice, JCI Insight, 4, e122247, doi: 10.1172/jci.insight.
polyacrylamide gel electrophoresis (BN PAGE), in Curr.
122247.
Protoc. Mouse Biol., John Wiley & Sons, Inc., Hoboken,
28.
Rovira Gonzalez, Y. I., Moyer, A. L., LeTexier, N. J.,
NJ, USA, pp.
1 14, doi:
10.1002/9780470942390.
Bratti, A. D., Feng, S., et al. (2021) Mss51 deletion
mo150182.
increases endurance and ameliorates histopathology in the
33. Schafer, E., Seelert, H., Reifschneider, N. H., Krause, F.,
mdx mouse model of Duchenne muscular dystrophy,
Dencher, N. A., and Vonck, J. (2006) Architecture of active
FASEB J., 35, e21276, doi: 10.1096/fj.202002106RR.
mammalian respiratory chain supercomplexes, J. Biol.
29.
Chicherin, I. V., Baleva, M. V., Levitskii, S. A.,
Chem., 281, 15370 15375, doi: 10.1074/jbc.M513525200.
Dashinimaev, E. B., Krasheninnikov, I. A., and
34. Kuzmenko, A., Atkinson, G. C., Levitskii, S., Zenkin, N.,
Kamenski, P. (2020) Initiation Factor 3 is dispensable for
Tenson, T., et al. (2014) Mitochondrial translation initiation
mitochondrial translation in cultured human cells, Sci.
machinery: conservation and diversification, Biochimie,
Rep., 10, doi: 10.1038/s41598 020 64139 5.
100, 132 140, doi: 10.1016/j.biochi.2013.07. 024.
30.
Shan, Q., Wang, Y., Li, J., Zhang, Y., Chen, K., et al.
35. Herrmann, J. M., Woellhaf, M. W., and Bonnefoy, N.
(2013) Targeted genome modification of crop plants using
(2013) Control of protein synthesis in yeast mitochondria:
a CRISPR Cas system, Nat. Biotechnol., 31, 686 688,
the concept of translational activators, Biochim. Biophys.
doi: 10.1038/nbt.2650.
Acta, 1833, 286 294, doi: 10.1016/j.bbamcr.2012.03.007.
YEAST TRANSLATIONAL ACTIVATOR Mss51p
AND HUMAN ZMYND17 - TWO PROTEINS
WITH A COMMON ORIGIN, BUT DIFFERENT FUNCTIONS
M. V. Baleva, U. Piunova, I. Chicherin, D. Krasavina, S. Levitskii*, and P. Kamenski
Faculty of Biology, Lomonosov Moscow State University, Department of Molecular Biology,
119234 Moscow, Russia; E'mail: sergey.levitskii@yandex.ru
Despite the similarity with protein biosynthesis in bacteria, translation in the mitochondria of modern eukaryotes has
several unique features. One of these features is the necessity to coordinate translation of individual mitochondrial
mRNAs encoding subunits of complexes of the oxidative phosphorylation chain with translation of other components
of these complexes in the cytosol. In the mitochondria of the baker’s yeast Saccharomyces cerevisiae, this coordina
tion is carried out through a system of translational activators, proteins that predominantly interact with the 5′
untranslated regions of mitochondrial mRNAs. No such system has been found in human mitochondria, although
one translational activator, TACO1, has been identified. In this work, we studied the effect of deletion of the
ZMYND17 gene, an ortholog of the yeast translational activator Mss51p, on mitochondrial translation in human cells.
We demonstrated that deletion of ZMYND17 does not affect translation in mitochondria but leads to decrease in the
activity of cytochrome c oxidase and increase in the amount of free F1 subunit of ATP synthase. In addition, we stud
ied the evolutionary history of Mss51p and ZMYND17 and identified a pathway for the divergence of functions of
these orthologous proteins.
Keywords: mitochondria, translation, translational activators, translation regulation
БИОХИМИЯ том 86 вып. 9 2021