БИОХИМИЯ, 2022, том 87, вып. 1, с. 3 - 15
УДК 577.123
ВЛИЯНИЕ МЕТИЛИРОВАНИЯ ДНК НА 3′→5′ ЭКЗОНУКЛЕАЗНУЮ
АКТИВНОСТЬ ОСНОВНОЙ АПУРИН АПИРИМИДИНОВОЙ
ЭНДОНУКЛЕАЗЫ ЧЕЛОВЕКА APEX1
© 2022
А.В. Ендуткин1, Д.Д. Яценко1, Д.О. Жарков1,2*
1 Институт химической биологии и фундаментальной медицины СО РАН, 630090 Новосибирск, Россия;
электронная почта: dzharkov@niboch.nsc.ru
2 Новосибирский государственный университет, факультет естественных наук, 630090 Новосибирск, Россия
Поступила в редакцию 28.07.2021
После доработки 23.11.2021
Принята к публикации 24.11.2021
Апурин апиримидиновые (АП) эндонуклеазы - ключевые ферменты пути эксцизионной репарации осно
ваний ДНК, гидролизующие фосфодиэфирную связь АП сайта, который образуется после удаления пов
реждённого основания. Основная АП эндонуклеаза человека APEX1, помимо этого, проявляет 3′ фосфо
диэстеразную и 3′→5′ экзонуклеазную активности. Биологические функции последней не выяснены;
предполагается, что она может корректировать ошибки репаративного синтеза ДНК. При повреждении
ДНК с 3′ стороны вблизи 5 метилцитозина (mC) проявление 3′→5′ экзонуклеазной активности может вы
зывать изменение статуса эпигенетического метилирования CpG динуклеотидов. Остаётся открытым воп
рос: вносит ли 3′→5′ экзонуклеазная активность APEX1 вклад в процесс активного эпигенетического де
метилирования или, напротив, она лимитирована в метилированных CpG динуклеотидах для сохранения
эпигенетического статуса при репарации случайных повреждений ДНК. В работе впервые систематически
исследована эффективность удаления ферментом APEX1 3′ концевых нуклеотидов из субстратов, пред
ставляющих собой интермедиаты репарации ДНК в CpG динуклеотидах. Показано, что во всех интерме
диатах олигонуклеотиды с некомплементарными матрице основаниями на 3′ конце представляют собой
наилучшие, а с mC - наихудший субстрат для проявления 3′→5′ экзонуклеазной активности APEX1. На
личие mC в комплементарной цепи значительно снижает константу скорости реакции даже для некомпле
ментарных 3′ концевых звеньев. Таким образом, эффективность 3′→5′ экзонуклеазной реакции, катали
зируемой APEX1, ограничена в метилированных CpG динуклеотидах, что, вероятно, связано с необходи
мостью поддержания эпигенетического статуса при репарации.
КЛЮЧЕВЫЕ СЛОВА: повреждение ДНК, репарация ДНК, эпигенетическое деметилирование, АП эндо
нуклеаза, 3′→5′ экзонуклеаза, APEX1, 5 метилцитозин.
DOI: 10.31857/S0320972522010018
ВВЕДЕНИЕ
по механизму эксцизионной репарации основа
ний (ЭРО) [1]. Этот процесс инициируется раз
Спонтанный гидролиз и реакции с активны
личными ДНК N гликозилазами, которые мо
ми формами кислорода входят в число основ
гут либо катализировать гидролиз N гликозид
ных причин повреждения ДНК в клетках чело
ной связи между повреждённым основанием и
века [1, 2]. Они приводят к появлению в ДНК
остатком дезоксирибозы, либо дополнительно
широкого круга повреждённых нуклеотидов,
вносить одноцепочечный разрыв в ДНК по ме
которые обладают высоким цитотоксичным и
ханизму β или β,δ элиминирования [1, 3]. Об
промутагенным потенциалом и исправляются
разующиеся при этом апурин апиримидиновые
сайты (АП сайты) или 3′ концевые α,β ненасы
щенные альдегиды служат субстратами для АП
Принятые сокращения: АП - апурин апиримиди
новый(ая); ОДН - олигодезоксирибонуклеотид; ЭРО -
эндонуклеаз, которые гидролизуют их 5′ фос
эксцизионная репарация оснований; APEX1 - апурин
фодиэфирную связь [1]. Процесс ЭРО далее
апиримидиновая эндо/экзонуклеаза 1; dmCMP - 5 ме
протекает с участием ДНК полимераз и ДНК
тилцитозин 2′ дезоксирибомонофосфат; F - 2 (гидрок
лигаз, которые восстанавливают каноническую
симетил)тетрагидрофуранол 3; mC - 5 метилцитозин;
структуру ДНК. Кроме борьбы с повреждения
OGG1 - 8 оксогуанин ДНК гликозилаза 1; oxoG - 8 ок
согуанин; TET - белки семейства Ten-Eleven Transloca
ми ДНК, ЭРО лежит в основе процесса актив
tion.
ного эпигенетического деметилирования, кото
* Адресат для корреспонденции.
рое у человека запускается направленным и
3
4
ЕНДУТКИН и др.
контролируемым диоксигеназами семейства
c Myc [17], RARα [18] и Hif 1α [19]. Показано,
TET (Ten-Eleven Translocation) окислением 5
что факторы транскрипции связываются с сай
метилцитозина (mC) с дальнейшим удалением
тами мишенями и привлекают деметилазу гис
продуктов окисления из ДНК [4, 5] (рис. 1, а).
тонов LSD1, которая в ходе окислительного де
Основная АП эндонуклеаза человека - бе
метилирования форм гистонов H3K4me2
лок APEX1 - помимо собственно АП эндонук
и H3K9me2 производит в качестве одного из
леазной и 3′ фосфодиэстеразной активностей,
продуктов H2O2, вызывающую окисление осно
обладает 3′→5′ экзонуклеазной активностью
вания гуанина в непосредственной близости от
[6-8]. Поскольку она преимущественно удаляет
места своего возникновения. Получившиеся ос
нуклеотиды в составе неканонических пар, вы
нования oxoG удаляются из ДНК системой ЭРО
сказывалось предположение, что одна из функ
с участием ДНК гликозилазы OGG1 и APEX1,
ций этой активности состоит в коррекции оши
что каким то образом приводит к активации
бок ДНК полимераз при репликативном или
транскрипции. Высказывалось предположение,
репаративном синтезе ДНК [6]. Однако счита
что активирующим фактором служат возникаю
ется, что у человека корректирующие функции
щие в ходе репарации одноцепочечные разрывы
при репликации выполняют 3′→5′ экзонуклеа
ДНК, вызывающие релаксацию хроматина. Од
зы TREX1 и TREX2 [9], а кроме того, ДНК по
нако в других системах разрывы при репарации
лимеразы δ и ε сами обладают способностью
oxoG в промоторах ингибируют инициацию
корректировать ошибки [10]. Гораздо больше
транскрипции [20, 21]. Кроме того, показано,
оснований полагать, что APEX1 может прояв
что одноцепочечные разрывы могут служить и
лять 3′→5′ экзонуклеазную активность в хо
«точкой входа» для экзонуклеаз либо геликаз и
де ЭРО; продукты экзонуклеазной реакции час
эндонуклеаз, которые гидролизуют более протя
то наблюдают в реконструированных систе
жённые участки цепи ДНК и могут вызывать де
мах ЭРО, включающих ДНК гликозилазы,
метилирование на значительных расстояниях от
APEX1, ДНК полимеразу β и ДНК лига
места разрыва (рис. 1, б) [22, 23]. Преимущество
зу [11-14]. С другой стороны, экзонуклеазная
такого механизма для быстрой активации генов
активность APEX1 ингибируется образующимся
связано с возможностью удаления многих ос
при репарации 5′ концевым остатком 2′ дезок
татков mC за один раз. Однако до сих пор не бы
сирибо 5′ фосфата [15]. Поэтому возможные
ла исследована потенциальная возможность
функции фермента APEX1 как экзонуклеазы
эпигенетического деметилирования, связанная
при репарации ДНК остаются неясными.
с репарацией oxoG в метилированных CpG ди
Недавно было достаточно неожиданно обна
нуклеотидах за счёт 3′→5′ экзонуклеазной ак
ружено, что 8 оксогуанин (oxoG), одно из са
тивности APEX1 (рис. 1, в). С одной стороны,
мых распространённых окисленных основа
такой процесс мог бы служить дополнительным
ний ДНК, служит ключевым элементом актива
механизмом локального активного деметилиро
ции генов факторами транскрипции ERα [16],
вания при контролируемом повреждении ДНК.
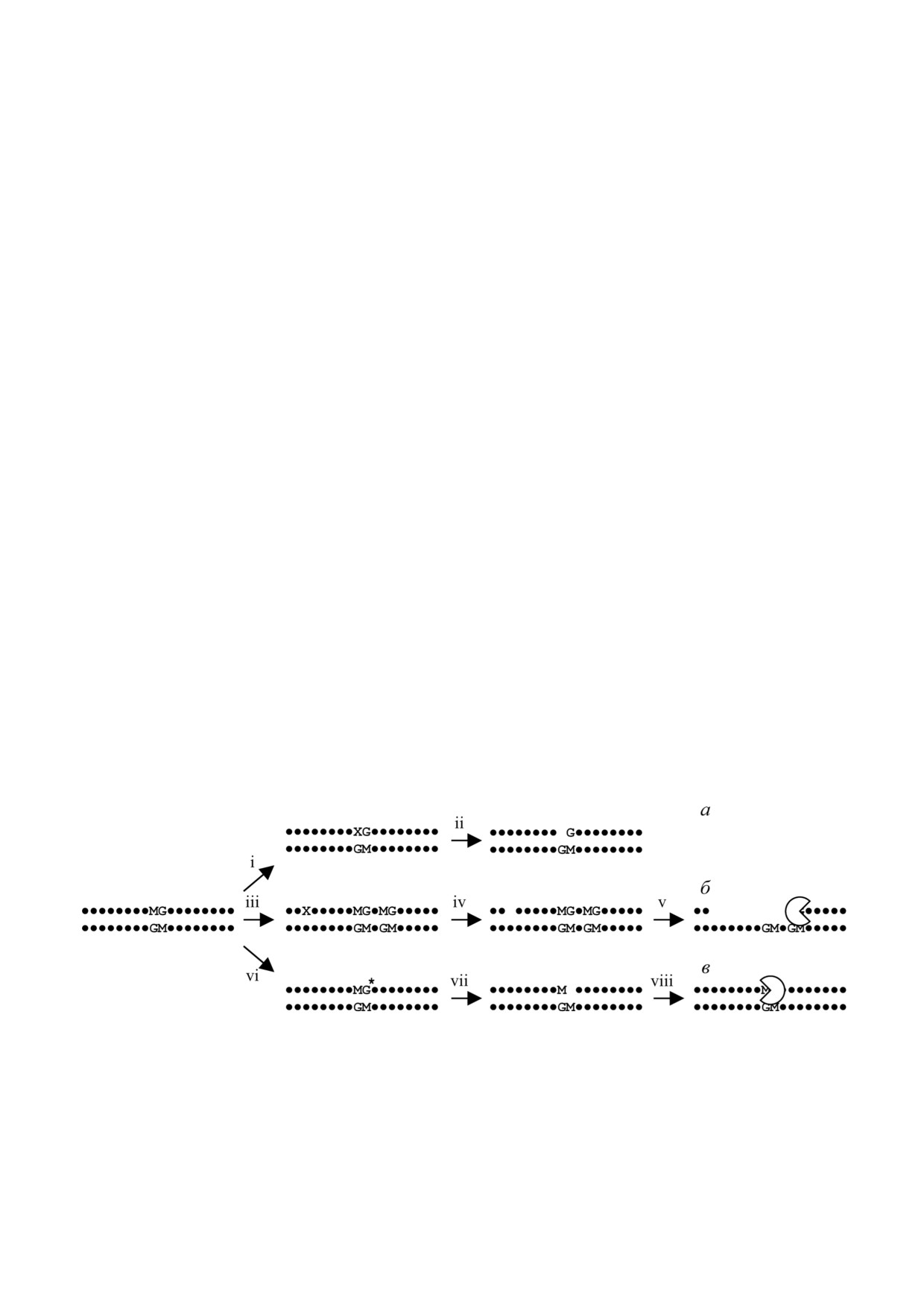
Рис. 1. Возможные пути активного деметилирования ДНК в клетках человека. Канонический путь активного деметили
рования (а): направленное регулируемое повреждение 5 метилцитозина диоксигеназами TET (i) и удаление этого пов
реждения системой ЭРО (ii). Альтернативный путь (б): повреждение ДНК на некотором расстоянии от сайта метилиро
вания (iii), внесение разрыва в этом месте при репарации (iv) и деградация участка ДНК экзонуклеазами (v). OxoG за
висимый путь (в): окисление гуанина в метилированном CpG динуклеотиде (vi), удаление oxoG системой ЭРО (vii) и со
путствующий процессинг разрыва 3′→5′ экзонуклеазной активностью фермента APEX1 (viii). Условные обозначения:
M - 5 метилцитозин, X - поврежденное основание, G* - 8 оксогуанин, сегментированный круг - фермент, обладаю
щий экзонуклеазной активностью
БИОХИМИЯ том 87 вып. 1 2022
ЭКЗОНУКЛЕАЗНАЯ АКТИВНОСТЬ APEX1 В CpG ДИНУКЛЕОТИДАХ
5
С другой стороны, удаление mC в ходе экзонук
де и прогревали при 95 °С в течение 5 мин. Про
леазной реакции при случайном ненаправлен
дукты реакции анализировали электрофорезом
ном повреждении ДНК внутри или в непосред
в 20% ном полиакриламидном геле, содержа
ственной близости от CpG сайтов изменяет ста
щем 7,2 М мочевину, визуализировали при по
тус метилирования, что даже при деметилирова
мощи радиолюминесцентного сканера Typhoon
нии единичных сайтов может иметь послед
FLA 9500 Imager («GE Healthcare», США) и об
ствия для экспрессии генов за счёт изменения
считывали с использованием программы Quantity
связывания регуляторных белков [24, 25] и сме
One v4.6.8 («Bio Rad Laboratories», США).
щения динамического равновесия между мети
Ферментативная кинетика. Для определения
лированием и деметилированием ДНК [26, 27].
параметров стационарной кинетики экзонукле
В настоящем исследовании впервые прове
азной реакции, катализируемой фермен
дён сравнительный анализ кинетики удаления
том APEX1, реакцию проводили в объёме
ферментом APEX1 канонических dNMP и
10 мкл в описанном выше реакционном буфере
5 метилцитозин 2′ дезоксирибомонофосфата
в течение 5 мин при 37 °С. Концентрации
(dmCMP) с 3′ конца олигонуклеотидов в соста
субстрата составляли 3,125; 6,25; 12,5; 25; 50 и
ве конструкций, моделирующих продукты ЭРО
100 нМ. Были подобраны такие концентрации
в CpG динуклеотидах, где комплементарная
фермента и время реакции, при которых рас
цепь содержит либо не содержит mC. Показано,
щепление субстрата не превышало 10-30%,
что dmCMP хуже всего процессируется 3′→5′
чтобы зависимость накопления продукта от
экзонуклеазной активностью APEX1. Таким об
времени была близка к линейной. В большин
разом, система ЭРО, вероятно, оптимизирована
стве случаев использовали концентрации фер
для сохранения статуса метилирования при ре
мента 0,5-1 нМ, что ниже минимальной концен
парации случайных повреждений ДНК.
трации субстрата, и лишь для наихудших
субстратов концентрацию фермента повышали
до 2-4 нМ. Реакцию останавливали и анализи
МАТЕРИАЛЫ И МЕТОДЫ
ровали её продукты, как описано выше; для
удобства обсчёта на гель наносили объёмы ре
Олигонуклеотиды и белки. Олигодезоксири
акционной смеси, содержащие одинаковое ко
бонуклеотиды (ОДН), использованные в рабо
личество радиоактивности. Полученные экспе
те, синтезировали в лаборатории биомедицинс
риментальные данные описывали уравнением
кой химии ИХБФМ СО РАН с использованием
Михаэлиса-Ментен, параметры уравнения оп
коммерчески доступных амидофосфитов («Glen
ределяли из данных 3-5 независимых экспери
Research», США). Последовательности ОДН
ментов нелинейной регрессией гиперболичес
приведены в таблице. Все ОДН подвергали
кой функции v0 = kcat[E]0[S]0/(KM+[S]0) в прог
очистке с помощью обращённо фазовой жидко
рамме SigmaPlot v9.0 («SPSS Inc.», США).
стной хроматографии высокого давления на ко
лонке LiChrosorb RP 18 («Merck», США), а за
тем с помощью электрофореза в полиакрила
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
мидном геле. После обессоливания обращённо
фазовой хроматографией на сорбенте С18
Дизайн ДНК субстратов. Поскольку 3′→5′
NenSorb ОДН при необходимости метили по 5′
экзонуклеазная активность фермента APEX1
концу с использованием [γ32P]ATP и полинук
проявляется в ходе ЭРО [11-14], для её система
леотидкиназы бактериофага T4 («Биосан», Рос
тического исследования были сконструированы
сия) и отжигали с необходимыми комплемен
субстраты, имитирующие некоторые интерме
тарными цепями. Белок APEX1 человека выде
диаты этого процесса. При этом представляло
ляли в рекомбинантном виде, как описано ра
интерес сравнить экзонуклеазную активность
нее [28].
для ДНК субстратов, в которых комплементар
Условия определения экзонуклеазной актив
ная цепь содержит или не содержит mC. В связи
ности белка APEX1. Реакцию проводили в объё
с этим были разработаны 4 серии субстратов,
ме 60 мкл в буфере, содержащем 20 мМ HEPES
каждая из которых включала две группы, разли
NaOH (pH 6,8), 50 мМ KCl, 1 мМ MgCl2,
чающиеся наличием C либо mC в составе CpG
1 мМ дитиотреитол, 4 нМ APEX1 и 20 нМ ОДН
динуклеотида в комплементарной цепи (табли
субстрат. Реакционную смесь инкубировали в
ца). Субстраты серии 1 (субстраты 1.1.1-1.1.5;
течение 1-20 мин при 37 °С, отбирая аликво
1.2.1-1.2.5) представляли собой двуцепочеч
ты (10 мкл), которые смешивали с 5 мкл раство
ные ОДН с выступающим 5′ одноцепочечным
ра 20 мМ ЭДТА, 0,1% ного ксиленцианола,
участком («праймер-матрица»), традиционно
0,1% ного бромфенолового синего в формами
используемые для изучения активности 3′→5′
БИОХИМИЯ том 87 вып. 1 2022
6
ЕНДУТКИН и др.
Структуры олигонуклеотидных субстратов, использованных в работе
Структура субстрата**, ***
3′ концевой нуклеотид
и статус метилирования*
Праймер-матрица (серия 1)
X = C
X = M
GGTACAATTCGAGTGAGAN
1.1.1. N = C
1.2.1. N = C
CCATGTATAGCTCACTCTGXAGTTCAACCCGAATGAGTCC
1.1.2. N = T
1.2.2. N = T
1.1.3. N = A
1.2.3. N = A
1.1.4. N = G
1.2.4. N = G
1.1.5. N = M
1.2.5. N = M
Одноцепочечный разрыв (серия 2)
X = C
X = M
GGTACAATTCGAGTGAGAN GTCAAGTTGGGCTTACTCAGG
2.1.1. N = C
2.2.1. N = C
CCATGTATAGCTCACTCTG~XAGTTCAACCCGAATGAGTCC
2.1.2. N = T
2.2.2. N = T
2.1.3. N = A
2.2.3. N = A
2.1.4. N = G
2.2.4. N = G
2.1.5. N = M
2.2.5. N = M
Одноцепочечный разрыв при 5′ концевом АП сайте (продукт АП эндонуклеазной реакции) (серия 3)
X = C
X = M
GGTACAATTCGAGTGAGAN FTCAAGTTGGGCTTACTCAGG
3.1.1. N = C
3.2.1. N = C
CCATGTATAGCTCACTCTG~XAGTTCAACCCGAATGAGTCC
3.1.2. N = T
3.2.2. N = T
3.1.3. N = A
3.2.3. N = A
3.1.4. N = G
3.2.4. N = G
3.1.5. N = M
3.2.5. N = M
Однонуклеотидная брешь (серия 4)
X = C
X = M
GGTACAATTCGAGTGAGAN TCAAGTTGGGCTTACTCAGG
4.1.1. N = C
4.2.1. N = C
CCATGTATAGCTCACTCTGXAGTTCAACCCGAATGAGTCC
4.1.2. N = T
4.2.2. N = T
4.1.3. N = A
4.2.3. N = A
4.1.4. N = G
4.2.4. N = G
4.1.5. N = M
4.2.5. N = M
Примечание. * M - 5 метилцитозин; ** F - 2 (гидроксиметил)тетрагидрофуранол 3.
*** Верхняя цепь записана в направлении 5′→3′.
экзонуклеаз. Субстраты серии 2 (2.1.1-2.1.5;
и репарации ДНК [29, 30]. Субстраты такого
2.2.1-2.2.5) содержали разрыв с 3′ стороны от
строения моделируют структуру интермедиата
удаляемого дезоксинуклеотида. Субстраты се
репарации, образующегося после действия мо
рии 3 (3.1.1-3.1.5; 3.2.1-3.2.5) также содержали
нофункциональной ДНК гликозилазы и АП
разрыв, при этом на 5′ конце примыкающего к
эндонуклеазы. Остаток F не содержал 5′ конце
разрыву ОДН содержался остаток 2 (гидрокси
вой фосфатной группы, которая заметно снижа
метил)тетрагидрофуранола 3 (F) - аналога 2′
ет 3′→5′ экзонуклеазную активность APEX1
дезоксирибозы, не подверженного β элимини
[15]. Наконец, субстраты серии 4 (субстраты
рованию, и потому гораздо более стабильного в
4.1.1-4.1.5; 4.2.1-4.2.5) содержали однонуклео
физиологических условиях по сравнению с АП
зидную брешь с 3′ стороны от удаляемого де
сайтом; этот модифицированный нуклеотид
зоксинуклеотида; они служат моделью интерме
часто применяется в исследованиях мутагенеза
диата репарации, образующегося после β эли
БИОХИМИЯ том 87 вып. 1 2022
ЭКЗОНУКЛЕАЗНАЯ АКТИВНОСТЬ APEX1 В CpG ДИНУКЛЕОТИДАХ
7
минирования и действия АП эндонуклеазы, ли
наличии в комплементарной цепи остатка mC
бо после β,δ элиминирования. Во всех случаях
(ср. рис. 2, а и б).
напротив удаляемого 3′ концевого звена распо
3′→5′ экзонуклеазная активность APEX1 за
лагалось основание G, которое с 5′ стороны в
висит от природы разрыва в ДНК. Для количест
своей цепи соседствовало либо с C (субстраты
венного анализа 3′→5′ экзонуклеазной актив
1.1.1-1.1.5; 2.1.1-2.1.5; 3.1.1-3.1.5; 4.1.1-4.1.5),
ности фермента APEX1 были определены пара
либо с mC (субстраты 1.2.1-1.2.5; 2.2.1-2.2.5;
метры стационарной кинетики этой реакции
3.2.1-3.2.5; 4.2.1-4.2.5). На 3′ конце гидролизу
для субстратов, различающихся окружением
емого ОДН содержались либо dCMP или
деградируемого 3′ конца (серии 1-4, см. выше).
dmCMP полностью комплементарные матрице,
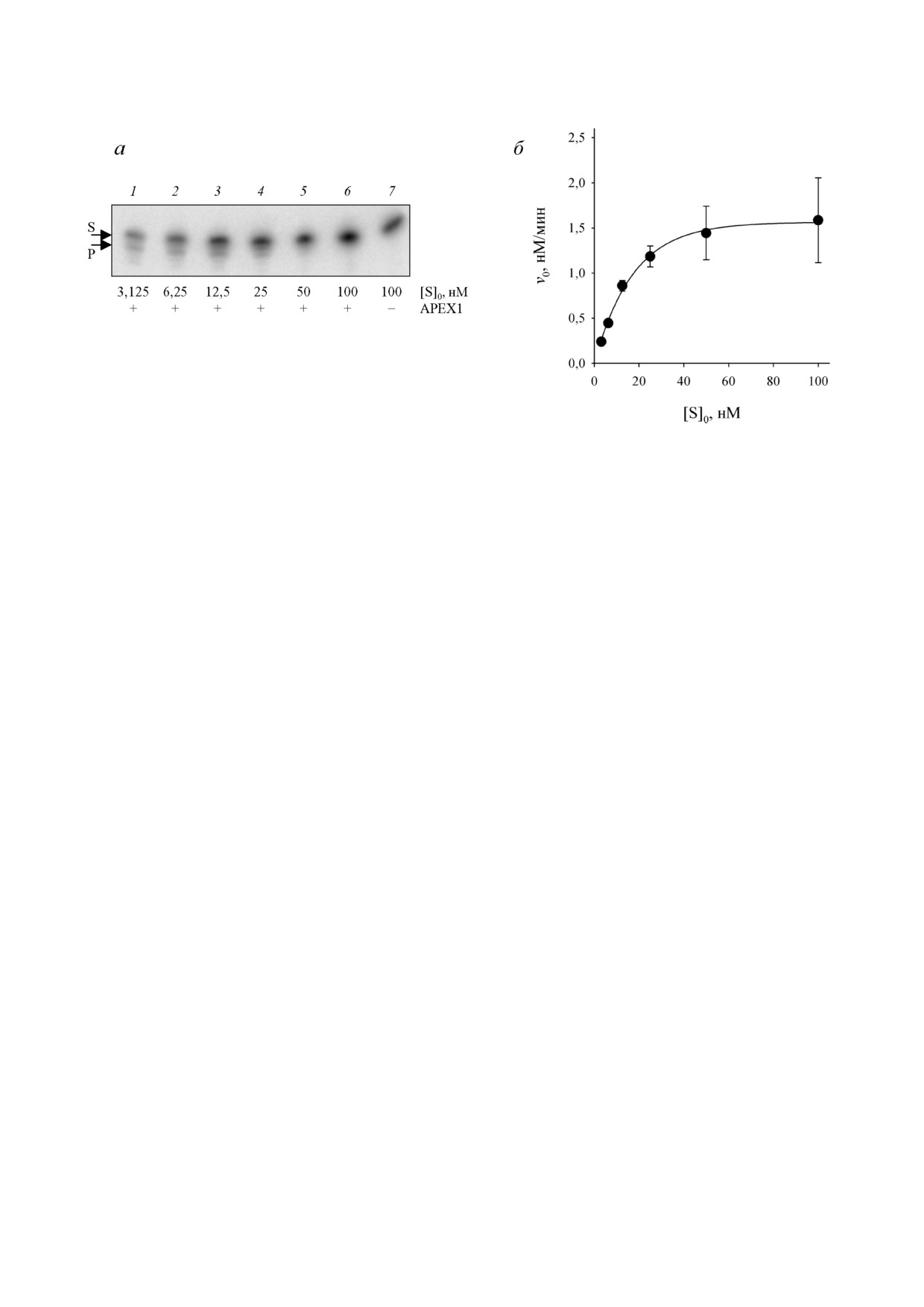
На рис. 3 приведены результаты типичных экс
либо некомплементарные нуклеотиды.
периментов по определению кинетических па
3′ концевой dmCMP неэффективно удаляется
раметров (KM, kcat) реакции.
3′→5′ экзонуклеазной активностью APEX1.
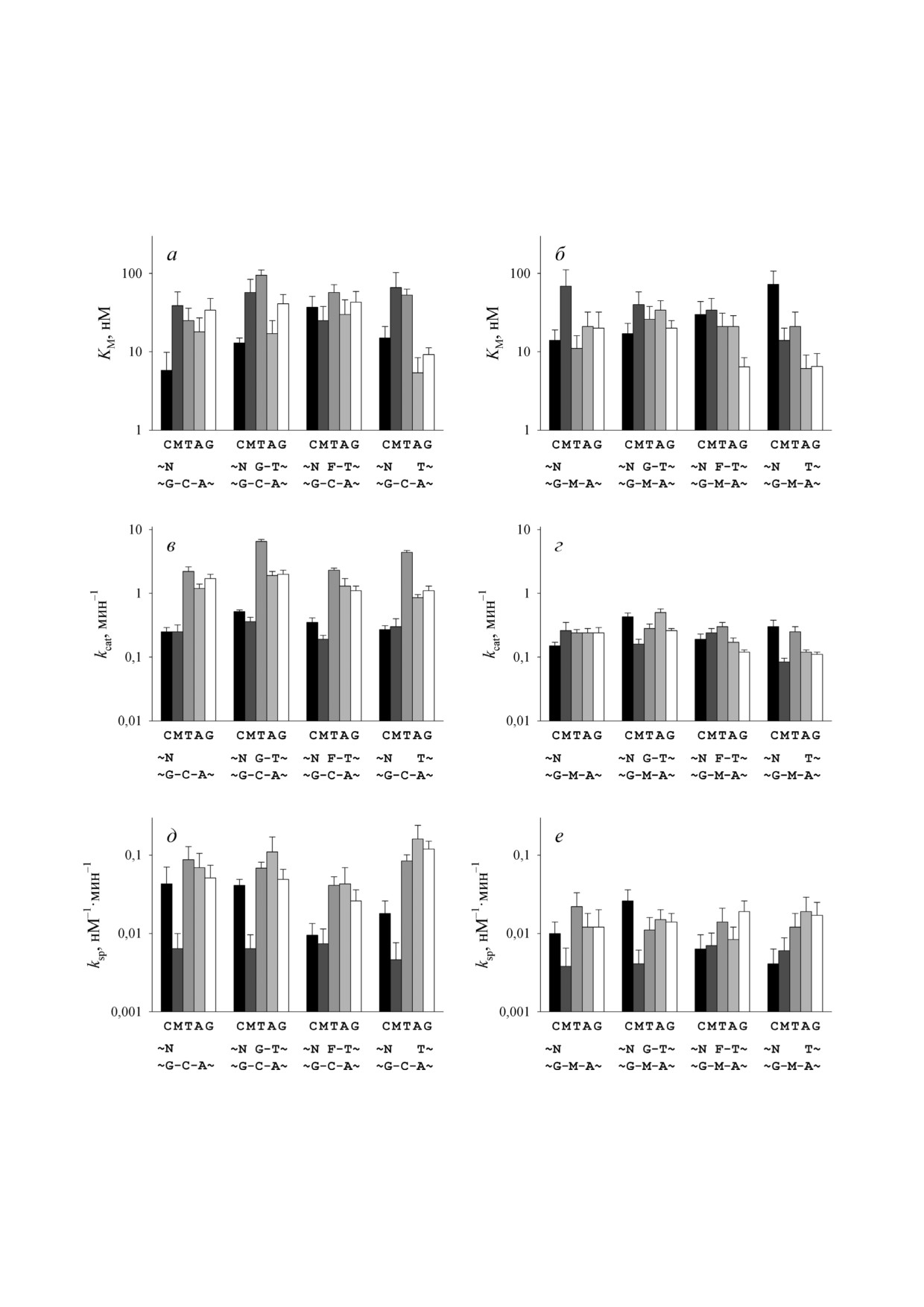
При рассмотрении профилей значений
На примере субстратов серии 1, не содержащих
константы Михаэлиса (KM), константы скорос
дополнительного примыкающего ОДН, была
ти реакции (kcat) и константы специфичности
исследована общая эффективность удаления
(ksp = kcat/KM) (рис. 4) выявляются некоторые за
комплементарных и некомплементарных 3′
кономерности их зависимости от природы
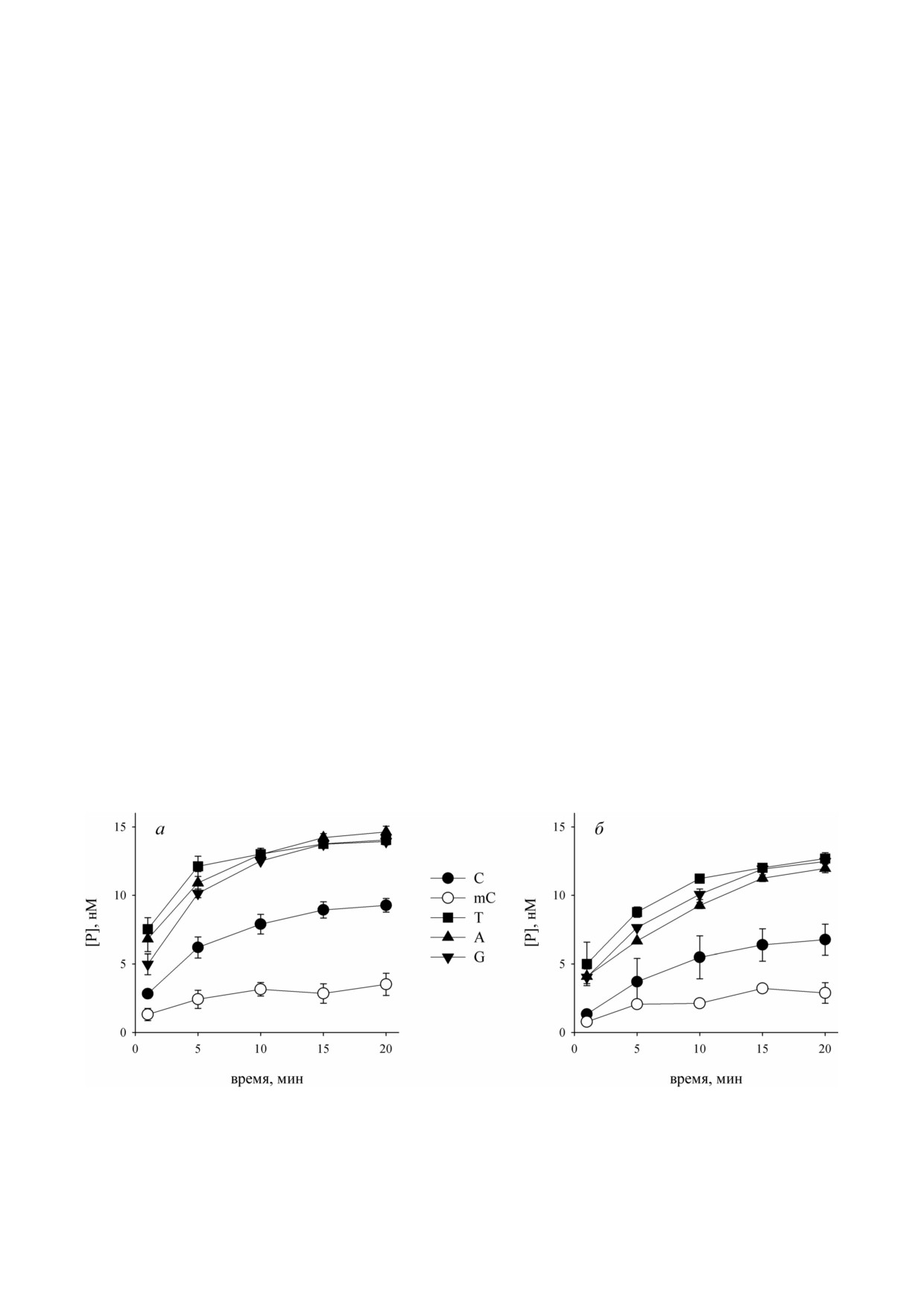
концевых dNMP ферментом APEX1 (рис. 2).
субстрата. В системе типа «праймер-матрица»
Во всех случаях для субстратов, содержащих не
наибольшая константа скорости реакции на
канонические пары, наблюдался более высокий
блюдалась для всех субстратов с некомплемен
уровень накопления продуктов реакции, что в
тарным
3′ концевым нуклеотидом, однако
целом согласуется с литературными данны
KM для них была выше, чем для субстратов с
ми [6-8]. Cкорость реакции для субстратов груп
полностью комплементарным праймером, и в
пы 1.1 уменьшалась в ряду T ~ A > G >C > mC,
результате значения ksp были близки. Праймер с
аналогичная закономерность наблюдалась для
3′ концевым mC в такой системе характеризо
группы 1.2: T > A ~ G >C> mC. Разные некано
вался значениями kcat, близкими к таковым для
нические пары (A/G, G/G, T/G) незначительно
полностью комплементарного праймера, при
отличались друг от друга по эффективности рас
высокой KM, таким образом, mC удалялся с 3′
щепления. Удаление 3′ концевого dmCMP, пол
конца хуже всего.
ностью комплементарного матрице, в использо
Наличие примыкающего ОДН, отделённого
ванных условиях было ещё менее эффективно,
разрывом или одноцепочечной брешью от 3′
чем удаление dCMP. Предпочтительное удале
конца праймера, несколько изменяло субстрат
ние некомплементарных 3′ концевых нуклеоти
ные предпочтения 3′→5′ экзонуклеазной актив
дов сохранялось при метилировании компле
ности APEX1. Наивысшая константа скорости
ментарной цепи, однако во всех случаях наблю
реакции в обоих случаях наблюдалась для прай
далась тенденция к замедлению реакции при
мера с dTMP на 3′ конце, однако при этом для
Рис. 2. Зависимость накопления продукта экзонуклеазного расщепления субстратов 1.1.1-1.1.5 (а) и 1.2.1-1.2.5 (б) фер
ментом APEX1 от времени (фермент - 4 нМ, субстрат - 20 нМ, условия реакции описаны в разделе «Материалы и мето
ды»). Приведены средние значения и стандартные ошибки (n = 3)
БИОХИМИЯ том 87 вып. 1 2022
8
ЕНДУТКИН и др.
Рис. 3. Репрезентативный радиоавтограф геля после электрофоретического разделения продуктов 3′→5′ экзонуклеазной
реакции (а, субстрат 2.1.3) и зависимость скорости накопления продукта от концентрации субстрата (б). Концентрации
субстрата указаны на рисунке. Концентрация фермента составляла 3 нМ, время реакции - 5 мин
него повышалось и значение KM, в результате
комплементарным 3′ концевым нуклеотидом
чего константы специфичности для всех
(субстраты 2, 3 и 4 в каждой группе), если комп
субстратов с некомплементарными 3′ концами
лементарная цепь была метилирована, в то вре
были сходны. Значения kcat для субстратов с C
мя как последствия модификации субстратов с
или mC на 3′ конце были заметно ниже, чем для
комплементарным 3′ концевым нуклеотидом
субстратов с некомплементарными 3′ концами.
(C и mC; субстраты 1 и 5 в каждой группе) были
При наличии бреши в несколько раз снижались
гораздо ниже или вовсе не наблюда
значения KM для субстратов с A и G на конце
лись (рис. 4, в и г). Метилирование комплемен
праймера. В целом при отсутствии метилирова
тарной цепи в некоторых случаях оказывало
ния специфичность APEX1 по отношению к
влияние и на KM: так, по сравнению с неметили
разным 3′ концевым нуклеотидам была похожа
рованной комплементарной цепью эта величи
для субстратов без примыкающего ОДН, с раз
на повышалась в 5 раз для субстрата 4.2.1 с C на
рывом и с брешью.
3′ конце при однонуклеотидной бреши и сни
В присутствии остатка F на 5′ конце примы
жалась в 7 раз для субстрата 3.2.4 с G на 3′ кон
кающего ОДН значение KM для субстратов с 3′
це при 5′ концевом остатке F, однако эти изме
концевым C возрастало (рис. 4, а). Поскольку
нения не носили столь систематического харак
остаток F служит аналогом 5′ концевого остатка
тера. На уровне специфичности, выраженной
2′ дезоксирибо 5′ фосфата, возникающего как
константой ksp, удаление 3′ концевого mC из
интермедиат ЭРО, этот результат согласуется с
субстратов без примыкающего ОДН (1.1.5 и
литературными данными о низкой 3′→5′ экзо
1.2.5) и с разрывом (2.1.5 и 2.2.5) было наименее
нуклеазной активности APEX1 в таких субстра
эффективно по сравнению с удалением других
тах [15]. Однако примечательно, что для 3′ кон
нуклеотидов вне зависимости от статуса мети
цевого mC эффективность экзонуклеазной ре
лирования комплементарной цепи. Однако при
акции APEX1 не изменялась, вследствие чего C
наличии бреши или остатка F при разрыве эф
и mC удалялись с близкой константой специ
фективность удаления mC из полностью мети
фичности (рис. 4, д).
лированного субстрата (3.2.5 и 4.2.5) была срав
3′→5′ экзонуклеазная активность APEX1 сни
нима с эффективностью удаления C (3.2.1
жена при метилировании комплементарной цепи.
и 4.2.1; рис. 4, д и е).
Наличие остатка mC в комплементарной цепи
ДНК субстрата оказывало неожиданно большое
влияние на
3′→5′ экзонуклеазную актив
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
ность APEX1. При сравнении действия фермен
та APEX1 по отношению к субстратам групп
3′→5′ экзонуклеазная активность основной
1.1-4.1 и 1.2-4.2 заметно снижались (в 4-23 ра
АП эндонуклеазы человека APEX1 была описа
за) значения kcat для всех типов субстратов с не
на довольно давно [31-33], но долгое время счи
БИОХИМИЯ том 87 вып. 1 2022
ЭКЗОНУКЛЕАЗНАЯ АКТИВНОСТЬ APEX1 В CpG ДИНУКЛЕОТИДАХ
9
талась биологически неважной, поскольку она
позднее было установлено, что 3′→5′ экзонук
намного ниже, чем АП эндонуклеазная, 3′ фос
леазная активность APEX1 более специфична
фодиэстеразная и 3′ фосфатазная активности,
для некомплементарных оснований на 3′ конце
принадлежащие этому полипептиду. Однако
субстрата типа «праймер-матрица» [6-8, 34,
Рис. 4. Значения KM (а, б), kcat (в, г) и ksp (д, е) 3′→5′ экзонуклеазной реакции, катализируемой ферментом APEX1 для раз
ных субстратов. Под каждым графиком приведены схематические изображения окружения удаляемого нуклеотида
(N, природа удаляемого нуклеотида указана под соответствующими столбцами). M - 5 метилцитозин, F - 2 (гидрокси
метил)тетрагидрофуранол 3
БИОХИМИЯ том 87 вып. 1 2022
10
ЕНДУТКИН и др.
35], и некоторые авторы рассматривают APEX1
ным типам субстратной ДНК в целом согласует
как фермент, участвующий в коррекции ошибок
ся с литературными данными, полученными
при репликативном или, что более вероятно, ре
для более узких серий аналогичных субстратов,
паративном синтезе ДНК [6, 14]. Помимо не
отличающихся последовательностью на 3′ кон
правильно включенных канонических нуклео
це [6-8, 34, 35]. Как и в этих работах, все
тидов, корректирующая экзонуклеазная актив
субстраты с 3′ концевыми некомплементарны
ность APEX1 удаляет из ДНК и многие 3′ кон
ми нуклеотидами расщеплялись ферментом
цевые остатки нуклеозидных ингибиторов
лучше, чем субстраты с 3′ концевыми компле
ДНК полимераз и других неканонических нук
ментарными нуклеотидами. В большинстве
леотидов [36-40]. Недавно было показано, что в
случаев наилучшие субстраты содержали на 3′
ходе репарации одноцепочечных разрывов ДНК
конце dTMP в составе неправильной пары T/G,
после удаления 3′ концевого остатка фермен
что ранее наблюдалось для субстратов типа
том APEX1 3′→5′ экзонуклеазная реакция про
«праймер-матрица» [6]. Что касается природы
должается с участием нуклеазы APEX2 - гомо
примыкающих ОДН, то в целом субстраты с 5′
лога APEX1, не проявляющего заметной АП эн
концевым остатком F использовались фермен
донуклеазной активности [41].
том несколько хуже, чем субстраты с разрывом
В исследовании были получены данные о
и с однонуклеотидной брешью (рис. 4, е), одна
гидролизе 40 субстратов, которые относились к
ко эта разница была менее выражена по сравне
4 структурным сериям, различающимся наличи
нию с описанными различиями, зависящими от
ем и природой примыкающего с
3′ сторо
наличия 5′ фосфата [8, 15, 34]. В тех случаях,
ны ОДН. В каждой серии на 3′ конце субстрата
когда возможно прямое сравнение субстратов с
находился либо нуклеотид, комплементарный G
разными примыкающими ОДН и однотипными
в противоположной цепи (dCMP, dmCMP), либо
5′ концами (фосфат или OH группа) разница в
некомплементарный нуклеотид (dAMP, dGMP,
активности APEX1 между такими субстратами
dTMP). Следует отметить, что примыкающие
не превышает 2 раз [8, 15, 34]. Ряд структур
олигонуклеотиды в составе субстратов не содер
комплексов APEX1 с ДНК, отражающих разные
жали 5′ концевого фосфата, который заметно
стадии экзо и эндонуклеазной реакции, позво
снижает эффективность 3′→5′ экзонуклеазной
ляет установить ключевые различия между эти
реакции APEX1 во всех типах разрывов [8, 15, 34].
ми двумя активностями фермента [50-55]. Для
Полученные в работе результаты согласуют
катализа АП эндонуклеазной реакции АП сайт
ся с литературными данными о том, что 3′→5′
переводится во внеспиральное состояние и свя
экзонуклеазная активность фермента APEX1 да
зывается в активном центре фермента, а его
же для некомплементарных нуклеотидов на
фосфатная группа координируется водородны
3′ конце заметно ниже его АП эндонуклеазной
ми связями с остатками Tyr171, Asn174, Asn212
активности. Значения kcat экзонуклеазной реак
и His309 (рис. 5, а). При этом в спираль ДНК
ции лежали в диапазоне 0,084-6,5 мин-1, в то
внедряются два боковых аминокислотных ради
время как для АП эндонуклеазной реакции они
кала: Arg177 заполняет полость, образовавшую
составляют 1-10 с-1 в стационарном режиме
ся при выворачивании повреждённого нуклео
[42-45], т.е. выше на 1-4 порядка, а константа
тида, а Met270 вклинивается напротив него
скорости химической стадии реакции, не ос
между основаниями комплементарной цепи и
ложнённой распадом комплекса фермент-про
вызывает её локальный излом в сторону боль
дукт, по данным предстационарной кинетики,
шой бороздки на ~25°. Ион Mg2+, координируе
превышает 700-850 с-1 [46, 47]. В случае экзо
мый карбоксильными группами остатков Asp70,
нуклеазной реакции её скорость, по видимому,
Glu96 и Asp308, поляризует связь P=O в фос
лимитируется именно высвобождением продук
фатной группе АП сайта, а роль атакующего
та [35]. С другой стороны, значения kcat экзонук
нуклеофила выполняет молекула воды, активи
леазной реакции сравнимы с таковыми для
рованная взаимодействием с карбоксильной
действия APEX1 в так называемой «инцизион
группой остатка Asp210 (рис. 5, а). Структуры
ной репарации нуклеотидов» - гидролизе 5′
субстрата для 3′→5′ экзонуклеазной реакции до
фосфодиэфирной связи модифицированных
сих пор удалось получить лишь при наличии не
нуклеотидов, содержащих основания (5,6 ди
комплементарного основания на 3′ конце в
гидроурацил, αdA, rU) [48, 49]. Интересно, что
системе с одноцепочечным разрывом ДНК
значения KM во всех этих случаях показывают
(аналогичной серии 2 в настоящей работе) [53,
значительно меньшую вариабельность и нахо
55]. Общая организация активного центра в
дятся внутри диапазона 1-100 нМ.
этом случае остаётся неизменной (рис. 5, б), од
Наблюдавшаяся специфичность экзонукле
нако, поскольку его объём не позволяет связать
азной активности APEX1 по отношению к раз
вывернутый из спирали нуклеотид с присут
БИОХИМИЯ том 87 вып. 1 2022
ЭКЗОНУКЛЕАЗНАЯ АКТИВНОСТЬ APEX1 В CpG ДИНУКЛЕОТИДАХ
11
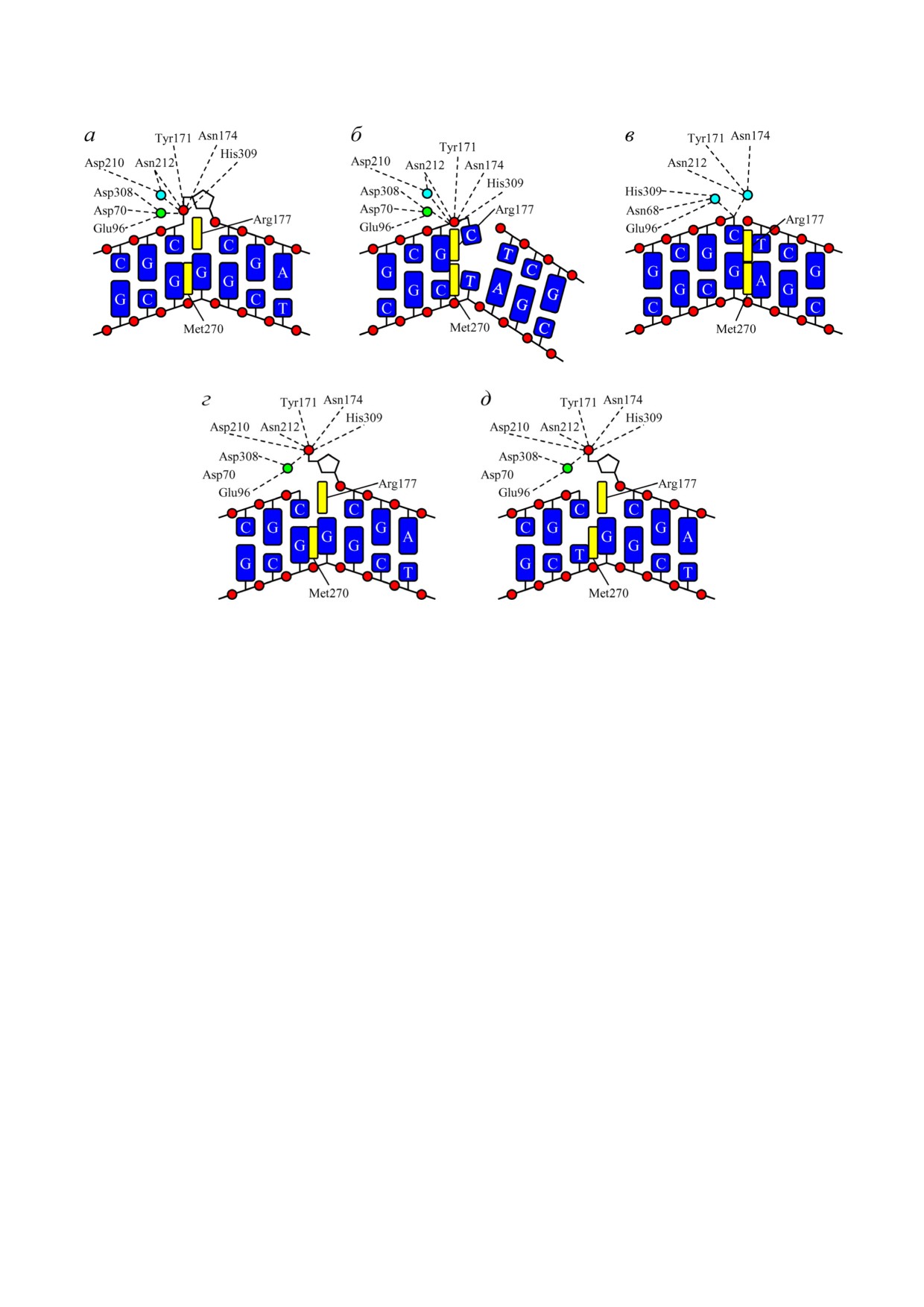
Рис. 5. Схема организации активного центра APEX1 при взаимодействии фермента с ДНК, содержащей остаток F (а; на
основе структуры 5DG0 [52]), одноцепочечный разрыв рядом с некомплементарной парой оснований C/T (б; на основе
структуры 5WN5 [53]), одноцепочечный разрыв рядом с комплементарной парой оснований C/G (в; на основе структуры
5WN0 [53]), аналог интермедиата ЭРО рядом с комплементарной парой оснований C/G (г; на основе структуры
5DFF [52]) и аналог интермедиата ЭРО рядом с некомплементарной парой оснований C/T (д; на основе структуры
6W2P [55]). Голубым кружком обозначена молекула воды, зелёным - ион Mg2+, красными - межнуклеозидные фосфаты
ствующим основанием, внедрение остатков
субстратам с комплементарными 3′ концевыми
Arg177 и Met270 сопровождается гораздо более
парами.
выраженным локальным изломом ДНК (~65°).
Несмотря на то что 3′→5′ экзонуклеазная
Возможно, именно с этим связано наблюдаемое
активность APEX1 часто наблюдается в рекон
в настоящей работе влияние mC на активность
струированной из рекомбинантных белков сис
APEX1: известно, что наличие C5 метильной
теме ЭРО [11-14], субстраты серии 3, моделиру
группы в большой бороздке вызывает стеричес
ющие возникающий после действия монофунк
кие затруднения при изломе ДНК и повышает
циональной ДНК гликозилазы и АП эндонук
её жёсткость [56, 57]. Если же рядом с разрывом
леазы интермедиат ЭРО, оказались в целом наи
ДНК на 3′ конце находится комплементарная
худшими для её проявления (ср. значения ksp
пара нуклеотидов, гидролизуемая фосфоди
на рис. 4, д). Со структурной точки зрения, это
эфирная связь в структуре располагается вне ак
объясняется, скорее всего, тем, что после гидро
тивного центра, а ион металла в таких структу
лиза фосфодиэфирной связи АП сайт остаётся
рах отсутствует, несмотря на его наличие в крис
связанным в активном центре фермента, сохра
таллизационном растворе, заменяясь на моле
няя бóльшую часть взаимодействий с аминокис
кулу воды (рис. 5, в). Arg177 и Met270 находятся
лотными остатками и ионом металла, что зат
в месте разрыва, взаимодействуя с ароматичес
рудняет перенос в активный центр другого фос
кими системами 3′ концевого основания и
фата ДНК даже при наличии некомплементар
комплементарного ему основания. Этими
ной пары на 3′ конце (рис. 5, г и д). С функцио
структурными особенностями, очевидно, объ
нальной же точки зрения, корректирующая ак
ясняется низкая 3′→5′ экзонуклеазная актив
тивность APEX1 в процессе ЭРО должна наблю
ность фермента APEX1 по отношению к
даться после включения ДНК полимеразой β
БИОХИМИЯ том 87 вып. 1 2022
12
ЕНДУТКИН и др.
неверного dNMP, что сопровождается вытесне
не вероятно, что в процессе ЭРО этап, катали
нием и удалением остатка 2′ дезоксирибо 5′
зируемый АП эндонуклеазой, оптимизирован в
фосфата N концевым доменом ДНК полимера
том числе для сохранения статуса метилирова
зы β [58, 59]. Поэтому для 3′→5′ экзонуклеаз
ния CpG динуклеотидов. Экспериментально
ной реакции более актуальны, как модели ЭРО,
наблюдаемая oxoG/OGG1/APEX1 зависимая
субстраты с разрывом ДНК без модификации
активация некоторых промоторов [16, 17, 19]
5′ конца примыкающего ОДН, на которых
может объясняться другими причинами, напри
APEX1 показывает наивысшую экзонуклеазную
мер, связанным с репарацией ремоделировани
активность.
ем хроматина [62, 63] или непосредственным
Комплементарный матрице
3′ концевой
взаимодействием OGG1 и APEX1 с транскрип
dmCMP удалялся ферментом APEX1 даже менее
ционными факторами [64-67]. Появление но
эффективно, чем dCMP. Аналогичный результат
вых методов картирования повреждений ДНК с
был недавно получен с использованием метода
нуклеотидным разрешением [68-71] в сочета
остановленного потока для субстратов типа
нии с mC специфичным секвенированием по
«праймер-матрица» [35]. Поскольку пара mC/G
может в будущем прояснить связь между про
термодинамически более стабильна, чем C/G
цессами повреждения ДНК, репарации и эпиге
[60, 61], это наблюдение согласуется с предпо
нетической регуляции в геноме человека.
ложением о стабильности 3′ концевой нуклео
тидной пары как ключевого фактора, определя
ющего эффективность 3′→5′ экзонуклеазной
Финансирование. Исследование поддержано
реакции APEX1 [34]. Однако интересно, что
Российским научным фондом (грант № 17 14
именно в случае F содержащего субстрата (се
01190П, экспериментальная биохимическая
рия 3) разницы между удалением dmCMP и
часть) и государственным заданием 0245 2021
dCMP не наблюдалось. Низкая эффективность
0002 (структурный анализ).
удаления dmCMP и снижение 3′→5′ экзонукле
Конфликт интересов. Авторы заявляют об от
азной активности фермента APEX1 при нали
сутствии конфликта интересов.
чии mC в неповреждённой цепи позволяет
Соблюдение этических норм. Настоящая
предположить, что эта активность вряд ли игра
статья не содержит описания каких либо иссле
ет значительную роль в активном деметилиро
дований с участием людей или животных в каче
вании ДНК в клетках человека. Напротив, впол стве объектов.
СПИСОК ЛИТЕРАТУРЫ
1.
Friedberg, E. C., Walker, G. C., Siede, W., Wood, R. D.,
9. Mazur, D. J., and Perrino, F. W. (1999) Identification and
Schultz, R. A., et al. (2006) DNA Repair and Mutagenesis,
expression of the TREX1 and TREX2 cDNA sequences
ASM Press, Washington, D.C., 1118 pp.
encoding mammalian 3′→5′ exonucleases, J. Biol. Chem.,
2.
Halliwell, B., and Gutteridge, J. M. C. (2007) Free Radicals
274, 19655 19660, doi: 10.1074/jbc.274.28.19655.
in Biology and Medicine, 4th Edn., Oxford University Press,
10. Albertson, T. M., Ogawa, M., Bugni, J. M., Hays, L. E.,
Oxford, 704 pp.
Chen, Y., et al. (2009) DNA polymerase ε and δ proofread
3.
Stivers, J. T., and Jiang, Y. L. (2003) A mechanistic per
ing suppress discrete mutator and cancer phenotypes in
spective on the chemistry of DNA repair glycosylases,
mice, Proc. Natl Acad. Sci. USA, 106, 1710117104,
Chem. Rev., 103, 2729 2760, doi: 10.1021/cr010219b.
doi: 10.1073/pnas.0907147106.
4.
Kohli, R. M., and Zhang, Y. (2013) TET enzymes, TDG
11. Kasymov, R. D., Grin, I. R., Endutkin, A. V., Smirnov, S.
and the dynamics of DNA demethylation, Nature, 502,
L., Ishchenko, A. A., et al. (2013) Excision of 8 oxoguanine
472 479, doi: 10.1038/nature12750.
from methylated CpG dinucleotides by human 8 oxogua
5.
Wu, X., and Zhang, Y. (2017) TET mediated active DNA
nine DNA glycosylase, FEBS Lett., 587, 31293134,
demethylation: Mechanism, function and beyond, Nat.
doi: 10.1016/j.febslet.2013.08.008.
Rev. Genet., 18, 517 534, doi: 10.1038/nrg.2017.33.
12. Beaver, J. M., Lai, Y., Xu, M., Casin, A. H., Laverde, E. E.,
6.
Chou, K. M., and Cheng, Y. C. (2002) An exonucleolytic
et al. (2015) AP endonuclease 1 prevents trinucleotide repeat
activity of human apurinic/apyrimidinic endonuclease on
expansion via a novel mechanism during base excision repair,
3′ mispaired DNA, Nature, 415, 655 659, doi: 10.1038/
Nucleic Acids Res., 43, 5948 5960, doi: 10.1093/nar/gkv530.
415655a.
13. Çağlayan, M., Horton, J. K., Dai, D. P., Stefanick, D. F.,
7.
Chou, K. M., and Cheng, Y. C. (2003) The exonuclease
and Wilson, S. H. (2017) Oxidized nucleotide insertion by
activity of human apurinic/apyrimidinic endonuclease
pol β confounds ligation during base excision repair, Nat.
(APE1): biochemical properties and inhibition by the nat
Commun., 8, 14045, doi: 10.1038/ncomms14045.
ural dinucleotide Gp4G, J. Biol. Chem., 278, 18289 18296,
14. Liu, T. C., Lin, C. T., Chang, K. C., Guo, K. W.,
doi: 10.1074/jbc.M212143200.
Wang, S., et al. (2021) APE1 distinguishes DNA substrates
8.
Wilson, D. M., III (2003) Properties of and substrate deter
in exonucleolytic cleavage by induced space filling, Nat.
minants for the exonuclease activity of human apurinic
Commun., 12, 601, doi: 10.1038/s41467 020 20853 2.
endonuclease Ape1, J. Mol. Biol.,
330,
10271037,
15. Wong, D., DeMott, M. S., and Demple, B.
(2003)
doi: 10.1016/S0022 2836(03)00712 5.
Modulation of the 3′→5′ exonuclease activity of human
БИОХИМИЯ том 87 вып. 1 2022
ЭКЗОНУКЛЕАЗНАЯ АКТИВНОСТЬ APEX1 В CpG ДИНУКЛЕОТИДАХ
13
apurinic endonuclease (Ape1) by its 5′ incised abasic DNA
Escherichia coli, Nucleic Acids Res., 32, 54805485,
product, J. Biol. Chem., 278, 36242 36249, doi: 10.1074/
doi: 10.1093/nar/gkh873.
jbc.M306065200.
31.
Seki, S., Hatsushika, M., Watanabe, S., Akiyama, K.,
16.
Perillo, B., Ombra, M. N., Bertoni, A., Cuozzo, C.,
Nagao, K., et al. (1992) cDNA cloning, sequencing,
Sacchetti, S., et al. (2008) DNA oxidation as triggered by
expression and possible domain structure of human APEX
H3K9me2 demethylation drives estrogen induced gene
nuclease homologous to Escherichia coli exonuclease III,
expression, Science, 319, 202 206, doi: 10.1126/science.
Biochim. Biophys. Acta, 1131, 287 299, doi: 10.1016/0167
1147674.
4781(92)90027 W.
17.
Amente, S., Bertoni, A., Morano, A., Lania, L.,
32.
Wilson, D. M., III, Takeshita, M., Grollman, A. P., and
Avvedimento, E. V., et al. (2010) LSD1 mediated demethy
Demple, B. (1995) Incision activity of human apurinic
lation of histone H3 lysine 4 triggers Myc induced tran
endonuclease (Ape) at abasic site analogs in DNA, J. Biol.
scription, Oncogene, 29, 3691 3702, doi: 10.1038/onc.2010.
Chem., 270, 16002 16007, doi: 10.1074/jbc.270.27.16002.
120.
33.
Lebedeva, N. A., Khodyreva, S. N., Favre, A., and Lavrik,
18.
Zuchegna, C., Aceto, F., Bertoni, A., Romano, A.,
O. I. (2003) AP endonuclease 1 has no biologically signifi
Perillo, B., et al. (2014) Mechanism of retinoic acid
cant 3′→5′ exonuclease activity, Biochem. Biophys. Res.
induced transcription: Histone code, DNA oxidation and
Commun.,
300,
182187, doi:
10.1016/S0006
formation of chromatin loops, Nucleic Acids Res., 42,
291X(02)02808 5.
11040 11055, doi: 10.1093/nar/gku823.
34.
Dyrkheeva, N. S., Lomzov, A. A., Pyshnyi, D. V.,
19.
Pastukh, V., Roberts, J. T., Clark, D. W., Bardwell, G. C.,
Khodyreva, S. N., and Lavrik, O. I. (2006) Efficiency of
Patel, M., et al. (2015) An oxidative DNA “damage” and
exonucleolytic action of apurinic/apyrimidinic endonucle
repair mechanism localized in the VEGF promoter is
ase 1 towards matched and mismatched dNMP at the 3′
important for hypoxia induced VEGF mRNA expression,
terminus of different oligomeric DNA structures correlates
Am. J. Physiol. Lung Cell. Mol. Physiol., 309, L1367 L1375,
with thermal stability of DNA duplexes, Biochim. Biophys.
doi: 10.1152/ajplung.00236.2015.
Acta, 1764, 699 706, doi: 10.1016/j.bbapap.2006.01.004.
20.
Allgayer, J., Kitsera, N., Bartelt, S., Epe, B., and
35.
Kuznetsova, A. A., Fedorova, O. S., and Kuznetsov, N. A.
Khobta, A. (2016) Widespread transcriptional gene inacti
(2018) Kinetic features of 3′ 5′ exonuclease activity of
vation initiated by a repair intermediate of 8 oxoguanine,
human AP endonuclease APE1, Molecules, 23, 2101,
Nucleic Acids Res., 44, 72677280, doi: 10.1093/nar/
doi: 10.3390/molecules23092101.
gkw473.
36.
Chou, K. M., Kukhanova, M., and Cheng, Y. C. (2000) A
21.
Müller, N., and Khobta, A. (2021) Regulation of GC box
novel action of human apurinic/apyrimidinic endonucle
activity by
8 oxoguanine, Redox Biol.,
43,
101997,
ase: excision of L configuration deoxyribonucleoside
doi: 10.1016/j.redox.2021.101997.
analogs from the 3′ termini of DNA, J. Biol. Chem., 275,
22.
Grin, I., and Ishchenko, A. A. (2016) An interplay of the
31009 31015, doi: 10.1074/jbc.M004082200.
base excision repair and mismatch repair pathways in active
37.
Lam, W., Park, S. Y., Leung, C. H., and Cheng, Y. C.
DNA demethylation, Nucleic Acids Res., 44, 3713 3727,
(2006) Apurinic/apyrimidinic endonuclease 1 protein level
doi: 10.1093/nar/gkw059.
is associated with the cytotoxicity of L configuration
23.
Woodrick, J., Gupta, S., Camacho, S., Parvathaneni, S.,
deoxycytidine analogs (troxacitabine and β L 2′,3′
Choudhury, S., et al. (2017) A new sub pathway of long
dideoxy 2′,3′ didehydro 5 fluorocytidine) but not D con
patch base excision repair involving 5′ gap formation,
figuration deoxycytidine analogs (gemcitabine and β D
EMBO J., 36, 1605 1622, doi: 10.15252/embj.201694920.
arabinofuranosylcytosine), Mol. Pharmacol., 69,
1607
24.
Murayama, A., Sakura, K., Nakama, M., Yasuzawa
1614, doi: 10.1124/mol.105.021527.
Tanaka, K., Fujita, E., et al. (2006) A specific CpG site
38.
Dyrkheeva, N. S., Khodyreva, S. N., Sukhanova, M. V.,
demethylation in the human interleukin 2 gene promoter is
Safronov, I. V., Dezhurov, S. V., et al. (2006) 3′-5′ exonu
an epigenetic memory, EMBO J.,
25,
10811092,
clease activity of human apurinic/apyrimidinic endonucle
doi: 10.1038/sj.emboj.7601012.
ase 1 towards DNAs containing dNMP and their modified
25.
Cuomo, M., Keller, S., Punzo, D., Nuzzo, T., Affinito, O.,
analogs at the 3′ end of single strand DNA break,
et al. (2019) Selective demethylation of two CpG sites caus
Biochemistry (Moscow),
71,
200210, doi:
10.1134/
es postnatal activation of the Dao gene and consequent
S0006297906020131.
removal of D serine within the mouse cerebellum, Clin.
39.
Dyrkheeva, N. S., Khodyreva, S. N., and Lavrik, O. I.
Epigenetics, 11, 149, doi: 10.1186/s13148 019 0732 z.
(2008) Quantitative parameters of the 3′-5′ exonuclease
26.
Turker, M. S. (2002) Gene silencing in mammalian cells
reaction of human apurinic/apyrimidinic endonuclease 1
and the spread of DNA methylation, Oncogene, 21, 5388
with nicked DNA containing dYMP or a modified dCMP
5393, doi: 10.1038/sj. onc. 1205599.
analogue, Russ. J. Bioorg. Chem., 34, 192 200, doi: 10.1134/
27.
Ehrlich, M., and Lacey, M. (2013) DNA hypomethylation
S1068162008020088.
and hemimethylation in cancer, Adv. Exp. Med. Biol., 754,
40.
Dyrkheeva, N. S., Lebedeva, N. A., Sherstyuk, Y. V.,
31 56, doi: 10.1007/978 1 4419 9967 2_2.
Abramova, T. V., Silnikov, V. N., et al. (2018) Excision of
28.
Sidorenko, V. S., Nevinsky, G. A., and Zharkov, D. O.
carbohydrate modified dNMP analogues from DNA 3′ end
(2007) Mechanism of interaction between human
8
by human apurinic/apyrimidinic endonuclease 1 (APE1)
oxoguanine DNA glycosylase and AP endonuclease,
and tyrosyl DNA phosphodiesterase 1 (TDP1), Mol. Biol.
DNA Repair, 6, 317 328, doi: 10.1016/j.dnarep. 2006.10.
(Mosk), 52, 922 928, doi: 10.1134/S0026893318060067.
022.
41.
Lin, Y., Raj, J., Li, J., Ha, A., Hossain, M. A., et al. (2020)
29.
Takeshita, M., Chang, C. N., Johnson, F., Will, S., and
APE1 senses DNA single strand breaks for repair and sig
Grollman, A. P. (1987) Oligodeoxynucleotides containing
naling, Nucleic Acids Res., 48, 1925 1940, doi: 10.1093/
synthetic abasic sites: model substrates for DNA polymeras
nar/gkz1175.
es and apurinic/apyrimidinic endonucleases, J. Biol. Chem.,
42.
Strauss, P. R., Beard, W. A., Patterson, T. A., and Wilson,
262, 10171 10179, doi: 10.1016/S0021 9258(18)61093 2.
S. H. (1997) Substrate binding by human apurinic/apyrim
30.
Kroeger, K. M., Goodman, M. F., and Greenberg, M. M.
idinic endonuclease indicates a Briggs-Haldane mecha
(2004) A comprehensive comparison of DNA replication
nism, J. Biol. Chem., 272, 1302 1307, doi: 10.1074/jbc.272.
past 2 deoxyribose and its tetrahydrofuran analog in
2.1302.
БИОХИМИЯ том 87 вып. 1 2022
14
ЕНДУТКИН и др.
43.
Mantha, A. K., Oezguen, N., Bhakat, K. K., Izumi, T.,
58.
Prasad, R., Beard, W. A., Strauss, P. R., and Wilson, S. H.
Braun, W., et al. (2008) Unusual role of a cysteine residue in
(1998) Human DNA polymerase β deoxyribose phosphate
substrate binding and activity of human AP endonucle
lyase: substrate specificity and catalytic mechanism, J. Biol.
ase 1, J. Mol. Biol., 379, 28 37, doi: 10.1016/j.jmb.2008.
Chem., 273, 15263 15270, doi: 10.1074/jbc.273.24.15263.
03.052.
59.
Sobol, R. W., Prasad, R., Evenski, A., Baker, A., Yang, X.
44.
Kanazhevskaya, L. Y., Koval, V. V., Zharkov, D. O., Strauss,
P., et al. (2000) The lyase activity of the DNA repair pro
P. R., and Fedorova, O. S. (2010) Conformational transi
tein β polymerase protects from DNA damage induced
tions in human AP endonuclease 1 and its active site mutant
cytotoxicity, Nature,
405,
807 810, doi:
10.1038/
during abasic site repair, Biochemistry, 49, 6451 6461,
35015598.
doi: 10.1021/bi100769k.
60.
Hoheisel, J. D., Craig, A. G., and Lehrach, H. (1990)
45.
Adhikari, S., Manthena, P. V., Kota, K. K., Karmahapatra,
Effect of 5 bromo and 5 methyldeoxycytosine on duplex
S. K., Roy, G., et al. (2012) A comparative study of recom
stability and discrimination of the NotI octadeoxynu
binant mouse and human apurinic/apyrimidinic endonu
cleotide: quantitative measurements using thin layer
clease, Mol. Cell. Biochem., 362, 195 201, doi: 10.1007/
chromatography, J. Biol. Chem., 265, 16656 16660,
s11010 011 1142 5.
doi: 10.1016/S0021 9258(17)46271 5.
46.
Maher, R. L., and Bloom, L. B. (2007) Pre steady state
61.
Lebedev, Y., Akopyants, N., Azhikina, T., Shevchenko, Y.,
kinetic characterization of the AP endonuclease activity of
Potapov, V., et al. (1996) Oligonucleotides containing 2
human AP endonuclease 1, J. Biol. Chem., 282, 30577
aminoadenine and 5 methylcytosine are more effective as
30585, doi: 10.1074/jbc.M704341200.
primers for PCR amplification than their nonmodified
47.
Schermerhorn, K. M., and Delaney, S. (2013) Transient
counterparts, Genet. Anal., 13, 15 21, doi: 10.1016/1050
state kinetics of apurinic/apyrimidinic (AP) endonuclease 1
3862(96)00139 8.
acting on an authentic AP site and commonly used substrate
62.
Menoni, H., Gasparutto, D., Hamiche, A., Cadet, J.,
analogs: The effect of diverse metal ions and base mis
Dimitrov, S., et al. (2007) ATP dependent chromatin
matches, Biochemistry, 52, 76697677, doi: 10.1021/
remodeling is required for base excision repair in conven
bi401218r.
tional but not in variant H2A. Bbd nucleosomes, Mol. Cell.
48.
Gros, L., Ishchenko, A. A., Ide, H., Elder, R. H., and
Biol., 27, 5949 5956, doi: 10.1128/MCB.00376 07.
Saparbaev, M. K. (2004) The major human AP endonucle
63.
Azzouz, D., Khan, M. A., and Palaniyar, N. (2021) ROS
ase (Ape1) is involved in the nucleotide incision repair path
induces NETosis by oxidizing DNA and initiating DNA
way, Nucleic Acids Res., 32, 73 81, doi: 10.1093/nar/
repair, Cell Death Discov., 7, 113, doi: 10.1038/s41420 021
gkh165.
00491 3.
49.
Kim, S. E., Gorrell, A., Rader, S. D., and Lee, C. H.
64.
Xanthoudakis, S., Miao, G., Wang, F., Pan, Y. C. E., and
(2010) Endoribonuclease activity of human apurinic/
Curran, T. (1992) Redox activation of Fos-Jun DNA bind
apyrimidinic endonuclease 1 revealed by a real time fluoro
ing activity is mediated by a DNA repair enzyme,
metric assay, Anal. Biochem., 398, 69 75, doi: 10.1016/
EMBO J., 11, 3323 3335, doi: 10.1002/j.1460 2075.1992.
j.ab.2009.11.024.
tb05411.x.
50.
Mol, C. D., Izumi, T., Mitra, S., and Tainer, J. A. (2000)
65.
Carrero, P., Okamoto, K., Coumailleau, P., O’Brien, S.,
DNA bound structures and mutants reveal abasic DNA
Tanaka, H., et al. (2000) Redox regulated recruitment of
binding by APE1 and DNA repair coordination, Nature,
the transcriptional coactivators CREB binding protein and
403, 451 456, doi: 10.1038/35000249.
SRC 1 to hypoxia inducible factor 1α, Mol. Cell. Biol., 20,
51.
Tsutakawa, S. E., Shin, D. S., Mol, C. D., Izumi, T., Arvai,
402 415, doi: 10.1128/MCB.20.1.402 415.2000.
A. S., et al. (2013) Conserved structural chemistry for inci
66.
Ando, K., Hirao, S., Kabe, Y., Ogura, Y., Sato, I., et al.
sion activity in structurally non homologous apurinic/
(2008) A new APE1/Ref 1 dependent pathway leading to
apyrimidinic endonuclease APE1 and endonuclease IV
reduction of NF κB and AP 1, and activation of their
DNA repair enzymes, J. Biol. Chem., 288, 8445 8455,
DNA binding activity, Nucleic Acids Res., 36, 4327 4336,
doi: 10.1074/jbc.M112.422774.
doi: 10.1093/nar/gkn416.
52.
Freudenthal, B. D., Beard, W. A., Cuneo, M. J.,
67.
Fleming, A. M., Ding, Y., and Burrows, C. J. (2017)
Dyrkheeva, N. S., and Wilson, S. H. (2015) Capturing
Oxidative DNA damage is epigenetic by regulating gene
snapshots of APE1 processing DNA damage, Nat. Struct.
transcription via base excision repair, Proc. Natl. Acad. Sci.
Mol. Biol., 22, 924 931, doi: 10.1038/nsmb.3105.
USA, 114, 2604 2609, doi: 10.1073/pnas.1619809114.
53.
Whitaker, A. M., Flynn, T. S., and Freudenthal, B. D.
68.
Liu, Z. J., Mart nez Cuesta, S., van Delft, P., and
(2018) Molecular snapshots of APE1 proofreading mis
Balasubramanian, S. (2019) Sequencing abasic sites in
matches and removing DNA damage, Nat. Commun., 9,
DNA at single nucleotide resolution, Nat. Chem., 11, 629
399, doi: 10.1038/s41467 017 02175 y.
637, doi: 10.1038/s41557 019 0279 9.
54.
Fairlamb, M. S., Whitaker, A. M., and Freudenthal, B. D.
69.
Fang, Y., and Zou, P. (2020) Genome wide mapping of
(2018) Apurinic/apyrimidinic (AP) endonuclease 1 process
oxidative DNA damage via engineering of 8 oxoguanine
ing of AP sites with 5′ mismatches, Acta Crystallogr. D Struct.
DNA glycosylase, Biochemistry, 59, 85 89, doi: 10.1021/
Biol., 74, 760 768, doi: 10.1107/S2059798318003340.
acs.biochem.9b00782.
55.
Whitaker, A. M., Stark, W. J., Flynn, T. S., and
70.
Gorini, F., Scala, G., Di Palo, G., Dellino, G. I.,
Freudenthal, B. D. (2020) Molecular and structural charac
Cocozza, S., et al. (2020) The genomic landscape of 8
terization of disease associated APE1 polymorphisms, DNA
oxodG reveals enrichment at specific inherently fragile pro
Repair, 91 92, 102867, doi: 10.1016/j.dnarep.2020.102867.
moters, Nucleic Acids Res., 48, 4309 4324, doi: 10.1093/
56.
Nathan, D., and Crothers, D. M. (2002) Bending and flex
nar/gkaa175.
ibility of methylated and unmethylated EcoRI DNA, J. Mol.
71.
Roychoudhury, S., Pramanik, S., Harris, H. L.,
Biol., 316, 7 17, doi: 10.1006/jmbi.2001.5247.
Tarpley, M., Sarkar, A., et al. (2020) Endogenous oxidized
57.
Teng, X., and Hwang, W. (2018) Effect of methylation on
DNA bases and APE1 regulate the formation of G quadru
local mechanics and hydration structure of DNA,
plex structures in the genome, Proc. Natl. Acad. Sci. USA,
Biophys. J., 114, 1791 1803, doi: 10.1016/j.bpj.2018.03.022.
117, 11409 11420, doi: 10.1073/pnas.1912355117.
БИОХИМИЯ том 87 вып. 1 2022
ЭКЗОНУКЛЕАЗНАЯ АКТИВНОСТЬ APEX1 В CpG ДИНУКЛЕОТИДАХ
15
DNA METHYLATION AFFECTS THE 3′→5′ EXONUCLEASE ACTIVITY
OF THE MAJOR HUMAN ABASIC SITE ENDONUCLEASE, APEX1
A. V. Endutkin1, D. D. Yatsenko1, and D. O. Zharkov1,2*
1 Institute of Chemical Biology and Fundamental Medicine, Siberian Branch of the Russian Academy of Sciences,
630090 Novosibirsk, Russia; E-mail: dzharkov@niboch.nsc.ru
2 Department of Natural Sciences, Novosibirsk State University, 630090 Novosibirsk, Russia
Apurinic/apyrimidinic (AP) endonucleases are key enzymes in the DNA base excision repair pathway that hydrolyze
the phosphodiester bond of the AP site formed after the removal of a damaged base. The major human AP endonu
clease APEX1 additionally possesses 3′ phosphodiesterase and 3′→5′ exonuclease activities. The biological roles of
the latter are not established at present; it is assumed to correct errors in the DNA repair synthesis. If DNA is dam
aged 3′ of a 5 methylcytosine (mC) residue, the 3′→5′ exonuclease activity can change the epigenetic methylation
status of the CpG dinucleotide. It remains unclear whether the 3′→5′ exonuclease activity of APEX1 contributes to
the process of active epigenetic demethylation or, on the contrary, is limited in methylated CpG dinucleotides to pre
serve the epigenetic status during the repair of accidental DNA damage. Here we report the first systematic study of
the efficiency of removal of 3′ terminal nucleotides from substrates modeling DNA repair intermediates in CpG din
ucleotides. In all intermediates, oligonucleotides with 3′ terminal bases non complementary to the template were the
best, and those with mC, the worst substrates for the 3′→5′ exonuclease activity of APEX1. The presence of mC in
the complementary strand significantly reduced the reaction rate even for non complementary 3′ termini. Thus, the
efficiency of the 3′→5′ exonuclease reaction catalyzed by APEX1 is limited in the methylated CpG context, which
likely reflects the need to maintain the epigenetic status during the repair.
Keywords: DNA damage, DNA repair, epigenetic demethylation, AP endonuclease, 3′→5′ exonuclease, APEX1,
5 methylcytosine
БИОХИМИЯ том 87 вып. 1 2022